改変された性質を有するアルファ−アミラーゼ
a)親AmyS様アルファ−アミラーゼのアミノ酸配列に対し相同性が少なくとも95%のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に対応するアミノ酸位置に置換を有するアルファ−アミラーゼ変異体と、b)別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とを含む組成物、この組成物による織物のデサイジング方法または洗濯または洗浄方法、及びこの組成物によるキットに関する。
【発明の詳細な説明】
【技術分野】
【0001】
本願は新規なアルファ−アミラーゼに関する。特に、本願は特定のアルファ−アミラーゼ変異体の活性を利用する方法、このアルファ−アミラーゼ変異体のブレンド物を汚れ除去及び洗濯用洗剤組成物の一成分として利用する方法に関する。
<配列表>
添付のSEQ ID NO: 1〜30からなる配列表の全てを、参照として本願に組み込む。
<関連出願とのクロスリファレンス>
本願は米国仮出願60/985,619 (2007年11月5日出願)、61/026,579 (2008年2月6日出願)、61/041,075 (2008年3月31日出願)、及び61/059,411 (2008年6月6日出願)に基づく利益を主張し、これらの出願は参照として本願に組み込まれる。
【背景技術】
【0002】
アルファ−アミラーゼ(アルファ-1,4-グルカン-4-グルカノヒドロダーゼ, E.C.3.2.1.1)は、澱粉及び直鎖または分岐1,4-グルコースのオリゴサッカライド及びポリサッカライドの加水分解触媒となる酵素群である。
【0003】
アルファ−アミラーゼは様々な用途に用いることができる。例えば、アルファ−アミラーゼは商業的に澱粉加工の初期段階(例えば液状化)、穀物の湿式粉砕、炭水化物を原料とするアルコール製造等で用いられている。また、アルファ−アミラーゼは洗浄剤、または洗剤の添加剤、織物工業での澱粉デサイジング剤、製パン用、飲料工業、油田での掘削工程、例えば紙の脱インク等のリサイクル工程、及び動物飼料にも用いられている。
【0004】
澱粉液状化や織物デサイジング剤等の特定の用途において、改良された性質を有するアルファ−アミラーゼ変異体の創生が試みられてきた。
【発明の概要】
【発明が解決しようとする課題】
【0005】
デサイジングや洗浄/洗濯、あるいは汚れ除去または澱粉除去等の種々の用途において、一般的工業用の酵素(例えばバシラス・リケニホルミス(Bacillus licheniformis)由来の酵素)に対し、製造上および/または性能上の利点を有する、改善されたアミラーゼの創生が求められている。
【課題を解決するための手段】
【0006】
一側面では、本願は特にAmyS-様α-アミラーゼ等の親α-アミラーゼの新規なα-アミラーゼ変異体に関する。特に、例えば織物のデサイジング等の澱粉の除去や、洗浄または洗濯において有用な改変された性質を有する新規なα-アミラーゼ変異体に関する。
【0007】
例えば、本願の変異体は親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して、下記の性質の1以上が改変されている。
正味電荷、基質特異性、基質分解性、基質結合性、熱安定性、1以上のpH域における活性、1以上のpH域における安定性、酸化環境下での安定性、Ca2+要求性、比活性度、触媒反応速度、触媒効率、キレート剤の存在下での活性、キレート剤存在下での熱またはpH安定性、デサイジングでの有用性、洗浄プロセスでの有用性、タンパク質発現系での発現量、またはその他の対象とする性質。
例えば、1以上の改変により、AmyS様アルファ−アミラーゼ等の親α-アミラーゼと比較して低減されたCa2+依存性、および/または、改変されたpH/活性依存性(プロファイル)、および/または、改変された熱安定性を有する変異体が得られる。
【0008】
一側面では、本願により親ゲオバシラス・ステアロサーモフィリス(Geobacillus stearothermophilus)アルファ−アミラーゼの変異体が提供される。この変異体は親ゲオバシラス・ステアロサーモフィリスのアルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有し、アミノ酸位置242に置換を備え、ここでペプチド配列中のアミノ酸位置番号は参照アミノ酸(例えばSEQ ID NO: 1または2) のアミノ酸位置番号に対応しており、この変異体はアルファ−アミラーゼ活性を有する。
【0009】
別の側面では、本願によりa) 親AmyS様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に対応する位置に置換を有するとともに、検出可能なアルファ−アミラーゼ活性を示す少なくとも1のアルファ−アミラーゼ変異体と、b) 別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とから成る組成物が提供される。
好ましい実施形態では、参照アミラーゼはSEQ ID NO: 1または2であり、組成物は洗濯、食器または硬質表面洗浄、デサイジング、あるいは繊維または汚れ処理に用いられる製品の一成分である。
【0010】
一つの実施形態では、組成物に含まれる別の酵素はプロテアーゼ、リパーゼ、アミラーゼ、セルラーゼ、ペルオキシダーゼ、オキシダーゼ、ペクチナーゼ、リアーゼ、クチナーゼ、ラッカーゼまたはこれらの組み合わせである。
【0011】
本願の実施形態では、界面活性剤は非イオン性、アニオン性、カチオン性、または両性イオン性である。アルファ−アミラーゼ変異体は、好ましくはS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体である。
いくつかの実施形態では、変異体は酸化に対する安定性が改変されている。またアルファ−アミラーゼ変異体は、親AmyS-様アルファ−アミラーゼのアミノ酸位置8, 9, 96, 200, 206, 284, 307, 311, 316, 及び438残基を含めてメチオニン残基の1以上の置換または欠失を備え、ここで参照アルファ−アミラーゼはSEQ ID NO: 2である。
【0012】
別の実施形態では、アルファ−アミラーゼ変異体はさらに、参照アルファ−アミラーゼのアミノ酸位置97, 179, 180, 193, 319, 349, 358, 416, 428, または443に対応するアミノ酸位置の1以上において、配列修飾を有する。
また別の実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【0013】
好ましい実施形態では、アルファ−アミラーゼ変異体は、例えばN193F置換またはV416G置換、またはこの両置換のように、N193置換またはV416置換、またはこの両置換を有する。別の実施形態では、アルファ−アミラーゼ変異体は位置F178, R179, G180, 1181, G182及びK183 にアミノ酸欠失を有する。
【0014】
好ましい実施形態では、アルファ−アミラーゼ変異体は改変された金属イオン依存性、あるいはカルシウム無添加時における改変された安定性または活性、キレート剤存在下での改変された安定性または活性を有する。
【0015】
好ましくは、アルファ−アミラーゼ変異体はSEQ ID NO:2に対し少なくとも95%, 98%, あるいは99%を超える相同性を有し、アミノ酸配列SEQ ID NO:1から成る参照アルファ−アミラーゼの位置番号242に相当する位置にアミノ酸置換を有し、このアルファ−アミラーゼ変異体がアルファ−アミラーゼ活性を有する。
【0016】
一つの実施形態では、親AmyS-様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16から成り、参照アルファ−アミラーゼがSEQ ID NO: 1 または2から成る。好ましくは、アルファ−アミラーゼ変異体は親AmyS-様アルファ−アミラーゼに対し、pH >約8での洗浄性能が改善されている。
【0017】
本願の実施形態では、アルファ−アミラーゼ変異体は次の組み合わされた置換を有する:a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E; または i) Q319R, Q358R, Q443E。
【0018】
別の側面では、本願により洗剤または洗浄剤処方組成物が提供され、この組成物には親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体が含まれ、このアルファ−アミラーゼ変異体が検出可能なアルファ−アミラーゼ活性を有し、ここで参照アミラーゼはSEQ ID NO: 1、または2である。
いくつかの実施形態では、アルファ−アミラーゼ変異体は少なくともS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242Tのいずれかを含む、S242変異体である。
【0019】
別の側面では、本願により織布製造後に織物をデサイジングする方法が提供され、この方法には、親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するアルファ−アミラーゼ変異体と、織物とを接触させる工程が含まれる。好ましくは、アルファ−アミラーゼ変異体は検出可能なアルファ−アミラーゼ活性を有する。接触工程は、織物からデサイジング剤の少なくとも一部が除去される条件及び時間において行われる。
【0020】
本願の実施形態では、アルファ−アミラーゼ変異体は、親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して、下記の性質の1以上が改変されている。
(a)正味電荷、(b)基質特異性、(c)基質分解性、(d)基質結合性、(e)熱安定性、(f)1以上のpH域における活性、(g)1以上のpH域における安定性、(h)酸化環境下での安定性、(i)Ca2+要求性、(j)比活性度、(k)触媒反応速度、(1)触媒効率、(m)キレート剤存在下での活性、(n)キレート剤存在下での熱またはpH安定性、(o)デサイジング効果、(p)タンパク質発現系における発現量。
【0021】
本願の実施形態では、親AmyS様アルファ−アミラーゼはSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16のいずれかであり、参照アルファ−アミラーゼはSEQ ID NO: 1または2である。好ましくは、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである。
【0022】
いくつかの実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。ここで、参照アルファ−アミラーゼはSEQ ID NO: 1または2である。
【0023】
また、本願により洗濯または洗浄方法が提供される。この方法は、洗濯または洗浄される1以上の物品を、親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体が含まれる組成物に接触させる工程が含まれる。この接触工程は、1以上の物品が洗濯または洗浄される条件及び時間において行われる。アルファ−アミラーゼ変異体は検出可能なアルファ−アミラーゼ活性を有する。
この方法の一例では、少なくとも1の物品は少なくとも1の澱粉含有物質で汚されており、この汚れの除去がアルファ−アミラーゼ変異体によって促進される。この方法の実施形態では、組成物にはさらに、別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1が含まれる。
【0024】
この方法の実施形態では、親AmyS様アルファ−アミラーゼはSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16のいずれかであり、参照アルファ−アミラーゼはSEQ ID NO: 1または2である。好ましくは、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである。
【0025】
本願の実施形態では、アルファ−アミラーゼ変異体は親AmyS-様アルファ−アミラーゼに対しpH >約8での洗浄性能が改善されている。
【0026】
一つの実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
別の実施形態では、アルファ−アミラーゼ変異体は次の組み合された置換を有する:a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E; または i) Q319R, Q358R, Q443E。
【0027】
この方法には、アミノ酸位置F178, R179, G180, 1181, G182, またはK183の1以上に欠失を有するアルファ−アミラーゼ変異体を使用することが含まれる。いくつかの実施形態では、アルファ−アミラーゼ変異体は改変された金属イオン依存性または金属イオン安定性、あるいはカルシウム無添加時における改変された活性、キレート剤存在下での改変された活性を有する。
【0028】
また本願により、a) 親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体が含まれ、検出可能なアルファ−アミラーゼ活性を有するアルファ−アミラーゼ変異体と、b) 別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とが含まれるキットが提供される。
【0029】
ひとつの実施形態では、このキットにはさらに、このキットの成分を織物のデサイジング、または澱粉含有物質で汚された1以上の物品を洗濯または洗浄する際の取扱説明書が含まれている。
以下、本願発明について詳しく説明する。
【図面の簡単な説明】
【0030】
【図1】本願で用いる親アルファ−アミラーゼ(AmyS様アルファ−アミラーゼ)のいくつかの候補のアミノ酸配列のアライメントを表わす図である。ゲオバシラス・ステアロサーモフィリス(SEQ ID NO: 1)由来のアミラーゼのアミノ酸位置(例えば1から520)に対応する位置を容易に決めることができる。SEQ ID NO:1, G. ステアロサーモフィリス(Geobacillus stearothermophilus)「BSG」由来のアルファ−アミラーゼ; SEQ ID NO:2, G. ステアロサーモフィリス由来の欠失アルファ−アミラーゼ(AmyS, SPEZYME XTRA); SEQ ID NO:3, G. ステアロサーモフィリス (S242A変異アミラーゼ); SEQ ID NO: 4, G. ステアロサーモフィリス (S242Q変異アミラーゼ); SEQ ID NO: 5, G. ステアロサーモフィリス (S242E変異アミラーゼ); SEQ ID NO:6, ヤマネ707 アミラーゼ; SEQ ID NO: 7, 成熟LATアミラーゼ; SEQ ID NO: 8, バスラス・リケニホルミス野生型アミラーゼ[TERMAMYL (NOVOZYMES) = WO 02/10355 A2のSEQ ID NO: 8に相当]; SEQ ID NO: 9, B. アミロリケファシエンス アミラーゼ, BAN; SEQ ID NO: 10, STAINZYME = AA560(WO 00/60060のSEQ ID NO:2またはUS 6,528,298 の SEQ ID NO:24に相当); SEQ ID NO: 11, B. ハルマパルス (halmapalus) アミラーゼ (NATALASE); SEQ ID NO: 12, KSM-1378 (花王, EP1199356のSEQ ID NO:3 に相当) ; SEQ ID NO: 13, バスラス種 KSM-K38 (花王, US 6,403,355 B1のSEQ ID NO:4 に相当); SEQ ID NO: 14, バスラス種 KSM-K36 (花王, US 6,403,355 B1のSEQ ID NO:2に相当); SEQ ID NO: 15, LIQUOZYME SC (NOVOZYMES); SEQ ID NO: 16, 親アルファ−アミラーゼ配列コンセンサス(consensus) 1;
【図2】pHPLT-AmySプラスミドを表わす図である。
【図3】S242変異体に95℃の熱ストレスを30分間与えた後の残留活性%を表わす図である。変異体位置P, S, W, 及びYが欠失しており、野生型AmyS (SpezymeTM Xtra (「Z」で示した))で置換されていた。陽性対照の、C末端の29アミノ酸が欠失したΔ179-180のG. ステアロサーモフィリス(すなわちSEQ ID NO:2)も併せて示す。図中の線は、野生型酵素の残留活性パーセントの標準偏差の2倍及び3倍に相当する値を表わす。S242A及びS242Qの残留活性は、明らかに野生型酵素よりも高い。
【図4】図4A〜Iは、図1のいくつかの配列についてのペアワイズ・アライメントとコンセンサス(consensus)配列、及びコンセンサス配列2, 3, 4, 5, 6, 7, 8, 9, 及び10、またはSEQ ID NO: 22, 23, 24, 25, 26, 27, 28, 29, 及び30を表わす。
【図5】野生型及び変異体アミラーゼにカルシウムを添加しなかったときの、熱融解曲線と融点を表わす図である。
【図6】野生型及び変異体アミラーゼの両者に2 mMのカルシウムを添加したときの、熱融解曲線と融点を表わす図である。
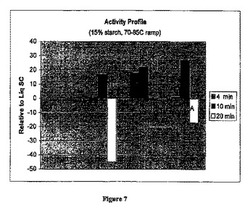
【図7】Spezyme Xtraと2種の変異体の4, 10, 及び20分後の活性分析結果を、Liquozyme SCの活性と対比して表わす図である。
【図8】4種の変異体の4, 10, 及び20分後の活性分析結果を、S242Q変異体の活性と対比して表わす図である。
【図9】S242Q電荷組合せライブラリー、米澱粉小見本片を用いたTide 2xによる20℃の北米衣類洗浄条件下の洗浄試験における、S242Q(黒丸)及びS242Q変異体(白丸)の性能と、電荷の関係を表わすグラフである。実施例10参照。
【図10】TS23t電荷組合せライブラリー、米澱粉小見本片を用いたPersilによる40℃の西ヨーロッパ衣類洗浄条件下の洗浄試験における、Q98R、M201L、S243Q、R309A、Q320R、Q359E、及びK444E突然変異を有する欠失バシラス種TS-23アミラーゼ(黒丸)と、その電荷変異体(白丸) (2008年6月6日出願のU.S. Patent Application No. PCT/US2008/007103参照) の性能と、電荷との関係を表わすグラフである。実施例10参照。
【図11】BODIPY-澱粉アッセイにおけるS242Q(黒丸)及びS242Q変異体(白丸)の性能と、電荷の関係を表わすグラフである。S242Q組合せ電荷ライブラリー(CCL)、BODIPY-澱粉に対する比活性度、及び標準アッセイ条件に関しては、実施例10を参照されたい。
【図12】図12Aは、相対的BODIPY-澱粉加水分解特性と、振蕩チューブ中での相対的発現特性との関係を表わすグラフである (すなわち、相対的BODIPY-澱粉加水分解特性vs. 相対的振蕩チューブ中発現特性) 。図12Bは、相対的小見本片-澱粉加水分解特性と、振蕩チューブ中での相対的発現特性との関係を表わすグラフである (すなわち、相対的小見本片-澱粉加水分解特性vs. 相対的振蕩チューブ中発現特性) 。実施例13参照。
【図13】図13Aは、振蕩チューブ中での相対的発現特性と電荷の関係を表わすグラフである。図13Bは、相対的BODIPY-澱粉加水分解特性と電荷の関係を表わすグラフである。実施例13参照。
【図14】図14Aは、振蕩チューブ中での相対的発現特性と電荷の関係を表わすグラフである。図14Bは、小見本片で評価した相対的洗浄活性と電荷の関係を表わすグラフである。実施例13参照。
【図15】LAUNDER-O-METERを用い活性タンパク質0.01ppm、85℃で30分間の試験条件で評価したときの、S242Q変異体のデサイジング性能に及ぼすCa2+の添加効果の影響を、Ethyl及びXtraと比較して表わす図である。デサイジングはCaCl2濃度0または5 ppmで行った。実施例14参照。
【図16】LAUNDER-O-METERを用い活性タンパク質0.01ppm、97℃で30分間の試験条件で評価したときの、S242Q変異体のデサイジング性能に及ぼすCa2+の添加効果の影響を、Ethyl及びXtraと比較して表わす図である。デサイジングはCaCl2濃度0または5 ppmで行った。実施例14参照。
【発明を実施するための形態】
【0031】
<1.定義と略号>
本願では以下の略号と定義を用いる。本願で用いる「1つの」及び「この」等の単数形には、特に断りのない限り複数形も含まれる。
従って、例えば「1のポリペプチド」と言うときは複数の同様のポリペプチドも含まれ、「その処方」と言うときは当業者に公知の同等の処方を含め、1以上の処方が含まれる。
【0032】
特に断りのない限り、本願では全ての科学及び技術用語は当業者が理解している通常の意味で用いられる。本願では以下の用語を用いる。
【0033】
<1.1. 略号>
特に断りの無い限り、以下の略号を用いる。
AATCC; 米国繊維化学者・色彩技術者協会(American Association of Textile Chemists and Colorists)
ADW; 自動食器洗浄機
AE; アルコールエトキシレート
AEO; アルコールエトキシレート
AEOS; アルコールエトキシ硫酸塩
AES; アルコールエトキシ硫酸塩
AFAU; 酸性菌類アルファ−アミラーゼ単位
AGU; グルコアミラーゼ活性単位
AOS; α−オレフィンスルホン酸塩
AS; アルキル硫酸塩
BAA; 細菌性アルファ−アミラーゼ
℃; 摂氏
CCL; 組み合わせ電荷ライブラリー
cDNA; 相補DNA
CMC; カルボキシメチルセルロース
dE; CIE-LAB色空間による全色差
dH2O; 脱イオン水
dIH2O; 脱イオン水、Milli-Q濾過水
DE; デキストロース当量 (Dextrose Equivalent)
DNA; デオキシリボ核酸
dNTP; デオキシリボ核酸三リン酸塩
DO; 溶解酸素
DP3; 3個のサブユニットの重合度
DPn; n個のサブユニットの重合度
DS;(またはds); 乾燥固形成分
DSC; 示差走査熱量測定
DTMPA; ジエチルトリアミンペンタ酢酸
EC; 酵素委員会 (enzyme commission for enzyme classification)
EDTA; エチレンジアミンテトラ酢酸
EDTMPA; エチレンジアミンテトラメチレンホスホン酸
EO; エチレンオキサイド
eq; 当量
ETOH; エタノール
F&HC; 衣類・日用品ケア剤 (fabric and household care)
FTU; 「フィターゼ」単位、フィチン酸塩加水分解単位
g (またはgm); グラム
GAU; グルコアミラーゼ単位
gpg; グレイン/ガロン (grains per gallon)
g/l; グラム/リットル
Genencor; Danisco US Inc社, Genencor Division, Palo Alto, CA
H2O; 水
HDG; ヘビーデューティ顆粒洗剤
HDL; ヘビーデューティ液体洗剤
HFCS; 高フラクトースコーンシロップ
HFSS; 高フラクトース澱粉ベースシロップ
HPAEC-PAD; アンペロメトリック検出器付高性能アニオン交換クロマトグラフィー
hr; 時間
IKA; IKA Works Inc.社 2635 North Chase Parkway SE, Wilmington, NC
IPTG; イソプロピルβ-D-チオガラクトシド
JPN; 日本
kg; キログラム
LA; ルリア寒天 (Luria Agar)
LAS; 直鎖アルキルベンゼンスルホン酸
LB; ルリア培地 (Luria Broth)
LU; リパーゼ単位
M; モル
MBD培地; MOPSベース既知組成培地
MES; 2-(N-モルフォリノ)エタンスルホン酸
mg; ミリグラム
min; 分
mL (またはml); ミリリトル
mm; ミリメートル
mM; ミリモル
MOPS; 3-(N-モルフォリノ)-プロパンスルホン酸
MW; 分子量
NA; 北米
Ncm; ニュートンセンチメートル
NEO; ネオマイシン
ng; ナノグラム
nm; ナノメータ
NOBS; ノナノニルオキシベンゼンスルホネート
N; 規定 (Normal)
NTA; ニトリロトリ酢酸
PAHBAH; p-ヒドロキシ安息香酸ヒドラジン
PCR; ポリメラーゼ連鎖反応
PEG; ポリエチレングリコール
pi; 等電点
ppm; 百万分の一
PVA; ポリビニルアルコール
PVP; ポリビニルピロリドン
RAU; 参照アミラーゼ単位
RMS; 二乗平均平方根
RNA; リボ核酸
rpm; 毎分回転数
SAPU; 分光光度分析酸性プロテアーゼ単位
SAS; 二級アルカンスルホネート
IX SSC; 0.15M NaCl, 0.015Mクエン酸ナトリウム, pH 7.
sec; 秒
%SRI; パーセント汚染除去指数
SSF; 同時糖化発酵
TAED; テトラアセチルエチレンジアミン
Tm; タンパク質の融点またはDSC測定カーブの熱中央値
TNBS; トリニトロベンゼンスルホン酸
μg; マイクログラム
μl, (μL); マイクロリットル
μNm; マイクロニュートンメートル
μm; マイクロメートル
μM; マイクロモル
U; 単位
V/V; 容積/容積
WE; 西ヨーロッパ
wt%; 重量パーセント
w/v (またはW/V); 質量/体積 (weight/volume)
w/w (またはW/w); 質量/質量 (weight/weight)
wt; 野生型
【0034】
<1.2. 定義>
幾つかの側面では、本発明は遺伝子工学及び分子生物学の分野において日常的に用いられている技術を用いる。以下の文献に、本願で用いる方法が記載されている。
Sambrook et al, MOLECULAR CLONING: A LABORATORY MANUAL (2nd Ed., 1989); Kreigler, GENE TRANSFER AND EXPRESSION; A LABORATORY MANUAL (1990) and Ausubel et al, Eds. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (1994)。
【0035】
特に断りのない限り、本明細書で用いる全ての技術的及び化学的言語は、本出願に関係する技術分野において当業者に通常理解されているものと同じ意味を有する。例えば、Singleton, et al, DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994) 及び THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991)は、本発明の技術分野の当業者が用いる、あるいは本願において多く用いられている用語の一般的な辞書である。本明細書で述べられているのと同じか、あるいは類似の種々の方法及び物質を本発明の実施に用いることができる。本明細書中では特定の好ましい方法及び物質にのみ言及する。
【0036】
「単離された」とは、例えば化合物や配列等の単離された物質が、人の手によって天然の化合物や配列等に対し改変されていることを意味する。例えば、単離された配列には、天然の配列に本来含まれる成分の少なくとも1が存在しないか、または実質的に存在しない。
【0037】
材料または物質について「精製された」というときは、その材料または物質が相対的に純粋な状態にあることを意味し、例えば純度が少なくとも約90%、約95%、約98%、または少なくとも約99%であることをいう。
【0038】
本願では、「澱粉」とは化学式(C6H10O5)X (Xは任意の数)で表わされ、アミロースおよび/またはアミロペクチンから成る複合多糖から成る炭水化物化合物を意味する。
好ましくは、澱粉とは植物中に存在する天然の炭化水素を意味し、植物の非限定的例示として穀物、草、塊茎、根茎が挙げられ、より詳しくは、小麦、大麦、トウモロコシ、ライ麦、米、ソルガム、キャッサバ、キビ、ジャガイモ、サツマイモ、及びタピオカに由来する。
また、澱粉というときは、酵素評価用の検出可能な基質として化学修飾された澱粉、あるいは使用時の性質を改良するために化学的または酵素的に修飾された澱粉等の、合成澱粉または修飾された澱粉も意味する。
【0039】
本願では、「フィチン酸」(またはイノシトールヘキサキスホスフェート(IP6))とは、例えば糠や種子等の、大部分の植物組織におけるリンの主要な貯蔵形態を意味する。また本願では、特にフィチン酸が塩の形態である場合、フィチン酸を「フィチン酸塩」と呼ぶことがある。また、イノシトールペンタホスフェート(IP5)、イノシトールテトラホスフェート(IP4)、及びイノシトールトリホスフェート(IP3)等の種々のイノシトールホスフェートをフィチン酸塩と呼ぶことがある。一般に、ヒト及び大部分の単胃動物はフィチン酸塩を消化することができない。
【0040】
本願では、フィチン酸塩を分解する酵素を「フィターゼ(phytases)」または「フィターゼ(fytases)」と呼ぶ。このような酵素は、ミオ(myo)・イノシトール・ヘキサキスホスフェート・ホスホヒドロラーゼ(phosphohydrolase)である。
フィターゼの活性はフィターゼ単位(FTUまたはU)として定義され、1 FTUは、pH 5.5、37℃の0.0015 mol/lフィチン酸ナトリウム塩から、無機リンを1分間に1マイクロモル放出させることができる酵素の量と定義される。この定義はフィターゼの定量に有用であり、活性測定のシンプルな基準である。
イーストのフィチン酸塩分解酵素 (例えばシュワニオミセス・オクシデンタリス(Schwanniomyces occidentalis)、ピチア・アノマラ(Pichia anomala)、アークスラ・アデニニボラン(Arxula adeninivorans))、グラム陰性菌のフィチン酸塩分解酵素 (例えば大腸菌、シュードモナス(Pseudomonas)種、クレブシエラ(Klebsiella)種)、グラム陽性菌のフィチン酸塩分解酵素 (例えばバスラス種)が同定され分析されている。多くの植物由来のフィターゼ、及びペニシリウム(Penicillium)種、アスペルギルス(Aspergillus) 種、トリコデルマ( Trichoderma) 種、ムコール・ピリホルミス(Mucor piriformis)、クラドスポリウム(Cladosporium)種等の糸状菌由来のフィターゼも知られている。加水分解の開始部位に応じて、3-フィターゼ(EC 3.1.3.8)と6-フィターゼ(EC 3.1.3.26)に分類される。また、フィターゼは「最適」pHに基づき「酸性」(最適pH約5)及び「アルカリ性」(最適pH約9) に分類されている。ROVABIO (Genencor International社) 等の多種類のフィターゼが市販されている。
【0041】
「アミラーゼ」とは、澱粉基質の開裂を触媒して澱粉を分解または一部分解することができる酵素を意味する。アミラーゼはヒドロラーゼの一種であり、澱粉中のグリコシド結合を開裂させる。本願のアミラーゼには、グルコアミラーゼ、アルファ−アミラーゼ、β-アミラーゼが含まれ、例えばバシラス種、特にB. リケニホルミス(licheniformis)の野生型アルファ−アミラーゼが含まれる。
一般に、アルファ-アミラーゼ(EC 3.2.1.1; (α-D-(1→4)-グルカングルカノヒドロラーゼ)は、澱粉中のα-D-(l→4) O-グリコサイド結合をランダムに切断するエンド型酵素と定義される。
これに対し、β-アミラーゼ(EC3.2.1.2; α-D-(l→4)-グルカンマルトヒドロラーゼ)や、マルトゲン性α-アミラーゼ(EC 3.2.1.133)のようないくつかの生成物特異的アミラーゼ等のエクソ型澱粉分解酵素は、基質の非還元末端から澱粉分子を切断する。β-アミラーゼ、α-グルコシダーゼ(EC 3.2.1.20; α-D-グルコシドグルコヒドロラーゼ)、グルコアミラーゼ(EC 3.2.1.3; α-D-(l→4)-グルカングルコヒドロラーゼ)、及び生成物特異的アミラーゼは、澱粉から特定の鎖長のマルトオリゴ糖を産出することができる。
本願では、バスラス・ステアロサーモフィリス由来の野生型アルファ−アミラーゼ、または「AmyS」アミラーゼをXTRA またはSPEZYME XTRAと呼ぶことがある。XTRAとSPEZYME XTRAはGenencor International社から入手可能な市販のAmySである。
【0042】
本願で言う「AmyS様アルファ−アミラーゼ」は、親アミラーゼとして有用である。AmyS様アルファ−アミラーゼは、本願に言うアルファ−アミラーゼとの相同性があることから、アルファ−アミラーゼの一種であると言える。本願では「AmyS様アルファ−アミラーゼ」とはアルファ−アミラーゼの一種を意味し、特にバシラス由来アルファ−アミラーゼを意味し、特にゲオバシラス・ステアロサーモフィリス由来アルファ−アミラーゼを意味する。
ゲオバシラス・ステアロサーモフィリス由来アルファ−アミラーゼは、アミノ酸レベルでは、本願のSEQ ID NO:2に示すアミノ酸配列を有するアルファ−アミラーゼと実質的に同一である。Spezyme XtraはDanisco US Inc社, Genencor Divisionから市販されている。ゲオバシラス・ステアロサーモフィリスは、文献ではバシラス・ステアロサーモフィリスと記載されている場合があり、本願では両者を同義で用いる。
本願にSEQ ID NO:1, 6, 7, 8, 9, 10, 11, 12, 15 及び16として示すアミノ酸配列のいずれかを有するアルファ−アミラーゼは全てAmyS様アルファ−アミラーゼであると言え、従って親アルファ−アミラーゼに適している。
【0043】
また、AmyS様アルファ−アミラーゼには、
i) SEQ ID NO: 1, 6, 7, 8, 9, 10, 11, 12, 15 及び16に示すアミノ酸配列の少なくともいずれか1に対し、相同性(同一性)を少なくとも約60%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%有するアルファ−アミラーゼ、および/または
ii) 上記の特異的アルファ−アミラーゼのいずれかをコードするDNA配列とハイブリダイズされたDNA配列でコードされたアルファ−アミラーゼ、または 本願のSEQ ID NO: 1, 6, 7, 8, 9, 10, 11, 12, 15 及び16に示すアミノ酸配列をコードするWO 06/002643のSEQ ID NO: 9 (BAN), 5 (BSG), 3 (SP722), 1 (SP690), 7 (LAT), 11 (AA560)に示されたDNA配列、または本願の明細書から明らかなDNA配列でコードされたアルファ−アミラーゼが含まれる。
【0044】
また別のAmyS様アルファ−アミラーゼとして有用な相同アルファ−アミラーゼ、すなわち本願の変異体の産出の親酵素として有用な相同アルファ−アミラーゼには、EP 0252666. (ATCC 27811)に開示されたB. リケニホルミス株から産出されたアルファ−アミラーゼ、及びWO 91/00353とWO 94/18314に開示されたアルファ−アミラーゼが含まれる。
市販のAmyS様アルファ−アミラーゼは、次の商品名で販売されている商品に含まれている。SpezymeTM AA 及び ULTRAPHLOW (Danisco US Inc社, Genencor Divisionから入手可能)、及びKeistase TM (Daiwa社から入手可能) 、及びLIQUEZYME SC (Novozymes社, Denmarkから入手可能)。
後述のセクション1.5で、AmyS様アルファ−アミラーゼについてさらに説明する。後述するTable Aに有用なAmyS様アルファ−アミラーゼのリストと、アミノ酸配列同士を比較する有用な方法を示す。
当業者であれば、本願の酵素としての使用可能性を判断するために、他のアルファ−アミラーゼについて同様の表を作成できることを理解できよう。
【0045】
「分光光度分析酸性プロテアーゼ単位 (SAPU)」とはプロテアーゼ酵素の活性を表わす単位を意味する。ここで、1 SAPUとは、アッセイ条件下でカゼイン基質から1分間に1マイクロモルのチロシンを放出させるプロテアーゼ酵素活性量である。
【0046】
「グリコアミラーゼ単位(GAU)」は澱粉分解活性の指標であり、pH 4.2で60℃の溶解性澱粉基質から1時間当り1gの還元糖(グルコースとして計算)を産出する酵素活性量と定義される。
【0047】
本願では「変異体」と「突然変異」とを同義で用いることがある。「変異体」は、ポリペプチドまたは核酸について用いる。変異体には、参照配列に対して1以上の位置における置換、挿入、欠失、切断、および/またはトランスバージョン逆位が含まれる。
核酸変異体には、本願に開示するヌクレオチド配列にハイブリダイズ可能な相補的な配列が含まれる。例えば、本願の変異体核酸配列は、ストリンジェントな条件下(例えば 50℃で0.2X SSC { IX SSC = 0.15 M NaCl, 0.015 Mクエン酸ナトリウム、pH 7.0})で本願に開示するヌクレオチド配列とハイブリッド形成可能な配列と少なくとも一部相補的であってもよい。好ましくは、変異体には、高度にストリンジェントな条件下(例えば 65℃で0.1X SSC)で、本願に開示するヌクレオチド配列とハイブリッド形成可能な配列に相補的な配列が含まれる。
【0048】
酵素について「熱安定性」と言うときは、その酵素が参照酵素よりも熱安定性であることを意味する。本願では、アルファ−アミラーゼ変異体と野生型B. リケニホルミスアルファ−アミラーゼを、例えば同一温度及び同一基質濃度等の同じ条件下に特定の時間置いた後、アルファ−アミラーゼ変異体の方が相対的に高酵素活性を示すとき、アルファ−アミラーゼ変異体は野生型B. リケニホルミスアルファ−アミラーゼよりも熱安定性であるとする。
または、熱安定性が高い酵素は、示差走査熱量測定を用いて参照酵素と比較したとき、より高い熱容量を示す。
【0049】
ポリペプチドの「融点(Tm)」とは、そのポリペプチドが、測定可能な温度依存性の変化を生じるようなコンフォメーション変化を生じる温度である。タンパク質のコンフォメーションとTmは、例えばタンパク質の折り畳み構造を研究するための一般的かつ基本的な方法である円偏光二色性により分析することができる。円偏光二色性では、円偏光の吸光を測定する。タンパク質の場合、アルファヘリックスやベータシート等のの構造はキラルであり、円偏光を吸収する。光吸収によりタンパク質の折り畳みの程度に関する測定を行うことができる。温度または変成剤濃度に対する光吸収の変化から、そのタンパク質の平衡アンフォールディングを測定することができる。このような分光学的分析と、タンパク質のフォールディング/アンフォールディングのキネティックを分析するストップフローミキサー (stopped flow mixer)とを込み合わせることもできる。
【0050】
「カルシウム依存性」とは、特定の酵素が、その酵素活性を実質的に示すためにカルシウムを必要とすることを意味する。本願で言う「カルシウム依存性」には、ある酵素がその酵素活性を示すために二価金属を必須とする性質が含まれ、さらに、その酵素の活性がカルシウムまたは他の二価金属の存在により実質的に (例えば20%以上)増加する性質が含まれる。
【0051】
酵素についての「pH安定性」という用語は、酵素活性、またはその酵素のタンパク質コンフォメーションに関して用いる。
酵素活性に関しては、「pH安定性」とは酵素が特定のpH、または特定のpH範囲において触媒活性を保持していることを意味する。
タンパク質コンフォメーションに関しては、あるpHにおいてタンパク質が不可逆的に変成されていないとき、その酵素は安定であると見なす。このような場合、その酵素が触媒活性を示すことができるpHに戻されたとき、再び触媒として作用する。
pH安定性という用語を、例えば参照酵素と対比する等、相対比較の意味で用いることもある。
本願のアルファ−アミラーゼ変異体の方が野生型B. リケニホルミスアルファ−アミラーゼよりも高活性である場合、例えば両者を所与のpH、またはpHを含め同一条件で比較したとき、本願のアルファ−アミラーゼ変異体の方が野生型B. リケニホルミスアルファ−アミラーゼよりもpH安定性が高い。
一般に、問題となるpH値はその酵素を実際に使用するときのpH値、またはその酵素が本来有する酵素活性を保持可能なpHの限界値またはその近傍のpH値である。
【0052】
「pH範囲」とはpHの範囲、例えば酸性側から塩基性側の範囲、またはこの逆の範囲を意味する。酵素活性に関しては、pH範囲は酵素が特定のレベルの活性、例えば最小活性、特定のパーセンテージの最大活性、または特定レベルの基質転換率または産物生成率を示すpHの上限値と下限値を意味する。
【0053】
細胞、核酸、タンパク質またはベクターについて「組み換え体」というときは、その細胞、核酸、タンパク質またはベクターに、非相同配列、または改変された天然配列が導入された結果物、または導入されたことを意味する。あるいは、その細胞が、そのように修飾または改変された細胞に由来することを意味する。従って、例えば組み換え体細胞は天然(非組み換え体)細胞には見られない遺伝子を発現するか、天然遺伝子を異なる態様(例えば過剰に発現するか、十分発現しない)で発現するか、異常に発現するか、または全く発現しない。
【0054】
「ヌクレオチド配列」または「核酸配列」とは、2以上のヌクレオチド、リボヌクレオチド等の配列、またはこれらの誘導体を意味する。ヌクレオチド配列にはオリゴヌクレオチド配列とポリヌクレオチド配列が含まれ、さらにこれらの変異体、相同体、断片、及び誘導体が含まれる。ヌクレオチド配列は一本鎖、二本鎖、または多重鎖である。ヌクレオチド配列は、例えばゲノム由来、合成由来、または組み換え体由来等、いかなる起源でもよく、ゲノムDNA、cDNA合成DNA、及びRNA等や、これらがハイブリッド形成されたものがヌクレオチド配列に含まれる。ヌクレオチド配列には1以上のコドンが含まれ、1以上のポリペプチドをコードする。ヌクレオチド配列は優先的に1以上のエネルギー的に最適な三次元構造をとる。
【0055】
「ベクター」とはin vitroの実験で有用なヌクレオチド配列を意味し、あるいは、1以上の細胞型へ核酸を導入するとき有用なヌクレオチド配列を意味する。ベクターには、クローン化ベクター、in vivo またはin vitroでの発現ベクター、シャトルベクター、プラスミド、ファージミド、コスミド、ファージ粒子、カセット等が含まれる。
【0056】
「発現ベクター」とは、適切な宿主中でDNAを発現可能な適切な制御配列に動作可能に結合したDNA配列を含むDNA構築体を意味する。このような制御配列には転写を開始するプロモータ、転写を制御する任意のオペレータ配列、mRNAに適切なリボソーム結合部位をコードする配列、転写と翻訳の終了を制御するエンハンサー及び配列が含まれる。
【0057】
他の配列に対し指定されたパーセント(例えば、少なくとも約80%, 85%, 90%, 95%, または99%)の配列同一性を有するポリヌクレオチドまたはポリペプチドとは、アライメントさせたとき、2つの配列の比較において一致するアミノ酸または塩基のパーセンテージを意味する。
このアライメント及び相同性または同一性パーセントは、例えばCURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel et al. (eds) 1987, Supplement 30, section 7.7.18) に記載されているような、公知のソフトウエアプログラムを用いて評価することができる。このようなプログラムにはGCG Pileupプログラム、FASTA (Pearson et al. (1988) Proc. Natl, Acad. Sci USA 85: 2444- 2448)、及びBLAST (BLAST Manual, Altschul et al. , Natl Cent. Biotechnol. Inf., Natl Lib. Med. (NCIB NLM NIH), Bethesda, Md., and Altschul et al, (1997) NAR 25:3389- 3402)が含まれている。また別のアライメントプログラムは、初期パラメータを用いるALIGN Plus (Scientific and Educational Software, PA)である。また別の有用な配列解析プログラムはSequence Software Package Version 6.0 (Genetics Computer Group, University of Wisconsin, Madison, WI)に含まれているTFASTA Data Searching Programである。
【0058】
当業者であれば、本願に含まれる配列は、例示したamyS配列とストリンジェントなハイブリッド形成条件下でハイブリダイズする能力によっても定義できることを理解できるであろう。(例えばWO 06/002643のSEQ ID NO:5参照)
核酸は一本鎖の形態のとき他の核酸配列とハイブリダイズすることができ、適切な温度及び溶液イオン強度の条件化で他の核酸配列とアニールすることができる。ハイブリッド形成条件及び洗浄条件は公知である。(例えば上記のSambrook (1989), 特に第9章及び11章参照) いくつかの実施形態では、ストリンジェントな条件は、Tm65℃, 0.1×SSC, 0.1% SDSである。
【0059】
「遺伝子」とは、ポリペプチドの産出に関与するDNAセグメントを意味し、コード領域の上流側及び下流側の領域と、各コードセグメント(エクソン)間の中間配列(イントロン)とを含む。
【0060】
ポリヌクレオチドまたはタンパク質について「非相同」というときは、天然の宿主細胞では生じないポリヌクレオチドまたはタンパク質を意味する。いくつかの実施形態では、タンパク質は商業的に重要なタンパク質である。非相同という用語には、天然遺伝子、突然変異遺伝子、または合成遺伝子でコードされたタンパク質が含まれる。
【0061】
ポリヌクレオチドまたはタンパク質について「内因性」というときは、天然宿主細胞で産出されるポリヌクレオチドまたはタンパク質を意味する。
【0062】
細胞について「形質転換された」、「安定に形質転換された」及び「遺伝子組み換えの」というときは、その細胞に少なくとも1の非天然(非相同)核酸配列が含まれていることを意味する。安定に形質転換された細胞には、この細胞のゲノム、または多世代にわたり保存されるエピソームプラスミドに組み込まれた、少なくとも1のこのような非相同核酸配列が含まれている。
【0063】
「発現」とは、遺伝子の核酸配列に基づいてポリペプチドが産出されるプロセスを意味する。このプロセスには、転写と翻訳の両者が含まれる。
【0064】
「シグナル配列」とは、タンパク質のN-末端に共有結合したアミノ酸配列を意味し、例えば成熟タンパク質の細胞外への分泌等、タンパク質の輸送を促進する。このシグナル配列の定義は機能面に関するものである。細胞外タンパク質の成熟型には、シグナル配列は含まれていない。シグナル配列は、例えば分泌プロセスの間に切断される。
【0065】
本願では「誘導された」という用語には、「に由来する」、「から得られる」、または「から得ることができる」及び「から単離された」等の用語も含まれる。
【0066】
本願では「タンパク質」及び「ポリペプチド」は同義で用いる。本願ではアミノ酸を表す従来の1文字のコード及び3文字のコードを用いる。
【0067】
「プロモータ」とは、遺伝子の転写を開始する際のRNAポリメラーゼの結合に関与する調節配列を意味する。プロモータは、誘導プロモータまたは構成的プロモータである。例えば、本願では誘導プロモータであるトリコデルマ・リーゼイ (Trichoderma reesei)由来のcbhlを用いることができる。
【0068】
「作動可能に結合」とは、各エレメントが物理的に近接した位置には無いが、互いに機能的に関連するように並置されていることを意味する。例えば、プロモータがコード配列を制御する能力を有し、転写を行える条件下、または転写が許可される条件下で実際にプロモータがコード配列の転写を制御しているとき、プロモータはコード配列に対し作動可能に結合していると言う。
【0069】
「選択マーカー」とは、宿主細胞中で発現することができる遺伝子であって、選択マーカー遺伝子を発現させることにより、宿主細胞の選択を容易に行なうことができる遺伝子を意味する。
選択可能マーカーの非限定的例示として、抗生物質(例えばハイグロマイシン、ブレオマイシン、またはクロラムフェニコール)に対する耐性を改変する遺伝子、および/または、例えば唯一の炭水化物を栄養源とする特定の基質上で成長するように宿主細胞に栄養的選択性を賦与する等の、代謝選択性を賦与する遺伝子が挙げられる。
【0070】
細胞中への核酸配列の挿入に関して「導入された」というときは、「トランスフェクション」または「形質転換」または「形質導入」を意味する。また「導入された」というときは、真核性または原核性細胞へ核酸を組み込むことも含まれ、この場合、核酸配列は細胞のゲノム (例えばクロモソーム、プラスミド、プラスチド、ミトコンドリアDNA)に組み込まれ、自律的レプリコンに転換されるか、一時的に発現される(例えばトランスフェクトmRNA)。
【0071】
「宿主」、「宿主株」、または「宿主細胞」とは、発現ベクター、または例えばアルファ−アミラーゼ変異体をコードするポリヌクレオチドを含むDNA構築体の導入に適した細胞を意味する。宿主株は好ましくは細菌の細胞である。好ましい実施形態では、「宿主細胞」とは細胞、および/または、例えばバスラス種等の微生物株の細胞由来のプロトプラストを意味する。
【0072】
「培養」とは微生物細胞の集団を、微生物細胞を成長させることが可能な培地上において適切な条件下で成長させることを意味する。ひとつの実施形態では、培養とは、澱粉粒を含む澱粉基質を発酵させ(通常容器または反応器中で)生物変換により最終製品にすることを意味する。
【0073】
「酵素的転換」とは、酵素の作用により基質を変化させることを意味する。また、この用語は澱粉基質を酵素の作用により変化させることも意味する。
【0074】
本願では、「糖化」とは澱粉からグルコースへの酵素的転換を意味する。
【0075】
「重合度(DP)」とは、あるサッカライド中の無水グルコピラノースユニットの数(n)を意味する。DP1の例は、グルコース及びフラクトース等のモノサッカライドである。DP2の例は、マルトース及びサッカロース等のジサッカライドである。DP>3は重合度が3より大きいポリマーを表わす。当業者であればDEが大きいほど、より高分子性になることを理解できよう。
【0076】
「最終製品」または「所望の最終製品」とは、例えば澱粉基質から酵素により転換された澱粉由来の物質等の、酵素的反応により得られる目的製品を意味する。
【0077】
「残留澱粉」とは、澱粉含有基質を発酵させた後の組成物中に残留している(溶解または非溶解)澱粉を意味する。
【0078】
「比活性度」とは、特定の条件下において、酵素調合液によって製品へ転換された、単位時間当たりの基質のモル数で定義される酵素単位を意味する。比活性度は単位(U)/タンパク質の単位重量で表わされ、通常U/mgタンパク質で表記する。
【0079】
「収量」とは、本願の方法で製造された最終製品または所望の最終製品の量を意味する。いくつかの実施形態では、本願による収量は、公知の方法で製造した場合よりも多い。いくつかの実施形態では、収量は最終製品の容積を意味し、別の実施形態では、収量は最終製品の濃度を意味する。
【0080】
「生物学的に活性」とは、例えば細胞、器官、有機体等の生物学系に有意な効果を及ぼす化合物または配列を意味する。
【0081】
「ATCC」はManassas, VA 20108にあるAmerican Type Culture Collectionを意味する。
【0082】
「NRRL」はPeoria, 111にあるAgricultural Research Service Culture Collection, National Center for Agricultural Utilization Researchを意味する。(以前の名称はUSDA Northern Regional Research Laboratoryであった。)
【0083】
「食物」とは、ヒトを含め動物に栄養を供給する材料、成分または組成物を意味する。
【0084】
本願の英文明細書では、タンパク質とそのタンパク質をコードする遺伝子を記述するとき、慣例により遺伝子をイタリック体で表記する。(例えばamyL (B.リケニホルミスAA)をコードする遺伝子はamyLと表記する。)タンパク質はイタリック体で表記せず、最初の文字を大文字で表記することがある。(例えばamyL遺伝子でコードされたタンパク質は、AmyLまたはamyLと表記する。)特に断りのない限り、核酸は左から右に向かって5'から3'方向に記載し、アミノ酸配列は左から右に向かってアミノ基からカルボキシル基方向に記載に記載する。
【0085】
英文明細書の「comprising」とその同義語は包括的意味で用いる。すなわち、「including」及びその同義語と同じである。数値範囲には上・下限値も含まれる。
【0086】
文中の見出しは本願の実施形態を限定するものではない。
【0087】
本願に開示した方法や原料と類似または同等の任意の方法や原料を本願発明の実施または試験に用いることができる。本願には現時点で好ましいと考えられる方法や原料を記載したが、本願発明は特定の方法、手段、試薬の使用に限定されず、適宜変更することができる。本願で参照する全ての特許及び文献、及びこれらに開示された配列は本願に参照として組み込まれる。
【0088】
<2.命名法>
本願では、アミノ酸残基の命名に従来用いられている1文字及び3文字のコードを用いる。分かり易くするため、アルファ−アミラーゼ変異体の表記には以下に示す命名法を用いる。
元のアミノ酸:位置:置換アミノ酸
【0089】
この命名法によれば、例えば位置242のセリンのアラニンによる置換は次のように表記する:
Ser242Ala または S242A
位置30のアラニンの欠失は次のように表記する:
Ala30* または A30* または ΔA30
リジン等のアミノ酸残基の挿入は次のように表記する:
Ala30AlaLys または A30AK
【0090】
例えばアミノ酸残基30〜33のような、連続するアミノ酸残基の欠失は次のように表記する:
(30-33)* または Δ(A30-N33)
【0091】
あるアルファ−アミラーゼが、他のアルファ−アミラーゼと比較したとき「欠失」を有し、さらに欠失した位置に挿入がある場合は次のように表記する。例えば位置36にアスパラギン酸の挿入がある場合には次のように表記する:
*36Asp または *36D
【0092】
多重突然変異はプラス記号で分離して表記する。すなわち、位置30及び34のアラニンとグルタミン酸をそれぞれアスパラギンとセリンで置換した場合には次のように表記する:
Ala30Asp+Glu34Ser または A30N+E34S
【0093】
所与の位置に1以上のアミノ酸残基が挿入される場合には次のように表記する:
A30N,E あるいは、A30N または A30E
【0094】
さらに、本願に好ましい修飾位置が指定されているが、その位置の修飾内容が指定されていない場合は、その位置に在るアミノ酸残基を任意のアミノ酸残基で置換できることを意味する。従って、例えば位置30のアラニンを修飾することは記載されているが、修飾内容が指定されていない場合は、そのアラニンは欠失されるか、他のアミノ酸、すなわち下記のアミノ酸のいずれかで置換されることを意味する:
R, N, D, A, C, Q, E, G, H, I, L, K, M, F, P, S, T, W, Y, V。
【0095】
さらに、「A30X」は下記の置換のいずれかであることを意味する。
A30R, A30N, A30D, A30C, A30Q, A30E, A30G, A30H, A30I, A30L, A30K, A30M, A30F, A30P, A30S, A30T, A30W, A30Y, or A30 V; または短縮して次のように表記する:
A30R,N,D,C,Q,E,G,H,I,L,K,M,F,P,S,T,W,Y,V.
【0096】
上記の番号付与に用いた親酵素が、置換用として示されたアミノ酸残基を上記の指定位置に既に備えている場合には、次のように表記する:
例えば、野生型にNまたはVが存在する場合、「X30N」または 「X30N,V」
これは、他の対応する親酵素は、位置30において「Asn」または「Val」で置換されることを示す。
【0097】
<3.アミノ酸残基の特性>
[荷電アミノ酸]
Asp, Glu, Arg, Lys, His
[負荷電アミノ酸](負荷電の最も強いものが最初)
Asp, Glu
[正荷電アミノ酸](正荷電の最も強いものが最初)
Arg, Lys, His
[中性アミノ酸]
Gly, Ala, Val, Leu, lie, Phe, Tyr, Trp, Met, Cys, Asn, Gln, Ser, Thr, Pro
[疎水性アミノ酸](疎水性の最も強いものが最後)
Gly, Ala, Val, Pro, Met, Leu, lie, Tyr, Phe, Trp,
[親水性アミノ酸](親水性の最も強いものが最後)
Thr, Ser, Cys, Gln, Asn, Asp, Lys, Arg
【0098】
<4. アルファ−アミラーゼ及びAmyS-様アミラーゼ>
4.1 種々のアルファ−アミラーゼのアミノ酸
バシラス種により産出される多くのアルファ−アミラーゼはアミノ酸レベルでの相同性(同一性)が高く、本願の親酵素として有用である。公知のバシラスアルファ−アミラーゼ相互間の同一性パーセント(アミノ酸配列基準)を下記のTABLE Aに示す。
【表1】

【0099】
当業者であれば、パーセント同一性は文献、公知の方法または本願に開示した方法で求められることを理解できよう。
例えば、B. リケニホルミスのアルファ−アミラーゼ(LAT)(SEQ ID NO: 7)とB. アミロリケファシエンスのアルファ−アミラーゼ(SEQ ID NO: 9)との相同性は約81%であり、G. ステアロサーモフィリスのアルファ−アミラーゼ(BSG) (SEQ ID NO: 1) との相同性は約65%であることが知られている。
さらに、SP690 及び SP722を含む相同アルファ−アミラーゼがWO 95/26397に開示されている。また、Tsukamotoらのバシラス種(SEQ ID NO:6)由来の#707アルファ−アミラーゼ(Tsukamoto et al., Biochemical and Biophysical Research Communications, 151 (1988), pp. 25-31)が知られている。WO 97/00324(KAO Corporation)にKSM AP1378アルファ−アミラーゼが開示されている。
【0100】
4.2 親アルファ−アミラーゼ
上記のAmyS-様アミラーゼを親アルファ−アミラーゼとして用いることができる。好ましい実施形態では、親アルファ−アミラーゼは、例えば上記のSEQ ID NO:1 または2のアミノ酸配列を有するG. ステアロサーモフィリスのアルファ−アミラーゼのように、G. ステアロサーモフィリスから誘導されたものである。
【0101】
4.3 親ハイブリッドアルファ−アミラーゼ
親アルファ−アミラーゼ(すなわちバックボーン・アルファ−アミラーゼ)はハイブリッドアルファ−アミラーゼでもよい。すなわち、少なくとも2のアルファ−アミラーゼから誘導されたアミノ酸配列の組合せから成るアルファ−アミラーゼでもよい。
【0102】
親ハイブリッドアルファ−アミラーゼは、アミノ酸の相同性(同一性)、および/または、DNAハイブリッド形成(上記のとおり)に基づき、上記のAmyS-様アミラーゼの範疇に属するとされるものである。この場合のハイブリッドアルファ−アミラーゼは典型的には、少なくとも1のAmyS-様アミラーゼの一部と、AmyS-様アミラーゼ、または微生物起源(細菌または菌類)、および/または哺乳動物起源の非AmyS-様アミラーゼから選択される1以上の他のアルファ−アミラーゼとから成る。
【0103】
すなわち、親ハイブリッドアルファ−アミラーゼは、少なくとも2のAmyS-様アミラーゼから誘導された複数のアミノ酸配列の一部同士の組合せ、または少なくとも1のAmyS-様アミラーゼ及び少なくとも1の細菌性非AmyS-様アミラーゼから誘導された複数のアミノ酸配列の一部同士の組合せから成る。
または、少なくとも1のAmyS-様アミラーゼ及び少なくとも1の細菌性非AmyS-様アミラーゼから誘導された複数のアミノ酸配列の一部同士の組合せから成る。または、少なくとも1のAmyS-様アミラーゼ及び少なくとも1の菌性非AmyS-様アミラーゼから誘導された複数のアミノ酸配列の一部同士の組合せから成る。アミノ酸配列の一部が誘導されるAmyS-様アミラーゼは、本願の特異的AmyS-様アミラーゼのいずれかである。
【0104】
親アルファ−アミラーゼは、例えばB.リケニホルミス株から誘導されたアルファ−アミラーゼのC-末端部と、G.ステアロサーモフィリス株またはG.ステアロサーモフィリス株(BSG)から誘導されたアルファ−アミラーゼのN-末端部とから成る。
【0105】
5. 相同性(同一性)
相同性とは、2つの配列の間の関係について、例えば1の配列が他の配列から派生したこと、またはその逆であることを示唆する、2つの配列の間の同一性の程度と定義することができる。相同性は目視による比較または計算で求めることができる。より便利な方法は、GCGプログラムパッケージ(上記)に含まれているGAP等の公知のコンピュータプログラムを用いることである。
すなわち、Gap GCG v8を、同一性についての初期スコアリング・マトリックス、及び以下の初期パラメータを設定して用いる:核酸配列、及び配列比較についてそれぞれGAPクリエーション・ペナルティ5.0、及びGAPエクステンション・ペナルティ0.3、タンパク質配列比較についてGAPクリエーション・ペナルティ3.0、及びGAPエクステンション・ペナルティ0.1。GAPでは、アライメントと同一性の計算に、Needlemanと Wunschの方法を用いている。(Needleman and Wunsch, (1970), J. MoI. Biol. 48: 443-453)
【0106】
Spezyme Xtra (SEQ ID NO:2)と他のアルファ−アミラーゼとの構造のアライメントを、他のAmyS-様アルファ−アミラーゼにおける同等/対応する位置の同定に用いることができる。
この構造のアライメントを行う1つの方法は、GCGパッケージに含まれるPile Upプログラムを、初期設定値をGAPクリエーション・ペナルティ3.0、及びGAPエクステンション・ペナルティ0.1に設定して用いることである。アライメントを行う別の方法には、疎水性クラスター分析法(Gaboriaud et al. , FEBS Lett. 224: 149- 155, 1987)や、逆ステッディング法(Huber, T; Torda, AE, Protein Sci. 7(1): 142-149, 1998)等がある。
【0107】
6. ハイブリッド形成
上記のAmyS-様アルファ−アミラーゼの解析に用いるオリゴヌクレオチドプローブは、対象とするアルファ−アミラーゼのヌクレオチドまたはアミノ酸配列の全部または一部に基づいて調製することができる。
【0108】
ハイブリッド形成を評価する好ましい条件には、5X SSCに予浸し、次に、20%ホルムアミド、5X Denhardt溶液、リン酸ナトリウム50mM, pH 6.8、及び超音波で切断した変性仔ウシ胸腺DNA50 mgを含む溶液中で40℃において1時間予備ハイブリッド形成し、次に、100mMのATPを追加した同じ溶液中で40℃において18時間ハイブリッド形成し、次に、フィルターにおいて2X SSC、0.2%SDSを用いて40℃(低ストリンジェント)、好ましくは50℃(中ストリンジェント)、より好ましくは65℃(高ストリンジェント)、さらに好ましくは75℃(より高ストリンジェント)で30分間洗浄する。ハイブリッド形成の詳細はSambrook et al, MOLECULAR CLONING: A LABORATORY MANUAL, 2nd Ed., Cold Spring Harbor, 1989に記載されている。
【0109】
本願では、「から誘導された」というときは、対象とする有機体の株から産出されたか、産出可能なアルファ−アミラーゼを意味するだけでなく、このような株から単離されたDNA配列を用いて形質転換された宿主有機体のDNA配列によりコードされたアルファ−アミラーゼも意味する。
すなわち、「から誘導された」という用語は、合成および/またはcDNA起源のDNA配列でコードされたアルファ−アミラーゼであって、対象とするアルファ−アミラーゼの特性を備えるアルファ−アミラーゼを意味する。
また、この用語は親アルファ−アミラーゼが天然アルファ−アミラーゼの変異体であること、すなわち天然アルファ−アミラーゼの1以上のアミノ酸残基を修飾(挿入、置換、欠失)して得られた変異体であることを意味する。
【0110】
7. アルファ−アミラーゼ変異体中の突然変異
ひとつの実施形態では、本願のアルファ−アミラーゼ変異体は上記の修飾に加え、1以上の修飾を有する。すなわち、修飾されたアルファ−アミラーゼ変異体の一部の1以上のプロリン残基(Pro)が、天然の非プロリン残基のいずれかで置き換えられていることが好ましく、この非プロリン残基はアラニン、グリシン、セリン、スレオニン、バリン、またはロイシンのいずれかであることが好ましい。
【0111】
同様に、ひとつの実施形態では、親アルファ−アミラーゼ中の1以上のシステイン残基がアラニン、グリシン、セリン、スレオニン、バリン、またはロイシンのいずれか等の非システイン残基で置き換えられていることが好ましい。
【0112】
本願には、このような修飾が2以上導入されたアルファ−アミラーゼ変異体が含まれる。
【0113】
さらに、1以上の下記の位置に突然変異を導入することが好ましい(番号はSEQ ID NO:7に従う)。
M15, V128, A111, H133, W138, T149, M197, N188, A209, A210, H405, T412。
特に、以下の一重、二重、三重、または多重突然変異が好ましい。
M15X,特にM15T,L;
V128X,特にV128E;
H133X,特にHl33Y;
N188X,特にN188S,T,P;
M197X,特にM197T,L;
A209X,特にA209V;
M197T/W138F; M197T/138Y; M15T/H133Y/N188S;
M15N128E/H133Y/N188S; E119C/S130C; D124C/R127C; H133Y/T149I;
G475R,H133Y/S187D; H133Y/A209V.
【0114】
SEQ ID No.7のアミノ酸配列を有する親アルファ−アミラーゼの場合、酸化安定性を向上させるために欠失または置換されるアミノ酸配列は単一のシステイン残基(C363)、及びID NO:2における位置M8, M9, M96, M200, M206, M284, M307, M311, M316及びM438にあるメチオニン残基である。
【0115】
アルファ−アミラーゼ変異体の熱安定性を親アルファ−アミラーゼよりも向上させる場合、SEQ ID NO:2に示すアミノ酸配列中の次のアミノ酸残基の1、好ましくは2、または3を欠失させることが好ましい:F178, R179, G180, I181, G182 及びK183。
【0116】
このようなタイプの欠失において、特に好ましいペアワイズ欠失はR179*+G180*; 及び I181*+G182* である(それぞれSEQ ID No.16、15参照)(または、本願の親アルファ−アミラーゼに対する要件を満たす他のアルファ−アミラーゼにおける、これらと同等のペアワイズ欠失)。
【0117】
EQ ID No.2に示すアミノ酸配列における他の修飾対象となる残基には、N193F 及び V416Gが含まれる。
【0118】
8. アルファ−アミラーゼ変異体の改変された性質
8.1 概論
以下に、本願の変異体中の突然変異と、この突然変異により生じる所望の改変された性質(親AmyS-様アルファ−アミラーゼに対し改変された性質)との関係を説明する。
【0119】
本願に、改変された性質を有するAmyS-様アルファ−アミラーゼを開示する。本願が対象とする親アルファ−アミラーゼは、AmyS-様アルファ−アミラーゼ及び親ハイブリッドAmyS-様アルファ−アミラーゼである。
【0120】
ひとつの実施形態では、ゲオバシラス・ステアロサーモフィリスのアルファ−アミラーゼ(SEQ ID NO:2)、すなわち親アミラーゼから出発する。しかし、別の実施形態ではSP722, BLA, BAN, AA560, SP690, KSM AP1378, #707または他のバシラスアルファ−アミラーゼを用いることができる。SEQ ID NO:2における位置に相当するアミノ酸位置は、本願の開示内容に従って容易に決めることができる。
【0121】
当業者であれば、特定の変異体中の修飾された、または修飾されるアミノ酸残基の位置番号/特定するための参照として、任意の親アルファ−アミラーゼを用いることができることを理解できるであろう。しかし、SEQ ID NO:1に示す配列が現時点で分かっている最も長いB.ステアロサーモフィリスの配列であることから、現時点ではSEQ ID NO:1がこの目的に適した配列である。
ひとつの側面では、本願は上記のような改変された性質を有するアルファ−アミラーゼ変異体に関する。
【0122】
いくつかの側面の中のひとつでは、本願により親G.ステアロサーモフィリスアルファ−アミラーゼの変異体が提供され、この変異体は下記の群から選択される1以上の位置(例えばSEQ ID NO:1の位置番号を用いる)が変更されている:P17, D19, T21, N28, S51, G72, V74, A82, Q86, Q89, A93, G95, Q97, W115, D117, P123, S124, D125, N127, I130, G132, Q135, P145, G146, G148, S153, Y159, W166, S169, K171, W187, P209, N224, S242, G256, D269, N271, T278, N281, G302, A304, R308, T321, Q358, P378, S382, K383, T398, H405, T417, E418, P420, G421, P432, W437, G446, G454, S457, T459, T461, S464, G474, R483;
ここで、
(a) 変更点はそれぞれ独立して(i)その位置を占めるアミノ酸の下流側へのアミノ酸の挿入、(ii)その位置を占めるアミノ酸の欠失、または(iii)その位置を占めるアミノ酸の別のアミノ酸による置換であり、
(b) その変異体はアルファ−アミラーゼ活性を有し、
(c) 各アミノ酸位置が、例えばGenencor社から商品名SPEZYME XTRAとして販売されている切断されたアルファ−アミラーゼ等の、SEQ ID NO:2に示すアミノ酸配列を有するG.ステアロサーモフィリス等の親アミラーゼのアミノ酸配列の位置に相当する。
【0123】
本願では特に S242A, S242Q, S242N 及び S242E変異体が好ましい。
【0124】
また、Rl79, Gl80, I181, Gl82, 及び K183残基をカルシウム−ナトリウム結合領域における突然変異の効果を検討するために選択し、またアルファ−へリックスの中央に位置するプロリンは独特であることからP245を選択した。
【0125】
他の親AmyS-様アルファ−アミラーゼにおいて対応する位置は、例えば図4に示したアライメントの配列等の、上記に記載したアライメントにより理解することができる。すなわち、本願には上記の番号の位置(例えばSEQ ID NO:1を比較用アミノ酸位置番号とする)の1以上が変更された親AmyS-様アルファ−アミラーゼの変異体を開示する。
【0126】
8.2改変された性質:安定性
本願のアルファ−アミラーゼ変異体において、改変された安定性、特に改良された安定性(すなわち増加または減少)を得る上で重要な突然変異(アミノ酸置換および欠損を含む)、特に高温度(すなわち約70〜120℃)、および/または厳しいpH(すなわち低pHまたは高pH領域、すなわちそれぞれpH4.0から6.0、pH 8.0から11.0)、特に60 ppm未満のカルシウムフリー濃度(すなわち非結合、従って溶液中)において、改良された安定性を得る上で重要な突然変異には、「改変された性質」に記載された突然変異のいずれかである。安定性は、下記の「測定方法」の項の記載に従って評価することができる。
【0127】
8.3 改変された性質:Ca2+安定性
改変されたCa2+安定性とは、Ca2+が欠乏した条件下での酵素の安定性が改善されることを意味する。すなわち、安定性が親酵素に対し増加または減少することである。本願のアルファ−アミラーゼ変異体では、改変されたCa2+安定性、特に改良されたCa2+安定性、すなわち増加または減少した安定性を、特に高pH領域(すなわちpH8.0から10.5)において得るために重要な突然変異(アミノ酸置換及び欠失を含む)には、「改変された性質」に記載された突然変異のいずれかが含まれる。
【0128】
8.4 改変された性質:比活性度
また別の側面では、特に約10-60℃、好ましくは20-50℃、特に約0-40℃において改変された比活性度、特に増加または減少した比活性度を得る上で重要な突然変異(アミノ酸置換及び欠失を含む)には、「改変された性質」に記載された突然変異のいずれかが含まれる。比活性度は、下記の「測定方法」の項の記載に従って評価することができる。
【0129】
8.5 改変された性質:酸化安定性
本願のアルファ−アミラーゼ変異体は、親アルファ−アミラーゼに対し改変された酸化安定性、特に改善された酸化安定性を有することができる。増加された酸化安定性は、例えば洗剤組成物において有用であり、減少された酸化安定性は、例えば澱粉液化用の組成物において有用である。酸化安定性は、下記の「測定方法」の項の記載に従って評価することができる。
【0130】
8.6 改変された性質:pH特性
改変されたpH特性、特に高pH(すなわちpH 8〜10.5)または低pH(すなわちpH 4〜6)における改善された活性を得るために重要なアミノ酸位置及び突然変異には、活性部位残基の近傍のアミノ酸残基の突然変異が含まれる。
好ましい特定の突然変異/置換には、上記の「改変された性質」に記載された対象とする位置に関する突然変異/置換が含まれる。改変されたpH特性はの評価方法は、下記の「測定方法」の項に記載されている。
【0131】
8.7 改変された性質:洗浄性能
改変された洗浄性能、特に高pH(すなわちpH 8.5〜11)における洗浄性能を得るために重要なアミノ酸位置及び突然変異には、上記の「改変された性質」に記載された対象とする位置に関する突然変異/置換が含まれる。
洗浄性能は、下記の「測定方法」の項の記載に従って評価することができる。
【0132】
9. アルファ−アミラーゼ変異体を調製する方法
遺伝子に突然変異を導入する方法は、アルファ−アミラーゼをコードするDNA配列をクローン化する方法として知られている。このような方法には、以下説明する、アルファ−アミラーゼをコードする配列中の特定の部位に突然変異を誘発させる方法が含まれる。
【0133】
9.1 アルファ−アミラーゼをコードするDNA配列のクローン化
親アルファ−アミラーゼをコードするDNA配列は、公知の種々の方法により、対象とするアルファ−アミラーゼを産出する細胞または微生物から分離することができる。
まず、対象とするアルファ−アミラーゼを産出する有機体由来の染色体DNAまたはメッセンジャーRNAを用いて、ゲノムDNAおよび/またはcDNAライブラリーを構築する。α−アミラーゼのアミノ酸配列が分かっている場合、相同の標識オリゴヌクレオチドプローブを合成し、これを用いて対象とする有機体から調製したゲノムライブラリーに由来するアルファ−アミラーゼをコードするクローンを特定する。
または、アミノ酸配列が分かっているα−アミラーゼ遺伝子に相同の配列を含む標識されたオリゴヌクレオチドをプローブとして用い、例えば低ストリンジェント条件のハイブリッド形成及び洗浄を用いて、アルファ−アミラーゼをコードするするクローンを特定することもできる。
【0134】
α−アミラーゼをコードするクローンを特定する別の方法では、ゲノムDNAの断片をプラスミドなどの発現ベクターに挿入し、得られたゲノムDNAライブラリーでα−アミラーゼ陰性細菌を形質転換し、この形質転換した細菌をα−アミラーゼ用の基質を含む寒天上に塗布し、次にクローンにα−アミラーゼを発現させることによって、α−アミラーゼをコードするクローンを容易に特定することができる。
【0135】
あるいは、酵素をコードするDNA配列を、確立された標準的方法で合成することによって作ることもできる。このような確立された標準的方法の例は、S. L. Beaucage and M. H. Caruthers, Tetrahedron Letters 22: 1859-1869 (1981)に記載されたホスホルアミダイド法、またはMatthes et al. , EMBO J. 3 : 801 -895 ( 1984)に記載された方法等である。
ホスホロアミダイト法では、オリゴヌクレオチドを例えば自動DNA合成機で合成し、次に精製、アニーリング、ライゲーション、および適切なベクター中でクローニングする。
【0136】
最後に、アルファ−アミラーゼをコードするDNA配列は、起源が異なる配列の混合体、例えばゲノム配列及び合成配列の混合体、合成配列及びcDNA配列の混合体、またはゲノム配列及びcDNA配列の混合体であり、好ましくは合成、ゲノム、またはcDNA起源の断片(この断片はDNA配列全体の様々な部分に相当する)を標準的な方法でライゲーションすることによって調製されたDNA配列である。
あるいは、例えば米国特許No. 4,683,202またはR. K. Saiki et al. EMBO J. 3:801-895 (1988) に開示された特定のプライマーを用いたポリメラーゼ連鎖反応(PCR)によってこのようなDNA配列を調製することもできる。
【0137】
9.2 部位特異的変異誘発
アルファ−アミラーゼをコードするDNA配列を単離し、突然変異させる所定の配列を特定した後、合成オリゴヌクレオチドを用いて突然変異を導入する。このようなオリゴヌクレオチドには、所定の突然変異部位に隣接するヌクレオチド配列が含まれている。突然変異ヌクレオチドは、オリゴヌクレオチドを合成しているとき挿入する。
特定の方法では、アルファ−アミラーゼをコードする配列を橋渡しするDNAの一本鎖ギャップが、アルファ−アミラーゼ遺伝子を有するベクター中に作られる。次にこの一本鎖DNAの相同な位置に、所定の突然変異を有する合成ヌクレオチドをアニールする。残りのギャップをDNAポリメラーゼI (Klenow断片)で埋め、得られた構築体をT4リガーゼによってライゲートする。この方法の例は、Morinaga et al. Biotechnology 2:636-639 (1984)に開示されている。
米国特許No. 4,760,025には、多重突然変異をコードするするオリゴヌクレオチドを、カセットの一部を改変して導入することが開示されている。しかしMorinagaの方法によれば、様々な種類と長さのオリゴヌクレオチドを導入することができるので、さらに多様な突然変異を随時導入することができる。
【0138】
Nelson and Long, Analytical Biochem., 180:147-151 (1989) に、アルファ−アミラーゼをコードする配列中に突然変異を導入する別の方法が開示されている。この方法には、PCR反応のプライマーの1つとして化学合成DNA鎖を用いて導入された所望の突然変異を含むPCR断片を生成させる3段階の工程が含まれている。制限エンドヌクレアーゼで切断することによって、生成したPCR断片から突然変異を保有するDNA断片を単離し、発現プラスミド中に再挿入する。
【0139】
当業者であれば、これら以外の様々な方法で本願の変異体を生成または得ることができることを理解できよう。例えばWO 95/22625 (Affymax Technologies N.V.)に開示された遺伝子シャッフリングや、WO 96/00343 (Novo Nordisk A/S)、または対象とする置換や欠失等の突然変異を含むハイブリッド酵素が得られるその他の方法を用いることができる。
【0140】
9.3. アルファ−アミラーゼ変異体の発現
本願に開示する方法、または別の公知の方法で作られ、酵素変異体をコードするDNA配列は、適切なプロモータ、オペレータ、リボソーム結合部位、翻訳開始シグナル、及び、任意にリプレッサー遺伝子、または種々のアクティベータ遺伝子をコードする制御配列を有する発現ベクターを用いて、酵素として発現させることができる。
【0141】
本願で用いるα-アミラーゼ変異体をコードするDNA配列を有する組換え発現ベクターは、DNA組換えに適したベクターであり、ベクターの選択はベクターが導入される宿主細胞に依存する。従って、ベクターは独立して複製するベクター、すなわち、染色体外の構成要素として存在するベクターである。ベクターの複製は染色体の複製から独立している。ベクターは、例えばプラスミド、バクテリオファージ、または染色体外の要素、ミニ染色体、または人工染色体である。
あるいは、ベクターは、宿主細胞のゲノムに組み込まれ、そのベクターが組み込まれた染色体とともに複製される。
【0142】
ベクター中では、DNA配列は、適切なプロモータ配列に作動可能に結合している。プロモータは、選択された宿主細胞中で転写活性を示すDNA配列であり、宿主細胞と相同または非相同の蛋白をコードする遺伝子に由来する。
本願のα-アミラーゼ変異体をコードするDNA配列の転写を行なうために、特に細菌性宿主中で転写を行なうために適するプロモータの例として、大腸菌の乳糖オペロンのプロモータ、スプレプトマイセス・セリカラー・アガラーゼ(Streptomyces coelicolor agarase)遺伝子のdagAのプロモータ、バシラス・リケニホルミス(Bacillus licheniformis)α-アミラーゼ遺伝子(amyL) のプロモータ、ゲオバシラス・ステアロサーモフィルス・マルトース生成性アミラーゼ遺伝子(amyM)のプロモータ、バシラス・アミロリキファシエンス(Bacillus amyloliquefaciens)α-アミラーゼ(amyQ) のプロモータ、バシラス・スブチリスxylA及びxylB遺伝子のプロモータ等が挙げられる。
菌類宿主中での転写において有用なプロモータの例として、A.オリザエ(oryzae)TAKAアミラーゼ、リゾムコール・ミエヘイ(Rhizomucor miehei)アスパラギン酸プロテイナーゼ、A. ニガー(niger)の中性アルファ−アミラーゼ、A. ニガーの酸安定性アルファ−アミラーゼ、A. ニガーグルコアミラーゼ、リゾムコール・ミエヘイリパーゼ、A.オリザエのアルカリ性プロテアーゼ、A.オリザエのオリオースリン酸イソメラーゼ、またはA. ニジュランス(nidulans)のアセトアミダーゼ等をコードする遺伝子由来のものが挙げられる。
【0143】
また本願で有用な発現ベクターには適切な転写ターミネーターが含まれ、真核生物では、アルファ−アミラーゼ変異体をコードするDNAに作動可能に結合したポリアデニル化配列が含まれる。ターミネーター配列及びポリアデニル化配列は、プロモータと同じ供給源から得ることができる。
【0144】
ベクターはさらに、対象とする宿主細胞中でのベクターの複製を可能にするDNA 配列を備える。このような配列の例は、プラスミドpUC19, pACYC177, pUBl10, pE194, pAMBl 及びpIJ702の複製起点である。
また、ベクターは選択マーカーを備える。選択マーカーは、例えばバシラス・スブチリス由来、またはバシラス・リケニホルミス由来のdal遺伝子のように宿主細胞の欠陥の相補体となる遺伝子、または、例えばアンピシリン耐性、カナマイシン耐性、クロラムフェニコール耐性、またはテトラサイクリン耐性等の、抗生物質耐性を賦与する遺伝子である。ベクターはさらに、amdS, argB, niaD 及びsC等のアスペルギルス選択マーカー、ハイグロマイシン耐性を高めるマーカーが含まれる。あるいは例えば、国際公開WO 91/17243に開示されているように、同時形質転換によって選択を行うこともできる。
【0145】
細胞内発現は、例えば宿主にある種の細菌を用いる場合等に有利であるが、一般的には、変異体の発現は細胞外の培地へ行なうことが好ましい。通常、本願のバシラスα-アミラーゼは、発現されたプロテアーゼの培地への分泌を可能にする前領域を備える。所望により、各前領域をコードするDNA配列を置換することにより、この前領域を別の前領域、またはシグナル配列で置き換えることができる。
【0146】
α-アミラーゼ変異体、プロモータ、ターミネーター、その他の要素をそれぞれコードするDNA構築体をライゲートし、複製に必要な情報を有するベクターにこれらを挿入するための方法は公知である(例えばSambrook et al, MOLECULAR CLONING: A LABORATORY MANUAL, 2nd Ed., Cold Spring Harbor, 1989参照)。
【0147】
本願で用いる細胞は、例えば上記のDNA構築体または発現ベクターのいずれかを含み、α-アミラーゼ変異体の組換え産出の宿主細胞として用いられる。この細胞は、宿主の染色体にDNA構築体(1以上のコピー)を組み込むことにより、変異体をコードするDNA構築体によって形質転換される。DNA配列は細胞中でより安定して存在し得るため、このような組み込みは有利であると考えられる。DNA構築体の宿主の染色体への組み込みは、例えば相同または非相同組換え等の公知の方法で行なうことができる。あるいは、宿主細胞を、上記の異なる種類の宿主細胞に関して説明したように、発現ベクターで形質転換することもできる。
【0148】
本願で用いる細胞は、哺乳類や昆虫等の高等な有機体の細胞でもよいが、好ましくは例えば細菌や菌類(イーストを含む)等の微生物の細胞である。
【0149】
好ましい細菌の例はグラム陽性細菌であり、例えばバシラス・スブチリス、バシラス・リケニホルミス、バシラス・レンタス(Bacillus lentus)、バシラス・ブレビス(Bacillus brevis)、ゲオバシラス・ステアロテルモフィラス、バシラス・アルカロフィラス(Bacillus alkalophilus)、バシラス・アミロリケファシンス(Bacillus amyloliquefaciens)、バシラス・コーギュランス(Bacillus coagulans)、バシラス・サーキュランス(Bacillus circulans)、バシラス・ロータス(lautus)、バシラス・メガテリウム(megaterium)、バシラス・チューリンゲンシス(Bacillus thuringiensis)、またはスプレプトマイセス・リビダンス(Streptomyces lividans)、スプレプトマイセス・ムリヌス(Streptomyces murinus)等であり、あるいは、大腸菌等のグラム陰性細菌を用いることもできる。
細菌の形質転換は、例えばプロトプラスト形質転換、または公知の方法でコンピテント細胞を用いて行うことができる
【0150】
発現にイーストを用いる場合、例えばサッカロミセス・セレビシエ (Saccharomyces cerevisiae)等の、サッカロミセス種またはシゾサッカロミセス種から選択したイーストを用いる。糸状菌を用いる場合は、アスペルギルス・オリザエやアスペルギルス・ニガー等のアスペルギルス種から選択する。真菌細胞は、プロトプラストを形成し、プロトプラストを形質転換し、次に公知の方法で細胞壁を再生することにより形質転換される。アスペルギルス宿主細胞の形質転換に適した方法は、例えばEP 238023に開示された方法である。
【0151】
また別の側面では、本願はα-アミラーゼ変異体を産出する方法に関する。この方法では、変異体を産出できる条件下で上記の方法によって宿主細胞を培養し、細胞および/または培地から変異体を回収する。
【0152】
宿主細胞を培養する培地は、宿主細胞の培養に適し、α-アミラーゼ変異体を発現させることができる公知の培地である。好ましい培地は市販されており、公知の処方(例えばATCCのカタログに記載されている)に従って調製することができる。
宿主細胞から分泌されたα-アミラーゼ変異体は、培地から公知の方法により回収することができる。この方法には、細胞を濾過または遠心分離によって培地から分離し、硫酸アンモニウム等の塩で培地中の蛋白性物質を沈殿させ、次にイオン交換や、アフィニティクロマトグラフィー等のクロマトグラフを行なうことが含まれる。
【0153】
9.4 変異体の分析及びスクリーニング方法
9.4.1 フィルタースクリーニング評価
以下の評価方法を用いて、高pHまたは低pH、および/またはCa2+が欠乏した条件下で、親酵素及びAmyS様アルファ−アミラーゼとの比較において改変された安定性を示すAmyS様アルファ−アミラーゼ変異体のスクリーニングを行うことができる。
【0154】
9.4.2 高pHフィルター評価
バシラスのライブラリーをセルロースアセテートフィルター(OE 67, Schleicher & Schuell, Dassel, Germany) のサンドイッチに塗布し、また37℃において少なくとも21時間、10マイクログラム/mlカナマイシンを含むTY寒天プレート上のニトロセルロースフィルター(Protran-Ba 85, Schleicher & Schuell, Dassel, Germany)上に塗布する。セルロースアセテート層をTY寒天プレートの上に位置させる。
【0155】
塗布した後、インキュベートする前に、フィルター上の陽性の変異体の位置を特定できるように、各フィルターサンドイッチに針で印をつけ、変異体が結合したニトロセルロースフィルターをpH 8.6〜10.6のグリシン-NaOH緩衝液が入れられた容器に移し、室温(10〜60℃でもよい)で15分間インキュベートする。
コロニーを有するセルロースアセテートフィルターは、使用するまでの間、室温においてTY-プレート上で保管する。
インキュベートした後の残留活性を、pH 8.6-10.6のグリシン-NaOH緩衝液中で、1%アガロース及び0.2% 澱粉を含むプレート上で評価する。ニトロセルロースフィルターの評価用プレートも、フィルターサンドイッチと同様にして印を付け、室温で2時間インキュベートする。フィルターを除去した後、評価用プレートを10% ルゴール液で染色する。
澱粉を分解する変異体は暗青色中の白点として検出され、次に保管プレート上で特定される。陽性の変異体について、最初のスクリーニングと同じ条件でさらに2回スクリーニングを繰り返す。
【0156】
9.4.3 低カルシウムフィルター評価
バシラスのライブラリーをセルロースアセテートフィルター(OE 67, Schleicher & Schuell, Dassel, Germany) のサンドイッチに塗布し、また37℃において少なくとも21時間、関連性の有る抗菌薬、例えばカナマイシンまたはクロラムフェニコールを含むTY寒天プレート上のニトロセルロースフィルター(Protran-Ba 85, Schleicher & Schuell, Dassel, Germany)上に塗布する。セルロースアセテート層をTY寒天プレートの上に位置させる。
【0157】
塗布した後、インキュベートする前に、フィルター上の陽性の変異体の位置を特定できるように、各フィルターサンドイッチに針で印をつけ、変異体が結合したニトロセルロースフィルターをpH 8.5〜10の炭酸塩/重炭酸塩緩衝液が入れられ、異なるEDTA濃度の (約0.001 mM〜約100 mM)容器に移す。これらのフィルターを室温で1時間インキュベートする。
コロニーを有するセルロースアセテートフィルターは、使用するまでの間、室温においてTY-プレート上で保管する。
インキュベートした後の残留活性を、pH 約8.5〜10の炭酸塩/重炭酸塩緩衝液中で、1%アガロース及び0.2% 澱粉を含むプレート上で評価する。ニトロセルロースフィルターの評価用プレートも、フィルターサンドイッチと同様にして印を付け、室温で約2時間インキュベートする。フィルターを除去した後、評価用プレートを約10% ルゴール液で染色する。
澱粉を分解する変異体は暗青色中の白点として検出され、次に保管プレート上で特定される。陽性の変異体について、最初のスクリーニングと同じ条件でさらに2回スクリーニングを繰り返す。
【0158】
9.4.4 低pHフィルター評価
バシラスのライブラリーをセルロースアセテートフィルター(OE 67, Schleicher & Schuell, Dassel, Germany) のサンドイッチに塗布し、また37℃において少なくとも21時間、10マイクログラム/mlクロラムフェニコールを含むTY寒天プレート上のニトロセルロースフィルター(Protran-Ba 85, Schleicher & Schuell, Dassel, Germany)上に塗布する。セルロースアセテート層をTY寒天プレートの上に位置させる。
【0159】
塗布した後、インキュベートする前に、フィルター上の陽性の変異体の位置を特定できるように、各フィルターサンドイッチに針で印をつけ、変異体が結合したニトロセルロースフィルターをpH 4.5のクエン酸緩衝液が入れられた容器に移し、80℃で20分間インキュベートし(野生型由来の変異体をスクリーニングする場合)、あるいは85℃で60分間インキュベートする(親アルファ−アミラーゼの変異体スクリーニングする場合)。
コロニーを有するセルロースアセテートフィルターは、使用するまでの間、室温においてTY-プレート上で保管する。
インキュベートした後の残留活性を、pH 6.0のクエン酸緩衝液中で、1%アガロース及び0.2% 澱粉を含むプレート上で評価する。ニトロセルロースフィルターの評価用プレートも、フィルターサンドイッチと同様にして印を付け、50℃で2時間インキュベートする。フィルターを除去した後、評価用プレートを10% ルゴール液で染色する。
澱粉を分解する変異体は暗青色中の白点として検出され、次に保管プレート上で特定される。陽性の変異体について、最初のスクリーニングと同じ条件でさらに2回再スクリーニングを繰り返す。
【0160】
9.4.5 二次スクリーニング
再スクリーニング後の陽性形質転換体を保管プレートから採取し、二次プレート評価を行う。
各陽性形質転換体を、5 mL LB+クロラムフェニコールを用いて37℃において22時間培養する。各陽性形質転換体のバシラス培養菌と、比較参照用の対応バックボーン(親アルファ−アミラーゼ)を発現するクローンとを、pH4.5のクエン酸緩衝液を用いて90℃においてインキュベートし、サンプルを0, 10, 20, 30, 40, 60及び80分後に採取する。3μLのサンプルを評価用プレートに植える。評価用プレートを10%ルゴール液で染色する。改良された変異体は、バックボーンよりも高い残留活性(評価用プレート上のハローとして検出される)を示す。改良された変異体を核酸配列の解析により特定する。
【0161】
9.4.6 未精製変異体の安定性評価
変異体の安定性は、以下のようにして評価することができる。
分析対象の変異体発現バシラス培養菌を、クロラムフェニコールを含有する10mLLB中で37℃において21時間培養する。この培地800マイクロリットルと、pH4.5のクエン酸緩衝液200マイクロリットルとを混合する。サンプルを70μLずつに分けて複数のPCRチューブ中に注入し、70℃または90℃において時間を種々変更して(典型的には5, 10, 15, 20, 25 及び 30分間)、PCR装置を用いてインキュベートする。0分のサンプルについては、高温でのインキュベートは行わない。サンプル中の活性は、下記の「アルファ−アミラーゼ活性の評価」で説明するように、20μLから200μLのアルファ−アミラーゼPNP-G7基質 MPR3 (Boehringer Mannheim Cat. No. 1660730) をトランスファーすることにより測定する。
測定結果は、(時間0に対する)活性パーセントを時間に対してプロットして示すか、または、所定時間インキュベートした後の残留活性パーセントで表わす。
【0162】
9.4.7 アルファ−アミラーゼ変異体の発酵と精製
関連する発現プラスミドを含むバシラス・スブチルス株を、以下のようにして発酵させ、精製する。
この株を、-80℃のストック溶液から採取した10μg/mlカナマイシンを含むLB-寒天上に洗浄に塗布し、37℃で一晩培養する。得られたコロニーを、10μg/ml クロラムフェニコールを含む100 mLのPS-1培地を有する500 mL振蕩フラスコ中に移す。
S-1培地の組成は以下の通りである。
パールシュガー: 100 g/l
大豆かす: 40 g/l
Na2HPO4, 12 H2O: 10 g/l
PluronicTM PE 6100: 0.1 g/l
CaCO3: 5 g/l
この培地を37℃、270rpmで5日間振蕩する。
【0163】
4500 rpmで20-25分間遠心分離することにより、発酵培地から細胞及び細胞残渣を除去する。次いで、上清を濾過して完全に透明な溶液を得る。濾液を濃縮しUF-フィルター(10000カットオフ膜)上で洗浄し、緩衝液をpH5.5の20mMアセテートに変更する。
UF-フィルター濾過物をS-SEPHAROSE F.F (Pharmacia社)に流通させ、溶出は0.2M NaClを添加した上記緩衝液を用いた段階溶出により行う。溶出液をpH9.0の10 mM Trisに対し透析し、Q-SEPHAROSE F.F. に流通させ、直線濃度勾配の0〜0.3M NaCl溶液 6カラム容積を用いて溶出させる。
活性(PHADEBASアッセイで測定)を有する分画を貯留し、pH 7.5に調整し、残留する色を0.5% w/v活性炭で5分間処理することにより除去する。
【0164】
9.4.8 比活性度測定
比活性度は、PHADEBASTM アッセイ(Magle Life Sciences社)を、活性/mg酵素で用いて評価した。
この製品の取扱説明は下記の通りである。(下記「アルファ−アミラーゼ活性の評価」も参照)
【0165】
9.4.9 等電点の評価
等電点は、等電点電気泳動法(例えばPharmacia社, Ampholine, pH 3.5- 9.3)により求めることができる。
【0166】
9.4.10 安定性評価
アミラーゼの安定性は、次のようにして評価することができる。
この酵素を関連する条件下でインキュベートする。サンプルを異なる時間、例えば0, 5, 10, 15 及び30後に採取し、アッセイ緩衝液(50 mM Britton緩衝液、pH 7.3)で25倍に希釈し(全サンプルについて同じ希釈率)、標準条件のpH7.3、37℃においてPHADEBASアッセイ(Magle Life Sciences社)を用いて活性を測定する。
【0167】
インキュベートする前に測定した活性を参照(100%)として用いる。活性の低下をインキュベート時間に対しパーセントで計算する。この結果は、例えば30分インキュベートした後の残留活性を表わす。
【0168】
9.4.11 アルファ−アミラーゼ活性の評価
1. PHADEBASアッセイ
アルファ−アミラーゼの活性をPHADEB ASTMタブレットを基質に用いる方法で評価する。PHADEBASタブレット(PHADEBASTM Amylase Test, 供給元Magle Life Sciences社)には、ウシ血清アルブミンと緩衝物質とタブレットとが添加された、青く着色され架橋された澱粉ポリマーが含まれている。
【0169】
測定のつど、5mLの50mM Britton-Robinson緩衝液(50mM 酢酸, 50mMリン酸, 50mMホウ酸, 0.1mM CaCl2, NaOHでpHを所定値に調整)が入れられた試験管中に、1つのタブレットを懸濁させる。この試験は所定の温度の水浴中で行なう。試験するアルファ−アミラーゼを50mM Britton-Robinson緩衝液で希釈する。1ミリリットルのアルファ−アミラーゼ溶液に、50mM Britton-Robinson緩衝液を5mL添加する。澱粉がアルファ−アミラーゼによって加水分解され、水溶性の青い断片が生じる。得られた青色溶液を分光光学的に測定し、620 nmにおける吸光度がアルファ−アミラーゼ活性の指標となる。
【0170】
10 または15分間(試験時間)インキュベートした後の620 nmの吸光度が、0.2から2.0吸光度単位の範囲にあることが必要である。この吸光度の範囲であれば、活性と吸光度の関係が直線的である(Lambert-Beerの法則)。
従って、この基準を満たすように酵素の希釈度を調整する必要がある。特定の条件(温度、pH、反応時間、緩衝液条件)の組み合わせにおいて、1 mgのアルファ−アミラーゼが有る値の量の基質を加水分解して青色を生じる。この色の強度を620nmにおいて測定する。所定の組み合わされた条件において、測定された吸光度は、対象とするアルファ−アミラーゼの比活性度(純粋なアルファ−アミラーゼタンパク質の活性/mg) に比例する。
【0171】
2. 別の方法
アルファ−アミラーゼの活性を、PNP-G7基質を用いて評価することができる。PNP-G7はp-ニトロフェニル-アルファ,D-マルトヘプタオシド(maltoheptaoside)の略であり、エンド-アミラーゼで切断されるブロックオリゴサッカライドである。切断後、キットに含まれるアルファ-グルコシダーゼが基質を消化してPNP分子を放出する。PNP分子は黄色を呈するので、λ=405 nm (400-420 nm)における可視光吸光度を測定することができる。PNP-G7基質及びアルファ-グルコシダーゼを含むキットは、Boehringer-Mannheim社(cat. No. 1054635) が製造販売している。
【0172】
製造者の推奨に従い、基質/緩衝液溶液10mLを、Lenzyme/緩衝液50mに加える。アッセイは、20マイクロIサンプルを96ウエルマイクロタイタープレートに移し、25℃でインキュベートすることにより行なう。予め25℃にした試薬溶液200μLを添加する。溶液を混合し、1分間予備インキュベートし、4分間にわたって30秒ごとにELISA読取機のOD 405 nmにおける吸光度を測定する。
吸光度変化の時間依存性の傾きが、所定の組み合わされた条件における測定対象のアルファ−アミラーゼの活性に比例する。
【0173】
9.4.12 LAS感受性の評価
複数の異なる濃度のLAS (直鎖アルキルベンゼンスルホン酸; Nansa 1169/P)を用いて、変異体を40℃で10分間インキュベートする。
残留活性をPHADEBASTMアッセイ法、または、PNP-G7基質を用いる別の方法により評価する。
LASをpH7.5の0.1Mリン酸緩衝液で希釈する。
以下のLAS濃度を用いる。
500 ppm, 250 ppm, 100 ppm, 50 ppm, 25 ppm, and 10 ppmまたは0 ppm。
【0174】
異なるLAS緩衝液を用いて、変異体を全容積が10mLで濃度が0.01-5 mg/lとなるように希釈し、温度制御された水浴を用いて10分間インキュベートする。少量を採取して冷アッセイ緩衝液へ移すことによりインキュベーションを終了させる。活性を測定しているとき、活性測定に影響しないように、LAS濃度を1 ppm未満にすることが重要である。残留活性は、上記のPHADEBASTMアッセイまたは別の方法を用い、二通りの方法で評価する。活性は、ブランクの値を差し引いて求める。LASが無い場合の活性を100%とする。
【0175】
10. アミラーゼ変異体の使用方法:工業用途
本願のアルファ−アミラーゼ変異体は、洗浄プロセス及び汚れ除去における様々な工業用途に応用可能な種々の特性を有する。
本願の1以上の酵素変異体または組成物は上記のように、洗剤、特に洗濯用洗剤組成物、食器洗浄用洗剤組成物、硬質表面洗浄用組成物に用いることができる。また本願の変異体を、布、織物、衣類のデサイジング用組成物、パルプ及び紙の製造用組成物、ビール醸造、エタノール製造、及び上記の澱粉転換プロセスに用いることができる。
【0176】
本願の変異体は、布、織物、衣類のデサイジング用組成物 (例えば本願に参照として組み込まれるWO 95/21247, U.S. 4,643,736, EP 119,920参照)、ビール製造または醸造、パルプ及び紙の製造、その他のプロセスにおいて有用である。
【0177】
10.1 パルプ及び紙製造
アルカリアルファ−アミラーゼ変異体を、澱粉補強された古紙またはボール紙からパルプ、紙、ボール紙等のリグノセルロース材料を製造する場合に用いることができ、特に再パルプ化が7以上のpHで生じ、アミラーゼが補強澱粉を分解することにより古紙の分解が促進される場合に用いることができる。アルファ−アミラーゼ変異体は、澱粉コートされた印刷済の紙から製紙用パルプを製造するプロセスにおいて特に有用である。このプロセスはWO 95/14807に開示された方法で実施され、a) 紙を分解してパルプにするステップと、b) ステップa)の前後またはステップa)の間に澱粉分解酵素で処理するステップと、c) ステップa)及びb)の後でインク粒子をパルプから分離するステップとから成る。
【0178】
またアルファ−アミラーゼは、酵素により改質された澱粉と、炭酸カルシウム、カオリン、及びクレイ等のアルカリ性フィラーとを用いて製紙するとき、澱粉の改質に非常に有用である。アルカリ性アルファ−アミラーゼはフィラーの存在下で澱粉を改質することができるので、工程を簡略化することができる。
【0179】
10.2 布、織物、衣料品のデサイジング
アルファ−アミラーゼ変異体は、布、織物、衣料品のデサイジングにおいても有用である。
繊維加工業では、澱粉被覆サイズ剤を除去するデサイジングプロセスを促進する副原料として、古くからアルファ−アミラーゼが用いられてきた。サイズ剤は、布を織る際に横糸の保護被覆剤として機能する。布を織った後にサイズ剤を完全に除去することは、その後の工程での洗浄、漂白、染色でよい結果を得るために重要である。酵素による澱粉分解が好まれるのは、繊維に悪影響を及ぼさないからである。
製造コストを下げて生産量を増加させるために、デサイジング加工は洗浄及び漂白工程と組み合わされることがある。このような場合には、澱粉の分解にアルカリまたは酸化剤等の非酵素系副原料が用いられる。これは、従来のアルファ−アミラーゼは高pHや漂白剤の存在下では正常に機能しないためである。
非酵素系の澱粉サイズ剤分解剤は比較的反応性が高い薬品であるため、繊維にダメージを与えることがある。本願のアルファ−アミラーゼ変異体はアルカリ性溶液中での性能が向上している事から、この用途に用いることができる。セルロースを含む布または織物をデサイジングする際、アルファ−アミラーゼをそれ単独、またはセルラーゼと組み合わせて用いることができる。
【0180】
デサイジング及び漂白プロセスは公知である。例えば、これらのプロセスは本願に参照として組み込まれる WO 95/21247, U.S. P. 4,643,736, EP 119,920に開示されている。
市販のデサイジング用の製品としてGenencor社のOPTISIZETM FLEXが挙げられる。
【0181】
10.3 洗浄プロセスと洗剤組成物
本願のアルファ−アミラーゼ変異体は、洗濯及び食器洗浄用等の、種々の洗浄または洗濯用の洗剤組成物の添加成分として用いることができる。
【0182】
本願の洗剤用組成物は、例えば手洗い用または洗濯機用洗剤組成物として処方する。本願の洗剤用組成物には、汚れた織物の前処理に適した洗濯用添加剤組成物、または織物の柔軟仕上げ剤が含まれる。あるいは、家庭内の硬質表面清掃用洗剤組成物として処方し、あるいは手洗い用または食器洗浄機用の洗剤として処方することができる。
【0183】
ある側面では、本願により酵素変異体を含む洗剤用添加剤が提供される。
洗剤用添加剤、及び洗剤組成物には1以上の他の酵素が含まれていてもよく、このような他の酵素は例えばプロテアーゼ、リパーゼ、ペルオキシダーゼ、他の澱粉分解活性酵素、例えば別のアルファ−アミラーゼ、グルコアミラーゼ、マルトゲンアミラーゼ、CGTase、および/または、セルラーゼマンナナーゼ (例えばDanisco US Inc.社, Genencor DivisionのMANNASTARTM)、ペクチナーゼ、ペクチン、リアーゼ、クチナーゼ、および/または、ラッカーゼ等である。
【0184】
一般に、選択した酵素と選択した洗剤との相性 (すなわち、最適pH値、他の酵素や非酵素成分との相性等) がよくなければならず、十分な量の酵素が存在しなければならない。
【0185】
<プロテアーゼ>
好ましいプロテアーゼには、動物、植物または微生物由来のプロテアーゼが含まれる。微生物由来のプロテアーゼが好ましい。化学的に修飾された変異体、遺伝子工学による変異体も含まれる。
プロテアーゼは、セリンプロテアーゼ、メタロプロテアーゼ、好ましくはアルカリ性微生物プロテアーゼ、またはトリプシン様プロテアーゼである。
アルカリ性プロテアーゼの例は、スブチリシン、特にバシラス由来のスブチリシンであり、例えばスブチリシン・ノボ(subtilisin Novo)、スブチリシン・カールスバーグ(subtilisin Carlsberg)、スブチリシン309、スブチリシン147、及びスブチリシン168(例えばWO 89/06279)等である。
トリプシン様プロテアーゼの例は、トリプシン(例えば豚または牛由来)、及びWO 89/06270とWO 94/25583に開示されたフサリウムプロテアーゼである。他の有用なプロテアーゼの例が、WO98/23732, WO99/20770, WO 92/19729, WO 98/20115, WO 98/20116,及び WO 98/34946に開示されている。
【0186】
市販のプロテアーゼ酵素の例にはAlcalaseTM, SavinaseTM, PrimaseTM, DuralaseTM, EsperaseTM,及びKannaseTM (Novo Nordisk A/S社); MaxataseTM, MaxacalTM, MaxapemTM, ProperaseTM, PurafectTM, Purafect OxPTM, FN2TM,及びFN3TM (Genencor International, Inc社)が含まれる。
【0187】
<リパーゼ>
好ましいリパーゼには、細菌または細菌由来のリパーゼが含まれる。化学的に修飾された変異体、遺伝子工学による変異体も含まれる。
有用なリパーゼの例には、例えばフミコーラ・ラヌギノサ(lanuginose)(T・ラヌギノサ)(EP 258068及びEP 305216参照)、またはフミコーラ・インソレンス(insolens)(WO 96/13580参照)等のフミコーラ(Humicola; サ−モミセス(Thermomyces)の異名) 由来のリパーゼ;シュードモナス(Pseudomonas)由来のリパーゼ (例えばP.アルカリゲネス(alcaligenes)またはP.シュードアルカリゲネス(pseudoalcaligenes)(EP218272参照)、P.セパシア(cepacia)( EP331376参照)、P.スタッツェリ(stutzeri)(GB 1,372,034参照)、P.フルオレセンス(fluorescens)、シュードモナス株SD 705(WO 95/06720及びWO 96/27002参照)、P.ウィスコンシネス(wisconsinensis)(WO 96/12012参照);バシラス由来のリパーゼ、例えばB.スブチリス由来(Dartois et al. (1993), Biochemica et Biophysica Acta, 1131, 253-360)、B.ステアロサーモフィルス(stearothermophilus)(JP 64/744992参照)、またはB.プミルス(pumilus)(WO 91/16422参照)が含まれる。
他の例は、WO 92/05249, WO 94/01541, EP 407 225, EP 260 105, WO 95/35381, WO 96/00292, WO 95/30744, WO 94/25578, WO 95/14783, WO 95/22615, WO 97/04079 及び WO 97/07202に開示されたリパーゼ変異体である。
【0188】
市販の好ましいリパーゼ酵素の例にはLipolaseTM及びLipolaseTM Ultra (Novo Nordisk A/S社)が含まれる。
【0189】
<アミラーゼ>
1以上の追加のアミラーゼを用いることもできる。
適したアミラーゼ(アルファおよび/またはベータ)には、細菌または菌類起源のものが含まれる。化学修飾または遺伝子組み換えされた変異体も含まれる。このようなアミラーゼには、例えばバシラスから得られるアルファ−アミラーゼ、例えばGB 1,296,839に詳細が開示されているB.リケニホルミスから得られるアルファ−アミラーゼが含まれる。
有用なアルファ−アミラーゼの例として、WO 94/18314, WO 96/39528, WO 94/02597, WO 94/18314, WO 96/23873, 及びWO 97/43424に開示された変異体が挙げられる。
【0190】
市販のアルファ−アミラーゼとして、DuramylTM, L1QUEZYMETM, TermamyTM, NATALASETM FungamylTM 及びBANTM (Novozymes A/S社), RapidaseTM,及びPurastarTM (Genencor社) 等が挙げられる。
【0191】
<セルラーゼ>
好ましいセルラーゼには、細菌または細菌由来のセルラーゼが含まれる。化学的に修飾された変異体、遺伝子工学による変異体も含まれる。
好ましいセルラーゼには、バシラス属、シュードモナス属、トリコデルマ属、フミコーラ属、フザリウム属、シエラビア族、アクレモニウム属由来のセルラーゼが含まれ、例えばU.S.P.4,435,307, UU.S.P.5,648,263, U.S.P.5,691,178, U.S.P.5,776,757 及びWO 89/09259に開示されたフミコーラ・インソレンス(Humicola insolens)、ミセリオフトラ・サーモフィリア(Myceliophthora thermophila)、フザリウム・オキシスポルム(Fusarium oxysporum)が含まれる。
トリコデルマ・リーゼイ(Trichoderma reesei) 由来のセルラーゼは、U.S.P.4,689,297, U.S.P.5,814,501, U.S.P.5,324,649, WO 92/06221 及びWO 92/06165に開示されている。
バシラス由来のセルラーゼは、U.S.P6,562,612に開示されている。
【0192】
市販のセルラーゼには、CelluzymeTM及びCarezymeTM (Novo Nordisk A/S社); ClazinaseTM及びPuradaxTM HA (Genencor International, Inc社);及びKAC-500(B) TM (花王)がある。
【0193】
<ペルオキシダーゼ/オキシダーゼ>
適切なペルオキシダーゼ/オキシダーゼには、植物、細菌、または細菌由来のセルラーゼが含まれる。化学的に修飾された変異体、遺伝子工学による変異体も含まれる。有用なペルオキシダーゼの例には、コプリヌス(Coprinus)属由来のペルオキシダーゼが含まれ、例えばWO 93/24618, WO 95/10602,及びWO 98/15257に開示されたコプリヌス・シネレウス(cinereus)及びその変異体由来のペルオキシダーゼが含まれる。
市販のペルオキシダーゼの例はGuardzymeTM (Novozymes A/S社)である。
【0194】
洗剤に1以上の酵素を含む添加剤を個別に添加するか、または全ての酵素を含む添加剤を添加することによって、洗剤に洗剤用酵素を含有させることができる。洗剤用添加剤、すなわち個別または一括して添加される添加剤は、例えば顆粒状、液状、スラリー状等とすることができる。好ましくは洗剤用添加剤を顆粒状とし、特に非粉塵飛散性顆粒、液状とし、特に安定化液状、またはスラリー状とする。
【0195】
非粉塵飛散性顆粒は、例えばU.S.P 4,106,991及びU.S.P 4,661,452の開示に従い調製することができ、所望により公知の方法でコーティングすることができる。ワックス状のコーティング材料の例として、平均分子量が約1000から約20000のポリエチレンオキサイド製品(例えばポリエチレングリコール, PEG);16から50のエチレンオキサイドユニットを有するエトキシ化ノニルフェノール;アルコールが炭素数12から20で、15から80のエチレンオキサイドユニットを有する、エトキシ化脂肪アルコール;脂肪アルコール;脂肪酸;脂肪酸のモノ−、ジ−及びトリグリセライドが挙げられる。流動床での使用に適したフィルムコーティング用材料の例は、GB 1483591に開示されている。酵素調合液は、例えばプロピレングリコール等のポリオール、糖、糖アルコール、乳酸、ホウ酸を公知の方法で添加して安定化されている。その他の酵素安定剤も公知である。保護された酵素は、例えばEP 238,216に開示された方法で調製することができる。
【0196】
洗剤用組成物は、例えば棒状、錠剤状、粉末状、顆粒状、ペースト状または液状等の形態にすることができる。液状洗剤は水性であり、一般に最大約70%の水と、0%から約30%の有機溶媒が含まれる。あるいは、非水性の液状洗剤でもよい。
【0197】
洗剤用組成物は、非イオン性、半極性、および/またはアニオン性、および/またはカチオン性、および/または両性イオン性の界面活性剤を、1以上含有する。界面活性剤は一般に、重量%で約0.1%から約60%含有される。
【0198】
界面活性剤が用いられる場合、洗剤には約1%から約40%の、直鎖アルキルベンゼンスルホネート(LAS);α−オレフィンスルホネート;アルキルスルフェート (脂肪アルコールスルフェート);アルコールエトキシスルフェート;二級アルカンスルホネート;α−スルホ脂肪酸メチルエステル;アルキルまたはアルケニルコハク酸;石鹸等のアニオン性界面活性剤が含まれる。
【0199】
界面活性剤が用いられる場合、洗剤には約0.2%から約40%の、アルコールエトキシレート、ノニルフェノールキシレート、アルキルポリグリコシド、アルキルジメチルアミンオキシド、エトキシ化脂肪酸モノエタノールアミド、脂肪酸モノエタノールアミド、またはポリヒドロキシアルキル脂肪酸アミド、またはグルコースアミンのN-アシル-N-アルキル誘導体(グルコアミド)等の非イオン性界面活性剤が含まれる。
【0200】
洗剤には0%から約65%の、ゼオライト、ジホスフェート、トリホスフェート、ホスホネート、炭酸塩、クエン酸塩、ニトリロ三酢酸、エチレンジアミン四酢酸、ジエチレントリアミン四酢酸、アルキルまたはアルケニルコハク酸、水溶性シリケートまたは層状シリケート(例えばHoechst社のSKS-6)等の、ビルダーまたは複合化剤が含まれる。
【0201】
洗剤には1以上のポリマーが含まれる。このようなポリマーの例として、カルボキシメチルセルロース、ポリビニルピロリドン、ポリエチレングリコール、ポリビニルアルコール、ポリ(ビニルピリジン-N-オキサイド)、ポリ(ビニルイミダゾール)、ポリアクリレート、マレイン酸/アクリル酸コポリマー、ラウリルメタクリレート/アクリル酸コポリマー等の、ポリカルボキシレートが挙げられる。
【0202】
洗剤には、ペルボレートまたはペルカーボネート等のH2O2源と、これらと組み合わされる過酸形成漂白活性剤(例えばテトラアセチルエチレンジアミン、またはノナノニルオキシベンゼンスルホネート)から成る、漂白剤系が含まれている。あるいは、漂白剤系には、ペルオキシ酸(例えばアミドタイプ、イミドタイプ、またはスルホンタイプ)が含まれる。
洗剤用組成物の酵素は、例えばプロピレングリコールまたはグリセロール等のポリオール、糖または糖アルコール、乳酸、ホウ酸、例えば芳香族ボレートエステル等のホウ酸誘導体、または例えば4-フォルミルフェニルホウ酸等のフェニルホウ酸誘導体等の、公知の酵素安定剤を用いて安定化される。洗剤用組成物は、例えば国際公開番号WO 92/19709及びWO 92/19708の開示内容に従い処方することができる。
【0203】
洗剤に、例えばクレイを含む衣料用コンディショナー、泡ブースター、泡抑制剤、防食剤、汚染物質懸濁財、再汚染防止剤、顔料、殺菌剤、増白剤、ハイドロトロープ、変色防止剤、香料等の公知の洗剤用原料が含まれていてもよい。
【0204】
洗剤組成物には酵素が添加され、特に1以上の本願の酵素変異体が添加される。
酵素変異体は、洗浄液1リットルにつき約0.01から約100 mgの酵素蛋白に相当する量が添加され、例えば洗浄液1リットルにつき約0.05から約5.0 mgの酵素蛋白に相当する量が添加され、特に洗浄液1リットルにつき約0.1から約1.0 mgの酵素蛋白に相当する量が添加される。
【0205】
本願の酵素変異体の1以上を、本願に参照として組み込むWO 97/07202に開示された洗剤処方に追加成分として添加することができる。
【0206】
<10.4 食器洗浄用洗剤組成物>
本願の酵素を以下に示す食器洗浄用洗剤組成物に用いることができる。
1) 顆粒自動食器洗浄機用組成物
非イオン性界面活性剤: 0.4-2.5%
メタ珪酸ナトリウム: 0-20%
ジ珪酸ナトリウム: 3-20%
トリ珪酸ナトリウム: 20-40%
炭酸ナトリウム: 0-20%
過ホウ酸ナトリウム: 2-9%
テトラアセチルエチレンジアミン(TAED): 1-4%
硫酸ナトリウム: 5-33%
酵素: 0.0001-0.1%
2) 顆粒自動食器洗浄機用組成物
非イオン性界面活性剤(例えばアルコールエトキシレート): 1-2%
ジ珪酸ナトリウム: 2-30%
炭酸ナトリウム: 10-50%
ホスホン酸ナトリウム: 0-5%
クエン酸三ナトリウム二水和物: 9-30%
酢酸ニトリロ三ナトリウム (NTA): 0-20%
過ホウ酸ナトリウム一水和物: 5-10%
テトラアセチルエチレンジアミン (TAED): 1-2%
ポリアクリレートポリマー(例えばマレイン酸/アクリル酸共重合体): 6-25%
酵素: 0.0001-0.1%
香料: 0.1-0.5%
水: 5-10 %
3) 顆粒 自動食器洗浄機用組成物
非イオン性界面活性剤: 0.5-2.0%
ジ珪酸ナトリウム: 25-40%
クエン酸ナトリウム: 30-55%
炭酸ナトリウム: 0-29%
重炭酸ナトリウム: 0-20%
過ホウ酸ナトリウム一水和物: 0-15%
テトラアセチルエチレンジアミン (TAED): 0-6%
マレイン酸/アクリル酸共重合体: 0-5%
クレイ: 1-3%
ポリアミノ酸: 0-20%
ポリアクリル酸ナトリウム: 0-8%
酵素: 0.0001-0.1%
4) 顆粒自動食器洗浄機用組成物
非イオン性界面活性剤: 1-2%
ゼオライロMAP: 15-42%
ジ珪酸ナトリウム: 30-34%
クエン酸ナトリウム: 0-12%
炭酸ナトリウム: 0-20%
過ホウ酸ナトリウム一水和物: 7-15%
テトラアセチルエチレン: 0-3%
ジアミン(TAED)ポリマー: 0-4%
マレイン酸/アクリル酸共重合体: 0-5%
有機ホスホネート: 0-4%
クレイ: 1-2%
酵素: 0.0001-0.1%
硫酸ナトリウム: 残余成分
5) 顆粒自動食器洗浄機用組成物
非イオン性界面活性剤: 1 -7%
ジ珪酸ナトリウム: 18-30%
Triクエン酸ナトリウム: 10-24%
炭酸ナトリウム: 12-20% :
モノペルスルフェート(2KHSO5.KHSO4.K2SO4): 15-21%
漂白剤安定剤: 0.1 -2%
マレイン酸/アクリル酸共重合体: 0-6%
ジエチレントリアミンペンタ酢酸五ナトリウム塩: 0-2.5%
酵素: 0.0001-0.1%
硫酸ナトリウム、水: 残余成分
6) 洗浄用界面活性剤を含む顆粒及び液体食器洗浄用組成物
非イオン性界面活性剤: 0-1.5%
オクタデシルジメチルアミンN-オキシド二水和物: 0-5%
オクタデシルジメチルアミンN-オキシド二水和物 とヘキサデシルジメチルアミンN-オキシド二水和物から成るC18/C16の80:20重量比ブレンド物: 0-4%
オクタデシルビス(ヒドロキシエチル)アミンN-オキシド 無水物とヘキサデシルビス(ヒドロキシエチル)アミンN-オキシド無水物から成るC18/C16の70:30重量比ブレンド物: 0-5%
平均エトキシ化率が3のC13-C15アルキルエトキシスルフェート: 0-10%
平均エトキシ化率が3のC12-C15アルキルエトキシスルフェート: 0-5%
平均エトキシ化率が12のC13-C15エトキシ化アルコール: 0-5%
平均エトキシ化率が9のC12-C15エトキシ化アルコールブレンド物: 0-6.5%
平均エトキシ化率が30のC13-C15エトキシ化アルコールブレンド物 0-4%
ジ珪酸ナトリウム: 0-33%
トリポリリン酸ナトリウム: 0-46%
クエン酸ナトリウム: 0-28%
クエン酸: 0-29%
炭酸ナトリウム: 0-20%
過ホウ酸ナトリウム一水和物: 0-1 1.5%
テトラアセチルエチレンジアミン(TAED): 0-4%
マレイン酸/アクリル酸共重合体: 0-7.5%
硫酸ナトリウム: 0-12.5%
酵素: 0.0001-0.1%
7) 非水性液体自動食器洗浄機用組成物
液状非イオン性界面活性剤(例えばアルコールエトキシレート): 2.0-10.0%
アルカリ金属ケイ酸塩: 3.0-15.0%
アルカリ金属リン酸塩: 20.0-40.0%
高級グリコール、ポリグリコール、ポリオキシド、グリコールエーテルから選択される液状キャリア: 25.0-45.0%
安定剤(例えばリン酸とC16-C18アルカノールの部分エステル): 0.5-7.0%
消泡剤(例えばシリコーン): 0-1.5%
酵素: 0.0001-0.1%
8) 非水性液体食器洗浄用組成物
液状非イオン性界面活性剤 (例えばアルコールエトキシレート) 2.0-10.0%
ケイ酸ナトリウム: 3.0-15.0%
アルカリ金属炭酸塩: 7.0-20.0%
クエン酸ナトリウム 0.0-1.5%
安定剤(例えばシリコーンと低分子量ジアルキルポリグリコールエーテルの微細分散混合物): 0.5-7.0%
低分子量ポリアクリレートポリマー: 5.0-15.0%
クレイゲル増粘剤(例えばベントナイト): 0.0-10.0%
ヒドロキシプロピルセルロースポリマー: 0.0-0.6%
酵素: 0.0001-0.1%
高級グリコール、ポリグリコール、ポリオキシド、グリコールエーテルから選択される液状キャリア: 残余成分
9) チクソトロピック液体自動食器洗浄機用組成物
C12-C14脂肪酸: 0-0.5%
ブロック共重合体界面活性剤: 1.5-15.0%
クエン酸ナトリウム 0-12% トリポリリン酸ナトリウム: 0-15%
炭酸ナトリウム: 0-8%
トリステアリン酸アルミニウム: 0-0.1%
クメンスルホン酸ナトリウム: 0-1.7%
ポリアクリレート増粘剤: 1.32-2.5%
ポリアクリル酸ナトリウム: 2.4-6.0%
ホウ酸: 0-4.0%
ギ酸ナトリウム: 0-0.45%
ギ酸カルシウム: 0-0.2%
n-デシジフェニルオキサイドジスルホン酸ナトリウム: 0-4.0%
メタノールアミン(MEA): 0-1.86%
水酸化ナトリウム(50%): 1.9-9.3%
1,2-プロパンジオール: 0-9.4%
酵素: 0.0001-0.1%
消泡剤、染料、香料、水: 残余成分
10) 液体自動食器洗浄機用組成物
アルコールエトキシレート: 0-20%
脂肪酸エステルスルホネート: 0-30%
ドデシルスルホン酸ナトリウム: 0-20%
アルキルポリグリコシド: 0-21%
オレイン酸: 0-10%
ジ珪酸ナトリウム一水和物: 18-33%
クエン酸ナトリウム二水和物: 18-33%
ステアイン酸ナトリウム: 0-2.5%
過ホウ酸ナトリウム一水和物: 0- 13%
テトラアセチルエチレンジアミン(TAED): 0-8%
マレイン酸/アクリル酸共重合体: 4-8%
酵素: 0.0001-0.1%
11) 保護された漂白剤粒子を含む液体自動食器洗浄機用組成物
珪酸ナトリウム: 5-10%
ピロリン酸三カリウム: 15-25%
トリ珪酸ナトリウム: 0-2%
炭酸カリウム: 4-8%
保護された漂白剤粒子、例えば塩素: 5-10%
高分子性増粘剤: 0.7-1.5%
水酸化カリウム: 0-2%
酵素: 0.0001-0.1%
水: 残余成分
12) 過ホウ酸塩を過炭酸塩二変更した1), 2), 3), 4), 6) 及び10)に記載の自動食器洗浄機用組成物
13) さらにマンガン触媒を含む l)-6)に記載の自動食器洗浄機用組成物
マンガン触媒は、"Efficient manganese catalysts for low-temperature bleaching", Nature 369: 637-39 (1994)に開示された化合物のいずれか1である。
14) プレミアHDL液体洗剤の処方
Bio-Soft S-101: 直鎖アルキルベンゼンスルホン酸
Steol CS-330: ラウレス硫酸ナトリウム
Bio-soft N25-7: 7モルのEOを含む直鎖アルキルエトキシレート
Stepanate SXS: キシレンスルホン酸ナトリウム
15) ウルトラ液体洗剤処方
Tionopal CBS-X: 蛍光増白剤
Alpha-step MC-48: アルファ−スルホメチルエステルナトリウム
Makon TD-6: トリデシルアルコールエトキシレート
【0207】
<11. アルファ−アミラーゼ変異体から成る組成物>
いくつかの側面では、本願によりa) 親AmyS様アルファ−アミラーゼに対しアミノ酸配列同一性を少なくとも95%有し、参照アルファ−アミラーゼの位置242に対応するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体であって、検出可能なアルファ−アミラーゼ活性を有するアルファ−アミラーゼ変異体と、b) 別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とが含まれる組成物が提供される。
【0208】
好ましい実施形態では、本願の変異体は親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して1以上が改変されていることにより、例えば本願に示す工業的プロセス等の用途における使用方法や性能が改変され得る。
このような改変された性質には例えば、正味電荷、基質特異性、基質分解性、基質結合性、熱安定性、1以上のpH域における活性、1以上のpH域における安定性、酸化環境下での安定性、Ca2+要求性、比活性度、触媒反応速度、触媒効率、キレート剤の存在下での活性、キレート剤存在下での熱またはpH安定性、デサイジングでの有用性、洗浄プロセスでの有用性、タンパク質発現系での発現量、またはその他の対象とする性質が含まれる。当業者であれば、このような改変された性質は、アミラーゼの最終用途、またはアミラーゼの製造、またはこの両者において有用である。
【0209】
公知のアミラーゼまたは配列を容易に特定できるアミラーゼを参照アミラーゼとして用いることができる。本願の実施形態では、参照アミラーゼはSEQ ID NO: 1 または2である。いくつかの実施形態では、親アミラーゼと参照アミラーゼが同じであってもよい。
【0210】
いくつかの実施形態では、組成物は洗濯、食器または硬質表面洗浄、デサイジング、あるいは繊維または汚れ処理に用いられる製品の一成分である。例えばこの組成物は液状、半固体状、固体状の食器洗浄用洗剤の一成分であり、あるいは顆粒状または液状洗剤の一成分である。この組成物には、その用途に応じて別の成分を添加することができる。このような用途における配合処方を本願に開示する。これ以外の配合処方も当業者にとって周知である。
【0211】
一つの実施形態では、組成物に別の酵素が含まれている。このような別の酵素は、プロテアーゼ、リパーゼ、アミラーゼ、セルラーゼ、ペルオキシダーゼ、オキシダーゼ、ペクチナーゼ、リアーゼ、クチナーゼ、ラッカーゼまたは他の有用な酵素のいずれかである。当業者にとって、本願のアミラーゼ変異体との組み合わせにおいて有用な別の酵素は周知である。特定の用途において有効な酵素の量は、実験により求めることができる。本願に、例えば実施例において、有効な酵素の量のガイドラインを示す。
【0212】
本願実施形態では、組成物には1以上の界面活性剤が含まれる。界面活性剤は非イオン性、アニオン性、カチオン性、または両性イオン性、またはこれらの組合せのいずれかである。
【0213】
ひとつの実施形態では、アルファ−アミラーゼ変異体は、好ましくはS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体である。
洗濯や洗浄等のいくつかの用途では、酸化に対する安定性やキレート剤に対する安定性、あるいは異なる金属イオン濃度に対する安定性を有することがが有用である。このため、いくつかの実施形態では、変異体は酸化に対する安定性が改変されている。またアルファ−アミラーゼ変異体は、親AmyS-様アルファ−アミラーゼのアミノ酸位置8, 9, 96, 200, 206, 284, 307, 311, 316, 及び438残基を含めてメチオニン残基の1以上の置換または欠失を備え、ここで参照アルファ−アミラーゼはSEQ ID NO: 2である。
別の実施形態では、アルファ−アミラーゼ変異体はさらに、参照アルファ−アミラーゼ(好ましくはSEQ ID NO: 2)のアミノ酸位置97, 179, 180, 193, 319, 349, 358, 416, 428, または443に対応するアミノ酸位置の1以上において、配列修飾を有する。
【0214】
別の実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【0215】
さらに、ひとつの実施形態では、アルファ−アミラーゼ変異体は、例えばN193F置換またはV416G置換、またはこの両置換のように、N193置換またはV416置換、またはこの両置換を有する。別の実施形態では、アルファ−アミラーゼ変異体は位置F178, R179, G180, 1181, G182及びK183 にアミノ酸欠失を有する。本願に開示するように、このような欠失はペアワイズ、またはそれ以上の組合せであることが好ましい。
好ましい実施形態では、アルファ−アミラーゼ変異体は改変された金属イオン依存性、あるいはカルシウム無添加時における改変された活性または安定性、キレート剤存在下での改変された活性をまたは安定性有する。このようなアミラーゼ変異体は洗濯及び洗浄プロセスにおいて有用である。
【0216】
ひとつの実施形態では、アルファ−アミラーゼ変異体はSEQ ID NO:2に対し少なくとも95%の相同性を有し、アミノ酸配列SEQ ID NO:1から成る参照アルファ−アミラーゼの位置番号242に相当する位置にアミノ酸置換を有する。このアルファ−アミラーゼ変異体は、使用条件下においてアルファ−アミラーゼ活性を有することが好ましい。
【0217】
好ましい実施形態では、親アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16であり、参照アルファ−アミラーゼがSEQ ID NO: 1 または2である。いくつかの実施形態では、低pHまたは高pHでの洗濯プロセスにおいて性能が改善されている。ひとつの実施形態では、アルファ−アミラーゼ変異体は親アルファ−アミラーゼに対し、pH >約8での洗浄性能が改善されている。より好ましくは、アルファ−アミラーゼ変異体はpH約8.5からpH約11での洗浄性能が改善されている。
【0218】
ひとつの実施形態では、アルファ−アミラーゼ変異体は参照アミラーゼ、例えばSEQ ID NO: 1または2のアミノ酸配列を参照配列として、次の組み合わされた置換せを有する:a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E; または i) Q319R, Q358R, Q443E。
【0219】
別の側面では、本願により洗剤用または洗浄剤用処方組成物が提供され、この組成物には親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するアミラーゼ変異体が含まれる。このアミラーゼ変異体は、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに、検出可能なアルファ−アミラーゼ活性を有する。参照アミラーゼは好ましくはSEQ ID NO: 1、または2である。
【0220】
いくつかの実施形態では、洗剤または洗浄剤配合処方には、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242Tの内の少なくともいずれかを含む、S242アルファ−アミラーゼ変異体が含まれる。上記の組成物には、本願に開示する変異体及び改変のいずれか1またはこれらの組合せが含まれる。
【0221】
また別の側面では、本願によりキットが提供される。
ひとつの実施形態では、このキットにはa) 親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するアルファ−アミラーゼ変異体であって、検出可能なアルファ−アミラーゼ活性を有するアルファ−アミラーゼ変異体と、b) 別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とが含まれる。
【0222】
ひとつの実施形態では、このキットにはさらに、このキットの成分を織物のデサイジング、または澱粉含有物質で汚された1以上の物品を洗濯または洗浄する際の取扱説明書が含まれている。
【0223】
当業者であれば、本願に開示するアルファ−アミラーゼを製造するキットも提供されることを理解できよう。このキットにより、親アルファ−アミラーゼ及び参照アミラーゼとして使用されるアミノ酸配列および/またはこれに由来する核酸等の、代表的配列が提供される。
【0224】
<12. デサイジング、及び洗濯/洗浄プロセスでのアミラーゼ変異体の使用>
別の側面では、本願はアルファ−アミラーゼ変異体を布や織物のデサイジング、及び洗濯または洗浄プロセスに使用する方法に関する。
【0225】
一つの側面では、本願により織布製造後に織物をデサイジングする方法が提供される。この方法には、織物と、アルファ−アミラーゼ変異体とを、織物からデサイジング剤の少なくとも一部が除去される条件及び時間接触させる工程が含まれる。アルファ−アミラーゼ変異体は、親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する。このアルファ−アミラーゼ変異体は検出可能なアルファ−アミラーゼ活性を有する。
【0226】
本願の実施形態では、アルファ−アミラーゼ変異体は、親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して、物性または酵素特性が改変されている。いくつかの実施形態では、アルファ−アミラーゼ変異体は、(a)正味電荷、(b)基質特異性、(c)基質分解性、(d)基質結合性、(e)熱安定性、(f)1以上のpH域における活性、(g)1以上のpH域における安定性、(h)酸化環境下での安定性、(i)Ca2+要求性、(j)比活性度、(k)触媒反応速度、(1)触媒効率、(m)キレート剤存在下での活性、(n)キレート剤存在下での熱またはpH安定性、(o)デサイジング効果、(p)タンパク質発現系における発現量の内の1以上の特性が改変されている。
【0227】
ここで参照アミラーゼは上記のものであり、この方法のひとつの実施形態では、参照アミラーゼはSEQ ID NO: 1、または2である。
【0228】
一つの実施形態では、親AmyS-様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16から成り、参照アルファ−アミラーゼがSEQ ID NO: 1 または2から成る。
いくつかの実施形態では、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242Tのいずれかである。
【0229】
また別の実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。ここで参照アミラーゼはSEQ ID NO: 1、または2である。
【0230】
別の側面では、本願は洗濯または洗浄方法に関する。洗濯または洗浄操作での酵素の使用は有益であるが、洗濯または洗浄プロセスにおいて酵素は過激な条件に曝され、酵素活性の限界に近い条件で使用される。
本願の方法は、洗濯または洗浄される1以上の物品を、親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体が含まれる組成物に接触させる工程が含まれる。アルファ−アミラーゼ変異体は検出可能なアルファ−アミラーゼ活性を有する。この接触工程は、1以上の物品が洗濯または洗浄される条件及び時間において行われる。
好ましくは、少なくとも1の物品は少なくとも1の澱粉含有物質で汚されており、この汚れの除去がアルファ−アミラーゼ変異体によって促進される。
【0231】
一つの実施形態では、組成物にはさらに洗濯処方または洗浄処方用の少なくとも1の成分が含まれる。
例えば組成物には、別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1が含まれる。
【0232】
一つの実施形態では、親アルファ−アミラーゼはSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16のいずれかであり、参照アルファ−アミラーゼはSEQ ID NO: 1または2である。いくつかの実施形態では、親アルファ−アミラーゼはSEQ ID NO: 1, 2, 15, または16のいずれかであり、別の実施形態では親アルファ−アミラーゼはSEQ ID NO: 6, 7, 8, 9, 10, 11, または12のいずれかである。好ましい実施形態では、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである。いくつかの実施形態では、参照アミラーゼはSEQ ID NO: 1または2のいずれかであり、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである。
【0233】
例えばアルファ−アミラーゼ変異体がS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体である実施形態では、アルファ−アミラーゼ変異体は参照アミラーゼアミノ酸位置97, 179, 180, 193, 319, 349, 358, 416, 428, または443に対応するアミノ酸位置に1以上の配列修飾を有する。より好ましくは、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
好ましい実施形態では、アルファ−アミラーゼ変異体は、例えばN193F置換またはV416G置換、またはこの両置換のように、N193置換またはV416置換、またはこの両置換を有する。
【0234】
別の実施形態では、アルファ−アミラーゼ変異体は位置F178, R179, G180, 1181, G182及びK183 にアミノ酸欠失を有する。このような実施形態では、アルファ−アミラーゼ変異体は改変された金属イオン依存性または金属イオン安定性、あるいはカルシウム無添加時における改変された活性、キレート剤存在下での改変された活性を有する。他の修飾の実施形態では、このような欠失は単独または前記の改変と組み合わせて実施される。
本願の実施形態では、アルファ−アミラーゼ変異体は親アルファ−アミラーゼに対し、例えばpH >約8での洗浄性能が改善されている。
【0235】
好ましい実施形態では、本願の方法では次の組み合された置換を有するアルファ−アミラーゼ変異体を使用する:a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E; または i) Q319R, Q358R, Q443E。
【実施例】
【0236】
本願について以下の実施例によりさらに詳しく説明する。これらの実施例は特許請求の範囲を限定するものではない。添付の図面は明細書の一部を構成する。引用した文献は、その内容の全てが本願に参照として組み込まれる。以下の実施例は説明のためのものであり、特許請求の範囲を限定するものではない。
【実施例1】
【0237】
<変異体の構築>
AmySの成熟配列の位置S242における変異体を、 部位特異的突然変異誘発を用いて構築した。突然変異誘発に用いたテンプレートは、New England Biolabs社(Massachusetts)のdam-Methylaseを用いたメチル化pHPLT- AmyS(図2参照)であった。縮重プライマー(下記に示すS242F(フォワード) 及び S242R(リバース))を合成し、Operon (Huntsville, AL)中へ希釈し10μMにした。
Operonは相補的フォワード及びリバース配列を有し、この両配列はいずれも反応においてライゲーションするための5'リン酸塩基を有する。親アルファ−アミラーゼの配列はSEQ ID NO:2であった。標的位置をNN(G/C)でランダム化したオリゴヌクレオチドプライマーを用いて、Stratagene Quik-ChangeTM Multi-siteキット(Stratagene社, La Jolla CA) によりライブラリーを構築した。選択したアミノ酸(すなわちS242)を、代替可能な19種のアミノ酸全てによりランダムに置換した。
下記のS242プライマーを突然変異誘発に用いた。
【化1】

【化2】

【0238】
<QUIK-CHANGETM反応>
この反応では、無菌蒸留水H2Oを18μL、キットに含まれる10x 緩衝液を2.5μL、キットに含まれるdNTPを1 μL、フォワードプライマーを1.25 μL (10 μM ストック液)、 リバースプライマーを1.25 μL (10 μM ストック液)、 テンプレートとしてpHPLT-AmySプラスミドDNAを1 μL (〜70 ng)、及びキットに含まれる酵素ブレンド物を1 μL 用い、全容量は26.5 μLであった。
【0239】
<サイクル条件>
先ず95℃で1分間の反応を1回行い、次に95℃で1分間、55℃で1分間、65℃で10分間のサイクルを25回繰り返した。
1マイクロリットルのDpn I (10 U/μL)をMulti-site Quik-ChangeTM反応混合物に添加し、37℃で18時間インキュベートし、次にさらに0.5 μL添加し3時間反応させた。
【0240】
1マイクロリットルのDpnI消化反応生成物を、TEMPLIPHI増幅キット(Amersham Biosciences社, Piscataway, NJ) によるローリングサイクル増幅のテンプレートに用い、Amersham社の取扱説明書に従い反応を行った。1マイクロリットルのローリングサイクルDNAを100μLのバシラス・スブチリスのコンピテント細胞(プロテアーゼ2欠失B.スブチリス株 (ΔaprE, AnprE, amyE::xylRPxylAcomK-phleo))中に形質転換し、37℃で1時間振蕩した。次に、全ての形質転換体をLA + 10 ppm Neo + 1% 不溶性澱粉のプレートに塗布し (1つのプレートに25 μL、別のプレートに75 μL)、37℃で一晩インキュベートした。
96の形質転換体を150 μLのLB + 10 ppm Neoを有するマイクロタイタープレートに植菌し、37℃で一晩成長させた。96ピンの複製ツールを用いて、一晩成長させたプレートから、より大きなLA + 10 ppm Neo + 1%不溶性澱粉のプレートに移しかえ、Quintara Biosciences社 (Berkeley, CA)へ送り、コロニーのPCRと配列解析を行った。
【0241】
変異体の配列を決定した後、125 μL のLB + 10 ppm Neoを有する96ウエルマイクロタイタープレートに変異体を4個一組の形態で植菌し、対照サンプルも植菌した。植菌したマイクロタイタープレートを37℃、250 rpmで6時間インキュベートした。
複製ツール(Enzyscreen社, Leiden, The Netherlands)を用いて、マイクロタイタープレートの培地を新しいマイクロタイタープレートに植菌した(マイクロタイタープレート及びプレートの蓋は Enzyscreen社製)。新しいマイクロタイタープレートには、タンパク質を発現させるためにMBD培養液150ul、及びタンパク質発現の栄養素の5 mM CaCl2を入れておいた(G. Vogtentanz et al, A Bacillus subtilis fusion protein system to produce soybean Bowman-Birk protease inhibitor, Prot. Expr. & Purif. 55 (2007) 40-52参照)。
タンパク質発現用プレートを37℃、250 rpm、湿度70%で64時間培養した。次に、発現させた培養液をミクロフィルタープレート(0.22 μm, Millipore社, Billerica, MA)で濾過し、熱安定性改善効果のスクリーニングに供した(実施例3参照)。
【実施例2】
【0242】
<変異体の発現、精製、及び分析>
実施例1のマイクロタイタープレートのコロニーを、ネオマイシンを10ppm含む澱粉プレート上に線状に塗布した。この澱粉プレートを37℃で一晩インキュベートし、シングルコロニーを採取し、培養液(下記参照)とネオマイシン10ppmとを入れた250 mL振蕩フラスコ(培養液は25 mL)に植菌した。この培養液を37℃、275 rpmで約8時間 (OD (600 nm)が2.0に達するまで) 培養した。この培養液と50%グリセロールとを2:1の比率で混合し、それぞれラベルを付した培養バイアルに個別に入れ、-80℃で冷凍した。以後の選択されたアルファ−アミラーゼの製造には、これらのグリセロールストック溶液を用いた。
【0243】
アミラーゼの発酵は、1% (w/v)のSoytoneを含むminimal MOPS培養培地(Neidhardt et al., J. Bacteriol. 119(3): 736-747, 1974)を入れた500mL振蕩フラスコを用いて、37℃で60時間培養することにより行った。
以下の手順により、疎水性相互作用クロマトグラフィーを用いて発酵後の培養液から酵素を精製した。
培養液を10倍に濃縮し、次にpH6.8の50 mM MES、2 mM CaCl2及び1M硫酸アンモニウムを含む溶液で元の濃度に戻し、次に無菌グラスファイバーフィルターで濾過した。
サンプルを、同じ緩衝液で予め平衡状態にしたPHENYL SEPHAROSE FF高密度カラム(20 x 95 mm; Amersham, GE Healthcare Bio-Sciences社, Sweden) に注入した。10カラム容積の硫酸アンモニウムを含まない前記緩衝液を注入し、引き続き用いて5カラム容積の水を注入して非アミラーゼタンパク質を溶出させた。
対象とする酵素は、pH 6.8の50 mM MES、2 mM CaCl2、及び40%プロピレングリコールを含む溶液で溶出させた。
【0244】
タンパク質の濃度は、標準的SDS pageゲル濃度定量法、またはMegazyme (Wicklow, Ireland)のアミラーゼ分析キットを用いた活性分析のいずれかの方法で測定した。精製したアミラーゼ(バシラス 707 アミラーゼ; SEQ ID NO:6)により作成した標準曲線を用いて、分析結果を比較した。
【実施例3】
【0245】
<改変された性質の評価:熱ストレス>
この実施例に、本願の変異体が親アルファ−アミラーゼに対し改変された性質を有することを示す。
G.ステアロサーモフィラスのアルファ−アミラーゼ(AmyS)変異体の、ハイスループット熱安定性スクリーニングを行った。
【0246】
最初の評価を行った後、野生型の酵素の熱ストレス後の活性が当初(ストレス前)の活性の約40% (すなわち、(熱ストレス後の活性)/( 熱ストレス前の活性) が約0.4) になる熱ストレス条件選択した。突然変異体のライブラリーを4個一組(quadruplicate) でスクリーニングし、熱ストレス後の残留活性が野生型酵素の熱ストレス後の平均残留活性よりも標準偏差の2以上高い変異体が、耐熱性を有する可能性の有る変異体であるものとして同定した。
【0247】
発現プレートの培養液上清中に、100 ppmの発現したアミラーゼが認められた。37℃、一定湿度の振蕩機を用いて60〜65時間培養した後(250 rpm、相対湿度70%)、フィルタープレートを用いて細胞質物質を除去することにより培養液上清を浄化した。浄化した上清をpH 5.8の50mM NaOAc/2.6mM CaCl2/0.002% Tween-20の緩衝液で10倍に希釈し、最終濃度を約10ppmとした。
各上清からサンプルを採取してさらに0.02 ppmまで希釈し、蛍光標識したトウモロコシ澱粉基質及び上記の方法を用いた酵素変異体活性測定に供した。
また、各上清からさらにサンプルを採取し、サーモサイクラーにより95℃で30分間熱ストレスをかけ、pH 5.8の50mM NaOAc/2.6mM CaCl2/0.002% Tween-20緩衝液で0.02ppmに希釈し、蛍光標識した基質及び下記の方法を用いて残留活性を測定した。
【0248】
アミラーゼの活性は、アミラーゼENZCHECK ULTRA AMYLASE分析キットを、製造者(Invitrogen社, San Diego CA)の取扱説明書に従って用いて評価した。評価におけるアミラーゼの最終濃度は約0.02ppmであった。アッセイ緩衝液には、pH 5.8の50mM NaOAc/2.6mM CaCl2/0.002% Tween-20緩衝液を用いた。基質には、BODIPY蛍光色素結合100μg/mL DQTM トウモロコシ澱粉(Invitrogen社, Eugene, OR) を用いた。アミラーゼ活性の指標となる蛍光の増加を、SpectraMAX M2 (Molecular Devices社, Sunnyvale, CA)を用いて測定した。反応を室温下で行い、この装置のキネティックモードで5分間記録した。励起波長は485nmで、515nmのカットオフフィルターを用い520nmの蛍光を測定した。
【0249】
95℃で30分間熱ストレスを与えた野生型AmyS(Xtra)の残留活性は33〜43%であった。同一の熱ストレスを与えたS242A及びS242QAmyS変異体の残留活性は、それぞれ55〜65%及び70-80%であった。図3とTable 3-1を参照されたい。これらの熱安定性の測定結果から、この2種の変異体は、野生型アルファ−アミラーゼよりも熱安定性が高いことが分かる。
【表2】

【実施例4】
【0250】
<改変された性質の評価:DSC>
疎水性相互作用クロマトグラフィーを用いて、振蕩フラスコの発酵培養液からSpezyme Xtra, S242A, S242E, 及びS242Qを精製した。50%プロピレングリコール及び2mM CaCl2を含有するpH 6.8の50 mM MESを用いてタンパク質をカラムから精製された状態で溶出させた。
【0251】
過剰熱容量曲線を、超高感度走査型ハイスループット・マイクロカロリーメータVP-CAP DSC (MicroCal, Inc.社, Northampton, MA)を用いて測定した。DSC測定の方法と解析方法は刊行物(Freire, E., "Differential Scanning Calorimetry," Methods. MoI. Biol. 41, 191- 218, 1995) に記載されている。
約500μLの0.5mg/ml野生型バシラス・ステアロサーモフィリスのα-アミラーゼ、またはS242A, S242E, 及びS242Q変異体(いずれも2mM塩化カルシウムを添加または無添加)について、30〜120℃の範囲を走査した。
同じサンプルについて、可逆性をチェックするために再スキャンした。α-アミラーゼの場合、熱変性は不可逆である。道板緩衝液はpH5.5の10 mM酢酸ナトリウムであった。凝集により生じ得る誤差を最小にするため、スキャン速度を200℃/hrとした。DSC曲線のサーマル・ポイント(Tm)を、供試したタンパク質の熱安定性の指標とした。Table 4-1に、供試したアミラーゼタンパク質の熱融点を示す。図5に、野生型アミラーゼ及びアミラーゼ変異体の熱融解曲線及び融点を示す。
【0252】
S242A, S242E, 及びS242Q変異体の熱変性は、2mM塩化カルシウムの有無にかかわらず、野生型との比較において融点の顕著な上昇として表れた。塩化カルシウムを添加しないときの野生型アミラーゼの融点は100.8℃であるのに対し、S242A, S242E, 及びS242Q変異体のTmは各々106.5℃, 107.8℃, 及び110.1℃であった。すなわち、S242をAで置換したときTmが5.7℃上昇し、S242をEで置換したときTmが7.0℃上昇し、S242をQで置換したときTmが9.3℃上昇した。
【0253】
2mM塩化カルシウムを添加したときの野生型アミラーゼの融点は106.8℃であるのに対し、S242A, S242E, 及びS242Q変異体のTmは各々111.8℃, 112.2℃及び113.8℃であった。すなわち、塩化カルシウムを添加しない場合と比較して、2mM塩化カルシウムの添加により4種のタンパク質全てのTmが上昇した。
カルシウムの添加により、野生型アミラーゼ及びS242A変異体のTmは各々6℃及び5.3℃上昇した。S242EのTmの上昇は4.4℃であった。S242QのTmの上昇は3.7℃であった。これは、S242Q変異体はカルシウムによってそれほど安定化されないか、またはS242Q変異体の安定性はカルシウムに依存しないことを示唆している。
野生型アミラーゼに対するS242A, S242E, 及びS242Q変異体のTmの上昇は、各々5℃, 5.4℃, 及び3℃であった。このことから、変異体の熱力学的特性が、野生型アミラーゼまたはSpezyme Xtraとは異なることが示唆される。この結果は、応用試験における改善された性能とも一致する(実施例5参照)。
【表3】

【実施例5】
【0254】
<活性プロファイル>
この実施例に、供試した変異体は親アルファ−アミラーゼだけでなく、工業上一般的な酵素に対しても改変された活性プロファイルを有することを示す。タンパク質の同定は、精製したサンプルまたはプレートのサンプルを用いて行った。アルファ−アミラーゼ変異体、及び標準アルファ−アミラーゼの評価は同じ濃度で行った。
【0255】
プレートまたは精製アミラーゼ変異体を、pH5.6のマレイン酸緩衝液を用いて約20ppmに希釈した。15%トウモロコシ澱粉がpH5.6のマレイン酸緩衝液中に含まれている基質を用いた。
400マイクロリットルの澱粉懸濁液を2.5分かけて70℃にした。次に、この澱粉懸濁液に希釈した酵素7μLを手早く添加し、タンパク質の最終的濃度を約0.36ppmにした。次に反応混合物を予め85℃に加熱しておいた振蕩機に取り付け、300rpmで撹拌した。所定時間後、125mM NaOHを50μL添加して反応を終了させた。反応チューブ内の反応液を遠心分離し、上清を10mM NaOHで10倍に希釈し、HPAEC-PAD(アンペロメトリック検出器付高性能アニオン交換クロマトグラフィー)でDP(重合度)プロファイルを分析した。
【0256】
反応は、4, 10 及び 20分間行った。4分間の反応には、基質から生成物への初期転換が反映される。10分間の反応には、酵素の熱活性が反映される。20分間の反応には、酵素の熱安定性が反映される。
【0257】
DP2からHPLC測定終了時までの面積を積分し、総タンパク質量と反応時間で割り算した。結果を図7及び8に示す。
【実施例6】
【0258】
<別の方法>
実施例において、以下の評価方法を用いた。これらの方法を一部変更した場合、各実施例に変更点を記載した。これらの評価方法において、反応により生じた生成物の吸光度の測定には分光光度計を用いた。
【0259】
<A. タンパク質含有量の測定>
[BCA (ビシンコニン酸)アッセイ]
マイクロタイタープレートスケールのサンプルのタンパク質含有量の測定には、BCA (Pierce)アッセイを用いた。使用した薬品及び試薬は:BCAタンパク質評価用試薬とPierce希釈緩衝液(50mM MES, pH6.5, 2mM CaCl2, 0.005% TWEENTM-80)であった。使用した測定装置はSpectraMAX (340型; Molecular Devices社)のMTP読取機であった。マイクロタイタープレートはCostar社製(9017型)であった。
【0260】
200μLの BCA試薬を各ウエルにピペットで入れ、次に希釈したタンパク質20μLを入れた。撹拌した後、マイクロタイタープレートを37℃で30分間インキュベートした。各ウエルの溶液の気泡を取り除いた後、562nmにおける光学密度を読み取った。タンパク質濃度を求めるために、各サンプルの計測値からバックグラウンドの値を差し引いた。複数の標準タンパク質(精製した酵素)のOD562をプロットして検量線を作成した。サンプル中のタンパク質濃度は、検量線の内挿から求めた。
【0261】
<ブラッドフォード(Bradford)アッセイ>
ブラッドフォード染料試薬(Quick Start社)法を用いて、マイクロタイタープレートスケールのサンプルのタンパク質含有量を測定した。使用した薬品及び試薬は:Quick Startブラッドフォード染料試薬(BIO-RAD カタログNo.500-0205)、及び希釈緩衝液(10mM NaCl, 0.1mM CaC12, 0.005%TWEENTM-80)であった。使用した装置は、Biomek FX Robot (Beckman社)、及びSpectraMAX(340型) MTP読取機であった。Costar社製(9017型)のマイクロタイタープレートを用いた。
【0262】
200μLのブラッドフォード染料試薬を各ウエルにピペットで入れ、次に希釈したタンパク質15μLを入れた。濾過した培養液10μLを各ウエルに添加した。撹拌した後、マイクロタイタープレートを室温で少なくとも10分間インキュベートした。各ウエルの溶液の気泡を取り除いた後、595nmにおける光学密度を読み取った。タンパク質濃度を求めるために、各サンプルの計測値からバックグラウンドの値(すなわち植菌していないウエルの計測値)を差し引いた。OD595の測定値から、サンプル中の相対的タンパク質濃度を求めた。
【0263】
<B. 見本片による酵素性能評価>
この評価で用いた洗剤は、酵素を含まない洗剤か、または市販の洗剤中の酵素を本願に開示する熱不活性化法で不活性化した洗剤であった。使用した装置はEppendorf Thermomixer、及びSpectraMAX(340型) MTP読取機であった。Costar社製(9017型)のマイクロタイタープレートを用いた。
【0264】
<洗剤の調製(AATCC HDL;米国の条件)>
Milli-Q水の硬度を6gpg(Ca/Mg=3/1)に調整し、増白剤無添加で1.5g/1のAATCC 2003標準参照液状洗剤を添加した。洗剤溶液を少なくとも15分間激しく撹拌した。次に、5 mM HEPES(遊離酸)を添加してpHを8.0に調整した。
【0265】
<米澱粉見本片によるアミラーゼの性能評価>
本願に開示した方法により試験用洗剤を調製した。使用した装置は、New Brunswick Innova 4230振蕩/インキュベータ、及びSpectraMAX(340型) MTP読取機であった。Costar社製(3641型)のマイクロタイタープレートを用いた。Center for Test Materials (Vlaardingen, Netherlands)から入手した黄色染料入り熟成米澱粉見本片(CS-28)を使用した。
この見本片を水洗した後、0.25インチの円形小見本片を切り取った。96ウエルのマイクロタイタープレートの各ウエルに、小見本片を2枚ずつ入れた。試験用洗剤の温度を20℃(北アメリカ条件)または40℃(西ヨーロッパ条件)に保った。
小見本片が入れられたマイクロタイタープレートの各ウエルに、洗剤溶液190μLを添加した。この混合物に、希釈した酵素溶液を10μL添加した。マイクロタイタープレートを接着性薄膜でシールし、所定の温度(20℃または40℃)のインキュベータ中において750rpmで撹拌しながら1時間インキュベートした。
その後、各ウエルから溶液を150μL採取し、新しいマイクロタイタープレートに入れ、SpectraMAX MTP読取機を用いて488nmにおいて測定し、洗浄効果を評価した。小試験片と洗剤を含み酵素は含まない参照サンプルと、ブランクサンプルについても洗浄効果を評価した。
【0266】
<酵素性能の計算>
吸光度の測定値を、ブランクの値(すなわち酵素を用いずにインキュベートした小見本片の測定値)で較正した。得られた吸光度の値を加水分解活性の指標とした。
【0267】
<C. 抗体滴定によるアミラーゼ濃度の測定>
いくつかの実施例では、アルファ−アミラーゼの濃度と比活性度を、抑制性ポリクロナール抗体を用いた滴定により求めた。バシラス・ステアロサーモフィリスのアルファ−アミラーゼ (AmyS)に対するポリクロナール抗体は、AmyS及びバシラス種 TS23由来のアルファ−アミラーゼに対する抑制性が強いことが分かった(例えば結合力が強いため、滴定した抗体の量に比例してアミラーゼの活性が直線的に低下する)。すなわち、この抗体を用いて酵素濃度を測定することができ、さらにこの濃度測定値から比活性度を求めることができる。
【0268】
いくつかの濃度が既知の抗体毎に、活性が抑制された酵素の量を測定した。この結果から、活性を完全に抑制するために必要な抗体の濃度を外挿により求めた。この抗体濃度は、サンプル中の酵素濃度に等しい。アルファ−アミラーゼの活性と抑制効果は、蛍光性BODIPY-澱粉アッセイにより測定した。使用した緩衝液は0.005% Tween-80を含むpH 7.0の50 mM MOPSであった。
【0269】
精製AmySに対するポリクロナール抗体はウサギを用いて生成させ、公知の方法で精製した。抗体ストック溶液の「見かけ濃度」は、比活性度が既知のAmySサンプルに対する抑制効果を測定して求めた。この抗体溶液を、AmyS及びTS23t変異体の濃度及び比活性度の測定に用いた。この測定値を用いて、全ての変異体の濃度が同一になるように希釈することにより規格化した96-ウエル酵素ストックプレートを作った。
【0270】
<D. 天然タンパク質ゲル電気泳動>
変異体タンパク質サンプルの電気泳動移動度を、PHASTGELシステム(GE Healthcare社)を用いて、プレキャストした濃度7.5%または12.5%ネイティブポリアクリルアミドゲル(PHASTGEL Homogeneous)上で測定した。0.88 M L- アラニン中のpH 8.8の 0.25 M Tris緩衝液から成るバッファー・ストリップ(PHASTGEL Native)を用いた。典型的な電気泳動条件は、アノードとカソード間の距離3.7cm、400Vで12.75分であった。
【0271】
別の方法では、タンパク質変異体サンプルの電気泳動移動度を、pH値が異なる(すなわち5.8, 8.0及び10.0) 厚さ1mmの0.5-1.5%アガロースゲルと、適切な緩衝液とを用いて測定した。電気泳動は、非変成条件下で行なった。アノードとカソード間の距離は13.9 cmであった。1〜2 μgのタンパク質のサンプルと、5%グリセロール+ 0.05% ブロモフェノールブルーとを混合し、ゲル上の各レーンで測定した。電気泳動は、100Vで1時間行った。
【0272】
ゲルを10%酢酸に溶解させたルイビルブルー(Louisville blue)染料で染色し、10%メタノール及び10%酸性水溶液で脱色した。使用したネイティブゲルの種類に応じて、12から20種のタンパク質変異体を同時に測定した。これにより、同一ゲル上の標準電荷ラダーに対するタンパク質変異体サンプルの電気泳動移動度を速やかに評価することができた。
【0273】
<E. 洗剤の熱不活性化>
市販の洗剤を用いて、酵素以外の成分の性能を維持しながら、洗剤に含まれるタンパク質成分の酵素活性を熱により不活性化させた。すなわち、この方法は酵素変異体の試験において使用する市販の洗剤の調製に適している。
北アメリカ(NA)と西ヨーロッパ(WE)のヘビーデューティ衣類液状 (HDL) 洗剤の場合、計量した液状洗剤(ガラス瓶入り)を95℃の水浴中で2時間加熱して不活性化した。北アメリカ(NA)と日本(JPN)のヘビーデューティ衣類液状 (HDG) 洗剤の場合、8時間加熱して熱不活性化し、西ヨーロッパ(WE)のHDGは5時間加熱して熱不活性化した。NAとWEの自動食器洗浄機(ADW)用洗剤は8時間加熱して熱不活性化した。これらの洗剤はスーパーマーケットで購入した。
不活性化の程度を正確に測定するため、熱処理した洗剤、及び熱処理していない洗剤の両者を5分以内に溶解して試験に用いた。洗剤の活性はsuc-AAPF-pNA法で行った。
【0274】
熱不活性化した洗剤中の酵素活性を測定するために、熱不活性化したストック溶液を用いて洗剤の試験用溶液を調製した。各洗剤を所定の同じ試験条件にするために、水の硬度調整剤(6 gpgまたは12 gpg)と緩衝液を各洗剤溶液に適宜添加した(Table 6-1参照)。溶液の入った瓶を振り、溶液を混合した。
【表4】

【0275】
<F. TERG-O-TOMETER法による洗浄性能の評価>
タンパク質及び炭水化物汚れの標準的な洗浄試験方法を用いた。布見本片の汚れの程度は、洗浄の前と後に標準的な方法で測定した。布見本片は、トウモロコシ澱粉、米澱粉、または血、ミルク、及びカーボンブラック混合物のいずれかで汚された綿布であった。布見本片はTestfabrics, Inc.社 (West Pittiston, PA)から購入した。トウモロコシ澱粉(EMPA 161)、血、ミルク、及びカーボンブラック(EMPA 116)人口汚れ材はCenter for Testmaterials BV 社製(Vlaardingen, Netherlands)であった。
各サンプルの試験前後における汚れの程度を、D65 (6500°K)標準光源を備えるMinolta Reflectometer CR-410を用いて、光反射率により測定した。L, a, b値の違いを、CIE-LAB色空間により定義された全色差(dE)に変換した。汚れの洗浄効果は、未洗浄(洗浄前)と非汚染の布の全色差の差に対する洗浄前後の全色差の差の比率から求めた、汚れ除去指数(%SRI)として表した。
【0276】
洗浄試験は、撹拌機付きステンレス製2L容器を6基備えるERG-O-TOMETER (United States Testing Co.社, Hoboken, NJ)を用いて行った。各試験は、1ガロン当り6グレインの3:1(カルシウム:マグネシウム)水硬化剤、または12グレインの水硬化剤を用い、全容積1Lで行った。
洗浄試験で用いた洗剤は、pH8の5mM HEPES緩衝液を含む1.5 g/LのAATCC HDL WOB 2003液状洗剤、0.7g/LのAATCC HDD WOB 1993顆粒状洗剤、過ホウ酸塩及びTAED漂白剤を含む8g/LのIEC A* 60456顆粒状洗剤、または5g/LのPersil Power Gel液体洗剤であった。
酵素を直接洗浄液に入れ、次に40g/Lまたは200g/Lの汚れ見本片布を完全に洗浄液に漬かるようにして入れて反応を開始した。洗浄は100rpmで撹拌しながら、 20℃、25℃、30℃、40℃、または50℃において、10, 15, または40分間行った。洗浄後、汚れ見本片を水道水で3分間すすぎ洗いし、電気洗濯機により1000rpmで脱水して余分な水を除き、低温のパーマネントプレスモードの乾燥機で約45分間乾燥させた。
光反射率測定により汚れ除去の程度を評価し、汚れ除去指数(%SRI)を求めた。実験の参照条件では酵素を用いずに洗浄し、ポジティブ参照条件では数種類の市販の酵素を用いて洗浄した。
【0277】
<G. BODIPY-澱粉アッセイによるアミラーゼ活性評価>
EnzChekTM Ultra Amylase Assayキット (E33651, Invitrogen社)を用いてBODIPY-澱粉アッセイを行った。
1mg/mLのDQ澱粉基質ストック溶液を、凍結乾燥された基質が入れられたバイアルにpH4.0の50 mM酢酸ナトリウム緩衝液100μLを加えて溶解させることにより調製した。このバイアルを約20秒振り混ぜた後、室温で暗所に置き、時々撹拌して完全に溶解させた。バイアルにアッセイ緩衝液(50mM酢酸ナトリウムと2.6mM CaCl2, pH5.8)900μLを加え、20秒間撹拌した。この基質溶液を室温で暗所に置き、使用するまで4℃で保管した。
この1mg/mL基質溶液からアッセイ緩衝液を用いて100μg/mLの試験用溶液を調製し、試験に供した。100μg/mLの基質溶液190μLを、平底96-ウエルマイクロタイタープレートの各ウエルに入れた。各酵素サンプル10μLをウエルに入れ、サーモミキサーを用いて800rpmで30秒間撹拌した。基質と緩衝液のみを含むブランクサンプル(酵素を含まないブランク)も含めてアッセイを行った。マイクロタイタープレート蛍光読取機を用いて、蛍光強度の変化率を25℃で5分間測定した(励起波長: 485 nm, 蛍光測定波長: 520 nm)。
【0278】
<H. 高分子量基質への酵素結合の測定>
トウモロコシ茎葉及び繊維に対するアミラーゼ(AmyS)電化ラダー(電荷変化= 野生型AmySに対し-12から+12)の基質結合性を評価した。使用した基質には搾りかす(National Renewable Energy Laboratoryが希釈酸で前処理、洗浄しpH5に緩衝したブラジルのサトウキビ搾りかす)、AFEX(アンモニア繊維膨潤トウモロコシ茎葉)、及びPCS (希硫酸で前処理し、洗浄し、pH5に調整されたトウモロコシ茎葉)が含まれていた。全ての基質について、使用する前に固形成分濃度を所定の値に調整した。
【0279】
アミラーゼ結合性:
試験に用いるアミラーゼ電荷ラダー変異体を精製し、濃度200ppmに希釈した。ホウ酸塩緩衝液(40mM, pH8.5, 0.016% Tween-80)を用いて1%セルロース繊維溶液を調製した。150μLの繊維溶液をマイクロタイタープ濾過レートの各ウエルに入れた。150μLのホウ酸塩緩衝液を、参照用として別のウエルに入れた。10μLのアミラーゼ荷電ラダー変異体を、各々2サンプルを一組として濾過プレートに入れた。濾過プレートを室温で2時間インキュベートした。濾液を回収し、上清中のアミラーゼ活性をBODIP Y-澱粉アッセイにより測定した。
【0280】
小見本片への酵素結合測定:
標準洗浄条件において、アミラーゼ変異体をCS-28米澱粉小見本片とともに、またはCS-28米澱粉小見本片無しで30分間インキュベートした。BODIPY-澱粉アッセイにより遊離酵素の量を測定した。小見本片に結合した酵素の量を次の式により計算した:
結合割合 = (見本片無での酵素活性 - 見本片有での酵素活性) / (見本片無での酵素活性)
【実施例7】
【0281】
<B.スブチリス中でのアミラーゼ産出>
この実施例では、バシラス・ステアロサーモフィリスアミラーゼのアルファ−アミラーゼ由来の欠失突然変異体 (S242Q突然変異と、C-末端における29アミノ酸欠失とを有する;本願ではS242Qと呼ぶ)、及びB.スブチリス中でのこの変異体の産出について説明する。
形質転換は公知の方法で行った(例えばWO 02/14490参照)。親アミラーゼをコードする遺伝子をpHPLT発現ベクター中にクローン化した。pHPLT発現ベクターは、LATプロモータ(PLAT)、LATシグナルペプチド(preLAT)をコードする配列、及びこれに続くクローン化用のPstl及びHpal 制限酵素認識部位を有する。
【0282】
LATシグナルペプチドのコード領域を以下に示す。
【化3】

LATシグナルペプチドのアミノ酸配列を以下に示す。
【化4】

【0283】
イタリック体で示すアミノ酸置換を有する成熟欠失S242Qアミラーゼのアミノ酸配列を基礎にして、本願の変異体ライブラリーを構築した。
【化5】

【0284】
PCR生成物をQiagen社のQIAQUIKカラムを用いて精製し、50μLの脱イオン水中に再懸濁させた。50μLの精製したDNAをHpaI(Roche社)及びPstI(Roche社)で消化し、得られたDNAを30μLの脱イオン水中に再懸濁させた。10〜20ng/LHのDNAを、paI及びPstIのクローン化部位を用いてプラスミドpHPLT中にクローン化した。ライゲーション混合物を、コンピテントB.スブチリス細胞(遺伝子型: Δvpr, ΔwprA,Δmpr-ybfJ, ΔnprB)中に直接形質転換した。
このB.スブチリス細胞はキシロース誘導プロモータに結合されたコンピテンシー遺伝子(comK)を有するので、DNA結合及び取り込み能力を誘導するためにキシロースを用いた(Hahn et al , MoI. Microbiol, 21 : 763-775, 1996参照)。
【0285】
pHPLT-AmySプラスミドのエレメントには、pUBl 10 = pUBl 10プラスミド由来のDNA断片(McKenzie et al, Plasmid 15: 93-103, 1986参照)が含まれる。プラスミドの構成要素には:ori-pUB 110 = pUB 110複製起源; neo = pUBl 10のネオマイシン耐性遺伝子由来; Plat = B.リケニホルミスアミラーゼ由来の転写プロモータ; Pre LAT = B.リケニホルミスアミラーゼ由来のシグナルペプチド;SAMY 425ss = 欠失AmyE遺伝子配列のコード領域 (本願において発現される欠失AmyE変異体のコード領域で置換されたもの);及びターミネーター = B.リケニホルミスアミラーゼ由来の転写ターミネーターが含まれる。
【実施例8】
【0286】
<酵素変異体の発現>
この実施例では、上記の実施例の形質転換B.スブチリスの種々の遺伝子組み換え酵素を発現させる方法について説明する。
【0287】
<アミラーゼの発現 - 2 mLスケール>
S242Q(またはその変異体) を含むB.スブチリスクローン発現ベクターを、グリセロールストック液からの自己複製子をLB培養液150μL + 10μg/ml ネオマイシンを含む96-ウエル培養プレート(BD, 353075)に入れ、37℃、220rpmで加湿雰囲気下において一晩培養することにより複製した。
5mL のプラスチック製培養チューブ中で、一晩培養した培養液100μLを合成培地2000μL+ 10μg/mlネオマイシンに植菌した。培養媒体には、MOPS緩衝液中に窒素源としての尿素、炭素源としてのグルコース、及び健全な細胞を成長させるための1% SOYTONEとカルシウム5mM を含む、富栄養半合成培地を用いた。
培養チューブ内の試料を37℃、250rpmで72時間インキュベートした。インキュベートした後、培養液を3000 x gで10分間遠心分離した。上清を15mLのポリプロピレン製円錐管に静かに移し、次に80μLのサンプルを96ウエルプレートに分取し、タンパク質を定量した。
【実施例9】
【0288】
<酵素変異体の産出>
この実施例では、酵素電荷ラダーの作り方と組み合わせ電荷ライブラリーの構築方法を説明する。
【0289】
<酵素電荷ラダー>
様々な物性を有する多数のタンパク質変異体を、公知の部位特異的突然変異誘発法(例えばGenencor International出願、U.S. Pat. Appln. Ser. No. 10/576,331, 11/581,102, 及び11/583,334参照) で調製するか、または公知のライブラリーから選び出した。所定の複数のタンパク質プローブのセットを、対象とする試験方法で評価した。
以下の表に示すアミラーゼ変異体電荷ラダーの例について、本願に開示する方法で評価した。これらの表には、親酵素に対する電荷変化が示されている。
【表5】

【0290】
<酵素組合せ電荷ライブラリー(CCL)>
[B.ステアロサーモフィリス AmyS-S242Q CCLの構築]
形質転換したB.スブチリス株 (遺伝子タイプ: ΔaprE, ΔnprE, amyE::xylRPxylAcomK-phleo)からAmyS-S242QプラスミドDNAを単離し、CCL構築用のテンプレートとしてDNA2.0 Inc.社へ送った。
DNA2.0 Inc.社 (Mountain View, CA)に、Table 15-2に示すAmy S- S242Q (S242Q)アミラーゼ中の各4部位のポジショナル・ライブラリーを構築するよう依頼した。変異体は96-ウエルプレート中のグリセロールストック液として送られてきた。
【0291】
AmyS S242Q組合せ電荷ライブラリーは、Gln-97, Gln 319, Gln 358, 及びGln 443の4つの残基を指定して設計した。各部位において野生型、アルギニン、またはアスパラギン酸の3つの可能性のある組合せを作ることにより、81の変異体を含み4つの部位に関するCCLが構築された。
【表6−1】

【表6−2】

【実施例10】
【0292】
<酵素の洗浄性能>
この実施例では、S242Q変異体を1.0 μg/ml含むAATCC HDL洗剤、または S242Q変異体を5 mM含むHEPES緩衝液の、様々なイオン強度下における小見本片評価試験について説明する。実施例12に示した方法を用いた(「米澱粉見本片によるアミラーゼの性能評価」と「トウモロコシ粉加水分解」参照)
【0293】
AATCC HDL洗剤中での酵素の洗浄性能において、最適な正味電荷変化が認められた。洗浄性能は、米澱粉小見本片活性アッセイで観察された相対的洗浄性能について評価した。このアッセイでは、値が約1.0のとき洗浄性能が良いことを意味する。これは、所与の結果または利点(例えば液体衣類洗剤の洗浄性能)を改善するためにタンパク質の物性(例えば正味電荷)を最適化する例である。この限られたタンパク質プローブのセットにより特定された最適な電荷は、電荷組合せライブラリー全体について観察された最適な電荷に一致する。従って、複数のタンパク質プローブを用いることにより、電荷組合せライブラリー全体の挙動を予測することができる。
【0294】
Debye-Huckelの理論(Israelachivili, Intermolecular and Surface Forces, 2nd Edition: With Applications to Colloidal and Biological Systems, Academic Press 2nd Ed. [1992])によれば、静電相互作用は主として、相互作用に関与する一定電位または一定電荷の物質(酵素、基質、繊維、及び洗剤)の間の二重層力の強度、そのサイズ、及び周囲環境の誘電率によって決まる。洗剤処方等の複雑な媒体中での粒子の静電挙動を明らかにするためには、同一のDebye遮蔽距離を有する単純化された環境における粒子間の相互作用を明らかにすれば足りる。これは、洗浄時の洗剤と同じpHと伝導度の緩衝液を選択することにより、実施することができる。このような試験に適した緩衝液は、異なる量のNaCl等の中立の電解質を含む pH8.0の5 mM HEPES緩衝液である。この緩衝液にNaC l を2.5 mM 添加することにより、pHと伝導度を北米の洗浄条件に適合させることができる。さらに高濃度のNaClを添加すれば、一般に水の硬度が高いことと洗剤濃度が高いことによりイオン強度が高い、日本及び欧州の洗浄条件に適合させることができる。
【0295】
図10は、正電荷のS242Q電荷変異体は、北米の衣類洗浄条件下において米澱粉小見本片の洗浄性能が優れていることを示している。同様に、負電荷のTS23t変異体は西ヨーロッパの衣類洗浄条件下において米澱粉小見本片の洗浄性能が優れている(図11)。
【0296】
図12は、正電荷のS242Q電荷変異体は顆粒状トウモロコシ澱粉の加水分解においてより高い比活性度を示すことを表わしている。
【実施例11】
【0297】
<熱安定性>
この実施例では、熱安定性とタンパク質電荷の関係の評価について説明する。アルファ−アミラーゼの評価は、上清の加熱前後でのBODIPY澱粉加水分解に基づいて行った。実施例6と同じ薬品及び試薬を用いた。
【0298】
<アルファ−アミラーゼの熱安定性評価>
濾過した培養液上清を、002%Tween を含むpH 5.8の50 mM酢酸ナトリウム + 2 mM CaCl2を用いて連続的に希釈した。希釈した各培養液上清10μLについて、BODIPY澱粉加水分解により初期アミラーゼ活性を求めるための試験を行った。各希釈培養液上清50μLを、薄型VWR PCR 96ウエルプレートに入れた。各ウエルに鉱物油30μLをシール剤として添加した。このプレートを、BioRad DNA engine Peltier Thermal Cyclerを用い、親酵素の安定性に応じて95℃において30分間または60分間インキュベートした。インキュベートした後、このプレートを4℃で5分間冷却し、室温で保存した。各サンプル10μLを新しいプレートに入れ、実施例1に示したBODIPY澱粉アッセイにより、最終的アミラーゼ活性を評価した。
【0299】
<熱安定性の計算>
サンプルの残留活性を、最終的吸光度と最初の吸光度の比で表わした。最終的吸光度と最初の吸光度はいずれもブランクにより較正した。比の値が大きいほど、変異体の熱安定性が良いことを示す。これは、液状衣類洗剤の酵素の熱安定性を改良するためにタンパク質の物性、この場合は正味電荷、を最適化する例である。
【0300】
<熱安定性評価>
上記のようにして、変異体の熱安定性を評価した。熱安定性の優れた変異体をTable 11-1に示す。熱安定性の優れた変異体は、親酵素(すなわちS242Q)の残留活性に対する変異体の残留活性の比率が1より大きい変異体である。
【表7】

【実施例12】
【0301】
<酵素性能>
この実施例に、酵素の性能が電荷に影響され得ることを示す。
酵素の性能評価は、実施例12に示した不活性化した洗剤を用いて行った。性能指数(PI)が1より大きいものを、性能が良いとした。PIは、変異体の残留活性と親(すなわちS242Q)の残留活性との比率である。結果をTable 12-1 及び12-2に示す。
【表8−1】

【表8−2】

【表9−1】

【表9−2】

【0302】
また、本願に開示したBODIPY澱粉加水分解アッセイを用いて活性を評価した。結果をTable 12-3に示す。この澱粉基質(トウモロコシ澱粉)に対する相対比活性度が1より大きいことは、その変異体の比活性度が親S242Q酵素より高いことを示す。相対ppmは力価を表わし、この値が1より大きいときは、親S242Q酵素より高力価(振蕩チューブ中で)であることを示す。
【表10−1】

【表10−2】

【実施例13】
【0303】
<アミラーゼの活性と発現に及ぼす突然変異の効果の最適化>
この実施例では、酵素の2種の性質が、タンパク質の電荷変化に対し相反する依存性を示すために負の相関関係にある場合でも、複数のアミノ酸置換の導入により、酵素のこれら2種の性質を同時に改善することができることを説明する。
【0304】
実験により、正電荷が増加するとAmyS- 242Qの培地での発現が減少することが認められた。しかし、正電荷が増加すると特異的BODIPY澱粉加水分解は増加する。
例えば燃料エタノール製造や洗剤に用いられる澱粉液状化用の遺伝子組み換えAmyS-242Q変異体の場合、アミラーゼ発現特性と澱粉加水分解特性の両者が改善されることが望ましい。しかし、この2種の特性は両立しないように見える。
本願の方法によれば、単一突然変異を選択的に組み合わせることにより、澱粉加水分解特性を損なうことなくアミラーゼ発現特性を向上させることができる。本願の方法によれば、第1の特性(例えば発現特性)が向上し、第2の特性(例えば澱粉加水分解特性)が向上ないし維持された選択的多置換AmyS-242Q変異体を製造することができる。
【0305】
また、AmyS-242Q変異体の培地での発現とは逆に、正電荷が増加するとAmyS-242Q変異体のトウモロコシ澱粉の小見本片洗浄性能は向上する。遺伝子組み換えAmyS-242Q変異体の場合、アミラーゼ発現特性と洗浄性能の両者が改善されることが望ましい。しかし、この2つは両立しないように見える。
本願の方法によれば、単一突然変異を選択的に組み合わせることにより、洗浄性能を損なうことなくアミラーゼ発現特性を向上させることができる。本願の方法によれば、第1の特性(例えば発現特性)が向上し、第2の特性(例えば米澱粉小見本片洗浄性能)が向上ないし維持された選択的多置換AmyS-242Q変異体を製造することができる。
【0306】
1から4の荷電残基の置換の組み合わせを有する変異体から成るAmyS-S242Q電荷組合せライブラリー(CCL)中の80種の変異体について、振蕩チューブでの発現、BODIPY-澱粉加水分解、及び米澱粉洗浄性能を評価した。優れたAmyS-S242QをTable 13-1 及び 13-1に示す。
Table 13-1に示す複数置換変異体は、親酵素と同等ないし改善された発現特性と、親酵素と同等ないし改善されたBODIPY-澱粉加水分解特性とを有する。またTable 13-2に示す複数置換変異体は、親酵素と同等ないし改善された発現特性と、親酵素と同等ないし改善された米澱粉洗浄性能とを有する。
【表11】

【表12】

【0307】
まとめると、酵素活性と酵素産出性能とは電荷依存性が異なるため(図13A, 13B, 14A 及び 14B参照)、負の相関関係にある(図12 A及び12B参照)。しかし、発現及び活性の両者が改善される変異体も多数存在し、ライブラリーを本願の方法で分析することにより、このような変異体を特定することができる。
【0308】
アミラーゼを例に説明したが、この方法はプロテアーゼ、リパーゼ、セルラーゼ、トランスファラーゼ、及びペクチナーゼ等の他の種類の酵素にも適用可能である。さらに、発現特性、活性、結合特性、熱安定性、洗剤及びキレート安定性等の特性の2以上を同時に分析することもできる。
【実施例14】
【0309】
<アミラーゼのデサイジング性能>
この実施例では、85℃と97℃においてカルシウム濃度を変化させたときのS242Q変異体のデサイジング性能を、Ethyl及びXtraと比較した。CaCl2の濃度は、実験毎にMilli Q水で調製したpH ~6.5のCaCl2ストック溶液の添加量を変えることにより、0〜20 ppmの範囲で変化させた。実験では、0.01ppm活性タンパク質のEthyl、Xtra、及びS242Q変異体を使用した。実験はLAUNDER-O-METERを用いて、液比50:1で行った。性能試験は、澱粉に指示染料を結合させた米澱粉汚れ見本片布(TestFabrics Cat. No. CS-28; TestFabrics Inc.社) を用いて行った。実験毎に、3枚のCS-28見本片(6cm×8cm)と4枚のプリント生地見本片(Testfabrics, Style 400R; 3インチ×4インチ) を試験材料に用いた。Milli Q water/Caを入れたLAUNDER-O-METERの温度を予め85℃または97℃にしておき、次に酵素と見本片を投入した。30分間反応させた後、全色差測定の前に見本片を水洗いして乾燥させた。
【0310】
性能評価は、反射率測定法でCIE-L*a*b*色空間を測定することにより行った。知覚可能な色を色空間におけるL*a*b*座標系で表わすことができる。「L*」は0から100のスケール、すなわち黒から白の明度またはグレースケールを表わす。「a*」はマジェンタからグリーンへの色相変化を表わしており、正の値が大きいほどマジェンタ色相が強く、負の値が大きいほどグリーン色相が強いことを表わす。「b*」は黄色からブルーへの色相変化を表わしており、正の値が大きいほど黄色相が強く、負の値が大きいほどブルー色相が強いことを表わす。a*とb*の値がともに0のときは色が無く、明度がL*で指定される純粋のグレーとなる。
【0311】
デサイジング性能を、D65標準光源を備えるMinolta Chromameter CR-200を用いて評価した。デサイジング性能を定量化するため、各CS-28見本片についてCIE L*を4点測定し(すなわち、見本片の表と裏を2点ずつ測定)、その後アミラーゼで処理した。CIE L*値が高いほど、デサイジング効果が高いことを意味する。
【0312】
図15と16に示すように、試験した条件下では、S242Q変異体はEthyl及びXtraのいずれよりも、デサイジング性能におけるカルシウム濃度依存性がはるかに低い。
【0313】
明細書に記載した全ての文献と特許は参照として本願に組み込まれる。本願に開示した方法及び酵素は特定の実施形態または好ましくは実施形態に関して説明されているが、本願発明の範囲はこれらの実施形態に限定されない。本願に開示した方法及び酵素を種々変更または改良できることは当業者にとって明らかであり、本願発明の範囲にはこのような変更または改良も含まれる。
【図1A】

【図1B】

【図1C】

【図1D】

【技術分野】
【0001】
本願は新規なアルファ−アミラーゼに関する。特に、本願は特定のアルファ−アミラーゼ変異体の活性を利用する方法、このアルファ−アミラーゼ変異体のブレンド物を汚れ除去及び洗濯用洗剤組成物の一成分として利用する方法に関する。
<配列表>
添付のSEQ ID NO: 1〜30からなる配列表の全てを、参照として本願に組み込む。
<関連出願とのクロスリファレンス>
本願は米国仮出願60/985,619 (2007年11月5日出願)、61/026,579 (2008年2月6日出願)、61/041,075 (2008年3月31日出願)、及び61/059,411 (2008年6月6日出願)に基づく利益を主張し、これらの出願は参照として本願に組み込まれる。
【背景技術】
【0002】
アルファ−アミラーゼ(アルファ-1,4-グルカン-4-グルカノヒドロダーゼ, E.C.3.2.1.1)は、澱粉及び直鎖または分岐1,4-グルコースのオリゴサッカライド及びポリサッカライドの加水分解触媒となる酵素群である。
【0003】
アルファ−アミラーゼは様々な用途に用いることができる。例えば、アルファ−アミラーゼは商業的に澱粉加工の初期段階(例えば液状化)、穀物の湿式粉砕、炭水化物を原料とするアルコール製造等で用いられている。また、アルファ−アミラーゼは洗浄剤、または洗剤の添加剤、織物工業での澱粉デサイジング剤、製パン用、飲料工業、油田での掘削工程、例えば紙の脱インク等のリサイクル工程、及び動物飼料にも用いられている。
【0004】
澱粉液状化や織物デサイジング剤等の特定の用途において、改良された性質を有するアルファ−アミラーゼ変異体の創生が試みられてきた。
【発明の概要】
【発明が解決しようとする課題】
【0005】
デサイジングや洗浄/洗濯、あるいは汚れ除去または澱粉除去等の種々の用途において、一般的工業用の酵素(例えばバシラス・リケニホルミス(Bacillus licheniformis)由来の酵素)に対し、製造上および/または性能上の利点を有する、改善されたアミラーゼの創生が求められている。
【課題を解決するための手段】
【0006】
一側面では、本願は特にAmyS-様α-アミラーゼ等の親α-アミラーゼの新規なα-アミラーゼ変異体に関する。特に、例えば織物のデサイジング等の澱粉の除去や、洗浄または洗濯において有用な改変された性質を有する新規なα-アミラーゼ変異体に関する。
【0007】
例えば、本願の変異体は親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して、下記の性質の1以上が改変されている。
正味電荷、基質特異性、基質分解性、基質結合性、熱安定性、1以上のpH域における活性、1以上のpH域における安定性、酸化環境下での安定性、Ca2+要求性、比活性度、触媒反応速度、触媒効率、キレート剤の存在下での活性、キレート剤存在下での熱またはpH安定性、デサイジングでの有用性、洗浄プロセスでの有用性、タンパク質発現系での発現量、またはその他の対象とする性質。
例えば、1以上の改変により、AmyS様アルファ−アミラーゼ等の親α-アミラーゼと比較して低減されたCa2+依存性、および/または、改変されたpH/活性依存性(プロファイル)、および/または、改変された熱安定性を有する変異体が得られる。
【0008】
一側面では、本願により親ゲオバシラス・ステアロサーモフィリス(Geobacillus stearothermophilus)アルファ−アミラーゼの変異体が提供される。この変異体は親ゲオバシラス・ステアロサーモフィリスのアルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有し、アミノ酸位置242に置換を備え、ここでペプチド配列中のアミノ酸位置番号は参照アミノ酸(例えばSEQ ID NO: 1または2) のアミノ酸位置番号に対応しており、この変異体はアルファ−アミラーゼ活性を有する。
【0009】
別の側面では、本願によりa) 親AmyS様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に対応する位置に置換を有するとともに、検出可能なアルファ−アミラーゼ活性を示す少なくとも1のアルファ−アミラーゼ変異体と、b) 別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とから成る組成物が提供される。
好ましい実施形態では、参照アミラーゼはSEQ ID NO: 1または2であり、組成物は洗濯、食器または硬質表面洗浄、デサイジング、あるいは繊維または汚れ処理に用いられる製品の一成分である。
【0010】
一つの実施形態では、組成物に含まれる別の酵素はプロテアーゼ、リパーゼ、アミラーゼ、セルラーゼ、ペルオキシダーゼ、オキシダーゼ、ペクチナーゼ、リアーゼ、クチナーゼ、ラッカーゼまたはこれらの組み合わせである。
【0011】
本願の実施形態では、界面活性剤は非イオン性、アニオン性、カチオン性、または両性イオン性である。アルファ−アミラーゼ変異体は、好ましくはS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体である。
いくつかの実施形態では、変異体は酸化に対する安定性が改変されている。またアルファ−アミラーゼ変異体は、親AmyS-様アルファ−アミラーゼのアミノ酸位置8, 9, 96, 200, 206, 284, 307, 311, 316, 及び438残基を含めてメチオニン残基の1以上の置換または欠失を備え、ここで参照アルファ−アミラーゼはSEQ ID NO: 2である。
【0012】
別の実施形態では、アルファ−アミラーゼ変異体はさらに、参照アルファ−アミラーゼのアミノ酸位置97, 179, 180, 193, 319, 349, 358, 416, 428, または443に対応するアミノ酸位置の1以上において、配列修飾を有する。
また別の実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【0013】
好ましい実施形態では、アルファ−アミラーゼ変異体は、例えばN193F置換またはV416G置換、またはこの両置換のように、N193置換またはV416置換、またはこの両置換を有する。別の実施形態では、アルファ−アミラーゼ変異体は位置F178, R179, G180, 1181, G182及びK183 にアミノ酸欠失を有する。
【0014】
好ましい実施形態では、アルファ−アミラーゼ変異体は改変された金属イオン依存性、あるいはカルシウム無添加時における改変された安定性または活性、キレート剤存在下での改変された安定性または活性を有する。
【0015】
好ましくは、アルファ−アミラーゼ変異体はSEQ ID NO:2に対し少なくとも95%, 98%, あるいは99%を超える相同性を有し、アミノ酸配列SEQ ID NO:1から成る参照アルファ−アミラーゼの位置番号242に相当する位置にアミノ酸置換を有し、このアルファ−アミラーゼ変異体がアルファ−アミラーゼ活性を有する。
【0016】
一つの実施形態では、親AmyS-様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16から成り、参照アルファ−アミラーゼがSEQ ID NO: 1 または2から成る。好ましくは、アルファ−アミラーゼ変異体は親AmyS-様アルファ−アミラーゼに対し、pH >約8での洗浄性能が改善されている。
【0017】
本願の実施形態では、アルファ−アミラーゼ変異体は次の組み合わされた置換を有する:a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E; または i) Q319R, Q358R, Q443E。
【0018】
別の側面では、本願により洗剤または洗浄剤処方組成物が提供され、この組成物には親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体が含まれ、このアルファ−アミラーゼ変異体が検出可能なアルファ−アミラーゼ活性を有し、ここで参照アミラーゼはSEQ ID NO: 1、または2である。
いくつかの実施形態では、アルファ−アミラーゼ変異体は少なくともS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242Tのいずれかを含む、S242変異体である。
【0019】
別の側面では、本願により織布製造後に織物をデサイジングする方法が提供され、この方法には、親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するアルファ−アミラーゼ変異体と、織物とを接触させる工程が含まれる。好ましくは、アルファ−アミラーゼ変異体は検出可能なアルファ−アミラーゼ活性を有する。接触工程は、織物からデサイジング剤の少なくとも一部が除去される条件及び時間において行われる。
【0020】
本願の実施形態では、アルファ−アミラーゼ変異体は、親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して、下記の性質の1以上が改変されている。
(a)正味電荷、(b)基質特異性、(c)基質分解性、(d)基質結合性、(e)熱安定性、(f)1以上のpH域における活性、(g)1以上のpH域における安定性、(h)酸化環境下での安定性、(i)Ca2+要求性、(j)比活性度、(k)触媒反応速度、(1)触媒効率、(m)キレート剤存在下での活性、(n)キレート剤存在下での熱またはpH安定性、(o)デサイジング効果、(p)タンパク質発現系における発現量。
【0021】
本願の実施形態では、親AmyS様アルファ−アミラーゼはSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16のいずれかであり、参照アルファ−アミラーゼはSEQ ID NO: 1または2である。好ましくは、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである。
【0022】
いくつかの実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。ここで、参照アルファ−アミラーゼはSEQ ID NO: 1または2である。
【0023】
また、本願により洗濯または洗浄方法が提供される。この方法は、洗濯または洗浄される1以上の物品を、親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体が含まれる組成物に接触させる工程が含まれる。この接触工程は、1以上の物品が洗濯または洗浄される条件及び時間において行われる。アルファ−アミラーゼ変異体は検出可能なアルファ−アミラーゼ活性を有する。
この方法の一例では、少なくとも1の物品は少なくとも1の澱粉含有物質で汚されており、この汚れの除去がアルファ−アミラーゼ変異体によって促進される。この方法の実施形態では、組成物にはさらに、別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1が含まれる。
【0024】
この方法の実施形態では、親AmyS様アルファ−アミラーゼはSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16のいずれかであり、参照アルファ−アミラーゼはSEQ ID NO: 1または2である。好ましくは、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである。
【0025】
本願の実施形態では、アルファ−アミラーゼ変異体は親AmyS-様アルファ−アミラーゼに対しpH >約8での洗浄性能が改善されている。
【0026】
一つの実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
別の実施形態では、アルファ−アミラーゼ変異体は次の組み合された置換を有する:a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E; または i) Q319R, Q358R, Q443E。
【0027】
この方法には、アミノ酸位置F178, R179, G180, 1181, G182, またはK183の1以上に欠失を有するアルファ−アミラーゼ変異体を使用することが含まれる。いくつかの実施形態では、アルファ−アミラーゼ変異体は改変された金属イオン依存性または金属イオン安定性、あるいはカルシウム無添加時における改変された活性、キレート剤存在下での改変された活性を有する。
【0028】
また本願により、a) 親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体が含まれ、検出可能なアルファ−アミラーゼ活性を有するアルファ−アミラーゼ変異体と、b) 別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とが含まれるキットが提供される。
【0029】
ひとつの実施形態では、このキットにはさらに、このキットの成分を織物のデサイジング、または澱粉含有物質で汚された1以上の物品を洗濯または洗浄する際の取扱説明書が含まれている。
以下、本願発明について詳しく説明する。
【図面の簡単な説明】
【0030】
【図1】本願で用いる親アルファ−アミラーゼ(AmyS様アルファ−アミラーゼ)のいくつかの候補のアミノ酸配列のアライメントを表わす図である。ゲオバシラス・ステアロサーモフィリス(SEQ ID NO: 1)由来のアミラーゼのアミノ酸位置(例えば1から520)に対応する位置を容易に決めることができる。SEQ ID NO:1, G. ステアロサーモフィリス(Geobacillus stearothermophilus)「BSG」由来のアルファ−アミラーゼ; SEQ ID NO:2, G. ステアロサーモフィリス由来の欠失アルファ−アミラーゼ(AmyS, SPEZYME XTRA); SEQ ID NO:3, G. ステアロサーモフィリス (S242A変異アミラーゼ); SEQ ID NO: 4, G. ステアロサーモフィリス (S242Q変異アミラーゼ); SEQ ID NO: 5, G. ステアロサーモフィリス (S242E変異アミラーゼ); SEQ ID NO:6, ヤマネ707 アミラーゼ; SEQ ID NO: 7, 成熟LATアミラーゼ; SEQ ID NO: 8, バスラス・リケニホルミス野生型アミラーゼ[TERMAMYL (NOVOZYMES) = WO 02/10355 A2のSEQ ID NO: 8に相当]; SEQ ID NO: 9, B. アミロリケファシエンス アミラーゼ, BAN; SEQ ID NO: 10, STAINZYME = AA560(WO 00/60060のSEQ ID NO:2またはUS 6,528,298 の SEQ ID NO:24に相当); SEQ ID NO: 11, B. ハルマパルス (halmapalus) アミラーゼ (NATALASE); SEQ ID NO: 12, KSM-1378 (花王, EP1199356のSEQ ID NO:3 に相当) ; SEQ ID NO: 13, バスラス種 KSM-K38 (花王, US 6,403,355 B1のSEQ ID NO:4 に相当); SEQ ID NO: 14, バスラス種 KSM-K36 (花王, US 6,403,355 B1のSEQ ID NO:2に相当); SEQ ID NO: 15, LIQUOZYME SC (NOVOZYMES); SEQ ID NO: 16, 親アルファ−アミラーゼ配列コンセンサス(consensus) 1;
【図2】pHPLT-AmySプラスミドを表わす図である。
【図3】S242変異体に95℃の熱ストレスを30分間与えた後の残留活性%を表わす図である。変異体位置P, S, W, 及びYが欠失しており、野生型AmyS (SpezymeTM Xtra (「Z」で示した))で置換されていた。陽性対照の、C末端の29アミノ酸が欠失したΔ179-180のG. ステアロサーモフィリス(すなわちSEQ ID NO:2)も併せて示す。図中の線は、野生型酵素の残留活性パーセントの標準偏差の2倍及び3倍に相当する値を表わす。S242A及びS242Qの残留活性は、明らかに野生型酵素よりも高い。
【図4】図4A〜Iは、図1のいくつかの配列についてのペアワイズ・アライメントとコンセンサス(consensus)配列、及びコンセンサス配列2, 3, 4, 5, 6, 7, 8, 9, 及び10、またはSEQ ID NO: 22, 23, 24, 25, 26, 27, 28, 29, 及び30を表わす。
【図5】野生型及び変異体アミラーゼにカルシウムを添加しなかったときの、熱融解曲線と融点を表わす図である。
【図6】野生型及び変異体アミラーゼの両者に2 mMのカルシウムを添加したときの、熱融解曲線と融点を表わす図である。
【図7】Spezyme Xtraと2種の変異体の4, 10, 及び20分後の活性分析結果を、Liquozyme SCの活性と対比して表わす図である。
【図8】4種の変異体の4, 10, 及び20分後の活性分析結果を、S242Q変異体の活性と対比して表わす図である。
【図9】S242Q電荷組合せライブラリー、米澱粉小見本片を用いたTide 2xによる20℃の北米衣類洗浄条件下の洗浄試験における、S242Q(黒丸)及びS242Q変異体(白丸)の性能と、電荷の関係を表わすグラフである。実施例10参照。
【図10】TS23t電荷組合せライブラリー、米澱粉小見本片を用いたPersilによる40℃の西ヨーロッパ衣類洗浄条件下の洗浄試験における、Q98R、M201L、S243Q、R309A、Q320R、Q359E、及びK444E突然変異を有する欠失バシラス種TS-23アミラーゼ(黒丸)と、その電荷変異体(白丸) (2008年6月6日出願のU.S. Patent Application No. PCT/US2008/007103参照) の性能と、電荷との関係を表わすグラフである。実施例10参照。
【図11】BODIPY-澱粉アッセイにおけるS242Q(黒丸)及びS242Q変異体(白丸)の性能と、電荷の関係を表わすグラフである。S242Q組合せ電荷ライブラリー(CCL)、BODIPY-澱粉に対する比活性度、及び標準アッセイ条件に関しては、実施例10を参照されたい。
【図12】図12Aは、相対的BODIPY-澱粉加水分解特性と、振蕩チューブ中での相対的発現特性との関係を表わすグラフである (すなわち、相対的BODIPY-澱粉加水分解特性vs. 相対的振蕩チューブ中発現特性) 。図12Bは、相対的小見本片-澱粉加水分解特性と、振蕩チューブ中での相対的発現特性との関係を表わすグラフである (すなわち、相対的小見本片-澱粉加水分解特性vs. 相対的振蕩チューブ中発現特性) 。実施例13参照。
【図13】図13Aは、振蕩チューブ中での相対的発現特性と電荷の関係を表わすグラフである。図13Bは、相対的BODIPY-澱粉加水分解特性と電荷の関係を表わすグラフである。実施例13参照。
【図14】図14Aは、振蕩チューブ中での相対的発現特性と電荷の関係を表わすグラフである。図14Bは、小見本片で評価した相対的洗浄活性と電荷の関係を表わすグラフである。実施例13参照。
【図15】LAUNDER-O-METERを用い活性タンパク質0.01ppm、85℃で30分間の試験条件で評価したときの、S242Q変異体のデサイジング性能に及ぼすCa2+の添加効果の影響を、Ethyl及びXtraと比較して表わす図である。デサイジングはCaCl2濃度0または5 ppmで行った。実施例14参照。
【図16】LAUNDER-O-METERを用い活性タンパク質0.01ppm、97℃で30分間の試験条件で評価したときの、S242Q変異体のデサイジング性能に及ぼすCa2+の添加効果の影響を、Ethyl及びXtraと比較して表わす図である。デサイジングはCaCl2濃度0または5 ppmで行った。実施例14参照。
【発明を実施するための形態】
【0031】
<1.定義と略号>
本願では以下の略号と定義を用いる。本願で用いる「1つの」及び「この」等の単数形には、特に断りのない限り複数形も含まれる。
従って、例えば「1のポリペプチド」と言うときは複数の同様のポリペプチドも含まれ、「その処方」と言うときは当業者に公知の同等の処方を含め、1以上の処方が含まれる。
【0032】
特に断りのない限り、本願では全ての科学及び技術用語は当業者が理解している通常の意味で用いられる。本願では以下の用語を用いる。
【0033】
<1.1. 略号>
特に断りの無い限り、以下の略号を用いる。
AATCC; 米国繊維化学者・色彩技術者協会(American Association of Textile Chemists and Colorists)
ADW; 自動食器洗浄機
AE; アルコールエトキシレート
AEO; アルコールエトキシレート
AEOS; アルコールエトキシ硫酸塩
AES; アルコールエトキシ硫酸塩
AFAU; 酸性菌類アルファ−アミラーゼ単位
AGU; グルコアミラーゼ活性単位
AOS; α−オレフィンスルホン酸塩
AS; アルキル硫酸塩
BAA; 細菌性アルファ−アミラーゼ
℃; 摂氏
CCL; 組み合わせ電荷ライブラリー
cDNA; 相補DNA
CMC; カルボキシメチルセルロース
dE; CIE-LAB色空間による全色差
dH2O; 脱イオン水
dIH2O; 脱イオン水、Milli-Q濾過水
DE; デキストロース当量 (Dextrose Equivalent)
DNA; デオキシリボ核酸
dNTP; デオキシリボ核酸三リン酸塩
DO; 溶解酸素
DP3; 3個のサブユニットの重合度
DPn; n個のサブユニットの重合度
DS;(またはds); 乾燥固形成分
DSC; 示差走査熱量測定
DTMPA; ジエチルトリアミンペンタ酢酸
EC; 酵素委員会 (enzyme commission for enzyme classification)
EDTA; エチレンジアミンテトラ酢酸
EDTMPA; エチレンジアミンテトラメチレンホスホン酸
EO; エチレンオキサイド
eq; 当量
ETOH; エタノール
F&HC; 衣類・日用品ケア剤 (fabric and household care)
FTU; 「フィターゼ」単位、フィチン酸塩加水分解単位
g (またはgm); グラム
GAU; グルコアミラーゼ単位
gpg; グレイン/ガロン (grains per gallon)
g/l; グラム/リットル
Genencor; Danisco US Inc社, Genencor Division, Palo Alto, CA
H2O; 水
HDG; ヘビーデューティ顆粒洗剤
HDL; ヘビーデューティ液体洗剤
HFCS; 高フラクトースコーンシロップ
HFSS; 高フラクトース澱粉ベースシロップ
HPAEC-PAD; アンペロメトリック検出器付高性能アニオン交換クロマトグラフィー
hr; 時間
IKA; IKA Works Inc.社 2635 North Chase Parkway SE, Wilmington, NC
IPTG; イソプロピルβ-D-チオガラクトシド
JPN; 日本
kg; キログラム
LA; ルリア寒天 (Luria Agar)
LAS; 直鎖アルキルベンゼンスルホン酸
LB; ルリア培地 (Luria Broth)
LU; リパーゼ単位
M; モル
MBD培地; MOPSベース既知組成培地
MES; 2-(N-モルフォリノ)エタンスルホン酸
mg; ミリグラム
min; 分
mL (またはml); ミリリトル
mm; ミリメートル
mM; ミリモル
MOPS; 3-(N-モルフォリノ)-プロパンスルホン酸
MW; 分子量
NA; 北米
Ncm; ニュートンセンチメートル
NEO; ネオマイシン
ng; ナノグラム
nm; ナノメータ
NOBS; ノナノニルオキシベンゼンスルホネート
N; 規定 (Normal)
NTA; ニトリロトリ酢酸
PAHBAH; p-ヒドロキシ安息香酸ヒドラジン
PCR; ポリメラーゼ連鎖反応
PEG; ポリエチレングリコール
pi; 等電点
ppm; 百万分の一
PVA; ポリビニルアルコール
PVP; ポリビニルピロリドン
RAU; 参照アミラーゼ単位
RMS; 二乗平均平方根
RNA; リボ核酸
rpm; 毎分回転数
SAPU; 分光光度分析酸性プロテアーゼ単位
SAS; 二級アルカンスルホネート
IX SSC; 0.15M NaCl, 0.015Mクエン酸ナトリウム, pH 7.
sec; 秒
%SRI; パーセント汚染除去指数
SSF; 同時糖化発酵
TAED; テトラアセチルエチレンジアミン
Tm; タンパク質の融点またはDSC測定カーブの熱中央値
TNBS; トリニトロベンゼンスルホン酸
μg; マイクログラム
μl, (μL); マイクロリットル
μNm; マイクロニュートンメートル
μm; マイクロメートル
μM; マイクロモル
U; 単位
V/V; 容積/容積
WE; 西ヨーロッパ
wt%; 重量パーセント
w/v (またはW/V); 質量/体積 (weight/volume)
w/w (またはW/w); 質量/質量 (weight/weight)
wt; 野生型
【0034】
<1.2. 定義>
幾つかの側面では、本発明は遺伝子工学及び分子生物学の分野において日常的に用いられている技術を用いる。以下の文献に、本願で用いる方法が記載されている。
Sambrook et al, MOLECULAR CLONING: A LABORATORY MANUAL (2nd Ed., 1989); Kreigler, GENE TRANSFER AND EXPRESSION; A LABORATORY MANUAL (1990) and Ausubel et al, Eds. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (1994)。
【0035】
特に断りのない限り、本明細書で用いる全ての技術的及び化学的言語は、本出願に関係する技術分野において当業者に通常理解されているものと同じ意味を有する。例えば、Singleton, et al, DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994) 及び THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991)は、本発明の技術分野の当業者が用いる、あるいは本願において多く用いられている用語の一般的な辞書である。本明細書で述べられているのと同じか、あるいは類似の種々の方法及び物質を本発明の実施に用いることができる。本明細書中では特定の好ましい方法及び物質にのみ言及する。
【0036】
「単離された」とは、例えば化合物や配列等の単離された物質が、人の手によって天然の化合物や配列等に対し改変されていることを意味する。例えば、単離された配列には、天然の配列に本来含まれる成分の少なくとも1が存在しないか、または実質的に存在しない。
【0037】
材料または物質について「精製された」というときは、その材料または物質が相対的に純粋な状態にあることを意味し、例えば純度が少なくとも約90%、約95%、約98%、または少なくとも約99%であることをいう。
【0038】
本願では、「澱粉」とは化学式(C6H10O5)X (Xは任意の数)で表わされ、アミロースおよび/またはアミロペクチンから成る複合多糖から成る炭水化物化合物を意味する。
好ましくは、澱粉とは植物中に存在する天然の炭化水素を意味し、植物の非限定的例示として穀物、草、塊茎、根茎が挙げられ、より詳しくは、小麦、大麦、トウモロコシ、ライ麦、米、ソルガム、キャッサバ、キビ、ジャガイモ、サツマイモ、及びタピオカに由来する。
また、澱粉というときは、酵素評価用の検出可能な基質として化学修飾された澱粉、あるいは使用時の性質を改良するために化学的または酵素的に修飾された澱粉等の、合成澱粉または修飾された澱粉も意味する。
【0039】
本願では、「フィチン酸」(またはイノシトールヘキサキスホスフェート(IP6))とは、例えば糠や種子等の、大部分の植物組織におけるリンの主要な貯蔵形態を意味する。また本願では、特にフィチン酸が塩の形態である場合、フィチン酸を「フィチン酸塩」と呼ぶことがある。また、イノシトールペンタホスフェート(IP5)、イノシトールテトラホスフェート(IP4)、及びイノシトールトリホスフェート(IP3)等の種々のイノシトールホスフェートをフィチン酸塩と呼ぶことがある。一般に、ヒト及び大部分の単胃動物はフィチン酸塩を消化することができない。
【0040】
本願では、フィチン酸塩を分解する酵素を「フィターゼ(phytases)」または「フィターゼ(fytases)」と呼ぶ。このような酵素は、ミオ(myo)・イノシトール・ヘキサキスホスフェート・ホスホヒドロラーゼ(phosphohydrolase)である。
フィターゼの活性はフィターゼ単位(FTUまたはU)として定義され、1 FTUは、pH 5.5、37℃の0.0015 mol/lフィチン酸ナトリウム塩から、無機リンを1分間に1マイクロモル放出させることができる酵素の量と定義される。この定義はフィターゼの定量に有用であり、活性測定のシンプルな基準である。
イーストのフィチン酸塩分解酵素 (例えばシュワニオミセス・オクシデンタリス(Schwanniomyces occidentalis)、ピチア・アノマラ(Pichia anomala)、アークスラ・アデニニボラン(Arxula adeninivorans))、グラム陰性菌のフィチン酸塩分解酵素 (例えば大腸菌、シュードモナス(Pseudomonas)種、クレブシエラ(Klebsiella)種)、グラム陽性菌のフィチン酸塩分解酵素 (例えばバスラス種)が同定され分析されている。多くの植物由来のフィターゼ、及びペニシリウム(Penicillium)種、アスペルギルス(Aspergillus) 種、トリコデルマ( Trichoderma) 種、ムコール・ピリホルミス(Mucor piriformis)、クラドスポリウム(Cladosporium)種等の糸状菌由来のフィターゼも知られている。加水分解の開始部位に応じて、3-フィターゼ(EC 3.1.3.8)と6-フィターゼ(EC 3.1.3.26)に分類される。また、フィターゼは「最適」pHに基づき「酸性」(最適pH約5)及び「アルカリ性」(最適pH約9) に分類されている。ROVABIO (Genencor International社) 等の多種類のフィターゼが市販されている。
【0041】
「アミラーゼ」とは、澱粉基質の開裂を触媒して澱粉を分解または一部分解することができる酵素を意味する。アミラーゼはヒドロラーゼの一種であり、澱粉中のグリコシド結合を開裂させる。本願のアミラーゼには、グルコアミラーゼ、アルファ−アミラーゼ、β-アミラーゼが含まれ、例えばバシラス種、特にB. リケニホルミス(licheniformis)の野生型アルファ−アミラーゼが含まれる。
一般に、アルファ-アミラーゼ(EC 3.2.1.1; (α-D-(1→4)-グルカングルカノヒドロラーゼ)は、澱粉中のα-D-(l→4) O-グリコサイド結合をランダムに切断するエンド型酵素と定義される。
これに対し、β-アミラーゼ(EC3.2.1.2; α-D-(l→4)-グルカンマルトヒドロラーゼ)や、マルトゲン性α-アミラーゼ(EC 3.2.1.133)のようないくつかの生成物特異的アミラーゼ等のエクソ型澱粉分解酵素は、基質の非還元末端から澱粉分子を切断する。β-アミラーゼ、α-グルコシダーゼ(EC 3.2.1.20; α-D-グルコシドグルコヒドロラーゼ)、グルコアミラーゼ(EC 3.2.1.3; α-D-(l→4)-グルカングルコヒドロラーゼ)、及び生成物特異的アミラーゼは、澱粉から特定の鎖長のマルトオリゴ糖を産出することができる。
本願では、バスラス・ステアロサーモフィリス由来の野生型アルファ−アミラーゼ、または「AmyS」アミラーゼをXTRA またはSPEZYME XTRAと呼ぶことがある。XTRAとSPEZYME XTRAはGenencor International社から入手可能な市販のAmySである。
【0042】
本願で言う「AmyS様アルファ−アミラーゼ」は、親アミラーゼとして有用である。AmyS様アルファ−アミラーゼは、本願に言うアルファ−アミラーゼとの相同性があることから、アルファ−アミラーゼの一種であると言える。本願では「AmyS様アルファ−アミラーゼ」とはアルファ−アミラーゼの一種を意味し、特にバシラス由来アルファ−アミラーゼを意味し、特にゲオバシラス・ステアロサーモフィリス由来アルファ−アミラーゼを意味する。
ゲオバシラス・ステアロサーモフィリス由来アルファ−アミラーゼは、アミノ酸レベルでは、本願のSEQ ID NO:2に示すアミノ酸配列を有するアルファ−アミラーゼと実質的に同一である。Spezyme XtraはDanisco US Inc社, Genencor Divisionから市販されている。ゲオバシラス・ステアロサーモフィリスは、文献ではバシラス・ステアロサーモフィリスと記載されている場合があり、本願では両者を同義で用いる。
本願にSEQ ID NO:1, 6, 7, 8, 9, 10, 11, 12, 15 及び16として示すアミノ酸配列のいずれかを有するアルファ−アミラーゼは全てAmyS様アルファ−アミラーゼであると言え、従って親アルファ−アミラーゼに適している。
【0043】
また、AmyS様アルファ−アミラーゼには、
i) SEQ ID NO: 1, 6, 7, 8, 9, 10, 11, 12, 15 及び16に示すアミノ酸配列の少なくともいずれか1に対し、相同性(同一性)を少なくとも約60%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%有するアルファ−アミラーゼ、および/または
ii) 上記の特異的アルファ−アミラーゼのいずれかをコードするDNA配列とハイブリダイズされたDNA配列でコードされたアルファ−アミラーゼ、または 本願のSEQ ID NO: 1, 6, 7, 8, 9, 10, 11, 12, 15 及び16に示すアミノ酸配列をコードするWO 06/002643のSEQ ID NO: 9 (BAN), 5 (BSG), 3 (SP722), 1 (SP690), 7 (LAT), 11 (AA560)に示されたDNA配列、または本願の明細書から明らかなDNA配列でコードされたアルファ−アミラーゼが含まれる。
【0044】
また別のAmyS様アルファ−アミラーゼとして有用な相同アルファ−アミラーゼ、すなわち本願の変異体の産出の親酵素として有用な相同アルファ−アミラーゼには、EP 0252666. (ATCC 27811)に開示されたB. リケニホルミス株から産出されたアルファ−アミラーゼ、及びWO 91/00353とWO 94/18314に開示されたアルファ−アミラーゼが含まれる。
市販のAmyS様アルファ−アミラーゼは、次の商品名で販売されている商品に含まれている。SpezymeTM AA 及び ULTRAPHLOW (Danisco US Inc社, Genencor Divisionから入手可能)、及びKeistase TM (Daiwa社から入手可能) 、及びLIQUEZYME SC (Novozymes社, Denmarkから入手可能)。
後述のセクション1.5で、AmyS様アルファ−アミラーゼについてさらに説明する。後述するTable Aに有用なAmyS様アルファ−アミラーゼのリストと、アミノ酸配列同士を比較する有用な方法を示す。
当業者であれば、本願の酵素としての使用可能性を判断するために、他のアルファ−アミラーゼについて同様の表を作成できることを理解できよう。
【0045】
「分光光度分析酸性プロテアーゼ単位 (SAPU)」とはプロテアーゼ酵素の活性を表わす単位を意味する。ここで、1 SAPUとは、アッセイ条件下でカゼイン基質から1分間に1マイクロモルのチロシンを放出させるプロテアーゼ酵素活性量である。
【0046】
「グリコアミラーゼ単位(GAU)」は澱粉分解活性の指標であり、pH 4.2で60℃の溶解性澱粉基質から1時間当り1gの還元糖(グルコースとして計算)を産出する酵素活性量と定義される。
【0047】
本願では「変異体」と「突然変異」とを同義で用いることがある。「変異体」は、ポリペプチドまたは核酸について用いる。変異体には、参照配列に対して1以上の位置における置換、挿入、欠失、切断、および/またはトランスバージョン逆位が含まれる。
核酸変異体には、本願に開示するヌクレオチド配列にハイブリダイズ可能な相補的な配列が含まれる。例えば、本願の変異体核酸配列は、ストリンジェントな条件下(例えば 50℃で0.2X SSC { IX SSC = 0.15 M NaCl, 0.015 Mクエン酸ナトリウム、pH 7.0})で本願に開示するヌクレオチド配列とハイブリッド形成可能な配列と少なくとも一部相補的であってもよい。好ましくは、変異体には、高度にストリンジェントな条件下(例えば 65℃で0.1X SSC)で、本願に開示するヌクレオチド配列とハイブリッド形成可能な配列に相補的な配列が含まれる。
【0048】
酵素について「熱安定性」と言うときは、その酵素が参照酵素よりも熱安定性であることを意味する。本願では、アルファ−アミラーゼ変異体と野生型B. リケニホルミスアルファ−アミラーゼを、例えば同一温度及び同一基質濃度等の同じ条件下に特定の時間置いた後、アルファ−アミラーゼ変異体の方が相対的に高酵素活性を示すとき、アルファ−アミラーゼ変異体は野生型B. リケニホルミスアルファ−アミラーゼよりも熱安定性であるとする。
または、熱安定性が高い酵素は、示差走査熱量測定を用いて参照酵素と比較したとき、より高い熱容量を示す。
【0049】
ポリペプチドの「融点(Tm)」とは、そのポリペプチドが、測定可能な温度依存性の変化を生じるようなコンフォメーション変化を生じる温度である。タンパク質のコンフォメーションとTmは、例えばタンパク質の折り畳み構造を研究するための一般的かつ基本的な方法である円偏光二色性により分析することができる。円偏光二色性では、円偏光の吸光を測定する。タンパク質の場合、アルファヘリックスやベータシート等のの構造はキラルであり、円偏光を吸収する。光吸収によりタンパク質の折り畳みの程度に関する測定を行うことができる。温度または変成剤濃度に対する光吸収の変化から、そのタンパク質の平衡アンフォールディングを測定することができる。このような分光学的分析と、タンパク質のフォールディング/アンフォールディングのキネティックを分析するストップフローミキサー (stopped flow mixer)とを込み合わせることもできる。
【0050】
「カルシウム依存性」とは、特定の酵素が、その酵素活性を実質的に示すためにカルシウムを必要とすることを意味する。本願で言う「カルシウム依存性」には、ある酵素がその酵素活性を示すために二価金属を必須とする性質が含まれ、さらに、その酵素の活性がカルシウムまたは他の二価金属の存在により実質的に (例えば20%以上)増加する性質が含まれる。
【0051】
酵素についての「pH安定性」という用語は、酵素活性、またはその酵素のタンパク質コンフォメーションに関して用いる。
酵素活性に関しては、「pH安定性」とは酵素が特定のpH、または特定のpH範囲において触媒活性を保持していることを意味する。
タンパク質コンフォメーションに関しては、あるpHにおいてタンパク質が不可逆的に変成されていないとき、その酵素は安定であると見なす。このような場合、その酵素が触媒活性を示すことができるpHに戻されたとき、再び触媒として作用する。
pH安定性という用語を、例えば参照酵素と対比する等、相対比較の意味で用いることもある。
本願のアルファ−アミラーゼ変異体の方が野生型B. リケニホルミスアルファ−アミラーゼよりも高活性である場合、例えば両者を所与のpH、またはpHを含め同一条件で比較したとき、本願のアルファ−アミラーゼ変異体の方が野生型B. リケニホルミスアルファ−アミラーゼよりもpH安定性が高い。
一般に、問題となるpH値はその酵素を実際に使用するときのpH値、またはその酵素が本来有する酵素活性を保持可能なpHの限界値またはその近傍のpH値である。
【0052】
「pH範囲」とはpHの範囲、例えば酸性側から塩基性側の範囲、またはこの逆の範囲を意味する。酵素活性に関しては、pH範囲は酵素が特定のレベルの活性、例えば最小活性、特定のパーセンテージの最大活性、または特定レベルの基質転換率または産物生成率を示すpHの上限値と下限値を意味する。
【0053】
細胞、核酸、タンパク質またはベクターについて「組み換え体」というときは、その細胞、核酸、タンパク質またはベクターに、非相同配列、または改変された天然配列が導入された結果物、または導入されたことを意味する。あるいは、その細胞が、そのように修飾または改変された細胞に由来することを意味する。従って、例えば組み換え体細胞は天然(非組み換え体)細胞には見られない遺伝子を発現するか、天然遺伝子を異なる態様(例えば過剰に発現するか、十分発現しない)で発現するか、異常に発現するか、または全く発現しない。
【0054】
「ヌクレオチド配列」または「核酸配列」とは、2以上のヌクレオチド、リボヌクレオチド等の配列、またはこれらの誘導体を意味する。ヌクレオチド配列にはオリゴヌクレオチド配列とポリヌクレオチド配列が含まれ、さらにこれらの変異体、相同体、断片、及び誘導体が含まれる。ヌクレオチド配列は一本鎖、二本鎖、または多重鎖である。ヌクレオチド配列は、例えばゲノム由来、合成由来、または組み換え体由来等、いかなる起源でもよく、ゲノムDNA、cDNA合成DNA、及びRNA等や、これらがハイブリッド形成されたものがヌクレオチド配列に含まれる。ヌクレオチド配列には1以上のコドンが含まれ、1以上のポリペプチドをコードする。ヌクレオチド配列は優先的に1以上のエネルギー的に最適な三次元構造をとる。
【0055】
「ベクター」とはin vitroの実験で有用なヌクレオチド配列を意味し、あるいは、1以上の細胞型へ核酸を導入するとき有用なヌクレオチド配列を意味する。ベクターには、クローン化ベクター、in vivo またはin vitroでの発現ベクター、シャトルベクター、プラスミド、ファージミド、コスミド、ファージ粒子、カセット等が含まれる。
【0056】
「発現ベクター」とは、適切な宿主中でDNAを発現可能な適切な制御配列に動作可能に結合したDNA配列を含むDNA構築体を意味する。このような制御配列には転写を開始するプロモータ、転写を制御する任意のオペレータ配列、mRNAに適切なリボソーム結合部位をコードする配列、転写と翻訳の終了を制御するエンハンサー及び配列が含まれる。
【0057】
他の配列に対し指定されたパーセント(例えば、少なくとも約80%, 85%, 90%, 95%, または99%)の配列同一性を有するポリヌクレオチドまたはポリペプチドとは、アライメントさせたとき、2つの配列の比較において一致するアミノ酸または塩基のパーセンテージを意味する。
このアライメント及び相同性または同一性パーセントは、例えばCURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel et al. (eds) 1987, Supplement 30, section 7.7.18) に記載されているような、公知のソフトウエアプログラムを用いて評価することができる。このようなプログラムにはGCG Pileupプログラム、FASTA (Pearson et al. (1988) Proc. Natl, Acad. Sci USA 85: 2444- 2448)、及びBLAST (BLAST Manual, Altschul et al. , Natl Cent. Biotechnol. Inf., Natl Lib. Med. (NCIB NLM NIH), Bethesda, Md., and Altschul et al, (1997) NAR 25:3389- 3402)が含まれている。また別のアライメントプログラムは、初期パラメータを用いるALIGN Plus (Scientific and Educational Software, PA)である。また別の有用な配列解析プログラムはSequence Software Package Version 6.0 (Genetics Computer Group, University of Wisconsin, Madison, WI)に含まれているTFASTA Data Searching Programである。
【0058】
当業者であれば、本願に含まれる配列は、例示したamyS配列とストリンジェントなハイブリッド形成条件下でハイブリダイズする能力によっても定義できることを理解できるであろう。(例えばWO 06/002643のSEQ ID NO:5参照)
核酸は一本鎖の形態のとき他の核酸配列とハイブリダイズすることができ、適切な温度及び溶液イオン強度の条件化で他の核酸配列とアニールすることができる。ハイブリッド形成条件及び洗浄条件は公知である。(例えば上記のSambrook (1989), 特に第9章及び11章参照) いくつかの実施形態では、ストリンジェントな条件は、Tm65℃, 0.1×SSC, 0.1% SDSである。
【0059】
「遺伝子」とは、ポリペプチドの産出に関与するDNAセグメントを意味し、コード領域の上流側及び下流側の領域と、各コードセグメント(エクソン)間の中間配列(イントロン)とを含む。
【0060】
ポリヌクレオチドまたはタンパク質について「非相同」というときは、天然の宿主細胞では生じないポリヌクレオチドまたはタンパク質を意味する。いくつかの実施形態では、タンパク質は商業的に重要なタンパク質である。非相同という用語には、天然遺伝子、突然変異遺伝子、または合成遺伝子でコードされたタンパク質が含まれる。
【0061】
ポリヌクレオチドまたはタンパク質について「内因性」というときは、天然宿主細胞で産出されるポリヌクレオチドまたはタンパク質を意味する。
【0062】
細胞について「形質転換された」、「安定に形質転換された」及び「遺伝子組み換えの」というときは、その細胞に少なくとも1の非天然(非相同)核酸配列が含まれていることを意味する。安定に形質転換された細胞には、この細胞のゲノム、または多世代にわたり保存されるエピソームプラスミドに組み込まれた、少なくとも1のこのような非相同核酸配列が含まれている。
【0063】
「発現」とは、遺伝子の核酸配列に基づいてポリペプチドが産出されるプロセスを意味する。このプロセスには、転写と翻訳の両者が含まれる。
【0064】
「シグナル配列」とは、タンパク質のN-末端に共有結合したアミノ酸配列を意味し、例えば成熟タンパク質の細胞外への分泌等、タンパク質の輸送を促進する。このシグナル配列の定義は機能面に関するものである。細胞外タンパク質の成熟型には、シグナル配列は含まれていない。シグナル配列は、例えば分泌プロセスの間に切断される。
【0065】
本願では「誘導された」という用語には、「に由来する」、「から得られる」、または「から得ることができる」及び「から単離された」等の用語も含まれる。
【0066】
本願では「タンパク質」及び「ポリペプチド」は同義で用いる。本願ではアミノ酸を表す従来の1文字のコード及び3文字のコードを用いる。
【0067】
「プロモータ」とは、遺伝子の転写を開始する際のRNAポリメラーゼの結合に関与する調節配列を意味する。プロモータは、誘導プロモータまたは構成的プロモータである。例えば、本願では誘導プロモータであるトリコデルマ・リーゼイ (Trichoderma reesei)由来のcbhlを用いることができる。
【0068】
「作動可能に結合」とは、各エレメントが物理的に近接した位置には無いが、互いに機能的に関連するように並置されていることを意味する。例えば、プロモータがコード配列を制御する能力を有し、転写を行える条件下、または転写が許可される条件下で実際にプロモータがコード配列の転写を制御しているとき、プロモータはコード配列に対し作動可能に結合していると言う。
【0069】
「選択マーカー」とは、宿主細胞中で発現することができる遺伝子であって、選択マーカー遺伝子を発現させることにより、宿主細胞の選択を容易に行なうことができる遺伝子を意味する。
選択可能マーカーの非限定的例示として、抗生物質(例えばハイグロマイシン、ブレオマイシン、またはクロラムフェニコール)に対する耐性を改変する遺伝子、および/または、例えば唯一の炭水化物を栄養源とする特定の基質上で成長するように宿主細胞に栄養的選択性を賦与する等の、代謝選択性を賦与する遺伝子が挙げられる。
【0070】
細胞中への核酸配列の挿入に関して「導入された」というときは、「トランスフェクション」または「形質転換」または「形質導入」を意味する。また「導入された」というときは、真核性または原核性細胞へ核酸を組み込むことも含まれ、この場合、核酸配列は細胞のゲノム (例えばクロモソーム、プラスミド、プラスチド、ミトコンドリアDNA)に組み込まれ、自律的レプリコンに転換されるか、一時的に発現される(例えばトランスフェクトmRNA)。
【0071】
「宿主」、「宿主株」、または「宿主細胞」とは、発現ベクター、または例えばアルファ−アミラーゼ変異体をコードするポリヌクレオチドを含むDNA構築体の導入に適した細胞を意味する。宿主株は好ましくは細菌の細胞である。好ましい実施形態では、「宿主細胞」とは細胞、および/または、例えばバスラス種等の微生物株の細胞由来のプロトプラストを意味する。
【0072】
「培養」とは微生物細胞の集団を、微生物細胞を成長させることが可能な培地上において適切な条件下で成長させることを意味する。ひとつの実施形態では、培養とは、澱粉粒を含む澱粉基質を発酵させ(通常容器または反応器中で)生物変換により最終製品にすることを意味する。
【0073】
「酵素的転換」とは、酵素の作用により基質を変化させることを意味する。また、この用語は澱粉基質を酵素の作用により変化させることも意味する。
【0074】
本願では、「糖化」とは澱粉からグルコースへの酵素的転換を意味する。
【0075】
「重合度(DP)」とは、あるサッカライド中の無水グルコピラノースユニットの数(n)を意味する。DP1の例は、グルコース及びフラクトース等のモノサッカライドである。DP2の例は、マルトース及びサッカロース等のジサッカライドである。DP>3は重合度が3より大きいポリマーを表わす。当業者であればDEが大きいほど、より高分子性になることを理解できよう。
【0076】
「最終製品」または「所望の最終製品」とは、例えば澱粉基質から酵素により転換された澱粉由来の物質等の、酵素的反応により得られる目的製品を意味する。
【0077】
「残留澱粉」とは、澱粉含有基質を発酵させた後の組成物中に残留している(溶解または非溶解)澱粉を意味する。
【0078】
「比活性度」とは、特定の条件下において、酵素調合液によって製品へ転換された、単位時間当たりの基質のモル数で定義される酵素単位を意味する。比活性度は単位(U)/タンパク質の単位重量で表わされ、通常U/mgタンパク質で表記する。
【0079】
「収量」とは、本願の方法で製造された最終製品または所望の最終製品の量を意味する。いくつかの実施形態では、本願による収量は、公知の方法で製造した場合よりも多い。いくつかの実施形態では、収量は最終製品の容積を意味し、別の実施形態では、収量は最終製品の濃度を意味する。
【0080】
「生物学的に活性」とは、例えば細胞、器官、有機体等の生物学系に有意な効果を及ぼす化合物または配列を意味する。
【0081】
「ATCC」はManassas, VA 20108にあるAmerican Type Culture Collectionを意味する。
【0082】
「NRRL」はPeoria, 111にあるAgricultural Research Service Culture Collection, National Center for Agricultural Utilization Researchを意味する。(以前の名称はUSDA Northern Regional Research Laboratoryであった。)
【0083】
「食物」とは、ヒトを含め動物に栄養を供給する材料、成分または組成物を意味する。
【0084】
本願の英文明細書では、タンパク質とそのタンパク質をコードする遺伝子を記述するとき、慣例により遺伝子をイタリック体で表記する。(例えばamyL (B.リケニホルミスAA)をコードする遺伝子はamyLと表記する。)タンパク質はイタリック体で表記せず、最初の文字を大文字で表記することがある。(例えばamyL遺伝子でコードされたタンパク質は、AmyLまたはamyLと表記する。)特に断りのない限り、核酸は左から右に向かって5'から3'方向に記載し、アミノ酸配列は左から右に向かってアミノ基からカルボキシル基方向に記載に記載する。
【0085】
英文明細書の「comprising」とその同義語は包括的意味で用いる。すなわち、「including」及びその同義語と同じである。数値範囲には上・下限値も含まれる。
【0086】
文中の見出しは本願の実施形態を限定するものではない。
【0087】
本願に開示した方法や原料と類似または同等の任意の方法や原料を本願発明の実施または試験に用いることができる。本願には現時点で好ましいと考えられる方法や原料を記載したが、本願発明は特定の方法、手段、試薬の使用に限定されず、適宜変更することができる。本願で参照する全ての特許及び文献、及びこれらに開示された配列は本願に参照として組み込まれる。
【0088】
<2.命名法>
本願では、アミノ酸残基の命名に従来用いられている1文字及び3文字のコードを用いる。分かり易くするため、アルファ−アミラーゼ変異体の表記には以下に示す命名法を用いる。
元のアミノ酸:位置:置換アミノ酸
【0089】
この命名法によれば、例えば位置242のセリンのアラニンによる置換は次のように表記する:
Ser242Ala または S242A
位置30のアラニンの欠失は次のように表記する:
Ala30* または A30* または ΔA30
リジン等のアミノ酸残基の挿入は次のように表記する:
Ala30AlaLys または A30AK
【0090】
例えばアミノ酸残基30〜33のような、連続するアミノ酸残基の欠失は次のように表記する:
(30-33)* または Δ(A30-N33)
【0091】
あるアルファ−アミラーゼが、他のアルファ−アミラーゼと比較したとき「欠失」を有し、さらに欠失した位置に挿入がある場合は次のように表記する。例えば位置36にアスパラギン酸の挿入がある場合には次のように表記する:
*36Asp または *36D
【0092】
多重突然変異はプラス記号で分離して表記する。すなわち、位置30及び34のアラニンとグルタミン酸をそれぞれアスパラギンとセリンで置換した場合には次のように表記する:
Ala30Asp+Glu34Ser または A30N+E34S
【0093】
所与の位置に1以上のアミノ酸残基が挿入される場合には次のように表記する:
A30N,E あるいは、A30N または A30E
【0094】
さらに、本願に好ましい修飾位置が指定されているが、その位置の修飾内容が指定されていない場合は、その位置に在るアミノ酸残基を任意のアミノ酸残基で置換できることを意味する。従って、例えば位置30のアラニンを修飾することは記載されているが、修飾内容が指定されていない場合は、そのアラニンは欠失されるか、他のアミノ酸、すなわち下記のアミノ酸のいずれかで置換されることを意味する:
R, N, D, A, C, Q, E, G, H, I, L, K, M, F, P, S, T, W, Y, V。
【0095】
さらに、「A30X」は下記の置換のいずれかであることを意味する。
A30R, A30N, A30D, A30C, A30Q, A30E, A30G, A30H, A30I, A30L, A30K, A30M, A30F, A30P, A30S, A30T, A30W, A30Y, or A30 V; または短縮して次のように表記する:
A30R,N,D,C,Q,E,G,H,I,L,K,M,F,P,S,T,W,Y,V.
【0096】
上記の番号付与に用いた親酵素が、置換用として示されたアミノ酸残基を上記の指定位置に既に備えている場合には、次のように表記する:
例えば、野生型にNまたはVが存在する場合、「X30N」または 「X30N,V」
これは、他の対応する親酵素は、位置30において「Asn」または「Val」で置換されることを示す。
【0097】
<3.アミノ酸残基の特性>
[荷電アミノ酸]
Asp, Glu, Arg, Lys, His
[負荷電アミノ酸](負荷電の最も強いものが最初)
Asp, Glu
[正荷電アミノ酸](正荷電の最も強いものが最初)
Arg, Lys, His
[中性アミノ酸]
Gly, Ala, Val, Leu, lie, Phe, Tyr, Trp, Met, Cys, Asn, Gln, Ser, Thr, Pro
[疎水性アミノ酸](疎水性の最も強いものが最後)
Gly, Ala, Val, Pro, Met, Leu, lie, Tyr, Phe, Trp,
[親水性アミノ酸](親水性の最も強いものが最後)
Thr, Ser, Cys, Gln, Asn, Asp, Lys, Arg
【0098】
<4. アルファ−アミラーゼ及びAmyS-様アミラーゼ>
4.1 種々のアルファ−アミラーゼのアミノ酸
バシラス種により産出される多くのアルファ−アミラーゼはアミノ酸レベルでの相同性(同一性)が高く、本願の親酵素として有用である。公知のバシラスアルファ−アミラーゼ相互間の同一性パーセント(アミノ酸配列基準)を下記のTABLE Aに示す。
【表1】

【0099】
当業者であれば、パーセント同一性は文献、公知の方法または本願に開示した方法で求められることを理解できよう。
例えば、B. リケニホルミスのアルファ−アミラーゼ(LAT)(SEQ ID NO: 7)とB. アミロリケファシエンスのアルファ−アミラーゼ(SEQ ID NO: 9)との相同性は約81%であり、G. ステアロサーモフィリスのアルファ−アミラーゼ(BSG) (SEQ ID NO: 1) との相同性は約65%であることが知られている。
さらに、SP690 及び SP722を含む相同アルファ−アミラーゼがWO 95/26397に開示されている。また、Tsukamotoらのバシラス種(SEQ ID NO:6)由来の#707アルファ−アミラーゼ(Tsukamoto et al., Biochemical and Biophysical Research Communications, 151 (1988), pp. 25-31)が知られている。WO 97/00324(KAO Corporation)にKSM AP1378アルファ−アミラーゼが開示されている。
【0100】
4.2 親アルファ−アミラーゼ
上記のAmyS-様アミラーゼを親アルファ−アミラーゼとして用いることができる。好ましい実施形態では、親アルファ−アミラーゼは、例えば上記のSEQ ID NO:1 または2のアミノ酸配列を有するG. ステアロサーモフィリスのアルファ−アミラーゼのように、G. ステアロサーモフィリスから誘導されたものである。
【0101】
4.3 親ハイブリッドアルファ−アミラーゼ
親アルファ−アミラーゼ(すなわちバックボーン・アルファ−アミラーゼ)はハイブリッドアルファ−アミラーゼでもよい。すなわち、少なくとも2のアルファ−アミラーゼから誘導されたアミノ酸配列の組合せから成るアルファ−アミラーゼでもよい。
【0102】
親ハイブリッドアルファ−アミラーゼは、アミノ酸の相同性(同一性)、および/または、DNAハイブリッド形成(上記のとおり)に基づき、上記のAmyS-様アミラーゼの範疇に属するとされるものである。この場合のハイブリッドアルファ−アミラーゼは典型的には、少なくとも1のAmyS-様アミラーゼの一部と、AmyS-様アミラーゼ、または微生物起源(細菌または菌類)、および/または哺乳動物起源の非AmyS-様アミラーゼから選択される1以上の他のアルファ−アミラーゼとから成る。
【0103】
すなわち、親ハイブリッドアルファ−アミラーゼは、少なくとも2のAmyS-様アミラーゼから誘導された複数のアミノ酸配列の一部同士の組合せ、または少なくとも1のAmyS-様アミラーゼ及び少なくとも1の細菌性非AmyS-様アミラーゼから誘導された複数のアミノ酸配列の一部同士の組合せから成る。
または、少なくとも1のAmyS-様アミラーゼ及び少なくとも1の細菌性非AmyS-様アミラーゼから誘導された複数のアミノ酸配列の一部同士の組合せから成る。または、少なくとも1のAmyS-様アミラーゼ及び少なくとも1の菌性非AmyS-様アミラーゼから誘導された複数のアミノ酸配列の一部同士の組合せから成る。アミノ酸配列の一部が誘導されるAmyS-様アミラーゼは、本願の特異的AmyS-様アミラーゼのいずれかである。
【0104】
親アルファ−アミラーゼは、例えばB.リケニホルミス株から誘導されたアルファ−アミラーゼのC-末端部と、G.ステアロサーモフィリス株またはG.ステアロサーモフィリス株(BSG)から誘導されたアルファ−アミラーゼのN-末端部とから成る。
【0105】
5. 相同性(同一性)
相同性とは、2つの配列の間の関係について、例えば1の配列が他の配列から派生したこと、またはその逆であることを示唆する、2つの配列の間の同一性の程度と定義することができる。相同性は目視による比較または計算で求めることができる。より便利な方法は、GCGプログラムパッケージ(上記)に含まれているGAP等の公知のコンピュータプログラムを用いることである。
すなわち、Gap GCG v8を、同一性についての初期スコアリング・マトリックス、及び以下の初期パラメータを設定して用いる:核酸配列、及び配列比較についてそれぞれGAPクリエーション・ペナルティ5.0、及びGAPエクステンション・ペナルティ0.3、タンパク質配列比較についてGAPクリエーション・ペナルティ3.0、及びGAPエクステンション・ペナルティ0.1。GAPでは、アライメントと同一性の計算に、Needlemanと Wunschの方法を用いている。(Needleman and Wunsch, (1970), J. MoI. Biol. 48: 443-453)
【0106】
Spezyme Xtra (SEQ ID NO:2)と他のアルファ−アミラーゼとの構造のアライメントを、他のAmyS-様アルファ−アミラーゼにおける同等/対応する位置の同定に用いることができる。
この構造のアライメントを行う1つの方法は、GCGパッケージに含まれるPile Upプログラムを、初期設定値をGAPクリエーション・ペナルティ3.0、及びGAPエクステンション・ペナルティ0.1に設定して用いることである。アライメントを行う別の方法には、疎水性クラスター分析法(Gaboriaud et al. , FEBS Lett. 224: 149- 155, 1987)や、逆ステッディング法(Huber, T; Torda, AE, Protein Sci. 7(1): 142-149, 1998)等がある。
【0107】
6. ハイブリッド形成
上記のAmyS-様アルファ−アミラーゼの解析に用いるオリゴヌクレオチドプローブは、対象とするアルファ−アミラーゼのヌクレオチドまたはアミノ酸配列の全部または一部に基づいて調製することができる。
【0108】
ハイブリッド形成を評価する好ましい条件には、5X SSCに予浸し、次に、20%ホルムアミド、5X Denhardt溶液、リン酸ナトリウム50mM, pH 6.8、及び超音波で切断した変性仔ウシ胸腺DNA50 mgを含む溶液中で40℃において1時間予備ハイブリッド形成し、次に、100mMのATPを追加した同じ溶液中で40℃において18時間ハイブリッド形成し、次に、フィルターにおいて2X SSC、0.2%SDSを用いて40℃(低ストリンジェント)、好ましくは50℃(中ストリンジェント)、より好ましくは65℃(高ストリンジェント)、さらに好ましくは75℃(より高ストリンジェント)で30分間洗浄する。ハイブリッド形成の詳細はSambrook et al, MOLECULAR CLONING: A LABORATORY MANUAL, 2nd Ed., Cold Spring Harbor, 1989に記載されている。
【0109】
本願では、「から誘導された」というときは、対象とする有機体の株から産出されたか、産出可能なアルファ−アミラーゼを意味するだけでなく、このような株から単離されたDNA配列を用いて形質転換された宿主有機体のDNA配列によりコードされたアルファ−アミラーゼも意味する。
すなわち、「から誘導された」という用語は、合成および/またはcDNA起源のDNA配列でコードされたアルファ−アミラーゼであって、対象とするアルファ−アミラーゼの特性を備えるアルファ−アミラーゼを意味する。
また、この用語は親アルファ−アミラーゼが天然アルファ−アミラーゼの変異体であること、すなわち天然アルファ−アミラーゼの1以上のアミノ酸残基を修飾(挿入、置換、欠失)して得られた変異体であることを意味する。
【0110】
7. アルファ−アミラーゼ変異体中の突然変異
ひとつの実施形態では、本願のアルファ−アミラーゼ変異体は上記の修飾に加え、1以上の修飾を有する。すなわち、修飾されたアルファ−アミラーゼ変異体の一部の1以上のプロリン残基(Pro)が、天然の非プロリン残基のいずれかで置き換えられていることが好ましく、この非プロリン残基はアラニン、グリシン、セリン、スレオニン、バリン、またはロイシンのいずれかであることが好ましい。
【0111】
同様に、ひとつの実施形態では、親アルファ−アミラーゼ中の1以上のシステイン残基がアラニン、グリシン、セリン、スレオニン、バリン、またはロイシンのいずれか等の非システイン残基で置き換えられていることが好ましい。
【0112】
本願には、このような修飾が2以上導入されたアルファ−アミラーゼ変異体が含まれる。
【0113】
さらに、1以上の下記の位置に突然変異を導入することが好ましい(番号はSEQ ID NO:7に従う)。
M15, V128, A111, H133, W138, T149, M197, N188, A209, A210, H405, T412。
特に、以下の一重、二重、三重、または多重突然変異が好ましい。
M15X,特にM15T,L;
V128X,特にV128E;
H133X,特にHl33Y;
N188X,特にN188S,T,P;
M197X,特にM197T,L;
A209X,特にA209V;
M197T/W138F; M197T/138Y; M15T/H133Y/N188S;
M15N128E/H133Y/N188S; E119C/S130C; D124C/R127C; H133Y/T149I;
G475R,H133Y/S187D; H133Y/A209V.
【0114】
SEQ ID No.7のアミノ酸配列を有する親アルファ−アミラーゼの場合、酸化安定性を向上させるために欠失または置換されるアミノ酸配列は単一のシステイン残基(C363)、及びID NO:2における位置M8, M9, M96, M200, M206, M284, M307, M311, M316及びM438にあるメチオニン残基である。
【0115】
アルファ−アミラーゼ変異体の熱安定性を親アルファ−アミラーゼよりも向上させる場合、SEQ ID NO:2に示すアミノ酸配列中の次のアミノ酸残基の1、好ましくは2、または3を欠失させることが好ましい:F178, R179, G180, I181, G182 及びK183。
【0116】
このようなタイプの欠失において、特に好ましいペアワイズ欠失はR179*+G180*; 及び I181*+G182* である(それぞれSEQ ID No.16、15参照)(または、本願の親アルファ−アミラーゼに対する要件を満たす他のアルファ−アミラーゼにおける、これらと同等のペアワイズ欠失)。
【0117】
EQ ID No.2に示すアミノ酸配列における他の修飾対象となる残基には、N193F 及び V416Gが含まれる。
【0118】
8. アルファ−アミラーゼ変異体の改変された性質
8.1 概論
以下に、本願の変異体中の突然変異と、この突然変異により生じる所望の改変された性質(親AmyS-様アルファ−アミラーゼに対し改変された性質)との関係を説明する。
【0119】
本願に、改変された性質を有するAmyS-様アルファ−アミラーゼを開示する。本願が対象とする親アルファ−アミラーゼは、AmyS-様アルファ−アミラーゼ及び親ハイブリッドAmyS-様アルファ−アミラーゼである。
【0120】
ひとつの実施形態では、ゲオバシラス・ステアロサーモフィリスのアルファ−アミラーゼ(SEQ ID NO:2)、すなわち親アミラーゼから出発する。しかし、別の実施形態ではSP722, BLA, BAN, AA560, SP690, KSM AP1378, #707または他のバシラスアルファ−アミラーゼを用いることができる。SEQ ID NO:2における位置に相当するアミノ酸位置は、本願の開示内容に従って容易に決めることができる。
【0121】
当業者であれば、特定の変異体中の修飾された、または修飾されるアミノ酸残基の位置番号/特定するための参照として、任意の親アルファ−アミラーゼを用いることができることを理解できるであろう。しかし、SEQ ID NO:1に示す配列が現時点で分かっている最も長いB.ステアロサーモフィリスの配列であることから、現時点ではSEQ ID NO:1がこの目的に適した配列である。
ひとつの側面では、本願は上記のような改変された性質を有するアルファ−アミラーゼ変異体に関する。
【0122】
いくつかの側面の中のひとつでは、本願により親G.ステアロサーモフィリスアルファ−アミラーゼの変異体が提供され、この変異体は下記の群から選択される1以上の位置(例えばSEQ ID NO:1の位置番号を用いる)が変更されている:P17, D19, T21, N28, S51, G72, V74, A82, Q86, Q89, A93, G95, Q97, W115, D117, P123, S124, D125, N127, I130, G132, Q135, P145, G146, G148, S153, Y159, W166, S169, K171, W187, P209, N224, S242, G256, D269, N271, T278, N281, G302, A304, R308, T321, Q358, P378, S382, K383, T398, H405, T417, E418, P420, G421, P432, W437, G446, G454, S457, T459, T461, S464, G474, R483;
ここで、
(a) 変更点はそれぞれ独立して(i)その位置を占めるアミノ酸の下流側へのアミノ酸の挿入、(ii)その位置を占めるアミノ酸の欠失、または(iii)その位置を占めるアミノ酸の別のアミノ酸による置換であり、
(b) その変異体はアルファ−アミラーゼ活性を有し、
(c) 各アミノ酸位置が、例えばGenencor社から商品名SPEZYME XTRAとして販売されている切断されたアルファ−アミラーゼ等の、SEQ ID NO:2に示すアミノ酸配列を有するG.ステアロサーモフィリス等の親アミラーゼのアミノ酸配列の位置に相当する。
【0123】
本願では特に S242A, S242Q, S242N 及び S242E変異体が好ましい。
【0124】
また、Rl79, Gl80, I181, Gl82, 及び K183残基をカルシウム−ナトリウム結合領域における突然変異の効果を検討するために選択し、またアルファ−へリックスの中央に位置するプロリンは独特であることからP245を選択した。
【0125】
他の親AmyS-様アルファ−アミラーゼにおいて対応する位置は、例えば図4に示したアライメントの配列等の、上記に記載したアライメントにより理解することができる。すなわち、本願には上記の番号の位置(例えばSEQ ID NO:1を比較用アミノ酸位置番号とする)の1以上が変更された親AmyS-様アルファ−アミラーゼの変異体を開示する。
【0126】
8.2改変された性質:安定性
本願のアルファ−アミラーゼ変異体において、改変された安定性、特に改良された安定性(すなわち増加または減少)を得る上で重要な突然変異(アミノ酸置換および欠損を含む)、特に高温度(すなわち約70〜120℃)、および/または厳しいpH(すなわち低pHまたは高pH領域、すなわちそれぞれpH4.0から6.0、pH 8.0から11.0)、特に60 ppm未満のカルシウムフリー濃度(すなわち非結合、従って溶液中)において、改良された安定性を得る上で重要な突然変異には、「改変された性質」に記載された突然変異のいずれかである。安定性は、下記の「測定方法」の項の記載に従って評価することができる。
【0127】
8.3 改変された性質:Ca2+安定性
改変されたCa2+安定性とは、Ca2+が欠乏した条件下での酵素の安定性が改善されることを意味する。すなわち、安定性が親酵素に対し増加または減少することである。本願のアルファ−アミラーゼ変異体では、改変されたCa2+安定性、特に改良されたCa2+安定性、すなわち増加または減少した安定性を、特に高pH領域(すなわちpH8.0から10.5)において得るために重要な突然変異(アミノ酸置換及び欠失を含む)には、「改変された性質」に記載された突然変異のいずれかが含まれる。
【0128】
8.4 改変された性質:比活性度
また別の側面では、特に約10-60℃、好ましくは20-50℃、特に約0-40℃において改変された比活性度、特に増加または減少した比活性度を得る上で重要な突然変異(アミノ酸置換及び欠失を含む)には、「改変された性質」に記載された突然変異のいずれかが含まれる。比活性度は、下記の「測定方法」の項の記載に従って評価することができる。
【0129】
8.5 改変された性質:酸化安定性
本願のアルファ−アミラーゼ変異体は、親アルファ−アミラーゼに対し改変された酸化安定性、特に改善された酸化安定性を有することができる。増加された酸化安定性は、例えば洗剤組成物において有用であり、減少された酸化安定性は、例えば澱粉液化用の組成物において有用である。酸化安定性は、下記の「測定方法」の項の記載に従って評価することができる。
【0130】
8.6 改変された性質:pH特性
改変されたpH特性、特に高pH(すなわちpH 8〜10.5)または低pH(すなわちpH 4〜6)における改善された活性を得るために重要なアミノ酸位置及び突然変異には、活性部位残基の近傍のアミノ酸残基の突然変異が含まれる。
好ましい特定の突然変異/置換には、上記の「改変された性質」に記載された対象とする位置に関する突然変異/置換が含まれる。改変されたpH特性はの評価方法は、下記の「測定方法」の項に記載されている。
【0131】
8.7 改変された性質:洗浄性能
改変された洗浄性能、特に高pH(すなわちpH 8.5〜11)における洗浄性能を得るために重要なアミノ酸位置及び突然変異には、上記の「改変された性質」に記載された対象とする位置に関する突然変異/置換が含まれる。
洗浄性能は、下記の「測定方法」の項の記載に従って評価することができる。
【0132】
9. アルファ−アミラーゼ変異体を調製する方法
遺伝子に突然変異を導入する方法は、アルファ−アミラーゼをコードするDNA配列をクローン化する方法として知られている。このような方法には、以下説明する、アルファ−アミラーゼをコードする配列中の特定の部位に突然変異を誘発させる方法が含まれる。
【0133】
9.1 アルファ−アミラーゼをコードするDNA配列のクローン化
親アルファ−アミラーゼをコードするDNA配列は、公知の種々の方法により、対象とするアルファ−アミラーゼを産出する細胞または微生物から分離することができる。
まず、対象とするアルファ−アミラーゼを産出する有機体由来の染色体DNAまたはメッセンジャーRNAを用いて、ゲノムDNAおよび/またはcDNAライブラリーを構築する。α−アミラーゼのアミノ酸配列が分かっている場合、相同の標識オリゴヌクレオチドプローブを合成し、これを用いて対象とする有機体から調製したゲノムライブラリーに由来するアルファ−アミラーゼをコードするクローンを特定する。
または、アミノ酸配列が分かっているα−アミラーゼ遺伝子に相同の配列を含む標識されたオリゴヌクレオチドをプローブとして用い、例えば低ストリンジェント条件のハイブリッド形成及び洗浄を用いて、アルファ−アミラーゼをコードするするクローンを特定することもできる。
【0134】
α−アミラーゼをコードするクローンを特定する別の方法では、ゲノムDNAの断片をプラスミドなどの発現ベクターに挿入し、得られたゲノムDNAライブラリーでα−アミラーゼ陰性細菌を形質転換し、この形質転換した細菌をα−アミラーゼ用の基質を含む寒天上に塗布し、次にクローンにα−アミラーゼを発現させることによって、α−アミラーゼをコードするクローンを容易に特定することができる。
【0135】
あるいは、酵素をコードするDNA配列を、確立された標準的方法で合成することによって作ることもできる。このような確立された標準的方法の例は、S. L. Beaucage and M. H. Caruthers, Tetrahedron Letters 22: 1859-1869 (1981)に記載されたホスホルアミダイド法、またはMatthes et al. , EMBO J. 3 : 801 -895 ( 1984)に記載された方法等である。
ホスホロアミダイト法では、オリゴヌクレオチドを例えば自動DNA合成機で合成し、次に精製、アニーリング、ライゲーション、および適切なベクター中でクローニングする。
【0136】
最後に、アルファ−アミラーゼをコードするDNA配列は、起源が異なる配列の混合体、例えばゲノム配列及び合成配列の混合体、合成配列及びcDNA配列の混合体、またはゲノム配列及びcDNA配列の混合体であり、好ましくは合成、ゲノム、またはcDNA起源の断片(この断片はDNA配列全体の様々な部分に相当する)を標準的な方法でライゲーションすることによって調製されたDNA配列である。
あるいは、例えば米国特許No. 4,683,202またはR. K. Saiki et al. EMBO J. 3:801-895 (1988) に開示された特定のプライマーを用いたポリメラーゼ連鎖反応(PCR)によってこのようなDNA配列を調製することもできる。
【0137】
9.2 部位特異的変異誘発
アルファ−アミラーゼをコードするDNA配列を単離し、突然変異させる所定の配列を特定した後、合成オリゴヌクレオチドを用いて突然変異を導入する。このようなオリゴヌクレオチドには、所定の突然変異部位に隣接するヌクレオチド配列が含まれている。突然変異ヌクレオチドは、オリゴヌクレオチドを合成しているとき挿入する。
特定の方法では、アルファ−アミラーゼをコードする配列を橋渡しするDNAの一本鎖ギャップが、アルファ−アミラーゼ遺伝子を有するベクター中に作られる。次にこの一本鎖DNAの相同な位置に、所定の突然変異を有する合成ヌクレオチドをアニールする。残りのギャップをDNAポリメラーゼI (Klenow断片)で埋め、得られた構築体をT4リガーゼによってライゲートする。この方法の例は、Morinaga et al. Biotechnology 2:636-639 (1984)に開示されている。
米国特許No. 4,760,025には、多重突然変異をコードするするオリゴヌクレオチドを、カセットの一部を改変して導入することが開示されている。しかしMorinagaの方法によれば、様々な種類と長さのオリゴヌクレオチドを導入することができるので、さらに多様な突然変異を随時導入することができる。
【0138】
Nelson and Long, Analytical Biochem., 180:147-151 (1989) に、アルファ−アミラーゼをコードする配列中に突然変異を導入する別の方法が開示されている。この方法には、PCR反応のプライマーの1つとして化学合成DNA鎖を用いて導入された所望の突然変異を含むPCR断片を生成させる3段階の工程が含まれている。制限エンドヌクレアーゼで切断することによって、生成したPCR断片から突然変異を保有するDNA断片を単離し、発現プラスミド中に再挿入する。
【0139】
当業者であれば、これら以外の様々な方法で本願の変異体を生成または得ることができることを理解できよう。例えばWO 95/22625 (Affymax Technologies N.V.)に開示された遺伝子シャッフリングや、WO 96/00343 (Novo Nordisk A/S)、または対象とする置換や欠失等の突然変異を含むハイブリッド酵素が得られるその他の方法を用いることができる。
【0140】
9.3. アルファ−アミラーゼ変異体の発現
本願に開示する方法、または別の公知の方法で作られ、酵素変異体をコードするDNA配列は、適切なプロモータ、オペレータ、リボソーム結合部位、翻訳開始シグナル、及び、任意にリプレッサー遺伝子、または種々のアクティベータ遺伝子をコードする制御配列を有する発現ベクターを用いて、酵素として発現させることができる。
【0141】
本願で用いるα-アミラーゼ変異体をコードするDNA配列を有する組換え発現ベクターは、DNA組換えに適したベクターであり、ベクターの選択はベクターが導入される宿主細胞に依存する。従って、ベクターは独立して複製するベクター、すなわち、染色体外の構成要素として存在するベクターである。ベクターの複製は染色体の複製から独立している。ベクターは、例えばプラスミド、バクテリオファージ、または染色体外の要素、ミニ染色体、または人工染色体である。
あるいは、ベクターは、宿主細胞のゲノムに組み込まれ、そのベクターが組み込まれた染色体とともに複製される。
【0142】
ベクター中では、DNA配列は、適切なプロモータ配列に作動可能に結合している。プロモータは、選択された宿主細胞中で転写活性を示すDNA配列であり、宿主細胞と相同または非相同の蛋白をコードする遺伝子に由来する。
本願のα-アミラーゼ変異体をコードするDNA配列の転写を行なうために、特に細菌性宿主中で転写を行なうために適するプロモータの例として、大腸菌の乳糖オペロンのプロモータ、スプレプトマイセス・セリカラー・アガラーゼ(Streptomyces coelicolor agarase)遺伝子のdagAのプロモータ、バシラス・リケニホルミス(Bacillus licheniformis)α-アミラーゼ遺伝子(amyL) のプロモータ、ゲオバシラス・ステアロサーモフィルス・マルトース生成性アミラーゼ遺伝子(amyM)のプロモータ、バシラス・アミロリキファシエンス(Bacillus amyloliquefaciens)α-アミラーゼ(amyQ) のプロモータ、バシラス・スブチリスxylA及びxylB遺伝子のプロモータ等が挙げられる。
菌類宿主中での転写において有用なプロモータの例として、A.オリザエ(oryzae)TAKAアミラーゼ、リゾムコール・ミエヘイ(Rhizomucor miehei)アスパラギン酸プロテイナーゼ、A. ニガー(niger)の中性アルファ−アミラーゼ、A. ニガーの酸安定性アルファ−アミラーゼ、A. ニガーグルコアミラーゼ、リゾムコール・ミエヘイリパーゼ、A.オリザエのアルカリ性プロテアーゼ、A.オリザエのオリオースリン酸イソメラーゼ、またはA. ニジュランス(nidulans)のアセトアミダーゼ等をコードする遺伝子由来のものが挙げられる。
【0143】
また本願で有用な発現ベクターには適切な転写ターミネーターが含まれ、真核生物では、アルファ−アミラーゼ変異体をコードするDNAに作動可能に結合したポリアデニル化配列が含まれる。ターミネーター配列及びポリアデニル化配列は、プロモータと同じ供給源から得ることができる。
【0144】
ベクターはさらに、対象とする宿主細胞中でのベクターの複製を可能にするDNA 配列を備える。このような配列の例は、プラスミドpUC19, pACYC177, pUBl10, pE194, pAMBl 及びpIJ702の複製起点である。
また、ベクターは選択マーカーを備える。選択マーカーは、例えばバシラス・スブチリス由来、またはバシラス・リケニホルミス由来のdal遺伝子のように宿主細胞の欠陥の相補体となる遺伝子、または、例えばアンピシリン耐性、カナマイシン耐性、クロラムフェニコール耐性、またはテトラサイクリン耐性等の、抗生物質耐性を賦与する遺伝子である。ベクターはさらに、amdS, argB, niaD 及びsC等のアスペルギルス選択マーカー、ハイグロマイシン耐性を高めるマーカーが含まれる。あるいは例えば、国際公開WO 91/17243に開示されているように、同時形質転換によって選択を行うこともできる。
【0145】
細胞内発現は、例えば宿主にある種の細菌を用いる場合等に有利であるが、一般的には、変異体の発現は細胞外の培地へ行なうことが好ましい。通常、本願のバシラスα-アミラーゼは、発現されたプロテアーゼの培地への分泌を可能にする前領域を備える。所望により、各前領域をコードするDNA配列を置換することにより、この前領域を別の前領域、またはシグナル配列で置き換えることができる。
【0146】
α-アミラーゼ変異体、プロモータ、ターミネーター、その他の要素をそれぞれコードするDNA構築体をライゲートし、複製に必要な情報を有するベクターにこれらを挿入するための方法は公知である(例えばSambrook et al, MOLECULAR CLONING: A LABORATORY MANUAL, 2nd Ed., Cold Spring Harbor, 1989参照)。
【0147】
本願で用いる細胞は、例えば上記のDNA構築体または発現ベクターのいずれかを含み、α-アミラーゼ変異体の組換え産出の宿主細胞として用いられる。この細胞は、宿主の染色体にDNA構築体(1以上のコピー)を組み込むことにより、変異体をコードするDNA構築体によって形質転換される。DNA配列は細胞中でより安定して存在し得るため、このような組み込みは有利であると考えられる。DNA構築体の宿主の染色体への組み込みは、例えば相同または非相同組換え等の公知の方法で行なうことができる。あるいは、宿主細胞を、上記の異なる種類の宿主細胞に関して説明したように、発現ベクターで形質転換することもできる。
【0148】
本願で用いる細胞は、哺乳類や昆虫等の高等な有機体の細胞でもよいが、好ましくは例えば細菌や菌類(イーストを含む)等の微生物の細胞である。
【0149】
好ましい細菌の例はグラム陽性細菌であり、例えばバシラス・スブチリス、バシラス・リケニホルミス、バシラス・レンタス(Bacillus lentus)、バシラス・ブレビス(Bacillus brevis)、ゲオバシラス・ステアロテルモフィラス、バシラス・アルカロフィラス(Bacillus alkalophilus)、バシラス・アミロリケファシンス(Bacillus amyloliquefaciens)、バシラス・コーギュランス(Bacillus coagulans)、バシラス・サーキュランス(Bacillus circulans)、バシラス・ロータス(lautus)、バシラス・メガテリウム(megaterium)、バシラス・チューリンゲンシス(Bacillus thuringiensis)、またはスプレプトマイセス・リビダンス(Streptomyces lividans)、スプレプトマイセス・ムリヌス(Streptomyces murinus)等であり、あるいは、大腸菌等のグラム陰性細菌を用いることもできる。
細菌の形質転換は、例えばプロトプラスト形質転換、または公知の方法でコンピテント細胞を用いて行うことができる
【0150】
発現にイーストを用いる場合、例えばサッカロミセス・セレビシエ (Saccharomyces cerevisiae)等の、サッカロミセス種またはシゾサッカロミセス種から選択したイーストを用いる。糸状菌を用いる場合は、アスペルギルス・オリザエやアスペルギルス・ニガー等のアスペルギルス種から選択する。真菌細胞は、プロトプラストを形成し、プロトプラストを形質転換し、次に公知の方法で細胞壁を再生することにより形質転換される。アスペルギルス宿主細胞の形質転換に適した方法は、例えばEP 238023に開示された方法である。
【0151】
また別の側面では、本願はα-アミラーゼ変異体を産出する方法に関する。この方法では、変異体を産出できる条件下で上記の方法によって宿主細胞を培養し、細胞および/または培地から変異体を回収する。
【0152】
宿主細胞を培養する培地は、宿主細胞の培養に適し、α-アミラーゼ変異体を発現させることができる公知の培地である。好ましい培地は市販されており、公知の処方(例えばATCCのカタログに記載されている)に従って調製することができる。
宿主細胞から分泌されたα-アミラーゼ変異体は、培地から公知の方法により回収することができる。この方法には、細胞を濾過または遠心分離によって培地から分離し、硫酸アンモニウム等の塩で培地中の蛋白性物質を沈殿させ、次にイオン交換や、アフィニティクロマトグラフィー等のクロマトグラフを行なうことが含まれる。
【0153】
9.4 変異体の分析及びスクリーニング方法
9.4.1 フィルタースクリーニング評価
以下の評価方法を用いて、高pHまたは低pH、および/またはCa2+が欠乏した条件下で、親酵素及びAmyS様アルファ−アミラーゼとの比較において改変された安定性を示すAmyS様アルファ−アミラーゼ変異体のスクリーニングを行うことができる。
【0154】
9.4.2 高pHフィルター評価
バシラスのライブラリーをセルロースアセテートフィルター(OE 67, Schleicher & Schuell, Dassel, Germany) のサンドイッチに塗布し、また37℃において少なくとも21時間、10マイクログラム/mlカナマイシンを含むTY寒天プレート上のニトロセルロースフィルター(Protran-Ba 85, Schleicher & Schuell, Dassel, Germany)上に塗布する。セルロースアセテート層をTY寒天プレートの上に位置させる。
【0155】
塗布した後、インキュベートする前に、フィルター上の陽性の変異体の位置を特定できるように、各フィルターサンドイッチに針で印をつけ、変異体が結合したニトロセルロースフィルターをpH 8.6〜10.6のグリシン-NaOH緩衝液が入れられた容器に移し、室温(10〜60℃でもよい)で15分間インキュベートする。
コロニーを有するセルロースアセテートフィルターは、使用するまでの間、室温においてTY-プレート上で保管する。
インキュベートした後の残留活性を、pH 8.6-10.6のグリシン-NaOH緩衝液中で、1%アガロース及び0.2% 澱粉を含むプレート上で評価する。ニトロセルロースフィルターの評価用プレートも、フィルターサンドイッチと同様にして印を付け、室温で2時間インキュベートする。フィルターを除去した後、評価用プレートを10% ルゴール液で染色する。
澱粉を分解する変異体は暗青色中の白点として検出され、次に保管プレート上で特定される。陽性の変異体について、最初のスクリーニングと同じ条件でさらに2回スクリーニングを繰り返す。
【0156】
9.4.3 低カルシウムフィルター評価
バシラスのライブラリーをセルロースアセテートフィルター(OE 67, Schleicher & Schuell, Dassel, Germany) のサンドイッチに塗布し、また37℃において少なくとも21時間、関連性の有る抗菌薬、例えばカナマイシンまたはクロラムフェニコールを含むTY寒天プレート上のニトロセルロースフィルター(Protran-Ba 85, Schleicher & Schuell, Dassel, Germany)上に塗布する。セルロースアセテート層をTY寒天プレートの上に位置させる。
【0157】
塗布した後、インキュベートする前に、フィルター上の陽性の変異体の位置を特定できるように、各フィルターサンドイッチに針で印をつけ、変異体が結合したニトロセルロースフィルターをpH 8.5〜10の炭酸塩/重炭酸塩緩衝液が入れられ、異なるEDTA濃度の (約0.001 mM〜約100 mM)容器に移す。これらのフィルターを室温で1時間インキュベートする。
コロニーを有するセルロースアセテートフィルターは、使用するまでの間、室温においてTY-プレート上で保管する。
インキュベートした後の残留活性を、pH 約8.5〜10の炭酸塩/重炭酸塩緩衝液中で、1%アガロース及び0.2% 澱粉を含むプレート上で評価する。ニトロセルロースフィルターの評価用プレートも、フィルターサンドイッチと同様にして印を付け、室温で約2時間インキュベートする。フィルターを除去した後、評価用プレートを約10% ルゴール液で染色する。
澱粉を分解する変異体は暗青色中の白点として検出され、次に保管プレート上で特定される。陽性の変異体について、最初のスクリーニングと同じ条件でさらに2回スクリーニングを繰り返す。
【0158】
9.4.4 低pHフィルター評価
バシラスのライブラリーをセルロースアセテートフィルター(OE 67, Schleicher & Schuell, Dassel, Germany) のサンドイッチに塗布し、また37℃において少なくとも21時間、10マイクログラム/mlクロラムフェニコールを含むTY寒天プレート上のニトロセルロースフィルター(Protran-Ba 85, Schleicher & Schuell, Dassel, Germany)上に塗布する。セルロースアセテート層をTY寒天プレートの上に位置させる。
【0159】
塗布した後、インキュベートする前に、フィルター上の陽性の変異体の位置を特定できるように、各フィルターサンドイッチに針で印をつけ、変異体が結合したニトロセルロースフィルターをpH 4.5のクエン酸緩衝液が入れられた容器に移し、80℃で20分間インキュベートし(野生型由来の変異体をスクリーニングする場合)、あるいは85℃で60分間インキュベートする(親アルファ−アミラーゼの変異体スクリーニングする場合)。
コロニーを有するセルロースアセテートフィルターは、使用するまでの間、室温においてTY-プレート上で保管する。
インキュベートした後の残留活性を、pH 6.0のクエン酸緩衝液中で、1%アガロース及び0.2% 澱粉を含むプレート上で評価する。ニトロセルロースフィルターの評価用プレートも、フィルターサンドイッチと同様にして印を付け、50℃で2時間インキュベートする。フィルターを除去した後、評価用プレートを10% ルゴール液で染色する。
澱粉を分解する変異体は暗青色中の白点として検出され、次に保管プレート上で特定される。陽性の変異体について、最初のスクリーニングと同じ条件でさらに2回再スクリーニングを繰り返す。
【0160】
9.4.5 二次スクリーニング
再スクリーニング後の陽性形質転換体を保管プレートから採取し、二次プレート評価を行う。
各陽性形質転換体を、5 mL LB+クロラムフェニコールを用いて37℃において22時間培養する。各陽性形質転換体のバシラス培養菌と、比較参照用の対応バックボーン(親アルファ−アミラーゼ)を発現するクローンとを、pH4.5のクエン酸緩衝液を用いて90℃においてインキュベートし、サンプルを0, 10, 20, 30, 40, 60及び80分後に採取する。3μLのサンプルを評価用プレートに植える。評価用プレートを10%ルゴール液で染色する。改良された変異体は、バックボーンよりも高い残留活性(評価用プレート上のハローとして検出される)を示す。改良された変異体を核酸配列の解析により特定する。
【0161】
9.4.6 未精製変異体の安定性評価
変異体の安定性は、以下のようにして評価することができる。
分析対象の変異体発現バシラス培養菌を、クロラムフェニコールを含有する10mLLB中で37℃において21時間培養する。この培地800マイクロリットルと、pH4.5のクエン酸緩衝液200マイクロリットルとを混合する。サンプルを70μLずつに分けて複数のPCRチューブ中に注入し、70℃または90℃において時間を種々変更して(典型的には5, 10, 15, 20, 25 及び 30分間)、PCR装置を用いてインキュベートする。0分のサンプルについては、高温でのインキュベートは行わない。サンプル中の活性は、下記の「アルファ−アミラーゼ活性の評価」で説明するように、20μLから200μLのアルファ−アミラーゼPNP-G7基質 MPR3 (Boehringer Mannheim Cat. No. 1660730) をトランスファーすることにより測定する。
測定結果は、(時間0に対する)活性パーセントを時間に対してプロットして示すか、または、所定時間インキュベートした後の残留活性パーセントで表わす。
【0162】
9.4.7 アルファ−アミラーゼ変異体の発酵と精製
関連する発現プラスミドを含むバシラス・スブチルス株を、以下のようにして発酵させ、精製する。
この株を、-80℃のストック溶液から採取した10μg/mlカナマイシンを含むLB-寒天上に洗浄に塗布し、37℃で一晩培養する。得られたコロニーを、10μg/ml クロラムフェニコールを含む100 mLのPS-1培地を有する500 mL振蕩フラスコ中に移す。
S-1培地の組成は以下の通りである。
パールシュガー: 100 g/l
大豆かす: 40 g/l
Na2HPO4, 12 H2O: 10 g/l
PluronicTM PE 6100: 0.1 g/l
CaCO3: 5 g/l
この培地を37℃、270rpmで5日間振蕩する。
【0163】
4500 rpmで20-25分間遠心分離することにより、発酵培地から細胞及び細胞残渣を除去する。次いで、上清を濾過して完全に透明な溶液を得る。濾液を濃縮しUF-フィルター(10000カットオフ膜)上で洗浄し、緩衝液をpH5.5の20mMアセテートに変更する。
UF-フィルター濾過物をS-SEPHAROSE F.F (Pharmacia社)に流通させ、溶出は0.2M NaClを添加した上記緩衝液を用いた段階溶出により行う。溶出液をpH9.0の10 mM Trisに対し透析し、Q-SEPHAROSE F.F. に流通させ、直線濃度勾配の0〜0.3M NaCl溶液 6カラム容積を用いて溶出させる。
活性(PHADEBASアッセイで測定)を有する分画を貯留し、pH 7.5に調整し、残留する色を0.5% w/v活性炭で5分間処理することにより除去する。
【0164】
9.4.8 比活性度測定
比活性度は、PHADEBASTM アッセイ(Magle Life Sciences社)を、活性/mg酵素で用いて評価した。
この製品の取扱説明は下記の通りである。(下記「アルファ−アミラーゼ活性の評価」も参照)
【0165】
9.4.9 等電点の評価
等電点は、等電点電気泳動法(例えばPharmacia社, Ampholine, pH 3.5- 9.3)により求めることができる。
【0166】
9.4.10 安定性評価
アミラーゼの安定性は、次のようにして評価することができる。
この酵素を関連する条件下でインキュベートする。サンプルを異なる時間、例えば0, 5, 10, 15 及び30後に採取し、アッセイ緩衝液(50 mM Britton緩衝液、pH 7.3)で25倍に希釈し(全サンプルについて同じ希釈率)、標準条件のpH7.3、37℃においてPHADEBASアッセイ(Magle Life Sciences社)を用いて活性を測定する。
【0167】
インキュベートする前に測定した活性を参照(100%)として用いる。活性の低下をインキュベート時間に対しパーセントで計算する。この結果は、例えば30分インキュベートした後の残留活性を表わす。
【0168】
9.4.11 アルファ−アミラーゼ活性の評価
1. PHADEBASアッセイ
アルファ−アミラーゼの活性をPHADEB ASTMタブレットを基質に用いる方法で評価する。PHADEBASタブレット(PHADEBASTM Amylase Test, 供給元Magle Life Sciences社)には、ウシ血清アルブミンと緩衝物質とタブレットとが添加された、青く着色され架橋された澱粉ポリマーが含まれている。
【0169】
測定のつど、5mLの50mM Britton-Robinson緩衝液(50mM 酢酸, 50mMリン酸, 50mMホウ酸, 0.1mM CaCl2, NaOHでpHを所定値に調整)が入れられた試験管中に、1つのタブレットを懸濁させる。この試験は所定の温度の水浴中で行なう。試験するアルファ−アミラーゼを50mM Britton-Robinson緩衝液で希釈する。1ミリリットルのアルファ−アミラーゼ溶液に、50mM Britton-Robinson緩衝液を5mL添加する。澱粉がアルファ−アミラーゼによって加水分解され、水溶性の青い断片が生じる。得られた青色溶液を分光光学的に測定し、620 nmにおける吸光度がアルファ−アミラーゼ活性の指標となる。
【0170】
10 または15分間(試験時間)インキュベートした後の620 nmの吸光度が、0.2から2.0吸光度単位の範囲にあることが必要である。この吸光度の範囲であれば、活性と吸光度の関係が直線的である(Lambert-Beerの法則)。
従って、この基準を満たすように酵素の希釈度を調整する必要がある。特定の条件(温度、pH、反応時間、緩衝液条件)の組み合わせにおいて、1 mgのアルファ−アミラーゼが有る値の量の基質を加水分解して青色を生じる。この色の強度を620nmにおいて測定する。所定の組み合わされた条件において、測定された吸光度は、対象とするアルファ−アミラーゼの比活性度(純粋なアルファ−アミラーゼタンパク質の活性/mg) に比例する。
【0171】
2. 別の方法
アルファ−アミラーゼの活性を、PNP-G7基質を用いて評価することができる。PNP-G7はp-ニトロフェニル-アルファ,D-マルトヘプタオシド(maltoheptaoside)の略であり、エンド-アミラーゼで切断されるブロックオリゴサッカライドである。切断後、キットに含まれるアルファ-グルコシダーゼが基質を消化してPNP分子を放出する。PNP分子は黄色を呈するので、λ=405 nm (400-420 nm)における可視光吸光度を測定することができる。PNP-G7基質及びアルファ-グルコシダーゼを含むキットは、Boehringer-Mannheim社(cat. No. 1054635) が製造販売している。
【0172】
製造者の推奨に従い、基質/緩衝液溶液10mLを、Lenzyme/緩衝液50mに加える。アッセイは、20マイクロIサンプルを96ウエルマイクロタイタープレートに移し、25℃でインキュベートすることにより行なう。予め25℃にした試薬溶液200μLを添加する。溶液を混合し、1分間予備インキュベートし、4分間にわたって30秒ごとにELISA読取機のOD 405 nmにおける吸光度を測定する。
吸光度変化の時間依存性の傾きが、所定の組み合わされた条件における測定対象のアルファ−アミラーゼの活性に比例する。
【0173】
9.4.12 LAS感受性の評価
複数の異なる濃度のLAS (直鎖アルキルベンゼンスルホン酸; Nansa 1169/P)を用いて、変異体を40℃で10分間インキュベートする。
残留活性をPHADEBASTMアッセイ法、または、PNP-G7基質を用いる別の方法により評価する。
LASをpH7.5の0.1Mリン酸緩衝液で希釈する。
以下のLAS濃度を用いる。
500 ppm, 250 ppm, 100 ppm, 50 ppm, 25 ppm, and 10 ppmまたは0 ppm。
【0174】
異なるLAS緩衝液を用いて、変異体を全容積が10mLで濃度が0.01-5 mg/lとなるように希釈し、温度制御された水浴を用いて10分間インキュベートする。少量を採取して冷アッセイ緩衝液へ移すことによりインキュベーションを終了させる。活性を測定しているとき、活性測定に影響しないように、LAS濃度を1 ppm未満にすることが重要である。残留活性は、上記のPHADEBASTMアッセイまたは別の方法を用い、二通りの方法で評価する。活性は、ブランクの値を差し引いて求める。LASが無い場合の活性を100%とする。
【0175】
10. アミラーゼ変異体の使用方法:工業用途
本願のアルファ−アミラーゼ変異体は、洗浄プロセス及び汚れ除去における様々な工業用途に応用可能な種々の特性を有する。
本願の1以上の酵素変異体または組成物は上記のように、洗剤、特に洗濯用洗剤組成物、食器洗浄用洗剤組成物、硬質表面洗浄用組成物に用いることができる。また本願の変異体を、布、織物、衣類のデサイジング用組成物、パルプ及び紙の製造用組成物、ビール醸造、エタノール製造、及び上記の澱粉転換プロセスに用いることができる。
【0176】
本願の変異体は、布、織物、衣類のデサイジング用組成物 (例えば本願に参照として組み込まれるWO 95/21247, U.S. 4,643,736, EP 119,920参照)、ビール製造または醸造、パルプ及び紙の製造、その他のプロセスにおいて有用である。
【0177】
10.1 パルプ及び紙製造
アルカリアルファ−アミラーゼ変異体を、澱粉補強された古紙またはボール紙からパルプ、紙、ボール紙等のリグノセルロース材料を製造する場合に用いることができ、特に再パルプ化が7以上のpHで生じ、アミラーゼが補強澱粉を分解することにより古紙の分解が促進される場合に用いることができる。アルファ−アミラーゼ変異体は、澱粉コートされた印刷済の紙から製紙用パルプを製造するプロセスにおいて特に有用である。このプロセスはWO 95/14807に開示された方法で実施され、a) 紙を分解してパルプにするステップと、b) ステップa)の前後またはステップa)の間に澱粉分解酵素で処理するステップと、c) ステップa)及びb)の後でインク粒子をパルプから分離するステップとから成る。
【0178】
またアルファ−アミラーゼは、酵素により改質された澱粉と、炭酸カルシウム、カオリン、及びクレイ等のアルカリ性フィラーとを用いて製紙するとき、澱粉の改質に非常に有用である。アルカリ性アルファ−アミラーゼはフィラーの存在下で澱粉を改質することができるので、工程を簡略化することができる。
【0179】
10.2 布、織物、衣料品のデサイジング
アルファ−アミラーゼ変異体は、布、織物、衣料品のデサイジングにおいても有用である。
繊維加工業では、澱粉被覆サイズ剤を除去するデサイジングプロセスを促進する副原料として、古くからアルファ−アミラーゼが用いられてきた。サイズ剤は、布を織る際に横糸の保護被覆剤として機能する。布を織った後にサイズ剤を完全に除去することは、その後の工程での洗浄、漂白、染色でよい結果を得るために重要である。酵素による澱粉分解が好まれるのは、繊維に悪影響を及ぼさないからである。
製造コストを下げて生産量を増加させるために、デサイジング加工は洗浄及び漂白工程と組み合わされることがある。このような場合には、澱粉の分解にアルカリまたは酸化剤等の非酵素系副原料が用いられる。これは、従来のアルファ−アミラーゼは高pHや漂白剤の存在下では正常に機能しないためである。
非酵素系の澱粉サイズ剤分解剤は比較的反応性が高い薬品であるため、繊維にダメージを与えることがある。本願のアルファ−アミラーゼ変異体はアルカリ性溶液中での性能が向上している事から、この用途に用いることができる。セルロースを含む布または織物をデサイジングする際、アルファ−アミラーゼをそれ単独、またはセルラーゼと組み合わせて用いることができる。
【0180】
デサイジング及び漂白プロセスは公知である。例えば、これらのプロセスは本願に参照として組み込まれる WO 95/21247, U.S. P. 4,643,736, EP 119,920に開示されている。
市販のデサイジング用の製品としてGenencor社のOPTISIZETM FLEXが挙げられる。
【0181】
10.3 洗浄プロセスと洗剤組成物
本願のアルファ−アミラーゼ変異体は、洗濯及び食器洗浄用等の、種々の洗浄または洗濯用の洗剤組成物の添加成分として用いることができる。
【0182】
本願の洗剤用組成物は、例えば手洗い用または洗濯機用洗剤組成物として処方する。本願の洗剤用組成物には、汚れた織物の前処理に適した洗濯用添加剤組成物、または織物の柔軟仕上げ剤が含まれる。あるいは、家庭内の硬質表面清掃用洗剤組成物として処方し、あるいは手洗い用または食器洗浄機用の洗剤として処方することができる。
【0183】
ある側面では、本願により酵素変異体を含む洗剤用添加剤が提供される。
洗剤用添加剤、及び洗剤組成物には1以上の他の酵素が含まれていてもよく、このような他の酵素は例えばプロテアーゼ、リパーゼ、ペルオキシダーゼ、他の澱粉分解活性酵素、例えば別のアルファ−アミラーゼ、グルコアミラーゼ、マルトゲンアミラーゼ、CGTase、および/または、セルラーゼマンナナーゼ (例えばDanisco US Inc.社, Genencor DivisionのMANNASTARTM)、ペクチナーゼ、ペクチン、リアーゼ、クチナーゼ、および/または、ラッカーゼ等である。
【0184】
一般に、選択した酵素と選択した洗剤との相性 (すなわち、最適pH値、他の酵素や非酵素成分との相性等) がよくなければならず、十分な量の酵素が存在しなければならない。
【0185】
<プロテアーゼ>
好ましいプロテアーゼには、動物、植物または微生物由来のプロテアーゼが含まれる。微生物由来のプロテアーゼが好ましい。化学的に修飾された変異体、遺伝子工学による変異体も含まれる。
プロテアーゼは、セリンプロテアーゼ、メタロプロテアーゼ、好ましくはアルカリ性微生物プロテアーゼ、またはトリプシン様プロテアーゼである。
アルカリ性プロテアーゼの例は、スブチリシン、特にバシラス由来のスブチリシンであり、例えばスブチリシン・ノボ(subtilisin Novo)、スブチリシン・カールスバーグ(subtilisin Carlsberg)、スブチリシン309、スブチリシン147、及びスブチリシン168(例えばWO 89/06279)等である。
トリプシン様プロテアーゼの例は、トリプシン(例えば豚または牛由来)、及びWO 89/06270とWO 94/25583に開示されたフサリウムプロテアーゼである。他の有用なプロテアーゼの例が、WO98/23732, WO99/20770, WO 92/19729, WO 98/20115, WO 98/20116,及び WO 98/34946に開示されている。
【0186】
市販のプロテアーゼ酵素の例にはAlcalaseTM, SavinaseTM, PrimaseTM, DuralaseTM, EsperaseTM,及びKannaseTM (Novo Nordisk A/S社); MaxataseTM, MaxacalTM, MaxapemTM, ProperaseTM, PurafectTM, Purafect OxPTM, FN2TM,及びFN3TM (Genencor International, Inc社)が含まれる。
【0187】
<リパーゼ>
好ましいリパーゼには、細菌または細菌由来のリパーゼが含まれる。化学的に修飾された変異体、遺伝子工学による変異体も含まれる。
有用なリパーゼの例には、例えばフミコーラ・ラヌギノサ(lanuginose)(T・ラヌギノサ)(EP 258068及びEP 305216参照)、またはフミコーラ・インソレンス(insolens)(WO 96/13580参照)等のフミコーラ(Humicola; サ−モミセス(Thermomyces)の異名) 由来のリパーゼ;シュードモナス(Pseudomonas)由来のリパーゼ (例えばP.アルカリゲネス(alcaligenes)またはP.シュードアルカリゲネス(pseudoalcaligenes)(EP218272参照)、P.セパシア(cepacia)( EP331376参照)、P.スタッツェリ(stutzeri)(GB 1,372,034参照)、P.フルオレセンス(fluorescens)、シュードモナス株SD 705(WO 95/06720及びWO 96/27002参照)、P.ウィスコンシネス(wisconsinensis)(WO 96/12012参照);バシラス由来のリパーゼ、例えばB.スブチリス由来(Dartois et al. (1993), Biochemica et Biophysica Acta, 1131, 253-360)、B.ステアロサーモフィルス(stearothermophilus)(JP 64/744992参照)、またはB.プミルス(pumilus)(WO 91/16422参照)が含まれる。
他の例は、WO 92/05249, WO 94/01541, EP 407 225, EP 260 105, WO 95/35381, WO 96/00292, WO 95/30744, WO 94/25578, WO 95/14783, WO 95/22615, WO 97/04079 及び WO 97/07202に開示されたリパーゼ変異体である。
【0188】
市販の好ましいリパーゼ酵素の例にはLipolaseTM及びLipolaseTM Ultra (Novo Nordisk A/S社)が含まれる。
【0189】
<アミラーゼ>
1以上の追加のアミラーゼを用いることもできる。
適したアミラーゼ(アルファおよび/またはベータ)には、細菌または菌類起源のものが含まれる。化学修飾または遺伝子組み換えされた変異体も含まれる。このようなアミラーゼには、例えばバシラスから得られるアルファ−アミラーゼ、例えばGB 1,296,839に詳細が開示されているB.リケニホルミスから得られるアルファ−アミラーゼが含まれる。
有用なアルファ−アミラーゼの例として、WO 94/18314, WO 96/39528, WO 94/02597, WO 94/18314, WO 96/23873, 及びWO 97/43424に開示された変異体が挙げられる。
【0190】
市販のアルファ−アミラーゼとして、DuramylTM, L1QUEZYMETM, TermamyTM, NATALASETM FungamylTM 及びBANTM (Novozymes A/S社), RapidaseTM,及びPurastarTM (Genencor社) 等が挙げられる。
【0191】
<セルラーゼ>
好ましいセルラーゼには、細菌または細菌由来のセルラーゼが含まれる。化学的に修飾された変異体、遺伝子工学による変異体も含まれる。
好ましいセルラーゼには、バシラス属、シュードモナス属、トリコデルマ属、フミコーラ属、フザリウム属、シエラビア族、アクレモニウム属由来のセルラーゼが含まれ、例えばU.S.P.4,435,307, UU.S.P.5,648,263, U.S.P.5,691,178, U.S.P.5,776,757 及びWO 89/09259に開示されたフミコーラ・インソレンス(Humicola insolens)、ミセリオフトラ・サーモフィリア(Myceliophthora thermophila)、フザリウム・オキシスポルム(Fusarium oxysporum)が含まれる。
トリコデルマ・リーゼイ(Trichoderma reesei) 由来のセルラーゼは、U.S.P.4,689,297, U.S.P.5,814,501, U.S.P.5,324,649, WO 92/06221 及びWO 92/06165に開示されている。
バシラス由来のセルラーゼは、U.S.P6,562,612に開示されている。
【0192】
市販のセルラーゼには、CelluzymeTM及びCarezymeTM (Novo Nordisk A/S社); ClazinaseTM及びPuradaxTM HA (Genencor International, Inc社);及びKAC-500(B) TM (花王)がある。
【0193】
<ペルオキシダーゼ/オキシダーゼ>
適切なペルオキシダーゼ/オキシダーゼには、植物、細菌、または細菌由来のセルラーゼが含まれる。化学的に修飾された変異体、遺伝子工学による変異体も含まれる。有用なペルオキシダーゼの例には、コプリヌス(Coprinus)属由来のペルオキシダーゼが含まれ、例えばWO 93/24618, WO 95/10602,及びWO 98/15257に開示されたコプリヌス・シネレウス(cinereus)及びその変異体由来のペルオキシダーゼが含まれる。
市販のペルオキシダーゼの例はGuardzymeTM (Novozymes A/S社)である。
【0194】
洗剤に1以上の酵素を含む添加剤を個別に添加するか、または全ての酵素を含む添加剤を添加することによって、洗剤に洗剤用酵素を含有させることができる。洗剤用添加剤、すなわち個別または一括して添加される添加剤は、例えば顆粒状、液状、スラリー状等とすることができる。好ましくは洗剤用添加剤を顆粒状とし、特に非粉塵飛散性顆粒、液状とし、特に安定化液状、またはスラリー状とする。
【0195】
非粉塵飛散性顆粒は、例えばU.S.P 4,106,991及びU.S.P 4,661,452の開示に従い調製することができ、所望により公知の方法でコーティングすることができる。ワックス状のコーティング材料の例として、平均分子量が約1000から約20000のポリエチレンオキサイド製品(例えばポリエチレングリコール, PEG);16から50のエチレンオキサイドユニットを有するエトキシ化ノニルフェノール;アルコールが炭素数12から20で、15から80のエチレンオキサイドユニットを有する、エトキシ化脂肪アルコール;脂肪アルコール;脂肪酸;脂肪酸のモノ−、ジ−及びトリグリセライドが挙げられる。流動床での使用に適したフィルムコーティング用材料の例は、GB 1483591に開示されている。酵素調合液は、例えばプロピレングリコール等のポリオール、糖、糖アルコール、乳酸、ホウ酸を公知の方法で添加して安定化されている。その他の酵素安定剤も公知である。保護された酵素は、例えばEP 238,216に開示された方法で調製することができる。
【0196】
洗剤用組成物は、例えば棒状、錠剤状、粉末状、顆粒状、ペースト状または液状等の形態にすることができる。液状洗剤は水性であり、一般に最大約70%の水と、0%から約30%の有機溶媒が含まれる。あるいは、非水性の液状洗剤でもよい。
【0197】
洗剤用組成物は、非イオン性、半極性、および/またはアニオン性、および/またはカチオン性、および/または両性イオン性の界面活性剤を、1以上含有する。界面活性剤は一般に、重量%で約0.1%から約60%含有される。
【0198】
界面活性剤が用いられる場合、洗剤には約1%から約40%の、直鎖アルキルベンゼンスルホネート(LAS);α−オレフィンスルホネート;アルキルスルフェート (脂肪アルコールスルフェート);アルコールエトキシスルフェート;二級アルカンスルホネート;α−スルホ脂肪酸メチルエステル;アルキルまたはアルケニルコハク酸;石鹸等のアニオン性界面活性剤が含まれる。
【0199】
界面活性剤が用いられる場合、洗剤には約0.2%から約40%の、アルコールエトキシレート、ノニルフェノールキシレート、アルキルポリグリコシド、アルキルジメチルアミンオキシド、エトキシ化脂肪酸モノエタノールアミド、脂肪酸モノエタノールアミド、またはポリヒドロキシアルキル脂肪酸アミド、またはグルコースアミンのN-アシル-N-アルキル誘導体(グルコアミド)等の非イオン性界面活性剤が含まれる。
【0200】
洗剤には0%から約65%の、ゼオライト、ジホスフェート、トリホスフェート、ホスホネート、炭酸塩、クエン酸塩、ニトリロ三酢酸、エチレンジアミン四酢酸、ジエチレントリアミン四酢酸、アルキルまたはアルケニルコハク酸、水溶性シリケートまたは層状シリケート(例えばHoechst社のSKS-6)等の、ビルダーまたは複合化剤が含まれる。
【0201】
洗剤には1以上のポリマーが含まれる。このようなポリマーの例として、カルボキシメチルセルロース、ポリビニルピロリドン、ポリエチレングリコール、ポリビニルアルコール、ポリ(ビニルピリジン-N-オキサイド)、ポリ(ビニルイミダゾール)、ポリアクリレート、マレイン酸/アクリル酸コポリマー、ラウリルメタクリレート/アクリル酸コポリマー等の、ポリカルボキシレートが挙げられる。
【0202】
洗剤には、ペルボレートまたはペルカーボネート等のH2O2源と、これらと組み合わされる過酸形成漂白活性剤(例えばテトラアセチルエチレンジアミン、またはノナノニルオキシベンゼンスルホネート)から成る、漂白剤系が含まれている。あるいは、漂白剤系には、ペルオキシ酸(例えばアミドタイプ、イミドタイプ、またはスルホンタイプ)が含まれる。
洗剤用組成物の酵素は、例えばプロピレングリコールまたはグリセロール等のポリオール、糖または糖アルコール、乳酸、ホウ酸、例えば芳香族ボレートエステル等のホウ酸誘導体、または例えば4-フォルミルフェニルホウ酸等のフェニルホウ酸誘導体等の、公知の酵素安定剤を用いて安定化される。洗剤用組成物は、例えば国際公開番号WO 92/19709及びWO 92/19708の開示内容に従い処方することができる。
【0203】
洗剤に、例えばクレイを含む衣料用コンディショナー、泡ブースター、泡抑制剤、防食剤、汚染物質懸濁財、再汚染防止剤、顔料、殺菌剤、増白剤、ハイドロトロープ、変色防止剤、香料等の公知の洗剤用原料が含まれていてもよい。
【0204】
洗剤組成物には酵素が添加され、特に1以上の本願の酵素変異体が添加される。
酵素変異体は、洗浄液1リットルにつき約0.01から約100 mgの酵素蛋白に相当する量が添加され、例えば洗浄液1リットルにつき約0.05から約5.0 mgの酵素蛋白に相当する量が添加され、特に洗浄液1リットルにつき約0.1から約1.0 mgの酵素蛋白に相当する量が添加される。
【0205】
本願の酵素変異体の1以上を、本願に参照として組み込むWO 97/07202に開示された洗剤処方に追加成分として添加することができる。
【0206】
<10.4 食器洗浄用洗剤組成物>
本願の酵素を以下に示す食器洗浄用洗剤組成物に用いることができる。
1) 顆粒自動食器洗浄機用組成物
非イオン性界面活性剤: 0.4-2.5%
メタ珪酸ナトリウム: 0-20%
ジ珪酸ナトリウム: 3-20%
トリ珪酸ナトリウム: 20-40%
炭酸ナトリウム: 0-20%
過ホウ酸ナトリウム: 2-9%
テトラアセチルエチレンジアミン(TAED): 1-4%
硫酸ナトリウム: 5-33%
酵素: 0.0001-0.1%
2) 顆粒自動食器洗浄機用組成物
非イオン性界面活性剤(例えばアルコールエトキシレート): 1-2%
ジ珪酸ナトリウム: 2-30%
炭酸ナトリウム: 10-50%
ホスホン酸ナトリウム: 0-5%
クエン酸三ナトリウム二水和物: 9-30%
酢酸ニトリロ三ナトリウム (NTA): 0-20%
過ホウ酸ナトリウム一水和物: 5-10%
テトラアセチルエチレンジアミン (TAED): 1-2%
ポリアクリレートポリマー(例えばマレイン酸/アクリル酸共重合体): 6-25%
酵素: 0.0001-0.1%
香料: 0.1-0.5%
水: 5-10 %
3) 顆粒 自動食器洗浄機用組成物
非イオン性界面活性剤: 0.5-2.0%
ジ珪酸ナトリウム: 25-40%
クエン酸ナトリウム: 30-55%
炭酸ナトリウム: 0-29%
重炭酸ナトリウム: 0-20%
過ホウ酸ナトリウム一水和物: 0-15%
テトラアセチルエチレンジアミン (TAED): 0-6%
マレイン酸/アクリル酸共重合体: 0-5%
クレイ: 1-3%
ポリアミノ酸: 0-20%
ポリアクリル酸ナトリウム: 0-8%
酵素: 0.0001-0.1%
4) 顆粒自動食器洗浄機用組成物
非イオン性界面活性剤: 1-2%
ゼオライロMAP: 15-42%
ジ珪酸ナトリウム: 30-34%
クエン酸ナトリウム: 0-12%
炭酸ナトリウム: 0-20%
過ホウ酸ナトリウム一水和物: 7-15%
テトラアセチルエチレン: 0-3%
ジアミン(TAED)ポリマー: 0-4%
マレイン酸/アクリル酸共重合体: 0-5%
有機ホスホネート: 0-4%
クレイ: 1-2%
酵素: 0.0001-0.1%
硫酸ナトリウム: 残余成分
5) 顆粒自動食器洗浄機用組成物
非イオン性界面活性剤: 1 -7%
ジ珪酸ナトリウム: 18-30%
Triクエン酸ナトリウム: 10-24%
炭酸ナトリウム: 12-20% :
モノペルスルフェート(2KHSO5.KHSO4.K2SO4): 15-21%
漂白剤安定剤: 0.1 -2%
マレイン酸/アクリル酸共重合体: 0-6%
ジエチレントリアミンペンタ酢酸五ナトリウム塩: 0-2.5%
酵素: 0.0001-0.1%
硫酸ナトリウム、水: 残余成分
6) 洗浄用界面活性剤を含む顆粒及び液体食器洗浄用組成物
非イオン性界面活性剤: 0-1.5%
オクタデシルジメチルアミンN-オキシド二水和物: 0-5%
オクタデシルジメチルアミンN-オキシド二水和物 とヘキサデシルジメチルアミンN-オキシド二水和物から成るC18/C16の80:20重量比ブレンド物: 0-4%
オクタデシルビス(ヒドロキシエチル)アミンN-オキシド 無水物とヘキサデシルビス(ヒドロキシエチル)アミンN-オキシド無水物から成るC18/C16の70:30重量比ブレンド物: 0-5%
平均エトキシ化率が3のC13-C15アルキルエトキシスルフェート: 0-10%
平均エトキシ化率が3のC12-C15アルキルエトキシスルフェート: 0-5%
平均エトキシ化率が12のC13-C15エトキシ化アルコール: 0-5%
平均エトキシ化率が9のC12-C15エトキシ化アルコールブレンド物: 0-6.5%
平均エトキシ化率が30のC13-C15エトキシ化アルコールブレンド物 0-4%
ジ珪酸ナトリウム: 0-33%
トリポリリン酸ナトリウム: 0-46%
クエン酸ナトリウム: 0-28%
クエン酸: 0-29%
炭酸ナトリウム: 0-20%
過ホウ酸ナトリウム一水和物: 0-1 1.5%
テトラアセチルエチレンジアミン(TAED): 0-4%
マレイン酸/アクリル酸共重合体: 0-7.5%
硫酸ナトリウム: 0-12.5%
酵素: 0.0001-0.1%
7) 非水性液体自動食器洗浄機用組成物
液状非イオン性界面活性剤(例えばアルコールエトキシレート): 2.0-10.0%
アルカリ金属ケイ酸塩: 3.0-15.0%
アルカリ金属リン酸塩: 20.0-40.0%
高級グリコール、ポリグリコール、ポリオキシド、グリコールエーテルから選択される液状キャリア: 25.0-45.0%
安定剤(例えばリン酸とC16-C18アルカノールの部分エステル): 0.5-7.0%
消泡剤(例えばシリコーン): 0-1.5%
酵素: 0.0001-0.1%
8) 非水性液体食器洗浄用組成物
液状非イオン性界面活性剤 (例えばアルコールエトキシレート) 2.0-10.0%
ケイ酸ナトリウム: 3.0-15.0%
アルカリ金属炭酸塩: 7.0-20.0%
クエン酸ナトリウム 0.0-1.5%
安定剤(例えばシリコーンと低分子量ジアルキルポリグリコールエーテルの微細分散混合物): 0.5-7.0%
低分子量ポリアクリレートポリマー: 5.0-15.0%
クレイゲル増粘剤(例えばベントナイト): 0.0-10.0%
ヒドロキシプロピルセルロースポリマー: 0.0-0.6%
酵素: 0.0001-0.1%
高級グリコール、ポリグリコール、ポリオキシド、グリコールエーテルから選択される液状キャリア: 残余成分
9) チクソトロピック液体自動食器洗浄機用組成物
C12-C14脂肪酸: 0-0.5%
ブロック共重合体界面活性剤: 1.5-15.0%
クエン酸ナトリウム 0-12% トリポリリン酸ナトリウム: 0-15%
炭酸ナトリウム: 0-8%
トリステアリン酸アルミニウム: 0-0.1%
クメンスルホン酸ナトリウム: 0-1.7%
ポリアクリレート増粘剤: 1.32-2.5%
ポリアクリル酸ナトリウム: 2.4-6.0%
ホウ酸: 0-4.0%
ギ酸ナトリウム: 0-0.45%
ギ酸カルシウム: 0-0.2%
n-デシジフェニルオキサイドジスルホン酸ナトリウム: 0-4.0%
メタノールアミン(MEA): 0-1.86%
水酸化ナトリウム(50%): 1.9-9.3%
1,2-プロパンジオール: 0-9.4%
酵素: 0.0001-0.1%
消泡剤、染料、香料、水: 残余成分
10) 液体自動食器洗浄機用組成物
アルコールエトキシレート: 0-20%
脂肪酸エステルスルホネート: 0-30%
ドデシルスルホン酸ナトリウム: 0-20%
アルキルポリグリコシド: 0-21%
オレイン酸: 0-10%
ジ珪酸ナトリウム一水和物: 18-33%
クエン酸ナトリウム二水和物: 18-33%
ステアイン酸ナトリウム: 0-2.5%
過ホウ酸ナトリウム一水和物: 0- 13%
テトラアセチルエチレンジアミン(TAED): 0-8%
マレイン酸/アクリル酸共重合体: 4-8%
酵素: 0.0001-0.1%
11) 保護された漂白剤粒子を含む液体自動食器洗浄機用組成物
珪酸ナトリウム: 5-10%
ピロリン酸三カリウム: 15-25%
トリ珪酸ナトリウム: 0-2%
炭酸カリウム: 4-8%
保護された漂白剤粒子、例えば塩素: 5-10%
高分子性増粘剤: 0.7-1.5%
水酸化カリウム: 0-2%
酵素: 0.0001-0.1%
水: 残余成分
12) 過ホウ酸塩を過炭酸塩二変更した1), 2), 3), 4), 6) 及び10)に記載の自動食器洗浄機用組成物
13) さらにマンガン触媒を含む l)-6)に記載の自動食器洗浄機用組成物
マンガン触媒は、"Efficient manganese catalysts for low-temperature bleaching", Nature 369: 637-39 (1994)に開示された化合物のいずれか1である。
14) プレミアHDL液体洗剤の処方
Bio-Soft S-101: 直鎖アルキルベンゼンスルホン酸
Steol CS-330: ラウレス硫酸ナトリウム
Bio-soft N25-7: 7モルのEOを含む直鎖アルキルエトキシレート
Stepanate SXS: キシレンスルホン酸ナトリウム
15) ウルトラ液体洗剤処方
Tionopal CBS-X: 蛍光増白剤
Alpha-step MC-48: アルファ−スルホメチルエステルナトリウム
Makon TD-6: トリデシルアルコールエトキシレート
【0207】
<11. アルファ−アミラーゼ変異体から成る組成物>
いくつかの側面では、本願によりa) 親AmyS様アルファ−アミラーゼに対しアミノ酸配列同一性を少なくとも95%有し、参照アルファ−アミラーゼの位置242に対応するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体であって、検出可能なアルファ−アミラーゼ活性を有するアルファ−アミラーゼ変異体と、b) 別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とが含まれる組成物が提供される。
【0208】
好ましい実施形態では、本願の変異体は親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して1以上が改変されていることにより、例えば本願に示す工業的プロセス等の用途における使用方法や性能が改変され得る。
このような改変された性質には例えば、正味電荷、基質特異性、基質分解性、基質結合性、熱安定性、1以上のpH域における活性、1以上のpH域における安定性、酸化環境下での安定性、Ca2+要求性、比活性度、触媒反応速度、触媒効率、キレート剤の存在下での活性、キレート剤存在下での熱またはpH安定性、デサイジングでの有用性、洗浄プロセスでの有用性、タンパク質発現系での発現量、またはその他の対象とする性質が含まれる。当業者であれば、このような改変された性質は、アミラーゼの最終用途、またはアミラーゼの製造、またはこの両者において有用である。
【0209】
公知のアミラーゼまたは配列を容易に特定できるアミラーゼを参照アミラーゼとして用いることができる。本願の実施形態では、参照アミラーゼはSEQ ID NO: 1 または2である。いくつかの実施形態では、親アミラーゼと参照アミラーゼが同じであってもよい。
【0210】
いくつかの実施形態では、組成物は洗濯、食器または硬質表面洗浄、デサイジング、あるいは繊維または汚れ処理に用いられる製品の一成分である。例えばこの組成物は液状、半固体状、固体状の食器洗浄用洗剤の一成分であり、あるいは顆粒状または液状洗剤の一成分である。この組成物には、その用途に応じて別の成分を添加することができる。このような用途における配合処方を本願に開示する。これ以外の配合処方も当業者にとって周知である。
【0211】
一つの実施形態では、組成物に別の酵素が含まれている。このような別の酵素は、プロテアーゼ、リパーゼ、アミラーゼ、セルラーゼ、ペルオキシダーゼ、オキシダーゼ、ペクチナーゼ、リアーゼ、クチナーゼ、ラッカーゼまたは他の有用な酵素のいずれかである。当業者にとって、本願のアミラーゼ変異体との組み合わせにおいて有用な別の酵素は周知である。特定の用途において有効な酵素の量は、実験により求めることができる。本願に、例えば実施例において、有効な酵素の量のガイドラインを示す。
【0212】
本願実施形態では、組成物には1以上の界面活性剤が含まれる。界面活性剤は非イオン性、アニオン性、カチオン性、または両性イオン性、またはこれらの組合せのいずれかである。
【0213】
ひとつの実施形態では、アルファ−アミラーゼ変異体は、好ましくはS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体である。
洗濯や洗浄等のいくつかの用途では、酸化に対する安定性やキレート剤に対する安定性、あるいは異なる金属イオン濃度に対する安定性を有することがが有用である。このため、いくつかの実施形態では、変異体は酸化に対する安定性が改変されている。またアルファ−アミラーゼ変異体は、親AmyS-様アルファ−アミラーゼのアミノ酸位置8, 9, 96, 200, 206, 284, 307, 311, 316, 及び438残基を含めてメチオニン残基の1以上の置換または欠失を備え、ここで参照アルファ−アミラーゼはSEQ ID NO: 2である。
別の実施形態では、アルファ−アミラーゼ変異体はさらに、参照アルファ−アミラーゼ(好ましくはSEQ ID NO: 2)のアミノ酸位置97, 179, 180, 193, 319, 349, 358, 416, 428, または443に対応するアミノ酸位置の1以上において、配列修飾を有する。
【0214】
別の実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【0215】
さらに、ひとつの実施形態では、アルファ−アミラーゼ変異体は、例えばN193F置換またはV416G置換、またはこの両置換のように、N193置換またはV416置換、またはこの両置換を有する。別の実施形態では、アルファ−アミラーゼ変異体は位置F178, R179, G180, 1181, G182及びK183 にアミノ酸欠失を有する。本願に開示するように、このような欠失はペアワイズ、またはそれ以上の組合せであることが好ましい。
好ましい実施形態では、アルファ−アミラーゼ変異体は改変された金属イオン依存性、あるいはカルシウム無添加時における改変された活性または安定性、キレート剤存在下での改変された活性をまたは安定性有する。このようなアミラーゼ変異体は洗濯及び洗浄プロセスにおいて有用である。
【0216】
ひとつの実施形態では、アルファ−アミラーゼ変異体はSEQ ID NO:2に対し少なくとも95%の相同性を有し、アミノ酸配列SEQ ID NO:1から成る参照アルファ−アミラーゼの位置番号242に相当する位置にアミノ酸置換を有する。このアルファ−アミラーゼ変異体は、使用条件下においてアルファ−アミラーゼ活性を有することが好ましい。
【0217】
好ましい実施形態では、親アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16であり、参照アルファ−アミラーゼがSEQ ID NO: 1 または2である。いくつかの実施形態では、低pHまたは高pHでの洗濯プロセスにおいて性能が改善されている。ひとつの実施形態では、アルファ−アミラーゼ変異体は親アルファ−アミラーゼに対し、pH >約8での洗浄性能が改善されている。より好ましくは、アルファ−アミラーゼ変異体はpH約8.5からpH約11での洗浄性能が改善されている。
【0218】
ひとつの実施形態では、アルファ−アミラーゼ変異体は参照アミラーゼ、例えばSEQ ID NO: 1または2のアミノ酸配列を参照配列として、次の組み合わされた置換せを有する:a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E; または i) Q319R, Q358R, Q443E。
【0219】
別の側面では、本願により洗剤用または洗浄剤用処方組成物が提供され、この組成物には親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するアミラーゼ変異体が含まれる。このアミラーゼ変異体は、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに、検出可能なアルファ−アミラーゼ活性を有する。参照アミラーゼは好ましくはSEQ ID NO: 1、または2である。
【0220】
いくつかの実施形態では、洗剤または洗浄剤配合処方には、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242Tの内の少なくともいずれかを含む、S242アルファ−アミラーゼ変異体が含まれる。上記の組成物には、本願に開示する変異体及び改変のいずれか1またはこれらの組合せが含まれる。
【0221】
また別の側面では、本願によりキットが提供される。
ひとつの実施形態では、このキットにはa) 親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するアルファ−アミラーゼ変異体であって、検出可能なアルファ−アミラーゼ活性を有するアルファ−アミラーゼ変異体と、b) 別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とが含まれる。
【0222】
ひとつの実施形態では、このキットにはさらに、このキットの成分を織物のデサイジング、または澱粉含有物質で汚された1以上の物品を洗濯または洗浄する際の取扱説明書が含まれている。
【0223】
当業者であれば、本願に開示するアルファ−アミラーゼを製造するキットも提供されることを理解できよう。このキットにより、親アルファ−アミラーゼ及び参照アミラーゼとして使用されるアミノ酸配列および/またはこれに由来する核酸等の、代表的配列が提供される。
【0224】
<12. デサイジング、及び洗濯/洗浄プロセスでのアミラーゼ変異体の使用>
別の側面では、本願はアルファ−アミラーゼ変異体を布や織物のデサイジング、及び洗濯または洗浄プロセスに使用する方法に関する。
【0225】
一つの側面では、本願により織布製造後に織物をデサイジングする方法が提供される。この方法には、織物と、アルファ−アミラーゼ変異体とを、織物からデサイジング剤の少なくとも一部が除去される条件及び時間接触させる工程が含まれる。アルファ−アミラーゼ変異体は、親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する。このアルファ−アミラーゼ変異体は検出可能なアルファ−アミラーゼ活性を有する。
【0226】
本願の実施形態では、アルファ−アミラーゼ変異体は、親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して、物性または酵素特性が改変されている。いくつかの実施形態では、アルファ−アミラーゼ変異体は、(a)正味電荷、(b)基質特異性、(c)基質分解性、(d)基質結合性、(e)熱安定性、(f)1以上のpH域における活性、(g)1以上のpH域における安定性、(h)酸化環境下での安定性、(i)Ca2+要求性、(j)比活性度、(k)触媒反応速度、(1)触媒効率、(m)キレート剤存在下での活性、(n)キレート剤存在下での熱またはpH安定性、(o)デサイジング効果、(p)タンパク質発現系における発現量の内の1以上の特性が改変されている。
【0227】
ここで参照アミラーゼは上記のものであり、この方法のひとつの実施形態では、参照アミラーゼはSEQ ID NO: 1、または2である。
【0228】
一つの実施形態では、親AmyS-様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16から成り、参照アルファ−アミラーゼがSEQ ID NO: 1 または2から成る。
いくつかの実施形態では、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242Tのいずれかである。
【0229】
また別の実施形態では、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。ここで参照アミラーゼはSEQ ID NO: 1、または2である。
【0230】
別の側面では、本願は洗濯または洗浄方法に関する。洗濯または洗浄操作での酵素の使用は有益であるが、洗濯または洗浄プロセスにおいて酵素は過激な条件に曝され、酵素活性の限界に近い条件で使用される。
本願の方法は、洗濯または洗浄される1以上の物品を、親AmyS-様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有する少なくとも1のアルファ−アミラーゼ変異体が含まれる組成物に接触させる工程が含まれる。アルファ−アミラーゼ変異体は検出可能なアルファ−アミラーゼ活性を有する。この接触工程は、1以上の物品が洗濯または洗浄される条件及び時間において行われる。
好ましくは、少なくとも1の物品は少なくとも1の澱粉含有物質で汚されており、この汚れの除去がアルファ−アミラーゼ変異体によって促進される。
【0231】
一つの実施形態では、組成物にはさらに洗濯処方または洗浄処方用の少なくとも1の成分が含まれる。
例えば組成物には、別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1が含まれる。
【0232】
一つの実施形態では、親アルファ−アミラーゼはSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16のいずれかであり、参照アルファ−アミラーゼはSEQ ID NO: 1または2である。いくつかの実施形態では、親アルファ−アミラーゼはSEQ ID NO: 1, 2, 15, または16のいずれかであり、別の実施形態では親アルファ−アミラーゼはSEQ ID NO: 6, 7, 8, 9, 10, 11, または12のいずれかである。好ましい実施形態では、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである。いくつかの実施形態では、参照アミラーゼはSEQ ID NO: 1または2のいずれかであり、アルファ−アミラーゼ変異体はS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである。
【0233】
例えばアルファ−アミラーゼ変異体がS242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体である実施形態では、アルファ−アミラーゼ変異体は参照アミラーゼアミノ酸位置97, 179, 180, 193, 319, 349, 358, 416, 428, または443に対応するアミノ酸位置に1以上の配列修飾を有する。より好ましくは、アルファ−アミラーゼ変異体は、次の位置における置換を1以上備える:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
好ましい実施形態では、アルファ−アミラーゼ変異体は、例えばN193F置換またはV416G置換、またはこの両置換のように、N193置換またはV416置換、またはこの両置換を有する。
【0234】
別の実施形態では、アルファ−アミラーゼ変異体は位置F178, R179, G180, 1181, G182及びK183 にアミノ酸欠失を有する。このような実施形態では、アルファ−アミラーゼ変異体は改変された金属イオン依存性または金属イオン安定性、あるいはカルシウム無添加時における改変された活性、キレート剤存在下での改変された活性を有する。他の修飾の実施形態では、このような欠失は単独または前記の改変と組み合わせて実施される。
本願の実施形態では、アルファ−アミラーゼ変異体は親アルファ−アミラーゼに対し、例えばpH >約8での洗浄性能が改善されている。
【0235】
好ましい実施形態では、本願の方法では次の組み合された置換を有するアルファ−アミラーゼ変異体を使用する:a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E; または i) Q319R, Q358R, Q443E。
【実施例】
【0236】
本願について以下の実施例によりさらに詳しく説明する。これらの実施例は特許請求の範囲を限定するものではない。添付の図面は明細書の一部を構成する。引用した文献は、その内容の全てが本願に参照として組み込まれる。以下の実施例は説明のためのものであり、特許請求の範囲を限定するものではない。
【実施例1】
【0237】
<変異体の構築>
AmySの成熟配列の位置S242における変異体を、 部位特異的突然変異誘発を用いて構築した。突然変異誘発に用いたテンプレートは、New England Biolabs社(Massachusetts)のdam-Methylaseを用いたメチル化pHPLT- AmyS(図2参照)であった。縮重プライマー(下記に示すS242F(フォワード) 及び S242R(リバース))を合成し、Operon (Huntsville, AL)中へ希釈し10μMにした。
Operonは相補的フォワード及びリバース配列を有し、この両配列はいずれも反応においてライゲーションするための5'リン酸塩基を有する。親アルファ−アミラーゼの配列はSEQ ID NO:2であった。標的位置をNN(G/C)でランダム化したオリゴヌクレオチドプライマーを用いて、Stratagene Quik-ChangeTM Multi-siteキット(Stratagene社, La Jolla CA) によりライブラリーを構築した。選択したアミノ酸(すなわちS242)を、代替可能な19種のアミノ酸全てによりランダムに置換した。
下記のS242プライマーを突然変異誘発に用いた。
【化1】

【化2】

【0238】
<QUIK-CHANGETM反応>
この反応では、無菌蒸留水H2Oを18μL、キットに含まれる10x 緩衝液を2.5μL、キットに含まれるdNTPを1 μL、フォワードプライマーを1.25 μL (10 μM ストック液)、 リバースプライマーを1.25 μL (10 μM ストック液)、 テンプレートとしてpHPLT-AmySプラスミドDNAを1 μL (〜70 ng)、及びキットに含まれる酵素ブレンド物を1 μL 用い、全容量は26.5 μLであった。
【0239】
<サイクル条件>
先ず95℃で1分間の反応を1回行い、次に95℃で1分間、55℃で1分間、65℃で10分間のサイクルを25回繰り返した。
1マイクロリットルのDpn I (10 U/μL)をMulti-site Quik-ChangeTM反応混合物に添加し、37℃で18時間インキュベートし、次にさらに0.5 μL添加し3時間反応させた。
【0240】
1マイクロリットルのDpnI消化反応生成物を、TEMPLIPHI増幅キット(Amersham Biosciences社, Piscataway, NJ) によるローリングサイクル増幅のテンプレートに用い、Amersham社の取扱説明書に従い反応を行った。1マイクロリットルのローリングサイクルDNAを100μLのバシラス・スブチリスのコンピテント細胞(プロテアーゼ2欠失B.スブチリス株 (ΔaprE, AnprE, amyE::xylRPxylAcomK-phleo))中に形質転換し、37℃で1時間振蕩した。次に、全ての形質転換体をLA + 10 ppm Neo + 1% 不溶性澱粉のプレートに塗布し (1つのプレートに25 μL、別のプレートに75 μL)、37℃で一晩インキュベートした。
96の形質転換体を150 μLのLB + 10 ppm Neoを有するマイクロタイタープレートに植菌し、37℃で一晩成長させた。96ピンの複製ツールを用いて、一晩成長させたプレートから、より大きなLA + 10 ppm Neo + 1%不溶性澱粉のプレートに移しかえ、Quintara Biosciences社 (Berkeley, CA)へ送り、コロニーのPCRと配列解析を行った。
【0241】
変異体の配列を決定した後、125 μL のLB + 10 ppm Neoを有する96ウエルマイクロタイタープレートに変異体を4個一組の形態で植菌し、対照サンプルも植菌した。植菌したマイクロタイタープレートを37℃、250 rpmで6時間インキュベートした。
複製ツール(Enzyscreen社, Leiden, The Netherlands)を用いて、マイクロタイタープレートの培地を新しいマイクロタイタープレートに植菌した(マイクロタイタープレート及びプレートの蓋は Enzyscreen社製)。新しいマイクロタイタープレートには、タンパク質を発現させるためにMBD培養液150ul、及びタンパク質発現の栄養素の5 mM CaCl2を入れておいた(G. Vogtentanz et al, A Bacillus subtilis fusion protein system to produce soybean Bowman-Birk protease inhibitor, Prot. Expr. & Purif. 55 (2007) 40-52参照)。
タンパク質発現用プレートを37℃、250 rpm、湿度70%で64時間培養した。次に、発現させた培養液をミクロフィルタープレート(0.22 μm, Millipore社, Billerica, MA)で濾過し、熱安定性改善効果のスクリーニングに供した(実施例3参照)。
【実施例2】
【0242】
<変異体の発現、精製、及び分析>
実施例1のマイクロタイタープレートのコロニーを、ネオマイシンを10ppm含む澱粉プレート上に線状に塗布した。この澱粉プレートを37℃で一晩インキュベートし、シングルコロニーを採取し、培養液(下記参照)とネオマイシン10ppmとを入れた250 mL振蕩フラスコ(培養液は25 mL)に植菌した。この培養液を37℃、275 rpmで約8時間 (OD (600 nm)が2.0に達するまで) 培養した。この培養液と50%グリセロールとを2:1の比率で混合し、それぞれラベルを付した培養バイアルに個別に入れ、-80℃で冷凍した。以後の選択されたアルファ−アミラーゼの製造には、これらのグリセロールストック溶液を用いた。
【0243】
アミラーゼの発酵は、1% (w/v)のSoytoneを含むminimal MOPS培養培地(Neidhardt et al., J. Bacteriol. 119(3): 736-747, 1974)を入れた500mL振蕩フラスコを用いて、37℃で60時間培養することにより行った。
以下の手順により、疎水性相互作用クロマトグラフィーを用いて発酵後の培養液から酵素を精製した。
培養液を10倍に濃縮し、次にpH6.8の50 mM MES、2 mM CaCl2及び1M硫酸アンモニウムを含む溶液で元の濃度に戻し、次に無菌グラスファイバーフィルターで濾過した。
サンプルを、同じ緩衝液で予め平衡状態にしたPHENYL SEPHAROSE FF高密度カラム(20 x 95 mm; Amersham, GE Healthcare Bio-Sciences社, Sweden) に注入した。10カラム容積の硫酸アンモニウムを含まない前記緩衝液を注入し、引き続き用いて5カラム容積の水を注入して非アミラーゼタンパク質を溶出させた。
対象とする酵素は、pH 6.8の50 mM MES、2 mM CaCl2、及び40%プロピレングリコールを含む溶液で溶出させた。
【0244】
タンパク質の濃度は、標準的SDS pageゲル濃度定量法、またはMegazyme (Wicklow, Ireland)のアミラーゼ分析キットを用いた活性分析のいずれかの方法で測定した。精製したアミラーゼ(バシラス 707 アミラーゼ; SEQ ID NO:6)により作成した標準曲線を用いて、分析結果を比較した。
【実施例3】
【0245】
<改変された性質の評価:熱ストレス>
この実施例に、本願の変異体が親アルファ−アミラーゼに対し改変された性質を有することを示す。
G.ステアロサーモフィラスのアルファ−アミラーゼ(AmyS)変異体の、ハイスループット熱安定性スクリーニングを行った。
【0246】
最初の評価を行った後、野生型の酵素の熱ストレス後の活性が当初(ストレス前)の活性の約40% (すなわち、(熱ストレス後の活性)/( 熱ストレス前の活性) が約0.4) になる熱ストレス条件選択した。突然変異体のライブラリーを4個一組(quadruplicate) でスクリーニングし、熱ストレス後の残留活性が野生型酵素の熱ストレス後の平均残留活性よりも標準偏差の2以上高い変異体が、耐熱性を有する可能性の有る変異体であるものとして同定した。
【0247】
発現プレートの培養液上清中に、100 ppmの発現したアミラーゼが認められた。37℃、一定湿度の振蕩機を用いて60〜65時間培養した後(250 rpm、相対湿度70%)、フィルタープレートを用いて細胞質物質を除去することにより培養液上清を浄化した。浄化した上清をpH 5.8の50mM NaOAc/2.6mM CaCl2/0.002% Tween-20の緩衝液で10倍に希釈し、最終濃度を約10ppmとした。
各上清からサンプルを採取してさらに0.02 ppmまで希釈し、蛍光標識したトウモロコシ澱粉基質及び上記の方法を用いた酵素変異体活性測定に供した。
また、各上清からさらにサンプルを採取し、サーモサイクラーにより95℃で30分間熱ストレスをかけ、pH 5.8の50mM NaOAc/2.6mM CaCl2/0.002% Tween-20緩衝液で0.02ppmに希釈し、蛍光標識した基質及び下記の方法を用いて残留活性を測定した。
【0248】
アミラーゼの活性は、アミラーゼENZCHECK ULTRA AMYLASE分析キットを、製造者(Invitrogen社, San Diego CA)の取扱説明書に従って用いて評価した。評価におけるアミラーゼの最終濃度は約0.02ppmであった。アッセイ緩衝液には、pH 5.8の50mM NaOAc/2.6mM CaCl2/0.002% Tween-20緩衝液を用いた。基質には、BODIPY蛍光色素結合100μg/mL DQTM トウモロコシ澱粉(Invitrogen社, Eugene, OR) を用いた。アミラーゼ活性の指標となる蛍光の増加を、SpectraMAX M2 (Molecular Devices社, Sunnyvale, CA)を用いて測定した。反応を室温下で行い、この装置のキネティックモードで5分間記録した。励起波長は485nmで、515nmのカットオフフィルターを用い520nmの蛍光を測定した。
【0249】
95℃で30分間熱ストレスを与えた野生型AmyS(Xtra)の残留活性は33〜43%であった。同一の熱ストレスを与えたS242A及びS242QAmyS変異体の残留活性は、それぞれ55〜65%及び70-80%であった。図3とTable 3-1を参照されたい。これらの熱安定性の測定結果から、この2種の変異体は、野生型アルファ−アミラーゼよりも熱安定性が高いことが分かる。
【表2】

【実施例4】
【0250】
<改変された性質の評価:DSC>
疎水性相互作用クロマトグラフィーを用いて、振蕩フラスコの発酵培養液からSpezyme Xtra, S242A, S242E, 及びS242Qを精製した。50%プロピレングリコール及び2mM CaCl2を含有するpH 6.8の50 mM MESを用いてタンパク質をカラムから精製された状態で溶出させた。
【0251】
過剰熱容量曲線を、超高感度走査型ハイスループット・マイクロカロリーメータVP-CAP DSC (MicroCal, Inc.社, Northampton, MA)を用いて測定した。DSC測定の方法と解析方法は刊行物(Freire, E., "Differential Scanning Calorimetry," Methods. MoI. Biol. 41, 191- 218, 1995) に記載されている。
約500μLの0.5mg/ml野生型バシラス・ステアロサーモフィリスのα-アミラーゼ、またはS242A, S242E, 及びS242Q変異体(いずれも2mM塩化カルシウムを添加または無添加)について、30〜120℃の範囲を走査した。
同じサンプルについて、可逆性をチェックするために再スキャンした。α-アミラーゼの場合、熱変性は不可逆である。道板緩衝液はpH5.5の10 mM酢酸ナトリウムであった。凝集により生じ得る誤差を最小にするため、スキャン速度を200℃/hrとした。DSC曲線のサーマル・ポイント(Tm)を、供試したタンパク質の熱安定性の指標とした。Table 4-1に、供試したアミラーゼタンパク質の熱融点を示す。図5に、野生型アミラーゼ及びアミラーゼ変異体の熱融解曲線及び融点を示す。
【0252】
S242A, S242E, 及びS242Q変異体の熱変性は、2mM塩化カルシウムの有無にかかわらず、野生型との比較において融点の顕著な上昇として表れた。塩化カルシウムを添加しないときの野生型アミラーゼの融点は100.8℃であるのに対し、S242A, S242E, 及びS242Q変異体のTmは各々106.5℃, 107.8℃, 及び110.1℃であった。すなわち、S242をAで置換したときTmが5.7℃上昇し、S242をEで置換したときTmが7.0℃上昇し、S242をQで置換したときTmが9.3℃上昇した。
【0253】
2mM塩化カルシウムを添加したときの野生型アミラーゼの融点は106.8℃であるのに対し、S242A, S242E, 及びS242Q変異体のTmは各々111.8℃, 112.2℃及び113.8℃であった。すなわち、塩化カルシウムを添加しない場合と比較して、2mM塩化カルシウムの添加により4種のタンパク質全てのTmが上昇した。
カルシウムの添加により、野生型アミラーゼ及びS242A変異体のTmは各々6℃及び5.3℃上昇した。S242EのTmの上昇は4.4℃であった。S242QのTmの上昇は3.7℃であった。これは、S242Q変異体はカルシウムによってそれほど安定化されないか、またはS242Q変異体の安定性はカルシウムに依存しないことを示唆している。
野生型アミラーゼに対するS242A, S242E, 及びS242Q変異体のTmの上昇は、各々5℃, 5.4℃, 及び3℃であった。このことから、変異体の熱力学的特性が、野生型アミラーゼまたはSpezyme Xtraとは異なることが示唆される。この結果は、応用試験における改善された性能とも一致する(実施例5参照)。
【表3】

【実施例5】
【0254】
<活性プロファイル>
この実施例に、供試した変異体は親アルファ−アミラーゼだけでなく、工業上一般的な酵素に対しても改変された活性プロファイルを有することを示す。タンパク質の同定は、精製したサンプルまたはプレートのサンプルを用いて行った。アルファ−アミラーゼ変異体、及び標準アルファ−アミラーゼの評価は同じ濃度で行った。
【0255】
プレートまたは精製アミラーゼ変異体を、pH5.6のマレイン酸緩衝液を用いて約20ppmに希釈した。15%トウモロコシ澱粉がpH5.6のマレイン酸緩衝液中に含まれている基質を用いた。
400マイクロリットルの澱粉懸濁液を2.5分かけて70℃にした。次に、この澱粉懸濁液に希釈した酵素7μLを手早く添加し、タンパク質の最終的濃度を約0.36ppmにした。次に反応混合物を予め85℃に加熱しておいた振蕩機に取り付け、300rpmで撹拌した。所定時間後、125mM NaOHを50μL添加して反応を終了させた。反応チューブ内の反応液を遠心分離し、上清を10mM NaOHで10倍に希釈し、HPAEC-PAD(アンペロメトリック検出器付高性能アニオン交換クロマトグラフィー)でDP(重合度)プロファイルを分析した。
【0256】
反応は、4, 10 及び 20分間行った。4分間の反応には、基質から生成物への初期転換が反映される。10分間の反応には、酵素の熱活性が反映される。20分間の反応には、酵素の熱安定性が反映される。
【0257】
DP2からHPLC測定終了時までの面積を積分し、総タンパク質量と反応時間で割り算した。結果を図7及び8に示す。
【実施例6】
【0258】
<別の方法>
実施例において、以下の評価方法を用いた。これらの方法を一部変更した場合、各実施例に変更点を記載した。これらの評価方法において、反応により生じた生成物の吸光度の測定には分光光度計を用いた。
【0259】
<A. タンパク質含有量の測定>
[BCA (ビシンコニン酸)アッセイ]
マイクロタイタープレートスケールのサンプルのタンパク質含有量の測定には、BCA (Pierce)アッセイを用いた。使用した薬品及び試薬は:BCAタンパク質評価用試薬とPierce希釈緩衝液(50mM MES, pH6.5, 2mM CaCl2, 0.005% TWEENTM-80)であった。使用した測定装置はSpectraMAX (340型; Molecular Devices社)のMTP読取機であった。マイクロタイタープレートはCostar社製(9017型)であった。
【0260】
200μLの BCA試薬を各ウエルにピペットで入れ、次に希釈したタンパク質20μLを入れた。撹拌した後、マイクロタイタープレートを37℃で30分間インキュベートした。各ウエルの溶液の気泡を取り除いた後、562nmにおける光学密度を読み取った。タンパク質濃度を求めるために、各サンプルの計測値からバックグラウンドの値を差し引いた。複数の標準タンパク質(精製した酵素)のOD562をプロットして検量線を作成した。サンプル中のタンパク質濃度は、検量線の内挿から求めた。
【0261】
<ブラッドフォード(Bradford)アッセイ>
ブラッドフォード染料試薬(Quick Start社)法を用いて、マイクロタイタープレートスケールのサンプルのタンパク質含有量を測定した。使用した薬品及び試薬は:Quick Startブラッドフォード染料試薬(BIO-RAD カタログNo.500-0205)、及び希釈緩衝液(10mM NaCl, 0.1mM CaC12, 0.005%TWEENTM-80)であった。使用した装置は、Biomek FX Robot (Beckman社)、及びSpectraMAX(340型) MTP読取機であった。Costar社製(9017型)のマイクロタイタープレートを用いた。
【0262】
200μLのブラッドフォード染料試薬を各ウエルにピペットで入れ、次に希釈したタンパク質15μLを入れた。濾過した培養液10μLを各ウエルに添加した。撹拌した後、マイクロタイタープレートを室温で少なくとも10分間インキュベートした。各ウエルの溶液の気泡を取り除いた後、595nmにおける光学密度を読み取った。タンパク質濃度を求めるために、各サンプルの計測値からバックグラウンドの値(すなわち植菌していないウエルの計測値)を差し引いた。OD595の測定値から、サンプル中の相対的タンパク質濃度を求めた。
【0263】
<B. 見本片による酵素性能評価>
この評価で用いた洗剤は、酵素を含まない洗剤か、または市販の洗剤中の酵素を本願に開示する熱不活性化法で不活性化した洗剤であった。使用した装置はEppendorf Thermomixer、及びSpectraMAX(340型) MTP読取機であった。Costar社製(9017型)のマイクロタイタープレートを用いた。
【0264】
<洗剤の調製(AATCC HDL;米国の条件)>
Milli-Q水の硬度を6gpg(Ca/Mg=3/1)に調整し、増白剤無添加で1.5g/1のAATCC 2003標準参照液状洗剤を添加した。洗剤溶液を少なくとも15分間激しく撹拌した。次に、5 mM HEPES(遊離酸)を添加してpHを8.0に調整した。
【0265】
<米澱粉見本片によるアミラーゼの性能評価>
本願に開示した方法により試験用洗剤を調製した。使用した装置は、New Brunswick Innova 4230振蕩/インキュベータ、及びSpectraMAX(340型) MTP読取機であった。Costar社製(3641型)のマイクロタイタープレートを用いた。Center for Test Materials (Vlaardingen, Netherlands)から入手した黄色染料入り熟成米澱粉見本片(CS-28)を使用した。
この見本片を水洗した後、0.25インチの円形小見本片を切り取った。96ウエルのマイクロタイタープレートの各ウエルに、小見本片を2枚ずつ入れた。試験用洗剤の温度を20℃(北アメリカ条件)または40℃(西ヨーロッパ条件)に保った。
小見本片が入れられたマイクロタイタープレートの各ウエルに、洗剤溶液190μLを添加した。この混合物に、希釈した酵素溶液を10μL添加した。マイクロタイタープレートを接着性薄膜でシールし、所定の温度(20℃または40℃)のインキュベータ中において750rpmで撹拌しながら1時間インキュベートした。
その後、各ウエルから溶液を150μL採取し、新しいマイクロタイタープレートに入れ、SpectraMAX MTP読取機を用いて488nmにおいて測定し、洗浄効果を評価した。小試験片と洗剤を含み酵素は含まない参照サンプルと、ブランクサンプルについても洗浄効果を評価した。
【0266】
<酵素性能の計算>
吸光度の測定値を、ブランクの値(すなわち酵素を用いずにインキュベートした小見本片の測定値)で較正した。得られた吸光度の値を加水分解活性の指標とした。
【0267】
<C. 抗体滴定によるアミラーゼ濃度の測定>
いくつかの実施例では、アルファ−アミラーゼの濃度と比活性度を、抑制性ポリクロナール抗体を用いた滴定により求めた。バシラス・ステアロサーモフィリスのアルファ−アミラーゼ (AmyS)に対するポリクロナール抗体は、AmyS及びバシラス種 TS23由来のアルファ−アミラーゼに対する抑制性が強いことが分かった(例えば結合力が強いため、滴定した抗体の量に比例してアミラーゼの活性が直線的に低下する)。すなわち、この抗体を用いて酵素濃度を測定することができ、さらにこの濃度測定値から比活性度を求めることができる。
【0268】
いくつかの濃度が既知の抗体毎に、活性が抑制された酵素の量を測定した。この結果から、活性を完全に抑制するために必要な抗体の濃度を外挿により求めた。この抗体濃度は、サンプル中の酵素濃度に等しい。アルファ−アミラーゼの活性と抑制効果は、蛍光性BODIPY-澱粉アッセイにより測定した。使用した緩衝液は0.005% Tween-80を含むpH 7.0の50 mM MOPSであった。
【0269】
精製AmySに対するポリクロナール抗体はウサギを用いて生成させ、公知の方法で精製した。抗体ストック溶液の「見かけ濃度」は、比活性度が既知のAmySサンプルに対する抑制効果を測定して求めた。この抗体溶液を、AmyS及びTS23t変異体の濃度及び比活性度の測定に用いた。この測定値を用いて、全ての変異体の濃度が同一になるように希釈することにより規格化した96-ウエル酵素ストックプレートを作った。
【0270】
<D. 天然タンパク質ゲル電気泳動>
変異体タンパク質サンプルの電気泳動移動度を、PHASTGELシステム(GE Healthcare社)を用いて、プレキャストした濃度7.5%または12.5%ネイティブポリアクリルアミドゲル(PHASTGEL Homogeneous)上で測定した。0.88 M L- アラニン中のpH 8.8の 0.25 M Tris緩衝液から成るバッファー・ストリップ(PHASTGEL Native)を用いた。典型的な電気泳動条件は、アノードとカソード間の距離3.7cm、400Vで12.75分であった。
【0271】
別の方法では、タンパク質変異体サンプルの電気泳動移動度を、pH値が異なる(すなわち5.8, 8.0及び10.0) 厚さ1mmの0.5-1.5%アガロースゲルと、適切な緩衝液とを用いて測定した。電気泳動は、非変成条件下で行なった。アノードとカソード間の距離は13.9 cmであった。1〜2 μgのタンパク質のサンプルと、5%グリセロール+ 0.05% ブロモフェノールブルーとを混合し、ゲル上の各レーンで測定した。電気泳動は、100Vで1時間行った。
【0272】
ゲルを10%酢酸に溶解させたルイビルブルー(Louisville blue)染料で染色し、10%メタノール及び10%酸性水溶液で脱色した。使用したネイティブゲルの種類に応じて、12から20種のタンパク質変異体を同時に測定した。これにより、同一ゲル上の標準電荷ラダーに対するタンパク質変異体サンプルの電気泳動移動度を速やかに評価することができた。
【0273】
<E. 洗剤の熱不活性化>
市販の洗剤を用いて、酵素以外の成分の性能を維持しながら、洗剤に含まれるタンパク質成分の酵素活性を熱により不活性化させた。すなわち、この方法は酵素変異体の試験において使用する市販の洗剤の調製に適している。
北アメリカ(NA)と西ヨーロッパ(WE)のヘビーデューティ衣類液状 (HDL) 洗剤の場合、計量した液状洗剤(ガラス瓶入り)を95℃の水浴中で2時間加熱して不活性化した。北アメリカ(NA)と日本(JPN)のヘビーデューティ衣類液状 (HDG) 洗剤の場合、8時間加熱して熱不活性化し、西ヨーロッパ(WE)のHDGは5時間加熱して熱不活性化した。NAとWEの自動食器洗浄機(ADW)用洗剤は8時間加熱して熱不活性化した。これらの洗剤はスーパーマーケットで購入した。
不活性化の程度を正確に測定するため、熱処理した洗剤、及び熱処理していない洗剤の両者を5分以内に溶解して試験に用いた。洗剤の活性はsuc-AAPF-pNA法で行った。
【0274】
熱不活性化した洗剤中の酵素活性を測定するために、熱不活性化したストック溶液を用いて洗剤の試験用溶液を調製した。各洗剤を所定の同じ試験条件にするために、水の硬度調整剤(6 gpgまたは12 gpg)と緩衝液を各洗剤溶液に適宜添加した(Table 6-1参照)。溶液の入った瓶を振り、溶液を混合した。
【表4】

【0275】
<F. TERG-O-TOMETER法による洗浄性能の評価>
タンパク質及び炭水化物汚れの標準的な洗浄試験方法を用いた。布見本片の汚れの程度は、洗浄の前と後に標準的な方法で測定した。布見本片は、トウモロコシ澱粉、米澱粉、または血、ミルク、及びカーボンブラック混合物のいずれかで汚された綿布であった。布見本片はTestfabrics, Inc.社 (West Pittiston, PA)から購入した。トウモロコシ澱粉(EMPA 161)、血、ミルク、及びカーボンブラック(EMPA 116)人口汚れ材はCenter for Testmaterials BV 社製(Vlaardingen, Netherlands)であった。
各サンプルの試験前後における汚れの程度を、D65 (6500°K)標準光源を備えるMinolta Reflectometer CR-410を用いて、光反射率により測定した。L, a, b値の違いを、CIE-LAB色空間により定義された全色差(dE)に変換した。汚れの洗浄効果は、未洗浄(洗浄前)と非汚染の布の全色差の差に対する洗浄前後の全色差の差の比率から求めた、汚れ除去指数(%SRI)として表した。
【0276】
洗浄試験は、撹拌機付きステンレス製2L容器を6基備えるERG-O-TOMETER (United States Testing Co.社, Hoboken, NJ)を用いて行った。各試験は、1ガロン当り6グレインの3:1(カルシウム:マグネシウム)水硬化剤、または12グレインの水硬化剤を用い、全容積1Lで行った。
洗浄試験で用いた洗剤は、pH8の5mM HEPES緩衝液を含む1.5 g/LのAATCC HDL WOB 2003液状洗剤、0.7g/LのAATCC HDD WOB 1993顆粒状洗剤、過ホウ酸塩及びTAED漂白剤を含む8g/LのIEC A* 60456顆粒状洗剤、または5g/LのPersil Power Gel液体洗剤であった。
酵素を直接洗浄液に入れ、次に40g/Lまたは200g/Lの汚れ見本片布を完全に洗浄液に漬かるようにして入れて反応を開始した。洗浄は100rpmで撹拌しながら、 20℃、25℃、30℃、40℃、または50℃において、10, 15, または40分間行った。洗浄後、汚れ見本片を水道水で3分間すすぎ洗いし、電気洗濯機により1000rpmで脱水して余分な水を除き、低温のパーマネントプレスモードの乾燥機で約45分間乾燥させた。
光反射率測定により汚れ除去の程度を評価し、汚れ除去指数(%SRI)を求めた。実験の参照条件では酵素を用いずに洗浄し、ポジティブ参照条件では数種類の市販の酵素を用いて洗浄した。
【0277】
<G. BODIPY-澱粉アッセイによるアミラーゼ活性評価>
EnzChekTM Ultra Amylase Assayキット (E33651, Invitrogen社)を用いてBODIPY-澱粉アッセイを行った。
1mg/mLのDQ澱粉基質ストック溶液を、凍結乾燥された基質が入れられたバイアルにpH4.0の50 mM酢酸ナトリウム緩衝液100μLを加えて溶解させることにより調製した。このバイアルを約20秒振り混ぜた後、室温で暗所に置き、時々撹拌して完全に溶解させた。バイアルにアッセイ緩衝液(50mM酢酸ナトリウムと2.6mM CaCl2, pH5.8)900μLを加え、20秒間撹拌した。この基質溶液を室温で暗所に置き、使用するまで4℃で保管した。
この1mg/mL基質溶液からアッセイ緩衝液を用いて100μg/mLの試験用溶液を調製し、試験に供した。100μg/mLの基質溶液190μLを、平底96-ウエルマイクロタイタープレートの各ウエルに入れた。各酵素サンプル10μLをウエルに入れ、サーモミキサーを用いて800rpmで30秒間撹拌した。基質と緩衝液のみを含むブランクサンプル(酵素を含まないブランク)も含めてアッセイを行った。マイクロタイタープレート蛍光読取機を用いて、蛍光強度の変化率を25℃で5分間測定した(励起波長: 485 nm, 蛍光測定波長: 520 nm)。
【0278】
<H. 高分子量基質への酵素結合の測定>
トウモロコシ茎葉及び繊維に対するアミラーゼ(AmyS)電化ラダー(電荷変化= 野生型AmySに対し-12から+12)の基質結合性を評価した。使用した基質には搾りかす(National Renewable Energy Laboratoryが希釈酸で前処理、洗浄しpH5に緩衝したブラジルのサトウキビ搾りかす)、AFEX(アンモニア繊維膨潤トウモロコシ茎葉)、及びPCS (希硫酸で前処理し、洗浄し、pH5に調整されたトウモロコシ茎葉)が含まれていた。全ての基質について、使用する前に固形成分濃度を所定の値に調整した。
【0279】
アミラーゼ結合性:
試験に用いるアミラーゼ電荷ラダー変異体を精製し、濃度200ppmに希釈した。ホウ酸塩緩衝液(40mM, pH8.5, 0.016% Tween-80)を用いて1%セルロース繊維溶液を調製した。150μLの繊維溶液をマイクロタイタープ濾過レートの各ウエルに入れた。150μLのホウ酸塩緩衝液を、参照用として別のウエルに入れた。10μLのアミラーゼ荷電ラダー変異体を、各々2サンプルを一組として濾過プレートに入れた。濾過プレートを室温で2時間インキュベートした。濾液を回収し、上清中のアミラーゼ活性をBODIP Y-澱粉アッセイにより測定した。
【0280】
小見本片への酵素結合測定:
標準洗浄条件において、アミラーゼ変異体をCS-28米澱粉小見本片とともに、またはCS-28米澱粉小見本片無しで30分間インキュベートした。BODIPY-澱粉アッセイにより遊離酵素の量を測定した。小見本片に結合した酵素の量を次の式により計算した:
結合割合 = (見本片無での酵素活性 - 見本片有での酵素活性) / (見本片無での酵素活性)
【実施例7】
【0281】
<B.スブチリス中でのアミラーゼ産出>
この実施例では、バシラス・ステアロサーモフィリスアミラーゼのアルファ−アミラーゼ由来の欠失突然変異体 (S242Q突然変異と、C-末端における29アミノ酸欠失とを有する;本願ではS242Qと呼ぶ)、及びB.スブチリス中でのこの変異体の産出について説明する。
形質転換は公知の方法で行った(例えばWO 02/14490参照)。親アミラーゼをコードする遺伝子をpHPLT発現ベクター中にクローン化した。pHPLT発現ベクターは、LATプロモータ(PLAT)、LATシグナルペプチド(preLAT)をコードする配列、及びこれに続くクローン化用のPstl及びHpal 制限酵素認識部位を有する。
【0282】
LATシグナルペプチドのコード領域を以下に示す。
【化3】

LATシグナルペプチドのアミノ酸配列を以下に示す。
【化4】

【0283】
イタリック体で示すアミノ酸置換を有する成熟欠失S242Qアミラーゼのアミノ酸配列を基礎にして、本願の変異体ライブラリーを構築した。
【化5】

【0284】
PCR生成物をQiagen社のQIAQUIKカラムを用いて精製し、50μLの脱イオン水中に再懸濁させた。50μLの精製したDNAをHpaI(Roche社)及びPstI(Roche社)で消化し、得られたDNAを30μLの脱イオン水中に再懸濁させた。10〜20ng/LHのDNAを、paI及びPstIのクローン化部位を用いてプラスミドpHPLT中にクローン化した。ライゲーション混合物を、コンピテントB.スブチリス細胞(遺伝子型: Δvpr, ΔwprA,Δmpr-ybfJ, ΔnprB)中に直接形質転換した。
このB.スブチリス細胞はキシロース誘導プロモータに結合されたコンピテンシー遺伝子(comK)を有するので、DNA結合及び取り込み能力を誘導するためにキシロースを用いた(Hahn et al , MoI. Microbiol, 21 : 763-775, 1996参照)。
【0285】
pHPLT-AmySプラスミドのエレメントには、pUBl 10 = pUBl 10プラスミド由来のDNA断片(McKenzie et al, Plasmid 15: 93-103, 1986参照)が含まれる。プラスミドの構成要素には:ori-pUB 110 = pUB 110複製起源; neo = pUBl 10のネオマイシン耐性遺伝子由来; Plat = B.リケニホルミスアミラーゼ由来の転写プロモータ; Pre LAT = B.リケニホルミスアミラーゼ由来のシグナルペプチド;SAMY 425ss = 欠失AmyE遺伝子配列のコード領域 (本願において発現される欠失AmyE変異体のコード領域で置換されたもの);及びターミネーター = B.リケニホルミスアミラーゼ由来の転写ターミネーターが含まれる。
【実施例8】
【0286】
<酵素変異体の発現>
この実施例では、上記の実施例の形質転換B.スブチリスの種々の遺伝子組み換え酵素を発現させる方法について説明する。
【0287】
<アミラーゼの発現 - 2 mLスケール>
S242Q(またはその変異体) を含むB.スブチリスクローン発現ベクターを、グリセロールストック液からの自己複製子をLB培養液150μL + 10μg/ml ネオマイシンを含む96-ウエル培養プレート(BD, 353075)に入れ、37℃、220rpmで加湿雰囲気下において一晩培養することにより複製した。
5mL のプラスチック製培養チューブ中で、一晩培養した培養液100μLを合成培地2000μL+ 10μg/mlネオマイシンに植菌した。培養媒体には、MOPS緩衝液中に窒素源としての尿素、炭素源としてのグルコース、及び健全な細胞を成長させるための1% SOYTONEとカルシウム5mM を含む、富栄養半合成培地を用いた。
培養チューブ内の試料を37℃、250rpmで72時間インキュベートした。インキュベートした後、培養液を3000 x gで10分間遠心分離した。上清を15mLのポリプロピレン製円錐管に静かに移し、次に80μLのサンプルを96ウエルプレートに分取し、タンパク質を定量した。
【実施例9】
【0288】
<酵素変異体の産出>
この実施例では、酵素電荷ラダーの作り方と組み合わせ電荷ライブラリーの構築方法を説明する。
【0289】
<酵素電荷ラダー>
様々な物性を有する多数のタンパク質変異体を、公知の部位特異的突然変異誘発法(例えばGenencor International出願、U.S. Pat. Appln. Ser. No. 10/576,331, 11/581,102, 及び11/583,334参照) で調製するか、または公知のライブラリーから選び出した。所定の複数のタンパク質プローブのセットを、対象とする試験方法で評価した。
以下の表に示すアミラーゼ変異体電荷ラダーの例について、本願に開示する方法で評価した。これらの表には、親酵素に対する電荷変化が示されている。
【表5】

【0290】
<酵素組合せ電荷ライブラリー(CCL)>
[B.ステアロサーモフィリス AmyS-S242Q CCLの構築]
形質転換したB.スブチリス株 (遺伝子タイプ: ΔaprE, ΔnprE, amyE::xylRPxylAcomK-phleo)からAmyS-S242QプラスミドDNAを単離し、CCL構築用のテンプレートとしてDNA2.0 Inc.社へ送った。
DNA2.0 Inc.社 (Mountain View, CA)に、Table 15-2に示すAmy S- S242Q (S242Q)アミラーゼ中の各4部位のポジショナル・ライブラリーを構築するよう依頼した。変異体は96-ウエルプレート中のグリセロールストック液として送られてきた。
【0291】
AmyS S242Q組合せ電荷ライブラリーは、Gln-97, Gln 319, Gln 358, 及びGln 443の4つの残基を指定して設計した。各部位において野生型、アルギニン、またはアスパラギン酸の3つの可能性のある組合せを作ることにより、81の変異体を含み4つの部位に関するCCLが構築された。
【表6−1】

【表6−2】

【実施例10】
【0292】
<酵素の洗浄性能>
この実施例では、S242Q変異体を1.0 μg/ml含むAATCC HDL洗剤、または S242Q変異体を5 mM含むHEPES緩衝液の、様々なイオン強度下における小見本片評価試験について説明する。実施例12に示した方法を用いた(「米澱粉見本片によるアミラーゼの性能評価」と「トウモロコシ粉加水分解」参照)
【0293】
AATCC HDL洗剤中での酵素の洗浄性能において、最適な正味電荷変化が認められた。洗浄性能は、米澱粉小見本片活性アッセイで観察された相対的洗浄性能について評価した。このアッセイでは、値が約1.0のとき洗浄性能が良いことを意味する。これは、所与の結果または利点(例えば液体衣類洗剤の洗浄性能)を改善するためにタンパク質の物性(例えば正味電荷)を最適化する例である。この限られたタンパク質プローブのセットにより特定された最適な電荷は、電荷組合せライブラリー全体について観察された最適な電荷に一致する。従って、複数のタンパク質プローブを用いることにより、電荷組合せライブラリー全体の挙動を予測することができる。
【0294】
Debye-Huckelの理論(Israelachivili, Intermolecular and Surface Forces, 2nd Edition: With Applications to Colloidal and Biological Systems, Academic Press 2nd Ed. [1992])によれば、静電相互作用は主として、相互作用に関与する一定電位または一定電荷の物質(酵素、基質、繊維、及び洗剤)の間の二重層力の強度、そのサイズ、及び周囲環境の誘電率によって決まる。洗剤処方等の複雑な媒体中での粒子の静電挙動を明らかにするためには、同一のDebye遮蔽距離を有する単純化された環境における粒子間の相互作用を明らかにすれば足りる。これは、洗浄時の洗剤と同じpHと伝導度の緩衝液を選択することにより、実施することができる。このような試験に適した緩衝液は、異なる量のNaCl等の中立の電解質を含む pH8.0の5 mM HEPES緩衝液である。この緩衝液にNaC l を2.5 mM 添加することにより、pHと伝導度を北米の洗浄条件に適合させることができる。さらに高濃度のNaClを添加すれば、一般に水の硬度が高いことと洗剤濃度が高いことによりイオン強度が高い、日本及び欧州の洗浄条件に適合させることができる。
【0295】
図10は、正電荷のS242Q電荷変異体は、北米の衣類洗浄条件下において米澱粉小見本片の洗浄性能が優れていることを示している。同様に、負電荷のTS23t変異体は西ヨーロッパの衣類洗浄条件下において米澱粉小見本片の洗浄性能が優れている(図11)。
【0296】
図12は、正電荷のS242Q電荷変異体は顆粒状トウモロコシ澱粉の加水分解においてより高い比活性度を示すことを表わしている。
【実施例11】
【0297】
<熱安定性>
この実施例では、熱安定性とタンパク質電荷の関係の評価について説明する。アルファ−アミラーゼの評価は、上清の加熱前後でのBODIPY澱粉加水分解に基づいて行った。実施例6と同じ薬品及び試薬を用いた。
【0298】
<アルファ−アミラーゼの熱安定性評価>
濾過した培養液上清を、002%Tween を含むpH 5.8の50 mM酢酸ナトリウム + 2 mM CaCl2を用いて連続的に希釈した。希釈した各培養液上清10μLについて、BODIPY澱粉加水分解により初期アミラーゼ活性を求めるための試験を行った。各希釈培養液上清50μLを、薄型VWR PCR 96ウエルプレートに入れた。各ウエルに鉱物油30μLをシール剤として添加した。このプレートを、BioRad DNA engine Peltier Thermal Cyclerを用い、親酵素の安定性に応じて95℃において30分間または60分間インキュベートした。インキュベートした後、このプレートを4℃で5分間冷却し、室温で保存した。各サンプル10μLを新しいプレートに入れ、実施例1に示したBODIPY澱粉アッセイにより、最終的アミラーゼ活性を評価した。
【0299】
<熱安定性の計算>
サンプルの残留活性を、最終的吸光度と最初の吸光度の比で表わした。最終的吸光度と最初の吸光度はいずれもブランクにより較正した。比の値が大きいほど、変異体の熱安定性が良いことを示す。これは、液状衣類洗剤の酵素の熱安定性を改良するためにタンパク質の物性、この場合は正味電荷、を最適化する例である。
【0300】
<熱安定性評価>
上記のようにして、変異体の熱安定性を評価した。熱安定性の優れた変異体をTable 11-1に示す。熱安定性の優れた変異体は、親酵素(すなわちS242Q)の残留活性に対する変異体の残留活性の比率が1より大きい変異体である。
【表7】

【実施例12】
【0301】
<酵素性能>
この実施例に、酵素の性能が電荷に影響され得ることを示す。
酵素の性能評価は、実施例12に示した不活性化した洗剤を用いて行った。性能指数(PI)が1より大きいものを、性能が良いとした。PIは、変異体の残留活性と親(すなわちS242Q)の残留活性との比率である。結果をTable 12-1 及び12-2に示す。
【表8−1】

【表8−2】

【表9−1】

【表9−2】

【0302】
また、本願に開示したBODIPY澱粉加水分解アッセイを用いて活性を評価した。結果をTable 12-3に示す。この澱粉基質(トウモロコシ澱粉)に対する相対比活性度が1より大きいことは、その変異体の比活性度が親S242Q酵素より高いことを示す。相対ppmは力価を表わし、この値が1より大きいときは、親S242Q酵素より高力価(振蕩チューブ中で)であることを示す。
【表10−1】

【表10−2】

【実施例13】
【0303】
<アミラーゼの活性と発現に及ぼす突然変異の効果の最適化>
この実施例では、酵素の2種の性質が、タンパク質の電荷変化に対し相反する依存性を示すために負の相関関係にある場合でも、複数のアミノ酸置換の導入により、酵素のこれら2種の性質を同時に改善することができることを説明する。
【0304】
実験により、正電荷が増加するとAmyS- 242Qの培地での発現が減少することが認められた。しかし、正電荷が増加すると特異的BODIPY澱粉加水分解は増加する。
例えば燃料エタノール製造や洗剤に用いられる澱粉液状化用の遺伝子組み換えAmyS-242Q変異体の場合、アミラーゼ発現特性と澱粉加水分解特性の両者が改善されることが望ましい。しかし、この2種の特性は両立しないように見える。
本願の方法によれば、単一突然変異を選択的に組み合わせることにより、澱粉加水分解特性を損なうことなくアミラーゼ発現特性を向上させることができる。本願の方法によれば、第1の特性(例えば発現特性)が向上し、第2の特性(例えば澱粉加水分解特性)が向上ないし維持された選択的多置換AmyS-242Q変異体を製造することができる。
【0305】
また、AmyS-242Q変異体の培地での発現とは逆に、正電荷が増加するとAmyS-242Q変異体のトウモロコシ澱粉の小見本片洗浄性能は向上する。遺伝子組み換えAmyS-242Q変異体の場合、アミラーゼ発現特性と洗浄性能の両者が改善されることが望ましい。しかし、この2つは両立しないように見える。
本願の方法によれば、単一突然変異を選択的に組み合わせることにより、洗浄性能を損なうことなくアミラーゼ発現特性を向上させることができる。本願の方法によれば、第1の特性(例えば発現特性)が向上し、第2の特性(例えば米澱粉小見本片洗浄性能)が向上ないし維持された選択的多置換AmyS-242Q変異体を製造することができる。
【0306】
1から4の荷電残基の置換の組み合わせを有する変異体から成るAmyS-S242Q電荷組合せライブラリー(CCL)中の80種の変異体について、振蕩チューブでの発現、BODIPY-澱粉加水分解、及び米澱粉洗浄性能を評価した。優れたAmyS-S242QをTable 13-1 及び 13-1に示す。
Table 13-1に示す複数置換変異体は、親酵素と同等ないし改善された発現特性と、親酵素と同等ないし改善されたBODIPY-澱粉加水分解特性とを有する。またTable 13-2に示す複数置換変異体は、親酵素と同等ないし改善された発現特性と、親酵素と同等ないし改善された米澱粉洗浄性能とを有する。
【表11】

【表12】

【0307】
まとめると、酵素活性と酵素産出性能とは電荷依存性が異なるため(図13A, 13B, 14A 及び 14B参照)、負の相関関係にある(図12 A及び12B参照)。しかし、発現及び活性の両者が改善される変異体も多数存在し、ライブラリーを本願の方法で分析することにより、このような変異体を特定することができる。
【0308】
アミラーゼを例に説明したが、この方法はプロテアーゼ、リパーゼ、セルラーゼ、トランスファラーゼ、及びペクチナーゼ等の他の種類の酵素にも適用可能である。さらに、発現特性、活性、結合特性、熱安定性、洗剤及びキレート安定性等の特性の2以上を同時に分析することもできる。
【実施例14】
【0309】
<アミラーゼのデサイジング性能>
この実施例では、85℃と97℃においてカルシウム濃度を変化させたときのS242Q変異体のデサイジング性能を、Ethyl及びXtraと比較した。CaCl2の濃度は、実験毎にMilli Q水で調製したpH ~6.5のCaCl2ストック溶液の添加量を変えることにより、0〜20 ppmの範囲で変化させた。実験では、0.01ppm活性タンパク質のEthyl、Xtra、及びS242Q変異体を使用した。実験はLAUNDER-O-METERを用いて、液比50:1で行った。性能試験は、澱粉に指示染料を結合させた米澱粉汚れ見本片布(TestFabrics Cat. No. CS-28; TestFabrics Inc.社) を用いて行った。実験毎に、3枚のCS-28見本片(6cm×8cm)と4枚のプリント生地見本片(Testfabrics, Style 400R; 3インチ×4インチ) を試験材料に用いた。Milli Q water/Caを入れたLAUNDER-O-METERの温度を予め85℃または97℃にしておき、次に酵素と見本片を投入した。30分間反応させた後、全色差測定の前に見本片を水洗いして乾燥させた。
【0310】
性能評価は、反射率測定法でCIE-L*a*b*色空間を測定することにより行った。知覚可能な色を色空間におけるL*a*b*座標系で表わすことができる。「L*」は0から100のスケール、すなわち黒から白の明度またはグレースケールを表わす。「a*」はマジェンタからグリーンへの色相変化を表わしており、正の値が大きいほどマジェンタ色相が強く、負の値が大きいほどグリーン色相が強いことを表わす。「b*」は黄色からブルーへの色相変化を表わしており、正の値が大きいほど黄色相が強く、負の値が大きいほどブルー色相が強いことを表わす。a*とb*の値がともに0のときは色が無く、明度がL*で指定される純粋のグレーとなる。
【0311】
デサイジング性能を、D65標準光源を備えるMinolta Chromameter CR-200を用いて評価した。デサイジング性能を定量化するため、各CS-28見本片についてCIE L*を4点測定し(すなわち、見本片の表と裏を2点ずつ測定)、その後アミラーゼで処理した。CIE L*値が高いほど、デサイジング効果が高いことを意味する。
【0312】
図15と16に示すように、試験した条件下では、S242Q変異体はEthyl及びXtraのいずれよりも、デサイジング性能におけるカルシウム濃度依存性がはるかに低い。
【0313】
明細書に記載した全ての文献と特許は参照として本願に組み込まれる。本願に開示した方法及び酵素は特定の実施形態または好ましくは実施形態に関して説明されているが、本願発明の範囲はこれらの実施形態に限定されない。本願に開示した方法及び酵素を種々変更または改良できることは当業者にとって明らかであり、本願発明の範囲にはこのような変更または改良も含まれる。
【図1A】

【図1B】

【図1C】

【図1D】

【特許請求の範囲】
【請求項1】
a)親AmyS−様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに、検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体と、
b)別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とを含む組成物。
【請求項2】
前記アルファ−アミラーゼ変異体が、親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して下記の性質の1以上が改変されている、請求項1に記載の組成物:(a)正味電荷、(b)基質特異性、(c)基質分解性、(d)基質結合性、(e)熱安定性、(f)1以上のpH域における活性、(g)1以上のpH域における安定性、(h)酸化環境下での安定性、(i)Ca2+要求性、(j)比活性度、(k)触媒反応速度、(1)触媒効率、(m)キレート剤存在下での活性、(n)キレート剤存在下での熱またはpH安定性、(o)デサイジング効果、(p)タンパク質発現系における発現量。
【請求項3】
参照アミラーゼがSEQ ID NO: 1、または2である、請求項1に記載の組成物。
【請求項4】
洗濯、食器または硬質表面洗浄、デサイジング、あるいは繊維または汚れ処理に用いられる製品の一成分である、請求項1に記載の組成物。
【請求項5】
別の酵素が、プロテアーゼ、リパーゼ、アミラーゼ、セルラーゼ、ペルオキシダーゼ、オキシダーゼ、ペクチナーゼ、リアーゼ、クチナーゼ、ラッカーゼ、またはこれらの組合せのいずれかである、請求項1から4のいずれか1項に記載の組成物。
【請求項6】
界面活性剤が非イオン性、アニオン性、カチオン性、または両性イオン性のいずれかである、請求項1から5のいずれか1項に記載の組成物。
【請求項7】
アルファ−アミラーゼ変異体が、S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである、請求項1から6のいずれか1項に記載の組成物。
【請求項8】
アルファ−アミラーゼ変異体の酸化に対する安定性が改変されており、またアルファ−アミラーゼ変異体がさらに、親AmyS−様アルファ−アミラーゼのアミノ酸位置8, 9, 96, 200, 206, 284, 307, 311, 316, 及び438残基を含めてメチオニン残基の1以上の置換または欠失を備え、ここで参照アルファ−アミラーゼがSEQ ID NO: 2である、請求項7に記載の組成物。
【請求項9】
アルファ−アミラーゼ変異体がさらに、参照アルファ−アミラーゼのアミノ酸位置97, 179, 180, 193, 319, 349, 358, 416, 428, または443に対応するアミノ酸位置の1以上において配列修飾を有する、請求項7に記載の組成物。
【請求項10】
アルファ−アミラーゼ変異体が次の位置における置換を1以上備える、請求項9に記載の組成物:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【請求項11】
アルファ−アミラーゼ変異体がN193置換またはV416置換、またはこの両置換を有する、請求項7から10のいずれか1項に記載の組成物。
【請求項12】
アルファ−アミラーゼ変異体がN193F置換またはV416G置換、またはこの両置換を有する、請求項11に記載の組成物。
【請求項13】
アルファ−アミラーゼ変異体が位置F178, R179, G180, l181, G182及びK183 に1以上のアミノ酸欠失を有する、請求項7から12のいずれか1項に記載の組成物。
【請求項14】
アルファ−アミラーゼ変異体が改変された金属イオン依存性、カルシウム無添加時における改変された活性または安定性、またはキレート剤存在下での改変された活性をまたは安定性有する、請求項13に記載の組成物。
【請求項15】
アルファ−アミラーゼ変異体がSEQ ID NO:2に対し少なくとも95%の相同性を有し、アミノ酸配列SEQ ID NO:1から成る参照アルファ−アミラーゼの位置番号242に相当する位置にアミノ酸置換を有するとともに、アルファ−アミラーゼ変異体がアルファ−アミラーゼ活性を有する、請求項1に記載の組成物。
【請求項16】
親AmyS−様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16であり、参照アルファ−アミラーゼがSEQ ID NO: 1 または2である、請求項1に記載の組成物。
【請求項17】
アルファ−アミラーゼ変異体が、親AmyS−様アルファ−アミラーゼに対しpH>約8での洗浄性能が改善されている、請求項1に記載の組成物。
【請求項18】
アルファ−アミラーゼ変異体が次の組み合わされた置換のいずれかを有する、請求項10に記載の組成物:a)Q97E,Q319E,Q358E,Q443E; b) Q97E,Q319R,Q358E,Q443R; c) Q97E,Q319R,Q358E; d) Q97E,Q319R,Q443E; e) Q97E,Q319R,Q443R; f) Q97E,Q358R; g) Q97E,Q443E; h) Q319R,Q358E,Q443E;または i) Q319R,Q358R,Q443E。
【請求項19】
請求項1から18のいずれか1項に記載の組成物、または親AmyS−様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに、検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体であって、参照アミラーゼがSEQ ID NO: 1または2であるアルファ−アミラーゼ変異体のいずれかを含む洗剤用または洗浄剤用処方品。
【請求項20】
アルファ−アミラーゼ変異体が、S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T置換の少なくともいずれか1のS242アルファ−アミラーゼ変異体である、請求項19に記載の洗剤用または洗浄剤用処方品。
【請求項21】
織布工程からの織物のデサイジング方法であって、請求項1から18のいずれか1項に記載の組成物、または親AmyS−様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有し、検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体と、織物とを、織物からデサイジング剤の少なくとも一部が除去される条件及び時間接触させる工程を含む、デサイジング方法。
【請求項22】
前記アルファ−アミラーゼ変異体が、親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して下記の性質の1以上が改変されている、請求項21に記載のデサイジング方法:(a)正味電荷、(b)基質特異性、(c)基質分解性、(d)基質結合性、(e)熱安定性、(f)1以上のpH域における活性、(g)1以上のpH域における安定性、(h)酸化環境下での安定性、(i)Ca2+要求性、(j)比活性度、(k)触媒反応速度、(1)触媒効率、(m)キレート剤存在下での活性、(n)キレート剤存在下での熱またはpH安定性、(o)デサイジング効果、(p)タンパク質発現系における発現量。
【請求項23】
親AmyS−様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16であり、参照アルファ−アミラーゼがSEQ ID NO: 1 または2である、請求項21に記載のデサイジング方法。
【請求項24】
アルファ−アミラーゼ変異体が、S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである、請求項21に記載のデサイジング方法。
【請求項25】
アルファ−アミラーゼ変異体が次の位置における置換を1以上備え、参照アルファ−アミラーゼがSEQ ID NO:1または2である、請求項24に記載のデサイジング方法:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【請求項26】
洗濯または洗浄方法であって、親AmyS−様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体を含む組成物、または請求項19に記載の洗剤と、洗濯または洗浄される1以上の物品とを、1以上の物品が洗濯または洗浄される条件及び時間において接触させる工程を含む、洗濯または洗浄方法。
【請求項27】
少なくとも1の物品が少なくとも1の澱粉含有物質で汚されており、この澱粉汚れの除去がアルファ−アミラーゼ変異体によって促進される、請求項26に記載の洗濯または洗浄方法。
【請求項28】
組成物に、別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の1以上がさらに含まれる、請求項26に記載の洗濯または洗浄方法。
【請求項29】
親AmyS−様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16であり、参照アルファ−アミラーゼがSEQ ID NO: 1 または2である、請求項26に記載の洗濯または洗浄方法。
【請求項30】
アルファ−アミラーゼ変異体が、S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである、請求項26に記載の洗濯または洗浄方法。
【請求項31】
アルファ−アミラーゼ変異体が、親AmyS−様アルファ−アミラーゼに対しpH>約8での洗浄性能が改善されている、請求項30に記載の洗濯または洗浄方法。
【請求項32】
アルファ−アミラーゼ変異体が次の位置における置換を1以上備える、請求項30に記載の洗濯または洗浄方法:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【請求項33】
アルファ−アミラーゼ変異体が次の組み合わされた置換のいずれかを有する、請求項32に記載の洗濯または洗浄方法:a)Q97E,Q319E,Q358E,Q443E; b)Q97E,Q319R,Q358E,Q443R; c)Q97E,Q319R,Q358E; d)Q97E,Q319R,Q443E; e)Q97E,Q319R,Q443R; f)Q97E,Q358R; g)Q97E,Q443E; h)Q319R,Q358E,Q443E;または i)Q319R,Q358R,Q443E。
【請求項34】
アルファ−アミラーゼ変異体が位置F178, R179, G180, l181, G182及びK183 に1以上のアミノ酸欠失を有する、請求項30に記載の洗濯または洗浄方法。
【請求項35】
アルファ−アミラーゼ変異体が改変された金属イオン依存性、カルシウム無添加時における改変された活性または安定性、またはキレート剤存在下での改変された活性をまたは安定性有する、請求項34に記載の洗濯または洗浄方法。
【請求項36】
a)親AmyS−様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体、または請求項1から18のいずれか1項に記載の組成物と、
b)別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とが含まれるキット。
【請求項37】
さらに、キットを織物のデサイジング、または澱粉含有物質で汚された1以上の物品を洗濯または洗浄する際の取扱説明書が含まれている、請求項36に記載のキット。
【請求項1】
a)親AmyS−様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに、検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体と、
b)別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とを含む組成物。
【請求項2】
前記アルファ−アミラーゼ変異体が、親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して下記の性質の1以上が改変されている、請求項1に記載の組成物:(a)正味電荷、(b)基質特異性、(c)基質分解性、(d)基質結合性、(e)熱安定性、(f)1以上のpH域における活性、(g)1以上のpH域における安定性、(h)酸化環境下での安定性、(i)Ca2+要求性、(j)比活性度、(k)触媒反応速度、(1)触媒効率、(m)キレート剤存在下での活性、(n)キレート剤存在下での熱またはpH安定性、(o)デサイジング効果、(p)タンパク質発現系における発現量。
【請求項3】
参照アミラーゼがSEQ ID NO: 1、または2である、請求項1に記載の組成物。
【請求項4】
洗濯、食器または硬質表面洗浄、デサイジング、あるいは繊維または汚れ処理に用いられる製品の一成分である、請求項1に記載の組成物。
【請求項5】
別の酵素が、プロテアーゼ、リパーゼ、アミラーゼ、セルラーゼ、ペルオキシダーゼ、オキシダーゼ、ペクチナーゼ、リアーゼ、クチナーゼ、ラッカーゼ、またはこれらの組合せのいずれかである、請求項1から4のいずれか1項に記載の組成物。
【請求項6】
界面活性剤が非イオン性、アニオン性、カチオン性、または両性イオン性のいずれかである、請求項1から5のいずれか1項に記載の組成物。
【請求項7】
アルファ−アミラーゼ変異体が、S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである、請求項1から6のいずれか1項に記載の組成物。
【請求項8】
アルファ−アミラーゼ変異体の酸化に対する安定性が改変されており、またアルファ−アミラーゼ変異体がさらに、親AmyS−様アルファ−アミラーゼのアミノ酸位置8, 9, 96, 200, 206, 284, 307, 311, 316, 及び438残基を含めてメチオニン残基の1以上の置換または欠失を備え、ここで参照アルファ−アミラーゼがSEQ ID NO: 2である、請求項7に記載の組成物。
【請求項9】
アルファ−アミラーゼ変異体がさらに、参照アルファ−アミラーゼのアミノ酸位置97, 179, 180, 193, 319, 349, 358, 416, 428, または443に対応するアミノ酸位置の1以上において配列修飾を有する、請求項7に記載の組成物。
【請求項10】
アルファ−アミラーゼ変異体が次の位置における置換を1以上備える、請求項9に記載の組成物:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【請求項11】
アルファ−アミラーゼ変異体がN193置換またはV416置換、またはこの両置換を有する、請求項7から10のいずれか1項に記載の組成物。
【請求項12】
アルファ−アミラーゼ変異体がN193F置換またはV416G置換、またはこの両置換を有する、請求項11に記載の組成物。
【請求項13】
アルファ−アミラーゼ変異体が位置F178, R179, G180, l181, G182及びK183 に1以上のアミノ酸欠失を有する、請求項7から12のいずれか1項に記載の組成物。
【請求項14】
アルファ−アミラーゼ変異体が改変された金属イオン依存性、カルシウム無添加時における改変された活性または安定性、またはキレート剤存在下での改変された活性をまたは安定性有する、請求項13に記載の組成物。
【請求項15】
アルファ−アミラーゼ変異体がSEQ ID NO:2に対し少なくとも95%の相同性を有し、アミノ酸配列SEQ ID NO:1から成る参照アルファ−アミラーゼの位置番号242に相当する位置にアミノ酸置換を有するとともに、アルファ−アミラーゼ変異体がアルファ−アミラーゼ活性を有する、請求項1に記載の組成物。
【請求項16】
親AmyS−様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16であり、参照アルファ−アミラーゼがSEQ ID NO: 1 または2である、請求項1に記載の組成物。
【請求項17】
アルファ−アミラーゼ変異体が、親AmyS−様アルファ−アミラーゼに対しpH>約8での洗浄性能が改善されている、請求項1に記載の組成物。
【請求項18】
アルファ−アミラーゼ変異体が次の組み合わされた置換のいずれかを有する、請求項10に記載の組成物:a)Q97E,Q319E,Q358E,Q443E; b) Q97E,Q319R,Q358E,Q443R; c) Q97E,Q319R,Q358E; d) Q97E,Q319R,Q443E; e) Q97E,Q319R,Q443R; f) Q97E,Q358R; g) Q97E,Q443E; h) Q319R,Q358E,Q443E;または i) Q319R,Q358R,Q443E。
【請求項19】
請求項1から18のいずれか1項に記載の組成物、または親AmyS−様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに、検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体であって、参照アミラーゼがSEQ ID NO: 1または2であるアルファ−アミラーゼ変異体のいずれかを含む洗剤用または洗浄剤用処方品。
【請求項20】
アルファ−アミラーゼ変異体が、S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T置換の少なくともいずれか1のS242アルファ−アミラーゼ変異体である、請求項19に記載の洗剤用または洗浄剤用処方品。
【請求項21】
織布工程からの織物のデサイジング方法であって、請求項1から18のいずれか1項に記載の組成物、または親AmyS−様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有するとともに参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有し、検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体と、織物とを、織物からデサイジング剤の少なくとも一部が除去される条件及び時間接触させる工程を含む、デサイジング方法。
【請求項22】
前記アルファ−アミラーゼ変異体が、親AmyS様アルファ−アミラーゼまたは参照アルファ−アミラーゼと比較して下記の性質の1以上が改変されている、請求項21に記載のデサイジング方法:(a)正味電荷、(b)基質特異性、(c)基質分解性、(d)基質結合性、(e)熱安定性、(f)1以上のpH域における活性、(g)1以上のpH域における安定性、(h)酸化環境下での安定性、(i)Ca2+要求性、(j)比活性度、(k)触媒反応速度、(1)触媒効率、(m)キレート剤存在下での活性、(n)キレート剤存在下での熱またはpH安定性、(o)デサイジング効果、(p)タンパク質発現系における発現量。
【請求項23】
親AmyS−様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16であり、参照アルファ−アミラーゼがSEQ ID NO: 1 または2である、請求項21に記載のデサイジング方法。
【請求項24】
アルファ−アミラーゼ変異体が、S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである、請求項21に記載のデサイジング方法。
【請求項25】
アルファ−アミラーゼ変異体が次の位置における置換を1以上備え、参照アルファ−アミラーゼがSEQ ID NO:1または2である、請求項24に記載のデサイジング方法:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【請求項26】
洗濯または洗浄方法であって、親AmyS−様アルファ−アミラーゼに対し少なくとも約95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体を含む組成物、または請求項19に記載の洗剤と、洗濯または洗浄される1以上の物品とを、1以上の物品が洗濯または洗浄される条件及び時間において接触させる工程を含む、洗濯または洗浄方法。
【請求項27】
少なくとも1の物品が少なくとも1の澱粉含有物質で汚されており、この澱粉汚れの除去がアルファ−アミラーゼ変異体によって促進される、請求項26に記載の洗濯または洗浄方法。
【請求項28】
組成物に、別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の1以上がさらに含まれる、請求項26に記載の洗濯または洗浄方法。
【請求項29】
親AmyS−様アルファ−アミラーゼがSEQ ID NO: 1, 2, 6, 7, 8, 9, 10, 11, 12, 15, または16であり、参照アルファ−アミラーゼがSEQ ID NO: 1 または2である、請求項26に記載の洗濯または洗浄方法。
【請求項30】
アルファ−アミラーゼ変異体が、S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q, またはS242T変異体のいずれかである、請求項26に記載の洗濯または洗浄方法。
【請求項31】
アルファ−アミラーゼ変異体が、親AmyS−様アルファ−アミラーゼに対しpH>約8での洗浄性能が改善されている、請求項30に記載の洗濯または洗浄方法。
【請求項32】
アルファ−アミラーゼ変異体が次の位置における置換を1以上備える、請求項30に記載の洗濯または洗浄方法:位置349のシステイン、位置428のステイン、位置97のグルタミン酸、位置97のアルギニン、位置319のグルタミン酸、位置319のアルギニン、位置358のグルタミン酸、位置358のアルギニン、位置443のグルタミン酸、位置443のアルギニン。
【請求項33】
アルファ−アミラーゼ変異体が次の組み合わされた置換のいずれかを有する、請求項32に記載の洗濯または洗浄方法:a)Q97E,Q319E,Q358E,Q443E; b)Q97E,Q319R,Q358E,Q443R; c)Q97E,Q319R,Q358E; d)Q97E,Q319R,Q443E; e)Q97E,Q319R,Q443R; f)Q97E,Q358R; g)Q97E,Q443E; h)Q319R,Q358E,Q443E;または i)Q319R,Q358R,Q443E。
【請求項34】
アルファ−アミラーゼ変異体が位置F178, R179, G180, l181, G182及びK183 に1以上のアミノ酸欠失を有する、請求項30に記載の洗濯または洗浄方法。
【請求項35】
アルファ−アミラーゼ変異体が改変された金属イオン依存性、カルシウム無添加時における改変された活性または安定性、またはキレート剤存在下での改変された活性をまたは安定性有する、請求項34に記載の洗濯または洗浄方法。
【請求項36】
a)親AmyS−様アルファ−アミラーゼに対し少なくとも95%相同のアミノ酸配列を有し、参照アルファ−アミラーゼの位置242に相当するアミノ酸位置に置換を有するとともに検出可能なアルファ−アミラーゼ活性を有する少なくとも1のアルファ−アミラーゼ変異体、または請求項1から18のいずれか1項に記載の組成物と、
b)別の酵素、洗剤、界面活性剤、キレート剤、酸化剤、酸性化剤、アルカリ化剤、過酸化物源、水硬化剤、塩、洗剤複合化剤、ポリマー、安定化剤、及び衣類柔軟剤の内の少なくとも1とが含まれるキット。
【請求項37】
さらに、キットを織物のデサイジング、または澱粉含有物質で汚された1以上の物品を洗濯または洗浄する際の取扱説明書が含まれている、請求項36に記載のキット。
【図2】


【図3】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図4F】


【図4G】


【図4H】


【図4I】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図3】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図4F】


【図4G】


【図4H】


【図4I】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公表番号】特表2011−505121(P2011−505121A)
【公表日】平成23年2月24日(2011.2.24)
【国際特許分類】
【出願番号】特願2010−533079(P2010−533079)
【出願日】平成20年11月3日(2008.11.3)
【国際出願番号】PCT/US2008/012411
【国際公開番号】WO2009/061379
【国際公開日】平成21年5月14日(2009.5.14)
【出願人】(509240479)ダニスコ・ユーエス・インク (81)
【Fターム(参考)】
【公表日】平成23年2月24日(2011.2.24)
【国際特許分類】
【出願日】平成20年11月3日(2008.11.3)
【国際出願番号】PCT/US2008/012411
【国際公開番号】WO2009/061379
【国際公開日】平成21年5月14日(2009.5.14)
【出願人】(509240479)ダニスコ・ユーエス・インク (81)
【Fターム(参考)】
[ Back to top ]

