改変された生分解速度論を有する多孔性構造
生分解性の多孔性の物体、例えば多孔性のケイ素の物体の生分解速度論は、その物体の外側表面上に配置されたポリマー鎖、例えばポリエチレングリコール鎖の分子量により制御することができる。生分解性の多孔性の物体を提供し、それらの生分解速度論はその配置されたポリマー鎖の分子量により制御される。そのような生分解性の多孔性の物体を作る方法、およびそのような生分解性の多孔性の物体を有効薬剤、例えば療法剤および/または造影剤の送達のために用いる方法も提供する。
【発明の詳細な説明】
【技術分野】
【0001】
連邦政府により資金助成された研究に関する記載
本発明の基礎をなすいくつかの研究は、助成金番号SA23−06−017の下でNASAからの、ならびに助成金番号W81XWH−04−2−0035およびW81XWH−07−2−0101の下で国防総省からの政府資金により援助された。米国政府はこの発明において一定の権利を有することができる。
【0002】
分野
本開示は概して有効薬剤、例えば療法または造影剤の送達のための生分解性構造に関し、特に、有効薬剤の送達のための生分解性多孔性構造、例えば生分解性多孔性ケイ素構造ならびにそのような構造を作る、および用いる方法に関する。
【背景技術】
【0003】
多孔性ケイ素(pSi)は1950年代半ばにベル研究所においてUhlirにより発見され、[1](上付き引用に対する説明は“参考文献”の節にある)現在生物医学研究の様々な分野において、生体分子のスクリーニング、[2]光学バイオセンシング(optical biosensing)、[3,4]注入可能なキャリヤーによる薬物送達[5,6]および植え込み可能な仕掛け(device)[7]、ならびに向上した生物学的利用能を有する経口投与される薬物[8]を含む多様な適用で用いられている。既にいくつかのFDAに認可されて市場に出されているpSi技術に基づく製品が存在し、それは眼科学においてそれらの適所を見出しており[9]、放射性32PでドープしたpSiに基づく他の製品が、手術不能肝癌の可能性のある新規の小線源療法処置として現在臨床試験にある[10]。
【0004】
多孔性の物体、例えば多孔性ケイ素の物体が薬物送達の適用において用いられる場合、有効薬剤、例えば療法および/または造影剤はその多孔性の物体の小孔内に捕えられることができる。次いで、時間の経過に伴う多孔性物質の分解により、捕えられた有効薬剤の放出を達成することができる。
【0005】
多孔性の物体、例えば多孔性ケイ素構造は、それらの細孔の内部により小さい粒子(“第2段階粒子)を含むことができるより大きい粒子(“第1段階”粒子)としての多段階薬物送達システムにおける使用に関しても提案された。[6]
典型的な多孔性ケイ素薬物送達構造において、多孔性物質の生分解速度論は主にその多孔性特性、例えば孔径および/または多孔度に依存し[11−13]、従ってそれはその構造の装填容量と結びついている。
【0006】
装填容量および生分解速度論が結びついていない多孔性薬物送達システム、すなわち装填容量および生分解速度論を互いに切り離して制御することができるシステムを開発する必要性が存在する。
【発明の概要】
【0007】
1態様に従って、生分解性の物体は外側表面および前記の外側表面上に配置されたポリマー鎖を有する多孔性の本体を含み、ここでその物体の生分解速度論はその多孔性の本体における孔径およびそのポリマー鎖の分子量により決定される。
【0008】
別の態様に従って、生分解性の物体を作る方法は以下を含む:A)多孔性の本体および外側表面を有する物体を得る、ここで、生分解時間はi)その多孔性の本体の孔径により決定され、ii)望まれる生分解時間の値より小さい;ならびにB)その物体の生分解時間を、その物体の外側表面上にポリマー鎖を配置することにより望まれる生分解時間の値に改変する、ここで、その物体の改変された生分解時間は、その多孔性の本体の孔径およびそのポリマー鎖の分子量により決定される。
【0009】
さらに別の態様に従って、送達方法は対象の体の中に多孔性の本体、外側表面および前記の外側表面の上に配置されたポリマー鎖を含む生分解性の物体を導入することを含み、ここでその物体の生分解速度論はその多孔性の本体における孔径およびそのポリマー鎖の分子量により決定される。
【図面の簡単な説明】
【0010】
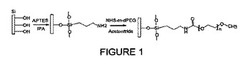
【図1】図1は、多孔性Si粒子のAPTESおよびPEG分子による化学修飾を図式的に説明する。
【図2】図2(A)〜(B)は、ICP−AESにより評価した大きい細孔のPEG化Siマイクロ粒子の分解速度論のグラフを示す。分解速度論のプロフィールは、分解媒体:(A)PBS pH7.2;(B)ウシ胎児血清(FBS)に放出された総Si含有量の百分率として表される。
【図3】図3(A)〜(C) PBS pH7.2中での分解プロセスの間のSi粒子のSEM画像。示されている系:A)APTES粒子;B)PEG861で修飾した粒子;C)PEG5000で修飾した粒子。時点:2、8、18および48時間。
【図4】図4(A)〜(B)は、分解媒体:(A)PBS;(B)FBS中で蛍光定量法により追跡した、粒子表面からの蛍光PEG対低MWプローブの浸食(erosion)のグラフを示す。
【図5】図5(A)〜(B)は、J744マクロファージによるPEG化(5000D)および非PEG化酸化多孔性ケイ素粒子の内在化のSEM画像を示す。
【図6】図6(A)〜(B)は、PEG化および非PEG化粒子と共に保温した後のHUVEC細胞による炎症誘発性サイトカイン(A)IL−6および(B)IL−8の放出を示す。
【図7】図7(A)〜(C)は、THP−1単球のマクロファージへの分化に対するPMA濃度の影響を示す(図7A)。様々な表面修飾を有する多孔性Si粒子と共に保温した後の、分化したTHP−1細胞による炎症誘発性サイトカインIL−6(図7B)およびIL−8(図7C)の放出。
【図8】図8(A)〜(B)は、大きい(30〜40nm)、および小さい(10nm)細孔を有する多孔性ケイ素粒子のPBS、pH7.2中での時間の経過に伴う分解に関する:(A)粒子分解のSEM画像および(B)ICPデータ。
【発明を実施するための形態】
【0011】
関連出願
下記の研究論文および特許文書は本発明を理解するために有用である可能性があり、それらを全て本明細書にそのまま援用する:
1) 2007年10月25日に公開された、PCT公開番号WO 2007/120248;
2) 2008年4月10日に公開された、PCT公開番号WO 2008/041970;
3) 2008年2月21日に公開された、PCT公開番号WO 2008/021908;
4) 2008年5月1日に公開された、米国特許出願公開番号2008/0102030;
5) 2003年6月19日に公開された、米国特許出願公開番号2003/0114366;
6) 2008年8月28日に公開された、米国特許出願公開番号2008/0206344;
7) 2008年11月13日に公開された、米国特許出願公開番号2008/0280140;
8) 2008年12月23日に出願された、PCT特許出願PCT/US2008/014001;
9) Tasciotti E. et al, 2008 Nature Nanotechnology 3, 151 - 157。
【0012】
定義
別途明記しない限り、”a”または”an”は1以上を意味する。
”マイクロ粒子”は、1ミクロンから1000ミクロンまで、または1ミクロンから100ミクロンまでの最大特徴寸法を有する粒子を意味する。”ナノ粒子”は、1ミクロン未満の最大特徴寸法を有する粒子を意味する。
【0013】
”ナノ多孔性(Nanoporous)”または”ナノポア(nanopores)”は、1ミクロン未満の平均寸法を有する細孔を指す。
”生分解性物質”は、生理的媒体、例えばPBSまたは血清中で溶解または分解することができる物質を指す。
【0014】
”生体適合性”は、それが生きた細胞にさらされた際に細胞内で望ましくない作用、例えば細胞の生命周期の変化;炎症誘発性サイトカインの放出;細胞の増殖速度の変化および細胞毒性作用を引き起こすことなく細胞の適切な細胞活動を維持するであろう物質を指す。
【0015】
APTESは3−アミノプロピルトリエトキシシランを表す。
PEGはポリエチレングリコールを指す。
ICP−AESは誘導結合プラズマ−原子発光分光法を表す。
【0016】
PBSはリン酸緩衝生理食塩水を表す。
FBSはウシ胎児血清を表す。
SEMは走査型電子顕微鏡を表す。
【0017】
HUVECはヒト臍帯静脈内皮細胞を表す。
PMAはホルボールミリステートアセテートを表す。
MWは分子量を表す。
【0018】
生分解速度論は、生分解プロセスの時間経過を指す。生分解性の物体の生分解速度論は、その中でその生分解プロセスが起こる個々の生理的媒体に依存し得る。異なる物体に関する生分解速度論の間の比較は、同じ生理的媒体に関してなされるべきである。
【0019】
生分解速度論は、生分解速度論プロフィールとして図表で表すことができる。
生分解時間は、生分解性の物体が個々の生理的媒体中で完全に分解するのに必要な時間を指す。
【0020】
装填容量または装填効率は、多孔性の物体の細孔中に含まれることができる装填物の量を指す。
生理的条件は、標準状態にある哺乳類の体、例えば人体中の血漿の条件に近い条件、例えば温度、モル浸透圧濃度、pHおよび動きを表す。
【0021】
開示
本発明者らは、多孔性の生分解性の物体、例えば多孔性インプラントまたは多孔性粒子の表面修飾はその物体の生分解速度論を制御するために用いることができることを発見した。従って、その物体の生分解速度論をその物体の多孔性特性、すなわち多孔度および/または孔径から、従ってその物体の装填容量から切り離すことができる。言い換えると、その物体の装填容量を実質的に変化させること無くその物体の生分解速度論を改変することができる。
【0022】
表面修飾は、その物体の外側表面の修飾を指す可能性がある。表面修飾は、生分解性の多孔性の物体の外側表面上にポリマー鎖、例えば親水性ポリマー鎖を配置することにより実施することができる。
【0023】
従って、1態様は生分解性の多孔性の物体、例えば多孔性インプラントまたは多孔性粒子であることができ、それはその多孔性特性により決定される生分解速度論とは異なる生分解速度論を有することができる。
【0024】
生分解性の多孔性の物体は、外側表面およびその外側表面上に配置されたポリマー鎖、好ましくは親水性ポリマー鎖を有する多孔性の本体を含むことができる。その物体は、その生分解速度論が事実上その多孔性の本体の孔径(または多孔度)およびその物体上に配置されたポリマー鎖の分子量により決定されるようなものであることができる。言い換えると、そのポリマー鎖の分子量は、その配置されたポリマー鎖が、配置されたポリマー鎖を持たない、他の点では類似した多孔性の物体の生分解速度論と比較してその物体の生分解速度論を改変するようなものである。
【0025】
別の態様は、望ましい生分解速度論または時間を有する生分解性の物体を作る方法であることができる。その方法は、望まれる生分解時間または速度論を選択する;それの多孔性特性、すなわちそれの孔径および/または多孔度により決定されるそれの生分解時間(この分解時間は望まれる生分解時間よりも短い)を有する最初の多孔性の物体を得る;およびその物体の外側表面上にポリマー鎖を配置し、それにより物体の生分解時間を望まれる値に改変することを含むことができる。その改変された生分解時間は、事実上その多孔性の本体の多孔性特性、すなわち孔径および/または多孔度および配置されたポリマー鎖の分子量の組み合わせにより決定されることができる。
【0026】
改変された生分解速度論
表面修飾、例えばポリマー鎖の堆積は、その生分解性の多孔性の物体の生分解を妨げる、すなわちその物体の生分解時間を表面修飾無しの他の点では類似した生分解性の多孔性の物体と比較して増大させることができる。例えば、5から200nmまで、または5から150nmまで、または5から120nmまで、または10から100nmまで、または10から80nmまで、または20から70nmまで、または25から60nmまで、または30nmから50nmまで、またはこれらの範囲内のあらゆる整数の平均孔径を有する多孔性ケイ素の物体に関して、生理的条件における生分解時間は少なくとも24時間、または少なくとも36時間、または少なくとも48時間、または少なくとも60時間、または少なくとも72時間、または少なくとも84時間、または少なくとも96時間、または少なくとも108時間、または少なくとも120時間、または少なくとも132時間、または少なくとも144時間、または少なくとも156時間、または少なくとも168時間、または少なくとも180時間、または少なくとも192時間であることができる。
【0027】
表面修飾、例えばポリマー鎖の堆積は不均一な生分解プロフィールをもたらすことができ、それは分解した物質が第1期間の間に、分解した物質が第2期間の間に放出される速度とは異なる速度で放出されるような第1期間および第2期間を含むことができる。その不均一なプロフィールは、異なる放出速度を有する2個より多くの期間を含むことができる。ある場合において、その不均一なプロフィールはa)その生分解性の物体が生理的媒体中に導入された際に始まり、その間に分解が起こらない、または実質的に分解が起こらないような第1期間;b)その間にその物体の実質的な分解が起こる第2期間を含むことができる。一部の態様において、分解が起こらない、または実質的に分解が起こらないその第1期間は、5から200nmまで、または5から150nmまで、または5から120nmまで、または10から100nmまで、または10から80nmまで、または20から70nmまで、または25から60nmまで、または30nmから50nmまで、またはこれらの範囲内のあらゆる整数の平均孔径を有する多孔性ケイ素の物体に関して、生理的条件において、少なくとも6時間、または少なくとも12時間、または少なくとも15時間、または少なくとも18時間であることができる。
【0028】
ポリマー鎖
生分解性の多孔性の物体の外側表面上に配置されたポリマー鎖は、好ましくは親水性ポリマー鎖、例えばポリエチレングリコール類(PEG類)または合成グリコカリックス(glycocalix)鎖である。先行技術において、PEG類は主に古典的な薬物送達システム、すなわち非多孔性システムにおいて、および医薬剤形において、細網内皮系(RES)の取込みを避けるために、従って生体内分布および循環時間を制御するために用いられる。[13]PEG類はFDAにより食品、化粧品ならびに注射用、局所用、直腸内、および経鼻配合物を含む医薬における使用に関して認可されている。PEG分子はほとんど毒性を示さず、代謝されること無く、30kDa未満のPEG類に関しては腎臓、またはより長いPEG類に関しては便中でのどちらかにより体から排除される。
【0029】
より重い分子量のポリマー鎖は、多孔性の生分解性物質の生分解に、より低い分子量よりも強く影響を与えることができる。その配置された鎖がそれに関してその生分解性の多孔性の物体の生分解速度論を有効に改変し始めるポリマー鎖の分子量の個々の値は、その多孔性の物体の孔径を含むいくつかの要素に依存する可能性がある。例えば、25から60nmの範囲の平均孔径を有する多孔性ケイ素の物体に関して、その物体上に配置された場合に生分解速度論を改変することができるポリマー鎖は、400より小さくない、または800より小さくない、または800から30,000まで、または800から20,000まで、または800から10,000まで、または800から7000まで、または1000から6000まで、または2000から6000まで、または3000から6000まで、またはこれらの範囲の間のあらゆる整数の分子量を有する。
【0030】
ポリマー鎖は生分解性の多孔性の物体の外側表面に共有結合させることができる。その物体の表面物質が、多孔性ケイ素の生分解性の物体の場合の酸化ケイ素のように酸化物を含む場合、そのポリマー鎖はシラン化学を用いて結合させることができる。例えば、まずアミノシラン、例えば3−アミノプロピルトリエトキシシラン(APTES)を外側表面上に配置することができ、次いでスクシンイミジル−エステル(SCM)で終結するポリマー鎖をそのアミノシランのアミノ基に結合させることができる。ポリマー鎖の共有結合のためにSCM−アミン以外のカップリング化学を用いることもできる。
【0031】
標的化部分(Targeting moieties)
その多孔性の物体が多孔性粒子である場合、その外側表面は1個以上の標的化部分、例えばデンドリマー、抗体、アプタマー(それはチオアプタマーであることができる)、結合基、例えばE−セレクチンもしくはP−セレクチン、または生体分子、例えばRGDペプチドを含むことができる。その標的化部分は、その粒子を対象の体内の特定の部位に向ける、および/または局在させるために用いることができる。その標的化される部位は脈管構造部位であることができる。一部の態様において、その脈管構造部位は腫瘍の脈管構造、例えば血管新生の脈管構造、組み込まれた(coopted)脈管構造または再正常化された脈管構造であることができる。
【0032】
標的化の選択性は、その粒子の表面の化学的部分を変更することにより調整することができる。例えば、組み込まれた脈管構造は、アンジオポエチン2に対する抗体を用いて特異的に認識することができ;血管新生の脈管構造は、血管内皮成長因子(VEGF)、塩基性線維芽細胞成長因子(FGFb)またはαvβ3インテグリンのような内皮マーカーに対する抗体を使用して認識することができ、一方、再正常化された脈管構造は、癌胎児抗原関連細胞接着分子1(carcinoembionic antigen−related vell adhesion molecule 1)(CEACAM1)、エンドセリン−B受容体(ET−B)、血管内皮成長因子阻害剤グラビン(gravin)/AKAP12、プロテインキナーゼAおよびプロテインキナーゼCに関する足場形成(scallofldoing)タンパク質を用いて認識することができる;例えばRobert S. Korbel “抗血管新生療法:癌に関する普遍的な化学増感戦略?”, Science 2006年5月26日, vol 312, no. 5777, 1171-1175を参照。
【0033】
一部の態様において、その標的化部分はその粒子の表面に共有結合的に、または非共有結合的に直接結合させることができる。さらに、一部の態様において、その標的化部分はその粒子の外側表面上に配置されたポリマー鎖に共有結合的に、または非共有結合的に結合させることができる。
【0034】
多孔性の物体
多孔性の物体は多孔性インプラントまたは多孔性粒子であることができる。
多孔性インプラントは様々な形状および大きさを有することができる。多孔性インプラントの寸法は特に限定されておらず、適用に依存する。一部の態様において、多孔性インプラントは0.1mmより小さくない、または0.2mmより小さくない、0.2mmより小さくない、または0.3mmより小さくない、または0.5mmより小さくない、または1.0mmより小さくない、または2mmより小さくない、または5mmより小さくない、または10mmより小さくない、または20mmより小さくない最小寸法を有することができる。一部の態様において、多孔性インプラントは0.1mmより小さくない、または0.2mmより小さくない、0.2mmより小さくない、または0.3mmより小さくない、または0.5mmより小さくない、または1.0mmより小さくない、または2mmより小さくない、または5mmより小さくない、または10mmより小さくない、または20mmより小さくない少なくとも2つの寸法を有することができる。多孔性ケイ素のインプラントは例えばWO99/53898において開示されており、それをそのまま本明細書に援用する。
【0035】
多孔性粒子も様々な形状および大きさを有することができる。多孔性粒子の寸法は特に限定されておらず、適用に依存する。例えば、脈管内投与に関して、その粒子の最大特徴寸法は、ヒトに関しては約4〜5ミクロンである対象中の最も小さい毛細血管の半径よりも小さいことが可能である。一部の態様において、多孔性粒子の最大特徴寸法は約100ミクロンよりも小さくてよく、または約50ミクロンよりも小さくてよく、または約20ミクロンよりも小さくてよく、または約10ミクロンよりも小さくてよく、または約5ミクロンよりも小さくてよく、または約4ミクロンよりも小さくてよく、または約3ミクロンよりも小さくてよく、または約2ミクロンよりも小さくてよく、または約1ミクロンよりも小さくてよい。さらに、一部の態様において、多孔性粒子の最大特徴寸法は100nmから3ミクロンまで、または200nmから3ミクロンまで、または500nmから3ミクロンまで、または700nmから2ミクロンまでであってよい。
【0036】
さらに、一部の態様において、多孔性粒子の最大特徴寸法は約2ミクロンよりも大きくてよく、または約5ミクロンよりも大きくてよく、または約10ミクロンよりも大きくてよい。
【0037】
多孔性粒子の形状は特に限定されていない。一部の態様において、その粒子は球形粒子であることができる。さらに、一部の態様において、その粒子は非球形粒子であることができる。一部の態様において、その粒子は対称的な形状を有していることができる。さらに、一部の態様において、その粒子は非対称な形状を有していることができる。
【0038】
一部の態様において、その粒子は、その粒子と標的部位の表面、例えば炎症を起こした脈管構造の内皮表面の間の接触を促進するように形作られた、選択された非球形の形状を有していることができる。適切な形状の例には偏球、円盤、または円柱が含まれるが、それらに限定されない。一部の態様において、その粒子は、それの外側表面の一部のみがその粒子と標的部位の表面、例えば内皮表面の間の接触を促進するように形作られた形状を定め、一方で外側表面の残りの部分はそれを定めないようなものであることができる。例えば、その粒子は切り詰められた偏球形粒子であることができる。
【0039】
その粒子と標的部位の表面の間の接触を促進することができる粒子の寸法および形状は、米国特許出願公開番号2008/0206344および2008年7月29日に出願された米国出願番号12/181,759において開示されている方法を用いて評価することができる。
【0040】
多孔性物質
多孔性の物体、例えばインプラントまたは粒子は、多孔性物質を含む。多くの態様において、その多孔性物質はポリマーではない多孔性物質、例えば多孔性酸化物物質または多孔性のエッチングされた物質であることができる。多孔性酸化物物質の例には、多孔性酸化ケイ素、多孔性酸化アルミニウム、多孔性酸化チタンおよび多孔性酸化鉄が含まれるが、それらに限定されない。用語“多孔性のエッチングされた物質”は、細孔が湿式エッチングの技法、例えば電気化学エッチングにより導入された物質を指す。多孔性のエッチングされた物質の例には、多孔性半導体物質、例えば多孔性ケイ素、多孔性ゲルマニウム、多孔性GaA類、多孔性InP、多孔性SiC、多孔性SixGe1−x、多孔性GaP、多孔性GaNが含まれる。多孔性のエッチングされた粒子を作る方法は、例えば米国特許出願公開番号2008/0280140において開示されている。
【0041】
多くの態様において、その多孔性の物体はナノ多孔性の物体であることができる。
一部の態様において、その多孔性の物体の平均孔径は、約1nmから約1ミクロンまで、または約1nmから約800nmまで、または約1nmから約500nmまで、または約1nmから約300nmまで、または約1nmから約200nmまで、または約2nmから約100nmまで、またはこれらの範囲内のあらゆる整数であってよい。
【0042】
一部の態様において、その多孔性の物体の平均孔径は、1ミクロンより大きくない、または800nmより大きくない、または500nmより大きい、または300nmより大きい、または200nmより大きくない、または100nmより大きくない、または80nmより大きくない、または50nmより大きくないことが可能である。
【0043】
一部の態様において、その多孔性の物体の平均孔径は、約5から200nmまで、または5から150nmまで、または5から120nmまで、または10から100nmまで、または10から80nmまで、または20から70nmまで、または25から60nmまで、または30nmから50nmまで、またはこれらの範囲内のあらゆる整数の大きさであることができる。
【0044】
一部の態様において、その多孔性粒子の平均孔径は、約3nmから約10nmまで、または約3nmから約10nmまで、または約3nmから約7nmまで、またはこれらの範囲内のあらゆる整数であることができる。
【0045】
一般に、孔径はN2吸着/脱着および顕微鏡法、例えば走査電子顕微鏡法を含むいくつかの技法を用いて決定されてよい。
一部の態様において、その多孔性粒子の細孔は線状の細孔であってよい。さらに、一部の態様において、その多孔性粒子の細孔はスポンジ様の細孔であってよい。
【0046】
多孔性ケイ素粒子およびそれらの製作の方法は、例えばCohen 15 M. H. et al Biomedical Microdevices 5:3, 253-259, 2003;米国特許出願公開番号2003/0114366;米国特許第6,107,102号および第6,355,270号;米国特許出願公開番号2008/0280140;PCT公開番号WO 2008/021908;Foraker, A.B. et al. Pharma. Res. 20 (1), 110-116 (2003); Salonen, J. et al. Jour. Contr. Rel. 108, 362-374 (2005)において開示されている。多孔性酸化ケイ素粒子およびそれらの製作の方法は、例えばPaik J. A. et al. J. Mater. Res., Vol 17, Aug 2002, p. 2121において開示されている。
【0047】
製作
多孔性の物体、例えば多孔性インプラントまたは多孔性粒子は、多くの技法を用いて調製されてよい。
【0048】
例えば、一部の態様において、その多孔性の物体はトップダウン(top−down)で製作された物体、すなわちトップダウンのマイクロ製作またはナノ製作技法、例えばフォトリソグラフィー、電子ビームリソグラフィー、X線リソグラフィー、深紫外リソグラフィー、ナノインプリントリソグラフィーまたは浸漬ペンナノリソグラフィーを利用して製造された物体であってよい。その製作法は、寸法が均一、または実質的に同一である多孔性粒子のスケールアップ製造を可能とすることができる。
【0049】
生体適合性
改変された生分解速度論を有する生分解性の多孔性の物体は、生体適合性であることができる。特に、その改変された生分解速度論を有する生分解性の多孔性の物体は、それらが生分解の間にIL−6およびIL−8のような炎症誘発性サイトカインの放出を誘導しないようなものであることができる。
【0050】
装填
有効薬剤および/またはより小さい粒子を、米国特許出願番号US2008280140および20030114366において;PCT公開番号WO20080219082およびWO99/53898において開示されている方法を含む多くの方法を用いてその生分解性の多孔性の物体の細孔の中に装填することができる。
【0051】
適用
改変された生分解速度論を有する生分解性の多孔性の物体は、医薬、化粧、医学、獣医学、診断および研究の適用のために用いることができる。例えば、その生分解性の多孔性の物体は、対象の体内に導入された際に、有効薬剤、例えば療法剤および/または造影剤を送達するために用いることができ、それは例えば哺乳類、例えばヒトであることができる。従って、その生分解性の物体は、対象において疾患または病気を処置する、予防する、または監視するために用いることができる。個々の疾患/病気は個々の有効薬剤に依存することができる。疾患/病気の限定的で無い例には、癌および炎症、神経変性疾患、皮膚障害、心臓血管の病気、内分泌学的障害、妊娠、糖尿病、感染性の(例えば微生物、寄生生物、真菌による)疾患が含まれる。
【0052】
一部の態様において、その有効薬剤は多孔性の本体の細孔の内部に含まれていることができる。例えば、その有効薬剤は特異的および/または非特異的相互作用によりその細孔の内部に捕えられた化学分子であることができる。
【0053】
一部の態様において、その生分解性の多孔性の物体の細孔は、有効薬剤を含むことができるより小さい大きさの粒子を含むことができる。そのような場合、その生分解性の多孔性の物体は、例えば米国特許出願番号US2008280140において、およびPCT公開番号WO2008021908において開示されているタイプのような多段階薬物送達システムの一部であることができる。
【0054】
一部の態様において、その多孔性の物体の多孔性の本体は有効薬剤を含むことができる。例えば、その多孔性の物体の多孔性の本体は放射性物質で作られていることができる。そのような放射性の多孔性の物体は癌、例えば乳癌、前立腺癌、子宮頚癌、肝癌、リンパ腫、卵巣癌およびメラノーマの放射線療法処置のために用いることができる。放射性の多孔性の物体の1つの限定的で無い例は、放射性32Pでドープした多孔性ケイ素であることができる。
【0055】
有効薬剤
有効薬剤は療法剤、造影剤またはそれらの組み合わせであることができる。有効薬剤の選択は個々の適用に依存する。
【0056】
療法剤
療法剤は、動物、例えば哺乳類またはヒトの標的部位において望まれる生物学的作用をもたらすことのできるあらゆる生理的に、または薬理学的に活性な物質であってよい。療法剤は、限定するわけでは無いが、ペプチド、タンパク質、siRNA、miRNAおよびDNAを含む核酸、ポリマーならびに小さい分子を含むあらゆる無機または有機化合物であってよく、そのいずれも特徴付けられていてよく、または特徴付けられていなくてよい。療法剤は様々な形、例えば未変化の分子、分子複合体、薬理学的に許容できる塩、例えば塩酸塩、臭化水素酸塩、硫酸塩、ラウリン酸塩、パルミチン酸塩、リン酸塩、亜硝酸塩、硝酸塩、ホウ酸塩、酢酸塩、マレイン酸塩、酒石酸塩、オレイン酸塩、サリチル酸塩、および同様のものであってよい。酸性の療法剤に関して、金属、アミンまたは有機陽イオン、例えば第四級アンモニウムの塩を用いることができる。薬物の誘導体、例えば塩基、エステルおよびアミドを療法剤として用いることもできる。水に不溶性である療法剤は、その水溶性誘導体である形で、またはその塩基誘導体(base derivative)として用いることができ、それはいずれの場合でも、またはその送達により、酵素により変換されて、体のpHにより、もしくは他の代謝プロセスにより加水分解されて、その本来の療法上有効な形になる。
【0057】
療法剤の例には、抗癌剤、例えば抗増殖剤、抗血管新生剤;抗マラリア剤;OTC薬物、例えば下熱剤、麻酔薬、咳止め薬;抗感染剤;駆虫薬(antiparasites)、例えば抗マラリア剤、例えばジヒドロアルテミシン(Dihydroartemisin);抗生物質、例えばペニシリン類、セファロスポリン類、マクロライド類、テトラサイクリン類、アミノグリコシド類、抗結核剤;抗真菌/抗カビ剤;遺伝分子、例えばアンチセンスオリゴヌクレオチド類、核酸類、オリゴヌクレオチド類、DNA、RNA;抗原虫剤;抗ウイルス剤、例えばアシクロビル(acyclovir)、ガンシクロビル(ganciclovir)、リバビリン(ribavirin)、抗HIV剤、抗肝炎剤;抗炎症剤、例えばNSAID類、ステロイド系薬剤、カンナビノイド類;抗アレルギー剤、例えば抗ヒスタミン薬、フェキソフェナジン(fexofenadine));気管支拡張薬;ワクチンまたは免疫原性薬剤、例えば破傷風トキソイド、減量ジフテリアトキソイド、無細胞百日咳ワクチン、おたふくかぜ(mums)ワクチン、天然痘ワクチン、抗HIVワクチン、肝炎ワクチン、肺炎ワクチン、インフルエンザワクチン;局所麻酔薬を含む麻酔薬;解熱薬、例えばパラセタモール、イブプロフェン、ジクロフェナク、アスピリン;重篤な事象、例えば心臓血管の発作(attacks)、発作(seizures)、低血糖症の処置のための薬剤;制吐薬および抗嘔吐剤;免疫調節薬および免疫賦活薬;心臓血管用薬物、例えばベータ−遮断薬、アルファ−遮断薬、カルシウムチャンネル遮断薬;ペプチドおよびステロイドホルモン類、例えばインスリン、インスリン誘導体、インスリンデテミール、インスリン単量体、オキシトシン、LHRH、LHRH類似体、副腎皮質刺激ホルモン、ソマトロピン、ロイプロリド、カルシトニン、副甲状腺ホルモン、エストロゲン類、テストステロン、副腎皮質ステロイド類、メゲストロール、プロゲステロン、性ホルモン類、成長ホルモン類、成長因子;ペプチドおよびタンパク質関連薬物、例えばアミノ酸、ペプチド、ポリペプチド、タンパク質;ビタミン類、例えばビタミンA、B群からのビタミン類、葉酸、Vit C、Vit D、Vit E、Vit K、ナイアシン、Vit Dの誘導体;自律神経系薬物;受精剤(fertilizing agents);抗うつ薬、例えばブスピロン(buspirone)、ベンラファキシン(venlafaxine)、ベンゾジアゼピン類、選択的セロトニン再取り込み阻害薬(SSRI)、セルトラリン(sertraline)、シタロプラム(citalopram)、3環系抗うつ薬、パロキセチン(paroxetine)、トラゾドン(trazodone)、リチウム、ブプロピオン(bupropion)、セルトラリン、フルオキセチン(fluoxetine);禁煙のための薬剤、例えばブプロピオン、ニコチン;脂質低下剤、例えば3 ヒドロキシ−3−メチルグルタリル補酵素A(HMG−CoA)レダクターゼの阻害剤、シンバスタチン(simvastatin)、アトルバスタチン(atrovastatinl);CNSまたは脊髄のための薬剤、例えばベンゾジアゼピン類、ロラゼパム、ヒドロモルホン、ミダゾラム(midazolam)、アセトアミノフェン、4’−ヒドロキシアセトアニリド、バルビツレート類、麻酔薬;抗てんかん剤、例えばバルプロ酸(valproic acid)およびその誘導体、カルバマゼピン(carbamazepin);アンギオテンシン拮抗薬、例えばバルサルタン(valsartan);抗精神病剤および抗統合失調症剤、例えばクエチアピン(quetiapine)、リスペリドン(risperidone);パーキンソン症候群の処置のための薬剤、例えばL−ドーパおよびその誘導体、トリヘキシフェニジル;抗アルツハイマー病剤、例えばコリンエステラーゼ阻害剤、ガランタミン(galantamine)、リバスチグミン(rivastigmine)、ドネペジル(donepezil)、タクリン、メマンチン(memantine)、N−メチル−D−アスパラギン酸(NMDA)拮抗薬;インスリン非依存性糖尿病の処置のための薬剤、例えばメトホルミン(metformine)、勃起不全に対する薬剤、例えばシルデナフィル(sildenafil)、タダラフィル(tadalafil)、パパベリン(papaverine)、バルデナフィル(vardenafil)、PGE1;プロスタグランジン類;膀胱機能不全に関する薬剤、例えばオキシブチニン、臭化プロパンテリン、トロスピウム、コハク酸ソリフェナシン;更年期症候群の処置のための薬剤、例えばエストロゲン類、非エストロゲン化合物、閉経後の女性におけるのぼせの処置のための薬剤;原発性または続発性性腺機能低下の処置のための薬剤、例えばテストステロン;サイトカイン類、例えばTNF、インターフェロン類、IFN−アルファ、IFN−ベータ、インターロイキン類;CNS刺激薬;筋弛緩薬;抗麻痺ガス剤;麻薬および拮抗薬、例えばオピエート類、オキシコドン;鎮痛剤、例えばオピエート類、エンドルフィン類、トラマドール、コデイン、NSAID類、ガバペンチン;催眠薬、例えばゾルピデム(Zolpidem)、ベンゾジアゼピン類、バルビツレート類、ラメルテオン(ramelteon);ヒスタミン類および抗ヒスタミン薬;抗片頭痛薬、例えばイミプラミン、プロプラノロール、スマトリプタン(sumatriptan);診断用薬剤、例えばフェノールスルホンフタレイン、色素T−1824、生体染色色素(Vital Dyes)、フェロシアン化カリウム、セクレチン、ペンタガストリン、セルレイン;局所用うっ血除去薬または抗炎症剤;抗にきび剤、例えばレチノイン酸誘導体、ドキシシリン(doxicillin)、ミノサイクリン;ADHD関連薬剤、例えばメチルフェニデート、デクスメチルフェニデート、デキストロアンフェタミン、d−およびl−アンフェタミンのラセミ混合物、ペモリン;利尿剤;抗骨粗鬆症剤、例えばビスホスホネート類、アレンドロネート(aledronate)、パミドロネート(pamidronate)、チルホスチン類(tirphostins);骨形成剤;抗喘息剤;抗けいれん剤(anti−Spasmotic agents)、例えばパパベリン;多発性硬化症および他の神経変性障害の処置のための薬剤、例えばミトキサントロン、グラチラマーアセテート、インターフェロンベータ−1a、インターフェロンベータ−1b;葉(leave)、根、花、種子、茎または枝の抽出物からの植物由来の薬剤。
【0058】
療法剤は、化学療法剤、免疫抑制剤、サイトカイン、細胞毒性剤、核酸分解化合物、放射性同位体、受容体、およびプロドラッグ活性化酵素であることができ、それは天然に存在するもの、または合成もしくは組換え法により製造されるもの、またはそれらのあらゆる組み合わせであってよい。
【0059】
古典的な多剤耐性により影響を受ける薬物、例えばビンカアルカロイド類(例えばビンブラスチンおよびビンクリスチン)、アントラサイクリン類(例えばドキソルビシンおよびダウノルビシン)、RNA転写阻害剤(例えばアクチノマイシン−D)および微小管安定化薬(例えばパクリタキセル)は、療法剤として特定の有用性を有する可能性がある。
【0060】
癌化学療法剤は好ましい療法剤である可能性がある。有用な癌化学療法薬には、ナイトロジェンマスタード類、ニトロソ尿素類、エチレンイミン、アルカンスルホネート類、テトラジン、白金化合物、ピリミジン類似体、プリン類似体、代謝拮抗薬、葉酸類似体、アントラサイクリン類、タキサン類、ビンカアルカロイド類、トポイソメラーゼ阻害剤およびホルモン剤が含まれる。代表的な化学療法薬は、アクチノマイシン−D、アルケラン、Ara−C、アナストロゾール(Anastrozole)、アスパラギナーゼ、BiCNU、ビカルタミド(Bicalutamide)、ブレオマイシン、ブスルファン、カペシタビン(Capecitabine)、カルボプラチン、カルボプラチナ(Carboplatinum)、カルムスチン、CCNU、クロラムブシル、シスプラチン、クラドリビン(Cladribine)、CPT−11、シクロホスファミド、シタラビン、シトシンアラビノシド、シトキサン、ダカルバジン、ダクチノマイシン、ダウノルビシン、デクスラゾキサン(Dexrazoxane)、ドセタキセル、ドキソルビシン、DTIC、エピルビシン、エチレンイミン、エトポシド、フロクスウリジン、フルダラビン、フルオロウラシル、フルタミド、ホテムスチン、ゲムシタビン、ハーセプチン、ヘキサメチルアミン、ヒドロキシ尿素、イダルビシン、イホスファミド、イリノテカン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、メトトレキセート、マイトマイシン、ミトタン、ミトキサントロン、オキサリプラチン、パクリタキセル、パミドロネート、ペントスタチン、プリカマイシン、プロカルバジン、リツキシマブ、ステロイド類、ストレプトゾシン、STI−571、ストレプトゾシン、タモキシフェン、テモゾロミド、テニポシド、テトラジン、チオグアニン、チオテパ、Tomudex、トポテカン、トレオスルファン(Treosulphan)、トリメトレキセート、ビンブラスチン、ビンクリスチン、ビンデシン、ビノレルビン、VP−16、およびゼローダである。
【0061】
有用な癌化学療法薬には以下のものも含まれる:アルキル化剤、例えばチオテパおよびシクロスホスファミド(cyclosphosphamide);アルキルスルホネート類、例えばブスルファン、インプロスルファンおよびピポスルファン;アジリジン類、例えばベンゾドーパ(Benzodopa)、カルボコン、メツレドーパ(Meturedopa)、およびウレドーパ(Uredopa);アルトレタミン、トリエチレンメラミン、トリエチレンホスホルアミド、トリエチレンチオホスホルアミド(triethylenethiophosphaoramide)およびトリメチロールメラミン(trimethylolomelamine)を含むエチレンイミン類およびメチルメラミン類(methylamelamine);ナイトロジェンマスタード類、例えばクロラムブシル、クロルナファジン、コロホスファミド(Cholophosphamide)、エストラムスチン、イホスファミド、メクロレタミン、メクロレタミンオキシド塩酸塩、メルファラン、ノベムビエヒン(Novembiehin)、フェネステリン、プレドニムスチン、トロホスファミド、ウラシルマスタード;ニトロ尿素類、例えばカンヌスチン(Cannustine)、クロロゾトシン、ホテムスチン、ロムスチン、ニムスチン、およびラニムスチン;抗生物質、例えばアクラシノマイシン類(Aclacinomysins)、アクチノマイシン、オースラマイシン(Authramycin)、アザセリン、ブレオマイシン類、カクチノマイシン、カリケアミシン、カラビシン、カルミノマイシン、カルジノフィリン、クロモイニシン類(Chromoinycins)、ダクチノマイシン、ダウノルビシン、デトルビシン、6−ジアゾ−5−オキソ−L−ノルロイシン、ドキソルビシン、エピルビシン、エソルビシン、イダムビシン(Idambicin)、マルセロマイシン、マイトマイシン類、ミコフェノール酸、ノガラマイシン、オリボマイシン類、ペプロマイシン、ポトフィロマイシン、ピューロマイシン、クエラマイシン、ロドルビシン、ストレプトニグリン、ストレプトゾシン、ツベルシジン、ウベニメクス、ジノスタチン、およびゾルビシン;代謝拮抗薬、例えばメトトレキセートおよび5−フルオロウラシル(5−FU);葉酸類似体、例えばデノプテリン、メトトレキセート、プテロプテリン、およびトリメトレキセート;プリン類似体、例えばフルダラビン、6−メルカプトプリン、チアミプリン、およびチオグアニン;ピリミジン類似体、例えばアンシタビン、アザシチジン、6−アザウリジン、カルモフール、シタラビン、ジデオキシウリジン、ドキシフルリジン、エノシタビン、フロクスウリジン、および5−FU;アンドロゲン類、例えばカルステロン、ドロモスタノロンプロピオネート、エピチオスタノール、ルネピチオスタン(Rnepitiostane)、およびテストラクトン;抗副腎薬(anti−adrenals)、例えばアミノグルテチミド、ミトタン、およびトリロスタン;葉酸補充物質(replenisher)、例えばフロリン酸(frolinic acid);アセグラトン;アルドホスファミドグリコシド;アミノレブリン酸;アムサクリン;ベストラブシル;ビサントレン;エダトラキセート;デフォファミン(Defofamine);デメコルシン(Demecolcine);ジアジコン(Diaziquone);エルフォルニチン(elfornithine);酢酸エリプチニウム(elliptinium);エトグルシド(Etoglucid);硝酸ガリウム;ヒドロキシ尿素;レンチナン;ロニダミン(Lonidamine);ミトグアゾン(Mitoguazone);ミトキサントロン;モピダモール(Mopidamol);ニトラクリン(Nitracrine);ペントスタチン;フェナメット(Phenamet);ピラルビシン;ポドフィリン酸(podophyllinic acid);2−エチルヒドラジド;プロカルバジン;PSK(登録商標);ラゾキサン(Razoxane);シゾフィラン;スピロゲルマニウム(Spirogermanium);テヌアゾン酸(tenuazonic acid);トリアジコン(triaziquone);2,2’,2’’−トリクロロトリエチルアミン;ウレタン;ビンデシン;ダカルバジン;マンノムスチン;ミトブロニトール;ミトラクトール;ピポブロマン(Pipobroman);ガシトシン(Gacytosine);アラビノシド(“Ara−C”);シクロホスファミド;チオテパ;タキソイド類、例えばパクリタキセル(TAXOL(登録商標)、Bristol−Myers Squibb Oncology、ニュージャージー州プリンストン)およびドキセタキセル(TAXOTERE(登録商標)、Rhone−Poulenc Rorer、アントニー、フランス);クロラムブシル;ゲムシタビン;6−チオグアニン;メルカプトプリン;メトトレキセート;白金類似体、例えばシスプラチンおよびカルボプラチン;ビンブラスチン;白金;エトポシド(VP−16);イホスファミド;マイトマイシンC;ミトキサントロン;ビンクリスチン;ビノレルビン;ナベルビン;ノバントロン;テニポシド;ダウノマイシン;アミノプテリン;ゼローダ;イバンドロネート;CPT−11;トポイソメラーゼ阻害剤RFS2000;ジフルオロメチルオルニチン(DMFO);レチノイン酸;エスペラミシン類;カペシタビン;ならびに上記のいずれかの医薬的に許容できる塩類、酸または誘導体。腫瘍へのホルモン作用を制御または阻害するように作用する抗ホルモン剤、例えばタモキシフェン、ラロキシフェン、アロマターゼ阻害性4(5)−イミダゾール類、4ヒドロキシタモキシフェン、トリオキシフェン、ケオキシフェン、オナプリストン、およびトレミフェン(フェアストン)を含む抗エストロゲン薬;ならびに抗アンドロゲン薬、例えばフルタミド、ニルタミド、ビカルタミド、ロイプロリド、およびゴセレリン;ならびに上記のいずれかの医薬的に許容できる塩類、酸または誘導体も含まれる。
【0062】
サイトカイン類も治療剤として用いることができる。そのようなサイトカイン類の例は、リンホカイン類、モノカイン類、および伝統的なポリペプチドホルモン類である。サイトカイン類の中に含まれるのは、成長ホルモン、例えばヒト成長ホルモン、N−メチオニルヒト成長ホルモン、およびウシ成長ホルモン;副甲状腺ホルモン;チロキシン;インスリン;プロインスリン;リラキシン;プロリラキシン;糖タンパク質ホルモン類、例えば濾胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、および黄体形成ホルモン(LH);肝成長因子;線維芽細胞成長因子;プロラクチン;胎盤性ラクトゲン;腫瘍壊死因子−αおよび−β;ミュラー管抑制物質;マウスゴナドトロピン関連ペプチド;インヒビン;アクチビン;血管内皮成長因子;インテグリン;トロンボポエチン(TPO);神経成長因子類、例えばNGF−β;血小板成長因子;トランスフォーミング成長因子類(TGF類)、例えばTGF−αおよびTGF−β;インスリン様成長因子−Iおよび−II;エリスロポエチン(EPO);骨誘導因子類;インターフェロン類、例えばインターフェロン−α、−βおよび−γ;コロニー刺激因子類(CSF類)、例えばマクロファージ−CSF(M−CSF);顆粒球−マクロファージ−CSF(GM−CSF);および顆粒球−CSF(GCSF);インターロイキン類(IL類)、例えばIL−1、IL−1a、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−11、IL−12、IL−15;腫瘍壊死因子、例えばTNF−αまたはTNF−β;ならびにLIFおよびkitリガンド(KL)を含む他のポリペプチド因子である。本明細書で用いられる用語(tern)サイトカインには、天然源からの、または組み換え細胞培養物からのタンパク質、およびその天然の配列のサイトカインの生物学的に活性な均等物が含まれる。
【0063】
一部の態様において、その療法剤は抗体に基づく療法剤、例えばハーセプチンであることができる。
一部の態様において、その療法剤はナノ粒子であることができる。例えば、一部の態様において、そのナノ粒子は熱奉納(thermal oblation)または熱療法のために用いることができるナノ粒子であることができる。そのようなナノ粒子の例には、鉄および金のナノ粒子が含まれる。
【0064】
造影剤
造影剤は、動物、例えば哺乳類またはヒトの体内の標的部位についての画像情報を提供することができる物質であることができる。造影剤は、磁気共鳴画像法(MRI)のための磁気材料、例えば酸化鉄またはガドリニウムを含む化合物を含むことができる。光学的画像法に関しては、有効薬剤は、例えば半導体ナノ結晶または量子ドットであることができる。光コヒーレンストモグラフィー画像法に関しては、造影剤は金属、例えば金または銀、ナノケージ粒子であることができる。造影剤は超音波コントラスト剤、例えばマイクロもしくはナノバブルまたは酸化鉄マイクロもしくはナノ粒子であることもできる。一部の態様において、その造影剤は、粒子の表面に共有結合的に、または非共有結合的に結合させることができる分子造影剤であることができる。
【0065】
投与
その多孔性の生分解性の物体が多孔性のマイクロまたはナノ粒子(単数または複数)である場合、それは複数のその粒子を含む組成物の一部として対象、例えばヒトに、生理的状態、例えば病気を処置、予防および/または監視するために、適切な投与法により投与することができる。
【0066】
特定の適用のために用いられる個々の方法は主治医が決定することができる。典型的には、その組成物は次の経路の内の1種類により投与することができる:局所、非経口、吸入/肺、経口、眼内、鼻内、バッカル(bucal)、膣および肛門。その粒子は腫瘍学的適用に、すなわち癌または癌と関係する腫瘍のような状態の処置および/または監視に特に有用である可能性がある。
【0067】
療法的適用の大部分は、いくつかのタイプの非経口投与を含む可能性があり、それには静脈内(i.v.)、筋肉内(i.m.)および皮下(s.c.)注射が含まれる。その粒子の投与は、全身性または局所性であることができる。上記で列挙した投与の内の非経口ではない例は、局所投与の例である。血管内投与は、局所性または全身性のどちらであることもできる。局所血管内送達は、ガイドカテーテルシステム、例えばCATスキャンガイドカテーテル、門脈注射(portal vein injectionr)の使用により、既知の病巣の近傍に療法物質を導くために使用することができる。一般的な注射、例えば大量i.v.注射または連続/点滴供給(trickle−feed)i.v.注入は、典型的には全身性である。
【0068】
好ましくは、粒子を含む組成物はi.v.注入により、管内投与により、または腫瘍内経路により投与される。
その粒子は、複数の粒子を含む懸濁液として配合されてよい。好ましくは、その粒子はそれらの寸法およびそれらの内容物において均一である。懸濁液を形成するために、上記のような粒子はあらゆる適当な水性キャリヤービヒクル中に懸濁させることができる。適当な医薬的キャリヤーは、使用される投与量および濃度において受容者に対して非毒性であり、配合物中の他の成分と適合性であるものであってよい。微細製作された粒子の懸濁液の調製は、例えば、米国特許出願公開番号20030114366において開示されている。
【0069】
本明細書において記述された態様は下記の実動する実施例によりさらに説明されるが、それに限定されるわけでは決して無い。
【実施例】
【0070】
実施例
メソ多孔性の半球形のケイ素のマイクロ粒子を、以前に記述されたように、フォトリソグラフィーおよび電気化学エッチングにより製作した。[6]この試験において、ケイ素に基づく材料のために開発された標準的な表面修飾の手順を用いた(図1において図式的に示した)。
【0071】
酸化プロセスの間、粒子表面の部分的な浸食が遊離ヒドロキシル基の導入をもたらし、その粒子に負のゼータ電位(−31.5mV)を与えた。シラン化学によりそのヒドロキシル表面基を正に荷電した3−アミノプロピルトリエトキシシラン(APTES)に共有結合させ、その粒子の正味の表面電荷を+14.73mVに逆転させた。
【0072】
APTESアミン基はさらに、その粒子表面に分子を結合させるためのバックグラウンドの役目を果たした。まず、表面修飾物のさらなるコンジュゲーションに適したモル比の範囲を見積もるため、反応媒体中の蛍光プローブ濃度のケイ素粒子の蛍光に対する作用を評価した。反応媒体中の488−Dylightの3.75〜15mMの濃度範囲では、粒子の正味の蛍光強度はプラトーに達し、それは粒子表面上の結合部位の飽和の結果であると考えることができる。プローブのより高い濃度において粒子の蛍光強度のわずかな低下が観察され、それは表面上でのプローブの消光効果に関係する可能性がある。この一般的なふるまいは、異なる実験の間で、pSiマイクロ粒子のわずかに異なる表面積および特性のため蛍光強度の数値がわずかに異なるにもかかわらず、一貫していて反復性であった。これらの結果に基づいて、粒子表面上の修飾物の飽和を得るために、PEGの10mMの濃度を選択した。蛍光プローブの場合のように、PEG分子(245から5000までのMW)はAPTESアミン基を通して粒子に結合した。PEG分子の長さとゼータ電位の値の間に直接の相関は観察されなかったが(表1参照)、APTESアミン基に結合した全てのPEGおよび蛍光プローブは結果としてAPTESにより導入された正電荷の中和をもたらし、従ってわずかに負のゼータ電位を引き起こし、それはPEGバックボーンの電荷遮蔽効果により部分的に説明できるであろう。
【0073】
表1.調べたマイクロ粒子の記述およびゼータ電位の値。
【0074】
【表1】

【0075】
粒子の分解速度を模擬の生理的条件下で評価するため、リン酸緩衝生理食塩水(PBS、pH7.2)およびウシ胎児血清血清(FBS)中での小さい細孔(10nm)および大きい細孔(30〜50nm)の非PEG化APTES粒子の分解を最初に試験した。公開されている文献と一致して、メソ多孔性Si粒子の分解速度論は細孔の大きさに強く依存していた[12]。小さい細孔を有する粒子は大きい細孔を有する粒子よりもはるかに遅く分解した。
【0076】
次の段階として、様々なPEGを用いた修飾のその粒子の分解速度論に対する影響を評価した。異なる分子量を有する7種類のPEGを用いた:245、333、509、686、1214、3400および5000Da。図2A〜Bは、大きい細孔のPEG化された粒子の、インビトロでのPBSおよび100%血清中での37℃における分解プロフィールを示す。概して、粒子は血清中でより速く分解し、そのPEGの分子量がより高いほど、その粒子の分解プロフィールは両方の生理的媒体中でより遅かった。最も低い分子量を有するPEGのその多孔性物質の表面へのコンジュゲーションは血清中での分解速度論のいかなる変化も引き起こさなかったが、分解を抑制し、結果としてオルトケイ酸の緩衝液中への放出を抑制した。より長い鎖を有するPEGを評価した際、粒子からのSiの質量の低下が遅くなり、それらは血清中で18〜24時間以内に、PBS中で48時間以内にほとんど完全に分解した。
【0077】
PEG3400および5000に関して最も劇的な効果が観察され、それはその系の分解を非常に顕著に抑制し、完全な分解は4日後に達成された。これらの粒子に関して、分解の早期の間に、質量の低下がほとんどまたは全く無い“遅延”期間が存在した。
【0078】
図2A〜Bにおいて示されているような時間の関数としての分解プロセスは、2つの段階に分けることができる:段階I、約24時間まで;および段階II、24時間から先。時間の経過に伴い溶液中で放出されるSiの百分率(Mt)は、両方の段階において一般的なべき乗法則αtβを用いて異なるスケーリング係数(scaling coefficients)で極めて正確に記述することができる。段階Iに関して、APTES修飾された表面および短いPEG鎖(PEG245)は同様にふるまい、Mtは平方根の関係
【0079】
【化1】

【0080】
に従って、それぞれα=23.10および23.48で時間と共に増大する(表2のようにR2=0.965および0.984)。
表2
【0081】
【表2−1】

【0082】
【表2−2】

【0083】
より長いPEG鎖を用いて作られたコーティングに関して、指数βは表2にリストしたようにポリマーの長さと共に増大し、βは0.7から1.5までの範囲であり;一方でαは減少してより長い分解時間をもたらす。PEG3400およびPEG5000に関してMt=αt3であるより高次の分解法則が観察され、それぞれα=0.0047およびα=0.0020であり、表2のように両方の場合においてR2=0.999であった。段階IIに関して、PEG3400およびPEG5000でコートされた粒子のみが著しい分解を示し、一方でAPTES修飾されたものおよび短いPEG鎖(PEG1214まで)を有する粒子は18時間後にほとんど完全に分解した。PEG3400およびPEG5000に関して、その分解法則は再びαtβ型の一般的なべき乗法則により記述することができ、β=0.6ならびにそれぞれα=6.87(R2=0.971)およびα=5.50(R2=0.992)であった。驚いたことに、APTES修飾された、およびPEG245でコートされた粒子に関して、その分解法則は平方根のふるまいを示し、それはあるいはその多孔性ケイ素母材から周囲の溶液中へのケイ酸の拡散放出と関係している可能性がある。粒子表面上に結合したPEG鎖の長さが増大するにつれ、そこで分解のほとんどがおこる細孔から周囲の媒体へのケイ酸の拡散は、あるいは表面のポリマー鎖との立体相互作用によりますます妨げられている可能性がある。特に、PEG3400およびPEG5000に関して段階IIの間に類似のふるまいが観察され、分解法則は指数β=0.6を示し、それは純粋な拡散と関係する指数(β=0.5)に非常に近い。これは、段階IIの間に、第1多孔性層の分解のため粒子表面を飾っているPEG鎖のほとんどが取り除かれて周囲の媒体中に放出されたことを示唆している可能性がある。
【0084】
pSiマイクロ粒子の表面形態の時間の経過に伴う劣化を、走査電子顕微鏡法(SEM)により評価した。図3A〜Cは、分解プロセスの間の粒子のSEM顕微鏡写真を示す。マイクロ粒子の劣化の速度はSiの化学的分解の速度と関係しており、より高い分子量のPEGにコンジュゲートしたマイクロ粒子ははるかに遅い速度での表面の劣化を示した。APTES修飾された(非PEG化)粒子の時間の経過に伴う分解は、粒子表面の、および細孔の浸食により起こったことが分かる。試験が進むにつれ、細孔の大きさはより広くなり、粒子の表面はより滑らかで無くなり、より不規則になった。
【0085】
中程度のPEG(MW 861)では、インビトロでの分解プロセスの間に粒子の外観が変化した。細孔において、粒子の外側表面と比較して最も顕著な浸食を見ることができる。本発明は運用理論により限定されるわけではないが、この異なる分解パターンは親水性ポリマー分子の立体障害に起因すると考えることができ、それはおそらく細孔の外側でより効率的に粒子表面を覆っており、そうして分解プロセスにおいて重要な役割を果たす水および他の構成要素の浸透を妨げている可能性がある。
【0086】
高MWのPEG(5000)の場合では、最初の48時間の内はほとんど分解が見られず、それはICP−AES分析により得られたデータを確証することができる。
粒子の表面分解の速度論を評価するため、APTESおよびPEG3400粒子をDylight488蛍光プローブで標識した。そのプローブの粒子表面から分解媒体中への放出速度論を、蛍光強度およびFACSにより追跡した。蛍光分析に基づき、非PEG化粒子に関して、表面にコンジュゲートした蛍光プローブは分解媒体に依存して8〜16時間以内に分解媒体中に放出された。PEG化粒子に関して、表面浸食速度が有意に延長され、蛍光プローブは24〜48時間後にようやく粒子表面から放出された(図4A〜B)。得られたプロフィールは、ICP−AESおよびSEMにより評価された粒子表面の分解速度論に関するデータと一致していた。
【0087】
医薬的システムからの薬物(療法剤)および造影剤の放出を制御する能力は、多くの臨床適用に関して決定的に重要である可能性がある。pSiの細孔の内部に第2段階ナノ粒子を含む第1段階マイクロ粒子を含む多段階送達キャリヤー[6]の場合では、第1段階pSiマイクロ粒子からの第2段階ナノ粒子の放出は、それらの細孔の外側での拡散を含むいくつかの機構に、および同時に起こる母材のSiの浸食および分解に依存する可能性がある。分解および生分解性制御放出システムからの薬物の放出の機構は、一般に3種類の基本的なパラメーターの点から記述することができる。第1に、そのシステムにおける加水分解的に不安定な結合のタイプおよびその位置。第2に、そのシステムが生分解する方式(表面で、またはその母材全体を通して均一に、のどちらか)は仕掛けの性能に実質的に影響を及ぼす可能性がある。第3の重要な因子は、システムの幾何学および形態に関して、ならびに療法剤の装填の機構に関して直面する、その薬物送達システムの設計である可能性がある。例えば、有効薬剤が粒子母材に共有結合していて薬物とポリマーの間の結合が切れた時に放出されてよい。
【0088】
多孔性Siにおける細孔の大きさおよび数はその生理化学的特性に影響を及ぼす可能性があり、結果として、異なるタイプのメソ多孔性Si粒子は水溶液および生物学的流体中で異なる速度で分解する可能性がある。粒子の細孔はボイド画分と考えることができ、分解流体と絶えず接触しており、おそらく多孔性ケイ素の分解産物であるオルトケイ酸を生じさせている。オルトケイ酸Si(OH)4はケイ素(Si)の生物学的に関係のある水溶性の形であり、最近骨およびコラーゲンの成長において重要な役割を果たしていることが証明された。多孔性Siフィルムは水溶液中で生理的pH範囲においてSi−O結合の加水分解によりSi(OH)4(ケイ酸)を放出することができ、[16]それは害を与えずに腎臓を通って尿中で排泄されることができる。[17]本試験は、pSi表面のPEGによる表面修飾がどのように分解速度論に影響を及ぼし得るかという疑問に取り組んだ。APTES粒子は均一な表面分解の対象であり、浸食は粒子および細孔の表面全体を通して均一に起こる。PEG化Si粒子の場合では、得られた分解プロフィールは、表面領域に加えての不均一な浸食として定義することができ、粒子の幾何学および形態は粒子表面を覆うポリマー鎖の長さによっても定義される。この場合におけるPEG化は、溶質のその粒子のSi母材中への浸透を制御する因子であり得る。
【0089】
外来の物質の体内への投与の後に起こる事象は急性または慢性の炎症を引き起こす可能性があり、その最後の1つはマクロファージの存在および炎症性サイトカイン類の放出により特性付けることができる。注射可能な生体材料は、免疫原性および炎症性の応答が無い点で生体適合性であることが期待される。ケイ素は結合組織、特に軟骨および骨形成に関与する体内の必須の微量元素として認識されてきたが、[19]結晶性二酸化ケイ素のいくつかの形はマクロファージにおける細胞毒性薬剤として知られている。[20,21]従って、様々な表面修飾を有するpSiマイクロ粒子のヒト免疫細胞に対する作用を評価することは重要である。これを念頭において、そのシステムのヒト単球由来の分化した培養マクロファージとの生体適合性を評価した。データは、試験したシステムがTHP−1マクロファージにおいて48時間の期間を経て炎症誘発性サイトカインIL−6およびIL−8の放出を誘導しなかったことを明確に示している(図7(A)〜(C))。一方、その細胞を陽性対照であるザイモサン粒子と共に培養した場合、非常に顕著なサイトカイン類の放出の増大が観察された。マクロファージ上の食作用受容体はザイモサンに結合し、粒子の抱き込みおよびサイトカイン類の放出を刺激する。この薬剤がマクロファージにおいてtoll様受容体TLR2およびTLR6を通して炎症性シグナルを誘導することは周知である。
【0090】
メソ多孔性ケイ素構造の分解および放出速度論の優れた対照は、多段階および多機能送達システムの開発において根本的に重要である可能性がある。pSiマイクロキャリヤーは全身的に投与することができ、異なる性質のペイロード(payload)(療法剤、造影剤)を送達するために用いることができる。pSi構造の細孔および表面化学は、製作過程の間およびその後に制御することができる。様々なバックボーンの長さを有するPEG類の、多孔を持たせた(porosified)ケイ素マイクロ粒子へのコンジュゲーションにより、大きい孔径を有する材料の分解速度論を細かく調整することが可能であることが分かった。PEG3400および5000に関してほとんど劇的な効果が観察され、それはそのシステムの分解を3日よりも長い期間にわたって抑制した。これらのデータは、PEG化によりメソ多孔性ケイ素マイクロ粒子および仕掛けの分解を制御できる可能性を示しており、重要な臨床的意味を有する。
【0091】
実験
多孔性ケイ素粒子の製作、表面修飾および特性付け
メソ多孔性ケイ素マイクロ粒子は、オースティンのテキサス大学のマイクロエレクトロニクス研究センターにおいて、以前に記述されたように[6]フォトリソグラフィーおよび電気化学エッチングにより製作された。大きい細孔(LP、30〜40nmの細孔)のケイ素粒子を、フッ化水素酸(49%HF)およびエタノールの混合物(3:7 v/v)中で、80mA cm−2の電流密度の25秒間の適用により形成した。高多孔性層を、320mA cm−2の電流密度の6秒間の適用により形成した。小さい細孔(SP、10nm)のケイ素粒子の製作に関して、HFの溶液およびエタノールを1:1(v/v)の比率で用い、6mA cm−2の電流密度を1.75分間適用した。窒化物層をHFにより除去した後、粒子をイソプロピルアルコール(IPA)中で1分間の超音波により放出させた。
【0092】
IPA中のケイ素微粒子をガラスビーカー中で加熱する(80〜90℃)ことにより乾燥させ、次いでピラニア溶液(1:2 H2O2:濃H2SO4(v/v))中で100〜110℃で2時間酸化し、断続的に超音波処理して凝集塊を分散させ、DI水中で洗浄し、さらなる使用までDI水中で4℃で保管した。3−アミノプロピルトリエトキシシラン(APTES,Sigma)による修飾の前に。次いでその粒子をDI水、続いてIPAで洗浄し、APTESを含むIPA(0.5% v/v)中で室温で45分間懸濁し、IPAで5回洗浄し、IPA中で4℃で保管した。
【0093】
APTES修飾された大きい細孔の粒子を、400〜500μlのアセトニトリル中で10mM mPEG−SCMまたはNHS−m−dPEGと1.5時間反応させた。PEG上のスクシンイミジルエステルはAPTES粒子の表面上に露出しているアミノ基と反応してPEGの粒子への安定な化学結合を与える。次いでその粒子を脱イオン水中で(遠心分離により)4〜6回洗浄してあらゆる未反応のPEGを除去した。その粒子を脱イオン水またはIPA中で4℃においてさらなる使用まで保管した。
【0094】
体積粒径、大きさの分布および計数は、Z2 Coulter(登録商標)粒子計数器および大きさ分析器(Beckman Coulter、米国カリフォルニア州フラートン)を用いて得られた。分析の前に、試料を平衡電解質溶液(ISOTON(登録商標)II希釈液、Beckman Coulter、米国カリフォルニア州フラートン)中で分散させ、5秒間超音波処理して均一な分散を確実にした。
【0095】
ケイ素粒子のゼータ電位は、Zetasizer nano ZS(Malvern Instruments Ltd.、米国マサチューセッツ州サウスボロ)を用いて分析した。分析のため、安定なゼータ値の評価を得るために少なくとも2×105個の粒子を含む2μLの粒子懸濁液を、リン酸緩衝液(PB、1.4mL、pH7.3)で満たされた(filed with)試料セルカウンター(countering)の中に注入した。セルを2分間超音波処理し、次いで電極−プローブをセルの中に置いた。測定は室温(23℃)で3通りで行った。
【0096】
模擬の生理的条件での分解試験
分解速度論を評価するため、107個の粒子をPBS(1.5mL、pH7.2)または100%ウシ胎児血清(FBS)に添加した。試料(n=3)を適切な時点が経過するまで37℃で保温し、ロータリーシェーカーを用いて絶えず混合した。部分量(85μL)をそのチューブから取り出し:75μLを遠心濾過し(filter−spun)(0.45μmフィルター)、分解媒体から分解しなかった粒子を分離し、得られた液体を後の誘導結合プラズマ原子発光分光計(ICP−AES)による総ケイ素の分析のために4℃で保管した。残った10μLを脱イオン(DI)水で大規模に(extensively)洗浄して塩類を除去し、格子上に置き、乾燥機中で乾燥させ、走査型電子顕微鏡(SEM)により粒子の形態に関してさらに分析した。粒子の表面にコンジュゲートした蛍光PEGの場合、その試料(150μL)を4500rpm×20分間で遠心沈殿させ、その上清を96ウェルプレート中に集め、粒子から放出された蛍光体の量に関して蛍光定量法により、およびSi含有量に関してICP−AESにより分析した。分解プロセスの間に粒子から放出されたケイ素含有量を、Varian Vista−Pro ICP−AESを用いて測定した。Siは250.69、251.43、251.61および288.158nmにおいて検出された。それぞれのグループの1w試料(1wsample)(100%)の前に内部対照(イッテリウム、1ppm)を含む較正運転を行い、粒子を1N NaOH中で37℃において4時間溶解させた。さらに、全ての結果を媒体に放出されたケイ酸の%として表した。粒子の構造および形態を調べるためにSEMを適用した。試料をCrC−150スパッタリングシステム(Torr International、ニューヨーク州ニューウィンザー)を用いて10nmにおいて金で2分間スパッタコートし、FEI Quanta 400電界放射型走査電子顕微鏡(FEI Company、オレゴン州ヒルズボロ)の下で、20kVの加速電圧、0.45Torrのチャンバー圧、およびスポットサイズ5.0で観察した。
【0097】
FITC−PEG(MW 3400)にコンジュゲートした粒子の蛍光を、FACScalibur(Becton Dickinson)を用いて評価した。対数側方散乱(SSC)対対数前方散乱(FSC)を定める二変数ドットプロットを用いて、未標識のケイ素粒子(直径3μm、高さ1.5μm)の大きさおよび形状を評価し、分析から非特異的事象を排除した。多角形領域(R1)は、未分解の粒子に関する関心(interest)の主な集団の中心の周囲の電子ゲートとして定義され、それは血球計数器のシグナル対ノイズ比の限界に近すぎる事象を排除した。試料のそれぞれにおいて同定されたピークを対応する蛍光ヒストグラムで分析し、幾何平均値を記録した。粒子の検出に関して、用いた検出器はFSC E−1およびSSCであり、電圧の設定は474ボルト(V)であった。蛍光検出器FL1は800Vで設定し、緑色蛍光をFL1で、530/30nm帯域通過フィルターを用いて検出した。それぞれの分析に関して、50,000〜200,000のゲートで制御された(gated)事象を集めた。機器の較正は、データの獲得のためのそれぞれの一連の実験の前、間、および後にBD Calibrite(商標)ビーズ(大きさ3.5μm)を用いて実行した。
【0098】
蛍光強度分析の分析のため、試料を96ウェルプレート(Nunclon、デンマーク)上に置き、粒子表面から放出されたFITC−PEGの量をBMG FluoSTARマイクロプレート可変波長蛍光分光光度計(Galaxy、励起488nm、発光523nm)を用いて3通りで決定した。
【0099】
観察された実験結果に基づき、数学的モデルを同定し、それを用いて、粒子の分解へのPEG化の作用に関わる基礎となる物理的および化学的プロセスへのさらなる洞察を得た。
【0100】
PEG化粒子とヒトマクロファージのインビトロでの生体適合性の評価
THP−1単球細胞株は、アメリカ培養細胞系統保存機関(ATCC)(バージニア州マナッサス)から得た。細胞を熱非働化FCS(10% w/v)、グルタミン(2mM)、ペニシリン(100U/mL)、およびストレプトマイシン(100μg/mL)を含むRPMI1640中で0.4〜2×106細胞/mLで培養し、37℃で5%CO2の下で維持した。全ての試薬および培地はATCCおよびGibco BRL(メリーランド州ゲーサーズバーグ)から購入した。THP−1細胞(0.2×106細胞/ウェル)を、1mL培地/ウェルを含む24ウェルプレート中で、ホルボールエステル(80ng、PMA、Sigma 米国)を用いて72時間かけてマクロファージに分化させた。PMAのストック溶液は、PMAを無菌のジメチルスルホキシド(Sigma)中で溶解させることにより調製した。そのストック溶液を−20℃で凍結させて保管した。使用の直前に、そのPMAストック溶液をRPMI培地中で希釈した。PMAのTHP−1細胞に関する分化誘導用量は、予備的な用量反応実験で決定した(データは示していない)。THP−1細胞の分化に関する基準は細胞接着、細胞形態の変化、および細胞表面マーカーの発現プロフィールの変化であった。72時間の培養の後、細胞を培地で2回洗浄し、粒子と共に保温した(粒子5個/細胞)。上清を集めてサイトカイン分析まで−70℃で保管した。
【0101】
炎症誘発性サイトカイン類であるインターロイキン−6(IL−6)およびインターロイキン−8(IL−8)を、市販のELISAキット(BD Biosciences)を用いて分析した。
【0102】
参考文献:
【0103】
【化2】

【0104】
【化3】

【0105】
上文は特定の好ましい態様に関するが、本発明がそのように限定されるわけではないことは理解されるであろう。当業者には、開示された態様に様々な修正がなされてよく、その修正は本発明の範囲内であることが意図されていることが思い当たるであろう。
【0106】
この明細書において引用されている刊行物、特許出願および特許の全てを本明細書にそのまま援用する。
【技術分野】
【0001】
連邦政府により資金助成された研究に関する記載
本発明の基礎をなすいくつかの研究は、助成金番号SA23−06−017の下でNASAからの、ならびに助成金番号W81XWH−04−2−0035およびW81XWH−07−2−0101の下で国防総省からの政府資金により援助された。米国政府はこの発明において一定の権利を有することができる。
【0002】
分野
本開示は概して有効薬剤、例えば療法または造影剤の送達のための生分解性構造に関し、特に、有効薬剤の送達のための生分解性多孔性構造、例えば生分解性多孔性ケイ素構造ならびにそのような構造を作る、および用いる方法に関する。
【背景技術】
【0003】
多孔性ケイ素(pSi)は1950年代半ばにベル研究所においてUhlirにより発見され、[1](上付き引用に対する説明は“参考文献”の節にある)現在生物医学研究の様々な分野において、生体分子のスクリーニング、[2]光学バイオセンシング(optical biosensing)、[3,4]注入可能なキャリヤーによる薬物送達[5,6]および植え込み可能な仕掛け(device)[7]、ならびに向上した生物学的利用能を有する経口投与される薬物[8]を含む多様な適用で用いられている。既にいくつかのFDAに認可されて市場に出されているpSi技術に基づく製品が存在し、それは眼科学においてそれらの適所を見出しており[9]、放射性32PでドープしたpSiに基づく他の製品が、手術不能肝癌の可能性のある新規の小線源療法処置として現在臨床試験にある[10]。
【0004】
多孔性の物体、例えば多孔性ケイ素の物体が薬物送達の適用において用いられる場合、有効薬剤、例えば療法および/または造影剤はその多孔性の物体の小孔内に捕えられることができる。次いで、時間の経過に伴う多孔性物質の分解により、捕えられた有効薬剤の放出を達成することができる。
【0005】
多孔性の物体、例えば多孔性ケイ素構造は、それらの細孔の内部により小さい粒子(“第2段階粒子)を含むことができるより大きい粒子(“第1段階”粒子)としての多段階薬物送達システムにおける使用に関しても提案された。[6]
典型的な多孔性ケイ素薬物送達構造において、多孔性物質の生分解速度論は主にその多孔性特性、例えば孔径および/または多孔度に依存し[11−13]、従ってそれはその構造の装填容量と結びついている。
【0006】
装填容量および生分解速度論が結びついていない多孔性薬物送達システム、すなわち装填容量および生分解速度論を互いに切り離して制御することができるシステムを開発する必要性が存在する。
【発明の概要】
【0007】
1態様に従って、生分解性の物体は外側表面および前記の外側表面上に配置されたポリマー鎖を有する多孔性の本体を含み、ここでその物体の生分解速度論はその多孔性の本体における孔径およびそのポリマー鎖の分子量により決定される。
【0008】
別の態様に従って、生分解性の物体を作る方法は以下を含む:A)多孔性の本体および外側表面を有する物体を得る、ここで、生分解時間はi)その多孔性の本体の孔径により決定され、ii)望まれる生分解時間の値より小さい;ならびにB)その物体の生分解時間を、その物体の外側表面上にポリマー鎖を配置することにより望まれる生分解時間の値に改変する、ここで、その物体の改変された生分解時間は、その多孔性の本体の孔径およびそのポリマー鎖の分子量により決定される。
【0009】
さらに別の態様に従って、送達方法は対象の体の中に多孔性の本体、外側表面および前記の外側表面の上に配置されたポリマー鎖を含む生分解性の物体を導入することを含み、ここでその物体の生分解速度論はその多孔性の本体における孔径およびそのポリマー鎖の分子量により決定される。
【図面の簡単な説明】
【0010】
【図1】図1は、多孔性Si粒子のAPTESおよびPEG分子による化学修飾を図式的に説明する。
【図2】図2(A)〜(B)は、ICP−AESにより評価した大きい細孔のPEG化Siマイクロ粒子の分解速度論のグラフを示す。分解速度論のプロフィールは、分解媒体:(A)PBS pH7.2;(B)ウシ胎児血清(FBS)に放出された総Si含有量の百分率として表される。
【図3】図3(A)〜(C) PBS pH7.2中での分解プロセスの間のSi粒子のSEM画像。示されている系:A)APTES粒子;B)PEG861で修飾した粒子;C)PEG5000で修飾した粒子。時点:2、8、18および48時間。
【図4】図4(A)〜(B)は、分解媒体:(A)PBS;(B)FBS中で蛍光定量法により追跡した、粒子表面からの蛍光PEG対低MWプローブの浸食(erosion)のグラフを示す。
【図5】図5(A)〜(B)は、J744マクロファージによるPEG化(5000D)および非PEG化酸化多孔性ケイ素粒子の内在化のSEM画像を示す。
【図6】図6(A)〜(B)は、PEG化および非PEG化粒子と共に保温した後のHUVEC細胞による炎症誘発性サイトカイン(A)IL−6および(B)IL−8の放出を示す。
【図7】図7(A)〜(C)は、THP−1単球のマクロファージへの分化に対するPMA濃度の影響を示す(図7A)。様々な表面修飾を有する多孔性Si粒子と共に保温した後の、分化したTHP−1細胞による炎症誘発性サイトカインIL−6(図7B)およびIL−8(図7C)の放出。
【図8】図8(A)〜(B)は、大きい(30〜40nm)、および小さい(10nm)細孔を有する多孔性ケイ素粒子のPBS、pH7.2中での時間の経過に伴う分解に関する:(A)粒子分解のSEM画像および(B)ICPデータ。
【発明を実施するための形態】
【0011】
関連出願
下記の研究論文および特許文書は本発明を理解するために有用である可能性があり、それらを全て本明細書にそのまま援用する:
1) 2007年10月25日に公開された、PCT公開番号WO 2007/120248;
2) 2008年4月10日に公開された、PCT公開番号WO 2008/041970;
3) 2008年2月21日に公開された、PCT公開番号WO 2008/021908;
4) 2008年5月1日に公開された、米国特許出願公開番号2008/0102030;
5) 2003年6月19日に公開された、米国特許出願公開番号2003/0114366;
6) 2008年8月28日に公開された、米国特許出願公開番号2008/0206344;
7) 2008年11月13日に公開された、米国特許出願公開番号2008/0280140;
8) 2008年12月23日に出願された、PCT特許出願PCT/US2008/014001;
9) Tasciotti E. et al, 2008 Nature Nanotechnology 3, 151 - 157。
【0012】
定義
別途明記しない限り、”a”または”an”は1以上を意味する。
”マイクロ粒子”は、1ミクロンから1000ミクロンまで、または1ミクロンから100ミクロンまでの最大特徴寸法を有する粒子を意味する。”ナノ粒子”は、1ミクロン未満の最大特徴寸法を有する粒子を意味する。
【0013】
”ナノ多孔性(Nanoporous)”または”ナノポア(nanopores)”は、1ミクロン未満の平均寸法を有する細孔を指す。
”生分解性物質”は、生理的媒体、例えばPBSまたは血清中で溶解または分解することができる物質を指す。
【0014】
”生体適合性”は、それが生きた細胞にさらされた際に細胞内で望ましくない作用、例えば細胞の生命周期の変化;炎症誘発性サイトカインの放出;細胞の増殖速度の変化および細胞毒性作用を引き起こすことなく細胞の適切な細胞活動を維持するであろう物質を指す。
【0015】
APTESは3−アミノプロピルトリエトキシシランを表す。
PEGはポリエチレングリコールを指す。
ICP−AESは誘導結合プラズマ−原子発光分光法を表す。
【0016】
PBSはリン酸緩衝生理食塩水を表す。
FBSはウシ胎児血清を表す。
SEMは走査型電子顕微鏡を表す。
【0017】
HUVECはヒト臍帯静脈内皮細胞を表す。
PMAはホルボールミリステートアセテートを表す。
MWは分子量を表す。
【0018】
生分解速度論は、生分解プロセスの時間経過を指す。生分解性の物体の生分解速度論は、その中でその生分解プロセスが起こる個々の生理的媒体に依存し得る。異なる物体に関する生分解速度論の間の比較は、同じ生理的媒体に関してなされるべきである。
【0019】
生分解速度論は、生分解速度論プロフィールとして図表で表すことができる。
生分解時間は、生分解性の物体が個々の生理的媒体中で完全に分解するのに必要な時間を指す。
【0020】
装填容量または装填効率は、多孔性の物体の細孔中に含まれることができる装填物の量を指す。
生理的条件は、標準状態にある哺乳類の体、例えば人体中の血漿の条件に近い条件、例えば温度、モル浸透圧濃度、pHおよび動きを表す。
【0021】
開示
本発明者らは、多孔性の生分解性の物体、例えば多孔性インプラントまたは多孔性粒子の表面修飾はその物体の生分解速度論を制御するために用いることができることを発見した。従って、その物体の生分解速度論をその物体の多孔性特性、すなわち多孔度および/または孔径から、従ってその物体の装填容量から切り離すことができる。言い換えると、その物体の装填容量を実質的に変化させること無くその物体の生分解速度論を改変することができる。
【0022】
表面修飾は、その物体の外側表面の修飾を指す可能性がある。表面修飾は、生分解性の多孔性の物体の外側表面上にポリマー鎖、例えば親水性ポリマー鎖を配置することにより実施することができる。
【0023】
従って、1態様は生分解性の多孔性の物体、例えば多孔性インプラントまたは多孔性粒子であることができ、それはその多孔性特性により決定される生分解速度論とは異なる生分解速度論を有することができる。
【0024】
生分解性の多孔性の物体は、外側表面およびその外側表面上に配置されたポリマー鎖、好ましくは親水性ポリマー鎖を有する多孔性の本体を含むことができる。その物体は、その生分解速度論が事実上その多孔性の本体の孔径(または多孔度)およびその物体上に配置されたポリマー鎖の分子量により決定されるようなものであることができる。言い換えると、そのポリマー鎖の分子量は、その配置されたポリマー鎖が、配置されたポリマー鎖を持たない、他の点では類似した多孔性の物体の生分解速度論と比較してその物体の生分解速度論を改変するようなものである。
【0025】
別の態様は、望ましい生分解速度論または時間を有する生分解性の物体を作る方法であることができる。その方法は、望まれる生分解時間または速度論を選択する;それの多孔性特性、すなわちそれの孔径および/または多孔度により決定されるそれの生分解時間(この分解時間は望まれる生分解時間よりも短い)を有する最初の多孔性の物体を得る;およびその物体の外側表面上にポリマー鎖を配置し、それにより物体の生分解時間を望まれる値に改変することを含むことができる。その改変された生分解時間は、事実上その多孔性の本体の多孔性特性、すなわち孔径および/または多孔度および配置されたポリマー鎖の分子量の組み合わせにより決定されることができる。
【0026】
改変された生分解速度論
表面修飾、例えばポリマー鎖の堆積は、その生分解性の多孔性の物体の生分解を妨げる、すなわちその物体の生分解時間を表面修飾無しの他の点では類似した生分解性の多孔性の物体と比較して増大させることができる。例えば、5から200nmまで、または5から150nmまで、または5から120nmまで、または10から100nmまで、または10から80nmまで、または20から70nmまで、または25から60nmまで、または30nmから50nmまで、またはこれらの範囲内のあらゆる整数の平均孔径を有する多孔性ケイ素の物体に関して、生理的条件における生分解時間は少なくとも24時間、または少なくとも36時間、または少なくとも48時間、または少なくとも60時間、または少なくとも72時間、または少なくとも84時間、または少なくとも96時間、または少なくとも108時間、または少なくとも120時間、または少なくとも132時間、または少なくとも144時間、または少なくとも156時間、または少なくとも168時間、または少なくとも180時間、または少なくとも192時間であることができる。
【0027】
表面修飾、例えばポリマー鎖の堆積は不均一な生分解プロフィールをもたらすことができ、それは分解した物質が第1期間の間に、分解した物質が第2期間の間に放出される速度とは異なる速度で放出されるような第1期間および第2期間を含むことができる。その不均一なプロフィールは、異なる放出速度を有する2個より多くの期間を含むことができる。ある場合において、その不均一なプロフィールはa)その生分解性の物体が生理的媒体中に導入された際に始まり、その間に分解が起こらない、または実質的に分解が起こらないような第1期間;b)その間にその物体の実質的な分解が起こる第2期間を含むことができる。一部の態様において、分解が起こらない、または実質的に分解が起こらないその第1期間は、5から200nmまで、または5から150nmまで、または5から120nmまで、または10から100nmまで、または10から80nmまで、または20から70nmまで、または25から60nmまで、または30nmから50nmまで、またはこれらの範囲内のあらゆる整数の平均孔径を有する多孔性ケイ素の物体に関して、生理的条件において、少なくとも6時間、または少なくとも12時間、または少なくとも15時間、または少なくとも18時間であることができる。
【0028】
ポリマー鎖
生分解性の多孔性の物体の外側表面上に配置されたポリマー鎖は、好ましくは親水性ポリマー鎖、例えばポリエチレングリコール類(PEG類)または合成グリコカリックス(glycocalix)鎖である。先行技術において、PEG類は主に古典的な薬物送達システム、すなわち非多孔性システムにおいて、および医薬剤形において、細網内皮系(RES)の取込みを避けるために、従って生体内分布および循環時間を制御するために用いられる。[13]PEG類はFDAにより食品、化粧品ならびに注射用、局所用、直腸内、および経鼻配合物を含む医薬における使用に関して認可されている。PEG分子はほとんど毒性を示さず、代謝されること無く、30kDa未満のPEG類に関しては腎臓、またはより長いPEG類に関しては便中でのどちらかにより体から排除される。
【0029】
より重い分子量のポリマー鎖は、多孔性の生分解性物質の生分解に、より低い分子量よりも強く影響を与えることができる。その配置された鎖がそれに関してその生分解性の多孔性の物体の生分解速度論を有効に改変し始めるポリマー鎖の分子量の個々の値は、その多孔性の物体の孔径を含むいくつかの要素に依存する可能性がある。例えば、25から60nmの範囲の平均孔径を有する多孔性ケイ素の物体に関して、その物体上に配置された場合に生分解速度論を改変することができるポリマー鎖は、400より小さくない、または800より小さくない、または800から30,000まで、または800から20,000まで、または800から10,000まで、または800から7000まで、または1000から6000まで、または2000から6000まで、または3000から6000まで、またはこれらの範囲の間のあらゆる整数の分子量を有する。
【0030】
ポリマー鎖は生分解性の多孔性の物体の外側表面に共有結合させることができる。その物体の表面物質が、多孔性ケイ素の生分解性の物体の場合の酸化ケイ素のように酸化物を含む場合、そのポリマー鎖はシラン化学を用いて結合させることができる。例えば、まずアミノシラン、例えば3−アミノプロピルトリエトキシシラン(APTES)を外側表面上に配置することができ、次いでスクシンイミジル−エステル(SCM)で終結するポリマー鎖をそのアミノシランのアミノ基に結合させることができる。ポリマー鎖の共有結合のためにSCM−アミン以外のカップリング化学を用いることもできる。
【0031】
標的化部分(Targeting moieties)
その多孔性の物体が多孔性粒子である場合、その外側表面は1個以上の標的化部分、例えばデンドリマー、抗体、アプタマー(それはチオアプタマーであることができる)、結合基、例えばE−セレクチンもしくはP−セレクチン、または生体分子、例えばRGDペプチドを含むことができる。その標的化部分は、その粒子を対象の体内の特定の部位に向ける、および/または局在させるために用いることができる。その標的化される部位は脈管構造部位であることができる。一部の態様において、その脈管構造部位は腫瘍の脈管構造、例えば血管新生の脈管構造、組み込まれた(coopted)脈管構造または再正常化された脈管構造であることができる。
【0032】
標的化の選択性は、その粒子の表面の化学的部分を変更することにより調整することができる。例えば、組み込まれた脈管構造は、アンジオポエチン2に対する抗体を用いて特異的に認識することができ;血管新生の脈管構造は、血管内皮成長因子(VEGF)、塩基性線維芽細胞成長因子(FGFb)またはαvβ3インテグリンのような内皮マーカーに対する抗体を使用して認識することができ、一方、再正常化された脈管構造は、癌胎児抗原関連細胞接着分子1(carcinoembionic antigen−related vell adhesion molecule 1)(CEACAM1)、エンドセリン−B受容体(ET−B)、血管内皮成長因子阻害剤グラビン(gravin)/AKAP12、プロテインキナーゼAおよびプロテインキナーゼCに関する足場形成(scallofldoing)タンパク質を用いて認識することができる;例えばRobert S. Korbel “抗血管新生療法:癌に関する普遍的な化学増感戦略?”, Science 2006年5月26日, vol 312, no. 5777, 1171-1175を参照。
【0033】
一部の態様において、その標的化部分はその粒子の表面に共有結合的に、または非共有結合的に直接結合させることができる。さらに、一部の態様において、その標的化部分はその粒子の外側表面上に配置されたポリマー鎖に共有結合的に、または非共有結合的に結合させることができる。
【0034】
多孔性の物体
多孔性の物体は多孔性インプラントまたは多孔性粒子であることができる。
多孔性インプラントは様々な形状および大きさを有することができる。多孔性インプラントの寸法は特に限定されておらず、適用に依存する。一部の態様において、多孔性インプラントは0.1mmより小さくない、または0.2mmより小さくない、0.2mmより小さくない、または0.3mmより小さくない、または0.5mmより小さくない、または1.0mmより小さくない、または2mmより小さくない、または5mmより小さくない、または10mmより小さくない、または20mmより小さくない最小寸法を有することができる。一部の態様において、多孔性インプラントは0.1mmより小さくない、または0.2mmより小さくない、0.2mmより小さくない、または0.3mmより小さくない、または0.5mmより小さくない、または1.0mmより小さくない、または2mmより小さくない、または5mmより小さくない、または10mmより小さくない、または20mmより小さくない少なくとも2つの寸法を有することができる。多孔性ケイ素のインプラントは例えばWO99/53898において開示されており、それをそのまま本明細書に援用する。
【0035】
多孔性粒子も様々な形状および大きさを有することができる。多孔性粒子の寸法は特に限定されておらず、適用に依存する。例えば、脈管内投与に関して、その粒子の最大特徴寸法は、ヒトに関しては約4〜5ミクロンである対象中の最も小さい毛細血管の半径よりも小さいことが可能である。一部の態様において、多孔性粒子の最大特徴寸法は約100ミクロンよりも小さくてよく、または約50ミクロンよりも小さくてよく、または約20ミクロンよりも小さくてよく、または約10ミクロンよりも小さくてよく、または約5ミクロンよりも小さくてよく、または約4ミクロンよりも小さくてよく、または約3ミクロンよりも小さくてよく、または約2ミクロンよりも小さくてよく、または約1ミクロンよりも小さくてよい。さらに、一部の態様において、多孔性粒子の最大特徴寸法は100nmから3ミクロンまで、または200nmから3ミクロンまで、または500nmから3ミクロンまで、または700nmから2ミクロンまでであってよい。
【0036】
さらに、一部の態様において、多孔性粒子の最大特徴寸法は約2ミクロンよりも大きくてよく、または約5ミクロンよりも大きくてよく、または約10ミクロンよりも大きくてよい。
【0037】
多孔性粒子の形状は特に限定されていない。一部の態様において、その粒子は球形粒子であることができる。さらに、一部の態様において、その粒子は非球形粒子であることができる。一部の態様において、その粒子は対称的な形状を有していることができる。さらに、一部の態様において、その粒子は非対称な形状を有していることができる。
【0038】
一部の態様において、その粒子は、その粒子と標的部位の表面、例えば炎症を起こした脈管構造の内皮表面の間の接触を促進するように形作られた、選択された非球形の形状を有していることができる。適切な形状の例には偏球、円盤、または円柱が含まれるが、それらに限定されない。一部の態様において、その粒子は、それの外側表面の一部のみがその粒子と標的部位の表面、例えば内皮表面の間の接触を促進するように形作られた形状を定め、一方で外側表面の残りの部分はそれを定めないようなものであることができる。例えば、その粒子は切り詰められた偏球形粒子であることができる。
【0039】
その粒子と標的部位の表面の間の接触を促進することができる粒子の寸法および形状は、米国特許出願公開番号2008/0206344および2008年7月29日に出願された米国出願番号12/181,759において開示されている方法を用いて評価することができる。
【0040】
多孔性物質
多孔性の物体、例えばインプラントまたは粒子は、多孔性物質を含む。多くの態様において、その多孔性物質はポリマーではない多孔性物質、例えば多孔性酸化物物質または多孔性のエッチングされた物質であることができる。多孔性酸化物物質の例には、多孔性酸化ケイ素、多孔性酸化アルミニウム、多孔性酸化チタンおよび多孔性酸化鉄が含まれるが、それらに限定されない。用語“多孔性のエッチングされた物質”は、細孔が湿式エッチングの技法、例えば電気化学エッチングにより導入された物質を指す。多孔性のエッチングされた物質の例には、多孔性半導体物質、例えば多孔性ケイ素、多孔性ゲルマニウム、多孔性GaA類、多孔性InP、多孔性SiC、多孔性SixGe1−x、多孔性GaP、多孔性GaNが含まれる。多孔性のエッチングされた粒子を作る方法は、例えば米国特許出願公開番号2008/0280140において開示されている。
【0041】
多くの態様において、その多孔性の物体はナノ多孔性の物体であることができる。
一部の態様において、その多孔性の物体の平均孔径は、約1nmから約1ミクロンまで、または約1nmから約800nmまで、または約1nmから約500nmまで、または約1nmから約300nmまで、または約1nmから約200nmまで、または約2nmから約100nmまで、またはこれらの範囲内のあらゆる整数であってよい。
【0042】
一部の態様において、その多孔性の物体の平均孔径は、1ミクロンより大きくない、または800nmより大きくない、または500nmより大きい、または300nmより大きい、または200nmより大きくない、または100nmより大きくない、または80nmより大きくない、または50nmより大きくないことが可能である。
【0043】
一部の態様において、その多孔性の物体の平均孔径は、約5から200nmまで、または5から150nmまで、または5から120nmまで、または10から100nmまで、または10から80nmまで、または20から70nmまで、または25から60nmまで、または30nmから50nmまで、またはこれらの範囲内のあらゆる整数の大きさであることができる。
【0044】
一部の態様において、その多孔性粒子の平均孔径は、約3nmから約10nmまで、または約3nmから約10nmまで、または約3nmから約7nmまで、またはこれらの範囲内のあらゆる整数であることができる。
【0045】
一般に、孔径はN2吸着/脱着および顕微鏡法、例えば走査電子顕微鏡法を含むいくつかの技法を用いて決定されてよい。
一部の態様において、その多孔性粒子の細孔は線状の細孔であってよい。さらに、一部の態様において、その多孔性粒子の細孔はスポンジ様の細孔であってよい。
【0046】
多孔性ケイ素粒子およびそれらの製作の方法は、例えばCohen 15 M. H. et al Biomedical Microdevices 5:3, 253-259, 2003;米国特許出願公開番号2003/0114366;米国特許第6,107,102号および第6,355,270号;米国特許出願公開番号2008/0280140;PCT公開番号WO 2008/021908;Foraker, A.B. et al. Pharma. Res. 20 (1), 110-116 (2003); Salonen, J. et al. Jour. Contr. Rel. 108, 362-374 (2005)において開示されている。多孔性酸化ケイ素粒子およびそれらの製作の方法は、例えばPaik J. A. et al. J. Mater. Res., Vol 17, Aug 2002, p. 2121において開示されている。
【0047】
製作
多孔性の物体、例えば多孔性インプラントまたは多孔性粒子は、多くの技法を用いて調製されてよい。
【0048】
例えば、一部の態様において、その多孔性の物体はトップダウン(top−down)で製作された物体、すなわちトップダウンのマイクロ製作またはナノ製作技法、例えばフォトリソグラフィー、電子ビームリソグラフィー、X線リソグラフィー、深紫外リソグラフィー、ナノインプリントリソグラフィーまたは浸漬ペンナノリソグラフィーを利用して製造された物体であってよい。その製作法は、寸法が均一、または実質的に同一である多孔性粒子のスケールアップ製造を可能とすることができる。
【0049】
生体適合性
改変された生分解速度論を有する生分解性の多孔性の物体は、生体適合性であることができる。特に、その改変された生分解速度論を有する生分解性の多孔性の物体は、それらが生分解の間にIL−6およびIL−8のような炎症誘発性サイトカインの放出を誘導しないようなものであることができる。
【0050】
装填
有効薬剤および/またはより小さい粒子を、米国特許出願番号US2008280140および20030114366において;PCT公開番号WO20080219082およびWO99/53898において開示されている方法を含む多くの方法を用いてその生分解性の多孔性の物体の細孔の中に装填することができる。
【0051】
適用
改変された生分解速度論を有する生分解性の多孔性の物体は、医薬、化粧、医学、獣医学、診断および研究の適用のために用いることができる。例えば、その生分解性の多孔性の物体は、対象の体内に導入された際に、有効薬剤、例えば療法剤および/または造影剤を送達するために用いることができ、それは例えば哺乳類、例えばヒトであることができる。従って、その生分解性の物体は、対象において疾患または病気を処置する、予防する、または監視するために用いることができる。個々の疾患/病気は個々の有効薬剤に依存することができる。疾患/病気の限定的で無い例には、癌および炎症、神経変性疾患、皮膚障害、心臓血管の病気、内分泌学的障害、妊娠、糖尿病、感染性の(例えば微生物、寄生生物、真菌による)疾患が含まれる。
【0052】
一部の態様において、その有効薬剤は多孔性の本体の細孔の内部に含まれていることができる。例えば、その有効薬剤は特異的および/または非特異的相互作用によりその細孔の内部に捕えられた化学分子であることができる。
【0053】
一部の態様において、その生分解性の多孔性の物体の細孔は、有効薬剤を含むことができるより小さい大きさの粒子を含むことができる。そのような場合、その生分解性の多孔性の物体は、例えば米国特許出願番号US2008280140において、およびPCT公開番号WO2008021908において開示されているタイプのような多段階薬物送達システムの一部であることができる。
【0054】
一部の態様において、その多孔性の物体の多孔性の本体は有効薬剤を含むことができる。例えば、その多孔性の物体の多孔性の本体は放射性物質で作られていることができる。そのような放射性の多孔性の物体は癌、例えば乳癌、前立腺癌、子宮頚癌、肝癌、リンパ腫、卵巣癌およびメラノーマの放射線療法処置のために用いることができる。放射性の多孔性の物体の1つの限定的で無い例は、放射性32Pでドープした多孔性ケイ素であることができる。
【0055】
有効薬剤
有効薬剤は療法剤、造影剤またはそれらの組み合わせであることができる。有効薬剤の選択は個々の適用に依存する。
【0056】
療法剤
療法剤は、動物、例えば哺乳類またはヒトの標的部位において望まれる生物学的作用をもたらすことのできるあらゆる生理的に、または薬理学的に活性な物質であってよい。療法剤は、限定するわけでは無いが、ペプチド、タンパク質、siRNA、miRNAおよびDNAを含む核酸、ポリマーならびに小さい分子を含むあらゆる無機または有機化合物であってよく、そのいずれも特徴付けられていてよく、または特徴付けられていなくてよい。療法剤は様々な形、例えば未変化の分子、分子複合体、薬理学的に許容できる塩、例えば塩酸塩、臭化水素酸塩、硫酸塩、ラウリン酸塩、パルミチン酸塩、リン酸塩、亜硝酸塩、硝酸塩、ホウ酸塩、酢酸塩、マレイン酸塩、酒石酸塩、オレイン酸塩、サリチル酸塩、および同様のものであってよい。酸性の療法剤に関して、金属、アミンまたは有機陽イオン、例えば第四級アンモニウムの塩を用いることができる。薬物の誘導体、例えば塩基、エステルおよびアミドを療法剤として用いることもできる。水に不溶性である療法剤は、その水溶性誘導体である形で、またはその塩基誘導体(base derivative)として用いることができ、それはいずれの場合でも、またはその送達により、酵素により変換されて、体のpHにより、もしくは他の代謝プロセスにより加水分解されて、その本来の療法上有効な形になる。
【0057】
療法剤の例には、抗癌剤、例えば抗増殖剤、抗血管新生剤;抗マラリア剤;OTC薬物、例えば下熱剤、麻酔薬、咳止め薬;抗感染剤;駆虫薬(antiparasites)、例えば抗マラリア剤、例えばジヒドロアルテミシン(Dihydroartemisin);抗生物質、例えばペニシリン類、セファロスポリン類、マクロライド類、テトラサイクリン類、アミノグリコシド類、抗結核剤;抗真菌/抗カビ剤;遺伝分子、例えばアンチセンスオリゴヌクレオチド類、核酸類、オリゴヌクレオチド類、DNA、RNA;抗原虫剤;抗ウイルス剤、例えばアシクロビル(acyclovir)、ガンシクロビル(ganciclovir)、リバビリン(ribavirin)、抗HIV剤、抗肝炎剤;抗炎症剤、例えばNSAID類、ステロイド系薬剤、カンナビノイド類;抗アレルギー剤、例えば抗ヒスタミン薬、フェキソフェナジン(fexofenadine));気管支拡張薬;ワクチンまたは免疫原性薬剤、例えば破傷風トキソイド、減量ジフテリアトキソイド、無細胞百日咳ワクチン、おたふくかぜ(mums)ワクチン、天然痘ワクチン、抗HIVワクチン、肝炎ワクチン、肺炎ワクチン、インフルエンザワクチン;局所麻酔薬を含む麻酔薬;解熱薬、例えばパラセタモール、イブプロフェン、ジクロフェナク、アスピリン;重篤な事象、例えば心臓血管の発作(attacks)、発作(seizures)、低血糖症の処置のための薬剤;制吐薬および抗嘔吐剤;免疫調節薬および免疫賦活薬;心臓血管用薬物、例えばベータ−遮断薬、アルファ−遮断薬、カルシウムチャンネル遮断薬;ペプチドおよびステロイドホルモン類、例えばインスリン、インスリン誘導体、インスリンデテミール、インスリン単量体、オキシトシン、LHRH、LHRH類似体、副腎皮質刺激ホルモン、ソマトロピン、ロイプロリド、カルシトニン、副甲状腺ホルモン、エストロゲン類、テストステロン、副腎皮質ステロイド類、メゲストロール、プロゲステロン、性ホルモン類、成長ホルモン類、成長因子;ペプチドおよびタンパク質関連薬物、例えばアミノ酸、ペプチド、ポリペプチド、タンパク質;ビタミン類、例えばビタミンA、B群からのビタミン類、葉酸、Vit C、Vit D、Vit E、Vit K、ナイアシン、Vit Dの誘導体;自律神経系薬物;受精剤(fertilizing agents);抗うつ薬、例えばブスピロン(buspirone)、ベンラファキシン(venlafaxine)、ベンゾジアゼピン類、選択的セロトニン再取り込み阻害薬(SSRI)、セルトラリン(sertraline)、シタロプラム(citalopram)、3環系抗うつ薬、パロキセチン(paroxetine)、トラゾドン(trazodone)、リチウム、ブプロピオン(bupropion)、セルトラリン、フルオキセチン(fluoxetine);禁煙のための薬剤、例えばブプロピオン、ニコチン;脂質低下剤、例えば3 ヒドロキシ−3−メチルグルタリル補酵素A(HMG−CoA)レダクターゼの阻害剤、シンバスタチン(simvastatin)、アトルバスタチン(atrovastatinl);CNSまたは脊髄のための薬剤、例えばベンゾジアゼピン類、ロラゼパム、ヒドロモルホン、ミダゾラム(midazolam)、アセトアミノフェン、4’−ヒドロキシアセトアニリド、バルビツレート類、麻酔薬;抗てんかん剤、例えばバルプロ酸(valproic acid)およびその誘導体、カルバマゼピン(carbamazepin);アンギオテンシン拮抗薬、例えばバルサルタン(valsartan);抗精神病剤および抗統合失調症剤、例えばクエチアピン(quetiapine)、リスペリドン(risperidone);パーキンソン症候群の処置のための薬剤、例えばL−ドーパおよびその誘導体、トリヘキシフェニジル;抗アルツハイマー病剤、例えばコリンエステラーゼ阻害剤、ガランタミン(galantamine)、リバスチグミン(rivastigmine)、ドネペジル(donepezil)、タクリン、メマンチン(memantine)、N−メチル−D−アスパラギン酸(NMDA)拮抗薬;インスリン非依存性糖尿病の処置のための薬剤、例えばメトホルミン(metformine)、勃起不全に対する薬剤、例えばシルデナフィル(sildenafil)、タダラフィル(tadalafil)、パパベリン(papaverine)、バルデナフィル(vardenafil)、PGE1;プロスタグランジン類;膀胱機能不全に関する薬剤、例えばオキシブチニン、臭化プロパンテリン、トロスピウム、コハク酸ソリフェナシン;更年期症候群の処置のための薬剤、例えばエストロゲン類、非エストロゲン化合物、閉経後の女性におけるのぼせの処置のための薬剤;原発性または続発性性腺機能低下の処置のための薬剤、例えばテストステロン;サイトカイン類、例えばTNF、インターフェロン類、IFN−アルファ、IFN−ベータ、インターロイキン類;CNS刺激薬;筋弛緩薬;抗麻痺ガス剤;麻薬および拮抗薬、例えばオピエート類、オキシコドン;鎮痛剤、例えばオピエート類、エンドルフィン類、トラマドール、コデイン、NSAID類、ガバペンチン;催眠薬、例えばゾルピデム(Zolpidem)、ベンゾジアゼピン類、バルビツレート類、ラメルテオン(ramelteon);ヒスタミン類および抗ヒスタミン薬;抗片頭痛薬、例えばイミプラミン、プロプラノロール、スマトリプタン(sumatriptan);診断用薬剤、例えばフェノールスルホンフタレイン、色素T−1824、生体染色色素(Vital Dyes)、フェロシアン化カリウム、セクレチン、ペンタガストリン、セルレイン;局所用うっ血除去薬または抗炎症剤;抗にきび剤、例えばレチノイン酸誘導体、ドキシシリン(doxicillin)、ミノサイクリン;ADHD関連薬剤、例えばメチルフェニデート、デクスメチルフェニデート、デキストロアンフェタミン、d−およびl−アンフェタミンのラセミ混合物、ペモリン;利尿剤;抗骨粗鬆症剤、例えばビスホスホネート類、アレンドロネート(aledronate)、パミドロネート(pamidronate)、チルホスチン類(tirphostins);骨形成剤;抗喘息剤;抗けいれん剤(anti−Spasmotic agents)、例えばパパベリン;多発性硬化症および他の神経変性障害の処置のための薬剤、例えばミトキサントロン、グラチラマーアセテート、インターフェロンベータ−1a、インターフェロンベータ−1b;葉(leave)、根、花、種子、茎または枝の抽出物からの植物由来の薬剤。
【0058】
療法剤は、化学療法剤、免疫抑制剤、サイトカイン、細胞毒性剤、核酸分解化合物、放射性同位体、受容体、およびプロドラッグ活性化酵素であることができ、それは天然に存在するもの、または合成もしくは組換え法により製造されるもの、またはそれらのあらゆる組み合わせであってよい。
【0059】
古典的な多剤耐性により影響を受ける薬物、例えばビンカアルカロイド類(例えばビンブラスチンおよびビンクリスチン)、アントラサイクリン類(例えばドキソルビシンおよびダウノルビシン)、RNA転写阻害剤(例えばアクチノマイシン−D)および微小管安定化薬(例えばパクリタキセル)は、療法剤として特定の有用性を有する可能性がある。
【0060】
癌化学療法剤は好ましい療法剤である可能性がある。有用な癌化学療法薬には、ナイトロジェンマスタード類、ニトロソ尿素類、エチレンイミン、アルカンスルホネート類、テトラジン、白金化合物、ピリミジン類似体、プリン類似体、代謝拮抗薬、葉酸類似体、アントラサイクリン類、タキサン類、ビンカアルカロイド類、トポイソメラーゼ阻害剤およびホルモン剤が含まれる。代表的な化学療法薬は、アクチノマイシン−D、アルケラン、Ara−C、アナストロゾール(Anastrozole)、アスパラギナーゼ、BiCNU、ビカルタミド(Bicalutamide)、ブレオマイシン、ブスルファン、カペシタビン(Capecitabine)、カルボプラチン、カルボプラチナ(Carboplatinum)、カルムスチン、CCNU、クロラムブシル、シスプラチン、クラドリビン(Cladribine)、CPT−11、シクロホスファミド、シタラビン、シトシンアラビノシド、シトキサン、ダカルバジン、ダクチノマイシン、ダウノルビシン、デクスラゾキサン(Dexrazoxane)、ドセタキセル、ドキソルビシン、DTIC、エピルビシン、エチレンイミン、エトポシド、フロクスウリジン、フルダラビン、フルオロウラシル、フルタミド、ホテムスチン、ゲムシタビン、ハーセプチン、ヘキサメチルアミン、ヒドロキシ尿素、イダルビシン、イホスファミド、イリノテカン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、メトトレキセート、マイトマイシン、ミトタン、ミトキサントロン、オキサリプラチン、パクリタキセル、パミドロネート、ペントスタチン、プリカマイシン、プロカルバジン、リツキシマブ、ステロイド類、ストレプトゾシン、STI−571、ストレプトゾシン、タモキシフェン、テモゾロミド、テニポシド、テトラジン、チオグアニン、チオテパ、Tomudex、トポテカン、トレオスルファン(Treosulphan)、トリメトレキセート、ビンブラスチン、ビンクリスチン、ビンデシン、ビノレルビン、VP−16、およびゼローダである。
【0061】
有用な癌化学療法薬には以下のものも含まれる:アルキル化剤、例えばチオテパおよびシクロスホスファミド(cyclosphosphamide);アルキルスルホネート類、例えばブスルファン、インプロスルファンおよびピポスルファン;アジリジン類、例えばベンゾドーパ(Benzodopa)、カルボコン、メツレドーパ(Meturedopa)、およびウレドーパ(Uredopa);アルトレタミン、トリエチレンメラミン、トリエチレンホスホルアミド、トリエチレンチオホスホルアミド(triethylenethiophosphaoramide)およびトリメチロールメラミン(trimethylolomelamine)を含むエチレンイミン類およびメチルメラミン類(methylamelamine);ナイトロジェンマスタード類、例えばクロラムブシル、クロルナファジン、コロホスファミド(Cholophosphamide)、エストラムスチン、イホスファミド、メクロレタミン、メクロレタミンオキシド塩酸塩、メルファラン、ノベムビエヒン(Novembiehin)、フェネステリン、プレドニムスチン、トロホスファミド、ウラシルマスタード;ニトロ尿素類、例えばカンヌスチン(Cannustine)、クロロゾトシン、ホテムスチン、ロムスチン、ニムスチン、およびラニムスチン;抗生物質、例えばアクラシノマイシン類(Aclacinomysins)、アクチノマイシン、オースラマイシン(Authramycin)、アザセリン、ブレオマイシン類、カクチノマイシン、カリケアミシン、カラビシン、カルミノマイシン、カルジノフィリン、クロモイニシン類(Chromoinycins)、ダクチノマイシン、ダウノルビシン、デトルビシン、6−ジアゾ−5−オキソ−L−ノルロイシン、ドキソルビシン、エピルビシン、エソルビシン、イダムビシン(Idambicin)、マルセロマイシン、マイトマイシン類、ミコフェノール酸、ノガラマイシン、オリボマイシン類、ペプロマイシン、ポトフィロマイシン、ピューロマイシン、クエラマイシン、ロドルビシン、ストレプトニグリン、ストレプトゾシン、ツベルシジン、ウベニメクス、ジノスタチン、およびゾルビシン;代謝拮抗薬、例えばメトトレキセートおよび5−フルオロウラシル(5−FU);葉酸類似体、例えばデノプテリン、メトトレキセート、プテロプテリン、およびトリメトレキセート;プリン類似体、例えばフルダラビン、6−メルカプトプリン、チアミプリン、およびチオグアニン;ピリミジン類似体、例えばアンシタビン、アザシチジン、6−アザウリジン、カルモフール、シタラビン、ジデオキシウリジン、ドキシフルリジン、エノシタビン、フロクスウリジン、および5−FU;アンドロゲン類、例えばカルステロン、ドロモスタノロンプロピオネート、エピチオスタノール、ルネピチオスタン(Rnepitiostane)、およびテストラクトン;抗副腎薬(anti−adrenals)、例えばアミノグルテチミド、ミトタン、およびトリロスタン;葉酸補充物質(replenisher)、例えばフロリン酸(frolinic acid);アセグラトン;アルドホスファミドグリコシド;アミノレブリン酸;アムサクリン;ベストラブシル;ビサントレン;エダトラキセート;デフォファミン(Defofamine);デメコルシン(Demecolcine);ジアジコン(Diaziquone);エルフォルニチン(elfornithine);酢酸エリプチニウム(elliptinium);エトグルシド(Etoglucid);硝酸ガリウム;ヒドロキシ尿素;レンチナン;ロニダミン(Lonidamine);ミトグアゾン(Mitoguazone);ミトキサントロン;モピダモール(Mopidamol);ニトラクリン(Nitracrine);ペントスタチン;フェナメット(Phenamet);ピラルビシン;ポドフィリン酸(podophyllinic acid);2−エチルヒドラジド;プロカルバジン;PSK(登録商標);ラゾキサン(Razoxane);シゾフィラン;スピロゲルマニウム(Spirogermanium);テヌアゾン酸(tenuazonic acid);トリアジコン(triaziquone);2,2’,2’’−トリクロロトリエチルアミン;ウレタン;ビンデシン;ダカルバジン;マンノムスチン;ミトブロニトール;ミトラクトール;ピポブロマン(Pipobroman);ガシトシン(Gacytosine);アラビノシド(“Ara−C”);シクロホスファミド;チオテパ;タキソイド類、例えばパクリタキセル(TAXOL(登録商標)、Bristol−Myers Squibb Oncology、ニュージャージー州プリンストン)およびドキセタキセル(TAXOTERE(登録商標)、Rhone−Poulenc Rorer、アントニー、フランス);クロラムブシル;ゲムシタビン;6−チオグアニン;メルカプトプリン;メトトレキセート;白金類似体、例えばシスプラチンおよびカルボプラチン;ビンブラスチン;白金;エトポシド(VP−16);イホスファミド;マイトマイシンC;ミトキサントロン;ビンクリスチン;ビノレルビン;ナベルビン;ノバントロン;テニポシド;ダウノマイシン;アミノプテリン;ゼローダ;イバンドロネート;CPT−11;トポイソメラーゼ阻害剤RFS2000;ジフルオロメチルオルニチン(DMFO);レチノイン酸;エスペラミシン類;カペシタビン;ならびに上記のいずれかの医薬的に許容できる塩類、酸または誘導体。腫瘍へのホルモン作用を制御または阻害するように作用する抗ホルモン剤、例えばタモキシフェン、ラロキシフェン、アロマターゼ阻害性4(5)−イミダゾール類、4ヒドロキシタモキシフェン、トリオキシフェン、ケオキシフェン、オナプリストン、およびトレミフェン(フェアストン)を含む抗エストロゲン薬;ならびに抗アンドロゲン薬、例えばフルタミド、ニルタミド、ビカルタミド、ロイプロリド、およびゴセレリン;ならびに上記のいずれかの医薬的に許容できる塩類、酸または誘導体も含まれる。
【0062】
サイトカイン類も治療剤として用いることができる。そのようなサイトカイン類の例は、リンホカイン類、モノカイン類、および伝統的なポリペプチドホルモン類である。サイトカイン類の中に含まれるのは、成長ホルモン、例えばヒト成長ホルモン、N−メチオニルヒト成長ホルモン、およびウシ成長ホルモン;副甲状腺ホルモン;チロキシン;インスリン;プロインスリン;リラキシン;プロリラキシン;糖タンパク質ホルモン類、例えば濾胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、および黄体形成ホルモン(LH);肝成長因子;線維芽細胞成長因子;プロラクチン;胎盤性ラクトゲン;腫瘍壊死因子−αおよび−β;ミュラー管抑制物質;マウスゴナドトロピン関連ペプチド;インヒビン;アクチビン;血管内皮成長因子;インテグリン;トロンボポエチン(TPO);神経成長因子類、例えばNGF−β;血小板成長因子;トランスフォーミング成長因子類(TGF類)、例えばTGF−αおよびTGF−β;インスリン様成長因子−Iおよび−II;エリスロポエチン(EPO);骨誘導因子類;インターフェロン類、例えばインターフェロン−α、−βおよび−γ;コロニー刺激因子類(CSF類)、例えばマクロファージ−CSF(M−CSF);顆粒球−マクロファージ−CSF(GM−CSF);および顆粒球−CSF(GCSF);インターロイキン類(IL類)、例えばIL−1、IL−1a、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−11、IL−12、IL−15;腫瘍壊死因子、例えばTNF−αまたはTNF−β;ならびにLIFおよびkitリガンド(KL)を含む他のポリペプチド因子である。本明細書で用いられる用語(tern)サイトカインには、天然源からの、または組み換え細胞培養物からのタンパク質、およびその天然の配列のサイトカインの生物学的に活性な均等物が含まれる。
【0063】
一部の態様において、その療法剤は抗体に基づく療法剤、例えばハーセプチンであることができる。
一部の態様において、その療法剤はナノ粒子であることができる。例えば、一部の態様において、そのナノ粒子は熱奉納(thermal oblation)または熱療法のために用いることができるナノ粒子であることができる。そのようなナノ粒子の例には、鉄および金のナノ粒子が含まれる。
【0064】
造影剤
造影剤は、動物、例えば哺乳類またはヒトの体内の標的部位についての画像情報を提供することができる物質であることができる。造影剤は、磁気共鳴画像法(MRI)のための磁気材料、例えば酸化鉄またはガドリニウムを含む化合物を含むことができる。光学的画像法に関しては、有効薬剤は、例えば半導体ナノ結晶または量子ドットであることができる。光コヒーレンストモグラフィー画像法に関しては、造影剤は金属、例えば金または銀、ナノケージ粒子であることができる。造影剤は超音波コントラスト剤、例えばマイクロもしくはナノバブルまたは酸化鉄マイクロもしくはナノ粒子であることもできる。一部の態様において、その造影剤は、粒子の表面に共有結合的に、または非共有結合的に結合させることができる分子造影剤であることができる。
【0065】
投与
その多孔性の生分解性の物体が多孔性のマイクロまたはナノ粒子(単数または複数)である場合、それは複数のその粒子を含む組成物の一部として対象、例えばヒトに、生理的状態、例えば病気を処置、予防および/または監視するために、適切な投与法により投与することができる。
【0066】
特定の適用のために用いられる個々の方法は主治医が決定することができる。典型的には、その組成物は次の経路の内の1種類により投与することができる:局所、非経口、吸入/肺、経口、眼内、鼻内、バッカル(bucal)、膣および肛門。その粒子は腫瘍学的適用に、すなわち癌または癌と関係する腫瘍のような状態の処置および/または監視に特に有用である可能性がある。
【0067】
療法的適用の大部分は、いくつかのタイプの非経口投与を含む可能性があり、それには静脈内(i.v.)、筋肉内(i.m.)および皮下(s.c.)注射が含まれる。その粒子の投与は、全身性または局所性であることができる。上記で列挙した投与の内の非経口ではない例は、局所投与の例である。血管内投与は、局所性または全身性のどちらであることもできる。局所血管内送達は、ガイドカテーテルシステム、例えばCATスキャンガイドカテーテル、門脈注射(portal vein injectionr)の使用により、既知の病巣の近傍に療法物質を導くために使用することができる。一般的な注射、例えば大量i.v.注射または連続/点滴供給(trickle−feed)i.v.注入は、典型的には全身性である。
【0068】
好ましくは、粒子を含む組成物はi.v.注入により、管内投与により、または腫瘍内経路により投与される。
その粒子は、複数の粒子を含む懸濁液として配合されてよい。好ましくは、その粒子はそれらの寸法およびそれらの内容物において均一である。懸濁液を形成するために、上記のような粒子はあらゆる適当な水性キャリヤービヒクル中に懸濁させることができる。適当な医薬的キャリヤーは、使用される投与量および濃度において受容者に対して非毒性であり、配合物中の他の成分と適合性であるものであってよい。微細製作された粒子の懸濁液の調製は、例えば、米国特許出願公開番号20030114366において開示されている。
【0069】
本明細書において記述された態様は下記の実動する実施例によりさらに説明されるが、それに限定されるわけでは決して無い。
【実施例】
【0070】
実施例
メソ多孔性の半球形のケイ素のマイクロ粒子を、以前に記述されたように、フォトリソグラフィーおよび電気化学エッチングにより製作した。[6]この試験において、ケイ素に基づく材料のために開発された標準的な表面修飾の手順を用いた(図1において図式的に示した)。
【0071】
酸化プロセスの間、粒子表面の部分的な浸食が遊離ヒドロキシル基の導入をもたらし、その粒子に負のゼータ電位(−31.5mV)を与えた。シラン化学によりそのヒドロキシル表面基を正に荷電した3−アミノプロピルトリエトキシシラン(APTES)に共有結合させ、その粒子の正味の表面電荷を+14.73mVに逆転させた。
【0072】
APTESアミン基はさらに、その粒子表面に分子を結合させるためのバックグラウンドの役目を果たした。まず、表面修飾物のさらなるコンジュゲーションに適したモル比の範囲を見積もるため、反応媒体中の蛍光プローブ濃度のケイ素粒子の蛍光に対する作用を評価した。反応媒体中の488−Dylightの3.75〜15mMの濃度範囲では、粒子の正味の蛍光強度はプラトーに達し、それは粒子表面上の結合部位の飽和の結果であると考えることができる。プローブのより高い濃度において粒子の蛍光強度のわずかな低下が観察され、それは表面上でのプローブの消光効果に関係する可能性がある。この一般的なふるまいは、異なる実験の間で、pSiマイクロ粒子のわずかに異なる表面積および特性のため蛍光強度の数値がわずかに異なるにもかかわらず、一貫していて反復性であった。これらの結果に基づいて、粒子表面上の修飾物の飽和を得るために、PEGの10mMの濃度を選択した。蛍光プローブの場合のように、PEG分子(245から5000までのMW)はAPTESアミン基を通して粒子に結合した。PEG分子の長さとゼータ電位の値の間に直接の相関は観察されなかったが(表1参照)、APTESアミン基に結合した全てのPEGおよび蛍光プローブは結果としてAPTESにより導入された正電荷の中和をもたらし、従ってわずかに負のゼータ電位を引き起こし、それはPEGバックボーンの電荷遮蔽効果により部分的に説明できるであろう。
【0073】
表1.調べたマイクロ粒子の記述およびゼータ電位の値。
【0074】
【表1】

【0075】
粒子の分解速度を模擬の生理的条件下で評価するため、リン酸緩衝生理食塩水(PBS、pH7.2)およびウシ胎児血清血清(FBS)中での小さい細孔(10nm)および大きい細孔(30〜50nm)の非PEG化APTES粒子の分解を最初に試験した。公開されている文献と一致して、メソ多孔性Si粒子の分解速度論は細孔の大きさに強く依存していた[12]。小さい細孔を有する粒子は大きい細孔を有する粒子よりもはるかに遅く分解した。
【0076】
次の段階として、様々なPEGを用いた修飾のその粒子の分解速度論に対する影響を評価した。異なる分子量を有する7種類のPEGを用いた:245、333、509、686、1214、3400および5000Da。図2A〜Bは、大きい細孔のPEG化された粒子の、インビトロでのPBSおよび100%血清中での37℃における分解プロフィールを示す。概して、粒子は血清中でより速く分解し、そのPEGの分子量がより高いほど、その粒子の分解プロフィールは両方の生理的媒体中でより遅かった。最も低い分子量を有するPEGのその多孔性物質の表面へのコンジュゲーションは血清中での分解速度論のいかなる変化も引き起こさなかったが、分解を抑制し、結果としてオルトケイ酸の緩衝液中への放出を抑制した。より長い鎖を有するPEGを評価した際、粒子からのSiの質量の低下が遅くなり、それらは血清中で18〜24時間以内に、PBS中で48時間以内にほとんど完全に分解した。
【0077】
PEG3400および5000に関して最も劇的な効果が観察され、それはその系の分解を非常に顕著に抑制し、完全な分解は4日後に達成された。これらの粒子に関して、分解の早期の間に、質量の低下がほとんどまたは全く無い“遅延”期間が存在した。
【0078】
図2A〜Bにおいて示されているような時間の関数としての分解プロセスは、2つの段階に分けることができる:段階I、約24時間まで;および段階II、24時間から先。時間の経過に伴い溶液中で放出されるSiの百分率(Mt)は、両方の段階において一般的なべき乗法則αtβを用いて異なるスケーリング係数(scaling coefficients)で極めて正確に記述することができる。段階Iに関して、APTES修飾された表面および短いPEG鎖(PEG245)は同様にふるまい、Mtは平方根の関係
【0079】
【化1】

【0080】
に従って、それぞれα=23.10および23.48で時間と共に増大する(表2のようにR2=0.965および0.984)。
表2
【0081】
【表2−1】

【0082】
【表2−2】

【0083】
より長いPEG鎖を用いて作られたコーティングに関して、指数βは表2にリストしたようにポリマーの長さと共に増大し、βは0.7から1.5までの範囲であり;一方でαは減少してより長い分解時間をもたらす。PEG3400およびPEG5000に関してMt=αt3であるより高次の分解法則が観察され、それぞれα=0.0047およびα=0.0020であり、表2のように両方の場合においてR2=0.999であった。段階IIに関して、PEG3400およびPEG5000でコートされた粒子のみが著しい分解を示し、一方でAPTES修飾されたものおよび短いPEG鎖(PEG1214まで)を有する粒子は18時間後にほとんど完全に分解した。PEG3400およびPEG5000に関して、その分解法則は再びαtβ型の一般的なべき乗法則により記述することができ、β=0.6ならびにそれぞれα=6.87(R2=0.971)およびα=5.50(R2=0.992)であった。驚いたことに、APTES修飾された、およびPEG245でコートされた粒子に関して、その分解法則は平方根のふるまいを示し、それはあるいはその多孔性ケイ素母材から周囲の溶液中へのケイ酸の拡散放出と関係している可能性がある。粒子表面上に結合したPEG鎖の長さが増大するにつれ、そこで分解のほとんどがおこる細孔から周囲の媒体へのケイ酸の拡散は、あるいは表面のポリマー鎖との立体相互作用によりますます妨げられている可能性がある。特に、PEG3400およびPEG5000に関して段階IIの間に類似のふるまいが観察され、分解法則は指数β=0.6を示し、それは純粋な拡散と関係する指数(β=0.5)に非常に近い。これは、段階IIの間に、第1多孔性層の分解のため粒子表面を飾っているPEG鎖のほとんどが取り除かれて周囲の媒体中に放出されたことを示唆している可能性がある。
【0084】
pSiマイクロ粒子の表面形態の時間の経過に伴う劣化を、走査電子顕微鏡法(SEM)により評価した。図3A〜Cは、分解プロセスの間の粒子のSEM顕微鏡写真を示す。マイクロ粒子の劣化の速度はSiの化学的分解の速度と関係しており、より高い分子量のPEGにコンジュゲートしたマイクロ粒子ははるかに遅い速度での表面の劣化を示した。APTES修飾された(非PEG化)粒子の時間の経過に伴う分解は、粒子表面の、および細孔の浸食により起こったことが分かる。試験が進むにつれ、細孔の大きさはより広くなり、粒子の表面はより滑らかで無くなり、より不規則になった。
【0085】
中程度のPEG(MW 861)では、インビトロでの分解プロセスの間に粒子の外観が変化した。細孔において、粒子の外側表面と比較して最も顕著な浸食を見ることができる。本発明は運用理論により限定されるわけではないが、この異なる分解パターンは親水性ポリマー分子の立体障害に起因すると考えることができ、それはおそらく細孔の外側でより効率的に粒子表面を覆っており、そうして分解プロセスにおいて重要な役割を果たす水および他の構成要素の浸透を妨げている可能性がある。
【0086】
高MWのPEG(5000)の場合では、最初の48時間の内はほとんど分解が見られず、それはICP−AES分析により得られたデータを確証することができる。
粒子の表面分解の速度論を評価するため、APTESおよびPEG3400粒子をDylight488蛍光プローブで標識した。そのプローブの粒子表面から分解媒体中への放出速度論を、蛍光強度およびFACSにより追跡した。蛍光分析に基づき、非PEG化粒子に関して、表面にコンジュゲートした蛍光プローブは分解媒体に依存して8〜16時間以内に分解媒体中に放出された。PEG化粒子に関して、表面浸食速度が有意に延長され、蛍光プローブは24〜48時間後にようやく粒子表面から放出された(図4A〜B)。得られたプロフィールは、ICP−AESおよびSEMにより評価された粒子表面の分解速度論に関するデータと一致していた。
【0087】
医薬的システムからの薬物(療法剤)および造影剤の放出を制御する能力は、多くの臨床適用に関して決定的に重要である可能性がある。pSiの細孔の内部に第2段階ナノ粒子を含む第1段階マイクロ粒子を含む多段階送達キャリヤー[6]の場合では、第1段階pSiマイクロ粒子からの第2段階ナノ粒子の放出は、それらの細孔の外側での拡散を含むいくつかの機構に、および同時に起こる母材のSiの浸食および分解に依存する可能性がある。分解および生分解性制御放出システムからの薬物の放出の機構は、一般に3種類の基本的なパラメーターの点から記述することができる。第1に、そのシステムにおける加水分解的に不安定な結合のタイプおよびその位置。第2に、そのシステムが生分解する方式(表面で、またはその母材全体を通して均一に、のどちらか)は仕掛けの性能に実質的に影響を及ぼす可能性がある。第3の重要な因子は、システムの幾何学および形態に関して、ならびに療法剤の装填の機構に関して直面する、その薬物送達システムの設計である可能性がある。例えば、有効薬剤が粒子母材に共有結合していて薬物とポリマーの間の結合が切れた時に放出されてよい。
【0088】
多孔性Siにおける細孔の大きさおよび数はその生理化学的特性に影響を及ぼす可能性があり、結果として、異なるタイプのメソ多孔性Si粒子は水溶液および生物学的流体中で異なる速度で分解する可能性がある。粒子の細孔はボイド画分と考えることができ、分解流体と絶えず接触しており、おそらく多孔性ケイ素の分解産物であるオルトケイ酸を生じさせている。オルトケイ酸Si(OH)4はケイ素(Si)の生物学的に関係のある水溶性の形であり、最近骨およびコラーゲンの成長において重要な役割を果たしていることが証明された。多孔性Siフィルムは水溶液中で生理的pH範囲においてSi−O結合の加水分解によりSi(OH)4(ケイ酸)を放出することができ、[16]それは害を与えずに腎臓を通って尿中で排泄されることができる。[17]本試験は、pSi表面のPEGによる表面修飾がどのように分解速度論に影響を及ぼし得るかという疑問に取り組んだ。APTES粒子は均一な表面分解の対象であり、浸食は粒子および細孔の表面全体を通して均一に起こる。PEG化Si粒子の場合では、得られた分解プロフィールは、表面領域に加えての不均一な浸食として定義することができ、粒子の幾何学および形態は粒子表面を覆うポリマー鎖の長さによっても定義される。この場合におけるPEG化は、溶質のその粒子のSi母材中への浸透を制御する因子であり得る。
【0089】
外来の物質の体内への投与の後に起こる事象は急性または慢性の炎症を引き起こす可能性があり、その最後の1つはマクロファージの存在および炎症性サイトカイン類の放出により特性付けることができる。注射可能な生体材料は、免疫原性および炎症性の応答が無い点で生体適合性であることが期待される。ケイ素は結合組織、特に軟骨および骨形成に関与する体内の必須の微量元素として認識されてきたが、[19]結晶性二酸化ケイ素のいくつかの形はマクロファージにおける細胞毒性薬剤として知られている。[20,21]従って、様々な表面修飾を有するpSiマイクロ粒子のヒト免疫細胞に対する作用を評価することは重要である。これを念頭において、そのシステムのヒト単球由来の分化した培養マクロファージとの生体適合性を評価した。データは、試験したシステムがTHP−1マクロファージにおいて48時間の期間を経て炎症誘発性サイトカインIL−6およびIL−8の放出を誘導しなかったことを明確に示している(図7(A)〜(C))。一方、その細胞を陽性対照であるザイモサン粒子と共に培養した場合、非常に顕著なサイトカイン類の放出の増大が観察された。マクロファージ上の食作用受容体はザイモサンに結合し、粒子の抱き込みおよびサイトカイン類の放出を刺激する。この薬剤がマクロファージにおいてtoll様受容体TLR2およびTLR6を通して炎症性シグナルを誘導することは周知である。
【0090】
メソ多孔性ケイ素構造の分解および放出速度論の優れた対照は、多段階および多機能送達システムの開発において根本的に重要である可能性がある。pSiマイクロキャリヤーは全身的に投与することができ、異なる性質のペイロード(payload)(療法剤、造影剤)を送達するために用いることができる。pSi構造の細孔および表面化学は、製作過程の間およびその後に制御することができる。様々なバックボーンの長さを有するPEG類の、多孔を持たせた(porosified)ケイ素マイクロ粒子へのコンジュゲーションにより、大きい孔径を有する材料の分解速度論を細かく調整することが可能であることが分かった。PEG3400および5000に関してほとんど劇的な効果が観察され、それはそのシステムの分解を3日よりも長い期間にわたって抑制した。これらのデータは、PEG化によりメソ多孔性ケイ素マイクロ粒子および仕掛けの分解を制御できる可能性を示しており、重要な臨床的意味を有する。
【0091】
実験
多孔性ケイ素粒子の製作、表面修飾および特性付け
メソ多孔性ケイ素マイクロ粒子は、オースティンのテキサス大学のマイクロエレクトロニクス研究センターにおいて、以前に記述されたように[6]フォトリソグラフィーおよび電気化学エッチングにより製作された。大きい細孔(LP、30〜40nmの細孔)のケイ素粒子を、フッ化水素酸(49%HF)およびエタノールの混合物(3:7 v/v)中で、80mA cm−2の電流密度の25秒間の適用により形成した。高多孔性層を、320mA cm−2の電流密度の6秒間の適用により形成した。小さい細孔(SP、10nm)のケイ素粒子の製作に関して、HFの溶液およびエタノールを1:1(v/v)の比率で用い、6mA cm−2の電流密度を1.75分間適用した。窒化物層をHFにより除去した後、粒子をイソプロピルアルコール(IPA)中で1分間の超音波により放出させた。
【0092】
IPA中のケイ素微粒子をガラスビーカー中で加熱する(80〜90℃)ことにより乾燥させ、次いでピラニア溶液(1:2 H2O2:濃H2SO4(v/v))中で100〜110℃で2時間酸化し、断続的に超音波処理して凝集塊を分散させ、DI水中で洗浄し、さらなる使用までDI水中で4℃で保管した。3−アミノプロピルトリエトキシシラン(APTES,Sigma)による修飾の前に。次いでその粒子をDI水、続いてIPAで洗浄し、APTESを含むIPA(0.5% v/v)中で室温で45分間懸濁し、IPAで5回洗浄し、IPA中で4℃で保管した。
【0093】
APTES修飾された大きい細孔の粒子を、400〜500μlのアセトニトリル中で10mM mPEG−SCMまたはNHS−m−dPEGと1.5時間反応させた。PEG上のスクシンイミジルエステルはAPTES粒子の表面上に露出しているアミノ基と反応してPEGの粒子への安定な化学結合を与える。次いでその粒子を脱イオン水中で(遠心分離により)4〜6回洗浄してあらゆる未反応のPEGを除去した。その粒子を脱イオン水またはIPA中で4℃においてさらなる使用まで保管した。
【0094】
体積粒径、大きさの分布および計数は、Z2 Coulter(登録商標)粒子計数器および大きさ分析器(Beckman Coulter、米国カリフォルニア州フラートン)を用いて得られた。分析の前に、試料を平衡電解質溶液(ISOTON(登録商標)II希釈液、Beckman Coulter、米国カリフォルニア州フラートン)中で分散させ、5秒間超音波処理して均一な分散を確実にした。
【0095】
ケイ素粒子のゼータ電位は、Zetasizer nano ZS(Malvern Instruments Ltd.、米国マサチューセッツ州サウスボロ)を用いて分析した。分析のため、安定なゼータ値の評価を得るために少なくとも2×105個の粒子を含む2μLの粒子懸濁液を、リン酸緩衝液(PB、1.4mL、pH7.3)で満たされた(filed with)試料セルカウンター(countering)の中に注入した。セルを2分間超音波処理し、次いで電極−プローブをセルの中に置いた。測定は室温(23℃)で3通りで行った。
【0096】
模擬の生理的条件での分解試験
分解速度論を評価するため、107個の粒子をPBS(1.5mL、pH7.2)または100%ウシ胎児血清(FBS)に添加した。試料(n=3)を適切な時点が経過するまで37℃で保温し、ロータリーシェーカーを用いて絶えず混合した。部分量(85μL)をそのチューブから取り出し:75μLを遠心濾過し(filter−spun)(0.45μmフィルター)、分解媒体から分解しなかった粒子を分離し、得られた液体を後の誘導結合プラズマ原子発光分光計(ICP−AES)による総ケイ素の分析のために4℃で保管した。残った10μLを脱イオン(DI)水で大規模に(extensively)洗浄して塩類を除去し、格子上に置き、乾燥機中で乾燥させ、走査型電子顕微鏡(SEM)により粒子の形態に関してさらに分析した。粒子の表面にコンジュゲートした蛍光PEGの場合、その試料(150μL)を4500rpm×20分間で遠心沈殿させ、その上清を96ウェルプレート中に集め、粒子から放出された蛍光体の量に関して蛍光定量法により、およびSi含有量に関してICP−AESにより分析した。分解プロセスの間に粒子から放出されたケイ素含有量を、Varian Vista−Pro ICP−AESを用いて測定した。Siは250.69、251.43、251.61および288.158nmにおいて検出された。それぞれのグループの1w試料(1wsample)(100%)の前に内部対照(イッテリウム、1ppm)を含む較正運転を行い、粒子を1N NaOH中で37℃において4時間溶解させた。さらに、全ての結果を媒体に放出されたケイ酸の%として表した。粒子の構造および形態を調べるためにSEMを適用した。試料をCrC−150スパッタリングシステム(Torr International、ニューヨーク州ニューウィンザー)を用いて10nmにおいて金で2分間スパッタコートし、FEI Quanta 400電界放射型走査電子顕微鏡(FEI Company、オレゴン州ヒルズボロ)の下で、20kVの加速電圧、0.45Torrのチャンバー圧、およびスポットサイズ5.0で観察した。
【0097】
FITC−PEG(MW 3400)にコンジュゲートした粒子の蛍光を、FACScalibur(Becton Dickinson)を用いて評価した。対数側方散乱(SSC)対対数前方散乱(FSC)を定める二変数ドットプロットを用いて、未標識のケイ素粒子(直径3μm、高さ1.5μm)の大きさおよび形状を評価し、分析から非特異的事象を排除した。多角形領域(R1)は、未分解の粒子に関する関心(interest)の主な集団の中心の周囲の電子ゲートとして定義され、それは血球計数器のシグナル対ノイズ比の限界に近すぎる事象を排除した。試料のそれぞれにおいて同定されたピークを対応する蛍光ヒストグラムで分析し、幾何平均値を記録した。粒子の検出に関して、用いた検出器はFSC E−1およびSSCであり、電圧の設定は474ボルト(V)であった。蛍光検出器FL1は800Vで設定し、緑色蛍光をFL1で、530/30nm帯域通過フィルターを用いて検出した。それぞれの分析に関して、50,000〜200,000のゲートで制御された(gated)事象を集めた。機器の較正は、データの獲得のためのそれぞれの一連の実験の前、間、および後にBD Calibrite(商標)ビーズ(大きさ3.5μm)を用いて実行した。
【0098】
蛍光強度分析の分析のため、試料を96ウェルプレート(Nunclon、デンマーク)上に置き、粒子表面から放出されたFITC−PEGの量をBMG FluoSTARマイクロプレート可変波長蛍光分光光度計(Galaxy、励起488nm、発光523nm)を用いて3通りで決定した。
【0099】
観察された実験結果に基づき、数学的モデルを同定し、それを用いて、粒子の分解へのPEG化の作用に関わる基礎となる物理的および化学的プロセスへのさらなる洞察を得た。
【0100】
PEG化粒子とヒトマクロファージのインビトロでの生体適合性の評価
THP−1単球細胞株は、アメリカ培養細胞系統保存機関(ATCC)(バージニア州マナッサス)から得た。細胞を熱非働化FCS(10% w/v)、グルタミン(2mM)、ペニシリン(100U/mL)、およびストレプトマイシン(100μg/mL)を含むRPMI1640中で0.4〜2×106細胞/mLで培養し、37℃で5%CO2の下で維持した。全ての試薬および培地はATCCおよびGibco BRL(メリーランド州ゲーサーズバーグ)から購入した。THP−1細胞(0.2×106細胞/ウェル)を、1mL培地/ウェルを含む24ウェルプレート中で、ホルボールエステル(80ng、PMA、Sigma 米国)を用いて72時間かけてマクロファージに分化させた。PMAのストック溶液は、PMAを無菌のジメチルスルホキシド(Sigma)中で溶解させることにより調製した。そのストック溶液を−20℃で凍結させて保管した。使用の直前に、そのPMAストック溶液をRPMI培地中で希釈した。PMAのTHP−1細胞に関する分化誘導用量は、予備的な用量反応実験で決定した(データは示していない)。THP−1細胞の分化に関する基準は細胞接着、細胞形態の変化、および細胞表面マーカーの発現プロフィールの変化であった。72時間の培養の後、細胞を培地で2回洗浄し、粒子と共に保温した(粒子5個/細胞)。上清を集めてサイトカイン分析まで−70℃で保管した。
【0101】
炎症誘発性サイトカイン類であるインターロイキン−6(IL−6)およびインターロイキン−8(IL−8)を、市販のELISAキット(BD Biosciences)を用いて分析した。
【0102】
参考文献:
【0103】
【化2】

【0104】
【化3】

【0105】
上文は特定の好ましい態様に関するが、本発明がそのように限定されるわけではないことは理解されるであろう。当業者には、開示された態様に様々な修正がなされてよく、その修正は本発明の範囲内であることが意図されていることが思い当たるであろう。
【0106】
この明細書において引用されている刊行物、特許出願および特許の全てを本明細書にそのまま援用する。
【特許請求の範囲】
【請求項1】
外側表面および前記の外側表面の上に配置されたポリマー鎖を有する多孔性の本体を含む生分解性の物体であって、その物体の生分解速度論が多孔性の本体における孔径およびポリマー鎖の分子量により決定される物体。
【請求項2】
前記の物体が複数のマイクロ粒子またはナノ粒子を含む、請求項1に記載の物体。
【請求項3】
インプラントである、請求項1に記載の物体。
【請求項4】
その多孔性の本体が多孔性のエッチングされた物質を含む、請求項1に記載の物体。
【請求項5】
その多孔性の本体が多孔性のケイ素を含む、請求項4に記載の物体。
【請求項6】
その多孔性の本体がナノ多孔性の物質を含む、請求項1に記載の物体。
【請求項7】
そのポリマー鎖が親水性ポリマー鎖である、請求項1に記載の物体。
【請求項8】
そのポリマー鎖がポリエチレングリコールを含む、請求項1に記載の物体。
【請求項9】
そのポリマー鎖が外側表面に共有結合している、請求項1に記載の物体。
【請求項10】
その多孔性の本体が25から120nmまでの孔径を有する、請求項1に記載の物体。
【請求項11】
その多孔性の本体が30から60nmまでの孔径を有する、請求項10に記載の物体。
【請求項12】
そのポリマー鎖が約800から約10,000までの分子量を有する、請求項10に記載の物体。
【請求項13】
そのポリマー鎖が約800から約7,000までの分子量を有する、請求項10に記載の物体。
【請求項14】
生体適合性である、請求項1に記載の物体。
【請求項15】
さらにその多孔性の本体の細孔中に有効薬剤を含む、請求項1に記載の物体。
【請求項16】
その有効薬剤が療法剤を含む、請求項15に記載の物体。
【請求項17】
その有効薬剤が造影剤を含む、請求項15に記載の物体。
【請求項18】
不均一な生分解プロフィールを有する、請求項1に記載の物体。
【請求項19】
以下:
A)多孔性の本体および外側表面を有する物体を得る、ここで、生分解時間はi)その多孔性の本体の孔径により決定され、ii)望まれる生分解時間の値より小さい;ならびに
B)その物体の生分解時間を、その物体の外側表面上にポリマー鎖を配置することにより望まれる生分解時間の値に改変する、ここで、その物体の改変された生分解時間は、その多孔性の本体の孔径およびそのポリマー鎖の分子量により決定される;
を含む、生分解性の物体を作る方法。
【請求項20】
その物体の多孔性の本体が多孔性のエッチングされた物質を含む、請求項19に記載の方法。
【請求項21】
その物体の多孔性の本体が多孔性のケイ素を含む、請求項20に記載の方法。
【請求項22】
その物体の多孔性の本体がナノ多孔性の物質を含む、請求項19に記載の方法。
【請求項23】
そのポリマー鎖が親水性ポリマー鎖である、請求項19に記載の方法。
【請求項24】
そのポリマー鎖がポリエチレングリコール鎖である、請求項23に記載の方法。
【請求項25】
その多孔性の本体が25から120nmまでの孔径を有する、請求項19に記載の方法。
【請求項26】
そのポリマー鎖が約800から約10,000までの分子量を有する、請求項25に記載の方法。
【請求項27】
そのポリマー鎖が約800から約7,000までの分子量を有する、請求項25に記載の方法。
【請求項28】
前記の配置の後にその物体が不均一な生分解プロフィールを有する、請求項19に記載の方法。
【請求項29】
さらに、その物体の多孔性の本体の細孔中に有効薬剤を装填することを含む、請求項19に記載の方法。
【請求項30】
前記の物体がインプラントである、請求項19に記載の方法。
【請求項31】
前記の物体が複数のマイクロまたはナノ粒子を含む、請求項19に記載の方法。
【請求項32】
前記の配置がポリマー鎖を外側表面に共有結合させることを含む、請求項19に記載の方法。
【請求項33】
対象の体の中に請求項19に記載の方法に従って作られた生分解性の物体を導入することを含む送達方法。
【請求項34】
前記の導入が対象において前記の物体を血管内に注射することを含む、請求項33に記載の方法。
【請求項35】
前記の導入が前記の物体を対象に植え込むことを含む、請求項34に記載の方法。
【請求項36】
対象の体の中に多孔性の本体、外側表面および前記の外側表面の上に配置されたポリマー鎖を含む生分解性の物体を導入することを含む送達方法であって、その物体の生分解速度論がその多孔性の本体における孔径およびそのポリマー鎖の分子量により決定される方法。
【請求項37】
前記の物体がマイクロまたはナノ粒子の母材を含む、請求項36に記載の方法。
【請求項38】
前記の導入が対象において前記の物体を血管内に注射することを含む、請求項36に記載の方法。
【請求項39】
前記の物体が植え込み可能な仕掛けを含み、前記の導入が前記の物体を対象に植え込むことを含む、請求項36に記載の方法。
【請求項40】
その多孔性の本体が多孔性のエッチングされた物質を含む、請求項36に記載の方法。
【請求項41】
その多孔性の本体が多孔性のケイ素を含む、請求項40に記載の方法。
【請求項42】
その多孔性の本体がナノ多孔性の物質を含む、請求項36に記載の方法。
【請求項43】
そのポリマー鎖が親水性ポリマー鎖である、請求項36に記載の方法。
【請求項44】
そのポリマー鎖がポリエチレングリコール鎖である、請求項43に記載の方法。
【請求項45】
そのポリマー鎖が外側表面に共有結合している、請求項36に記載の方法。
【請求項46】
その多孔性の本体が25から120nmまでの孔径を有する、請求項36に記載の方法。
【請求項47】
その多孔性の本体が30から50nmまでの孔径を有する、請求項46に記載の方法。
【請求項48】
そのポリマー鎖が約800から約10,000までの分子量を有する、請求項46に記載の方法。
【請求項49】
そのポリマー鎖が約800から約7,000までの分子量を有する、請求項48に記載の方法。
【請求項50】
その物体がさらにその多孔性の本体の細孔中に有効薬剤を含む、請求項36に記載の方法。
【請求項51】
その有効薬剤が療法剤を含む、請求項50に記載の方法。
【請求項52】
その有効薬剤が造影剤を含む、請求項50に記載の方法。
【請求項53】
その物体が不均一な生分解プロフィールを有する、請求項36に記載の方法。
【請求項54】
その対象がヒトである、請求項37に記載の方法。
【請求項1】
外側表面および前記の外側表面の上に配置されたポリマー鎖を有する多孔性の本体を含む生分解性の物体であって、その物体の生分解速度論が多孔性の本体における孔径およびポリマー鎖の分子量により決定される物体。
【請求項2】
前記の物体が複数のマイクロ粒子またはナノ粒子を含む、請求項1に記載の物体。
【請求項3】
インプラントである、請求項1に記載の物体。
【請求項4】
その多孔性の本体が多孔性のエッチングされた物質を含む、請求項1に記載の物体。
【請求項5】
その多孔性の本体が多孔性のケイ素を含む、請求項4に記載の物体。
【請求項6】
その多孔性の本体がナノ多孔性の物質を含む、請求項1に記載の物体。
【請求項7】
そのポリマー鎖が親水性ポリマー鎖である、請求項1に記載の物体。
【請求項8】
そのポリマー鎖がポリエチレングリコールを含む、請求項1に記載の物体。
【請求項9】
そのポリマー鎖が外側表面に共有結合している、請求項1に記載の物体。
【請求項10】
その多孔性の本体が25から120nmまでの孔径を有する、請求項1に記載の物体。
【請求項11】
その多孔性の本体が30から60nmまでの孔径を有する、請求項10に記載の物体。
【請求項12】
そのポリマー鎖が約800から約10,000までの分子量を有する、請求項10に記載の物体。
【請求項13】
そのポリマー鎖が約800から約7,000までの分子量を有する、請求項10に記載の物体。
【請求項14】
生体適合性である、請求項1に記載の物体。
【請求項15】
さらにその多孔性の本体の細孔中に有効薬剤を含む、請求項1に記載の物体。
【請求項16】
その有効薬剤が療法剤を含む、請求項15に記載の物体。
【請求項17】
その有効薬剤が造影剤を含む、請求項15に記載の物体。
【請求項18】
不均一な生分解プロフィールを有する、請求項1に記載の物体。
【請求項19】
以下:
A)多孔性の本体および外側表面を有する物体を得る、ここで、生分解時間はi)その多孔性の本体の孔径により決定され、ii)望まれる生分解時間の値より小さい;ならびに
B)その物体の生分解時間を、その物体の外側表面上にポリマー鎖を配置することにより望まれる生分解時間の値に改変する、ここで、その物体の改変された生分解時間は、その多孔性の本体の孔径およびそのポリマー鎖の分子量により決定される;
を含む、生分解性の物体を作る方法。
【請求項20】
その物体の多孔性の本体が多孔性のエッチングされた物質を含む、請求項19に記載の方法。
【請求項21】
その物体の多孔性の本体が多孔性のケイ素を含む、請求項20に記載の方法。
【請求項22】
その物体の多孔性の本体がナノ多孔性の物質を含む、請求項19に記載の方法。
【請求項23】
そのポリマー鎖が親水性ポリマー鎖である、請求項19に記載の方法。
【請求項24】
そのポリマー鎖がポリエチレングリコール鎖である、請求項23に記載の方法。
【請求項25】
その多孔性の本体が25から120nmまでの孔径を有する、請求項19に記載の方法。
【請求項26】
そのポリマー鎖が約800から約10,000までの分子量を有する、請求項25に記載の方法。
【請求項27】
そのポリマー鎖が約800から約7,000までの分子量を有する、請求項25に記載の方法。
【請求項28】
前記の配置の後にその物体が不均一な生分解プロフィールを有する、請求項19に記載の方法。
【請求項29】
さらに、その物体の多孔性の本体の細孔中に有効薬剤を装填することを含む、請求項19に記載の方法。
【請求項30】
前記の物体がインプラントである、請求項19に記載の方法。
【請求項31】
前記の物体が複数のマイクロまたはナノ粒子を含む、請求項19に記載の方法。
【請求項32】
前記の配置がポリマー鎖を外側表面に共有結合させることを含む、請求項19に記載の方法。
【請求項33】
対象の体の中に請求項19に記載の方法に従って作られた生分解性の物体を導入することを含む送達方法。
【請求項34】
前記の導入が対象において前記の物体を血管内に注射することを含む、請求項33に記載の方法。
【請求項35】
前記の導入が前記の物体を対象に植え込むことを含む、請求項34に記載の方法。
【請求項36】
対象の体の中に多孔性の本体、外側表面および前記の外側表面の上に配置されたポリマー鎖を含む生分解性の物体を導入することを含む送達方法であって、その物体の生分解速度論がその多孔性の本体における孔径およびそのポリマー鎖の分子量により決定される方法。
【請求項37】
前記の物体がマイクロまたはナノ粒子の母材を含む、請求項36に記載の方法。
【請求項38】
前記の導入が対象において前記の物体を血管内に注射することを含む、請求項36に記載の方法。
【請求項39】
前記の物体が植え込み可能な仕掛けを含み、前記の導入が前記の物体を対象に植え込むことを含む、請求項36に記載の方法。
【請求項40】
その多孔性の本体が多孔性のエッチングされた物質を含む、請求項36に記載の方法。
【請求項41】
その多孔性の本体が多孔性のケイ素を含む、請求項40に記載の方法。
【請求項42】
その多孔性の本体がナノ多孔性の物質を含む、請求項36に記載の方法。
【請求項43】
そのポリマー鎖が親水性ポリマー鎖である、請求項36に記載の方法。
【請求項44】
そのポリマー鎖がポリエチレングリコール鎖である、請求項43に記載の方法。
【請求項45】
そのポリマー鎖が外側表面に共有結合している、請求項36に記載の方法。
【請求項46】
その多孔性の本体が25から120nmまでの孔径を有する、請求項36に記載の方法。
【請求項47】
その多孔性の本体が30から50nmまでの孔径を有する、請求項46に記載の方法。
【請求項48】
そのポリマー鎖が約800から約10,000までの分子量を有する、請求項46に記載の方法。
【請求項49】
そのポリマー鎖が約800から約7,000までの分子量を有する、請求項48に記載の方法。
【請求項50】
その物体がさらにその多孔性の本体の細孔中に有効薬剤を含む、請求項36に記載の方法。
【請求項51】
その有効薬剤が療法剤を含む、請求項50に記載の方法。
【請求項52】
その有効薬剤が造影剤を含む、請求項50に記載の方法。
【請求項53】
その物体が不均一な生分解プロフィールを有する、請求項36に記載の方法。
【請求項54】
その対象がヒトである、請求項37に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2012−515201(P2012−515201A)
【公表日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願番号】特願2011−546234(P2011−546234)
【出願日】平成21年1月15日(2009.1.15)
【国際出願番号】PCT/US2009/000239
【国際公開番号】WO2010/082910
【国際公開日】平成22年7月22日(2010.7.22)
【出願人】(506140479)ボード・オブ・リージェンツ・オブ・ザ・ユニバーシティ・オブ・テキサス・システム (5)
【Fターム(参考)】
【公表日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願日】平成21年1月15日(2009.1.15)
【国際出願番号】PCT/US2009/000239
【国際公開番号】WO2010/082910
【国際公開日】平成22年7月22日(2010.7.22)
【出願人】(506140479)ボード・オブ・リージェンツ・オブ・ザ・ユニバーシティ・オブ・テキサス・システム (5)
【Fターム(参考)】
[ Back to top ]

