改良されたマイクロ流体チップ
【課題】
所定温度で開始されることが必要な反応を、マイクロ流体チップを用いて実施する際、高度な送液制御や定量化機構を必要とせずに、簡便な1液の送液のみで高効率な反応を可能とする方法を提供する。
【解決手段】
反応に必要な試薬を単独では反応が起こらない試薬構成に分割し、一方の試薬を固体状態でマイクロ流体チップ上に作製された流路内に保持し、実施する反応に要求される温度にマイクロ流体チップを加温する。そこへ、もう一方の液体状態の試薬を流路へ導入後送液し、固体状態の試薬と接触し溶解させることで反応が起こり得る試薬組成となり、反応が開始される。これにより、所定温度下で反応が開始される試薬組成にすることが必要な場合の反応をマイクロ流体チップ上で実施する際に問題であった、複数の溶液を流路内で定量的に混合する高度な送液技術や流路内試薬定量化機構が不要となった。
所定温度で開始されることが必要な反応を、マイクロ流体チップを用いて実施する際、高度な送液制御や定量化機構を必要とせずに、簡便な1液の送液のみで高効率な反応を可能とする方法を提供する。
【解決手段】
反応に必要な試薬を単独では反応が起こらない試薬構成に分割し、一方の試薬を固体状態でマイクロ流体チップ上に作製された流路内に保持し、実施する反応に要求される温度にマイクロ流体チップを加温する。そこへ、もう一方の液体状態の試薬を流路へ導入後送液し、固体状態の試薬と接触し溶解させることで反応が起こり得る試薬組成となり、反応が開始される。これにより、所定温度下で反応が開始される試薬組成にすることが必要な場合の反応をマイクロ流体チップ上で実施する際に問題であった、複数の溶液を流路内で定量的に混合する高度な送液技術や流路内試薬定量化機構が不要となった。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生化学およびマイクロ流体チップの分野に属するものであり、遺伝子検査や免疫学的検査等の生化学的検査および診断、または化学分析、化学反応に好適なマイクロ流体チップに関するものである。
【背景技術】
【0002】
近年、化学反応や化学分析等を微細化して行うμ−TAS(μ−Total Analysis Systems)が注目を集めている。その背景には、ナノテクノロジーに代表される微細加工技術の進歩や、環境負荷の低減を目指したグリーンケミストリーの考え方の浸透が挙げられる。μ−TASにおいては、従来バルクで行われていた化学反応や化学分析をマイクロ流体チップに集積化することで、必要試薬量の低減、それによる産業廃棄物の削減、操作の簡便性、さらに、反応液容量当たりの反応液と容器との接触面積(比表面積)の増大による攪拌効率向上に起因する、反応時間および分析所要時間の大幅な短縮が期待されている。
【0003】
また、装置全体の小型化に伴う省スペース化、さらに、持ち運び可能なサイズにすることで、必要な場所で必要な分析が迅速に実施可能となり、Point of Care Testing(その場分析)の実現が期待されている。例えば、感染症の診断においては、適切で効果のある治療を行うために感染している生物種を特定する必要があり、免疫学的検査や遺伝子検査が実施されている。
【0004】
遺伝子検査においては、細菌やウィルス由来の核酸を増幅するために、PCR(ポリメレースチェーンリアクション)法の適用が検討されている。しかしながら、従来の遺伝子検査においては、検体の前処理や必要な試薬類の保存や調製、さらには、大掛かりな核酸増幅装置などが必要であり、中央検査室と称される大型の医療機関において主に利用されてきた。
【0005】
一方、マイクロ流体チップに上記の検査項目を集積化することが可能ならば、小病院への各種検査法の導入のみならず、入院患者がベッドサイドで自ら分析することや、ひいては、自宅で簡便に健康状態を把握することも可能となり、QOL(Quality Of Life;生活の質)の向上による豊かな暮らしへの貢献が期待される。
【0006】
上記のように多くの利点が期待されるため、マイクロ流体チップに種々の生化学反応を集積化する試みが研究されている。具体的には、前記した核酸増幅反応であるPCR法(非特許文献1参照)や、電気泳動による核酸分析をマイクロ流体チップ上で実施することが試みられている。
【0007】
PCR法のマイクロ流体チップへの適用においては、PCR法に必要な試薬類および分析対象の鋳型DNAを含む試料をあらかじめ全て混合し、その混合液をマイクロ流体チップ上に作製された流路に導入する方法が取られている。導入された混合液は、流路内でPCR法に基づく温度サイクルを実施されることで鋳型DNAが増幅される。
【0008】
しかしながら、PCR法においては、鋳型DNAの塩基配列や用いるオリゴヌクレオチドプライマーの塩基配列の組み合わせによっては、一般にホットスタート法と称される方法を適用しなければ、鋳型DNAの高効率な増幅が得られない場合がある。ホットスタート法とは、オリゴヌクレオチドプライマーのミスアニーリングに起因する非特異的増幅反応を回避し、目的の増幅産物を得るための方法であり、PCR法の場合、酵素(一般に耐熱菌由来DNAポリメレース)以外の試薬類および鋳型DNAの混合液を、一旦、オリゴヌクレオチドプライマーの変性温度まで加温し、変性温度下で初めて酵素を添加後、通常の温度サイクルを実施することで達成される。
【0009】
PCR法におけるホットスタート法の別の手法として、抗DNAポリメレース抗体とDNAポリメレースとの複合体を室温下で試薬類および鋳型DNAの混合液に添加し、該混合液をオリゴヌクレオチドプライマーの変性温度に加温し、抗DNAポリメレース抗体を変性、失活させ、DNAポリメレースが遊離することでDNAポリメレース活性が現れる方法のように、特別に調製されたDNAポリメレースを用いる方法もある(特許文献1、非特許文献2参照)。このような、ホットスタート法によって初めてPCR法が成功する場合がしばしば見受けられる。
【0010】
一方、RNA増幅反応であるNASBA法(特許文献2および3、非特許文献3および4参照)やTRC法(特許文献4、非特許文献5参照)においても、所定の温度下で酵素類(RNAポリメレース、逆転写酵素など)を添加することが好ましく、室温下で上記酵素類を添加し、その後、通常の反応温度に加温した場合と比較して、増幅効率が向上することが分かっている。
【0011】
【特許文献1】米国特許第5338671号
【特許文献2】特許第3241717号
【特許文献3】特許第2650159号
【特許文献4】特開2000−14400号公報
【非特許文献1】Chee G.Koh et al. Anal.Chem.(2003) 75 :4591−4598
【非特許文献2】Kellogg D.E.et al.Biotechiniques(1994) 16 :1134−1137
【非特許文献3】Compton J.W. Nature(1991) Mar 7;350(6313):91−2
【非特許文献4】Romano J.W. et al. Clin.Lab.Med.(1996) Mar;16(1):89−103
【非特許文献5】Ishigro T.et al. Anal.Biochem.(2003) 314 :77−86
【非特許文献6】Song M.D. et al. FEBS Lett.(1987)Aug 31;221(1):167−71
【非特許文献7】Ishigro T.et al. Nucleic Acid Res.(1996)24;4992−4997
【発明の開示】
【発明が解決しようとする課題】
【0012】
前述のような、核酸増幅反応に必要な試薬のうち、酵素以外の試薬類を所定温度に加温し、所定温度下で酵素類を添加することが必要な核酸増幅反応をマイクロ流体チップ上で実施する場合、所定温度に加温されたマイクロ流体チップの複数の流路内に、複数に構成した核酸増幅試薬を導入し、各流路の合流部で核酸増幅試薬が混合されることで初めて核酸増幅反応が開始される状態の試薬組成となる方法が必要となる。
【0013】
この場合、複数に構成された核酸増幅試薬を定量的に流路に導入し、かつ、それら複数の試薬を同時に送液しながら定量的に混合する必要がある。または、複数に構成された核酸増幅試薬を非定量的に複数の流路内に導入し、流路に作り込まれた液体の定量化機構により複数に構成され導入された試薬を定量的に混合する方法も考えられる。しかしながら、流路内に導入する試薬は極微量(ナノリットルもしくはマイクロリットルのスケール)であるため、極微量な複数の試薬を送液して、流路合流部で定量的に混合することや、流路内で極微量の液体を定量化してから混合することは非常に高度な技術である。
【0014】
この高度な技術を達成する方法として、Y字型またはT字型構造の流路を備えたマイクロ流体チップを用い、流路の合流部で酵素を含まない核酸増幅試薬と酵素類とを合流させ混合する方法が考えられる。この方法によれば、複数に構成した試薬を流路内で予備加熱してから混合させることが可能となり、所定温度下で初めて核酸増幅反応が開始されることが必要な核酸増幅反応への対応が可能となる。しかしながら、このような形状の流路を用いた場合、導入した複数の試薬を定量的に一液に混合するためには、複数の試薬を送液して合流部に同時に到達するような、厳密な送液制御が必要となる。もしも、流路合流部への試薬の到達タイミングがずれたならば、図1に示した状況に陥り、定量的な試薬の混合がなされず、意図した試薬組成と異なる核酸増幅試薬が生成するため、核酸増幅反応の効率低下や再現性の低下につながる恐れがある。
【0015】
また、複数の試薬の混合タイミングが実験ごとおよび実験者ごとに変化することが予想され、それによっても再現性の低下が懸念される。マイクロ流体チップは、臨床診断分野への応用が期待されるものであり、低再現性は実用化への致命的な問題である。
【0016】
本発明は、反応開始前の予備加熱が必要な反応を、マイクロチップ上で実施する際、複数に構成した試薬の送液制御という高度な技術を必要とせず、簡便な方法で高効率な反応を実現することが可能であり、反応の再現性を高めた高精度なマイクロ流体チップおよび反応方法を提供するものである。
【課題を解決するための手段】
【0017】
本発明者は上記課題を解決するべく鋭意研究を重ねた結果、反応に必要な試薬成分の一部または全部の試薬成分をマイクロ流体チップの流路内に固体状態で入れ、マイクロ流体チップを所定温度に保温しておき、そこへ反応に必要な残りの試薬成分を送液することで、固体状態の試薬と送液した液体状態の試薬が混合され、高効率かつ高精度な反応が可能となることを見出した。
【0018】
以下、本発明を詳細に説明する。
【0019】
本発明は、マイクロ流体チップを用いた反応において、反応開始前の予備加熱が必要な場合を含む、全ての反応を実現するための手法に関するものである。本発明は、所定温度下で反応が開始されることが必須要件である核酸増幅反応、例えば、ホットスタート法を適用しなければ特異的な核酸増幅が望めない場合のPCR法などに特に効果的であるが、ホットスタート法を必ずしも必要としない通常のPCR法や各種化学反応においても適用可能である。
【0020】
また本発明は反応開始後の温度条件には関係なく適用することが可能であり、PCR法を本発明に則り実施する際には、温度サイクルを実行可能なヒーターを準備し、その上で実施することで実行可能である。さらに、マイクロ流体チップにおいては通常使用する反応容器と比べ、比表面積が非常に大きくなるため、設定温度への到達速度が高速となる。そのため、DNAポリメレースの核酸重合反応速度が許容する範囲で、温度プログラムのサイクル間隔を短くすることが可能であり、核酸増幅反応が高速化されるメリットがある。
【0021】
本発明の反応に必要な試薬成分とは、反応に必要な試薬成分の全部が混合されることで反応が開始されるものであり、試薬成分のそれぞれの組成は、実施する反応ごとに最適な組成を検討することは言うまでもない。また、反応開始前の予備加熱や所定の温度を要求する反応の実施においては、液体状態の試薬成分は単独で反応が進行しない組成であって、固体状態の試薬を溶解し、固体状態の試薬と液体状態の試薬が混合されることで反応が開始されることが必要である。また固体状態の試薬も、単独で反応が進行しない組成が好ましいが、試薬調製後に速やかに固体化することにより、反応が開始されないならばこの限りではない。ただし本発明においては反応に必要な試薬成分の全部が混合されたときに反応が開始されれば良く、たとえば液体状態の試薬の調整時に予備的な反応が生じたとしても、液体状態の試薬と固体状態の試薬が混合されることで、他の反応が生じる試薬成分となっていれば良い。TRC法の場合を例にあげると、液体状態の試薬に標的核酸を含む試料とオリゴヌクレオチドプライマーが含まれていて、固体状態の試薬に逆転写酵素が含まれている場合、液体状態の試薬の調製時にハイブリダイゼーション反応が生じるが、液体状態の試薬と固体状態の試薬が混合されると逆転写反応が生じるため、本発明の効果を奏する。
【0022】
本発明の反応に必要な試薬成分とは、PCR法の場合を例にあげると、標的核酸を含む試料、増幅反応の基質となるモノヌクレオチド(dNTP)からなる基質試薬、標的核酸またはその相補鎖の配列に相補的結合が可能な配列を含むオリゴヌクレオチドプライマーやオリゴヌクレオチドプローブからなるプライマー試薬および増幅反応の触媒となるDNAポリメレースからなる酵素試薬を含むものであり、TRC法の場合を例にあげると、標的核酸を含む試料、増幅反応の基質となるモノヌクレオチド(dNTP、NTPおよびITP)からなる基質試薬、標的核酸またはその相補鎖の配列に相補的結合が可能な配列を含むオリゴヌクレオチドプライマーやオリゴヌクレオチドプローブからなるプライマー試薬、増幅反応の触媒となる逆転写酵素、RNAポリメレースやその他の酵素(リボヌクレースHなど)からなる酵素試薬を含むものである。また、PCR法およびTRC法ともに上記試薬成分の他にも、核酸増幅反応に必ずしも必須ではないが、核酸増幅反応を最適化するためや試薬の安定性を高めるため、増幅核酸を検出するためなどの試薬(各種無機塩類、DMSO、ソルビトール、インヒビター、DTT、検出プローブなど)からなるその他の試薬が含まれていても良い。これらの標的核酸の増幅に必要な試薬成分を構成する固体状態の試薬および液体状態の試薬を混合することで、増幅反応が開始される。たとえば本発明を利用して遺伝子検査のための核酸増幅反応を行う場合などは、標的核酸を含む試料を試薬溶液に混合することで液体状態の試薬を調製し、この液体状態の試薬をマイクロ流体チップに導入することが高効率かつ高精度な反応を行うためには好適である。
【0023】
本発明の固体状態の試薬は、反応に必要な試薬成分の一部または全部を含んでいても良く、含まれる試薬の種類や数には限定されない。核酸増幅反応の場合を例にあげると、たとえば基質試薬の一部を固体状態の試薬とし、残りの一部を液体状態の試薬としていても良い。また各試薬成分は液体状態の試薬および固体状態の試薬の両方に含まれていても良く、特にその他の試薬のうち、試薬の安定性を向上させるという目的のために添加されているものに関しては、液体状態の試薬および固体状態の試薬の両方に含まれることで効果的となる場合もある。また核酸増幅反応の場合を例にあげると、検査項目に特異的な成分の全部を、固体状態の試薬または液体状態の試薬のどちらか一方に含ませておくことにより、試薬の取り違えによる誤診の可能性の低減が期待される。たとえば、検査項目に特異的であるプライマー試薬を固体状態の試薬に含ませておくことで、測定する標的核酸を含む試料と固体状態の試薬が入ったマイクロ流体チップを正しく組み合わせれば、液体状態の試薬は検査項目に依存せず広く使用できる試薬とすることが可能な場合、試薬の取り違えの可能性が低減することとなる。また、液体状態の試薬についてはその保存性から冷凍保存(−20℃以下)が望ましいが、試薬を固体状態にすることで常温保存が可能となる。したがって、凍結融解により安定性が損なわれる試薬成分が含まれる場合は、その試薬成分を固体状態の試薬とすることが好ましい。
【0024】
本発明の固体状態の試薬は常温で固体であり、液体状態の試薬は常温で液体であることを特徴とする。また固体状態の試薬における固体化の方法は特に限定されないが、液体状態の試薬と混合されることで迅速に溶解することが好適であるため、試薬成分を風乾、真空乾燥または凍結乾燥したものであることが好ましい。なお、固体化により酵素試薬の活性が低下するような場合には、酵素試薬を液体状態の試薬とすることが例示できる。
【0025】
本発明の液体状態の試薬は、基本的には固体状態の試薬と補完的であり、両者が混合されることにより反応が開始されうる成分を含むものである。たとえば、固体状態の試薬に反応に必要な成分の全部が含まれている場合、液体状態の試薬の成分は水のみとなることが例示できる。したがって実験者は水のみをマイクロ流体チップに導入することで、反応を開始することができる。また核酸増幅反応の場合を例にあげると、固体状態の試薬に、標的核酸を含む試料以外の反応に必要な成分が含まれている場合には、実験者が標的核酸を含む試料または希釈して調製した試料をマイクロ流体チップに導入し、標的核酸の増幅反応を開始することとなる。また、固体状態の試薬がプライマー試薬のみからなる場合、液体状態の試薬の成分は標的核酸を含む試料、酵素試薬、基質試薬およびその他の試薬から構成され、実験者は試料を酵素試薬、基質試薬およびその他の試薬と混合した後にマイクロ流体チップに導入することで固体状態の試薬を溶解させ、標的核酸の増幅反応を行うこととなる。
【0026】
本発明において固体状態の試薬は調製したものを流路内の最適な位置に配置すれば良く、その配置方法には限定されず、流路内の1ヶ所に配置しても複数に分割して配置してもよい。ただし液体状態の試薬の送液を妨げるように固体状態の試薬が流路を塞いでしまってはならず、少なくとも送液により生じる気体を通過させるように配置されなければならない。したがってたとえば流路に設けられたチャンバー内に固体状態の試薬を配置することなどが例示できる。また固体状態の試薬を流路内ヘ導入する方法として、試薬を流路上で乾燥させて固体化することや、別容器で固体化させた固体状態の試薬を気体を通過させるように必要量配置することでも、送液の妨げとはならない態様として例示することができる。特に試薬を流路内で乾燥させて固体化する方法においては、流路に固体状態の試薬が密着するため、マイクロ流体チップの取り扱いが簡便となるという点において好ましい。
【0027】
また、マイクロ流体チップは複数の分析項目をワンチップ上に集積可能であり、ハイスループットな核酸分析が実現可能であるが、その場合、一項目当たりの流路の構造や送液制御がシンプルなほど、より多くの項目を集積化することが容易となる。そこで、本発明の方法を適用することで、マイクロ流体チップ上に複雑な分岐流路や合流流路などが不要となり、ハイスループットな集積化マイクロ流体チップの実現可能性が向上する。
【0028】
さらに、標的核酸の増幅反応においては、標的核酸の増幅に伴い蛍光特性が変化するように設計された検出プローブを固体状態の試薬または液体状態の試薬のどちらか一方、または両方にあらかじめ添加しておくことにより、標的核酸増幅のリアルタイムな測定が可能となるため、検査結果を迅速に得る目的としては非常に有効である。使用する検出プローブは特に限定はされないが、標的核酸の増幅産物と相補的2本鎖を形成可能な核酸プローブとインターカレーター性蛍光色素、もしくは、インターカレーター性蛍光色素を標識した核酸プローブで、かつ標的核酸と形成した相補的2本鎖部分に前記インターカレーター性蛍光色素部分がインターカレートすることによって蛍光特性が変化するべく構成された核酸プローブを例示することができる。
【0029】
なお、流路、流路に接続したチャンバーまたは流路に接続した検出用チップの少なくとも一部が、標的核酸の増幅を検出することが可能となるようにマイクロ流体チップを設計しておくことで、混合された試薬をマイクロ流体チップから排出することなく、検査結果を迅速に得ることが可能となる。具体的には、吸光度測定、蛍光測定または目視による測定などの光学的検出や表面プラズモン共鳴を利用した検出が可能となるように、光透過性材料を使用したり、光透過用の穴を設けることが例示できる。また、電気化学的検出が可能となるように導電性材料を使用したり、振動子を使用して水晶発振子マイクロバランス法などの検出を可能とすることが例示できる。
【発明の効果】
【0030】
本発明により、所定温度で反応が初めて開始されることが必要な反応をマイクロ流体チップで実施する際にも、複数の試薬を定量的に送液する高度な制御や、流路内での液体の定量機構なしに、高効率かつ高精度な反応を行うことができる。
【0031】
また、本発明の一態様として核酸増幅反応を行う場合において、固体状態の試薬に検査項目に特異的な成分であるプライマー試薬を含むことで、試薬の取り違えの可能性を低減させることができる。さらに固体状態の試薬にプライマー試薬、基質試薬、酵素試薬およびその他の試薬を含むことで、標的核酸の増幅に必要な試薬は試料だけとなり、試料をマイクロ流体チップに導入することで核酸増幅反応を行うことができるため、試薬の分注などの技能や設備のない個人や小病院などが使用することが可能となる。また固体状態の試薬および/または液体状態の試薬に検出プローブを含むことで、標的核酸の増幅を検出することが可能であるマイクロ流体チップを提供する。
【実施例】
【0032】
以下、実施例を用いてさらに詳細に説明するが、本発明はこれらに限定される物ではない。
【0033】
実施例1記載の番号(1)から(8)は、一定温度条件下で核酸増幅反応が開始されることで増幅効率が向上する核酸増幅反応の一つであるTRC法を、本発明に則りマイクロ流体チップ上で実施したものである。一方、実施例1記載の番号(9)から(15)は、従来の方法である核酸増幅に必要な試薬を全て混合した後、マイクロ流体チップ上の流路に導入する方法である。さらに、(16)から(19)は、通常の容器におけるTRC法である。これらの結果を比較することで、マイクロ流体チップで核酸増幅反応を行う際、本発明を適用することの優位性が明らかとなった。
【0034】
実施例1 核酸増幅マイクロ流体チップにおけるTRC法の適用とその効果
(1)図2の形状のアクリル製チップ(流路幅:500μm、流路深さ:500μm)と図3の形状のラミネートフィルム(フィルム厚さ:100μm)を、10%濃度の牛血清アルブミンに一定時間浸漬し、純水ですすいでから風乾した。同時に、図5(試薬組成表1)に示した組成の試薬A、試薬Bを調製した。
【0035】
(2)調製した試薬Aを図2のアクリル製チップ上の流路1、2、3の中央付近に2μlづつ滴下後、該チップをマイナス80℃で凍結し、その後、凍結乾燥機にて流路上の試薬Aを凍結乾燥した。
【0036】
(3)凍結乾燥した試薬Aが保持されたアクリル製チップを、牛血清アルブミンを処理した図3のラミネートフィルムを熱圧着で張り合わせ、液体状態の試薬を送液可能な流路および液体導入口(図4(10、11、12))と液体排出口(図4(13、14、15))を有するマイクロ流体チップを作製した。
【0037】
(4)作製したマイクロ流体チップを、表面温度が44.0℃に調整されたホットプレート上に設置した。
【0038】
(5)試薬Bを、マイクロ流体チップの液体導入口(図4(10、11、12))に5μlずつ導入し、それぞれの液体導入口には、液体状態の試薬を送液するためにシリンジポンプを接続した。
【0039】
(6)試薬Bを導入後、毎分10μlの送液速度に設定したシリンジポンプを動作させ、液体導入口に導入した試薬Bを送液した。試薬Bが凍結乾燥状態で流路中に保持されている試薬Aの位置に到達後、試薬Bにより試薬Aが速やかに溶解された様子が観察された。試薬Bが試薬Aを全て溶解させた後、シリンジポンプによる送液を停止し、そのまま流路内で25分間インキュベートした。
【0040】
(7)インキュベート終了後、シリンジポンプによる送液を再開し、流路内の試薬Aと試薬Bの混合液を液体排出口(図4(13、14、15))から回収した。
【0041】
(8)回収した試薬Aと試薬Bの混合液の2μlをアガロースゲルで電気泳動を行った後、SYBR GreenIIで染色し、デンシトメーターで増幅産物RNAのバンド濃度を定量した。
【0042】
(9)図2の形状のアクリル製チップ(流路幅:500μm、流路深さ:500μm)と図3の形状のラミネートフィルム(フィルム厚さ:100μm)を、10%濃度の牛血清アルブミンに一定時間浸漬し、純水ですすいでから風乾した。同時に、図6(試薬組成表2)に示した組成の試薬を調製した。
【0043】
(10)牛血清アルブミン処理を施したアクリル製チップに、牛血清アルブミンを処理したラミネートフィルムを熱圧着で張り合わせ、液体状態の試薬を送液可能な流路および液体導入口と液体排出口を有するマイクロ流体チップ(図4)を作製した。
【0044】
(11)上記のマイクロ流体チップを、表面温度が44.0℃に調整されたホットプレート上に設置した。
【0045】
(12)図6(試薬組成表2)記載の試薬Aと試薬Bの混合液を、マイクロ流体チップの液体導入口(図4(10、11、12))に5μlずつ導入し、それぞれの液体導入口には、試薬Aと試薬Bの混合液を送液するためにシリンジポンプを接続した。
【0046】
(13)試薬Aと試薬Bの混合液を導入後、毎分10μlの送液速度に設定したシリンジポンプを動作させ、液体導入口に導入した試薬Aと試薬Bの混合液を送液した。試薬Aと試薬Bの混合液が流路の中央付近に到達後シリンジポンプによる送液を停止し、そのまま流路内で25分間インキュベートした。
【0047】
(14)インキュベート終了後、シリンジポンプによる送液を再開し、流路内の試薬Aと試薬Bの混合液を液体排出口(図4(13、14、15))より回収した。
【0048】
(15)回収した試薬Aと試薬Bの混合液の2μlをアガロースゲルで電気泳動を行った後、SYBR GreenIIで染色し、デンシトメーターで増幅産物RNAのバンド濃度を定量した。
【0049】
(16)図6(試薬組成表2)に示した組成の試薬を作製し、試薬Aの25μlを0.5ml容PCRチューブに分注した。
【0050】
(17)上記の試薬Aを44℃で5分間保温後、試薬組成表2記載の試薬Bを5μl添加した。また、あらかじめ加温しないで試薬を混合した場合の核酸増幅効率と比較するため、44℃で5分間の保温なしに試薬Bの5μlを添加したものも平行して実施した。
【0051】
(18)引き続き上記2通りの方法で試薬が混合されたPCRチューブを、44℃で25分間保温しRNA増幅反応を行った。
【0052】
(19)上記溶液の2μlをアガロースゲルで電気泳動を行った後、SYBR GreenIIで染色し、デンシトメーターで増幅産物RNAのバンド濃度を定量した。
【0053】
(20)図5および図6に記載の標準RNAとは、mecA(メチシリン耐性黄色ブドウ球菌の細胞壁合成酵素PBP2’遺伝子配列(非特許文献6参照))を含む2183塩基のRNAであり、この標準RNAをRNA希釈液(10mM Tris−HCl (pH8.0)、0.1mM EDTA、1mM DTT、0.5U/μl RNase Inhibitor)で1000コピー/5μlになるように調製しRNA試料とした。
【0054】
(21)試薬組成表1および2に記載の第一のオリゴヌクレオチド、第二のオリゴヌクレオチド、第三のオリゴヌクレオチドはそれぞれ以下の通りである。
第一のオリゴヌクレオチド(配列表の配列番号1に記載のもの、T7RNAポリメレース・プロモーター配列含有センスプライマー)
第二のオリゴヌクレオチド(配列表の配列番号2に記載のもの、アンチセンスプライマー)
第三のオリゴヌクレオチド(配列表の配列番号3に記載のもの、3’末端をアミノ基修飾)
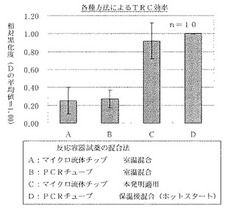
図7に示したように、アガロースゲル電気泳動で増幅産物量を数値化した結果、本発明の方法を適用してマイクロ流体チップでTRC法による核酸増幅を行った場合(図7C)、通常容器で通常方法に則って行った場合(図7D)とほぼ同じ効率で核酸が増幅されていることが明らかとなった。一方、あらかじめ一液に混合した試薬を流路に導入した場合(図7A)、得られた増幅産物の量が顕著に少なかった。また、通常容器でTRC法を行ったが、試薬をあらかじめ加温しない状態で混合した場合(図7B)も、同様に低い増幅効率を示した。
【0055】
これらのことから、通常容器でTRC法を行う場合には、図6の試薬Aと試薬Bをそれぞれ保温してから添加することが必要であり、反応容器をマイクロ流体チップに替えても同様であると判断される。また、本発明の方法に則ってマイクロ流体チップでTRC法を行えば、通常容器でホットスタート法を適用した場合と同様な反応効率が得られることが分かる。
【0056】
さらに、図4を見ると明らかなように、マイクロ流体チップ上に作製された流路には特別な定量化機構は存在せず、一定量の試薬を単純に送液するだけで高効率な核酸増幅反応が達成された。
【0057】
実施例2 核酸分析マイクロ流体チップにおけるTRC法による増幅産物の検出
(1)図8の形状のアクリル製チップ(流路幅:500μm、流路深さ:500μm)と図9の形状のラミネートフィルム(フィルム厚さ:100μm)を、10%濃度の牛血清アルブミンに一定時間浸漬し、純水ですすいでから風乾した。同時に、図11(試薬組成表3)に示した組成の試薬A、試薬Bを調製した。また、コントロールとして、標準RNAの替わりに注射用蒸留水を添加した試薬B’を作製した。
【0058】
(2)調製した試薬Aを図8のアクリル製チップ上の流路1、2の中央付近に2μlづつ滴下後、該チップをマイナス80℃の温度で凍結し、その後、凍結乾燥機にて流路上の試薬Bを凍結乾燥した。
【0059】
(3)標的RNAである標準RNAと相補的な配列を有し、かつ3’末端側にビオチンが標識されたインターカレーター標識プローブをDynabeads M280 Streptavidin(DYNAL社製)に固定化し、直径100μmのガラスビーズと混合し、混合ビーズを作製した。
【0060】
(4)混合ビーズを、試薬Aが流路上に凍結乾燥により保持されたアクリル製チップのチャンバー部分(図8(3、4))に導入後、牛血清アルブミンを処理したラミネートフィルムを熱圧着で張り合わせ、試薬を送液可能な流路および液体導入口と液体排出口を有するマイクロ流体チップ(図10)を作製した。
【0061】
(5)上記のマイクロ流体チップを、表面温度が44.0℃に調整されたホットプレート上に設置した。ホットプレートには、チャンバー部分に導入した混合ビーズに含まれるインターカレーター標識プローブの蛍光色素を励起させるため、図10のマイクロ流体チップに対してAの方向から励起光源として青色LEDを照射可能な装置を組み込んだ。同時に、チャンバー部分の下部(ラミネートを張り合わせていない側)に、蛍光色素が発する蛍光を集光するためのホトマルチプライヤーを設置した。
【0062】
(6)試薬BおよびB’を、マイクロ流体チップの別々の液体導入口(図10(9、10))に5μlずつ導入し、それぞれの液体導入口には、サンプルを送液するためにシリンジポンプを接続した。
【0063】
(7)毎分10μlの送液速度に設定したシリンジポンプを動作させ、液体導入口に導入した試薬BおよびB’を送液した。試薬BおよびB’が凍結乾燥状態で流路中に保持されている試薬Aの位置に到達後、試薬BおよびB’により試薬Aが速やかに溶解された様子が観察された。試薬BおよびB’が試薬Aを全て溶解させた後、シリンジポンプによる送液を停止し、そのまま流路内で25分間インキュベートした。
【0064】
(8)インキュベート終了後、青色LEDの照射とホトマルチプライヤーによる集光、およびシリンジポンプによる送液を再開し、流路内の試薬混合液をマイクロ流体チップ上の蛍光検出部チャンバー(図10(13、14))へ送液し、混合液の全てが蛍光検出部チャンバーへ到達後、シリンジポンプによる送液を停止した。
【0065】
(9)送液開始直後からホトマルチプライヤーによる集光を開始し、混合液の全てが蛍光検出部チャンバーに到達後数分間継続した。ホトマルチプライヤーからの電気信号をデータロガーにより蛍光強度の増減をモニターした。
【0066】
(10)図11の試薬組成表3記載の標準RNAは、実施例1で使用したものと同一である。
【0067】
(11)図11の試薬組成表3記載の第一のオリゴヌクレオチド、第二のオリゴヌクレオチド、第三のオリゴヌクレオチドとは実施例1で使用したものと同一である。インターカレーター標識プローブとは、インターカレーター性蛍光色素で標識されたオリゴヌクレオチドプローブのことである。該オリゴヌクレオチドプローブは、オリゴヌクレオチド中のリン原子にリンカーを介してインターカレーター性蛍光色素を結合させたもので、標的核酸と相補的な2本鎖を形成するとインターカレーター部分が前記2本鎖部分にインターカレートして蛍光特性が変化することを特徴とする(非特許文献7参照)。本実施例では、オキサゾールイエローを標識したインターカレーター標識プローブを使用した。該プローブは、配列番号4に記載の配列中の5’末端から6番目の塩基(G)と7番目の塩基(G)の間のリン原子に、インターカレーター性蛍光色素としてオキサゾールイエローを標識したものである。
【0068】
図12に示したように、本発明の方法に則ってマイクロ流体チップで増幅された核酸は、インターカレーター標識プローブの存在下、蛍光強度の増減をモニターすることによって、標的RNAを検出できることが分かった。実施例2においては、インターカレーター標識プローブを固相に固定化したが、遊離の状態で試薬溶液中に存在させて、核酸増幅を経時的にモニターすることも可能であると考えられる。
【図面の簡単な説明】
【0069】
【図1】Y字型流路合流部を有するマイクロ流体チップにおいて、流路に導入した2つの液を同時に送液した際に起こりうる現象の模式図である。送液した二液の先端が揃って合流部に到達しなければ、図のように混合途中に空気を挟み込むことを示している。(時間の流れはPhase1からPhase4の方向)
【図2】板厚2mmのアクリル製チップであり、幅500μm、深さ500μmの流路が3本(1、2、3)作製されている。破線の円で囲まれた付近の流路上に固体状態の試薬を保持させる。
【図3】厚さ100μmのラミネートフィルムであり、図2のチップに張り合わせた際、図2のチップの流路両端部と同位置になるような貫通穴を6箇所有する。チップとの張り合わせ面にはラミネート接着用接着剤が予め塗布されている。
【図4】図2のチップと図3のフィルムをラミネート接着して作製したマイクロ流体チップである。10、11、12および13、14、15は液体導入口および液体排出口である。
【図5】試薬組成表1であり、試薬Aは流路内に固体状態で保持させておく試薬の組成であり、試薬Bは液状のまま液体導入口(図4の10、11、12)に導入し、送液することで固体状態の試薬Aを溶解する。両試薬が混合された際、記載の最終濃度になるようにそれぞれの試薬を調製する。両試薬共に単独で核酸増幅反応は起こらない。
【図6】試薬組成表2であり、通常容器で行う通常のTRC法の場合は、予め保温した25.0μlの試薬Aに5.0μlの試薬Bを添加することにより核酸増幅反応を開始させる。実施例1におけるマイクロ流体チップを用いたTRC法のうち、流路内に試薬の一部を固体状態で保持しない場合の例では、試薬Aおよび試薬Bを作製し、両試薬を混合後速やかに流路内へ導入した。両試薬が混合された際、記載の最終濃度になるようにそれぞれの試薬を調製する。両試薬共に単独で核酸増幅反応は起こらない組成である。
【図7】各種方法で実施したTRC法の核酸増幅効率を示したものである。通常のPCRチューブでホットスタート法を実行した場合(D)の平均値を1.00とした。各データのエラーバーは標準偏差を示す。各データのテスト数は10回である。
【図8】板厚2mmのアクリル製チップであり、幅500μm、深さ500μmの流路が2本(1、2)が作製されている。1、2は液体導入口となり、3、4は蛍光検出部チャンバーとなる。破線の円で囲まれた付近の流路上に固体状態の試薬を保持させる。
【図9】厚さ100μmのラミネートフィルムであり、図8のチップに張り合わせた際、図8のチップの流路両端部と同位置になるような貫通穴を4箇所有する。チップとの張り合わせ面にはラミネート接着用接着剤が予め塗布されている。
【図10】図8のチップと図9のフィルムをラミネート接着して作製したマイクロ流体チップであり、9、10は溶液状態の液体導入口であり、13、14は蛍光検出部チャンバーである。
【図11】試薬組成表3であり、試薬Aは流路内に固体状態で保持させておく試薬の組成であり、試薬Bは液体状態のまま液体導入口(図10の9、10)に導入し、送液することで固体状態の試薬Aを溶解する。両試薬が混合された際、記載の最終濃度になるようにそれぞれの試薬を調製する。両試薬共に単独で核酸増幅反応は起こりえない組成である。
【図12】本発明を適用してマイクロ流体チップでTRC法に則った核酸増幅を行い、インターカレーター標識プローブの蛍光増感で増幅核酸の有無を検出したものである。
【技術分野】
【0001】
本発明は、生化学およびマイクロ流体チップの分野に属するものであり、遺伝子検査や免疫学的検査等の生化学的検査および診断、または化学分析、化学反応に好適なマイクロ流体チップに関するものである。
【背景技術】
【0002】
近年、化学反応や化学分析等を微細化して行うμ−TAS(μ−Total Analysis Systems)が注目を集めている。その背景には、ナノテクノロジーに代表される微細加工技術の進歩や、環境負荷の低減を目指したグリーンケミストリーの考え方の浸透が挙げられる。μ−TASにおいては、従来バルクで行われていた化学反応や化学分析をマイクロ流体チップに集積化することで、必要試薬量の低減、それによる産業廃棄物の削減、操作の簡便性、さらに、反応液容量当たりの反応液と容器との接触面積(比表面積)の増大による攪拌効率向上に起因する、反応時間および分析所要時間の大幅な短縮が期待されている。
【0003】
また、装置全体の小型化に伴う省スペース化、さらに、持ち運び可能なサイズにすることで、必要な場所で必要な分析が迅速に実施可能となり、Point of Care Testing(その場分析)の実現が期待されている。例えば、感染症の診断においては、適切で効果のある治療を行うために感染している生物種を特定する必要があり、免疫学的検査や遺伝子検査が実施されている。
【0004】
遺伝子検査においては、細菌やウィルス由来の核酸を増幅するために、PCR(ポリメレースチェーンリアクション)法の適用が検討されている。しかしながら、従来の遺伝子検査においては、検体の前処理や必要な試薬類の保存や調製、さらには、大掛かりな核酸増幅装置などが必要であり、中央検査室と称される大型の医療機関において主に利用されてきた。
【0005】
一方、マイクロ流体チップに上記の検査項目を集積化することが可能ならば、小病院への各種検査法の導入のみならず、入院患者がベッドサイドで自ら分析することや、ひいては、自宅で簡便に健康状態を把握することも可能となり、QOL(Quality Of Life;生活の質)の向上による豊かな暮らしへの貢献が期待される。
【0006】
上記のように多くの利点が期待されるため、マイクロ流体チップに種々の生化学反応を集積化する試みが研究されている。具体的には、前記した核酸増幅反応であるPCR法(非特許文献1参照)や、電気泳動による核酸分析をマイクロ流体チップ上で実施することが試みられている。
【0007】
PCR法のマイクロ流体チップへの適用においては、PCR法に必要な試薬類および分析対象の鋳型DNAを含む試料をあらかじめ全て混合し、その混合液をマイクロ流体チップ上に作製された流路に導入する方法が取られている。導入された混合液は、流路内でPCR法に基づく温度サイクルを実施されることで鋳型DNAが増幅される。
【0008】
しかしながら、PCR法においては、鋳型DNAの塩基配列や用いるオリゴヌクレオチドプライマーの塩基配列の組み合わせによっては、一般にホットスタート法と称される方法を適用しなければ、鋳型DNAの高効率な増幅が得られない場合がある。ホットスタート法とは、オリゴヌクレオチドプライマーのミスアニーリングに起因する非特異的増幅反応を回避し、目的の増幅産物を得るための方法であり、PCR法の場合、酵素(一般に耐熱菌由来DNAポリメレース)以外の試薬類および鋳型DNAの混合液を、一旦、オリゴヌクレオチドプライマーの変性温度まで加温し、変性温度下で初めて酵素を添加後、通常の温度サイクルを実施することで達成される。
【0009】
PCR法におけるホットスタート法の別の手法として、抗DNAポリメレース抗体とDNAポリメレースとの複合体を室温下で試薬類および鋳型DNAの混合液に添加し、該混合液をオリゴヌクレオチドプライマーの変性温度に加温し、抗DNAポリメレース抗体を変性、失活させ、DNAポリメレースが遊離することでDNAポリメレース活性が現れる方法のように、特別に調製されたDNAポリメレースを用いる方法もある(特許文献1、非特許文献2参照)。このような、ホットスタート法によって初めてPCR法が成功する場合がしばしば見受けられる。
【0010】
一方、RNA増幅反応であるNASBA法(特許文献2および3、非特許文献3および4参照)やTRC法(特許文献4、非特許文献5参照)においても、所定の温度下で酵素類(RNAポリメレース、逆転写酵素など)を添加することが好ましく、室温下で上記酵素類を添加し、その後、通常の反応温度に加温した場合と比較して、増幅効率が向上することが分かっている。
【0011】
【特許文献1】米国特許第5338671号
【特許文献2】特許第3241717号
【特許文献3】特許第2650159号
【特許文献4】特開2000−14400号公報
【非特許文献1】Chee G.Koh et al. Anal.Chem.(2003) 75 :4591−4598
【非特許文献2】Kellogg D.E.et al.Biotechiniques(1994) 16 :1134−1137
【非特許文献3】Compton J.W. Nature(1991) Mar 7;350(6313):91−2
【非特許文献4】Romano J.W. et al. Clin.Lab.Med.(1996) Mar;16(1):89−103
【非特許文献5】Ishigro T.et al. Anal.Biochem.(2003) 314 :77−86
【非特許文献6】Song M.D. et al. FEBS Lett.(1987)Aug 31;221(1):167−71
【非特許文献7】Ishigro T.et al. Nucleic Acid Res.(1996)24;4992−4997
【発明の開示】
【発明が解決しようとする課題】
【0012】
前述のような、核酸増幅反応に必要な試薬のうち、酵素以外の試薬類を所定温度に加温し、所定温度下で酵素類を添加することが必要な核酸増幅反応をマイクロ流体チップ上で実施する場合、所定温度に加温されたマイクロ流体チップの複数の流路内に、複数に構成した核酸増幅試薬を導入し、各流路の合流部で核酸増幅試薬が混合されることで初めて核酸増幅反応が開始される状態の試薬組成となる方法が必要となる。
【0013】
この場合、複数に構成された核酸増幅試薬を定量的に流路に導入し、かつ、それら複数の試薬を同時に送液しながら定量的に混合する必要がある。または、複数に構成された核酸増幅試薬を非定量的に複数の流路内に導入し、流路に作り込まれた液体の定量化機構により複数に構成され導入された試薬を定量的に混合する方法も考えられる。しかしながら、流路内に導入する試薬は極微量(ナノリットルもしくはマイクロリットルのスケール)であるため、極微量な複数の試薬を送液して、流路合流部で定量的に混合することや、流路内で極微量の液体を定量化してから混合することは非常に高度な技術である。
【0014】
この高度な技術を達成する方法として、Y字型またはT字型構造の流路を備えたマイクロ流体チップを用い、流路の合流部で酵素を含まない核酸増幅試薬と酵素類とを合流させ混合する方法が考えられる。この方法によれば、複数に構成した試薬を流路内で予備加熱してから混合させることが可能となり、所定温度下で初めて核酸増幅反応が開始されることが必要な核酸増幅反応への対応が可能となる。しかしながら、このような形状の流路を用いた場合、導入した複数の試薬を定量的に一液に混合するためには、複数の試薬を送液して合流部に同時に到達するような、厳密な送液制御が必要となる。もしも、流路合流部への試薬の到達タイミングがずれたならば、図1に示した状況に陥り、定量的な試薬の混合がなされず、意図した試薬組成と異なる核酸増幅試薬が生成するため、核酸増幅反応の効率低下や再現性の低下につながる恐れがある。
【0015】
また、複数の試薬の混合タイミングが実験ごとおよび実験者ごとに変化することが予想され、それによっても再現性の低下が懸念される。マイクロ流体チップは、臨床診断分野への応用が期待されるものであり、低再現性は実用化への致命的な問題である。
【0016】
本発明は、反応開始前の予備加熱が必要な反応を、マイクロチップ上で実施する際、複数に構成した試薬の送液制御という高度な技術を必要とせず、簡便な方法で高効率な反応を実現することが可能であり、反応の再現性を高めた高精度なマイクロ流体チップおよび反応方法を提供するものである。
【課題を解決するための手段】
【0017】
本発明者は上記課題を解決するべく鋭意研究を重ねた結果、反応に必要な試薬成分の一部または全部の試薬成分をマイクロ流体チップの流路内に固体状態で入れ、マイクロ流体チップを所定温度に保温しておき、そこへ反応に必要な残りの試薬成分を送液することで、固体状態の試薬と送液した液体状態の試薬が混合され、高効率かつ高精度な反応が可能となることを見出した。
【0018】
以下、本発明を詳細に説明する。
【0019】
本発明は、マイクロ流体チップを用いた反応において、反応開始前の予備加熱が必要な場合を含む、全ての反応を実現するための手法に関するものである。本発明は、所定温度下で反応が開始されることが必須要件である核酸増幅反応、例えば、ホットスタート法を適用しなければ特異的な核酸増幅が望めない場合のPCR法などに特に効果的であるが、ホットスタート法を必ずしも必要としない通常のPCR法や各種化学反応においても適用可能である。
【0020】
また本発明は反応開始後の温度条件には関係なく適用することが可能であり、PCR法を本発明に則り実施する際には、温度サイクルを実行可能なヒーターを準備し、その上で実施することで実行可能である。さらに、マイクロ流体チップにおいては通常使用する反応容器と比べ、比表面積が非常に大きくなるため、設定温度への到達速度が高速となる。そのため、DNAポリメレースの核酸重合反応速度が許容する範囲で、温度プログラムのサイクル間隔を短くすることが可能であり、核酸増幅反応が高速化されるメリットがある。
【0021】
本発明の反応に必要な試薬成分とは、反応に必要な試薬成分の全部が混合されることで反応が開始されるものであり、試薬成分のそれぞれの組成は、実施する反応ごとに最適な組成を検討することは言うまでもない。また、反応開始前の予備加熱や所定の温度を要求する反応の実施においては、液体状態の試薬成分は単独で反応が進行しない組成であって、固体状態の試薬を溶解し、固体状態の試薬と液体状態の試薬が混合されることで反応が開始されることが必要である。また固体状態の試薬も、単独で反応が進行しない組成が好ましいが、試薬調製後に速やかに固体化することにより、反応が開始されないならばこの限りではない。ただし本発明においては反応に必要な試薬成分の全部が混合されたときに反応が開始されれば良く、たとえば液体状態の試薬の調整時に予備的な反応が生じたとしても、液体状態の試薬と固体状態の試薬が混合されることで、他の反応が生じる試薬成分となっていれば良い。TRC法の場合を例にあげると、液体状態の試薬に標的核酸を含む試料とオリゴヌクレオチドプライマーが含まれていて、固体状態の試薬に逆転写酵素が含まれている場合、液体状態の試薬の調製時にハイブリダイゼーション反応が生じるが、液体状態の試薬と固体状態の試薬が混合されると逆転写反応が生じるため、本発明の効果を奏する。
【0022】
本発明の反応に必要な試薬成分とは、PCR法の場合を例にあげると、標的核酸を含む試料、増幅反応の基質となるモノヌクレオチド(dNTP)からなる基質試薬、標的核酸またはその相補鎖の配列に相補的結合が可能な配列を含むオリゴヌクレオチドプライマーやオリゴヌクレオチドプローブからなるプライマー試薬および増幅反応の触媒となるDNAポリメレースからなる酵素試薬を含むものであり、TRC法の場合を例にあげると、標的核酸を含む試料、増幅反応の基質となるモノヌクレオチド(dNTP、NTPおよびITP)からなる基質試薬、標的核酸またはその相補鎖の配列に相補的結合が可能な配列を含むオリゴヌクレオチドプライマーやオリゴヌクレオチドプローブからなるプライマー試薬、増幅反応の触媒となる逆転写酵素、RNAポリメレースやその他の酵素(リボヌクレースHなど)からなる酵素試薬を含むものである。また、PCR法およびTRC法ともに上記試薬成分の他にも、核酸増幅反応に必ずしも必須ではないが、核酸増幅反応を最適化するためや試薬の安定性を高めるため、増幅核酸を検出するためなどの試薬(各種無機塩類、DMSO、ソルビトール、インヒビター、DTT、検出プローブなど)からなるその他の試薬が含まれていても良い。これらの標的核酸の増幅に必要な試薬成分を構成する固体状態の試薬および液体状態の試薬を混合することで、増幅反応が開始される。たとえば本発明を利用して遺伝子検査のための核酸増幅反応を行う場合などは、標的核酸を含む試料を試薬溶液に混合することで液体状態の試薬を調製し、この液体状態の試薬をマイクロ流体チップに導入することが高効率かつ高精度な反応を行うためには好適である。
【0023】
本発明の固体状態の試薬は、反応に必要な試薬成分の一部または全部を含んでいても良く、含まれる試薬の種類や数には限定されない。核酸増幅反応の場合を例にあげると、たとえば基質試薬の一部を固体状態の試薬とし、残りの一部を液体状態の試薬としていても良い。また各試薬成分は液体状態の試薬および固体状態の試薬の両方に含まれていても良く、特にその他の試薬のうち、試薬の安定性を向上させるという目的のために添加されているものに関しては、液体状態の試薬および固体状態の試薬の両方に含まれることで効果的となる場合もある。また核酸増幅反応の場合を例にあげると、検査項目に特異的な成分の全部を、固体状態の試薬または液体状態の試薬のどちらか一方に含ませておくことにより、試薬の取り違えによる誤診の可能性の低減が期待される。たとえば、検査項目に特異的であるプライマー試薬を固体状態の試薬に含ませておくことで、測定する標的核酸を含む試料と固体状態の試薬が入ったマイクロ流体チップを正しく組み合わせれば、液体状態の試薬は検査項目に依存せず広く使用できる試薬とすることが可能な場合、試薬の取り違えの可能性が低減することとなる。また、液体状態の試薬についてはその保存性から冷凍保存(−20℃以下)が望ましいが、試薬を固体状態にすることで常温保存が可能となる。したがって、凍結融解により安定性が損なわれる試薬成分が含まれる場合は、その試薬成分を固体状態の試薬とすることが好ましい。
【0024】
本発明の固体状態の試薬は常温で固体であり、液体状態の試薬は常温で液体であることを特徴とする。また固体状態の試薬における固体化の方法は特に限定されないが、液体状態の試薬と混合されることで迅速に溶解することが好適であるため、試薬成分を風乾、真空乾燥または凍結乾燥したものであることが好ましい。なお、固体化により酵素試薬の活性が低下するような場合には、酵素試薬を液体状態の試薬とすることが例示できる。
【0025】
本発明の液体状態の試薬は、基本的には固体状態の試薬と補完的であり、両者が混合されることにより反応が開始されうる成分を含むものである。たとえば、固体状態の試薬に反応に必要な成分の全部が含まれている場合、液体状態の試薬の成分は水のみとなることが例示できる。したがって実験者は水のみをマイクロ流体チップに導入することで、反応を開始することができる。また核酸増幅反応の場合を例にあげると、固体状態の試薬に、標的核酸を含む試料以外の反応に必要な成分が含まれている場合には、実験者が標的核酸を含む試料または希釈して調製した試料をマイクロ流体チップに導入し、標的核酸の増幅反応を開始することとなる。また、固体状態の試薬がプライマー試薬のみからなる場合、液体状態の試薬の成分は標的核酸を含む試料、酵素試薬、基質試薬およびその他の試薬から構成され、実験者は試料を酵素試薬、基質試薬およびその他の試薬と混合した後にマイクロ流体チップに導入することで固体状態の試薬を溶解させ、標的核酸の増幅反応を行うこととなる。
【0026】
本発明において固体状態の試薬は調製したものを流路内の最適な位置に配置すれば良く、その配置方法には限定されず、流路内の1ヶ所に配置しても複数に分割して配置してもよい。ただし液体状態の試薬の送液を妨げるように固体状態の試薬が流路を塞いでしまってはならず、少なくとも送液により生じる気体を通過させるように配置されなければならない。したがってたとえば流路に設けられたチャンバー内に固体状態の試薬を配置することなどが例示できる。また固体状態の試薬を流路内ヘ導入する方法として、試薬を流路上で乾燥させて固体化することや、別容器で固体化させた固体状態の試薬を気体を通過させるように必要量配置することでも、送液の妨げとはならない態様として例示することができる。特に試薬を流路内で乾燥させて固体化する方法においては、流路に固体状態の試薬が密着するため、マイクロ流体チップの取り扱いが簡便となるという点において好ましい。
【0027】
また、マイクロ流体チップは複数の分析項目をワンチップ上に集積可能であり、ハイスループットな核酸分析が実現可能であるが、その場合、一項目当たりの流路の構造や送液制御がシンプルなほど、より多くの項目を集積化することが容易となる。そこで、本発明の方法を適用することで、マイクロ流体チップ上に複雑な分岐流路や合流流路などが不要となり、ハイスループットな集積化マイクロ流体チップの実現可能性が向上する。
【0028】
さらに、標的核酸の増幅反応においては、標的核酸の増幅に伴い蛍光特性が変化するように設計された検出プローブを固体状態の試薬または液体状態の試薬のどちらか一方、または両方にあらかじめ添加しておくことにより、標的核酸増幅のリアルタイムな測定が可能となるため、検査結果を迅速に得る目的としては非常に有効である。使用する検出プローブは特に限定はされないが、標的核酸の増幅産物と相補的2本鎖を形成可能な核酸プローブとインターカレーター性蛍光色素、もしくは、インターカレーター性蛍光色素を標識した核酸プローブで、かつ標的核酸と形成した相補的2本鎖部分に前記インターカレーター性蛍光色素部分がインターカレートすることによって蛍光特性が変化するべく構成された核酸プローブを例示することができる。
【0029】
なお、流路、流路に接続したチャンバーまたは流路に接続した検出用チップの少なくとも一部が、標的核酸の増幅を検出することが可能となるようにマイクロ流体チップを設計しておくことで、混合された試薬をマイクロ流体チップから排出することなく、検査結果を迅速に得ることが可能となる。具体的には、吸光度測定、蛍光測定または目視による測定などの光学的検出や表面プラズモン共鳴を利用した検出が可能となるように、光透過性材料を使用したり、光透過用の穴を設けることが例示できる。また、電気化学的検出が可能となるように導電性材料を使用したり、振動子を使用して水晶発振子マイクロバランス法などの検出を可能とすることが例示できる。
【発明の効果】
【0030】
本発明により、所定温度で反応が初めて開始されることが必要な反応をマイクロ流体チップで実施する際にも、複数の試薬を定量的に送液する高度な制御や、流路内での液体の定量機構なしに、高効率かつ高精度な反応を行うことができる。
【0031】
また、本発明の一態様として核酸増幅反応を行う場合において、固体状態の試薬に検査項目に特異的な成分であるプライマー試薬を含むことで、試薬の取り違えの可能性を低減させることができる。さらに固体状態の試薬にプライマー試薬、基質試薬、酵素試薬およびその他の試薬を含むことで、標的核酸の増幅に必要な試薬は試料だけとなり、試料をマイクロ流体チップに導入することで核酸増幅反応を行うことができるため、試薬の分注などの技能や設備のない個人や小病院などが使用することが可能となる。また固体状態の試薬および/または液体状態の試薬に検出プローブを含むことで、標的核酸の増幅を検出することが可能であるマイクロ流体チップを提供する。
【実施例】
【0032】
以下、実施例を用いてさらに詳細に説明するが、本発明はこれらに限定される物ではない。
【0033】
実施例1記載の番号(1)から(8)は、一定温度条件下で核酸増幅反応が開始されることで増幅効率が向上する核酸増幅反応の一つであるTRC法を、本発明に則りマイクロ流体チップ上で実施したものである。一方、実施例1記載の番号(9)から(15)は、従来の方法である核酸増幅に必要な試薬を全て混合した後、マイクロ流体チップ上の流路に導入する方法である。さらに、(16)から(19)は、通常の容器におけるTRC法である。これらの結果を比較することで、マイクロ流体チップで核酸増幅反応を行う際、本発明を適用することの優位性が明らかとなった。
【0034】
実施例1 核酸増幅マイクロ流体チップにおけるTRC法の適用とその効果
(1)図2の形状のアクリル製チップ(流路幅:500μm、流路深さ:500μm)と図3の形状のラミネートフィルム(フィルム厚さ:100μm)を、10%濃度の牛血清アルブミンに一定時間浸漬し、純水ですすいでから風乾した。同時に、図5(試薬組成表1)に示した組成の試薬A、試薬Bを調製した。
【0035】
(2)調製した試薬Aを図2のアクリル製チップ上の流路1、2、3の中央付近に2μlづつ滴下後、該チップをマイナス80℃で凍結し、その後、凍結乾燥機にて流路上の試薬Aを凍結乾燥した。
【0036】
(3)凍結乾燥した試薬Aが保持されたアクリル製チップを、牛血清アルブミンを処理した図3のラミネートフィルムを熱圧着で張り合わせ、液体状態の試薬を送液可能な流路および液体導入口(図4(10、11、12))と液体排出口(図4(13、14、15))を有するマイクロ流体チップを作製した。
【0037】
(4)作製したマイクロ流体チップを、表面温度が44.0℃に調整されたホットプレート上に設置した。
【0038】
(5)試薬Bを、マイクロ流体チップの液体導入口(図4(10、11、12))に5μlずつ導入し、それぞれの液体導入口には、液体状態の試薬を送液するためにシリンジポンプを接続した。
【0039】
(6)試薬Bを導入後、毎分10μlの送液速度に設定したシリンジポンプを動作させ、液体導入口に導入した試薬Bを送液した。試薬Bが凍結乾燥状態で流路中に保持されている試薬Aの位置に到達後、試薬Bにより試薬Aが速やかに溶解された様子が観察された。試薬Bが試薬Aを全て溶解させた後、シリンジポンプによる送液を停止し、そのまま流路内で25分間インキュベートした。
【0040】
(7)インキュベート終了後、シリンジポンプによる送液を再開し、流路内の試薬Aと試薬Bの混合液を液体排出口(図4(13、14、15))から回収した。
【0041】
(8)回収した試薬Aと試薬Bの混合液の2μlをアガロースゲルで電気泳動を行った後、SYBR GreenIIで染色し、デンシトメーターで増幅産物RNAのバンド濃度を定量した。
【0042】
(9)図2の形状のアクリル製チップ(流路幅:500μm、流路深さ:500μm)と図3の形状のラミネートフィルム(フィルム厚さ:100μm)を、10%濃度の牛血清アルブミンに一定時間浸漬し、純水ですすいでから風乾した。同時に、図6(試薬組成表2)に示した組成の試薬を調製した。
【0043】
(10)牛血清アルブミン処理を施したアクリル製チップに、牛血清アルブミンを処理したラミネートフィルムを熱圧着で張り合わせ、液体状態の試薬を送液可能な流路および液体導入口と液体排出口を有するマイクロ流体チップ(図4)を作製した。
【0044】
(11)上記のマイクロ流体チップを、表面温度が44.0℃に調整されたホットプレート上に設置した。
【0045】
(12)図6(試薬組成表2)記載の試薬Aと試薬Bの混合液を、マイクロ流体チップの液体導入口(図4(10、11、12))に5μlずつ導入し、それぞれの液体導入口には、試薬Aと試薬Bの混合液を送液するためにシリンジポンプを接続した。
【0046】
(13)試薬Aと試薬Bの混合液を導入後、毎分10μlの送液速度に設定したシリンジポンプを動作させ、液体導入口に導入した試薬Aと試薬Bの混合液を送液した。試薬Aと試薬Bの混合液が流路の中央付近に到達後シリンジポンプによる送液を停止し、そのまま流路内で25分間インキュベートした。
【0047】
(14)インキュベート終了後、シリンジポンプによる送液を再開し、流路内の試薬Aと試薬Bの混合液を液体排出口(図4(13、14、15))より回収した。
【0048】
(15)回収した試薬Aと試薬Bの混合液の2μlをアガロースゲルで電気泳動を行った後、SYBR GreenIIで染色し、デンシトメーターで増幅産物RNAのバンド濃度を定量した。
【0049】
(16)図6(試薬組成表2)に示した組成の試薬を作製し、試薬Aの25μlを0.5ml容PCRチューブに分注した。
【0050】
(17)上記の試薬Aを44℃で5分間保温後、試薬組成表2記載の試薬Bを5μl添加した。また、あらかじめ加温しないで試薬を混合した場合の核酸増幅効率と比較するため、44℃で5分間の保温なしに試薬Bの5μlを添加したものも平行して実施した。
【0051】
(18)引き続き上記2通りの方法で試薬が混合されたPCRチューブを、44℃で25分間保温しRNA増幅反応を行った。
【0052】
(19)上記溶液の2μlをアガロースゲルで電気泳動を行った後、SYBR GreenIIで染色し、デンシトメーターで増幅産物RNAのバンド濃度を定量した。
【0053】
(20)図5および図6に記載の標準RNAとは、mecA(メチシリン耐性黄色ブドウ球菌の細胞壁合成酵素PBP2’遺伝子配列(非特許文献6参照))を含む2183塩基のRNAであり、この標準RNAをRNA希釈液(10mM Tris−HCl (pH8.0)、0.1mM EDTA、1mM DTT、0.5U/μl RNase Inhibitor)で1000コピー/5μlになるように調製しRNA試料とした。
【0054】
(21)試薬組成表1および2に記載の第一のオリゴヌクレオチド、第二のオリゴヌクレオチド、第三のオリゴヌクレオチドはそれぞれ以下の通りである。
第一のオリゴヌクレオチド(配列表の配列番号1に記載のもの、T7RNAポリメレース・プロモーター配列含有センスプライマー)
第二のオリゴヌクレオチド(配列表の配列番号2に記載のもの、アンチセンスプライマー)
第三のオリゴヌクレオチド(配列表の配列番号3に記載のもの、3’末端をアミノ基修飾)
図7に示したように、アガロースゲル電気泳動で増幅産物量を数値化した結果、本発明の方法を適用してマイクロ流体チップでTRC法による核酸増幅を行った場合(図7C)、通常容器で通常方法に則って行った場合(図7D)とほぼ同じ効率で核酸が増幅されていることが明らかとなった。一方、あらかじめ一液に混合した試薬を流路に導入した場合(図7A)、得られた増幅産物の量が顕著に少なかった。また、通常容器でTRC法を行ったが、試薬をあらかじめ加温しない状態で混合した場合(図7B)も、同様に低い増幅効率を示した。
【0055】
これらのことから、通常容器でTRC法を行う場合には、図6の試薬Aと試薬Bをそれぞれ保温してから添加することが必要であり、反応容器をマイクロ流体チップに替えても同様であると判断される。また、本発明の方法に則ってマイクロ流体チップでTRC法を行えば、通常容器でホットスタート法を適用した場合と同様な反応効率が得られることが分かる。
【0056】
さらに、図4を見ると明らかなように、マイクロ流体チップ上に作製された流路には特別な定量化機構は存在せず、一定量の試薬を単純に送液するだけで高効率な核酸増幅反応が達成された。
【0057】
実施例2 核酸分析マイクロ流体チップにおけるTRC法による増幅産物の検出
(1)図8の形状のアクリル製チップ(流路幅:500μm、流路深さ:500μm)と図9の形状のラミネートフィルム(フィルム厚さ:100μm)を、10%濃度の牛血清アルブミンに一定時間浸漬し、純水ですすいでから風乾した。同時に、図11(試薬組成表3)に示した組成の試薬A、試薬Bを調製した。また、コントロールとして、標準RNAの替わりに注射用蒸留水を添加した試薬B’を作製した。
【0058】
(2)調製した試薬Aを図8のアクリル製チップ上の流路1、2の中央付近に2μlづつ滴下後、該チップをマイナス80℃の温度で凍結し、その後、凍結乾燥機にて流路上の試薬Bを凍結乾燥した。
【0059】
(3)標的RNAである標準RNAと相補的な配列を有し、かつ3’末端側にビオチンが標識されたインターカレーター標識プローブをDynabeads M280 Streptavidin(DYNAL社製)に固定化し、直径100μmのガラスビーズと混合し、混合ビーズを作製した。
【0060】
(4)混合ビーズを、試薬Aが流路上に凍結乾燥により保持されたアクリル製チップのチャンバー部分(図8(3、4))に導入後、牛血清アルブミンを処理したラミネートフィルムを熱圧着で張り合わせ、試薬を送液可能な流路および液体導入口と液体排出口を有するマイクロ流体チップ(図10)を作製した。
【0061】
(5)上記のマイクロ流体チップを、表面温度が44.0℃に調整されたホットプレート上に設置した。ホットプレートには、チャンバー部分に導入した混合ビーズに含まれるインターカレーター標識プローブの蛍光色素を励起させるため、図10のマイクロ流体チップに対してAの方向から励起光源として青色LEDを照射可能な装置を組み込んだ。同時に、チャンバー部分の下部(ラミネートを張り合わせていない側)に、蛍光色素が発する蛍光を集光するためのホトマルチプライヤーを設置した。
【0062】
(6)試薬BおよびB’を、マイクロ流体チップの別々の液体導入口(図10(9、10))に5μlずつ導入し、それぞれの液体導入口には、サンプルを送液するためにシリンジポンプを接続した。
【0063】
(7)毎分10μlの送液速度に設定したシリンジポンプを動作させ、液体導入口に導入した試薬BおよびB’を送液した。試薬BおよびB’が凍結乾燥状態で流路中に保持されている試薬Aの位置に到達後、試薬BおよびB’により試薬Aが速やかに溶解された様子が観察された。試薬BおよびB’が試薬Aを全て溶解させた後、シリンジポンプによる送液を停止し、そのまま流路内で25分間インキュベートした。
【0064】
(8)インキュベート終了後、青色LEDの照射とホトマルチプライヤーによる集光、およびシリンジポンプによる送液を再開し、流路内の試薬混合液をマイクロ流体チップ上の蛍光検出部チャンバー(図10(13、14))へ送液し、混合液の全てが蛍光検出部チャンバーへ到達後、シリンジポンプによる送液を停止した。
【0065】
(9)送液開始直後からホトマルチプライヤーによる集光を開始し、混合液の全てが蛍光検出部チャンバーに到達後数分間継続した。ホトマルチプライヤーからの電気信号をデータロガーにより蛍光強度の増減をモニターした。
【0066】
(10)図11の試薬組成表3記載の標準RNAは、実施例1で使用したものと同一である。
【0067】
(11)図11の試薬組成表3記載の第一のオリゴヌクレオチド、第二のオリゴヌクレオチド、第三のオリゴヌクレオチドとは実施例1で使用したものと同一である。インターカレーター標識プローブとは、インターカレーター性蛍光色素で標識されたオリゴヌクレオチドプローブのことである。該オリゴヌクレオチドプローブは、オリゴヌクレオチド中のリン原子にリンカーを介してインターカレーター性蛍光色素を結合させたもので、標的核酸と相補的な2本鎖を形成するとインターカレーター部分が前記2本鎖部分にインターカレートして蛍光特性が変化することを特徴とする(非特許文献7参照)。本実施例では、オキサゾールイエローを標識したインターカレーター標識プローブを使用した。該プローブは、配列番号4に記載の配列中の5’末端から6番目の塩基(G)と7番目の塩基(G)の間のリン原子に、インターカレーター性蛍光色素としてオキサゾールイエローを標識したものである。
【0068】
図12に示したように、本発明の方法に則ってマイクロ流体チップで増幅された核酸は、インターカレーター標識プローブの存在下、蛍光強度の増減をモニターすることによって、標的RNAを検出できることが分かった。実施例2においては、インターカレーター標識プローブを固相に固定化したが、遊離の状態で試薬溶液中に存在させて、核酸増幅を経時的にモニターすることも可能であると考えられる。
【図面の簡単な説明】
【0069】
【図1】Y字型流路合流部を有するマイクロ流体チップにおいて、流路に導入した2つの液を同時に送液した際に起こりうる現象の模式図である。送液した二液の先端が揃って合流部に到達しなければ、図のように混合途中に空気を挟み込むことを示している。(時間の流れはPhase1からPhase4の方向)
【図2】板厚2mmのアクリル製チップであり、幅500μm、深さ500μmの流路が3本(1、2、3)作製されている。破線の円で囲まれた付近の流路上に固体状態の試薬を保持させる。
【図3】厚さ100μmのラミネートフィルムであり、図2のチップに張り合わせた際、図2のチップの流路両端部と同位置になるような貫通穴を6箇所有する。チップとの張り合わせ面にはラミネート接着用接着剤が予め塗布されている。
【図4】図2のチップと図3のフィルムをラミネート接着して作製したマイクロ流体チップである。10、11、12および13、14、15は液体導入口および液体排出口である。
【図5】試薬組成表1であり、試薬Aは流路内に固体状態で保持させておく試薬の組成であり、試薬Bは液状のまま液体導入口(図4の10、11、12)に導入し、送液することで固体状態の試薬Aを溶解する。両試薬が混合された際、記載の最終濃度になるようにそれぞれの試薬を調製する。両試薬共に単独で核酸増幅反応は起こらない。
【図6】試薬組成表2であり、通常容器で行う通常のTRC法の場合は、予め保温した25.0μlの試薬Aに5.0μlの試薬Bを添加することにより核酸増幅反応を開始させる。実施例1におけるマイクロ流体チップを用いたTRC法のうち、流路内に試薬の一部を固体状態で保持しない場合の例では、試薬Aおよび試薬Bを作製し、両試薬を混合後速やかに流路内へ導入した。両試薬が混合された際、記載の最終濃度になるようにそれぞれの試薬を調製する。両試薬共に単独で核酸増幅反応は起こらない組成である。
【図7】各種方法で実施したTRC法の核酸増幅効率を示したものである。通常のPCRチューブでホットスタート法を実行した場合(D)の平均値を1.00とした。各データのエラーバーは標準偏差を示す。各データのテスト数は10回である。
【図8】板厚2mmのアクリル製チップであり、幅500μm、深さ500μmの流路が2本(1、2)が作製されている。1、2は液体導入口となり、3、4は蛍光検出部チャンバーとなる。破線の円で囲まれた付近の流路上に固体状態の試薬を保持させる。
【図9】厚さ100μmのラミネートフィルムであり、図8のチップに張り合わせた際、図8のチップの流路両端部と同位置になるような貫通穴を4箇所有する。チップとの張り合わせ面にはラミネート接着用接着剤が予め塗布されている。
【図10】図8のチップと図9のフィルムをラミネート接着して作製したマイクロ流体チップであり、9、10は溶液状態の液体導入口であり、13、14は蛍光検出部チャンバーである。
【図11】試薬組成表3であり、試薬Aは流路内に固体状態で保持させておく試薬の組成であり、試薬Bは液体状態のまま液体導入口(図10の9、10)に導入し、送液することで固体状態の試薬Aを溶解する。両試薬が混合された際、記載の最終濃度になるようにそれぞれの試薬を調製する。両試薬共に単独で核酸増幅反応は起こりえない組成である。
【図12】本発明を適用してマイクロ流体チップでTRC法に則った核酸増幅を行い、インターカレーター標識プローブの蛍光増感で増幅核酸の有無を検出したものである。
【特許請求の範囲】
【請求項1】
液体導入口と、液体導入口に接続された流路と、流路に接続された液体排出口または流路に接続された空気穴と、を有するマイクロ流体チップにおいて、流路内に反応に必要な試薬成分の一部または全部が固体状態で入っており、反応に必要な残りの試薬成分を液体状態で液体導入口へ導入し流路に送液することで、液体状態の試薬と固体状態の試薬が接触し、固体状態の試薬が溶解することにより反応が開始されることを特徴とする、マイクロ流体チップ。
【請求項2】
固体状態の試薬が、風乾、真空乾燥または凍結乾燥により調製された試薬であることを特徴とする、請求項1のマイクロ流体チップ。
【請求項3】
反応が一定温度で開始される必要があるものであることを特徴とする、請求項1または2のマイクロ流体チップ。
【請求項4】
反応が核酸増幅反応であることを特徴とする、請求項1ないし3のいずれかのマイクロ流体チップ。
【請求項5】
固体状態の試薬にプライマー試薬を含むことを特徴とする、請求項4のマイクロ流体チップ。
【請求項6】
固体状態の試薬にプライマー試薬、基質試薬、酵素試薬およびその他の試薬を含むことを特徴とする、請求項4のマイクロ流体チップ。
【請求項7】
固体状態の試薬および/または液体状態の試薬に、標的核酸の増幅に伴い蛍光特性が変化するように設計された検出プローブを含むことを特徴とする、請求項4ないし6のいずれかのマイクロ流体チップ。
【請求項8】
流路、流路に接続したチャンバーまたは流路に接続した検出用チップの少なくとも一部が、標的核酸の増幅を検出することが可能となるように、光透過性材料、導電性材料または振動子からなることを特徴とする、請求項4ないし7のいずれかのマイクロ流体チップ。
【請求項9】
液体導入口と、液体導入口に接続され反応に必要な試薬成分の一部または全部が固体状態で入っている流路と、流路に接続された液体排出口または流路に接続された空気穴と、を有するマイクロ流体チップに、反応に必要な残りの試薬成分を液体状態で液体導入口へ導入し流路に送液することで、液体状態の試薬と固体状態の試薬が接触し、固体状態の試薬が溶解することにより反応が開始されることを特徴とする、マイクロ流体チップによる反応方法。
【請求項10】
固体状態の試薬にプライマー試薬、基質試薬、酵素試薬およびその他の試薬を含み、液体状態の試薬に標的核酸を含む試料を含むことを特徴とする、請求項9のマイクロ流体チップによる反応方法。
【請求項11】
固体状態の試薬および/または液体状態の試薬に、標的核酸の増幅に伴い蛍光特性が変化するように設計された検出プローブを含むことを特徴とする、請求項9または10のマイクロ流体チップによる反応方法。
【請求項1】
液体導入口と、液体導入口に接続された流路と、流路に接続された液体排出口または流路に接続された空気穴と、を有するマイクロ流体チップにおいて、流路内に反応に必要な試薬成分の一部または全部が固体状態で入っており、反応に必要な残りの試薬成分を液体状態で液体導入口へ導入し流路に送液することで、液体状態の試薬と固体状態の試薬が接触し、固体状態の試薬が溶解することにより反応が開始されることを特徴とする、マイクロ流体チップ。
【請求項2】
固体状態の試薬が、風乾、真空乾燥または凍結乾燥により調製された試薬であることを特徴とする、請求項1のマイクロ流体チップ。
【請求項3】
反応が一定温度で開始される必要があるものであることを特徴とする、請求項1または2のマイクロ流体チップ。
【請求項4】
反応が核酸増幅反応であることを特徴とする、請求項1ないし3のいずれかのマイクロ流体チップ。
【請求項5】
固体状態の試薬にプライマー試薬を含むことを特徴とする、請求項4のマイクロ流体チップ。
【請求項6】
固体状態の試薬にプライマー試薬、基質試薬、酵素試薬およびその他の試薬を含むことを特徴とする、請求項4のマイクロ流体チップ。
【請求項7】
固体状態の試薬および/または液体状態の試薬に、標的核酸の増幅に伴い蛍光特性が変化するように設計された検出プローブを含むことを特徴とする、請求項4ないし6のいずれかのマイクロ流体チップ。
【請求項8】
流路、流路に接続したチャンバーまたは流路に接続した検出用チップの少なくとも一部が、標的核酸の増幅を検出することが可能となるように、光透過性材料、導電性材料または振動子からなることを特徴とする、請求項4ないし7のいずれかのマイクロ流体チップ。
【請求項9】
液体導入口と、液体導入口に接続され反応に必要な試薬成分の一部または全部が固体状態で入っている流路と、流路に接続された液体排出口または流路に接続された空気穴と、を有するマイクロ流体チップに、反応に必要な残りの試薬成分を液体状態で液体導入口へ導入し流路に送液することで、液体状態の試薬と固体状態の試薬が接触し、固体状態の試薬が溶解することにより反応が開始されることを特徴とする、マイクロ流体チップによる反応方法。
【請求項10】
固体状態の試薬にプライマー試薬、基質試薬、酵素試薬およびその他の試薬を含み、液体状態の試薬に標的核酸を含む試料を含むことを特徴とする、請求項9のマイクロ流体チップによる反応方法。
【請求項11】
固体状態の試薬および/または液体状態の試薬に、標的核酸の増幅に伴い蛍光特性が変化するように設計された検出プローブを含むことを特徴とする、請求項9または10のマイクロ流体チップによる反応方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2007−43998(P2007−43998A)
【公開日】平成19年2月22日(2007.2.22)
【国際特許分類】
【出願番号】特願2005−233698(P2005−233698)
【出願日】平成17年8月11日(2005.8.11)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成19年2月22日(2007.2.22)
【国際特許分類】
【出願日】平成17年8月11日(2005.8.11)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

