改良されたワクチン
【課題】改良されたワクチンを提供する。
【解決手段】改良されたワクチンを開示する。改良されたワクチンは、細胞内標的化配列に連結されるか、これを含む免疫原性標的蛋白質を含むコーディング配列をコードするヌクレオチド配列を含み、該コーディング配列は制御要素に作動可能に連結される個体を免疫する方法を開示する。免疫原性標的蛋白質は病原体抗原、癌関連抗原、又は自己免疫疾患に関連した抗原である。更に、細胞内での免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列を包含する。
【解決手段】改良されたワクチンを開示する。改良されたワクチンは、細胞内標的化配列に連結されるか、これを含む免疫原性標的蛋白質を含むコーディング配列をコードするヌクレオチド配列を含み、該コーディング配列は制御要素に作動可能に連結される個体を免疫する方法を開示する。免疫原性標的蛋白質は病原体抗原、癌関連抗原、又は自己免疫疾患に関連した抗原である。更に、細胞内での免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列を包含する。
【発明の詳細な説明】
【発明の開示】
【0001】
発明の属する技術分野
本発明は、改良された防御性治療用ワクチンおよび抗原に対して予防用および/または治療用に免疫応答を誘導する改良法に関する。
発明の背景
DNAワクチンは、障害、疾患、症状および感染に関連した抗原に向けて各個体における免疫応答を誘導することにより、そのような障害、疾患、症状および感染を予防および治療するための手段を提供する新しい分野を代表する。本質的には、遺伝子発現に必要な制御要素に作動可能なように連結された抗原コード配列を含むプラスミドDNAを個体に投与する。その個体の細胞はプラスミドDNAを取り込んで、コード配列を発現する。そうして生成された抗原は、免疫応答が向けられる標的となる。抗原に対して向けられた免疫応答は、あらゆるアレルゲン、病原、癌細胞、または抗原に対する免疫応答により認識されるエピトープを包含する自己免疫細胞に対する各個体の予防上または治療上の利益を提供した。
【0002】
DNAワクチン類は、裸の(naked)および便利化(facilitated)ワクチンを包含する。さらに、それらは、組織へ物質を投与するためのいくつかの異なる装置を包含する様々な技術により投与されてよい。公表された文献は、DNA技術の側面を記載し且つ該技術を用いて得られた結果の多くの報告を引用するいくつかの総説文献を包含する。以下の総説文献は、各々の総説文献において引用された各文献がそうであるように引用により本明細書に編入され、そしてDNAワクチン技術を論じる:McDonell W.M and F.K.Askari 19996 New Engl. J. Med. 334 (1) 42-45;Robinson, A, 1995 Can. Med. Assoc. J. 152 (10): 1629-1632;Fynan, E. F. et al. 1995 Int. J. Immunpharmac. 17 (2) 79-83; Pardoll, D. M. and A. M. Beckerleg 1995 Immunity 3: 165-169; およびSpooner et al. 1995 Gene Therapy 2: 173-180。
【0003】
そのようなワクチンは、しばしば病原体感染またはヒト疾患に対して予防上または治療上人を免疫するのに効果があるが、改良されたワクチンに関する要求がある。高められた免疫応答を生じる組成物および方法に関する要求がある。
発明の概要
本発明は、真核細胞内の発現に必要な制御要素に作動可能に連結した免疫原性標的抗原をコードするヌクレオチド配列を含むプラスミドに関するが、但し、免疫原性抗原をコードするヌクレオチド配列は、細胞内での免疫原性標的抗原の輸送(trafficking)を指示するシグナル配列をコードするヌクレオチド配列を包含する。いくつかの好ましい態様において、免疫原性標的抗原は、病原体抗原、癌関連抗原または自己免疫疾患に関連した細胞に連結した抗原である。いくつかの態様において、細胞内の免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列は、免疫原性標的抗原を分泌させるかまたは細胞質、細胞膜、小胞体、リソソームに局在させるシグナル配列をコードする。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は非天然シグナル配列である。
【0004】
本発明は、個体において抗原に対する免疫応答を誘導するための方法に関し、真核細胞における発現に必要な制御要素に作動可能に連結した免疫原性標的抗原をコードするヌクレオチド配列を含むプラスミドを、個体に投与する工程からなるが、但し、免疫原性抗原をコードするヌクレオチド配列は、細胞内での免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列を含む。いくつかの好ましい態様において、免疫原性標的抗原は、病原体抗原、癌関連抗原または自己免疫疾患に関連した細胞に連結した抗原である。いくつかの態様において、細胞内の免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列は、免疫原性標的抗原を分泌させるかまたは細胞質、細胞膜、小胞体、リソソームに局在させるシグナル配列をコードする。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は非天然シグナル配列である。
【0005】
本発明は、真核細胞における発現に必要な制御要素に作動可能に連結した免疫原性標的抗原をコードするヌクレオチド配列を含む、改良されたDNAワクチンに関するが、但し、免疫原性抗原をコードするヌクレオチド配列は、細胞内での免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列を含む。いくつかの好ましい態様において、免疫原性標的抗原は、病原体抗原、癌関連抗原または自己免疫疾患に関連した細胞に連結した抗原である。いくつかの態様において、細胞内の免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列は、免疫原性標的抗原を分泌させるかまたは細胞質、細胞膜、小胞体、リソソームに局在させるシグナル配列をコードする。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は非天然シグナル配列である。
【0006】
本発明は、病原体、癌または自己免疫疾患に対して個体を免疫するための方法に関し、真核細胞における発現に必要な制御要素に作動可能に連結した免疫原性標的抗原をコードするヌクレオチド配列を含むDNAワクチンを個体に投与する工程からなるが、但し、免疫原性抗原をコードするヌクレオチド配列は、細胞内での免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列を包含する。いくつかの好ましい態様において、免疫原性標的抗原は、病原体抗原、癌関連抗原または自己免疫疾患に関連した細胞に連結した抗原である。いくつかの態様において、細胞内の免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列は、免疫原性標的抗原を分泌させるかまたは細胞質、細胞膜、小胞体、リソソームに局在させるシグナル配列をコードする。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は非天然シグナル配列である。
発明の詳細な説明
本発明は、改良されたDNAワクチンに関する。DNAワクチンは、米国特許第5,589,466号および第5,973,972号、およびPCTの公開出願、PCT/US90/01515,PCT/US93/02338,PCT/US93/048131およびPCT/US94/00899、及びそれらの中に引用される優先出願に記載されており、それらは引用により本明細書に編入される。それらの出願において記載された送達プロトコルに加えて、別のDNA送達方法が、米国特許第4,945,050号および第5,036,006号に記載されており、両者は引用により本明細書に編入される。さらに、上記総説文献は、DNAワクチン技術を記載し、そしてDNAワクチンの例を引用する。各々の場合に、プラスミドDNAは、プラスミドを取り込んだ個体の細胞に送達されて、該プラスミドによりコードされる免疫原性標的蛋白質を発現する。免疫原性標的蛋白質に対して生じた免疫応答は、ワクチン投与された個体に対して、予防上または治療上の利益を提供する。
【0007】
本発明によれば、免疫原性標的蛋白質をコードするプラスミド上のコーディング配列は、その蛋白質上の存在が発現された蛋白質の特定の細胞内の位置をもたらすアミノ酸配列をコードするコーディング配列と共に提供される。細胞内蛋白質輸送を指示するアミノ酸配列であって、DNAワクチン組成物として用いられるプラスミド構築物中に含まれる免疫原性蛋白質のコーディング配列中に含まれるアミノ酸配列をコードするヌクレオチド配列は、特定の免疫応答の増強をもたらす細胞内の特定のエリアへの局在化を指示する。
【0008】
本明細書にて用いられるとおり、用語「遺伝構築物」は、免疫原性標的蛋白質並びに細胞内の蛋白質輸送を指示するアミノ酸配列をコードするコーディング配列を含むプラスミドを意味し、該コーディング配列は真核細胞内でのコーディング配列の発現に必要な制御要素に作動可能に連結している。DNA発現のための制御要素は、プロモーターおよびポリアデニル化シグナルを含む。さらに、他の要素、例えばコザック領域も、遺伝構築物に含めてよい。開始および停止シグナルは、しばしばコーディング配列の考慮すべき部分である、必要な制御要素である。本発明の遺伝構築物のコーディング配列は、機能的な開始および停止シグナルを含む。
【0009】
本明細書にて用いられるとおり、用語「免疫原性標的蛋白質」は、症状、感染、疾患または障害に関連した蛋白質、例えばアレルゲン、病原体抗原、癌細胞または自己免疫疾患に関与する細胞に関連した抗原に向けられた免疫応答のための標的である抗原を指すことを意味する。免疫原性標的抗原は、DNAワクチン中で用いられる遺伝構築物のコーディング配列によりコードされる。DNAワクチンはワクチン接種された個体(vaccinated individual)に投与されて、遺伝構築物がその個体の細胞に取り込まれて、コーディング配列が発現され、そして免疫原性標的蛋白質が生成される。免疫原性標的蛋白質は、その個体において免疫原性標的蛋白質に対する免疫応答を誘導する。免疫応答は、症状、感染、疾患または障害に関連した対、例えばアレルゲン、病原体抗原、癌細胞または自己免疫疾患に関与する細胞に関連した抗原に対して向けられる。即ち、ワクチン投与された個体は、予防または治療のために免疫されて、症状、感染、疾患または障害を予防または治療してよい。免疫原性標的蛋白質は、免疫応答のために標的蛋白質として作用する本発明の遺伝構築物によりコードされるペプチドおよび蛋白質を意味する。用語「免疫原性標的評定蛋白質」は、免疫応答が引き出されうる蛋白質を意味する。免疫原性標的蛋白質は、アレルゲン、病原体からの蛋白質、または不所望な蛋白質または細胞種、例えば癌細胞または免疫を必要とする自己免疫疾患に関与する細胞との間で、少なくともエピトープを共用する。免疫原性標的蛋白質に対する免疫応答は、アレルゲン、病原体からの蛋白質、または不所望な蛋白質または細胞種が関連する特定の感染または疾患から個体を防御し、そして治療する。免疫原性標的蛋白質は、免疫が要求される蛋白質と同一である必要はない。さらに、免疫原性標的蛋白質は、免疫が要求される蛋白質に交差反応する免疫応答を誘導することができなければならない。
【0010】
本明細書において用いられるとおり、用語「非天然シグナル配列」は、免疫原性標的抗原の細胞内の輸送(trafficking)を指示する外来シグナル配列であるシグナル配列を意味する。非天然シグナル配列は、天然においては免疫原性標的蛋白質に連結されることが見いだされていないがシグナル配列をコードするヌクレオチド配列が免疫原性標的抗原をコードするヌクレオチド配列と連結した遺伝構築物を製造することにより生じる。いくつかの態様において、天然シグナル配列は、免疫原性標的蛋白質をコードするコーディング配列から取り出されてよく、そして天然配列が蛋白質を指示する位置とは異なる位置に蛋白質を局在させる非天然シグナル配列かまたは天然配列が蛋白質を指示する位置と同じ位置に蛋白質を局在させる非天然シグナル配列に置換されてよい。
【0011】
本発明によれば、免疫原性標的蛋白質は、細胞内のその局在を指示する配列を含む。蛋白質の局在を指示する、天然に生じる配列は、シグナル配列を供給するか、キメラ蛋白質をデザインするか、または該配列を免疫原性蛋白質配列中に移植することにより、DNAワクチンの免疫原性標的蛋白質に取り込んでよい。DNAワクチンはプラスミドであり、そして免疫原性標的蛋白質のコーディング配列は標準分子生物学方法論により操作されて、細胞内蛋白質輸送を指示するシグナル配列を含む免疫原性標的蛋白質か、または細胞内蛋白質輸送を指示する領域を含むキメラ免疫原性標的蛋白質をコードするコーディング配列を生じる。さらに、日常的な分子生物学の技術を用いることにより、免疫原性標的蛋白質のアミノ酸配列を変化させて、細胞内蛋白質標的化を指示する配列をその配列中に含ませてよい。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は、非天然シグナル配列である。公知の技術を用いて、一つの蛋白質のシグナル配列をコードするヌクレオチド配列を修飾し、単離し、そして異なる蛋白質をコードするコーディング配列に連結してよい。
【0012】
免疫原性標的蛋白質が指示される位置は、免疫原性標的蛋白質に対してその個体が生じる免疫応答に影響する。DNAワクチンの遺伝構築物によりコードされる免疫原性標的蛋白質の細胞内標的化は、免疫原性標的抗原に対して増強された免疫応答をもたらすことが発見された。細胞内標的化シグナルのコーディング配列を、免疫原性標的蛋白質のコーディング配列の一部として提供することにより、免疫原性標的蛋白質が細胞の一部に局在する。ある局在は免疫応答の増強された特定種と関連していることが発見された。例えば、小胞体、特に粗面小胞体に保持されるかまたはリサイクルされる指示蛋白質(directing protein)が、特定の細胞内局在を標的とする配列を含まないワクチンを用いて観察された誘導に比して増強されたCTL応答をワクチン接種動物中においてもたらすことが発見された。
【0013】
本発明の改良は、DNAワクチンを投与した個体の細胞において生成された免疫原性標的蛋白質の細胞内局在を指示するための遺伝物質の包含に関する。
本発明は、遺伝物質によりコードされる蛋白質およびペプチドに対して免疫応答を誘導するために、個体の細胞に遺伝物質を導入する方法に関する。該方法は、個体の組織に、発現のために必要とされる制御要素に作動可能なように連結したコーディング配列を含むDNAを投与する工程からなる。コーディング配列は、細胞内輸送シグナルに関するコーディング配列に連結したかまたは含む、免疫原性標的蛋白質のコーディング配列を含む。
【0014】
細胞内輸送シグナルは当業界においてよく知られている。
いくつかの態様において、蛋白質は分泌される。そのような蛋白質は、N−末端疎水性配列を含む。RNAが翻訳された場合、N末端の疎水性配列は蛋白質を粗面小胞体に固着させる。疎水性配列は、次にプロテアーゼにより切り外されて、蛋白質を分泌する。本発明のいくつかの態様において、免疫原性標的蛋白質は、細胞内で発現された場合に免疫原性標的蛋白質の分泌を指示するN末端疎水性リーダー配列を含んでよい。
【0015】
いくつかの態様において、蛋白質は膜結合である。そのような蛋白質は、N−末端疎水性配列および内部疎水性領域を含む。分泌された形態におけるように、RNAが翻訳された場合、N末端の疎水性配列は蛋白質を粗面小胞体に固着させる。N末端疎水性配列は、次にプロテアーゼにより切り外される。蛋白質は同じ分泌経路に従うが、内部疎水性配列が分泌を阻害して蛋白質は膜結合になる。本発明のいくつかの態様において、免疫原性標的蛋白質は、N末端疎水性リーダー配列および細胞内にて発現された場合に膜結合蛋白質になる免疫原性標的蛋白質をもたらす内部疎水性配列を含んでよい。
【0016】
いくつかの態様において、蛋白質は細胞質に局在される。そのような蛋白質は、N−末端疎水性配列を含まない。RNAが翻訳された場合、蛋白質は粗面小胞体に固着せず、そして蛋白質は細胞性になる。本発明のいくつかの態様において、免疫原性標的蛋白質はN末端疎水性リーダー配列を含まず、よって免疫原性標的蛋白質は細胞内で発現された場合に細胞質蛋白質になる。
【0017】
いくつかの態様において、蛋白質はリソソーム中に局在化する。そのような蛋白質は、リソソームへの蛋白質の局在を指示する配列DKQTLL(配列番号:1)を含んでよい。本発明のいくつかの態様において、免疫原性標的蛋白質は配列DKQTLL(配列番号:1)を含むことにより、免疫原性標的蛋白質が細胞内で発現された場合にリソソームに向けられる。
【0018】
いくつかの態様において、蛋白質はゴルジ体からERに局在化される。そのような蛋白質は、C末端に、蛋白質がERにリサイクルされるように局在化を指示する配列KDEL(配列番号:2)を含んでよい。本発明のいくつかの態様において、免疫原性標的蛋白質はC末端に配列KDEL(配列番号:2)を含むことにより、免疫原性標的蛋白質が細胞内で発現された場合にERに向けられる。
【0019】
そのような「ERリサイクルシグナル」の他の例は、アデノウイルスからのE19蛋白質のC末端配列として報告される。その蛋白質は、それがMHCsに結合し、そして免疫応答誘導の一部としてT細胞リセプターと複合体形成する場所である表面においてMHCにより提示される蛋白質を効果的に負荷し続けるERに局在化される。E109蛋白質はヘキサペプチドDEKKMP(配列番号:3)である。いくつかの態様において、C末端に配列DEKKMP(配列番号:3)を含むことにより、蛋白質はERに局在化する。本発明のいくつかの態様において、免疫原性標的蛋白質はC末端に配列DEKKMP(配列番号:3)を含むことにより、免疫原性標的蛋白質はERに向けられる。
【0020】
増強しようと意図する免疫応答の種類に依存して、別の細胞内局在化が望まれる。クラスI免疫応答の場合には、細胞内で合成された蛋白質は分解され、そしてそれらがMHCs上に負荷される場所であるERに輸送され、そして次に細胞表面に異動してCD8+T細胞のT細胞リセプターと複合体形成する。この作用は、CTL応答を導く。クラスII免疫応答の場合には、蛋白質はCD4+T細胞と相互作用し、抗体応答に関連した細胞を包含する、ヘルパーT細胞を必要とする抗原提示細胞(APCs)と複合体形成する。
【0021】
クラスI免疫応答を増強するために、細胞質またはERへの蛋白質の局在化は、そのような蛋白質がクラスI経路により接近可能になることを可能にする。
クラスII免疫応答を増強するために、膜貫通またはリソソームへの蛋白質の局在化または蛋白質の分泌は、そのような蛋白質がクラスII経路により接近可能になることを可能にする。
【0022】
本発明は、細胞内局在化のための配列を含む免疫原性標的蛋白質のコーディング配列を含むDNAワクチンとして有用な遺伝構築物を提供する。
いくつかの態様において、遺伝構築物は、Biocca, S. et al. 1990 EMBO J. 9: 101-108に記載された局在化リーダー配列を含む。遺伝構築物は、図6Aに記載されたのと同じ配列でそれらのリーダー配列を含む。特定すれば、リーダー配列は、興味のある蛋白質のプロモーターとコーディング配列の間で蛋白質のN末端において生じる。いくつかの態様において、本発明の遺伝構築物は、本出願の図6Aに記載されたリーダー配列の一つを含む。いくつかの態様において、本発明の遺伝構築物は、本出願の図6Bに記載されたリーダー配列の一つを含む。
【0023】
いくつかの態様において、遺伝構築物は、小胞体内での保持のためのアデノウイルスE19蛋白質からの末端ヘキサペプチドを含む。DNAワクチンの免疫原性標的蛋白質のC末端がDEKKMP(配列番号:3)である場合、蛋白質はERに保持される。
【0024】
いくつかの態様において、遺伝構築物は、小胞体内での保持のためのC末端クオドラペプチドを含む。DNAワクチンの免疫原性標的蛋白質のC末端がKDEL(配列番号:2)である場合、蛋白質はERに保持される。
【0025】
図7Aおよび7Bは、ER保持のためのいくつかのC末端配列を示す。Jackson, M. R., et al. 1990 EMBO J. 9: 3153-3162は、図7AのC末端配列が、通常はER内に保持されない蛋白質のC末端において連結された場合に、キメラ蛋白質のER保持をもたらすことを報告する。
【0026】
いくつかの態様において、遺伝構築物は、免疫原性標的蛋白質のC末端テイルにおいてリソソーム標的化対(doublets)を含む。C末端テイルは最後の20-30アミノ酸である。該対LLおよび/またはYQおよび/またはQYを含むことにより、蛋白質はリソソームに向けられる。いくつかの態様において、一つまたは複数のリソソーム標的化対を含むC末端テイルは、膜貫通蛋白質の細胞質テイルである。いくつかの態様において、該対は、免疫原性蛋白質の配列中において最後の30アミノ酸中に含まれる。
【0027】
本発明によれば、アレルゲン、病原体または異常な疾患関連細胞または蛋白質に対して個体を予防上および/または治療上免疫する組成物および方法が提供される。標的蛋白質、即ちアレルゲン、病原体または抗原または標的とされる細胞との間で少なくともエピトープを共用するペプチドまたは蛋白質をコードする遺伝物質、および細胞内輸送シグナルをコードする遺伝物質。遺伝物質は個々の細胞中で発現されて、免疫応答が引き出される免疫原性標的として機能する。細胞内輸送シグナルの存在は、所望の免疫応答を誘導するのにより効果的な細胞内の位置への蛋白質の局在化を指示する。アレルゲン、病原体または抗原または細胞と反応する、その結果の免疫応答は、細胞内輸送シグナルを欠く同様な遺伝構築物により誘導された免疫応答に比して増強される。
【0028】
本発明は、アレルゲン、病原体または個体自身の「異常な」細胞に特に関連した蛋白質に対する免疫応答を引き出すために有用である。本発明は、病原体蛋白質に対する免疫応答が病原体に対する防御性免疫を提供するように、アレルゲン、または病原因子および生物に対して個体を免疫するのに有用である。本発明は、高増殖性の細胞に特に関連した標的蛋白質に対する免疫応答を引き出すことにより、癌のような高増殖性疾患および障害と格闘するのに有用である。本発明は、自己免疫疾患に関与する細胞に特に関連した標的蛋白質に対する免疫応答を引き出すことにより自己免疫疾患および障害と格闘するのに有用である。
【0029】
本発明によれば、DNAは、細胞内輸送配列または細胞内輸送配列を含むペプチド配列のいずれかに連結した免疫原性標的配列をコードする。シグナル配列は、細胞の通常の蛋白質プロセシングの一部として切り離される。さらに、免疫原性標的蛋白質をコードするDNAは、蛋白質のコーディング配列中に細胞内輸送配列を含んでよい。DNA発現のための制御要素は、プロモーターおよびポリアデニル化シグナルを含む。さらに、他の要素、例えばコザック領域も遺伝構築物中に含まれてよい。
【0030】
本明細書において用いられるとおり、用語「発現可能な形態」は、個体の細胞中に存在する場合にコーディング配列が発現されるように免疫原性標的蛋白質をコードするコーディング配列に作動可能なように連結された必要な制御要素を含む遺伝構築物を意味する。
【0031】
本明細書において用いられるとおり、用語「エピトープを共用する(share an epitope)」は、他の蛋白質のエピトープと同一かまたは実質的に類似の少なくとも一つのエピトープを含む蛋白質を意味する。
【0032】
本明細書において用いられるとおり、用語「実質的に類似のエピトープ」は、蛋白質のエピトープと同一ではない構造を有するが、それでもなおその蛋白質と交差反応する細胞または体液の免疫応答を呼び出すエピトープを意味する。
【0033】
遺伝構築物は、遺伝子発現に必要な制御要素に作動可能なように連結した細胞内輸送配列を含む免疫原性標的蛋白質をコードするヌクレオチド配列を含む。
細胞から取り出された場合、遺伝構築物は細胞内において染色体外分子として存在するか、および/または細胞の染色体DNAにインテグレートされて保持されてよい。DNAは、一つまたは複数のプラスミドの形態で別の遺伝物質として残るように細胞中に導入されてよい。別法として、染色体にインテグレートしうる直鎖状DNAを細胞中に導入してよい。細胞中にDNAを導入する場合、染色体へのDNAインテグレーションを促進する薬剤を付加してよい。インテグレーションを促進するのに有用なDNA配列をDNA分子中に含ませてもよい。別法として、RNAを細胞に投与してよい。セントロメア、テロメアおよび複製開始点を含む直鎖ミニクロモソームとして遺伝構築物を提供することも意図される。遺伝構築物は、弱毒化生存微生物または細胞中で生存する組換え微生物ベクター中の遺伝物質の一部を残してよい。遺伝構築物は、遺伝物質が細胞の染色体にインテグレートされるかまたは染色体外に残るように、組換えウイルスワクチンのゲノムの一部であってよい。
【0034】
遺伝構築物は、核酸分子の遺伝子発現に必要な制御要素を含む。要素は、プロモーター、開始コドン、停止コドン、およびポリアデニル化シグナルを含む。さらに、免疫原性標的蛋白質をコードする配列の遺伝子発現にはエンハンサーがしばしば必要である。これらの要素は、所望の蛋白質をコードする配列に作動可能なように連結すること、および制御要素が投与された個体において作動することが必要である。
【0035】
開始コドンおよび停止コドンは、一般に、免疫原性標的蛋白質をコードするヌクレオチド配列の一部であると考えられる。しかしながら、これらの要素は、遺伝構築物が投与される個体において機能することが必要である。開始および停止コドンは、コーディング配列のフレーム中になければならない。
【0036】
用いられるプロモーターおよびポリアデニル化シグナルは個体の細胞内で機能しなければならない。
本発明の実施、特にヒトのための遺伝ワクチンの製造における実施のために有用なプロモーターの例は、限定されないが、シミアンウイルス40(SV40)のプロモーター、マウス乳癌ウイルス(MMTV)プロモーター、ヒト免疫不全ウイルス(HIV)例えばHIVロングターミナルリピート(LTR)プロモーター、モロニーウイルス、ALV、サイトメガロウイルス(CMV)例えばCMV介在初期プロモーター、エプスタインバールウイルス(EBV)、ラウスサルコーマウイルス(RSV)並びにヒト遺伝子例えばヒトアクチン、ヒトミオシン、ヒトヘモグロビン、ヒト筋肉クレアチンおよびヒトメタロチオネインからのプロモーターを含む。
【0037】
本発明の実施、特にヒトのための遺伝ワクチンの製造における実施のために有用なポリアデニル化シグナルの例は、限定されないが、SV40ポリアデニル化シグナルおよびLTRポリアデニル化シグナルを含む。特に、SV40ポリアデニル化シグナルと呼ばれる、pCEP4プラスミド(Invitrogen, サンディエゴ、CA)中のSV40ポリアデニル化シグナルを用いる。
【0038】
DNA発現に必要な制御要素に加えて、他の要素もDNA分子中に含ませてよい。そのような付加的要素は、エンハンサーを含む。エンハンサーは、ヒトアクチン、ヒトミオシン、ヒトヘモグロビン、ヒト筋肉クレアチンおよびウイルスエンハンサー例えばCMV,RSVおよびEBVからのエンハンサーを含む群から選択されるが、これらに限定されない。
【0039】
染色体外に構築物を保持して細胞内で複数コピーの構築物を生成するためには、遺伝構築物は哺乳類の複製開始点を伴うことができる。Invitrogen社(サンディエゴ、CA)のプラスミドpCEP4およびpREP4は、エプスタインバールウイルスおよびインテグレーション無しに高コピー数のエピソーム複製を生じる核抗原EBNA-1コーディング領域を含む。
【0040】
免疫化の適用に関するいくつかの好ましい態様において、標的蛋白質、IL-12蛋白質をコードするヌクレオチド配列および、付加的にそのような標的蛋白質に対する免疫応答をさらに増強する蛋白質の遺伝子を含む核酸分子が送達される。そのような遺伝子の例は、サイトカインおよびリンフォカイン、例えばα−インターフェロン、ガンマ−インターフェロン、血小板由来成長因子(PDGF)、GC-SF,GM-CSF,TNF,表皮成長因子(EGF)、IL-1,IL-2,IL-4,IL-6,IL-8,IL-10およびB7.2をコードする遺伝子である。いくつかの態様において、GM-CSFをコードする遺伝子が免疫化組成物において使用される遺伝構築物に含まれることが好ましい。
【0041】
何らかの理由により遺伝構築物を受容する細胞を除去することが望まれるなら、細胞破壊のための標的物として機能する付加的要素を加えてよい。発現可能な形態でのヘルペスチミジンキナーゼ(tk)遺伝子を遺伝構築物中に含ませることができる。薬剤ガングシクロビア(gangcyclovir)は個体に投与することができ、そしてその薬剤はtkを生産するあらゆる細胞の選択的殺傷を引き起こし、即ち、遺伝構築物と共に細胞の選択的破壊のための手段を提供する。
【0042】
蛋白質の生成を最大にするためには、構築物が投与される細胞における遺伝子発現にうまく適合した制御配列を選択してよい。さらに、細胞中においてもっとも効率よく転写されるコドンを選択してよい。当業者であれば、細胞中において機能するDNA構築物を生産することができる。
【0043】
本発明の方法は、個体の組織へ核酸分子を投与する工程を含む。いくつかの態様において、核酸分子は、筋肉内、鼻腔内、腹腔内、皮下、皮内、または局所または膣、直腸、尿道、頬および舌下からなる群から選択される粘膜組織への洗浄により投与される。
【0044】
いくつかの態様において、核酸分子は促進剤の投与と共に細胞内に送達される。促進剤は、ポリヌクレオチド機能エンハンサーまたは遺伝ワクチン促進剤とも呼ばれる。促進剤は、1993年1月26日に出願された米国出願連続番号08/008,342、1993年3月11日に出願された米国出願連続番号08/029,336、1993年9月21日に出願された米国出願連続番号08/125,012、および1994年1月26日に出願された国際出願連続番号PCT/US94/00899に記載されており、引用により各々は編入される。さらに、促進剤は、PCT出願連続番号PCT/US95/04071に記載されており、引用により編入される。核酸分子と共に投与される促進剤は、核酸分子との混合物として投与されるか、または同時にか、核酸分子の投与前または後に、別個に投与されてよい。さらに、トランスフェクト薬剤および/または複製剤および/または炎症剤として機能してよく、そして促進剤が有るか無しかに拘わらず同時に投与されてよい他の薬剤は、成長因子、サイトカインおよびリンフォカイン、例えばα−インターフェロン、ガンマ−インターフェロン、血小板由来成長因子(PDGF)、GC-SF,GM-CSF,TNF,表皮成長因子(EGF)、IL-1,IL-2,IL-4,IL-6,IL-8,IL-10およびB7.2並びに繊維芽細胞成長因子、界面活性剤、例えば、免疫刺激性複合体(ISCOMOS)、フロイント不完全アジュバント、モノホスホリルリピッドA(MPL)を含むLPS類似体、ムラミルペプチド、キノン類似体および小胞例えばスクアランおよびスクアランを含み、そしてヒアルウロン酸も遺伝構築物と共に投与してよい。
【0045】
いくつかの態様において、本発明の遺伝構築物は、安息香酸エステル類、アニリド類、アミジン類、ウレタン類およびそれらの塩酸塩からなる群から選択される促進剤、例えば局所麻酔剤のファミリーの促進剤と共に製剤化されるかまたは共に投与される。
【0046】
いくつかの好ましい態様における促進剤は、以下の式:
【0047】
Ar−R1−O−R2−R3
または
【0048】
Ar−N−R1−R2−R3
または
【0049】
R4−N−R5−R6
または
【0050】
R4−O−R1−N−R7
(式中、
Arはベンゼン、p-アミノベンゼン、m-アミノベンゼン、o-アミノベンゼン、置換されたベンゼン、置換されたp-アミノベンゼン、置換されたm-アミノベンゼン、置換されたo-アミノベンゼンであり、但し、アミノベンゼン中のアミノ基はアミノ、C1−C5アルキルアミン、C1−C5,C1−C5ジアルキルアミンであることができ、そして置換された化合物中の置換基はハロゲン、C1−C5アルキルおよびC1−C5アルコキシであり;
R1はC=Oであり;
R2はC1−C10アルキルであり、分枝アルキルを含み;
R3は水素、アミン、C1−C5アルキルアミン、C1−C5,C1−C5ジアルキルアミンであり;
R2+R3は環状アルキル、C1−C10アルキルで置換された環状アルキル、環状脂肪族アミン、C1−C10アルキルで置換された環状脂肪族アミン、複素環、C1−C10アルキルで置換された複素環(C1−C10アルキルN−置換された複素環を含む)を形成でき;
R4はAr、R2またはC1−C5アルコキシ、環状アルキル、C1−C10アルキルで置換された環状アルキル、環状脂肪族アミン、C1−C10で置換された複素環およびC1−C10アルコキシで置換された複素環(C1−C10アルキルN−置換された複素環を含む)であり;
R5はC=NHであり;
R6はAr、R2またはC1−C5アルコキシ、環状アルキル、C1−C10アルキルで置換された環状アルキル、環状脂肪族アミン、C1−C10で置換された複素環およびC1−C10アルコキシで置換された複素環(C1−C10アルキルN−置換された複素環を含む)であり;そして
R7はAr、R2またはC1−C5アルコキシ、環状アルキル、C1−C10アルキルで置換された環状アルキル、環状脂肪族アミン、C1−C10で置換された複素環およびC1−C10アルコキシで置換された複素環(C1−C10アルキルN−置換された複素環を含む)である)
の一つを有する化合物であってよい。
【0051】
エステルの例は、安息香酸エステル類、例えばピペロカイン、メプリルカインおよびイソブカイン;パラ−アミノ安息香酸エステル類、例えばプロカイン、テトラカイン、ブテサミン、プロポキシカインおよびクロロプロカイン;メタブサミンおよびプリマカインを含むメタ−アミノ安息香酸エステル類;およびパラ−アミノ安息香酸エステル類、例えばパレトキシカインを含む。アニリドの例は、リドカイン、エチドカイン、メピバカイン、ブピバカイン、ピロカインおよびプリロカインを含む。そのような化合物の他の例は、ジブカイン、ベンゾカイン、ジクロニン、プラモキシン、プロパラカイン、ブタカイン、ベノキシネート、カーボカイン、メチルブピバカイン、ブタシンピクレート、フェナカイン、ジオサン、ルカイン、イントラカイン、ヌペルカイン、メタブトキシカイン、ピリドカイン、ビフェナミンおよび植物由来の二環式、例えばコカイン、シナモイルコカイン、トルキシリンおよびコカエチレンおよび塩酸と複合したそのような化合物の全てを含む。
【0052】
好ましい態様において、促進剤はブピバカインである。ブピバカインとメピバカインの違いは、メピバカインのN−メチル基に代えてブピバカインがN−ブチル基を有することである。化合物は、そのNにおいて、C1−C10を有してよい。化合物は、プロカインおよびクロロプロカインのようにハロゲンで置換されてよい。アニリドが好ましい。
【0053】
促進剤は、遺伝構築物の前、同時または後に投与する。促進剤および遺伝構築物は同じ組成物中に製剤化してよい。
ブピバカイン-HClは、2-ピペリジンカルボキサミド、1-ブチル-N-(2,6-ジメチルフェニル)−一塩酸塩、一水塩として化学的にデザインされ、そして多くの源から薬学上の用途の為に広く市販されており、Astra Pharmaceutical Product Inc.(ウエストボロ、MA)およびSanofi Winthrop Pharmaceuticals(ニューヨーク、NY)、Eastman Kodak(ロチェスター、NY)を含む。ブピバカインは、メチルパラベンを含むか含まないかに拘わらず、そしてエピネフィリンを含むか含まないかに拘わらず製剤化されて市販されている。そのようなあらゆる製剤を使用してよい。0.25%,0.5%および0.75%の濃度において薬学上の用途の為に市販されており、本発明に用いてよい。違う濃度、特に0.05%から1.0%の間は所望の効果を引き出すが、望むのであれば調製してよい。本発明によれば、約250μgから約10mgのブピバカインが投与される。いくつかの態様においては、約250μgから約7.5mgのブピバカインが投与される。いくつかの態様においては、約0.05mgから約5.0mgのブピバカインが投与される。いくつかの態様においては、約0.5mgから約3.0mgのブピバカインが投与される。いくつかの態様においては、約5から50μgのブピバカインが投与される。例えば、いくつかの態様においては、等張の薬学上のキャリアー中の0.25-0.50%ブピバカイン-HClおよび0.1%のメピバカイン約50μlから約2ml、好ましくは約50μlから約1500μlそしてより好ましくは1mlを、ワクチンが投与される前、同時または後に同じ部位に投与する。同様に、いくつかの態様においては、等張の薬学上のキャリアー中の0.25-0.50%ブピバカイン-HCl約50μlから約2ml、好ましくは約50μlから約1500μlそしてより好ましくは1mlを、ワクチンが投与される前、同時または後に同じ部位に投与する。ブピバカインおよびあらゆる他の類似の作用化合物、特に局所麻酔剤の関連ファミリーのそれらは、細胞による遺伝構築物の取り込みの所望の促進を提供する濃度において投与してよい。
【0054】
本発明のいくつかの態様においては、ある個体は、遺伝構築物投与前に促進剤を注射される最初の患者である。即ち、例えば、遺伝構築物投与前の約1週間から10日までは、その個体は最初に促進剤を注射される。いくつかの態様においては、約1日から5日間促進剤を注射され;いくつかの態様においては、遺伝構築物の投与の前または後から24時間に注射される。別法としては、使い切るならば、遺伝構築物と同時かまたは遺伝構築物の投与前または後の数分に促進剤を投与する。したがって、促進剤と遺伝構築物は単一の薬学組成物を形成するように化合されてよい。
【0055】
いくつかの態様において、遺伝構築物は促進剤無しに投与されて、即ち、遺伝構築物が促進剤投与と共に投与されない場合の投与プロトコルを用いて促進剤なしに製剤化される。
【0056】
本発明により細胞に送達される核酸分子は、予防上および/または治療上の免疫剤として機能する蛋白質の遺伝上の鋳型として作用してよい。好ましい態様において、核酸分子は、動物の細胞の中でコーディング配列の転写および翻訳のために必要な制御配列を含む。
【0057】
本発明は、全ての病原体、例えばウイルス、原核生物および病原性真核生物、例えば、単細胞病原生物および多細胞寄生虫に対して個体を免疫するの使用してよい。本発明は、特に、細胞に感染し、そしてウイルスのように封入されないそれらの病原体、そして原核生物例えば淋菌、リステリア(listeria)およびシゲラ(shigella)に対する個体の免疫に有用である。さらに、本発明は、それらが細胞内病原体である場合の生活サイクルのステージを含むプロトゾア病原体に対する個体の免疫にも有用である。本明細書において用いられるとおり、用語「細胞内病原体」は、その再生または生活サイクルの少なくとも一部において宿主細胞中に存在してその中で病原体蛋白質を生産するウイルスまたは病原体生物を意味する。表1は、本発明のワクチンが作成されうるウイルスファミリーおよび属のいくつかの掲載を提供する。該表に掲載された抗原のような病原体抗原上に現れるエピトープと同一かまたは実質的に類似のエピトープ少なくとも一つを有するペプチドをコードするDNA配列を含むDNA構築物は、ワクチン中にて有用である。さらに、本発明は、表2に掲載された原核生物および真核生物のプロトゾア病原体並びに多細胞寄生虫に対して個体を免疫するのにも有用である。
【0058】
病原体感染に対して防御するための遺伝子ワクチンを生成するためには、防御性免疫応答が構築されうる免疫原性蛋白質をコードする遺伝物質が、標的のためのコーディング配列として遺伝構築物中に含まれていなければならない。病原体が本発明が特に有用な細胞内感染をするかまたは細胞外感染をするか、全ての病原体抗原が防御性応答を引き出す見込はない。DNAおよびRNAは、両方とも相対的に小さくて相対的に用意に生産できるから、本発明は、複数の病原体抗原をワクチン接種させる付加的な利点を提供する。遺伝子ワクチン中に置いて用いられる遺伝構築物は、多くの病原体抗原をコードする遺伝物質を含むことができる。例えば、いくつかのウイルス遺伝子は単一の構築物中に含ませてよく、それにより複数の標的を提供する。
【0059】
表1および2は、感染から個体を防御するのに遺伝子ワクチンが製造されうる病原因子および生物のいくつかの掲載を含む。いくつかの好ましい態様においては、病原体に対して個体を防御するための方法は、HIV,HTLVおよびHBVに向けられる。
【0060】
本発明の他の側面は、高増殖性疾患における特徴である高増殖性細胞に対する、広範囲に基づく防御性免疫応答を比較する方法、および高増殖性疾患を罹患する患者を治療する方法を提供する。本明細書において用いられるとおり、用語「高増殖性疾患」は、細胞の高増殖性により特徴付けされるそれらの疾患および障害を意味する。高増殖性疾患の例は、全ての形態の癌および乾癬を含む。
【0061】
免疫原性「高増殖性細胞」関連蛋白質をコードするヌクレオチド配列を含む遺伝構築物の個体の細胞への導入は、その個体のワクチン接種化細胞におけるそれら蛋白質の生産をもたらすことが発見された。本明細書において用いられるとおり、用語「高増殖性関連蛋白質」は、高増殖性疾患に関した蛋白質を意味する。高増殖性疾患に対して免疫するためには、高増殖性疾患に関連した蛋白質をコードするヌクレオチド配列を含む遺伝構築物を個体に投与する。
【0062】
高増殖性関連蛋白質を効果的な免疫原性標的にするためには、独占的に生産されるか、または正常細胞に比して高増殖性細胞中においてより高いレベルで生産される蛋白質でなければならない。標的蛋白質は、そのような蛋白質上に見いだされるエピトープを少なくとも一つ含むそのような蛋白質、その断片またはペプチドを含む。いくつかの場合、高増殖性蛋白質は、蛋白質をコードする遺伝子の変異産物である。変異された遺伝子は、正常な蛋白質において見いだされない異なるエピトープをもたらすわずかに異なるアミノ酸配列を有する以外は、正常蛋白質とほとんど同一な蛋白質である。そのような標的蛋白質は、癌遺伝子例えばmyb,myc,fyn,および転移遺伝子bcr/abl,ras,src,P53,neu,trkおよびEGRFによりコードされる蛋白質である蛋白質を含む。標的抗原としての癌遺伝子産物に加えて、抗癌治療および防御養生法のための標的蛋白質は、B細胞リンパ腫により作成される抗体の可変領域およびT細胞リンパ腫のT細胞リセプターの可変領域を含み、いくつかの態様において、それらは自己免疫疾患に関する抗原標的化にも使用される。他の腫瘍関連蛋白質は標的蛋白質として用いることもでき、例えば、モノクローナル抗体17-1Aにより認識される蛋白質および葉酸塩結合蛋白質を含む、腫瘍において高いレベルで見いだされる蛋白質を含む。
【0063】
本発明は、一つまたは複数のいくつかの形態の癌に対して個体を免疫するのに用いてよいが、本発明は、特定の癌を発症する素因を有する個体または癌を有しており且つ従って再発する疑いのある個体を予防のために免疫するのに特に有用である。遺伝学および技術並びに疫学の発展は、個体の癌の発症の可能性の決定および危険度評価を可能にする。遺伝スクリーニングおよび/または家族の健康の歴史を用いることにより、いくつかの種の癌のいずれか一つを発症する特定の個体の可能性を予測することが可能である。
【0064】
同様に、すでに癌を発症した個体および癌を切除する治療を受けたことがある個体または他の方法で養生している個体は、特に、再発(relapse)および再度の発症(reoccurrence)の疑いがある。治療養生法の一部として、そのような個体は、再発を攻撃誘発しなければならないとして診断を受けた癌に対して免疫されうる。即ち、個体ある種の癌を罹患し、そして再発の危険があることがわかったら、それらの免疫系を作って癌のあらゆる未来の出現を攻撃誘発するために、免疫されうる。
【0065】
本発明は、高増殖性疾患を罹患した個体を治療する方法を提供する。そのような方法において、遺伝構築物の導入は、標的蛋白質を生成する高増殖性細胞を攻撃誘発するように個体の免疫系を免疫治療上指示および促進するものとして機能する。
【0066】
本発明は、細胞リセプターおよび「自己」指示抗体を生成する細胞を包含する、自己免疫に関連した標的に対する広範囲に基づく免疫応答を提供することにより、自己免疫疾患および障害を罹患した個体を治療する方法を提供する。
【0067】
T細胞介在自己免疫疾患は、慢性関節リウマチ(RA)、多発硬化症(MS)、シェーグレン症候群、類肉腫、インスリン依存性糖尿病(IDDM)、自己免疫性甲状腺炎、反応性関節炎、強直性脊椎炎、硬皮症、多発筋炎、皮膚筋炎、乾癬、脈管炎、ウエジナー肉芽腫、クローン病および潰瘍性大腸炎を含む。これらの疾患の各々は、内因性抗原に結合し、そして自己免疫疾患に関連した炎症性カスケードを開始するT細胞リセプターにより特徴付けられる。T細胞の可変領域に対してのワクチン接種は、CTLsを含む免疫応答を引き出してそれらのT細胞を除去する。
【0068】
RAにおいては、その疾患に関与するT細胞リセプター(TCRs)のいくつかの特定の可変領域が同定された。これらのTCRsは、Vβ-3,Vβ-14,Vβ-17およびVα-17を含む。即ち、これらの蛋白質の少なくとも一つをコードするDNAワクチンによるワクチン接種は、RAに関与するT細胞を標的化する免疫応答を引き出す。Howell, M. D., et al., 1991 Proc. Natl. Acad. Sci. USA 88: 10921-10925; Paliard, X., et al., 1991 Science 253: 325-329; Williams, W. V., et al., 1992 J. Clin. Invest. 90: 326-333;を参照されたい:これらの各々は引用により編入される。
【0069】
MSにおいては、この疾患に関与するTCRsのいくつかの特定の可変領域が同定された。これらのTCRsは、Vβ-7およびVα-10を含む。即ち、これらの蛋白質の少なくとも一つをコードするDNAワクチンによるワクチン接種は、MSに関与するT細胞を標的化する免疫応答を引き出す。Wucherpfennig, K. W. et al., 1990 Science 248: 1016-1019;Oksenberg, J. R., et al., 1990 Nature345: 344-346;を参照されたい:これらの各々は引用により編入される。
【0070】
硬皮症においては、この疾患に関与するTCRsのいくつかの特定の可変領域が同定された。これらのTCRsは、Vβ-6,Vβ-8,Vβ-14およびVα-16,Vα-3C,Vα-7,Vα-14,Vα-15,Vα-16,Vα-28およびVα-12を含む。即ち、これらの蛋白質の少なくとも一つをコードするDNAワクチンによるワクチン接種は、硬皮症に関与するT細胞を標的化する免疫応答を引き出す。
【0071】
T細胞介在自己免疫疾患、特にTCRの可変領域がまだ同定されていない疾患を罹患する患者を治療するためには、滑膜生検を実施しうる。T細胞が存在するサンプルを取ることができ、そしてそれらのTCRs可変領域は標準技術を用いて同定されうる。遺伝子ワクチンは、この情報を用いて作成できる。
【0072】
B細胞介在自己免疫疾患は、狼瘡、グレーブス病、重症筋無力症、自己免疫性溶血性貧血、自己免疫性血小板減少症、ゼンソク、寒冷グロブリン血症、原発性胆汁性硬化症および悪性貧血症を含む。これらの疾患の各々は、内因性抗原に結合し、そして自己免疫疾患に関連した炎症性カスケードを開始する抗体により特徴付けられる。抗体の可変領域に対してのワクチン接種は、CTLsを含む免疫応答を引き出してそれらのB細胞を除去するはずである。
【0073】
B細胞介在自己免疫疾患を罹患した患者を治療するためには、自己免疫活性に関与する抗体の可変領域を同定しなければならない。生検を実施することができ、そして炎症部位に存在する抗体のサンプルを取り出すことができる。それらの抗体の可変領域は標準技術を用いて同定されうる。遺伝子ワクチンは、この情報を用いて作成できる。
【0074】
SLEの場合、ひとつの抗原はDNAであると信じられる。即ち、SLEに対して免疫される患者においては、それらの血清を抗-DNA抗体に関してスクリーニングでき、そして該血清中に見いだされるそのような抗-DNA抗体の可変領域をコードするDNA構築物を含むワクチンを製造することができる。
【0075】
TCRsおよび抗体の可変領域の間で共通な構造上の特徴はよく知られている。特定のTCRsおよび抗体をコードするDNA配列は以下の公知の方法において一般的に見いだすことができる:Kabat, et al., 1987 Sequence od Proteins of Immunological Interest U. S. Department of Health and Human Services, Bethesda MD、これは引用により編入される。さらに、抗体からの機能性可変領域をクローン化する方法は、Chaudhary, V. K., et al., 1990 Proc. Natl. Acad. Sci. USA 87: 1066に見いだすことができ、引用により編入される。
実施例
実施例1
腎炎原性(nephritogenic)自己抗体抗-DNA IL/IM:
このモノクローナル抗体(mAb)は、MRL-lpr/lprマウスに由来するハイブリドーマ(Vlahakos, et al., 1992 Kidney Int 41, 1690-1700)の大きなパネルから同定されたが、何故ならば腎炎を有するMRL-lpr/lprマウスの腎臓から溶出されたIgと抗原結合特性が共有であったからである。抗-DNA IL/IMは、5.1のpIを有するJ558 VH遺伝子ファミリーのIgG2a抗体である。抗-DNA IL/IM抗体は、ssDNA,dsDNA,SmRNPおよび糸球体抽出物に特異的に結合する。正常な組織適合性マウスに投与後、抗-DNA IL/IMは、腎臓内において、糸球体、内皮下および管腔内免疫沈積物を形成する。
【0076】
抗-DNA IL/IM産生ハイブリドーマ細胞が組織適合性マウスに腹腔内投与される場合、毛管壁肥大、糸球体間置(interposition)および拡張(expansion)、糸球体毛管ループの動脈瘤性拡張および管腔内閉塞、および重度のタンパク尿症に関連した、濃い膜内および管腔内沈積物を生じる。糸球体の免疫沈積物の形態学上の出現は寒冷グロブリン血症に関連したそれらの暗示(reminiscent)であるが、高い血清抗-DNA抗体活性を有する抗-DNA IL/IMハイブリドーマ産生マウスは、検出可能な寒冷グロブリン血症並びにリウマチ因子活性を有さなかった。糸球体免疫沈積物の形成は、毛管壁肥大、糸球体間置および拡張、糸球体毛管ループの動脈瘤性拡張および管腔内閉塞、および重度のタンパク尿症に関連した。
【0077】
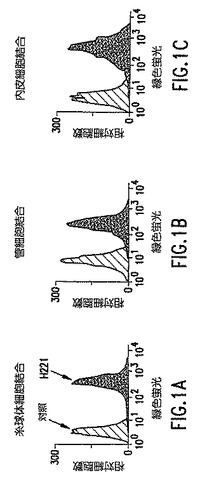
その交差反応性および明確な腎炎原性の特性があれば、抗-DNA IL/IMが糸球体Agとの直接の相互作用により免疫沈積物を形成するか否かの分析が考えられた。この可能性に接近するために、モノクローナル抗-DNA IgG2a抗体、抗-DNA IL/IM抗体が糸球体細胞表面抗原に結合する能力を評価した。抗-DNA IL/IM抗体は、正常マウスに生体内投与後に糸球体、内皮下および管腔内免疫沈積物を生成した。FACSにより、抗-DNA IL/IM抗体(ハイブリドーマ番号H221により呼ばれる)は糸球体、管状上皮および大動脈内皮表面に結合したが、糸球体免疫沈積物を生成しなかったアイソタイプ適合抗-DNA抗体による表面結合は観察されなかった。結果を図1A,1Bおよび1Cに示す(マウス内皮細胞はFuad Ziyadeh博士(腎臓部門、ペンシルバニア大学)から寄贈された)。
【0078】
抗−DNA抗体を用いて釣り上げた成分糸球体細胞の全細胞溶解物を用いたウエスタンブロットは抗-DNA IL/IM抗体が複数のバンドと反応したことを示したが、免疫沈積物を形成しない抗-DNA抗体は反応しなかった。細胞表面抗原のビオチン化並びに抗-DNA IL/IM抗体との免疫沈殿の後に、糸球体細胞溶解物の中の100kDのバンドが、アイソタイプ適合対照モノクローナル抗-DNA抗体により認識されないものとして同定された。
【0079】
即ち、抗-DNA IL/IMモノクローナル抗体は、マウスの腎臓の糸球体細胞および大動脈内皮細胞に結合することが証明され、そして候補の表面蛋白質抗原が同定された。これはこのモノクローナル抗体の複数に特異的な抗原結合特性を示し、これは病原性SLE抗体に共通の特徴であり、そして糸球体免疫沈積物形成の開始における細胞表面抗原への結合に必須かもしれない。
【0080】
抗-DNA IL/IM(H221)の配列分析を実施した。完全なVL-VJL配列(配列番号:4)およびほぼ完全なVH-DH-JH配列(配列番号:6)がここに示される:
【0081】
【化5】

【0082】
この結果は、抗-DNA IL/IM(H221)がJ558 VHファミリーのメンバーであることおよび研究デザインおよび方法部門に記載された実験を行うための試薬を提供することを確証する。重鎖配列を完全にするための付加的な配列分析は、進行中である。
抗-DNA IL/IM に対する遺伝子免疫化:
以前の研究は、抗-DNA IL/IMのVHまたはFv領域をコードするDNA構築物でAKR×DBA/2マウスを免疫して、次に致死量の親ハイブリドーマ細胞を攻撃誘発することにより実施した。簡単に言えば、図2Aに示されるとおり、VHおよびFv領域を、CMVプロモーター存在下にてV領域を置かれた遺伝子免疫ベクター中にクローン化した。図2Bに示されるとおり、V領域は、細胞質、分泌されるか、細胞質に保持されるか、またはアデノウイルスE19蛋白質ER保持シグナルを用いて小胞体に保持されるかの、何れかを標的とした。リソソームを標的とした構築物も開発した。
【0083】
引用により編入されるBiocca, S. et al. 1990 EMBO J. 9(1): 101-108は、細胞膜、分泌、細胞質局在を標的とすることを記載する。Nilsson, et al. 1989 Cell 58: 707-718,Jackson et al., 1993 J. Cell Biol. 121(2)317-333およびJackson et al 1990 Embo J. 9: 3153-3162は、アデノウイルスE19蛋白質ER保持シグナルを用いて小胞体に保持された蛋白質を記載した。Letourner, F. and R. D. Klausner 1992 Cell 69: 1143-1157は、リソソームを標的とする蛋白質を記載した。
【0084】
以前の実験においては、ブピバカイン前処理後に、精製されたプラスミドDNAをマウスに接種し、そして幾度化のブースト後にマウスの抗体応答を評価した。対照は殺傷されたハイブリドーマ細胞および精製された抗体Fv領域を含んだ。これらの免疫原の何れもが、抗-DNA IL/IM Fab断片に対して血清学上の応答を引き出すことができなかった(検出は標識したストレプトコッカスのプロテインGを用いた)。以前の研究においては、増殖性および細胞毒性のT細胞応答がいくつかの構築物により引き出された。最良の構築物は、大きなグループのマウス中での評価に関して選択した。4匹のAKR×DBA/2マウスのグループを、一回、100μgのプラスミドDNAおよび同時にブピバカインで免疫した。1週間後、動物を犠牲にして、細胞毒性T細胞および増殖性応答に関して評価した。増殖は、精製されたH221モノクローナル抗体(25または5=B5g/ウエル)または20,000または100,000の殺傷された抗-DNA IL/IMハイブリドーマ細胞の何れかで72時間、免疫性脾臓卵母細胞を刺激し、そしてトリチウム化チミジンを用いて一晩パルスすることにより評価した。結果を図3に示す。
【0085】
最良の増殖応答は、殺傷されたハイブリドーマ細胞において誘導された。測定可能な応答(ベクターのみと比較して)はほとんどの構築物に関して観察されたが、規模において穏和でしかなかった。精製されたモノクローナル抗体に対する増殖性応答は、殺傷された細胞またはER標的化ワクチンで免疫されたマウスに関して(バックボーン対照を上回る>2標準誤差)顕著であった。ハイブリドーマ細胞に対する増殖性応答は両ER標的化ワクチン、およびVH可溶性およびVH細胞質性ワクチンに関して(バックボーン対照を上回る>2標準誤差)顕著であった。対照的に、引き出されたCTL応答は目立った。結果を図4A,4Bおよび4Cに示す。
【0086】
免疫性脾臓細胞を、7日間、殺傷された抗-DNA IL/IM刺激剤の存在下で(20:1の比の脾臓細胞対刺激剤)、最初の2日間コンカナバリン、次に刺激剤のみの存在下で培養した。抗-DNA IL/IMハイブリドーマ細胞を51Crで標識し、そして丸底マイクロタイタープレート中で溶解を測定した。平均=B1標準偏差%特異的溶解(CD4に関して上記のとおり)は様々なエフェクター:標的比に関して示される。興味を引くことは、一つ(可溶性重鎖V領域またはVH溶液)以外の全ての構築物が殺傷された細胞より良好なCTL活性を引き出し、これがアッセイにおける陽性対照であった。特に、細胞質およびER標的化構築物に関しては、例外的な応答が観察された。これは、これらの区画への標的化が、観察されたCTL応答をブーストすることを示す。
【0087】
これらの研究は、評価されたDNAワクチンのほとんどによる良から最良のCTL応答誘導を示す。この実験は、他を除外しながらこの研究を続けるために特定のワクチンを選択するために使用されるDNAワクチンの例として機能しうる。即ち、細胞質を標的としたFv構築物は、他の構築物よりも明らかに高い(>2標準誤差)CTL応答を引き出した。この分析に基づくと、このワクチンはさらなる評価を招く。同様に、VH可溶性ワクチンは良好なCTL応答を引き出さなかった。したがって、このワクチンはさらなる分析から除外されるはずであり、CD4系中で生じた仮設に基づいて防御性応答を引き出すことは期待されない。
【0088】
このワクチンを用いた付加的な実験は、これが全く事実であることを明らかにした。この実験において、5匹または6匹のマウスのグループを、3回、DNAワクチンの100=B5g'sで免疫した。次に、それらは、抗-DNA IL/IMハイブリドーマ細胞で腹腔内攻撃誘発された。4週間後、対照動物中で腫瘍が発生していた場合は、全てのマウスを犠牲にし、そして腹水の腫瘍負荷および量に関して評価した。マウスが発生した腫瘍の比率も定量した。結果を図5A,5Bおよび5Cに示す。
【0089】
図5Aは、腫瘍が発生したマウスの比率を示す。図5Bは、グループ中の平均腫瘍質量、並びに個々のマウスの値を示す。図5Cは、得られた悪性の腹水の体積を示す。この特定の実験において、殺傷細胞で免疫したマウス(我々の陽性対照)は、何れの測定においても、ベクターのみを免疫されたマウス(我々の陰性対照)と大きく異ならなかったことは注目すべきである。これにもかかわらず、いくつかのDNAワクチン、特にFV細胞質標的ワクチンおよびFVおよびVH小胞体(ER)を標的とするワクチンの両者は、明らかな防御能力を示した。これは、このワクチンのCTL応答を引き出す能力とよく相関する。VH可溶性ワクチンは防御活性を示さなく、CTL活性を示さないことと相関する。
実施例2
いくつかのヒトの疾患は、BおよびT細胞の病原性増殖に関連する。これは、悪性腫瘍または高増殖性疾患、例えばリンパ腫および白血病、および自己免疫疾患例えば病原性自己抗体が組織の損傷に介在する場合の全身性エリテマトーデス(SLE)を含む。これらの疾患に関する現在の治療は不十分であり、そして処置は発生率の高い副作用に関連する。そのような疾患の治療に対するより論理的なアプローチは、病原性細胞を特定的に除去することである。これは、それらの可変領域を標的とする活性の有る免疫療法により達成されるかもしれない。V領域に対する活性な免疫化は、病原性細胞を除去する能力を有する。さらに、防御性免疫を除去することにより、病原性クローンの再出現が排除できる。しかしながら、免疫化により排除された免疫応答も有害な結果を生ずる可能性を有する。例えば、B細胞のV領域を生成する自己抗体に対する理想的なワクチン接種は、細胞毒性T細胞(CTL)を除去して、病原性B細胞を排除して自己抗体の生産を制限するべきである。しかしながら、もしもヘルパーT細胞、(即ち、TH2タイプの応答)が排除されたのであれば、自己抗体生産が事実増大して患者に損害を与えるかもしれない。よって、病原性BまたはT細胞のV領域に対する活性な免疫化をデザインすることにより、所望の免疫応答(例えば、CTL応答)を引き出して、有害な応答(例えば、TH2応答)を可能な限り制限するべきである。
【0090】
自己抗体V領域に対するDNAワクチン接種は、以下のとおりに評価された。自己抗体産生ハイブリドーマの抗-DNA IL/IM(H221とも呼ばれる)を、MRL-lpr/lprマウス由来のハイブリドーマの大きなパネルから選択した;抗-DNA IL/IM産生ハイブリドーマ細胞を組織適合性のマウスに腹腔内投与する場合には、毛管壁肥大、糸球体間置および拡張、糸球体毛管ループの動脈瘤性拡張および管腔内閉塞、および重度のタンパク尿症に関連した、濃い膜内および管腔内沈積物により特徴付けされる糸球体腎炎を生じる。これは、防御性免疫を引き出す病原性自己抗体のV領域を標的とするイディオタイプのDNAワクチン接種の効率を評価するインビボ系を提供した。これらのワクチンの免疫原性を増強する能力を調査するために、特定の細胞内対細胞外区画(細胞質、分泌のための小胞体(ER)および保持のためのER)に対して遺伝子発現を標的化した。単一のV領域(VH領域)に対するワクチン接種および完全なFv断片(VLに連結したVH)に対するワクチン接種を用いた。結果は、H221のVHおよびFv領域に対するDNA接種が、特定の細胞性免疫応答、特に有力なCTL応答を引き出し、細胞質で発現されるかまたはER中に保持されるV領域を標的化することによりCTL活性の増強を伴った。さらに、特にER中の保持のために遺伝子産物が標的化された場合には、イディオタイプDNAワクチン接種はH221細胞に対して防御性免疫を引き出した。
【0091】
材料と方法
DNA構築物
pBBkanは、転写を指示するCMVプロモーターおよびRSVエンハンサーを利用する真核生物発現ベクターである。これを最初に、マウスIgGからの分泌リーダーまたは細胞質性リーダーをNotIとXbaIの間のマルチクローニング部位にサブクローニングすることにより修飾した。分泌リーダーを伴うベクターは、分泌されたワクチンおよびER保持されたワクチンのための親ベクターであった。同様に、細胞質性リーダーを伴うベクターは、細胞質で発現されたワクチンのための親ベクターであった。H221のVHおよびVL領域をポリメラーゼ鎖反応(PCR)により増幅し、そして組換えPCRを用いることにより、Fvコーディング配列を生じさせた(Srikatan, et al. 1994 AIDS 8: 1525-32, 引用により編入される)。ひとつのXbaI制限部位を単一の重鎖産物の5'末端およびカッパ軽鎖産物(Fv)の5'末端へクローン化した。CPR産物は制限消化されて、次に標準のフェノール−クロロホルム抽出により2%低融点アガロースから精製して、ゲル精製して、そして直接ベクターに連結されるか(領域を配列と共に)または他の断片に連結され、そして3'標的化配列上をスプライシングするさらなるPCR反応のための鋳型として指示する場所で用いられた(E19へのCD4 TM、CD4-E19へのFvまたはVh)。E19の単一配列をCD8-E19から増幅した(Nilsson, et al. 1989 CELL 58: 707-718,引用により編入される)。用いられたプライマーは、表3に掲載される。イムノグロブリンリーダー(分泌または保持のためのER標的化)(配列番号:22)、細胞質リーダー(配列番号:23)、H221 VL領域(配列番号:24)、リンカーペプチド(配列番号:25)、H221 VH領域(配列番号:26)およびCD4膜貫通並びにE19細胞質ドメイン(ER保持のため)(配列番号:27)のアミノ酸配列を表4に掲載する。イムノグロブリンリーダー(配列番号:22)は、分泌のためのERまたはER保持に遺伝子産物を標的化するのに用いられたマウスイムノグロブリンリーダーであった。細胞質リーダー(配列番号:23)は、抗体の細胞内発現に関して以前に報告された配列であった(Biocca, et al. 1990 EMBO J. 9:101-108,引用により編入される)。VHおよびVL配列(それぞれ、配列番号:24および配列番号:25)は、PCR産物のクローニング後に決定された。リンカーペプチド(配列番号:25)は、Fv領域の機能性発現のために使用した。ヒトCD4膜貫通領域は、ER保持のためのアデノウイルスE19標的化配列(配列番号:27)と組み合わされた。
【0092】
これらのPCR産物は、pBBkan中にクローン化されて、DH5アルファ大腸菌(Life Technologies Inc., Gaitherburg, MD)を形質転換し、そして正確な制限パターンを有するクローンをABI蛍光配列決定キット(Applied Biosystems Inc., Foster City, CA)により配列決定した。産物は、キットの指示書のとおりに精製しそして乾燥し、そしてゲル泳動および分析はペンシルバニアガンセンターコア配列決定設備により実施された。配列分析は、H221が、Vk1遺伝子により対合されたJ558 VHおよびJH3遺伝子を利用することを明らかにする。ベクター、構築物および挿入配列は図8および表4に示す。プラスミド調製物は、スーパーブロス(1.2% w/v ディフコ社トリプトファン、2.4% w/vディフコ社イーストエキストラクト、0.5% v/vグリセロール、72mM 第二リン酸カリウム、28mM 第一リン酸カリウム)中で生育させ、そして製造者のプロトコルに従いキアゲン社の500チップを用いて精製した(Giagen Inc., Chatsworth, CA)。DNA接種はブピバカイン前処理と共に実施した(Wang, et al., 1993 Proc. Natl. Acad. Sci. USA 90: 4156-4160,引用により編入される)。
増殖アッセイ
ワクチン接種されたマウスからの個々の脾臓を滅菌様式により抽出して、RPMI中で穏やかに破壊し、そしてゲイズ(Gey's)溶液で処理することにより、赤血球細胞を溶解する。脾臓卵母細胞を、96ウエルの平底組織培養プレート(Falcon 3072;Becton Dickinson,Franklin Lakes,NJ)中にウエルあたり500,000個にて200μlの体積で入れる。3通りのウエルを培地のみ、2μg/mLコンカナバリンA,5および25μg/mLのMab H221,および5:1または25:1(脾臓卵母細胞:刺激剤)のマイトマイシンで殺傷されたH221ハイブリドーマ細胞に暴露する。106個のハイブリドーマ細胞/mLを25μg/mLのマイトマイシンCで45分間37℃においてPBS中で処理して、次に3回PBSで洗浄して毒素を除去した。37℃において5% CO2下の培養3日後、1μCiのトリチウム化チミジン(NEN Life Science, Boston MA)を20μl培地中に加えて、18時間後にプレートをTomec Harvester 96(Tomec, Orange, CT)上に回収する。フィルターマットを乾燥して、次にMicrobeta 1450シンチレーションカウンター(Wallac Inc., Gaithersburg, MD)上でベータシンチレーションを計数する。
細胞毒性T細胞アッセイ
脾臓卵母細胞を5×105/mLにて2μg/mLコンカナバリンAおよびマイトマイシンC処理した刺激剤と共に刺激剤に対する脾臓卵母細胞の20:1にて24時間、培地が分裂促進剤を除去するように変化する点まで培養する。追加の4日の培養後に、細胞を10mLの培地に回収してFicoll上で20分間1500gにて遠心分離する。次に、細胞を計数して100:1、50:1、25:1および12.5:1のエフェクター:標的と一定数の細胞を、各丸底ウエルに入れた。標的細胞は、107の生存可能なH221細胞を250μlの培地に懸濁して75μCiの51Cr-クロム酸ナトリウム(NEN/Life Science Inc., Boston, MA)を加え、そして室温にて2時間インキュベートする。次に、これらの細胞をRPMI完全培地で3回洗浄してプレーティングのために懸濁した。プレートを800rpmで2分間遠心分離して、次に37℃において5および16時間インキュベートして、そのときに50μLの上清を注意深く取り出し、そしてシンチレーションカウンター中でOptiphaseシンチレーション液体(Wallace Inc., Gaitherburg, MD)で計数した。パーセントの特異的な溶解を以下の等式により計算した:
%特異的溶解 = 実験上の放出−自発放出/全放出−自発放出
(自発放出は培地のみでインキュベートした細胞のcpmであり、そして全放出は1%SDS中でのインキュベートによる標的細胞の全溶解により放出された放出。)
インビボ腫瘍攻撃誘発
マウスをプリスタン(1ml腹腔内)で3DNA接種の最後にの開始した。1週間後に、マウス(グループあたり6匹)に106の2回洗浄された生存可能なH221ハイブリドーマ細胞を腹腔内注射して、PBS中に107/mlで懸濁した。腫瘍成長のサインに関して、最初の2週間マウスを毎週チェックし、その後は週に2回チェックした(触知可能な質量および/または腹水)。攻撃誘発後4週間目にマウスを犠牲にして、固形の腫瘍を切除して秤量することにより腫瘍質量を定量した。悪性の腹水を有するマウスにおいては、腹水の細胞内含有量も秤量して、腫瘍質量に加えた。
抗-DNA抗体アッセイ
マウスからの血清を抗-dsDNAのELISA中で試験した(Madaio, et al. 1984 J. Immunol. 132: 872,引用により編入される)。
【0093】
結果
イディオタイプDNA接種は特定の免疫応答を引き出す
予備実験において、精製されたプラスミドDNAをAKR×DBA/2マウス中に接種して、幾度化のブーストの後に、マウスを細胞性および体液性免疫応答に関して評価した。対照は、殺傷されたハイブリドーマ細胞および精製されたH221 mAbを含んだ。リンパ球増殖性および細胞毒性T細胞の応答の両者は、抗-DNA IL/IM Fab断片に対する検出可能な血清学上の応答不在下で、構築物を有するH221細胞に対して引き出された(検出は標識されたストレプトコッカスプロテインGを用いてなされた)。細胞性免疫応答はより厳密に評価された。4匹のAKRおよびDBA/2マウスのグループを、一回、プラスミドDNAと共にブピバカイン−HClも同時に接種した。1週間後、それらのマウスを犠牲にして、細胞毒性T細胞および増殖性応答に関して評価した。結果を図9および図10に示す。
【0094】
単一のDNA接種後の脾臓卵母細胞の増殖性応答を評価するための実験において、マウスに、一回、0.25%のブピバカイン中の100μgのプラスミドDNAを接種して、1週間後、脾臓卵母細胞を除去して、培地のみまたは殺傷されたH221細胞またはH221 Fabの何れかとインキュベートした。増殖は、精製されたH221 mAb(25または5μg/ウエル)または殺傷された抗-DNA IL/IMハイブリドーマ細胞(20,000または100,000/ウエル)の何れかを用いて免疫性脾臓卵母細胞を刺激することにより評価した。陽性対照は、殺傷されたH221細胞(殺傷細胞)を接種し、そして陰性対照はベクターのみの接種であった。3日培養後、細胞を一晩トリチウム化チミジンでパルスして、分あたりの計数(CPM)の取り込みを測定した。平均△CPM(実験マイナス培地のみ)±3通りのウエルの標準偏差が2種類の濃度のFabおよび2種類の濃度の殺傷H221細胞に関して示される。結果を図9に示す。
【0095】
単一のDNA接種後の細胞毒性T細胞(CTL)応答を評価する実験において、マウスに、0.25%のブピバカイン中の100μgのプラスミドDNAを接種して、1週間後、脾臓卵母細胞を除去して、コンカナバリンAと殺傷されたH221細胞と共にインキュベートした(20:1のエフェクター:刺激剤比)。24-48時間後、ConAを除去して、細胞を生育させ、そして培養を全部で5日間続けた。陽性対照は、殺傷されたH221細胞(殺傷細胞)を接種し、そして陰性対照はベクターのみの接種であった。5日培養後、不連続勾配遠心分離によりエフェクター細胞を単離し、そして示された様々な比において51Cr標識された標的細胞を溶解するために用いられた。%特異的溶解は、材料と方法に記載されたとおりに計算された。平均±標準偏差%特異的溶解を3通りの測定に関して示す。対照(殺傷されたH221細胞およびベクターのみ)は参考のために全3つのグラフ中に示される。結果を図10A、10Bおよび10Cに示す。
【0096】
他の実験におけるとおり、最良の増殖性応答は殺傷されたハイブリドーマ細胞により誘導された(図9)。測定可能な応答(ベクターのみと比較して)は、ほとんどの構築物において観察されたが、規模においては適度でしかなかった。精製されたmAbに対する増殖性応答は、殺傷細胞あるいはER保持されたワクチンで免疫されたマウスに関して顕著であった(バックボーン対照を上回る>2の標準誤差)。ハイブリドーマ細胞に対する増殖性応答は、ER保持ワクチンおよびVH可溶性並びにVH細胞質性ワクチンの両者に関して顕著であった(バックボーン対照を上回る>2の標準誤差)。
【0097】
対照的に、引き出されたCTL応答は目立った(図10)。可溶性重鎖V領域(VH sol)を除く全ての構築物は殺傷細胞と同じかまたはより良好にCTL活性を引き出し、これをアッセイの陽性対照とした。他の実験において、VH solは対照に比して顕著なCTL応答を引き出した(典型的な実験においてVH sol構築物対対照に関して100:1のエフェクター:標的において10%特異的溶解に比して22%)。独占的な応答が細胞質およびER保持構築物に関して観察されたことから、これらの区画に対する標的化がCTL応答をブーストすることが示される。ER保持されたワクチンを除いて、Fv構築物は、通常、より有力なCTLsを引き出した。
ハイブリドーマ攻撃誘発からの防御
インビボにおける自己抗体生産ハイブリドーマ細胞による攻撃誘発からの防御におけるこれらのDNAワクチンの効率を評価するために、5−6匹のマウスのグループを3回隔週の間隔でブピバカイン中の100μgのDNAワクチンで免疫した。マウスを、生きた抗-DNA LK/IMハイブリドーマ細胞(H221細胞)で腹腔内に攻撃誘発した。4週間後、マウスを腫瘍負荷および腹水に関して評価した。腫瘍または腹水を有する全てのマウスを犠牲にして、腫瘍を切り出して、腫瘍の負荷を測定した。結果を図11Aおよび11Bに示す。図11Aは、各ワクチン接種グループに関する腫瘍質量を示す。平均値を棒グラフで示し、そして個々のマウスに関する値を上に加える。図11Bは、各グループ内における4週間の腫瘍形成におけるマウスの比率を示す。いくつかのDNAワクチンは特定の作用を示したことが、低下した腫瘍負荷から明らかとなった。FvおよびVH保持ワクチンの両者は、殺傷された細胞で免疫した3/6およびベクター対照を受けた2/5に比して、それぞれ6/6および4/5のマウスにおける腫瘍形成を妨害した。
【0098】
評価したほとんど全てのマウスはベースラインの応答に比して血清抗-DNA力価における増加を示したが、これは相対的に小さかった。このパラメーター中のグループ間に顕著な相違はなかったが、ベクターのみの対照に比してより低い抗-DNAレベルが、Fv ER保持ワクチンで免疫されたグループにおいて観察された(ベクター対照マウスにおける1.6±0.55に比して、Fv ER保持ワクチンに関する0.83±0.41の力価の増加、p=0.025の学生のt-試験)。即ち、もっとも有力なワクチンはこのモデルにおいても同じく、循環抗-DNAレベルを顕著に低下させた。
生存者における免疫応答
腫瘍攻撃誘発で生存したいくつかのマウスにおける殺傷されたH221細胞に応答したCTL活性および増殖を評価した。これは、殺傷された細胞で免疫された3マウス、細胞質性Fv構築物で免疫した3マウス、およびER処理したFv構築物で免疫した3マウスを含んだ。5週目(最初の攻撃誘発から38日)にマウスを犠牲にし、そして殺傷されたH221細胞に応答した脾臓卵母細胞の増殖を図9に記載されるとおりに測定した。3通りのウエルの平均CPM取り込みは個々のマウスに関して示され、そして受容したワクチンに従い標識した。CTL応答は衰退し(アッセイ前にマウスはブーストされなかった)、もっとも高い応答(50:1エフェクター:標的比において13%の特異的溶解)はER保持構築物で免疫したマウスにおいて観察されたが、同様な応答は他でも観察された(殺傷細胞の免疫化において7%およびFv細胞質構築物の免疫化において7%)。対照的に、増殖性応答はまだ激しかった(図12)。殺傷細胞または細胞質を標的とするFv構築物で最初に免疫したマウスはインビボにおいて殺傷H221細胞に応答した(培地のみの対照に関する721±409および5、044±1902に比して、それぞれ7,488±5,864CPMおよび6,663±4,171CPMの平均値)。対照的に、ER保持されたFv構築物で最初に免疫されたそれらのマウスは、インビトロにおいて殺傷H221細胞に対して応答した(平均37,351±9,004CPM対培地のみの4,651±1,345)。この豊富な増殖応答は平行培養における増強されたIL-2生産により写し出された(平均して、殺傷された細胞で免疫された場合に比してFv ER保持ワクチンにおいてほぼ2倍であった)。並びに、これらの結果は、Fv Er保持ワクチンで免疫されて攻撃誘発に生存したマウスにおける強い細胞増殖性応答を示す。
【0099】
考察
これらの研究は、イディオタイプのDNAワクチンが、検出可能な体液性免疫応答の不在下において細胞性免疫応答を引き出すことができることを示す。さらに、評価されたほとんどのワクチンに関して、CTL応答は、殺傷された細胞により引き出されたCTL応答と同等かまたは凌いだ(図10)。殺傷された細胞のワクチンとは対照的に、しかしながら、増殖性応答(典型的にはTH応答と相関する)はDNAワクチン接種後にかろうじて検出可能であった(図9)。即ち、イディオタイプDNAワクチン接種を用いることにより、ほんのわずかなTH応答を伴う有力なCTL応答を引き出すことが可能である。これは、防御性免疫を誘導する際のCTLsの効率の調査を可能にする。これらのイディオタイプDNAワクチンの免疫原性は、DNAワクチンを特定の細胞内区画に標的化することにより。特にCTL応答に関して顕著に増強された(図10)。細胞質への標的化およびER中の保持はCTL応答を増強し、MHCクラスIで制限された応答に関して予測されたとおりであった。Fvワクチン(VHおよびVL領域共に)はVH領域のみよりも免疫原性がより高いことが観察された。これは、免疫系に対するより多くのエピトープによるらしい。リンカーペプチドの直接の効果は除外できない。
【0100】
イディオタイプのDNAワクチンの接種は、ワクチンが適切な細胞内区画を標的とされたならば、組織適合性腫瘍攻撃誘発からマウスを保護することができる(図11)。この防御性応答は、腫瘍誘発攻撃唐の生存者においてさえもこの系において体液性免疫が検出不可能であったことから、細胞性免疫によるものであることは明らかである。もっともよく観察された防御は、有力なCTL応答がER保持ワクチンにより引き出されたことから、引き出されたCTL応答によるものであり、これは「もっとも防御性のある」ワクチンであった。これは、ER中の抗原の濃度およびCTL'sの引き出しが防御性免疫をもたらすことを暗示する。他の因子は防御性応答に貢献でき、例えばワクチン接種のために用いられる構築物の非自己抗原決定基の存在である。ER保持されたワクチンで免疫されて腫瘍誘発に生存したマウスは、印象的な増殖応答を開始した(mounted)(図12)。これは、ER保持されたFv DNAワクチンが、イディオタイプ特異的T細胞の顕著な拡張を伴う腫瘍攻撃誘発に対する二次応答のための免疫系を開始したことを示す。この増殖応答は、殺傷された細胞またはFv細胞質ワクチンを最初に免疫された生存者におけるよりも高くなかった。これは、単一の時間点のみがこの研究においてサンプルされたことから、攻撃誘発後の免疫応答のタイミングに関連するかもしれない。しかしながら、有力なCTL応答を開始する際のER保持されたワクチンの選択性の効果は、このグループにおける腫瘍攻撃誘発からの完全な防御により指示される。
【0101】
DNAワクチンの発現、細胞局在、および他のパラメーターを操作する能力は、インビボにおける防御に通じ得る誘導された免疫応答の性質に、調査を特別に適合させる。DNAワクチン接種は様々な腫瘍抗原モデルに対して使用されてきており、ヒトCD4を発現するマウスリンパ腫細胞を用いた我々の研究、ベータ−ガラクトシダーゼ遺伝子、ヒト癌胎児抗原、ヒトp53遺伝子の変異型からの単一のエピトープを用いた同様な系を含む。これらの研究は、モデル腫瘍抗原に対するDNAワクチン接種の利用性を確立する。用いられた抗原の全ては、事実、臨床上遭遇したはずの腫瘍自己抗原より典型的にはもっと免疫原性の高い外来蛋白質であった。
【0102】
ヒトGM-CSFの連結された発現があると無しとに拘わらずCγ1およびCκもコードする発現ベクターにおけるマウスリンパ腫のVHおよびVL領域の使用が報告された(Syrengelas, et al. 1996 Nature Medicine 2: 1038-1041,引用により編入される)。即ち、免疫原は、興味のある自己V領域に連結した外来性抗原決定基を有した。筋肉内または内皮へのこれらの構築物を伴うDNA接種は、抗イディオタイプ抗体応答、並びにインビボにおける腫瘍攻撃誘発からの部分的な防御をもたらした。ヒトGM-CSFの連結された発現は、引き出された応答を顕著に増強した。DNA免疫化は、弱くて他に認識できない腫瘍抗原に対する免疫応答を誘導し、これはDNAを伴う付加的な刺激に依存した(即ち、ヒト定常領域およびGM-CSF)。
【0103】
単離された同系V領域のDNA免疫化は、自己免疫疾患のマウスモデルにおいて、防御性免疫応答を引き出すことができることを示した。DNAに基づくマウスVβ8.2に対する免疫化は、実験上の自己免疫脳脊髄炎(EAE)からH-2uマウスの防御を示した(Waisman, et al. 1996 Nature Medicine 2: 899-905,引用により編入される)。細胞性免疫応答が証明され、そしてそのデータはDNA免疫化が病原性T細胞をシャットオフすることを示したが、この系においてはVβ8.2を発現するクローンにより支配される。それらのワクチン接種のアプローチを伴うVβ8.2生成細胞の欠如の証拠(リーダーペプチドまたはCDR3と対合なしに単離されたV領域を用いた)は示されなかった。
【0104】
【表1】

【0105】
【表2】

【0106】
【表3】

【0107】
【表4】

【0108】
【表5】

【0109】
【表6】

【0110】
【表7】

【0111】
【表8】

【0112】
【表9】

【図面の簡単な説明】
【0113】
【図1】図1A、1Bおよび1Cは、H221結合のFACS分析データを示す。
【図2】図2Aは、VHまたはFv領域がクローン化された遺伝免疫ベクターの地図を示す。図2Bは、細胞内の異なる位置に対してV領域を標的とするように用いられたV領域をコードする挿入物の構築物の地図を示す。
【図3】図3は、細胞内の様々な位置において標的とするようにデザインされた異なる構築物を細胞毒性T細胞および増殖性応答のそれらの誘導に関して比較した、実験結果を示す。
【図4−1】図4Aおよび4Bは、様々な細胞内標的DNAワクチンにより引き出されたCTL応答を評価する実験結果を示す。
【図4−2】図4Cは、様々な細胞内標的DNAワクチンにより引き出されたCTL応答を評価する実験結果を示す。
【図5−1】図5Aは、その可変領域がDNAワクチンによりコードされる抗体を生成するハイブリドーマ細胞を用いた腫瘍攻撃誘発(challenge)実験の結果を示す。
【図5−2】図5Bよび5Cは、その可変領域がDNAワクチンによりコードされる抗体を生成するハイブリドーマ細胞を用いた腫瘍攻撃誘発(challenge)実験の結果を示す。
【図6】図6Aおよび6Bは、特定のリーダー配列を含む、本発明の遺伝構築物を示す。
【図7A】図7Aは、ER(小胞体)保持のためのいくつかのC末端配列を示す。
【図7B】図7Bは、ER(小胞体)保持のためのいくつかのC末端配列を示す。
【図8】図8は、DNAワクチンの構造を示す。用いられたDNAワクチンのバックボーンは、pBBkanバックボーンであった。これは、転写を作動させるためにCMVプロモーターおよびRSVプロモーターを用いる。挿入物は表4に記載され、VH Fv(VHに連結したVL)領域、次にリーダーペプチド(マウスIgGからの疎水性リーダー(Igリーダー)または細胞質標的のための親水性リーダー(細胞質リーダー)のいずれか)、および付加された細胞膜並びに小胞体保持シグナルを伴う細胞質テイル(CD4 TMおよびE19細胞質)を伴う。
【図9】図9は、一回のDNA接種後の脾臓卵母細胞(spleenocytes)の増殖応答を評価するための実験結果を示す。
【図10A】図10A、10Bおよび10Cは、一回のDNA接種後の細胞毒性T細胞(CTL)の応答を評価するための実験結果を示す。図10Aは、ワクチンが分泌のためにH221 VHまたはFv領域からERを標的とした場合の実験のデータを示す。
【図10B】図10A、10Bおよび10Cは、一回のDNA接種後の細胞毒性T細胞(CTL)の応答を評価するための実験結果を示す。図10Bは、ワクチンが保持のためにH221 VHまたはFv領域からERを標的とした場合の実験のデータを示す。
【図10C】図10A、10Bおよび10Cは、一回のDNA接種後の細胞毒性T細胞(CTL)の応答を評価するための実験結果を示す。図10Cは、ワクチンがH221 VHまたはFv領域から細胞質を標的とした場合の実験のデータを示す。
【図11A】図11Aは、DNA接種および攻撃誘発後の生存およひ腫瘍負荷(tumor burden)に関するデータを示す。
【図11B】図11Bは、DNA接種および攻撃誘発後の生存およひ腫瘍負荷(tumor burden)に関するデータを示す。
【図12】図12は、腫瘍攻撃誘発の生存者における増殖応答を評価する実験のデータを示す。
【発明の開示】
【0001】
発明の属する技術分野
本発明は、改良された防御性治療用ワクチンおよび抗原に対して予防用および/または治療用に免疫応答を誘導する改良法に関する。
発明の背景
DNAワクチンは、障害、疾患、症状および感染に関連した抗原に向けて各個体における免疫応答を誘導することにより、そのような障害、疾患、症状および感染を予防および治療するための手段を提供する新しい分野を代表する。本質的には、遺伝子発現に必要な制御要素に作動可能なように連結された抗原コード配列を含むプラスミドDNAを個体に投与する。その個体の細胞はプラスミドDNAを取り込んで、コード配列を発現する。そうして生成された抗原は、免疫応答が向けられる標的となる。抗原に対して向けられた免疫応答は、あらゆるアレルゲン、病原、癌細胞、または抗原に対する免疫応答により認識されるエピトープを包含する自己免疫細胞に対する各個体の予防上または治療上の利益を提供した。
【0002】
DNAワクチン類は、裸の(naked)および便利化(facilitated)ワクチンを包含する。さらに、それらは、組織へ物質を投与するためのいくつかの異なる装置を包含する様々な技術により投与されてよい。公表された文献は、DNA技術の側面を記載し且つ該技術を用いて得られた結果の多くの報告を引用するいくつかの総説文献を包含する。以下の総説文献は、各々の総説文献において引用された各文献がそうであるように引用により本明細書に編入され、そしてDNAワクチン技術を論じる:McDonell W.M and F.K.Askari 19996 New Engl. J. Med. 334 (1) 42-45;Robinson, A, 1995 Can. Med. Assoc. J. 152 (10): 1629-1632;Fynan, E. F. et al. 1995 Int. J. Immunpharmac. 17 (2) 79-83; Pardoll, D. M. and A. M. Beckerleg 1995 Immunity 3: 165-169; およびSpooner et al. 1995 Gene Therapy 2: 173-180。
【0003】
そのようなワクチンは、しばしば病原体感染またはヒト疾患に対して予防上または治療上人を免疫するのに効果があるが、改良されたワクチンに関する要求がある。高められた免疫応答を生じる組成物および方法に関する要求がある。
発明の概要
本発明は、真核細胞内の発現に必要な制御要素に作動可能に連結した免疫原性標的抗原をコードするヌクレオチド配列を含むプラスミドに関するが、但し、免疫原性抗原をコードするヌクレオチド配列は、細胞内での免疫原性標的抗原の輸送(trafficking)を指示するシグナル配列をコードするヌクレオチド配列を包含する。いくつかの好ましい態様において、免疫原性標的抗原は、病原体抗原、癌関連抗原または自己免疫疾患に関連した細胞に連結した抗原である。いくつかの態様において、細胞内の免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列は、免疫原性標的抗原を分泌させるかまたは細胞質、細胞膜、小胞体、リソソームに局在させるシグナル配列をコードする。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は非天然シグナル配列である。
【0004】
本発明は、個体において抗原に対する免疫応答を誘導するための方法に関し、真核細胞における発現に必要な制御要素に作動可能に連結した免疫原性標的抗原をコードするヌクレオチド配列を含むプラスミドを、個体に投与する工程からなるが、但し、免疫原性抗原をコードするヌクレオチド配列は、細胞内での免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列を含む。いくつかの好ましい態様において、免疫原性標的抗原は、病原体抗原、癌関連抗原または自己免疫疾患に関連した細胞に連結した抗原である。いくつかの態様において、細胞内の免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列は、免疫原性標的抗原を分泌させるかまたは細胞質、細胞膜、小胞体、リソソームに局在させるシグナル配列をコードする。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は非天然シグナル配列である。
【0005】
本発明は、真核細胞における発現に必要な制御要素に作動可能に連結した免疫原性標的抗原をコードするヌクレオチド配列を含む、改良されたDNAワクチンに関するが、但し、免疫原性抗原をコードするヌクレオチド配列は、細胞内での免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列を含む。いくつかの好ましい態様において、免疫原性標的抗原は、病原体抗原、癌関連抗原または自己免疫疾患に関連した細胞に連結した抗原である。いくつかの態様において、細胞内の免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列は、免疫原性標的抗原を分泌させるかまたは細胞質、細胞膜、小胞体、リソソームに局在させるシグナル配列をコードする。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は非天然シグナル配列である。
【0006】
本発明は、病原体、癌または自己免疫疾患に対して個体を免疫するための方法に関し、真核細胞における発現に必要な制御要素に作動可能に連結した免疫原性標的抗原をコードするヌクレオチド配列を含むDNAワクチンを個体に投与する工程からなるが、但し、免疫原性抗原をコードするヌクレオチド配列は、細胞内での免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列を包含する。いくつかの好ましい態様において、免疫原性標的抗原は、病原体抗原、癌関連抗原または自己免疫疾患に関連した細胞に連結した抗原である。いくつかの態様において、細胞内の免疫原性標的抗原の輸送を指示するシグナル配列をコードするヌクレオチド配列は、免疫原性標的抗原を分泌させるかまたは細胞質、細胞膜、小胞体、リソソームに局在させるシグナル配列をコードする。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は非天然シグナル配列である。
発明の詳細な説明
本発明は、改良されたDNAワクチンに関する。DNAワクチンは、米国特許第5,589,466号および第5,973,972号、およびPCTの公開出願、PCT/US90/01515,PCT/US93/02338,PCT/US93/048131およびPCT/US94/00899、及びそれらの中に引用される優先出願に記載されており、それらは引用により本明細書に編入される。それらの出願において記載された送達プロトコルに加えて、別のDNA送達方法が、米国特許第4,945,050号および第5,036,006号に記載されており、両者は引用により本明細書に編入される。さらに、上記総説文献は、DNAワクチン技術を記載し、そしてDNAワクチンの例を引用する。各々の場合に、プラスミドDNAは、プラスミドを取り込んだ個体の細胞に送達されて、該プラスミドによりコードされる免疫原性標的蛋白質を発現する。免疫原性標的蛋白質に対して生じた免疫応答は、ワクチン投与された個体に対して、予防上または治療上の利益を提供する。
【0007】
本発明によれば、免疫原性標的蛋白質をコードするプラスミド上のコーディング配列は、その蛋白質上の存在が発現された蛋白質の特定の細胞内の位置をもたらすアミノ酸配列をコードするコーディング配列と共に提供される。細胞内蛋白質輸送を指示するアミノ酸配列であって、DNAワクチン組成物として用いられるプラスミド構築物中に含まれる免疫原性蛋白質のコーディング配列中に含まれるアミノ酸配列をコードするヌクレオチド配列は、特定の免疫応答の増強をもたらす細胞内の特定のエリアへの局在化を指示する。
【0008】
本明細書にて用いられるとおり、用語「遺伝構築物」は、免疫原性標的蛋白質並びに細胞内の蛋白質輸送を指示するアミノ酸配列をコードするコーディング配列を含むプラスミドを意味し、該コーディング配列は真核細胞内でのコーディング配列の発現に必要な制御要素に作動可能に連結している。DNA発現のための制御要素は、プロモーターおよびポリアデニル化シグナルを含む。さらに、他の要素、例えばコザック領域も、遺伝構築物に含めてよい。開始および停止シグナルは、しばしばコーディング配列の考慮すべき部分である、必要な制御要素である。本発明の遺伝構築物のコーディング配列は、機能的な開始および停止シグナルを含む。
【0009】
本明細書にて用いられるとおり、用語「免疫原性標的蛋白質」は、症状、感染、疾患または障害に関連した蛋白質、例えばアレルゲン、病原体抗原、癌細胞または自己免疫疾患に関与する細胞に関連した抗原に向けられた免疫応答のための標的である抗原を指すことを意味する。免疫原性標的抗原は、DNAワクチン中で用いられる遺伝構築物のコーディング配列によりコードされる。DNAワクチンはワクチン接種された個体(vaccinated individual)に投与されて、遺伝構築物がその個体の細胞に取り込まれて、コーディング配列が発現され、そして免疫原性標的蛋白質が生成される。免疫原性標的蛋白質は、その個体において免疫原性標的蛋白質に対する免疫応答を誘導する。免疫応答は、症状、感染、疾患または障害に関連した対、例えばアレルゲン、病原体抗原、癌細胞または自己免疫疾患に関与する細胞に関連した抗原に対して向けられる。即ち、ワクチン投与された個体は、予防または治療のために免疫されて、症状、感染、疾患または障害を予防または治療してよい。免疫原性標的蛋白質は、免疫応答のために標的蛋白質として作用する本発明の遺伝構築物によりコードされるペプチドおよび蛋白質を意味する。用語「免疫原性標的評定蛋白質」は、免疫応答が引き出されうる蛋白質を意味する。免疫原性標的蛋白質は、アレルゲン、病原体からの蛋白質、または不所望な蛋白質または細胞種、例えば癌細胞または免疫を必要とする自己免疫疾患に関与する細胞との間で、少なくともエピトープを共用する。免疫原性標的蛋白質に対する免疫応答は、アレルゲン、病原体からの蛋白質、または不所望な蛋白質または細胞種が関連する特定の感染または疾患から個体を防御し、そして治療する。免疫原性標的蛋白質は、免疫が要求される蛋白質と同一である必要はない。さらに、免疫原性標的蛋白質は、免疫が要求される蛋白質に交差反応する免疫応答を誘導することができなければならない。
【0010】
本明細書において用いられるとおり、用語「非天然シグナル配列」は、免疫原性標的抗原の細胞内の輸送(trafficking)を指示する外来シグナル配列であるシグナル配列を意味する。非天然シグナル配列は、天然においては免疫原性標的蛋白質に連結されることが見いだされていないがシグナル配列をコードするヌクレオチド配列が免疫原性標的抗原をコードするヌクレオチド配列と連結した遺伝構築物を製造することにより生じる。いくつかの態様において、天然シグナル配列は、免疫原性標的蛋白質をコードするコーディング配列から取り出されてよく、そして天然配列が蛋白質を指示する位置とは異なる位置に蛋白質を局在させる非天然シグナル配列かまたは天然配列が蛋白質を指示する位置と同じ位置に蛋白質を局在させる非天然シグナル配列に置換されてよい。
【0011】
本発明によれば、免疫原性標的蛋白質は、細胞内のその局在を指示する配列を含む。蛋白質の局在を指示する、天然に生じる配列は、シグナル配列を供給するか、キメラ蛋白質をデザインするか、または該配列を免疫原性蛋白質配列中に移植することにより、DNAワクチンの免疫原性標的蛋白質に取り込んでよい。DNAワクチンはプラスミドであり、そして免疫原性標的蛋白質のコーディング配列は標準分子生物学方法論により操作されて、細胞内蛋白質輸送を指示するシグナル配列を含む免疫原性標的蛋白質か、または細胞内蛋白質輸送を指示する領域を含むキメラ免疫原性標的蛋白質をコードするコーディング配列を生じる。さらに、日常的な分子生物学の技術を用いることにより、免疫原性標的蛋白質のアミノ酸配列を変化させて、細胞内蛋白質標的化を指示する配列をその配列中に含ませてよい。いくつかの態様において、免疫原性標的抗原の細胞内輸送を指示するシグナル配列をコードするヌクレオチド配列は、非天然シグナル配列である。公知の技術を用いて、一つの蛋白質のシグナル配列をコードするヌクレオチド配列を修飾し、単離し、そして異なる蛋白質をコードするコーディング配列に連結してよい。
【0012】
免疫原性標的蛋白質が指示される位置は、免疫原性標的蛋白質に対してその個体が生じる免疫応答に影響する。DNAワクチンの遺伝構築物によりコードされる免疫原性標的蛋白質の細胞内標的化は、免疫原性標的抗原に対して増強された免疫応答をもたらすことが発見された。細胞内標的化シグナルのコーディング配列を、免疫原性標的蛋白質のコーディング配列の一部として提供することにより、免疫原性標的蛋白質が細胞の一部に局在する。ある局在は免疫応答の増強された特定種と関連していることが発見された。例えば、小胞体、特に粗面小胞体に保持されるかまたはリサイクルされる指示蛋白質(directing protein)が、特定の細胞内局在を標的とする配列を含まないワクチンを用いて観察された誘導に比して増強されたCTL応答をワクチン接種動物中においてもたらすことが発見された。
【0013】
本発明の改良は、DNAワクチンを投与した個体の細胞において生成された免疫原性標的蛋白質の細胞内局在を指示するための遺伝物質の包含に関する。
本発明は、遺伝物質によりコードされる蛋白質およびペプチドに対して免疫応答を誘導するために、個体の細胞に遺伝物質を導入する方法に関する。該方法は、個体の組織に、発現のために必要とされる制御要素に作動可能なように連結したコーディング配列を含むDNAを投与する工程からなる。コーディング配列は、細胞内輸送シグナルに関するコーディング配列に連結したかまたは含む、免疫原性標的蛋白質のコーディング配列を含む。
【0014】
細胞内輸送シグナルは当業界においてよく知られている。
いくつかの態様において、蛋白質は分泌される。そのような蛋白質は、N−末端疎水性配列を含む。RNAが翻訳された場合、N末端の疎水性配列は蛋白質を粗面小胞体に固着させる。疎水性配列は、次にプロテアーゼにより切り外されて、蛋白質を分泌する。本発明のいくつかの態様において、免疫原性標的蛋白質は、細胞内で発現された場合に免疫原性標的蛋白質の分泌を指示するN末端疎水性リーダー配列を含んでよい。
【0015】
いくつかの態様において、蛋白質は膜結合である。そのような蛋白質は、N−末端疎水性配列および内部疎水性領域を含む。分泌された形態におけるように、RNAが翻訳された場合、N末端の疎水性配列は蛋白質を粗面小胞体に固着させる。N末端疎水性配列は、次にプロテアーゼにより切り外される。蛋白質は同じ分泌経路に従うが、内部疎水性配列が分泌を阻害して蛋白質は膜結合になる。本発明のいくつかの態様において、免疫原性標的蛋白質は、N末端疎水性リーダー配列および細胞内にて発現された場合に膜結合蛋白質になる免疫原性標的蛋白質をもたらす内部疎水性配列を含んでよい。
【0016】
いくつかの態様において、蛋白質は細胞質に局在される。そのような蛋白質は、N−末端疎水性配列を含まない。RNAが翻訳された場合、蛋白質は粗面小胞体に固着せず、そして蛋白質は細胞性になる。本発明のいくつかの態様において、免疫原性標的蛋白質はN末端疎水性リーダー配列を含まず、よって免疫原性標的蛋白質は細胞内で発現された場合に細胞質蛋白質になる。
【0017】
いくつかの態様において、蛋白質はリソソーム中に局在化する。そのような蛋白質は、リソソームへの蛋白質の局在を指示する配列DKQTLL(配列番号:1)を含んでよい。本発明のいくつかの態様において、免疫原性標的蛋白質は配列DKQTLL(配列番号:1)を含むことにより、免疫原性標的蛋白質が細胞内で発現された場合にリソソームに向けられる。
【0018】
いくつかの態様において、蛋白質はゴルジ体からERに局在化される。そのような蛋白質は、C末端に、蛋白質がERにリサイクルされるように局在化を指示する配列KDEL(配列番号:2)を含んでよい。本発明のいくつかの態様において、免疫原性標的蛋白質はC末端に配列KDEL(配列番号:2)を含むことにより、免疫原性標的蛋白質が細胞内で発現された場合にERに向けられる。
【0019】
そのような「ERリサイクルシグナル」の他の例は、アデノウイルスからのE19蛋白質のC末端配列として報告される。その蛋白質は、それがMHCsに結合し、そして免疫応答誘導の一部としてT細胞リセプターと複合体形成する場所である表面においてMHCにより提示される蛋白質を効果的に負荷し続けるERに局在化される。E109蛋白質はヘキサペプチドDEKKMP(配列番号:3)である。いくつかの態様において、C末端に配列DEKKMP(配列番号:3)を含むことにより、蛋白質はERに局在化する。本発明のいくつかの態様において、免疫原性標的蛋白質はC末端に配列DEKKMP(配列番号:3)を含むことにより、免疫原性標的蛋白質はERに向けられる。
【0020】
増強しようと意図する免疫応答の種類に依存して、別の細胞内局在化が望まれる。クラスI免疫応答の場合には、細胞内で合成された蛋白質は分解され、そしてそれらがMHCs上に負荷される場所であるERに輸送され、そして次に細胞表面に異動してCD8+T細胞のT細胞リセプターと複合体形成する。この作用は、CTL応答を導く。クラスII免疫応答の場合には、蛋白質はCD4+T細胞と相互作用し、抗体応答に関連した細胞を包含する、ヘルパーT細胞を必要とする抗原提示細胞(APCs)と複合体形成する。
【0021】
クラスI免疫応答を増強するために、細胞質またはERへの蛋白質の局在化は、そのような蛋白質がクラスI経路により接近可能になることを可能にする。
クラスII免疫応答を増強するために、膜貫通またはリソソームへの蛋白質の局在化または蛋白質の分泌は、そのような蛋白質がクラスII経路により接近可能になることを可能にする。
【0022】
本発明は、細胞内局在化のための配列を含む免疫原性標的蛋白質のコーディング配列を含むDNAワクチンとして有用な遺伝構築物を提供する。
いくつかの態様において、遺伝構築物は、Biocca, S. et al. 1990 EMBO J. 9: 101-108に記載された局在化リーダー配列を含む。遺伝構築物は、図6Aに記載されたのと同じ配列でそれらのリーダー配列を含む。特定すれば、リーダー配列は、興味のある蛋白質のプロモーターとコーディング配列の間で蛋白質のN末端において生じる。いくつかの態様において、本発明の遺伝構築物は、本出願の図6Aに記載されたリーダー配列の一つを含む。いくつかの態様において、本発明の遺伝構築物は、本出願の図6Bに記載されたリーダー配列の一つを含む。
【0023】
いくつかの態様において、遺伝構築物は、小胞体内での保持のためのアデノウイルスE19蛋白質からの末端ヘキサペプチドを含む。DNAワクチンの免疫原性標的蛋白質のC末端がDEKKMP(配列番号:3)である場合、蛋白質はERに保持される。
【0024】
いくつかの態様において、遺伝構築物は、小胞体内での保持のためのC末端クオドラペプチドを含む。DNAワクチンの免疫原性標的蛋白質のC末端がKDEL(配列番号:2)である場合、蛋白質はERに保持される。
【0025】
図7Aおよび7Bは、ER保持のためのいくつかのC末端配列を示す。Jackson, M. R., et al. 1990 EMBO J. 9: 3153-3162は、図7AのC末端配列が、通常はER内に保持されない蛋白質のC末端において連結された場合に、キメラ蛋白質のER保持をもたらすことを報告する。
【0026】
いくつかの態様において、遺伝構築物は、免疫原性標的蛋白質のC末端テイルにおいてリソソーム標的化対(doublets)を含む。C末端テイルは最後の20-30アミノ酸である。該対LLおよび/またはYQおよび/またはQYを含むことにより、蛋白質はリソソームに向けられる。いくつかの態様において、一つまたは複数のリソソーム標的化対を含むC末端テイルは、膜貫通蛋白質の細胞質テイルである。いくつかの態様において、該対は、免疫原性蛋白質の配列中において最後の30アミノ酸中に含まれる。
【0027】
本発明によれば、アレルゲン、病原体または異常な疾患関連細胞または蛋白質に対して個体を予防上および/または治療上免疫する組成物および方法が提供される。標的蛋白質、即ちアレルゲン、病原体または抗原または標的とされる細胞との間で少なくともエピトープを共用するペプチドまたは蛋白質をコードする遺伝物質、および細胞内輸送シグナルをコードする遺伝物質。遺伝物質は個々の細胞中で発現されて、免疫応答が引き出される免疫原性標的として機能する。細胞内輸送シグナルの存在は、所望の免疫応答を誘導するのにより効果的な細胞内の位置への蛋白質の局在化を指示する。アレルゲン、病原体または抗原または細胞と反応する、その結果の免疫応答は、細胞内輸送シグナルを欠く同様な遺伝構築物により誘導された免疫応答に比して増強される。
【0028】
本発明は、アレルゲン、病原体または個体自身の「異常な」細胞に特に関連した蛋白質に対する免疫応答を引き出すために有用である。本発明は、病原体蛋白質に対する免疫応答が病原体に対する防御性免疫を提供するように、アレルゲン、または病原因子および生物に対して個体を免疫するのに有用である。本発明は、高増殖性の細胞に特に関連した標的蛋白質に対する免疫応答を引き出すことにより、癌のような高増殖性疾患および障害と格闘するのに有用である。本発明は、自己免疫疾患に関与する細胞に特に関連した標的蛋白質に対する免疫応答を引き出すことにより自己免疫疾患および障害と格闘するのに有用である。
【0029】
本発明によれば、DNAは、細胞内輸送配列または細胞内輸送配列を含むペプチド配列のいずれかに連結した免疫原性標的配列をコードする。シグナル配列は、細胞の通常の蛋白質プロセシングの一部として切り離される。さらに、免疫原性標的蛋白質をコードするDNAは、蛋白質のコーディング配列中に細胞内輸送配列を含んでよい。DNA発現のための制御要素は、プロモーターおよびポリアデニル化シグナルを含む。さらに、他の要素、例えばコザック領域も遺伝構築物中に含まれてよい。
【0030】
本明細書において用いられるとおり、用語「発現可能な形態」は、個体の細胞中に存在する場合にコーディング配列が発現されるように免疫原性標的蛋白質をコードするコーディング配列に作動可能なように連結された必要な制御要素を含む遺伝構築物を意味する。
【0031】
本明細書において用いられるとおり、用語「エピトープを共用する(share an epitope)」は、他の蛋白質のエピトープと同一かまたは実質的に類似の少なくとも一つのエピトープを含む蛋白質を意味する。
【0032】
本明細書において用いられるとおり、用語「実質的に類似のエピトープ」は、蛋白質のエピトープと同一ではない構造を有するが、それでもなおその蛋白質と交差反応する細胞または体液の免疫応答を呼び出すエピトープを意味する。
【0033】
遺伝構築物は、遺伝子発現に必要な制御要素に作動可能なように連結した細胞内輸送配列を含む免疫原性標的蛋白質をコードするヌクレオチド配列を含む。
細胞から取り出された場合、遺伝構築物は細胞内において染色体外分子として存在するか、および/または細胞の染色体DNAにインテグレートされて保持されてよい。DNAは、一つまたは複数のプラスミドの形態で別の遺伝物質として残るように細胞中に導入されてよい。別法として、染色体にインテグレートしうる直鎖状DNAを細胞中に導入してよい。細胞中にDNAを導入する場合、染色体へのDNAインテグレーションを促進する薬剤を付加してよい。インテグレーションを促進するのに有用なDNA配列をDNA分子中に含ませてもよい。別法として、RNAを細胞に投与してよい。セントロメア、テロメアおよび複製開始点を含む直鎖ミニクロモソームとして遺伝構築物を提供することも意図される。遺伝構築物は、弱毒化生存微生物または細胞中で生存する組換え微生物ベクター中の遺伝物質の一部を残してよい。遺伝構築物は、遺伝物質が細胞の染色体にインテグレートされるかまたは染色体外に残るように、組換えウイルスワクチンのゲノムの一部であってよい。
【0034】
遺伝構築物は、核酸分子の遺伝子発現に必要な制御要素を含む。要素は、プロモーター、開始コドン、停止コドン、およびポリアデニル化シグナルを含む。さらに、免疫原性標的蛋白質をコードする配列の遺伝子発現にはエンハンサーがしばしば必要である。これらの要素は、所望の蛋白質をコードする配列に作動可能なように連結すること、および制御要素が投与された個体において作動することが必要である。
【0035】
開始コドンおよび停止コドンは、一般に、免疫原性標的蛋白質をコードするヌクレオチド配列の一部であると考えられる。しかしながら、これらの要素は、遺伝構築物が投与される個体において機能することが必要である。開始および停止コドンは、コーディング配列のフレーム中になければならない。
【0036】
用いられるプロモーターおよびポリアデニル化シグナルは個体の細胞内で機能しなければならない。
本発明の実施、特にヒトのための遺伝ワクチンの製造における実施のために有用なプロモーターの例は、限定されないが、シミアンウイルス40(SV40)のプロモーター、マウス乳癌ウイルス(MMTV)プロモーター、ヒト免疫不全ウイルス(HIV)例えばHIVロングターミナルリピート(LTR)プロモーター、モロニーウイルス、ALV、サイトメガロウイルス(CMV)例えばCMV介在初期プロモーター、エプスタインバールウイルス(EBV)、ラウスサルコーマウイルス(RSV)並びにヒト遺伝子例えばヒトアクチン、ヒトミオシン、ヒトヘモグロビン、ヒト筋肉クレアチンおよびヒトメタロチオネインからのプロモーターを含む。
【0037】
本発明の実施、特にヒトのための遺伝ワクチンの製造における実施のために有用なポリアデニル化シグナルの例は、限定されないが、SV40ポリアデニル化シグナルおよびLTRポリアデニル化シグナルを含む。特に、SV40ポリアデニル化シグナルと呼ばれる、pCEP4プラスミド(Invitrogen, サンディエゴ、CA)中のSV40ポリアデニル化シグナルを用いる。
【0038】
DNA発現に必要な制御要素に加えて、他の要素もDNA分子中に含ませてよい。そのような付加的要素は、エンハンサーを含む。エンハンサーは、ヒトアクチン、ヒトミオシン、ヒトヘモグロビン、ヒト筋肉クレアチンおよびウイルスエンハンサー例えばCMV,RSVおよびEBVからのエンハンサーを含む群から選択されるが、これらに限定されない。
【0039】
染色体外に構築物を保持して細胞内で複数コピーの構築物を生成するためには、遺伝構築物は哺乳類の複製開始点を伴うことができる。Invitrogen社(サンディエゴ、CA)のプラスミドpCEP4およびpREP4は、エプスタインバールウイルスおよびインテグレーション無しに高コピー数のエピソーム複製を生じる核抗原EBNA-1コーディング領域を含む。
【0040】
免疫化の適用に関するいくつかの好ましい態様において、標的蛋白質、IL-12蛋白質をコードするヌクレオチド配列および、付加的にそのような標的蛋白質に対する免疫応答をさらに増強する蛋白質の遺伝子を含む核酸分子が送達される。そのような遺伝子の例は、サイトカインおよびリンフォカイン、例えばα−インターフェロン、ガンマ−インターフェロン、血小板由来成長因子(PDGF)、GC-SF,GM-CSF,TNF,表皮成長因子(EGF)、IL-1,IL-2,IL-4,IL-6,IL-8,IL-10およびB7.2をコードする遺伝子である。いくつかの態様において、GM-CSFをコードする遺伝子が免疫化組成物において使用される遺伝構築物に含まれることが好ましい。
【0041】
何らかの理由により遺伝構築物を受容する細胞を除去することが望まれるなら、細胞破壊のための標的物として機能する付加的要素を加えてよい。発現可能な形態でのヘルペスチミジンキナーゼ(tk)遺伝子を遺伝構築物中に含ませることができる。薬剤ガングシクロビア(gangcyclovir)は個体に投与することができ、そしてその薬剤はtkを生産するあらゆる細胞の選択的殺傷を引き起こし、即ち、遺伝構築物と共に細胞の選択的破壊のための手段を提供する。
【0042】
蛋白質の生成を最大にするためには、構築物が投与される細胞における遺伝子発現にうまく適合した制御配列を選択してよい。さらに、細胞中においてもっとも効率よく転写されるコドンを選択してよい。当業者であれば、細胞中において機能するDNA構築物を生産することができる。
【0043】
本発明の方法は、個体の組織へ核酸分子を投与する工程を含む。いくつかの態様において、核酸分子は、筋肉内、鼻腔内、腹腔内、皮下、皮内、または局所または膣、直腸、尿道、頬および舌下からなる群から選択される粘膜組織への洗浄により投与される。
【0044】
いくつかの態様において、核酸分子は促進剤の投与と共に細胞内に送達される。促進剤は、ポリヌクレオチド機能エンハンサーまたは遺伝ワクチン促進剤とも呼ばれる。促進剤は、1993年1月26日に出願された米国出願連続番号08/008,342、1993年3月11日に出願された米国出願連続番号08/029,336、1993年9月21日に出願された米国出願連続番号08/125,012、および1994年1月26日に出願された国際出願連続番号PCT/US94/00899に記載されており、引用により各々は編入される。さらに、促進剤は、PCT出願連続番号PCT/US95/04071に記載されており、引用により編入される。核酸分子と共に投与される促進剤は、核酸分子との混合物として投与されるか、または同時にか、核酸分子の投与前または後に、別個に投与されてよい。さらに、トランスフェクト薬剤および/または複製剤および/または炎症剤として機能してよく、そして促進剤が有るか無しかに拘わらず同時に投与されてよい他の薬剤は、成長因子、サイトカインおよびリンフォカイン、例えばα−インターフェロン、ガンマ−インターフェロン、血小板由来成長因子(PDGF)、GC-SF,GM-CSF,TNF,表皮成長因子(EGF)、IL-1,IL-2,IL-4,IL-6,IL-8,IL-10およびB7.2並びに繊維芽細胞成長因子、界面活性剤、例えば、免疫刺激性複合体(ISCOMOS)、フロイント不完全アジュバント、モノホスホリルリピッドA(MPL)を含むLPS類似体、ムラミルペプチド、キノン類似体および小胞例えばスクアランおよびスクアランを含み、そしてヒアルウロン酸も遺伝構築物と共に投与してよい。
【0045】
いくつかの態様において、本発明の遺伝構築物は、安息香酸エステル類、アニリド類、アミジン類、ウレタン類およびそれらの塩酸塩からなる群から選択される促進剤、例えば局所麻酔剤のファミリーの促進剤と共に製剤化されるかまたは共に投与される。
【0046】
いくつかの好ましい態様における促進剤は、以下の式:
【0047】
Ar−R1−O−R2−R3
または
【0048】
Ar−N−R1−R2−R3
または
【0049】
R4−N−R5−R6
または
【0050】
R4−O−R1−N−R7
(式中、
Arはベンゼン、p-アミノベンゼン、m-アミノベンゼン、o-アミノベンゼン、置換されたベンゼン、置換されたp-アミノベンゼン、置換されたm-アミノベンゼン、置換されたo-アミノベンゼンであり、但し、アミノベンゼン中のアミノ基はアミノ、C1−C5アルキルアミン、C1−C5,C1−C5ジアルキルアミンであることができ、そして置換された化合物中の置換基はハロゲン、C1−C5アルキルおよびC1−C5アルコキシであり;
R1はC=Oであり;
R2はC1−C10アルキルであり、分枝アルキルを含み;
R3は水素、アミン、C1−C5アルキルアミン、C1−C5,C1−C5ジアルキルアミンであり;
R2+R3は環状アルキル、C1−C10アルキルで置換された環状アルキル、環状脂肪族アミン、C1−C10アルキルで置換された環状脂肪族アミン、複素環、C1−C10アルキルで置換された複素環(C1−C10アルキルN−置換された複素環を含む)を形成でき;
R4はAr、R2またはC1−C5アルコキシ、環状アルキル、C1−C10アルキルで置換された環状アルキル、環状脂肪族アミン、C1−C10で置換された複素環およびC1−C10アルコキシで置換された複素環(C1−C10アルキルN−置換された複素環を含む)であり;
R5はC=NHであり;
R6はAr、R2またはC1−C5アルコキシ、環状アルキル、C1−C10アルキルで置換された環状アルキル、環状脂肪族アミン、C1−C10で置換された複素環およびC1−C10アルコキシで置換された複素環(C1−C10アルキルN−置換された複素環を含む)であり;そして
R7はAr、R2またはC1−C5アルコキシ、環状アルキル、C1−C10アルキルで置換された環状アルキル、環状脂肪族アミン、C1−C10で置換された複素環およびC1−C10アルコキシで置換された複素環(C1−C10アルキルN−置換された複素環を含む)である)
の一つを有する化合物であってよい。
【0051】
エステルの例は、安息香酸エステル類、例えばピペロカイン、メプリルカインおよびイソブカイン;パラ−アミノ安息香酸エステル類、例えばプロカイン、テトラカイン、ブテサミン、プロポキシカインおよびクロロプロカイン;メタブサミンおよびプリマカインを含むメタ−アミノ安息香酸エステル類;およびパラ−アミノ安息香酸エステル類、例えばパレトキシカインを含む。アニリドの例は、リドカイン、エチドカイン、メピバカイン、ブピバカイン、ピロカインおよびプリロカインを含む。そのような化合物の他の例は、ジブカイン、ベンゾカイン、ジクロニン、プラモキシン、プロパラカイン、ブタカイン、ベノキシネート、カーボカイン、メチルブピバカイン、ブタシンピクレート、フェナカイン、ジオサン、ルカイン、イントラカイン、ヌペルカイン、メタブトキシカイン、ピリドカイン、ビフェナミンおよび植物由来の二環式、例えばコカイン、シナモイルコカイン、トルキシリンおよびコカエチレンおよび塩酸と複合したそのような化合物の全てを含む。
【0052】
好ましい態様において、促進剤はブピバカインである。ブピバカインとメピバカインの違いは、メピバカインのN−メチル基に代えてブピバカインがN−ブチル基を有することである。化合物は、そのNにおいて、C1−C10を有してよい。化合物は、プロカインおよびクロロプロカインのようにハロゲンで置換されてよい。アニリドが好ましい。
【0053】
促進剤は、遺伝構築物の前、同時または後に投与する。促進剤および遺伝構築物は同じ組成物中に製剤化してよい。
ブピバカイン-HClは、2-ピペリジンカルボキサミド、1-ブチル-N-(2,6-ジメチルフェニル)−一塩酸塩、一水塩として化学的にデザインされ、そして多くの源から薬学上の用途の為に広く市販されており、Astra Pharmaceutical Product Inc.(ウエストボロ、MA)およびSanofi Winthrop Pharmaceuticals(ニューヨーク、NY)、Eastman Kodak(ロチェスター、NY)を含む。ブピバカインは、メチルパラベンを含むか含まないかに拘わらず、そしてエピネフィリンを含むか含まないかに拘わらず製剤化されて市販されている。そのようなあらゆる製剤を使用してよい。0.25%,0.5%および0.75%の濃度において薬学上の用途の為に市販されており、本発明に用いてよい。違う濃度、特に0.05%から1.0%の間は所望の効果を引き出すが、望むのであれば調製してよい。本発明によれば、約250μgから約10mgのブピバカインが投与される。いくつかの態様においては、約250μgから約7.5mgのブピバカインが投与される。いくつかの態様においては、約0.05mgから約5.0mgのブピバカインが投与される。いくつかの態様においては、約0.5mgから約3.0mgのブピバカインが投与される。いくつかの態様においては、約5から50μgのブピバカインが投与される。例えば、いくつかの態様においては、等張の薬学上のキャリアー中の0.25-0.50%ブピバカイン-HClおよび0.1%のメピバカイン約50μlから約2ml、好ましくは約50μlから約1500μlそしてより好ましくは1mlを、ワクチンが投与される前、同時または後に同じ部位に投与する。同様に、いくつかの態様においては、等張の薬学上のキャリアー中の0.25-0.50%ブピバカイン-HCl約50μlから約2ml、好ましくは約50μlから約1500μlそしてより好ましくは1mlを、ワクチンが投与される前、同時または後に同じ部位に投与する。ブピバカインおよびあらゆる他の類似の作用化合物、特に局所麻酔剤の関連ファミリーのそれらは、細胞による遺伝構築物の取り込みの所望の促進を提供する濃度において投与してよい。
【0054】
本発明のいくつかの態様においては、ある個体は、遺伝構築物投与前に促進剤を注射される最初の患者である。即ち、例えば、遺伝構築物投与前の約1週間から10日までは、その個体は最初に促進剤を注射される。いくつかの態様においては、約1日から5日間促進剤を注射され;いくつかの態様においては、遺伝構築物の投与の前または後から24時間に注射される。別法としては、使い切るならば、遺伝構築物と同時かまたは遺伝構築物の投与前または後の数分に促進剤を投与する。したがって、促進剤と遺伝構築物は単一の薬学組成物を形成するように化合されてよい。
【0055】
いくつかの態様において、遺伝構築物は促進剤無しに投与されて、即ち、遺伝構築物が促進剤投与と共に投与されない場合の投与プロトコルを用いて促進剤なしに製剤化される。
【0056】
本発明により細胞に送達される核酸分子は、予防上および/または治療上の免疫剤として機能する蛋白質の遺伝上の鋳型として作用してよい。好ましい態様において、核酸分子は、動物の細胞の中でコーディング配列の転写および翻訳のために必要な制御配列を含む。
【0057】
本発明は、全ての病原体、例えばウイルス、原核生物および病原性真核生物、例えば、単細胞病原生物および多細胞寄生虫に対して個体を免疫するの使用してよい。本発明は、特に、細胞に感染し、そしてウイルスのように封入されないそれらの病原体、そして原核生物例えば淋菌、リステリア(listeria)およびシゲラ(shigella)に対する個体の免疫に有用である。さらに、本発明は、それらが細胞内病原体である場合の生活サイクルのステージを含むプロトゾア病原体に対する個体の免疫にも有用である。本明細書において用いられるとおり、用語「細胞内病原体」は、その再生または生活サイクルの少なくとも一部において宿主細胞中に存在してその中で病原体蛋白質を生産するウイルスまたは病原体生物を意味する。表1は、本発明のワクチンが作成されうるウイルスファミリーおよび属のいくつかの掲載を提供する。該表に掲載された抗原のような病原体抗原上に現れるエピトープと同一かまたは実質的に類似のエピトープ少なくとも一つを有するペプチドをコードするDNA配列を含むDNA構築物は、ワクチン中にて有用である。さらに、本発明は、表2に掲載された原核生物および真核生物のプロトゾア病原体並びに多細胞寄生虫に対して個体を免疫するのにも有用である。
【0058】
病原体感染に対して防御するための遺伝子ワクチンを生成するためには、防御性免疫応答が構築されうる免疫原性蛋白質をコードする遺伝物質が、標的のためのコーディング配列として遺伝構築物中に含まれていなければならない。病原体が本発明が特に有用な細胞内感染をするかまたは細胞外感染をするか、全ての病原体抗原が防御性応答を引き出す見込はない。DNAおよびRNAは、両方とも相対的に小さくて相対的に用意に生産できるから、本発明は、複数の病原体抗原をワクチン接種させる付加的な利点を提供する。遺伝子ワクチン中に置いて用いられる遺伝構築物は、多くの病原体抗原をコードする遺伝物質を含むことができる。例えば、いくつかのウイルス遺伝子は単一の構築物中に含ませてよく、それにより複数の標的を提供する。
【0059】
表1および2は、感染から個体を防御するのに遺伝子ワクチンが製造されうる病原因子および生物のいくつかの掲載を含む。いくつかの好ましい態様においては、病原体に対して個体を防御するための方法は、HIV,HTLVおよびHBVに向けられる。
【0060】
本発明の他の側面は、高増殖性疾患における特徴である高増殖性細胞に対する、広範囲に基づく防御性免疫応答を比較する方法、および高増殖性疾患を罹患する患者を治療する方法を提供する。本明細書において用いられるとおり、用語「高増殖性疾患」は、細胞の高増殖性により特徴付けされるそれらの疾患および障害を意味する。高増殖性疾患の例は、全ての形態の癌および乾癬を含む。
【0061】
免疫原性「高増殖性細胞」関連蛋白質をコードするヌクレオチド配列を含む遺伝構築物の個体の細胞への導入は、その個体のワクチン接種化細胞におけるそれら蛋白質の生産をもたらすことが発見された。本明細書において用いられるとおり、用語「高増殖性関連蛋白質」は、高増殖性疾患に関した蛋白質を意味する。高増殖性疾患に対して免疫するためには、高増殖性疾患に関連した蛋白質をコードするヌクレオチド配列を含む遺伝構築物を個体に投与する。
【0062】
高増殖性関連蛋白質を効果的な免疫原性標的にするためには、独占的に生産されるか、または正常細胞に比して高増殖性細胞中においてより高いレベルで生産される蛋白質でなければならない。標的蛋白質は、そのような蛋白質上に見いだされるエピトープを少なくとも一つ含むそのような蛋白質、その断片またはペプチドを含む。いくつかの場合、高増殖性蛋白質は、蛋白質をコードする遺伝子の変異産物である。変異された遺伝子は、正常な蛋白質において見いだされない異なるエピトープをもたらすわずかに異なるアミノ酸配列を有する以外は、正常蛋白質とほとんど同一な蛋白質である。そのような標的蛋白質は、癌遺伝子例えばmyb,myc,fyn,および転移遺伝子bcr/abl,ras,src,P53,neu,trkおよびEGRFによりコードされる蛋白質である蛋白質を含む。標的抗原としての癌遺伝子産物に加えて、抗癌治療および防御養生法のための標的蛋白質は、B細胞リンパ腫により作成される抗体の可変領域およびT細胞リンパ腫のT細胞リセプターの可変領域を含み、いくつかの態様において、それらは自己免疫疾患に関する抗原標的化にも使用される。他の腫瘍関連蛋白質は標的蛋白質として用いることもでき、例えば、モノクローナル抗体17-1Aにより認識される蛋白質および葉酸塩結合蛋白質を含む、腫瘍において高いレベルで見いだされる蛋白質を含む。
【0063】
本発明は、一つまたは複数のいくつかの形態の癌に対して個体を免疫するのに用いてよいが、本発明は、特定の癌を発症する素因を有する個体または癌を有しており且つ従って再発する疑いのある個体を予防のために免疫するのに特に有用である。遺伝学および技術並びに疫学の発展は、個体の癌の発症の可能性の決定および危険度評価を可能にする。遺伝スクリーニングおよび/または家族の健康の歴史を用いることにより、いくつかの種の癌のいずれか一つを発症する特定の個体の可能性を予測することが可能である。
【0064】
同様に、すでに癌を発症した個体および癌を切除する治療を受けたことがある個体または他の方法で養生している個体は、特に、再発(relapse)および再度の発症(reoccurrence)の疑いがある。治療養生法の一部として、そのような個体は、再発を攻撃誘発しなければならないとして診断を受けた癌に対して免疫されうる。即ち、個体ある種の癌を罹患し、そして再発の危険があることがわかったら、それらの免疫系を作って癌のあらゆる未来の出現を攻撃誘発するために、免疫されうる。
【0065】
本発明は、高増殖性疾患を罹患した個体を治療する方法を提供する。そのような方法において、遺伝構築物の導入は、標的蛋白質を生成する高増殖性細胞を攻撃誘発するように個体の免疫系を免疫治療上指示および促進するものとして機能する。
【0066】
本発明は、細胞リセプターおよび「自己」指示抗体を生成する細胞を包含する、自己免疫に関連した標的に対する広範囲に基づく免疫応答を提供することにより、自己免疫疾患および障害を罹患した個体を治療する方法を提供する。
【0067】
T細胞介在自己免疫疾患は、慢性関節リウマチ(RA)、多発硬化症(MS)、シェーグレン症候群、類肉腫、インスリン依存性糖尿病(IDDM)、自己免疫性甲状腺炎、反応性関節炎、強直性脊椎炎、硬皮症、多発筋炎、皮膚筋炎、乾癬、脈管炎、ウエジナー肉芽腫、クローン病および潰瘍性大腸炎を含む。これらの疾患の各々は、内因性抗原に結合し、そして自己免疫疾患に関連した炎症性カスケードを開始するT細胞リセプターにより特徴付けられる。T細胞の可変領域に対してのワクチン接種は、CTLsを含む免疫応答を引き出してそれらのT細胞を除去する。
【0068】
RAにおいては、その疾患に関与するT細胞リセプター(TCRs)のいくつかの特定の可変領域が同定された。これらのTCRsは、Vβ-3,Vβ-14,Vβ-17およびVα-17を含む。即ち、これらの蛋白質の少なくとも一つをコードするDNAワクチンによるワクチン接種は、RAに関与するT細胞を標的化する免疫応答を引き出す。Howell, M. D., et al., 1991 Proc. Natl. Acad. Sci. USA 88: 10921-10925; Paliard, X., et al., 1991 Science 253: 325-329; Williams, W. V., et al., 1992 J. Clin. Invest. 90: 326-333;を参照されたい:これらの各々は引用により編入される。
【0069】
MSにおいては、この疾患に関与するTCRsのいくつかの特定の可変領域が同定された。これらのTCRsは、Vβ-7およびVα-10を含む。即ち、これらの蛋白質の少なくとも一つをコードするDNAワクチンによるワクチン接種は、MSに関与するT細胞を標的化する免疫応答を引き出す。Wucherpfennig, K. W. et al., 1990 Science 248: 1016-1019;Oksenberg, J. R., et al., 1990 Nature345: 344-346;を参照されたい:これらの各々は引用により編入される。
【0070】
硬皮症においては、この疾患に関与するTCRsのいくつかの特定の可変領域が同定された。これらのTCRsは、Vβ-6,Vβ-8,Vβ-14およびVα-16,Vα-3C,Vα-7,Vα-14,Vα-15,Vα-16,Vα-28およびVα-12を含む。即ち、これらの蛋白質の少なくとも一つをコードするDNAワクチンによるワクチン接種は、硬皮症に関与するT細胞を標的化する免疫応答を引き出す。
【0071】
T細胞介在自己免疫疾患、特にTCRの可変領域がまだ同定されていない疾患を罹患する患者を治療するためには、滑膜生検を実施しうる。T細胞が存在するサンプルを取ることができ、そしてそれらのTCRs可変領域は標準技術を用いて同定されうる。遺伝子ワクチンは、この情報を用いて作成できる。
【0072】
B細胞介在自己免疫疾患は、狼瘡、グレーブス病、重症筋無力症、自己免疫性溶血性貧血、自己免疫性血小板減少症、ゼンソク、寒冷グロブリン血症、原発性胆汁性硬化症および悪性貧血症を含む。これらの疾患の各々は、内因性抗原に結合し、そして自己免疫疾患に関連した炎症性カスケードを開始する抗体により特徴付けられる。抗体の可変領域に対してのワクチン接種は、CTLsを含む免疫応答を引き出してそれらのB細胞を除去するはずである。
【0073】
B細胞介在自己免疫疾患を罹患した患者を治療するためには、自己免疫活性に関与する抗体の可変領域を同定しなければならない。生検を実施することができ、そして炎症部位に存在する抗体のサンプルを取り出すことができる。それらの抗体の可変領域は標準技術を用いて同定されうる。遺伝子ワクチンは、この情報を用いて作成できる。
【0074】
SLEの場合、ひとつの抗原はDNAであると信じられる。即ち、SLEに対して免疫される患者においては、それらの血清を抗-DNA抗体に関してスクリーニングでき、そして該血清中に見いだされるそのような抗-DNA抗体の可変領域をコードするDNA構築物を含むワクチンを製造することができる。
【0075】
TCRsおよび抗体の可変領域の間で共通な構造上の特徴はよく知られている。特定のTCRsおよび抗体をコードするDNA配列は以下の公知の方法において一般的に見いだすことができる:Kabat, et al., 1987 Sequence od Proteins of Immunological Interest U. S. Department of Health and Human Services, Bethesda MD、これは引用により編入される。さらに、抗体からの機能性可変領域をクローン化する方法は、Chaudhary, V. K., et al., 1990 Proc. Natl. Acad. Sci. USA 87: 1066に見いだすことができ、引用により編入される。
実施例
実施例1
腎炎原性(nephritogenic)自己抗体抗-DNA IL/IM:
このモノクローナル抗体(mAb)は、MRL-lpr/lprマウスに由来するハイブリドーマ(Vlahakos, et al., 1992 Kidney Int 41, 1690-1700)の大きなパネルから同定されたが、何故ならば腎炎を有するMRL-lpr/lprマウスの腎臓から溶出されたIgと抗原結合特性が共有であったからである。抗-DNA IL/IMは、5.1のpIを有するJ558 VH遺伝子ファミリーのIgG2a抗体である。抗-DNA IL/IM抗体は、ssDNA,dsDNA,SmRNPおよび糸球体抽出物に特異的に結合する。正常な組織適合性マウスに投与後、抗-DNA IL/IMは、腎臓内において、糸球体、内皮下および管腔内免疫沈積物を形成する。
【0076】
抗-DNA IL/IM産生ハイブリドーマ細胞が組織適合性マウスに腹腔内投与される場合、毛管壁肥大、糸球体間置(interposition)および拡張(expansion)、糸球体毛管ループの動脈瘤性拡張および管腔内閉塞、および重度のタンパク尿症に関連した、濃い膜内および管腔内沈積物を生じる。糸球体の免疫沈積物の形態学上の出現は寒冷グロブリン血症に関連したそれらの暗示(reminiscent)であるが、高い血清抗-DNA抗体活性を有する抗-DNA IL/IMハイブリドーマ産生マウスは、検出可能な寒冷グロブリン血症並びにリウマチ因子活性を有さなかった。糸球体免疫沈積物の形成は、毛管壁肥大、糸球体間置および拡張、糸球体毛管ループの動脈瘤性拡張および管腔内閉塞、および重度のタンパク尿症に関連した。
【0077】
その交差反応性および明確な腎炎原性の特性があれば、抗-DNA IL/IMが糸球体Agとの直接の相互作用により免疫沈積物を形成するか否かの分析が考えられた。この可能性に接近するために、モノクローナル抗-DNA IgG2a抗体、抗-DNA IL/IM抗体が糸球体細胞表面抗原に結合する能力を評価した。抗-DNA IL/IM抗体は、正常マウスに生体内投与後に糸球体、内皮下および管腔内免疫沈積物を生成した。FACSにより、抗-DNA IL/IM抗体(ハイブリドーマ番号H221により呼ばれる)は糸球体、管状上皮および大動脈内皮表面に結合したが、糸球体免疫沈積物を生成しなかったアイソタイプ適合抗-DNA抗体による表面結合は観察されなかった。結果を図1A,1Bおよび1Cに示す(マウス内皮細胞はFuad Ziyadeh博士(腎臓部門、ペンシルバニア大学)から寄贈された)。
【0078】
抗−DNA抗体を用いて釣り上げた成分糸球体細胞の全細胞溶解物を用いたウエスタンブロットは抗-DNA IL/IM抗体が複数のバンドと反応したことを示したが、免疫沈積物を形成しない抗-DNA抗体は反応しなかった。細胞表面抗原のビオチン化並びに抗-DNA IL/IM抗体との免疫沈殿の後に、糸球体細胞溶解物の中の100kDのバンドが、アイソタイプ適合対照モノクローナル抗-DNA抗体により認識されないものとして同定された。
【0079】
即ち、抗-DNA IL/IMモノクローナル抗体は、マウスの腎臓の糸球体細胞および大動脈内皮細胞に結合することが証明され、そして候補の表面蛋白質抗原が同定された。これはこのモノクローナル抗体の複数に特異的な抗原結合特性を示し、これは病原性SLE抗体に共通の特徴であり、そして糸球体免疫沈積物形成の開始における細胞表面抗原への結合に必須かもしれない。
【0080】
抗-DNA IL/IM(H221)の配列分析を実施した。完全なVL-VJL配列(配列番号:4)およびほぼ完全なVH-DH-JH配列(配列番号:6)がここに示される:
【0081】
【化5】

【0082】
この結果は、抗-DNA IL/IM(H221)がJ558 VHファミリーのメンバーであることおよび研究デザインおよび方法部門に記載された実験を行うための試薬を提供することを確証する。重鎖配列を完全にするための付加的な配列分析は、進行中である。
抗-DNA IL/IM に対する遺伝子免疫化:
以前の研究は、抗-DNA IL/IMのVHまたはFv領域をコードするDNA構築物でAKR×DBA/2マウスを免疫して、次に致死量の親ハイブリドーマ細胞を攻撃誘発することにより実施した。簡単に言えば、図2Aに示されるとおり、VHおよびFv領域を、CMVプロモーター存在下にてV領域を置かれた遺伝子免疫ベクター中にクローン化した。図2Bに示されるとおり、V領域は、細胞質、分泌されるか、細胞質に保持されるか、またはアデノウイルスE19蛋白質ER保持シグナルを用いて小胞体に保持されるかの、何れかを標的とした。リソソームを標的とした構築物も開発した。
【0083】
引用により編入されるBiocca, S. et al. 1990 EMBO J. 9(1): 101-108は、細胞膜、分泌、細胞質局在を標的とすることを記載する。Nilsson, et al. 1989 Cell 58: 707-718,Jackson et al., 1993 J. Cell Biol. 121(2)317-333およびJackson et al 1990 Embo J. 9: 3153-3162は、アデノウイルスE19蛋白質ER保持シグナルを用いて小胞体に保持された蛋白質を記載した。Letourner, F. and R. D. Klausner 1992 Cell 69: 1143-1157は、リソソームを標的とする蛋白質を記載した。
【0084】
以前の実験においては、ブピバカイン前処理後に、精製されたプラスミドDNAをマウスに接種し、そして幾度化のブースト後にマウスの抗体応答を評価した。対照は殺傷されたハイブリドーマ細胞および精製された抗体Fv領域を含んだ。これらの免疫原の何れもが、抗-DNA IL/IM Fab断片に対して血清学上の応答を引き出すことができなかった(検出は標識したストレプトコッカスのプロテインGを用いた)。以前の研究においては、増殖性および細胞毒性のT細胞応答がいくつかの構築物により引き出された。最良の構築物は、大きなグループのマウス中での評価に関して選択した。4匹のAKR×DBA/2マウスのグループを、一回、100μgのプラスミドDNAおよび同時にブピバカインで免疫した。1週間後、動物を犠牲にして、細胞毒性T細胞および増殖性応答に関して評価した。増殖は、精製されたH221モノクローナル抗体(25または5=B5g/ウエル)または20,000または100,000の殺傷された抗-DNA IL/IMハイブリドーマ細胞の何れかで72時間、免疫性脾臓卵母細胞を刺激し、そしてトリチウム化チミジンを用いて一晩パルスすることにより評価した。結果を図3に示す。
【0085】
最良の増殖応答は、殺傷されたハイブリドーマ細胞において誘導された。測定可能な応答(ベクターのみと比較して)はほとんどの構築物に関して観察されたが、規模において穏和でしかなかった。精製されたモノクローナル抗体に対する増殖性応答は、殺傷された細胞またはER標的化ワクチンで免疫されたマウスに関して(バックボーン対照を上回る>2標準誤差)顕著であった。ハイブリドーマ細胞に対する増殖性応答は両ER標的化ワクチン、およびVH可溶性およびVH細胞質性ワクチンに関して(バックボーン対照を上回る>2標準誤差)顕著であった。対照的に、引き出されたCTL応答は目立った。結果を図4A,4Bおよび4Cに示す。
【0086】
免疫性脾臓細胞を、7日間、殺傷された抗-DNA IL/IM刺激剤の存在下で(20:1の比の脾臓細胞対刺激剤)、最初の2日間コンカナバリン、次に刺激剤のみの存在下で培養した。抗-DNA IL/IMハイブリドーマ細胞を51Crで標識し、そして丸底マイクロタイタープレート中で溶解を測定した。平均=B1標準偏差%特異的溶解(CD4に関して上記のとおり)は様々なエフェクター:標的比に関して示される。興味を引くことは、一つ(可溶性重鎖V領域またはVH溶液)以外の全ての構築物が殺傷された細胞より良好なCTL活性を引き出し、これがアッセイにおける陽性対照であった。特に、細胞質およびER標的化構築物に関しては、例外的な応答が観察された。これは、これらの区画への標的化が、観察されたCTL応答をブーストすることを示す。
【0087】
これらの研究は、評価されたDNAワクチンのほとんどによる良から最良のCTL応答誘導を示す。この実験は、他を除外しながらこの研究を続けるために特定のワクチンを選択するために使用されるDNAワクチンの例として機能しうる。即ち、細胞質を標的としたFv構築物は、他の構築物よりも明らかに高い(>2標準誤差)CTL応答を引き出した。この分析に基づくと、このワクチンはさらなる評価を招く。同様に、VH可溶性ワクチンは良好なCTL応答を引き出さなかった。したがって、このワクチンはさらなる分析から除外されるはずであり、CD4系中で生じた仮設に基づいて防御性応答を引き出すことは期待されない。
【0088】
このワクチンを用いた付加的な実験は、これが全く事実であることを明らかにした。この実験において、5匹または6匹のマウスのグループを、3回、DNAワクチンの100=B5g'sで免疫した。次に、それらは、抗-DNA IL/IMハイブリドーマ細胞で腹腔内攻撃誘発された。4週間後、対照動物中で腫瘍が発生していた場合は、全てのマウスを犠牲にし、そして腹水の腫瘍負荷および量に関して評価した。マウスが発生した腫瘍の比率も定量した。結果を図5A,5Bおよび5Cに示す。
【0089】
図5Aは、腫瘍が発生したマウスの比率を示す。図5Bは、グループ中の平均腫瘍質量、並びに個々のマウスの値を示す。図5Cは、得られた悪性の腹水の体積を示す。この特定の実験において、殺傷細胞で免疫したマウス(我々の陽性対照)は、何れの測定においても、ベクターのみを免疫されたマウス(我々の陰性対照)と大きく異ならなかったことは注目すべきである。これにもかかわらず、いくつかのDNAワクチン、特にFV細胞質標的ワクチンおよびFVおよびVH小胞体(ER)を標的とするワクチンの両者は、明らかな防御能力を示した。これは、このワクチンのCTL応答を引き出す能力とよく相関する。VH可溶性ワクチンは防御活性を示さなく、CTL活性を示さないことと相関する。
実施例2
いくつかのヒトの疾患は、BおよびT細胞の病原性増殖に関連する。これは、悪性腫瘍または高増殖性疾患、例えばリンパ腫および白血病、および自己免疫疾患例えば病原性自己抗体が組織の損傷に介在する場合の全身性エリテマトーデス(SLE)を含む。これらの疾患に関する現在の治療は不十分であり、そして処置は発生率の高い副作用に関連する。そのような疾患の治療に対するより論理的なアプローチは、病原性細胞を特定的に除去することである。これは、それらの可変領域を標的とする活性の有る免疫療法により達成されるかもしれない。V領域に対する活性な免疫化は、病原性細胞を除去する能力を有する。さらに、防御性免疫を除去することにより、病原性クローンの再出現が排除できる。しかしながら、免疫化により排除された免疫応答も有害な結果を生ずる可能性を有する。例えば、B細胞のV領域を生成する自己抗体に対する理想的なワクチン接種は、細胞毒性T細胞(CTL)を除去して、病原性B細胞を排除して自己抗体の生産を制限するべきである。しかしながら、もしもヘルパーT細胞、(即ち、TH2タイプの応答)が排除されたのであれば、自己抗体生産が事実増大して患者に損害を与えるかもしれない。よって、病原性BまたはT細胞のV領域に対する活性な免疫化をデザインすることにより、所望の免疫応答(例えば、CTL応答)を引き出して、有害な応答(例えば、TH2応答)を可能な限り制限するべきである。
【0090】
自己抗体V領域に対するDNAワクチン接種は、以下のとおりに評価された。自己抗体産生ハイブリドーマの抗-DNA IL/IM(H221とも呼ばれる)を、MRL-lpr/lprマウス由来のハイブリドーマの大きなパネルから選択した;抗-DNA IL/IM産生ハイブリドーマ細胞を組織適合性のマウスに腹腔内投与する場合には、毛管壁肥大、糸球体間置および拡張、糸球体毛管ループの動脈瘤性拡張および管腔内閉塞、および重度のタンパク尿症に関連した、濃い膜内および管腔内沈積物により特徴付けされる糸球体腎炎を生じる。これは、防御性免疫を引き出す病原性自己抗体のV領域を標的とするイディオタイプのDNAワクチン接種の効率を評価するインビボ系を提供した。これらのワクチンの免疫原性を増強する能力を調査するために、特定の細胞内対細胞外区画(細胞質、分泌のための小胞体(ER)および保持のためのER)に対して遺伝子発現を標的化した。単一のV領域(VH領域)に対するワクチン接種および完全なFv断片(VLに連結したVH)に対するワクチン接種を用いた。結果は、H221のVHおよびFv領域に対するDNA接種が、特定の細胞性免疫応答、特に有力なCTL応答を引き出し、細胞質で発現されるかまたはER中に保持されるV領域を標的化することによりCTL活性の増強を伴った。さらに、特にER中の保持のために遺伝子産物が標的化された場合には、イディオタイプDNAワクチン接種はH221細胞に対して防御性免疫を引き出した。
【0091】
材料と方法
DNA構築物
pBBkanは、転写を指示するCMVプロモーターおよびRSVエンハンサーを利用する真核生物発現ベクターである。これを最初に、マウスIgGからの分泌リーダーまたは細胞質性リーダーをNotIとXbaIの間のマルチクローニング部位にサブクローニングすることにより修飾した。分泌リーダーを伴うベクターは、分泌されたワクチンおよびER保持されたワクチンのための親ベクターであった。同様に、細胞質性リーダーを伴うベクターは、細胞質で発現されたワクチンのための親ベクターであった。H221のVHおよびVL領域をポリメラーゼ鎖反応(PCR)により増幅し、そして組換えPCRを用いることにより、Fvコーディング配列を生じさせた(Srikatan, et al. 1994 AIDS 8: 1525-32, 引用により編入される)。ひとつのXbaI制限部位を単一の重鎖産物の5'末端およびカッパ軽鎖産物(Fv)の5'末端へクローン化した。CPR産物は制限消化されて、次に標準のフェノール−クロロホルム抽出により2%低融点アガロースから精製して、ゲル精製して、そして直接ベクターに連結されるか(領域を配列と共に)または他の断片に連結され、そして3'標的化配列上をスプライシングするさらなるPCR反応のための鋳型として指示する場所で用いられた(E19へのCD4 TM、CD4-E19へのFvまたはVh)。E19の単一配列をCD8-E19から増幅した(Nilsson, et al. 1989 CELL 58: 707-718,引用により編入される)。用いられたプライマーは、表3に掲載される。イムノグロブリンリーダー(分泌または保持のためのER標的化)(配列番号:22)、細胞質リーダー(配列番号:23)、H221 VL領域(配列番号:24)、リンカーペプチド(配列番号:25)、H221 VH領域(配列番号:26)およびCD4膜貫通並びにE19細胞質ドメイン(ER保持のため)(配列番号:27)のアミノ酸配列を表4に掲載する。イムノグロブリンリーダー(配列番号:22)は、分泌のためのERまたはER保持に遺伝子産物を標的化するのに用いられたマウスイムノグロブリンリーダーであった。細胞質リーダー(配列番号:23)は、抗体の細胞内発現に関して以前に報告された配列であった(Biocca, et al. 1990 EMBO J. 9:101-108,引用により編入される)。VHおよびVL配列(それぞれ、配列番号:24および配列番号:25)は、PCR産物のクローニング後に決定された。リンカーペプチド(配列番号:25)は、Fv領域の機能性発現のために使用した。ヒトCD4膜貫通領域は、ER保持のためのアデノウイルスE19標的化配列(配列番号:27)と組み合わされた。
【0092】
これらのPCR産物は、pBBkan中にクローン化されて、DH5アルファ大腸菌(Life Technologies Inc., Gaitherburg, MD)を形質転換し、そして正確な制限パターンを有するクローンをABI蛍光配列決定キット(Applied Biosystems Inc., Foster City, CA)により配列決定した。産物は、キットの指示書のとおりに精製しそして乾燥し、そしてゲル泳動および分析はペンシルバニアガンセンターコア配列決定設備により実施された。配列分析は、H221が、Vk1遺伝子により対合されたJ558 VHおよびJH3遺伝子を利用することを明らかにする。ベクター、構築物および挿入配列は図8および表4に示す。プラスミド調製物は、スーパーブロス(1.2% w/v ディフコ社トリプトファン、2.4% w/vディフコ社イーストエキストラクト、0.5% v/vグリセロール、72mM 第二リン酸カリウム、28mM 第一リン酸カリウム)中で生育させ、そして製造者のプロトコルに従いキアゲン社の500チップを用いて精製した(Giagen Inc., Chatsworth, CA)。DNA接種はブピバカイン前処理と共に実施した(Wang, et al., 1993 Proc. Natl. Acad. Sci. USA 90: 4156-4160,引用により編入される)。
増殖アッセイ
ワクチン接種されたマウスからの個々の脾臓を滅菌様式により抽出して、RPMI中で穏やかに破壊し、そしてゲイズ(Gey's)溶液で処理することにより、赤血球細胞を溶解する。脾臓卵母細胞を、96ウエルの平底組織培養プレート(Falcon 3072;Becton Dickinson,Franklin Lakes,NJ)中にウエルあたり500,000個にて200μlの体積で入れる。3通りのウエルを培地のみ、2μg/mLコンカナバリンA,5および25μg/mLのMab H221,および5:1または25:1(脾臓卵母細胞:刺激剤)のマイトマイシンで殺傷されたH221ハイブリドーマ細胞に暴露する。106個のハイブリドーマ細胞/mLを25μg/mLのマイトマイシンCで45分間37℃においてPBS中で処理して、次に3回PBSで洗浄して毒素を除去した。37℃において5% CO2下の培養3日後、1μCiのトリチウム化チミジン(NEN Life Science, Boston MA)を20μl培地中に加えて、18時間後にプレートをTomec Harvester 96(Tomec, Orange, CT)上に回収する。フィルターマットを乾燥して、次にMicrobeta 1450シンチレーションカウンター(Wallac Inc., Gaithersburg, MD)上でベータシンチレーションを計数する。
細胞毒性T細胞アッセイ
脾臓卵母細胞を5×105/mLにて2μg/mLコンカナバリンAおよびマイトマイシンC処理した刺激剤と共に刺激剤に対する脾臓卵母細胞の20:1にて24時間、培地が分裂促進剤を除去するように変化する点まで培養する。追加の4日の培養後に、細胞を10mLの培地に回収してFicoll上で20分間1500gにて遠心分離する。次に、細胞を計数して100:1、50:1、25:1および12.5:1のエフェクター:標的と一定数の細胞を、各丸底ウエルに入れた。標的細胞は、107の生存可能なH221細胞を250μlの培地に懸濁して75μCiの51Cr-クロム酸ナトリウム(NEN/Life Science Inc., Boston, MA)を加え、そして室温にて2時間インキュベートする。次に、これらの細胞をRPMI完全培地で3回洗浄してプレーティングのために懸濁した。プレートを800rpmで2分間遠心分離して、次に37℃において5および16時間インキュベートして、そのときに50μLの上清を注意深く取り出し、そしてシンチレーションカウンター中でOptiphaseシンチレーション液体(Wallace Inc., Gaitherburg, MD)で計数した。パーセントの特異的な溶解を以下の等式により計算した:
%特異的溶解 = 実験上の放出−自発放出/全放出−自発放出
(自発放出は培地のみでインキュベートした細胞のcpmであり、そして全放出は1%SDS中でのインキュベートによる標的細胞の全溶解により放出された放出。)
インビボ腫瘍攻撃誘発
マウスをプリスタン(1ml腹腔内)で3DNA接種の最後にの開始した。1週間後に、マウス(グループあたり6匹)に106の2回洗浄された生存可能なH221ハイブリドーマ細胞を腹腔内注射して、PBS中に107/mlで懸濁した。腫瘍成長のサインに関して、最初の2週間マウスを毎週チェックし、その後は週に2回チェックした(触知可能な質量および/または腹水)。攻撃誘発後4週間目にマウスを犠牲にして、固形の腫瘍を切除して秤量することにより腫瘍質量を定量した。悪性の腹水を有するマウスにおいては、腹水の細胞内含有量も秤量して、腫瘍質量に加えた。
抗-DNA抗体アッセイ
マウスからの血清を抗-dsDNAのELISA中で試験した(Madaio, et al. 1984 J. Immunol. 132: 872,引用により編入される)。
【0093】
結果
イディオタイプDNA接種は特定の免疫応答を引き出す
予備実験において、精製されたプラスミドDNAをAKR×DBA/2マウス中に接種して、幾度化のブーストの後に、マウスを細胞性および体液性免疫応答に関して評価した。対照は、殺傷されたハイブリドーマ細胞および精製されたH221 mAbを含んだ。リンパ球増殖性および細胞毒性T細胞の応答の両者は、抗-DNA IL/IM Fab断片に対する検出可能な血清学上の応答不在下で、構築物を有するH221細胞に対して引き出された(検出は標識されたストレプトコッカスプロテインGを用いてなされた)。細胞性免疫応答はより厳密に評価された。4匹のAKRおよびDBA/2マウスのグループを、一回、プラスミドDNAと共にブピバカイン−HClも同時に接種した。1週間後、それらのマウスを犠牲にして、細胞毒性T細胞および増殖性応答に関して評価した。結果を図9および図10に示す。
【0094】
単一のDNA接種後の脾臓卵母細胞の増殖性応答を評価するための実験において、マウスに、一回、0.25%のブピバカイン中の100μgのプラスミドDNAを接種して、1週間後、脾臓卵母細胞を除去して、培地のみまたは殺傷されたH221細胞またはH221 Fabの何れかとインキュベートした。増殖は、精製されたH221 mAb(25または5μg/ウエル)または殺傷された抗-DNA IL/IMハイブリドーマ細胞(20,000または100,000/ウエル)の何れかを用いて免疫性脾臓卵母細胞を刺激することにより評価した。陽性対照は、殺傷されたH221細胞(殺傷細胞)を接種し、そして陰性対照はベクターのみの接種であった。3日培養後、細胞を一晩トリチウム化チミジンでパルスして、分あたりの計数(CPM)の取り込みを測定した。平均△CPM(実験マイナス培地のみ)±3通りのウエルの標準偏差が2種類の濃度のFabおよび2種類の濃度の殺傷H221細胞に関して示される。結果を図9に示す。
【0095】
単一のDNA接種後の細胞毒性T細胞(CTL)応答を評価する実験において、マウスに、0.25%のブピバカイン中の100μgのプラスミドDNAを接種して、1週間後、脾臓卵母細胞を除去して、コンカナバリンAと殺傷されたH221細胞と共にインキュベートした(20:1のエフェクター:刺激剤比)。24-48時間後、ConAを除去して、細胞を生育させ、そして培養を全部で5日間続けた。陽性対照は、殺傷されたH221細胞(殺傷細胞)を接種し、そして陰性対照はベクターのみの接種であった。5日培養後、不連続勾配遠心分離によりエフェクター細胞を単離し、そして示された様々な比において51Cr標識された標的細胞を溶解するために用いられた。%特異的溶解は、材料と方法に記載されたとおりに計算された。平均±標準偏差%特異的溶解を3通りの測定に関して示す。対照(殺傷されたH221細胞およびベクターのみ)は参考のために全3つのグラフ中に示される。結果を図10A、10Bおよび10Cに示す。
【0096】
他の実験におけるとおり、最良の増殖性応答は殺傷されたハイブリドーマ細胞により誘導された(図9)。測定可能な応答(ベクターのみと比較して)は、ほとんどの構築物において観察されたが、規模においては適度でしかなかった。精製されたmAbに対する増殖性応答は、殺傷細胞あるいはER保持されたワクチンで免疫されたマウスに関して顕著であった(バックボーン対照を上回る>2の標準誤差)。ハイブリドーマ細胞に対する増殖性応答は、ER保持ワクチンおよびVH可溶性並びにVH細胞質性ワクチンの両者に関して顕著であった(バックボーン対照を上回る>2の標準誤差)。
【0097】
対照的に、引き出されたCTL応答は目立った(図10)。可溶性重鎖V領域(VH sol)を除く全ての構築物は殺傷細胞と同じかまたはより良好にCTL活性を引き出し、これをアッセイの陽性対照とした。他の実験において、VH solは対照に比して顕著なCTL応答を引き出した(典型的な実験においてVH sol構築物対対照に関して100:1のエフェクター:標的において10%特異的溶解に比して22%)。独占的な応答が細胞質およびER保持構築物に関して観察されたことから、これらの区画に対する標的化がCTL応答をブーストすることが示される。ER保持されたワクチンを除いて、Fv構築物は、通常、より有力なCTLsを引き出した。
ハイブリドーマ攻撃誘発からの防御
インビボにおける自己抗体生産ハイブリドーマ細胞による攻撃誘発からの防御におけるこれらのDNAワクチンの効率を評価するために、5−6匹のマウスのグループを3回隔週の間隔でブピバカイン中の100μgのDNAワクチンで免疫した。マウスを、生きた抗-DNA LK/IMハイブリドーマ細胞(H221細胞)で腹腔内に攻撃誘発した。4週間後、マウスを腫瘍負荷および腹水に関して評価した。腫瘍または腹水を有する全てのマウスを犠牲にして、腫瘍を切り出して、腫瘍の負荷を測定した。結果を図11Aおよび11Bに示す。図11Aは、各ワクチン接種グループに関する腫瘍質量を示す。平均値を棒グラフで示し、そして個々のマウスに関する値を上に加える。図11Bは、各グループ内における4週間の腫瘍形成におけるマウスの比率を示す。いくつかのDNAワクチンは特定の作用を示したことが、低下した腫瘍負荷から明らかとなった。FvおよびVH保持ワクチンの両者は、殺傷された細胞で免疫した3/6およびベクター対照を受けた2/5に比して、それぞれ6/6および4/5のマウスにおける腫瘍形成を妨害した。
【0098】
評価したほとんど全てのマウスはベースラインの応答に比して血清抗-DNA力価における増加を示したが、これは相対的に小さかった。このパラメーター中のグループ間に顕著な相違はなかったが、ベクターのみの対照に比してより低い抗-DNAレベルが、Fv ER保持ワクチンで免疫されたグループにおいて観察された(ベクター対照マウスにおける1.6±0.55に比して、Fv ER保持ワクチンに関する0.83±0.41の力価の増加、p=0.025の学生のt-試験)。即ち、もっとも有力なワクチンはこのモデルにおいても同じく、循環抗-DNAレベルを顕著に低下させた。
生存者における免疫応答
腫瘍攻撃誘発で生存したいくつかのマウスにおける殺傷されたH221細胞に応答したCTL活性および増殖を評価した。これは、殺傷された細胞で免疫された3マウス、細胞質性Fv構築物で免疫した3マウス、およびER処理したFv構築物で免疫した3マウスを含んだ。5週目(最初の攻撃誘発から38日)にマウスを犠牲にし、そして殺傷されたH221細胞に応答した脾臓卵母細胞の増殖を図9に記載されるとおりに測定した。3通りのウエルの平均CPM取り込みは個々のマウスに関して示され、そして受容したワクチンに従い標識した。CTL応答は衰退し(アッセイ前にマウスはブーストされなかった)、もっとも高い応答(50:1エフェクター:標的比において13%の特異的溶解)はER保持構築物で免疫したマウスにおいて観察されたが、同様な応答は他でも観察された(殺傷細胞の免疫化において7%およびFv細胞質構築物の免疫化において7%)。対照的に、増殖性応答はまだ激しかった(図12)。殺傷細胞または細胞質を標的とするFv構築物で最初に免疫したマウスはインビボにおいて殺傷H221細胞に応答した(培地のみの対照に関する721±409および5、044±1902に比して、それぞれ7,488±5,864CPMおよび6,663±4,171CPMの平均値)。対照的に、ER保持されたFv構築物で最初に免疫されたそれらのマウスは、インビトロにおいて殺傷H221細胞に対して応答した(平均37,351±9,004CPM対培地のみの4,651±1,345)。この豊富な増殖応答は平行培養における増強されたIL-2生産により写し出された(平均して、殺傷された細胞で免疫された場合に比してFv ER保持ワクチンにおいてほぼ2倍であった)。並びに、これらの結果は、Fv Er保持ワクチンで免疫されて攻撃誘発に生存したマウスにおける強い細胞増殖性応答を示す。
【0099】
考察
これらの研究は、イディオタイプのDNAワクチンが、検出可能な体液性免疫応答の不在下において細胞性免疫応答を引き出すことができることを示す。さらに、評価されたほとんどのワクチンに関して、CTL応答は、殺傷された細胞により引き出されたCTL応答と同等かまたは凌いだ(図10)。殺傷された細胞のワクチンとは対照的に、しかしながら、増殖性応答(典型的にはTH応答と相関する)はDNAワクチン接種後にかろうじて検出可能であった(図9)。即ち、イディオタイプDNAワクチン接種を用いることにより、ほんのわずかなTH応答を伴う有力なCTL応答を引き出すことが可能である。これは、防御性免疫を誘導する際のCTLsの効率の調査を可能にする。これらのイディオタイプDNAワクチンの免疫原性は、DNAワクチンを特定の細胞内区画に標的化することにより。特にCTL応答に関して顕著に増強された(図10)。細胞質への標的化およびER中の保持はCTL応答を増強し、MHCクラスIで制限された応答に関して予測されたとおりであった。Fvワクチン(VHおよびVL領域共に)はVH領域のみよりも免疫原性がより高いことが観察された。これは、免疫系に対するより多くのエピトープによるらしい。リンカーペプチドの直接の効果は除外できない。
【0100】
イディオタイプのDNAワクチンの接種は、ワクチンが適切な細胞内区画を標的とされたならば、組織適合性腫瘍攻撃誘発からマウスを保護することができる(図11)。この防御性応答は、腫瘍誘発攻撃唐の生存者においてさえもこの系において体液性免疫が検出不可能であったことから、細胞性免疫によるものであることは明らかである。もっともよく観察された防御は、有力なCTL応答がER保持ワクチンにより引き出されたことから、引き出されたCTL応答によるものであり、これは「もっとも防御性のある」ワクチンであった。これは、ER中の抗原の濃度およびCTL'sの引き出しが防御性免疫をもたらすことを暗示する。他の因子は防御性応答に貢献でき、例えばワクチン接種のために用いられる構築物の非自己抗原決定基の存在である。ER保持されたワクチンで免疫されて腫瘍誘発に生存したマウスは、印象的な増殖応答を開始した(mounted)(図12)。これは、ER保持されたFv DNAワクチンが、イディオタイプ特異的T細胞の顕著な拡張を伴う腫瘍攻撃誘発に対する二次応答のための免疫系を開始したことを示す。この増殖応答は、殺傷された細胞またはFv細胞質ワクチンを最初に免疫された生存者におけるよりも高くなかった。これは、単一の時間点のみがこの研究においてサンプルされたことから、攻撃誘発後の免疫応答のタイミングに関連するかもしれない。しかしながら、有力なCTL応答を開始する際のER保持されたワクチンの選択性の効果は、このグループにおける腫瘍攻撃誘発からの完全な防御により指示される。
【0101】
DNAワクチンの発現、細胞局在、および他のパラメーターを操作する能力は、インビボにおける防御に通じ得る誘導された免疫応答の性質に、調査を特別に適合させる。DNAワクチン接種は様々な腫瘍抗原モデルに対して使用されてきており、ヒトCD4を発現するマウスリンパ腫細胞を用いた我々の研究、ベータ−ガラクトシダーゼ遺伝子、ヒト癌胎児抗原、ヒトp53遺伝子の変異型からの単一のエピトープを用いた同様な系を含む。これらの研究は、モデル腫瘍抗原に対するDNAワクチン接種の利用性を確立する。用いられた抗原の全ては、事実、臨床上遭遇したはずの腫瘍自己抗原より典型的にはもっと免疫原性の高い外来蛋白質であった。
【0102】
ヒトGM-CSFの連結された発現があると無しとに拘わらずCγ1およびCκもコードする発現ベクターにおけるマウスリンパ腫のVHおよびVL領域の使用が報告された(Syrengelas, et al. 1996 Nature Medicine 2: 1038-1041,引用により編入される)。即ち、免疫原は、興味のある自己V領域に連結した外来性抗原決定基を有した。筋肉内または内皮へのこれらの構築物を伴うDNA接種は、抗イディオタイプ抗体応答、並びにインビボにおける腫瘍攻撃誘発からの部分的な防御をもたらした。ヒトGM-CSFの連結された発現は、引き出された応答を顕著に増強した。DNA免疫化は、弱くて他に認識できない腫瘍抗原に対する免疫応答を誘導し、これはDNAを伴う付加的な刺激に依存した(即ち、ヒト定常領域およびGM-CSF)。
【0103】
単離された同系V領域のDNA免疫化は、自己免疫疾患のマウスモデルにおいて、防御性免疫応答を引き出すことができることを示した。DNAに基づくマウスVβ8.2に対する免疫化は、実験上の自己免疫脳脊髄炎(EAE)からH-2uマウスの防御を示した(Waisman, et al. 1996 Nature Medicine 2: 899-905,引用により編入される)。細胞性免疫応答が証明され、そしてそのデータはDNA免疫化が病原性T細胞をシャットオフすることを示したが、この系においてはVβ8.2を発現するクローンにより支配される。それらのワクチン接種のアプローチを伴うVβ8.2生成細胞の欠如の証拠(リーダーペプチドまたはCDR3と対合なしに単離されたV領域を用いた)は示されなかった。
【0104】
【表1】

【0105】
【表2】

【0106】
【表3】

【0107】
【表4】

【0108】
【表5】

【0109】
【表6】

【0110】
【表7】

【0111】
【表8】

【0112】
【表9】

【図面の簡単な説明】
【0113】
【図1】図1A、1Bおよび1Cは、H221結合のFACS分析データを示す。
【図2】図2Aは、VHまたはFv領域がクローン化された遺伝免疫ベクターの地図を示す。図2Bは、細胞内の異なる位置に対してV領域を標的とするように用いられたV領域をコードする挿入物の構築物の地図を示す。
【図3】図3は、細胞内の様々な位置において標的とするようにデザインされた異なる構築物を細胞毒性T細胞および増殖性応答のそれらの誘導に関して比較した、実験結果を示す。
【図4−1】図4Aおよび4Bは、様々な細胞内標的DNAワクチンにより引き出されたCTL応答を評価する実験結果を示す。
【図4−2】図4Cは、様々な細胞内標的DNAワクチンにより引き出されたCTL応答を評価する実験結果を示す。
【図5−1】図5Aは、その可変領域がDNAワクチンによりコードされる抗体を生成するハイブリドーマ細胞を用いた腫瘍攻撃誘発(challenge)実験の結果を示す。
【図5−2】図5Bよび5Cは、その可変領域がDNAワクチンによりコードされる抗体を生成するハイブリドーマ細胞を用いた腫瘍攻撃誘発(challenge)実験の結果を示す。
【図6】図6Aおよび6Bは、特定のリーダー配列を含む、本発明の遺伝構築物を示す。
【図7A】図7Aは、ER(小胞体)保持のためのいくつかのC末端配列を示す。
【図7B】図7Bは、ER(小胞体)保持のためのいくつかのC末端配列を示す。
【図8】図8は、DNAワクチンの構造を示す。用いられたDNAワクチンのバックボーンは、pBBkanバックボーンであった。これは、転写を作動させるためにCMVプロモーターおよびRSVプロモーターを用いる。挿入物は表4に記載され、VH Fv(VHに連結したVL)領域、次にリーダーペプチド(マウスIgGからの疎水性リーダー(Igリーダー)または細胞質標的のための親水性リーダー(細胞質リーダー)のいずれか)、および付加された細胞膜並びに小胞体保持シグナルを伴う細胞質テイル(CD4 TMおよびE19細胞質)を伴う。
【図9】図9は、一回のDNA接種後の脾臓卵母細胞(spleenocytes)の増殖応答を評価するための実験結果を示す。
【図10A】図10A、10Bおよび10Cは、一回のDNA接種後の細胞毒性T細胞(CTL)の応答を評価するための実験結果を示す。図10Aは、ワクチンが分泌のためにH221 VHまたはFv領域からERを標的とした場合の実験のデータを示す。
【図10B】図10A、10Bおよび10Cは、一回のDNA接種後の細胞毒性T細胞(CTL)の応答を評価するための実験結果を示す。図10Bは、ワクチンが保持のためにH221 VHまたはFv領域からERを標的とした場合の実験のデータを示す。
【図10C】図10A、10Bおよび10Cは、一回のDNA接種後の細胞毒性T細胞(CTL)の応答を評価するための実験結果を示す。図10Cは、ワクチンがH221 VHまたはFv領域から細胞質を標的とした場合の実験のデータを示す。
【図11A】図11Aは、DNA接種および攻撃誘発後の生存およひ腫瘍負荷(tumor burden)に関するデータを示す。
【図11B】図11Bは、DNA接種および攻撃誘発後の生存およひ腫瘍負荷(tumor burden)に関するデータを示す。
【図12】図12は、腫瘍攻撃誘発の生存者における増殖応答を評価する実験のデータを示す。
【特許請求の範囲】
【請求項1】
制御要素に作動可能に連結したコーディング配列をコードするヌクレオチド配列を含むプラスミドであって、コーディング配列は細胞内標的化配列に連結されるかこれを含む免疫原性標的蛋白質をコードする、上記プラスミド。
【請求項1】
制御要素に作動可能に連結したコーディング配列をコードするヌクレオチド配列を含むプラスミドであって、コーディング配列は細胞内標的化配列に連結されるかこれを含む免疫原性標的蛋白質をコードする、上記プラスミド。
【図1】


【図2】


【図3】


【図4−1】


【図4−2】


【図5−1】


【図5−2】


【図6】


【図7A】


【図7B】


【図8】


【図9】


【図10A】


【図10B】


【図10C】


【図11A】


【図11B】


【図12】




【図2】


【図3】


【図4−1】


【図4−2】


【図5−1】


【図5−2】


【図6】


【図7A】


【図7B】


【図8】


【図9】


【図10A】


【図10B】


【図10C】


【図11A】


【図11B】


【図12】


【公開番号】特開2008−245651(P2008−245651A)
【公開日】平成20年10月16日(2008.10.16)
【国際特許分類】
【出願番号】特願2008−107021(P2008−107021)
【出願日】平成20年4月16日(2008.4.16)
【分割の表示】特願平10−519728の分割
【原出願日】平成9年10月23日(1997.10.23)
【出願人】(500429103)ザ・トラスティーズ・オブ・ザ・ユニバーシティ・オブ・ペンシルバニア (102)
【Fターム(参考)】
【公開日】平成20年10月16日(2008.10.16)
【国際特許分類】
【出願日】平成20年4月16日(2008.4.16)
【分割の表示】特願平10−519728の分割
【原出願日】平成9年10月23日(1997.10.23)
【出願人】(500429103)ザ・トラスティーズ・オブ・ザ・ユニバーシティ・オブ・ペンシルバニア (102)
【Fターム(参考)】
[ Back to top ]

