改良された効力を備えた、ロイプロリドのポリマー送達処方物
【課題】生分解性熱可塑性ポリエステル(水性媒体または体液内で少なくとも実質的に不溶性である)、生体適合性極性非プロトン溶媒(水性媒体または体液内に分散し得るように混和性である)および酢酸ロイプロリドを含む、徐放性移植物として使用する流動性組成物、そのような組成物を含む移植キット、ならびにこの流動性組成物を形成する方法を提供すること。
【解決手段】本発明はまた、患者においてインサイチュで形成される生分解性移植物、生きている患者において生分解性移植物をインサイチュで形成する方法(患者の身体内に流動性組成物を注射する工程、および生分解性固体移植物を生成するように生体適合性極性非プロトン溶媒が分散することを可能にする工程を包含する)、および癌の処置を必要とする患者に有効量の本発明の流動性組成物を投与することで患者の癌を処置する方法、または患者におけるLHRHレベルを減少させる方法に関する。
【解決手段】本発明はまた、患者においてインサイチュで形成される生分解性移植物、生きている患者において生分解性移植物をインサイチュで形成する方法(患者の身体内に流動性組成物を注射する工程、および生分解性固体移植物を生成するように生体適合性極性非プロトン溶媒が分散することを可能にする工程を包含する)、および癌の処置を必要とする患者に有効量の本発明の流動性組成物を投与することで患者の癌を処置する方法、または患者におけるLHRHレベルを減少させる方法に関する。
【発明の詳細な説明】
【背景技術】
【0001】
(発明の背景)
酢酸ロイプロリドは、LHRHアゴニストのアナログであり、ホルモンが関連した前立腺癌、乳癌、子宮内膜症、および早発思春期の待期療法に有用である。継続使用により、酢酸ロイプロリドは、下垂体の脱感作(desnsitizing)と下方制御を引き起こして下垂体−性腺系(pituitary−gonodal axis)に作用し、黄体形成ホルモンおよび性ホルモンの循環レベルの抑制を導く。進行型前立腺癌を有する患者において、0.5ng/ml(化学的去勢レベル)以下の循環テストステロンレベルを得ることが、治療行為の好ましい薬理学的指標である。
【0002】
最初に、酢酸ロイプロリドが、アナログ溶液の毎日の皮下(s.c.)注射として、アメリカ合衆国で始められた。慢性的な反復性注射の不便さは、ポリ(DL−ラクチド−コ−グリコリド)ミクロスフェア(Lupron(登録商標)Depot)に基づく、1ヶ月の持続放出性貯蔵生成物の開発により、後に排除された。現在、1ヶ月処方物、3ヶ月処方物、および4ヶ月処方物が、ミクロスフェアの筋肉内(i.m.)注射として広く利用可能である。
【0003】
現在のLupron(登録商標)Depotミクロスフェアは効果的であるように見えるが、このミクロスフェア生成物を製造するのは困難であり、そして、このミクロスフェア全てが患者に適切に投与されることを確実にするために、そのミクロスフェア生成物全てが、大量の液剤を用いた深部筋肉内(i.m.)注射を必要とする。これらの注射は、しばしば有痛性で、組織損傷を導く。
【0004】
Lupron(登録商標)Depot以外の生分解性ポリマーは、薬剤送達デバイスを含む、多数の医学適用において使用されている。概して、薬剤は、ポリマー組成物中に組み入れられ、その物体の外観を好ましい形状に形成される。その後、この固体移植物は、代表的には、ヒト、動物、鳥などの体内に、切開を介して挿入される。あるいは、これらのポリマーから構成される小さな個々の粒子が、シリンジにより体内に注射され得る。しかし、好ましくは、これらのポリマーのいくつかが、液状ポリマー組成物としてシリンジを介して注射され得る。
【0005】
生分解性徐放性薬剤送達系に有用な液状ポリマー組成物は、例えば、米国特許第4,938,763号;同第5,702,716号;同第5,744,153号;同第5,990,194号;および同第5,324,519号に記載されている。これらの組成物は、液体状態でか、あるいは溶液として、代表的にはシリンジを介して身体に投与される。一旦身体内に入ると、この組成物は凝析して固体になる。ポリマー組成物の1つの型は、体液分散性溶媒中に溶解した、非反応性熱可塑性ポリマーまたは非反応性熱可塑性コポリマーを含む。このポリマー溶液は身体内に配置され、そこでこのポリマーは、周囲の身体組織中へと溶媒が放散または拡散する際に、凝結するかまたは促進的に凝固する。これらの組成物のロイプロリドが、Lupron(登録商標)Depot中にあるものと同じであり、かつポリマーが類似しているので、これらの組成物は、Lupron(登録商標)Depotと同程度に効果的であると予期される。
【0006】
しかし驚いたことに、本発明による液状ポリマー組成物は、酢酸ロイプロリドを送達する際にLupron(登録商標)Depotよりも効果的であることが、発見された。具体的には、この酢酸ロリプロリドを含む本発明の液状ポリマー組成物を用いて得られたテストステロンレベルの方が、Lupron(登録商標)Depotと比較してイヌで長時間で低く、そしてまたLupron(登録商標)Depotに関する文献(Sharifi,R.,J.Urology,Vol.143、Jan.,68(1990))にて報告された値と比較してヒトで6ヶ月時点で低い。
【発明の概要】
【課題を解決するための手段】
【0007】
(発明の要旨)
本発明は、酢酸ロイプロリドの徐放性移植物としての使用に適した、流動性組成物を提供する。この流動性組成物は、水性媒体または体液中において少なくとも実質的に不溶性である、生分解性熱可塑性ポリエステルを含む。この流動性組成物はまた、生体適合性極性非プロトン溶媒を含む。この生体適合性極性非プロトン溶媒は、アミド、エステル、カルボネート、ケトン、エーテル、またはスルホニルであり得る。この生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である。この流動性組成物はまた、酢酸ロイプロリドを含む。この酢酸ロイプロリドは、好ましくは、この組成物の約2重量%〜約4重量%、または、この組成物の約4重量%〜約8重量%存在する。好ましくは、この流動性組成物は、注射可能な皮下送達系として処方される。この注射可能な組成物は、好ましくは、約0.20mL〜約0.40mLまたは約0.30mL〜約0.50mLの容量を有する。この注射可能な組成物は、好ましくは、1ヶ月につき約1回の投与、3ヶ月につき約1回の投与、または4ヶ月につき約1回の投与〜6ヶ月につき約1回の投与のために、処方される。好ましくは、この流動性組成物は、患者への注射に適した、液状組成物またはゲル組成物である。
【0008】
好ましくは、この生分解性熱可塑性ポリエステルは、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、またはそれらの任意の組み合わせである。より好ましくは、この生分解性熱可塑性ポリエステルは、ポリラクチド、ポリグリコリド、それらのコポリマー、それらのターポリマー、またはそれらの組み合わせである。より好ましくは、適切な生分解性熱可塑性ポリエステルは、カルボキシ末端基を有する50/50ポリ(DL−ラクチド−コ−グリコリド)であるか、または、保護されたカルボキシ末端基を有する75/25ポリ(DL−ラクチド−コ−グリコリド)である。適切な生分解性熱可塑性ポリエステルは、任意の適切な量で存在し得るが、ただし、生分解性熱可塑性ポリエステルは、水性媒体または体液中において少なくとも実質的に不溶性である。適切な生分解性熱可塑性ポリエステルは、好ましくは、この流動性組成物の約30重量%〜約40重量%存在するか、または、この流動性組成物の約40重量%〜約50重量%存在する。好ましくは、この生分解性熱可塑性ポリエステルは、平均分子量約23,000〜約45,000または約15,000〜約24,000を有する。
【0009】
好ましくは、この生体適合性極性非プロトン溶媒は、N−メチル−2−ピロリドン、2−ピロリドン、N,N−ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカルボネート、カプロラクタム、トリアセチン、またはそれらの任意の組み合わせである。より好ましくは、この生体適合性極性非プロトン溶媒は、N−メチル−2−ピロリドンである。好ましくは、この極性非プロトン溶媒は、その組成物の約60重量%〜約70重量%存在するか、または、その組成物の約45重量%〜約55重量%存在する。
【0010】
本発明はまた、流動性組成物を形成するための方法を提供する。この流動性組成物は、徐放性移植物として有用である。この方法は、任意の順序で、生分解性熱可塑性ポリエステル、生体適合性極性非プロトン溶媒、および酢酸ロイプロリドを混合する工程を包含する。これらの成分、それらの性質、および好ましい量は、上記に開示されるとおりである。この混合は、徐放性移植物としての使用のための流動性組成物を形成するために有効な、十分な時間、実施される。好ましくは、この生体適合性熱可塑性ポリエステルおよびこの生体適合性極性非プロトン溶媒は、混合物を形成するために一緒に混合され、その後、この混合物は、この流動性組成物を形成するため、酢酸ロイプロリドと混合される。
【0011】
本発明はまた、患者においてインサイチュで形成された生分解性移植物を提供する。この生分解性移植物生成物は、患者の身体内で流動性組成物を注射するプロセスにより調製され、生分解性固体移植物を生成するように、この生体適合性極性非プロトン溶媒が分散することを可能にする。これらの成分、それらの性質、および好ましい量は上記に開示された通りである。好ましくは、この患者はヒトである。この固体移植物は、好ましくは、この固体移植物が患者において生分解する場合に、有効量のロイプロリドを放出する。
【0012】
本発明はまた、生きている患者において、生分解性移植物をインサイチュで形成する方法を提供する。この方法は、患者の身体内に本発明の流動性組成物を注射する工程、および、生分解性固体移植物を生成するように、その生体適合性極性非プロトン溶媒が分散することを可能にする工程を包含する。この流動性組成物は、有効量の生分解性熱可塑性ポリエステル、有効量の生体適合性極性非プロトン溶媒、および有効量の酢酸ロイプロリドを含む。これらの成分、それらの性質、および好ましい量は上記に開示された通りである。好ましくは、その生分解性固体移植物は、拡散、崩壊(erosion)、または、拡散と崩壊(erosion)との組み合わせにより、患者においてその固体移植物が生分解する場合に、有効量の酢酸ロイプロリドを放出する。
【0013】
本発明はまた、患者において、癌を処置するか、または予防する方法を提供する。この方法は、そのような処置または予防を必要とする患者に、有効量の本発明の流動性組成物を投与する工程を包含する。具体的には、この癌は、前立腺癌であり得る。さらに、この患者は、ヒトであり得る。
【0014】
本発明はまた、患者において、LHRHレベルを減少させる方法を提供する。この方法は、そのようなLHRH減少を必要とする患者に、有効量の本発明の流動性組成物を投与する工程を包含する。具体的には、LHRHレベルの減少は、子宮内膜症を処置するために有用であり得る。さらに、この患者は、ヒトであり得る。
【0015】
本発明はまた、キットも提供する。このキットは、第1容器および第2容器を含む。この第1容器は、生分解性熱可塑性ポリエステルおよび生体適合性極性非プロトン溶媒を含む、組成物を含む。この第2容器は、酢酸ロイプロリドを含む。これらの成分、それらの性質、および好ましい量は上記に開示された通りである。好ましくは、この第1容器はシリンジであり、そしてこの第2容器はシリンジである。さらに、その酢酸ロイプロリドは、好ましくは凍結乾燥されている。このキットは、好ましくは、指示書を含み得る。好ましくは、この第1容器はこの第2容器に連結され得る。より好ましくは、この第1容器およびこの第2容器は、互いに直接連結されるように、それぞれ構成されている。
本発明はまた、固体移植物を提供する。この固体移植物は、生体適合性熱可塑性ポリエステルおよび酢酸ロイプロリドを含む。この生体適合性熱可塑性ポリエステルは、水性媒体または体液中において少なくとも実質的に不溶性である。この固体移植物は、固形またはゲル状の細孔性マトリックス(microporous matrix)を有し、ここで、そのマトリックスは被膜(skin)に囲まれたコア(core)である。この固体移植物はさらに、生体適合性の有機溶媒を含み得る。この生体適合性有機溶媒は、好ましくは、水性液または体液中において混和性から分散性までの性質である。さらに、この生体適合性有機溶媒は、好ましくは、その熱可塑性ポリエステルを溶解する。この生体適合性有機溶媒の量は、存在する場合は、好ましくは、その組成物の0重量%〜約20重量%のように少量である。さらに、この生体適合性有機溶媒の量は、好ましくは、経時的に低下する。そのコアは、好ましくは、直径約1〜約1000ミクロンの細孔を含む。その被膜は、好ましくは、このコアの細孔の直径よりも、より小さな直径の細孔を含む。さらに、この被膜細孔は、好ましくは、そのコアと比較して、その被膜が機能上は無孔であるようなサイズである。
例えば、本発明は以下の項目を提供する。
(項目1) 徐放性移植物としての使用に適した流動性組成物であって、該組成物は、以下:
a)水性媒体または体液中において少なくとも実質的に不溶性である、生分解性熱可塑性ポリエステル;
b)アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される生体適合性極性非プロトン溶媒であって、ここで、該生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である、生体適合性極性非プロトン溶媒;ならびに
c)酢酸ロイプロリド
を含む、組成物。
(項目2) 前記生分解性熱可塑性ポリエステルが、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、またはそれらの任意の組み合わせである、項目1に記載の組成物。
(項目3) 前記生分解性熱可塑性ポリエステルが、ポリラクチド、ポリグリコリド、それらのコポリマー、それらのターポリマー、またはそれらの組み合わせである、項目1に記載の組成物。
(項目4) 前記生分解性熱可塑性ポリエステルが、カルボキシ末端基を有する50/50ポリ(DL−ラクチド−コ−グリコリド)である、項目1に記載の組成物。
(項目5) 前記生分解性熱可塑性ポリエステルが、カルボキシ末端基を有さない75/25ポリ(DL−ラクチド−コ−グリコリド)である、項目1に記載の組成物。
(項目6) 前記生分解性熱可塑性ポリエステルが、前記組成物の約30重量%〜約40重量%、または約40重量%〜約50重量%存在する、項目1に記載の組成物。
(項目7) 前記生分解性熱可塑性ポリエステルが、平均分子量約23,000〜約45,000または約15,000〜約24,000を有する、項目1に記載の組成物。
(項目8) 前記生体適合性極性非プロトン溶媒が、N−メチル−2−ピロリドン、2−ピロリドン、N,N−ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカルボネート、カプロラクタム、トリアセチン、またはそれらの任意の組み合わせである、項目1に記載の組成物。
(項目9) 前記生体適合性極性非プロトン溶媒が、N−メチル−2−ピロリドンである、項目1に記載の組成物。
(項目10) 前記生体適合性極性非プロトン溶媒が、前記組成物の約60重量%〜約70重量%存在する、項目1に記載の組成物。
(項目11) 前記生体適合性極性非プロトン溶媒が、前記組成物の約50重量%〜約60重量%存在する、項目1に記載の組成物。
(項目12) 前記酢酸ロイプロリドが、前記組成物の約2重量%〜約4重量%存在する、項目1に記載の組成物。
(項目13) 前記酢酸ロイプロリドが、前記組成物の約4重量%〜約8重量%存在する、項目1に記載の組成物。
(項目14) 注射可能な皮下送達系として処方された、項目1に記載の組成物。
(項目15) 約0.2mL〜約0.4mLの容量を有する、項目14に記載の組成物。
(項目16) 約0.3mL〜約0.5mLの容量を有する、項目14に記載の組成物。
(項目17) 1ヶ月につき約1回の投与のために処方された、項目14に記載の組成物。
(項目18) 3ヶ月につき約1回の投与のために処方された、項目14に記載の組成物。
(項目19) 4ヶ月につき約1回の投与〜6ヶ月につき約1回の投与のために処方された、項目14に記載の組成物。
(項目20) 徐放性移植物としての使用のための流動性組成物を形成するための方法あって、任意の順序で、以下:
a)水性媒体または体液中において少なくとも実質的に不溶性である、生分解性熱可塑性ポリエステル;
b)アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される生体適合性極性非プロトン溶媒であって;ここで、該生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である、生体適合性極性非プロトン溶媒;ならびに
c)酢酸ロイプロリド
を混合する工程を包含し、ここで、該混合する工程は、徐放性移植物としての使用のための該流動性組成物を形成するために有効な、十分な時間行われる、方法。
(項目21) 前記生体適合性熱可塑性ポリエステルと前記生体適合性極性非プロトン溶媒が一緒に混合されて混合物が形成され、その後、該混合物が、前記酢酸ロイプロリドと混合されて前記流動性組成物が形成される、項目20に記載の方法。
(項目22)
(a)組成物を患者の身体内に注射すること;および
(b)生体適合性極性非プロトン性溶媒を分散させて、生分解性固体移植物を形成すること、
を含む工程により、該患者においてインサイチュで形成された生分解性移植物であって、ここで、該組成物は、有効量の生分解性熱可塑性ポリエステルと;アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される、有効量の生体適合性極性非プロトン溶媒と;有効量の酢酸ロイプロリドとを含み、ここで、該生分解性熱可塑性ポリエステルは水性媒体または体液中において少なくとも実質的に不溶性であり、該生体適合性極性非プロトン溶媒は水性媒体または体液中において混和性から分散性までの性質である、生分解性移植物。
(項目23) 前記患者がヒトである、項目22に記載の生分解性移植物。
(項目24) 前記固体移植物が、前記患者において生分解する場合に、該固体移植物が有効量のロイプロリドを放出する、項目22に記載の生分解性移植物。
(項目25) 前記生分解性固体移植物が、前記患者の身体内の組織に付着する、項目22に記載の生分解性移植物。
(項目26) 生きている患者において生分解性移植物をインサイチュで形成する方法であって、以下:
(a)患者の身体内に流動性組成物を注射する工程;および
(b)生体適合性極性非プロトン溶媒を分散させて、生分解性固体移植物を生成する工程、
を包含し、ここで該流動性組成物は、水性媒体または体液中において少なくとも実質的に不溶性である、有効量の生分解性熱可塑性ポリエステルと;アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される、有効量の生体適合性極性非プロトン溶媒と;有効量の酢酸ロイプロリドとを含み、ここで、該生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である、方法。
(項目27) 前記生分解性固体移植物が前記患者において生分解する場合に、拡散、崩壊、または、拡散と崩壊との組み合わせにより、該固体移植物が前記有効量の酢酸ロイプロリドを放出する、項目26に記載の方法。
(項目28) 患者の癌を処置する方法であって、そのような処置または予防を必要とする患者に、有効量の、項目1に記載の流動性組成物を投与する工程を包含する、方法。
(項目29) 前記癌が前立腺癌である、項目28に記載の方法。
(項目30) 前記患者がヒトである、項目28に記載の方法。
(項目31) 患者におけるLHRHレベルを減少させる方法であって、そのようなLHRHの減少を必要とする患者に、有効量の、項目1に記載の流動性組成物を投与する工程を包含する、方法。
(項目32) 前記LHRHレベルの減少が、子宮内膜症を処置するために有用である、項目31に記載の方法。
(項目33) キットであって、
(a)水性媒体または体液中において少なくとも実質的に不溶性である生分解性熱可塑性ポリエステルと、アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される生体適合性極性非プロトン溶媒とを含む組成物を含む、第1容器;ならびに
(b)酢酸ロイプロリドを含む、第2容器、
を含み、ここで、該生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である、キット。
(項目34) 前記第1容器がシリンジである、項目33に記載のキット。
(項目35) 前記第2容器がシリンジである、項目33に記載のキット。
(項目36) 前記酢酸ロイプロリドが凍結乾燥されている、項目33に記載のキット。
(項目37) 指示書をさらに含む、項目33に記載のキット。
(項目38) 前記第1容器が、前記第2容器に連結され得る、項目33に記載のキット。
(項目39) 前記第1容器および前記第2容器が、互いに直接連結されるようにそれぞれ構成されている、項目33に記載のキット。
(項目40) 固体移植物であって、
(a)水性媒体または体液中において少なくとも実質的に不溶性である、生体適合性熱可塑性ポリエステル;および
(b)酢酸ロイプロリド;
を含み、ここで、
該固体移植物は、固体またはゲル状の細孔性マトリックスを有し、該マトリックスは、被膜に囲まれたコアである、固体移植物。
(項目41) 項目40に記載の固体移植物であって、生体適合性有機溶媒をさらに含み、該生体適合性有機溶媒は、水性液または体液において混和性から分散性までの性質であり、そして前記熱可塑性ポリエステルを溶解する、固体移植物。
(項目42) 前記生体適合性有機溶媒の量が最小である、項目41に記載の固体移植物。
(項目43) 前記生体適合性有機溶媒の量が経時的に低下する、項目41に記載の固体移植物。
(項目44) 前記コアが、直径約1〜約1000ミクロンの細孔を含む、項目40に記載の固体移植物。
(項目45) 前記被膜が、前記コアの細孔の直径より小さな直径の細孔を含む、項目40に記載の固体移植物。
(項目46) 前記被膜細孔は、前記コアと比較して前記被膜が機能上は無孔であるようなサイズである、項目40に記載の固体移植物。
【図面の簡単な説明】
【0016】
【図1】図1は、イヌにおける、ATRIGEL(登録商標)−6%w/w薬物およびLupron(登録商標)処方物投与後の、血清ロイプロリドレベルを示す。
【図2】図2は、イヌにおける、ATRIGEL(登録商標)およびLupron(登録商標)90日処方物によるテストステロン抑制を示す。
【図3】図3は、イヌ(n=8)における、22.5mgLAで投与された、ATRIGEL(登録商標)およびLupron(登録商標)90日処方物投与後の、血清ロイプロリドレベルを示す。
【図4】図4は、イヌ(n=8)における、22.5mgLAで投与された、ATRIGEL(登録商標)およびLupron(登録商標)90日処方物投与後の、血清テストステロンレベルを示す。
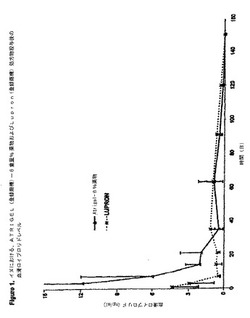
【図5】図5は、ラットにおける血清テストステロンレベル−4ヶ月処方物14,860ダルトン対26,234ダルトン、を示す。
【発明を実施するための形態】
【0017】
(発明の詳細な説明)
特定かつ好ましい、生分解性熱可塑性ポリエステルおよび極性非プロトン溶媒;熱可塑性ポリエステル、極性非プロトン溶媒、酢酸ロイプロリド、および流動性組成物の範囲;この熱可塑性ポリエステルの分子量;および、本明細書中で以下に述べられた固体移植物の範囲は、説明のためだけであり;それらは、他の、生分解性熱可塑性ポリエステルおよび極性非プロトン溶媒;熱可塑性ポリエステル、極性非プロトン溶媒、酢酸ロイプロリド、および流動性組成物の範囲;この熱可塑性ポリエステルの分子量;およびその固体移植物の範囲を除外しない。
【0018】
本発明は、徐放性移植物としての使用に関して適切な流動性組成物、この流動性組成物を形成するための方法、この流動性組成物を使用するための方法、この流動性組成物からインサイチュで形成された生分解性移植物、この生分解性移植物をインサイチュで形成する方法、インサイチュで形成されたこの生分解性移植物を使用する方法、この流動性組成物を含むキット、およびその固体移植物を提供する。この流動性組成物は、動物においてインサイチュで形成された、生分解性または生崩壊性(bioerodible)の微小孔性移植物を、提供し得る。この流動性組成物は、適切な極性非プロトン溶媒と組み合わされた、生分解性熱可塑性ポリマーまたは生分解性熱可塑性コポリマーから構成される。この生分解性熱可塑性ポリエステルまたは生分解性熱可塑性コポリマーは、動物の身体内で、水または体液中に実質的に不溶性であり、生体適合性であり、そして生分解性であり、そして/または生体侵食性である。この流動性組成物は、液体またはゲルとして組織に投与され、その組織において、その移植物がインサイチュで形成される。この組成物は、生体適合性であり、そして、そのポリマーマトリックスは、移植部位で実質的な組織過敏または組織壊死を引き起こさない。その移植物は、酢酸ロイプロリドを送達するために使用され得る。
【0019】
好ましくは、この流動性組成物は、患者(例えばヒト)での注射に適した、液体またはゲルであり得る。本明細書中で使用される場合、「流動性」とは、患者の身体内に媒介物(例えばシリンジ)を介して注射される組成物の能力を言う。例えば、この組成物は、シリンジの使用により、患者の皮下に注射され得る。患者に注射されるこの組成物の能力は、この組成物の粘性に主として依存する。従って、この組成物は、この組成物を媒介物(例えばシリンジ)を介して患者の身体内に無理やり押し込み得るような、適当な粘性を有する。本明細書中で使用される場合、「液体」とは、剪断応力のもとで継続的に変形する物質である。Concise Chemical and Technical Dictionary、第4増補版、Chemical Publishing Co.,Inc.,p.707,NY,NY(1986)。本明細書中で使用される場合、「ゲル」とは、ゼラチン状特性、ゼリー状特性、またはコロイド状特性を有する、物質である。Concise Chemical and Technical
Dictionary、第4増補版、Chemical Publishing Co.,Inc.,p.567,NY,NY(1986)。
【0020】
(生分解性熱可塑性ポリエステル)
流動性組成物を形成するように、固体の生分解性ポリエステルおよび酢酸ロイプロリドが生体適合性極性非プロトン溶媒に溶解されている、熱可塑性組成物が提供され、その後、この組成物は、シリンジと針とを介して投与され得る。任意の適切な生分解性熱可塑性ポリエステルが使用され得るが、ただし、この生分解性熱可塑性ポリエステルは、水性媒体または体液中において少なくとも実質的に不溶性である。適切な生分解性熱可塑性ポリエステルは、例えば、米国特許第5,324,519号;同第4,938,763号;同第5,702,716号;同第5,744,153号;および同第5,990,194号において開示され、ここで、適切な生分解性熱可塑性ポリエステルは、熱可塑性ポリマーとして開示されている。適切な生分解性熱可塑性ポリエステルの例としては、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、およびそれらの任意の組み合わせが挙げられる。好ましくは、適切な生分解性熱可塑性ポリエステルは、ポリラクチド、ポリグリコリド、それらのコポリマー、それらのターポリマー、またはそれらの組み合わせである。
【0021】
この組成物中に存在する生分解性熱可塑性ポリエステルの型、分子量、および量は、その徐放性移植物の望まれる特性に主として依存する。例えば、生分解性熱可塑性ポリエステルの型、分子量、および量は、その徐放性移植物から酢酸ロイプロリドが放出される時間の長さに影響し得る。特に、本発明の1つの実施形態において、この組成物は、酢酸ロイプロリドの1ヶ月送達系を処方するために使用され得る。そのような実施形態において、その生分解性熱可塑性ポリエステルは、好ましくは、カルボキシ末端基を有する50/50ポリ(DL−ラクチド−コ−グリコリド)であり得;その組成物の約30重量%〜約40重量%存在し得;そして、平均分子量約23,000〜約45,000を有し得る。あるいは、本発明の別の実施形態において、この組成物は、酢酸ロイプロリドの3ヶ月送達系を処方するために使用され得る。そのような実施形態において、その生分解性熱可塑性ポリエステルは、好ましくは、カルボキシ末端基を有さない75/25ポリ(DL−ラクチド−コ−グリコリド)であり得;その組成物の約40重量%から約50重量%存在し得;そして、平均分子量約15,000〜約24,000を有し得る。
【0022】
75/25ポリ(DL−ラクチド−コ−グリコリド)のカルボキシ末端基は、適切な任意の保護基により保護され得る。適切なカルボキシ保護基は、当業者に公知である(例えば、T.W.Greene,Protecting Groups In Organic Synthesis;Wiley:New York,1981、および、この中の参考文献を参照のこと)。適切な、例示カルボキシ保護基は、(C1−C12)アルキルおよび(C6−C10)アリール(C1−C12)アルキルを含み、ここで、任意のアルキルまたはアリールが、必要に応じて、1つ以上(例えば、1、2、または3個)のヒドロキシにより置換され得る。好ましい保護基としては、例えば、メチル、ドデシル、および1−ヘキサノールが挙げられる。
【0023】
(熱可塑性ポリエステルの分子量)
本発明において使用されるポリマーの分子量は、この流動性組成物が中間体として使用されている限り、酢酸ロイプロリド放出速度に影響し得る。これらの条件下で、このポリマーの分子量が増加するにつれて、その系からの酢酸ロイプロリド放出速度は減少する。この現象は、酢酸ロイプロリドの制御放出のための系の処方において、有利に使用され得る。酢酸ロイプロリドの比較的迅速な放出のために、低分子量ポリマーは、好ましい放出速度を生ずるように選択され得る。比較的長時間にわたる酢酸ロイプロリドの放出のために、より高いポリマー分子量が選択され得る。従って、ポリマー系は、選択された時間にわたる酢酸ロイプロリド放出のために、最適なポリマー分子量範囲で生成され得る。
【0024】
ポリマーの分子量は、任意の種々の方法により変化され得る。この方法の選択は、ポリマー組成物の型により主として決定される。例えば、加水分解により生分解可能性である熱可塑性ポリエステルが使用される場合、その分子量は、蒸気オートクレーブ内のような、制御された加水分解により変化され得る。代表的に、重合度は、例えば、反応基の数および型、ならびに反応時間を変えることにより制御され得る。
【0025】
(極性非プロトン溶媒)
任意の適切な極性非プロトン溶媒が使用され得るが、ただし、この適切な極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である。適切な極性非プロトン溶媒は、例えば、Aldrich Handbook of Fine Chemicals and Laboratory Equipment,Milwaukee,WI(2000);米国特許第5,324,519号;同第4,938,763号;同第5,702,716号;同第5,744,153号;および同第5,990,194号に開示されている。この適切な極性非プロトン溶媒は、この流動性組成物が、凝析または凝固するように、体液中に拡散し得るべきである。その生分解性ポリマーのためのこの極性非プロトン溶媒が、無毒性であるか、あるいは生体適合性であることもまた、好ましい。この極性非プロトン溶媒は、好ましくは、生体適合性である。適切な極性非プロトン溶媒の例としては、アミド基、エステル基、カルボネート基、ケトン基、エーテル、スルホニル基、またはそれらの組み合わせを有する、極性非プロトン溶媒が挙げられる。好ましくは、この極性非プロトン溶媒は、N−メチル−2−ピロリドン、2−ピロリドン、N,N−ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカルボネート、カプロラクタム、トリアセチン、またはそれらの任意の組み合わせであり得る。より好ましくは、この極性非プロトン溶媒は、N−メチル−2−ピロリドンであり得る。
【0026】
この極性非プロトン溶媒は、任意の適切な量で存在し得るが、ただし、この極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である。この組成物中に存在する生体適合性極性非プロトン溶媒の型および量は、その徐放性移植物の望まれる特性に主として依存する。例えば、生体適合性極性非プロトン溶媒の型および量は、その酢酸ロイプロリドがその徐放性移植物から放出される、時間に影響し得る。特に、本発明の1つの実施形態において、この組成物は、酢酸ロイプロリドの1ヶ月送達系を処方するために使用され得る。そのような実施形態において、その生体適合性極性非プロトン溶媒は、好ましくはN−メチル−2−ピロリドンであり得、そして、好ましくは、この組成物の約60重量%〜約70重量%存在し得る。あるいは、本発明の別の実施形態において、この組成物は、酢酸ロイプロリドの3ヶ月送達系を処方するために使用され得る。そのような実施形態において、この生体適合性極性非プロトン溶媒は、好ましくは、N−メチル−2−ピロリドンであり得、そして、好ましくは、この組成物の約50重量%〜約60重量%存在し得る。
【0027】
様々な極性非プロトン溶媒における生分解性熱可塑性ポリエステルの溶解度は、それらの結晶性、それらの親水性、水素結合、および分子量に依存して異なる。従って、この生分解性の熱可塑性ポリエステル全てが同じ極性非プロトン溶媒に溶解するとは限らない。しかし、それぞれの生分解性熱可塑性ポリマーまたは生分解性熱可塑性コポリマーは、それぞれの適した極性非プロトン溶媒を有する。より低分子量のポリマーは、通常は、この溶媒中で、高分子量ポリマーよりも容易に溶解する。結果として、種々の溶媒に溶解したポリマーの濃度は、ポリマーの型およびその分子量に依存して異なる。逆に、より高分子量のポリマーは、通常は、極めて低分子量のポリマーよりも速く凝析または凝固する傾向がある。さらに、より高分子量のポリマーは、低分子量物質よりも高い溶液粘性を示す傾向がある。
【0028】
例えば、乳酸の縮合により形成される低分子量のポリ乳酸は、なおも23ゲージのシリンジ針を容易に貫流する73重量%溶液を生ずるように、N−メチル−2−ピロリドン(NMP)に溶解する。一方、DL−ラクチドの付加重合により形成されるより高分子量のポリ(DL−ラクチド)(DL−PLA)は、たったの50重量%でNMPに溶解された場合に、同じ溶液粘性を示す。高分子量である方のポリマー溶液は、水中に配置された場合、即時に凝析する。この低分子量ポリマー溶液は、より濃縮されるが、水中に配置された場合とてもゆっくりと凝析する傾向がある。
【0029】
また、非常に高濃度の高分子量ポリマーを含む溶液は、時々、より薄い溶液よりもゆっくりと凝析または凝固する。この高濃度のポリマーは、ポリマーマトリックス内からの溶媒の拡散を妨げ、そしてその結果、ポリマー鎖を沈殿し得るマトリックス内への、水の浸透を抑えると考えられる。従って、溶媒がポリマー溶液から外に拡散し得、そして、ポリマーを凝析させるように水が内部に浸透する至適濃度が存在する。
【0030】
この酢酸ロイプロリドは、好ましくは、使用前に凍結乾燥される。代表的に、この酢酸ロイプロリドは、水性溶液に溶解され得、濾過滅菌され得、そしてシリンジ内で凍結乾燥され得る。このポリマー/溶媒溶液は、別のシリンジに充填され得る。その後、この2つのシリンジは共に連結され得、その内容物は、このポリマー/溶媒溶液およびこの酢酸ロイプロリドが効果的に一緒に混合されて流動性組成物を形成するまで、この2つのシリンジの間を前後に引かれ得る。この流動性組成物は、1つのシリンジに引き込まれ得る。その後、この2つのシリンジは外され得る。この流動性組成物を含んでいるシリンジ上に、針が差し込まれ得る。その後、この流動性組成物は、この針を介して身体内に注射され得る。この流動性組成物は、例えば米国特許第5,324,519号;同4,938,763号;同5,702,716号;同5,744,153号;および同5,990,194号;に記載されているように、または本明細書中で記載されているように、処方され得、そして患者に投与され得る。一旦適所に配置されると、この溶媒は分散し、残存するポリマーが凝析し、そして、固体構造が形成される。この溶媒は分散し、そして、そのポリマーは、凝析し、そして酢酸ロイプロリドを固体マトリックス内に捕捉または収容する。
【0031】
これらの固体移植物からの酢酸ロイプロリドの放出は、巨大なポリマーデバイスからの薬剤放出に関する、同じ一般規則に従う。酢酸ロイプロリドの放出は、この移植物のサイズおよび形、移植物内への酢酸ロイプロリドの充填、この酢酸ロイプロリドおよびその特定のポリマーに関する透過性係数、およびそのポリマーの分解、により影響され得る。送達のために選択される酢酸ロイプロリドの量に依存して、上記パラメーターは、好ましい放出の速度および放出持続時間を生じるように、薬剤送達の当業者により調整され得る。
【0032】
インサイチュでの流動性の固体形成移植物に組み込まれる酢酸ロイプロリドの量は、望ましい放出プロフィール、生物学的効果のために必要とされる酢酸ロイプロリドの濃度、および、処置のためにこの酢酸ロイプロリドが放出されるべき時間に、依存する。シリンジの針を介する注射のために受容可能な溶液または分散粘性の量を除いて、このポリマー溶液中に取り込まれる酢酸ロイプロリドの量に臨界的上限はない。この送達系に取り込まれる酢酸ロイプロリドの下限値は、単に、この酢酸ロイプロリドの活性および処置に必要とされる時間に依存する。具体的には、本発明の1つの実施形態において、この組成物は、酢酸ロイプロリドの1ヶ月送達系を処方するために使用され得る。そのような実施形態において、この酢酸ロイプロリドは、好ましくは、その組成物の約2重量%〜約4重量%存在し得る。あるいは、本発明の別の実施形態において、この組成物は、酢酸ロイプロリドの3ヶ月送達系を処方するために使用され得る。そのような実施形態において、その酢酸ロイプロリドは、好ましくはその組成物の約4重量%〜約8重量%存在し得る。この流動性システムから形成される固体移植物は、その酢酸ロイプロリドが事実上枯渇するまで、制御された速度でそのマトリックス内に含まれるその酢酸ロイプロリドを放出する。
【0033】
(投与量)
流動性組成物の投与量は、代表的には、その徐放性移植物の望ましい性質に依存する。例えば、流動性組成物の量は、その酢酸ロイプロリドがその徐放性移植物から放出される時間に影響し得る。具体的には、本発明の1つの実施形態において、この組成物は、酢酸ロイプロリドの1ヶ月送達系を処方するために使用され得る。そのような実施形態において、約0.2mL〜約0.4mLのこの流動性組成物が投与され得る。あるいは、本発明の別の実施形態において、この組成物は、酢酸ロイプロリドの3ヶ月送達系を処方するために使用され得る。そのような実施形態において、約0.3mL〜約0.5mLのこの流動性組成物が投与され得る。
【0034】
驚いたことに、本発明によるこの液状ポリマー組成物は、酢酸ロイプロリドを送達する際にLupron(登録商標)Depotよりも効果的であることが、発見された。具体的には、下記の実施例において示すように、この酢酸ロリプロリドを含む本発明の液状ポリマー組成物を用いて得られたテストステロンレベルの方が、Lupron(登録商標)Depotと比較してイヌで長時間で低く、そしてまたLupron(登録商標)Depotに関する文献(Sharifi,R.,J.Urology,Vol.143、Jan.,68(1990))にて報告された値と比較してヒトで6ヶ月時点で低い。
【0035】
全ての刊行物、特許、ならびに特許出願が、あたかも参考として個々に援用される様に、本明細書中で参考として援用されている。 本発明は今、次の、限定されない実施例により示される。
【0036】
(実施例)
(実施例1)
ラクチド対グリコリド比50/50、および末端カルボキシル基を有するポリ(DL−ラクチド−コ−グリコリド)(Boehringer Ingelheimから入手可能であるRG 504H)を、34重量%のポリマー溶液を生じるように、N−メチル−2−ピロリドン(NMP)に溶解した。このATRIGEL(登録商標)ポリマー溶液を、容量330mLで雌ルアーロック取付具を備える1.25ccのポリプロピレンシリンジに充填し、20キログレイのγ線照射に曝すことにより最後に滅菌した。γ線照射後のこのポリマーの分子量は、32,000ダルトンであった。酢酸ロイプロリドを水に溶解し、0.2mmフィルターに通して濾過滅菌し、そして、雄ルアーロック取付具を備える1.00ccのポリプロピレンシリンジに充填した。この水性溶液を凍結し、そして、その水を真空下で除去して、このペプチドの凍結乾燥ケーキ10.2mgを生じた。この2つのシリンジを使用直前に連結し、その内容物を、この2つのシリンジの間を前後に30サイクル行ったり来たりさせて混合した。雌継手を備えるシリンジにこの処方物を引き戻し、この2つのシリンジを分離し、そして1/2インチの長さの20ゲージの針を取り付けた。その後、7.5mgの酢酸ロイプロリドを含む合計250mgのポリマー処方物を投与するために、このシリンジの内容物を7匹の雄性ビーグル犬に皮下注射した。7.5mgの酢酸ロイプロリドを含むLupron(登録商標)Depotミクロスフェアを、第2セットの7匹のビーグル犬に筋肉内注射した。血清サンプルを、これらの犬全てから、ベースライン時ならびに1日目、3日目、7日目、14日目、21日目、28日目、35日目、42日目、49日目、55日目、63日目、77日目、および91日目に収集した。
【0037】
この血清サンプルを、テストステロンについてRIA法を用いて分析した。表1に示す結果は、両製品が、そのテストステロン濃度を約14日後にはヒトの去勢レベル0.5ng/mL未満に減少させること、そして42日目まで完全にこの効果を持続することにおいて、効果的であることを示した。概して、このLupron(登録商標)Depotを用いて得られたこのテストステロンレベルは、ATRIGEL(登録商標)ポリマー系を用いて観察されたテストステロンレベルよりも僅かに低いようであった。
【0038】
【表1】

(実施例2)
分子量48,000ダルトンを有するポリマー処方物を得るため、実施例1に記載されているのと同じポリマー溶液を0.2mmフィルターに通して濾過滅菌した。その後、この滅菌したポリマー溶液を、その雌型ポリプロピレンシリンジに無菌的に充填した。また、濾過滅菌前の同じバルクポリマー溶液を4つの異なるサンプルに分割し、ポリプロピレンシリンジに充填し、このポリマーを異なる分子量に分解するため、4つの照射レベルでγ線照射に曝した。この異なる線量レベルでの照射後のポリマーは、33,500ダルトン、26,500ダルトン、23,000ダルトン、および20,000ダルトンの分子量を有した。5つの処方物全てを、上記に記載されているように酢酸ロイプロリドと混合し、雄性ビーグル犬に皮下注射した。45日間にわたる血清テストステロンの測定は、最も低い分子量20,000ダルトンを有する処方物を除くこれらの処方物全てが、テストステロン濃度を去勢レベル未満に減少させることにおいて効果的であったことを示した。従って、酢酸ロイプロリドを含むこのATRIGEL(登録商標)ポリマー処方物は、23,000〜45,000ダルトンに及ぶ広範囲のポリマー分子量にわたり、1ヶ月間テストステロンを減少させることにおいて効果的である。
【0039】
(実施例3)
20キログレイでのγ線照射後の、実施例1に記載されているポリマー処方物を酢酸ロイプロリドと混合し、そして8匹の雄性ビーグル犬に皮下注射した。7.5mgの酢酸ロイプロリドを含むLupron(登録商標)Depotを、8匹の雄性ビーグル犬に筋肉注射した。血清サンプルを、ベースライン時および1日目、2日目、3日目、7日目、14日目、22日目、28日目、30日目、32日目、34日目、および36日目に収集した。この血清サンプルを、血清テストステロンおよび血清ロイプロリドについて、RIAにより分析した。表2に示されるこの血清テストステロン濃度の値は、両製品が、イヌにおいて、そのテストステロンをヒト去勢レベル未満に減少させることにおいて効果的であったこと示し、このLupron(登録商標)Depot製品が、より遅い時点で、わずかに、より効果的であるようである。この差異に関する原因は、表3に示すように、中間時点で、このLupron(登録商標)Depot製品についての、より高い血清ロイプロリドレベルであると考えられた。このデータに基づいて、ロイプロリドを含むこのATRIGEL(登録商標)製品が効果的であるが、おそらくこのLupron(登録商標)Depot製品ほど効果的ではないと予期された。
【0040】
【表2】

【0041】
【表3】

(実施例4)
実施例1に記載されているポリマー処方物を、GMP条件下で調製し、シリンジに充填し、そして20キログレイで照射した。その後、この滅菌ポリマー溶液を、別のシリンジ中で濾過滅菌した酢酸ロイプロリドと混合した。この2つのシリンジを連結し、その内容物を一緒に30サイクルの間混合した。そして、この内容物を、精巣摘出された前立腺癌の患者に皮下注射した。28日間にわたり血清サンプルを収集し、有効なRIA法を用いてロイプロリド濃度を分析した。表4に示すデータは、薬物の初期バーストの後に、28日間にわたりかなり一定のレベルが続くことを示す。これらのデータを、文献に公表されているLupron(登録商標)Depotに関するデータと比較した場合、それらの値は非常に類似し、両製品とも前立腺癌において同じ効力を生ずると考えられる。
【0042】
【表4】

(実施例5)
極めて重要な臨床試験において、実施例4に記載されているATRIGEL(登録商標)ロイプロリド製品を、前立腺癌患者に皮下(s.c.)注射した。6回の注射を受けるまで、28日毎に、この患者にこの製品をもう一回注射した。血清サンプルを種々の時間に収集し、有効なRIA法によりテストステロン濃度を分析した。表5に示された値は、血清テストステロン濃度が21日目に去勢値50ng/dL(0.5ng/mL)に至ったことを示す。その後、このテストステロン濃度は56日目に7.77ng/dLに低下し、この研究の残り全体にわたりこのレベルのままであった。表5に示されるように、このテストステロン濃度を、Lupron(登録商標)Depotを用いて得られた公表されている値と比較すると、ATRIGEL(登録商標)ロイプロリド製品の方が、ヒトにおいて、低いテストステロンレベルを示すので、効果的であることを示す。
【0043】
【表5】

(実施例6)
45重量%のポリマーを含む溶液を生じるように、ラクチド:グリコリドのモル濃度比75/25を有するポリ(DL−ラクチド−コ−グリコリド)(Birmingham Polymer,Inc)をNMPに溶解した。この溶液を、雄ルアーロック取付具を備える3.0ccのポリプロピレンシリンジ中に充填し、そして、23.2〜24.6キログレイのγ線照射にさらすことにより最後に滅菌した。照射後のこのポリマーの分子量は、15,094ダルトンであった。酢酸ロイプロリドを水に溶解し、0.2mmのフィルターに通して濾過滅菌し、そして、雄ルアーロック取付具を備えるポリプロピレンシリンジに充填した。水性溶液を凍結し、そして、その水を真空により除去して、ロイプロリドの凍結乾燥ケーキを生じた。その2つのシリンジを使用直前に連結器により一緒に連結し、そして、2つのシリンジの内容物を2つのシリンジの間で前後に40サイクル動かすことにより、それらの物質を混合して、6重量%のロイプロリド酢酸を含む処方物を提供した。その後、この生成物を、雄ルアーロック取付具を備えるシリンジに引き込み、そして1/2インチの長さの20ゲージの針を取り付けた。
【0044】
その後、この酢酸ロイプロリドを含む処方物を、標的用量25.6mg/kg/日で5匹の雄性ビーグル犬に皮下注射した。市販の3ヶ月Lupron(登録商標)Depotミクロスフェアを、同じ標的用量で、5匹の雄性ビーグル犬に筋肉内注射した。実際の投与量は、ロイプロリドを含むATRIGEL(登録商標)については31.4mg/kg/日であり、Lupron(登録商標)Depotについては25.3mg/kg/日であった。ベースライン時ならびに1日目、2日目、3日目、4日目、7日目、14日目、21日目、28日目、35日目、49日目、63日目、71日目、81日目、91日目、105日目、120日目、134日目、および150日目に、それぞれのイヌから血清を収集し、そして、RIAによりテストステロンについて、およびLC/MS/MSによりロイプロリド濃度について分析した。
【0045】
そのデータは、この血清ロイプロリドレベルが、最初の30日間にわたり、Lupron(登録商標)Depot製品と比較して、ATRIGEL(登録商標)処方に関しての方が実際に高かったが、その後、次の120日にわたり、Lupron(登録商標)Depot製品と同じレベルまで減少した(図1)ことを示した。しかし、この2つの製品に関して、70日間の間、それらのテストステロンレベルは同等であったが、その後、Lupron(登録商標)Depot製品は、ヒト去勢テストステロンレベルを維持しなかった。この結果は、後者の時点にわたるこの2つの製品の同等のロイプロリドレベルに基づいて、驚くべきことであった。
【0046】
(実施例7)
実施例6に記載されているのと同じポリマー処方物を調製し、そして、容量440mLの雌ルアーロック取付具を備える1.25ccのポリプロピレンシリンジに充填した。この生成物を、23〜25キログレイのγ線照射に曝すことにより最後に滅菌した。照射後のこのポリマーの分子量は14,800ダルトンであった。酢酸ロイプロリドを水に溶解し、0.2mmのフィルターを用いて濾過滅菌し、そして雄ルアーロック取付具を備える1.00ccのポリプロピレンシリンジに充填した。この水性溶液を凍結し、そしてその水を真空により除去して、酢酸ロイプロリドの凍結乾燥ケーキ28.2mgを生じた。使用直前に、この2つのシリンジを一緒に連結し、その内容物をその2つのシリンジの間で前後に40サイクル動かすことにより、その材料を混合し、6重量%の酢酸ロイプロリドを含む均質な混合物を提供した。その後、雄ルアーロック取付具を備えるシリンジに処方物を引き込み、それらのシリンジを分離し、そして1/2インチの長さの20ゲージの針を取り付けた。
【0047】
全送達用量22.5mgの酢酸ロイプロリドを投与するために、この処方物を8匹の雄性ビーグル犬に皮下注射した。市販の3ヶ月Lupron(登録商標)Depotミクロスフェアを、8匹の雄性ビーグル犬に筋肉内注射した。6時間目および12時間目、ならびに1日目、2日目、3日目、7日目、14日目、21日目、28日目、35日目、49日目、64日目、77日目、および91日目に、テストステロン濃度およびロイプロリド濃度の分析のために、血清サンプルを収集した。91日目に、再度これらの動物に上記処方物を注射し、91日目の6時間目および12時間目、ならびに、再び92日目、93日目、94日目、99日目、および105日目にもまた、血清を収集した。表6および図3に示すように、長時間の時点で、このATRIGEL(登録商標)処方物よりもこのLupron(登録商標)Depot製品に関してのほうが、その平均血清ロイプロリド濃度は非常に高かった。しかし、表7および図4に示すように、そのテストステロン濃度は、このATRIGEL(登録商標)処方物に関しての方が実際に低かった。
【0048】
【表6】

【0049】
【表7】

(実施例8)
異なる分子量を有する45重量%の75/25ポリ(DL−ラクチド−コ−グリコリド)を含む3つのポリマー処方物を調製し、そして440mLの容量の雌ルアーロック取付具を備える1.25ccのポリプロピレンシリンジに充填した。これらのシリンジを23〜25キログレイのγ線照射に曝すことにより、最後に滅菌した。照射後のこれら3つのポリマーの分子量は、11,901ダルトン、13,308ダルトン、および21,268ダルトンであった。これらのポリマー溶液を、別のシリンジ内の凍結乾燥した酢酸ロイプロリドと混合し、そして、実施例7に記載されているように、投与量22.5mgでイヌに皮下注射した。血清サンプルを、ベースライン時ならびに1日目、7日目、14日目、21日目、28日目、35日目、42日目、56日目、70日目、84日目、98日目、112日目、および126日目に収集した。この血清を、RIAによりテストステロン濃度について分析した。2つの低分子量ポリマー処方物は、全90日間の間、そのテストステロン濃度を去勢未満に抑制しなかったが、分子量21,268ダルトンを有するポリマーが、評価された3ヶ月にわたり効果的であったことを、このデータは示した。
【0050】
(実施例9)
異なる分子量を有する45重量%の75/25ポリ(DL−ラクチド−コ−グリコリド)を含む2つのポリマー処方物を調製し、1.25ccのポリプロピレンシリンジに充填した。これらのシリンジを24〜27キログレイのγ線照射に曝すことにより、最後に滅菌した。照射後のこの2つのポリマーの分子量は、14,864ダルトンおよび26,234ダルトンであった。これらのポリマー溶液を、別の1.25ccのポリプロピレンシリンジ内の凍結乾燥された酢酸ロイプロリドと混合し、そして、前後に40サイクル動かすことにより混合し、6重量%の酢酸ロイプロリドを含む均質な混合物を生成した。その後、この内容物を一方のシリンジに引き込み、それらのシリンジを分離し、そして1/2インチの長さの20ゲージの針を取り付けた。その後、酢酸ロイプロリドを含むこの処方物を、投与量100mg/kg/日(12mg/kg)で、1グループにつき5匹のラットに皮下注射した。ベースライン時ならびに3日目、7日目、14日目、21日目、35日目、49日目、63日目、70日目、80日目、91日目、105日目、120日目、および132日目に、これらの動物全てから血清サンプルを収集し、そして、RIA法を用いてテストステロン濃度について分析した。図5に示すデータは、両方のポリマー分子量処方物が、132日間の間、テストステロンをヒトの去勢レベル未満に抑制することに効果的であったことを示す。
【背景技術】
【0001】
(発明の背景)
酢酸ロイプロリドは、LHRHアゴニストのアナログであり、ホルモンが関連した前立腺癌、乳癌、子宮内膜症、および早発思春期の待期療法に有用である。継続使用により、酢酸ロイプロリドは、下垂体の脱感作(desnsitizing)と下方制御を引き起こして下垂体−性腺系(pituitary−gonodal axis)に作用し、黄体形成ホルモンおよび性ホルモンの循環レベルの抑制を導く。進行型前立腺癌を有する患者において、0.5ng/ml(化学的去勢レベル)以下の循環テストステロンレベルを得ることが、治療行為の好ましい薬理学的指標である。
【0002】
最初に、酢酸ロイプロリドが、アナログ溶液の毎日の皮下(s.c.)注射として、アメリカ合衆国で始められた。慢性的な反復性注射の不便さは、ポリ(DL−ラクチド−コ−グリコリド)ミクロスフェア(Lupron(登録商標)Depot)に基づく、1ヶ月の持続放出性貯蔵生成物の開発により、後に排除された。現在、1ヶ月処方物、3ヶ月処方物、および4ヶ月処方物が、ミクロスフェアの筋肉内(i.m.)注射として広く利用可能である。
【0003】
現在のLupron(登録商標)Depotミクロスフェアは効果的であるように見えるが、このミクロスフェア生成物を製造するのは困難であり、そして、このミクロスフェア全てが患者に適切に投与されることを確実にするために、そのミクロスフェア生成物全てが、大量の液剤を用いた深部筋肉内(i.m.)注射を必要とする。これらの注射は、しばしば有痛性で、組織損傷を導く。
【0004】
Lupron(登録商標)Depot以外の生分解性ポリマーは、薬剤送達デバイスを含む、多数の医学適用において使用されている。概して、薬剤は、ポリマー組成物中に組み入れられ、その物体の外観を好ましい形状に形成される。その後、この固体移植物は、代表的には、ヒト、動物、鳥などの体内に、切開を介して挿入される。あるいは、これらのポリマーから構成される小さな個々の粒子が、シリンジにより体内に注射され得る。しかし、好ましくは、これらのポリマーのいくつかが、液状ポリマー組成物としてシリンジを介して注射され得る。
【0005】
生分解性徐放性薬剤送達系に有用な液状ポリマー組成物は、例えば、米国特許第4,938,763号;同第5,702,716号;同第5,744,153号;同第5,990,194号;および同第5,324,519号に記載されている。これらの組成物は、液体状態でか、あるいは溶液として、代表的にはシリンジを介して身体に投与される。一旦身体内に入ると、この組成物は凝析して固体になる。ポリマー組成物の1つの型は、体液分散性溶媒中に溶解した、非反応性熱可塑性ポリマーまたは非反応性熱可塑性コポリマーを含む。このポリマー溶液は身体内に配置され、そこでこのポリマーは、周囲の身体組織中へと溶媒が放散または拡散する際に、凝結するかまたは促進的に凝固する。これらの組成物のロイプロリドが、Lupron(登録商標)Depot中にあるものと同じであり、かつポリマーが類似しているので、これらの組成物は、Lupron(登録商標)Depotと同程度に効果的であると予期される。
【0006】
しかし驚いたことに、本発明による液状ポリマー組成物は、酢酸ロイプロリドを送達する際にLupron(登録商標)Depotよりも効果的であることが、発見された。具体的には、この酢酸ロリプロリドを含む本発明の液状ポリマー組成物を用いて得られたテストステロンレベルの方が、Lupron(登録商標)Depotと比較してイヌで長時間で低く、そしてまたLupron(登録商標)Depotに関する文献(Sharifi,R.,J.Urology,Vol.143、Jan.,68(1990))にて報告された値と比較してヒトで6ヶ月時点で低い。
【発明の概要】
【課題を解決するための手段】
【0007】
(発明の要旨)
本発明は、酢酸ロイプロリドの徐放性移植物としての使用に適した、流動性組成物を提供する。この流動性組成物は、水性媒体または体液中において少なくとも実質的に不溶性である、生分解性熱可塑性ポリエステルを含む。この流動性組成物はまた、生体適合性極性非プロトン溶媒を含む。この生体適合性極性非プロトン溶媒は、アミド、エステル、カルボネート、ケトン、エーテル、またはスルホニルであり得る。この生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である。この流動性組成物はまた、酢酸ロイプロリドを含む。この酢酸ロイプロリドは、好ましくは、この組成物の約2重量%〜約4重量%、または、この組成物の約4重量%〜約8重量%存在する。好ましくは、この流動性組成物は、注射可能な皮下送達系として処方される。この注射可能な組成物は、好ましくは、約0.20mL〜約0.40mLまたは約0.30mL〜約0.50mLの容量を有する。この注射可能な組成物は、好ましくは、1ヶ月につき約1回の投与、3ヶ月につき約1回の投与、または4ヶ月につき約1回の投与〜6ヶ月につき約1回の投与のために、処方される。好ましくは、この流動性組成物は、患者への注射に適した、液状組成物またはゲル組成物である。
【0008】
好ましくは、この生分解性熱可塑性ポリエステルは、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、またはそれらの任意の組み合わせである。より好ましくは、この生分解性熱可塑性ポリエステルは、ポリラクチド、ポリグリコリド、それらのコポリマー、それらのターポリマー、またはそれらの組み合わせである。より好ましくは、適切な生分解性熱可塑性ポリエステルは、カルボキシ末端基を有する50/50ポリ(DL−ラクチド−コ−グリコリド)であるか、または、保護されたカルボキシ末端基を有する75/25ポリ(DL−ラクチド−コ−グリコリド)である。適切な生分解性熱可塑性ポリエステルは、任意の適切な量で存在し得るが、ただし、生分解性熱可塑性ポリエステルは、水性媒体または体液中において少なくとも実質的に不溶性である。適切な生分解性熱可塑性ポリエステルは、好ましくは、この流動性組成物の約30重量%〜約40重量%存在するか、または、この流動性組成物の約40重量%〜約50重量%存在する。好ましくは、この生分解性熱可塑性ポリエステルは、平均分子量約23,000〜約45,000または約15,000〜約24,000を有する。
【0009】
好ましくは、この生体適合性極性非プロトン溶媒は、N−メチル−2−ピロリドン、2−ピロリドン、N,N−ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカルボネート、カプロラクタム、トリアセチン、またはそれらの任意の組み合わせである。より好ましくは、この生体適合性極性非プロトン溶媒は、N−メチル−2−ピロリドンである。好ましくは、この極性非プロトン溶媒は、その組成物の約60重量%〜約70重量%存在するか、または、その組成物の約45重量%〜約55重量%存在する。
【0010】
本発明はまた、流動性組成物を形成するための方法を提供する。この流動性組成物は、徐放性移植物として有用である。この方法は、任意の順序で、生分解性熱可塑性ポリエステル、生体適合性極性非プロトン溶媒、および酢酸ロイプロリドを混合する工程を包含する。これらの成分、それらの性質、および好ましい量は、上記に開示されるとおりである。この混合は、徐放性移植物としての使用のための流動性組成物を形成するために有効な、十分な時間、実施される。好ましくは、この生体適合性熱可塑性ポリエステルおよびこの生体適合性極性非プロトン溶媒は、混合物を形成するために一緒に混合され、その後、この混合物は、この流動性組成物を形成するため、酢酸ロイプロリドと混合される。
【0011】
本発明はまた、患者においてインサイチュで形成された生分解性移植物を提供する。この生分解性移植物生成物は、患者の身体内で流動性組成物を注射するプロセスにより調製され、生分解性固体移植物を生成するように、この生体適合性極性非プロトン溶媒が分散することを可能にする。これらの成分、それらの性質、および好ましい量は上記に開示された通りである。好ましくは、この患者はヒトである。この固体移植物は、好ましくは、この固体移植物が患者において生分解する場合に、有効量のロイプロリドを放出する。
【0012】
本発明はまた、生きている患者において、生分解性移植物をインサイチュで形成する方法を提供する。この方法は、患者の身体内に本発明の流動性組成物を注射する工程、および、生分解性固体移植物を生成するように、その生体適合性極性非プロトン溶媒が分散することを可能にする工程を包含する。この流動性組成物は、有効量の生分解性熱可塑性ポリエステル、有効量の生体適合性極性非プロトン溶媒、および有効量の酢酸ロイプロリドを含む。これらの成分、それらの性質、および好ましい量は上記に開示された通りである。好ましくは、その生分解性固体移植物は、拡散、崩壊(erosion)、または、拡散と崩壊(erosion)との組み合わせにより、患者においてその固体移植物が生分解する場合に、有効量の酢酸ロイプロリドを放出する。
【0013】
本発明はまた、患者において、癌を処置するか、または予防する方法を提供する。この方法は、そのような処置または予防を必要とする患者に、有効量の本発明の流動性組成物を投与する工程を包含する。具体的には、この癌は、前立腺癌であり得る。さらに、この患者は、ヒトであり得る。
【0014】
本発明はまた、患者において、LHRHレベルを減少させる方法を提供する。この方法は、そのようなLHRH減少を必要とする患者に、有効量の本発明の流動性組成物を投与する工程を包含する。具体的には、LHRHレベルの減少は、子宮内膜症を処置するために有用であり得る。さらに、この患者は、ヒトであり得る。
【0015】
本発明はまた、キットも提供する。このキットは、第1容器および第2容器を含む。この第1容器は、生分解性熱可塑性ポリエステルおよび生体適合性極性非プロトン溶媒を含む、組成物を含む。この第2容器は、酢酸ロイプロリドを含む。これらの成分、それらの性質、および好ましい量は上記に開示された通りである。好ましくは、この第1容器はシリンジであり、そしてこの第2容器はシリンジである。さらに、その酢酸ロイプロリドは、好ましくは凍結乾燥されている。このキットは、好ましくは、指示書を含み得る。好ましくは、この第1容器はこの第2容器に連結され得る。より好ましくは、この第1容器およびこの第2容器は、互いに直接連結されるように、それぞれ構成されている。
本発明はまた、固体移植物を提供する。この固体移植物は、生体適合性熱可塑性ポリエステルおよび酢酸ロイプロリドを含む。この生体適合性熱可塑性ポリエステルは、水性媒体または体液中において少なくとも実質的に不溶性である。この固体移植物は、固形またはゲル状の細孔性マトリックス(microporous matrix)を有し、ここで、そのマトリックスは被膜(skin)に囲まれたコア(core)である。この固体移植物はさらに、生体適合性の有機溶媒を含み得る。この生体適合性有機溶媒は、好ましくは、水性液または体液中において混和性から分散性までの性質である。さらに、この生体適合性有機溶媒は、好ましくは、その熱可塑性ポリエステルを溶解する。この生体適合性有機溶媒の量は、存在する場合は、好ましくは、その組成物の0重量%〜約20重量%のように少量である。さらに、この生体適合性有機溶媒の量は、好ましくは、経時的に低下する。そのコアは、好ましくは、直径約1〜約1000ミクロンの細孔を含む。その被膜は、好ましくは、このコアの細孔の直径よりも、より小さな直径の細孔を含む。さらに、この被膜細孔は、好ましくは、そのコアと比較して、その被膜が機能上は無孔であるようなサイズである。
例えば、本発明は以下の項目を提供する。
(項目1) 徐放性移植物としての使用に適した流動性組成物であって、該組成物は、以下:
a)水性媒体または体液中において少なくとも実質的に不溶性である、生分解性熱可塑性ポリエステル;
b)アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される生体適合性極性非プロトン溶媒であって、ここで、該生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である、生体適合性極性非プロトン溶媒;ならびに
c)酢酸ロイプロリド
を含む、組成物。
(項目2) 前記生分解性熱可塑性ポリエステルが、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、またはそれらの任意の組み合わせである、項目1に記載の組成物。
(項目3) 前記生分解性熱可塑性ポリエステルが、ポリラクチド、ポリグリコリド、それらのコポリマー、それらのターポリマー、またはそれらの組み合わせである、項目1に記載の組成物。
(項目4) 前記生分解性熱可塑性ポリエステルが、カルボキシ末端基を有する50/50ポリ(DL−ラクチド−コ−グリコリド)である、項目1に記載の組成物。
(項目5) 前記生分解性熱可塑性ポリエステルが、カルボキシ末端基を有さない75/25ポリ(DL−ラクチド−コ−グリコリド)である、項目1に記載の組成物。
(項目6) 前記生分解性熱可塑性ポリエステルが、前記組成物の約30重量%〜約40重量%、または約40重量%〜約50重量%存在する、項目1に記載の組成物。
(項目7) 前記生分解性熱可塑性ポリエステルが、平均分子量約23,000〜約45,000または約15,000〜約24,000を有する、項目1に記載の組成物。
(項目8) 前記生体適合性極性非プロトン溶媒が、N−メチル−2−ピロリドン、2−ピロリドン、N,N−ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカルボネート、カプロラクタム、トリアセチン、またはそれらの任意の組み合わせである、項目1に記載の組成物。
(項目9) 前記生体適合性極性非プロトン溶媒が、N−メチル−2−ピロリドンである、項目1に記載の組成物。
(項目10) 前記生体適合性極性非プロトン溶媒が、前記組成物の約60重量%〜約70重量%存在する、項目1に記載の組成物。
(項目11) 前記生体適合性極性非プロトン溶媒が、前記組成物の約50重量%〜約60重量%存在する、項目1に記載の組成物。
(項目12) 前記酢酸ロイプロリドが、前記組成物の約2重量%〜約4重量%存在する、項目1に記載の組成物。
(項目13) 前記酢酸ロイプロリドが、前記組成物の約4重量%〜約8重量%存在する、項目1に記載の組成物。
(項目14) 注射可能な皮下送達系として処方された、項目1に記載の組成物。
(項目15) 約0.2mL〜約0.4mLの容量を有する、項目14に記載の組成物。
(項目16) 約0.3mL〜約0.5mLの容量を有する、項目14に記載の組成物。
(項目17) 1ヶ月につき約1回の投与のために処方された、項目14に記載の組成物。
(項目18) 3ヶ月につき約1回の投与のために処方された、項目14に記載の組成物。
(項目19) 4ヶ月につき約1回の投与〜6ヶ月につき約1回の投与のために処方された、項目14に記載の組成物。
(項目20) 徐放性移植物としての使用のための流動性組成物を形成するための方法あって、任意の順序で、以下:
a)水性媒体または体液中において少なくとも実質的に不溶性である、生分解性熱可塑性ポリエステル;
b)アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される生体適合性極性非プロトン溶媒であって;ここで、該生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である、生体適合性極性非プロトン溶媒;ならびに
c)酢酸ロイプロリド
を混合する工程を包含し、ここで、該混合する工程は、徐放性移植物としての使用のための該流動性組成物を形成するために有効な、十分な時間行われる、方法。
(項目21) 前記生体適合性熱可塑性ポリエステルと前記生体適合性極性非プロトン溶媒が一緒に混合されて混合物が形成され、その後、該混合物が、前記酢酸ロイプロリドと混合されて前記流動性組成物が形成される、項目20に記載の方法。
(項目22)
(a)組成物を患者の身体内に注射すること;および
(b)生体適合性極性非プロトン性溶媒を分散させて、生分解性固体移植物を形成すること、
を含む工程により、該患者においてインサイチュで形成された生分解性移植物であって、ここで、該組成物は、有効量の生分解性熱可塑性ポリエステルと;アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される、有効量の生体適合性極性非プロトン溶媒と;有効量の酢酸ロイプロリドとを含み、ここで、該生分解性熱可塑性ポリエステルは水性媒体または体液中において少なくとも実質的に不溶性であり、該生体適合性極性非プロトン溶媒は水性媒体または体液中において混和性から分散性までの性質である、生分解性移植物。
(項目23) 前記患者がヒトである、項目22に記載の生分解性移植物。
(項目24) 前記固体移植物が、前記患者において生分解する場合に、該固体移植物が有効量のロイプロリドを放出する、項目22に記載の生分解性移植物。
(項目25) 前記生分解性固体移植物が、前記患者の身体内の組織に付着する、項目22に記載の生分解性移植物。
(項目26) 生きている患者において生分解性移植物をインサイチュで形成する方法であって、以下:
(a)患者の身体内に流動性組成物を注射する工程;および
(b)生体適合性極性非プロトン溶媒を分散させて、生分解性固体移植物を生成する工程、
を包含し、ここで該流動性組成物は、水性媒体または体液中において少なくとも実質的に不溶性である、有効量の生分解性熱可塑性ポリエステルと;アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される、有効量の生体適合性極性非プロトン溶媒と;有効量の酢酸ロイプロリドとを含み、ここで、該生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である、方法。
(項目27) 前記生分解性固体移植物が前記患者において生分解する場合に、拡散、崩壊、または、拡散と崩壊との組み合わせにより、該固体移植物が前記有効量の酢酸ロイプロリドを放出する、項目26に記載の方法。
(項目28) 患者の癌を処置する方法であって、そのような処置または予防を必要とする患者に、有効量の、項目1に記載の流動性組成物を投与する工程を包含する、方法。
(項目29) 前記癌が前立腺癌である、項目28に記載の方法。
(項目30) 前記患者がヒトである、項目28に記載の方法。
(項目31) 患者におけるLHRHレベルを減少させる方法であって、そのようなLHRHの減少を必要とする患者に、有効量の、項目1に記載の流動性組成物を投与する工程を包含する、方法。
(項目32) 前記LHRHレベルの減少が、子宮内膜症を処置するために有用である、項目31に記載の方法。
(項目33) キットであって、
(a)水性媒体または体液中において少なくとも実質的に不溶性である生分解性熱可塑性ポリエステルと、アミド、エステル、カルボネート、ケトン、エーテル、およびスルホニルからなる群より選択される生体適合性極性非プロトン溶媒とを含む組成物を含む、第1容器;ならびに
(b)酢酸ロイプロリドを含む、第2容器、
を含み、ここで、該生体適合性極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である、キット。
(項目34) 前記第1容器がシリンジである、項目33に記載のキット。
(項目35) 前記第2容器がシリンジである、項目33に記載のキット。
(項目36) 前記酢酸ロイプロリドが凍結乾燥されている、項目33に記載のキット。
(項目37) 指示書をさらに含む、項目33に記載のキット。
(項目38) 前記第1容器が、前記第2容器に連結され得る、項目33に記載のキット。
(項目39) 前記第1容器および前記第2容器が、互いに直接連結されるようにそれぞれ構成されている、項目33に記載のキット。
(項目40) 固体移植物であって、
(a)水性媒体または体液中において少なくとも実質的に不溶性である、生体適合性熱可塑性ポリエステル;および
(b)酢酸ロイプロリド;
を含み、ここで、
該固体移植物は、固体またはゲル状の細孔性マトリックスを有し、該マトリックスは、被膜に囲まれたコアである、固体移植物。
(項目41) 項目40に記載の固体移植物であって、生体適合性有機溶媒をさらに含み、該生体適合性有機溶媒は、水性液または体液において混和性から分散性までの性質であり、そして前記熱可塑性ポリエステルを溶解する、固体移植物。
(項目42) 前記生体適合性有機溶媒の量が最小である、項目41に記載の固体移植物。
(項目43) 前記生体適合性有機溶媒の量が経時的に低下する、項目41に記載の固体移植物。
(項目44) 前記コアが、直径約1〜約1000ミクロンの細孔を含む、項目40に記載の固体移植物。
(項目45) 前記被膜が、前記コアの細孔の直径より小さな直径の細孔を含む、項目40に記載の固体移植物。
(項目46) 前記被膜細孔は、前記コアと比較して前記被膜が機能上は無孔であるようなサイズである、項目40に記載の固体移植物。
【図面の簡単な説明】
【0016】
【図1】図1は、イヌにおける、ATRIGEL(登録商標)−6%w/w薬物およびLupron(登録商標)処方物投与後の、血清ロイプロリドレベルを示す。
【図2】図2は、イヌにおける、ATRIGEL(登録商標)およびLupron(登録商標)90日処方物によるテストステロン抑制を示す。
【図3】図3は、イヌ(n=8)における、22.5mgLAで投与された、ATRIGEL(登録商標)およびLupron(登録商標)90日処方物投与後の、血清ロイプロリドレベルを示す。
【図4】図4は、イヌ(n=8)における、22.5mgLAで投与された、ATRIGEL(登録商標)およびLupron(登録商標)90日処方物投与後の、血清テストステロンレベルを示す。
【図5】図5は、ラットにおける血清テストステロンレベル−4ヶ月処方物14,860ダルトン対26,234ダルトン、を示す。
【発明を実施するための形態】
【0017】
(発明の詳細な説明)
特定かつ好ましい、生分解性熱可塑性ポリエステルおよび極性非プロトン溶媒;熱可塑性ポリエステル、極性非プロトン溶媒、酢酸ロイプロリド、および流動性組成物の範囲;この熱可塑性ポリエステルの分子量;および、本明細書中で以下に述べられた固体移植物の範囲は、説明のためだけであり;それらは、他の、生分解性熱可塑性ポリエステルおよび極性非プロトン溶媒;熱可塑性ポリエステル、極性非プロトン溶媒、酢酸ロイプロリド、および流動性組成物の範囲;この熱可塑性ポリエステルの分子量;およびその固体移植物の範囲を除外しない。
【0018】
本発明は、徐放性移植物としての使用に関して適切な流動性組成物、この流動性組成物を形成するための方法、この流動性組成物を使用するための方法、この流動性組成物からインサイチュで形成された生分解性移植物、この生分解性移植物をインサイチュで形成する方法、インサイチュで形成されたこの生分解性移植物を使用する方法、この流動性組成物を含むキット、およびその固体移植物を提供する。この流動性組成物は、動物においてインサイチュで形成された、生分解性または生崩壊性(bioerodible)の微小孔性移植物を、提供し得る。この流動性組成物は、適切な極性非プロトン溶媒と組み合わされた、生分解性熱可塑性ポリマーまたは生分解性熱可塑性コポリマーから構成される。この生分解性熱可塑性ポリエステルまたは生分解性熱可塑性コポリマーは、動物の身体内で、水または体液中に実質的に不溶性であり、生体適合性であり、そして生分解性であり、そして/または生体侵食性である。この流動性組成物は、液体またはゲルとして組織に投与され、その組織において、その移植物がインサイチュで形成される。この組成物は、生体適合性であり、そして、そのポリマーマトリックスは、移植部位で実質的な組織過敏または組織壊死を引き起こさない。その移植物は、酢酸ロイプロリドを送達するために使用され得る。
【0019】
好ましくは、この流動性組成物は、患者(例えばヒト)での注射に適した、液体またはゲルであり得る。本明細書中で使用される場合、「流動性」とは、患者の身体内に媒介物(例えばシリンジ)を介して注射される組成物の能力を言う。例えば、この組成物は、シリンジの使用により、患者の皮下に注射され得る。患者に注射されるこの組成物の能力は、この組成物の粘性に主として依存する。従って、この組成物は、この組成物を媒介物(例えばシリンジ)を介して患者の身体内に無理やり押し込み得るような、適当な粘性を有する。本明細書中で使用される場合、「液体」とは、剪断応力のもとで継続的に変形する物質である。Concise Chemical and Technical Dictionary、第4増補版、Chemical Publishing Co.,Inc.,p.707,NY,NY(1986)。本明細書中で使用される場合、「ゲル」とは、ゼラチン状特性、ゼリー状特性、またはコロイド状特性を有する、物質である。Concise Chemical and Technical
Dictionary、第4増補版、Chemical Publishing Co.,Inc.,p.567,NY,NY(1986)。
【0020】
(生分解性熱可塑性ポリエステル)
流動性組成物を形成するように、固体の生分解性ポリエステルおよび酢酸ロイプロリドが生体適合性極性非プロトン溶媒に溶解されている、熱可塑性組成物が提供され、その後、この組成物は、シリンジと針とを介して投与され得る。任意の適切な生分解性熱可塑性ポリエステルが使用され得るが、ただし、この生分解性熱可塑性ポリエステルは、水性媒体または体液中において少なくとも実質的に不溶性である。適切な生分解性熱可塑性ポリエステルは、例えば、米国特許第5,324,519号;同第4,938,763号;同第5,702,716号;同第5,744,153号;および同第5,990,194号において開示され、ここで、適切な生分解性熱可塑性ポリエステルは、熱可塑性ポリマーとして開示されている。適切な生分解性熱可塑性ポリエステルの例としては、ポリラクチド、ポリグリコリド、ポリカプロラクトン、それらのコポリマー、それらのターポリマー、およびそれらの任意の組み合わせが挙げられる。好ましくは、適切な生分解性熱可塑性ポリエステルは、ポリラクチド、ポリグリコリド、それらのコポリマー、それらのターポリマー、またはそれらの組み合わせである。
【0021】
この組成物中に存在する生分解性熱可塑性ポリエステルの型、分子量、および量は、その徐放性移植物の望まれる特性に主として依存する。例えば、生分解性熱可塑性ポリエステルの型、分子量、および量は、その徐放性移植物から酢酸ロイプロリドが放出される時間の長さに影響し得る。特に、本発明の1つの実施形態において、この組成物は、酢酸ロイプロリドの1ヶ月送達系を処方するために使用され得る。そのような実施形態において、その生分解性熱可塑性ポリエステルは、好ましくは、カルボキシ末端基を有する50/50ポリ(DL−ラクチド−コ−グリコリド)であり得;その組成物の約30重量%〜約40重量%存在し得;そして、平均分子量約23,000〜約45,000を有し得る。あるいは、本発明の別の実施形態において、この組成物は、酢酸ロイプロリドの3ヶ月送達系を処方するために使用され得る。そのような実施形態において、その生分解性熱可塑性ポリエステルは、好ましくは、カルボキシ末端基を有さない75/25ポリ(DL−ラクチド−コ−グリコリド)であり得;その組成物の約40重量%から約50重量%存在し得;そして、平均分子量約15,000〜約24,000を有し得る。
【0022】
75/25ポリ(DL−ラクチド−コ−グリコリド)のカルボキシ末端基は、適切な任意の保護基により保護され得る。適切なカルボキシ保護基は、当業者に公知である(例えば、T.W.Greene,Protecting Groups In Organic Synthesis;Wiley:New York,1981、および、この中の参考文献を参照のこと)。適切な、例示カルボキシ保護基は、(C1−C12)アルキルおよび(C6−C10)アリール(C1−C12)アルキルを含み、ここで、任意のアルキルまたはアリールが、必要に応じて、1つ以上(例えば、1、2、または3個)のヒドロキシにより置換され得る。好ましい保護基としては、例えば、メチル、ドデシル、および1−ヘキサノールが挙げられる。
【0023】
(熱可塑性ポリエステルの分子量)
本発明において使用されるポリマーの分子量は、この流動性組成物が中間体として使用されている限り、酢酸ロイプロリド放出速度に影響し得る。これらの条件下で、このポリマーの分子量が増加するにつれて、その系からの酢酸ロイプロリド放出速度は減少する。この現象は、酢酸ロイプロリドの制御放出のための系の処方において、有利に使用され得る。酢酸ロイプロリドの比較的迅速な放出のために、低分子量ポリマーは、好ましい放出速度を生ずるように選択され得る。比較的長時間にわたる酢酸ロイプロリドの放出のために、より高いポリマー分子量が選択され得る。従って、ポリマー系は、選択された時間にわたる酢酸ロイプロリド放出のために、最適なポリマー分子量範囲で生成され得る。
【0024】
ポリマーの分子量は、任意の種々の方法により変化され得る。この方法の選択は、ポリマー組成物の型により主として決定される。例えば、加水分解により生分解可能性である熱可塑性ポリエステルが使用される場合、その分子量は、蒸気オートクレーブ内のような、制御された加水分解により変化され得る。代表的に、重合度は、例えば、反応基の数および型、ならびに反応時間を変えることにより制御され得る。
【0025】
(極性非プロトン溶媒)
任意の適切な極性非プロトン溶媒が使用され得るが、ただし、この適切な極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である。適切な極性非プロトン溶媒は、例えば、Aldrich Handbook of Fine Chemicals and Laboratory Equipment,Milwaukee,WI(2000);米国特許第5,324,519号;同第4,938,763号;同第5,702,716号;同第5,744,153号;および同第5,990,194号に開示されている。この適切な極性非プロトン溶媒は、この流動性組成物が、凝析または凝固するように、体液中に拡散し得るべきである。その生分解性ポリマーのためのこの極性非プロトン溶媒が、無毒性であるか、あるいは生体適合性であることもまた、好ましい。この極性非プロトン溶媒は、好ましくは、生体適合性である。適切な極性非プロトン溶媒の例としては、アミド基、エステル基、カルボネート基、ケトン基、エーテル、スルホニル基、またはそれらの組み合わせを有する、極性非プロトン溶媒が挙げられる。好ましくは、この極性非プロトン溶媒は、N−メチル−2−ピロリドン、2−ピロリドン、N,N−ジメチルホルムアミド、ジメチルスルホキシド、プロピレンカルボネート、カプロラクタム、トリアセチン、またはそれらの任意の組み合わせであり得る。より好ましくは、この極性非プロトン溶媒は、N−メチル−2−ピロリドンであり得る。
【0026】
この極性非プロトン溶媒は、任意の適切な量で存在し得るが、ただし、この極性非プロトン溶媒は、水性媒体または体液中において混和性から分散性までの性質である。この組成物中に存在する生体適合性極性非プロトン溶媒の型および量は、その徐放性移植物の望まれる特性に主として依存する。例えば、生体適合性極性非プロトン溶媒の型および量は、その酢酸ロイプロリドがその徐放性移植物から放出される、時間に影響し得る。特に、本発明の1つの実施形態において、この組成物は、酢酸ロイプロリドの1ヶ月送達系を処方するために使用され得る。そのような実施形態において、その生体適合性極性非プロトン溶媒は、好ましくはN−メチル−2−ピロリドンであり得、そして、好ましくは、この組成物の約60重量%〜約70重量%存在し得る。あるいは、本発明の別の実施形態において、この組成物は、酢酸ロイプロリドの3ヶ月送達系を処方するために使用され得る。そのような実施形態において、この生体適合性極性非プロトン溶媒は、好ましくは、N−メチル−2−ピロリドンであり得、そして、好ましくは、この組成物の約50重量%〜約60重量%存在し得る。
【0027】
様々な極性非プロトン溶媒における生分解性熱可塑性ポリエステルの溶解度は、それらの結晶性、それらの親水性、水素結合、および分子量に依存して異なる。従って、この生分解性の熱可塑性ポリエステル全てが同じ極性非プロトン溶媒に溶解するとは限らない。しかし、それぞれの生分解性熱可塑性ポリマーまたは生分解性熱可塑性コポリマーは、それぞれの適した極性非プロトン溶媒を有する。より低分子量のポリマーは、通常は、この溶媒中で、高分子量ポリマーよりも容易に溶解する。結果として、種々の溶媒に溶解したポリマーの濃度は、ポリマーの型およびその分子量に依存して異なる。逆に、より高分子量のポリマーは、通常は、極めて低分子量のポリマーよりも速く凝析または凝固する傾向がある。さらに、より高分子量のポリマーは、低分子量物質よりも高い溶液粘性を示す傾向がある。
【0028】
例えば、乳酸の縮合により形成される低分子量のポリ乳酸は、なおも23ゲージのシリンジ針を容易に貫流する73重量%溶液を生ずるように、N−メチル−2−ピロリドン(NMP)に溶解する。一方、DL−ラクチドの付加重合により形成されるより高分子量のポリ(DL−ラクチド)(DL−PLA)は、たったの50重量%でNMPに溶解された場合に、同じ溶液粘性を示す。高分子量である方のポリマー溶液は、水中に配置された場合、即時に凝析する。この低分子量ポリマー溶液は、より濃縮されるが、水中に配置された場合とてもゆっくりと凝析する傾向がある。
【0029】
また、非常に高濃度の高分子量ポリマーを含む溶液は、時々、より薄い溶液よりもゆっくりと凝析または凝固する。この高濃度のポリマーは、ポリマーマトリックス内からの溶媒の拡散を妨げ、そしてその結果、ポリマー鎖を沈殿し得るマトリックス内への、水の浸透を抑えると考えられる。従って、溶媒がポリマー溶液から外に拡散し得、そして、ポリマーを凝析させるように水が内部に浸透する至適濃度が存在する。
【0030】
この酢酸ロイプロリドは、好ましくは、使用前に凍結乾燥される。代表的に、この酢酸ロイプロリドは、水性溶液に溶解され得、濾過滅菌され得、そしてシリンジ内で凍結乾燥され得る。このポリマー/溶媒溶液は、別のシリンジに充填され得る。その後、この2つのシリンジは共に連結され得、その内容物は、このポリマー/溶媒溶液およびこの酢酸ロイプロリドが効果的に一緒に混合されて流動性組成物を形成するまで、この2つのシリンジの間を前後に引かれ得る。この流動性組成物は、1つのシリンジに引き込まれ得る。その後、この2つのシリンジは外され得る。この流動性組成物を含んでいるシリンジ上に、針が差し込まれ得る。その後、この流動性組成物は、この針を介して身体内に注射され得る。この流動性組成物は、例えば米国特許第5,324,519号;同4,938,763号;同5,702,716号;同5,744,153号;および同5,990,194号;に記載されているように、または本明細書中で記載されているように、処方され得、そして患者に投与され得る。一旦適所に配置されると、この溶媒は分散し、残存するポリマーが凝析し、そして、固体構造が形成される。この溶媒は分散し、そして、そのポリマーは、凝析し、そして酢酸ロイプロリドを固体マトリックス内に捕捉または収容する。
【0031】
これらの固体移植物からの酢酸ロイプロリドの放出は、巨大なポリマーデバイスからの薬剤放出に関する、同じ一般規則に従う。酢酸ロイプロリドの放出は、この移植物のサイズおよび形、移植物内への酢酸ロイプロリドの充填、この酢酸ロイプロリドおよびその特定のポリマーに関する透過性係数、およびそのポリマーの分解、により影響され得る。送達のために選択される酢酸ロイプロリドの量に依存して、上記パラメーターは、好ましい放出の速度および放出持続時間を生じるように、薬剤送達の当業者により調整され得る。
【0032】
インサイチュでの流動性の固体形成移植物に組み込まれる酢酸ロイプロリドの量は、望ましい放出プロフィール、生物学的効果のために必要とされる酢酸ロイプロリドの濃度、および、処置のためにこの酢酸ロイプロリドが放出されるべき時間に、依存する。シリンジの針を介する注射のために受容可能な溶液または分散粘性の量を除いて、このポリマー溶液中に取り込まれる酢酸ロイプロリドの量に臨界的上限はない。この送達系に取り込まれる酢酸ロイプロリドの下限値は、単に、この酢酸ロイプロリドの活性および処置に必要とされる時間に依存する。具体的には、本発明の1つの実施形態において、この組成物は、酢酸ロイプロリドの1ヶ月送達系を処方するために使用され得る。そのような実施形態において、この酢酸ロイプロリドは、好ましくは、その組成物の約2重量%〜約4重量%存在し得る。あるいは、本発明の別の実施形態において、この組成物は、酢酸ロイプロリドの3ヶ月送達系を処方するために使用され得る。そのような実施形態において、その酢酸ロイプロリドは、好ましくはその組成物の約4重量%〜約8重量%存在し得る。この流動性システムから形成される固体移植物は、その酢酸ロイプロリドが事実上枯渇するまで、制御された速度でそのマトリックス内に含まれるその酢酸ロイプロリドを放出する。
【0033】
(投与量)
流動性組成物の投与量は、代表的には、その徐放性移植物の望ましい性質に依存する。例えば、流動性組成物の量は、その酢酸ロイプロリドがその徐放性移植物から放出される時間に影響し得る。具体的には、本発明の1つの実施形態において、この組成物は、酢酸ロイプロリドの1ヶ月送達系を処方するために使用され得る。そのような実施形態において、約0.2mL〜約0.4mLのこの流動性組成物が投与され得る。あるいは、本発明の別の実施形態において、この組成物は、酢酸ロイプロリドの3ヶ月送達系を処方するために使用され得る。そのような実施形態において、約0.3mL〜約0.5mLのこの流動性組成物が投与され得る。
【0034】
驚いたことに、本発明によるこの液状ポリマー組成物は、酢酸ロイプロリドを送達する際にLupron(登録商標)Depotよりも効果的であることが、発見された。具体的には、下記の実施例において示すように、この酢酸ロリプロリドを含む本発明の液状ポリマー組成物を用いて得られたテストステロンレベルの方が、Lupron(登録商標)Depotと比較してイヌで長時間で低く、そしてまたLupron(登録商標)Depotに関する文献(Sharifi,R.,J.Urology,Vol.143、Jan.,68(1990))にて報告された値と比較してヒトで6ヶ月時点で低い。
【0035】
全ての刊行物、特許、ならびに特許出願が、あたかも参考として個々に援用される様に、本明細書中で参考として援用されている。 本発明は今、次の、限定されない実施例により示される。
【0036】
(実施例)
(実施例1)
ラクチド対グリコリド比50/50、および末端カルボキシル基を有するポリ(DL−ラクチド−コ−グリコリド)(Boehringer Ingelheimから入手可能であるRG 504H)を、34重量%のポリマー溶液を生じるように、N−メチル−2−ピロリドン(NMP)に溶解した。このATRIGEL(登録商標)ポリマー溶液を、容量330mLで雌ルアーロック取付具を備える1.25ccのポリプロピレンシリンジに充填し、20キログレイのγ線照射に曝すことにより最後に滅菌した。γ線照射後のこのポリマーの分子量は、32,000ダルトンであった。酢酸ロイプロリドを水に溶解し、0.2mmフィルターに通して濾過滅菌し、そして、雄ルアーロック取付具を備える1.00ccのポリプロピレンシリンジに充填した。この水性溶液を凍結し、そして、その水を真空下で除去して、このペプチドの凍結乾燥ケーキ10.2mgを生じた。この2つのシリンジを使用直前に連結し、その内容物を、この2つのシリンジの間を前後に30サイクル行ったり来たりさせて混合した。雌継手を備えるシリンジにこの処方物を引き戻し、この2つのシリンジを分離し、そして1/2インチの長さの20ゲージの針を取り付けた。その後、7.5mgの酢酸ロイプロリドを含む合計250mgのポリマー処方物を投与するために、このシリンジの内容物を7匹の雄性ビーグル犬に皮下注射した。7.5mgの酢酸ロイプロリドを含むLupron(登録商標)Depotミクロスフェアを、第2セットの7匹のビーグル犬に筋肉内注射した。血清サンプルを、これらの犬全てから、ベースライン時ならびに1日目、3日目、7日目、14日目、21日目、28日目、35日目、42日目、49日目、55日目、63日目、77日目、および91日目に収集した。
【0037】
この血清サンプルを、テストステロンについてRIA法を用いて分析した。表1に示す結果は、両製品が、そのテストステロン濃度を約14日後にはヒトの去勢レベル0.5ng/mL未満に減少させること、そして42日目まで完全にこの効果を持続することにおいて、効果的であることを示した。概して、このLupron(登録商標)Depotを用いて得られたこのテストステロンレベルは、ATRIGEL(登録商標)ポリマー系を用いて観察されたテストステロンレベルよりも僅かに低いようであった。
【0038】
【表1】

(実施例2)
分子量48,000ダルトンを有するポリマー処方物を得るため、実施例1に記載されているのと同じポリマー溶液を0.2mmフィルターに通して濾過滅菌した。その後、この滅菌したポリマー溶液を、その雌型ポリプロピレンシリンジに無菌的に充填した。また、濾過滅菌前の同じバルクポリマー溶液を4つの異なるサンプルに分割し、ポリプロピレンシリンジに充填し、このポリマーを異なる分子量に分解するため、4つの照射レベルでγ線照射に曝した。この異なる線量レベルでの照射後のポリマーは、33,500ダルトン、26,500ダルトン、23,000ダルトン、および20,000ダルトンの分子量を有した。5つの処方物全てを、上記に記載されているように酢酸ロイプロリドと混合し、雄性ビーグル犬に皮下注射した。45日間にわたる血清テストステロンの測定は、最も低い分子量20,000ダルトンを有する処方物を除くこれらの処方物全てが、テストステロン濃度を去勢レベル未満に減少させることにおいて効果的であったことを示した。従って、酢酸ロイプロリドを含むこのATRIGEL(登録商標)ポリマー処方物は、23,000〜45,000ダルトンに及ぶ広範囲のポリマー分子量にわたり、1ヶ月間テストステロンを減少させることにおいて効果的である。
【0039】
(実施例3)
20キログレイでのγ線照射後の、実施例1に記載されているポリマー処方物を酢酸ロイプロリドと混合し、そして8匹の雄性ビーグル犬に皮下注射した。7.5mgの酢酸ロイプロリドを含むLupron(登録商標)Depotを、8匹の雄性ビーグル犬に筋肉注射した。血清サンプルを、ベースライン時および1日目、2日目、3日目、7日目、14日目、22日目、28日目、30日目、32日目、34日目、および36日目に収集した。この血清サンプルを、血清テストステロンおよび血清ロイプロリドについて、RIAにより分析した。表2に示されるこの血清テストステロン濃度の値は、両製品が、イヌにおいて、そのテストステロンをヒト去勢レベル未満に減少させることにおいて効果的であったこと示し、このLupron(登録商標)Depot製品が、より遅い時点で、わずかに、より効果的であるようである。この差異に関する原因は、表3に示すように、中間時点で、このLupron(登録商標)Depot製品についての、より高い血清ロイプロリドレベルであると考えられた。このデータに基づいて、ロイプロリドを含むこのATRIGEL(登録商標)製品が効果的であるが、おそらくこのLupron(登録商標)Depot製品ほど効果的ではないと予期された。
【0040】
【表2】

【0041】
【表3】

(実施例4)
実施例1に記載されているポリマー処方物を、GMP条件下で調製し、シリンジに充填し、そして20キログレイで照射した。その後、この滅菌ポリマー溶液を、別のシリンジ中で濾過滅菌した酢酸ロイプロリドと混合した。この2つのシリンジを連結し、その内容物を一緒に30サイクルの間混合した。そして、この内容物を、精巣摘出された前立腺癌の患者に皮下注射した。28日間にわたり血清サンプルを収集し、有効なRIA法を用いてロイプロリド濃度を分析した。表4に示すデータは、薬物の初期バーストの後に、28日間にわたりかなり一定のレベルが続くことを示す。これらのデータを、文献に公表されているLupron(登録商標)Depotに関するデータと比較した場合、それらの値は非常に類似し、両製品とも前立腺癌において同じ効力を生ずると考えられる。
【0042】
【表4】

(実施例5)
極めて重要な臨床試験において、実施例4に記載されているATRIGEL(登録商標)ロイプロリド製品を、前立腺癌患者に皮下(s.c.)注射した。6回の注射を受けるまで、28日毎に、この患者にこの製品をもう一回注射した。血清サンプルを種々の時間に収集し、有効なRIA法によりテストステロン濃度を分析した。表5に示された値は、血清テストステロン濃度が21日目に去勢値50ng/dL(0.5ng/mL)に至ったことを示す。その後、このテストステロン濃度は56日目に7.77ng/dLに低下し、この研究の残り全体にわたりこのレベルのままであった。表5に示されるように、このテストステロン濃度を、Lupron(登録商標)Depotを用いて得られた公表されている値と比較すると、ATRIGEL(登録商標)ロイプロリド製品の方が、ヒトにおいて、低いテストステロンレベルを示すので、効果的であることを示す。
【0043】
【表5】

(実施例6)
45重量%のポリマーを含む溶液を生じるように、ラクチド:グリコリドのモル濃度比75/25を有するポリ(DL−ラクチド−コ−グリコリド)(Birmingham Polymer,Inc)をNMPに溶解した。この溶液を、雄ルアーロック取付具を備える3.0ccのポリプロピレンシリンジ中に充填し、そして、23.2〜24.6キログレイのγ線照射にさらすことにより最後に滅菌した。照射後のこのポリマーの分子量は、15,094ダルトンであった。酢酸ロイプロリドを水に溶解し、0.2mmのフィルターに通して濾過滅菌し、そして、雄ルアーロック取付具を備えるポリプロピレンシリンジに充填した。水性溶液を凍結し、そして、その水を真空により除去して、ロイプロリドの凍結乾燥ケーキを生じた。その2つのシリンジを使用直前に連結器により一緒に連結し、そして、2つのシリンジの内容物を2つのシリンジの間で前後に40サイクル動かすことにより、それらの物質を混合して、6重量%のロイプロリド酢酸を含む処方物を提供した。その後、この生成物を、雄ルアーロック取付具を備えるシリンジに引き込み、そして1/2インチの長さの20ゲージの針を取り付けた。
【0044】
その後、この酢酸ロイプロリドを含む処方物を、標的用量25.6mg/kg/日で5匹の雄性ビーグル犬に皮下注射した。市販の3ヶ月Lupron(登録商標)Depotミクロスフェアを、同じ標的用量で、5匹の雄性ビーグル犬に筋肉内注射した。実際の投与量は、ロイプロリドを含むATRIGEL(登録商標)については31.4mg/kg/日であり、Lupron(登録商標)Depotについては25.3mg/kg/日であった。ベースライン時ならびに1日目、2日目、3日目、4日目、7日目、14日目、21日目、28日目、35日目、49日目、63日目、71日目、81日目、91日目、105日目、120日目、134日目、および150日目に、それぞれのイヌから血清を収集し、そして、RIAによりテストステロンについて、およびLC/MS/MSによりロイプロリド濃度について分析した。
【0045】
そのデータは、この血清ロイプロリドレベルが、最初の30日間にわたり、Lupron(登録商標)Depot製品と比較して、ATRIGEL(登録商標)処方に関しての方が実際に高かったが、その後、次の120日にわたり、Lupron(登録商標)Depot製品と同じレベルまで減少した(図1)ことを示した。しかし、この2つの製品に関して、70日間の間、それらのテストステロンレベルは同等であったが、その後、Lupron(登録商標)Depot製品は、ヒト去勢テストステロンレベルを維持しなかった。この結果は、後者の時点にわたるこの2つの製品の同等のロイプロリドレベルに基づいて、驚くべきことであった。
【0046】
(実施例7)
実施例6に記載されているのと同じポリマー処方物を調製し、そして、容量440mLの雌ルアーロック取付具を備える1.25ccのポリプロピレンシリンジに充填した。この生成物を、23〜25キログレイのγ線照射に曝すことにより最後に滅菌した。照射後のこのポリマーの分子量は14,800ダルトンであった。酢酸ロイプロリドを水に溶解し、0.2mmのフィルターを用いて濾過滅菌し、そして雄ルアーロック取付具を備える1.00ccのポリプロピレンシリンジに充填した。この水性溶液を凍結し、そしてその水を真空により除去して、酢酸ロイプロリドの凍結乾燥ケーキ28.2mgを生じた。使用直前に、この2つのシリンジを一緒に連結し、その内容物をその2つのシリンジの間で前後に40サイクル動かすことにより、その材料を混合し、6重量%の酢酸ロイプロリドを含む均質な混合物を提供した。その後、雄ルアーロック取付具を備えるシリンジに処方物を引き込み、それらのシリンジを分離し、そして1/2インチの長さの20ゲージの針を取り付けた。
【0047】
全送達用量22.5mgの酢酸ロイプロリドを投与するために、この処方物を8匹の雄性ビーグル犬に皮下注射した。市販の3ヶ月Lupron(登録商標)Depotミクロスフェアを、8匹の雄性ビーグル犬に筋肉内注射した。6時間目および12時間目、ならびに1日目、2日目、3日目、7日目、14日目、21日目、28日目、35日目、49日目、64日目、77日目、および91日目に、テストステロン濃度およびロイプロリド濃度の分析のために、血清サンプルを収集した。91日目に、再度これらの動物に上記処方物を注射し、91日目の6時間目および12時間目、ならびに、再び92日目、93日目、94日目、99日目、および105日目にもまた、血清を収集した。表6および図3に示すように、長時間の時点で、このATRIGEL(登録商標)処方物よりもこのLupron(登録商標)Depot製品に関してのほうが、その平均血清ロイプロリド濃度は非常に高かった。しかし、表7および図4に示すように、そのテストステロン濃度は、このATRIGEL(登録商標)処方物に関しての方が実際に低かった。
【0048】
【表6】

【0049】
【表7】

(実施例8)
異なる分子量を有する45重量%の75/25ポリ(DL−ラクチド−コ−グリコリド)を含む3つのポリマー処方物を調製し、そして440mLの容量の雌ルアーロック取付具を備える1.25ccのポリプロピレンシリンジに充填した。これらのシリンジを23〜25キログレイのγ線照射に曝すことにより、最後に滅菌した。照射後のこれら3つのポリマーの分子量は、11,901ダルトン、13,308ダルトン、および21,268ダルトンであった。これらのポリマー溶液を、別のシリンジ内の凍結乾燥した酢酸ロイプロリドと混合し、そして、実施例7に記載されているように、投与量22.5mgでイヌに皮下注射した。血清サンプルを、ベースライン時ならびに1日目、7日目、14日目、21日目、28日目、35日目、42日目、56日目、70日目、84日目、98日目、112日目、および126日目に収集した。この血清を、RIAによりテストステロン濃度について分析した。2つの低分子量ポリマー処方物は、全90日間の間、そのテストステロン濃度を去勢未満に抑制しなかったが、分子量21,268ダルトンを有するポリマーが、評価された3ヶ月にわたり効果的であったことを、このデータは示した。
【0050】
(実施例9)
異なる分子量を有する45重量%の75/25ポリ(DL−ラクチド−コ−グリコリド)を含む2つのポリマー処方物を調製し、1.25ccのポリプロピレンシリンジに充填した。これらのシリンジを24〜27キログレイのγ線照射に曝すことにより、最後に滅菌した。照射後のこの2つのポリマーの分子量は、14,864ダルトンおよび26,234ダルトンであった。これらのポリマー溶液を、別の1.25ccのポリプロピレンシリンジ内の凍結乾燥された酢酸ロイプロリドと混合し、そして、前後に40サイクル動かすことにより混合し、6重量%の酢酸ロイプロリドを含む均質な混合物を生成した。その後、この内容物を一方のシリンジに引き込み、それらのシリンジを分離し、そして1/2インチの長さの20ゲージの針を取り付けた。その後、酢酸ロイプロリドを含むこの処方物を、投与量100mg/kg/日(12mg/kg)で、1グループにつき5匹のラットに皮下注射した。ベースライン時ならびに3日目、7日目、14日目、21日目、35日目、49日目、63日目、70日目、80日目、91日目、105日目、120日目、および132日目に、これらの動物全てから血清サンプルを収集し、そして、RIA法を用いてテストステロン濃度について分析した。図5に示すデータは、両方のポリマー分子量処方物が、132日間の間、テストステロンをヒトの去勢レベル未満に抑制することに効果的であったことを示す。
【特許請求の範囲】
【請求項1】
明細書に記載の発明。
【請求項1】
明細書に記載の発明。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−12418(P2012−12418A)
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−227390(P2011−227390)
【出願日】平成23年10月14日(2011.10.14)
【分割の表示】特願2002−533836(P2002−533836)の分割
【原出願日】平成13年9月21日(2001.9.21)
【出願人】(501034922)アトリックス ラボラトリーズ,インコーポレイティド (1)
【Fターム(参考)】
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願番号】特願2011−227390(P2011−227390)
【出願日】平成23年10月14日(2011.10.14)
【分割の表示】特願2002−533836(P2002−533836)の分割
【原出願日】平成13年9月21日(2001.9.21)
【出願人】(501034922)アトリックス ラボラトリーズ,インコーポレイティド (1)
【Fターム(参考)】
[ Back to top ]

