改良された逆転写方法
【課題】 長鎖のmRNAを鋳型とする場合であっても、mRNAの全長に渡って逆転写が可能であり、その結果、完全長のcDNAを得ることができる方法の提供。
【解決手段】 mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度、例えば45℃以上の温度行う方法。前記逆転写を、例えば、非耐熱性逆転写酵素を用い、かつトレハロースやベタインのようなシャペロン作用のある物質の存在下で行う方法。前記逆転写を前記逆転写酵素の活性化に必要な金属イオンの存在下で行うに際して、前記金属イオンに対するデオキシヌクレオチド トリフォスフェートのようなキレート剤を存在させる方法。
【解決手段】 mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度、例えば45℃以上の温度行う方法。前記逆転写を、例えば、非耐熱性逆転写酵素を用い、かつトレハロースやベタインのようなシャペロン作用のある物質の存在下で行う方法。前記逆転写を前記逆転写酵素の活性化に必要な金属イオンの存在下で行うに際して、前記金属イオンに対するデオキシヌクレオチド トリフォスフェートのようなキレート剤を存在させる方法。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】本発明は、mRNAから完全長cDNAを得ることができる逆転写方法に関する。
【0002】
【従来の技術】逆転写酵素(RAN 依存性DNA ポリメラーゼ)を用いてin vitroでmRNAからcDNAを得ることができることが知られている。また、ヒトの遺伝子配列を解明するプロジェクトが進行されているが、その中で、遺伝子を鋳型としてmRNAを作成し、さらに、作成されたmRNAを鋳型として完全長cDNAを得ることが試みられている。即ち、mRNAからcDNAの第一鎖を合成し、これがcDNAライブラリー作成法やRT-PCRの第一ステップとなる。
【0003】
【発明が解決しようとする課題】上記mRNAから完全長cDNAを得るために逆転写方法が利用される。しかるに、従来の逆転写方法では、mRNAの最先端であるcap サイトまで逆転写が到達しないため、mRNAから完全長のcDNAを得ることができなかった。本発明者の検討によれば、タンパク質の2次構造と同様に、長鎖のmRNAは1本のmRNAの鎖内で2次構造を形成してしまい、2次構造を形成している部分で逆転写酵素の伸長が立体的構造による阻害を受け、その結果、mRNAの末端まで逆転写が行われないためであることが判明した。
【0004】即ち、現在の技術的限界は、mRNAの安定な2次構造の為、反応が早期に終了し転写単位の5'末端まで到達する効率が非常に低いことである。この技術的な限界はライブラリーの品質に影響を与える。何故ならオリゴdTをプライマーとし、3'端のpoly Aより合成されたcDNAは、途中で合成が停止するため、殆どのクローンが3'端のみを持ち、完全長を持たないことが多い。このステップを克服する為、今までにいくつかの試みがなされてきた。例えば、第一鎖の合成の前に、mRNAの2次構造を解く為に70℃の前処理をすることが挙げられる。また、mRNAの熱処理の代わりに水酸化メチル水銀で処理することも可能である。これらの方法は第一鎖合成の効率を上げるのにある程度効果的であるにも拘わらず、完全長cDNAを効率良く回収するには十分でなかった。特に数Kbp 以上の長いmRNAを逆転写する場合には、特に効率が悪い。
【0005】そこで本発明の第1の目的は、長鎖のmRNAを鋳型とする場合であっても、mRNAの全長に渡って逆転写が可能であり、その結果、完全長のcDNAを得ることができる方法を提供することにある。
【0006】それに対して、本発明者は、逆転写を行う温度をmRNAが2次構造を形成しない温度とすることにより上記本発明の第1の目的を達成できることを見いだした。さらに、mRNAが2次構造を形成しない状態にある温度は、緩衝液の組成等にも依存するが、例えば、45℃以上、特に60℃以上の温度である。
【0007】これらの温度下では、mRNAを2次構造を取らない状態に維持でき、第一鎖の合成を効率よく行うことができるのであるが、上記のような温度条件下では、■酵素の種類によっては逆転写酵素の活性が低下または失活するという問題があること、及び■逆転写酵素の活性化に必要なマグネシウムのような金属イオンと緩衝剤、例えばトリス(Tris)〔トリス(ヒドロキシメチル)アミノメタン〕が共存するとmRNAの安定性が低下する(切断される)という問題があることが、それぞれ判明した。
【0008】そこで本発明の第2の目的は、逆転写をmRNAが2次構造を取らない温度で行うことにより、長鎖のmRNAを鋳型とする場合であってもmRNAの全長に渡って逆転写が可能であり、かつ非耐熱性の逆転写酵素を用いる場合であってもこの酵素の熱による活性低下も防止でき、即ち熱活性化でき、その結果、高い信頼性のもと完全長のcDNAを得ることができる方法を提供することにある。
【0009】本発明の第3の目的は、逆転写をmRNAが2次構造を取らない温度で行うことにより、長鎖のmRNAを鋳型とする場合であってもmRNAの全長に渡って逆転写が可能であり、かつ耐熱性の逆転写酵素を用い、その結果、高い信頼性のもと完全長のcDNAを得ることができる方法を提供することにある。
【0010】さらに本発明の第4の目的は、逆転写をmRNAが2次構造を取らない温度で行うことにより、長鎖のmRNAを鋳型とする場合であってもmRNAの全長に渡って逆転写が可能であり、かつ逆転写酵素の活性化に必要な金属イオンが存在する場合、特に、さらにトリス(Tris)のような緩衝液が共存する場合であっても、mRNAの安定性を維持でき、その結果、高い信頼性のもと完全長のcDNAを得ることができる方法を提供することにある。
【0011】
【課題を解決するための手段】上記本発明の第1の目的を達成する本発明の第1の態様は、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度で行うことを特徴とする方法である。
【0012】上記本発明の第2の目的を達成する本発明の第2の態様は、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度で、非耐熱性酵素を用い、かつ糖類の存在下で行うことを特徴とする方法である。
【0013】上記本発明の第3の目的を達成する本発明の第3の態様は、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度で、かつ耐熱性酵素を用いて行うことを特徴とする方法である。
【0014】上記本発明の第4の目的を達成する本発明の第4の態様は、mRNAが2次構造を取らない温度で、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写を前記逆転写酵素の活性化に必要な金属イオンとトリス緩衝液の存在下で行うに際して、前記金属イオンに対するキレート剤を存在させることを特徴とする方法である。
【0015】発明の好ましい態様の1つは、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、■前記逆転写をmRNAが2次構造を取らない温度で行うこと、■前記逆転写を非耐熱性逆転写酵素を用い、かつ1種または2種以上の糖類の存在下で行うこと、及び■前記逆転写を前記逆転写酵素の活性化に必要な金属イオンの存在下で行うに際して、前記金属イオンに対するキレート剤を存在させて行うことを特徴とする方法である。
【0016】さらに発明の好ましい別の態様の1つは、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、■前記逆転写をmRNAが2次構造を取らない状態にある温度で行うこと、■前記逆転写を非耐熱性逆転写酵素を用い、かつ1種または2種以上の糖類と1種または2種以上の多価アルコールとの存在下で行うこと、及び■前記逆転写を前記逆転写酵素の活性化に必要な金属イオンの存在下で行うに際して、前記金属イオンに対するキレート剤を存在させて行うことを特徴とする方法である。
【0017】
【発明の実施の形態】以下本発明について説明する。本発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の第1の態様は、前記逆転写をmRNAが2次構造を取らない温度で行うことを特徴とする。前記「mRNAが2次構造を取らない温度」とは、例えば、45℃以上の温度であり、さらに詳しくは、45〜90℃の範囲の温度である。但し、温度が高くなるにつれてmRNAを2次構造を取らない状態にすることは容易になるが、逆転写酵素の活性やmRNAの安定性が低下する傾向があるので、上記温度は好ましくは50〜75℃の範囲である。
【0018】また、本発明の方法に用いるmRNAの鎖の長さについては特に制限はない。但し、2次構造を取りにくい鎖長の短いmRNAについては本発明を適用する必要がないのに対して、4Kbp超え、特に7Kbpを超えるmRNAについて2次構造を解かなければ、完全長のcDNAを逆転写は困難である。そこで、このような観点から、本発明の方法は、4Kbp超え、特に7Kbpを超えるmRNAの逆転写に特に有効である。しかし、本発明の範囲から4Kbp以下のmRNAを対象から排除する意図ではない。
【0019】本発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の第2の態様は、非耐熱性逆転写酵素を用い、かつ前記逆転写をシャペロン作用のある物質の存在下で行うことを特徴とする。
【0020】本発明において非耐熱性逆転写酵素とは、至適温度が約45℃以下の酵素を言う。そのような非耐熱性逆転写酵素の例として、Superscript II、AMV 逆転写酵素及びMuLV逆転写酵素等を挙げることができる。但し、これらに限定する意図はない。上記のように45℃以上の温度におていは、常温で使用されるタイプのSuperscript IIのような逆転写酵素は、至適温度における酵素活性に比べて低い活性しか示さず、一定温度以上ではほとんど活性を示さなくなる。また、50℃で一定時間以上高い温度に放置すると、室温に戻しても活性を示さなくなる。
【0021】特に、mRNAの鎖長が長い場合、酵素の熱失活のため合成途中で逆転写が停止する確率が高く、全長の転写を困難にする。そこで、本発明では、昇温下においても逆転写酵素が活性を維持できる(活性の低下の防止と熱による失活の防止ができる)ことを目的として、上記逆転写の系にシャペロン作用のある物質を共存させる。
【0022】ここでシャペロン作用を有する物質としては、糖類、アミノ酸、多価アルコール及びそれらの誘導体、並びにシャペロンタンパク質を挙げることができる。但し、これらに限定されるものではなく、シャペロン作用を有する物質であればよい。尚、本明細書において「シャペロン作用」とは、熱等によるストレスの為、変性したタンパク質を再生するか、またはネイティブの構造を保持させる為、熱によるタンパク質の完全変性を防止する作用を言う。
【0023】糖類として、例えば、オリゴ糖類や単糖類を挙げることができ、さらにその具体例として、例えば、トレハロース、マルトース、グルコース、スクロース、ラクトース、キシロビオース、アガロビオース、セロビオース、レバンビオース、キトビオース、2−β−グルクロノシルグルクロン酸、アロース、アルトロース、ガラクトース、グロース、イドース、マンノース、タロース、ソルビトール、レブロース、キシリトール及びアラビトール等を挙げることができる。但し、これらに限定する意図はない。上記糖類は、単独で用いても、2種以上を併用しても良い。尚、特に、トレハロース、ソルビトール、レブロース、キシリトール及びアラビトールは、シャペロン作用が強く、酵素の熱活性化の効果が著しい。
【0024】アミノ酸又はその誘導体として、 Ne −アセチル−β−リジン、アラニン、γ−アミノブチル酸、ベタイン、 Na −カルバモイル−L−グルタミン−1−アミド、コリン、ジメチルテチン、エコトイン、グルタメート、β−グルタミン、グリシン、オクトパイン、プロリン、サルコシン、タウリン及びトリメチルアミンN−オキシドを挙げることができる。上記アミノ酸類は、単独で用いても、2種以上を併用しても良い。尚、特に、ベタイン及びサルコシンは、シャペロン作用が強く、酵素の熱活性化の効果が著しい。
【0025】シャペロン作用を有する物質として多価アルコールを挙げることができる。上記糖類も多価アルコールではあるが、それ以外の多価アルコールの例としては、例えば、グリセロール、エチレングリコール、ポリエチレングリコール等を挙げることができる。上記多価アルコールは、単独で用いても、2種以上を併用しても良い。
【0026】さらに、シャペロン作用を有する物質としてシャペロンタンパク質を挙げることができ、シャペロンタンパク質としては耐熱性菌のシャペロンタンパク質やヒートウョックタンパク質、例えば、HSP60、HSP70、HSP90等を挙げることができる。上記シャペロンタンパク質は、単独で用いても、2種以上を併用しても良い。
【0027】これらシャペロン作用を有する物質は、その種類により、また酵素の種類により、酵素に対する最適安定化濃度が異なる。従って、シャペロン作用を有する物質の種類と酵素の種類に応じて、反応系に対する添加濃度を適宜決定することができる。また、シャペロン作用を有する物質の効果を補強するという観点から、上記1種または2種以上の糖類、アミノ酸またはシャペロンタンパク質にさらに、1種または2種以上の多価アルコールを併用することもできる。多価アルコールの例としては、例えば、グリセロール、エチレングリコール、ポリエチレングリコール等を挙げることができる。
【0028】本発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の第3の態様は、耐熱性逆転写酵素を用いて行うことを特徴とする。本発明において耐熱性逆転写酵素とは、約40℃を超える至適温度を有する酵素を言う。そのような耐熱性逆転写酵素の例として、Tth ポリメラーゼを挙げることができる。但し、これに限定される意図はない。Tth ポリメラーゼは至適温度が70℃であり、上記45℃以上の温度において高い活性で逆転写を行うことができる。
【0029】本発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の第4の態様は、前記逆転写を前記逆転写酵素の活性化に必要な金属イオンの存在下で行うに際して、前記金属イオンに対するキレート剤を存在させることを特徴とする。酵素は活性化のため金属イオンを必要とすることがあり、例えば、逆転写酵素であるSuperscript IIは、活性化のため、金属イオンとしてマグネシウムイオンを必要とする。ところが、上記のような温度条件下のマグネシウムイオンを含む緩衝液、例えば、トリス(Tris)緩衝液中では、mRNAの切断が進み、完全長のcDNAを得ることが困難である。同様に、Tth ポリメラーゼは、活性化のため、金属イオンとしてマンガンイオンを必要とする。ところが、マンガンイオンを含む緩衝液、例えば、トリス(Tris)緩衝液中、上記のような温度条件下で逆転写反応を行うと、mRNAの切断が極めて進み、完全長のcDNAを得ることが困難である。
【0030】それに対して、本発明の方法では、逆転写酵素の活性は維持しながら、かつmRNAの切断を阻止できる方法として、金属イオンに対するキレート剤を存在させる。但し、逆転写酵素の活性化のための金属イオンを完全にキレートしてしまうと逆転写酵素が活性を示さなくなるので、キレート力の比較的弱いキレート剤を用いることが適当である。キレート力の比較的弱いキレート剤としては、例えば、デオキシヌクレオチド トリフォスフェート(dNTP)を挙げることができる。キレート力の比較的弱いキレート剤は、金属イオンに対して当モル数前後の濃度を用いることが適当である。
【0031】キレート剤としてデオキシヌクレオチド トリフォスフェートを使用する場合は、金属イオンに対して当モル数前後を添加することが適当である。従って、キレート剤の添加量は、対象となる金属イオンに対するキレート力を考慮して、逆転写酵素活性は維持でき、かつmRNAの切断も阻止できる量を適宜決定できる。尚、デオキシヌクレオチド トリフォスフェートはdATP、dGTP、dCTP、dTTPのいずれか1種を使用しても或いは2種以上を併用してもよい。また、dATP、dGTP、dCTP、dTTPの4種を併用しても良い。しかもこれらは全て逆転写の基質としての役割も果たす為、4種を併用することが通常である。
【0032】発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の好ましい、しかし非限定的な態様は、■前記逆転写をmRNAが2次構造を取らない温度、例えば、45〜90℃の温度、特に好ましくは60℃前後の温度で行うこと、■前記逆転写を1種または2種以上の糖類と1種または2種以上の多価アルコールの存在下で行うこと、及び■前記逆転写を前記逆転写酵素の活性化に必要な金属イオンの存在下で行うに際して、前記金属イオンに対するキレート剤を存在させて行うこと、例えば、キレート剤としてデオキシヌクレオチド トリフォスフェートとマグネシウムイオンを含むトリス(Tris)緩衝液中、逆転写酵素としてSeperscript IIを用いて行うことを特徴とする方法である。
【0033】
【実施例】以下、実施例に基づいて本発明について詳細に説明する。
参考例1金属イオン含有バッファーにおけるmRNAの安定性(dNTPの付加)バッファー(50mM Tris pH8.3, 3mM MgCl2)に幾つかの添加剤を添加した場合のRNA の安定性について検討するため、トータルリバー(Total Liver)RNAを用い、下記の組成のバッファー中でインキュベーションした。
【0034】
【表1】

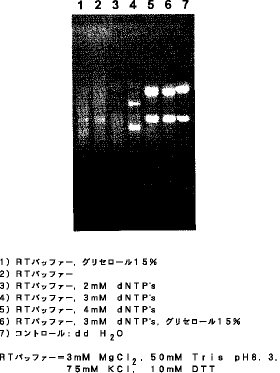
【0035】インキュベーション後のRNA の切断を見る為に検体をSambrookらが記載しているRNA アガロースゲル泳動に供した(Molecular Cloning, The second editionpp 7.43-7.45)。ゲルはエチジウムプロマイドで染め、RNA の切断の程度の評価はリポゾームRNA のバンドの相対的強度を比較することにより評価した。アガロースゲル泳動の結果(レーン1〜7)を図1に示す。
【0036】レーン1に示すように、高濃度フリーのマグネシウムイオン(フリー Mg2+ )の下、つまりRNA を50mM Tris pH8.3, 3mM MgCl2 15%(v/v) グリセロールでインキュベーションしたときには、グリセロールはRNA を切断から守るのに十分働かなかった。事実、切断の程度は50mM Tris pH8.3, 3mM MgCl2、グリセロール非存在下で処理したもの(レーン2)と同程度であった。レーン3に示すように、50mM Tris pH8.3, 3mM MgCl2, 2mM dNTPで処理してもRNA の切断を十分には防ぎ切れなかった。一方、レーン4に示すように、50mM Tris pH8.3, 3mM MgCl2, 3mM dNTP(NTPとMg2+は同一モル濃度) の条件下ではRNA の切断を部分的に防止することができた。
【0037】さらに、レーン5に示すように、50mM Tris pH8.3, 3mM MgCl2, 4mM dNTPの存在下、つまりMg2+よりNTP が 1mM多く含まれている条件下では、RNA は非常に安定であったが、この条件下では逆転写酵素の活性が下がるという結果を得ている。そこで、レーン6に示すように、50mM Tris pH8.3, 3mM MgCl2, 3mM dNTP (NTP とMg2+は同一モル濃度) に15%グリセロールを加えると、RNA は切断を受けなかった。また、この条件下では逆転写酵素活性は完全に保たれることが別の実験から明らかになった。レーン6で使用した条件下ではRNA の安定性は、レーン7に示す滅菌水の安定性と殆ど変わらなかった。
【0038】実施例1逆転写酵素の耐熱化による逆転写効率の向上上記レーン6で使用した新しい条件下において、逆転写活性を見る為、T7 RNAポリメラーゼでin vitro転写されたRNA を鋳型RNA として用い、それからcDNAを合成し、その産物に関して評価した。T7 RNAポリメラーゼでin vitro転写されたRNA は、制限酵素NotIによる切断により直線状に開裂したpBluescript II SK をT7 RNAポリメラーゼでin vitro転写することにより調製した。この反応はpBluescript II SK の使用説明に書いてあるT7プロモーターから開始される。in vitroで転写されたRNA を鋳型にして変性ゲル電気泳動を用いると、逆転写反応の効率を各々の検体で比較でき、また、早期の逆転写の終結や反応効率の減少を示す非特異的転写の終結を評価できる。
【0039】コントロールとして、逆転写の標準バッファーの条件は次のものを用いた。
50mM Tris-HCl pH8.3, 75mM KCl, 3mM MgCl2, 10mMジチオスレイトール, 各0.75mMdNTP (dATP, dGTP, dCTP, dTTP) 。
上記標準バッファーに 1μg 鋳型RNA, 400ngプライマー(20mer SK プライマー, CGCTCTAGAACTAGTGGATC), とsuperscript II 200unitを20μl に調整する。0.2 μl の [α-32P]dGTP を逆転写産物標識の為に用いた。その他の全ての基質を入れる前に、RNA とプライマーの混合検体は65℃にインキュベートされた。その後の反応は42℃1時間で実行した。反応産物は変性アガロース電気泳動法に供され、完全長cDNAの回収率と、短い不完全伸長による産物との割合を調べる為にオートラジオグフィで電気泳動パターンを調べた。結果を図2のレーン1に示す。尚、逆転写酵素superscript IIは、上記標準バッファー条件下では50℃以上の温度にすると失活した。
【0040】オリゴ糖類を添加すると酵素反応が安定化されることを示す為に、逆転写のバッファー条件を次のように設定した。
50mM Tris-HCl pH8.3, 75mM KCl, 3mM MgCl2, 10mM ジチオスレイトール, 各dNTP (dATP, dGTP, dCTP, dTTP) 0.75mM, 20 %(w/v) トレハロース、20%(v/v) グリセロール。
上記バッファーに 1μg 鋳型RNA, 400ngプライマー(20mer SK プライマー) と200unit のsuperscript IIを24μl の水溶液中で反応させた。0.2 μl の [α-32P]dGTP を逆転写産物標識の為に用いた。この条件下では逆転写酵素superscript IIは標準温度 (42℃) のコントロール反応より高い活性を有した。酵素活性はプライマーと鋳型RNA を37℃で2分間アニールした後、60℃で測定した。
【0041】反応産物は上記と同様に変性アガロース電気泳動法に供され、完全長cDNAの回収率と、短い不完全伸長による産物との割合を調べる為にオートラジオグフィで電気泳動パターンを調べた。結果を図2に示す。レーン1に示すように、標準バッファー42℃での条件下では、途中の特異的な部分で逆転写が止まった産物や非特異的に逆転写が停止した産物がみられる。レーン2に示すように、同じく42℃においては20%トレハロース20%グリセロールを加えてもこれらの途中で停止した産物は同様にみられた。レーン3に示すように、60℃に温度を上げると、途中で合成反応が停止した産物は極めて少なくなり、完全長が合成されている。レーン5に示すように、レーン3の条件にさらに0.125 μg/μl のBSAを加えると、更に酵素活性が安定化した。しかし、20%トレハロース20%グリセロールを添加せず、BSAのみでは酵素の耐熱化は十分ではなかった。レーン4に示すように、レーン3の条件にさらにtriton X100 を0.05%加えると、途中で停止した不完全逆転写反応物はさらに減少した。しかし、逆転写酵素全体の活性がやや低下した。
【0042】尚、レーン3で採用した条件と同様の条件で、但し、トレハロースの代わりにグルコースまたはマルトースを用いて電気泳動パターンを調べた結果、トレハロースを用いた場合と同様に途中で合成反応が停止した産物は極めて少なくなり、完全長が合成された。
【0043】mRNAを出発材料としたcDNA合成上記参考例及び実施例1で得られた知見から、ブァッファー条件として(50mMTris-HCl pH8.3, 75mM KCl, 3mM MgCl2, 10mMジチオスレイトール, dNTP 0.75mM それぞれ, 20 %(w/v) トレハロース、20%(v/v) グリセロール)を用いることで、mRNAを出発材料として高効率でcDNAを合成することが出来ることが明らかになった。尚、反応条件は、1μgの鋳型RNA 、400ng オリゴ dT (12-18) プライマーと200unit のsuperscript IIが [α-32P]dGTP 存在下で24μl 中とし、さらに、37℃でプライマーと鋳型RNA を2分間アニールしたのち60℃での反応とした。得られる第一鎖cDNAは、続いて完全長cDNAライブラリーの構築long RT-PCR に用いられる。
【0044】実施例2トレハロースの代わりにアラビトール、ソルビトール、レブロース、キシリトール又はベタインを用いた以外、実施例1におけるレーン3で採用した条件と同様の条件で逆転写を行い、産物の電気泳動パターンを調べた。その結果、実施例1のレーン3のトレハロースを用いた場合と同様に途中で合成反応が停止した産物は極めて少なくなり、完全長が合成された。
【図面の簡単な説明】
【図1】 参考例1で得られたアガロースゲル泳動結果を示す図面に代わる写真。
【図2】 実施例1で得られたアガロースゲル泳動結果を示す図面に代わる写真。
【0001】
【発明の属する技術分野】本発明は、mRNAから完全長cDNAを得ることができる逆転写方法に関する。
【0002】
【従来の技術】逆転写酵素(RAN 依存性DNA ポリメラーゼ)を用いてin vitroでmRNAからcDNAを得ることができることが知られている。また、ヒトの遺伝子配列を解明するプロジェクトが進行されているが、その中で、遺伝子を鋳型としてmRNAを作成し、さらに、作成されたmRNAを鋳型として完全長cDNAを得ることが試みられている。即ち、mRNAからcDNAの第一鎖を合成し、これがcDNAライブラリー作成法やRT-PCRの第一ステップとなる。
【0003】
【発明が解決しようとする課題】上記mRNAから完全長cDNAを得るために逆転写方法が利用される。しかるに、従来の逆転写方法では、mRNAの最先端であるcap サイトまで逆転写が到達しないため、mRNAから完全長のcDNAを得ることができなかった。本発明者の検討によれば、タンパク質の2次構造と同様に、長鎖のmRNAは1本のmRNAの鎖内で2次構造を形成してしまい、2次構造を形成している部分で逆転写酵素の伸長が立体的構造による阻害を受け、その結果、mRNAの末端まで逆転写が行われないためであることが判明した。
【0004】即ち、現在の技術的限界は、mRNAの安定な2次構造の為、反応が早期に終了し転写単位の5'末端まで到達する効率が非常に低いことである。この技術的な限界はライブラリーの品質に影響を与える。何故ならオリゴdTをプライマーとし、3'端のpoly Aより合成されたcDNAは、途中で合成が停止するため、殆どのクローンが3'端のみを持ち、完全長を持たないことが多い。このステップを克服する為、今までにいくつかの試みがなされてきた。例えば、第一鎖の合成の前に、mRNAの2次構造を解く為に70℃の前処理をすることが挙げられる。また、mRNAの熱処理の代わりに水酸化メチル水銀で処理することも可能である。これらの方法は第一鎖合成の効率を上げるのにある程度効果的であるにも拘わらず、完全長cDNAを効率良く回収するには十分でなかった。特に数Kbp 以上の長いmRNAを逆転写する場合には、特に効率が悪い。
【0005】そこで本発明の第1の目的は、長鎖のmRNAを鋳型とする場合であっても、mRNAの全長に渡って逆転写が可能であり、その結果、完全長のcDNAを得ることができる方法を提供することにある。
【0006】それに対して、本発明者は、逆転写を行う温度をmRNAが2次構造を形成しない温度とすることにより上記本発明の第1の目的を達成できることを見いだした。さらに、mRNAが2次構造を形成しない状態にある温度は、緩衝液の組成等にも依存するが、例えば、45℃以上、特に60℃以上の温度である。
【0007】これらの温度下では、mRNAを2次構造を取らない状態に維持でき、第一鎖の合成を効率よく行うことができるのであるが、上記のような温度条件下では、
【0008】そこで本発明の第2の目的は、逆転写をmRNAが2次構造を取らない温度で行うことにより、長鎖のmRNAを鋳型とする場合であってもmRNAの全長に渡って逆転写が可能であり、かつ非耐熱性の逆転写酵素を用いる場合であってもこの酵素の熱による活性低下も防止でき、即ち熱活性化でき、その結果、高い信頼性のもと完全長のcDNAを得ることができる方法を提供することにある。
【0009】本発明の第3の目的は、逆転写をmRNAが2次構造を取らない温度で行うことにより、長鎖のmRNAを鋳型とする場合であってもmRNAの全長に渡って逆転写が可能であり、かつ耐熱性の逆転写酵素を用い、その結果、高い信頼性のもと完全長のcDNAを得ることができる方法を提供することにある。
【0010】さらに本発明の第4の目的は、逆転写をmRNAが2次構造を取らない温度で行うことにより、長鎖のmRNAを鋳型とする場合であってもmRNAの全長に渡って逆転写が可能であり、かつ逆転写酵素の活性化に必要な金属イオンが存在する場合、特に、さらにトリス(Tris)のような緩衝液が共存する場合であっても、mRNAの安定性を維持でき、その結果、高い信頼性のもと完全長のcDNAを得ることができる方法を提供することにある。
【0011】
【課題を解決するための手段】上記本発明の第1の目的を達成する本発明の第1の態様は、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度で行うことを特徴とする方法である。
【0012】上記本発明の第2の目的を達成する本発明の第2の態様は、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度で、非耐熱性酵素を用い、かつ糖類の存在下で行うことを特徴とする方法である。
【0013】上記本発明の第3の目的を達成する本発明の第3の態様は、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度で、かつ耐熱性酵素を用いて行うことを特徴とする方法である。
【0014】上記本発明の第4の目的を達成する本発明の第4の態様は、mRNAが2次構造を取らない温度で、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写を前記逆転写酵素の活性化に必要な金属イオンとトリス緩衝液の存在下で行うに際して、前記金属イオンに対するキレート剤を存在させることを特徴とする方法である。
【0015】発明の好ましい態様の1つは、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、
【0016】さらに発明の好ましい別の態様の1つは、mRNAからcDNAを逆転写酵素を用いて調製する方法であって、
【0017】
【発明の実施の形態】以下本発明について説明する。本発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の第1の態様は、前記逆転写をmRNAが2次構造を取らない温度で行うことを特徴とする。前記「mRNAが2次構造を取らない温度」とは、例えば、45℃以上の温度であり、さらに詳しくは、45〜90℃の範囲の温度である。但し、温度が高くなるにつれてmRNAを2次構造を取らない状態にすることは容易になるが、逆転写酵素の活性やmRNAの安定性が低下する傾向があるので、上記温度は好ましくは50〜75℃の範囲である。
【0018】また、本発明の方法に用いるmRNAの鎖の長さについては特に制限はない。但し、2次構造を取りにくい鎖長の短いmRNAについては本発明を適用する必要がないのに対して、4Kbp超え、特に7Kbpを超えるmRNAについて2次構造を解かなければ、完全長のcDNAを逆転写は困難である。そこで、このような観点から、本発明の方法は、4Kbp超え、特に7Kbpを超えるmRNAの逆転写に特に有効である。しかし、本発明の範囲から4Kbp以下のmRNAを対象から排除する意図ではない。
【0019】本発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の第2の態様は、非耐熱性逆転写酵素を用い、かつ前記逆転写をシャペロン作用のある物質の存在下で行うことを特徴とする。
【0020】本発明において非耐熱性逆転写酵素とは、至適温度が約45℃以下の酵素を言う。そのような非耐熱性逆転写酵素の例として、Superscript II、AMV 逆転写酵素及びMuLV逆転写酵素等を挙げることができる。但し、これらに限定する意図はない。上記のように45℃以上の温度におていは、常温で使用されるタイプのSuperscript IIのような逆転写酵素は、至適温度における酵素活性に比べて低い活性しか示さず、一定温度以上ではほとんど活性を示さなくなる。また、50℃で一定時間以上高い温度に放置すると、室温に戻しても活性を示さなくなる。
【0021】特に、mRNAの鎖長が長い場合、酵素の熱失活のため合成途中で逆転写が停止する確率が高く、全長の転写を困難にする。そこで、本発明では、昇温下においても逆転写酵素が活性を維持できる(活性の低下の防止と熱による失活の防止ができる)ことを目的として、上記逆転写の系にシャペロン作用のある物質を共存させる。
【0022】ここでシャペロン作用を有する物質としては、糖類、アミノ酸、多価アルコール及びそれらの誘導体、並びにシャペロンタンパク質を挙げることができる。但し、これらに限定されるものではなく、シャペロン作用を有する物質であればよい。尚、本明細書において「シャペロン作用」とは、熱等によるストレスの為、変性したタンパク質を再生するか、またはネイティブの構造を保持させる為、熱によるタンパク質の完全変性を防止する作用を言う。
【0023】糖類として、例えば、オリゴ糖類や単糖類を挙げることができ、さらにその具体例として、例えば、トレハロース、マルトース、グルコース、スクロース、ラクトース、キシロビオース、アガロビオース、セロビオース、レバンビオース、キトビオース、2−β−グルクロノシルグルクロン酸、アロース、アルトロース、ガラクトース、グロース、イドース、マンノース、タロース、ソルビトール、レブロース、キシリトール及びアラビトール等を挙げることができる。但し、これらに限定する意図はない。上記糖類は、単独で用いても、2種以上を併用しても良い。尚、特に、トレハロース、ソルビトール、レブロース、キシリトール及びアラビトールは、シャペロン作用が強く、酵素の熱活性化の効果が著しい。
【0024】アミノ酸又はその誘導体として、 Ne −アセチル−β−リジン、アラニン、γ−アミノブチル酸、ベタイン、 Na −カルバモイル−L−グルタミン−1−アミド、コリン、ジメチルテチン、エコトイン、グルタメート、β−グルタミン、グリシン、オクトパイン、プロリン、サルコシン、タウリン及びトリメチルアミンN−オキシドを挙げることができる。上記アミノ酸類は、単独で用いても、2種以上を併用しても良い。尚、特に、ベタイン及びサルコシンは、シャペロン作用が強く、酵素の熱活性化の効果が著しい。
【0025】シャペロン作用を有する物質として多価アルコールを挙げることができる。上記糖類も多価アルコールではあるが、それ以外の多価アルコールの例としては、例えば、グリセロール、エチレングリコール、ポリエチレングリコール等を挙げることができる。上記多価アルコールは、単独で用いても、2種以上を併用しても良い。
【0026】さらに、シャペロン作用を有する物質としてシャペロンタンパク質を挙げることができ、シャペロンタンパク質としては耐熱性菌のシャペロンタンパク質やヒートウョックタンパク質、例えば、HSP60、HSP70、HSP90等を挙げることができる。上記シャペロンタンパク質は、単独で用いても、2種以上を併用しても良い。
【0027】これらシャペロン作用を有する物質は、その種類により、また酵素の種類により、酵素に対する最適安定化濃度が異なる。従って、シャペロン作用を有する物質の種類と酵素の種類に応じて、反応系に対する添加濃度を適宜決定することができる。また、シャペロン作用を有する物質の効果を補強するという観点から、上記1種または2種以上の糖類、アミノ酸またはシャペロンタンパク質にさらに、1種または2種以上の多価アルコールを併用することもできる。多価アルコールの例としては、例えば、グリセロール、エチレングリコール、ポリエチレングリコール等を挙げることができる。
【0028】本発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の第3の態様は、耐熱性逆転写酵素を用いて行うことを特徴とする。本発明において耐熱性逆転写酵素とは、約40℃を超える至適温度を有する酵素を言う。そのような耐熱性逆転写酵素の例として、Tth ポリメラーゼを挙げることができる。但し、これに限定される意図はない。Tth ポリメラーゼは至適温度が70℃であり、上記45℃以上の温度において高い活性で逆転写を行うことができる。
【0029】本発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の第4の態様は、前記逆転写を前記逆転写酵素の活性化に必要な金属イオンの存在下で行うに際して、前記金属イオンに対するキレート剤を存在させることを特徴とする。酵素は活性化のため金属イオンを必要とすることがあり、例えば、逆転写酵素であるSuperscript IIは、活性化のため、金属イオンとしてマグネシウムイオンを必要とする。ところが、上記のような温度条件下のマグネシウムイオンを含む緩衝液、例えば、トリス(Tris)緩衝液中では、mRNAの切断が進み、完全長のcDNAを得ることが困難である。同様に、Tth ポリメラーゼは、活性化のため、金属イオンとしてマンガンイオンを必要とする。ところが、マンガンイオンを含む緩衝液、例えば、トリス(Tris)緩衝液中、上記のような温度条件下で逆転写反応を行うと、mRNAの切断が極めて進み、完全長のcDNAを得ることが困難である。
【0030】それに対して、本発明の方法では、逆転写酵素の活性は維持しながら、かつmRNAの切断を阻止できる方法として、金属イオンに対するキレート剤を存在させる。但し、逆転写酵素の活性化のための金属イオンを完全にキレートしてしまうと逆転写酵素が活性を示さなくなるので、キレート力の比較的弱いキレート剤を用いることが適当である。キレート力の比較的弱いキレート剤としては、例えば、デオキシヌクレオチド トリフォスフェート(dNTP)を挙げることができる。キレート力の比較的弱いキレート剤は、金属イオンに対して当モル数前後の濃度を用いることが適当である。
【0031】キレート剤としてデオキシヌクレオチド トリフォスフェートを使用する場合は、金属イオンに対して当モル数前後を添加することが適当である。従って、キレート剤の添加量は、対象となる金属イオンに対するキレート力を考慮して、逆転写酵素活性は維持でき、かつmRNAの切断も阻止できる量を適宜決定できる。尚、デオキシヌクレオチド トリフォスフェートはdATP、dGTP、dCTP、dTTPのいずれか1種を使用しても或いは2種以上を併用してもよい。また、dATP、dGTP、dCTP、dTTPの4種を併用しても良い。しかもこれらは全て逆転写の基質としての役割も果たす為、4種を併用することが通常である。
【0032】発明のmRNAからcDNAを逆転写酵素を用いて調製する方法の好ましい、しかし非限定的な態様は、
【0033】
【実施例】以下、実施例に基づいて本発明について詳細に説明する。
参考例1金属イオン含有バッファーにおけるmRNAの安定性(dNTPの付加)バッファー(50mM Tris pH8.3, 3mM MgCl2)に幾つかの添加剤を添加した場合のRNA の安定性について検討するため、トータルリバー(Total Liver)RNAを用い、下記の組成のバッファー中でインキュベーションした。
【0034】
【表1】

【0035】インキュベーション後のRNA の切断を見る為に検体をSambrookらが記載しているRNA アガロースゲル泳動に供した(Molecular Cloning, The second editionpp 7.43-7.45)。ゲルはエチジウムプロマイドで染め、RNA の切断の程度の評価はリポゾームRNA のバンドの相対的強度を比較することにより評価した。アガロースゲル泳動の結果(レーン1〜7)を図1に示す。
【0036】レーン1に示すように、高濃度フリーのマグネシウムイオン(フリー Mg2+ )の下、つまりRNA を50mM Tris pH8.3, 3mM MgCl2 15%(v/v) グリセロールでインキュベーションしたときには、グリセロールはRNA を切断から守るのに十分働かなかった。事実、切断の程度は50mM Tris pH8.3, 3mM MgCl2、グリセロール非存在下で処理したもの(レーン2)と同程度であった。レーン3に示すように、50mM Tris pH8.3, 3mM MgCl2, 2mM dNTPで処理してもRNA の切断を十分には防ぎ切れなかった。一方、レーン4に示すように、50mM Tris pH8.3, 3mM MgCl2, 3mM dNTP(NTPとMg2+は同一モル濃度) の条件下ではRNA の切断を部分的に防止することができた。
【0037】さらに、レーン5に示すように、50mM Tris pH8.3, 3mM MgCl2, 4mM dNTPの存在下、つまりMg2+よりNTP が 1mM多く含まれている条件下では、RNA は非常に安定であったが、この条件下では逆転写酵素の活性が下がるという結果を得ている。そこで、レーン6に示すように、50mM Tris pH8.3, 3mM MgCl2, 3mM dNTP (NTP とMg2+は同一モル濃度) に15%グリセロールを加えると、RNA は切断を受けなかった。また、この条件下では逆転写酵素活性は完全に保たれることが別の実験から明らかになった。レーン6で使用した条件下ではRNA の安定性は、レーン7に示す滅菌水の安定性と殆ど変わらなかった。
【0038】実施例1逆転写酵素の耐熱化による逆転写効率の向上上記レーン6で使用した新しい条件下において、逆転写活性を見る為、T7 RNAポリメラーゼでin vitro転写されたRNA を鋳型RNA として用い、それからcDNAを合成し、その産物に関して評価した。T7 RNAポリメラーゼでin vitro転写されたRNA は、制限酵素NotIによる切断により直線状に開裂したpBluescript II SK をT7 RNAポリメラーゼでin vitro転写することにより調製した。この反応はpBluescript II SK の使用説明に書いてあるT7プロモーターから開始される。in vitroで転写されたRNA を鋳型にして変性ゲル電気泳動を用いると、逆転写反応の効率を各々の検体で比較でき、また、早期の逆転写の終結や反応効率の減少を示す非特異的転写の終結を評価できる。
【0039】コントロールとして、逆転写の標準バッファーの条件は次のものを用いた。
50mM Tris-HCl pH8.3, 75mM KCl, 3mM MgCl2, 10mMジチオスレイトール, 各0.75mMdNTP (dATP, dGTP, dCTP, dTTP) 。
上記標準バッファーに 1μg 鋳型RNA, 400ngプライマー(20mer SK プライマー, CGCTCTAGAACTAGTGGATC), とsuperscript II 200unitを20μl に調整する。0.2 μl の [α-32P]dGTP を逆転写産物標識の為に用いた。その他の全ての基質を入れる前に、RNA とプライマーの混合検体は65℃にインキュベートされた。その後の反応は42℃1時間で実行した。反応産物は変性アガロース電気泳動法に供され、完全長cDNAの回収率と、短い不完全伸長による産物との割合を調べる為にオートラジオグフィで電気泳動パターンを調べた。結果を図2のレーン1に示す。尚、逆転写酵素superscript IIは、上記標準バッファー条件下では50℃以上の温度にすると失活した。
【0040】オリゴ糖類を添加すると酵素反応が安定化されることを示す為に、逆転写のバッファー条件を次のように設定した。
50mM Tris-HCl pH8.3, 75mM KCl, 3mM MgCl2, 10mM ジチオスレイトール, 各dNTP (dATP, dGTP, dCTP, dTTP) 0.75mM, 20 %(w/v) トレハロース、20%(v/v) グリセロール。
上記バッファーに 1μg 鋳型RNA, 400ngプライマー(20mer SK プライマー) と200unit のsuperscript IIを24μl の水溶液中で反応させた。0.2 μl の [α-32P]dGTP を逆転写産物標識の為に用いた。この条件下では逆転写酵素superscript IIは標準温度 (42℃) のコントロール反応より高い活性を有した。酵素活性はプライマーと鋳型RNA を37℃で2分間アニールした後、60℃で測定した。
【0041】反応産物は上記と同様に変性アガロース電気泳動法に供され、完全長cDNAの回収率と、短い不完全伸長による産物との割合を調べる為にオートラジオグフィで電気泳動パターンを調べた。結果を図2に示す。レーン1に示すように、標準バッファー42℃での条件下では、途中の特異的な部分で逆転写が止まった産物や非特異的に逆転写が停止した産物がみられる。レーン2に示すように、同じく42℃においては20%トレハロース20%グリセロールを加えてもこれらの途中で停止した産物は同様にみられた。レーン3に示すように、60℃に温度を上げると、途中で合成反応が停止した産物は極めて少なくなり、完全長が合成されている。レーン5に示すように、レーン3の条件にさらに0.125 μg/μl のBSAを加えると、更に酵素活性が安定化した。しかし、20%トレハロース20%グリセロールを添加せず、BSAのみでは酵素の耐熱化は十分ではなかった。レーン4に示すように、レーン3の条件にさらにtriton X100 を0.05%加えると、途中で停止した不完全逆転写反応物はさらに減少した。しかし、逆転写酵素全体の活性がやや低下した。
【0042】尚、レーン3で採用した条件と同様の条件で、但し、トレハロースの代わりにグルコースまたはマルトースを用いて電気泳動パターンを調べた結果、トレハロースを用いた場合と同様に途中で合成反応が停止した産物は極めて少なくなり、完全長が合成された。
【0043】mRNAを出発材料としたcDNA合成上記参考例及び実施例1で得られた知見から、ブァッファー条件として(50mMTris-HCl pH8.3, 75mM KCl, 3mM MgCl2, 10mMジチオスレイトール, dNTP 0.75mM それぞれ, 20 %(w/v) トレハロース、20%(v/v) グリセロール)を用いることで、mRNAを出発材料として高効率でcDNAを合成することが出来ることが明らかになった。尚、反応条件は、1μgの鋳型RNA 、400ng オリゴ dT (12-18) プライマーと200unit のsuperscript IIが [α-32P]dGTP 存在下で24μl 中とし、さらに、37℃でプライマーと鋳型RNA を2分間アニールしたのち60℃での反応とした。得られる第一鎖cDNAは、続いて完全長cDNAライブラリーの構築long RT-PCR に用いられる。
【0044】実施例2トレハロースの代わりにアラビトール、ソルビトール、レブロース、キシリトール又はベタインを用いた以外、実施例1におけるレーン3で採用した条件と同様の条件で逆転写を行い、産物の電気泳動パターンを調べた。その結果、実施例1のレーン3のトレハロースを用いた場合と同様に途中で合成反応が停止した産物は極めて少なくなり、完全長が合成された。
【図面の簡単な説明】
【図1】 参考例1で得られたアガロースゲル泳動結果を示す図面に代わる写真。
【図2】 実施例1で得られたアガロースゲル泳動結果を示す図面に代わる写真。
【特許請求の範囲】
【請求項1】 mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度で行うことを特徴とする方法。
【請求項2】 前記逆転写を45℃以上の温度で行う請求項1に記載の方法。
【請求項3】 前記逆転写を45〜90℃の温度で行う請求項2に記載の方法。
【請求項4】 前記逆転写を非耐熱性逆転写酵素を用い、かつシャペロン作用のある物質の存在下で行う請求項1〜3のいずれか1項に記載の方法。
【請求項5】 シャペロン作用を有する物質が糖類、アミノ酸、多価アルコール及びそれらの誘導体、並びにシャペロンタンパク質からなる群から選ばれる1種または2種以上の物質である請求項4に記載の方法。
【請求項6】 糖類が、トレハロース、マルトース、グルコース、スクロース、ラクトース、キシロビオース、アガロビオース、セロビオース、レバンビオース、キトビオース、2−β−グルクロノシルグルクロン酸、アロース、アルトロース、ガラクトース、グロース、イドース、マンノース、タロース、ソルビトール、レブロース、キシリトール及びアラビトールからなる群から選ばれる少なくとも1種の糖である請求項5に記載の方法。
【請求項7】 糖類がトレハロース、ソルビトール、レブロース、キシリトール又はアラビトールである請求項5に記載の方法。
【請求項8】 アミノ酸またはその誘導体が Ne −アセチル−β−リジン、アラニン、γ−アミノブチル酸、ベタイン、 Na −カルバモイル−L−グルタミン−1−アミド、コリン、ジメチルテチン、エコトイン、グルタメート、β−グルタミン、グリシン、オクトパイン、プロリン、サルコシン、タウリン及びトリメチルアミンN−オキシドからなる群から選ばれる請求項5に記載の方法。
【請求項9】 アミノ酸またはその誘導体がベタイン又はサルコシンである請求項5に記載の方法。
【請求項10】 シャペロンタンパク質が耐熱性菌のシャペロンタンパク質またはヒートショックタンパク質である請求項5に記載の方法。
【請求項11】 前記逆転写を1種または2種以上のシャペロン作用を有する物質と1種または2種以上の多価アルコールの共存下で行う、請求項4〜10のいずれか1項に記載の方法。
【請求項12】 前記逆転写を耐熱性逆転写酵素を用いて行う請求項1〜3のいずれか1項に記載の方法。
【請求項13】 耐熱性逆転写酵素がTth ポリメラーゼである請求項12に記載の方法。
【請求項14】 前記逆転写を前記逆転写酵素の活性化に必要な金属イオンの存在下で行うに際して、前記金属イオンに対するキレート剤を存在させる請求項1〜13のいずれか1項に記載の方法。
【請求項15】 金属イオンがマグネシウムイオンまたはマンガンイオンである請求項14に記載の方法。
【請求項16】 キレート剤が1種または2種以上のデオキシヌクレオチド トリフォスフェートである請求項14またば15に記載の方法。
【請求項1】 mRNAからcDNAを逆転写酵素を用いて調製する方法であって、前記逆転写をmRNAが2次構造を取らない温度で行うことを特徴とする方法。
【請求項2】 前記逆転写を45℃以上の温度で行う請求項1に記載の方法。
【請求項3】 前記逆転写を45〜90℃の温度で行う請求項2に記載の方法。
【請求項4】 前記逆転写を非耐熱性逆転写酵素を用い、かつシャペロン作用のある物質の存在下で行う請求項1〜3のいずれか1項に記載の方法。
【請求項5】 シャペロン作用を有する物質が糖類、アミノ酸、多価アルコール及びそれらの誘導体、並びにシャペロンタンパク質からなる群から選ばれる1種または2種以上の物質である請求項4に記載の方法。
【請求項6】 糖類が、トレハロース、マルトース、グルコース、スクロース、ラクトース、キシロビオース、アガロビオース、セロビオース、レバンビオース、キトビオース、2−β−グルクロノシルグルクロン酸、アロース、アルトロース、ガラクトース、グロース、イドース、マンノース、タロース、ソルビトール、レブロース、キシリトール及びアラビトールからなる群から選ばれる少なくとも1種の糖である請求項5に記載の方法。
【請求項7】 糖類がトレハロース、ソルビトール、レブロース、キシリトール又はアラビトールである請求項5に記載の方法。
【請求項8】 アミノ酸またはその誘導体が Ne −アセチル−β−リジン、アラニン、γ−アミノブチル酸、ベタイン、 Na −カルバモイル−L−グルタミン−1−アミド、コリン、ジメチルテチン、エコトイン、グルタメート、β−グルタミン、グリシン、オクトパイン、プロリン、サルコシン、タウリン及びトリメチルアミンN−オキシドからなる群から選ばれる請求項5に記載の方法。
【請求項9】 アミノ酸またはその誘導体がベタイン又はサルコシンである請求項5に記載の方法。
【請求項10】 シャペロンタンパク質が耐熱性菌のシャペロンタンパク質またはヒートショックタンパク質である請求項5に記載の方法。
【請求項11】 前記逆転写を1種または2種以上のシャペロン作用を有する物質と1種または2種以上の多価アルコールの共存下で行う、請求項4〜10のいずれか1項に記載の方法。
【請求項12】 前記逆転写を耐熱性逆転写酵素を用いて行う請求項1〜3のいずれか1項に記載の方法。
【請求項13】 耐熱性逆転写酵素がTth ポリメラーゼである請求項12に記載の方法。
【請求項14】 前記逆転写を前記逆転写酵素の活性化に必要な金属イオンの存在下で行うに際して、前記金属イオンに対するキレート剤を存在させる請求項1〜13のいずれか1項に記載の方法。
【請求項15】 金属イオンがマグネシウムイオンまたはマンガンイオンである請求項14に記載の方法。
【請求項16】 キレート剤が1種または2種以上のデオキシヌクレオチド トリフォスフェートである請求項14またば15に記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開平10−84961
【公開日】平成10年(1998)4月7日
【国際特許分類】
【出願番号】特願平9−198201
【出願日】平成9年(1997)7月24日
【出願人】(000006792)理化学研究所 (14)
【公開日】平成10年(1998)4月7日
【国際特許分類】
【出願日】平成9年(1997)7月24日
【出願人】(000006792)理化学研究所 (14)
[ Back to top ]

