改良型ハロヒドリンエポキシダーゼ
【課題】立体選択性、生成物阻害耐性等が向上した改良型ハロヒドリンエポキシダーゼ得ることができるとともに、これらを利用して光学活性なエピハロヒドリンまたは4−ハロ−3−ヒドロキシブチロニトリルを効率よく製造する方法を提供する。
【解決手段】特定の配列で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第2番目のAlaがLysに置換され、且つ、第128番目のAlaがCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼを用いる。
【解決手段】特定の配列で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第2番目のAlaがLysに置換され、且つ、第128番目のAlaがCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼを用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、改良型ハロヒドリンエポキシダーゼ及びその製造方法に関する。
【背景技術】
【0002】
ハロヒドリンエポキシダーゼは、ハロヒドリンハイドロゲンハライドリアーゼ、ハロヒドリンデハロゲナーゼまたはハロアルコールデハロゲナーゼとも称され、1,3−ジハロ−2−プロパノールをエピハロヒドリンに変換する活性及びその逆反応を触媒する活性を有する酵素(EC number:4.5.1.−)である。ハロヒドリンエポキシダーゼは、アミノ酸配列の相同性等から、3つのアイソザイム(A型、B型、C型)が存在することが知られている(非特許文献1:J.Bacteriology,183(17),5058−5066,2001)。A型ハロヒドリンエポキシダーゼとして、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheA(非特許文献2:Biosci.Biotechnol.Biochem.,58(8),1451−1457,1994)、アースロバクター属(Arthrobacter sp.)AD2株由来のHheA AD2(非特許文献1)、アースロバクター属(Arthrobacter sp.)PY1株由来のDeh−PY1(非特許文献3:J.Health.Sci.,50(6),605−612,2004)等が知られている。また、B型ハロヒドリンエポキシダーゼとして、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(非特許文献2)、マイコバクテリウム属(Mycobacterium sp.)GP1株由来のHheB GP1(非特許文献1)、アースロバクター エリシー(Arthrobacter erithii)H10a株由来のDehA(非特許文献4:Enz.Microbiol.Technol.,22,568−574,1998)等が知られている。そして、C型ハロヒドリンエポキシダーゼとして、アグロバクテリウム ラジオバクター(Agrobacterium radiobacter)DH094株由来のHheC(特許文献1:特開平10−210981号公報)、アグロバクテリウム ラジオバクター(Agrobacterium radiobacter)AD1株由来のHheC(非特許文献1)、アグロバクテリウム チュメファシエンス(Agrobacterium tumefaciens)由来のHalB(非特許文献5:Thesis(1996)University of Wales,Cardiff,United Kingdom)等が知られている。
【0003】
エピハロヒドリンは種々の医薬品や生理活性物質の合成原料として有用な物質である。例えば、(R)−エピハロヒドリンの開環シアノ化によって得られる(R)−4−ハロ−3−ヒドロキシブチロニトリルは、L−カルニチンの合成原料として有用であることが知られている(特許文献2:特開昭57−165352号公報)。少なくとも一部のハロヒドリンエポキシダーゼについては、上述した1,3−ジハロ−2−プロパノールをエピハロヒドリンに変換する活性及びその逆反応を触媒する活性に加え、シアン化合物の存在下にエピハロヒドリンを開環シアノ化して4−ハロ−3−ヒドロキシブチロニトリルを生成する反応を触媒することが明らかになっており、その反応を利用した例として、1,3−ジハロ−2−プロパノールから光学活性4−ハロ−3−ヒドロキシブチロニトリルを製造する方法(特許文献3:特開平3−053889号公報、特許文献4:特開2001−25397号公報)及びエピハロヒドリンから光学活性4−ハロ−3−ヒドロキシブチロニトリルを製造する方法(特許文献5:特開平3−053890号公報)が知られている。
【0004】
ところで、近年の遺伝子工学技術の進歩により、酵素タンパク質の構成アミノ酸の1個以上を欠失、付加または挿入させるか、あるいは他のアミノ酸で置換した変異体を意図的に作製することが可能となっている。これら変異体は、該変異の種類によっては、変異の導入されていない酵素と比較して、活性、安定性、有機溶媒耐性、耐熱性、耐酸性、耐アルカリ性、基質特異性、立体選択性等の性能が向上することが知られている。これら性能の向上は、活性あたりの酵素触媒製造コスト低減、酵素触媒の安定化、反応工程の簡略化、反応収率の向上等を通じて、酵素反応を利用した工業的生産における大幅な生産コスト低減をもたらすことがある。従って、多くの酵素において様々な性能が向上した有用な改良酵素の創製が行われている。ハロヒドリンエポキシダーゼにおいても、構成アミノ酸の1個以上を欠失、付加、挿入、または他のアミノ酸で置換した変異体の報告がなされている。例えば、特許文献6(米国特許出願公開第2005/0272064号明細書)には、アグロバクテリウム ラジオバクター(Agrobacterium radiobacter)AD1株由来のHheCの変異体570種類及びコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBの変異体1種類が記載されている。また、特許文献7(米国特許出願公開第2006/0099700号明細書)には、アグロバクテリウム ラジオバクター(Agrobacterium radiobacter)AD1株由来のHheCの変異体1422種類及びコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBの変異体1種類が記載されている。これらのうちのいくつかの変異体については、エチル(R)−4−クロロ−3−ヒドロキシブチレイトからエチル(S)−4−シアノ−3−ヒドロキシブチレイトへの変換反応における活性が向上したことが示されている。さらに、特許文献8(国際公開第2008/108466号パンフレット)には、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBの変異体22株が記載されている。これらのうちのいくつかの変異体については、形質転換体当たりのハロヒドリンエポキシダーゼ活性が向上したことが示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−210981号公報
【特許文献2】特開昭57−165352号公報
【特許文献3】特開平3−053889号公報
【特許文献4】特開2001−25397号公報
【特許文献5】特開平3−053890号公報
【特許文献6】米国特許出願公開第2005/0272064号明細書
【特許文献7】米国特許出願公開第2006/0099700号明細書
【特許文献8】国際公開第2008/108466号パンフレット
【非特許文献】
【0006】
【非特許文献1】J.Bacteriol.,183(17),5058−5066,2001
【非特許文献2】Biosci.Biotechnol.Biochem.,58(8),1451−1457,1994
【非特許文献3】J.Health.Sci.,50(6),605−612,2004
【非特許文献4】Enz.Microbiol.Technol.,22,568−574,1998
【非特許文献5】Thesis(1996)University of Wales, Cardiff, United Kingdom
【発明の概要】
【発明が解決しようとする課題】
【0007】
ハロヒドリンエポキシダーゼを工業的に利用する場合には、酵素触媒として更なる高度化が望まれる。例えば、光学活性な4−ハロ−3−ヒドロキシブチロニトリルの製造を目的とする場合、既知のハロヒドリンエポキシダーゼにより製造される4−ハロ−3−ヒドロキシブチロニトリルの光学純度は必ずしも十分に高いものではない。従って、より光学純度の高い4−ハロ−3−ヒドロキシブチロニトリルを生成するような、立体選択性が向上したハロヒドリンエポキシダーゼが望まれる。また、1,3−ジハロ−2−プロパノールを出発原料としてハロヒドリンエポキシダーゼにより4−ハロ−3−ヒドロキシブチロニトリルの製造を行う場合、生成物(ハロゲン化物イオン及び4−ハロ−3−ヒドロキシブチロニトリル)の阻害による反応速度の低下が生じうる。従って、生成物阻害を受け難いハロヒドリンエポキシダーゼが望まれる。
【0008】
そこで、本発明の目的は、これら課題を解決しうるハロヒドリンエポキシダーゼ、及びその製造方法、ならびにそれを用いたエピハロヒドリンまたは4−ハロ−3−ヒドロキシブチロニトリルの製造方法を提供することにある。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために鋭意研究を行った。その結果、野生型ハロヒドリンエポキシダーゼのアミノ酸配列、特にB型アイソザイムに分類される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、結晶構造解析を行った結果、ハロヒドリンエポキシダーゼのアミノ酸配列のうち、所定位置のアミノ酸残基のいずれかまたは全部を他のアミノ酸に置換することにより、形質転換体あたりのハロヒドリンエポキシダーゼ活性、立体選択性、生成物阻害耐性、生成物蓄積能等の属性が向上した改良型ハロヒドリンエポキシダーゼを創出できることを見出し、本発明を完成するに至った。
すなわち、本発明は以下の通りである。
(1)以下のアミノ酸配列I:
S−α1−α2−α3−α4−α5−α6−α7−α8−α9−α10−α11−α12−Y−α13−α14−A−R−α15(配列番号15)
(SはSer残基、YはTyr残基、AはAla残基、RはArg残基を表し、α1〜α15はそれぞれ独立して同一のまたは異なる任意のアミノ酸残基を表す。)
を含む野生型ハロヒドリンエポキシダーゼのアミノ酸配列に対して、開始アミノ酸残基(通常はMet残基)より1残基C末端側のアミノ酸残基がLysに置換され、且つ、α10残基が他のアミノ酸に置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
(2)α10残基におけるアミノ酸変異がCys,Gln,Ile,MetまたはValである、(1)に記載の改良型ハロヒドリンエポキシダーゼ。
(3)野生型ハロヒドリンエポキシダーゼが、グループBに分類されるものである、(1)または(2)に記載の改良型ハロヒドリンエポキシダーゼ。
(4)野生型ハロヒドリンエポキシダーゼが、コリネバクテリウム(Corynebacterium)属細菌またはマイコバクテリウム(Mycobacterium)属細菌由来のものである、(1)〜(3)のいずれかに記載の改良型ハロヒドリンエポキシダーゼ。
(5)(1)〜(4)のいずれかに記載の改良型ハロヒドリンエポキシダーゼをコードする遺伝子。
(6)(5)に記載の遺伝子を含む組換えベクター。
(7)(6)に記載の組換えベクターを宿主に導入してなる形質転換体または形質導入体。
(8)(7)に記載の形質転換体または形質導入体を培養して得られる培養物。
(9)(8)に記載の培養物から改良型ハロヒドリンエポキシダーゼを採取することを特徴とする、改良型ハロヒドリンエポキシダーゼの製造方法。
(10)(1)〜(4)のいずれかに記載の改良型ハロヒドリンエポキシダーゼ及び/または(8)に記載の培養物を、1,3−ジハロ−2−プロパノールと接触させることによりエピハロヒドリンを生成させることを特徴とする、エピハロヒドリンの製造方法。
(11)(1)〜(4)のいずれかに記載の改良型ハロヒドリンエポキシダーゼ及び/または(8)に記載の培養物を、シアン化合物存在下、1,3−ジハロ−2−プロパノールまたはエピハロヒドリンと接触させることにより4−ハロ−3−ヒドロキシブチロニトリルを生成させることを特徴とする、4−ハロ−3−ヒドロキシブチロニトリルの製造方法。
(12)配列番号1で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第2番目のAlaがLysに置換され、且つ、第128番目のAlaが他のアミノ酸に置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
(13)配列番号2で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第136番目のAlaが他のアミノ酸に置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
(14)配列番号1で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第2番目のAlaがLysに置換され、且つ、第128番目のAlaがCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
(15)配列番号2で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第136番目のAlaがCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
【発明の効果】
【0010】
本発明によれば、立体選択性、生成物阻害耐性等が向上した改良型ハロヒドリンエポキシダーゼ得ることができるとともに、これらを利用して光学活性なエピハロヒドリンまたは4−ハロ−3−ヒドロキシブチロニトリルを効率よく製造することができる。
【図面の簡単な説明】
【0011】
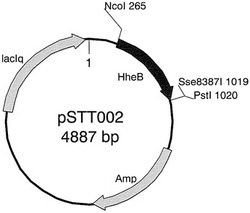
【図1】プラスミドpSTT002を示す図である。
【発明を実施するための形態】
【0012】
以下に本発明の実施の形態について説明するが、本実施の形態は、本発明を説明するための例示であり、本発明をこの実施の形態にのみ限定する趣旨ではない。本発明は、その要旨を逸脱しない限り、さまざまな形態で実施をすることができる。
【0013】
1.ハロヒドリンエポキシダーゼ
(1)野生型ハロヒドリンエポキシダーゼ
「野生型ハロヒドリンエポキシダーゼ」とは、自然界の生物より分離され得るハロヒドリンエポキシダーゼを指し、由来は限定されるものではない。また、当該酵素を構成するアミノ酸配列において、意図的または非意図的なアミノ酸の欠失または他のアミノ酸による置換もしくは挿入がなく、天然由来の属性を保持したままのハロヒドリンエポキシダーゼを意味する。
【0014】
さらに、本発明において用いる野生型ハロヒドリンエポキシダーゼは、以下のアミノ酸配列I(19アミノ酸残基):
S−α1−α2−α3−α4−α5−α6−α7−α8−α9−α10−α11−α12−Y−α13−α14−A−R−α15(配列番号15)
(SはSer残基、YはTyr残基、AはAla残基、RはArg残基を表し、α1〜α15はそれぞれ独立して同一のまたは異なる任意のアミノ酸残基を表す。)を含むアミノ酸配列からなる。野生型ハロヒドリンエポキシダーゼが、アミノ酸配列Iを含むアミノ酸配列からなるものであるか否かは、公共の配列データベース、例えば、米国生物工学情報センター(NCBI;National Center for Biotechnology Information)により提供されるGenBankデータベース(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?CMD=search&DB=protein)においてハロヒドリンエポキシダーゼとして登録されているものを検索し、該当したもののアミノ酸配列中に、上記アミノ酸配列Iが含まれるか否かを調べればよい。必要に応じて、遺伝子情報解析用ソフトウェアを用いて検索を行うことができる。また、公知文献で野生型ハロヒドリンエポキシダーゼのアミノ酸配列について記載されているものがあればそれを参考にしてもよい。例えば、J.Bacteriology,183(17),5058−5066,2001に記載されている各種野生型ハロヒドリンエポキシダーゼアミノ酸配列のアラインメント定法を参考にすることで、アミノ酸配列Iが含まれるか否か、および全アミノ酸配列中のどの位置に含まれるかを知ることができる。なお、アミノ酸配列IにおけるSer残基、Tyr残基、Arg残基およびAla残基は、既知の各種野生型ハロヒドリンエポキシダーゼのアミノ酸配列において高度に保存されている。
【0015】
野生型ハロヒドリンエポキシダーゼは、アミノ酸配列の相同性等から、3つのアイソザイム(A型、B型、C型)に大別されることが知られている(J.Bacteriology,183(17),5058−5066,2001)。本発明において用いる野生型ハロヒドリンエポキシダーゼは、B型に属するものが好ましい。
【0016】
B型に分類されるハロヒドリンエポキシダーゼ (「HheB」ともいう) としては、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(Biosci.Biotechnol.Biochem.,58(8),1451,1994)、マイコバクテリウム属(Mycobacterium sp.)GP1株由来のHheB GP1(J.Bacteriology,183(17),5058−5066,2001)、アースロバクター エリシー(Arthrobacter erithii)H10a株由来のDehA(Enz.Microbiol.Technol.,22,568−574,1998)等が挙げられる。中でも、コリネバクテリウム属、マイコバクテリウム属のものが、好ましい。
【0017】
これらハロヒドリンエポキシダーゼのうち、アミノ酸配列が明らかにされているものについては、米国生物工学情報センター(NCBI; National Center for Biotechnology Information)により提供されるGenBankデータベース(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?CMD=search&DB=protein)において、以下のAccession No.により登録されている。
「Accession No.BAA14362」:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBのアミノ酸配列、
「Accession No.AAK73175」:マイコバクテリウム属(Mycobacterium sp.)GP1株由来のHheB GP1のアミノ酸配列。
【0018】
本発明において、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のハロヒドリンエポキシダーゼのアミノ酸配列(HheB)については、その遺伝子(HHEB)が2つの開始コドンを有するため、結果的に、N末端近傍の8アミノ酸残基の有無のみが異なる2種のハロヒドリンエポキシダーゼが存在することが報告されている(Biosci.Biotechnol.Biochem.,58(8),1451−1457,1994)。本発明において、両者(上記2種のハロヒドリンエポキシダーゼ)を区別して称するときは、最初の開始コドンから翻訳されたアミノ酸配列(配列番号2)からなるHheBを「HheB(1st)」と称し、2番目の開始コドン (次に登場するメチオニン)から翻訳されたアミノ酸配列(配列番号1)からなるHheBを「HheB(2nd)」と称することとし、これらはいずれも野生型ハロヒドリンエポキシダーゼであるものとする。
【0019】
本明細書においては、主にコリネバクテリウム属(Corynebacterium sp.)N−1074株由来の野生型ハロヒドリンエポキシダーゼHheBを例に挙げて説明するが、前述のように、ハロヒドリンエポキシダーゼの由来は限定されず、HheB以外のハロヒドリンエポキシダーゼであっても前記アミノ酸配列Iを含むアミノ酸配列からなるものであれば、同様の説明が適用され得る。また、本発明で示した変異の位置または変異するアミノ酸種若しくは塩基配列を操作することによって、いずれの改良型ハロヒドリンエポキシダーゼを得ることもできる。なお、本発明において、「高い相同性」というときは、例えば60%以上の相同性をいい、好ましくは75%以上の相同性であり、特に好ましくは90%以上の相同性をいう。
【0020】
(2)改良型ハロヒドリンエポキシダーゼ
本発明者は、配列番号1に示すアミノ酸配列からなる野生型ハロヒドリンエポキシダーゼの結晶構造を解析し、その結果から、配列番号1に示すアミノ酸配列のうち前述したアミノ酸配列I(配列番号15)中のα10アミノ酸残基(Ala)がHheBの立体選択性及び基質認識に重要である点を見出し、本発明における改良型ハロヒドリンエポキシダーゼの変異導入部位を特定した。すなわち、本発明における「改良型ハロヒドリンエポキシダーゼ」は、主として遺伝子組換え技術を利用して、野生型ハロヒドリンエポキシダーゼに含まれるアミノ酸配列I(配列番号15)に対してα10アミノ酸残基について置換変異が導入されたアミノ酸配列からなるものであり、立体選択性、生成物蓄積能等が向上したハロヒドリンエポキシダーゼである。
【0021】
本発明における改良型ハロヒドリンエポキシダーゼには、基質1,3−ジハロ−2−プロパノールまたはエピハロヒドリンから、エピハロヒドリンまたは4−ハロ−3−ヒドロキシブチロニトリルを生成させた場合の該生成物の光学純度が、野生型ハロヒドリンエポキシダーゼにより同基質から同生成物を生成させた場合の該生成物の光学純度よりも高くなるという属性を有するものが含まれる。すなわち、基質である1,3−ジハロ−2−プロパノール及び/またはエピハロヒドリンに対する立体選択性が、野生型ハロヒドリンエポキシダーゼよりも向上しているものが含まれる。立体選択性向上の本質的な原因としては、アミノ酸置換変異に起因するものであれば如何なるものでもよい。
【0022】
本発明において、「光学活性」とは、一方の鏡像異性体が他方の鏡像異性体よりも多く含まれている物質の状態、またはいずれか一方の鏡像異性体のみから成っている物質の状態を言う。また、「光学純度」とは、「鏡像異性体過剰率(%e.e.)」にほぼ等しいものであるとし、次式で定義する。
【0023】
光学純度≒鏡像異性体過剰率=100×(|[R]−[S]|)/([R]+[S]) (%e.e.)
【0024】
ここで、[R]及び[S]は試料中の鏡像異性体のそれぞれの濃度を示す。また、本発明において、「立体選択性」とは、ハロヒドリンエポキシダーゼが、基質から生成物を生成する際に、いずれか一方の鏡像異性体が生成する反応を優先的に触媒する性質を言う。
【0025】
本発明の改良型ハロヒドリンエポキシダーゼは、具体的には、前述したアミノ酸配列Iを含む野生型ハロヒドリンエポキシダーゼのアミノ酸配列に対して以下のアミノ酸変異が導入されたアミノ酸配列からなるタンパク質である;
【0026】
(a)開始アミノ酸残基より1残基C末端側のアミノ酸残基がLysに置換され、且つ、アミノ酸配列I中のα10残基が、他のアミノ酸に置換されたアミノ酸変異。
【0027】
なお、上記(a)において「開始アミノ酸残基」とは、野生型ハロヒドリンエポキシダーゼを遺伝子(DNAまたはmRNA)中の翻訳開始コドンがコードするアミノ酸に対応するアミノ酸残基を意味する。すなわち、翻訳後の野生型ハロヒドリンエポキシダーゼのアミノ酸配列におけるN末端アミノ酸残基(通常はMet残基)を意味する。
【0028】
上記(a)で表されるタンパク質のアミノ酸変異は、野生型ハロヒドリンエポキシダーゼのアミノ酸配列において最もN末端側に位置する開始アミノ酸残基(通常はMet残基)を1番目と定義したときに、当該開始アミノ酸残基からC末端側に向かって何番目のアミノ酸残基におけるアミノ酸変異であるかによっても特定することができる。例えば、野生型ハロヒドリンエポキシダーゼが、配列番号1に示されるアミノ酸配列からなるコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)である場合は、(a)における「開始アミノ酸残基より1残基C末端側のアミノ酸残基」、および「α10残基」は、それぞれ「2番目のアミノ酸残基(Ala残基)」および「128番目のAla残基」に該当する。また、野生型ハロヒドリンエポキシダーゼが、配列番号2に示されるアミノ酸配列からなるコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)である場合は、(a)における「開始アミノ酸残基より1残基C末端側のアミノ酸残基」、および「α10残基」は、それぞれ「2番目のアミノ酸残基(Ala残基)」および「136番目のAla残基」に該当する。また、しかし、HheB(2nd)は、HheB(1st)のアミノ酸配列におけるN末端近傍の8アミノ酸残基が欠失したアミノ酸配列からなるタンパク質に過ぎず、HheB(1st)及びHheB(2nd)の両アミノ酸配列における各アミノ酸残基の絶対的役割は実質的に同一である。
【0029】
本発明の改良型ハロヒドリンエポキシダーゼの好ましい態様としては、例えば、以下のアミノ酸変異が導入されたアミノ酸配列からなるものが挙げられる;
【0030】
(b)開始アミノ酸残基より1残基C末端側のアミノ酸残基がLysに置換され、且つ、アミノ酸配列I中のα10残基が、他のアミノ酸としてCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異。
【0031】
ここで、上記(b)のアミノ酸変異は、前述した(a)のアミノ酸変異の具体的態様を例示したもの(詳しくは「他のアミノ酸」の具体例を示したもの)である。
【0032】
そのため、前述した(a)の場合と同様に、上記(b)における「開始アミノ酸残基より1残基C末端側のアミノ酸残基」および「α10残基」は、それぞれ野生型ハロヒドリンエポキシダーゼアミノ酸配列において最もN末端側に位置するアミノ酸残基(通常はMet残基)を1番目と定義したときに、当該開始アミノ酸残基からC末端側に向かって何番目のアミノ酸残基であるかによっても特定することができる。すなわち、例えば野生型ハロヒドリンエポキシダーゼが配列番号1に示されるアミノ酸配列からなるコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)である場合は、上記(b)のアミノ酸変異の態様は、以下のように特定することができる。
【0033】
(b)2番目のアミノ酸残基(Ala残基)がLysに置換され、且つ、128番目のアミノ酸残基(Ala残基)が、他のアミノ酸としてCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異。
【0034】
また、野生型ハロヒドリンエポキシダーゼが配列番号2に示されるアミノ酸配列からなるコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)である場合は、上記(b)のアミノ酸変異の態様は、以下のように特定することができる。
【0035】
(b)2番目のアミノ酸残基(Ala残基)がLysに置換され、且つ、136番目のアミノ酸残基(Ala残基)が、他のアミノ酸としてCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異。
【0036】
本発明における改良型ハロヒドリンエポキシダーゼは、上記(a)、好ましくは(b)より選択されるアミノ酸変異を有するアミノ酸配列からなるものであればよい。
【0037】
本発明における「改良型ハロヒドリンエポキシダーゼ」のさらに具体的且つ好ましい態様としては、野生型ハロヒドリンエポキシダーゼが、配列番号1に示されるアミノ酸配列を有するコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)である場合は、配列番号16〜20に示されるアミノ酸配列を有する改良型ハロヒドリンエポキシダーゼが挙げられる。また、野生型ハロヒドリンエポキシダーゼが、配列番号2に示されるアミノ酸配列を有するコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)である場合は、配列番号21〜25に示されるアミノ酸配列を有する改良型ハロヒドリンエポキシダーゼが挙げられる。
【0038】
なお、本発明において、アミノ酸の種類を3文字または1文字のアルファベット表記で表すことがある。さらに、数字の前または前後に、3文字または1文字のアルファベットを配して表記することがあり、この場合は、アミノ酸残基の箇所及び置換前後のアミノ酸の種類を表す。すなわち、数字は、特に断りがない限り、上述したように、翻訳開始コドンによりコードされるアミノ酸残基(通常はメチオニン)を1番目と定義した場合に、何番目のアミノ酸残基であるかを示すものである。また、数字の前に表示した3文字または1文字のアルファベットは、アミノ酸置換前のアミノ酸の3文字または1文字表記を表し、数字の後に表示した3文字または1文字のアルファベットは、アミノ酸置換が生じた場合の置換後のアミノ酸の3文字または1文字表記を表すものとする。例えば、128番目のアラニン残基は「Ala128」または「A128」と表記し、128番目のアラニン残基がバリンに置換された場合は「Ala128Val」または「A128V」と表記することがある。
【0039】
2.ハロヒドリンエポキシダーゼ活性
本発明において、「ハロヒドリンエポキシダーゼ活性」とは、1,3−ジハロ−2−プロパノールをエピハロヒドリンに変換する活性及びその逆反応を触媒する活性を意味する。1,3−ジハロ−2−プロパノールは、下記一般式(1)で示される化合物である。
【0040】
【化1】

(式中、X1及びX2は、それぞれ独立して同一のまたは異なるハロゲン原子を表す。)
【0041】
ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的には1,3−ジフルオロ−2−プロパノール、1,3−ジクロロ−2−プロパノール(以下、「DCP」と称することがある)、1,3−ジブロモ−2−プロパノール、1,3−ジヨード−2−プロパノール等が挙げられ、好ましくは、1,3−ジクロロ−2−プロパノール、1,3−ジブロモ−2−プロパノールである。
エピハロヒドリンは、下記一般式(2)で示される化合物である。
【0042】
【化2】

【0043】
ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的にはエピフルオロヒドリン、エピクロロヒドリン(以下、「ECH」と称することがある)、エピブロモヒドリン、エピヨードヒドリン等が挙げられ、特に好ましくはエピクロロヒドリン、エピブロモヒドリンである。
【0044】
本発明においては、「ハロヒドリンエポキシダーゼ活性」は、時間あたりの1,3−ジハロ−2−プロパノールからのエピハロヒドリン生成量またはハロゲン化物イオン生成量を測定することにより求めることができる。エピハロヒドリン生成量は、例えば、液体クロマトグラフィやガスクロマトグラフィ等によって定量することができる。また、ハロゲン化物イオン生成量は、例えば、そのハロゲン化物イオンの生成に伴って低下するpHをある一定の値に保つように、連続的または断続的にアルカリ溶液を添加し、時間あたりに要したアルカリの量から便宜的に求めることができる。この方法により算出されるハロヒドリンエポキシダーゼ活性を特に「脱ハロ活性」と呼ぶことがある。また、ハロヒドリンエポキシダーゼ活性は、改良型ハロヒドリンエポキシダーゼに対する抗体を作製し、ウェスタンブロットやELISA法等の免疫学的手法によっても算出することが可能である。その他、ハロヒドリンエポキシダーゼ活性が形質転換体内における発現量と比例すると仮定する場合は、ハロヒドリンエポキシダーゼ活性が既知であるサンプルと比較すること等により、SDS−PAGE等の分析手段によっても間接的に求めることができる。SDS−PAGEは当業者であれば公知の方法を用いて行うことができる。
【0045】
なお、少なくとも一部のハロヒドリンエポキシダーゼについては、上述の「ハロヒドリンエポキシダーゼ活性」に加え、シアン化合物の存在下にエピハロヒドリンを開環シアノ化して4−ハロ−3−ヒドロキシブチロニトリルを生成する反応を触媒する活性を有する。この場合におけるシアン化合物としては、シアン化水素、シアン化カリウム (以下、「KCN」と称することがある)、シアン化ナトリウム、シアン酸またはアセトンシアンヒドリン等の反応液中に添加した際にシアンイオン(CN−)またはシアン化水素を生じる化合物またはその溶液等が挙げられる。また、4−ハロ−3−ヒドロキシブチロニトリルは、下記一般式 (3)で示される化合物である。
【0046】
【化3】

【0047】
ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的には4−フルオロ−3−ヒドロキシブチロニトリル、4−クロロ−3−ヒドロキシブチロニトリル(以下、「CHBN」と称することがある)、4−ブロモ−3−ヒドロキシブチロニトリル、4−ヨード−3−ヒドロキシブチロニトリル等が挙げられ、好ましくは、4−クロロ−3−ヒドロキシブチロニトリル、4−ブロモ−3−ヒドロキシブチロニトリルである。
【0048】
3.ハロヒドリンエポキシダーゼ遺伝子
(1)野生型ハロヒドリンエポキシダーゼ遺伝子
野生型ハロヒドリンエポキシダーゼのうち、その遺伝子配列(塩基配列)が明らかにされているものについては、米国生物工学情報センター(NCBI; National Center for Biotechnology Information)により提供されるGenBankデータベース(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=Nucleotide)において、以下のAccession No.により登録されている;
「Accession No.D90350」:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBをコードする遺伝子の塩基配列、
「Accession No.AY044094」:マイコバクテリウム属(Mycobacterium sp.)GP1株由来のHheB GP1をコードする遺伝子の塩基配列。
【0049】
本発明においては、これらを「野生型ハロヒドリンエポキシダーゼ遺伝子」と呼ぶものとする。ここで、当該野生型ハロヒドリンエポキシダーゼ遺伝子における「野生型」の語は、「ハロヒドリンエポキシダーゼ」に係る語であり、ハロヒドリンエポキシダーゼのアミノ酸配列が野生型であることを意味する。本発明における野生型ハロヒドリンエポキシダーゼ遺伝子を構成する塩基配列は、形質転換体宿主において利用可能なコドンをコードするものであればよく、必ずしも由来生物ゲノムDNA上にコードされている野生型ハロヒドリンエポキシダーゼ遺伝子の塩基配列に限定はされない。なお、HheB(1st)をコードする野生型ハロヒドリンエポキシダーゼ遺伝子をHHEB(1st)と称し、HheB(2nd)をコードする遺伝子をHHEB(2nd)と称するものとする。HHEB(1st)の塩基配列は配列番号4に示され、HHEB(2nd)の塩基配列は配列番号3に示される。
【0050】
塩基配列が明らかになっている野生型ハロヒドリンエポキシダーゼ遺伝子を取得する方法としては、由来生物からゲノムDNAを調製し、明らかにされている野生型ハロヒドリンエポキシダーゼ遺伝子配列情報をもとにプライマーを設計し、該プライマーを用いてPCR法でハロヒドリンエポキシダーゼをコードする遺伝子を増幅する方法が挙げられる。由来生物として、例えば、N−1074株が挙げられ、当該株は、受託番号「FERM BP−2643」として、独立行政法人産業技術総合研究所特許生物寄託センター(茨城県つくば市東1−1−1中央第6(以下、本明細書において同様))に昭和63(1988)年11月10日付で寄託されている。
【0051】
また、公知の遺伝子配列情報を基に、合成オリゴDNAを組み合わせたPCR法(assembly PCR)等を利用して、野生型ハロヒドリンエポキシダーゼ遺伝子の全長を化学的に合成することも可能である。例えば、野生型ハロヒドリンエポキシダーゼ遺伝子をいくつかの領域(例えば、50塩基程度)に分割し、隣り合う領域とのオーバーラップ(例えば、20塩基程度)を両端に有する複数のオリゴヌクレオチドを設計及び合成する。該オリゴヌクレオチドをPCR法で互いにアニールさせることにより野生型ハロヒドリンエポキシダーゼ遺伝子を増幅することができる。
【0052】
また、必要に応じて、野生型ハロヒドリンエポキシダーゼ遺伝子のコドンを変更してもよい。コドンを変更する手段としては、例えば、Molecular Cloning,A Laboratory Manual 2nd ed.,Cold Spring Harbor Laboratory Press(1989)、Current Protocols in Molecular Biology,John Wiley&Sons(1987−1997)等に記載の部位特異的変位誘発法や、部位特異的突然変異誘発法を利用した変異導入用キット(例えばQuickChangeTM Site−Directed Mutagenesis Kit(ストラタジーン社製)、GeneTailorTM Site−Directed Mutagenesis System(インビトロジェン社製)、TaKaRa Site−Directed MutagenesisSystem(Mutan−K、Mutan−Super Express Km等)(タカラバイオ社製))等を用いて行うことができる。この他、上述したように、合成オリゴDNAを組み合わせたPCR法(assembly PCR)を行う際に、コドンを変更したプライマーを用いることでコドンを変更することも可能である。
【0053】
(2)改良型ハロヒドリンエポキシダーゼ遺伝子
本発明における改良型ハロヒドリンエポキシダーゼ遺伝子とは、前記改良型ハロヒドリンエポキシダーゼ酵素タンパク質をコードする遺伝子を意味する。本発明の改良型ハロヒドリンエポキシダーゼ遺伝子とは、例えば、配列番号1または2に示されるアミノ酸配列からなる野生型ハロヒドリンエポキシダーゼに対して前記1.(2)の項に記載のアミノ酸変異が導入されたアミノ酸配列を有する改良型ハロヒドリンエポキシダーゼをコードする遺伝子である。
【0054】
野生型ハロヒドリンエポキシダーゼ遺伝子及び上記アミノ酸変異導入後のアミノ酸残基を構成する塩基配列は、形質転換体宿主において利用可能なコドンをコードするものであればよく、必ずしも由来生物ゲノムDNA上にコードされている野生型ハロヒドリンエポキシダーゼ遺伝子の塩基配列に限定されない。なお、野生型ハロヒドリンエポキシダーゼにおいて述べたHheB(1st)をコードする野生型ハロヒドリンエポキシダーゼ遺伝子であるHHEB(1st)(配列番号4)、及びHheB(2nd)をコードする野生型ハロヒドリンエポキシダーゼ遺伝子であるHHEB(2nd)(配列番号3)は、いずれも、改良型ハロヒドリンエポキシダーゼ遺伝子を得るためのベースとなる野生型ハロヒドリンエポキシダーゼ遺伝子としても用いることができる。
【0055】
本発明の改良型ハロヒドリンエポキシダーゼ遺伝子のさらに具体的かつ好ましい態様としては、配列番号1に示されるアミノ酸配列を有するコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)である場合は、配列番号3に示される塩基配列に前記変異後のアミノ酸配列をコードするように改変した改良型ハロヒドリンエポキシダーゼ遺伝子が挙げられる。
【0056】
本発明における改良型ハロヒドリンエポキシダーゼ遺伝子は、前記1.(2)の項に記載のアミノ酸変異が導入された改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする遺伝子であればよく、従って、前記1.(2)の項に記載の(a),(b)の特徴を有する改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする遺伝子も含まれる。
【0057】
さらに、本発明の改良型ハロヒドリンエポキシダーゼ遺伝子としては、前記(a),(b)より選択されるいずれかのアミノ酸変異が導入された改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする塩基配列に相補的な塩基配列からなるDNAと、ストリンジェントな条件下でハイブリダイズし、かつ、ハロヒドリンエポキシダーゼ活性を有するタンパク質をコードするDNAも含まれる。
【0058】
このようなDNAは、例えば、上記(a),(b)より選択されるアミノ酸配列をコードする塩基配列からなる改良型ハロヒドリンエポキシダーゼ遺伝子DNA若しくはその相補配列、またはこれらの断片をプローブとして、コロニーハイブリダイゼーション、プラークハイブリダイゼーション、サザンブロット等の公知のハイブリダイゼーション法により、cDNAライブラリ及びゲノムライブラリから得ることができる。ライブラリは、公知の方法で作製されたものを利用することができ、また市販のcDNAライブラリ及びゲノムライブラリを利用することもできる。
【0059】
「ストリンジェントな条件」とは、ハイブリダイゼーション後の洗浄時の条件であって塩濃度が300mM〜2000mM、温度が40℃〜75℃、好ましくは塩濃度が600mM〜900mM、温度が65℃の条件を意味する。例えば、2×SSCで50℃等の条件を挙げることができる。当業者であれば、このようなバッファーの塩濃度、温度等の条件に加えて、その他のプローブ濃度、プローブの長さ、反応時間等の諸条件を加味し、前記改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする塩基配列と相補的な塩基配列からなるDNAと、ストリンジェントな条件下でハイブリダイズするDNAを得るための条件を設定することができる。
【0060】
ハイブリダイゼーション法の詳細な手順については、Molecular Cloning,A Laboratory Manual 2nd ed.(Cold Spring Harbor Laboratory Press(1989))等を参照することができる。ハイブリダイズするDNAとしては、例えば、前記改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする塩基配列に対して、少なくとも40%以上、好ましくは60%、さらに好ましくは90%以上の同一性を有する塩基配列を含むDNAまたはその部分断片が挙げられる。
【0061】
本発明において、改良型ハロヒドリンエポキシダーゼ遺伝子の調製を行う方法は、変異を導入する既知の如何なる方法でもよく、通常は、公知の方法で行うことができる。例えば、野生型ハロヒドリンエポキシダーゼ遺伝子を基に、市販のキットを利用して部位特異的な置換を生じさせる方法や、遺伝子DNAを選択的に開裂し、次いで選択されたオリゴヌクレオチドを除去・付加し連結する方法等が挙げられる。これらの部位特異的変異誘発法は「Molecular Cloning,A Laboratory Manual 2nd ed.」(Cold Spring Harbor Press(1989))、「Current Protocols in Molecular Biology」(John Wiley&Sons(1987−1997))、Kunkel,Proc.Natl.Acad.Sci.USA,82:488−492(1985),Kramer and Fritz Method.Enzymol.,154:350−367(1987)、Kunkel,Method.Enzymol.,85:2763−2766(1988)等に記載されている。
【0062】
また、目的とする変異導入箇所が、対象遺伝子配列において消化・連結が容易な制限酵素部位の近隣に存在する場合、目的変異を導入したプライマー(合成オリゴDNA)を用いてPCRを行うことで、目的変異が導入された遺伝子DNA断片を容易に得ることができる。さらには、合成オリゴDNAを組み合わせたPCR法(assembly PCR)で伸長させて合成遺伝子として得ることもできる。また、ハイドロキシルアミンや亜硝酸等の変異源となる薬剤を接触・作用させる方法、紫外線照射により変異を誘発する方法、PCR(ポリメラーゼ連鎖反応)を用いてランダムに変異を導入する方法等のランダムな変異導入法によっても、野生型ハロヒドリンエポキシダーゼ遺伝子から改良型ハロヒドリンエポキシダーゼ遺伝子を得ることができる。
【0063】
4.組換えベクター、形質転換体
(1)組換えベクター
上記の方法によって得た本発明の改良型ハロヒドリンエポキシダーゼ遺伝子を宿主で発現させるために、遺伝子の上流に転写プロモーターを、下流にターミネーターを挿入して発現カセットを構築し、このカセットを発現ベクターに挿入することができる。あるいは、当該改良型ハロヒドリンエポキシダーゼ遺伝子を導入する発現ベクターに転写プロモーターとターミネーターがすでに存在する場合には、発現カセットを構築することなく、ベクター中のプロモーターとターミネーターを利用してその間に当該変異遺伝子を挿入すればよい。ベクターに当該改良型ハロヒドリンエポキシダーゼ遺伝子を挿入するには、制限酵素を用いる方法、トポイソメラーゼを用いる方法等を利用することができる。また、挿入の際に必要であれば、適当なリンカーを付加してもよい。なお、本発明においては、このような組み込み操作を、改良型ハロヒドリンエポキシダーゼ遺伝子の調製操作と兼ねて行うこともできる。すなわち、他のアミノ酸をコードする塩基配列に置換した塩基配列を有するプライマーを用い、野生型ハロヒドリンエポキシダーゼ遺伝子がクローニングされた組換えベクターを鋳型としてPCRを行い、得られた増幅産物をベクターに組み込むことができる。
【0064】
プロモーターの種類は宿主において適切な発現を可能にするものであれば特に限定されるものではないが、例えば、大腸菌宿主において利用できるのものとしては、トリプトファンオペロンのtrpプロモーター、ラクトースオペロンのlacプロモーター、ラムダファージ由来のPLプロモーター及びPRプロモーター等が挙げられ、tacプロモーター、trcプロモーターのように改変、設計された配列も利用できる。枯草菌宿主において利用できるものとしては、グルコン酸合成酵素プロモーター(gnt)、アルカリプロテアーゼプロモーター(apr)、中性プロテアーゼプロモーター(npr)、α−アミラーゼプロモーター(amy)等が挙げられる。ロドコッカス属細菌宿主において利用できるものとしては、発現ベクターpSJ034に含まれるロドコッカス エリスロポリス(Rhodococcus erythropolis)SK92−B1株由来のニトリラーゼ発現調節遺伝子に係るプロモーターが挙げられる。pSJ034はロドコッカス(Rhodococcus)属細菌においてニトリルヒドラターゼを発現するプラスミドであり、特開平10−337185号公報に示す方法でpSJ023より作製することができる。なお、pSJ023は、形質転換体ATCC12674/pSJ023(受託番号「FERM BP−6232」)として独立行政法人産業技術総合研究所特許生物寄託センター(茨城県つくば市東1−1−1中央第6)に平成9(1997)年3月4日付けで寄託されている。
【0065】
ターミネーターは必ずしも必要ではなく、その種類も特に限定されるものではなく、例えば因子非依存性のもの、例えばリポプロテインターミネーター、trpオペロンターミネーター、rrnBターミネーター等が挙げられる。
【0066】
また、アミノ酸への翻訳にとって重要な塩基配列として、SD配列やKozak配列等のリボソーム結合配列が知られており、これらの配列を変異遺伝子の上流に挿入することもできる。原核生物を宿主に用いるときにはSD配列を、真核細胞を宿主に用いるときにはKozak配列をPCR法等により付加してもよい。SD配列としては、大腸菌由来または枯草菌由来の配列等が挙げられるが、大腸菌や枯草菌等の所望の宿主内で機能する配列であれば特に限定されるものではない。たとえば、16SリボゾームRNAの3’末端領域に相補的な配列が4塩基以上連続したコンセンサス配列をDNA合成により作製して利用してもよい。
【0067】
一般に、ベクターには目的とする形質転換体を選別するための因子(選択マーカー)が含まれる。選択マーカーとしては、薬剤耐性遺伝子や栄養要求性相補遺伝子、資化性付与遺伝子等が挙げられ、目的や宿主に応じて選択されうる。例えば大腸菌で選択マーカーとして用いられる薬剤耐性遺伝子としては、アンピシリン耐性遺伝子、カナマイシン遺伝子、ジヒドロ葉酸還元酵素遺伝子、ネオマイシン耐性遺伝子等が挙げられる。
【0068】
本発明において使用されるベクターは、上記の変異遺伝子を保持するものであれば特に限定されず、それぞれの宿主に適したベクターを使用することができる。ベクターとしては、例えば、プラスミドDNA、バクテリオファージDNA、レトロトランスポゾンDNA、人工染色体DNA等が挙げられる。例えば、大腸菌を宿主とする場合には、大腸菌内での自律複製可能な領域を有するpTrc99A(Centraalbureau voor Schimmelcultures(CBS)、オランダ;http://www.cbs.knaw.nl/)、pUC19(タカラバイオ、日本)、pKK233−2(Centraalbureau voor Schimmelcultures(CBS)、オランダ;http://www.cbs.knaw.nl/)、pET−12(Novagen社、ドイツ)、pET−26b(Novagen社、ドイツ)等を用いることができる。また、必要に応じてこれらベクターを改変したものも用いることができる。また、発現効率の高い発現ベクター、例えばtrcプロモーター、lacオペレーターを有する発現ベクターpTrc99AまたはpKK233−2等を用いることもできる。
【0069】
上記の改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターは、本発明の範囲に含まれる。改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターの具体的なものとしては、例えば、pSTT002、pSTT156、pSTT160、pSTT161、pSTT165、pSTT167等が挙げられる。
【0070】
(2)形質転換体
本発明の組換えベクターを宿主に形質転換または形質導入することで、形質転換体または形質導入体(以下、これらをまとめて「形質転換体」という)を作製する。当該形質転換体も本発明の範囲に含まれる。
【0071】
本発明において使用する宿主は、上記組換えベクターが導入された後、目的の改良型ハロヒドリンエポキシダーゼを発現することができる限り特に限定されるものではない。宿主としては、例えば大腸菌、枯草菌、ロドコッカス属細菌等の細菌、酵母(Pichia、Saccharomyces)、カビ(Aspergillus)、動物細胞、昆虫細胞、植物細胞等が挙げられる。
【0072】
細菌を宿主とする場合、本発明においては、大腸菌、ロドコッカス属細菌を好ましい宿主として用いることができる。大腸菌としては、例えば、大腸菌K12株やB株、あるいはそれら野生株由来の派生株であるJM109株、XL1−Blue株、C600株等を挙げることができる。特に、上述したようなラクトースオペロンのlacプロモーター及びその派生プロモーターを発現プロモーターとして用いる場合、lacIレプレッサー遺伝子を有する宿主を用いれば発現が誘導型となり(IPTG等で誘導)、lacIレプレッサー遺伝子を有しない宿主を用いれば発現は構成型となるので、必要に応じた宿主を利用することができる。これら菌株は、例えば、アメリカン・タイプカルチャー・コレクション(ATCC)等から容易に入手可能である。枯草菌としては、例えば、バチルス ズブチリス(Bacillus subtilis)等が挙げられる。ロドコッカス(Rhodococcus)属細菌としては、例えば、ロドコッカス ロドクロウス(Rhodococcus rhodochrous)ATCC12674株、ロドコッカス ロドクロウス(Rhodococcus rhodochrous)J1株 (受託番号「FERM BP−1478」)、ロドコッカス エリスロポリス(Rhodococcus erythropolis)IFO12538株、等が挙げられる。好ましくはロドコッカス ロドクロウス(Rhodococcus rhodochrous)J1株(受託番号「FERM BP−1478」)が挙げられる。なお、上記ATCC株はアメリカンタイプカルチャーコレクションから、IFO株は独立行政法人製品評価技術基盤機構バイオテクノロジー本部生物遺伝資源部門(NBRC)から、FERM株は、独立行政法人産業技術総合研究所 特許生物寄託センターからそれぞれ入手可能である。
【0073】
細菌への組換えベクターの導入方法としては、細菌にDNAを導入する方法であれば特に限定されるものではない。例えば、カルシウムイオンを用いる方法、エレクトロポレーション法等が挙げられる。酵母を宿主とする場合は、例えばサッカロミセス セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス ポンベ(Schizosaccharomyces pombe)、ピヒア パストリス(Pichia pastoris)等が用いられる。酵母への組換えベクターの導入方法としては、酵母にDNAを導入する方法であれば特に限定されず、例えばエレクトロポレーション法、スフェロプラスト法、酢酸リチウム法等が挙げられる。動物細胞を宿主とする場合は、サル細胞COS−7、Vero、CHO細胞、マウスL細胞、ラットGH3、ヒトFL細胞等が用いられる。動物細胞への組換えベクターの導入方法としては、例えばエレクトロポレーション法、リン酸カルシウム法、リポフェクション法等が挙げられる。昆虫細胞を宿主とする場合は、Sf9細胞、Sf21細胞等が用いられる。昆虫細胞への組換えベクターの導入方法としては、例えばリン酸カルシウム法、リポフェクション法、エレクトロポレーション法等が用いられる。植物細胞を宿主とする場合は、タバコBY−2細胞等が挙げられるが、これらに限定されるものではない。植物細胞への組換えベクターの導入方法としては、例えばアグロバクテリウム法、パーティクルガン法、PEG法、エレクトロポレーション法等が用いられる。
【0074】
上記の改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターにより得られる形質転換体は、本発明の範囲に含まれる。改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターによる形質転換体の具体的なものとしては、例えば、本発明で例示するJM109/pSTT002、JM109/pSTT156、JM109/pSTT160、JM109/pSTT161、JM109/pSTT165、JM109/pSTT167等が挙げられる。
【0075】
5.改良型ハロヒドリンエポキシダーゼの製造方法
本発明において、改良型ハロヒドリンエポキシダーゼは、上記形質転換体を培養して得られる培養物自体として、または培養物から採取することにより製造することができる。本発明において、「培養物」とは、培養液、培養液上清、細胞または菌体、細胞または菌体の懸濁液、細胞または菌体の破砕液、粗酵素液及びこれらの処理物等、改良型ハロヒドリンエポキシダーゼを生産する形質転換体を培養することによって得られるもの及びそれらに起因するもののいずれをも含む意味である。本発明の形質転換体を培養して得られる培養物は、本発明の範囲に含まれる。本発明の形質転換体を培養する方法は、宿主の培養に用いられる通常の方法に従って行うことができる。目的の改良型ハロヒドリンエポキシダーゼは、上記培養物中のいずれかに蓄積される。
【0076】
本発明の形質転換体を培養する培地は、宿主が資化し得る炭素源、窒素源、無機塩類等を含有し、形質転換体の培養を効率的に行うことができる培地であれば、天然培地、合成培地のいずれを用いてもよい。炭素源としては、グルコース、ガラクトース、フラクトース、スクロース、ラフィノース、デンプン等の炭水化物、酢酸、プロピオン酸等の有機酸、エタノール、プロパノール等のアルコール類が挙げられる。窒素源としては、アンモニア、塩化アンモニウム、硫酸アンモニウム、酢酸アンモニウム、リン酸アンモニウム等の無機酸若しくは有機酸のアンモニウム塩またはその他の含窒素化合物が挙げられる。その他、ペプトン、酵母エキス、肉エキス、コーンスティープリカー、各種アミノ酸等を用いてもよい。無機物としては、リン酸第一カリウム、リン酸第二カリウム、リン酸マグネシウム、硫酸マグネシウム、塩化ナトリウム、硫酸第一鉄、硫酸マンガン、硫酸亜鉛、硫酸銅、炭酸カルシウム等が挙げられる。また、必要に応じ、培養中の発泡を防ぐために消泡剤を添加してもよい。また、ビタミン等を必要に応じて適宜添加してもよい。培養中は必要に応じてアンピシリンやテトラサイクリン等の抗生物質を培地に添加してもよい。
【0077】
培養中、ベクター及び目的遺伝子の脱落を防ぐために選択圧を掛けた状態で培養してもよい。すなわち、選択マーカーが薬剤耐性遺伝子である場合に相当する薬剤を培地に添加してもよく、選択マーカーが栄養要求性相補遺伝子である場合に相当する栄養因子を培地から除いてもよい。また、選択マーカーが資化性付与遺伝子である場合は、相当する資化因子を必要に応じて唯一因子として添加することができる。例えば、アンピシリン耐性遺伝子を含むベクターで形質転換した大腸菌を培養する場合、培養中に、必要に応じてアンピシリンを培地に添加してもよい。
【0078】
プロモーターとして誘導性のプロモーターを用いた発現ベクターで形質転換した形質転換体を培養する場合は、必要に応じてインデューサーを培地に添加してもよい。例えば、イソプロピル−β−D−チオガラクトシド(IPTG)で誘導可能なプロモーターを有する発現ベクターで形質転換した形質転換体を培養するときには、IPTG等を培地に添加することができる。
【0079】
形質転換体の培養条件は、目的の改良型ハロヒドリンエポキシダーゼの生産性及び宿主の生育が妨げられない条件であれば特に限定されるものではないが、通常、培養温度は10℃〜45℃、好ましくは10℃〜40℃、さらに好ましくは15℃〜40℃、さらにより好ましくは20℃〜37℃で行い、必要に応じて、培養中に温度を変更してもよい。培養時間は5時間〜120時間、好ましくは5時間〜100時間、さらに好ましくは10時間〜100時間、さらにより好ましくは15時間〜80時間程度行う。pHの調整は、無機または有機酸、アルカリ溶液等を用いて行い、大腸菌であれば通常6〜9に調整する。培養方法としては、固体培養、静置培養、振盪培養、通気攪拌培養等が挙げられる。
【0080】
特に大腸菌形質転換体を培養する場合には、振盪培養または通気攪拌培養(ジャーファーメンター)により好気的条件下で培養することが好ましく、この場合、通常の固体培養法で培養してもよいが、可能な限り液体培養法を採用して培養するのが好ましい。培養に用いる培地としては、例えば、酵母エキス、トリプトン、ポリペプトン、コーンスティープリカー、及び大豆または小麦ふすまの浸出液等の1種以上の窒素源に、塩化ナトリウム、リン酸第一カリウム、リン酸第二カリウム、硫酸マグネシウム、塩化マグネシウム、塩化第二鉄、硫酸第二鉄若しくは硫酸マンガン等の無機塩類の1種以上を添加し、更に必要により糖質原料、ビタミン等を適宜添加したものが用いられる。なお、培地の初発pHは7〜9に調整するのが適当である。また、培養は、5℃〜40℃、好ましくは10℃〜37℃で5時間〜100時間行う。通気攪拌深部培養、振盪培養、静置培養、流加培養等により実施するのが好ましい。特に、工業的規模での改良型ハロヒドリンエポキシダーゼ生産を行う場合は、通気攪拌培養を利用することができる。さらに、通気攪拌培養の操作方式としては限定されることなく、当分野の技術常識に基づいて選択することができる。
【0081】
動物細胞を宿主として得られた形質転換体を培養する培地としては、一般に使用されているRPMI1640培地、DMEM培地またはこれらの培地に牛胎児血清等を添加した培地等が挙げられる。培養は、通常、5%CO2存在下、37℃で1日〜30日行う。培養中は必要に応じてカナマイシン及びペニシリン等の抗生物質を培地に添加してもよい。
【0082】
形質転換(導入)体が植物細胞または植物組織である場合は、培養は、通常の植物培養用培地、例えばMS基本培地、LS基本培地等を用いることにより行うことができる。培養方法は、通常の固体培養法、液体培養法のいずれをも採用することができる。
【0083】
上記培養条件で培養すると、本発明の改良型ハロヒドリンエポキシダーゼを上記培養物中、すなわち、培養液、培養上清、細胞、菌体、または細胞若しくは菌体の破砕物の少なくともいずれかに蓄積させることができる。
【0084】
培養後、改良型ハロヒドリンエポキシダーゼが菌体内または細胞内に生産される場合には、菌体または細胞のまま物質生産における触媒として用いることもできるし、あるいは菌体または細胞を破砕することにより、目的の改良型ハロヒドリンエポキシダーゼを採取することもできる。いずれの場合にも、必要であれば、遠心分離や膜濾過等の固液分離操作により、培地除去及び洗浄を行うことができる。固液分離操作の方法は限定されず、当分野の技術常識に基づいて選択することができる。
【0085】
上記の培地除去及び洗浄操作を行った後、菌体または細胞を再度水、あるいは必要に応じて緩衝液、等張液に懸濁し、菌体または細胞懸濁液を調製することができる。菌体または細胞懸濁液は、そのまま物質生産における触媒として用いることもできるし、必要に応じ、例えば界面活性剤等による処理を行った後に用いることもできる。界面活性剤で処理した菌は、緩衝液で洗浄して用いてもよいし、洗浄せずそのまま用いてもよい。
【0086】
また、上述した培地除去及び洗浄操作を行わずに、直接、菌体または細胞の界面活性剤等による処理を行うこともできる。
【0087】
また、菌体または細胞は、固定化して用いることもできる。具体的には、例えば、培養後の細胞または菌体をアクリルアミド等のゲルで包含したもの、アルミナ、シリカ、ゼオライト、珪藻土等の無機担体に担持したもの等が挙げられる。
【0088】
一方、菌体または細胞を破砕することにより、目的の改良型ハロヒドリンエポキシダーゼを採取することもできる。菌体または細胞の破砕方法としては、超音波処理、フレンチプレスやホモジナイザーによる高圧処理、ビーズミルによる磨砕処理、衝撃破砕装置による衝突処理、リゾチーム、セルラーゼ、ペクチナーゼ等を用いる酵素処理、凍結融解処理、低張液処理、ファージによる溶菌誘導処理等が挙げられ、いずれかの方法を単独または必要に応じ組み合わせて利用することができる。
【0089】
得られた破砕液から菌体または細胞破砕残渣を除去する必要がある場合は、例えば、遠心分離や濾過(デッドエンド方式あるいはクロスフロー方式)等、当分野の技術常識に基づいて適切な方法を選択し、実施することにより除去することができる。
【0090】
残渣を除去した後に得られた上清は、細胞抽出液可溶性画分であり、改良型ハロヒドリンエポキシダーゼを含む粗酵素溶液とすることができる。その後、必要に応じて、タンパク質の単離精製に用いられる一般的な生化学的方法、例えば硫酸アンモニウム沈殿、各種クロマトグラフィ(例えばゲル濾過クロマトグラフィ(例えばSephadexカラム)、イオン交換クロマトグラフィ(例えばDEAE−Toyopearl)、アフィニティクロマトグラフィ、疎水性クロマトグラフィ(例えばbutyl Toyopearl)、陰イオンクロマトグラフィ(例えばMonoQカラム)等)、SDSポリアクリルアミドゲル電気泳動等を単独でまたは適宜組み合わせて用いることにより、前記培養物中からハロヒドリンエポキシダーゼを単離精製することができる。
【0091】
本発明の形質転換体が遺伝子組換え体であり、かつ、製造工程での形質転換体の環境への漏出、製品への混入、または使用後の取り扱い等で、二次的に微生物汚染を引き起こす可能性を危惧する場合には、必要に応じて不活化処理を行うことができる。不活化方法としては、改良型ハロヒドリンエポキシダーゼ活性または該活性回収率を低下させず、かつ、形質転換体を不活化できる方法であればいかなる方法でも良く、例えば、熱処理、菌体破砕処理、薬剤処理等の方法を単独または組み合わせて利用できる。
【0092】
一方、改良型ハロヒドリンエポキシダーゼが菌体外または細胞外に生産される場合には、培養液をそのまま使用するか、上述したような遠心分離や濾過等により菌体または細胞を除去する。その後必要に応じて、例えば前述のようにタンパク質の単離精製に用いられる一般的な生化学的方法を単独または適宜組み合わせて用いることにより、改良型ハロヒドリンエポキシダーゼを精製することもできる。
【0093】
形質転換体が植物細胞または植物組織である場合は、セルラーゼ、ペクチナーゼ等の酵素を用いた細胞溶解処理、超音波破砕処理、磨砕処理等により細胞を破壊する。その後必要に応じて、例えば前述のようにタンパク質の単離精製に用いられる一般的な生化学的方法を単独または適宜組み合わせて用いることにより、前記培養物中からハロヒドリンエポキシダーゼを単離精製することができる。単離したハロヒドリンエポキシダーゼは、上述の細胞または菌体と同様に、適当な担体に保持し固定化酵素として使用することもできる。
【0094】
以上のようにして得られる培養物及び改良型ハロヒドリンエポキシダーゼは、本発明の範囲に含まれる。得られる培養物及び改良型ハロヒドリンエポキシダーゼの生産収率は、ハロヒドリンエポキシダーゼ活性を測定し、培養装置あたり、培養液あたり、菌体(形質転換体)湿重量または乾燥重量あたり、酵素液中タンパク質重量あたり等の活性算出することにより求めることができる。
【0095】
また、本発明においては、上記改良型ハロヒドリンエポキシダーゼ遺伝子または改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターから改良型ハロヒドリンエポキシダーゼを採取することも可能である。すなわち、本発明においては、生細胞を全く使用することなく無細胞タンパク質合成系を採用して、改良型ハロヒドリンエポキシダーゼを産生することが可能である。無細胞タンパク質合成系とは、細胞抽出液を用いて試験管等の人工容器内でタンパク質を合成する系である。なお、本発明において使用される無細胞タンパク質合成系には、DNAを鋳型としてRNAを合成する無細胞転写系も含まれる。この場合、上記の宿主に対応する生物は、下記の細胞抽出液の由来する生物に相当する。ここで、上記細胞抽出液は、真核細胞由来または原核細胞由来の抽出液、例えば、小麦胚芽、大腸菌等の抽出液を使用することができる。なお、これらの細胞抽出液は濃縮されたものであっても濃縮されないものであってもよい。細胞抽出液は、例えば限外濾過、透析、ポリエチレングリコール(PEG)沈殿等によって得ることができる。さらに本発明において、無細胞タンパク質合成は、市販のキットを用いて行うこともできる。そのようなキットとしては、例えば試薬キットPROTEIOSTM(東洋紡)、TNTTM System(プロメガ)、合成装置のPG−MateTM(東洋紡)、RTS(ロシュ・ダイアグノスティクス)等が挙げられる。
【0096】
上記のように無細胞タンパク質合成によって得られる改良型ハロヒドリンエポキシダーゼは、例えば前述のように適宜クロマトグラフィを選択して、精製することができる。
【0097】
6.エピハロヒドリン及び4−ハロ−3−ヒドロキシブチロニトリルの製造方法
上述のようにして製造された改良型ハロヒドリンエポキシダーゼは、酵素触媒として物質生産に利用することができる。すなわち、以下の(1)〜(3)に示す反応に供することができる。
【0098】
(1)1,3−ジハロ−2−プロパノールのエピハロヒドリンへの変換
本変換反応は、1,3−ジハロ−2−プロパノールを、上述の改良型ハロヒドリンエポキシダーゼ及び/または上述の培養により得られる培養物と接触させることにより行うことができる。「接触」とは、1,3−ジハロ−2−プロパノールと上記改良型ハロヒドリンエポキシダーゼ及び/または培養物とを同一の反応系または培養系に存在させること等が挙げられる。具体的には、細胞培養器に1,3−ジハロ−2−プロパノールを添加すること、改良型ハロヒドリンエポキシダーゼ及び/または上記培養物と1,3−ジハロ−2−プロパノールとを混合すること、あるいは細胞を1,3−ジハロ−2−プロパノールの存在下で培養すること等が挙げられる。
【0099】
基質である1,3−ジハロ−2−プロパノールは、前述した一般式(1)で示される化合物である。ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的には1,3−ジフルオロ−2−プロパノール、1,3−ジクロロ−2−プロパノール、1,3−ジブロモ−2−プロパノール、1,3−ジヨード−2−プロパノール等が挙げられ、好ましくは、1,3−ジクロロ−2−プロパノール、1,3−ジブロモ−2−プロパノールである。
【0100】
変換反応液中の基質濃度は、0.01%〜15(W/V)%が好ましい。この範囲内であると酵素安定性の観点から好ましく、0.01%〜10%が特に好ましい。基質は反応液に一括添加あるいは分割添加することができる。分割添加により基質濃度を一定にすることが蓄積性の観点から望ましい。
【0101】
反応液の溶媒としては、酵素活性の最適pH4〜10の付近である水または緩衝液が好ましい。緩衝液としては、例えば、リン酸、ホウ酸、クエン酸、グルタル酸、リンゴ酸、マロン酸、o−フタル酸、コハク酸または酢酸等の塩等によって構成される緩衝液、Tris緩衝液あるいはグッド緩衝液等が好ましい。
【0102】
反応温度は、5℃〜50℃、反応pHは4〜10の範囲で行うことが好ましい。反応温度は、より好ましくは10℃〜40℃である。反応pHは、より好ましくはpH6〜9である。反応時間は基質等の濃度、菌体濃度あるいはその他の反応条件等によって適時選択するが、1時間〜120時間で終了するように条件を設定するのが好ましい。尚、本反応においては、反応の進行に伴い生成するハロゲン化物イオンを反応系内から取り除くことにより、光学純度をより一層向上させることができる。このハロゲン化物イオンの除去は、硝酸銀等の添加によって行うことが好ましい。
【0103】
反応液中に生成、蓄積したエピハロヒドリンは公知の方法を用いて採取及び精製することができる。例えば、酢酸エチル等の溶媒で抽出を行い、減圧下に溶媒を除去することによりエピハロヒドリンのシロップを得ることができる。また、これらのシロップを減圧下に蒸留することによりさらに精製することもできる。
【0104】
(2)1,3−ジハロ−2−プロパノールの4−ハロ−3−ヒドロキシブチロニトリルへの変換
本変換反応は、1,3−ジハロ−2−プロパノールを、上述の改良型ハロヒドリンエポキシダーゼ及び/または上述の培養により得られる培養物と接触させることにより行うことができる。
【0105】
基質である1,3−ジハロ−2−プロパノールは、前述した一般式(1)で示される化合物であり、好ましくは1,3−ジクロロ−2−プロパノール、1,3−ジブロモ−2−プロパノール等である。また、シアン化合物としては、シアン化水素、シアン化カリウム、シアン化ナトリウム、シアン酸またはアセトンシアンヒドリン等の反応液中に添加した際にシアンイオン(CN−)またはシアン化水素を生じる化合物またはその溶液を用いることができる。反応液中の基質濃度は、酵素安定性の観点から0.01%〜15(W/V)%が好ましく、0.01%〜10%が特に好ましい。また、シアン化合物の使用量は、酵素安定性の観点から基質の1倍量〜3倍量(モル)が好ましい。反応条件は、上記6.(1)と同様に行うことができる。
【0106】
反応液中に生成、蓄積した4−ハロ−3−ヒドロキシブチロニトリルは、公知の方法を用いて採取及び精製することができる。例えば、反応液から遠心分離等の方法を用いて菌体を除いた後、酢酸エチル等の溶媒で抽出を行い、減圧下に溶媒を除去することにより4−ハロ−3−ヒドロキシブチロニトリルのシロップを得ることができる。また、これらのシロップを減圧下に蒸留することによりさらに精製することもできる。
【0107】
(3)エピハロヒドリンの4−ハロ−3−ヒドロキシブチロニトリルへの変換
本変換反応は、エピハロヒドリンを、上述の改良型ハロヒドリンエポキシダーゼ及び/または上述の培養により得られる培養物と接触させることにより行う。
【0108】
基質であるエピハロヒドリンは、前述した一般式(2)で示される化合物である。ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的にはエピフルオロヒドリン、エピクロロヒドリン、エピブロモヒドリン、エピヨードヒドリン等が挙げられ、特に好ましくはエピクロロヒドリン、エピブロモヒドリンである。また、シアン化合物はシアン化水素、シアン化カリウム、シアン化ナトリウム、シアン酸またはアセトンシアンヒドリン等の反応液中に添加した際にシアンイオン(CN−)またはシアン化水素を生じる化合物またはその溶液を用いることができる。反応条件、採取及び精製方法は、上記6.(2)と同様に行うことができる。
【0109】
以下、実施例により本発明をさらに具体的に説明する。但し、本発明はこれら実施例によって何ら限定されるものではない。
【実施例1】
【0110】
部位特異的変異導入による改良型ハロヒドリンエポキシダーゼ発現ベクターの作製
【0111】
有用なハロヒドリンエポキシダーゼを取得するため、部位特異的変異導入により配列番号1において第128番目のアミノ酸残基(アラニン残基)に変異が導入されたハロヒドリンエポキシダーゼ遺伝子を発現する組換ベクターを作製した。
【0112】
ハロヒドリンエポキシダーゼHheB(2nd)において、2番目のアミノ酸残基(アラニン)がリジンに置換されたタンパク質をコードする遺伝子が、発現ベクターpTrc99A上にクローニングされているプラスミドpSTT002を鋳型として、PCRによるハロヒドリンエポキシダーゼ遺伝子への部位特異的変異導入を次のように行った。以下の表の組成のPCR反応液を各50μl調製した。
【0113】
【表1】

プライマーとして用いたオリゴヌクレオチドの配列は以下の表の通りである。
【0114】
【表2】

PCR反応用チューブに調製した50μlのPCR反応液を、以下の熱サイクル処理に供した。
【0115】
【表3】

得られたPCR反応液を組換ベクター溶液とし、形質転換に供した。
【実施例2】
【0116】
部位特異的変異を導入した改良型ハロヒドリンエポキシダーゼ遺伝子の配列確認と形質転換体の作製
実施例1にて熱サイクル処理を行ったPCR反応液各2μlに対し、後述の方法にて予め調製しておいた大腸菌JM109株コンピテントセル200μlを加え、0℃で30分間放置した。続いて、当該コンピテントセルに42℃で45秒間ヒートショックを与え、0℃で2分間冷却した。その後、SOC培地(20mM グルコース、2%バクトトリプトン、0.5%バクトイーストエキス、10mM NaCl、2.5mM KCl、1mM MgSO4、1mM MgCl2)を1ml添加し、37℃にて1時間振盪培養した。培養後の培養液200μlをLB Amp寒天培地(アンピシリン100mg/l、寒天2%を含有するLB培地)に塗布し、37℃で一晩培養した。各寒天培地上に出現したコロニーを滅菌爪楊枝で採取して2mlのLB Amp液体培地に接種し、37℃で一晩培養した。得られた各培養液から、PureYieldTM Miniprep System(Promega)を用いてプラスミドを回収した。各プラスミド中のハロヒドリンエポキシダーゼ遺伝子について、キャピラリーDNAシーケンサーCEQ2000(ベックマン・コールター)を用い、添付のマニュアルに従って塩基配列の解析を行った。変異導入が確認されたコロニーを各改良型ハロヒドリンエポキシダーゼ保有形質転換体とした。各プラスミド及び形質転換体を後述の表4のように命名した。
【0117】
大腸菌JM109株のコンピテントセル調製は次のように行った。
大腸菌JM109株をLB培地(1% バクトトリプトン、0.5%バクトイーストエキス、1% NaCl)1mlに接種し37℃、5時間好気的に培養して前培養液を得た。該前培養液0.4mlをSOB培地(2%バクトトリプトン、0.5%バクトイーストエキス、10mM NaCl、2.5mM KCl、1mM MgSO4、1mM MgCl2)40mlに加え、18℃で20時間培養して本培養液を得た。該本培養液を遠心分離 (3700×g、10分間、4℃)により集菌した後、冷TF溶液(20mM PIPES−KOH(pH6.0)、200mM KCl、10mM CaCl2、40mM MnCl2) を13ml加え、0℃で10分間放置し、再度遠心分離(3700×g、10分間、4℃)して上清を除き、大腸菌菌体を得た。該大腸菌菌体を冷TF溶液3.2mlに懸濁し、0.22mlのジメチルスルホキシドを加えて菌体懸濁液を得た。該菌体懸濁液を0℃で10分間放置した後、液体窒素を用いて凍結処理し、−80℃にて保存しておいたものを大腸菌JM109株コンピテントセルとした。
【0118】
【表4】

【実施例3】
【0119】
改良型ハロヒドリンエポキシダーゼによる(R)−CHBN合成反応
(1)改良型ハロヒドリンエポキシダーゼ粗酵素液の調製
実施例2でそのハロヒドリンエポキシダーゼ遺伝子変異が確認された5株(JM109/pSTT156、JM109/pSTT160、JM109/pSTT161、JM109/pSTT165、JM109/pSTT167)及び対照とするJM109/pSTT002の計6株について、各株を用いて合成した(R)−CHBNの光学純度を調べるため、まず各改良型ハロヒドリンエポキシダーゼを発現する形質転換体より粗酵素液を調製した。LB Amp培地をワッセルマン試験管に1mlづつ分注し、各試験管に二次評価選抜株10株及び対照とするJM109/pSTT002のコロニーをそれぞれ植菌した。37℃、210rpmで約8時間培養した後、得られた各培養液100μlを、IPTGを終濃度として1mM含むLB Amp培地(500ml容三角フラスコ中の100ml)に植菌し、37℃、210rpmで16時間培養した。得られた各培養液100mlから遠心分離(3700×g、10分間、4℃)により各菌体を回収し、20mM Tris−硫酸緩衝液(pH8.0)で洗浄した後、菌濃度が12.5gD.C./lとなるように同緩衝液に懸濁した。得られた菌体懸濁液の3mlを、超音波破砕機VP−15S(タイテック、日本)を用いて、出力コントロール4、DUTY CYCLE40%、PULS、TIMER=Bモード10sの条件で氷冷しながら10分間破砕した。破砕した菌体懸濁液を遠心分離(12000rpm、10分間、4℃)に供し、上清を粗酵素液として採取した。得られた各粗酵素液を、それぞれ破砕前の(菌体懸濁液時点での)菌濃度として6.25gD.C./lとなるよう、20mM Tris−硫酸緩衝液(pH8.0)で希釈し、本粗酵素液を用いて以下の方法によりハロヒドリンエポキシダーゼ活性(脱クロル活性)を測定した。100mlの活性測定用反応液(50mM DCP、20mM Tris−硫酸緩衝液(pH8.0))を調製して、温度を20℃に調整した。該反応液に上記粗酵素液を添加し、反応を開始した。ハロヒドリンエポキシダーゼ活性による塩化物イオンの遊離に伴うpHの低下を、pH自動コントローラを用いて0.01規定の水酸化ナトリウム水溶液の投入によりpHを8に保つよう連続的に調整した。10分間の反応の間に、pHを8に保つために投入された0.01規定の水酸化ナトリウム水溶液の量から、塩化物イオン生成量を算出し、ハロヒドリンエポキシダーゼ活性(脱クロル活性)(U)を算出した。1Uを上記条件下でDCPから1分間当たり1μmol塩化物イオンの脱離する酵素量に相当するものと定義し、活性測定に用いた各粗酵素液の活性、及び該活性を活性測定に用いた各粗酵素液の液量で除することにより各粗酵素液の液活性を算出した。
【0120】
(2)分析方法
後述する改良型ハロヒドリンエポキシダーゼによる(R)−CHBNの合成反応において実施する反応液中のDCP、ECH及びCHBN濃度分析及び生成CHBNの光学純度分析は、以下のように行った。
【0121】
<反応液中のDCP、ECH及びCHBN濃度分析>
反応液中のDCP、ECH及びCHBN濃度分析は、逆相HPLCにより行った。逆相HPLC分析条件を表5に示す。
【0122】
【表5】

【0123】
反応終了液100μlを、上表記載の移動相5mlにより希釈混合した後、上表記載の分析条件により分析を行った。予め、濃度既知のDCP、ECH及びCHBN溶液を用いて検量線を作成し、該検量線を用いて反応液中のDCP、ECH及びCHBN濃度を求めた。
【0124】
<生成CHBNの光学純度分析>
生成CHBNの光学純度分析は、CHBNをエステル化後、順相系HPLCにより行った。順相系HPLC分析条件を表6に示す。
【0125】
【表6】

【0126】
反応終了液約400μlに等量の酢酸エチルを加えて抽出を行った。酢酸エチル相を分取し、少量の無水硫酸マグネシウムを加えて攪拌した。酢酸エチル相を全量なすフラスコに分取してロータリーエバポレータ(東京理化機械)にセットし、50℃、250torr、60分間濃縮した。残存物に20μlのジクロロメタンと20μlのピリジン、及び20μlの(+)−α−メトキシ−α−(トリフルオロメチル)フェニルアセチルクロライド(以下、(+)−MTPAと称することがある)を添加した。室温で一晩反応させた後、400μlのジイソプロピルエーテル(以下、IPEと称することがある)を添加し、1規定の塩酸を加えて抽出を行った。IPE相を分取し、飽和炭酸水素ナトリウム水溶液を400μl加えて抽出を行った。IPE相を1.5mlチューブに分取し、アスピレータによりIPE相を揮発させた。残存物をn−ヘキサン:2−プロパノール=4:1の混合液に懸濁した後、表5に記載の分析条件により分析を行った。(R)−CHBN−(+)−MTPAエステル及び(S)−CHBN−(+)−MTPAエステルのエリア面積比から各濃度を算出し、本明細書において説明した要領(前述)でCHBNの光学純度を算出した。
【0127】
(3)改良型ハロヒドリンエポキシダーゼによるDCPからの(R)−CHBNの合成
実施例3(1)で調製した各改良型ハロヒドリンエポキシダーゼ発現形質転換体由来粗酵素液を用い、シアン化カリウム存在下、DCPまたはECHからのCHBN合成反応を行った。反応液基本組成は以下の表のようにし、反応スケールは0.5mlで行った。
【0128】
【表7】

【0129】
反応は20℃にて3時間行った。反応終了後、実施例3(2)に記載の分析条件により、反応液中のDCP、ECH及びCHBN濃度及び生成CHBNの光学純度を分析した。結果を表8に示した。
【0130】
【表8】

【0131】
対照とする形質転換体株JM109/pSTT002由来の粗酵素液を用いて合成された(R)−CHBNの光学純度は91.7%e.e.であった。これに対し改良型ハロヒドリンエポキシダーゼを発現する4種の形質転換体株(JM109/pSTT156、JM109/pSTT160、JM109/pSTT161、JM109/pSTT167)由来の粗酵素液を用いて合成された(R)−CHBNの光学純度は92.8から99.9%e.e.を超えており、光学純度が向上していることが確認された。従って、これらの改良型ハロヒドリンエポキシダーゼは、DCP及び/または中間体ECHに対する立体選択性が向上していると言える。
【0132】
(4)改良型ハロヒドリンエポキシダーゼによるECHからの(R)−CHBNの合成
実施例3(1)で調製した各改良型ハロヒドリンエポキシダーゼ発現形質転換体由来粗酵素液を用い、シアン化カリウム存在下、ECHからのCHBN合成反応を行った。反応液基本組成は以下の表のようにし、反応スケールは0.5mlで行った。
【0133】
【表9】

【0134】
反応は20℃にて3時間行った。反応終了後、実施例3(2)に記載の分析条件により、反応液中のDCP、ECH及びCHBN濃度及び生成CHBNの光学純度を分析した。結果を表10に示した。
【0135】
【表10】

【0136】
対照とする形質転換体株JM109/pSTT002由来の粗酵素液を用いて合成された(R)−CHBNの光学純度は78.9%e.e.であった。これに対し改良型ハロヒドリンエポキシダーゼを発現する4種の形質転換体株(JM109/pSTT156、JM109/pSTT160、JM109/pSTT161、JM109/pSTT165)由来の粗酵素液を用いて合成された(R)−CHBNの光学純度は79.9〜93.6%e.e.であり、光学純度が向上していることが確認された。従って、これらの改良型ハロヒドリンエポキシダーゼは、ECHに対する立体選択性が向上していると言える。
【産業上の利用可能性】
【0137】
本発明の改良型ハロヒドリンエポキシダーゼは、立体選択性に優れており、本発明の酵素を利用することにより、光学活性エピハロヒドリンまたは4−ハロ−3−ヒドロキシブチロニトリルを効率よく製造することができる。
【受託番号】
【0138】
N−1074株:受託番号「FERM BP−2643」として、独立行政法人産業技術総合研究所特許生物寄託センター(茨城県つくば市東1−1−1中央第6に昭和63(1988)年11月10日付で寄託されている。
【0139】
pSJ023:形質転換体ATCC12674/pSJ023(受託番号「FERM BP−6232」)として独立行政法人産業技術総合研究所特許生物寄託センター(茨城県つくば市東1−1−1中央第6)に平成9(1997)年3月4日付けで寄託されている。
Rhodococcus rhodochrous J1株(受託番号「FERM BP−1478」)
[配列表の説明]
配列番号1:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)のアミノ酸配列
配列番号2:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)のアミノ酸配列
配列番号3:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)の塩基配列
配列番号4:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)の塩基配列
配列番号5:プライマーDH−75
配列番号6:プライマーDH−76
配列番号7:プライマーDH−83
配列番号8:プライマーDH−84
配列番号9:プライマーDH−85
配列番号10:プライマーDH−86
配列番号11:プライマーDH−93
配列番号12:プライマーDH−94
配列番号13:プライマーDH−97
配列番号14:プライマーDH−98
配列番号15:アミノ酸配列I
配列番号16:変異ペプチド
配列番号17:変異ペプチド
配列番号18:変異ペプチド
配列番号19:変異ペプチド
配列番号20:変異ペプチド
配列番号21:変異ペプチド
配列番号22:変異ペプチド
配列番号23:変異ペプチド
配列番号24:変異ペプチド
配列番号25:変異ペプチド
【技術分野】
【0001】
本発明は、改良型ハロヒドリンエポキシダーゼ及びその製造方法に関する。
【背景技術】
【0002】
ハロヒドリンエポキシダーゼは、ハロヒドリンハイドロゲンハライドリアーゼ、ハロヒドリンデハロゲナーゼまたはハロアルコールデハロゲナーゼとも称され、1,3−ジハロ−2−プロパノールをエピハロヒドリンに変換する活性及びその逆反応を触媒する活性を有する酵素(EC number:4.5.1.−)である。ハロヒドリンエポキシダーゼは、アミノ酸配列の相同性等から、3つのアイソザイム(A型、B型、C型)が存在することが知られている(非特許文献1:J.Bacteriology,183(17),5058−5066,2001)。A型ハロヒドリンエポキシダーゼとして、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheA(非特許文献2:Biosci.Biotechnol.Biochem.,58(8),1451−1457,1994)、アースロバクター属(Arthrobacter sp.)AD2株由来のHheA AD2(非特許文献1)、アースロバクター属(Arthrobacter sp.)PY1株由来のDeh−PY1(非特許文献3:J.Health.Sci.,50(6),605−612,2004)等が知られている。また、B型ハロヒドリンエポキシダーゼとして、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(非特許文献2)、マイコバクテリウム属(Mycobacterium sp.)GP1株由来のHheB GP1(非特許文献1)、アースロバクター エリシー(Arthrobacter erithii)H10a株由来のDehA(非特許文献4:Enz.Microbiol.Technol.,22,568−574,1998)等が知られている。そして、C型ハロヒドリンエポキシダーゼとして、アグロバクテリウム ラジオバクター(Agrobacterium radiobacter)DH094株由来のHheC(特許文献1:特開平10−210981号公報)、アグロバクテリウム ラジオバクター(Agrobacterium radiobacter)AD1株由来のHheC(非特許文献1)、アグロバクテリウム チュメファシエンス(Agrobacterium tumefaciens)由来のHalB(非特許文献5:Thesis(1996)University of Wales,Cardiff,United Kingdom)等が知られている。
【0003】
エピハロヒドリンは種々の医薬品や生理活性物質の合成原料として有用な物質である。例えば、(R)−エピハロヒドリンの開環シアノ化によって得られる(R)−4−ハロ−3−ヒドロキシブチロニトリルは、L−カルニチンの合成原料として有用であることが知られている(特許文献2:特開昭57−165352号公報)。少なくとも一部のハロヒドリンエポキシダーゼについては、上述した1,3−ジハロ−2−プロパノールをエピハロヒドリンに変換する活性及びその逆反応を触媒する活性に加え、シアン化合物の存在下にエピハロヒドリンを開環シアノ化して4−ハロ−3−ヒドロキシブチロニトリルを生成する反応を触媒することが明らかになっており、その反応を利用した例として、1,3−ジハロ−2−プロパノールから光学活性4−ハロ−3−ヒドロキシブチロニトリルを製造する方法(特許文献3:特開平3−053889号公報、特許文献4:特開2001−25397号公報)及びエピハロヒドリンから光学活性4−ハロ−3−ヒドロキシブチロニトリルを製造する方法(特許文献5:特開平3−053890号公報)が知られている。
【0004】
ところで、近年の遺伝子工学技術の進歩により、酵素タンパク質の構成アミノ酸の1個以上を欠失、付加または挿入させるか、あるいは他のアミノ酸で置換した変異体を意図的に作製することが可能となっている。これら変異体は、該変異の種類によっては、変異の導入されていない酵素と比較して、活性、安定性、有機溶媒耐性、耐熱性、耐酸性、耐アルカリ性、基質特異性、立体選択性等の性能が向上することが知られている。これら性能の向上は、活性あたりの酵素触媒製造コスト低減、酵素触媒の安定化、反応工程の簡略化、反応収率の向上等を通じて、酵素反応を利用した工業的生産における大幅な生産コスト低減をもたらすことがある。従って、多くの酵素において様々な性能が向上した有用な改良酵素の創製が行われている。ハロヒドリンエポキシダーゼにおいても、構成アミノ酸の1個以上を欠失、付加、挿入、または他のアミノ酸で置換した変異体の報告がなされている。例えば、特許文献6(米国特許出願公開第2005/0272064号明細書)には、アグロバクテリウム ラジオバクター(Agrobacterium radiobacter)AD1株由来のHheCの変異体570種類及びコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBの変異体1種類が記載されている。また、特許文献7(米国特許出願公開第2006/0099700号明細書)には、アグロバクテリウム ラジオバクター(Agrobacterium radiobacter)AD1株由来のHheCの変異体1422種類及びコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBの変異体1種類が記載されている。これらのうちのいくつかの変異体については、エチル(R)−4−クロロ−3−ヒドロキシブチレイトからエチル(S)−4−シアノ−3−ヒドロキシブチレイトへの変換反応における活性が向上したことが示されている。さらに、特許文献8(国際公開第2008/108466号パンフレット)には、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBの変異体22株が記載されている。これらのうちのいくつかの変異体については、形質転換体当たりのハロヒドリンエポキシダーゼ活性が向上したことが示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−210981号公報
【特許文献2】特開昭57−165352号公報
【特許文献3】特開平3−053889号公報
【特許文献4】特開2001−25397号公報
【特許文献5】特開平3−053890号公報
【特許文献6】米国特許出願公開第2005/0272064号明細書
【特許文献7】米国特許出願公開第2006/0099700号明細書
【特許文献8】国際公開第2008/108466号パンフレット
【非特許文献】
【0006】
【非特許文献1】J.Bacteriol.,183(17),5058−5066,2001
【非特許文献2】Biosci.Biotechnol.Biochem.,58(8),1451−1457,1994
【非特許文献3】J.Health.Sci.,50(6),605−612,2004
【非特許文献4】Enz.Microbiol.Technol.,22,568−574,1998
【非特許文献5】Thesis(1996)University of Wales, Cardiff, United Kingdom
【発明の概要】
【発明が解決しようとする課題】
【0007】
ハロヒドリンエポキシダーゼを工業的に利用する場合には、酵素触媒として更なる高度化が望まれる。例えば、光学活性な4−ハロ−3−ヒドロキシブチロニトリルの製造を目的とする場合、既知のハロヒドリンエポキシダーゼにより製造される4−ハロ−3−ヒドロキシブチロニトリルの光学純度は必ずしも十分に高いものではない。従って、より光学純度の高い4−ハロ−3−ヒドロキシブチロニトリルを生成するような、立体選択性が向上したハロヒドリンエポキシダーゼが望まれる。また、1,3−ジハロ−2−プロパノールを出発原料としてハロヒドリンエポキシダーゼにより4−ハロ−3−ヒドロキシブチロニトリルの製造を行う場合、生成物(ハロゲン化物イオン及び4−ハロ−3−ヒドロキシブチロニトリル)の阻害による反応速度の低下が生じうる。従って、生成物阻害を受け難いハロヒドリンエポキシダーゼが望まれる。
【0008】
そこで、本発明の目的は、これら課題を解決しうるハロヒドリンエポキシダーゼ、及びその製造方法、ならびにそれを用いたエピハロヒドリンまたは4−ハロ−3−ヒドロキシブチロニトリルの製造方法を提供することにある。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために鋭意研究を行った。その結果、野生型ハロヒドリンエポキシダーゼのアミノ酸配列、特にB型アイソザイムに分類される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、結晶構造解析を行った結果、ハロヒドリンエポキシダーゼのアミノ酸配列のうち、所定位置のアミノ酸残基のいずれかまたは全部を他のアミノ酸に置換することにより、形質転換体あたりのハロヒドリンエポキシダーゼ活性、立体選択性、生成物阻害耐性、生成物蓄積能等の属性が向上した改良型ハロヒドリンエポキシダーゼを創出できることを見出し、本発明を完成するに至った。
すなわち、本発明は以下の通りである。
(1)以下のアミノ酸配列I:
S−α1−α2−α3−α4−α5−α6−α7−α8−α9−α10−α11−α12−Y−α13−α14−A−R−α15(配列番号15)
(SはSer残基、YはTyr残基、AはAla残基、RはArg残基を表し、α1〜α15はそれぞれ独立して同一のまたは異なる任意のアミノ酸残基を表す。)
を含む野生型ハロヒドリンエポキシダーゼのアミノ酸配列に対して、開始アミノ酸残基(通常はMet残基)より1残基C末端側のアミノ酸残基がLysに置換され、且つ、α10残基が他のアミノ酸に置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
(2)α10残基におけるアミノ酸変異がCys,Gln,Ile,MetまたはValである、(1)に記載の改良型ハロヒドリンエポキシダーゼ。
(3)野生型ハロヒドリンエポキシダーゼが、グループBに分類されるものである、(1)または(2)に記載の改良型ハロヒドリンエポキシダーゼ。
(4)野生型ハロヒドリンエポキシダーゼが、コリネバクテリウム(Corynebacterium)属細菌またはマイコバクテリウム(Mycobacterium)属細菌由来のものである、(1)〜(3)のいずれかに記載の改良型ハロヒドリンエポキシダーゼ。
(5)(1)〜(4)のいずれかに記載の改良型ハロヒドリンエポキシダーゼをコードする遺伝子。
(6)(5)に記載の遺伝子を含む組換えベクター。
(7)(6)に記載の組換えベクターを宿主に導入してなる形質転換体または形質導入体。
(8)(7)に記載の形質転換体または形質導入体を培養して得られる培養物。
(9)(8)に記載の培養物から改良型ハロヒドリンエポキシダーゼを採取することを特徴とする、改良型ハロヒドリンエポキシダーゼの製造方法。
(10)(1)〜(4)のいずれかに記載の改良型ハロヒドリンエポキシダーゼ及び/または(8)に記載の培養物を、1,3−ジハロ−2−プロパノールと接触させることによりエピハロヒドリンを生成させることを特徴とする、エピハロヒドリンの製造方法。
(11)(1)〜(4)のいずれかに記載の改良型ハロヒドリンエポキシダーゼ及び/または(8)に記載の培養物を、シアン化合物存在下、1,3−ジハロ−2−プロパノールまたはエピハロヒドリンと接触させることにより4−ハロ−3−ヒドロキシブチロニトリルを生成させることを特徴とする、4−ハロ−3−ヒドロキシブチロニトリルの製造方法。
(12)配列番号1で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第2番目のAlaがLysに置換され、且つ、第128番目のAlaが他のアミノ酸に置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
(13)配列番号2で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第136番目のAlaが他のアミノ酸に置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
(14)配列番号1で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第2番目のAlaがLysに置換され、且つ、第128番目のAlaがCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
(15)配列番号2で表される野生型ハロヒドリンエポキシダーゼのアミノ酸配列において、第136番目のAlaがCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
【発明の効果】
【0010】
本発明によれば、立体選択性、生成物阻害耐性等が向上した改良型ハロヒドリンエポキシダーゼ得ることができるとともに、これらを利用して光学活性なエピハロヒドリンまたは4−ハロ−3−ヒドロキシブチロニトリルを効率よく製造することができる。
【図面の簡単な説明】
【0011】
【図1】プラスミドpSTT002を示す図である。
【発明を実施するための形態】
【0012】
以下に本発明の実施の形態について説明するが、本実施の形態は、本発明を説明するための例示であり、本発明をこの実施の形態にのみ限定する趣旨ではない。本発明は、その要旨を逸脱しない限り、さまざまな形態で実施をすることができる。
【0013】
1.ハロヒドリンエポキシダーゼ
(1)野生型ハロヒドリンエポキシダーゼ
「野生型ハロヒドリンエポキシダーゼ」とは、自然界の生物より分離され得るハロヒドリンエポキシダーゼを指し、由来は限定されるものではない。また、当該酵素を構成するアミノ酸配列において、意図的または非意図的なアミノ酸の欠失または他のアミノ酸による置換もしくは挿入がなく、天然由来の属性を保持したままのハロヒドリンエポキシダーゼを意味する。
【0014】
さらに、本発明において用いる野生型ハロヒドリンエポキシダーゼは、以下のアミノ酸配列I(19アミノ酸残基):
S−α1−α2−α3−α4−α5−α6−α7−α8−α9−α10−α11−α12−Y−α13−α14−A−R−α15(配列番号15)
(SはSer残基、YはTyr残基、AはAla残基、RはArg残基を表し、α1〜α15はそれぞれ独立して同一のまたは異なる任意のアミノ酸残基を表す。)を含むアミノ酸配列からなる。野生型ハロヒドリンエポキシダーゼが、アミノ酸配列Iを含むアミノ酸配列からなるものであるか否かは、公共の配列データベース、例えば、米国生物工学情報センター(NCBI;National Center for Biotechnology Information)により提供されるGenBankデータベース(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?CMD=search&DB=protein)においてハロヒドリンエポキシダーゼとして登録されているものを検索し、該当したもののアミノ酸配列中に、上記アミノ酸配列Iが含まれるか否かを調べればよい。必要に応じて、遺伝子情報解析用ソフトウェアを用いて検索を行うことができる。また、公知文献で野生型ハロヒドリンエポキシダーゼのアミノ酸配列について記載されているものがあればそれを参考にしてもよい。例えば、J.Bacteriology,183(17),5058−5066,2001に記載されている各種野生型ハロヒドリンエポキシダーゼアミノ酸配列のアラインメント定法を参考にすることで、アミノ酸配列Iが含まれるか否か、および全アミノ酸配列中のどの位置に含まれるかを知ることができる。なお、アミノ酸配列IにおけるSer残基、Tyr残基、Arg残基およびAla残基は、既知の各種野生型ハロヒドリンエポキシダーゼのアミノ酸配列において高度に保存されている。
【0015】
野生型ハロヒドリンエポキシダーゼは、アミノ酸配列の相同性等から、3つのアイソザイム(A型、B型、C型)に大別されることが知られている(J.Bacteriology,183(17),5058−5066,2001)。本発明において用いる野生型ハロヒドリンエポキシダーゼは、B型に属するものが好ましい。
【0016】
B型に分類されるハロヒドリンエポキシダーゼ (「HheB」ともいう) としては、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(Biosci.Biotechnol.Biochem.,58(8),1451,1994)、マイコバクテリウム属(Mycobacterium sp.)GP1株由来のHheB GP1(J.Bacteriology,183(17),5058−5066,2001)、アースロバクター エリシー(Arthrobacter erithii)H10a株由来のDehA(Enz.Microbiol.Technol.,22,568−574,1998)等が挙げられる。中でも、コリネバクテリウム属、マイコバクテリウム属のものが、好ましい。
【0017】
これらハロヒドリンエポキシダーゼのうち、アミノ酸配列が明らかにされているものについては、米国生物工学情報センター(NCBI; National Center for Biotechnology Information)により提供されるGenBankデータベース(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?CMD=search&DB=protein)において、以下のAccession No.により登録されている。
「Accession No.BAA14362」:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBのアミノ酸配列、
「Accession No.AAK73175」:マイコバクテリウム属(Mycobacterium sp.)GP1株由来のHheB GP1のアミノ酸配列。
【0018】
本発明において、コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のハロヒドリンエポキシダーゼのアミノ酸配列(HheB)については、その遺伝子(HHEB)が2つの開始コドンを有するため、結果的に、N末端近傍の8アミノ酸残基の有無のみが異なる2種のハロヒドリンエポキシダーゼが存在することが報告されている(Biosci.Biotechnol.Biochem.,58(8),1451−1457,1994)。本発明において、両者(上記2種のハロヒドリンエポキシダーゼ)を区別して称するときは、最初の開始コドンから翻訳されたアミノ酸配列(配列番号2)からなるHheBを「HheB(1st)」と称し、2番目の開始コドン (次に登場するメチオニン)から翻訳されたアミノ酸配列(配列番号1)からなるHheBを「HheB(2nd)」と称することとし、これらはいずれも野生型ハロヒドリンエポキシダーゼであるものとする。
【0019】
本明細書においては、主にコリネバクテリウム属(Corynebacterium sp.)N−1074株由来の野生型ハロヒドリンエポキシダーゼHheBを例に挙げて説明するが、前述のように、ハロヒドリンエポキシダーゼの由来は限定されず、HheB以外のハロヒドリンエポキシダーゼであっても前記アミノ酸配列Iを含むアミノ酸配列からなるものであれば、同様の説明が適用され得る。また、本発明で示した変異の位置または変異するアミノ酸種若しくは塩基配列を操作することによって、いずれの改良型ハロヒドリンエポキシダーゼを得ることもできる。なお、本発明において、「高い相同性」というときは、例えば60%以上の相同性をいい、好ましくは75%以上の相同性であり、特に好ましくは90%以上の相同性をいう。
【0020】
(2)改良型ハロヒドリンエポキシダーゼ
本発明者は、配列番号1に示すアミノ酸配列からなる野生型ハロヒドリンエポキシダーゼの結晶構造を解析し、その結果から、配列番号1に示すアミノ酸配列のうち前述したアミノ酸配列I(配列番号15)中のα10アミノ酸残基(Ala)がHheBの立体選択性及び基質認識に重要である点を見出し、本発明における改良型ハロヒドリンエポキシダーゼの変異導入部位を特定した。すなわち、本発明における「改良型ハロヒドリンエポキシダーゼ」は、主として遺伝子組換え技術を利用して、野生型ハロヒドリンエポキシダーゼに含まれるアミノ酸配列I(配列番号15)に対してα10アミノ酸残基について置換変異が導入されたアミノ酸配列からなるものであり、立体選択性、生成物蓄積能等が向上したハロヒドリンエポキシダーゼである。
【0021】
本発明における改良型ハロヒドリンエポキシダーゼには、基質1,3−ジハロ−2−プロパノールまたはエピハロヒドリンから、エピハロヒドリンまたは4−ハロ−3−ヒドロキシブチロニトリルを生成させた場合の該生成物の光学純度が、野生型ハロヒドリンエポキシダーゼにより同基質から同生成物を生成させた場合の該生成物の光学純度よりも高くなるという属性を有するものが含まれる。すなわち、基質である1,3−ジハロ−2−プロパノール及び/またはエピハロヒドリンに対する立体選択性が、野生型ハロヒドリンエポキシダーゼよりも向上しているものが含まれる。立体選択性向上の本質的な原因としては、アミノ酸置換変異に起因するものであれば如何なるものでもよい。
【0022】
本発明において、「光学活性」とは、一方の鏡像異性体が他方の鏡像異性体よりも多く含まれている物質の状態、またはいずれか一方の鏡像異性体のみから成っている物質の状態を言う。また、「光学純度」とは、「鏡像異性体過剰率(%e.e.)」にほぼ等しいものであるとし、次式で定義する。
【0023】
光学純度≒鏡像異性体過剰率=100×(|[R]−[S]|)/([R]+[S]) (%e.e.)
【0024】
ここで、[R]及び[S]は試料中の鏡像異性体のそれぞれの濃度を示す。また、本発明において、「立体選択性」とは、ハロヒドリンエポキシダーゼが、基質から生成物を生成する際に、いずれか一方の鏡像異性体が生成する反応を優先的に触媒する性質を言う。
【0025】
本発明の改良型ハロヒドリンエポキシダーゼは、具体的には、前述したアミノ酸配列Iを含む野生型ハロヒドリンエポキシダーゼのアミノ酸配列に対して以下のアミノ酸変異が導入されたアミノ酸配列からなるタンパク質である;
【0026】
(a)開始アミノ酸残基より1残基C末端側のアミノ酸残基がLysに置換され、且つ、アミノ酸配列I中のα10残基が、他のアミノ酸に置換されたアミノ酸変異。
【0027】
なお、上記(a)において「開始アミノ酸残基」とは、野生型ハロヒドリンエポキシダーゼを遺伝子(DNAまたはmRNA)中の翻訳開始コドンがコードするアミノ酸に対応するアミノ酸残基を意味する。すなわち、翻訳後の野生型ハロヒドリンエポキシダーゼのアミノ酸配列におけるN末端アミノ酸残基(通常はMet残基)を意味する。
【0028】
上記(a)で表されるタンパク質のアミノ酸変異は、野生型ハロヒドリンエポキシダーゼのアミノ酸配列において最もN末端側に位置する開始アミノ酸残基(通常はMet残基)を1番目と定義したときに、当該開始アミノ酸残基からC末端側に向かって何番目のアミノ酸残基におけるアミノ酸変異であるかによっても特定することができる。例えば、野生型ハロヒドリンエポキシダーゼが、配列番号1に示されるアミノ酸配列からなるコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)である場合は、(a)における「開始アミノ酸残基より1残基C末端側のアミノ酸残基」、および「α10残基」は、それぞれ「2番目のアミノ酸残基(Ala残基)」および「128番目のAla残基」に該当する。また、野生型ハロヒドリンエポキシダーゼが、配列番号2に示されるアミノ酸配列からなるコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)である場合は、(a)における「開始アミノ酸残基より1残基C末端側のアミノ酸残基」、および「α10残基」は、それぞれ「2番目のアミノ酸残基(Ala残基)」および「136番目のAla残基」に該当する。また、しかし、HheB(2nd)は、HheB(1st)のアミノ酸配列におけるN末端近傍の8アミノ酸残基が欠失したアミノ酸配列からなるタンパク質に過ぎず、HheB(1st)及びHheB(2nd)の両アミノ酸配列における各アミノ酸残基の絶対的役割は実質的に同一である。
【0029】
本発明の改良型ハロヒドリンエポキシダーゼの好ましい態様としては、例えば、以下のアミノ酸変異が導入されたアミノ酸配列からなるものが挙げられる;
【0030】
(b)開始アミノ酸残基より1残基C末端側のアミノ酸残基がLysに置換され、且つ、アミノ酸配列I中のα10残基が、他のアミノ酸としてCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異。
【0031】
ここで、上記(b)のアミノ酸変異は、前述した(a)のアミノ酸変異の具体的態様を例示したもの(詳しくは「他のアミノ酸」の具体例を示したもの)である。
【0032】
そのため、前述した(a)の場合と同様に、上記(b)における「開始アミノ酸残基より1残基C末端側のアミノ酸残基」および「α10残基」は、それぞれ野生型ハロヒドリンエポキシダーゼアミノ酸配列において最もN末端側に位置するアミノ酸残基(通常はMet残基)を1番目と定義したときに、当該開始アミノ酸残基からC末端側に向かって何番目のアミノ酸残基であるかによっても特定することができる。すなわち、例えば野生型ハロヒドリンエポキシダーゼが配列番号1に示されるアミノ酸配列からなるコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)である場合は、上記(b)のアミノ酸変異の態様は、以下のように特定することができる。
【0033】
(b)2番目のアミノ酸残基(Ala残基)がLysに置換され、且つ、128番目のアミノ酸残基(Ala残基)が、他のアミノ酸としてCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異。
【0034】
また、野生型ハロヒドリンエポキシダーゼが配列番号2に示されるアミノ酸配列からなるコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)である場合は、上記(b)のアミノ酸変異の態様は、以下のように特定することができる。
【0035】
(b)2番目のアミノ酸残基(Ala残基)がLysに置換され、且つ、136番目のアミノ酸残基(Ala残基)が、他のアミノ酸としてCys、Gln、Ile、MetまたはValに置換されたアミノ酸変異。
【0036】
本発明における改良型ハロヒドリンエポキシダーゼは、上記(a)、好ましくは(b)より選択されるアミノ酸変異を有するアミノ酸配列からなるものであればよい。
【0037】
本発明における「改良型ハロヒドリンエポキシダーゼ」のさらに具体的且つ好ましい態様としては、野生型ハロヒドリンエポキシダーゼが、配列番号1に示されるアミノ酸配列を有するコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)である場合は、配列番号16〜20に示されるアミノ酸配列を有する改良型ハロヒドリンエポキシダーゼが挙げられる。また、野生型ハロヒドリンエポキシダーゼが、配列番号2に示されるアミノ酸配列を有するコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)である場合は、配列番号21〜25に示されるアミノ酸配列を有する改良型ハロヒドリンエポキシダーゼが挙げられる。
【0038】
なお、本発明において、アミノ酸の種類を3文字または1文字のアルファベット表記で表すことがある。さらに、数字の前または前後に、3文字または1文字のアルファベットを配して表記することがあり、この場合は、アミノ酸残基の箇所及び置換前後のアミノ酸の種類を表す。すなわち、数字は、特に断りがない限り、上述したように、翻訳開始コドンによりコードされるアミノ酸残基(通常はメチオニン)を1番目と定義した場合に、何番目のアミノ酸残基であるかを示すものである。また、数字の前に表示した3文字または1文字のアルファベットは、アミノ酸置換前のアミノ酸の3文字または1文字表記を表し、数字の後に表示した3文字または1文字のアルファベットは、アミノ酸置換が生じた場合の置換後のアミノ酸の3文字または1文字表記を表すものとする。例えば、128番目のアラニン残基は「Ala128」または「A128」と表記し、128番目のアラニン残基がバリンに置換された場合は「Ala128Val」または「A128V」と表記することがある。
【0039】
2.ハロヒドリンエポキシダーゼ活性
本発明において、「ハロヒドリンエポキシダーゼ活性」とは、1,3−ジハロ−2−プロパノールをエピハロヒドリンに変換する活性及びその逆反応を触媒する活性を意味する。1,3−ジハロ−2−プロパノールは、下記一般式(1)で示される化合物である。
【0040】
【化1】

(式中、X1及びX2は、それぞれ独立して同一のまたは異なるハロゲン原子を表す。)
【0041】
ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的には1,3−ジフルオロ−2−プロパノール、1,3−ジクロロ−2−プロパノール(以下、「DCP」と称することがある)、1,3−ジブロモ−2−プロパノール、1,3−ジヨード−2−プロパノール等が挙げられ、好ましくは、1,3−ジクロロ−2−プロパノール、1,3−ジブロモ−2−プロパノールである。
エピハロヒドリンは、下記一般式(2)で示される化合物である。
【0042】
【化2】

【0043】
ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的にはエピフルオロヒドリン、エピクロロヒドリン(以下、「ECH」と称することがある)、エピブロモヒドリン、エピヨードヒドリン等が挙げられ、特に好ましくはエピクロロヒドリン、エピブロモヒドリンである。
【0044】
本発明においては、「ハロヒドリンエポキシダーゼ活性」は、時間あたりの1,3−ジハロ−2−プロパノールからのエピハロヒドリン生成量またはハロゲン化物イオン生成量を測定することにより求めることができる。エピハロヒドリン生成量は、例えば、液体クロマトグラフィやガスクロマトグラフィ等によって定量することができる。また、ハロゲン化物イオン生成量は、例えば、そのハロゲン化物イオンの生成に伴って低下するpHをある一定の値に保つように、連続的または断続的にアルカリ溶液を添加し、時間あたりに要したアルカリの量から便宜的に求めることができる。この方法により算出されるハロヒドリンエポキシダーゼ活性を特に「脱ハロ活性」と呼ぶことがある。また、ハロヒドリンエポキシダーゼ活性は、改良型ハロヒドリンエポキシダーゼに対する抗体を作製し、ウェスタンブロットやELISA法等の免疫学的手法によっても算出することが可能である。その他、ハロヒドリンエポキシダーゼ活性が形質転換体内における発現量と比例すると仮定する場合は、ハロヒドリンエポキシダーゼ活性が既知であるサンプルと比較すること等により、SDS−PAGE等の分析手段によっても間接的に求めることができる。SDS−PAGEは当業者であれば公知の方法を用いて行うことができる。
【0045】
なお、少なくとも一部のハロヒドリンエポキシダーゼについては、上述の「ハロヒドリンエポキシダーゼ活性」に加え、シアン化合物の存在下にエピハロヒドリンを開環シアノ化して4−ハロ−3−ヒドロキシブチロニトリルを生成する反応を触媒する活性を有する。この場合におけるシアン化合物としては、シアン化水素、シアン化カリウム (以下、「KCN」と称することがある)、シアン化ナトリウム、シアン酸またはアセトンシアンヒドリン等の反応液中に添加した際にシアンイオン(CN−)またはシアン化水素を生じる化合物またはその溶液等が挙げられる。また、4−ハロ−3−ヒドロキシブチロニトリルは、下記一般式 (3)で示される化合物である。
【0046】
【化3】

【0047】
ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的には4−フルオロ−3−ヒドロキシブチロニトリル、4−クロロ−3−ヒドロキシブチロニトリル(以下、「CHBN」と称することがある)、4−ブロモ−3−ヒドロキシブチロニトリル、4−ヨード−3−ヒドロキシブチロニトリル等が挙げられ、好ましくは、4−クロロ−3−ヒドロキシブチロニトリル、4−ブロモ−3−ヒドロキシブチロニトリルである。
【0048】
3.ハロヒドリンエポキシダーゼ遺伝子
(1)野生型ハロヒドリンエポキシダーゼ遺伝子
野生型ハロヒドリンエポキシダーゼのうち、その遺伝子配列(塩基配列)が明らかにされているものについては、米国生物工学情報センター(NCBI; National Center for Biotechnology Information)により提供されるGenBankデータベース(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=Nucleotide)において、以下のAccession No.により登録されている;
「Accession No.D90350」:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheBをコードする遺伝子の塩基配列、
「Accession No.AY044094」:マイコバクテリウム属(Mycobacterium sp.)GP1株由来のHheB GP1をコードする遺伝子の塩基配列。
【0049】
本発明においては、これらを「野生型ハロヒドリンエポキシダーゼ遺伝子」と呼ぶものとする。ここで、当該野生型ハロヒドリンエポキシダーゼ遺伝子における「野生型」の語は、「ハロヒドリンエポキシダーゼ」に係る語であり、ハロヒドリンエポキシダーゼのアミノ酸配列が野生型であることを意味する。本発明における野生型ハロヒドリンエポキシダーゼ遺伝子を構成する塩基配列は、形質転換体宿主において利用可能なコドンをコードするものであればよく、必ずしも由来生物ゲノムDNA上にコードされている野生型ハロヒドリンエポキシダーゼ遺伝子の塩基配列に限定はされない。なお、HheB(1st)をコードする野生型ハロヒドリンエポキシダーゼ遺伝子をHHEB(1st)と称し、HheB(2nd)をコードする遺伝子をHHEB(2nd)と称するものとする。HHEB(1st)の塩基配列は配列番号4に示され、HHEB(2nd)の塩基配列は配列番号3に示される。
【0050】
塩基配列が明らかになっている野生型ハロヒドリンエポキシダーゼ遺伝子を取得する方法としては、由来生物からゲノムDNAを調製し、明らかにされている野生型ハロヒドリンエポキシダーゼ遺伝子配列情報をもとにプライマーを設計し、該プライマーを用いてPCR法でハロヒドリンエポキシダーゼをコードする遺伝子を増幅する方法が挙げられる。由来生物として、例えば、N−1074株が挙げられ、当該株は、受託番号「FERM BP−2643」として、独立行政法人産業技術総合研究所特許生物寄託センター(茨城県つくば市東1−1−1中央第6(以下、本明細書において同様))に昭和63(1988)年11月10日付で寄託されている。
【0051】
また、公知の遺伝子配列情報を基に、合成オリゴDNAを組み合わせたPCR法(assembly PCR)等を利用して、野生型ハロヒドリンエポキシダーゼ遺伝子の全長を化学的に合成することも可能である。例えば、野生型ハロヒドリンエポキシダーゼ遺伝子をいくつかの領域(例えば、50塩基程度)に分割し、隣り合う領域とのオーバーラップ(例えば、20塩基程度)を両端に有する複数のオリゴヌクレオチドを設計及び合成する。該オリゴヌクレオチドをPCR法で互いにアニールさせることにより野生型ハロヒドリンエポキシダーゼ遺伝子を増幅することができる。
【0052】
また、必要に応じて、野生型ハロヒドリンエポキシダーゼ遺伝子のコドンを変更してもよい。コドンを変更する手段としては、例えば、Molecular Cloning,A Laboratory Manual 2nd ed.,Cold Spring Harbor Laboratory Press(1989)、Current Protocols in Molecular Biology,John Wiley&Sons(1987−1997)等に記載の部位特異的変位誘発法や、部位特異的突然変異誘発法を利用した変異導入用キット(例えばQuickChangeTM Site−Directed Mutagenesis Kit(ストラタジーン社製)、GeneTailorTM Site−Directed Mutagenesis System(インビトロジェン社製)、TaKaRa Site−Directed MutagenesisSystem(Mutan−K、Mutan−Super Express Km等)(タカラバイオ社製))等を用いて行うことができる。この他、上述したように、合成オリゴDNAを組み合わせたPCR法(assembly PCR)を行う際に、コドンを変更したプライマーを用いることでコドンを変更することも可能である。
【0053】
(2)改良型ハロヒドリンエポキシダーゼ遺伝子
本発明における改良型ハロヒドリンエポキシダーゼ遺伝子とは、前記改良型ハロヒドリンエポキシダーゼ酵素タンパク質をコードする遺伝子を意味する。本発明の改良型ハロヒドリンエポキシダーゼ遺伝子とは、例えば、配列番号1または2に示されるアミノ酸配列からなる野生型ハロヒドリンエポキシダーゼに対して前記1.(2)の項に記載のアミノ酸変異が導入されたアミノ酸配列を有する改良型ハロヒドリンエポキシダーゼをコードする遺伝子である。
【0054】
野生型ハロヒドリンエポキシダーゼ遺伝子及び上記アミノ酸変異導入後のアミノ酸残基を構成する塩基配列は、形質転換体宿主において利用可能なコドンをコードするものであればよく、必ずしも由来生物ゲノムDNA上にコードされている野生型ハロヒドリンエポキシダーゼ遺伝子の塩基配列に限定されない。なお、野生型ハロヒドリンエポキシダーゼにおいて述べたHheB(1st)をコードする野生型ハロヒドリンエポキシダーゼ遺伝子であるHHEB(1st)(配列番号4)、及びHheB(2nd)をコードする野生型ハロヒドリンエポキシダーゼ遺伝子であるHHEB(2nd)(配列番号3)は、いずれも、改良型ハロヒドリンエポキシダーゼ遺伝子を得るためのベースとなる野生型ハロヒドリンエポキシダーゼ遺伝子としても用いることができる。
【0055】
本発明の改良型ハロヒドリンエポキシダーゼ遺伝子のさらに具体的かつ好ましい態様としては、配列番号1に示されるアミノ酸配列を有するコリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)である場合は、配列番号3に示される塩基配列に前記変異後のアミノ酸配列をコードするように改変した改良型ハロヒドリンエポキシダーゼ遺伝子が挙げられる。
【0056】
本発明における改良型ハロヒドリンエポキシダーゼ遺伝子は、前記1.(2)の項に記載のアミノ酸変異が導入された改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする遺伝子であればよく、従って、前記1.(2)の項に記載の(a),(b)の特徴を有する改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする遺伝子も含まれる。
【0057】
さらに、本発明の改良型ハロヒドリンエポキシダーゼ遺伝子としては、前記(a),(b)より選択されるいずれかのアミノ酸変異が導入された改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする塩基配列に相補的な塩基配列からなるDNAと、ストリンジェントな条件下でハイブリダイズし、かつ、ハロヒドリンエポキシダーゼ活性を有するタンパク質をコードするDNAも含まれる。
【0058】
このようなDNAは、例えば、上記(a),(b)より選択されるアミノ酸配列をコードする塩基配列からなる改良型ハロヒドリンエポキシダーゼ遺伝子DNA若しくはその相補配列、またはこれらの断片をプローブとして、コロニーハイブリダイゼーション、プラークハイブリダイゼーション、サザンブロット等の公知のハイブリダイゼーション法により、cDNAライブラリ及びゲノムライブラリから得ることができる。ライブラリは、公知の方法で作製されたものを利用することができ、また市販のcDNAライブラリ及びゲノムライブラリを利用することもできる。
【0059】
「ストリンジェントな条件」とは、ハイブリダイゼーション後の洗浄時の条件であって塩濃度が300mM〜2000mM、温度が40℃〜75℃、好ましくは塩濃度が600mM〜900mM、温度が65℃の条件を意味する。例えば、2×SSCで50℃等の条件を挙げることができる。当業者であれば、このようなバッファーの塩濃度、温度等の条件に加えて、その他のプローブ濃度、プローブの長さ、反応時間等の諸条件を加味し、前記改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする塩基配列と相補的な塩基配列からなるDNAと、ストリンジェントな条件下でハイブリダイズするDNAを得るための条件を設定することができる。
【0060】
ハイブリダイゼーション法の詳細な手順については、Molecular Cloning,A Laboratory Manual 2nd ed.(Cold Spring Harbor Laboratory Press(1989))等を参照することができる。ハイブリダイズするDNAとしては、例えば、前記改良型ハロヒドリンエポキシダーゼのアミノ酸配列をコードする塩基配列に対して、少なくとも40%以上、好ましくは60%、さらに好ましくは90%以上の同一性を有する塩基配列を含むDNAまたはその部分断片が挙げられる。
【0061】
本発明において、改良型ハロヒドリンエポキシダーゼ遺伝子の調製を行う方法は、変異を導入する既知の如何なる方法でもよく、通常は、公知の方法で行うことができる。例えば、野生型ハロヒドリンエポキシダーゼ遺伝子を基に、市販のキットを利用して部位特異的な置換を生じさせる方法や、遺伝子DNAを選択的に開裂し、次いで選択されたオリゴヌクレオチドを除去・付加し連結する方法等が挙げられる。これらの部位特異的変異誘発法は「Molecular Cloning,A Laboratory Manual 2nd ed.」(Cold Spring Harbor Press(1989))、「Current Protocols in Molecular Biology」(John Wiley&Sons(1987−1997))、Kunkel,Proc.Natl.Acad.Sci.USA,82:488−492(1985),Kramer and Fritz Method.Enzymol.,154:350−367(1987)、Kunkel,Method.Enzymol.,85:2763−2766(1988)等に記載されている。
【0062】
また、目的とする変異導入箇所が、対象遺伝子配列において消化・連結が容易な制限酵素部位の近隣に存在する場合、目的変異を導入したプライマー(合成オリゴDNA)を用いてPCRを行うことで、目的変異が導入された遺伝子DNA断片を容易に得ることができる。さらには、合成オリゴDNAを組み合わせたPCR法(assembly PCR)で伸長させて合成遺伝子として得ることもできる。また、ハイドロキシルアミンや亜硝酸等の変異源となる薬剤を接触・作用させる方法、紫外線照射により変異を誘発する方法、PCR(ポリメラーゼ連鎖反応)を用いてランダムに変異を導入する方法等のランダムな変異導入法によっても、野生型ハロヒドリンエポキシダーゼ遺伝子から改良型ハロヒドリンエポキシダーゼ遺伝子を得ることができる。
【0063】
4.組換えベクター、形質転換体
(1)組換えベクター
上記の方法によって得た本発明の改良型ハロヒドリンエポキシダーゼ遺伝子を宿主で発現させるために、遺伝子の上流に転写プロモーターを、下流にターミネーターを挿入して発現カセットを構築し、このカセットを発現ベクターに挿入することができる。あるいは、当該改良型ハロヒドリンエポキシダーゼ遺伝子を導入する発現ベクターに転写プロモーターとターミネーターがすでに存在する場合には、発現カセットを構築することなく、ベクター中のプロモーターとターミネーターを利用してその間に当該変異遺伝子を挿入すればよい。ベクターに当該改良型ハロヒドリンエポキシダーゼ遺伝子を挿入するには、制限酵素を用いる方法、トポイソメラーゼを用いる方法等を利用することができる。また、挿入の際に必要であれば、適当なリンカーを付加してもよい。なお、本発明においては、このような組み込み操作を、改良型ハロヒドリンエポキシダーゼ遺伝子の調製操作と兼ねて行うこともできる。すなわち、他のアミノ酸をコードする塩基配列に置換した塩基配列を有するプライマーを用い、野生型ハロヒドリンエポキシダーゼ遺伝子がクローニングされた組換えベクターを鋳型としてPCRを行い、得られた増幅産物をベクターに組み込むことができる。
【0064】
プロモーターの種類は宿主において適切な発現を可能にするものであれば特に限定されるものではないが、例えば、大腸菌宿主において利用できるのものとしては、トリプトファンオペロンのtrpプロモーター、ラクトースオペロンのlacプロモーター、ラムダファージ由来のPLプロモーター及びPRプロモーター等が挙げられ、tacプロモーター、trcプロモーターのように改変、設計された配列も利用できる。枯草菌宿主において利用できるものとしては、グルコン酸合成酵素プロモーター(gnt)、アルカリプロテアーゼプロモーター(apr)、中性プロテアーゼプロモーター(npr)、α−アミラーゼプロモーター(amy)等が挙げられる。ロドコッカス属細菌宿主において利用できるものとしては、発現ベクターpSJ034に含まれるロドコッカス エリスロポリス(Rhodococcus erythropolis)SK92−B1株由来のニトリラーゼ発現調節遺伝子に係るプロモーターが挙げられる。pSJ034はロドコッカス(Rhodococcus)属細菌においてニトリルヒドラターゼを発現するプラスミドであり、特開平10−337185号公報に示す方法でpSJ023より作製することができる。なお、pSJ023は、形質転換体ATCC12674/pSJ023(受託番号「FERM BP−6232」)として独立行政法人産業技術総合研究所特許生物寄託センター(茨城県つくば市東1−1−1中央第6)に平成9(1997)年3月4日付けで寄託されている。
【0065】
ターミネーターは必ずしも必要ではなく、その種類も特に限定されるものではなく、例えば因子非依存性のもの、例えばリポプロテインターミネーター、trpオペロンターミネーター、rrnBターミネーター等が挙げられる。
【0066】
また、アミノ酸への翻訳にとって重要な塩基配列として、SD配列やKozak配列等のリボソーム結合配列が知られており、これらの配列を変異遺伝子の上流に挿入することもできる。原核生物を宿主に用いるときにはSD配列を、真核細胞を宿主に用いるときにはKozak配列をPCR法等により付加してもよい。SD配列としては、大腸菌由来または枯草菌由来の配列等が挙げられるが、大腸菌や枯草菌等の所望の宿主内で機能する配列であれば特に限定されるものではない。たとえば、16SリボゾームRNAの3’末端領域に相補的な配列が4塩基以上連続したコンセンサス配列をDNA合成により作製して利用してもよい。
【0067】
一般に、ベクターには目的とする形質転換体を選別するための因子(選択マーカー)が含まれる。選択マーカーとしては、薬剤耐性遺伝子や栄養要求性相補遺伝子、資化性付与遺伝子等が挙げられ、目的や宿主に応じて選択されうる。例えば大腸菌で選択マーカーとして用いられる薬剤耐性遺伝子としては、アンピシリン耐性遺伝子、カナマイシン遺伝子、ジヒドロ葉酸還元酵素遺伝子、ネオマイシン耐性遺伝子等が挙げられる。
【0068】
本発明において使用されるベクターは、上記の変異遺伝子を保持するものであれば特に限定されず、それぞれの宿主に適したベクターを使用することができる。ベクターとしては、例えば、プラスミドDNA、バクテリオファージDNA、レトロトランスポゾンDNA、人工染色体DNA等が挙げられる。例えば、大腸菌を宿主とする場合には、大腸菌内での自律複製可能な領域を有するpTrc99A(Centraalbureau voor Schimmelcultures(CBS)、オランダ;http://www.cbs.knaw.nl/)、pUC19(タカラバイオ、日本)、pKK233−2(Centraalbureau voor Schimmelcultures(CBS)、オランダ;http://www.cbs.knaw.nl/)、pET−12(Novagen社、ドイツ)、pET−26b(Novagen社、ドイツ)等を用いることができる。また、必要に応じてこれらベクターを改変したものも用いることができる。また、発現効率の高い発現ベクター、例えばtrcプロモーター、lacオペレーターを有する発現ベクターpTrc99AまたはpKK233−2等を用いることもできる。
【0069】
上記の改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターは、本発明の範囲に含まれる。改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターの具体的なものとしては、例えば、pSTT002、pSTT156、pSTT160、pSTT161、pSTT165、pSTT167等が挙げられる。
【0070】
(2)形質転換体
本発明の組換えベクターを宿主に形質転換または形質導入することで、形質転換体または形質導入体(以下、これらをまとめて「形質転換体」という)を作製する。当該形質転換体も本発明の範囲に含まれる。
【0071】
本発明において使用する宿主は、上記組換えベクターが導入された後、目的の改良型ハロヒドリンエポキシダーゼを発現することができる限り特に限定されるものではない。宿主としては、例えば大腸菌、枯草菌、ロドコッカス属細菌等の細菌、酵母(Pichia、Saccharomyces)、カビ(Aspergillus)、動物細胞、昆虫細胞、植物細胞等が挙げられる。
【0072】
細菌を宿主とする場合、本発明においては、大腸菌、ロドコッカス属細菌を好ましい宿主として用いることができる。大腸菌としては、例えば、大腸菌K12株やB株、あるいはそれら野生株由来の派生株であるJM109株、XL1−Blue株、C600株等を挙げることができる。特に、上述したようなラクトースオペロンのlacプロモーター及びその派生プロモーターを発現プロモーターとして用いる場合、lacIレプレッサー遺伝子を有する宿主を用いれば発現が誘導型となり(IPTG等で誘導)、lacIレプレッサー遺伝子を有しない宿主を用いれば発現は構成型となるので、必要に応じた宿主を利用することができる。これら菌株は、例えば、アメリカン・タイプカルチャー・コレクション(ATCC)等から容易に入手可能である。枯草菌としては、例えば、バチルス ズブチリス(Bacillus subtilis)等が挙げられる。ロドコッカス(Rhodococcus)属細菌としては、例えば、ロドコッカス ロドクロウス(Rhodococcus rhodochrous)ATCC12674株、ロドコッカス ロドクロウス(Rhodococcus rhodochrous)J1株 (受託番号「FERM BP−1478」)、ロドコッカス エリスロポリス(Rhodococcus erythropolis)IFO12538株、等が挙げられる。好ましくはロドコッカス ロドクロウス(Rhodococcus rhodochrous)J1株(受託番号「FERM BP−1478」)が挙げられる。なお、上記ATCC株はアメリカンタイプカルチャーコレクションから、IFO株は独立行政法人製品評価技術基盤機構バイオテクノロジー本部生物遺伝資源部門(NBRC)から、FERM株は、独立行政法人産業技術総合研究所 特許生物寄託センターからそれぞれ入手可能である。
【0073】
細菌への組換えベクターの導入方法としては、細菌にDNAを導入する方法であれば特に限定されるものではない。例えば、カルシウムイオンを用いる方法、エレクトロポレーション法等が挙げられる。酵母を宿主とする場合は、例えばサッカロミセス セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス ポンベ(Schizosaccharomyces pombe)、ピヒア パストリス(Pichia pastoris)等が用いられる。酵母への組換えベクターの導入方法としては、酵母にDNAを導入する方法であれば特に限定されず、例えばエレクトロポレーション法、スフェロプラスト法、酢酸リチウム法等が挙げられる。動物細胞を宿主とする場合は、サル細胞COS−7、Vero、CHO細胞、マウスL細胞、ラットGH3、ヒトFL細胞等が用いられる。動物細胞への組換えベクターの導入方法としては、例えばエレクトロポレーション法、リン酸カルシウム法、リポフェクション法等が挙げられる。昆虫細胞を宿主とする場合は、Sf9細胞、Sf21細胞等が用いられる。昆虫細胞への組換えベクターの導入方法としては、例えばリン酸カルシウム法、リポフェクション法、エレクトロポレーション法等が用いられる。植物細胞を宿主とする場合は、タバコBY−2細胞等が挙げられるが、これらに限定されるものではない。植物細胞への組換えベクターの導入方法としては、例えばアグロバクテリウム法、パーティクルガン法、PEG法、エレクトロポレーション法等が用いられる。
【0074】
上記の改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターにより得られる形質転換体は、本発明の範囲に含まれる。改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターによる形質転換体の具体的なものとしては、例えば、本発明で例示するJM109/pSTT002、JM109/pSTT156、JM109/pSTT160、JM109/pSTT161、JM109/pSTT165、JM109/pSTT167等が挙げられる。
【0075】
5.改良型ハロヒドリンエポキシダーゼの製造方法
本発明において、改良型ハロヒドリンエポキシダーゼは、上記形質転換体を培養して得られる培養物自体として、または培養物から採取することにより製造することができる。本発明において、「培養物」とは、培養液、培養液上清、細胞または菌体、細胞または菌体の懸濁液、細胞または菌体の破砕液、粗酵素液及びこれらの処理物等、改良型ハロヒドリンエポキシダーゼを生産する形質転換体を培養することによって得られるもの及びそれらに起因するもののいずれをも含む意味である。本発明の形質転換体を培養して得られる培養物は、本発明の範囲に含まれる。本発明の形質転換体を培養する方法は、宿主の培養に用いられる通常の方法に従って行うことができる。目的の改良型ハロヒドリンエポキシダーゼは、上記培養物中のいずれかに蓄積される。
【0076】
本発明の形質転換体を培養する培地は、宿主が資化し得る炭素源、窒素源、無機塩類等を含有し、形質転換体の培養を効率的に行うことができる培地であれば、天然培地、合成培地のいずれを用いてもよい。炭素源としては、グルコース、ガラクトース、フラクトース、スクロース、ラフィノース、デンプン等の炭水化物、酢酸、プロピオン酸等の有機酸、エタノール、プロパノール等のアルコール類が挙げられる。窒素源としては、アンモニア、塩化アンモニウム、硫酸アンモニウム、酢酸アンモニウム、リン酸アンモニウム等の無機酸若しくは有機酸のアンモニウム塩またはその他の含窒素化合物が挙げられる。その他、ペプトン、酵母エキス、肉エキス、コーンスティープリカー、各種アミノ酸等を用いてもよい。無機物としては、リン酸第一カリウム、リン酸第二カリウム、リン酸マグネシウム、硫酸マグネシウム、塩化ナトリウム、硫酸第一鉄、硫酸マンガン、硫酸亜鉛、硫酸銅、炭酸カルシウム等が挙げられる。また、必要に応じ、培養中の発泡を防ぐために消泡剤を添加してもよい。また、ビタミン等を必要に応じて適宜添加してもよい。培養中は必要に応じてアンピシリンやテトラサイクリン等の抗生物質を培地に添加してもよい。
【0077】
培養中、ベクター及び目的遺伝子の脱落を防ぐために選択圧を掛けた状態で培養してもよい。すなわち、選択マーカーが薬剤耐性遺伝子である場合に相当する薬剤を培地に添加してもよく、選択マーカーが栄養要求性相補遺伝子である場合に相当する栄養因子を培地から除いてもよい。また、選択マーカーが資化性付与遺伝子である場合は、相当する資化因子を必要に応じて唯一因子として添加することができる。例えば、アンピシリン耐性遺伝子を含むベクターで形質転換した大腸菌を培養する場合、培養中に、必要に応じてアンピシリンを培地に添加してもよい。
【0078】
プロモーターとして誘導性のプロモーターを用いた発現ベクターで形質転換した形質転換体を培養する場合は、必要に応じてインデューサーを培地に添加してもよい。例えば、イソプロピル−β−D−チオガラクトシド(IPTG)で誘導可能なプロモーターを有する発現ベクターで形質転換した形質転換体を培養するときには、IPTG等を培地に添加することができる。
【0079】
形質転換体の培養条件は、目的の改良型ハロヒドリンエポキシダーゼの生産性及び宿主の生育が妨げられない条件であれば特に限定されるものではないが、通常、培養温度は10℃〜45℃、好ましくは10℃〜40℃、さらに好ましくは15℃〜40℃、さらにより好ましくは20℃〜37℃で行い、必要に応じて、培養中に温度を変更してもよい。培養時間は5時間〜120時間、好ましくは5時間〜100時間、さらに好ましくは10時間〜100時間、さらにより好ましくは15時間〜80時間程度行う。pHの調整は、無機または有機酸、アルカリ溶液等を用いて行い、大腸菌であれば通常6〜9に調整する。培養方法としては、固体培養、静置培養、振盪培養、通気攪拌培養等が挙げられる。
【0080】
特に大腸菌形質転換体を培養する場合には、振盪培養または通気攪拌培養(ジャーファーメンター)により好気的条件下で培養することが好ましく、この場合、通常の固体培養法で培養してもよいが、可能な限り液体培養法を採用して培養するのが好ましい。培養に用いる培地としては、例えば、酵母エキス、トリプトン、ポリペプトン、コーンスティープリカー、及び大豆または小麦ふすまの浸出液等の1種以上の窒素源に、塩化ナトリウム、リン酸第一カリウム、リン酸第二カリウム、硫酸マグネシウム、塩化マグネシウム、塩化第二鉄、硫酸第二鉄若しくは硫酸マンガン等の無機塩類の1種以上を添加し、更に必要により糖質原料、ビタミン等を適宜添加したものが用いられる。なお、培地の初発pHは7〜9に調整するのが適当である。また、培養は、5℃〜40℃、好ましくは10℃〜37℃で5時間〜100時間行う。通気攪拌深部培養、振盪培養、静置培養、流加培養等により実施するのが好ましい。特に、工業的規模での改良型ハロヒドリンエポキシダーゼ生産を行う場合は、通気攪拌培養を利用することができる。さらに、通気攪拌培養の操作方式としては限定されることなく、当分野の技術常識に基づいて選択することができる。
【0081】
動物細胞を宿主として得られた形質転換体を培養する培地としては、一般に使用されているRPMI1640培地、DMEM培地またはこれらの培地に牛胎児血清等を添加した培地等が挙げられる。培養は、通常、5%CO2存在下、37℃で1日〜30日行う。培養中は必要に応じてカナマイシン及びペニシリン等の抗生物質を培地に添加してもよい。
【0082】
形質転換(導入)体が植物細胞または植物組織である場合は、培養は、通常の植物培養用培地、例えばMS基本培地、LS基本培地等を用いることにより行うことができる。培養方法は、通常の固体培養法、液体培養法のいずれをも採用することができる。
【0083】
上記培養条件で培養すると、本発明の改良型ハロヒドリンエポキシダーゼを上記培養物中、すなわち、培養液、培養上清、細胞、菌体、または細胞若しくは菌体の破砕物の少なくともいずれかに蓄積させることができる。
【0084】
培養後、改良型ハロヒドリンエポキシダーゼが菌体内または細胞内に生産される場合には、菌体または細胞のまま物質生産における触媒として用いることもできるし、あるいは菌体または細胞を破砕することにより、目的の改良型ハロヒドリンエポキシダーゼを採取することもできる。いずれの場合にも、必要であれば、遠心分離や膜濾過等の固液分離操作により、培地除去及び洗浄を行うことができる。固液分離操作の方法は限定されず、当分野の技術常識に基づいて選択することができる。
【0085】
上記の培地除去及び洗浄操作を行った後、菌体または細胞を再度水、あるいは必要に応じて緩衝液、等張液に懸濁し、菌体または細胞懸濁液を調製することができる。菌体または細胞懸濁液は、そのまま物質生産における触媒として用いることもできるし、必要に応じ、例えば界面活性剤等による処理を行った後に用いることもできる。界面活性剤で処理した菌は、緩衝液で洗浄して用いてもよいし、洗浄せずそのまま用いてもよい。
【0086】
また、上述した培地除去及び洗浄操作を行わずに、直接、菌体または細胞の界面活性剤等による処理を行うこともできる。
【0087】
また、菌体または細胞は、固定化して用いることもできる。具体的には、例えば、培養後の細胞または菌体をアクリルアミド等のゲルで包含したもの、アルミナ、シリカ、ゼオライト、珪藻土等の無機担体に担持したもの等が挙げられる。
【0088】
一方、菌体または細胞を破砕することにより、目的の改良型ハロヒドリンエポキシダーゼを採取することもできる。菌体または細胞の破砕方法としては、超音波処理、フレンチプレスやホモジナイザーによる高圧処理、ビーズミルによる磨砕処理、衝撃破砕装置による衝突処理、リゾチーム、セルラーゼ、ペクチナーゼ等を用いる酵素処理、凍結融解処理、低張液処理、ファージによる溶菌誘導処理等が挙げられ、いずれかの方法を単独または必要に応じ組み合わせて利用することができる。
【0089】
得られた破砕液から菌体または細胞破砕残渣を除去する必要がある場合は、例えば、遠心分離や濾過(デッドエンド方式あるいはクロスフロー方式)等、当分野の技術常識に基づいて適切な方法を選択し、実施することにより除去することができる。
【0090】
残渣を除去した後に得られた上清は、細胞抽出液可溶性画分であり、改良型ハロヒドリンエポキシダーゼを含む粗酵素溶液とすることができる。その後、必要に応じて、タンパク質の単離精製に用いられる一般的な生化学的方法、例えば硫酸アンモニウム沈殿、各種クロマトグラフィ(例えばゲル濾過クロマトグラフィ(例えばSephadexカラム)、イオン交換クロマトグラフィ(例えばDEAE−Toyopearl)、アフィニティクロマトグラフィ、疎水性クロマトグラフィ(例えばbutyl Toyopearl)、陰イオンクロマトグラフィ(例えばMonoQカラム)等)、SDSポリアクリルアミドゲル電気泳動等を単独でまたは適宜組み合わせて用いることにより、前記培養物中からハロヒドリンエポキシダーゼを単離精製することができる。
【0091】
本発明の形質転換体が遺伝子組換え体であり、かつ、製造工程での形質転換体の環境への漏出、製品への混入、または使用後の取り扱い等で、二次的に微生物汚染を引き起こす可能性を危惧する場合には、必要に応じて不活化処理を行うことができる。不活化方法としては、改良型ハロヒドリンエポキシダーゼ活性または該活性回収率を低下させず、かつ、形質転換体を不活化できる方法であればいかなる方法でも良く、例えば、熱処理、菌体破砕処理、薬剤処理等の方法を単独または組み合わせて利用できる。
【0092】
一方、改良型ハロヒドリンエポキシダーゼが菌体外または細胞外に生産される場合には、培養液をそのまま使用するか、上述したような遠心分離や濾過等により菌体または細胞を除去する。その後必要に応じて、例えば前述のようにタンパク質の単離精製に用いられる一般的な生化学的方法を単独または適宜組み合わせて用いることにより、改良型ハロヒドリンエポキシダーゼを精製することもできる。
【0093】
形質転換体が植物細胞または植物組織である場合は、セルラーゼ、ペクチナーゼ等の酵素を用いた細胞溶解処理、超音波破砕処理、磨砕処理等により細胞を破壊する。その後必要に応じて、例えば前述のようにタンパク質の単離精製に用いられる一般的な生化学的方法を単独または適宜組み合わせて用いることにより、前記培養物中からハロヒドリンエポキシダーゼを単離精製することができる。単離したハロヒドリンエポキシダーゼは、上述の細胞または菌体と同様に、適当な担体に保持し固定化酵素として使用することもできる。
【0094】
以上のようにして得られる培養物及び改良型ハロヒドリンエポキシダーゼは、本発明の範囲に含まれる。得られる培養物及び改良型ハロヒドリンエポキシダーゼの生産収率は、ハロヒドリンエポキシダーゼ活性を測定し、培養装置あたり、培養液あたり、菌体(形質転換体)湿重量または乾燥重量あたり、酵素液中タンパク質重量あたり等の活性算出することにより求めることができる。
【0095】
また、本発明においては、上記改良型ハロヒドリンエポキシダーゼ遺伝子または改良型ハロヒドリンエポキシダーゼ遺伝子を含む組換えベクターから改良型ハロヒドリンエポキシダーゼを採取することも可能である。すなわち、本発明においては、生細胞を全く使用することなく無細胞タンパク質合成系を採用して、改良型ハロヒドリンエポキシダーゼを産生することが可能である。無細胞タンパク質合成系とは、細胞抽出液を用いて試験管等の人工容器内でタンパク質を合成する系である。なお、本発明において使用される無細胞タンパク質合成系には、DNAを鋳型としてRNAを合成する無細胞転写系も含まれる。この場合、上記の宿主に対応する生物は、下記の細胞抽出液の由来する生物に相当する。ここで、上記細胞抽出液は、真核細胞由来または原核細胞由来の抽出液、例えば、小麦胚芽、大腸菌等の抽出液を使用することができる。なお、これらの細胞抽出液は濃縮されたものであっても濃縮されないものであってもよい。細胞抽出液は、例えば限外濾過、透析、ポリエチレングリコール(PEG)沈殿等によって得ることができる。さらに本発明において、無細胞タンパク質合成は、市販のキットを用いて行うこともできる。そのようなキットとしては、例えば試薬キットPROTEIOSTM(東洋紡)、TNTTM System(プロメガ)、合成装置のPG−MateTM(東洋紡)、RTS(ロシュ・ダイアグノスティクス)等が挙げられる。
【0096】
上記のように無細胞タンパク質合成によって得られる改良型ハロヒドリンエポキシダーゼは、例えば前述のように適宜クロマトグラフィを選択して、精製することができる。
【0097】
6.エピハロヒドリン及び4−ハロ−3−ヒドロキシブチロニトリルの製造方法
上述のようにして製造された改良型ハロヒドリンエポキシダーゼは、酵素触媒として物質生産に利用することができる。すなわち、以下の(1)〜(3)に示す反応に供することができる。
【0098】
(1)1,3−ジハロ−2−プロパノールのエピハロヒドリンへの変換
本変換反応は、1,3−ジハロ−2−プロパノールを、上述の改良型ハロヒドリンエポキシダーゼ及び/または上述の培養により得られる培養物と接触させることにより行うことができる。「接触」とは、1,3−ジハロ−2−プロパノールと上記改良型ハロヒドリンエポキシダーゼ及び/または培養物とを同一の反応系または培養系に存在させること等が挙げられる。具体的には、細胞培養器に1,3−ジハロ−2−プロパノールを添加すること、改良型ハロヒドリンエポキシダーゼ及び/または上記培養物と1,3−ジハロ−2−プロパノールとを混合すること、あるいは細胞を1,3−ジハロ−2−プロパノールの存在下で培養すること等が挙げられる。
【0099】
基質である1,3−ジハロ−2−プロパノールは、前述した一般式(1)で示される化合物である。ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的には1,3−ジフルオロ−2−プロパノール、1,3−ジクロロ−2−プロパノール、1,3−ジブロモ−2−プロパノール、1,3−ジヨード−2−プロパノール等が挙げられ、好ましくは、1,3−ジクロロ−2−プロパノール、1,3−ジブロモ−2−プロパノールである。
【0100】
変換反応液中の基質濃度は、0.01%〜15(W/V)%が好ましい。この範囲内であると酵素安定性の観点から好ましく、0.01%〜10%が特に好ましい。基質は反応液に一括添加あるいは分割添加することができる。分割添加により基質濃度を一定にすることが蓄積性の観点から望ましい。
【0101】
反応液の溶媒としては、酵素活性の最適pH4〜10の付近である水または緩衝液が好ましい。緩衝液としては、例えば、リン酸、ホウ酸、クエン酸、グルタル酸、リンゴ酸、マロン酸、o−フタル酸、コハク酸または酢酸等の塩等によって構成される緩衝液、Tris緩衝液あるいはグッド緩衝液等が好ましい。
【0102】
反応温度は、5℃〜50℃、反応pHは4〜10の範囲で行うことが好ましい。反応温度は、より好ましくは10℃〜40℃である。反応pHは、より好ましくはpH6〜9である。反応時間は基質等の濃度、菌体濃度あるいはその他の反応条件等によって適時選択するが、1時間〜120時間で終了するように条件を設定するのが好ましい。尚、本反応においては、反応の進行に伴い生成するハロゲン化物イオンを反応系内から取り除くことにより、光学純度をより一層向上させることができる。このハロゲン化物イオンの除去は、硝酸銀等の添加によって行うことが好ましい。
【0103】
反応液中に生成、蓄積したエピハロヒドリンは公知の方法を用いて採取及び精製することができる。例えば、酢酸エチル等の溶媒で抽出を行い、減圧下に溶媒を除去することによりエピハロヒドリンのシロップを得ることができる。また、これらのシロップを減圧下に蒸留することによりさらに精製することもできる。
【0104】
(2)1,3−ジハロ−2−プロパノールの4−ハロ−3−ヒドロキシブチロニトリルへの変換
本変換反応は、1,3−ジハロ−2−プロパノールを、上述の改良型ハロヒドリンエポキシダーゼ及び/または上述の培養により得られる培養物と接触させることにより行うことができる。
【0105】
基質である1,3−ジハロ−2−プロパノールは、前述した一般式(1)で示される化合物であり、好ましくは1,3−ジクロロ−2−プロパノール、1,3−ジブロモ−2−プロパノール等である。また、シアン化合物としては、シアン化水素、シアン化カリウム、シアン化ナトリウム、シアン酸またはアセトンシアンヒドリン等の反応液中に添加した際にシアンイオン(CN−)またはシアン化水素を生じる化合物またはその溶液を用いることができる。反応液中の基質濃度は、酵素安定性の観点から0.01%〜15(W/V)%が好ましく、0.01%〜10%が特に好ましい。また、シアン化合物の使用量は、酵素安定性の観点から基質の1倍量〜3倍量(モル)が好ましい。反応条件は、上記6.(1)と同様に行うことができる。
【0106】
反応液中に生成、蓄積した4−ハロ−3−ヒドロキシブチロニトリルは、公知の方法を用いて採取及び精製することができる。例えば、反応液から遠心分離等の方法を用いて菌体を除いた後、酢酸エチル等の溶媒で抽出を行い、減圧下に溶媒を除去することにより4−ハロ−3−ヒドロキシブチロニトリルのシロップを得ることができる。また、これらのシロップを減圧下に蒸留することによりさらに精製することもできる。
【0107】
(3)エピハロヒドリンの4−ハロ−3−ヒドロキシブチロニトリルへの変換
本変換反応は、エピハロヒドリンを、上述の改良型ハロヒドリンエポキシダーゼ及び/または上述の培養により得られる培養物と接触させることにより行う。
【0108】
基質であるエピハロヒドリンは、前述した一般式(2)で示される化合物である。ハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が好ましく、塩素、臭素が特に好ましい。具体的にはエピフルオロヒドリン、エピクロロヒドリン、エピブロモヒドリン、エピヨードヒドリン等が挙げられ、特に好ましくはエピクロロヒドリン、エピブロモヒドリンである。また、シアン化合物はシアン化水素、シアン化カリウム、シアン化ナトリウム、シアン酸またはアセトンシアンヒドリン等の反応液中に添加した際にシアンイオン(CN−)またはシアン化水素を生じる化合物またはその溶液を用いることができる。反応条件、採取及び精製方法は、上記6.(2)と同様に行うことができる。
【0109】
以下、実施例により本発明をさらに具体的に説明する。但し、本発明はこれら実施例によって何ら限定されるものではない。
【実施例1】
【0110】
部位特異的変異導入による改良型ハロヒドリンエポキシダーゼ発現ベクターの作製
【0111】
有用なハロヒドリンエポキシダーゼを取得するため、部位特異的変異導入により配列番号1において第128番目のアミノ酸残基(アラニン残基)に変異が導入されたハロヒドリンエポキシダーゼ遺伝子を発現する組換ベクターを作製した。
【0112】
ハロヒドリンエポキシダーゼHheB(2nd)において、2番目のアミノ酸残基(アラニン)がリジンに置換されたタンパク質をコードする遺伝子が、発現ベクターpTrc99A上にクローニングされているプラスミドpSTT002を鋳型として、PCRによるハロヒドリンエポキシダーゼ遺伝子への部位特異的変異導入を次のように行った。以下の表の組成のPCR反応液を各50μl調製した。
【0113】
【表1】

プライマーとして用いたオリゴヌクレオチドの配列は以下の表の通りである。
【0114】
【表2】

PCR反応用チューブに調製した50μlのPCR反応液を、以下の熱サイクル処理に供した。
【0115】
【表3】

得られたPCR反応液を組換ベクター溶液とし、形質転換に供した。
【実施例2】
【0116】
部位特異的変異を導入した改良型ハロヒドリンエポキシダーゼ遺伝子の配列確認と形質転換体の作製
実施例1にて熱サイクル処理を行ったPCR反応液各2μlに対し、後述の方法にて予め調製しておいた大腸菌JM109株コンピテントセル200μlを加え、0℃で30分間放置した。続いて、当該コンピテントセルに42℃で45秒間ヒートショックを与え、0℃で2分間冷却した。その後、SOC培地(20mM グルコース、2%バクトトリプトン、0.5%バクトイーストエキス、10mM NaCl、2.5mM KCl、1mM MgSO4、1mM MgCl2)を1ml添加し、37℃にて1時間振盪培養した。培養後の培養液200μlをLB Amp寒天培地(アンピシリン100mg/l、寒天2%を含有するLB培地)に塗布し、37℃で一晩培養した。各寒天培地上に出現したコロニーを滅菌爪楊枝で採取して2mlのLB Amp液体培地に接種し、37℃で一晩培養した。得られた各培養液から、PureYieldTM Miniprep System(Promega)を用いてプラスミドを回収した。各プラスミド中のハロヒドリンエポキシダーゼ遺伝子について、キャピラリーDNAシーケンサーCEQ2000(ベックマン・コールター)を用い、添付のマニュアルに従って塩基配列の解析を行った。変異導入が確認されたコロニーを各改良型ハロヒドリンエポキシダーゼ保有形質転換体とした。各プラスミド及び形質転換体を後述の表4のように命名した。
【0117】
大腸菌JM109株のコンピテントセル調製は次のように行った。
大腸菌JM109株をLB培地(1% バクトトリプトン、0.5%バクトイーストエキス、1% NaCl)1mlに接種し37℃、5時間好気的に培養して前培養液を得た。該前培養液0.4mlをSOB培地(2%バクトトリプトン、0.5%バクトイーストエキス、10mM NaCl、2.5mM KCl、1mM MgSO4、1mM MgCl2)40mlに加え、18℃で20時間培養して本培養液を得た。該本培養液を遠心分離 (3700×g、10分間、4℃)により集菌した後、冷TF溶液(20mM PIPES−KOH(pH6.0)、200mM KCl、10mM CaCl2、40mM MnCl2) を13ml加え、0℃で10分間放置し、再度遠心分離(3700×g、10分間、4℃)して上清を除き、大腸菌菌体を得た。該大腸菌菌体を冷TF溶液3.2mlに懸濁し、0.22mlのジメチルスルホキシドを加えて菌体懸濁液を得た。該菌体懸濁液を0℃で10分間放置した後、液体窒素を用いて凍結処理し、−80℃にて保存しておいたものを大腸菌JM109株コンピテントセルとした。
【0118】
【表4】

【実施例3】
【0119】
改良型ハロヒドリンエポキシダーゼによる(R)−CHBN合成反応
(1)改良型ハロヒドリンエポキシダーゼ粗酵素液の調製
実施例2でそのハロヒドリンエポキシダーゼ遺伝子変異が確認された5株(JM109/pSTT156、JM109/pSTT160、JM109/pSTT161、JM109/pSTT165、JM109/pSTT167)及び対照とするJM109/pSTT002の計6株について、各株を用いて合成した(R)−CHBNの光学純度を調べるため、まず各改良型ハロヒドリンエポキシダーゼを発現する形質転換体より粗酵素液を調製した。LB Amp培地をワッセルマン試験管に1mlづつ分注し、各試験管に二次評価選抜株10株及び対照とするJM109/pSTT002のコロニーをそれぞれ植菌した。37℃、210rpmで約8時間培養した後、得られた各培養液100μlを、IPTGを終濃度として1mM含むLB Amp培地(500ml容三角フラスコ中の100ml)に植菌し、37℃、210rpmで16時間培養した。得られた各培養液100mlから遠心分離(3700×g、10分間、4℃)により各菌体を回収し、20mM Tris−硫酸緩衝液(pH8.0)で洗浄した後、菌濃度が12.5gD.C./lとなるように同緩衝液に懸濁した。得られた菌体懸濁液の3mlを、超音波破砕機VP−15S(タイテック、日本)を用いて、出力コントロール4、DUTY CYCLE40%、PULS、TIMER=Bモード10sの条件で氷冷しながら10分間破砕した。破砕した菌体懸濁液を遠心分離(12000rpm、10分間、4℃)に供し、上清を粗酵素液として採取した。得られた各粗酵素液を、それぞれ破砕前の(菌体懸濁液時点での)菌濃度として6.25gD.C./lとなるよう、20mM Tris−硫酸緩衝液(pH8.0)で希釈し、本粗酵素液を用いて以下の方法によりハロヒドリンエポキシダーゼ活性(脱クロル活性)を測定した。100mlの活性測定用反応液(50mM DCP、20mM Tris−硫酸緩衝液(pH8.0))を調製して、温度を20℃に調整した。該反応液に上記粗酵素液を添加し、反応を開始した。ハロヒドリンエポキシダーゼ活性による塩化物イオンの遊離に伴うpHの低下を、pH自動コントローラを用いて0.01規定の水酸化ナトリウム水溶液の投入によりpHを8に保つよう連続的に調整した。10分間の反応の間に、pHを8に保つために投入された0.01規定の水酸化ナトリウム水溶液の量から、塩化物イオン生成量を算出し、ハロヒドリンエポキシダーゼ活性(脱クロル活性)(U)を算出した。1Uを上記条件下でDCPから1分間当たり1μmol塩化物イオンの脱離する酵素量に相当するものと定義し、活性測定に用いた各粗酵素液の活性、及び該活性を活性測定に用いた各粗酵素液の液量で除することにより各粗酵素液の液活性を算出した。
【0120】
(2)分析方法
後述する改良型ハロヒドリンエポキシダーゼによる(R)−CHBNの合成反応において実施する反応液中のDCP、ECH及びCHBN濃度分析及び生成CHBNの光学純度分析は、以下のように行った。
【0121】
<反応液中のDCP、ECH及びCHBN濃度分析>
反応液中のDCP、ECH及びCHBN濃度分析は、逆相HPLCにより行った。逆相HPLC分析条件を表5に示す。
【0122】
【表5】

【0123】
反応終了液100μlを、上表記載の移動相5mlにより希釈混合した後、上表記載の分析条件により分析を行った。予め、濃度既知のDCP、ECH及びCHBN溶液を用いて検量線を作成し、該検量線を用いて反応液中のDCP、ECH及びCHBN濃度を求めた。
【0124】
<生成CHBNの光学純度分析>
生成CHBNの光学純度分析は、CHBNをエステル化後、順相系HPLCにより行った。順相系HPLC分析条件を表6に示す。
【0125】
【表6】

【0126】
反応終了液約400μlに等量の酢酸エチルを加えて抽出を行った。酢酸エチル相を分取し、少量の無水硫酸マグネシウムを加えて攪拌した。酢酸エチル相を全量なすフラスコに分取してロータリーエバポレータ(東京理化機械)にセットし、50℃、250torr、60分間濃縮した。残存物に20μlのジクロロメタンと20μlのピリジン、及び20μlの(+)−α−メトキシ−α−(トリフルオロメチル)フェニルアセチルクロライド(以下、(+)−MTPAと称することがある)を添加した。室温で一晩反応させた後、400μlのジイソプロピルエーテル(以下、IPEと称することがある)を添加し、1規定の塩酸を加えて抽出を行った。IPE相を分取し、飽和炭酸水素ナトリウム水溶液を400μl加えて抽出を行った。IPE相を1.5mlチューブに分取し、アスピレータによりIPE相を揮発させた。残存物をn−ヘキサン:2−プロパノール=4:1の混合液に懸濁した後、表5に記載の分析条件により分析を行った。(R)−CHBN−(+)−MTPAエステル及び(S)−CHBN−(+)−MTPAエステルのエリア面積比から各濃度を算出し、本明細書において説明した要領(前述)でCHBNの光学純度を算出した。
【0127】
(3)改良型ハロヒドリンエポキシダーゼによるDCPからの(R)−CHBNの合成
実施例3(1)で調製した各改良型ハロヒドリンエポキシダーゼ発現形質転換体由来粗酵素液を用い、シアン化カリウム存在下、DCPまたはECHからのCHBN合成反応を行った。反応液基本組成は以下の表のようにし、反応スケールは0.5mlで行った。
【0128】
【表7】

【0129】
反応は20℃にて3時間行った。反応終了後、実施例3(2)に記載の分析条件により、反応液中のDCP、ECH及びCHBN濃度及び生成CHBNの光学純度を分析した。結果を表8に示した。
【0130】
【表8】

【0131】
対照とする形質転換体株JM109/pSTT002由来の粗酵素液を用いて合成された(R)−CHBNの光学純度は91.7%e.e.であった。これに対し改良型ハロヒドリンエポキシダーゼを発現する4種の形質転換体株(JM109/pSTT156、JM109/pSTT160、JM109/pSTT161、JM109/pSTT167)由来の粗酵素液を用いて合成された(R)−CHBNの光学純度は92.8から99.9%e.e.を超えており、光学純度が向上していることが確認された。従って、これらの改良型ハロヒドリンエポキシダーゼは、DCP及び/または中間体ECHに対する立体選択性が向上していると言える。
【0132】
(4)改良型ハロヒドリンエポキシダーゼによるECHからの(R)−CHBNの合成
実施例3(1)で調製した各改良型ハロヒドリンエポキシダーゼ発現形質転換体由来粗酵素液を用い、シアン化カリウム存在下、ECHからのCHBN合成反応を行った。反応液基本組成は以下の表のようにし、反応スケールは0.5mlで行った。
【0133】
【表9】

【0134】
反応は20℃にて3時間行った。反応終了後、実施例3(2)に記載の分析条件により、反応液中のDCP、ECH及びCHBN濃度及び生成CHBNの光学純度を分析した。結果を表10に示した。
【0135】
【表10】

【0136】
対照とする形質転換体株JM109/pSTT002由来の粗酵素液を用いて合成された(R)−CHBNの光学純度は78.9%e.e.であった。これに対し改良型ハロヒドリンエポキシダーゼを発現する4種の形質転換体株(JM109/pSTT156、JM109/pSTT160、JM109/pSTT161、JM109/pSTT165)由来の粗酵素液を用いて合成された(R)−CHBNの光学純度は79.9〜93.6%e.e.であり、光学純度が向上していることが確認された。従って、これらの改良型ハロヒドリンエポキシダーゼは、ECHに対する立体選択性が向上していると言える。
【産業上の利用可能性】
【0137】
本発明の改良型ハロヒドリンエポキシダーゼは、立体選択性に優れており、本発明の酵素を利用することにより、光学活性エピハロヒドリンまたは4−ハロ−3−ヒドロキシブチロニトリルを効率よく製造することができる。
【受託番号】
【0138】
N−1074株:受託番号「FERM BP−2643」として、独立行政法人産業技術総合研究所特許生物寄託センター(茨城県つくば市東1−1−1中央第6に昭和63(1988)年11月10日付で寄託されている。
【0139】
pSJ023:形質転換体ATCC12674/pSJ023(受託番号「FERM BP−6232」)として独立行政法人産業技術総合研究所特許生物寄託センター(茨城県つくば市東1−1−1中央第6)に平成9(1997)年3月4日付けで寄託されている。
Rhodococcus rhodochrous J1株(受託番号「FERM BP−1478」)
[配列表の説明]
配列番号1:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)のアミノ酸配列
配列番号2:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)のアミノ酸配列
配列番号3:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(2nd)の塩基配列
配列番号4:コリネバクテリウム属(Corynebacterium sp.)N−1074株由来のHheB(1st)の塩基配列
配列番号5:プライマーDH−75
配列番号6:プライマーDH−76
配列番号7:プライマーDH−83
配列番号8:プライマーDH−84
配列番号9:プライマーDH−85
配列番号10:プライマーDH−86
配列番号11:プライマーDH−93
配列番号12:プライマーDH−94
配列番号13:プライマーDH−97
配列番号14:プライマーDH−98
配列番号15:アミノ酸配列I
配列番号16:変異ペプチド
配列番号17:変異ペプチド
配列番号18:変異ペプチド
配列番号19:変異ペプチド
配列番号20:変異ペプチド
配列番号21:変異ペプチド
配列番号22:変異ペプチド
配列番号23:変異ペプチド
配列番号24:変異ペプチド
配列番号25:変異ペプチド
【特許請求の範囲】
【請求項1】
以下のアミノ酸配列I:
S−α1−α2−α3−α4−α5−α6−α7−α8−α9−α10−α11−α12−Y−α13−α14−A−R−α15(配列番号15)
(SはSer残基、YはTyr残基、AはAla残基、RはArg残基を表し、α1〜α15はそれぞれ独立して同一のまたは異なる任意のアミノ酸残基を表す。)
を含む野生型ハロヒドリンエポキシダーゼのアミノ酸配列に対して、開始アミノ酸残基より1残基C末端側のアミノ酸残基がLysに置換され、且つ、α10残基が他のアミノ酸に置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
【請求項2】
α10残基におけるアミノ酸変異がCys,Gln,Ile,MetまたはValである、請求項1に記載の改良型ハロヒドリンエポキシダーゼ。
【請求項3】
野生型ハロヒドリンエポキシダーゼが、B型に分類されるものである、請求項1または2に記載の改良型ハロヒドリンエポキシダーゼ。
【請求項4】
野生型ハロヒドリンエポキシダーゼが、コリネバクテリウム(Corynebacterium)属細菌またはマイコバクテリウム(Mycobacterium)属細菌由来のものである、請求項1〜3のいずれかに記載の改良型ハロヒドリンエポキシダーゼ。
【請求項5】
請求項1〜4のいずれかに記載の改良型ハロヒドリンエポキシダーゼをコードする遺伝子。
【請求項6】
請求項5に記載の遺伝子を含む組換えベクター。
【請求項7】
請求項6に記載の組換えベクターを宿主に導入してなる形質転換体または形質導入体。
【請求項8】
請求項7に記載の形質転換体または形質導入体を培養して得られる培養物。
【請求項9】
請求項1〜4のいずれかに記載の改良型ハロヒドリンエポキシダーゼ及び/または請求項8に記載の培養物を、1,3−ジハロ−2−プロパノールと接触させることによりエピハロヒドリンを生成させることを特徴とする、エピハロヒドリンの製造方法。
【請求項10】
請求項1〜4のいずれかに記載の改良型ハロヒドリンエポキシダーゼ及び/または請求項8に記載の培養物を、シアン化合物存在下、1,3−ジハロ−2−プロパノールまたはエピハロヒドリンと接触させることにより4−ハロ−3−ヒドロキシブチロニトリルを生成させることを特徴とする、4−ハロ−3−ヒドロキシブチロニトリルの製造方法。
【請求項1】
以下のアミノ酸配列I:
S−α1−α2−α3−α4−α5−α6−α7−α8−α9−α10−α11−α12−Y−α13−α14−A−R−α15(配列番号15)
(SはSer残基、YはTyr残基、AはAla残基、RはArg残基を表し、α1〜α15はそれぞれ独立して同一のまたは異なる任意のアミノ酸残基を表す。)
を含む野生型ハロヒドリンエポキシダーゼのアミノ酸配列に対して、開始アミノ酸残基より1残基C末端側のアミノ酸残基がLysに置換され、且つ、α10残基が他のアミノ酸に置換されたアミノ酸変異が導入されたアミノ酸配列からなる、改良型ハロヒドリンエポキシダーゼ。
【請求項2】
α10残基におけるアミノ酸変異がCys,Gln,Ile,MetまたはValである、請求項1に記載の改良型ハロヒドリンエポキシダーゼ。
【請求項3】
野生型ハロヒドリンエポキシダーゼが、B型に分類されるものである、請求項1または2に記載の改良型ハロヒドリンエポキシダーゼ。
【請求項4】
野生型ハロヒドリンエポキシダーゼが、コリネバクテリウム(Corynebacterium)属細菌またはマイコバクテリウム(Mycobacterium)属細菌由来のものである、請求項1〜3のいずれかに記載の改良型ハロヒドリンエポキシダーゼ。
【請求項5】
請求項1〜4のいずれかに記載の改良型ハロヒドリンエポキシダーゼをコードする遺伝子。
【請求項6】
請求項5に記載の遺伝子を含む組換えベクター。
【請求項7】
請求項6に記載の組換えベクターを宿主に導入してなる形質転換体または形質導入体。
【請求項8】
請求項7に記載の形質転換体または形質導入体を培養して得られる培養物。
【請求項9】
請求項1〜4のいずれかに記載の改良型ハロヒドリンエポキシダーゼ及び/または請求項8に記載の培養物を、1,3−ジハロ−2−プロパノールと接触させることによりエピハロヒドリンを生成させることを特徴とする、エピハロヒドリンの製造方法。
【請求項10】
請求項1〜4のいずれかに記載の改良型ハロヒドリンエポキシダーゼ及び/または請求項8に記載の培養物を、シアン化合物存在下、1,3−ジハロ−2−プロパノールまたはエピハロヒドリンと接触させることにより4−ハロ−3−ヒドロキシブチロニトリルを生成させることを特徴とする、4−ハロ−3−ヒドロキシブチロニトリルの製造方法。
【図1】




【公開番号】特開2012−228221(P2012−228221A)
【公開日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願番号】特願2011−99619(P2011−99619)
【出願日】平成23年4月27日(2011.4.27)
【出願人】(000006035)三菱レイヨン株式会社 (2,875)
【Fターム(参考)】
【公開日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願日】平成23年4月27日(2011.4.27)
【出願人】(000006035)三菱レイヨン株式会社 (2,875)
【Fターム(参考)】
[ Back to top ]

