放射性同位体で標識されたリジン及びオルニチン誘導体、それらの使用及び製造方法
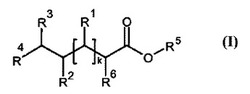
本発明は、キレート剤を含まない放射性同位体による放射標識に適した化合物、及び一般式I:

で示される放射標識化合物に関する。前記化合物はオルニチン又はリジン誘導体である。

で示される放射標識化合物に関する。前記化合物はオルニチン又はリジン誘導体である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、キレート剤を含まない放射性同位体による放射標識に適した化合物、及び、一般式Iの放射標識化合物:
【化1】

に関する。
【0002】
前記化合物はオルニチン又はリジン誘導体である。本発明はさらに、疾患を造影するための前記化合物の使用、斯かる化合物を製造する方法、斯かる化合物を含む組成物、斯かる化合物又は組成物を含むキットに関する。
【背景技術】
【0003】
悪性腫瘍の早期診断は腫瘍患者の生存予測において重要な役割を担っている。この診断においては、非侵襲的な画像診断プロセスが重要な手段である。近年、特にPET技術(Positron Emission Tomography)が極めて有用であるとわかった。PET技術の感度及び特異性は、使用されるシグナル伝達物質(トレーサー)及びその体内分布に著しく依存する。適当なトレーサーの探索において、腫瘍組織を健康な周囲の組織から識別する、腫瘍のある性質を利用する試みがなされてきた。PETスキャンに使用される放射性核種は典型的には、炭素−11(〜20分間)、窒素−13(〜10分間)、酸素−15(〜2分間),フッ素−18(〜110分間)、ヨウ素−131(〜8日間)及びヨウ素−124(〜4.2日間)といった短半減期の陽電子放出同位体である。これらの放射性核種は、グルコース(又はグルコース類似体)、水、又はアンモニア等の生体が通常利用する化合物に、或いは受容体やその他の薬物作用部位に結合する分子に取り込まれる。このような標識化合物は放射性トレーサーとして知られる。PETに使用される商業的に利用される好ましい同位体は18Fである。2時間未満という短い半減期ゆえに、好適な放射性トレーサーの製造において、18Fには特定の要請が課される。トレーサーを造影及び/又は診断に使用する前に同位体の放射能の大部分が崩壊しまうため、煩雑且つ長い合成経路及び精製はこの同位体には使用できない。従って、非放射性フッ素化の確立された合成経路は18Fトレーサーの合成に使用できない場合が多い。加えて、18Fは比活性が高い(約80GBq/nmol)ため、トレーサー合成用の[18F]フッ素物質は極めて少量となり、ひいては極度に過剰の前駆体が要求されるため、非放射性フッ素化反応に基づく放射性合成戦略の成功は予測不能となってしまう。
【0004】
FDG([18F]2−フルオロデオキシグルコース)−PETは、腫瘍の診断及び追加的臨床モニタリングにおいて広く受け入れられ、且つ広範囲に普及している手段である。悪性腫瘍は、栄養供給に対するグルコース供給について宿主生物と競合する(Warburg O. Ueber den Stoffwechsel der Carcinomzelle [Concerning the Metabolism of the Carcinoma Cell]. Biochem. Zeitschrift 1924; 152: 309-339; Kellof G. Progress and Promise of FDG-PET Imaging for Cancer Patient Management and Oncologic Drug Development. Clin Cancer Res. 2005; 11(8): 2785-2807)。ここで、腫瘍細胞は通常、周囲の正常組織の細胞と比較してグルコース代謝が増大している。この腫瘍特異的メカニズムが、グルコース誘導体であるフルオロデオキシグルコース(FDG)の使用において利用され、この誘導体は増加量で細胞内に輸送されるが、そこでリン酸化の後にFDG6−ホスファートとして代謝的に捕捉される(「ワールブルグ効果」)。故に18F−標識FDGはPET技術による患者の腫瘍の検出に有用なトレーサーである。新規なPETトレーサーの探索において、近年、アミノ酸もまた18F PET造影に利用されることが多くなっている(例えば(総説):Eur J Nucl Med Mol Imaging. 2002 May; 29(5):681-90)。ここでは、18F−標識アミノ酸の幾つかが蛋白合成速度の測定に好適であるが、他の殆どの誘導体は、腫瘍における直接的細胞取り込みの測定に好適である。既知の18F−標識アミノ酸は、例えばチロシン、フェニルアラニン、プロリン、アスパラギン及び非天然アミノ酸から誘導される(例えば、J. Nucl Med 1991; 32:1338-1346, J Nucl Med 1996; 37:320-325, J Nucl Med 2001; 42:752-754 and J Nucl Med 1999; 40:331-338)。
【0005】
腫瘍診断に利用されている現在のPETトレーサーには、議論の余地のない幾つかの不都合がある。即ち、FDGはグルコース代謝が増大している細胞に集積するのが好ましいのであるが、他の病的及び生理的状態に関連する細胞及び組織、例えば感染巣又は創傷治癒巣でもグルコース代謝の増大がある(J. Nucl. Med. Technol. (2005), 33, 145-155に要約されている)。FDG−PETによって検出された病変が本当に腫瘍起源のものであるのか、それとも別の生理的又は病的な組織の状態に帰するべきものなのか、判断することは今なおしばしば困難である。全体として、腫瘍学におけるFDG−PETによる診断活動は、84%の感度及び88%の特異性を有する(Gambhir et al. “A tabulated summary of the FDG PET literature” J. Nucl. Med. 2001, 42, 1-93S)。脳の腫瘍は、例えば健康な脳組織にFDGが高集積するため、極めて不完全にしか示されない。
【0006】
これまでに知られている18F−標識アミノ酸誘導体は、一部の例では脳内の腫瘍の検出に適している((総説):Eur J Nucl Med Mol Imaging . 2002 May; 29(5):681-90)が、他の腫瘍では、それらは「ゴールドスタンダード」である[18F]2−FDGの造影特性に匹敵し得ない。
【0007】
従って、より有効な疾患標的化能力を示す放射性トレーサーに対する明白な要請が存在する。前記放射性トレーサーには、信頼性が高く明快な患者のPET画像を生成可能であることが求められる。
【0008】
これまでのF−18−標識アミノ酸の、腫瘍性組織における代謝的集積及び滞留は一般的にはFDGよりも低い。さらに、異性体的に純粋なF−18−標識化非芳香族アミノ酸へのアクセス可能性は、化学的に極めて厳しい。オルニチンは尿素サイクルで役割を果たしているアミノ酸である。オルニチンは、尿素を作り出すL−アルギニンに働く酵素アルギナーゼの作用の生成物の1つである。よってオルニチンは、過剰の窒素を処理する尿素サイクルの中心部である。オルニチンはDNAによってコードされているアミノ酸ではなく、その意味では蛋白合成に関与していない。しかしながら哺乳動物の非肝臓組織では、尿素サイクルの主たる用途はアルギニン生合成にあり、従って代謝プロセスの中間体としてオルニチンはかなり重要である。
【0009】
フッ素化オルニチン誘導体はずっと以前から知られており、文献に記載されている。例えば4−フルオロ−オルニチン(Journal of Fluorine Chemistry, volume 7, issue 4, April (1976), p. 397-407)。
【0010】
【化2】

【0011】
Jandre de VilliersはL−3−フルオロ−オルニチン誘導体(2)について述べているが、その合成は失敗している(“Master Thesis“, University of Stellenbosch, 2007, p. 26)。
【0012】
【化3】

【0013】
フッ素化オルニチン誘導体L−5−(フルオロメチル)−オルニチン(3)が文献及び特許に記載されている(例えば、Tetrahedron: Asymmetry (1997), 8(2), 327-335、WO 9524181A1、EP326766)。
【0014】
【化4】

【0015】
酵素オルニチンデカルボキシラーゼ(ODC)のレベルが各々の腫瘍病期と良く相関することが観察されている。酵素ODCはポリアミン生合成経路における第一の且つ律速酵素である。OCDはオルニチンからポリアミン類への細胞内変換を担っている。高い蛋白量及び増大したODCの酵素活性が種々の腫瘍組織で観察された。
【0016】
高いODCレベル及び増大した酵素活性は、腫瘍組織において高いポリアミンレベルを導く。ポリアミンレベル自身がやはり腫瘍病期に相関することが示されている。即ち、非腫瘍組織に対比して腫瘍組織では高いポリアミン含有量が観察されており、高い腫瘍病期はさらに増加したポリアミン含有量を示した。
【0017】
リジンは動物では合成されないアミノ酸であり、哺乳動物において代謝され、α−ケトグルタラートによる初期のアミノ基転移を経てアセチルCoAを生成する。このリジン代謝の初期工程に関与する酵素がリジン−2−オキソグルタラートレダクターゼ及びサッカロピンデヒドロゲナーゼである(Fellows et al. Biochem J. 1973 October; 136(2): 329-334)。
【0018】
アセチル−CoAもまた神経伝達物質アセチルコリンの生合成における重要な構成成分である。アセチル−CoAと合したコリンは酵素コリンアセチルトランスフェラーゼで触媒されてアセチルコリン及び副生成物の補酵素を産生する。
【0019】
フッ素化リジン誘導体もまた知られている。例えば(5S)−5−フルオロ−L−リジン(例えばJournal of Medicinal Chemistry; 47; 4; (2004); 900 - 906)又は例えばα−N−Boc−4R−フルオロ−L−リジン(例えばOrganic and Biomolecular Chemistry; 1; 20; (2003); 3527 - 3534)。
【0020】
ポリアミン類は、細胞の増殖、生存及びアポトーシスを支配する重要な分子である(総説:J. Biochem. 139, 27-33, (2006))。プトリシン(1,4−ジアミノブタン)は、スペルミン及びスペルミジンのような天然ポリアミンの生合成のための前駆体である。腫瘍におけるポリアミン代謝の造影は野心的目標である。Welch et al. (Int. Jour. Radiat. Appl. Instrum. 1986, Vol 37, No. 7, 607-612)は[18F]フルオロ−プトリシンの合成を開発した。あいにく[18F]フルオロ−プトリシンは、遊離の[18F]フッ化物の比較的高いインビボ放出のため、腫瘍の造影又は腫瘍のポリアミン代謝の造影に適していないことが判明した。
【発明の概要】
【発明が解決しようとする課題】
【0021】
本発明の目的は、過剰増殖性疾患のような疾患の造影のため、キレート剤を含まない放射性同位体で放射標識するのに適した新規アミノ酸化合物を発見することである。好ましいアミノ酸はオルニチン及びリジンである。
【0022】
癌と診断された患者は、腫瘍の解剖学的広がりに従って病期診断、又は分類される。病期診断は、治療法を選択し、予後を予測し、そして他の臨床医及び科学者とのコミュニケーションを容易にするために用いられる。固形腫瘍を持つ患者における病期診断は、(1)原発腫瘍の解剖学的広がり(T)、(2)局所リンパ節への転移の存在及び位置(N)、及び(3)遠隔臓器への転移の存在及び位置(M)を決定することから成る(Zuluaga et al., 1998)。癌の病期診断、反応評価、及び放射線治療の計画のため、腫瘍学においてPETがますます使用されつつある。得られたPET画像は放射線治療計画のための必要不可欠な情報を提供する。局所及び遠隔転移を検出及び診断するための現行法は、治療を最適化するに充分な感受性及び特異性を欠いている。検出されない微小転移のある多くの患者が、間違いなく完全な治療を受けておらず、一方で「高リスク」群に分類された別の患者達が、腫瘍が広がっているか否かさえ確認されずに積極的全身治療を受けている。
【0023】
過剰増殖性疾患の検出、病期診断、及び治療監視のための、分子レベルに至るまで正確且つ感度の高い情報を提供する非侵襲的造影モダリティを開発する差し迫った必要性が存在する。
【0024】
全身放射性核種治療は、患者内への放射線源の投与を含む放射線治療の1形態である。全身放射性核種治療を利用すると、疾患の生理がこの治療の最終結果に大きく貢献し、腫瘍への放射性核種のデリバリーをもたらす。患者自身の生理的プロセスによって腫瘍にデリバリーされる放射性材料を使用することにより、最小量の患者の操作で特定の腫瘍に高い線量の放射線をデリバリーすることが可能である。放射性核種及びターゲッティング剤から成る放射性トレーサーは、PET造影中のバックグラウンドシグナルを産む非特異結合を回避しつつ、標的部位に特異的且つ効率的にビークル化(vehiculate)されるであろう。過剰増殖性疾患に関与する標的部位に特異的に結合又は集積する放射性トレーサーを開発する、差し迫った必要性が存在する。
【0025】
驚くべきことに、本発明化合物は造影に好適であることが見出された。好ましくは本発明化合物は、PET、SPECT又はマイクロPET造影のために、又はコンピューター断層撮影(CT)、及び磁気共鳴(MR)分光法のような他の従来の造影法と組み合わせるのが好適である。
【0026】
驚くべきことに、本発明化合物は放射線治療又は競合的治療として知られる過剰増殖性疾患の治療に好適であることが見出された。放射線治療は、本発明の無キレート剤放射標識化合物の放射特性を利用することによって実施される。
【0027】
驚くべきことに、本発明化合物は、過剰増殖性疾患の進行の病期診断、監視、又は過剰増殖性疾患に向けられた治療に対する反応の監視に好適であることが見出された。
【課題を解決するための手段】
【0028】
本発明の規定による、一般式Iに示される無キレート剤放射性核種標識リジン又はオルニチン誘導体(それらのジアステレオマー及びエナンチオマーを包含する)により、目的が達成される:
【0029】
・本発明は、式Iで示される新規化合物を提供する。これら式Iの化合物が、無キレート剤放射性核種、好ましくは18F又は19Fを持たず、代わりに適当な脱離基を含んでいる場合、これらは無キレート剤放射性核種、好ましくは式Iを有する18F−標識又は19F−標識された化合物の合成のための前駆体化合物である。式Iを有する19F−標識化合物は、無キレート剤放射性核種で標識された式Iの化合物への合成の標準参照化合物(同定手段としての、及び品質確認のための)である。以下において、適当な脱離基を含み無キレート剤放射性核種又は19Fを含まない式Iの化合物もまた「式Iを有する前駆体化合物」と称する。さらに、無キレート剤放射性核種を含み、適当な脱離基又は適当な脱離基への変換に適した部分を含まない式Iの化合物もまた、「無キレート剤放射性核種で標識された式Iの化合物」と称する。さらに、式Iの前駆体化合物の一部である適当な脱離基に変換されるのに適した部分を含む式Iの化合物は、「式Iを有する出発材料」とも称される。好ましくは、無キレート剤放射性核種は18Fである。
【0030】
・本発明はさらに、疾患を造影する及び/又は疾患を診断する方法を提供し、この方法は、検出可能量の無キレート剤放射性核種、好ましくは18Fで標識された式Iの化合物を患者内に導入することを含む。
【0031】
・本発明はさらに、医薬として使用するための、無キレート剤放射性核種、好ましくは18Fで標識された、又は19Fで標識された、式Iの化合物をも提供する。
【0032】
・本発明はさらに、化合物、好ましくは式Iを有する無キレート剤放射性核種標識化合物及び医薬的に許容される担体又は希釈剤を含む医薬組成物をも提供する。
【0033】
・本発明のもう一つの局面は、医薬の製造のための式Iの化合物の使用、好ましくは18F−又は19F−標識された式Iの化合物の使用を対象とする。
【0034】
・本発明はさらに、式Iを有する前駆体化合物から無キレート剤放射性核種で標識された式Iの化合物を取得する方法をも提供する。
【0035】
・本発明はさらに、式Iを有する前駆体化合物から19F−標識された式Iの化合物を取得する方法をも提供する。
【0036】
・本発明はさらに、放射性医薬品を製造するためのキットをも提供し、このキットは、
a)式Iの化合物、又は、
b)式Vの化合物及び式VIの化合物又はこれらの混合物、
を含む密封バイアルを含む。
【0037】
・本発明はさらに、式Iを有する出発化合物(ここで、式Iを有する前駆体化合物の脱離基に変換される化学的官能基は、sp2−ハイブリダイズした炭素原子にも結合している)から「式Iを有する前駆体化合物」(ここで、式Iを有する前駆体化合物の脱離基は、sp2−ハイブリダイズした炭素原子に結合している)を得るための方法をも提供する。
【0038】
・本発明はさらに、式Iを有する出発化合物(ここで、式Iを有する前駆体化合物の脱離基に変換される化学的官能基は、sp3−ハイブリダイズした炭素原子にも結合している)から「式Iを有する前駆体化合物」(ここで、式Iを有する前駆体化合物の脱離基は、sp3−ハイブリダイズした炭素原子に結合している)を得るための方法をも提供する。
【0039】
・本発明はさらに、疾患を造影するためのキットをも提供する。より詳細には、本発明化合物は、腫瘍を包含する(但しこれに限定される訳ではない)過剰増殖性疾患の造影に有用である。故に本発明は、これらの疾患を診断するための、そして病期診断及び治療監視するための、造影化合物の使用にも関連する。
【0040】
・本発明はさらに、SPECT造影(I−123;「ヨウ素SPECT化合物」)又はPET造影(I−124;「ヨウ素PET化合物」)又は放射線治療(I−125及びI−131;「ヨウ素治療化合物」)又は標準参照化合物(I−127;「ヨウ素参照標準化合物」)に適した放射性ヨウ素同位体で標識された式Iの化合物をも提供する。
【図面の簡単な説明】
【0041】
【図1】細胞競合実験における(5R)−[18F]−フルオロメチル−L−オルニチン(38)の生物活性の調査(NCI−H460及びA549細胞、PBS−Puffer中0.25MBqの(5R)−[18F]−フルオロメチル−L−オルニチンと共に30分間インキュベート、L−オルニチン濃度1mM)。
【図2】幾つかの腫瘍セルラインへの(5R)−[18F]−フルオロメチル−L−オルニチン(38)の結合。(A549、H460(共にヒトNSCLC)並びにPC3及びDU145(共に前立腺)腫瘍セルラインを使用し、0.25MBqの(5R)−[18F]−フルオロメチル−L−オルニチンと共に最長30分間インキュベートした。10分、20分及び30分後に細胞に結合した活性の割合を決定した。
【図3】14C−オルニチン取り込みについて競合する(3R)−3−フルオロ−L−オルニチンジヒドロクロリド(31)の特異性を、A549細胞における細胞競合実験で決定した(0.1μCiの14C−オルニチンをトレーサーとして使用し、(3R)−3−フルオロ−L−オルニチン−ジヒドロクロリドを1mM濃度で使用した。インキュベーション時間10分間)。
【図4】腫瘍細胞への取り込みについての(4S)−[18F]−フルオロ−L−オルニチン(29)の特異性を、A549及びPC3腫瘍細胞を用いる細胞競合実験で決定した(0.25MBqの(4S)−[18F]−フルオロ−L−オルニチンをトレーサーとして使用し、過剰の1mM L−オルニチンを取り込み系の飽和のために使用した。インキュベーション時間30分間)。
【図5】(4S)−[18F]−フルオロ−L−オルニチン(29)の取り込みの時間依存性を調べた。(A549及びPC3細胞を0.25MBqの(4S)−[18F]−フルオロ−L−オルニチンと共に最長60分間インキュベートし、10、20、30及び60分後に細胞に結合した割合を決定した)。
【図6】A549腫瘍細胞における(4S)−[18F]−フルオロ−L−オルニチン(29)の保持の調査。A549細胞にPBS中の0.25MBq(4S)−[18F]−フルオロ−L−オルニチンを30分間ロードした。洗浄後、この細胞を新たな緩衝液(活性無し)と共にさらに10、20、30分間インキュベートした。上清への放射能の放出及び細胞内部への保持を測定した。
【図7】H460腫瘍を有するラットにおける(4S)−[18F]−フルオロ−L−オルニチン(29)のPET造影。7.16MBqの放射性トレーサーをラットにi.v.注射した。Inveon PET/CTスキャナーを使用し45分のp.i.から30分間PET画像を取得した。
【発明を実施するための形態】
【0042】
第1の局面では、本発明は、式Iの化合物:
【化5】

[式中、
R1、R2及びR3は、
a)水素、
b)R7−C1−C10アルコキシ、
c)R7−C1−C10アルキル、
d)R7−C2−C10アルケニル、
e)R7−C2−C10アルキニル、
f)(R7−アリール)−C0−C10アルキル、
g)(R7−ヘテロアリール)−C0−C10アルキル、
h)((R7−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
i)R7、
j)ヒドロキシ、
k)C6−C10アラルキル、
l)C1−C10アルキル、及び、
m)C1−C10アルコキシ、
を含む群から独立且つ個別に選択され;
R4は、
a)NH2、及び、
b)R14、
を含む群から選択され;
R5は、
a)水素、
b)Z、及び、
c)R13、
を含む群から選択され;
R6は、
a)NH2、及び、
b)R14、
を含む群から選択され;
R7は、
a)[19F]フルオロ、
b)無キレート剤放射性核種、
c)R15、及び、
d)R10、
を含む群から選択され;
R10は、R20及びR30を含む群から選択され;
R15は、脱離基であり;
R14は、
a)N(H)(R9)、
b)N(R9)2、
c)N=C(R11)(R12)、
d)1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル(フタルイミド)、及び、
e)アジド基、
を含む群から選択され;
R13は、カルボン酸保護基であり;
R20は、
a)ヨード、
b)−Sn((C1−C6)アルキル)3、
c)−B(OR60)(OR61)[式中、Bは硼素を意味する]、及び、
d)−NMe2、
を含む群から選択され;
R30は、ヒドロキシであり;
Zは、金属イオン等価物であり;
R9は、アミノ保護基であり;
R11及びR12は、
a)C1−C5アルキル、
b)置換又は非置換アリール、
c)置換又は非置換アラルキル、及び、
d)置換又は非置換ヘテロアリール、
を含む群から独立且つ個別に選択され;
R60及びR61は、水素、(C1−C6)アルキル及びシクロアルキルを含む群から独立且つ個別に選択され;ここで、R60及びR61は、単結合又は「メチレン橋」により相互に連結されていてもよく;
kは、1〜4の整数である]であって、
前記化合物の全異性体型を包含し、前記全異性体型は、限定されるものではないが、エナンチオマー及びジアステレオマー並びにラセミ混合物を包含する、化合物、並びに医薬的に許容されるその塩、エステル、アミド、複合体又はプロドラッグに関する。
【0043】
ある態様では、本発明は、式Iの化合物(但し、式Iの化合物は少なくとも1個のR7を含む)を対象とする。好ましくは、式Iの化合物は2〜3個のR7を含む。より好ましくは、式Iの化合物は、ただ1個のR7を含む。
【0044】
ある態様では、本発明は、式I[式中、R1、R2及びR3は、
a)水素、
b)R7−C1−C6アルコキシ、
c)R7−C1−C6アルキル、
d)R7−C2−C6アルケニル、
e)R7−C2−C6アルキニル、
f)(R7−アリール)−C1−C6アルキル、
g)(R7−ヘテロアリール)−C1−C6アルキル、
h)R7、
i)ヒドロキシ、及び、
j)C1−C5アルキル、
を含む群から個別且つ独立に選択される]
の化合物を対象とする。
【0045】
好ましくは、R1、R2及びR3は、
a)水素、
b)R7−C1−C6アルコキシ、
c)R7−C1−C6アルキル、
d)R7−C2−C6アルケニル、
e)(R7−フェニル)−C1−C4アルキル、
f)(R7−ピリジル)−C1−C4アルキル、
g)R7、及び、
h)C1−C5アルキル、
を含む群から個別且つ独立に選択される。
【0046】
より好ましくは、R1、R2及びR3は、
a)水素、
b)R7−C1−C6アルキル、
c)R7、及び、
d)C1−C5アルキル、
を含む群から個別且つ独立に選択される。
【0047】
さらに好ましくは、R1、R2及びR3は、
a)水素、
b)R7−C1−C5アルキル、
c)R7、及び、
d)C1−C5アルキル、
を含む群から個別且つ独立に選択される。
【0048】
さらに好ましくは、R1、R2及びR3は、
a)水素、
b)R7−C1−C5アルキル、及び、
c)R7、
を含む群から個別且つ独立に選択される。
【0049】
ある態様では、本発明は、式Iにおいて、
R1、R2及びR3が、
a)水素、
b)R7−C1−C10アルキル、
c)C1−C10アルキル、
d)ヒドロキシ、
e)C1−C10アラルキル、及び、
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され;
但し、R7を1個のみ含む、式Iの化合物を対象とする。
【0050】
好ましい態様では、本発明は、式Iにおいて、
R1、R2及びR3は、
a)水素、
b)R7−C2−C10アルキル、
c)C1−C10アルキル、
d)ヒドロキシ、
e)C1−C10アラルキル、及び、
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択される、式Iの化合物を対象とする。
【0051】
より好ましい態様では、本発明は、式Iにおいて、
R1、R2及びR3は、
a)水素、
b)R7−C3−C10アルキル、
c)C1−C10アルキル、
d)ヒドロキシ、
e)C1−C10アラルキル、及び、
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択される、式Iの化合物を対象とする。
【0052】
さらに好ましい態様では、本発明は、式Iにおいて、
R1、R2及びR3は、
a)水素、
b)R7−C4−C10アルキル、
c)C1−C10アルキル、
d)ヒドロキシ、
e)C1−C10アラルキル、及び、
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択される、式Iの化合物を対象とする。
【0053】
ある態様では、本発明は、式Iにおいて、
R7は、
a)無キレート剤放射性核種、
b)R15、及び、
c)R10、
を含む群から選択される、式Iの化合物を対象とする。
【0054】
別の態様では、本発明は、式Iにおいて、
R7は、
a)19F、
b)無キレート剤放射性核種、及び、
c)R15、
を含む群から選択される、式Iの化合物を対象とする。
【0055】
さらに別の態様では、本発明は、式Iにおいて、
R7は、
a)無キレート剤放射性核種、
b)R15、及び、
c)R10、
を含む群から選択される、式Iの化合物を対象とする。
【0056】
さらに別の態様では、本発明は、式Iにおいて、
R7は、
a)無キレート剤放射性核種、及び、
b)R15、
を含む群から選択される、式Iの化合物を対象とする。
【0057】
さらに別の態様では、本発明は、式Iの化合物であって、
R7は、無キレート剤放射性核種である、化合物を対象とする。
【0058】
好ましくは、R7は、R10又はR15である。
【0059】
ある態様では、本発明は、R7が[19F]フルオロである式Iの化合物を対象とする。
【0060】
R7が[19F]フルオロである時、本化合物はインビトロ及びインビボアッセイの参照化合物として、及び医薬(治療薬)として使用できる。
【0061】
ある態様では、本発明は、式Iの化合物であって、
R7は、無キレート剤放射性核種であるか、又は無キレート剤放射性核種を含む、化合物を対象とする。
【0062】
好ましくは、無キレート剤放射性核種は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]又はフッ素−18[18F]である。
【0063】
より好ましくは、無キレート剤放射性核種は、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、又はヨウ素131[131ヨード]である。さらに好ましくは、無キレート剤放射性核種は、治療用途のためのヨウ素−125[125ヨード]又はヨウ素131[131ヨード]である。より好ましくは、無キレート剤放射性核種が炭素−11[11C]である時、R7は、11CH3、−O(11CH3)、−N(11CH3)(C1−C5)アルキルである。
【0064】
本発明は、SPECT造影(I−123;「ヨウ素SPECT化合物」)又はPET造影(I−124;「ヨウ素PET化合物」)又は放射線治療(I−125及びI−131;「ヨウ素治療化合物」)又は標準参照化合物(I−127;「ヨウ素参照標準化合物」)に適した放射性ヨウ素同位体で標識された式Iの化合物を提供する。
【0065】
ある態様では、R7が、基11CH3、−O(11CH3)、−N(11CH3)(C1−C5)アルキルから選択される時、R7は、好ましくは式Iのsp2−ハイブリダイズした炭素原子に結合している。
【0066】
ある態様では、R7が[18F]フルオロである時、R4及びR6はNH2である。
【0067】
より好ましくは、無キレート剤放射性核種は[18F]フルオロである。
【0068】
R7が[18F]フルオロである時、本化合物はPET又はマイクロPET造影に使用できる。
【0069】
ある態様では、本発明は、R7がR10である式Iの化合物を対象とする。
【0070】
ある態様では、本発明は、R7がR15である式Iの化合物を対象とする。
【0071】
ある態様では、本発明は、R7が、
a)[19F]フルオロ、
b)[18F]フルオロ、
c)R15、
d)R10、
e)[123]ヨード、
f)[124]ヨード、
g)[125]ヨード、
h)[127]ヨード、及び、
i)[131]ヨード、
である式Iの化合物を対象とする。
【0072】
好ましくは、R7は、
a)[19F]フルオロ、
b)[18F]フルオロ、
c)R15、及び、
d)R10、
を含む群から選択される。
【0073】
ある態様では、本発明は、式Iにおいて、
R7が無キレート剤ヨウ素である時、R1、R2及びR3は、
a)水素、
b)(R7−アリール)−C0−C10アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び、
f)C1−C10アルコキシ、
を含む群から独立且つ個別に選択される、式Iの化合物を対象とする。
【0074】
好ましくは、R1、R2及びR3は、
a)水素、及び、
b)(R7−フェニル)−C1−C4アルキル、
を含む群から独立且つ個別に選択される。
【0075】
ある態様では、本発明は、R4がNH2である式Iの化合物を対象とする。
【0076】
ある態様では、本発明は、R4がR14である式Iの化合物を対象とする。
【0077】
ある態様では、本発明は、R5が水素である式Iの化合物を対象とする。
【0078】
ある態様では、本発明は、R5がR13である式Iの化合物を対象とする。
【0079】
ある態様では、本発明は、R5がZである式Iの化合物を対象とする。好ましくは、Zは、Na+、K+、Ca2+及びMg2+を含む群から選択される。より好ましくは、ZはNa+である。
【0080】
ある態様では、本発明は、R6がNH2である式Iの化合物を対象とする。
【0081】
ある態様では、本発明は、R6がR14である式Iの化合物を対象とする。
【0082】
ある態様では、本発明は、式Iにおいて、
R9(アミノ保護基)は、
a)tert−ブトキシカルボニル、
b)アリルオキシカルボニル、
c)ベンジルオキシカルボニル、
d)エトキシカルボニル、
e)メトキシカルボニル、
f)プロポキシカルボニル、
g)2,2,2−トリ塩素エトキシカルボニル、
h)1,1−ジメチルプロピニル、
i)1−メチル−1−フェニル−エトキシカルボニル、
j)1−メチル−1−(4−ビフェニリル)−エトキシカルボニル、
k)シクロブチルカルボニル、
l)1−メチルシクロブチルカルボニル、
m)ビニルカルボニル、
n)アリルカルボニル、
o)アダマンチルカルボニル、
p)ジフェニルメチルカルボニル、
q)シンナミルカルボニル、
r)ホルミル、
s)ベンゾイル、
t)トリチル、
u)−C(H)(CH3)C(H)=C(H)−C(O)OR5、
v)p−メトキシフェニル−ジフェニルメチル、及び、
w)[ジ−(p−メトキシフェニル)]−フェニルメチル、
を含む群から選択される、式Iの化合物を対象とする。
【0083】
好ましくは、R9は、
a)tert−ブトキシカルボニル、
b)ホルミル、
c)トリチル、
d)p−メトキシフェニル−ジフェニルメチル、及び、
e)[ジ−(p−メトキシフェニル)]−フェニルメチル、
を含む群から選択される。
【0084】
より好ましくは、R9は、
a)tert−ブトキシカルボニル、
b)ホルミル、及び、
c)トリチル、
を含む群から選択される。
【0085】
ある態様では、R9はtert−ブトキシカルボニルであり;
別の態様では、R9はホルミルであり;
さらに別の態様では、R9はトリチルである。
【0086】
ある態様では、本発明は、式Iにおいて、
R13(カルボン酸保護基)は、
a)C1−C5アルキル、
b)C2−C5アルケニル、
c)(C1−C5アルキル−(O−C1−C4アルキル))n−O−)C1−C4アルキル、
d)C2−C5アルキニル、
e)p−メトキシベンジル、及び、
f)トリフェニルメチル、
を含む群から選択され、
式中、nは、0、1、2又は3の整数である式Iの化合物を対象とする。
【0087】
好ましくは、R13は、
a)メチル、
b)エチル、
c)tert−ブチル、
d)p−メトキシベンジル、及び、
e)トリフェニルメチル、
を含む群から選択される。
【0088】
ある態様では、本発明は、R15(脱離基)がR33又はR34である式Iの化合物を対象とする。
【0089】
好ましくは、R15はR33であり、この態様は、R15がsp2−ハイブリダイズしたC原子に結合している場合に好ましい。
【0090】
好ましくは、R15はR34であり、この態様は、R15がsp3−ハイブリダイズしたC原子に結合している場合に好ましい。
【0091】
R33は、−I+(R25)(X-)、−I+(R26)(X-)、ニトロ、−N+(Me)3(X-)、塩素及び臭素を含む群から選択される。
【0092】
好ましくは、R33は、−I+(R25)(X-)、−I+(R26)(X-)、ニトロ、−N+(Me)3(X-)、及び臭素を含む群から選択される。
【0093】
より好ましくは、R33は、−I+(R25)(X-)、−I+(R26)(X-)、ニトロ及び−N+(Me)3(X-)を含む群から選択される。
【0094】
さらに好ましくは、R33は、−I+(R25)(X-)及び−I+(R26)(X-)を含む群から選択される。
【0095】
さらに好ましくは、R33はニトロである。
【0096】
さらに好ましくは、R33は、N+(Me)3(X-)である。
【0097】
R34は、当業者にとって既知又は明白な脱離基であり、Synthesis (1982), p. 85-125, table 2 (p. 86;(この表2の最後の項目は訂正の必要があり、“n-C4H9S(O)2-O-nonaflat”ではなく“n-C4F9S(O)2-O-nonaflat ”である)、Carey and Sundberg, Organische Synthese, (1995), page 279-281, table 5.8;又はNetscher, Recent Res. Dev. Org. Chem., 2003, 7, 71-83, scheme 1, 2, 10 and 15に記載又は指定されているものから選択されるが、それらに限定される訳ではない。
【0098】
R34は、塩素、臭素及びヨード、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ、ノナ−フルオロブチルスルホニルオキシ、(4−臭素−フェニル)スルホニルオキシ、(4−ニトロ−フェニル)スルホニルオキシ、(2−ニトロ−フェニル)スルホニルオキシ、(4−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリ−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリメチル−フェニル)スルホニルオキシ、(4−tertブチル−フェニル)スルホニルオキシ及び(4−メトキシ−フェニル)スルホニルオキシを含む群から選択される。
【0099】
好ましくは、R34は、ヨード、臭素、塩素、メシルオキシ、トシルオキシ、(4−ニトロ−フェニル)スルホニルオキシ及び(2−ニトロ−フェニル)スルホニルオキシを含む群から選択される。
【0100】
より好ましくは、R34は、メシルオキシ、トシルオキシ及び(4−ニトロ−フェニル)スルホニルオキシを含む群から選択される。
【0101】
R25は、置換又は非置換アリールである。
【0102】
好ましくは、R25は、フェニル、(4−メチル)−フェニル、(4−メトキシ)−フェニル、(3−メチル)−フェニル、(3−メトキシ)−フェニル、(4−(ジメチルカルバモイル)(メチル)アミノ)フェニル及びナフチルを含む群から選択される。
より好ましくは、R25は、フェニル、(4−メチル)−フェニル及び(4−メトキシ)−フェニルを含む群から選択される。
【0103】
さらに好ましくは、R25は、フェニル及び(4−メトキシ)−フェニルを含む群から選択される。
【0104】
より好ましくは、R25は(4−(ジメチルカルバモイル)(メチル)アミノ)フェニルである。
【0105】
R26は、置換又は非置換へテロアリールである。
【0106】
好ましくは、R26は、2−フラニル及び2−チエニルを含む群から選択される。
【0107】
より好ましくは、R26は2−チエニルである。
【0108】
X-は、
a)無機酸のアニオン、及び、
b)有機酸のアニオン、
を含む群から選択される。
【0109】
好ましくは、X-は、
a)CH3S(O)2O-、
b)((4−メチル)フェニル)S(O)2O-、
c)CF3S(O)2O-、
d)C4F9S(O)2O-、
e)CF3C(O)O-、
f)H3CC(O)O-、
g)ヨウ化物アニオン、
h)臭化物アニオン、
i)塩化物アニオン、
j)過塩素酸アニオン(ClO4-)、及び、
k)リン酸アニオン、
を含む群から選択される。
【0110】
より好ましくは、X-は、
a)CF3S(O)2O-、
b)C4F9S(O)2O-、
c)ヨウ化物アニオン、
d)臭化物アニオン、及び、
e)CF3C(O)O-、
を含む群から選択される。
【0111】
さらに好ましくは、X-は、
a)CF3S(O)2O-、
b)臭化物アニオン、及び、
c)CF3C(O)O-、
を含む群から選択される。
【0112】
ある態様では、R15がsp2−ハイブリダイズしたC原子に結合している場合、R10は好ましくはR20である。
【0113】
別の態様では、R15がsp3−ハイブリダイズしたC原子に結合している場合、R10は好ましくはR30である。
【0114】
ある態様では、R20は、−Sn((C1−C6)アルキル)3及び−B(OR60)(OR61)を含む群から選択される。
【0115】
別の態様では、R20は−NMe2である。
【0116】
さらに別の態様では、R20はヨードである。
【0117】
ある態様では、本発明は、kが1〜3の整数である式Iの化合物を対象とする。
好ましくは、kは1又は2の整数である。
より好ましくは、kは整数1である。
より好ましくは、kは整数2である。
【0118】
ある態様では、本発明は、nが0〜3の整数である式Iの化合物を対象とする。
好ましくは、nは1又は2の整数である。
より好ましくは、nは整数1である。
より好ましくは、nは整数2である。
【0119】
R60及びR61は、水素、(C1−C6)アルキル及びシクロアルキルを含む群から独立且つ個別に選択され、一方、R60及びR61は、結合又はメチレン「ブリッジ」により相互に連結していてもよい。
【0120】
但し、WO2009/027727A2に開示され、下に記載する化合物を特許請求する意図はない。
【0121】
【化6】

メチル N2,N5−ビス(tert−ブトキシカルボニル)−4−{3−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]プロピル}−L−オルニチナート
【0122】
本発明化合物は、以下の化合物から選択されるが、これらに限定される訳ではない。
(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−ヒドロキシ−L−オルニチナート(26)
【化7】

(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−[(メチルスルホニル)オキシ]−L−オルニチナート(27)
【化8】

(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−{[(4−メチルフェニル)スルホニル]オキシ}−L−オルニチナート(28)
【化9】

(4S)−[18F]−フルオロ−L−オルニチン(29)
【化10】

(3R)−N2,N5−ビス(tert−ブトキシカルボニル)−3−フルオロ−L−オルニチナート(30)
【化11】

(3R)−3−フルオロ−L−オルニチン(31)
【化12】

メチル−(5S)−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−5−ヒドロキシ−L−ノルロイシナート(34)
【化13】

メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−L−ノルロイシナート(35)
【化14】

メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−ヒドロキシ−L−ノルロイシナート(36)
【化15】

(5R)−[18F]−フルオロメチル−L−オルニチン(38)
【化16】

(2S)−5−アミノ−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロペンタン酸(43)
【化17】

ベンジル(2S)−5−アジド−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロペンタノアート(42)
【化18】

【化19】

4−(18F)フルオロ−L−オルニチン
【化20】

3−(18F)フルオロ−L−オルニチン
【化21】

5−アミノ−6−(18F)フルオロ−L−ノルロイシン
【0123】
R7が[19F]フルオロである式Iの化合物は、標準参照化合物に対応する。前記化合物は、好ましくは、同定手段としての市販キットにおける標準参照としてインビトロアッセイに、そして品質確認に好適である。
【0124】
R7が[18F]フルオロ、[123I]ヨード、[124I]ヨード又は[131I]ヨードである、好ましくはR7が[18F]フルオロである式Iの化合物は、インビボでそれらの放射性同位体を比較的わずかに(例えば[18F]フルオロ−プトリシンと比較して)放出し、その結果、腫瘍の造影又は腫瘍におけるポリアミン代謝の造影が可能となる。
【0125】
第2の局面では、本発明は、式Iの化合物又は医薬的に許容されるその無機又は有機酸の塩、その水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグ、及び医薬的に許容される担体、希釈剤、賦形剤又はアジュバントを含む医薬組成物に関する。
【0126】
ある態様では、この医薬組成物は、医薬的に許容されるその塩、水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグである式Iの化合物を含む。
【0127】
ある態様では、この医薬組成物は、R7が19F又は[18F]である式Iの化合物又はそれらの混合物を含む医薬組成物である。
【0128】
ある態様では、この医薬組成物は、R7が19Fである式Iを有する標準参照化合物を含む医薬組成物である。
【0129】
ある態様では、この医薬組成物は、R7が前記定義による無キレート剤放射性核種である放射性医薬組成物である。好ましくはこの無キレート剤放射性核種は、[18F]、[125I]、[131I]、[123I]、又は[124I]である。より好ましくは、R7は[18F]である。
【0130】
本発明に係る式I、Ib又はIcを有する化合物、好ましくは本発明により提供される式I、Ib又はIcによる無キレート剤放射性核種標識化合物は、任意の適当な医薬的に許容される担体、例えば生理食塩水媒体のような従来の媒体中で、又は血漿媒体中で静脈内投与され得る。このような媒体は、例えば浸透圧を調節するための医薬的に許容される塩類、緩衝剤、保存剤などのような従来の医薬材料をも含有できる。好ましい媒体には生理食塩水及び血漿がある。
【0131】
適当な医薬的に許容される担体は当業者に知られている。この点において、例えばRemington's Practice of Pharmacy, 13th ed.及びJ. of. Pharmaceutical Science & Technology, Vol. 52, No. 5, Sept-Oct., p. 238-311を参考にでき、これらを引用により本明細書の一部とする。
【0132】
式I、Ib又はIcの化合物、好ましくは本発明に係る18F−標識化合物及び医薬的に許容される担体の、例えば水性媒体中の濃度は、個々の使用分野と共に変化する。生物学的標的(例えば腫瘍)の満足できる視覚化が達成できる場合には、医薬的に許容される担体中に充分量が存在する。
【0133】
本発明によれば、中性組成物としての、又は医薬的に許容される対イオンとの塩としての、式I、Ib又はIcを有する放射標識化合物は、単一ユニット注射用量で投与される。当業者に知られる任意の一般的担体、例えば滅菌生理食塩水又は血漿を、本発明に従って種々の臓器、腫瘍などを造影するための注射溶液を作製するために、放射標識後に利用できる。一般に、診断薬のために投与される単位用量は、約0.1mCi〜約100mCi、好ましくは1mCi〜20mCiの放射能を有する。放射線治療薬のためには、治療用単位用量の放射能は、約10mCi〜約700mCi、好ましくは50mCi〜400mCiである。単位用量で注射される溶液は、約0.01ml〜約30mlである。造影目的のためには、静脈内投与の後、臓器又は疾患位置のインビボ造影が、およそ数分以内に起こり得る。しかしながら、所望により、患者への注射後数時間又はより遅くに造影を生起させることもできる。大抵の例では、充分量の投与用量が造影されるべき領域に約0.1時間以内に集積し、PET又は単一光子放射型コンピューター断層撮影(SPECT)画像の取得が可能となる。造影目的の、又はコンピューター断層撮影(CT)及び磁気共鳴(MR)分光法のような他の従来の造影法と組み合わせた、任意の従来のPET又はSPECT造影を、本発明に従って利用することができる。
【0134】
第3の局面では、本発明は、参照化合物、医薬(治療薬)又は放射性医薬品として使用するための、式Iの化合物に関する。
【0135】
換言すると、本発明は、参照化合物、医薬又は放射性医薬品としての、式Iの化合物の使用に関する。
【0136】
好ましくは、本発明は、式Iにおいて、R7が前記定義による[19F]である、[19F]化合物であって、参照化合物、医薬又は放射性医薬品として使用するための化合物に関する。
【0137】
より好ましくは、本発明は、式Iにおいて、R7が前記定義による[19F]である、[19F]化合物であって、参照化合物として使用するための化合物に関する。
【0138】
好ましくは、本発明は、式Iにおいて、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物であって、医薬又は放射性医薬品として使用するための化合物に関する。より好ましくは、R7は前記と同義であり、全ての好ましい態様が本明細書に包含される。
【0139】
より好ましくは、R7は[18F]である。
【0140】
本発明はさらに、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物、又は、式Iにおいて、R7が前記定義による[19F]である、[19F]化合物の使用であって、過剰増殖性疾患の処置のための医薬又は放射性医薬品を製造するための使用に関する。
【0141】
過剰増殖性疾患は、任意の種類の異常な細胞増殖又は異常な増殖調節に関連する全ての疾患及び状態、特に腫瘍におけるものを包含する。
【0142】
好ましくは、過剰増殖性疾患は、腫瘍又は転移を発現する癌を意味する。より好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、腎臓、膀胱、甲状腺、前立腺、子宮内膜、卵巣、精巣の癌腫、悪性黒色腫、小細胞及び非小細胞気管支癌腫、口腔粘膜の異形成癌腫、浸潤性口腔癌;乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫、星状細胞腫、骨肉腫、髄膜腫を包含する);柔組織肉腫;血管腫及び内分泌腫瘍(下垂体腺腫、有色細胞腫、傍神経節腫を包含する)、血液学的腫瘍(リンパ腫及び白血病を包含する);又は上記腫瘍のうち1つの転移である。
【0143】
より好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、腎臓、膀胱、前立腺、卵巣の癌腫、小細胞及び非小細胞気管支癌腫、乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫、星状細胞腫、骨肉腫、髄膜腫を包含する);柔組織肉腫;血管腫及び内分泌腫瘍(下垂体腺腫、有色細胞腫、傍神経節腫を包含する)、血液学的腫瘍(リンパ腫を包含する);又は上記腫瘍のうち1つの転移である。
【0144】
さらに好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、前立腺の癌腫、小細胞及び非小細胞気管支癌腫、乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫を包含する)、血液学的腫瘍(リンパ腫を包含する)、又は上記腫瘍のうち1つの転移である。
【0145】
驚くべきことに、本発明化合物は放射線治療又は競合的治療に好適であることが判明した。放射線治療は本発明の無キレート剤放射標識化合物の放射特性を利用することによって実施される。
【0146】
本発明はさらに、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物、又は、R7が前記定義による[19F]である、式Iの[19F]化合物の治療有効量を患者内に投与し、シグナルを検出する工程を含む、前記定義による過剰増殖性疾患の処置方法を対象とする。
【0147】
上に開示した好ましい態様を本明細書に含める。
【0148】
第4の局面では、本発明は、造影剤として使用するための式Iの化合物に関する。
【0149】
好ましくは、本発明は、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物であって、造影剤として使用するための化合物に関する。より好ましくは、R7は前記と同義であり、全ての好ましい態様が本明細書に包含される。
【0150】
より好ましくは、R7は[18F]である。
【0151】
換言すると、本発明は、造影剤としての式Iの化合物の使用に関する。
【0152】
好ましくは、本発明は、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物の使用であって、造影剤としての使用に関する。
【0153】
より好ましくは、R7は前記と同義であり、全ての好ましい態様が本明細書に包含される。
【0154】
より好ましくは、R7は[18F]である。
【0155】
好ましくは、この造影剤は、PET、SPECT又はマイクロPET造影のために、又はコンピューター断層撮影(CT)、及び磁気共鳴(MR)分光法のような他の従来の造影法と組み合わせる際に有用である。より好ましくは、この造影剤はPET造影に有用である。
【0156】
好ましくは、この造影剤は過剰増殖性疾患の造影に好適である。
【0157】
過剰増殖性疾患は、任意の種類の異常な細胞増殖又は異常な増殖調節に関連する全ての疾患及び状態、特に腫瘍におけるものを包含する。
【0158】
好ましくは、過剰増殖性疾患は、腫瘍又は転移を発現する癌を意味する。より好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、腎臓、膀胱、甲状腺、前立腺、子宮内膜、卵巣、精巣の癌腫、悪性黒色腫、小細胞及び非小細胞気管支癌腫、口腔粘膜の異形成癌腫、浸潤性口腔癌;乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫、星状細胞腫、骨肉腫、髄膜腫を包含する);柔組織肉腫;血管腫及び内分泌腫瘍(下垂体腺腫、有色細胞腫、傍神経節腫を包含する)、血液学的腫瘍(リンパ腫及び白血病を包含する);又は上記腫瘍のうち1つの転移である。
【0159】
より好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、腎臓、膀胱、前立腺、卵巣の癌腫、小細胞及び非小細胞気管支癌腫、乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫、星状細胞腫、骨肉腫、髄膜腫を包含する);柔組織肉腫;血管腫及び内分泌腫瘍(下垂体腺腫、有色細胞腫、傍神経節腫を包含する)、血液学的腫瘍(リンパ腫を包含する);又は上記腫瘍のうち1つの転移である。
【0160】
さらに好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、前立腺の癌腫、小細胞及び非小細胞気管支癌腫、乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫を包含する)、血液学的腫瘍(リンパ腫を包含する)、又は上記腫瘍のうち1つの転移である。
【0161】
本発明はさらに、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物の検出可能量を患者内に導入する工程を含む、上記定義による過剰増殖性疾患の造影方法を対象とする。さらに、放射線を測定し、又はシグナルを検出し、診断を確立してもよい。
【0162】
上に開示した好ましい態様が本明細書に包含される。
【0163】
第5の局面では、本発明は、式Iの化合物、或いは一般式Iに含まれる式、即ち式Ib及び式Icの化合物であって、R7が無キレート剤放射性核種又は[19F]である化合物を取得するための方法に関する。
【0164】
驚くべきことに、式Iの化合物を取得するための方法が4つ確定された。
【0165】
第1の方法では、本発明は、R7が脱離基である式Iの化合物を適当な標識剤と反応させることにより、R7が無キレート剤放射性核種又は[19F]である式Iの化合物を取得する方法を対象とする。
【0166】
上記で得られた、R7が無キレート剤放射性核種又は[19F]である式Iの化合物を、任意により、アミン−及び/又はカルボキシ−保護基の位置で脱保護してもよい。脱保護は、保護基R5及びR9を除去することにより実施される。
【0167】
換言すると、R7が無キレート剤放射性核種又は[19F]である式Iの化合物を取得する方法は、
− R7が脱離基である式Iの化合物を、適当な標識剤と反応させ、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0168】
好適な標識剤は、無キレート剤放射性核種又は[19F]誘導体を含む化学物質として定義され、ここで前記化学物質は標識化反応を実現できる。
【0169】
好ましくは、式Iの化合物を、前記定義によるR4、R5及びR6に定義される官能性OH及びNH2部分において保護する。
【0170】
好ましくは、脱離基は、R7[前記定義によるR15である]として定義される。
【0171】
好ましくは、R7が前記定義によるR15である時、R4及びR6は前記定義によるR14であり、R5は前記定義によるR13である。
【0172】
ある態様では、本発明は、R7が脱離基である式Iの化合物を適当な放射標識剤と反応させることにより、R7が無キレート剤放射性核種である式Iの化合物を取得する方法を対象とする。
【0173】
上記で得られた、R7が無キレート剤放射性核種である式Iの化合物を、任意により、アミン−及び/又はカルボキシ−保護基の位置で脱保護してもよい。脱保護は、保護基R5及びR9を除去することにより実施される。
【0174】
換言すると、R7が無キレート剤放射性核種である式Iの化合物を取得する方法は、
− R7が脱離基である式Iの化合物を、適当な放射標識剤と反応させ、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0175】
好ましくは、脱離基は、R7[前記定義によるR15である]として定義される。
【0176】
好ましくは、R7が前記定義によるR15である時、R4及びR6は前記定義によるR14であり、R5は前記定義によるR13である。
【0177】
本明細書で使用される「好適な放射標識剤」という語は、当業者にとって既知又は明白な反応条件を惹起する試薬を指し、酸性、塩基性、水素化分解的、酸化的、光分解的、好ましくは酸性開裂条件から選ばれ(但しこれらに限定されない)、Greene and Wuts, Protecting groups in Organic Synthesis, third edition, page 494-653 and 249-290にそれぞれ記載のものから選択されるがそれらに限定される訳ではない。
【0178】
無キレート剤放射性核種であるR7は、既に開示された全態様と共に上記のように定義されている。好ましくは、R7は[18F]である。
【0179】
R15(脱離基)は、既に開示された全態様と共に上記のように定義されている。
【0180】
ある態様では、本発明は、R7が脱離基である式Iの化合物を、適当なフルオロ放射標識剤と反応させることにより、R7は[18F]である式Iの化合物を取得する方法を対象とする。
【0181】
任意により、R7が[18F]である式Iの化合物をアミン−及び/又はカルボキシ−保護基の位置で脱保護してもよい。脱保護は、保護基R5及びR9を除去することにより実施される。
【0182】
換言すると、R7が[18F]である式Iの化合物を取得する方法は、
− R7が脱離基である式Iの化合物を適当なフルオロ放射標識剤と反応させ、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0183】
好ましくは、フルオロ放射標識剤はF−アニオン(Fは18Fを意味する)を含む化合物である。より好ましくは、F−フルオロ放射標識剤は、4,7,13,16,21,24−ヘキサオキサ−1,10−ジアザビシクロ[8.8.8]−ヘキサコサンKF、即ち、クラウンエーテル塩Kryptofix KF、KF、HF、KHF2、CsF、NaF、及びFのテトラアルキルアンモニウム塩、例えばテトラブチルアンモニウムフルオリドを含む群から選択され、ここで、F=18Fである。
【0184】
好ましくは、脱離基は、R7[前記定義によるR15である]として定義される。
【0185】
R15(脱離基)は既に開示された全態様と共に上記のように定義されている。
【0186】
脱離基を含む式Iの化合物が、R7がR15であるとさらに定義されている場合、R4及びR6はR14(好ましくは前記と同義)であり、そしてR5はR13である。
【0187】
脱離基を含む式Iの化合物が、さらに以下:
R7がR15であり、
R4がR14であり、
R6がR14であり、
R5がR13である、
のように定義されている場合、得られる式Iのフルオロ放射標識化合物は、好ましくは、R4及びR6及びR5が水素である化合物である。
【0188】
本明細書で使用される、分子を「放射標識」するという語は、通常、分子内に18F原子のような放射性核種を導入することを指す。
【0189】
ある態様では、本発明は、R7が[19F]である式Iの化合物を取得する方法であって、R7が脱離基である式Iの化合物を適当なフルオロ標識剤と反応させることによる方法を対象とする。
【0190】
R7が[18F]である式Iの化合物を、任意により、アミン−及び/又はカルボキシ−保護基の位置で脱保護してもよい。脱保護は、保護基R5及びR9を除去することにより実施される。
【0191】
換言すると、R7が[19F]である式Iの化合物を取得する方法は、
− R7が脱離基である式Iの化合物を適当なフルオロ標識剤と反応させ、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0192】
好ましくは、フルオロ標識剤はF−アニオン(Fは[19F]を意味する)を含む化合物である。より好ましくは、F−フルオロ放射標識剤は、4,7,13,16,21,24−ヘキサオキサ−1,10−ジアザビシクロ[8.8.8]−ヘキサコサンKF、即ち、クラウンエーテル塩Kryptofix KF、KF、HF、KHF2、CsF、NaF、及びFのテトラアルキルアンモニウム塩、例えばテトラブチルアンモニウムフルオリドを含む群から選択され、ここで、F=[19F]である。
【0193】
好ましくは、脱離基は、R7[前記定義によるR15である]として定義される。
R15(脱離基)は、既に開示された全態様と共に、上記のように定義される。
【0194】
脱離基を含む式Iの化合物において、更にR7がR15である定義されている場合、R4及びR6はR14(好ましくは前記と同義)であり、R5はR13である。
【0195】
脱離基を含む式Iの化合物が、さらに
R7がR15であり、
R4がR14であり、
R6がR14であり、
R5がR13である、
と定義されている場合、得られる式Iのフルオロ標識化合物は、好ましくは、R4及びR6及びR5が水素である化合物である。
【0196】
上に開示された好ましい態様が本明細書に包含される。
【0197】
第2の方法では、本発明は、式Ibの化合物:
【化22】

を取得する方法であって、
式V:
【化23】

の化合物を、R86を含む標識剤と反応させて、式IVの化合物:
【化24】

を生成し、この式IVの化合物を、式VIの化合物:
【化25】

で置換し、
任意により、アミン−及び/又はカルボキシ−保護基を脱保護することによる、方法
[但し、式中、
式Ibは以下のように定義され:
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種又は[19F]であり、
R4、R5、R6、及びkは前記と同義であり;
式Vは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり;
式IVは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり、
R86は無キレート剤放射性核種又は[19F]であり;
式VIは以下のように定義され:
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]を対象とする。
【0198】
換言すると、式Ibの化合物を取得する方法は、
− 式Vの化合物を、R86を含む標識剤と反応させて、式IVの化合物を生成し、
− 式IVの化合物を、式VIの化合物で置換し、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0199】
式Ibの好ましい態様:
好ましくは、R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含む。
より好ましくは、R101、R102及びR103のうち1個は((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
【0200】
好ましくは、R86は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]及びフッ素−18[18F]の群から選択される無キレート剤放射性核種である。
【0201】
より好ましくは、無キレート剤放射性核種は、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、又はヨウ素131[131ヨード]である。
【0202】
より好ましくは、無キレート剤放射性核種は[18F]フルオロである。
【0203】
好ましくは、R86は[19F]である。
【0204】
好ましくは、式Ibの化合物は、1又は2個のR86を含む。より好ましくは、式Ibの化合物は、ただ1個のR86を含む。
【0205】
上に開示された好ましい態様は、R4、R5、R6、k及び無キレート剤放射性核種について本明細書に包含される。
【0206】
式Vの好ましい態様:
好ましくは、aは、0〜2の整数である。より好ましくは、aは0〜1の整数である。
【0207】
好ましくは、Bは、ハロ、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ、ノナ−フルオロブチルスルホニルオキシ、(4−臭素−フェニル)スルホニルオキシ、(4−ニトロ−フェニル)スルホニルオキシ、(2−ニトロ−フェニル)スルホニルオキシ、(4−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリ−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリメチル−フェニル)スルホニルオキシ、(4−tertブチル−フェニル)スルホニルオキシ及び(4−メトキシ−フェニル)スルホニルオキシを含む群から個別且つ独立に選択される脱離基である。
【0208】
より好ましくは、Bは、ヨード、臭素、塩素、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ及びノナ−フルオロブチルスルホニルオキシを含む群から選択される。
【0209】
好ましくは、ハロは、塩素、臭素又はヨードである。
【0210】
式IVの好ましい態様:
a及びBは、式Vの場合と同義である。
【0211】
R86は、式Ibの場合と同義である。
【0212】
式VIの好ましい態様:
好ましくは、R201、R202及びR203は、
a)水素、
b)((R8−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR8を含む。
【0213】
より好ましくは、R201、R202及びR203のうち1個は((R8−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
R8はヒドロキシである。
【0214】
好ましくは、式Ibの化合物は1又は2個のR8を含む。より好ましくは、式Ibの化合物は、ただ1個のR8を含む。
【0215】
R4、R5、R6及びkについて上述した好ましい態様は、本明細書に包含される。
【0216】
好適な標識剤は、無キレート剤放射性核種又は[19F]誘導体を含む化学物質として定義され、ここで前記化学物質は標識化反応を実現できる。
【0217】
さらなる態様では、本発明は、式Ibの化合物:
【化26】

[式中、R86は無キレート剤放射性核種である]
を取得する方法であって、
式V:
【化27】

の化合物を、R86を含む適当な放射標識剤と反応させて、式IV:
【化28】

の化合物を生成し、この式IVの化合物を、式VI:
【化29】

の化合物で置換し、
任意により、アミン−及び/又はカルボキシ−保護基を脱保護することによる、方法
[式中、
式Ibは以下のように定義され:
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種であり、
R4、R5、R6、及びkは前記と同義であり、
式Vは以下のように定義され:
aは、0〜5の整数であり、
Bが脱離基であり、
式IVは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり、
R86は無キレート剤放射性核種であり、
式VIは以下のように定義され:
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]を対象とする。
【0218】
換言すると、R86が無キレート剤放射性核種である式Ibの化合物を取得する方法は、
− 式Vの化合物を、R86[ここでR86は無キレート剤放射性核種である]を含む適当な放射標識剤と反応させて、式IVの化合物を生成し、
− 式IVの化合物を、式VIの化合物で置換し、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0219】
式Ibの好ましい態様:
好ましくは、R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含む。
【0220】
より好ましくは、R101、R102及びR103のうち1個は((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
【0221】
好ましくは、R86は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]及びフッ素−18[18F]の群から選択される無キレート剤放射性核種である。
【0222】
より好ましくは、無キレート剤放射性核種は、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、又はヨウ素131[131ヨード]である。
【0223】
より好ましくは、無キレート剤放射性核種は[18F]フルオロである。
【0224】
好ましくは、式Ibの化合物は、1又は2個のR86を含む。より好ましくは、式Ibの化合物は、ただ1個のR86を含む。
【0225】
上に開示された好ましい態様は、R4、R5、R6、k及び無キレート剤放射性核種について本明細書に包含される。
【0226】
式Vの好ましい態様:
好ましくは、aは、0〜2の整数である。より好ましくは、aは0〜1の整数である。
【0227】
好ましくは、脱離基Bは、当業者にとって既知又は明白であり、Synthesis (1982), p. 85-125, table 2 (p. 86;(この表2の最後の項目は訂正の必要があり、“n-C4H9S(O)2-O-nonaflat”ではなく“n-C4F9S(O)2-O-nonaflat ”である)、Carey and Sundberg, Organische Synthese, (1995), page 279-281, table 5.8;又はNetscher, Recent Res. Dev. Org. Chem., 2003, 7, 71-83, scheme 1, 2, 10 and 15に記載又は指定されているものから選択されるが、それらに限定される訳ではない。
【0228】
より好ましくは、Bは、ハロ、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ、ノナ−フルオロブチルスルホニルオキシ、(4−臭素−フェニル)スルホニルオキシ、(4−ニトロ−フェニル)スルホニルオキシ、(2−ニトロ−フェニル)スルホニルオキシ、(4−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリ−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリメチル−フェニル)スルホニルオキシ、(4−tert−ブチル−フェニル)スルホニルオキシ、及び(4−メトキシ−フェニル)スルホニルオキシを含む群から個別且つ独立に選択される脱離基である。
【0229】
さらに好ましくは、Bは、ヨード、臭素、塩素、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ及びノナ−フルオロブチルスルホニルオキシを含む群から選択される。
【0230】
好ましくは、ハロは、塩素、臭素又はヨードである。
【0231】
式IVの好ましい態様:
a及びBは、式Vの場合と同義である。
【0232】
R86は、式Ibの場合と同義である。
【0233】
式VIの好ましい態様:
好ましくは、R201、R202及びR203は、
a)水素、
b)((R8−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR8を含む。
【0234】
より好ましくは、R201、R202及びR203のうち1個は((R8−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
R8はヒドロキシである。
好ましくは、式Ibの化合物は1又は2個のR8を含む。より好ましくは、式Ibの化合物は、ただ1個のR8を含む。
【0235】
R4、R5、R6及びkについて上述した好ましい態様は、本明細書に包含される。
【0236】
好適な放射標識剤は、無キレート剤放射性核種誘導体を含む化学物質として定義され、ここで前記化学物質は放射標識化反応を実現できる。
【0237】
さらなる態様では、本発明は、
− 式Vの化合物を、R86[ここでR86は[19F]である]を含む適当な標識剤と反応させて、式IVの化合物を生成し、
− 式IVの化合物を、式VIの化合物で置換し、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む、R86は[19F]である式Ibの化合物を得る方法を対象とする。
【0238】
好適なフルオロ標識剤は、F−アニオン(Fは[19F]を意味する)を含む化合物である。より好ましくは、F−フルオロ放射標識剤は、4,7,13,16,21,24−ヘキサオキサ−1,10−ジアザビシクロ[8.8.8]−ヘキサコサンKF、即ち、クラウンエーテル塩Kryptofix KF、KF、HF、KHF2、CsF、NaF、及びFのテトラアルキルアンモニウム塩、例えばテトラブチルアンモニウムフルオリドを含む群から選択され、ここで、F=[19F]である。
【0239】
上に開示された好ましい態様は本明細書に包含される。
【0240】
本明細書で使用される「標識剤」という語は、当業者にとって既知又は明白な反応条件を惹起する試薬を指し、酸性、塩基性、水素化分解的、酸化的、光分解的、好ましくは酸性開裂条件から選ばれ(但しこれらに限定されない)、Greene and Wuts, Protecting groups in Organic Synthesis, third edition, page 494-653 and 249-290にそれぞれ記載のものから選択されるがそれらに限定される訳ではない。
【0241】
好ましくは、放射標識剤は、F−アニオンを含む又はそれで構成される化合物である。より好ましくは、フルオロ放射標識剤は、4,7,13,16,21,24−ヘキサオキサ−1,10−ジアザビシクロ[8.8.8]−ヘキサコサンKF、即ち、クラウンエーテル塩Kryptofix KF、KF、HF、KHF2、CsF、NaF、及びFのテトラアルキルアンモニウム塩、例えばテトラブチルアンモニウムフルオリドを含む群から選択され、ここで、F=[19F]である。
【0242】
第6の局面では、本発明は、式Ib、及び下記に定義されるVIの化合物
式Ib
【化30】

[式中、
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種又は[19F]であり、
R4、R5、R6、及びkは前記と同義である]に関する。
【0243】
式Ibの好ましい態様:
好ましくは、R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含む。
より好ましくは、R101、R102及びR103のうち1個は((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
【0244】
好ましくは、R86は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]及びフッ素−18[18F]の群から選択される無キレート剤放射性核種である。
【0245】
より好ましくは、無キレート剤放射性核種は、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、又はヨウ素131[131ヨード]である。
より好ましくは、無キレート剤放射性核種は[18F]フルオロである。
【0246】
好ましくは、R86は[19F]である。
好ましくは、式Ibの化合物は、1又は2個のR86を含む。より好ましくは、式Ibの化合物は、ただ1個のR86を含む。
【0247】
R4、R5、R6及びkについて上述した好ましい態様は、本明細書に包含される。
【0248】
【化31】

[式中、
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]。
【0249】
上に開示された好ましい態様は本明細書に包含される。
【0250】
第7の局面では、本発明は、式Ib又はVIを有する化合物、その混合物又は医薬的に許容されるその無機又は有機酸の塩、その水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグ、及び医薬的に許容される担体、希釈剤、賦形剤又はアジュバントを含む医薬組成物に関する。
【0251】
ある態様では、この医薬組成物は、医薬的に許容されるその塩、水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグである、式Ib、VI又はIcの化合物を含む。
【0252】
第8の局面では、本発明は、参照化合物、医薬又は放射性医薬品としての使用のための、式Ib又はVIを有する化合物に関する。
【0253】
換言すれば、本発明は、参照化合物、医薬又は放射性医薬品としての、式Ib又はVIを有する化合物の使用に関する。
【0254】
本発明はさらに、過剰増殖性疾患の処置のための医薬又は放射性医薬品を製造するための、式Ib又はVI(式中、R86は、上の定義による無キレート剤放射性核種又は[19F]であり;R8はヒドロキシであり;R40は、それぞれ上の定義による無キレート剤放射性核種又は[19F]である)を有する無キレート剤放射標識化合物の使用に関する。
【0255】
式Iの化合物の使用に関して上に開示された好ましい態様は、本明細書に包含される。
【0256】
第9の局面では、本発明は、造影剤として使用するための式Ibを有する化合物に関する。
【0257】
換言すると、本発明は、造影剤としての式Ibを有する化合物の使用に関する。
【0258】
本発明はさらに、過剰増殖性疾患を造影するための造影剤を製造するための、式I(式中、R7は、前記定義による無キレート剤放射性核種である)を有する無キレート剤放射標識化合物の使用に関する。
【0259】
式Iの化合物の使用に関して上に開示された好ましい態様は、本明細書に包含される。
【0260】
第10の局面では、本発明は、
a)式Iの化合物、又は、
b)上の定義による式Vの化合物及び式VIの化合物又はそれらの混合物、
の所定量を含んだ密封バイアルを含むキットを対象とする。
【0261】
好ましくは、式Iの化合物は、R7がR15又はR10である化合物である。この化合物を標識化反応の前駆体と称する。
【0262】
好ましくは、式Iの化合物は、R7が無キレート剤放射性核種である化合物である。この化合物を、治療又は造影に直ちに使用できる、又は使用前に脱保護及び/又は精製を受ける、放射性医薬品と称する。好ましくは、式Iの化合物は、R7が[19F]である化合物である。この化合物を参照化合物と称する。
【0263】
式I、V及びVIの化合物に関して上に開示された好ましい態様は、本明細書に包含される。
【0264】
本発明の第11の局面では、
1)R1〜R6は前記と同義であり、R7はR15であり、R4はR14であり、そしてR5は前記定義によるR13である]
を有する化合物を取得する方法を対象とする。
【0265】
ある態様では、本発明は、
− R7は前記定義によるR10であり、R10は前記定義によるR30であり;R5は前記定義によるR13であり;そしてR4は前記定義によるR14である]で示される出発化合物を、「求電子試薬」と反応させる、
工程を含む、前記定義によるR7はR15であり、R15はR34であり、R4はR14であり、そしてR5は前記定義によるR13である]を有する前駆体化合物を取得する方法を対象とする。
【0266】
ある態様では、本発明は、
− R7は前記定義によるR10であり、R10は前記定義によるR30であり;R5は前記定義によるR13であり;そしてR4は前記定義によるR14である]で示される出発化合物を、「求電子試薬」と反応させる(但し、式Iの化合物に含まれているR7、R15、R34、R10及びR30は、sp3ハイブリダイズした炭素原子に結合している)、
工程を含む、前記定義によるR7はR15であり、R15はR34であり、R4はR14であり、そしてR5は前記定義によるR13である]を有する前駆体化合物を取得する方法を対象とする。
【0267】
別の態様では、本発明は、
− R7はR10であり、R10は前記定義によるR20であり、R4はR14であり、そしてR5は前記定義によるR13である]で示される出発化合物を、「活性化剤」と反応させる、
工程を含む、前記定義によるR7はR15であり、R4はR14であり、そしてR5は前記定義によるR13であり、R15は前記定義によるR33である]を有する前駆体化合物を取得する方法を対象とする。
【0268】
好ましい態様では、本発明は、
− R7はR10であり、R10は前記定義によるR20であり、R4はR14であり、そしてR5は前記定義によるR13である]で示される出発化合物を、活性化剤と反応させる(但し、式Iの化合物に含まれているR7、R15、R33、R10及びR20は、sp2ハイブリダイズした炭素原子に結合している)、
工程を含む、前記定義によるR7はR15であり、R4はR14であり、そしてR5は前記定義によるR13であり、R15は前記定義によるR33である]を有する前駆体化合物を取得する方法を対象とする。
【0269】
第12の局面では、本発明は、過剰増殖性疾患の進行を病期診断し、監視し、又は過剰増殖性疾患を対象とする治療に対する応答を監視するための方法を対象とする。
【0270】
驚くべきことに、ポリアミン生合成経路を標的とする、R7は無キレート剤放射性核種である]で示される本発明化合物は、正常組織よりも腫瘍細胞で大量に取り込まれる。故に、各々の腫瘍病期が放射性トレーサーの取り込みレベルに反映される。
【0271】
ある態様では、この病期診断法は、(i)R7は無キレート剤放射性核種である式Iの化合物を含む化合物の治療有効量を哺乳動物に投与し、(ii)該哺乳動物の1又はそれ以上の臓器又は組織又はその両者の画像を取得し;(iii)前記画像から、該哺乳動物の1又はそれ以上の臓器又は組織又はその両者に存在する、関与しているポリアミン生合成経路を定量し、(iv)決定された量及び対照の量を利用して、その病態の病期に到達する、ことを含む。
【0272】
ある態様では、この過剰増殖性疾患の進行を監視する方法は、(i)R7は無キレート剤放射性核種である式Iの化合物を含む化合物の治療有効量を哺乳動物に投与し、(ii)該哺乳動物の1又はそれ以上の臓器又は組織又はその両者の画像を取得し;(iii)前記画像から、該哺乳動物の1又はそれ以上の臓器又は組織又はその両者に存在する、関与しているポリアミン生合成経路を定量し、(iv)決定された量を利用して、過剰増殖性疾患の進行を監視する、ことを含む。
【0273】
ある態様では、哺乳動物の1又はそれ以上の臓器又は組織又はその両者に関連する過剰増殖性疾患を対象とする治療に対する該哺乳動物の応答を監視する方法は、(i)R7は無キレート剤放射性核種である式Iの化合物を含む化合物の治療有効量を哺乳動物に投与し、(ii)該哺乳動物の1又はそれ以上の臓器又は組織又はその両者の画像を取得し;(iii)前記画像から、該哺乳動物の1又はそれ以上の臓器又は組織又はその両者に存在する、関与しているポリアミン生合成経路を定量し、(iv)決定された量及び対照の量を利用して、治療に対する該哺乳動物の応答があればそれを評価する、ことを含む。
【0274】
好ましくは、この方法は治療に対する哺乳動物の応答を早期に監視するのに有用である。
【0275】
上に開示された好ましい態様は本明細書に包含される。
【0276】
本発明のこの局面は、式Ibの化合物にも適用される。
【0277】
好ましくは、本発明化合物は本明細書に開示されるL−オルニチン誘導体(2S)である。
【0278】
定義
以下は、本発明の説明の理解に役立つであろう幾つかの定義である。これらは一般的な定義を意図しており、決して本発明の範囲をそれらの用語のみに限定すべきではなく、以下の説明のより良い理解を進めるものである。
【0279】
文脈上他の意味に解すべき場合又は特にそれに反する旨が記載されている場合を除き、本明細書に、単数の整数、工程又は構成要素として明白に列挙されている整数、工程、又は本発明の構成要素は、列挙されたその整数、工程又は構成要素の単数及び複数形の両者を包含する。本明細書全編を通じ、文脈上他の意味に解すべき場合を除き、「含む(comprise)」、又は「含む(comprises)」又は「含む(comprising)」といった変化形は、記載された工程又は構成要素又は整数又は工程又は構成要素又は整数の群を包含していることを意味し、任意の他の工程又は構成要素又は整数又は構成要素又は整数の群の排除を意味する訳でないことを理解されたい。即ち、本明細書の文脈では、「含む」という語は、「主要なものとして包含するが必ずしも唯一ではない」ことを意味する。当業者は、本明細書に記載の本発明は、具体的に記載された内容以外の変化及び修飾を受け入れる余地があることを理解できるであろう。本発明がこのような変化及び修飾の全てを包含することを理解すべきである。本発明はさらに、本明細書で個別に又は集合的に言及又は指摘された全ての工程、特徴、組成物及び化合物、並びに、任意の及び全ての前記工程又は特徴の組み合わせ又は任意の2又はそれ以上の前記工程又は特徴を包含する。
【0280】
本発明化合物にキラル中心又はその他の形態の異性体中心が存在する場合、エナンチオマー及びジアステレオマーを包含するそのような立体異性体の全形態が本発明に包含されることが意図されている。キラル中心を含む化合物は、ラセミ混合物又はエナンチオマー的に濃縮された混合物又はジアステレオマー化合物又はジアステレオマー的に濃縮された混合物として使用でき、又は、これらの異性体混合物を周知の技術を用いて分離し、個々の立体異性体を単独で利用することができる。化合物が炭素−炭素二重結合を有する場合、(Z)−異性体及び(E)−異性体の両者並びにこれらの混合物が本発明の範囲内にある。化合物が互変異性型、例えばケト−エノール互変異性体として存在し得る場合、各互変異性型は、平衡状態で存在していようと一方の型が大部分であろうと、本発明の範囲内に包含されると考えられる。
【0281】
本発明の文脈において、好ましい好適な塩は、本発明に係る化合物の医薬的に許容される塩である。本発明はさらに、それらとしては薬学的応用に適当でないものの、例えば本発明化合物の単離又は精製に利用できる塩をも含む。本発明化合物の医薬的に許容される塩は、鉱酸、カルボン酸及びスルホン酸の酸付加塩、例えば、塩酸、臭化水素酸、硫酸、リン酸、メタンスルホン産、エタンスルホン酸、トルエンスルホン酸、ベンゼンスルホン酸、ナフタレンジスルホン酸、酢酸、トリフルオロ酢酸、プロピオン酸、乳酸、酒石酸、リンゴ酸、クエン酸、フマル酸、マレイン酸及び安息香酸の塩を包含する。
【0282】
本発明化合物の医薬的に許容される塩は、通常の塩基の塩、例えば例として、そして好ましいものとして、アルカリ金属塩(例えばナトリウム塩及びカリウム塩)、アルカリ土類金属塩(例えばカルシウム塩及びマグネシウム塩)、並びにアンモニウム塩、アンモニア又は1〜16個の炭素原子を有する有機アミン、例えば例として、そして好ましいものとして、エチルアミン、ジエチルアミン、トリエチルアミン、エチルジイソプロピルアミン、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、ジシクロヘキシルアミン、ジメチルアミノエタノール、プロカイン、ジベンジルアミン、N メチルモルホリン、アルギニン、リジン、エチレンジアミン及びN メチルピペリジンから誘導される塩を包含する。
【0283】
本明細書で使用される「治療有効量」という語は、その意味内に、所望の治療効果又は造影効果を提供するのに充分であるが非毒性である、本発明に係る化合物又は組成物の量を包含する。正確な必要量は、処置される種、対象の年齢及び一般状態、処置される状態の重篤度、投与される個別化合物、投与様式などといった因子に応じて対象毎に変わるであろう。従って、正確な「治療有効量」を特定することはできないが、与えられた任意の症例について、日常的な検査及び実験のみを用いて当業者が適切な「治療有効量」を決定することはできる。
【0284】
本明細書で使用される「処置」という語は、疾患の状態又は症状を治療し、疾患の成立を防止し、又はさもなければ、いかなるものであれ疾患又はその他の望ましくない症状を何らかの方法で防止し、妨げ、遅らせ、又は回復させる、任意の及び全ての使用を指す。
【0285】
本明細書で使用される「放射性核種」という語は、核内に新たに創成された放射粒子、又は原子内電子(内部転換を参照されたい)の何れかに付与されるために利用される過剰エネルギーを特徴とする核である、不安定な核を有する原子を指す。このプロセスにおいて放射性核種は放射性崩壊を受け、γ線及び/又は亜原子粒子を放射する。これらの粒子は電離放射線を構成する。放射性核種は天然に存在し得るが、人工的に作製することもできる。
【0286】
本明細書で使用される「無キレート剤放射性核種」という語は、標的化分子の原子に共有結合的にそして直接的に結合している放射性核種を指し、ここでは、共有結合的又は非共有結合的関連性による放射性核種及び標的化分子間の空間的近接性を提供するために、キレート化構造が利用されていない。キレート剤とは、DOTA、DTPA、及びEDTAのようなキレート化構造体である。
【0287】
無キレート剤放射性核種は、PET、SPECT又はマイクロPETに、又はコンピューター断層撮影(CT)、及び磁気共鳴(MR)分光造影法のような他の従来の造影法と組み合わせるのが有用である。
【0288】
好ましくは、無キレート剤放射性核種は、臭素、酸素、窒素、炭素、ヨウ素又はフッ素といった適当なPET又はSPECT同位体で構成され、又はそれらを含む。より好ましくは、好適なPET又はSPECT同位体は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]又はフッ素−18[18F]である。より好ましくは、この無キレート剤放射性核種はフッ素−18[18F]である。
【0289】
炭素−11[11C]を含む無キレート剤放射性核種は、好ましくは、11CH3、−O(11CH3)又は−N(11CH3)(C1−C5)アルキルであるがこれらに限定される訳ではない。
【0290】
本明細書で使用される「標的化分子」という語は、本発明で開示されるオルニチン又はリジン誘導体を指す。
【0291】
本明細書において単独で、又は他の基の一部分として使用される「アミン−保護基」という語は、当業者にとって既知又は明白であり、それは、あるクラスの保護基、即ち、カルバメート、アミド、イミド、N−アルキルアミン、N−アリールアミン、イミン、エナミン、ボラン、N−P保護基、N−スルフェニル、N−スルホニル及びN−シリルから選ばれ(但しこれらに限定されない)、教科書Greene and Wuts, Protecting groups in Organic Synthesis, third edition, page 494-653(引用により本明細書の一部とする)に記載されているものから選択されるがそれらに限定されない。
【0292】
本明細書において単独で、又は他の基の一部分として使用される「カルボン酸保護基」という語は、当業者にとって既知又は明白であり、それは、教科書Greene and Wuts, Protecting groups in Organic Synthesis, third edition, page 494-653(引用により本明細書の一部とする。)に記載されているあるクラスの保護基、即ち、メチル、エチル、tert−ブチル、p−メトキシベンジル及びトリフェニルメチルから選択されるがそれらに限定されない。
【0293】
本明細書及び請求項で以下に使用される「無機酸」及び「有機酸」という語は、炭酸、硝酸、塩酸、臭化水素酸、ヨウ化水素酸、リン酸、過塩素酸、過塩素酸又は硫酸のような酸を包含する(但しこれらに限定される訳ではない)鉱酸、又はそれらの酸性塩、例えば硫酸水素カリウム、又は、脂肪酸、脂環式酸、芳香族酸、芳香脂肪族(araliphatic)酸、ヘテロ環式酸、カルボン酸及びスルホン酸のような酸を包含する(但しこれらに限定されない)適当な有機酸(その例にはそれぞれ、蟻酸、酢酸、トリフルオロ酢酸、プロピオン酸、琥珀酸、グリコール酸、グルコン酸、乳酸、リンゴ酸、フマル酸、ピルビン酸、安息香酸、アントラニル酸、メシル酸、フマル酸、サリチル酸、フェニル酢酸、マンデル酸、エンボン酸、メタンスルホン酸、エタンスルホン酸、ベンゼンスルホン酸、パントテン酸、トルエンスルホン酸、トリフルオロメタンスルホン酸及びスルファニル酸がある)を指す。
【0294】
本明細書において単独で、又は他の基の一部分として使用される「脱離基」という語は、当業者にとって既知又は明白であり、ある原子又は原子群が、求核試薬、例えばフッ化物原子(fluoride atom)によって化学物質から分離可能であることを意味する。典型的には、脱離基は、結合電子を連れて安定種として置換される。
【0295】
脱離基は当業者にとって既知又は明白であり、Synthesis (1982), p. 85-125, table 2 (p. 86;(この表2の最後の項目は訂正の必要があり、“n-C4H9S(O)2-O-nonaflat”ではなく“n-C4F9S(O)2-O-nonaflat ”である)、Carey and Sundberg, Organische Synthese, (1995), page 279-281, table 5.8;Netscher, Recent Res. Dev. Org. Chem., 2003, 7, 71-83, scheme 1, 2, 10 and 15他);Fluorine-18 Labeling Methods: Features and Possibilities of Basic Reactions, (2006), in: Schubiger P.A., Friebe M., Lehmann L., (eds), PET-Chemistry - The Driving Force in Molecular Imaging. Springer, Berlin Heidelberg, pp.15-50, explicitly: scheme 4 pp. 25, scheme 5 pp 28, table 4 pp 30, Fig 7 pp 33)に記載又は指定されているものから選択されるが、それらに限定される訳ではない。
【0296】
本明細書中、「アリール」、「ヘテロアリール」又は芳香族系を指す他の任意の用語が用いられる任意の箇所において、当該用語は、斯かる芳香族系が1又は2以上の適当な置換基、例えばOH、ハロ、(C1−C6)アルキル、CF3、CN、(C1−C6)アルケニル、(C1−C6)アルキニル、(C1−C6)アルコキシ、(ジメチルカルバモイル)(メチル)アミノ、NH2、NO2、SO3H、−SO2NH2、−N(H)C(O)(C1−C5)アルキル、−C(O)N(H)(C1−C5)アルキルで置換されている可能性をも包含する。
【0297】
本明細書において単独で、又は他の基の一部分として使用される「アリール」という語は、環部分に6〜12個の炭素、好ましくは環部分に6〜10個の炭素を含む単環式又は二環式芳香族基、例えば、フェニル、ナフチル又はテトラヒドロナフチル(これら自身が、ハロ、ニトロ、(C1−C6)カルボニル、シアノ、ニトリル、ヒドロキシ、ペルフルオロ−(C1−C16)アルキル、特にトリフルオロメチル、(C1−C6)アルキルスルホニル、(C1−C6)アルキル、(C1−C6)アルコキシ、(ジメチルカルバモイル)(メチル)アミノ及び(C1−C6)アルキルスルファニルを含む群から独立且つ個別に選択される1、2又は3個の置換基で置換されていてもよい)を指す。上に概説したように、このような「アリール」は1又は数個の置換基でさらに置換されていてもよい。上記の置換基が同一の置換基内で合していてもよいということは、当業者には明らかである(例えば、ハロ−アルキル、ペルフルオロアルキル−アルコキシ、など)。好ましくは、アリールはフェニル、ナフチルである。
【0298】
本明細書で使用される「ヘテロアリール」という語は、5〜14個の環原子;環状配置(cyclic array)において共有されている6、10又は14個のΠ(パイ)電子を有し、炭素原子(これは、ハロ、ニトロ、((C1−C6)アルキル)カルボニル、シアノ、ヒドロキシ、トリフルオロメチル、(C1−C6)スルホニル、(C1−C6)アルキル、(C1−C6)アルケニル、(C1−C6)アルキニル、(C1−C6)アルコキシ又は((C1−C6)アルキル)スルファニルで置換されていてもよい)、及び、1、2、3又は4個の酸素、窒素又は硫黄ヘテロ原子を含む基を指す(ここで、ヘテロアリール基の例は、チエニル、ベンゾ[b]チエニル、ナフト[2,3−b]チエニル、チアントレニル、フラニル、ピラニル、イソベンゾフラニル、ベンズオキサゾリル、クロメニル、キサンテニル、フェノキサチイニル、2H−ピロリル、ピロリル、イミダゾリル、ピラゾリル、ピリジル、ピラジニル、ピリミジニル、ピリダジニル、インドリジニル、イソインドリル、3H−インドリル、インドリル、インダゾリル、プリニル、4H−キノリジニル、イソキノリル、キノリル、フタラジニル、ナフチリジニル、キナゾリニル、シンノリニル、プテリジニル、4aH−カルバゾリル、カルバゾリル、カルボリニル、フェナントリジニル、アクリジニル、ペリミジニル、フェナントロリニル、フェナジニル、イソチアゾリル、フェノチアジニル、イソオキサゾリル、フラザニル及びフェノキサジニル基である)。好ましくは、ヘテロアリールは、ピリジル、2−フラニル、及び2−チエニルである。
【0299】
上に概説したように、このような「ヘテロアリール」は1又は数個の置換基でさらに置換されていてもよい。
【0300】
本明細書で使用される「アラルキル」という語は、アリール基がアルキルH原子で置換されている基を指す。アリール化アルキルから誘導される。
【0301】
以後、本明細書及び請求項で使用される「アルキル」という語は、単独で、又は他の基の一部分として、1〜10個の炭素原子を有する直鎖又は分岐鎖アルキル基、例えば、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、tert−ブチル、ペンチル、イソペンチル、ネオペンチル、ヘプチル、ヘキシル、デシルを指す。アルキル基はさらに、例えばハロゲン原子、ヒドロキシ基、C1−C4アルコキシ基又はC6−C12アリール基(これはさらに、例えば1〜3個のハロゲン原子で置換されていてもよい)で置換されていてもよい。より好ましくは、アルキルは(C1−C10)アルキル、(C1−C6)アルキル、(C1−C5)アルキル、(C2−C5)アルキル又は(C1−C4)アルキルである。
【0302】
以後、本明細書及び請求項で使用される「アルケニル」及び「アルキニル」という語は、アルキルと同様に定義されるが、それぞれ少なくとも1個の炭素−炭素二重結合又は三重結合を含んでいる。
【0303】
以後、本明細書及び請求項で使用される「アルコキシ(又はアルキルオキシ)」という語は、酸素原子によって上の定義によるアルキル部分とそれぞれ連結しているアルキル基を指す。
【0304】
本明細書及び請求項で使用される、上の定義による、そして置換基「アルキル」、「アルケニル」、「アルキニル」、「アルコキシ」などに結合している置換基R7は、対応する置換基「アルキル」、「アルケニル」、「アルキニル」、「アルコキシ」などに、任意の炭素の位置で結合できる。従って、「R7−(C1−C5)アルコキシ」という語は位置異性に関して様々な可能性を包含し、例えば、R7−(C5)ペントキシは、例えばR7−CH2−CH2−CH2−CH2−CH2−O−、CH3−C(R7)H−CH2−CH2−CH2−O−又はCH(−CH2−R7)(−CH3)−CH2−CH2−O−などを意味し得る。
【0305】
「置換された」という語が使用される時は常に、それは、「置換された」が用いられる表現において示される原子に結合した1又はそれ以上の水素が、示された基から選択されるもので置き換えられることを意味する。但し、示された原子の正常な原子価を超えず、また、その置換が、化学的に安定な化合物、即ち、反応混合物からの有用な純度に至るまでの単離、及び医薬組成物への製剤化に対して存続するに充分なほど強固な化合物を生成するという条件においてである。置換基は、ハロゲン原子(フルオロ、塩素、臭素、ヨード)、ヒドロキシ基、−SO3H、ニトロ、(C1−C6)アルキルカルボニル、シアノ、ニトリル、トリフルオロメチル、(C1−C6)アルキルスルホニル、(C1−C6)アルキル、(C2−C6)アルケニル、(C1−C6)アルキニル、(C1−C6)アルコキシ及び(C1−C6)アルキルスルファニルから選択できる。
【0306】
「ハロ」又は「ハロゲン」という語は、フッ素(F)、塩素(Cl)、臭素(Br)、及びヨウ素(I)を指す。
【0307】
本発明化合物にキラル中心又はその他の形態の異性体中心が存在する場合、エナンチオマー及びジアステレオマーを包含するそのような立体異性体の全形態が本発明に包含されることが意図されている。キラル中心を含む化合物は、ラセミ混合物又はエナンチオマー的に濃縮された混合物として使用でき、又は、ラセミ混合物を周知の技術を用いて分離し、個々の立体異性体を単独で利用することができる。化合物が不飽和の炭素−炭素二重結合を有する場合、(Z)−異性体及び(E)−異性体の両者が本発明の範囲内にある。化合物が互変異性型、例えばケト−エノール互変異性体として存在し得る場合、各互変異性型は、平衡状態で存在していようと一方の型が大部分であろうと、本発明の範囲内に包含されると考えられる。
【0308】
特に規定のない限り、本発明の式の化合物自体及びその任意の医薬組成物に言及する場合、本発明は、本発明化合物の水和物、塩、溶媒和物、複合体、及びプロドラッグの全てを包含する。プロドラッグとは、式Iに示される活性な親薬物を放出する、共有結合で結合した任意の化合物である。
【0309】
以後、本明細書及び請求項で使用される「活性化剤」という語は、「芳香族超原子価ヨード化合物」又は「酸化剤」又は「メチル化剤」を指す。
【0310】
以後、本明細書及び請求項で使用される「メチル化剤」という語は、芳香族−NMe2基を芳香族−N+Me3基に変換するのに適したヨウ化メチル及びメチルトリフラートを包含する化学物質を指すが、それらに限定されない(例えば、Chemistry - A European Journal; 13; 8; (2007); 2189 - 2200; Journal of Fluorine Chemistry;128; 7; (2007); 806 - 812)。
【0311】
以後、本明細書及び請求項で使用される「求電子試薬」という語は、脱離基中のヒドロキシ基の変換に適した、四臭化炭素(CBr4) 、トリフェニルホスフィン/臭素(PPh3/Br2)、四塩化炭素(CCl4)、チオニルクロリド(SOCl2)、メシルクロリド、メシル無水物、トシルクロリド、トシル無水物、トリフルオロメチルスルホニルクロリド、トリフルオロメチルスルホニル無水物、ノナ−フルオロブチルスルホニルクロリド、ノナ−フルオロブチルスルホニル無水物、(4−臭素−フェニル)スルホニルクロリド、 (4−臭素−フェニル)スルホニル無水物、(4−ニトロ−フェニル)スルホニルクロリド、(4−ニトロ−フェニル)スルホニルクロリド、(2−ニトロ−フェニル)スルホニルクロリド、(2−ニトロ−フェニル)スルホニル無水物、(4−イソプロピル−フェニル)スルホニルクロリド、(4−イソプロピル−フェニル)スルホニル無水物、(2,4,6−トリ−イソプロピル−フェニル)スルホニルクロリド、(2,4,6−トリ−イソプロピル−フェニル)スルホニル無水物、(2,4,6−トリメチル−フェニル)スルホニルクロリド、(2,4,6−トリメチル−フェニル)スルホニル無水物、(4−tertブチル−フェニル)スルホニルクロリド、(4−tertブチル−フェニル)スルホニル無水物、(4−メトキシ−フェニル)スルホニルクロリド、(4−メトキシ−フェニル)スルホニル無水物、即ちスルホナート又はハロゲン化物を包含する化学物質を指すが、これらに限定されない。
【0312】
以後、本明細書及び請求項で使用される「オキシダント」という語は、環状スルファミダイトを環状スルファミダートに変換するのに適した、m−塩素ペルオキシ安息香酸、過マンガン酸カリウム(KMnO4)、水和酸化ルテニウム(IV)(RuO2xH2O)に過ヨウ素酸ナトリウム(NaIO4)を加えたもの、及び過ヨウ素酸ナトリウム/三塩化ルテニウム(NaIO4/RuCl3)を包含する化学物質を指すが、これらに限定されない(例えば、Tetrahedron 59, (2003), 2581-2616, page 2585及びそこに引用されている文献)。
【0313】
以後、本明細書及び請求項で使用される「過剰増殖性疾患」という語は、制御されない増殖(正常限界を超えた分割)、浸潤(隣接組織への侵入及びその破壊)、及び時に転移(リンパ又は血液を介した身体の他の位置への蔓延)を特徴とする、癌(医学用語:悪性腫瘍)という一般用語に分類される疾患を指す。癌のこれら3つの悪性の特性により、自己限定性であり、浸潤又は転移しない良性腫瘍と癌とが区別される。殆どの癌は固形腫瘍を形成するが、白血病のようにそうでないものもある。
【0314】
以後、本明細書及び請求項で使用される「参照化合物」という語は、参照化合物は同定手段としての、そして品質確認のための放射標識がなされていないという点で放射性トレーサーと異なっている化合物を指す。
【0315】
以後、本明細書及び請求項で使用される「マイクロPET」という語は、小実験動物の高分解能造影のために設計されたPET造影技術を指す。
【0316】
以後、本明細書及び請求項で使用される「プロドラッグ」という語は、式Iによる活性な親薬物、好ましくは式Iで示される18F標識化化合物を放出する、共有結合で結合した任意の化合物を意味する。
【0317】
この文書全体で使用されている「プロドラッグ」という語は、その誘導体のインビボ生体内変化で生じる生成物が式(I)の化合物で定義される活性薬物であるような、エステル、アミド及びホスファートといった薬理学的に許容される誘導体を意味する。プロドラッグを一般的に説明しているGoodman and Gilman (The Pharmaco- logical Basis of Therapeutics, 8 ed, McGraw-HiM, Int. Ed. 1992,"Biotransformation of Drugs", p 13-15)による参考文献を本明細書の一部とする。本発明化合物のプロドラッグは、その修飾が、従来の操作又はインビボで親化合物へと開裂されるように、化合物に存在する官能基を修飾することによって製造する。本発明化合物のプロドラッグは、例えばヒドロキシ基、例えば不斉炭素原子上のヒドロキシ基、又はアミノ基が、そのプロドラッグが患者に投与された時に開裂して各々遊離ヒドロキシ又は遊離アミノを形成する任意の基に結合しているような化合物を包含する。
【0318】
プロドラッグの典型例は、例えばWO99/33795、WO99/33815、WO99/33793及びWO99/33792に記載されており、これら全てを引用により本明細書の一部とする。
【0319】
プロドラッグは、優れた水溶性、増大した生体利用能を特徴とし、インビボで容易に代謝されて活性阻害剤となる。
【0320】
略語及び頭字語
当分野における通常の知識を有する有機化学者が使用する略語の総合リストがThe ACS Style Guide(第3版)又はthe Guidelines for Authors for the Journal of Organic Chemistryに掲載されている。前記リストに含まれている略語及び当分野における通常の知識を有する有機化学者が使用する全略語を引用して本明細書の一部とする。本発明の目的のため、化学元素はthe Periodic Table of the Elements, CAS version, Handbook of Chemistry and Physics, 67th Ed., 1986-87に従って特定する。
【0321】
より詳細には、本開示全編にわたり以下の略語が使用される時、それらは以下の意味を有する:
【0322】
Boc tert−ブトキシカルボニル
DAST ジエチルアミノ硫黄トリフルオリド
eq.;equiv. 当量
h 時間
m−CPBA メタ−塩素過安息香酸
TFA トリフルオロ酢酸
【実施例】
【0323】
実験データ
[18F]−4−フルオロ−L−オルニチン(29)の合成:
【化32】

【0324】
Org. Lett. 2001, 3, 3153に記載の方法に従い(4)を合成した。次いで遊離アミン官能性を、水素化工程で開裂させることのできるベンジルオキシカルバメート(CbzHN)基として保護した。Cbz基の他に、ベンジル又はメトキシベンジルのような他の酸化還元不安定性アミン保護基、及びトリアジノン類のような酸不安定性保護基又はフタロイル基のようなイミド様部分を使用することもできる(P. J. Kocienski, Protecting Groups, 3rd ed, Georg Thieme Verlag 2005, p. 487-591)。遊離アルコール(26)を、メタンスルホニルクロリド又はp−トルエンスルホン酸無水物のような求電子試薬との反応により求核性フッ化物イオンと反応可能なスルホナートに変換し、それぞれ対応する前駆体(27)及び(28)を得る。当業者は、ノシラート、ブロシラート、ノナフラート、トリフラート、ヨウ化物、臭化物又は塩化物といった他の脱離基を前駆体への変換に利用することもできる(J. March, Advanced Organic Chemistry, 4th ed. 1992, John Wiley & Sons, pp 352ff)。
【0325】
tert−ブチル(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−ヒドロキシ−L−オルニチナート(26)の合成:
【化33】

【0326】
テトラヒドロフラン(12.5mL)中のジベンジルジカルボナート(600mg、2.09mmol)の溶液に0℃でテトラヒドロフラン/ジ塩素メタン(1:1、5mL)中の(4)(455mg、1.50mmol)の溶液を加えた。この温度で1時間攪拌した後、飽和重炭酸ナトリウム水溶液(20mL)を加えて反応停止させた。層を分離し、水相を酢酸エチル(3x20mL)で抽出し、合した有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去した。粗生成物をカラムクロマトグラフィー(シリカ、ヘキサン/酢酸エチル)で精製した。収量:548mg、83%。
【0327】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 1.45 (s, 9H), 1.47 (s, 9H), 1.68 - 1.84 (m, 1H), 1.90 - 2.02 (m, 1H), 3.13 (ddd, 1H), 3.28 - 3.51 (m, 2H), 3.91 (br. s., 1H), 4.22 (dd, 1H), 5.11 (s, 2H), 5.23 (br. s., 1H), 5.39 (br. s., 1H), 7.29 - 7.40 (m, 5H)。
MS (ESIpos): m/z = 439 [M+H]+。
【0328】
tert−ブチル(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−[(メチルスルホニル)オキシ]−L−オルニチナート(27)の合成:
【化34】

【0329】
ジ塩素メタン(40mL)中の(26)(547mg、1.25mmol)の溶液に0℃でトリエチルアミン(0.87mL、6.24mmol)及びメタンスルホニルクロリド(0.24mL、3.12mmol)を加えた。この温度で3時間攪拌した後、反応混合物を酢酸エチル(100mL)で希釈し、飽和塩化アンモニウム水溶液で洗浄した。次いで水相を酢酸エチルで2回抽出し、合した有機相を硫酸マグネシウムで乾燥した。溶媒を除去した後、粗生成物をカラムクロマトグラフィー(シリカ、ヘキサン/酢酸エチル)で精製した。収量:546mg、85%。
【0330】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 1.45 (s, 9H), 1.48 (s, 9H), 2.09 - 2.23 (m, 2H), 3.05 (s, 3H), 3.47 - 3.67 (m, 2H), 4.27 (br. s., 1H), 4.89 (br. s., 1H), 5.12 (s, 2H), 5.25 (br. s., 2H), 7.29 - 7.42 (m, 5H)。
MS (ESIpos): m/z = 517 [M+H]+。
【0331】
tert−ブチル(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−{[(4−メチルフェニル)スルホニル]オキシ}−L−オルニチナート(28)の合成:
【化35】

【0332】
ジ塩素メタン/ピリジン(4:1、5mL)中の(26)(50.0mg、0.11mmol)の溶液に0℃でp−トルエンスルホン酸無水物(55.8mg、0.17mmol)を加えた。0℃で2時間、そして室温で1時間攪拌した後、追加量のp−トルエンスルホン酸無水物(55.8mg、0.17mmol)を加えた。室温で14時間攪拌した後、反応混合物を酢酸エチル(20mL)で希釈し、2N塩酸、ブラインで洗浄し、硫酸マグネシウムで乾燥した。溶媒を除去した後、粗生成物をカラムクロマトグラフィー(シリカ、ヘキサン/酢酸エチル)で精製した。収量:58.2mg、68%。
【0333】
1H-NMR (400MHz, 塩素ホルム-d): δ [ppm]= 1.43 (s, 9H), 1.45 (s, 9H), 1.92 - 2.05 (m, 1H), 2.17 (d, 1H), 2.43 (s, 3H), 3.46 - 3.60 (m, 2H), 4.08 - 4.24 (m, 1H), 4.73 (br. s., 1H), 5.01 - 5.15 (m, 4H), 7.29 - 7.39 (m, 7H), 7.80 (d, 2H)。
MS (ESIpos): m/z = 593 [M+H]+。
【0334】
(4S)−[18F]−フルオロ−L−オルニチン(29)の合成:
【化36】

【0335】
水性[18F]−フルオリドを18O(p,n)18F反応により生成した。[18F]−フルオリド(1.64〜2.70GBq)を、前処理済みQMA陰イオン交換カラム(30mg、CO3_型)を用いてターゲット水から分離し、メタノール中0.2Mのテトラブチルアンモニウムメタンスルホナート(TBAOMs)1mLを使用して円錐形ガラスバイアル中に溶出した。この溶液を窒素気流下に開放ガラスバイアル中、130℃で乾燥した。残留水を除去するため、アセトニトリル1.0mLを加え、溶液を再度乾燥した。この最終工程を2回反復し、残余の固体残留物を、tert−ブチル(4R)−N−[(ベンジルオキシ)カルボニル]−N−(tert−ブトキシカルボニル)−4−[(メチルスルホニル)オキシ]−L−オルニチナート(27)5.0mgを含有するアセトニトリル300μLに再溶解した。このガラスバイアルに蓋をし、90℃で15分間加熱した。冷却後、反応混合物をアセトニトリル/水(1/2 v/v)4mLで希釈し、続いて、リモコン操作のHPLC注入システムを用いてHPLCユニットに移し、Agilent Zolbax Bonus-RP C18、5μm;250_9.4mmカラムを用いるセミ分取HPLC精製に付した。溶離液は、流速4mL/分の0.1%トリフルオロ酢酸を含むアセトニトリル/水であった。精製のため、40〜80%アセトニトリルの直線勾配を20分以内使用した。
【0336】
HPLC画分を水4mLで希釈し、前処理したC18ライトカートリッジに適用した。カートリッジを水5mLで洗浄し、エタノール2mLで第二の円錐形ガラスバイアル中に溶出した。パラジウム炭素(Pd/C)(10%)3mg及び固体蟻酸アンモニウム4mgをこのガラスバイアルに加え、蓋をした後、90℃で25分間加熱した。冷却した反応混合物を、Pd/Cを除去するために4mmHPLCシリンジフィルターを通過させて第三の円錐形ガラスバイアルに入れた。次に、濾液に4N塩酸100μLを加え、被蓋ガラスバイアル中でこの溶液を再度90℃で15分間加熱した。冷却した反応混合物を4N水酸化ナトリウム(pH6〜8)で最後に中和し、濾過滅菌すると12〜31MBqの最終トレーサーが、約153分間の合成時間後に、放射化学収率2±1%、放射化学純度90〜99%で得られた。
【0337】
(3R)−3−フルオロ−L−オルニチン(31)の合成:
【化37】

【0338】
保護3−ヒドロキシオルニチン(11)をモルホリノ−硫黄トリフルオリドとの反応により、対応する3−フルオロ誘導体(30)に変換した(H. Vorbrueggen, Synthesis 2008, 8, 1165-1174)。この保護3−フルオロオルニチンの脱保護を酸性条件下に塩酸で実施した。当業者にとっては、硫酸又はトリフルオロ酢酸のような他の有機又は無機酸及び水酸化ナトリウム水溶液のような塩基性条件を保護基の除去に使用することもできる。
【0339】
メチル(3R)−N2,N5−ビス(tert−ブトキシカルボニル)−3−フルオロ−L−オルニチナート(30)の合成:
【化38】

【0340】
ジ塩素メタン(10mL)中のアルコール(11)(100mg、0.28mmol)の溶液に0℃で4−(トリフルオロ−λ4−スルファニル)モルホリン(69μL、0.55mmol)を加え、混合物をこの温度で2時間攪拌した。次いで反応混合物を酢酸エチル(20mL)で希釈し、飽和重炭酸ナトリウム水溶液、ブラインで洗浄し、硫酸マグネシウムで乾燥した。溶媒を減圧除去した後、残留物を分取HPLC(XBridge C18 5μ 100×30mm、アセトニトリル/1%水性蟻酸勾配、50mL/分)で精製すると標記化合物が得られた。収量:2.4mg、3%。
【0341】
1H-NMR (400MHz, 塩素ホルム-d): δ [ppm]= 1.45 (s, 9H), 1.47 (s, 9H), 1.71 - 2.06 (m, 2H), 3.21 - 3.38 (m, 2H), 3.81 (s, 3H), 4.53 (dd, 1H), 4.72 (br. s., 1H), 5.12 (dd, 1H), 5.22 (d, 1H)。
MS (ESIpos): m/z = 365 [M+H]+。
【0342】
(3R)−3−フルオロ−L−オルニチン−ジヒドロクロリド(31)の合成:
【化39】

【0343】
6N塩酸中の(30)(2.0mg、2.7μmol)の溶液を80℃で3.5時間攪拌した。混合物を減圧濃縮した後、水で希釈し凍結乾燥すると、灰白色固体の標記化合物が得られた。収量:1.0mg、82%。
MS (ESIpos): m/z = 151 [M - 2 HCl + H]+。
【0344】
(5R)−[18F]フルオロメチル−L−オルニチン(38)の合成:
【化40】

【0345】
Org. Biomol. Chem. 2003, 973に記載の方法に従い(32)を合成した。次いでホモアリルグリシン(32)の二重結合を市販のAD−ミックス−αで非対称的にジヒドロキシ化した。tert−ブチルヒドロペルオキシドのような共酸化剤と組み合わせたOsO4のような当業者に知られる他のジヒドロキシ化法(J. Am. Chem. Soc. 1976, 98, 1986)以外にも、N−メチルモルホリノN−オキシド(Tetrahedron Lett. 1976, 1973)その他が使用できる。さらに、ジェイコブセン(Catalytic Asymmetric Synthesis, Ojima, I. Ed., VCH Publishers, 1993, pp 159-202)又はシャープレス(Comp. Org. Syn. 1991, 7, 389)によるタンデムエポキシ化−加水分解法もまた所望の構造パターンを導くことができる。次にこの第一級アルコールをtert−ブチル−ジメチルシリルエーテルとして化学選択的に保護し、第二級アルコールをミツノブ条件下にジフェニルホスホロアジダート(DPPA)、ジエチルアゾジカルボキシラート(DEAD)及びPPh3により、対応するアジドに変換した(Chem. Eur. J. 2007, 13, 10225)。この他に、2個のヒドロキシ基の識別を、他のピバラート(Tetrahedron 2009, 2226)、トリチル(Tetrahedron Asymmetry 2009, 78)その他のような嵩高い保護基によって達成できる(Protecting Groups, Kocienski P. J., Thieme, 2005, pp 187-364)。第一級アルコール(36)の脱保護の後、ヒドロキシ基を、後にフッ素−18によるこの化合物の標識化を可能にするメタンスルホナートに変換した。当業者にとっては、他のスルホナート及びハロゲン化物のような他の脱離基(J. Lab. Cmpd. Rad. 2005, 771)もまた求核的フッ素化反応における求電子試薬として働くことができる。
【0346】
メチル−(5S)−N−(tert−ブトキシカルボニル)−5,6−ジヒドロキシ−L−ノルロイシナート(33)の合成:
【化41】

【0347】
tert ブタノール/水(1:1、40mL)中のアルケン(32)(1.42g、5.85mmol)の溶液に、0℃でAD−ミックスα(9.00g、1.54g/mmol)を加えた。この懸濁液を一夜撹拌した。チオ硫酸ナトリウムの飽和水溶液及び酢酸エチルを加え、反応混合物を25℃で1時間攪拌した。層を分離し、水層を酢酸エチル(3x)で抽出した。合した有機層を飽和塩化アンモニウム水溶液で洗浄し、硫酸ナトリウムで乾燥した。蒸発後に粗生成物が得られ(758mg)、これをさらに精製せずに次工程に使用した。分析用キラルHPLC(Chiralpak AD-H 5μm 150x4.6mm、ヘキサン/エタノール80:20、1.0mL/分、25℃、検出:Corona CAD)により、78%d.e.のジアステレオマー過剰率(x10)を確認した。
MS (ESIpos): m/z = 278 [M+H]+。
【0348】
メチル−(5S)−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−5−ヒドロキシ−L−ノルロイシナート(34)の合成:
【化42】

【0349】
ジアステレオマーのジオール(33)の混合物(758mg、2.73mmol)をジ塩素メタン(40ml)に溶解し、tert−ブチルジメチルシリルクロリド(412mg、2.73mmol)及びイミダゾール(279mg、4.10mmol)を加え、混合物を25℃で一夜撹拌した。ジ塩素メタン及び水を加えた後、層を分離し、水層をジ塩素メタン(3x)で抽出した。合した有機層を硫酸ナトリウムで乾燥し、蒸発乾固した。残留物をフラッシュクロマトグラフィー(n−ヘキサン/酢酸エチル(2:1))で精製して無色油状物の所望化合物を得た(518mg、1.32mmol、48%)。
【0350】
13C NMR (75 MHz, 塩素ホルム-d) δ = -5.37 (CH3), 18.26 (C), 25.86 (CH3) (3x), 28.30 (CH3) (3x), 28.40 (CH2), 28.91 (CH2), 52.28 (CH3), 53.21 (CH), 67.02 (CH2), 71.05 (CH), 79.83 (C), 155.41 (C), 173.25 (C) ppm。
MS (ESIpos): m/z = 392 [M+H]+。
【0351】
メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−L−ノルロイシナート(35)の合成:
【化43】

【0352】
トリフェニルホスフィン(700mg、2.64mmol)、ジエチルアゾジカルボキシラート(417μL、2.65mmol)、及びジフェニルホスホロアジダート(342μL、1.59mmol)を、テトラヒドロフラン(10mL)中のアルコール(34)(518mg、1.32mmol)の撹拌溶液に、室温、アルゴン雰囲気下で順に加えた。反応混合物を同じ温度で3時間攪拌した。溶媒を減圧除去した後、残留物を、ヘキサン/酢酸エチル(8:1)を溶離液とするカラムクロマトグラフィーで精製し、無色油状物の所望化合物(439mg、1.05mmol、80%)を得た。
【0353】
13C NMR (75 MHz, 塩素ホルム-d) δ = -5.57 (CH3) (2x), 18.19 (C), 25.76 (CH3) (3x), 26.32 (CH2), 28.28 (CH3) (3x), 29.52 (CH2), 52.39 (CH3), 53.18 (CH), 63.17 (CH), 66.17 (CH2), 80.04 (C), 155.26 (C), 172.90 (C) ppm。
MS (ESIpos): m/z = 417 [M+H]+。
【0354】
メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−ヒドロキシ−L−ノルロイシナート(36)の合成:
【化44】

【0355】
TBDMS−保護されたアジド(35)(439mg、1.05mmol)を0℃でテトラヒドロフラン(30mL)に溶解した。次いでこの溶液に、テトラヒドロフラン中のテトラブチルアンモニウムフルオリド(TBAF、1.27mL、1.27mmol)の1M溶液を加えた。混合物を25℃で1時間攪拌した。混合物を濃縮し、残留物をシリカゲルクロマトグラフィー(ヘキサン/酢酸エチル 1:1)に付し、無色油状物の所望化合物(292mg、0.97mmol、92%)を得た。
【0356】
13C NMR (75 MHz, 塩素ホルム-d) δ = 26.43 (CH2), 28.28 (CH3) (3x), 29.32 (CH2), 52.48 (CH3), 53.18 (CH), 63.62 (CH), 65.20 (CH2), 80.18 (C), 155.34 (C), 172.78 (C) ppm。
MS (ESIpos): m/z = 303 [M+H]+。
【0357】
メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−[(メチルスルホニル)オキシ]−L−ノルロイシナート(37)の合成:
【化45】

【0358】
アジドアルコール(36)(80mg、0.27mmol)及びトリエチルアミン(55μL、0.40mmol)をジ塩素メタン(5mL)に溶解し、0℃に冷却した。メタンスルフリルクロリドの溶液(20μL、0.27mmol)をゆっくりと加えた。反応を徐々に室温まで温め、さらに5時間攪拌した。反応混合物を水で希釈し、ジ塩素メタンで4回洗浄して粗生成物を得、これをカラムクロマトグラフィー(SiO2:ヘキサン/酢酸エチル 1:1)で精製すると、無色油状物の所望化合物(110mg、0.29mmol、99%)が得られた。
【0359】
13C NMR (151 MHz, 塩素ホルム-d) δ = 26.40 (CH2), 28.26 (CH3) (3x), 29.18 (CH2), 37.70 (CH3), 52.61 (CH3), 52.86(CH), 60.17 (CH), 70.21 (CH2), 80.26 (C), 155.31 (C), 172.54 (C) ppm。
MS (ESIpos): m/z = 381 [M+H]+。
【0360】
(5R)−[18F]−フルオロメチル−L−オルニチン(38)の合成:
【化46】

【0361】
水性[18F]−フルオリドを18O(p,n)18F反応により生成した。[18F]−フルオリド(1.51〜3.69GBq)を、前処理済みQMA陰イオン交換カラム(30mg、CO3−型)を用いてターゲット水から分離し、新たに調製したテトラブチルアンモニウム炭酸水素塩(TBAHCO3)溶液(これは、アセトニトリル/水(9/1 v/v)中の40%テトラブチルアンモニウムヒドロキシド(5μL)の溶液中に二酸化炭素を30分間通気することによって製造した)2mLを使用して円錐形ガラスバイアル中に溶出した。この溶液を窒素気流下に開放ガラスバイアル中、130℃で乾燥した。残留水を除去するため、アセトニトリル1.0mLを加え、溶液を再度乾燥した。この最終工程を2回反復し、残余の固体残留物を、前駆体メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−[(メチルスルホニル)オキシ]−L−ノルロイシナート(37)3.0mgをも含有する2−メチル−2−ブタノール150μLに再溶解した。このガラスバイアルに蓋をし、120℃で30分間加熱した。冷却後、反応混合物をアセトニトリル/水(9.5/0.5 v/v)10mLで希釈し、前処理したC18 Plusカートリッジに入れ、30mLの水で洗浄した。1.2mLアセトニトリルにより活性がカートリッジから第二の円錐形ガラスバイアルに溶出し、2N水酸化ナトリウム500μLを加えた。このガラスバイアルを被蓋せずに80℃で10分間加熱した。冷却後、反応混合物を水9mLで希釈し、前処理したC18 Plusカートリッジに入れ、5mLの水で2回洗浄した。1.5mLアセトニトリルにより活性がカートリッジから第三の円錐形ガラスバイアルに溶出し、穏やかな窒素気流下に開放バイアル中、130℃で蒸発させた。残留水を除去するため、アセトニトリル1.0mLを加え、溶液を再度乾燥した。この最終工程を1回反復し、固体残留物を、エタノール500μLに再溶解した。パラジウム炭素(Pd/C)(10%)3mg及び固体蟻酸アンモニウム4mgを加えた後、蓋をしたこのガラスバイアルを70℃で30分間加熱した。冷却した反応混合物を、Pd/Cを除去するために4mmHPLCシリンジフィルターを通過させて第四の円錐形ガラスバイアルに入れた。次に、濾液に4N塩酸500μLを加え、被蓋ガラスバイアル中でこの溶液を再度80℃で5分間加熱した。冷却した反応混合物を4N水酸化ナトリウム(pH6〜8)で最後に中和し、濾過滅菌すると、73〜97MBqの最終トレーサーが、約210分間の合成時間後に、放射化学収率14±7%、放射化学純度92〜97%で得られた。
【0362】
4−フルオロ−L−オルニチン(2)の合成:
【化47】

【0363】
保護(S)−アリルグリシン(40)のヨードフッ素化によって4−ある悪露−L−オルニチン(2)の合成を達成した(例えばM. Kuroboshi et al., Tetrahedron Lett. 1991, 32(9), 1215)。臭素フッ素化のように第2級フッ素官能性を導く他のハロフッ素化反応をこの工程に利用することもできる。(例えばJ. B. Hester et al., J. Med. Chem. 2001, 44(7), 1099)。次いで末端ヨード基を窒素求核試薬としてのアジドで置換した。この他に、フタルイミド又はベンジルアミドのような別の窒素求核試薬をこの変換に利用することもできる。アジ時の還元並びにα−アミン感応性及びカルボキシ基の脱保護によって4−フルオロ−L−オルニチン(2)を得た。
【0364】
ベンジル(2S)−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)ペンタ−4−エノアート(4)の合成:
【化48】

【0365】
乾燥テトラヒドロフラン(10mL)中の(S)−アリルグリシン(100mg、0.87mmol)、N−カルベトキシフタルイミド(200mg、0.91mmol)及びトリエチルアミン(0.17mL、1.22mmol)の溶液を還流下に14撹拌した。硫酸ナトリウムで乾燥後、溶媒を減圧留去した。
【0366】
残留物をアセトン(3mL)に溶解し、炭酸カリウム(532mg、3.85mmol)及びベンジルブロミド(0.17mL、1.41mmol)を加えた。混合物をマイクロ波を照射しながら60℃で2時間加熱し、冷却し、セライトで濾過した。溶媒を減圧除去し、粗生成物をカラムクロマトグラフィー(SiO2、ヘキサン/酢酸エチル勾配)で精製すると、標記化合物が得られた。収量:151mg、70%。
【0367】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 2.96 - 3.11 (m, 2H), 4.96 - 5.25 (m, 5H), 5.64 - 5.78 (m, 1H), 7.24 - 7.37 (m, 5H), 7.70 - 7.88 (m, 4H)。
MS (ESIpos): m/z = 336 [M+H]+。
【0368】
ベンジル(2S)−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロ−5−ヨード−ペンタノアート(41)の合成:
【化49】

【0369】
乾燥ジ塩素メタン(10mL)中の(40)(500mg、1.49mmol)及びテトラ−N−ブチルアンモニウム 三フッ化二水素(2.33mL、7.46mmol)の溶液にN−ヨードスクシンイミド(671mg、2.98mmol)を室温で2時間かけて少しずつ加え、反応混合物をこの温度でさらに20時間攪拌した。次いで混合物を酢酸エチルで希釈し、飽和重炭酸ナトリウム溶液、ブラインで洗浄し、硫酸マグネシウムで乾燥した。溶媒を除去した後、粗生成物をカラムクロマトグラフィー(SiO2、ヘキサン/酢酸エチル勾配)で精製して標記化合物を得た。収量:126mg、18%。
【0370】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 2.45 - 3.08 (m, 2H), 3.31 (dd, 2H), 4.31 - 4.73 (m, 1H), 5.07 - 5.30 (m, 3H), 7.20 - 7.39 (m, 5H), 7.72 - 7.91 (m, 4H)。
19F-NMR (376MHz, 塩素ホルム-d): δ [ppm]= -173.46 (m)。
MS (ESIpos): m/z = 482 [M+H]+。
【0371】
ベンジル(2S)−5−アジド−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロ−ペンタノアート(42)の合成:
【化50】

【0372】
乾燥ジメチルホルムアミド(10mL)中の(41)(110mg、0.23mmol)及びアジドナトリウム(74.3mg、1.14mmol)の溶液を、マイクロ波照射しながら80℃で3時間加熱した。室温に冷却した後、反応混合物を酢酸エチルで希釈し、飽和重炭酸ナトリウム溶液及びブラインで洗浄し、減圧濃縮した。粗生成物をカラムクロマトグラフィー(SiO2、ヘキサン/酢酸エチル勾配)で精製して標記化合物を得た。収量:73mg、81%。
【0373】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 2.39 - 2.75 (m, 2H), 3.34 - 3.50 (m, 2H), 4.40 - 4.72 (m, 1H), 5.03 - 5.25 (m, 3H), 7.18 - 7.41 (m, 5H), 7.69 - 7.95 (m, 4H)。
MS (ESIpos): m/z = 397 [M+H]+。
【0374】
(2S)−5−アミノ−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロ−ペンタン酸(43)の合成:
【化51】

【0375】
メタノール(5mL)中の(42)(110mg、0.278mmol)及びパラジウム(33mg、活性炭上10%、31μmol)の混合物を水素雰囲気下に室温で3時間攪拌した。次にこの混合物をセライトで濾過し、濾過ケーキをさらなるメタノールで洗浄し、濾液を減圧濃縮した。収量:35.0mg、45%。
【0376】
1H-NMR (400MHz, 酸化ジュウテリウム): δ [ppm]= 2.25 - 2.62 (m, 2H), 3.13 - 3.41 (m, 2H), 4.78 - 4.87 (m, 1H), 4.91 - 5.14 (m, 1H), 7.76 - 7.89 (m, 4H)。
19F-NMR (376MHz, 酸化ジュウテリウム): δ [ppm]= -191.17 (m, 0.5 F), -191.71 (m, 0.5 F)。
MS (ESIpos): m/z = 281 [M+H]+。
【0377】
バイオデータ
実施例(38) (5R)−[18F]−フルオロメチル−L−オルニチン
(5R)−[18F]−フルオロメチル−L−オルニチン(38)の特異性を決定するため、このフッ素化化合物を、競合用に過剰のL−オルニチン(1mM)を使用するA549(ヒトNSCLC)及びH460(ヒトNSCLC)腫瘍細胞における細胞競合実験においてトレーサーとして使用した。驚くべきことに、(5R)−[18F]−フルオロメチル−L−オルニチンの取り込みは過剰のL−オルニチンにより遮断可能であり、このことは、同じ輸送系が取り込みに使用されていることを示すものであった(図1)。
【0378】
第二の実験では、幾つかの腫瘍セルラインへの(5R)−[18F]−フルオロメチル−L−オルニチンの結合の時間依存性を、A549、H460並びにPC3(前立腺)及びDU145(前立腺)腫瘍セルラインを用いて決定した。0.25MBqで30分間インキュベーションした後に、適用量の最大5%(PC3細胞)が細胞に結合した(図2)。
【0379】
実施例(31)(3R)−3−フルオロ−L−オルニチン−ジヒドロクロリド
(3R)−3−フルオロ−L−オルニチン−ジヒドロクロリド(31)を、14C−オルニチンをトレーサーに用いる細胞競合実験に使用した。3−フルオロオルニチンはA549細胞において14C−オルニチンの取り込みを大幅に遮断できることが発見された(図3)。
【0380】
実施例(29) 腫瘍細胞における(4S)−[18F]−フルオロ−L−オルニチンの生物活性の決定
(4S)−[18F]−フルオロ−L−オルニチン(29)の特異性を決定するため、このフッ素化化合物を、A549及びPC3腫瘍細胞における過剰のL−オルニチン(1mM)に対する細胞競合実験においてトレーサーとして使用した。興味深いことに、(4S)−[18F]−フルオロ−L−オルニチンの取り込みは過剰のオルニチンにより遮断可能であり、このことは、同じ取り込み系の使用を示すものであった(図4)。
【0381】
第二の実験では、A549及びPC3細胞を(4S)−[18F]−フルオロ−L−オルニチンと共に最長60分間インキュベートし、細胞に結合した割合を測定した。60分間のインキュベーション時間の間に適用量のおよそ5%が細胞により取り込まれた(図5)。
【0382】
第三の実験では、腫瘍細胞における活性の保持を調べた。A549細胞を(4S)−[18F]−フルオロ−L−オルニチンと共に30分間インキュベートした。この時間の後、細胞を新たな緩衝液(放射性トレーサーを含まない)と共に最長30分間インキュベートした。上清への放射能の放出及び細胞内部への保持を調べた。流出条件下で30分の後、活性のおよそ66%が腫瘍細胞に保持されていた(図6)。
【0383】
動物実験。(4S)−[18F]−フルオロ−L−オルニチンをNCI−H460(ヒトNSCLC)腫瘍を持つラットにおいてPET造影を用いて調べた。放射性トレーサー(7.16MBq)を30分間投与した45分後からPET画像を取得した。腫瘍は極めて良好に視覚化され、腫瘍1グラムにつき最大2.2%の注射用量がROI解析によって決定された。より遅い時点では若干の部分的脱フッ素化が観察され、放出された[F18]−フッ化物が骨に取り込まれる結果となった(図7)。PET造影実験の後(98分のp.i.)ラットを殺し、幾つかの臓器を摘出し、組織の放射能の量を測定した。表1を参照されたい。腫瘍(1.43% ID/g)、膵臓(2.47% ID/g)及び骨(2.08% ID/g)に高い量の放射能が観察された。
【0384】
【表1】

【技術分野】
【0001】
本発明は、キレート剤を含まない放射性同位体による放射標識に適した化合物、及び、一般式Iの放射標識化合物:
【化1】

に関する。
【0002】
前記化合物はオルニチン又はリジン誘導体である。本発明はさらに、疾患を造影するための前記化合物の使用、斯かる化合物を製造する方法、斯かる化合物を含む組成物、斯かる化合物又は組成物を含むキットに関する。
【背景技術】
【0003】
悪性腫瘍の早期診断は腫瘍患者の生存予測において重要な役割を担っている。この診断においては、非侵襲的な画像診断プロセスが重要な手段である。近年、特にPET技術(Positron Emission Tomography)が極めて有用であるとわかった。PET技術の感度及び特異性は、使用されるシグナル伝達物質(トレーサー)及びその体内分布に著しく依存する。適当なトレーサーの探索において、腫瘍組織を健康な周囲の組織から識別する、腫瘍のある性質を利用する試みがなされてきた。PETスキャンに使用される放射性核種は典型的には、炭素−11(〜20分間)、窒素−13(〜10分間)、酸素−15(〜2分間),フッ素−18(〜110分間)、ヨウ素−131(〜8日間)及びヨウ素−124(〜4.2日間)といった短半減期の陽電子放出同位体である。これらの放射性核種は、グルコース(又はグルコース類似体)、水、又はアンモニア等の生体が通常利用する化合物に、或いは受容体やその他の薬物作用部位に結合する分子に取り込まれる。このような標識化合物は放射性トレーサーとして知られる。PETに使用される商業的に利用される好ましい同位体は18Fである。2時間未満という短い半減期ゆえに、好適な放射性トレーサーの製造において、18Fには特定の要請が課される。トレーサーを造影及び/又は診断に使用する前に同位体の放射能の大部分が崩壊しまうため、煩雑且つ長い合成経路及び精製はこの同位体には使用できない。従って、非放射性フッ素化の確立された合成経路は18Fトレーサーの合成に使用できない場合が多い。加えて、18Fは比活性が高い(約80GBq/nmol)ため、トレーサー合成用の[18F]フッ素物質は極めて少量となり、ひいては極度に過剰の前駆体が要求されるため、非放射性フッ素化反応に基づく放射性合成戦略の成功は予測不能となってしまう。
【0004】
FDG([18F]2−フルオロデオキシグルコース)−PETは、腫瘍の診断及び追加的臨床モニタリングにおいて広く受け入れられ、且つ広範囲に普及している手段である。悪性腫瘍は、栄養供給に対するグルコース供給について宿主生物と競合する(Warburg O. Ueber den Stoffwechsel der Carcinomzelle [Concerning the Metabolism of the Carcinoma Cell]. Biochem. Zeitschrift 1924; 152: 309-339; Kellof G. Progress and Promise of FDG-PET Imaging for Cancer Patient Management and Oncologic Drug Development. Clin Cancer Res. 2005; 11(8): 2785-2807)。ここで、腫瘍細胞は通常、周囲の正常組織の細胞と比較してグルコース代謝が増大している。この腫瘍特異的メカニズムが、グルコース誘導体であるフルオロデオキシグルコース(FDG)の使用において利用され、この誘導体は増加量で細胞内に輸送されるが、そこでリン酸化の後にFDG6−ホスファートとして代謝的に捕捉される(「ワールブルグ効果」)。故に18F−標識FDGはPET技術による患者の腫瘍の検出に有用なトレーサーである。新規なPETトレーサーの探索において、近年、アミノ酸もまた18F PET造影に利用されることが多くなっている(例えば(総説):Eur J Nucl Med Mol Imaging. 2002 May; 29(5):681-90)。ここでは、18F−標識アミノ酸の幾つかが蛋白合成速度の測定に好適であるが、他の殆どの誘導体は、腫瘍における直接的細胞取り込みの測定に好適である。既知の18F−標識アミノ酸は、例えばチロシン、フェニルアラニン、プロリン、アスパラギン及び非天然アミノ酸から誘導される(例えば、J. Nucl Med 1991; 32:1338-1346, J Nucl Med 1996; 37:320-325, J Nucl Med 2001; 42:752-754 and J Nucl Med 1999; 40:331-338)。
【0005】
腫瘍診断に利用されている現在のPETトレーサーには、議論の余地のない幾つかの不都合がある。即ち、FDGはグルコース代謝が増大している細胞に集積するのが好ましいのであるが、他の病的及び生理的状態に関連する細胞及び組織、例えば感染巣又は創傷治癒巣でもグルコース代謝の増大がある(J. Nucl. Med. Technol. (2005), 33, 145-155に要約されている)。FDG−PETによって検出された病変が本当に腫瘍起源のものであるのか、それとも別の生理的又は病的な組織の状態に帰するべきものなのか、判断することは今なおしばしば困難である。全体として、腫瘍学におけるFDG−PETによる診断活動は、84%の感度及び88%の特異性を有する(Gambhir et al. “A tabulated summary of the FDG PET literature” J. Nucl. Med. 2001, 42, 1-93S)。脳の腫瘍は、例えば健康な脳組織にFDGが高集積するため、極めて不完全にしか示されない。
【0006】
これまでに知られている18F−標識アミノ酸誘導体は、一部の例では脳内の腫瘍の検出に適している((総説):Eur J Nucl Med Mol Imaging . 2002 May; 29(5):681-90)が、他の腫瘍では、それらは「ゴールドスタンダード」である[18F]2−FDGの造影特性に匹敵し得ない。
【0007】
従って、より有効な疾患標的化能力を示す放射性トレーサーに対する明白な要請が存在する。前記放射性トレーサーには、信頼性が高く明快な患者のPET画像を生成可能であることが求められる。
【0008】
これまでのF−18−標識アミノ酸の、腫瘍性組織における代謝的集積及び滞留は一般的にはFDGよりも低い。さらに、異性体的に純粋なF−18−標識化非芳香族アミノ酸へのアクセス可能性は、化学的に極めて厳しい。オルニチンは尿素サイクルで役割を果たしているアミノ酸である。オルニチンは、尿素を作り出すL−アルギニンに働く酵素アルギナーゼの作用の生成物の1つである。よってオルニチンは、過剰の窒素を処理する尿素サイクルの中心部である。オルニチンはDNAによってコードされているアミノ酸ではなく、その意味では蛋白合成に関与していない。しかしながら哺乳動物の非肝臓組織では、尿素サイクルの主たる用途はアルギニン生合成にあり、従って代謝プロセスの中間体としてオルニチンはかなり重要である。
【0009】
フッ素化オルニチン誘導体はずっと以前から知られており、文献に記載されている。例えば4−フルオロ−オルニチン(Journal of Fluorine Chemistry, volume 7, issue 4, April (1976), p. 397-407)。
【0010】
【化2】

【0011】
Jandre de VilliersはL−3−フルオロ−オルニチン誘導体(2)について述べているが、その合成は失敗している(“Master Thesis“, University of Stellenbosch, 2007, p. 26)。
【0012】
【化3】

【0013】
フッ素化オルニチン誘導体L−5−(フルオロメチル)−オルニチン(3)が文献及び特許に記載されている(例えば、Tetrahedron: Asymmetry (1997), 8(2), 327-335、WO 9524181A1、EP326766)。
【0014】
【化4】

【0015】
酵素オルニチンデカルボキシラーゼ(ODC)のレベルが各々の腫瘍病期と良く相関することが観察されている。酵素ODCはポリアミン生合成経路における第一の且つ律速酵素である。OCDはオルニチンからポリアミン類への細胞内変換を担っている。高い蛋白量及び増大したODCの酵素活性が種々の腫瘍組織で観察された。
【0016】
高いODCレベル及び増大した酵素活性は、腫瘍組織において高いポリアミンレベルを導く。ポリアミンレベル自身がやはり腫瘍病期に相関することが示されている。即ち、非腫瘍組織に対比して腫瘍組織では高いポリアミン含有量が観察されており、高い腫瘍病期はさらに増加したポリアミン含有量を示した。
【0017】
リジンは動物では合成されないアミノ酸であり、哺乳動物において代謝され、α−ケトグルタラートによる初期のアミノ基転移を経てアセチルCoAを生成する。このリジン代謝の初期工程に関与する酵素がリジン−2−オキソグルタラートレダクターゼ及びサッカロピンデヒドロゲナーゼである(Fellows et al. Biochem J. 1973 October; 136(2): 329-334)。
【0018】
アセチル−CoAもまた神経伝達物質アセチルコリンの生合成における重要な構成成分である。アセチル−CoAと合したコリンは酵素コリンアセチルトランスフェラーゼで触媒されてアセチルコリン及び副生成物の補酵素を産生する。
【0019】
フッ素化リジン誘導体もまた知られている。例えば(5S)−5−フルオロ−L−リジン(例えばJournal of Medicinal Chemistry; 47; 4; (2004); 900 - 906)又は例えばα−N−Boc−4R−フルオロ−L−リジン(例えばOrganic and Biomolecular Chemistry; 1; 20; (2003); 3527 - 3534)。
【0020】
ポリアミン類は、細胞の増殖、生存及びアポトーシスを支配する重要な分子である(総説:J. Biochem. 139, 27-33, (2006))。プトリシン(1,4−ジアミノブタン)は、スペルミン及びスペルミジンのような天然ポリアミンの生合成のための前駆体である。腫瘍におけるポリアミン代謝の造影は野心的目標である。Welch et al. (Int. Jour. Radiat. Appl. Instrum. 1986, Vol 37, No. 7, 607-612)は[18F]フルオロ−プトリシンの合成を開発した。あいにく[18F]フルオロ−プトリシンは、遊離の[18F]フッ化物の比較的高いインビボ放出のため、腫瘍の造影又は腫瘍のポリアミン代謝の造影に適していないことが判明した。
【発明の概要】
【発明が解決しようとする課題】
【0021】
本発明の目的は、過剰増殖性疾患のような疾患の造影のため、キレート剤を含まない放射性同位体で放射標識するのに適した新規アミノ酸化合物を発見することである。好ましいアミノ酸はオルニチン及びリジンである。
【0022】
癌と診断された患者は、腫瘍の解剖学的広がりに従って病期診断、又は分類される。病期診断は、治療法を選択し、予後を予測し、そして他の臨床医及び科学者とのコミュニケーションを容易にするために用いられる。固形腫瘍を持つ患者における病期診断は、(1)原発腫瘍の解剖学的広がり(T)、(2)局所リンパ節への転移の存在及び位置(N)、及び(3)遠隔臓器への転移の存在及び位置(M)を決定することから成る(Zuluaga et al., 1998)。癌の病期診断、反応評価、及び放射線治療の計画のため、腫瘍学においてPETがますます使用されつつある。得られたPET画像は放射線治療計画のための必要不可欠な情報を提供する。局所及び遠隔転移を検出及び診断するための現行法は、治療を最適化するに充分な感受性及び特異性を欠いている。検出されない微小転移のある多くの患者が、間違いなく完全な治療を受けておらず、一方で「高リスク」群に分類された別の患者達が、腫瘍が広がっているか否かさえ確認されずに積極的全身治療を受けている。
【0023】
過剰増殖性疾患の検出、病期診断、及び治療監視のための、分子レベルに至るまで正確且つ感度の高い情報を提供する非侵襲的造影モダリティを開発する差し迫った必要性が存在する。
【0024】
全身放射性核種治療は、患者内への放射線源の投与を含む放射線治療の1形態である。全身放射性核種治療を利用すると、疾患の生理がこの治療の最終結果に大きく貢献し、腫瘍への放射性核種のデリバリーをもたらす。患者自身の生理的プロセスによって腫瘍にデリバリーされる放射性材料を使用することにより、最小量の患者の操作で特定の腫瘍に高い線量の放射線をデリバリーすることが可能である。放射性核種及びターゲッティング剤から成る放射性トレーサーは、PET造影中のバックグラウンドシグナルを産む非特異結合を回避しつつ、標的部位に特異的且つ効率的にビークル化(vehiculate)されるであろう。過剰増殖性疾患に関与する標的部位に特異的に結合又は集積する放射性トレーサーを開発する、差し迫った必要性が存在する。
【0025】
驚くべきことに、本発明化合物は造影に好適であることが見出された。好ましくは本発明化合物は、PET、SPECT又はマイクロPET造影のために、又はコンピューター断層撮影(CT)、及び磁気共鳴(MR)分光法のような他の従来の造影法と組み合わせるのが好適である。
【0026】
驚くべきことに、本発明化合物は放射線治療又は競合的治療として知られる過剰増殖性疾患の治療に好適であることが見出された。放射線治療は、本発明の無キレート剤放射標識化合物の放射特性を利用することによって実施される。
【0027】
驚くべきことに、本発明化合物は、過剰増殖性疾患の進行の病期診断、監視、又は過剰増殖性疾患に向けられた治療に対する反応の監視に好適であることが見出された。
【課題を解決するための手段】
【0028】
本発明の規定による、一般式Iに示される無キレート剤放射性核種標識リジン又はオルニチン誘導体(それらのジアステレオマー及びエナンチオマーを包含する)により、目的が達成される:
【0029】
・本発明は、式Iで示される新規化合物を提供する。これら式Iの化合物が、無キレート剤放射性核種、好ましくは18F又は19Fを持たず、代わりに適当な脱離基を含んでいる場合、これらは無キレート剤放射性核種、好ましくは式Iを有する18F−標識又は19F−標識された化合物の合成のための前駆体化合物である。式Iを有する19F−標識化合物は、無キレート剤放射性核種で標識された式Iの化合物への合成の標準参照化合物(同定手段としての、及び品質確認のための)である。以下において、適当な脱離基を含み無キレート剤放射性核種又は19Fを含まない式Iの化合物もまた「式Iを有する前駆体化合物」と称する。さらに、無キレート剤放射性核種を含み、適当な脱離基又は適当な脱離基への変換に適した部分を含まない式Iの化合物もまた、「無キレート剤放射性核種で標識された式Iの化合物」と称する。さらに、式Iの前駆体化合物の一部である適当な脱離基に変換されるのに適した部分を含む式Iの化合物は、「式Iを有する出発材料」とも称される。好ましくは、無キレート剤放射性核種は18Fである。
【0030】
・本発明はさらに、疾患を造影する及び/又は疾患を診断する方法を提供し、この方法は、検出可能量の無キレート剤放射性核種、好ましくは18Fで標識された式Iの化合物を患者内に導入することを含む。
【0031】
・本発明はさらに、医薬として使用するための、無キレート剤放射性核種、好ましくは18Fで標識された、又は19Fで標識された、式Iの化合物をも提供する。
【0032】
・本発明はさらに、化合物、好ましくは式Iを有する無キレート剤放射性核種標識化合物及び医薬的に許容される担体又は希釈剤を含む医薬組成物をも提供する。
【0033】
・本発明のもう一つの局面は、医薬の製造のための式Iの化合物の使用、好ましくは18F−又は19F−標識された式Iの化合物の使用を対象とする。
【0034】
・本発明はさらに、式Iを有する前駆体化合物から無キレート剤放射性核種で標識された式Iの化合物を取得する方法をも提供する。
【0035】
・本発明はさらに、式Iを有する前駆体化合物から19F−標識された式Iの化合物を取得する方法をも提供する。
【0036】
・本発明はさらに、放射性医薬品を製造するためのキットをも提供し、このキットは、
a)式Iの化合物、又は、
b)式Vの化合物及び式VIの化合物又はこれらの混合物、
を含む密封バイアルを含む。
【0037】
・本発明はさらに、式Iを有する出発化合物(ここで、式Iを有する前駆体化合物の脱離基に変換される化学的官能基は、sp2−ハイブリダイズした炭素原子にも結合している)から「式Iを有する前駆体化合物」(ここで、式Iを有する前駆体化合物の脱離基は、sp2−ハイブリダイズした炭素原子に結合している)を得るための方法をも提供する。
【0038】
・本発明はさらに、式Iを有する出発化合物(ここで、式Iを有する前駆体化合物の脱離基に変換される化学的官能基は、sp3−ハイブリダイズした炭素原子にも結合している)から「式Iを有する前駆体化合物」(ここで、式Iを有する前駆体化合物の脱離基は、sp3−ハイブリダイズした炭素原子に結合している)を得るための方法をも提供する。
【0039】
・本発明はさらに、疾患を造影するためのキットをも提供する。より詳細には、本発明化合物は、腫瘍を包含する(但しこれに限定される訳ではない)過剰増殖性疾患の造影に有用である。故に本発明は、これらの疾患を診断するための、そして病期診断及び治療監視するための、造影化合物の使用にも関連する。
【0040】
・本発明はさらに、SPECT造影(I−123;「ヨウ素SPECT化合物」)又はPET造影(I−124;「ヨウ素PET化合物」)又は放射線治療(I−125及びI−131;「ヨウ素治療化合物」)又は標準参照化合物(I−127;「ヨウ素参照標準化合物」)に適した放射性ヨウ素同位体で標識された式Iの化合物をも提供する。
【図面の簡単な説明】
【0041】
【図1】細胞競合実験における(5R)−[18F]−フルオロメチル−L−オルニチン(38)の生物活性の調査(NCI−H460及びA549細胞、PBS−Puffer中0.25MBqの(5R)−[18F]−フルオロメチル−L−オルニチンと共に30分間インキュベート、L−オルニチン濃度1mM)。
【図2】幾つかの腫瘍セルラインへの(5R)−[18F]−フルオロメチル−L−オルニチン(38)の結合。(A549、H460(共にヒトNSCLC)並びにPC3及びDU145(共に前立腺)腫瘍セルラインを使用し、0.25MBqの(5R)−[18F]−フルオロメチル−L−オルニチンと共に最長30分間インキュベートした。10分、20分及び30分後に細胞に結合した活性の割合を決定した。
【図3】14C−オルニチン取り込みについて競合する(3R)−3−フルオロ−L−オルニチンジヒドロクロリド(31)の特異性を、A549細胞における細胞競合実験で決定した(0.1μCiの14C−オルニチンをトレーサーとして使用し、(3R)−3−フルオロ−L−オルニチン−ジヒドロクロリドを1mM濃度で使用した。インキュベーション時間10分間)。
【図4】腫瘍細胞への取り込みについての(4S)−[18F]−フルオロ−L−オルニチン(29)の特異性を、A549及びPC3腫瘍細胞を用いる細胞競合実験で決定した(0.25MBqの(4S)−[18F]−フルオロ−L−オルニチンをトレーサーとして使用し、過剰の1mM L−オルニチンを取り込み系の飽和のために使用した。インキュベーション時間30分間)。
【図5】(4S)−[18F]−フルオロ−L−オルニチン(29)の取り込みの時間依存性を調べた。(A549及びPC3細胞を0.25MBqの(4S)−[18F]−フルオロ−L−オルニチンと共に最長60分間インキュベートし、10、20、30及び60分後に細胞に結合した割合を決定した)。
【図6】A549腫瘍細胞における(4S)−[18F]−フルオロ−L−オルニチン(29)の保持の調査。A549細胞にPBS中の0.25MBq(4S)−[18F]−フルオロ−L−オルニチンを30分間ロードした。洗浄後、この細胞を新たな緩衝液(活性無し)と共にさらに10、20、30分間インキュベートした。上清への放射能の放出及び細胞内部への保持を測定した。
【図7】H460腫瘍を有するラットにおける(4S)−[18F]−フルオロ−L−オルニチン(29)のPET造影。7.16MBqの放射性トレーサーをラットにi.v.注射した。Inveon PET/CTスキャナーを使用し45分のp.i.から30分間PET画像を取得した。
【発明を実施するための形態】
【0042】
第1の局面では、本発明は、式Iの化合物:
【化5】

[式中、
R1、R2及びR3は、
a)水素、
b)R7−C1−C10アルコキシ、
c)R7−C1−C10アルキル、
d)R7−C2−C10アルケニル、
e)R7−C2−C10アルキニル、
f)(R7−アリール)−C0−C10アルキル、
g)(R7−ヘテロアリール)−C0−C10アルキル、
h)((R7−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
i)R7、
j)ヒドロキシ、
k)C6−C10アラルキル、
l)C1−C10アルキル、及び、
m)C1−C10アルコキシ、
を含む群から独立且つ個別に選択され;
R4は、
a)NH2、及び、
b)R14、
を含む群から選択され;
R5は、
a)水素、
b)Z、及び、
c)R13、
を含む群から選択され;
R6は、
a)NH2、及び、
b)R14、
を含む群から選択され;
R7は、
a)[19F]フルオロ、
b)無キレート剤放射性核種、
c)R15、及び、
d)R10、
を含む群から選択され;
R10は、R20及びR30を含む群から選択され;
R15は、脱離基であり;
R14は、
a)N(H)(R9)、
b)N(R9)2、
c)N=C(R11)(R12)、
d)1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル(フタルイミド)、及び、
e)アジド基、
を含む群から選択され;
R13は、カルボン酸保護基であり;
R20は、
a)ヨード、
b)−Sn((C1−C6)アルキル)3、
c)−B(OR60)(OR61)[式中、Bは硼素を意味する]、及び、
d)−NMe2、
を含む群から選択され;
R30は、ヒドロキシであり;
Zは、金属イオン等価物であり;
R9は、アミノ保護基であり;
R11及びR12は、
a)C1−C5アルキル、
b)置換又は非置換アリール、
c)置換又は非置換アラルキル、及び、
d)置換又は非置換ヘテロアリール、
を含む群から独立且つ個別に選択され;
R60及びR61は、水素、(C1−C6)アルキル及びシクロアルキルを含む群から独立且つ個別に選択され;ここで、R60及びR61は、単結合又は「メチレン橋」により相互に連結されていてもよく;
kは、1〜4の整数である]であって、
前記化合物の全異性体型を包含し、前記全異性体型は、限定されるものではないが、エナンチオマー及びジアステレオマー並びにラセミ混合物を包含する、化合物、並びに医薬的に許容されるその塩、エステル、アミド、複合体又はプロドラッグに関する。
【0043】
ある態様では、本発明は、式Iの化合物(但し、式Iの化合物は少なくとも1個のR7を含む)を対象とする。好ましくは、式Iの化合物は2〜3個のR7を含む。より好ましくは、式Iの化合物は、ただ1個のR7を含む。
【0044】
ある態様では、本発明は、式I[式中、R1、R2及びR3は、
a)水素、
b)R7−C1−C6アルコキシ、
c)R7−C1−C6アルキル、
d)R7−C2−C6アルケニル、
e)R7−C2−C6アルキニル、
f)(R7−アリール)−C1−C6アルキル、
g)(R7−ヘテロアリール)−C1−C6アルキル、
h)R7、
i)ヒドロキシ、及び、
j)C1−C5アルキル、
を含む群から個別且つ独立に選択される]
の化合物を対象とする。
【0045】
好ましくは、R1、R2及びR3は、
a)水素、
b)R7−C1−C6アルコキシ、
c)R7−C1−C6アルキル、
d)R7−C2−C6アルケニル、
e)(R7−フェニル)−C1−C4アルキル、
f)(R7−ピリジル)−C1−C4アルキル、
g)R7、及び、
h)C1−C5アルキル、
を含む群から個別且つ独立に選択される。
【0046】
より好ましくは、R1、R2及びR3は、
a)水素、
b)R7−C1−C6アルキル、
c)R7、及び、
d)C1−C5アルキル、
を含む群から個別且つ独立に選択される。
【0047】
さらに好ましくは、R1、R2及びR3は、
a)水素、
b)R7−C1−C5アルキル、
c)R7、及び、
d)C1−C5アルキル、
を含む群から個別且つ独立に選択される。
【0048】
さらに好ましくは、R1、R2及びR3は、
a)水素、
b)R7−C1−C5アルキル、及び、
c)R7、
を含む群から個別且つ独立に選択される。
【0049】
ある態様では、本発明は、式Iにおいて、
R1、R2及びR3が、
a)水素、
b)R7−C1−C10アルキル、
c)C1−C10アルキル、
d)ヒドロキシ、
e)C1−C10アラルキル、及び、
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され;
但し、R7を1個のみ含む、式Iの化合物を対象とする。
【0050】
好ましい態様では、本発明は、式Iにおいて、
R1、R2及びR3は、
a)水素、
b)R7−C2−C10アルキル、
c)C1−C10アルキル、
d)ヒドロキシ、
e)C1−C10アラルキル、及び、
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択される、式Iの化合物を対象とする。
【0051】
より好ましい態様では、本発明は、式Iにおいて、
R1、R2及びR3は、
a)水素、
b)R7−C3−C10アルキル、
c)C1−C10アルキル、
d)ヒドロキシ、
e)C1−C10アラルキル、及び、
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択される、式Iの化合物を対象とする。
【0052】
さらに好ましい態様では、本発明は、式Iにおいて、
R1、R2及びR3は、
a)水素、
b)R7−C4−C10アルキル、
c)C1−C10アルキル、
d)ヒドロキシ、
e)C1−C10アラルキル、及び、
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択される、式Iの化合物を対象とする。
【0053】
ある態様では、本発明は、式Iにおいて、
R7は、
a)無キレート剤放射性核種、
b)R15、及び、
c)R10、
を含む群から選択される、式Iの化合物を対象とする。
【0054】
別の態様では、本発明は、式Iにおいて、
R7は、
a)19F、
b)無キレート剤放射性核種、及び、
c)R15、
を含む群から選択される、式Iの化合物を対象とする。
【0055】
さらに別の態様では、本発明は、式Iにおいて、
R7は、
a)無キレート剤放射性核種、
b)R15、及び、
c)R10、
を含む群から選択される、式Iの化合物を対象とする。
【0056】
さらに別の態様では、本発明は、式Iにおいて、
R7は、
a)無キレート剤放射性核種、及び、
b)R15、
を含む群から選択される、式Iの化合物を対象とする。
【0057】
さらに別の態様では、本発明は、式Iの化合物であって、
R7は、無キレート剤放射性核種である、化合物を対象とする。
【0058】
好ましくは、R7は、R10又はR15である。
【0059】
ある態様では、本発明は、R7が[19F]フルオロである式Iの化合物を対象とする。
【0060】
R7が[19F]フルオロである時、本化合物はインビトロ及びインビボアッセイの参照化合物として、及び医薬(治療薬)として使用できる。
【0061】
ある態様では、本発明は、式Iの化合物であって、
R7は、無キレート剤放射性核種であるか、又は無キレート剤放射性核種を含む、化合物を対象とする。
【0062】
好ましくは、無キレート剤放射性核種は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]又はフッ素−18[18F]である。
【0063】
より好ましくは、無キレート剤放射性核種は、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、又はヨウ素131[131ヨード]である。さらに好ましくは、無キレート剤放射性核種は、治療用途のためのヨウ素−125[125ヨード]又はヨウ素131[131ヨード]である。より好ましくは、無キレート剤放射性核種が炭素−11[11C]である時、R7は、11CH3、−O(11CH3)、−N(11CH3)(C1−C5)アルキルである。
【0064】
本発明は、SPECT造影(I−123;「ヨウ素SPECT化合物」)又はPET造影(I−124;「ヨウ素PET化合物」)又は放射線治療(I−125及びI−131;「ヨウ素治療化合物」)又は標準参照化合物(I−127;「ヨウ素参照標準化合物」)に適した放射性ヨウ素同位体で標識された式Iの化合物を提供する。
【0065】
ある態様では、R7が、基11CH3、−O(11CH3)、−N(11CH3)(C1−C5)アルキルから選択される時、R7は、好ましくは式Iのsp2−ハイブリダイズした炭素原子に結合している。
【0066】
ある態様では、R7が[18F]フルオロである時、R4及びR6はNH2である。
【0067】
より好ましくは、無キレート剤放射性核種は[18F]フルオロである。
【0068】
R7が[18F]フルオロである時、本化合物はPET又はマイクロPET造影に使用できる。
【0069】
ある態様では、本発明は、R7がR10である式Iの化合物を対象とする。
【0070】
ある態様では、本発明は、R7がR15である式Iの化合物を対象とする。
【0071】
ある態様では、本発明は、R7が、
a)[19F]フルオロ、
b)[18F]フルオロ、
c)R15、
d)R10、
e)[123]ヨード、
f)[124]ヨード、
g)[125]ヨード、
h)[127]ヨード、及び、
i)[131]ヨード、
である式Iの化合物を対象とする。
【0072】
好ましくは、R7は、
a)[19F]フルオロ、
b)[18F]フルオロ、
c)R15、及び、
d)R10、
を含む群から選択される。
【0073】
ある態様では、本発明は、式Iにおいて、
R7が無キレート剤ヨウ素である時、R1、R2及びR3は、
a)水素、
b)(R7−アリール)−C0−C10アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び、
f)C1−C10アルコキシ、
を含む群から独立且つ個別に選択される、式Iの化合物を対象とする。
【0074】
好ましくは、R1、R2及びR3は、
a)水素、及び、
b)(R7−フェニル)−C1−C4アルキル、
を含む群から独立且つ個別に選択される。
【0075】
ある態様では、本発明は、R4がNH2である式Iの化合物を対象とする。
【0076】
ある態様では、本発明は、R4がR14である式Iの化合物を対象とする。
【0077】
ある態様では、本発明は、R5が水素である式Iの化合物を対象とする。
【0078】
ある態様では、本発明は、R5がR13である式Iの化合物を対象とする。
【0079】
ある態様では、本発明は、R5がZである式Iの化合物を対象とする。好ましくは、Zは、Na+、K+、Ca2+及びMg2+を含む群から選択される。より好ましくは、ZはNa+である。
【0080】
ある態様では、本発明は、R6がNH2である式Iの化合物を対象とする。
【0081】
ある態様では、本発明は、R6がR14である式Iの化合物を対象とする。
【0082】
ある態様では、本発明は、式Iにおいて、
R9(アミノ保護基)は、
a)tert−ブトキシカルボニル、
b)アリルオキシカルボニル、
c)ベンジルオキシカルボニル、
d)エトキシカルボニル、
e)メトキシカルボニル、
f)プロポキシカルボニル、
g)2,2,2−トリ塩素エトキシカルボニル、
h)1,1−ジメチルプロピニル、
i)1−メチル−1−フェニル−エトキシカルボニル、
j)1−メチル−1−(4−ビフェニリル)−エトキシカルボニル、
k)シクロブチルカルボニル、
l)1−メチルシクロブチルカルボニル、
m)ビニルカルボニル、
n)アリルカルボニル、
o)アダマンチルカルボニル、
p)ジフェニルメチルカルボニル、
q)シンナミルカルボニル、
r)ホルミル、
s)ベンゾイル、
t)トリチル、
u)−C(H)(CH3)C(H)=C(H)−C(O)OR5、
v)p−メトキシフェニル−ジフェニルメチル、及び、
w)[ジ−(p−メトキシフェニル)]−フェニルメチル、
を含む群から選択される、式Iの化合物を対象とする。
【0083】
好ましくは、R9は、
a)tert−ブトキシカルボニル、
b)ホルミル、
c)トリチル、
d)p−メトキシフェニル−ジフェニルメチル、及び、
e)[ジ−(p−メトキシフェニル)]−フェニルメチル、
を含む群から選択される。
【0084】
より好ましくは、R9は、
a)tert−ブトキシカルボニル、
b)ホルミル、及び、
c)トリチル、
を含む群から選択される。
【0085】
ある態様では、R9はtert−ブトキシカルボニルであり;
別の態様では、R9はホルミルであり;
さらに別の態様では、R9はトリチルである。
【0086】
ある態様では、本発明は、式Iにおいて、
R13(カルボン酸保護基)は、
a)C1−C5アルキル、
b)C2−C5アルケニル、
c)(C1−C5アルキル−(O−C1−C4アルキル))n−O−)C1−C4アルキル、
d)C2−C5アルキニル、
e)p−メトキシベンジル、及び、
f)トリフェニルメチル、
を含む群から選択され、
式中、nは、0、1、2又は3の整数である式Iの化合物を対象とする。
【0087】
好ましくは、R13は、
a)メチル、
b)エチル、
c)tert−ブチル、
d)p−メトキシベンジル、及び、
e)トリフェニルメチル、
を含む群から選択される。
【0088】
ある態様では、本発明は、R15(脱離基)がR33又はR34である式Iの化合物を対象とする。
【0089】
好ましくは、R15はR33であり、この態様は、R15がsp2−ハイブリダイズしたC原子に結合している場合に好ましい。
【0090】
好ましくは、R15はR34であり、この態様は、R15がsp3−ハイブリダイズしたC原子に結合している場合に好ましい。
【0091】
R33は、−I+(R25)(X-)、−I+(R26)(X-)、ニトロ、−N+(Me)3(X-)、塩素及び臭素を含む群から選択される。
【0092】
好ましくは、R33は、−I+(R25)(X-)、−I+(R26)(X-)、ニトロ、−N+(Me)3(X-)、及び臭素を含む群から選択される。
【0093】
より好ましくは、R33は、−I+(R25)(X-)、−I+(R26)(X-)、ニトロ及び−N+(Me)3(X-)を含む群から選択される。
【0094】
さらに好ましくは、R33は、−I+(R25)(X-)及び−I+(R26)(X-)を含む群から選択される。
【0095】
さらに好ましくは、R33はニトロである。
【0096】
さらに好ましくは、R33は、N+(Me)3(X-)である。
【0097】
R34は、当業者にとって既知又は明白な脱離基であり、Synthesis (1982), p. 85-125, table 2 (p. 86;(この表2の最後の項目は訂正の必要があり、“n-C4H9S(O)2-O-nonaflat”ではなく“n-C4F9S(O)2-O-nonaflat ”である)、Carey and Sundberg, Organische Synthese, (1995), page 279-281, table 5.8;又はNetscher, Recent Res. Dev. Org. Chem., 2003, 7, 71-83, scheme 1, 2, 10 and 15に記載又は指定されているものから選択されるが、それらに限定される訳ではない。
【0098】
R34は、塩素、臭素及びヨード、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ、ノナ−フルオロブチルスルホニルオキシ、(4−臭素−フェニル)スルホニルオキシ、(4−ニトロ−フェニル)スルホニルオキシ、(2−ニトロ−フェニル)スルホニルオキシ、(4−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリ−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリメチル−フェニル)スルホニルオキシ、(4−tertブチル−フェニル)スルホニルオキシ及び(4−メトキシ−フェニル)スルホニルオキシを含む群から選択される。
【0099】
好ましくは、R34は、ヨード、臭素、塩素、メシルオキシ、トシルオキシ、(4−ニトロ−フェニル)スルホニルオキシ及び(2−ニトロ−フェニル)スルホニルオキシを含む群から選択される。
【0100】
より好ましくは、R34は、メシルオキシ、トシルオキシ及び(4−ニトロ−フェニル)スルホニルオキシを含む群から選択される。
【0101】
R25は、置換又は非置換アリールである。
【0102】
好ましくは、R25は、フェニル、(4−メチル)−フェニル、(4−メトキシ)−フェニル、(3−メチル)−フェニル、(3−メトキシ)−フェニル、(4−(ジメチルカルバモイル)(メチル)アミノ)フェニル及びナフチルを含む群から選択される。
より好ましくは、R25は、フェニル、(4−メチル)−フェニル及び(4−メトキシ)−フェニルを含む群から選択される。
【0103】
さらに好ましくは、R25は、フェニル及び(4−メトキシ)−フェニルを含む群から選択される。
【0104】
より好ましくは、R25は(4−(ジメチルカルバモイル)(メチル)アミノ)フェニルである。
【0105】
R26は、置換又は非置換へテロアリールである。
【0106】
好ましくは、R26は、2−フラニル及び2−チエニルを含む群から選択される。
【0107】
より好ましくは、R26は2−チエニルである。
【0108】
X-は、
a)無機酸のアニオン、及び、
b)有機酸のアニオン、
を含む群から選択される。
【0109】
好ましくは、X-は、
a)CH3S(O)2O-、
b)((4−メチル)フェニル)S(O)2O-、
c)CF3S(O)2O-、
d)C4F9S(O)2O-、
e)CF3C(O)O-、
f)H3CC(O)O-、
g)ヨウ化物アニオン、
h)臭化物アニオン、
i)塩化物アニオン、
j)過塩素酸アニオン(ClO4-)、及び、
k)リン酸アニオン、
を含む群から選択される。
【0110】
より好ましくは、X-は、
a)CF3S(O)2O-、
b)C4F9S(O)2O-、
c)ヨウ化物アニオン、
d)臭化物アニオン、及び、
e)CF3C(O)O-、
を含む群から選択される。
【0111】
さらに好ましくは、X-は、
a)CF3S(O)2O-、
b)臭化物アニオン、及び、
c)CF3C(O)O-、
を含む群から選択される。
【0112】
ある態様では、R15がsp2−ハイブリダイズしたC原子に結合している場合、R10は好ましくはR20である。
【0113】
別の態様では、R15がsp3−ハイブリダイズしたC原子に結合している場合、R10は好ましくはR30である。
【0114】
ある態様では、R20は、−Sn((C1−C6)アルキル)3及び−B(OR60)(OR61)を含む群から選択される。
【0115】
別の態様では、R20は−NMe2である。
【0116】
さらに別の態様では、R20はヨードである。
【0117】
ある態様では、本発明は、kが1〜3の整数である式Iの化合物を対象とする。
好ましくは、kは1又は2の整数である。
より好ましくは、kは整数1である。
より好ましくは、kは整数2である。
【0118】
ある態様では、本発明は、nが0〜3の整数である式Iの化合物を対象とする。
好ましくは、nは1又は2の整数である。
より好ましくは、nは整数1である。
より好ましくは、nは整数2である。
【0119】
R60及びR61は、水素、(C1−C6)アルキル及びシクロアルキルを含む群から独立且つ個別に選択され、一方、R60及びR61は、結合又はメチレン「ブリッジ」により相互に連結していてもよい。
【0120】
但し、WO2009/027727A2に開示され、下に記載する化合物を特許請求する意図はない。
【0121】
【化6】

メチル N2,N5−ビス(tert−ブトキシカルボニル)−4−{3−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]プロピル}−L−オルニチナート
【0122】
本発明化合物は、以下の化合物から選択されるが、これらに限定される訳ではない。
(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−ヒドロキシ−L−オルニチナート(26)
【化7】

(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−[(メチルスルホニル)オキシ]−L−オルニチナート(27)
【化8】

(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−{[(4−メチルフェニル)スルホニル]オキシ}−L−オルニチナート(28)
【化9】

(4S)−[18F]−フルオロ−L−オルニチン(29)
【化10】

(3R)−N2,N5−ビス(tert−ブトキシカルボニル)−3−フルオロ−L−オルニチナート(30)
【化11】

(3R)−3−フルオロ−L−オルニチン(31)
【化12】

メチル−(5S)−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−5−ヒドロキシ−L−ノルロイシナート(34)
【化13】

メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−L−ノルロイシナート(35)
【化14】

メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−ヒドロキシ−L−ノルロイシナート(36)
【化15】

(5R)−[18F]−フルオロメチル−L−オルニチン(38)
【化16】

(2S)−5−アミノ−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロペンタン酸(43)
【化17】

ベンジル(2S)−5−アジド−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロペンタノアート(42)
【化18】

【化19】

4−(18F)フルオロ−L−オルニチン
【化20】

3−(18F)フルオロ−L−オルニチン
【化21】

5−アミノ−6−(18F)フルオロ−L−ノルロイシン
【0123】
R7が[19F]フルオロである式Iの化合物は、標準参照化合物に対応する。前記化合物は、好ましくは、同定手段としての市販キットにおける標準参照としてインビトロアッセイに、そして品質確認に好適である。
【0124】
R7が[18F]フルオロ、[123I]ヨード、[124I]ヨード又は[131I]ヨードである、好ましくはR7が[18F]フルオロである式Iの化合物は、インビボでそれらの放射性同位体を比較的わずかに(例えば[18F]フルオロ−プトリシンと比較して)放出し、その結果、腫瘍の造影又は腫瘍におけるポリアミン代謝の造影が可能となる。
【0125】
第2の局面では、本発明は、式Iの化合物又は医薬的に許容されるその無機又は有機酸の塩、その水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグ、及び医薬的に許容される担体、希釈剤、賦形剤又はアジュバントを含む医薬組成物に関する。
【0126】
ある態様では、この医薬組成物は、医薬的に許容されるその塩、水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグである式Iの化合物を含む。
【0127】
ある態様では、この医薬組成物は、R7が19F又は[18F]である式Iの化合物又はそれらの混合物を含む医薬組成物である。
【0128】
ある態様では、この医薬組成物は、R7が19Fである式Iを有する標準参照化合物を含む医薬組成物である。
【0129】
ある態様では、この医薬組成物は、R7が前記定義による無キレート剤放射性核種である放射性医薬組成物である。好ましくはこの無キレート剤放射性核種は、[18F]、[125I]、[131I]、[123I]、又は[124I]である。より好ましくは、R7は[18F]である。
【0130】
本発明に係る式I、Ib又はIcを有する化合物、好ましくは本発明により提供される式I、Ib又はIcによる無キレート剤放射性核種標識化合物は、任意の適当な医薬的に許容される担体、例えば生理食塩水媒体のような従来の媒体中で、又は血漿媒体中で静脈内投与され得る。このような媒体は、例えば浸透圧を調節するための医薬的に許容される塩類、緩衝剤、保存剤などのような従来の医薬材料をも含有できる。好ましい媒体には生理食塩水及び血漿がある。
【0131】
適当な医薬的に許容される担体は当業者に知られている。この点において、例えばRemington's Practice of Pharmacy, 13th ed.及びJ. of. Pharmaceutical Science & Technology, Vol. 52, No. 5, Sept-Oct., p. 238-311を参考にでき、これらを引用により本明細書の一部とする。
【0132】
式I、Ib又はIcの化合物、好ましくは本発明に係る18F−標識化合物及び医薬的に許容される担体の、例えば水性媒体中の濃度は、個々の使用分野と共に変化する。生物学的標的(例えば腫瘍)の満足できる視覚化が達成できる場合には、医薬的に許容される担体中に充分量が存在する。
【0133】
本発明によれば、中性組成物としての、又は医薬的に許容される対イオンとの塩としての、式I、Ib又はIcを有する放射標識化合物は、単一ユニット注射用量で投与される。当業者に知られる任意の一般的担体、例えば滅菌生理食塩水又は血漿を、本発明に従って種々の臓器、腫瘍などを造影するための注射溶液を作製するために、放射標識後に利用できる。一般に、診断薬のために投与される単位用量は、約0.1mCi〜約100mCi、好ましくは1mCi〜20mCiの放射能を有する。放射線治療薬のためには、治療用単位用量の放射能は、約10mCi〜約700mCi、好ましくは50mCi〜400mCiである。単位用量で注射される溶液は、約0.01ml〜約30mlである。造影目的のためには、静脈内投与の後、臓器又は疾患位置のインビボ造影が、およそ数分以内に起こり得る。しかしながら、所望により、患者への注射後数時間又はより遅くに造影を生起させることもできる。大抵の例では、充分量の投与用量が造影されるべき領域に約0.1時間以内に集積し、PET又は単一光子放射型コンピューター断層撮影(SPECT)画像の取得が可能となる。造影目的の、又はコンピューター断層撮影(CT)及び磁気共鳴(MR)分光法のような他の従来の造影法と組み合わせた、任意の従来のPET又はSPECT造影を、本発明に従って利用することができる。
【0134】
第3の局面では、本発明は、参照化合物、医薬(治療薬)又は放射性医薬品として使用するための、式Iの化合物に関する。
【0135】
換言すると、本発明は、参照化合物、医薬又は放射性医薬品としての、式Iの化合物の使用に関する。
【0136】
好ましくは、本発明は、式Iにおいて、R7が前記定義による[19F]である、[19F]化合物であって、参照化合物、医薬又は放射性医薬品として使用するための化合物に関する。
【0137】
より好ましくは、本発明は、式Iにおいて、R7が前記定義による[19F]である、[19F]化合物であって、参照化合物として使用するための化合物に関する。
【0138】
好ましくは、本発明は、式Iにおいて、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物であって、医薬又は放射性医薬品として使用するための化合物に関する。より好ましくは、R7は前記と同義であり、全ての好ましい態様が本明細書に包含される。
【0139】
より好ましくは、R7は[18F]である。
【0140】
本発明はさらに、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物、又は、式Iにおいて、R7が前記定義による[19F]である、[19F]化合物の使用であって、過剰増殖性疾患の処置のための医薬又は放射性医薬品を製造するための使用に関する。
【0141】
過剰増殖性疾患は、任意の種類の異常な細胞増殖又は異常な増殖調節に関連する全ての疾患及び状態、特に腫瘍におけるものを包含する。
【0142】
好ましくは、過剰増殖性疾患は、腫瘍又は転移を発現する癌を意味する。より好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、腎臓、膀胱、甲状腺、前立腺、子宮内膜、卵巣、精巣の癌腫、悪性黒色腫、小細胞及び非小細胞気管支癌腫、口腔粘膜の異形成癌腫、浸潤性口腔癌;乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫、星状細胞腫、骨肉腫、髄膜腫を包含する);柔組織肉腫;血管腫及び内分泌腫瘍(下垂体腺腫、有色細胞腫、傍神経節腫を包含する)、血液学的腫瘍(リンパ腫及び白血病を包含する);又は上記腫瘍のうち1つの転移である。
【0143】
より好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、腎臓、膀胱、前立腺、卵巣の癌腫、小細胞及び非小細胞気管支癌腫、乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫、星状細胞腫、骨肉腫、髄膜腫を包含する);柔組織肉腫;血管腫及び内分泌腫瘍(下垂体腺腫、有色細胞腫、傍神経節腫を包含する)、血液学的腫瘍(リンパ腫を包含する);又は上記腫瘍のうち1つの転移である。
【0144】
さらに好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、前立腺の癌腫、小細胞及び非小細胞気管支癌腫、乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫を包含する)、血液学的腫瘍(リンパ腫を包含する)、又は上記腫瘍のうち1つの転移である。
【0145】
驚くべきことに、本発明化合物は放射線治療又は競合的治療に好適であることが判明した。放射線治療は本発明の無キレート剤放射標識化合物の放射特性を利用することによって実施される。
【0146】
本発明はさらに、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物、又は、R7が前記定義による[19F]である、式Iの[19F]化合物の治療有効量を患者内に投与し、シグナルを検出する工程を含む、前記定義による過剰増殖性疾患の処置方法を対象とする。
【0147】
上に開示した好ましい態様を本明細書に含める。
【0148】
第4の局面では、本発明は、造影剤として使用するための式Iの化合物に関する。
【0149】
好ましくは、本発明は、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物であって、造影剤として使用するための化合物に関する。より好ましくは、R7は前記と同義であり、全ての好ましい態様が本明細書に包含される。
【0150】
より好ましくは、R7は[18F]である。
【0151】
換言すると、本発明は、造影剤としての式Iの化合物の使用に関する。
【0152】
好ましくは、本発明は、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物の使用であって、造影剤としての使用に関する。
【0153】
より好ましくは、R7は前記と同義であり、全ての好ましい態様が本明細書に包含される。
【0154】
より好ましくは、R7は[18F]である。
【0155】
好ましくは、この造影剤は、PET、SPECT又はマイクロPET造影のために、又はコンピューター断層撮影(CT)、及び磁気共鳴(MR)分光法のような他の従来の造影法と組み合わせる際に有用である。より好ましくは、この造影剤はPET造影に有用である。
【0156】
好ましくは、この造影剤は過剰増殖性疾患の造影に好適である。
【0157】
過剰増殖性疾患は、任意の種類の異常な細胞増殖又は異常な増殖調節に関連する全ての疾患及び状態、特に腫瘍におけるものを包含する。
【0158】
好ましくは、過剰増殖性疾患は、腫瘍又は転移を発現する癌を意味する。より好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、腎臓、膀胱、甲状腺、前立腺、子宮内膜、卵巣、精巣の癌腫、悪性黒色腫、小細胞及び非小細胞気管支癌腫、口腔粘膜の異形成癌腫、浸潤性口腔癌;乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫、星状細胞腫、骨肉腫、髄膜腫を包含する);柔組織肉腫;血管腫及び内分泌腫瘍(下垂体腺腫、有色細胞腫、傍神経節腫を包含する)、血液学的腫瘍(リンパ腫及び白血病を包含する);又は上記腫瘍のうち1つの転移である。
【0159】
より好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、腎臓、膀胱、前立腺、卵巣の癌腫、小細胞及び非小細胞気管支癌腫、乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫、星状細胞腫、骨肉腫、髄膜腫を包含する);柔組織肉腫;血管腫及び内分泌腫瘍(下垂体腺腫、有色細胞腫、傍神経節腫を包含する)、血液学的腫瘍(リンパ腫を包含する);又は上記腫瘍のうち1つの転移である。
【0160】
さらに好ましくは、腫瘍は、胃腸又は結腸直腸の悪性腫瘍、肝臓、膵臓、前立腺の癌腫、小細胞及び非小細胞気管支癌腫、乳癌(ホルモン依存性及びホルモン非依存性乳癌を包含する)、扁平上皮癌腫、神経学的癌(神経芽腫、神経膠腫を包含する)、血液学的腫瘍(リンパ腫を包含する)、又は上記腫瘍のうち1つの転移である。
【0161】
本発明はさらに、R7が前記定義による無キレート剤放射性核種である、式Iの無キレート剤放射標識化合物の検出可能量を患者内に導入する工程を含む、上記定義による過剰増殖性疾患の造影方法を対象とする。さらに、放射線を測定し、又はシグナルを検出し、診断を確立してもよい。
【0162】
上に開示した好ましい態様が本明細書に包含される。
【0163】
第5の局面では、本発明は、式Iの化合物、或いは一般式Iに含まれる式、即ち式Ib及び式Icの化合物であって、R7が無キレート剤放射性核種又は[19F]である化合物を取得するための方法に関する。
【0164】
驚くべきことに、式Iの化合物を取得するための方法が4つ確定された。
【0165】
第1の方法では、本発明は、R7が脱離基である式Iの化合物を適当な標識剤と反応させることにより、R7が無キレート剤放射性核種又は[19F]である式Iの化合物を取得する方法を対象とする。
【0166】
上記で得られた、R7が無キレート剤放射性核種又は[19F]である式Iの化合物を、任意により、アミン−及び/又はカルボキシ−保護基の位置で脱保護してもよい。脱保護は、保護基R5及びR9を除去することにより実施される。
【0167】
換言すると、R7が無キレート剤放射性核種又は[19F]である式Iの化合物を取得する方法は、
− R7が脱離基である式Iの化合物を、適当な標識剤と反応させ、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0168】
好適な標識剤は、無キレート剤放射性核種又は[19F]誘導体を含む化学物質として定義され、ここで前記化学物質は標識化反応を実現できる。
【0169】
好ましくは、式Iの化合物を、前記定義によるR4、R5及びR6に定義される官能性OH及びNH2部分において保護する。
【0170】
好ましくは、脱離基は、R7[前記定義によるR15である]として定義される。
【0171】
好ましくは、R7が前記定義によるR15である時、R4及びR6は前記定義によるR14であり、R5は前記定義によるR13である。
【0172】
ある態様では、本発明は、R7が脱離基である式Iの化合物を適当な放射標識剤と反応させることにより、R7が無キレート剤放射性核種である式Iの化合物を取得する方法を対象とする。
【0173】
上記で得られた、R7が無キレート剤放射性核種である式Iの化合物を、任意により、アミン−及び/又はカルボキシ−保護基の位置で脱保護してもよい。脱保護は、保護基R5及びR9を除去することにより実施される。
【0174】
換言すると、R7が無キレート剤放射性核種である式Iの化合物を取得する方法は、
− R7が脱離基である式Iの化合物を、適当な放射標識剤と反応させ、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0175】
好ましくは、脱離基は、R7[前記定義によるR15である]として定義される。
【0176】
好ましくは、R7が前記定義によるR15である時、R4及びR6は前記定義によるR14であり、R5は前記定義によるR13である。
【0177】
本明細書で使用される「好適な放射標識剤」という語は、当業者にとって既知又は明白な反応条件を惹起する試薬を指し、酸性、塩基性、水素化分解的、酸化的、光分解的、好ましくは酸性開裂条件から選ばれ(但しこれらに限定されない)、Greene and Wuts, Protecting groups in Organic Synthesis, third edition, page 494-653 and 249-290にそれぞれ記載のものから選択されるがそれらに限定される訳ではない。
【0178】
無キレート剤放射性核種であるR7は、既に開示された全態様と共に上記のように定義されている。好ましくは、R7は[18F]である。
【0179】
R15(脱離基)は、既に開示された全態様と共に上記のように定義されている。
【0180】
ある態様では、本発明は、R7が脱離基である式Iの化合物を、適当なフルオロ放射標識剤と反応させることにより、R7は[18F]である式Iの化合物を取得する方法を対象とする。
【0181】
任意により、R7が[18F]である式Iの化合物をアミン−及び/又はカルボキシ−保護基の位置で脱保護してもよい。脱保護は、保護基R5及びR9を除去することにより実施される。
【0182】
換言すると、R7が[18F]である式Iの化合物を取得する方法は、
− R7が脱離基である式Iの化合物を適当なフルオロ放射標識剤と反応させ、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0183】
好ましくは、フルオロ放射標識剤はF−アニオン(Fは18Fを意味する)を含む化合物である。より好ましくは、F−フルオロ放射標識剤は、4,7,13,16,21,24−ヘキサオキサ−1,10−ジアザビシクロ[8.8.8]−ヘキサコサンKF、即ち、クラウンエーテル塩Kryptofix KF、KF、HF、KHF2、CsF、NaF、及びFのテトラアルキルアンモニウム塩、例えばテトラブチルアンモニウムフルオリドを含む群から選択され、ここで、F=18Fである。
【0184】
好ましくは、脱離基は、R7[前記定義によるR15である]として定義される。
【0185】
R15(脱離基)は既に開示された全態様と共に上記のように定義されている。
【0186】
脱離基を含む式Iの化合物が、R7がR15であるとさらに定義されている場合、R4及びR6はR14(好ましくは前記と同義)であり、そしてR5はR13である。
【0187】
脱離基を含む式Iの化合物が、さらに以下:
R7がR15であり、
R4がR14であり、
R6がR14であり、
R5がR13である、
のように定義されている場合、得られる式Iのフルオロ放射標識化合物は、好ましくは、R4及びR6及びR5が水素である化合物である。
【0188】
本明細書で使用される、分子を「放射標識」するという語は、通常、分子内に18F原子のような放射性核種を導入することを指す。
【0189】
ある態様では、本発明は、R7が[19F]である式Iの化合物を取得する方法であって、R7が脱離基である式Iの化合物を適当なフルオロ標識剤と反応させることによる方法を対象とする。
【0190】
R7が[18F]である式Iの化合物を、任意により、アミン−及び/又はカルボキシ−保護基の位置で脱保護してもよい。脱保護は、保護基R5及びR9を除去することにより実施される。
【0191】
換言すると、R7が[19F]である式Iの化合物を取得する方法は、
− R7が脱離基である式Iの化合物を適当なフルオロ標識剤と反応させ、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0192】
好ましくは、フルオロ標識剤はF−アニオン(Fは[19F]を意味する)を含む化合物である。より好ましくは、F−フルオロ放射標識剤は、4,7,13,16,21,24−ヘキサオキサ−1,10−ジアザビシクロ[8.8.8]−ヘキサコサンKF、即ち、クラウンエーテル塩Kryptofix KF、KF、HF、KHF2、CsF、NaF、及びFのテトラアルキルアンモニウム塩、例えばテトラブチルアンモニウムフルオリドを含む群から選択され、ここで、F=[19F]である。
【0193】
好ましくは、脱離基は、R7[前記定義によるR15である]として定義される。
R15(脱離基)は、既に開示された全態様と共に、上記のように定義される。
【0194】
脱離基を含む式Iの化合物において、更にR7がR15である定義されている場合、R4及びR6はR14(好ましくは前記と同義)であり、R5はR13である。
【0195】
脱離基を含む式Iの化合物が、さらに
R7がR15であり、
R4がR14であり、
R6がR14であり、
R5がR13である、
と定義されている場合、得られる式Iのフルオロ標識化合物は、好ましくは、R4及びR6及びR5が水素である化合物である。
【0196】
上に開示された好ましい態様が本明細書に包含される。
【0197】
第2の方法では、本発明は、式Ibの化合物:
【化22】

を取得する方法であって、
式V:
【化23】

の化合物を、R86を含む標識剤と反応させて、式IVの化合物:
【化24】

を生成し、この式IVの化合物を、式VIの化合物:
【化25】

で置換し、
任意により、アミン−及び/又はカルボキシ−保護基を脱保護することによる、方法
[但し、式中、
式Ibは以下のように定義され:
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種又は[19F]であり、
R4、R5、R6、及びkは前記と同義であり;
式Vは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり;
式IVは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり、
R86は無キレート剤放射性核種又は[19F]であり;
式VIは以下のように定義され:
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]を対象とする。
【0198】
換言すると、式Ibの化合物を取得する方法は、
− 式Vの化合物を、R86を含む標識剤と反応させて、式IVの化合物を生成し、
− 式IVの化合物を、式VIの化合物で置換し、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0199】
式Ibの好ましい態様:
好ましくは、R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含む。
より好ましくは、R101、R102及びR103のうち1個は((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
【0200】
好ましくは、R86は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]及びフッ素−18[18F]の群から選択される無キレート剤放射性核種である。
【0201】
より好ましくは、無キレート剤放射性核種は、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、又はヨウ素131[131ヨード]である。
【0202】
より好ましくは、無キレート剤放射性核種は[18F]フルオロである。
【0203】
好ましくは、R86は[19F]である。
【0204】
好ましくは、式Ibの化合物は、1又は2個のR86を含む。より好ましくは、式Ibの化合物は、ただ1個のR86を含む。
【0205】
上に開示された好ましい態様は、R4、R5、R6、k及び無キレート剤放射性核種について本明細書に包含される。
【0206】
式Vの好ましい態様:
好ましくは、aは、0〜2の整数である。より好ましくは、aは0〜1の整数である。
【0207】
好ましくは、Bは、ハロ、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ、ノナ−フルオロブチルスルホニルオキシ、(4−臭素−フェニル)スルホニルオキシ、(4−ニトロ−フェニル)スルホニルオキシ、(2−ニトロ−フェニル)スルホニルオキシ、(4−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリ−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリメチル−フェニル)スルホニルオキシ、(4−tertブチル−フェニル)スルホニルオキシ及び(4−メトキシ−フェニル)スルホニルオキシを含む群から個別且つ独立に選択される脱離基である。
【0208】
より好ましくは、Bは、ヨード、臭素、塩素、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ及びノナ−フルオロブチルスルホニルオキシを含む群から選択される。
【0209】
好ましくは、ハロは、塩素、臭素又はヨードである。
【0210】
式IVの好ましい態様:
a及びBは、式Vの場合と同義である。
【0211】
R86は、式Ibの場合と同義である。
【0212】
式VIの好ましい態様:
好ましくは、R201、R202及びR203は、
a)水素、
b)((R8−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR8を含む。
【0213】
より好ましくは、R201、R202及びR203のうち1個は((R8−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
R8はヒドロキシである。
【0214】
好ましくは、式Ibの化合物は1又は2個のR8を含む。より好ましくは、式Ibの化合物は、ただ1個のR8を含む。
【0215】
R4、R5、R6及びkについて上述した好ましい態様は、本明細書に包含される。
【0216】
好適な標識剤は、無キレート剤放射性核種又は[19F]誘導体を含む化学物質として定義され、ここで前記化学物質は標識化反応を実現できる。
【0217】
さらなる態様では、本発明は、式Ibの化合物:
【化26】

[式中、R86は無キレート剤放射性核種である]
を取得する方法であって、
式V:
【化27】

の化合物を、R86を含む適当な放射標識剤と反応させて、式IV:
【化28】

の化合物を生成し、この式IVの化合物を、式VI:
【化29】

の化合物で置換し、
任意により、アミン−及び/又はカルボキシ−保護基を脱保護することによる、方法
[式中、
式Ibは以下のように定義され:
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種であり、
R4、R5、R6、及びkは前記と同義であり、
式Vは以下のように定義され:
aは、0〜5の整数であり、
Bが脱離基であり、
式IVは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり、
R86は無キレート剤放射性核種であり、
式VIは以下のように定義され:
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]を対象とする。
【0218】
換言すると、R86が無キレート剤放射性核種である式Ibの化合物を取得する方法は、
− 式Vの化合物を、R86[ここでR86は無キレート剤放射性核種である]を含む適当な放射標識剤と反応させて、式IVの化合物を生成し、
− 式IVの化合物を、式VIの化合物で置換し、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む。
【0219】
式Ibの好ましい態様:
好ましくは、R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含む。
【0220】
より好ましくは、R101、R102及びR103のうち1個は((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
【0221】
好ましくは、R86は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]及びフッ素−18[18F]の群から選択される無キレート剤放射性核種である。
【0222】
より好ましくは、無キレート剤放射性核種は、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、又はヨウ素131[131ヨード]である。
【0223】
より好ましくは、無キレート剤放射性核種は[18F]フルオロである。
【0224】
好ましくは、式Ibの化合物は、1又は2個のR86を含む。より好ましくは、式Ibの化合物は、ただ1個のR86を含む。
【0225】
上に開示された好ましい態様は、R4、R5、R6、k及び無キレート剤放射性核種について本明細書に包含される。
【0226】
式Vの好ましい態様:
好ましくは、aは、0〜2の整数である。より好ましくは、aは0〜1の整数である。
【0227】
好ましくは、脱離基Bは、当業者にとって既知又は明白であり、Synthesis (1982), p. 85-125, table 2 (p. 86;(この表2の最後の項目は訂正の必要があり、“n-C4H9S(O)2-O-nonaflat”ではなく“n-C4F9S(O)2-O-nonaflat ”である)、Carey and Sundberg, Organische Synthese, (1995), page 279-281, table 5.8;又はNetscher, Recent Res. Dev. Org. Chem., 2003, 7, 71-83, scheme 1, 2, 10 and 15に記載又は指定されているものから選択されるが、それらに限定される訳ではない。
【0228】
より好ましくは、Bは、ハロ、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ、ノナ−フルオロブチルスルホニルオキシ、(4−臭素−フェニル)スルホニルオキシ、(4−ニトロ−フェニル)スルホニルオキシ、(2−ニトロ−フェニル)スルホニルオキシ、(4−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリ−イソプロピル−フェニル)スルホニルオキシ、(2,4,6−トリメチル−フェニル)スルホニルオキシ、(4−tert−ブチル−フェニル)スルホニルオキシ、及び(4−メトキシ−フェニル)スルホニルオキシを含む群から個別且つ独立に選択される脱離基である。
【0229】
さらに好ましくは、Bは、ヨード、臭素、塩素、メシルオキシ、トシルオキシ、トリフルオロメチルスルホニルオキシ及びノナ−フルオロブチルスルホニルオキシを含む群から選択される。
【0230】
好ましくは、ハロは、塩素、臭素又はヨードである。
【0231】
式IVの好ましい態様:
a及びBは、式Vの場合と同義である。
【0232】
R86は、式Ibの場合と同義である。
【0233】
式VIの好ましい態様:
好ましくは、R201、R202及びR203は、
a)水素、
b)((R8−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR8を含む。
【0234】
より好ましくは、R201、R202及びR203のうち1個は((R8−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
R8はヒドロキシである。
好ましくは、式Ibの化合物は1又は2個のR8を含む。より好ましくは、式Ibの化合物は、ただ1個のR8を含む。
【0235】
R4、R5、R6及びkについて上述した好ましい態様は、本明細書に包含される。
【0236】
好適な放射標識剤は、無キレート剤放射性核種誘導体を含む化学物質として定義され、ここで前記化学物質は放射標識化反応を実現できる。
【0237】
さらなる態様では、本発明は、
− 式Vの化合物を、R86[ここでR86は[19F]である]を含む適当な標識剤と反応させて、式IVの化合物を生成し、
− 式IVの化合物を、式VIの化合物で置換し、
− 任意により、アミン−及び/又はカルボキシ−保護基を脱保護する、
工程を含む、R86は[19F]である式Ibの化合物を得る方法を対象とする。
【0238】
好適なフルオロ標識剤は、F−アニオン(Fは[19F]を意味する)を含む化合物である。より好ましくは、F−フルオロ放射標識剤は、4,7,13,16,21,24−ヘキサオキサ−1,10−ジアザビシクロ[8.8.8]−ヘキサコサンKF、即ち、クラウンエーテル塩Kryptofix KF、KF、HF、KHF2、CsF、NaF、及びFのテトラアルキルアンモニウム塩、例えばテトラブチルアンモニウムフルオリドを含む群から選択され、ここで、F=[19F]である。
【0239】
上に開示された好ましい態様は本明細書に包含される。
【0240】
本明細書で使用される「標識剤」という語は、当業者にとって既知又は明白な反応条件を惹起する試薬を指し、酸性、塩基性、水素化分解的、酸化的、光分解的、好ましくは酸性開裂条件から選ばれ(但しこれらに限定されない)、Greene and Wuts, Protecting groups in Organic Synthesis, third edition, page 494-653 and 249-290にそれぞれ記載のものから選択されるがそれらに限定される訳ではない。
【0241】
好ましくは、放射標識剤は、F−アニオンを含む又はそれで構成される化合物である。より好ましくは、フルオロ放射標識剤は、4,7,13,16,21,24−ヘキサオキサ−1,10−ジアザビシクロ[8.8.8]−ヘキサコサンKF、即ち、クラウンエーテル塩Kryptofix KF、KF、HF、KHF2、CsF、NaF、及びFのテトラアルキルアンモニウム塩、例えばテトラブチルアンモニウムフルオリドを含む群から選択され、ここで、F=[19F]である。
【0242】
第6の局面では、本発明は、式Ib、及び下記に定義されるVIの化合物
式Ib
【化30】

[式中、
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種又は[19F]であり、
R4、R5、R6、及びkは前記と同義である]に関する。
【0243】
式Ibの好ましい態様:
好ましくは、R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含む。
より好ましくは、R101、R102及びR103のうち1個は((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)である。
【0244】
好ましくは、R86は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]及びフッ素−18[18F]の群から選択される無キレート剤放射性核種である。
【0245】
より好ましくは、無キレート剤放射性核種は、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、又はヨウ素131[131ヨード]である。
より好ましくは、無キレート剤放射性核種は[18F]フルオロである。
【0246】
好ましくは、R86は[19F]である。
好ましくは、式Ibの化合物は、1又は2個のR86を含む。より好ましくは、式Ibの化合物は、ただ1個のR86を含む。
【0247】
R4、R5、R6及びkについて上述した好ましい態様は、本明細書に包含される。
【0248】
【化31】

[式中、
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]。
【0249】
上に開示された好ましい態様は本明細書に包含される。
【0250】
第7の局面では、本発明は、式Ib又はVIを有する化合物、その混合物又は医薬的に許容されるその無機又は有機酸の塩、その水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグ、及び医薬的に許容される担体、希釈剤、賦形剤又はアジュバントを含む医薬組成物に関する。
【0251】
ある態様では、この医薬組成物は、医薬的に許容されるその塩、水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグである、式Ib、VI又はIcの化合物を含む。
【0252】
第8の局面では、本発明は、参照化合物、医薬又は放射性医薬品としての使用のための、式Ib又はVIを有する化合物に関する。
【0253】
換言すれば、本発明は、参照化合物、医薬又は放射性医薬品としての、式Ib又はVIを有する化合物の使用に関する。
【0254】
本発明はさらに、過剰増殖性疾患の処置のための医薬又は放射性医薬品を製造するための、式Ib又はVI(式中、R86は、上の定義による無キレート剤放射性核種又は[19F]であり;R8はヒドロキシであり;R40は、それぞれ上の定義による無キレート剤放射性核種又は[19F]である)を有する無キレート剤放射標識化合物の使用に関する。
【0255】
式Iの化合物の使用に関して上に開示された好ましい態様は、本明細書に包含される。
【0256】
第9の局面では、本発明は、造影剤として使用するための式Ibを有する化合物に関する。
【0257】
換言すると、本発明は、造影剤としての式Ibを有する化合物の使用に関する。
【0258】
本発明はさらに、過剰増殖性疾患を造影するための造影剤を製造するための、式I(式中、R7は、前記定義による無キレート剤放射性核種である)を有する無キレート剤放射標識化合物の使用に関する。
【0259】
式Iの化合物の使用に関して上に開示された好ましい態様は、本明細書に包含される。
【0260】
第10の局面では、本発明は、
a)式Iの化合物、又は、
b)上の定義による式Vの化合物及び式VIの化合物又はそれらの混合物、
の所定量を含んだ密封バイアルを含むキットを対象とする。
【0261】
好ましくは、式Iの化合物は、R7がR15又はR10である化合物である。この化合物を標識化反応の前駆体と称する。
【0262】
好ましくは、式Iの化合物は、R7が無キレート剤放射性核種である化合物である。この化合物を、治療又は造影に直ちに使用できる、又は使用前に脱保護及び/又は精製を受ける、放射性医薬品と称する。好ましくは、式Iの化合物は、R7が[19F]である化合物である。この化合物を参照化合物と称する。
【0263】
式I、V及びVIの化合物に関して上に開示された好ましい態様は、本明細書に包含される。
【0264】
本発明の第11の局面では、
1)R1〜R6は前記と同義であり、R7はR15であり、R4はR14であり、そしてR5は前記定義によるR13である]
を有する化合物を取得する方法を対象とする。
【0265】
ある態様では、本発明は、
− R7は前記定義によるR10であり、R10は前記定義によるR30であり;R5は前記定義によるR13であり;そしてR4は前記定義によるR14である]で示される出発化合物を、「求電子試薬」と反応させる、
工程を含む、前記定義によるR7はR15であり、R15はR34であり、R4はR14であり、そしてR5は前記定義によるR13である]を有する前駆体化合物を取得する方法を対象とする。
【0266】
ある態様では、本発明は、
− R7は前記定義によるR10であり、R10は前記定義によるR30であり;R5は前記定義によるR13であり;そしてR4は前記定義によるR14である]で示される出発化合物を、「求電子試薬」と反応させる(但し、式Iの化合物に含まれているR7、R15、R34、R10及びR30は、sp3ハイブリダイズした炭素原子に結合している)、
工程を含む、前記定義によるR7はR15であり、R15はR34であり、R4はR14であり、そしてR5は前記定義によるR13である]を有する前駆体化合物を取得する方法を対象とする。
【0267】
別の態様では、本発明は、
− R7はR10であり、R10は前記定義によるR20であり、R4はR14であり、そしてR5は前記定義によるR13である]で示される出発化合物を、「活性化剤」と反応させる、
工程を含む、前記定義によるR7はR15であり、R4はR14であり、そしてR5は前記定義によるR13であり、R15は前記定義によるR33である]を有する前駆体化合物を取得する方法を対象とする。
【0268】
好ましい態様では、本発明は、
− R7はR10であり、R10は前記定義によるR20であり、R4はR14であり、そしてR5は前記定義によるR13である]で示される出発化合物を、活性化剤と反応させる(但し、式Iの化合物に含まれているR7、R15、R33、R10及びR20は、sp2ハイブリダイズした炭素原子に結合している)、
工程を含む、前記定義によるR7はR15であり、R4はR14であり、そしてR5は前記定義によるR13であり、R15は前記定義によるR33である]を有する前駆体化合物を取得する方法を対象とする。
【0269】
第12の局面では、本発明は、過剰増殖性疾患の進行を病期診断し、監視し、又は過剰増殖性疾患を対象とする治療に対する応答を監視するための方法を対象とする。
【0270】
驚くべきことに、ポリアミン生合成経路を標的とする、R7は無キレート剤放射性核種である]で示される本発明化合物は、正常組織よりも腫瘍細胞で大量に取り込まれる。故に、各々の腫瘍病期が放射性トレーサーの取り込みレベルに反映される。
【0271】
ある態様では、この病期診断法は、(i)R7は無キレート剤放射性核種である式Iの化合物を含む化合物の治療有効量を哺乳動物に投与し、(ii)該哺乳動物の1又はそれ以上の臓器又は組織又はその両者の画像を取得し;(iii)前記画像から、該哺乳動物の1又はそれ以上の臓器又は組織又はその両者に存在する、関与しているポリアミン生合成経路を定量し、(iv)決定された量及び対照の量を利用して、その病態の病期に到達する、ことを含む。
【0272】
ある態様では、この過剰増殖性疾患の進行を監視する方法は、(i)R7は無キレート剤放射性核種である式Iの化合物を含む化合物の治療有効量を哺乳動物に投与し、(ii)該哺乳動物の1又はそれ以上の臓器又は組織又はその両者の画像を取得し;(iii)前記画像から、該哺乳動物の1又はそれ以上の臓器又は組織又はその両者に存在する、関与しているポリアミン生合成経路を定量し、(iv)決定された量を利用して、過剰増殖性疾患の進行を監視する、ことを含む。
【0273】
ある態様では、哺乳動物の1又はそれ以上の臓器又は組織又はその両者に関連する過剰増殖性疾患を対象とする治療に対する該哺乳動物の応答を監視する方法は、(i)R7は無キレート剤放射性核種である式Iの化合物を含む化合物の治療有効量を哺乳動物に投与し、(ii)該哺乳動物の1又はそれ以上の臓器又は組織又はその両者の画像を取得し;(iii)前記画像から、該哺乳動物の1又はそれ以上の臓器又は組織又はその両者に存在する、関与しているポリアミン生合成経路を定量し、(iv)決定された量及び対照の量を利用して、治療に対する該哺乳動物の応答があればそれを評価する、ことを含む。
【0274】
好ましくは、この方法は治療に対する哺乳動物の応答を早期に監視するのに有用である。
【0275】
上に開示された好ましい態様は本明細書に包含される。
【0276】
本発明のこの局面は、式Ibの化合物にも適用される。
【0277】
好ましくは、本発明化合物は本明細書に開示されるL−オルニチン誘導体(2S)である。
【0278】
定義
以下は、本発明の説明の理解に役立つであろう幾つかの定義である。これらは一般的な定義を意図しており、決して本発明の範囲をそれらの用語のみに限定すべきではなく、以下の説明のより良い理解を進めるものである。
【0279】
文脈上他の意味に解すべき場合又は特にそれに反する旨が記載されている場合を除き、本明細書に、単数の整数、工程又は構成要素として明白に列挙されている整数、工程、又は本発明の構成要素は、列挙されたその整数、工程又は構成要素の単数及び複数形の両者を包含する。本明細書全編を通じ、文脈上他の意味に解すべき場合を除き、「含む(comprise)」、又は「含む(comprises)」又は「含む(comprising)」といった変化形は、記載された工程又は構成要素又は整数又は工程又は構成要素又は整数の群を包含していることを意味し、任意の他の工程又は構成要素又は整数又は構成要素又は整数の群の排除を意味する訳でないことを理解されたい。即ち、本明細書の文脈では、「含む」という語は、「主要なものとして包含するが必ずしも唯一ではない」ことを意味する。当業者は、本明細書に記載の本発明は、具体的に記載された内容以外の変化及び修飾を受け入れる余地があることを理解できるであろう。本発明がこのような変化及び修飾の全てを包含することを理解すべきである。本発明はさらに、本明細書で個別に又は集合的に言及又は指摘された全ての工程、特徴、組成物及び化合物、並びに、任意の及び全ての前記工程又は特徴の組み合わせ又は任意の2又はそれ以上の前記工程又は特徴を包含する。
【0280】
本発明化合物にキラル中心又はその他の形態の異性体中心が存在する場合、エナンチオマー及びジアステレオマーを包含するそのような立体異性体の全形態が本発明に包含されることが意図されている。キラル中心を含む化合物は、ラセミ混合物又はエナンチオマー的に濃縮された混合物又はジアステレオマー化合物又はジアステレオマー的に濃縮された混合物として使用でき、又は、これらの異性体混合物を周知の技術を用いて分離し、個々の立体異性体を単独で利用することができる。化合物が炭素−炭素二重結合を有する場合、(Z)−異性体及び(E)−異性体の両者並びにこれらの混合物が本発明の範囲内にある。化合物が互変異性型、例えばケト−エノール互変異性体として存在し得る場合、各互変異性型は、平衡状態で存在していようと一方の型が大部分であろうと、本発明の範囲内に包含されると考えられる。
【0281】
本発明の文脈において、好ましい好適な塩は、本発明に係る化合物の医薬的に許容される塩である。本発明はさらに、それらとしては薬学的応用に適当でないものの、例えば本発明化合物の単離又は精製に利用できる塩をも含む。本発明化合物の医薬的に許容される塩は、鉱酸、カルボン酸及びスルホン酸の酸付加塩、例えば、塩酸、臭化水素酸、硫酸、リン酸、メタンスルホン産、エタンスルホン酸、トルエンスルホン酸、ベンゼンスルホン酸、ナフタレンジスルホン酸、酢酸、トリフルオロ酢酸、プロピオン酸、乳酸、酒石酸、リンゴ酸、クエン酸、フマル酸、マレイン酸及び安息香酸の塩を包含する。
【0282】
本発明化合物の医薬的に許容される塩は、通常の塩基の塩、例えば例として、そして好ましいものとして、アルカリ金属塩(例えばナトリウム塩及びカリウム塩)、アルカリ土類金属塩(例えばカルシウム塩及びマグネシウム塩)、並びにアンモニウム塩、アンモニア又は1〜16個の炭素原子を有する有機アミン、例えば例として、そして好ましいものとして、エチルアミン、ジエチルアミン、トリエチルアミン、エチルジイソプロピルアミン、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、ジシクロヘキシルアミン、ジメチルアミノエタノール、プロカイン、ジベンジルアミン、N メチルモルホリン、アルギニン、リジン、エチレンジアミン及びN メチルピペリジンから誘導される塩を包含する。
【0283】
本明細書で使用される「治療有効量」という語は、その意味内に、所望の治療効果又は造影効果を提供するのに充分であるが非毒性である、本発明に係る化合物又は組成物の量を包含する。正確な必要量は、処置される種、対象の年齢及び一般状態、処置される状態の重篤度、投与される個別化合物、投与様式などといった因子に応じて対象毎に変わるであろう。従って、正確な「治療有効量」を特定することはできないが、与えられた任意の症例について、日常的な検査及び実験のみを用いて当業者が適切な「治療有効量」を決定することはできる。
【0284】
本明細書で使用される「処置」という語は、疾患の状態又は症状を治療し、疾患の成立を防止し、又はさもなければ、いかなるものであれ疾患又はその他の望ましくない症状を何らかの方法で防止し、妨げ、遅らせ、又は回復させる、任意の及び全ての使用を指す。
【0285】
本明細書で使用される「放射性核種」という語は、核内に新たに創成された放射粒子、又は原子内電子(内部転換を参照されたい)の何れかに付与されるために利用される過剰エネルギーを特徴とする核である、不安定な核を有する原子を指す。このプロセスにおいて放射性核種は放射性崩壊を受け、γ線及び/又は亜原子粒子を放射する。これらの粒子は電離放射線を構成する。放射性核種は天然に存在し得るが、人工的に作製することもできる。
【0286】
本明細書で使用される「無キレート剤放射性核種」という語は、標的化分子の原子に共有結合的にそして直接的に結合している放射性核種を指し、ここでは、共有結合的又は非共有結合的関連性による放射性核種及び標的化分子間の空間的近接性を提供するために、キレート化構造が利用されていない。キレート剤とは、DOTA、DTPA、及びEDTAのようなキレート化構造体である。
【0287】
無キレート剤放射性核種は、PET、SPECT又はマイクロPETに、又はコンピューター断層撮影(CT)、及び磁気共鳴(MR)分光造影法のような他の従来の造影法と組み合わせるのが有用である。
【0288】
好ましくは、無キレート剤放射性核種は、臭素、酸素、窒素、炭素、ヨウ素又はフッ素といった適当なPET又はSPECT同位体で構成され、又はそれらを含む。より好ましくは、好適なPET又はSPECT同位体は、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]又はフッ素−18[18F]である。より好ましくは、この無キレート剤放射性核種はフッ素−18[18F]である。
【0289】
炭素−11[11C]を含む無キレート剤放射性核種は、好ましくは、11CH3、−O(11CH3)又は−N(11CH3)(C1−C5)アルキルであるがこれらに限定される訳ではない。
【0290】
本明細書で使用される「標的化分子」という語は、本発明で開示されるオルニチン又はリジン誘導体を指す。
【0291】
本明細書において単独で、又は他の基の一部分として使用される「アミン−保護基」という語は、当業者にとって既知又は明白であり、それは、あるクラスの保護基、即ち、カルバメート、アミド、イミド、N−アルキルアミン、N−アリールアミン、イミン、エナミン、ボラン、N−P保護基、N−スルフェニル、N−スルホニル及びN−シリルから選ばれ(但しこれらに限定されない)、教科書Greene and Wuts, Protecting groups in Organic Synthesis, third edition, page 494-653(引用により本明細書の一部とする)に記載されているものから選択されるがそれらに限定されない。
【0292】
本明細書において単独で、又は他の基の一部分として使用される「カルボン酸保護基」という語は、当業者にとって既知又は明白であり、それは、教科書Greene and Wuts, Protecting groups in Organic Synthesis, third edition, page 494-653(引用により本明細書の一部とする。)に記載されているあるクラスの保護基、即ち、メチル、エチル、tert−ブチル、p−メトキシベンジル及びトリフェニルメチルから選択されるがそれらに限定されない。
【0293】
本明細書及び請求項で以下に使用される「無機酸」及び「有機酸」という語は、炭酸、硝酸、塩酸、臭化水素酸、ヨウ化水素酸、リン酸、過塩素酸、過塩素酸又は硫酸のような酸を包含する(但しこれらに限定される訳ではない)鉱酸、又はそれらの酸性塩、例えば硫酸水素カリウム、又は、脂肪酸、脂環式酸、芳香族酸、芳香脂肪族(araliphatic)酸、ヘテロ環式酸、カルボン酸及びスルホン酸のような酸を包含する(但しこれらに限定されない)適当な有機酸(その例にはそれぞれ、蟻酸、酢酸、トリフルオロ酢酸、プロピオン酸、琥珀酸、グリコール酸、グルコン酸、乳酸、リンゴ酸、フマル酸、ピルビン酸、安息香酸、アントラニル酸、メシル酸、フマル酸、サリチル酸、フェニル酢酸、マンデル酸、エンボン酸、メタンスルホン酸、エタンスルホン酸、ベンゼンスルホン酸、パントテン酸、トルエンスルホン酸、トリフルオロメタンスルホン酸及びスルファニル酸がある)を指す。
【0294】
本明細書において単独で、又は他の基の一部分として使用される「脱離基」という語は、当業者にとって既知又は明白であり、ある原子又は原子群が、求核試薬、例えばフッ化物原子(fluoride atom)によって化学物質から分離可能であることを意味する。典型的には、脱離基は、結合電子を連れて安定種として置換される。
【0295】
脱離基は当業者にとって既知又は明白であり、Synthesis (1982), p. 85-125, table 2 (p. 86;(この表2の最後の項目は訂正の必要があり、“n-C4H9S(O)2-O-nonaflat”ではなく“n-C4F9S(O)2-O-nonaflat ”である)、Carey and Sundberg, Organische Synthese, (1995), page 279-281, table 5.8;Netscher, Recent Res. Dev. Org. Chem., 2003, 7, 71-83, scheme 1, 2, 10 and 15他);Fluorine-18 Labeling Methods: Features and Possibilities of Basic Reactions, (2006), in: Schubiger P.A., Friebe M., Lehmann L., (eds), PET-Chemistry - The Driving Force in Molecular Imaging. Springer, Berlin Heidelberg, pp.15-50, explicitly: scheme 4 pp. 25, scheme 5 pp 28, table 4 pp 30, Fig 7 pp 33)に記載又は指定されているものから選択されるが、それらに限定される訳ではない。
【0296】
本明細書中、「アリール」、「ヘテロアリール」又は芳香族系を指す他の任意の用語が用いられる任意の箇所において、当該用語は、斯かる芳香族系が1又は2以上の適当な置換基、例えばOH、ハロ、(C1−C6)アルキル、CF3、CN、(C1−C6)アルケニル、(C1−C6)アルキニル、(C1−C6)アルコキシ、(ジメチルカルバモイル)(メチル)アミノ、NH2、NO2、SO3H、−SO2NH2、−N(H)C(O)(C1−C5)アルキル、−C(O)N(H)(C1−C5)アルキルで置換されている可能性をも包含する。
【0297】
本明細書において単独で、又は他の基の一部分として使用される「アリール」という語は、環部分に6〜12個の炭素、好ましくは環部分に6〜10個の炭素を含む単環式又は二環式芳香族基、例えば、フェニル、ナフチル又はテトラヒドロナフチル(これら自身が、ハロ、ニトロ、(C1−C6)カルボニル、シアノ、ニトリル、ヒドロキシ、ペルフルオロ−(C1−C16)アルキル、特にトリフルオロメチル、(C1−C6)アルキルスルホニル、(C1−C6)アルキル、(C1−C6)アルコキシ、(ジメチルカルバモイル)(メチル)アミノ及び(C1−C6)アルキルスルファニルを含む群から独立且つ個別に選択される1、2又は3個の置換基で置換されていてもよい)を指す。上に概説したように、このような「アリール」は1又は数個の置換基でさらに置換されていてもよい。上記の置換基が同一の置換基内で合していてもよいということは、当業者には明らかである(例えば、ハロ−アルキル、ペルフルオロアルキル−アルコキシ、など)。好ましくは、アリールはフェニル、ナフチルである。
【0298】
本明細書で使用される「ヘテロアリール」という語は、5〜14個の環原子;環状配置(cyclic array)において共有されている6、10又は14個のΠ(パイ)電子を有し、炭素原子(これは、ハロ、ニトロ、((C1−C6)アルキル)カルボニル、シアノ、ヒドロキシ、トリフルオロメチル、(C1−C6)スルホニル、(C1−C6)アルキル、(C1−C6)アルケニル、(C1−C6)アルキニル、(C1−C6)アルコキシ又は((C1−C6)アルキル)スルファニルで置換されていてもよい)、及び、1、2、3又は4個の酸素、窒素又は硫黄ヘテロ原子を含む基を指す(ここで、ヘテロアリール基の例は、チエニル、ベンゾ[b]チエニル、ナフト[2,3−b]チエニル、チアントレニル、フラニル、ピラニル、イソベンゾフラニル、ベンズオキサゾリル、クロメニル、キサンテニル、フェノキサチイニル、2H−ピロリル、ピロリル、イミダゾリル、ピラゾリル、ピリジル、ピラジニル、ピリミジニル、ピリダジニル、インドリジニル、イソインドリル、3H−インドリル、インドリル、インダゾリル、プリニル、4H−キノリジニル、イソキノリル、キノリル、フタラジニル、ナフチリジニル、キナゾリニル、シンノリニル、プテリジニル、4aH−カルバゾリル、カルバゾリル、カルボリニル、フェナントリジニル、アクリジニル、ペリミジニル、フェナントロリニル、フェナジニル、イソチアゾリル、フェノチアジニル、イソオキサゾリル、フラザニル及びフェノキサジニル基である)。好ましくは、ヘテロアリールは、ピリジル、2−フラニル、及び2−チエニルである。
【0299】
上に概説したように、このような「ヘテロアリール」は1又は数個の置換基でさらに置換されていてもよい。
【0300】
本明細書で使用される「アラルキル」という語は、アリール基がアルキルH原子で置換されている基を指す。アリール化アルキルから誘導される。
【0301】
以後、本明細書及び請求項で使用される「アルキル」という語は、単独で、又は他の基の一部分として、1〜10個の炭素原子を有する直鎖又は分岐鎖アルキル基、例えば、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、tert−ブチル、ペンチル、イソペンチル、ネオペンチル、ヘプチル、ヘキシル、デシルを指す。アルキル基はさらに、例えばハロゲン原子、ヒドロキシ基、C1−C4アルコキシ基又はC6−C12アリール基(これはさらに、例えば1〜3個のハロゲン原子で置換されていてもよい)で置換されていてもよい。より好ましくは、アルキルは(C1−C10)アルキル、(C1−C6)アルキル、(C1−C5)アルキル、(C2−C5)アルキル又は(C1−C4)アルキルである。
【0302】
以後、本明細書及び請求項で使用される「アルケニル」及び「アルキニル」という語は、アルキルと同様に定義されるが、それぞれ少なくとも1個の炭素−炭素二重結合又は三重結合を含んでいる。
【0303】
以後、本明細書及び請求項で使用される「アルコキシ(又はアルキルオキシ)」という語は、酸素原子によって上の定義によるアルキル部分とそれぞれ連結しているアルキル基を指す。
【0304】
本明細書及び請求項で使用される、上の定義による、そして置換基「アルキル」、「アルケニル」、「アルキニル」、「アルコキシ」などに結合している置換基R7は、対応する置換基「アルキル」、「アルケニル」、「アルキニル」、「アルコキシ」などに、任意の炭素の位置で結合できる。従って、「R7−(C1−C5)アルコキシ」という語は位置異性に関して様々な可能性を包含し、例えば、R7−(C5)ペントキシは、例えばR7−CH2−CH2−CH2−CH2−CH2−O−、CH3−C(R7)H−CH2−CH2−CH2−O−又はCH(−CH2−R7)(−CH3)−CH2−CH2−O−などを意味し得る。
【0305】
「置換された」という語が使用される時は常に、それは、「置換された」が用いられる表現において示される原子に結合した1又はそれ以上の水素が、示された基から選択されるもので置き換えられることを意味する。但し、示された原子の正常な原子価を超えず、また、その置換が、化学的に安定な化合物、即ち、反応混合物からの有用な純度に至るまでの単離、及び医薬組成物への製剤化に対して存続するに充分なほど強固な化合物を生成するという条件においてである。置換基は、ハロゲン原子(フルオロ、塩素、臭素、ヨード)、ヒドロキシ基、−SO3H、ニトロ、(C1−C6)アルキルカルボニル、シアノ、ニトリル、トリフルオロメチル、(C1−C6)アルキルスルホニル、(C1−C6)アルキル、(C2−C6)アルケニル、(C1−C6)アルキニル、(C1−C6)アルコキシ及び(C1−C6)アルキルスルファニルから選択できる。
【0306】
「ハロ」又は「ハロゲン」という語は、フッ素(F)、塩素(Cl)、臭素(Br)、及びヨウ素(I)を指す。
【0307】
本発明化合物にキラル中心又はその他の形態の異性体中心が存在する場合、エナンチオマー及びジアステレオマーを包含するそのような立体異性体の全形態が本発明に包含されることが意図されている。キラル中心を含む化合物は、ラセミ混合物又はエナンチオマー的に濃縮された混合物として使用でき、又は、ラセミ混合物を周知の技術を用いて分離し、個々の立体異性体を単独で利用することができる。化合物が不飽和の炭素−炭素二重結合を有する場合、(Z)−異性体及び(E)−異性体の両者が本発明の範囲内にある。化合物が互変異性型、例えばケト−エノール互変異性体として存在し得る場合、各互変異性型は、平衡状態で存在していようと一方の型が大部分であろうと、本発明の範囲内に包含されると考えられる。
【0308】
特に規定のない限り、本発明の式の化合物自体及びその任意の医薬組成物に言及する場合、本発明は、本発明化合物の水和物、塩、溶媒和物、複合体、及びプロドラッグの全てを包含する。プロドラッグとは、式Iに示される活性な親薬物を放出する、共有結合で結合した任意の化合物である。
【0309】
以後、本明細書及び請求項で使用される「活性化剤」という語は、「芳香族超原子価ヨード化合物」又は「酸化剤」又は「メチル化剤」を指す。
【0310】
以後、本明細書及び請求項で使用される「メチル化剤」という語は、芳香族−NMe2基を芳香族−N+Me3基に変換するのに適したヨウ化メチル及びメチルトリフラートを包含する化学物質を指すが、それらに限定されない(例えば、Chemistry - A European Journal; 13; 8; (2007); 2189 - 2200; Journal of Fluorine Chemistry;128; 7; (2007); 806 - 812)。
【0311】
以後、本明細書及び請求項で使用される「求電子試薬」という語は、脱離基中のヒドロキシ基の変換に適した、四臭化炭素(CBr4) 、トリフェニルホスフィン/臭素(PPh3/Br2)、四塩化炭素(CCl4)、チオニルクロリド(SOCl2)、メシルクロリド、メシル無水物、トシルクロリド、トシル無水物、トリフルオロメチルスルホニルクロリド、トリフルオロメチルスルホニル無水物、ノナ−フルオロブチルスルホニルクロリド、ノナ−フルオロブチルスルホニル無水物、(4−臭素−フェニル)スルホニルクロリド、 (4−臭素−フェニル)スルホニル無水物、(4−ニトロ−フェニル)スルホニルクロリド、(4−ニトロ−フェニル)スルホニルクロリド、(2−ニトロ−フェニル)スルホニルクロリド、(2−ニトロ−フェニル)スルホニル無水物、(4−イソプロピル−フェニル)スルホニルクロリド、(4−イソプロピル−フェニル)スルホニル無水物、(2,4,6−トリ−イソプロピル−フェニル)スルホニルクロリド、(2,4,6−トリ−イソプロピル−フェニル)スルホニル無水物、(2,4,6−トリメチル−フェニル)スルホニルクロリド、(2,4,6−トリメチル−フェニル)スルホニル無水物、(4−tertブチル−フェニル)スルホニルクロリド、(4−tertブチル−フェニル)スルホニル無水物、(4−メトキシ−フェニル)スルホニルクロリド、(4−メトキシ−フェニル)スルホニル無水物、即ちスルホナート又はハロゲン化物を包含する化学物質を指すが、これらに限定されない。
【0312】
以後、本明細書及び請求項で使用される「オキシダント」という語は、環状スルファミダイトを環状スルファミダートに変換するのに適した、m−塩素ペルオキシ安息香酸、過マンガン酸カリウム(KMnO4)、水和酸化ルテニウム(IV)(RuO2xH2O)に過ヨウ素酸ナトリウム(NaIO4)を加えたもの、及び過ヨウ素酸ナトリウム/三塩化ルテニウム(NaIO4/RuCl3)を包含する化学物質を指すが、これらに限定されない(例えば、Tetrahedron 59, (2003), 2581-2616, page 2585及びそこに引用されている文献)。
【0313】
以後、本明細書及び請求項で使用される「過剰増殖性疾患」という語は、制御されない増殖(正常限界を超えた分割)、浸潤(隣接組織への侵入及びその破壊)、及び時に転移(リンパ又は血液を介した身体の他の位置への蔓延)を特徴とする、癌(医学用語:悪性腫瘍)という一般用語に分類される疾患を指す。癌のこれら3つの悪性の特性により、自己限定性であり、浸潤又は転移しない良性腫瘍と癌とが区別される。殆どの癌は固形腫瘍を形成するが、白血病のようにそうでないものもある。
【0314】
以後、本明細書及び請求項で使用される「参照化合物」という語は、参照化合物は同定手段としての、そして品質確認のための放射標識がなされていないという点で放射性トレーサーと異なっている化合物を指す。
【0315】
以後、本明細書及び請求項で使用される「マイクロPET」という語は、小実験動物の高分解能造影のために設計されたPET造影技術を指す。
【0316】
以後、本明細書及び請求項で使用される「プロドラッグ」という語は、式Iによる活性な親薬物、好ましくは式Iで示される18F標識化化合物を放出する、共有結合で結合した任意の化合物を意味する。
【0317】
この文書全体で使用されている「プロドラッグ」という語は、その誘導体のインビボ生体内変化で生じる生成物が式(I)の化合物で定義される活性薬物であるような、エステル、アミド及びホスファートといった薬理学的に許容される誘導体を意味する。プロドラッグを一般的に説明しているGoodman and Gilman (The Pharmaco- logical Basis of Therapeutics, 8 ed, McGraw-HiM, Int. Ed. 1992,"Biotransformation of Drugs", p 13-15)による参考文献を本明細書の一部とする。本発明化合物のプロドラッグは、その修飾が、従来の操作又はインビボで親化合物へと開裂されるように、化合物に存在する官能基を修飾することによって製造する。本発明化合物のプロドラッグは、例えばヒドロキシ基、例えば不斉炭素原子上のヒドロキシ基、又はアミノ基が、そのプロドラッグが患者に投与された時に開裂して各々遊離ヒドロキシ又は遊離アミノを形成する任意の基に結合しているような化合物を包含する。
【0318】
プロドラッグの典型例は、例えばWO99/33795、WO99/33815、WO99/33793及びWO99/33792に記載されており、これら全てを引用により本明細書の一部とする。
【0319】
プロドラッグは、優れた水溶性、増大した生体利用能を特徴とし、インビボで容易に代謝されて活性阻害剤となる。
【0320】
略語及び頭字語
当分野における通常の知識を有する有機化学者が使用する略語の総合リストがThe ACS Style Guide(第3版)又はthe Guidelines for Authors for the Journal of Organic Chemistryに掲載されている。前記リストに含まれている略語及び当分野における通常の知識を有する有機化学者が使用する全略語を引用して本明細書の一部とする。本発明の目的のため、化学元素はthe Periodic Table of the Elements, CAS version, Handbook of Chemistry and Physics, 67th Ed., 1986-87に従って特定する。
【0321】
より詳細には、本開示全編にわたり以下の略語が使用される時、それらは以下の意味を有する:
【0322】
Boc tert−ブトキシカルボニル
DAST ジエチルアミノ硫黄トリフルオリド
eq.;equiv. 当量
h 時間
m−CPBA メタ−塩素過安息香酸
TFA トリフルオロ酢酸
【実施例】
【0323】
実験データ
[18F]−4−フルオロ−L−オルニチン(29)の合成:
【化32】

【0324】
Org. Lett. 2001, 3, 3153に記載の方法に従い(4)を合成した。次いで遊離アミン官能性を、水素化工程で開裂させることのできるベンジルオキシカルバメート(CbzHN)基として保護した。Cbz基の他に、ベンジル又はメトキシベンジルのような他の酸化還元不安定性アミン保護基、及びトリアジノン類のような酸不安定性保護基又はフタロイル基のようなイミド様部分を使用することもできる(P. J. Kocienski, Protecting Groups, 3rd ed, Georg Thieme Verlag 2005, p. 487-591)。遊離アルコール(26)を、メタンスルホニルクロリド又はp−トルエンスルホン酸無水物のような求電子試薬との反応により求核性フッ化物イオンと反応可能なスルホナートに変換し、それぞれ対応する前駆体(27)及び(28)を得る。当業者は、ノシラート、ブロシラート、ノナフラート、トリフラート、ヨウ化物、臭化物又は塩化物といった他の脱離基を前駆体への変換に利用することもできる(J. March, Advanced Organic Chemistry, 4th ed. 1992, John Wiley & Sons, pp 352ff)。
【0325】
tert−ブチル(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−ヒドロキシ−L−オルニチナート(26)の合成:
【化33】

【0326】
テトラヒドロフラン(12.5mL)中のジベンジルジカルボナート(600mg、2.09mmol)の溶液に0℃でテトラヒドロフラン/ジ塩素メタン(1:1、5mL)中の(4)(455mg、1.50mmol)の溶液を加えた。この温度で1時間攪拌した後、飽和重炭酸ナトリウム水溶液(20mL)を加えて反応停止させた。層を分離し、水相を酢酸エチル(3x20mL)で抽出し、合した有機層を硫酸ナトリウムで乾燥し、溶媒を減圧留去した。粗生成物をカラムクロマトグラフィー(シリカ、ヘキサン/酢酸エチル)で精製した。収量:548mg、83%。
【0327】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 1.45 (s, 9H), 1.47 (s, 9H), 1.68 - 1.84 (m, 1H), 1.90 - 2.02 (m, 1H), 3.13 (ddd, 1H), 3.28 - 3.51 (m, 2H), 3.91 (br. s., 1H), 4.22 (dd, 1H), 5.11 (s, 2H), 5.23 (br. s., 1H), 5.39 (br. s., 1H), 7.29 - 7.40 (m, 5H)。
MS (ESIpos): m/z = 439 [M+H]+。
【0328】
tert−ブチル(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−[(メチルスルホニル)オキシ]−L−オルニチナート(27)の合成:
【化34】

【0329】
ジ塩素メタン(40mL)中の(26)(547mg、1.25mmol)の溶液に0℃でトリエチルアミン(0.87mL、6.24mmol)及びメタンスルホニルクロリド(0.24mL、3.12mmol)を加えた。この温度で3時間攪拌した後、反応混合物を酢酸エチル(100mL)で希釈し、飽和塩化アンモニウム水溶液で洗浄した。次いで水相を酢酸エチルで2回抽出し、合した有機相を硫酸マグネシウムで乾燥した。溶媒を除去した後、粗生成物をカラムクロマトグラフィー(シリカ、ヘキサン/酢酸エチル)で精製した。収量:546mg、85%。
【0330】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 1.45 (s, 9H), 1.48 (s, 9H), 2.09 - 2.23 (m, 2H), 3.05 (s, 3H), 3.47 - 3.67 (m, 2H), 4.27 (br. s., 1H), 4.89 (br. s., 1H), 5.12 (s, 2H), 5.25 (br. s., 2H), 7.29 - 7.42 (m, 5H)。
MS (ESIpos): m/z = 517 [M+H]+。
【0331】
tert−ブチル(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−{[(4−メチルフェニル)スルホニル]オキシ}−L−オルニチナート(28)の合成:
【化35】

【0332】
ジ塩素メタン/ピリジン(4:1、5mL)中の(26)(50.0mg、0.11mmol)の溶液に0℃でp−トルエンスルホン酸無水物(55.8mg、0.17mmol)を加えた。0℃で2時間、そして室温で1時間攪拌した後、追加量のp−トルエンスルホン酸無水物(55.8mg、0.17mmol)を加えた。室温で14時間攪拌した後、反応混合物を酢酸エチル(20mL)で希釈し、2N塩酸、ブラインで洗浄し、硫酸マグネシウムで乾燥した。溶媒を除去した後、粗生成物をカラムクロマトグラフィー(シリカ、ヘキサン/酢酸エチル)で精製した。収量:58.2mg、68%。
【0333】
1H-NMR (400MHz, 塩素ホルム-d): δ [ppm]= 1.43 (s, 9H), 1.45 (s, 9H), 1.92 - 2.05 (m, 1H), 2.17 (d, 1H), 2.43 (s, 3H), 3.46 - 3.60 (m, 2H), 4.08 - 4.24 (m, 1H), 4.73 (br. s., 1H), 5.01 - 5.15 (m, 4H), 7.29 - 7.39 (m, 7H), 7.80 (d, 2H)。
MS (ESIpos): m/z = 593 [M+H]+。
【0334】
(4S)−[18F]−フルオロ−L−オルニチン(29)の合成:
【化36】

【0335】
水性[18F]−フルオリドを18O(p,n)18F反応により生成した。[18F]−フルオリド(1.64〜2.70GBq)を、前処理済みQMA陰イオン交換カラム(30mg、CO3_型)を用いてターゲット水から分離し、メタノール中0.2Mのテトラブチルアンモニウムメタンスルホナート(TBAOMs)1mLを使用して円錐形ガラスバイアル中に溶出した。この溶液を窒素気流下に開放ガラスバイアル中、130℃で乾燥した。残留水を除去するため、アセトニトリル1.0mLを加え、溶液を再度乾燥した。この最終工程を2回反復し、残余の固体残留物を、tert−ブチル(4R)−N−[(ベンジルオキシ)カルボニル]−N−(tert−ブトキシカルボニル)−4−[(メチルスルホニル)オキシ]−L−オルニチナート(27)5.0mgを含有するアセトニトリル300μLに再溶解した。このガラスバイアルに蓋をし、90℃で15分間加熱した。冷却後、反応混合物をアセトニトリル/水(1/2 v/v)4mLで希釈し、続いて、リモコン操作のHPLC注入システムを用いてHPLCユニットに移し、Agilent Zolbax Bonus-RP C18、5μm;250_9.4mmカラムを用いるセミ分取HPLC精製に付した。溶離液は、流速4mL/分の0.1%トリフルオロ酢酸を含むアセトニトリル/水であった。精製のため、40〜80%アセトニトリルの直線勾配を20分以内使用した。
【0336】
HPLC画分を水4mLで希釈し、前処理したC18ライトカートリッジに適用した。カートリッジを水5mLで洗浄し、エタノール2mLで第二の円錐形ガラスバイアル中に溶出した。パラジウム炭素(Pd/C)(10%)3mg及び固体蟻酸アンモニウム4mgをこのガラスバイアルに加え、蓋をした後、90℃で25分間加熱した。冷却した反応混合物を、Pd/Cを除去するために4mmHPLCシリンジフィルターを通過させて第三の円錐形ガラスバイアルに入れた。次に、濾液に4N塩酸100μLを加え、被蓋ガラスバイアル中でこの溶液を再度90℃で15分間加熱した。冷却した反応混合物を4N水酸化ナトリウム(pH6〜8)で最後に中和し、濾過滅菌すると12〜31MBqの最終トレーサーが、約153分間の合成時間後に、放射化学収率2±1%、放射化学純度90〜99%で得られた。
【0337】
(3R)−3−フルオロ−L−オルニチン(31)の合成:
【化37】

【0338】
保護3−ヒドロキシオルニチン(11)をモルホリノ−硫黄トリフルオリドとの反応により、対応する3−フルオロ誘導体(30)に変換した(H. Vorbrueggen, Synthesis 2008, 8, 1165-1174)。この保護3−フルオロオルニチンの脱保護を酸性条件下に塩酸で実施した。当業者にとっては、硫酸又はトリフルオロ酢酸のような他の有機又は無機酸及び水酸化ナトリウム水溶液のような塩基性条件を保護基の除去に使用することもできる。
【0339】
メチル(3R)−N2,N5−ビス(tert−ブトキシカルボニル)−3−フルオロ−L−オルニチナート(30)の合成:
【化38】

【0340】
ジ塩素メタン(10mL)中のアルコール(11)(100mg、0.28mmol)の溶液に0℃で4−(トリフルオロ−λ4−スルファニル)モルホリン(69μL、0.55mmol)を加え、混合物をこの温度で2時間攪拌した。次いで反応混合物を酢酸エチル(20mL)で希釈し、飽和重炭酸ナトリウム水溶液、ブラインで洗浄し、硫酸マグネシウムで乾燥した。溶媒を減圧除去した後、残留物を分取HPLC(XBridge C18 5μ 100×30mm、アセトニトリル/1%水性蟻酸勾配、50mL/分)で精製すると標記化合物が得られた。収量:2.4mg、3%。
【0341】
1H-NMR (400MHz, 塩素ホルム-d): δ [ppm]= 1.45 (s, 9H), 1.47 (s, 9H), 1.71 - 2.06 (m, 2H), 3.21 - 3.38 (m, 2H), 3.81 (s, 3H), 4.53 (dd, 1H), 4.72 (br. s., 1H), 5.12 (dd, 1H), 5.22 (d, 1H)。
MS (ESIpos): m/z = 365 [M+H]+。
【0342】
(3R)−3−フルオロ−L−オルニチン−ジヒドロクロリド(31)の合成:
【化39】

【0343】
6N塩酸中の(30)(2.0mg、2.7μmol)の溶液を80℃で3.5時間攪拌した。混合物を減圧濃縮した後、水で希釈し凍結乾燥すると、灰白色固体の標記化合物が得られた。収量:1.0mg、82%。
MS (ESIpos): m/z = 151 [M - 2 HCl + H]+。
【0344】
(5R)−[18F]フルオロメチル−L−オルニチン(38)の合成:
【化40】

【0345】
Org. Biomol. Chem. 2003, 973に記載の方法に従い(32)を合成した。次いでホモアリルグリシン(32)の二重結合を市販のAD−ミックス−αで非対称的にジヒドロキシ化した。tert−ブチルヒドロペルオキシドのような共酸化剤と組み合わせたOsO4のような当業者に知られる他のジヒドロキシ化法(J. Am. Chem. Soc. 1976, 98, 1986)以外にも、N−メチルモルホリノN−オキシド(Tetrahedron Lett. 1976, 1973)その他が使用できる。さらに、ジェイコブセン(Catalytic Asymmetric Synthesis, Ojima, I. Ed., VCH Publishers, 1993, pp 159-202)又はシャープレス(Comp. Org. Syn. 1991, 7, 389)によるタンデムエポキシ化−加水分解法もまた所望の構造パターンを導くことができる。次にこの第一級アルコールをtert−ブチル−ジメチルシリルエーテルとして化学選択的に保護し、第二級アルコールをミツノブ条件下にジフェニルホスホロアジダート(DPPA)、ジエチルアゾジカルボキシラート(DEAD)及びPPh3により、対応するアジドに変換した(Chem. Eur. J. 2007, 13, 10225)。この他に、2個のヒドロキシ基の識別を、他のピバラート(Tetrahedron 2009, 2226)、トリチル(Tetrahedron Asymmetry 2009, 78)その他のような嵩高い保護基によって達成できる(Protecting Groups, Kocienski P. J., Thieme, 2005, pp 187-364)。第一級アルコール(36)の脱保護の後、ヒドロキシ基を、後にフッ素−18によるこの化合物の標識化を可能にするメタンスルホナートに変換した。当業者にとっては、他のスルホナート及びハロゲン化物のような他の脱離基(J. Lab. Cmpd. Rad. 2005, 771)もまた求核的フッ素化反応における求電子試薬として働くことができる。
【0346】
メチル−(5S)−N−(tert−ブトキシカルボニル)−5,6−ジヒドロキシ−L−ノルロイシナート(33)の合成:
【化41】

【0347】
tert ブタノール/水(1:1、40mL)中のアルケン(32)(1.42g、5.85mmol)の溶液に、0℃でAD−ミックスα(9.00g、1.54g/mmol)を加えた。この懸濁液を一夜撹拌した。チオ硫酸ナトリウムの飽和水溶液及び酢酸エチルを加え、反応混合物を25℃で1時間攪拌した。層を分離し、水層を酢酸エチル(3x)で抽出した。合した有機層を飽和塩化アンモニウム水溶液で洗浄し、硫酸ナトリウムで乾燥した。蒸発後に粗生成物が得られ(758mg)、これをさらに精製せずに次工程に使用した。分析用キラルHPLC(Chiralpak AD-H 5μm 150x4.6mm、ヘキサン/エタノール80:20、1.0mL/分、25℃、検出:Corona CAD)により、78%d.e.のジアステレオマー過剰率(x10)を確認した。
MS (ESIpos): m/z = 278 [M+H]+。
【0348】
メチル−(5S)−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−5−ヒドロキシ−L−ノルロイシナート(34)の合成:
【化42】

【0349】
ジアステレオマーのジオール(33)の混合物(758mg、2.73mmol)をジ塩素メタン(40ml)に溶解し、tert−ブチルジメチルシリルクロリド(412mg、2.73mmol)及びイミダゾール(279mg、4.10mmol)を加え、混合物を25℃で一夜撹拌した。ジ塩素メタン及び水を加えた後、層を分離し、水層をジ塩素メタン(3x)で抽出した。合した有機層を硫酸ナトリウムで乾燥し、蒸発乾固した。残留物をフラッシュクロマトグラフィー(n−ヘキサン/酢酸エチル(2:1))で精製して無色油状物の所望化合物を得た(518mg、1.32mmol、48%)。
【0350】
13C NMR (75 MHz, 塩素ホルム-d) δ = -5.37 (CH3), 18.26 (C), 25.86 (CH3) (3x), 28.30 (CH3) (3x), 28.40 (CH2), 28.91 (CH2), 52.28 (CH3), 53.21 (CH), 67.02 (CH2), 71.05 (CH), 79.83 (C), 155.41 (C), 173.25 (C) ppm。
MS (ESIpos): m/z = 392 [M+H]+。
【0351】
メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−L−ノルロイシナート(35)の合成:
【化43】

【0352】
トリフェニルホスフィン(700mg、2.64mmol)、ジエチルアゾジカルボキシラート(417μL、2.65mmol)、及びジフェニルホスホロアジダート(342μL、1.59mmol)を、テトラヒドロフラン(10mL)中のアルコール(34)(518mg、1.32mmol)の撹拌溶液に、室温、アルゴン雰囲気下で順に加えた。反応混合物を同じ温度で3時間攪拌した。溶媒を減圧除去した後、残留物を、ヘキサン/酢酸エチル(8:1)を溶離液とするカラムクロマトグラフィーで精製し、無色油状物の所望化合物(439mg、1.05mmol、80%)を得た。
【0353】
13C NMR (75 MHz, 塩素ホルム-d) δ = -5.57 (CH3) (2x), 18.19 (C), 25.76 (CH3) (3x), 26.32 (CH2), 28.28 (CH3) (3x), 29.52 (CH2), 52.39 (CH3), 53.18 (CH), 63.17 (CH), 66.17 (CH2), 80.04 (C), 155.26 (C), 172.90 (C) ppm。
MS (ESIpos): m/z = 417 [M+H]+。
【0354】
メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−ヒドロキシ−L−ノルロイシナート(36)の合成:
【化44】

【0355】
TBDMS−保護されたアジド(35)(439mg、1.05mmol)を0℃でテトラヒドロフラン(30mL)に溶解した。次いでこの溶液に、テトラヒドロフラン中のテトラブチルアンモニウムフルオリド(TBAF、1.27mL、1.27mmol)の1M溶液を加えた。混合物を25℃で1時間攪拌した。混合物を濃縮し、残留物をシリカゲルクロマトグラフィー(ヘキサン/酢酸エチル 1:1)に付し、無色油状物の所望化合物(292mg、0.97mmol、92%)を得た。
【0356】
13C NMR (75 MHz, 塩素ホルム-d) δ = 26.43 (CH2), 28.28 (CH3) (3x), 29.32 (CH2), 52.48 (CH3), 53.18 (CH), 63.62 (CH), 65.20 (CH2), 80.18 (C), 155.34 (C), 172.78 (C) ppm。
MS (ESIpos): m/z = 303 [M+H]+。
【0357】
メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−[(メチルスルホニル)オキシ]−L−ノルロイシナート(37)の合成:
【化45】

【0358】
アジドアルコール(36)(80mg、0.27mmol)及びトリエチルアミン(55μL、0.40mmol)をジ塩素メタン(5mL)に溶解し、0℃に冷却した。メタンスルフリルクロリドの溶液(20μL、0.27mmol)をゆっくりと加えた。反応を徐々に室温まで温め、さらに5時間攪拌した。反応混合物を水で希釈し、ジ塩素メタンで4回洗浄して粗生成物を得、これをカラムクロマトグラフィー(SiO2:ヘキサン/酢酸エチル 1:1)で精製すると、無色油状物の所望化合物(110mg、0.29mmol、99%)が得られた。
【0359】
13C NMR (151 MHz, 塩素ホルム-d) δ = 26.40 (CH2), 28.26 (CH3) (3x), 29.18 (CH2), 37.70 (CH3), 52.61 (CH3), 52.86(CH), 60.17 (CH), 70.21 (CH2), 80.26 (C), 155.31 (C), 172.54 (C) ppm。
MS (ESIpos): m/z = 381 [M+H]+。
【0360】
(5R)−[18F]−フルオロメチル−L−オルニチン(38)の合成:
【化46】

【0361】
水性[18F]−フルオリドを18O(p,n)18F反応により生成した。[18F]−フルオリド(1.51〜3.69GBq)を、前処理済みQMA陰イオン交換カラム(30mg、CO3−型)を用いてターゲット水から分離し、新たに調製したテトラブチルアンモニウム炭酸水素塩(TBAHCO3)溶液(これは、アセトニトリル/水(9/1 v/v)中の40%テトラブチルアンモニウムヒドロキシド(5μL)の溶液中に二酸化炭素を30分間通気することによって製造した)2mLを使用して円錐形ガラスバイアル中に溶出した。この溶液を窒素気流下に開放ガラスバイアル中、130℃で乾燥した。残留水を除去するため、アセトニトリル1.0mLを加え、溶液を再度乾燥した。この最終工程を2回反復し、残余の固体残留物を、前駆体メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−[(メチルスルホニル)オキシ]−L−ノルロイシナート(37)3.0mgをも含有する2−メチル−2−ブタノール150μLに再溶解した。このガラスバイアルに蓋をし、120℃で30分間加熱した。冷却後、反応混合物をアセトニトリル/水(9.5/0.5 v/v)10mLで希釈し、前処理したC18 Plusカートリッジに入れ、30mLの水で洗浄した。1.2mLアセトニトリルにより活性がカートリッジから第二の円錐形ガラスバイアルに溶出し、2N水酸化ナトリウム500μLを加えた。このガラスバイアルを被蓋せずに80℃で10分間加熱した。冷却後、反応混合物を水9mLで希釈し、前処理したC18 Plusカートリッジに入れ、5mLの水で2回洗浄した。1.5mLアセトニトリルにより活性がカートリッジから第三の円錐形ガラスバイアルに溶出し、穏やかな窒素気流下に開放バイアル中、130℃で蒸発させた。残留水を除去するため、アセトニトリル1.0mLを加え、溶液を再度乾燥した。この最終工程を1回反復し、固体残留物を、エタノール500μLに再溶解した。パラジウム炭素(Pd/C)(10%)3mg及び固体蟻酸アンモニウム4mgを加えた後、蓋をしたこのガラスバイアルを70℃で30分間加熱した。冷却した反応混合物を、Pd/Cを除去するために4mmHPLCシリンジフィルターを通過させて第四の円錐形ガラスバイアルに入れた。次に、濾液に4N塩酸500μLを加え、被蓋ガラスバイアル中でこの溶液を再度80℃で5分間加熱した。冷却した反応混合物を4N水酸化ナトリウム(pH6〜8)で最後に中和し、濾過滅菌すると、73〜97MBqの最終トレーサーが、約210分間の合成時間後に、放射化学収率14±7%、放射化学純度92〜97%で得られた。
【0362】
4−フルオロ−L−オルニチン(2)の合成:
【化47】

【0363】
保護(S)−アリルグリシン(40)のヨードフッ素化によって4−ある悪露−L−オルニチン(2)の合成を達成した(例えばM. Kuroboshi et al., Tetrahedron Lett. 1991, 32(9), 1215)。臭素フッ素化のように第2級フッ素官能性を導く他のハロフッ素化反応をこの工程に利用することもできる。(例えばJ. B. Hester et al., J. Med. Chem. 2001, 44(7), 1099)。次いで末端ヨード基を窒素求核試薬としてのアジドで置換した。この他に、フタルイミド又はベンジルアミドのような別の窒素求核試薬をこの変換に利用することもできる。アジ時の還元並びにα−アミン感応性及びカルボキシ基の脱保護によって4−フルオロ−L−オルニチン(2)を得た。
【0364】
ベンジル(2S)−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)ペンタ−4−エノアート(4)の合成:
【化48】

【0365】
乾燥テトラヒドロフラン(10mL)中の(S)−アリルグリシン(100mg、0.87mmol)、N−カルベトキシフタルイミド(200mg、0.91mmol)及びトリエチルアミン(0.17mL、1.22mmol)の溶液を還流下に14撹拌した。硫酸ナトリウムで乾燥後、溶媒を減圧留去した。
【0366】
残留物をアセトン(3mL)に溶解し、炭酸カリウム(532mg、3.85mmol)及びベンジルブロミド(0.17mL、1.41mmol)を加えた。混合物をマイクロ波を照射しながら60℃で2時間加熱し、冷却し、セライトで濾過した。溶媒を減圧除去し、粗生成物をカラムクロマトグラフィー(SiO2、ヘキサン/酢酸エチル勾配)で精製すると、標記化合物が得られた。収量:151mg、70%。
【0367】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 2.96 - 3.11 (m, 2H), 4.96 - 5.25 (m, 5H), 5.64 - 5.78 (m, 1H), 7.24 - 7.37 (m, 5H), 7.70 - 7.88 (m, 4H)。
MS (ESIpos): m/z = 336 [M+H]+。
【0368】
ベンジル(2S)−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロ−5−ヨード−ペンタノアート(41)の合成:
【化49】

【0369】
乾燥ジ塩素メタン(10mL)中の(40)(500mg、1.49mmol)及びテトラ−N−ブチルアンモニウム 三フッ化二水素(2.33mL、7.46mmol)の溶液にN−ヨードスクシンイミド(671mg、2.98mmol)を室温で2時間かけて少しずつ加え、反応混合物をこの温度でさらに20時間攪拌した。次いで混合物を酢酸エチルで希釈し、飽和重炭酸ナトリウム溶液、ブラインで洗浄し、硫酸マグネシウムで乾燥した。溶媒を除去した後、粗生成物をカラムクロマトグラフィー(SiO2、ヘキサン/酢酸エチル勾配)で精製して標記化合物を得た。収量:126mg、18%。
【0370】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 2.45 - 3.08 (m, 2H), 3.31 (dd, 2H), 4.31 - 4.73 (m, 1H), 5.07 - 5.30 (m, 3H), 7.20 - 7.39 (m, 5H), 7.72 - 7.91 (m, 4H)。
19F-NMR (376MHz, 塩素ホルム-d): δ [ppm]= -173.46 (m)。
MS (ESIpos): m/z = 482 [M+H]+。
【0371】
ベンジル(2S)−5−アジド−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロ−ペンタノアート(42)の合成:
【化50】

【0372】
乾燥ジメチルホルムアミド(10mL)中の(41)(110mg、0.23mmol)及びアジドナトリウム(74.3mg、1.14mmol)の溶液を、マイクロ波照射しながら80℃で3時間加熱した。室温に冷却した後、反応混合物を酢酸エチルで希釈し、飽和重炭酸ナトリウム溶液及びブラインで洗浄し、減圧濃縮した。粗生成物をカラムクロマトグラフィー(SiO2、ヘキサン/酢酸エチル勾配)で精製して標記化合物を得た。収量:73mg、81%。
【0373】
1H-NMR (300MHz, 塩素ホルム-d): δ [ppm]= 2.39 - 2.75 (m, 2H), 3.34 - 3.50 (m, 2H), 4.40 - 4.72 (m, 1H), 5.03 - 5.25 (m, 3H), 7.18 - 7.41 (m, 5H), 7.69 - 7.95 (m, 4H)。
MS (ESIpos): m/z = 397 [M+H]+。
【0374】
(2S)−5−アミノ−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロ−ペンタン酸(43)の合成:
【化51】

【0375】
メタノール(5mL)中の(42)(110mg、0.278mmol)及びパラジウム(33mg、活性炭上10%、31μmol)の混合物を水素雰囲気下に室温で3時間攪拌した。次にこの混合物をセライトで濾過し、濾過ケーキをさらなるメタノールで洗浄し、濾液を減圧濃縮した。収量:35.0mg、45%。
【0376】
1H-NMR (400MHz, 酸化ジュウテリウム): δ [ppm]= 2.25 - 2.62 (m, 2H), 3.13 - 3.41 (m, 2H), 4.78 - 4.87 (m, 1H), 4.91 - 5.14 (m, 1H), 7.76 - 7.89 (m, 4H)。
19F-NMR (376MHz, 酸化ジュウテリウム): δ [ppm]= -191.17 (m, 0.5 F), -191.71 (m, 0.5 F)。
MS (ESIpos): m/z = 281 [M+H]+。
【0377】
バイオデータ
実施例(38) (5R)−[18F]−フルオロメチル−L−オルニチン
(5R)−[18F]−フルオロメチル−L−オルニチン(38)の特異性を決定するため、このフッ素化化合物を、競合用に過剰のL−オルニチン(1mM)を使用するA549(ヒトNSCLC)及びH460(ヒトNSCLC)腫瘍細胞における細胞競合実験においてトレーサーとして使用した。驚くべきことに、(5R)−[18F]−フルオロメチル−L−オルニチンの取り込みは過剰のL−オルニチンにより遮断可能であり、このことは、同じ輸送系が取り込みに使用されていることを示すものであった(図1)。
【0378】
第二の実験では、幾つかの腫瘍セルラインへの(5R)−[18F]−フルオロメチル−L−オルニチンの結合の時間依存性を、A549、H460並びにPC3(前立腺)及びDU145(前立腺)腫瘍セルラインを用いて決定した。0.25MBqで30分間インキュベーションした後に、適用量の最大5%(PC3細胞)が細胞に結合した(図2)。
【0379】
実施例(31)(3R)−3−フルオロ−L−オルニチン−ジヒドロクロリド
(3R)−3−フルオロ−L−オルニチン−ジヒドロクロリド(31)を、14C−オルニチンをトレーサーに用いる細胞競合実験に使用した。3−フルオロオルニチンはA549細胞において14C−オルニチンの取り込みを大幅に遮断できることが発見された(図3)。
【0380】
実施例(29) 腫瘍細胞における(4S)−[18F]−フルオロ−L−オルニチンの生物活性の決定
(4S)−[18F]−フルオロ−L−オルニチン(29)の特異性を決定するため、このフッ素化化合物を、A549及びPC3腫瘍細胞における過剰のL−オルニチン(1mM)に対する細胞競合実験においてトレーサーとして使用した。興味深いことに、(4S)−[18F]−フルオロ−L−オルニチンの取り込みは過剰のオルニチンにより遮断可能であり、このことは、同じ取り込み系の使用を示すものであった(図4)。
【0381】
第二の実験では、A549及びPC3細胞を(4S)−[18F]−フルオロ−L−オルニチンと共に最長60分間インキュベートし、細胞に結合した割合を測定した。60分間のインキュベーション時間の間に適用量のおよそ5%が細胞により取り込まれた(図5)。
【0382】
第三の実験では、腫瘍細胞における活性の保持を調べた。A549細胞を(4S)−[18F]−フルオロ−L−オルニチンと共に30分間インキュベートした。この時間の後、細胞を新たな緩衝液(放射性トレーサーを含まない)と共に最長30分間インキュベートした。上清への放射能の放出及び細胞内部への保持を調べた。流出条件下で30分の後、活性のおよそ66%が腫瘍細胞に保持されていた(図6)。
【0383】
動物実験。(4S)−[18F]−フルオロ−L−オルニチンをNCI−H460(ヒトNSCLC)腫瘍を持つラットにおいてPET造影を用いて調べた。放射性トレーサー(7.16MBq)を30分間投与した45分後からPET画像を取得した。腫瘍は極めて良好に視覚化され、腫瘍1グラムにつき最大2.2%の注射用量がROI解析によって決定された。より遅い時点では若干の部分的脱フッ素化が観察され、放出された[F18]−フッ化物が骨に取り込まれる結果となった(図7)。PET造影実験の後(98分のp.i.)ラットを殺し、幾つかの臓器を摘出し、組織の放射能の量を測定した。表1を参照されたい。腫瘍(1.43% ID/g)、膵臓(2.47% ID/g)及び骨(2.08% ID/g)に高い量の放射能が観察された。
【0384】
【表1】

【特許請求の範囲】
【請求項1】
式Iの化合物:
【化1】

[式中、
R1、R2及びR3は、
a)水素、
b)R7−C1−C10アルコキシ、
c)R7−C1−C10アルキル、
d)R7−C2−C10アルケニル、
e)R7−C2−C10アルキニル、
f)(R7−アリール)−C0−C10アルキル、
g)(R7−ヘテロアリール)−C0−C10アルキル、
h)((R7−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
i)R7、
j)ヒドロキシ、
k)C6−C10アラルキル、
l)C1−C10アルキル、及び、
m)C1−C10アルコキシ、
を含む群から独立且つ個別に選択され;
R4は、
a)NH2、及び、
b)R14、
を含む群から選択され;
R5は、
a)水素、
b)Z、及び、
c)R13、
を含む群から選択され;
R6は、
a)NH2、及び、
b)R14、
を含む群から選択され;
R7は、
a)[19F]フルオロ、
b)無キレート剤放射性核種、
c)R15、及び、
d)R10、
を含む群から選択され;
R10は、R20及びR30を含む群から選択され;
R15は、脱離基であり;
R14は、
a)N(H)(R9)、
b)N(R9)2、
c)N=C(R11)(R12)、
d)1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル(フタルイミド)、及び、
e)アジド基、
を含む群から選択され;
R13は、カルボン酸保護基であり;
R20は、
a)ヨード、
b)−Sn((C1−C6)アルキル)3、
c)−B(OR60)(OR61)[式中、Bは硼素を意味する]、及び、
d)−NMe2、
を含む群から選択され;
R30は、ヒドロキシであり;
Zは、金属イオン等価物であり;
R9は、アミノ保護基であり;
R11及びR12は、
a)C1−C5アルキル、
b)置換又は非置換アリール、
c)置換又は非置換アラルキル、及び、
d)置換又は非置換ヘテロアリール、
を含む群から独立且つ個別に選択され;
R60及びR61は、水素、(C1−C6)アルキル及びシクロアルキルを含む群から独立且つ個別に選択され;ここで、R60及びR61は、単結合又は「メチレン橋」により相互に連結されていてもよく;
kは、1〜4の整数である]であって、
前記化合物の全異性体型を包含し、前記全異性体型は、限定されるものではないが、エナンチオマー及びジアステレオマー並びにラセミ混合物を包含する、化合物、並びに医薬的に許容されるその塩、エステル、アミド、複合体又はプロドラッグ。
【請求項2】
R1、R2及びR3が、
a)水素、
b)R7−C1−C6アルキル、
c)R7、及び、
d)C1−C5アルキル、
を含む群から個別且つ独立に選択され、
但し、式Iの化合物がR7を1個のみ有する、請求項1に記載の化合物。
【請求項3】
R7が無キレート剤放射性核種である、請求項2に記載の化合物。
【請求項4】
無キレート剤放射性核種が、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]又はフッ素−18[18F]、好ましくはフッ素−18[18F]である、請求項3に記載の化合物。
【請求項5】
Zが、Na+、K+、Ca2+及びMg2+を含む群から選択される、請求項1に記載の化合物。
【請求項6】
相互に独立に、
kが1又は2の整数であり、
nが1又は2の整数である、
請求項1〜5の何れか1項に記載の化合物。
【請求項7】
(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−ヒドロキシ−L−オルニチナート(26)
【化2】

(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−[(メチルスルホニル)オキシ]−L−オルニチナート(27)
【化3】

(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−{[(4−メチルフェニル)スルホニル]オキシ}−L−オルニチナート(28)
【化4】

(4S)−[18F]−フルオロ−L−オルニチン(29)
【化5】

(3R)−N2,N5−ビス(tert−ブトキシカルボニル)−3−フルオロ−L−オルニチナート(30)
【化6】

(3R)−3−フルオロ−L−オルニチン(31)
【化7】

メチル−(5S)−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−5−ヒドロキシ−L−ノルロイシナート(34)
【化8】

メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−L−ノルロイシナート(35)
【化9】

メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−ヒドロキシ−L−ノルロイシナート(36)
【化10】

(5R)−[18F]−フルオロメチル−L−オルニチン(38)
【化11】

(2S)−5−アミノ−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロペンタン酸(43)
【化12】

ベンジル(2S)−5−アジド−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロペンタノアート(42)
【化13】

【化14】

4−(18F)フルオロ−L−オルニチン
【化15】

3−(18F)フルオロ−L−オルニチン
【化16】

5−アミノ−6−(18F)フルオロ−L−ノルロイシン
から選択される、請求項1に記載の化合物。
【請求項8】
請求項1に記載の式Iの化合物又は医薬的に許容されるその無機又は有機酸の塩、その水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグと、医薬的に許容される担体、希釈剤、賦形剤又はアジュバントとを含む医薬組成物。
【請求項9】
参照化合物、医薬又は放射性医薬品として使用するための、請求項1〜7の何れか1項に記載の式Iの化合物。
【請求項10】
造影剤として使用するための、請求項1〜7の何れか1項に記載の式Iの化合物。
【請求項11】
PET、SPECT又はマイクロPET造影に適した、又は、過剰増殖性疾患のコンピューター断層撮影(CT)及び磁気共鳴(MR)分光法等の他の従来の造影法との組み合わせに適した、請求項10に記載の造影剤。
【請求項12】
R7が無キレート剤放射性核種又は[19F]である式Iの化合物を取得する方法であって、R7が脱離基である式Iの化合物を適当な標識剤と反応させることによる方法。
【請求項13】
式Ibの化合物:
【化17】

を取得する方法であって、
式V:
【化18】

の化合物を、R86を含む標識剤と反応させて、式IVの化合物:
【化19】

を生成し、この式IVの化合物を、式VIの化合物:
【化20】

で置換し、
任意により、アミン−及び/又はカルボキシ−保護基を脱保護することによる、方法
[但し、式中、
式Ibは以下のように定義され:
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種又は[19F]であり、
R4、R5、R6、及びkは前記と同義であり;
式Vは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり;
式IVは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり、
R86は無キレート剤放射性核種又は[19F]であり;
式VIは以下のように定義され:
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]。
【請求項14】
式Ibの化合物:
【化21】

[式中、
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種又は[19F]であり、
R4、R5、R6、及びkは前記と同義である]であって、
前記化合物の全異性体型を包含し、前記全異性体型は、限定されるものではないが、エナンチオマー及びジアステレオマー並びにラセミ混合物を包含する、化合物、並びに医薬的に許容されるその塩、エステル、アミド、複合体又はプロドラッグ。
【請求項15】
式VIの化合物:
【化22】

[式中、
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]であって、
前記化合物の全異性体型を包含し、前記全異性体型は、限定されるものではないが、エナンチオマー及びジアステレオマー並びにラセミ混合物を包含する、化合物、並びに医薬的に許容されるその塩、エステル、アミド、複合体又はプロドラッグ。
【請求項16】
所定量の化合物を含む密封バイアルを含むキットであって、前記化合物が、
a)請求項1に記載の式Iの化合物、又は、
b)請求項13に定義される式Vの化合物、請求項15に定義される式VIの化合物、又はそれらの混合物である、キット。
【請求項17】
式Iの化合物であって、R1〜R6が前記と同義であり、R7がR15であり、R4がR14であり、R5がR13であり、これらが前記と同義である、化合物を取得する方法。
【請求項18】
過剰増殖性疾患の進行を病期診断・監視し、又は、過剰増殖性疾患の治療に対する反応を監視する方法であって、請求項1〜7、15及び17に記載の化合物を使用する方法。
【請求項1】
式Iの化合物:
【化1】

[式中、
R1、R2及びR3は、
a)水素、
b)R7−C1−C10アルコキシ、
c)R7−C1−C10アルキル、
d)R7−C2−C10アルケニル、
e)R7−C2−C10アルキニル、
f)(R7−アリール)−C0−C10アルキル、
g)(R7−ヘテロアリール)−C0−C10アルキル、
h)((R7−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
i)R7、
j)ヒドロキシ、
k)C6−C10アラルキル、
l)C1−C10アルキル、及び、
m)C1−C10アルコキシ、
を含む群から独立且つ個別に選択され;
R4は、
a)NH2、及び、
b)R14、
を含む群から選択され;
R5は、
a)水素、
b)Z、及び、
c)R13、
を含む群から選択され;
R6は、
a)NH2、及び、
b)R14、
を含む群から選択され;
R7は、
a)[19F]フルオロ、
b)無キレート剤放射性核種、
c)R15、及び、
d)R10、
を含む群から選択され;
R10は、R20及びR30を含む群から選択され;
R15は、脱離基であり;
R14は、
a)N(H)(R9)、
b)N(R9)2、
c)N=C(R11)(R12)、
d)1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル(フタルイミド)、及び、
e)アジド基、
を含む群から選択され;
R13は、カルボン酸保護基であり;
R20は、
a)ヨード、
b)−Sn((C1−C6)アルキル)3、
c)−B(OR60)(OR61)[式中、Bは硼素を意味する]、及び、
d)−NMe2、
を含む群から選択され;
R30は、ヒドロキシであり;
Zは、金属イオン等価物であり;
R9は、アミノ保護基であり;
R11及びR12は、
a)C1−C5アルキル、
b)置換又は非置換アリール、
c)置換又は非置換アラルキル、及び、
d)置換又は非置換ヘテロアリール、
を含む群から独立且つ個別に選択され;
R60及びR61は、水素、(C1−C6)アルキル及びシクロアルキルを含む群から独立且つ個別に選択され;ここで、R60及びR61は、単結合又は「メチレン橋」により相互に連結されていてもよく;
kは、1〜4の整数である]であって、
前記化合物の全異性体型を包含し、前記全異性体型は、限定されるものではないが、エナンチオマー及びジアステレオマー並びにラセミ混合物を包含する、化合物、並びに医薬的に許容されるその塩、エステル、アミド、複合体又はプロドラッグ。
【請求項2】
R1、R2及びR3が、
a)水素、
b)R7−C1−C6アルキル、
c)R7、及び、
d)C1−C5アルキル、
を含む群から個別且つ独立に選択され、
但し、式Iの化合物がR7を1個のみ有する、請求項1に記載の化合物。
【請求項3】
R7が無キレート剤放射性核種である、請求項2に記載の化合物。
【請求項4】
無キレート剤放射性核種が、臭素−77[77Br]、臭素−76[76Br]、酸素−15[15O]、窒素−13[13N]、炭素−11[11C]、ヨウ素−123[123]ヨード、ヨウ素−124[124ヨード]、ヨウ素−125[125ヨード]、ヨウ素−127[127ヨード]、ヨウ素131[131ヨード]又はフッ素−18[18F]、好ましくはフッ素−18[18F]である、請求項3に記載の化合物。
【請求項5】
Zが、Na+、K+、Ca2+及びMg2+を含む群から選択される、請求項1に記載の化合物。
【請求項6】
相互に独立に、
kが1又は2の整数であり、
nが1又は2の整数である、
請求項1〜5の何れか1項に記載の化合物。
【請求項7】
(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−ヒドロキシ−L−オルニチナート(26)
【化2】

(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−[(メチルスルホニル)オキシ]−L−オルニチナート(27)
【化3】

(4R)−N5−[(ベンジルオキシ)カルボニル]−N2−(tert−ブトキシカルボニル)−4−{[(4−メチルフェニル)スルホニル]オキシ}−L−オルニチナート(28)
【化4】

(4S)−[18F]−フルオロ−L−オルニチン(29)
【化5】

(3R)−N2,N5−ビス(tert−ブトキシカルボニル)−3−フルオロ−L−オルニチナート(30)
【化6】

(3R)−3−フルオロ−L−オルニチン(31)
【化7】

メチル−(5S)−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−5−ヒドロキシ−L−ノルロイシナート(34)
【化8】

メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−{[tert−ブチル(ジメチル)シリル]オキシ}−L−ノルロイシナート(35)
【化9】

メチル−(5R)−5−アジド−N−(tert−ブトキシカルボニル)−6−ヒドロキシ−L−ノルロイシナート(36)
【化10】

(5R)−[18F]−フルオロメチル−L−オルニチン(38)
【化11】

(2S)−5−アミノ−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロペンタン酸(43)
【化12】

ベンジル(2S)−5−アジド−2−(1,3−ジオキソ−1,3−ジヒドロ−2H−イソインドール−2−イル)−4−フルオロペンタノアート(42)
【化13】

【化14】

4−(18F)フルオロ−L−オルニチン
【化15】

3−(18F)フルオロ−L−オルニチン
【化16】

5−アミノ−6−(18F)フルオロ−L−ノルロイシン
から選択される、請求項1に記載の化合物。
【請求項8】
請求項1に記載の式Iの化合物又は医薬的に許容されるその無機又は有機酸の塩、その水和物、複合体、エステル、アミド、溶媒和物又はプロドラッグと、医薬的に許容される担体、希釈剤、賦形剤又はアジュバントとを含む医薬組成物。
【請求項9】
参照化合物、医薬又は放射性医薬品として使用するための、請求項1〜7の何れか1項に記載の式Iの化合物。
【請求項10】
造影剤として使用するための、請求項1〜7の何れか1項に記載の式Iの化合物。
【請求項11】
PET、SPECT又はマイクロPET造影に適した、又は、過剰増殖性疾患のコンピューター断層撮影(CT)及び磁気共鳴(MR)分光法等の他の従来の造影法との組み合わせに適した、請求項10に記載の造影剤。
【請求項12】
R7が無キレート剤放射性核種又は[19F]である式Iの化合物を取得する方法であって、R7が脱離基である式Iの化合物を適当な標識剤と反応させることによる方法。
【請求項13】
式Ibの化合物:
【化17】

を取得する方法であって、
式V:
【化18】

の化合物を、R86を含む標識剤と反応させて、式IVの化合物:
【化19】

を生成し、この式IVの化合物を、式VIの化合物:
【化20】

で置換し、
任意により、アミン−及び/又はカルボキシ−保護基を脱保護することによる、方法
[但し、式中、
式Ibは以下のように定義され:
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種又は[19F]であり、
R4、R5、R6、及びkは前記と同義であり;
式Vは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり;
式IVは以下のように定義され:
aは、0〜5の整数であり、
Bは脱離基であり、
R86は無キレート剤放射性核種又は[19F]であり;
式VIは以下のように定義され:
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]。
【請求項14】
式Ibの化合物:
【化21】

[式中、
R101、R102及びR103は、
a)水素、
b)((R86−(C1−C6)アルコキシ)アリール)(C0−C10)アルキル)、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
但し、式Ibの化合物は少なくとも1個のR86を含み、
R86は、無キレート剤放射性核種又は[19F]であり、
R4、R5、R6、及びkは前記と同義である]であって、
前記化合物の全異性体型を包含し、前記全異性体型は、限定されるものではないが、エナンチオマー及びジアステレオマー並びにラセミ混合物を包含する、化合物、並びに医薬的に許容されるその塩、エステル、アミド、複合体又はプロドラッグ。
【請求項15】
式VIの化合物:
【化22】

[式中、
R201、R202及びR203は、
a)水素、
b)((R8−アリール)(C0−C10)アルキル、
c)ヒドロキシ、
d)C6−C10アラルキル、
e)C1−C10アルキル、及び
f)C1−C10アルコキシ、
を含む群から個別且つ独立に選択され、
R8はヒドロキシであり;
但し、式VIの化合物は少なくとも1個のR8を含み、
R4、R5、R6、及びkは前記と同義である]であって、
前記化合物の全異性体型を包含し、前記全異性体型は、限定されるものではないが、エナンチオマー及びジアステレオマー並びにラセミ混合物を包含する、化合物、並びに医薬的に許容されるその塩、エステル、アミド、複合体又はプロドラッグ。
【請求項16】
所定量の化合物を含む密封バイアルを含むキットであって、前記化合物が、
a)請求項1に記載の式Iの化合物、又は、
b)請求項13に定義される式Vの化合物、請求項15に定義される式VIの化合物、又はそれらの混合物である、キット。
【請求項17】
式Iの化合物であって、R1〜R6が前記と同義であり、R7がR15であり、R4がR14であり、R5がR13であり、これらが前記と同義である、化合物を取得する方法。
【請求項18】
過剰増殖性疾患の進行を病期診断・監視し、又は、過剰増殖性疾患の治療に対する反応を監視する方法であって、請求項1〜7、15及び17に記載の化合物を使用する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2012−510958(P2012−510958A)
【公表日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願番号】特願2011−538875(P2011−538875)
【出願日】平成21年11月26日(2009.11.26)
【国際出願番号】PCT/EP2009/008419
【国際公開番号】WO2010/063403
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(300049958)バイエル ファーマ アクチエンゲゼルシャフト (357)
【Fターム(参考)】
【公表日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願日】平成21年11月26日(2009.11.26)
【国際出願番号】PCT/EP2009/008419
【国際公開番号】WO2010/063403
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(300049958)バイエル ファーマ アクチエンゲゼルシャフト (357)
【Fターム(参考)】
[ Back to top ]

