放射性標識ガリウム錯体、その合成法並びに悪性腫瘍におけるEGFR発現のPETイメージングにおける使用
マイクロ波活性化による放射性標識ガリウム錯体の標識合成法を提供する。得られたガリウム同位体標識化合物は、放射性医薬品として、特に陽電子放射断層撮影(PET)での使用に有用である。PETを用いて腫瘍でのEGFRの過剰発現をイメージングする方法も提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、放射性標識ガリウム錯体及びその合成法に関する。本発明の放射性標識ガリウム錯体は、特に陽電子放射断層撮影(PET)用の放射性医薬品として有用である。これらは悪性腫瘍における上皮増殖因子受容体(EGFR)発現の検出に特に有用である。
【背景技術】
【0002】
HER1及びErbB−1としても知られる上皮増殖因子受容体(EGFR)は、チロシンキナーゼ受容体ファミリーに属する膜貫通型タンパク質である。EGFRの活性化は、細胞分裂、運動性の増加及びアポトーシスの抑制を導くシグナル伝達を惹起する(非特許文献1)。数多くの癌腫において、EGFR遺伝子の増幅又は転位置は、転写の増加とその後の高レベルのEGFR発現を惹起する(非特許文献2、非特許文献3)。乳癌(非特許文献4、非特許文献5)、肺癌(非特許文献6)及び膀胱癌(非特許文献7)でEGFRの過剰発現が報告されている。高水準のEGFR発現は、細胞の増殖及び転移の広がりが増し、アポトーシスが減少することによって悪性細胞の生存に好都合であるとも考えられる。現在のところ、EGFRシグナル伝達の不活性化によって腫瘍成長を抑制する数多くの取組みが臨床で使用又は盛んに臨床試験されている。これらの取組みは、EGFRの細胞外領域にリガンドが結合するのを抗EGFR抗体を用いて遮断するか、或いは選択的チロシンキナーゼ阻害剤で細胞内シグナル伝達を阻止するかのいずれかに基づくものである(非特許文献8)。
【0003】
腫瘍におけるEGFR発現の検出が予後値及び予測値として報告されている。EGFRの過剰発現が、結腸癌(非特許文献9)、直腸癌(非特許文献10)、非小細胞肺癌(非特許文献11)及び乳癌(非特許文献5、非特許文献12)での低い生存率及び再発と関連していることが報告されている。EGFRの発現状態によって、術前化学療法及び放射線療法後の成果の乏しい進行上咽頭癌に属する患者のサブグループを確認できると示唆されている(非特許文献13)。EGFRの発現がヒト前立腺癌での疾患再発及びアンドロゲン非依存性への進行と関連することが明らかにされている(非特許文献14)。実際の診療でのEGFRの検出がEGFRを標的とした薬物の使用の妥当性の問題を始めとする患者管理に影響する可能性があることは明らかである。
【0004】
EGFRの検出は、外科試料又は穿刺生検試料で免疫組織化学的検査又はFISH法を用いて可能である。しかし、核医学画像化は、原発腫瘍及び腫瘍転移を全体的に評価でき、サンプリングエラー及びEGFR発現の不均一性に付随する偽陰性の結果を避けることができるという利点があると考えられる。
【0005】
インジウム−111標識抗EGFR抗体425が、悪性神経膠腫の検出に成功裡に用いられている(非特許文献15)。Tc−99m−標識抗EGFRヒト化抗体hR3及びC225は臨床評価の段階にある(非特許文献16、非特許文献17)。ただし、嵩高い抗体タンパク質の使用は、健常組織を通しての腫瘍への放射性コンジュゲートの拡散が難しくなるおそれがある。抗EGFR抗体に代わるものとして、腫瘍細胞に放射性核種を送達するためのターゲティングベクターとして天然リガンドである上皮増殖因子(EGF)を用いることが考えられる(非特許文献17)。EGFは分子量(6.2kDa)が小さいので、腫瘍への速い浸透及び速い血液クリアランスが可能となり、良好なコントラストの画像を得ることができると考えられる。従前、131I−標識EGFが肺癌の画像化に成功裡に用いられている(非特許文献18)。しかし、放射性ハロゲンは細胞保持が不十分なため、腫瘍での蓄積が減少し、画像コントラストも最適とはいいがたいので、EGFの標識には放射性金属を使用した方がよい選択となり得る(非特許文献19)。EGFに対して様々な単一光子放射性金属標識が提案されている。モノアミドDTPA(非特許文献19、非特許文献20)又はイソチオシアネート−ベンジル−DTPA(非特許文献21)を用いてEGFに111In(T1/2=2,8d)が結合されている。ジェネレータ生成99mTc(T1/2=6h)によるEGFの標識にMAG3(非特許文献22)、導入SH基(非特許文献23)又はHYNIC(Tolmachev、未発表データ)が利用されている。しかし、陽電子放射断層撮影(PET)の方が、SPECTと比較して、感度、解像度及び数量化の点で優れた検出技術であるので、EGFに陽電子放射標識を使用した方が有利であるとも考えられる(非特許文献24、非特許文献25)。
【0006】
PETイメージングは、陽電子を放出する放射性トレーサー分子を用いた核断層撮影技術である。陽電子が電子と遭遇すると、それらは消滅してガンマ線としてエネルギーを放出し、これをPETスキャナーで検出する。トレーサー分子として体内で用いられる天然物質を使用すると、PETは体内の構造に関する情報を与えるだけでなく体又は体内の特定領域の生理的機能に関する情報も与える。一般的なトレーサー分子は例えば天然のグルコースと類似した2−フルオロ−2−デオキシ−D−グルコース(FDG)に18F原子を付加したものである。陽電子放出フッ素から発生するガンマ線はPETスキャナーで検出され、体の特定領域又は組織(例えば脳又は心臓)におけるFDGの代謝を示す。トレーサー分子の選択は、何をスキャンすべきかによって左右される。一般に、トレーサーは重要な領域に蓄積又はある種の組織(例えば癌細胞)に選択的に取り込まれるものが選択される。スキャニングは、放射性トレーサー分子が問題とする生化学過程に入る時間間隔後に得られた一連の動的又は静止画像のいずれかからなる。スキャナーはトレーサー分子の空間的及び時間的分布を検出する。PETは、放射性トレーサー分子の局所濃度を測定できる定量的イメージング法でもある。
【0007】
PETトレーサーに常用される放射性核種は、11C、18F、15O、13N又は76Brである。近年、二官能性キレート剤と放射性金属とを含む放射性標識金属錯体に基づく新たなPETトレーサーが製造されている。二官能性キレート剤は金属イオンに配位しているとともに、患者体内の標的部位に結合するターゲティングベクターと連結したキレート剤である。かかるターゲティングベクターとしては、ある種の受容体、大抵は体内の特定の領域又は疾患に関連した受容体と結合するペプチドがある。ターゲティングベクターは、例えば活性化した腫瘍遺伝子に特異的なオリゴヌクレオチドで、腫瘍の位置特定のためのオリゴヌクレオチドであってもよい。かかる錯体の利点は、例えば68Ga、213Bi又は86Yなどの様々な放射性金属で二官能性キレート剤を標識できることである。こうして、特殊な特性をもつ放射性標識錯体を特定の用途のために「仕立てる」ことができる。
【0008】
68Gaは、PETイメージングでトレーサー分子として用いられるGa−放射性標識金属錯体の製造に特に重要である。68Gaは68Ge/68Gaジェネレータから得られ、サイクロトロンを一切必要としない。68Gaは2.92MeVの陽電子放出によって89%まで崩壊し、その半減期68分は、不必要な放射線なしでインビボでの数多くの生化学過程を追跡するのに十分である。68Gaはその+IIIの酸化状態で各種のキレート剤と安定な錯体を形成し、68Gaトレーサーは脳、腎臓、骨組織、血液プール、肺及び腫瘍のイメージングに用いられている。
【0009】
この核種の短い半減期はEGFの速い血液クリアランスに適合する。DOTA又はNOTAのような大環状キレート剤の誘導体の使用によって、ソマトスタチンの類似体及びオリゴヌクレオチドの安定ガリウム標識が得られている(非特許文献26、非特許文献27、非特許文献28、非特許文献29、非特許文献30、非特許文献31)。非環状キレート剤での初期の実験から、それらをEGFに結合しても、その受容体に対するEGF結合親和性が低減しないことが明らかにされている。こうした理由から、EGFへのDOTAのカップリングがガリウムでの標識に適した方法を与えるかもしれない。しかし、先行技術には、これらの科学的知見を腫瘍におけるEGFR過剰発現のイメージングにどのように用いるかについてなんら示唆又は教示されていない。
【0010】
そこで、医学界では、腫瘍におけるEGFR過剰発現を検出するための非侵襲性PETトレーサーが長い間待望されていた。かかるトレーサーは、高感度でのインビボ非侵襲性PET法の開発に極めて有用であろう。多くの癌腫でのEGFRの過剰発現の検出は重要な診断情報を与え、患者管理に影響を及ぼす可能性がある。従って、EGFRの天然リガンドに基づく陽電子放出トレーサーの製造方法、ヒト組換え上皮増殖因子(hEGF)及び腫瘍でのEGFR過剰発現のイメージングにおけるトレーサーの使用法を提供することが望ましい。
【0011】
本明細書における文献についての説明又は引用は、これらの文献が本発明の先行技術であることを是認するもの解釈すべきではない。
【非特許文献1】Yarden Y, Sliwkowski MX. Untangling the ErbB signaling network. Nat Rev Mol Cell Biol. 2001; 2(2): 127-137
【非特許文献2】Collins VP. Amplified genes in human gliomas. Semin Cancer Biol. 1993; 4(1): 27-32
【非特許文献3】Bigner SH, Burger PC, Wong AJ, et al. Gene amplification in malignant human gliomas: clinical and histopathologic aspects. J Neuropathol Exp Neurol. 1988; 47(3): 191-205
【非特許文献4】Walker RA, Dearing SJ. Expression of epidermal growth factor receptor mRNA and protein in primary breast carcinomas. Breast Cancer Res Treat. 1999; 53(2): 167-176
【非特許文献5】Witton CJ, Reeves JR, Going JJ, Cooke TG, Bartlett JM. Expression of the HER1-4 family of receptor tyrosine kinases in breast cancer. J Pathol. 2003; 200(3): 290-297
【非特許文献6】Hirsch FR, Varella-Garcia M, Bunn PA, Jr., et al. Epidermal growth factor receptor in non-small-cell lung carcinomas: correlation between gene copy number and protein expression and impact on prognosis. J Clin Oncol. 2003; 21(20): 3798-3807
【非特許文献7】Neal DE, Mellon K. Epidermal growth factor receptor and bladder cancer: a review. Urol Int. 1992; 48(4): 365-371
【非特許文献8】Castillo L, Etienne-Grimaldi MC, Fischel JL, Formento P, Magne N, Milano G. Pharmacological background of EGFR targeting. Ann Oncol. 2004; 15(7): 1007-1012
【非特許文献9】Resnick MB, Routhier J, Konkin T, Sabo E, Pricolo VE. Epidermal growth factor receptor, c-MET, beta-catenin, and p53 expression as prognostic indicators in stage II colon cancer: a tissue microarray study. Clin Cancer Res. 2004; 10(9): 3069-3075
【非特許文献10】Kopp R, Rothbauer E, Mueller E, Schildberg FW, Jauch KW, Pfeiffer A. Reduced survival of rectal cancer patients with increased tumor epidermal growth factor receptor levels. Dis Colon Rectum. 2003; 46(10): 1391-1399
【非特許文献11】Selvaggi G, Novello S, Torri V, et al. Epidermal growth factor receptor overexpression correlates with a poor prognosis in completely resected non-small-cell lung cancer. Ann Oncol. 2004; 15(1): 28-32
【非特許文献12】Tsutsui S, Kataoka A, Ohno S, Murakami S, Kinoshita J, Hachitanda Y. Prognostic and predictive value of epidermal growth factor receptor in recurrent breast cancer. Clin Cancer Res. 2002; 8(11): 3454-3460
【非特許文献13】Chua DT, Nicholls JM, Sham JS, Au GK. Prognostic value of epidermal growth factor receptor expression in patients with advanced stage nasopharyngeal carcinoma treated with induction chemotherapy and radiotherapy. Int J Radiat Oncol Biol Phys. 2004; 59(1): 11-20
【非特許文献14】Di Lorenzo G, Tortora G, D'Armiento FP, et al. Expression of epidermal growth factor receptor correlates with disease relapse and progression to androgen-independence in human prostate cancer. Clin Cancer Res. 2002; 8(11): 3438-3444
【非特許文献15】Dadparvar S, Krishna L, Miyamoto C, et al. Indium-111-labeled anti-EGFr-425 scintigraphy in the detection of malignant gliomas. Cancer. 1994; 73(3 Suppl): 884-889
【非特許文献16】Vallis KA, Reilly RM, Chen P, et al. A phase I study of 99mTc-hR3 (DiaCIM), a humanized immunoconjugate directed towards the epidermal growth factor receptor. Nucl Med Commun. 2002; 23(12): 1155-1164
【非特許文献17】Schechter NR, Wendt RE, 3rd, Yang DJ, et al. Radiation dosimetry of 99mTc-labeled C225 in patients with squamous cell carcinoma of the head and neck. J Nucl Med. 2004; 45(10): 1683-1687
【非特許文献18】Cuartero-Plaza A, Martinez-Miralles E, Rosell R, Vadell-Nadal C, Farre M, Real FX. Radiolocalization of squamous lung carcinoma with 131I-labeled epidermal growth factor. Clin Cancer Res. 1996; 2(1): 13-20
【非特許文献19】Orlova A, Bruskin A, Sjostrom A, Lundqvist H, Gedda L, Tolmachev V. Cellular processing of (125)I- and (111)in-labeled epidermal growth factor (EGF) bound to cultured A431 tumor cells. Nucl Med Biol. 2000; 27(8): 827-835
【非特許文献20】Reilly RM, Gariepy J. Factors influencing the sensitivity of tumor imaging with a receptor-binding radiopharmaceutical. J Nucl Med. 1998; 39(6): 1036-1043
【非特許文献21】Sundberg AL, Orlova A, Bruskin A, et al. [(111)In]Bz-DTPA-hEGF: Preparation and in vitro characterization of a potential anti-glioblastoma targeting agent. Cancer Biother Radiopharm. 2003; 18(4): 643-654
【非特許文献22】Hnatowich DJ, Qu T, Chang F, Ley AC, Ladner RC, Rusckowski M. Labeling peptides with technetium-99m using a bifunctional chelator of a N-hydroxysuccinimide ester of mercaptoacetyltriglycine. J Nucl Med. 1998; 39(1): 56-64
【非特許文献23】Capala J, Barth RF, Bailey MQ, Fenstermaker RA, Marek MJ, Rhodes BA. Radiolabeling of epidermal growth factor with 99mTc and in vivo localization following intracerebral injection into normal and glioma-bearing rats. Bioconjug Chem. 1997; 8(3): 289-295
【非特許文献24】Lundqvist H, Lubberink M, Tolmachev V. Positron Emission Tomography. European Journal of Physics. 1999; 19: 537-552
【非特許文献25】Lundqvist H, Tolmachev V. Targeting peptides and positron emission tomography. Biopolymers. 2002; 66(6): 381-392
【非特許文献26】Hofmann M, Maecke H, Borner R, et al. Biokinetics and imaging with the somatostatin receptor PET radioligand (68)Ga-DOTATOC: preliminary data. Eur J Nucl Med. 2001; 28(12): 1751-1757
【非特許文献27】Ugur O, Kothari PJ, Finn RD, et al. Ga-66 labeled somatostatin analogue DOTA-DPhe1-Tyr3-octreotide as a potential agent for positron emission tomography imaging and receptor mediated internal radiotherapy of somatostatin receptor positive tumors. Nucl Med Biol. 2002; 29(2): 147-157
【非特許文献28】Eisenwiener KP, Prata MI, Buschmann I, et al. NODAGATOC, a new chelator-coupled somatostatin analogue labeled with [67/68Ga] and [111In] for SPECT, PET, and targeted therapeutic applications of somatostatin receptor (hsst2) expressing tumors. Bioconjug Chem. 2002; 13(3): 530-541
【非特許文献29】Froidevaux S, Eberle AN, Christe M, et al. Neuroendocrine tumor targeting: study of novel gallium-labeled somatostatin radiopeptides in a rat pancreatic tumor model. Int J Cancer. 2002; 98(6): 930-937
【非特許文献30】Velikyan I, Beyer GJ, Langstrom B. Microwave-supported preparation of (68)Ga bioconjugates with high specific radioactivity. Bioconjug Chem. 2004; 15(3): 554-560
【非特許文献31】Velikyan I, Lendvai G, Valila M, et al. Microwave accelerated Ga-68-labelling of oligonucleotides. Journal of Labelled Compounds & Radiopharmaceuticals. 2004; 47(1): 79-89
【発明の開示】
【課題を解決するための手段】
【0012】
本発明は、放射性標識ガリウム錯体の標識合成法であって、
(a)68Ga3+放射性同位体を用意し、
(b)68Ga3+放射性同位体をマイクロ波活性化を用いてキレート剤と反応させ、
(c)得られた放射性標識ガリウム錯体を回収すること
を含んでなる方法を提供する。
【0013】
本発明は、さらにPETトレーサーとしての放射性標識ガリウム錯体を提供する。本発明に係る好ましいトレーサーは68Ga−DOTA−hEGFである。
【0014】
さらに別の実施形態では、本発明は、また、放射性標識ガリウム錯体をヒトに投与することを含んでなる、腫瘍におけるEGFR過剰発現のイメージング法であって、上記放射性標識ガリウム錯体が陽電子放射断層撮影でイメージングできるものであり、陽電子放射断層撮影を行って腫瘍におけるEGFR過剰発現を検出する方法を提供する。さらに別の実施形態では、本発明は、68Gaを得るのに使用できるキット及び68Ga−放射性標識錯体の製造に使用できるキットを提供する。
【発明を実施するための最良の形態】
【0015】
本発明の目的の一つは、放射性医薬品として、特にPETでの使用に有用な放射性標識ガリウム錯体の合成法を提供することである。これらは、悪性腫瘍における上皮増殖因子受容体(EGFR)発現の検出に特に有用である。これは、本明細書に記載の方法で達成される。
【0016】
68Gaは68Ge/68Gaジェネレータから得られる。かかるジェネレータは当技術分野で公知であり、例えばC. Loc'h et al, J. Nucl. Med. 21, 1980, 171-173又はJ. Schuhmacher et al. Int. J. appl. Radiat. Isotopes 32, 1981, 31-36を参照されたい。68Geは、例えば20MeVプロトンでのGe2(SO4)3の照射によってサイクロトロン生産で得ることもできる。また、例えば0.5MのHCl中の68Geとしても市販されている。一般に、有機樹脂或いは二酸化スズ、二酸化アルミニウム又は二酸化チタンのような無機金属酸化物からなるカラムに68Geをローディングする。HCl水溶液によってカラムから68Gaが溶出し、68GaCl3が得られる。68Ga3+はその製造にサイクロトロンが不要で、その半減期68分は、長時間放射せずにPETイメージング法での多くのインビボ生化学過程の追跡に十分であるので本発明の方法で特に好ましい。
【0017】
68Ge/68Gaジェネレータに適したカラムは、二酸化アルミニウム、二酸化チタン又は二酸化スズのような無機酸化物、或いはフェノール性水酸基(米国特許第4264468号)又はピロガロール(J. Schuhmacher et al., Int. J. appl. Radiat. Isotopes 32, 1981, 31-36)を含む樹脂のような有機樹脂からなる。好ましい実施形態では、二酸化チタンを含むカラムを備える68Ge/68Gaジェネレータを本発明の方法に用いる。
【0018】
68Ge/68Gaジェネレータカラムからの68Gaの溶出に用いられるHCl水溶液の濃度はカラム材料によって左右される。68Gaの溶出には、0.05〜5MのHClが好適に使用される。好ましい実施形態では、溶出液は、二酸化チタンを含むカラムを備える68Ge/68Gaジェネレータから得られ、68Gaは0.05〜0.1MのHCl、好ましくは約0.1MのHClを用いて溶出される。
【0019】
本発明の方法の好ましい実施形態では、対イオンとしてHCO3−を含む強い陰イオン交換体、好ましくは対イオンとしてHCO3−を含む強い陰イオン交換体を用いる。別の好ましい実施形態では、陰イオン交換体は第四級アミン官能基を含む。さらに別の好ましい実施形態では、陰イオン交換体はポリスチレン−ジビニルベンゼン系の強い陰イオン交換樹脂である。特に好ましい実施形態では、本発明の方法で使用される陰イオン交換体は、対イオンとしてのHCO3−、第四級アミン基を含む強い陰イオン交換樹脂であり、樹脂はポリスチレン−ジビニルベンゼン系である。
【0020】
好適には、本発明の方法では、陰イオン交換体からの68Gaの溶出には水を用いる。
【0021】
本発明の方法で得られる68Gaは、好ましくは68Ga−放射性標識錯体の製造、好ましくは二官能性キレート剤(ターゲティングベクターと結合したキレート剤)を含む68Ga−放射性標識PETトレーサーの製造に用いられる。
【0022】
そこで、本発明の別の態様は、
a)68Ge/68Gaジェネレータからの溶出液を対イオンとしてHCO3−を含む陰イオン交換体と接触させ、陰イオン交換体から68Ga3+を溶出して68Gaを得て、
b)68Gaをキレート剤と反応させる
ことによって68Ga−放射性標識錯体を製造する方法である。
【0023】
本発明の方法での使用に好ましいキレート剤は、生理学的に認容性の形態の68Gaを与えるものである。さらに好ましいキレート剤は、放射性標識錯体を用いた診断検査に要する時間安定な68Ga錯体を形成するものである。
【0024】
適当なキレート剤は、例えばDTPA、EDTA、DTPA−BMA、DOA3、DOTA、NOTA、HP−DOA3、TMT又はDPDPのようなポリアミノポリ酸キレート剤である。これらのキレート剤は放射性医薬品及び放射線診断として周知である。これらの使用法及び合成は、例えば、米国特許第4647447号、同第5362475号、同第5534241号、同第5358704号、同第5198208号、同第4963344号、欧州特許出願公開第230893号、同第130934号、同第606683号、同第438206号、同第434345号、国際公開第97/00087号、同第96/40274号、同第96/30377号、同第96/28420号、同第96/16678号、同第96/11023号、同第95/32741号、同第95/27705号、同第95/26754号、同第95/28967号、同第95/28392号、同第95/24225号、同第95/17920号、同第95/15319号、同第95/09848号、同第94/27644号、同第94/22368号、同第94/08624号、同第93/16375号、同第93/06868号、同第92/11232号、同第92/09884号、同第92/08707号、同第91/15467号、同第91/10669号、同第91/10645号、同第91/07191号、同第91/05762号、同第90/12050号、同第90/03804号、同第89/00052号、同第89/00557号、同第88/01178号、同第86/02841号及び同第86/02005号に記載されている。
【0025】
適当なキレート剤としては、大環状キレート剤、例えばZhang et al., Inorg. Chem. 37(5), 1998, 956-963に記載のポルフィリン様分子及びペンタアザ大環状化合物、フタロシアニン、クラウンエーテル、例えばセパルクレート及びクリプテートのような窒素クラウンエーテル、ヘミン(プロトポルフィリンIXクロリド)、ヘム及び平面正方形の対称性を有するキレート剤が挙げられる。
【0026】
本発明の方法では大環状キレート剤が好ましく使用される。好ましい実施形態では、これらの大環状キレート剤は、ポリアザ−及びポリオキソ大環状化合物のように酸素及び/又は窒素などの1以上の硬いドナー原子を含む。ポリアザ大環状キレート剤の好ましい例としては、DOTA、NOTA、TRITA、TETA及びHETAが挙げられ、DOTAが特に好ましい。
【0027】
特に好ましい大環状キレート剤は、カルボキシル基又はアミン基のようにGa3+への配位には必須ではなく、ターゲティングベクターのような他の分子とキレート剤とのカップリングに使用できる官能基を含む。かかる官能基を含む大環状キレート剤の例は、DOTA、NOTA、TRITA、TETA又はHETAである。
【0028】
さらに好ましい実施形態では、二官能性キレート剤を本発明の方法で用いる。本発明に関して「二官能性キレート剤」とは、ターゲティングベクターと連結したキレート剤を意味する。本発明の方法で有用な二官能性キレート剤に適したターゲティングベクターは、ターゲティングベクターを含む68Ga放射性標識錯体を患者に投与したとき患者の体内の標的部位に結合する化学又は生物学的部分である。本発明の方法で有用な二官能性キレート剤に好ましいターゲティングベクターは、EGFRに対する天然リガンドである上皮増殖因子(EGF)又はそれらの一部、断片、誘導体もしくは錯体である。EGFは分子量(6.2kDa)が小さいので、腫瘍への速い浸透及び速い血液クリアランスが可能となり、良好なコントラストの画像を与える。EGF用の陽電子放射標識の使用は、PETがSPECTに比べて感度、解像度及び数量化の点で優れた検出技術であるので特に有利である。特に好ましいターゲティングベクターは、ヒト組換え上皮増殖因子(hEGF)又はその一部、断片、誘導体もしくは錯体である。
【0029】
特に好ましい実施形態では、大環状二官能性キレート剤を本発明の方法で使用する。好ましい大環状二官能性キレート剤は、DOTA、NOTA、TRITA又はHETAをターゲティングベクター、好ましくはEGF又はその一部、断片、誘導体もしくは錯体、特に好ましくはhEGF又はその一部、断片、誘導体若しく錯体に連結したものからなる。
【0030】
ターゲティングベクターは、リンカー基又はスペーサー分子を介してキレート剤に結合させることができる。リンカー基の例は、ジスルフィド、エステル又はアミドであり、スペーサー分子の例は、鎖状分子、例えばリシン又はヘキシルアミン或いは短鎖ペプチド系スペーサーである。好ましい実施形態では、ターゲティングベクターと放射性標識ガリウム錯体のキレート剤との結合は、ターゲティングベクターが、放射性標識ガリウム錯体の存在によって阻害も妨害もされずに、体内の標的と相互作用できるものである。
【0031】
本発明の好ましい一態様は、
c)68Ge/68Gaジェネレータからの溶出液を、HCO3−を対イオンとして含む陰イオン交換体と接触させて、陰イオン交換体から68Gaを溶出することによって68Gaを得て、
d)68Gaをマイクロ波活性化を用いてキレート剤と反応させる
ことによって68Ga−放射性標識錯体を製造する方法である。
【0032】
マイクロ波活性化の使用によって、68Ga−キレート剤錯体形成の効率及び再現性が大幅に向上することが判明した。マイクロ波活性化によって、化学反応時間を大幅に短縮することができ、反応は2分以内に完了する。反応時間を10分短縮できれば、約10%の68Ga活性が助かるので、明らかな改善である。さらに、マイクロ波活性化は副反応の低減及び選択性の増加による放射化学的収率の向上ももたらす。
【0033】
好適には、マイクロ波活性化の実施にはマイクロ波オーブン、好ましくは単一モードマイクロ波オーブンを用いる。マイクロ波活性化は、好適には80〜120W、好ましくは90〜110W、特に好ましくは約100Wで実施される。好適なマイクロ波活性化時間は20秒〜2分、好ましくは30秒〜90秒、特に好ましくは45秒〜60秒である。
【0034】
本発明の方法で例えばペプチド又はタンパク質をターゲティングベクターとして含む二官能性キレート剤のような温度感受性のキレート剤を用いるときは反応の温度制御が推奨される。マイクロ波活性化の期間は、反応混合物の温度がキレート剤及び/又はターゲティングベクターの分解を生じないように調節すべきである。本発明の方法で用いるキレート剤がペプチド又はタンパク質を含む場合、高い温度を短時間加える方が低い温度を長時間加えるよりも概して有利である。
【0035】
マイクロ波活性化は連続的に或いは反応の過程で幾つかのマイクロ波活性化周期で実施できる。
【0036】
本発明の別の態様は、68Ge/68Gaジェネレータから68Gaを得るためのキットであって、ジェネレータカラムとHCO3−を対イオンとして含む陰イオン交換体からなる第の二カラムとを備えるキットである。
【0037】
好ましい実施形態では、キットは、複数のカラムを直列に接続する手段及び/又は68Gaをジェネレータカラムから溶出するためのHCl水溶液及び/又は68Gaを陰イオン交換カラムから溶出するための水をさらに備える。HCl及び水は好ましくは無菌であり、密封容器に収容されている。
【0038】
別の好ましい実施形態では、本発明に係るキットは、キレート剤、好ましくは二官能性キレート剤つまりターゲティングベクターに結合したキレート剤をさらに含む。
【0039】
本発明は、PETトレーサーとしての放射性標識ガリウム錯体をさらに提供する。本発明に係る好ましいトレーサーは68Ga−DOTA−hEGFである。
【0040】
さらに別の実施形態では、本発明は、放射性標識ガリウム錯体をヒトに投与することを含んでなる、腫瘍におけるEGFR過剰発現のイメージング法であって、上記放射性標識ガリウム錯体が陽電子放射断層撮影でイメージングできるものであり、陽電子放射断層撮影法を行って腫瘍におけるEGFR過剰発現を検出する方法も提供する。
【実施例】
【0041】
以下の実施例で本発明をさらに例証するが、本発明はこれらの実施例に限定されるものではない。
【0042】
実施例1−68Ga−DOTA−hEGF調製の化学及び放射化学
I.材料
組換えヒト上皮増殖因子(hEGF)は、Chemicon社(米国カリフォルニア州テメキュラ)から購入した。酢酸ナトリウム(99.995%)、HEPES(4−(2−ヒドロキシエチル)ピペラジン−1−エタンスルホン酸)、再蒸留塩酸(Reidel de Haen社製)はSigma−Aldrich Sweden(スウェーデン国ストックホルム)から入手した。リン酸二水素ナトリウム、リン酸水素二ナトリウム及びトリフルオロ酢酸(TFA)は、Merck社(ドイツ国ダルムシュタット)から入手した。DOTA(1,4,7,10−テトラアザシクロドデカン−1,4,7,10−テトラ酢酸)のスルホ−NHSエステルは、Macrocyclics社(米国テキサス州ダラス)から購入した。購入した化学物質はそれ以上精製せずに使用した。すべての反応で、Elga社製Purelab Maxima系(英国バッキンガムシャー)で製造した脱イオン水(18.2MΩ)を使用した。68Gaは68Ge/68Gaジェネレータ(Cyclotron C.、ロシア国オブニンスク)から入手した。
【0043】
II.HPLC分析
液体クロマトグラフィー(LC)分析は、126ポンプ、166UV検出器及び放射線検出器を直列に連結したBeckman社(米国カリフォルニア州フラートン)製のHPLCシステムを用いて行った。データの取得及び操作はBeckman System Gold Nouveau Chromatographyソフトウェアパッケージを用いて行った。使用したカラムは、寸法150mm×4.6mm、粒径5μmのVydac RP 300Å HPLCカラム(Vydac社、米国)である。用いた勾配溶出は以下のパラメーターであった:A=10mMのTFA、B=70%アセトニトリル(MeCN)、30%H2O、10mMのTFAで220nmでのUV検出、流速は1.2mL/分、20%Bの均一濃度で0〜2分、20〜90%Bの直線濃度勾配8分、90〜20%Bの直線濃度勾配2分。カラムに保持された68Ga−DOTA−hEGF及び放射性不純物の量は、カラムに注入した試料及び出口から回収した画分の活性を結晶シンチレーションカウンターで測定することによって得ることができた。システムでの全損失は10%であった。68Ga−DOTA−hEGF及び親水性放射性不純物の画分の測定放射能はHPLCクロマトグラムから得られたそれぞれの値と一致した。対応する相対標準偏差は親水性放射性不純物及び68Ga−DOTA−hEGFについてそれぞれ7%及び0.5%であった。
【0044】
III.68Ga−DOTA−hEGFの調製
0.08Mホウ酸緩衝液(pH9.4)中のhEGF(32〜70ナノモル、80〜180μL)を攪拌しながら乾燥DOTAのN−ヒドロキシスルホスクシンイミドエステル(10〜20倍過剰)に加え、ホウ酸緩衝液(240〜340μL)を加えてpHを9.0に調整した。混合物を室温で3〜4時間又は一晩放置した。コンジュゲートをBio−select RP C18 C−18 SPEカラム(Vydac社製)で精製した。反応混合物を抽出ディスクにゆっくりと流し、次いで2mLの0.1%TFAで洗浄した。生成物は、0.1%のTFAを含む1mLの70%アセトニトリルで溶出した。溶媒を、50℃で作動させた真空遠心分離機(Labconco社(米国ミズーリ州カンザスシティ)製CentriVap Console)を用いて蒸発させ、乾燥精製標品を0℃未満の温度で保存した。
【0045】
コンジュゲートの標識は、先行技術に記載の通り(Velikyan I, Beyer GJ, Langstrom B. Microwave-supported preparation of (68)Ga bioconjugates with high specific radioactivity. Bioconjug Chem. 2004; 15(3): 554-560)、未濃縮68Ga−溶出液又は予備濃縮した溶出液のいずれかを用いて行った。場合によっては、標識反応に用いる68Gaの量を増すため、2つのジェネレータからの溶出液を予備濃縮した。標識反応に使用したDOTA−hEGFの量は、未濃縮及び予備濃縮した68Ga−溶出液を使用するときそれぞれ6〜10及び2〜5ナノモルであった。未濃縮68Gaでの標識には酢酸ナトリウム緩衝液(pH5.0〜5.5)を使用し、予備濃縮した溶出液ではHEPES緩衝液(pH4.6〜4.8)を使用した。標識は1分間のマイクロ波加熱で実施した。生成物は、上述のBio−select RP C18 C−18 SPEカラムで精製した。次いで溶媒をNAP−5カラム(Sephadex G−25、Amersham Pharmacia Biotech社(スウェーデン国ウプサラ)製)でPBS(リン酸緩衝食塩水)緩衝液に交換した。コンジュゲートの純度はHPLCで調べ、コンジュゲート及びトレーサーの濃度はUV−HPLC較正曲線から求めた。
【0046】
hEGFへの68Gaの結合がDOTAで媒介されることを検証するため、ブランク試験を行った。操作は上記と同じであるが、非連結hEGFを使用した。
【0047】
69,71Gaの天然同位体組成物を同じ手順を用いてDOTA−hEGFと錯体化した。放射性HPLCクロマトグラムシグナルの同定には、LC−ESI−MSで特性決定した69,71Ga−DOTA−hEGFを用いた。
【0048】
IV.マイクロ波加熱及びLC−ESI−MS分析
マイクロ波加熱は、2450MHzでの連続照射を発生するSmithCreator(商標)単一モード空洞共振器(Personal Chemistry社(スウェーデン国ウプサラ)製)で実施した。反応の間、温度、圧力及び照射出力をモニターした。照射完了後、反応バイアルを加圧空気で冷却した。
【0049】
Waters Micromass Quattro Premier質量分析計(Micromass社(英国)製)及びフォトダイオードアレーUV検出器を備えたAlliance社製(Waters 269、英国)HPLCシステムを用いてエレクトロスプレーイオン化液体クロマトグラフィー質量分析(LC−ESI−MS)を行った。使用したカラムは、寸法100mm×2.1mm、粒径3μmのAtlantis dC 18 RP HPLCカラムである。均一濃度溶出を以下のパラメーターで用いた。A=10mMギ酸、B=100%アセトニトリル(MeCN)であり、210〜400nmでのUV検出、流速0.3mL/分。LC−ESI−MSは、ポジティブモードスキャン及び[M+6H]6+、[M+7H]7+及び[M+8H]8+種を検出する選択イオン記録(SIR)で実施した。hEGFは、[M+8H]8+についてm/z=781.5、[M+7H]7+についてm/z=893及び[M+6H]6+についてm/z=1042で検出された。データを再構成すると、M=6244.67±1.15となる。(DOTA)1−hEGFは、[M+8H]8+についてm/z=829.75、[M+7H]7+についてm/z=948.13及び[M+6H]6+についてm/z=1105で検出された。データを再構成すると、M=6629.95±0.05となる。(DOTA)2−hEGFは、[M+8H]8+についてm/z=878、[M+7H]7+についてm/z=1103.3及び[M+6H]6+についてm/z=1170.36で検出された。データを再構成すると、M=7016±0.08となる。(DOTA)3−hEGFは、[M+8H]8+についてm/z=926.29、[M+7H]7+についてm/z=1058.47及び[M+6H]6+についてm/z=1234.72で検出された。データを再構成すると、M=7402±0.1となる。(Ga−DOTA)1−hEGFは、[M+8H]8+についてm/z=838.5、[M+7H]7+についてm/z=958.13及び[M+6H]6+についてm/z=1117.66で検出された。データを再構成すると、M=6699.95±0.05となる。(Ga−DOTA)2−hEGFは、[M+8H]8+についてm/z=896.05、[M+7H]7+についてm/z=1023.3及び[M+6H]6+についてm/z=1193.69で検出された。データを再構成すると、M=7157.55±2.47となる。(Ga−DOTA)3−hEGFは、[M+8H]8+についてm/z=952.54、[M+7H]7+についてm/z=1088.47及び[M+6H]6+についてm/z=1269.72で検出された。データを再構成すると、M=7612.31±0.05となる。
【0050】
V.結果
68Ga−DOTA−hEGFは、まずhEGFを二官能性キレート剤DOTAに連結し、次いでキレート剤と68Gaとの錯形成反応による68Gaでの標識との二段階法で合成した。連結段階においてDOTAキレートのカルボキシル基の1つがペプチドのアミン官能価とカップリングしてアミド結合を形成する(スキーム1)。連結反応に必要な塩基性pHはホウ酸緩衝液で与えた。hEGFは、1残基の末端リシンと2残基のリシンアミノ基を含有する。したがって、LC−ESI−MS分析で判明したように、hEGFの連結反応で、DOTA断片を1、2及び3個有する分子の混合物が形成される。
【0051】
コンジュゲートのマイクロ波促進標識(スキーム1)を、未濃縮又は予備濃縮ジェネレータ68Ga溶出液を用いて実施した。未濃縮コンジュゲートの場合、標識収率は60±10%(N=3)であった。予備濃縮したものを用いると、77±4%(N=3)に増加させることができた。溶出液を予備濃縮すると28MBq/nmolの比放射能を得ることができた。非連結hEGFを同じように処理しても標識ペプチドは得られなかったので、hEGFへの68Gaの結合はDOTAで媒介される。この研究におけるトレーサーの放射化学純度は99%超であった。このトレーサーはPBS中で安定であり、4時間の安定性アッセイでそれ以上の放射性HPLC信号を生じなかった。
【0052】
【化1】

実施例2−細胞結合及び保持実験
I.細胞培養
ヒト扁平上皮癌細胞系A431(ATCC、CLR 1555、米国メリーランド州ロックビル)及び悪性神経膠腫細胞系U343MGaC12:6(Westermark B, Magnusson A, Heldin CH. Effect of epidermal growth factor on membrane motility and cell locomotion in cultures of human clonal glioma cells. J Neurosci Res. 1982; 8(2-3): 491-507)(以下、「U343」という)をすべての細胞実験で使用した。A431細胞系は1細胞当り約2×106個のEGFRを発現し、U343細胞系は1細胞当り約5.5×105個のEGFRを発現すると報告されている。細胞は、10%ウシ胎仔血清(Sigma社製)、L−グルタミン(2mM)及びPEST(ペニシリン100IU/ml及びストレプトマイシン100μg/ml)(いずれもBiochrom社製)を添加したHam’s F10培地(Biochrom社製)で培養した。細胞培養及び細胞実験の際の細胞は(特記しない限り)、5%CO2で平衡化した加湿空気を入れたインキュベーター中37℃で増殖させた。細胞はBiochrom社製のトリプシン−EDTA(Ca及びMgを含まないPBS中、0.25%トリプシン、0.02%EDTA)でトリプシン処理した。
【0053】
II.細胞への68Ga−DOTA−EGFの結合
A431及びU343細胞は3cmシャーレ中で培養した(それぞれ1シャーレ当りの細胞数3.5×105及び1.9×105)。細胞を1回洗浄した後、細胞培養液中の68Ga−DOTA−EGF(A431細胞では35ng/シャーレ、50kBq/シャーレ、U343細胞では5ng/シャーレ、20kBq/シャーレ)を添加した。添加したトレーサーの濃度は、A431細胞では0.26〜16.9nM、U343細胞では0.14〜36nMであった。幾つかのシャーレには、モル過剰のEGF(5又は3μg/シャーレ)を標識コンジュゲートと共に添加して68Ga−DOTA−EGFコンジュゲートの結合特異性を調べた。37℃で0.5〜6時間のインキュベートした後、細胞を血清不含非放射性培地で6回洗浄し、次いで0.5mlのトリプシン−EDTA(37℃、15分)を用いて細胞を回収した。1mlの細胞培養液の添加によってトリプシン処理を終了し、細胞懸濁液の一部(0.5ml)を細胞計数に使用し、残りはガンマカウンターで測定した。
【0054】
68Ga−DOTA−EGFコンジュゲートの細胞内部移行を調べるため、結合実験の際に多数の追加の細胞シャーレを用いて、コンジュゲートの膜結合画分を内部移行放射能から分離した。コンジュゲートの膜結合画分の抽出には、細胞のトリプシン処理に代えて、0.5mlの氷冷0.1Mグリシン−HCl緩衝液(pH2.5)での0℃で6分間の処理を用いた。追加の0.5mlのグリシン−HCl緩衝液を用いて細胞を1回洗浄した。内部移行放射能と考えられる残りの放射能は、37℃で0.5mlの1M NaOH溶液で約60分間処理することによって回収した。別途0.5mlのNaOH溶液を洗浄に用いた。回収画分は自動ガンマカウンターで測定した。
【0055】
飽和実験で結合に要する時間を求めるため、氷上でのA431細胞及びU343細胞への68Ga−DOTA−EGFの結合も調べた。氷上に載せた細胞シャーレを氷冷68Ga−DOTA−EGF溶液と共に0.5〜4時間インキュベートした。次いで細胞を上述の通り洗浄し、トリプシン処理し、カウントした。
【0056】
III.放射能の細胞保持、飽和アッセイ及び動物腫瘍モデル
68Ga−DOTA−EGFで1時間インキュベートした後、放射能の細胞保持を調べた。インキュベーション後、細胞を十分に洗浄して未結合コンジュゲートを除去し、次いで新鮮な細胞培養液中でインキュベーションを続けた。0.5〜4時間後、細胞を上述の通りトリプシン処理し、計数し、放射能測定した。
【0057】
A431細胞及びU343細胞での68Ga−DOTA−EGFによる飽和実験から解離平衡定数Kdを求めた。24ウェルシャーレで培養した細胞(1ウェル当り約3.1×104個のA431細胞及び1ウェル当り約7.8×104個のU343細胞)を氷上に載せ、様々な濃度の氷冷68Ga−DOTA−EGF溶液(A431では0.26〜16.9nM、U343では0.14〜36nM)を添加した。各濃度について、100倍過剰の非標識EGFを幾つかのウェルに添加して非特異的なバックグラウンド結合を調べた。2時間インキュベートした後(この時間は氷上での取込み実験の結果から決定した。)、細胞を血清不含非放射性培地で6回洗浄した。細胞を次で0.5mlのトリプシン−EDTAでトリプシン処理し(37℃で15分間)、細胞数を計数するとともにガンマカウンターで放射能測定した。
【0058】
腫瘍を異種移植した成熟雌Balb/c nu/nuマウス(21〜25g)(Mollegard、デンマーク)でインビボ実験を実施した。動物はすべてスウェーデン動物愛護協会の指針に準拠して取り扱い、実験は当地の動物実験に関する倫理委員会によって承認された。マウスの両前肢にA431腫瘍細胞(100μlの細胞培養液中の腫瘍当り約7百万個の細胞)を皮下注射した。腫瘍を12〜13日間増殖させてから実験を行ったが、そのときの重量は0.1〜0.8gに達していた。
【0059】
IV.結果
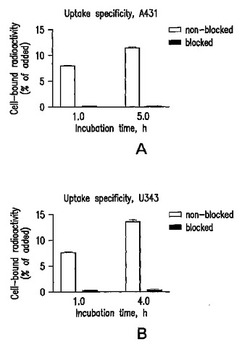
インビトロでのEGFR発現細胞系への68Ga−DOTA−EGFの結合特異性を図1に示す。細胞実験では、EGFRの発現が報告されている子宮頚癌A431及び神経膠腫U343細胞系を使用した。結合が受容体特異性であることを実証するため、対照実験では大量の非標識EGFを細胞に添加してEGFRを飽和させた。結合特異性実験の結果は、すべての試験データポイントで両細胞系への68Ga−DOTA−EGFの結合が受容体の飽和によって阻止されることを示していた。これは標識コンジュゲートの結合が受容体特異的であることを示している。
【0060】
子宮頚癌A431及び神経膠腫U343細胞系での68Ga−DOTA−EGFによる飽和実験の結果を、それぞれ図2A及び2Bに示す。amol/細胞で示す特異的結合を、添加した放射性標識コンジュゲートの合計モル濃度に対してプロットし、結果をGraphPad Prismソフトウェアを用いた非線形回帰分析で解析した。いずれの曲線も最大値に達し、飽和したことを示している。得られたKd値はA431では2.0nM、U343では2.3nMであり、よく一致していた。U343での細胞当りの結合部位の最大数7.8×105という値は、[111In]−Bz−DTPA−EGFコンジュゲートで従前報告されている5.4×105という値(22)とまずまず一致している。A431での細胞当り190万という結合部位の数も、文献記載のデータとよく一致している。
【0061】
この実験では、内部移行の程度を酸洗浄によって評価した。放射能のうち、酸性緩衝液で細胞から除かれるものは膜結合型と考えられ、残りは内部移行したものと考えられる。かかる実験の結果を図3に示すが、この図から、いずれの細胞系でも68Ga−DOTA−EGFの内部移行が迅速なプロセスであることが分かる。ただし、これらの実験の結果は、内部移行の速度がA431に比べて神経膠腫U343細胞で速かったことを示している。これは、内部移行した受容体を細胞表面に再循環できるというA431細胞について報告された能力によるものかもしれない。神経膠腫U343細胞の場合には、インキュベーションを開始してから30分で50%を超える放射能が内部移行した。
【0062】
68Ga−DOTA−EGFでのインキュベーションを中断した後の放射能の保持パターンはA431及びU343細胞いずれの細胞系でも同様であった(図4)。最初に放射能が降下するが(膜結合コンジュゲートの解離による可能性が最も高い。)、その後は細胞結合68Gaの量は比較的一定である。いずれの細胞系も良好な保持性を示し、インキュベーション中断後、標識の半減期の3倍を越える4時間の間、70%を超える放射能が依然として細胞に結合していた。
【0063】
実施例3−体内分布実験
I.A431腫瘍を異種移植したマウスにおける体内分布
コンジュゲート注入量が腫瘍及び健常組織への取り込みに与える影響を調べるため、体内分布実験を行った。A431腫瘍を異種移植したマウスに、50μlの68Ga−DOTA−EGF溶液(1匹当りPBS中0.16nmol又は0.016nmol)を静脈内注射し、30分後にマウスを屠殺して解剖した。マウスは、Rompun(1mg/ml)とKetalar(10mg/ml)の混合物をマウス体重10g当り0.2ml腹腔内投与して麻酔し、心臓穿刺によって屠殺した。腫瘍の他に、血液、心臓、膵臓、脾臓、胃、肝臓、腎臓、肺、小腸及び大腸、筋肉、骨並びに唾液腺を回収して秤量し、自動ガンマカウンターで測定した。注射の正確さを判定するため、尾部についても放射能含量を測定した。臓器の値は、臓器1g当りの注射した放射能の百分率(%IA/g)として計算した。
【0064】
II.結果
A431担癌マウスにおける68Ga−DOTA−EGFの体内分布データの概要を図5に示す。68Ga−DOTA−EGFの静脈内投与30分後の臓器放射能の計測は、いずれのコンジュゲートについても腎臓及び肝臓で最も高い値を示した。膵臓、唾液腺、小腸及び大腸、胃並びに脾臓では放射能蓄積量は低かった。A431腫瘍異種移植片への68Ga−DOTA−EGFの取込みは、0.016nmol及び0.16nmolのコンジュゲート注射でそれぞれ1.51±0.16%IA/g及び2.69±0.29%IA/g(p=0.036)であった。放射性トレーサーは速い血液クリアランスを有しており、いずれのコンジュゲートでも(大差なく)、30分循環したときの残存量は1%IA/g未満であった。コンジュゲートの注入量が増すと、膵臓、脾臓及び胃における放射能取込み量に統計的に有意な減少が認められた。腫瘍対健常臓器に注目すると、コンジュゲート量の増加の影響は一段と顕著である。腫瘍対血液比では、0.016及び0.16nmolのコンジュゲート注射のそれぞれで4.42±1.81%IA/g及び4.50±2.53%IA/g(p=0.036)と差異はないが、心臓、膵臓、胃、脾臓、肺、腸、筋肉及び唾液腺では、0.16nmolのコンジュゲートを注射したときに腫瘍対臓器比に統計的に有意な増加が認められる。
【0065】
実施例4−microPETイメージング
イメージングは、コンピューター制御式ベッドを備えた断面視野10cm及び軸方向視野8cmのmicroPET R4スキャナー(Concorde Microsystems社)で行った。それは専ら三次元リストモードで作動させ、セプタはなかった。すべての生データをまず三次元シノグラムとし、次いでフーリエリビニング及び二次元フィルタ逆投影による画像再構成によって解像度2mmの画像を得る。マウスは実験直前に実験室に持ち込んだ。マウスを赤色電球下で短時間加温した後、酸素と空気の45/55%混合気に2%のイソフルレンを供給するように調節したイソフルレン気化器に接続したシリンダー内に入れた。マウスが気絶したら、ヘパリン処理した静脈カテーテルを尾静脈に入れ、0.9%NaCl及び10IUのヘパリンを含む1ml注射器に接続した。しかる後、マウスを腹部を下にして腫瘍のある前肢を体からできるだけ前に伸ばしてカメラベッドにセットし、熱及び水分損失を最小限にするためサランラップで覆った。実験中の体温の損失を減少させるために熱風(40℃)をマウスに吹き付けた。カメラを始動した直後に大量瞬時投与としてトレーサーを100μl注射し、次いで100μlの生理食塩水を注射した。実験終了後、マウスを麻酔状態で断頭し、血液、肝臓及び腎臓試料を回収して放射能測定した。
【0066】
散乱補正、ランダムカウント及び不感時間補正をすべて再構成アルゴリズムに組み込んだ。トレーサー注射前に68Ge/68Gaを含む2本の回転ロッド源で各マウスにおける放射能減衰を測定し、画像を放射能減衰について補正した。PET試験はすべて20分透過スキャンで開始した。注射した納車能量は2.0±0.5MBqであった。この実験では、2通りのイメージングプロトコルを使用した。取得時間は以下の通りであった:プロトコル1(期間120分)10×30秒、5×120秒及び5×300秒、8×600秒、プロトコル2(期間30分)10×30秒、5×60秒、10×120秒。関心領域(ROI)を、肝臓、腎臓、膀胱、唾液腺及び腫瘍に描いた。注射後の時間経過としての放射能濃度(組織1g当りの注射量の百分率)を表す薬物動態曲線を求めた。取込み指数は、臓器中の放射能[kBq/mL]/注射量[kBq]×100%として計算した。
【0067】
microPETイメージングで求めた担癌マウスにおける68Ga−DOTA−EGFの局在化(図6)に続いて、マウスの断頭後回収した血液、肝臓、及び腎臓の試料の放射能測定を行った。2.0MBq(比放射能12〜20MBq/nmol)の68Ga−DOTA−EGF投与30分後の担癌マウスの画像を、図6の左側に示す。microPETイメージングの評価結果を、血液、肝臓及び腎臓試料の放射能測定と相関させた。右左の脚の腫瘍はいずれも周辺のバックグラウンドから明瞭なコントラストで視認できた。肝臓及び腎臓で顕著な取込みが観察され、膀胱を通しての放射能のクリアランスが歴然であった(図7)。腫瘍及び唾液腺への分布は比較的遅かった。microPET及び体内分布実験で得られた取込みデータは、イメージング後の組織サンプリングで得られたデータと一致し、対照できることが判明した。
【0068】
具体的な実施形態、参照文献
本発明の技術的範囲は本明細書に記載した特定の実施形態によって限定されるものではない。実際、本明細書の以上の記載から当業者には本明細書に記載した変更例以外の変更例も明らかであろう。かかる変更例も特許請求の範囲に記載された技術的範囲に属する。
【0069】
本明細書では、様々な刊行物及び特許出願を引用したが、それらの開示内容は援用によって本明細書の内容の一部をなす。
【図面の簡単な説明】
【0070】
【図1】A431癌腫(a)及びU343神経膠腫(b)細胞系に対する68Ga−DOTA−EGFの結合特異性を示す図。すべての時点で、対照細胞のEGF受容体は100倍過剰量の非標識EGFで遮断した。結合を抑圧することができたことから、結合が特異的であることが分かる。図示したデータは3つの測定値の平均と標準偏差である。
【図2】培養癌腫A431及び神経膠腫U343細胞への68Ga−DOTA−hEGFの結合の飽和を示す図。それぞれ非特異的結合及び全結合量を得るため非標識hEGFの存在下又は非存在下で、様々な濃度の68Ga−DOTA−hEGF(A431細胞では0.26〜16.9nM及びU343細胞では0.14〜36nM)と共に氷上で2時間インキュベートした。データはGraphPad Prism 3.0で解析した。すべてのデータポイントは3以上のデータポイントの平均であり、最大偏差も示す。
【図3】癌腫A431細胞及び神経膠腫U343細胞に結合した後の68Ga−DOTA−EGFの内部移行を示す図。内部移行は、異なる2つの時点での酸洗浄によって測定した。酸性緩衝液で細胞から除かれたものは膜結合型であり、その残りは内部移行したものと考えた。図示したデータは3つの測定値の平均と標準偏差である。
【図4】68Ga−DOTA−EGFでのA431(実線)及びU343(破線)のインキュベーションを中断した後の時間の関数としての細胞結合68Ga放射能を示す図。インキュベーション中断後時間0での細胞結合放射能を100%とみなした。すべてのデータポイントは3つの測定値の平均と標準偏差である。A431及びU343の細胞培養液はいずれも68Ga−DOTA−hEGFで4時間インキュベートした。
【図5】図5Aは、担癌ヌードマウスにおける30分の時点での組織1グラム当りの注入量%として表される68Ga−DOTA−EGFの体内分布の図である。図5Bは、担癌ヌードマウスにおける30分の時点での68Ga−DOTA−EGFの腫瘍対組織比を示す図である。マウスには、0.016nmol又は0.16nmolのいずれかの量の放射性トレーサーを静脈内注射した。データは平均±標準偏差(n=4)として示す。
【図6】図6左は、フレーム20〜24の相加を示す画像(x−注入30分後)である。頭の両側に腫瘍が明瞭に認められる。図6右はマウスの配置の写真である。
【図7】68Ga−DOTA−EGFの(0.16nmol注入)の肝臓、腎臓及び腫瘍への急速な分布を示す薬物動態曲線である。尿中への排出が観測期間を通して継続する。
【技術分野】
【0001】
本発明は、放射性標識ガリウム錯体及びその合成法に関する。本発明の放射性標識ガリウム錯体は、特に陽電子放射断層撮影(PET)用の放射性医薬品として有用である。これらは悪性腫瘍における上皮増殖因子受容体(EGFR)発現の検出に特に有用である。
【背景技術】
【0002】
HER1及びErbB−1としても知られる上皮増殖因子受容体(EGFR)は、チロシンキナーゼ受容体ファミリーに属する膜貫通型タンパク質である。EGFRの活性化は、細胞分裂、運動性の増加及びアポトーシスの抑制を導くシグナル伝達を惹起する(非特許文献1)。数多くの癌腫において、EGFR遺伝子の増幅又は転位置は、転写の増加とその後の高レベルのEGFR発現を惹起する(非特許文献2、非特許文献3)。乳癌(非特許文献4、非特許文献5)、肺癌(非特許文献6)及び膀胱癌(非特許文献7)でEGFRの過剰発現が報告されている。高水準のEGFR発現は、細胞の増殖及び転移の広がりが増し、アポトーシスが減少することによって悪性細胞の生存に好都合であるとも考えられる。現在のところ、EGFRシグナル伝達の不活性化によって腫瘍成長を抑制する数多くの取組みが臨床で使用又は盛んに臨床試験されている。これらの取組みは、EGFRの細胞外領域にリガンドが結合するのを抗EGFR抗体を用いて遮断するか、或いは選択的チロシンキナーゼ阻害剤で細胞内シグナル伝達を阻止するかのいずれかに基づくものである(非特許文献8)。
【0003】
腫瘍におけるEGFR発現の検出が予後値及び予測値として報告されている。EGFRの過剰発現が、結腸癌(非特許文献9)、直腸癌(非特許文献10)、非小細胞肺癌(非特許文献11)及び乳癌(非特許文献5、非特許文献12)での低い生存率及び再発と関連していることが報告されている。EGFRの発現状態によって、術前化学療法及び放射線療法後の成果の乏しい進行上咽頭癌に属する患者のサブグループを確認できると示唆されている(非特許文献13)。EGFRの発現がヒト前立腺癌での疾患再発及びアンドロゲン非依存性への進行と関連することが明らかにされている(非特許文献14)。実際の診療でのEGFRの検出がEGFRを標的とした薬物の使用の妥当性の問題を始めとする患者管理に影響する可能性があることは明らかである。
【0004】
EGFRの検出は、外科試料又は穿刺生検試料で免疫組織化学的検査又はFISH法を用いて可能である。しかし、核医学画像化は、原発腫瘍及び腫瘍転移を全体的に評価でき、サンプリングエラー及びEGFR発現の不均一性に付随する偽陰性の結果を避けることができるという利点があると考えられる。
【0005】
インジウム−111標識抗EGFR抗体425が、悪性神経膠腫の検出に成功裡に用いられている(非特許文献15)。Tc−99m−標識抗EGFRヒト化抗体hR3及びC225は臨床評価の段階にある(非特許文献16、非特許文献17)。ただし、嵩高い抗体タンパク質の使用は、健常組織を通しての腫瘍への放射性コンジュゲートの拡散が難しくなるおそれがある。抗EGFR抗体に代わるものとして、腫瘍細胞に放射性核種を送達するためのターゲティングベクターとして天然リガンドである上皮増殖因子(EGF)を用いることが考えられる(非特許文献17)。EGFは分子量(6.2kDa)が小さいので、腫瘍への速い浸透及び速い血液クリアランスが可能となり、良好なコントラストの画像を得ることができると考えられる。従前、131I−標識EGFが肺癌の画像化に成功裡に用いられている(非特許文献18)。しかし、放射性ハロゲンは細胞保持が不十分なため、腫瘍での蓄積が減少し、画像コントラストも最適とはいいがたいので、EGFの標識には放射性金属を使用した方がよい選択となり得る(非特許文献19)。EGFに対して様々な単一光子放射性金属標識が提案されている。モノアミドDTPA(非特許文献19、非特許文献20)又はイソチオシアネート−ベンジル−DTPA(非特許文献21)を用いてEGFに111In(T1/2=2,8d)が結合されている。ジェネレータ生成99mTc(T1/2=6h)によるEGFの標識にMAG3(非特許文献22)、導入SH基(非特許文献23)又はHYNIC(Tolmachev、未発表データ)が利用されている。しかし、陽電子放射断層撮影(PET)の方が、SPECTと比較して、感度、解像度及び数量化の点で優れた検出技術であるので、EGFに陽電子放射標識を使用した方が有利であるとも考えられる(非特許文献24、非特許文献25)。
【0006】
PETイメージングは、陽電子を放出する放射性トレーサー分子を用いた核断層撮影技術である。陽電子が電子と遭遇すると、それらは消滅してガンマ線としてエネルギーを放出し、これをPETスキャナーで検出する。トレーサー分子として体内で用いられる天然物質を使用すると、PETは体内の構造に関する情報を与えるだけでなく体又は体内の特定領域の生理的機能に関する情報も与える。一般的なトレーサー分子は例えば天然のグルコースと類似した2−フルオロ−2−デオキシ−D−グルコース(FDG)に18F原子を付加したものである。陽電子放出フッ素から発生するガンマ線はPETスキャナーで検出され、体の特定領域又は組織(例えば脳又は心臓)におけるFDGの代謝を示す。トレーサー分子の選択は、何をスキャンすべきかによって左右される。一般に、トレーサーは重要な領域に蓄積又はある種の組織(例えば癌細胞)に選択的に取り込まれるものが選択される。スキャニングは、放射性トレーサー分子が問題とする生化学過程に入る時間間隔後に得られた一連の動的又は静止画像のいずれかからなる。スキャナーはトレーサー分子の空間的及び時間的分布を検出する。PETは、放射性トレーサー分子の局所濃度を測定できる定量的イメージング法でもある。
【0007】
PETトレーサーに常用される放射性核種は、11C、18F、15O、13N又は76Brである。近年、二官能性キレート剤と放射性金属とを含む放射性標識金属錯体に基づく新たなPETトレーサーが製造されている。二官能性キレート剤は金属イオンに配位しているとともに、患者体内の標的部位に結合するターゲティングベクターと連結したキレート剤である。かかるターゲティングベクターとしては、ある種の受容体、大抵は体内の特定の領域又は疾患に関連した受容体と結合するペプチドがある。ターゲティングベクターは、例えば活性化した腫瘍遺伝子に特異的なオリゴヌクレオチドで、腫瘍の位置特定のためのオリゴヌクレオチドであってもよい。かかる錯体の利点は、例えば68Ga、213Bi又は86Yなどの様々な放射性金属で二官能性キレート剤を標識できることである。こうして、特殊な特性をもつ放射性標識錯体を特定の用途のために「仕立てる」ことができる。
【0008】
68Gaは、PETイメージングでトレーサー分子として用いられるGa−放射性標識金属錯体の製造に特に重要である。68Gaは68Ge/68Gaジェネレータから得られ、サイクロトロンを一切必要としない。68Gaは2.92MeVの陽電子放出によって89%まで崩壊し、その半減期68分は、不必要な放射線なしでインビボでの数多くの生化学過程を追跡するのに十分である。68Gaはその+IIIの酸化状態で各種のキレート剤と安定な錯体を形成し、68Gaトレーサーは脳、腎臓、骨組織、血液プール、肺及び腫瘍のイメージングに用いられている。
【0009】
この核種の短い半減期はEGFの速い血液クリアランスに適合する。DOTA又はNOTAのような大環状キレート剤の誘導体の使用によって、ソマトスタチンの類似体及びオリゴヌクレオチドの安定ガリウム標識が得られている(非特許文献26、非特許文献27、非特許文献28、非特許文献29、非特許文献30、非特許文献31)。非環状キレート剤での初期の実験から、それらをEGFに結合しても、その受容体に対するEGF結合親和性が低減しないことが明らかにされている。こうした理由から、EGFへのDOTAのカップリングがガリウムでの標識に適した方法を与えるかもしれない。しかし、先行技術には、これらの科学的知見を腫瘍におけるEGFR過剰発現のイメージングにどのように用いるかについてなんら示唆又は教示されていない。
【0010】
そこで、医学界では、腫瘍におけるEGFR過剰発現を検出するための非侵襲性PETトレーサーが長い間待望されていた。かかるトレーサーは、高感度でのインビボ非侵襲性PET法の開発に極めて有用であろう。多くの癌腫でのEGFRの過剰発現の検出は重要な診断情報を与え、患者管理に影響を及ぼす可能性がある。従って、EGFRの天然リガンドに基づく陽電子放出トレーサーの製造方法、ヒト組換え上皮増殖因子(hEGF)及び腫瘍でのEGFR過剰発現のイメージングにおけるトレーサーの使用法を提供することが望ましい。
【0011】
本明細書における文献についての説明又は引用は、これらの文献が本発明の先行技術であることを是認するもの解釈すべきではない。
【非特許文献1】Yarden Y, Sliwkowski MX. Untangling the ErbB signaling network. Nat Rev Mol Cell Biol. 2001; 2(2): 127-137
【非特許文献2】Collins VP. Amplified genes in human gliomas. Semin Cancer Biol. 1993; 4(1): 27-32
【非特許文献3】Bigner SH, Burger PC, Wong AJ, et al. Gene amplification in malignant human gliomas: clinical and histopathologic aspects. J Neuropathol Exp Neurol. 1988; 47(3): 191-205
【非特許文献4】Walker RA, Dearing SJ. Expression of epidermal growth factor receptor mRNA and protein in primary breast carcinomas. Breast Cancer Res Treat. 1999; 53(2): 167-176
【非特許文献5】Witton CJ, Reeves JR, Going JJ, Cooke TG, Bartlett JM. Expression of the HER1-4 family of receptor tyrosine kinases in breast cancer. J Pathol. 2003; 200(3): 290-297
【非特許文献6】Hirsch FR, Varella-Garcia M, Bunn PA, Jr., et al. Epidermal growth factor receptor in non-small-cell lung carcinomas: correlation between gene copy number and protein expression and impact on prognosis. J Clin Oncol. 2003; 21(20): 3798-3807
【非特許文献7】Neal DE, Mellon K. Epidermal growth factor receptor and bladder cancer: a review. Urol Int. 1992; 48(4): 365-371
【非特許文献8】Castillo L, Etienne-Grimaldi MC, Fischel JL, Formento P, Magne N, Milano G. Pharmacological background of EGFR targeting. Ann Oncol. 2004; 15(7): 1007-1012
【非特許文献9】Resnick MB, Routhier J, Konkin T, Sabo E, Pricolo VE. Epidermal growth factor receptor, c-MET, beta-catenin, and p53 expression as prognostic indicators in stage II colon cancer: a tissue microarray study. Clin Cancer Res. 2004; 10(9): 3069-3075
【非特許文献10】Kopp R, Rothbauer E, Mueller E, Schildberg FW, Jauch KW, Pfeiffer A. Reduced survival of rectal cancer patients with increased tumor epidermal growth factor receptor levels. Dis Colon Rectum. 2003; 46(10): 1391-1399
【非特許文献11】Selvaggi G, Novello S, Torri V, et al. Epidermal growth factor receptor overexpression correlates with a poor prognosis in completely resected non-small-cell lung cancer. Ann Oncol. 2004; 15(1): 28-32
【非特許文献12】Tsutsui S, Kataoka A, Ohno S, Murakami S, Kinoshita J, Hachitanda Y. Prognostic and predictive value of epidermal growth factor receptor in recurrent breast cancer. Clin Cancer Res. 2002; 8(11): 3454-3460
【非特許文献13】Chua DT, Nicholls JM, Sham JS, Au GK. Prognostic value of epidermal growth factor receptor expression in patients with advanced stage nasopharyngeal carcinoma treated with induction chemotherapy and radiotherapy. Int J Radiat Oncol Biol Phys. 2004; 59(1): 11-20
【非特許文献14】Di Lorenzo G, Tortora G, D'Armiento FP, et al. Expression of epidermal growth factor receptor correlates with disease relapse and progression to androgen-independence in human prostate cancer. Clin Cancer Res. 2002; 8(11): 3438-3444
【非特許文献15】Dadparvar S, Krishna L, Miyamoto C, et al. Indium-111-labeled anti-EGFr-425 scintigraphy in the detection of malignant gliomas. Cancer. 1994; 73(3 Suppl): 884-889
【非特許文献16】Vallis KA, Reilly RM, Chen P, et al. A phase I study of 99mTc-hR3 (DiaCIM), a humanized immunoconjugate directed towards the epidermal growth factor receptor. Nucl Med Commun. 2002; 23(12): 1155-1164
【非特許文献17】Schechter NR, Wendt RE, 3rd, Yang DJ, et al. Radiation dosimetry of 99mTc-labeled C225 in patients with squamous cell carcinoma of the head and neck. J Nucl Med. 2004; 45(10): 1683-1687
【非特許文献18】Cuartero-Plaza A, Martinez-Miralles E, Rosell R, Vadell-Nadal C, Farre M, Real FX. Radiolocalization of squamous lung carcinoma with 131I-labeled epidermal growth factor. Clin Cancer Res. 1996; 2(1): 13-20
【非特許文献19】Orlova A, Bruskin A, Sjostrom A, Lundqvist H, Gedda L, Tolmachev V. Cellular processing of (125)I- and (111)in-labeled epidermal growth factor (EGF) bound to cultured A431 tumor cells. Nucl Med Biol. 2000; 27(8): 827-835
【非特許文献20】Reilly RM, Gariepy J. Factors influencing the sensitivity of tumor imaging with a receptor-binding radiopharmaceutical. J Nucl Med. 1998; 39(6): 1036-1043
【非特許文献21】Sundberg AL, Orlova A, Bruskin A, et al. [(111)In]Bz-DTPA-hEGF: Preparation and in vitro characterization of a potential anti-glioblastoma targeting agent. Cancer Biother Radiopharm. 2003; 18(4): 643-654
【非特許文献22】Hnatowich DJ, Qu T, Chang F, Ley AC, Ladner RC, Rusckowski M. Labeling peptides with technetium-99m using a bifunctional chelator of a N-hydroxysuccinimide ester of mercaptoacetyltriglycine. J Nucl Med. 1998; 39(1): 56-64
【非特許文献23】Capala J, Barth RF, Bailey MQ, Fenstermaker RA, Marek MJ, Rhodes BA. Radiolabeling of epidermal growth factor with 99mTc and in vivo localization following intracerebral injection into normal and glioma-bearing rats. Bioconjug Chem. 1997; 8(3): 289-295
【非特許文献24】Lundqvist H, Lubberink M, Tolmachev V. Positron Emission Tomography. European Journal of Physics. 1999; 19: 537-552
【非特許文献25】Lundqvist H, Tolmachev V. Targeting peptides and positron emission tomography. Biopolymers. 2002; 66(6): 381-392
【非特許文献26】Hofmann M, Maecke H, Borner R, et al. Biokinetics and imaging with the somatostatin receptor PET radioligand (68)Ga-DOTATOC: preliminary data. Eur J Nucl Med. 2001; 28(12): 1751-1757
【非特許文献27】Ugur O, Kothari PJ, Finn RD, et al. Ga-66 labeled somatostatin analogue DOTA-DPhe1-Tyr3-octreotide as a potential agent for positron emission tomography imaging and receptor mediated internal radiotherapy of somatostatin receptor positive tumors. Nucl Med Biol. 2002; 29(2): 147-157
【非特許文献28】Eisenwiener KP, Prata MI, Buschmann I, et al. NODAGATOC, a new chelator-coupled somatostatin analogue labeled with [67/68Ga] and [111In] for SPECT, PET, and targeted therapeutic applications of somatostatin receptor (hsst2) expressing tumors. Bioconjug Chem. 2002; 13(3): 530-541
【非特許文献29】Froidevaux S, Eberle AN, Christe M, et al. Neuroendocrine tumor targeting: study of novel gallium-labeled somatostatin radiopeptides in a rat pancreatic tumor model. Int J Cancer. 2002; 98(6): 930-937
【非特許文献30】Velikyan I, Beyer GJ, Langstrom B. Microwave-supported preparation of (68)Ga bioconjugates with high specific radioactivity. Bioconjug Chem. 2004; 15(3): 554-560
【非特許文献31】Velikyan I, Lendvai G, Valila M, et al. Microwave accelerated Ga-68-labelling of oligonucleotides. Journal of Labelled Compounds & Radiopharmaceuticals. 2004; 47(1): 79-89
【発明の開示】
【課題を解決するための手段】
【0012】
本発明は、放射性標識ガリウム錯体の標識合成法であって、
(a)68Ga3+放射性同位体を用意し、
(b)68Ga3+放射性同位体をマイクロ波活性化を用いてキレート剤と反応させ、
(c)得られた放射性標識ガリウム錯体を回収すること
を含んでなる方法を提供する。
【0013】
本発明は、さらにPETトレーサーとしての放射性標識ガリウム錯体を提供する。本発明に係る好ましいトレーサーは68Ga−DOTA−hEGFである。
【0014】
さらに別の実施形態では、本発明は、また、放射性標識ガリウム錯体をヒトに投与することを含んでなる、腫瘍におけるEGFR過剰発現のイメージング法であって、上記放射性標識ガリウム錯体が陽電子放射断層撮影でイメージングできるものであり、陽電子放射断層撮影を行って腫瘍におけるEGFR過剰発現を検出する方法を提供する。さらに別の実施形態では、本発明は、68Gaを得るのに使用できるキット及び68Ga−放射性標識錯体の製造に使用できるキットを提供する。
【発明を実施するための最良の形態】
【0015】
本発明の目的の一つは、放射性医薬品として、特にPETでの使用に有用な放射性標識ガリウム錯体の合成法を提供することである。これらは、悪性腫瘍における上皮増殖因子受容体(EGFR)発現の検出に特に有用である。これは、本明細書に記載の方法で達成される。
【0016】
68Gaは68Ge/68Gaジェネレータから得られる。かかるジェネレータは当技術分野で公知であり、例えばC. Loc'h et al, J. Nucl. Med. 21, 1980, 171-173又はJ. Schuhmacher et al. Int. J. appl. Radiat. Isotopes 32, 1981, 31-36を参照されたい。68Geは、例えば20MeVプロトンでのGe2(SO4)3の照射によってサイクロトロン生産で得ることもできる。また、例えば0.5MのHCl中の68Geとしても市販されている。一般に、有機樹脂或いは二酸化スズ、二酸化アルミニウム又は二酸化チタンのような無機金属酸化物からなるカラムに68Geをローディングする。HCl水溶液によってカラムから68Gaが溶出し、68GaCl3が得られる。68Ga3+はその製造にサイクロトロンが不要で、その半減期68分は、長時間放射せずにPETイメージング法での多くのインビボ生化学過程の追跡に十分であるので本発明の方法で特に好ましい。
【0017】
68Ge/68Gaジェネレータに適したカラムは、二酸化アルミニウム、二酸化チタン又は二酸化スズのような無機酸化物、或いはフェノール性水酸基(米国特許第4264468号)又はピロガロール(J. Schuhmacher et al., Int. J. appl. Radiat. Isotopes 32, 1981, 31-36)を含む樹脂のような有機樹脂からなる。好ましい実施形態では、二酸化チタンを含むカラムを備える68Ge/68Gaジェネレータを本発明の方法に用いる。
【0018】
68Ge/68Gaジェネレータカラムからの68Gaの溶出に用いられるHCl水溶液の濃度はカラム材料によって左右される。68Gaの溶出には、0.05〜5MのHClが好適に使用される。好ましい実施形態では、溶出液は、二酸化チタンを含むカラムを備える68Ge/68Gaジェネレータから得られ、68Gaは0.05〜0.1MのHCl、好ましくは約0.1MのHClを用いて溶出される。
【0019】
本発明の方法の好ましい実施形態では、対イオンとしてHCO3−を含む強い陰イオン交換体、好ましくは対イオンとしてHCO3−を含む強い陰イオン交換体を用いる。別の好ましい実施形態では、陰イオン交換体は第四級アミン官能基を含む。さらに別の好ましい実施形態では、陰イオン交換体はポリスチレン−ジビニルベンゼン系の強い陰イオン交換樹脂である。特に好ましい実施形態では、本発明の方法で使用される陰イオン交換体は、対イオンとしてのHCO3−、第四級アミン基を含む強い陰イオン交換樹脂であり、樹脂はポリスチレン−ジビニルベンゼン系である。
【0020】
好適には、本発明の方法では、陰イオン交換体からの68Gaの溶出には水を用いる。
【0021】
本発明の方法で得られる68Gaは、好ましくは68Ga−放射性標識錯体の製造、好ましくは二官能性キレート剤(ターゲティングベクターと結合したキレート剤)を含む68Ga−放射性標識PETトレーサーの製造に用いられる。
【0022】
そこで、本発明の別の態様は、
a)68Ge/68Gaジェネレータからの溶出液を対イオンとしてHCO3−を含む陰イオン交換体と接触させ、陰イオン交換体から68Ga3+を溶出して68Gaを得て、
b)68Gaをキレート剤と反応させる
ことによって68Ga−放射性標識錯体を製造する方法である。
【0023】
本発明の方法での使用に好ましいキレート剤は、生理学的に認容性の形態の68Gaを与えるものである。さらに好ましいキレート剤は、放射性標識錯体を用いた診断検査に要する時間安定な68Ga錯体を形成するものである。
【0024】
適当なキレート剤は、例えばDTPA、EDTA、DTPA−BMA、DOA3、DOTA、NOTA、HP−DOA3、TMT又はDPDPのようなポリアミノポリ酸キレート剤である。これらのキレート剤は放射性医薬品及び放射線診断として周知である。これらの使用法及び合成は、例えば、米国特許第4647447号、同第5362475号、同第5534241号、同第5358704号、同第5198208号、同第4963344号、欧州特許出願公開第230893号、同第130934号、同第606683号、同第438206号、同第434345号、国際公開第97/00087号、同第96/40274号、同第96/30377号、同第96/28420号、同第96/16678号、同第96/11023号、同第95/32741号、同第95/27705号、同第95/26754号、同第95/28967号、同第95/28392号、同第95/24225号、同第95/17920号、同第95/15319号、同第95/09848号、同第94/27644号、同第94/22368号、同第94/08624号、同第93/16375号、同第93/06868号、同第92/11232号、同第92/09884号、同第92/08707号、同第91/15467号、同第91/10669号、同第91/10645号、同第91/07191号、同第91/05762号、同第90/12050号、同第90/03804号、同第89/00052号、同第89/00557号、同第88/01178号、同第86/02841号及び同第86/02005号に記載されている。
【0025】
適当なキレート剤としては、大環状キレート剤、例えばZhang et al., Inorg. Chem. 37(5), 1998, 956-963に記載のポルフィリン様分子及びペンタアザ大環状化合物、フタロシアニン、クラウンエーテル、例えばセパルクレート及びクリプテートのような窒素クラウンエーテル、ヘミン(プロトポルフィリンIXクロリド)、ヘム及び平面正方形の対称性を有するキレート剤が挙げられる。
【0026】
本発明の方法では大環状キレート剤が好ましく使用される。好ましい実施形態では、これらの大環状キレート剤は、ポリアザ−及びポリオキソ大環状化合物のように酸素及び/又は窒素などの1以上の硬いドナー原子を含む。ポリアザ大環状キレート剤の好ましい例としては、DOTA、NOTA、TRITA、TETA及びHETAが挙げられ、DOTAが特に好ましい。
【0027】
特に好ましい大環状キレート剤は、カルボキシル基又はアミン基のようにGa3+への配位には必須ではなく、ターゲティングベクターのような他の分子とキレート剤とのカップリングに使用できる官能基を含む。かかる官能基を含む大環状キレート剤の例は、DOTA、NOTA、TRITA、TETA又はHETAである。
【0028】
さらに好ましい実施形態では、二官能性キレート剤を本発明の方法で用いる。本発明に関して「二官能性キレート剤」とは、ターゲティングベクターと連結したキレート剤を意味する。本発明の方法で有用な二官能性キレート剤に適したターゲティングベクターは、ターゲティングベクターを含む68Ga放射性標識錯体を患者に投与したとき患者の体内の標的部位に結合する化学又は生物学的部分である。本発明の方法で有用な二官能性キレート剤に好ましいターゲティングベクターは、EGFRに対する天然リガンドである上皮増殖因子(EGF)又はそれらの一部、断片、誘導体もしくは錯体である。EGFは分子量(6.2kDa)が小さいので、腫瘍への速い浸透及び速い血液クリアランスが可能となり、良好なコントラストの画像を与える。EGF用の陽電子放射標識の使用は、PETがSPECTに比べて感度、解像度及び数量化の点で優れた検出技術であるので特に有利である。特に好ましいターゲティングベクターは、ヒト組換え上皮増殖因子(hEGF)又はその一部、断片、誘導体もしくは錯体である。
【0029】
特に好ましい実施形態では、大環状二官能性キレート剤を本発明の方法で使用する。好ましい大環状二官能性キレート剤は、DOTA、NOTA、TRITA又はHETAをターゲティングベクター、好ましくはEGF又はその一部、断片、誘導体もしくは錯体、特に好ましくはhEGF又はその一部、断片、誘導体若しく錯体に連結したものからなる。
【0030】
ターゲティングベクターは、リンカー基又はスペーサー分子を介してキレート剤に結合させることができる。リンカー基の例は、ジスルフィド、エステル又はアミドであり、スペーサー分子の例は、鎖状分子、例えばリシン又はヘキシルアミン或いは短鎖ペプチド系スペーサーである。好ましい実施形態では、ターゲティングベクターと放射性標識ガリウム錯体のキレート剤との結合は、ターゲティングベクターが、放射性標識ガリウム錯体の存在によって阻害も妨害もされずに、体内の標的と相互作用できるものである。
【0031】
本発明の好ましい一態様は、
c)68Ge/68Gaジェネレータからの溶出液を、HCO3−を対イオンとして含む陰イオン交換体と接触させて、陰イオン交換体から68Gaを溶出することによって68Gaを得て、
d)68Gaをマイクロ波活性化を用いてキレート剤と反応させる
ことによって68Ga−放射性標識錯体を製造する方法である。
【0032】
マイクロ波活性化の使用によって、68Ga−キレート剤錯体形成の効率及び再現性が大幅に向上することが判明した。マイクロ波活性化によって、化学反応時間を大幅に短縮することができ、反応は2分以内に完了する。反応時間を10分短縮できれば、約10%の68Ga活性が助かるので、明らかな改善である。さらに、マイクロ波活性化は副反応の低減及び選択性の増加による放射化学的収率の向上ももたらす。
【0033】
好適には、マイクロ波活性化の実施にはマイクロ波オーブン、好ましくは単一モードマイクロ波オーブンを用いる。マイクロ波活性化は、好適には80〜120W、好ましくは90〜110W、特に好ましくは約100Wで実施される。好適なマイクロ波活性化時間は20秒〜2分、好ましくは30秒〜90秒、特に好ましくは45秒〜60秒である。
【0034】
本発明の方法で例えばペプチド又はタンパク質をターゲティングベクターとして含む二官能性キレート剤のような温度感受性のキレート剤を用いるときは反応の温度制御が推奨される。マイクロ波活性化の期間は、反応混合物の温度がキレート剤及び/又はターゲティングベクターの分解を生じないように調節すべきである。本発明の方法で用いるキレート剤がペプチド又はタンパク質を含む場合、高い温度を短時間加える方が低い温度を長時間加えるよりも概して有利である。
【0035】
マイクロ波活性化は連続的に或いは反応の過程で幾つかのマイクロ波活性化周期で実施できる。
【0036】
本発明の別の態様は、68Ge/68Gaジェネレータから68Gaを得るためのキットであって、ジェネレータカラムとHCO3−を対イオンとして含む陰イオン交換体からなる第の二カラムとを備えるキットである。
【0037】
好ましい実施形態では、キットは、複数のカラムを直列に接続する手段及び/又は68Gaをジェネレータカラムから溶出するためのHCl水溶液及び/又は68Gaを陰イオン交換カラムから溶出するための水をさらに備える。HCl及び水は好ましくは無菌であり、密封容器に収容されている。
【0038】
別の好ましい実施形態では、本発明に係るキットは、キレート剤、好ましくは二官能性キレート剤つまりターゲティングベクターに結合したキレート剤をさらに含む。
【0039】
本発明は、PETトレーサーとしての放射性標識ガリウム錯体をさらに提供する。本発明に係る好ましいトレーサーは68Ga−DOTA−hEGFである。
【0040】
さらに別の実施形態では、本発明は、放射性標識ガリウム錯体をヒトに投与することを含んでなる、腫瘍におけるEGFR過剰発現のイメージング法であって、上記放射性標識ガリウム錯体が陽電子放射断層撮影でイメージングできるものであり、陽電子放射断層撮影法を行って腫瘍におけるEGFR過剰発現を検出する方法も提供する。
【実施例】
【0041】
以下の実施例で本発明をさらに例証するが、本発明はこれらの実施例に限定されるものではない。
【0042】
実施例1−68Ga−DOTA−hEGF調製の化学及び放射化学
I.材料
組換えヒト上皮増殖因子(hEGF)は、Chemicon社(米国カリフォルニア州テメキュラ)から購入した。酢酸ナトリウム(99.995%)、HEPES(4−(2−ヒドロキシエチル)ピペラジン−1−エタンスルホン酸)、再蒸留塩酸(Reidel de Haen社製)はSigma−Aldrich Sweden(スウェーデン国ストックホルム)から入手した。リン酸二水素ナトリウム、リン酸水素二ナトリウム及びトリフルオロ酢酸(TFA)は、Merck社(ドイツ国ダルムシュタット)から入手した。DOTA(1,4,7,10−テトラアザシクロドデカン−1,4,7,10−テトラ酢酸)のスルホ−NHSエステルは、Macrocyclics社(米国テキサス州ダラス)から購入した。購入した化学物質はそれ以上精製せずに使用した。すべての反応で、Elga社製Purelab Maxima系(英国バッキンガムシャー)で製造した脱イオン水(18.2MΩ)を使用した。68Gaは68Ge/68Gaジェネレータ(Cyclotron C.、ロシア国オブニンスク)から入手した。
【0043】
II.HPLC分析
液体クロマトグラフィー(LC)分析は、126ポンプ、166UV検出器及び放射線検出器を直列に連結したBeckman社(米国カリフォルニア州フラートン)製のHPLCシステムを用いて行った。データの取得及び操作はBeckman System Gold Nouveau Chromatographyソフトウェアパッケージを用いて行った。使用したカラムは、寸法150mm×4.6mm、粒径5μmのVydac RP 300Å HPLCカラム(Vydac社、米国)である。用いた勾配溶出は以下のパラメーターであった:A=10mMのTFA、B=70%アセトニトリル(MeCN)、30%H2O、10mMのTFAで220nmでのUV検出、流速は1.2mL/分、20%Bの均一濃度で0〜2分、20〜90%Bの直線濃度勾配8分、90〜20%Bの直線濃度勾配2分。カラムに保持された68Ga−DOTA−hEGF及び放射性不純物の量は、カラムに注入した試料及び出口から回収した画分の活性を結晶シンチレーションカウンターで測定することによって得ることができた。システムでの全損失は10%であった。68Ga−DOTA−hEGF及び親水性放射性不純物の画分の測定放射能はHPLCクロマトグラムから得られたそれぞれの値と一致した。対応する相対標準偏差は親水性放射性不純物及び68Ga−DOTA−hEGFについてそれぞれ7%及び0.5%であった。
【0044】
III.68Ga−DOTA−hEGFの調製
0.08Mホウ酸緩衝液(pH9.4)中のhEGF(32〜70ナノモル、80〜180μL)を攪拌しながら乾燥DOTAのN−ヒドロキシスルホスクシンイミドエステル(10〜20倍過剰)に加え、ホウ酸緩衝液(240〜340μL)を加えてpHを9.0に調整した。混合物を室温で3〜4時間又は一晩放置した。コンジュゲートをBio−select RP C18 C−18 SPEカラム(Vydac社製)で精製した。反応混合物を抽出ディスクにゆっくりと流し、次いで2mLの0.1%TFAで洗浄した。生成物は、0.1%のTFAを含む1mLの70%アセトニトリルで溶出した。溶媒を、50℃で作動させた真空遠心分離機(Labconco社(米国ミズーリ州カンザスシティ)製CentriVap Console)を用いて蒸発させ、乾燥精製標品を0℃未満の温度で保存した。
【0045】
コンジュゲートの標識は、先行技術に記載の通り(Velikyan I, Beyer GJ, Langstrom B. Microwave-supported preparation of (68)Ga bioconjugates with high specific radioactivity. Bioconjug Chem. 2004; 15(3): 554-560)、未濃縮68Ga−溶出液又は予備濃縮した溶出液のいずれかを用いて行った。場合によっては、標識反応に用いる68Gaの量を増すため、2つのジェネレータからの溶出液を予備濃縮した。標識反応に使用したDOTA−hEGFの量は、未濃縮及び予備濃縮した68Ga−溶出液を使用するときそれぞれ6〜10及び2〜5ナノモルであった。未濃縮68Gaでの標識には酢酸ナトリウム緩衝液(pH5.0〜5.5)を使用し、予備濃縮した溶出液ではHEPES緩衝液(pH4.6〜4.8)を使用した。標識は1分間のマイクロ波加熱で実施した。生成物は、上述のBio−select RP C18 C−18 SPEカラムで精製した。次いで溶媒をNAP−5カラム(Sephadex G−25、Amersham Pharmacia Biotech社(スウェーデン国ウプサラ)製)でPBS(リン酸緩衝食塩水)緩衝液に交換した。コンジュゲートの純度はHPLCで調べ、コンジュゲート及びトレーサーの濃度はUV−HPLC較正曲線から求めた。
【0046】
hEGFへの68Gaの結合がDOTAで媒介されることを検証するため、ブランク試験を行った。操作は上記と同じであるが、非連結hEGFを使用した。
【0047】
69,71Gaの天然同位体組成物を同じ手順を用いてDOTA−hEGFと錯体化した。放射性HPLCクロマトグラムシグナルの同定には、LC−ESI−MSで特性決定した69,71Ga−DOTA−hEGFを用いた。
【0048】
IV.マイクロ波加熱及びLC−ESI−MS分析
マイクロ波加熱は、2450MHzでの連続照射を発生するSmithCreator(商標)単一モード空洞共振器(Personal Chemistry社(スウェーデン国ウプサラ)製)で実施した。反応の間、温度、圧力及び照射出力をモニターした。照射完了後、反応バイアルを加圧空気で冷却した。
【0049】
Waters Micromass Quattro Premier質量分析計(Micromass社(英国)製)及びフォトダイオードアレーUV検出器を備えたAlliance社製(Waters 269、英国)HPLCシステムを用いてエレクトロスプレーイオン化液体クロマトグラフィー質量分析(LC−ESI−MS)を行った。使用したカラムは、寸法100mm×2.1mm、粒径3μmのAtlantis dC 18 RP HPLCカラムである。均一濃度溶出を以下のパラメーターで用いた。A=10mMギ酸、B=100%アセトニトリル(MeCN)であり、210〜400nmでのUV検出、流速0.3mL/分。LC−ESI−MSは、ポジティブモードスキャン及び[M+6H]6+、[M+7H]7+及び[M+8H]8+種を検出する選択イオン記録(SIR)で実施した。hEGFは、[M+8H]8+についてm/z=781.5、[M+7H]7+についてm/z=893及び[M+6H]6+についてm/z=1042で検出された。データを再構成すると、M=6244.67±1.15となる。(DOTA)1−hEGFは、[M+8H]8+についてm/z=829.75、[M+7H]7+についてm/z=948.13及び[M+6H]6+についてm/z=1105で検出された。データを再構成すると、M=6629.95±0.05となる。(DOTA)2−hEGFは、[M+8H]8+についてm/z=878、[M+7H]7+についてm/z=1103.3及び[M+6H]6+についてm/z=1170.36で検出された。データを再構成すると、M=7016±0.08となる。(DOTA)3−hEGFは、[M+8H]8+についてm/z=926.29、[M+7H]7+についてm/z=1058.47及び[M+6H]6+についてm/z=1234.72で検出された。データを再構成すると、M=7402±0.1となる。(Ga−DOTA)1−hEGFは、[M+8H]8+についてm/z=838.5、[M+7H]7+についてm/z=958.13及び[M+6H]6+についてm/z=1117.66で検出された。データを再構成すると、M=6699.95±0.05となる。(Ga−DOTA)2−hEGFは、[M+8H]8+についてm/z=896.05、[M+7H]7+についてm/z=1023.3及び[M+6H]6+についてm/z=1193.69で検出された。データを再構成すると、M=7157.55±2.47となる。(Ga−DOTA)3−hEGFは、[M+8H]8+についてm/z=952.54、[M+7H]7+についてm/z=1088.47及び[M+6H]6+についてm/z=1269.72で検出された。データを再構成すると、M=7612.31±0.05となる。
【0050】
V.結果
68Ga−DOTA−hEGFは、まずhEGFを二官能性キレート剤DOTAに連結し、次いでキレート剤と68Gaとの錯形成反応による68Gaでの標識との二段階法で合成した。連結段階においてDOTAキレートのカルボキシル基の1つがペプチドのアミン官能価とカップリングしてアミド結合を形成する(スキーム1)。連結反応に必要な塩基性pHはホウ酸緩衝液で与えた。hEGFは、1残基の末端リシンと2残基のリシンアミノ基を含有する。したがって、LC−ESI−MS分析で判明したように、hEGFの連結反応で、DOTA断片を1、2及び3個有する分子の混合物が形成される。
【0051】
コンジュゲートのマイクロ波促進標識(スキーム1)を、未濃縮又は予備濃縮ジェネレータ68Ga溶出液を用いて実施した。未濃縮コンジュゲートの場合、標識収率は60±10%(N=3)であった。予備濃縮したものを用いると、77±4%(N=3)に増加させることができた。溶出液を予備濃縮すると28MBq/nmolの比放射能を得ることができた。非連結hEGFを同じように処理しても標識ペプチドは得られなかったので、hEGFへの68Gaの結合はDOTAで媒介される。この研究におけるトレーサーの放射化学純度は99%超であった。このトレーサーはPBS中で安定であり、4時間の安定性アッセイでそれ以上の放射性HPLC信号を生じなかった。
【0052】
【化1】

実施例2−細胞結合及び保持実験
I.細胞培養
ヒト扁平上皮癌細胞系A431(ATCC、CLR 1555、米国メリーランド州ロックビル)及び悪性神経膠腫細胞系U343MGaC12:6(Westermark B, Magnusson A, Heldin CH. Effect of epidermal growth factor on membrane motility and cell locomotion in cultures of human clonal glioma cells. J Neurosci Res. 1982; 8(2-3): 491-507)(以下、「U343」という)をすべての細胞実験で使用した。A431細胞系は1細胞当り約2×106個のEGFRを発現し、U343細胞系は1細胞当り約5.5×105個のEGFRを発現すると報告されている。細胞は、10%ウシ胎仔血清(Sigma社製)、L−グルタミン(2mM)及びPEST(ペニシリン100IU/ml及びストレプトマイシン100μg/ml)(いずれもBiochrom社製)を添加したHam’s F10培地(Biochrom社製)で培養した。細胞培養及び細胞実験の際の細胞は(特記しない限り)、5%CO2で平衡化した加湿空気を入れたインキュベーター中37℃で増殖させた。細胞はBiochrom社製のトリプシン−EDTA(Ca及びMgを含まないPBS中、0.25%トリプシン、0.02%EDTA)でトリプシン処理した。
【0053】
II.細胞への68Ga−DOTA−EGFの結合
A431及びU343細胞は3cmシャーレ中で培養した(それぞれ1シャーレ当りの細胞数3.5×105及び1.9×105)。細胞を1回洗浄した後、細胞培養液中の68Ga−DOTA−EGF(A431細胞では35ng/シャーレ、50kBq/シャーレ、U343細胞では5ng/シャーレ、20kBq/シャーレ)を添加した。添加したトレーサーの濃度は、A431細胞では0.26〜16.9nM、U343細胞では0.14〜36nMであった。幾つかのシャーレには、モル過剰のEGF(5又は3μg/シャーレ)を標識コンジュゲートと共に添加して68Ga−DOTA−EGFコンジュゲートの結合特異性を調べた。37℃で0.5〜6時間のインキュベートした後、細胞を血清不含非放射性培地で6回洗浄し、次いで0.5mlのトリプシン−EDTA(37℃、15分)を用いて細胞を回収した。1mlの細胞培養液の添加によってトリプシン処理を終了し、細胞懸濁液の一部(0.5ml)を細胞計数に使用し、残りはガンマカウンターで測定した。
【0054】
68Ga−DOTA−EGFコンジュゲートの細胞内部移行を調べるため、結合実験の際に多数の追加の細胞シャーレを用いて、コンジュゲートの膜結合画分を内部移行放射能から分離した。コンジュゲートの膜結合画分の抽出には、細胞のトリプシン処理に代えて、0.5mlの氷冷0.1Mグリシン−HCl緩衝液(pH2.5)での0℃で6分間の処理を用いた。追加の0.5mlのグリシン−HCl緩衝液を用いて細胞を1回洗浄した。内部移行放射能と考えられる残りの放射能は、37℃で0.5mlの1M NaOH溶液で約60分間処理することによって回収した。別途0.5mlのNaOH溶液を洗浄に用いた。回収画分は自動ガンマカウンターで測定した。
【0055】
飽和実験で結合に要する時間を求めるため、氷上でのA431細胞及びU343細胞への68Ga−DOTA−EGFの結合も調べた。氷上に載せた細胞シャーレを氷冷68Ga−DOTA−EGF溶液と共に0.5〜4時間インキュベートした。次いで細胞を上述の通り洗浄し、トリプシン処理し、カウントした。
【0056】
III.放射能の細胞保持、飽和アッセイ及び動物腫瘍モデル
68Ga−DOTA−EGFで1時間インキュベートした後、放射能の細胞保持を調べた。インキュベーション後、細胞を十分に洗浄して未結合コンジュゲートを除去し、次いで新鮮な細胞培養液中でインキュベーションを続けた。0.5〜4時間後、細胞を上述の通りトリプシン処理し、計数し、放射能測定した。
【0057】
A431細胞及びU343細胞での68Ga−DOTA−EGFによる飽和実験から解離平衡定数Kdを求めた。24ウェルシャーレで培養した細胞(1ウェル当り約3.1×104個のA431細胞及び1ウェル当り約7.8×104個のU343細胞)を氷上に載せ、様々な濃度の氷冷68Ga−DOTA−EGF溶液(A431では0.26〜16.9nM、U343では0.14〜36nM)を添加した。各濃度について、100倍過剰の非標識EGFを幾つかのウェルに添加して非特異的なバックグラウンド結合を調べた。2時間インキュベートした後(この時間は氷上での取込み実験の結果から決定した。)、細胞を血清不含非放射性培地で6回洗浄した。細胞を次で0.5mlのトリプシン−EDTAでトリプシン処理し(37℃で15分間)、細胞数を計数するとともにガンマカウンターで放射能測定した。
【0058】
腫瘍を異種移植した成熟雌Balb/c nu/nuマウス(21〜25g)(Mollegard、デンマーク)でインビボ実験を実施した。動物はすべてスウェーデン動物愛護協会の指針に準拠して取り扱い、実験は当地の動物実験に関する倫理委員会によって承認された。マウスの両前肢にA431腫瘍細胞(100μlの細胞培養液中の腫瘍当り約7百万個の細胞)を皮下注射した。腫瘍を12〜13日間増殖させてから実験を行ったが、そのときの重量は0.1〜0.8gに達していた。
【0059】
IV.結果
インビトロでのEGFR発現細胞系への68Ga−DOTA−EGFの結合特異性を図1に示す。細胞実験では、EGFRの発現が報告されている子宮頚癌A431及び神経膠腫U343細胞系を使用した。結合が受容体特異性であることを実証するため、対照実験では大量の非標識EGFを細胞に添加してEGFRを飽和させた。結合特異性実験の結果は、すべての試験データポイントで両細胞系への68Ga−DOTA−EGFの結合が受容体の飽和によって阻止されることを示していた。これは標識コンジュゲートの結合が受容体特異的であることを示している。
【0060】
子宮頚癌A431及び神経膠腫U343細胞系での68Ga−DOTA−EGFによる飽和実験の結果を、それぞれ図2A及び2Bに示す。amol/細胞で示す特異的結合を、添加した放射性標識コンジュゲートの合計モル濃度に対してプロットし、結果をGraphPad Prismソフトウェアを用いた非線形回帰分析で解析した。いずれの曲線も最大値に達し、飽和したことを示している。得られたKd値はA431では2.0nM、U343では2.3nMであり、よく一致していた。U343での細胞当りの結合部位の最大数7.8×105という値は、[111In]−Bz−DTPA−EGFコンジュゲートで従前報告されている5.4×105という値(22)とまずまず一致している。A431での細胞当り190万という結合部位の数も、文献記載のデータとよく一致している。
【0061】
この実験では、内部移行の程度を酸洗浄によって評価した。放射能のうち、酸性緩衝液で細胞から除かれるものは膜結合型と考えられ、残りは内部移行したものと考えられる。かかる実験の結果を図3に示すが、この図から、いずれの細胞系でも68Ga−DOTA−EGFの内部移行が迅速なプロセスであることが分かる。ただし、これらの実験の結果は、内部移行の速度がA431に比べて神経膠腫U343細胞で速かったことを示している。これは、内部移行した受容体を細胞表面に再循環できるというA431細胞について報告された能力によるものかもしれない。神経膠腫U343細胞の場合には、インキュベーションを開始してから30分で50%を超える放射能が内部移行した。
【0062】
68Ga−DOTA−EGFでのインキュベーションを中断した後の放射能の保持パターンはA431及びU343細胞いずれの細胞系でも同様であった(図4)。最初に放射能が降下するが(膜結合コンジュゲートの解離による可能性が最も高い。)、その後は細胞結合68Gaの量は比較的一定である。いずれの細胞系も良好な保持性を示し、インキュベーション中断後、標識の半減期の3倍を越える4時間の間、70%を超える放射能が依然として細胞に結合していた。
【0063】
実施例3−体内分布実験
I.A431腫瘍を異種移植したマウスにおける体内分布
コンジュゲート注入量が腫瘍及び健常組織への取り込みに与える影響を調べるため、体内分布実験を行った。A431腫瘍を異種移植したマウスに、50μlの68Ga−DOTA−EGF溶液(1匹当りPBS中0.16nmol又は0.016nmol)を静脈内注射し、30分後にマウスを屠殺して解剖した。マウスは、Rompun(1mg/ml)とKetalar(10mg/ml)の混合物をマウス体重10g当り0.2ml腹腔内投与して麻酔し、心臓穿刺によって屠殺した。腫瘍の他に、血液、心臓、膵臓、脾臓、胃、肝臓、腎臓、肺、小腸及び大腸、筋肉、骨並びに唾液腺を回収して秤量し、自動ガンマカウンターで測定した。注射の正確さを判定するため、尾部についても放射能含量を測定した。臓器の値は、臓器1g当りの注射した放射能の百分率(%IA/g)として計算した。
【0064】
II.結果
A431担癌マウスにおける68Ga−DOTA−EGFの体内分布データの概要を図5に示す。68Ga−DOTA−EGFの静脈内投与30分後の臓器放射能の計測は、いずれのコンジュゲートについても腎臓及び肝臓で最も高い値を示した。膵臓、唾液腺、小腸及び大腸、胃並びに脾臓では放射能蓄積量は低かった。A431腫瘍異種移植片への68Ga−DOTA−EGFの取込みは、0.016nmol及び0.16nmolのコンジュゲート注射でそれぞれ1.51±0.16%IA/g及び2.69±0.29%IA/g(p=0.036)であった。放射性トレーサーは速い血液クリアランスを有しており、いずれのコンジュゲートでも(大差なく)、30分循環したときの残存量は1%IA/g未満であった。コンジュゲートの注入量が増すと、膵臓、脾臓及び胃における放射能取込み量に統計的に有意な減少が認められた。腫瘍対健常臓器に注目すると、コンジュゲート量の増加の影響は一段と顕著である。腫瘍対血液比では、0.016及び0.16nmolのコンジュゲート注射のそれぞれで4.42±1.81%IA/g及び4.50±2.53%IA/g(p=0.036)と差異はないが、心臓、膵臓、胃、脾臓、肺、腸、筋肉及び唾液腺では、0.16nmolのコンジュゲートを注射したときに腫瘍対臓器比に統計的に有意な増加が認められる。
【0065】
実施例4−microPETイメージング
イメージングは、コンピューター制御式ベッドを備えた断面視野10cm及び軸方向視野8cmのmicroPET R4スキャナー(Concorde Microsystems社)で行った。それは専ら三次元リストモードで作動させ、セプタはなかった。すべての生データをまず三次元シノグラムとし、次いでフーリエリビニング及び二次元フィルタ逆投影による画像再構成によって解像度2mmの画像を得る。マウスは実験直前に実験室に持ち込んだ。マウスを赤色電球下で短時間加温した後、酸素と空気の45/55%混合気に2%のイソフルレンを供給するように調節したイソフルレン気化器に接続したシリンダー内に入れた。マウスが気絶したら、ヘパリン処理した静脈カテーテルを尾静脈に入れ、0.9%NaCl及び10IUのヘパリンを含む1ml注射器に接続した。しかる後、マウスを腹部を下にして腫瘍のある前肢を体からできるだけ前に伸ばしてカメラベッドにセットし、熱及び水分損失を最小限にするためサランラップで覆った。実験中の体温の損失を減少させるために熱風(40℃)をマウスに吹き付けた。カメラを始動した直後に大量瞬時投与としてトレーサーを100μl注射し、次いで100μlの生理食塩水を注射した。実験終了後、マウスを麻酔状態で断頭し、血液、肝臓及び腎臓試料を回収して放射能測定した。
【0066】
散乱補正、ランダムカウント及び不感時間補正をすべて再構成アルゴリズムに組み込んだ。トレーサー注射前に68Ge/68Gaを含む2本の回転ロッド源で各マウスにおける放射能減衰を測定し、画像を放射能減衰について補正した。PET試験はすべて20分透過スキャンで開始した。注射した納車能量は2.0±0.5MBqであった。この実験では、2通りのイメージングプロトコルを使用した。取得時間は以下の通りであった:プロトコル1(期間120分)10×30秒、5×120秒及び5×300秒、8×600秒、プロトコル2(期間30分)10×30秒、5×60秒、10×120秒。関心領域(ROI)を、肝臓、腎臓、膀胱、唾液腺及び腫瘍に描いた。注射後の時間経過としての放射能濃度(組織1g当りの注射量の百分率)を表す薬物動態曲線を求めた。取込み指数は、臓器中の放射能[kBq/mL]/注射量[kBq]×100%として計算した。
【0067】
microPETイメージングで求めた担癌マウスにおける68Ga−DOTA−EGFの局在化(図6)に続いて、マウスの断頭後回収した血液、肝臓、及び腎臓の試料の放射能測定を行った。2.0MBq(比放射能12〜20MBq/nmol)の68Ga−DOTA−EGF投与30分後の担癌マウスの画像を、図6の左側に示す。microPETイメージングの評価結果を、血液、肝臓及び腎臓試料の放射能測定と相関させた。右左の脚の腫瘍はいずれも周辺のバックグラウンドから明瞭なコントラストで視認できた。肝臓及び腎臓で顕著な取込みが観察され、膀胱を通しての放射能のクリアランスが歴然であった(図7)。腫瘍及び唾液腺への分布は比較的遅かった。microPET及び体内分布実験で得られた取込みデータは、イメージング後の組織サンプリングで得られたデータと一致し、対照できることが判明した。
【0068】
具体的な実施形態、参照文献
本発明の技術的範囲は本明細書に記載した特定の実施形態によって限定されるものではない。実際、本明細書の以上の記載から当業者には本明細書に記載した変更例以外の変更例も明らかであろう。かかる変更例も特許請求の範囲に記載された技術的範囲に属する。
【0069】
本明細書では、様々な刊行物及び特許出願を引用したが、それらの開示内容は援用によって本明細書の内容の一部をなす。
【図面の簡単な説明】
【0070】
【図1】A431癌腫(a)及びU343神経膠腫(b)細胞系に対する68Ga−DOTA−EGFの結合特異性を示す図。すべての時点で、対照細胞のEGF受容体は100倍過剰量の非標識EGFで遮断した。結合を抑圧することができたことから、結合が特異的であることが分かる。図示したデータは3つの測定値の平均と標準偏差である。
【図2】培養癌腫A431及び神経膠腫U343細胞への68Ga−DOTA−hEGFの結合の飽和を示す図。それぞれ非特異的結合及び全結合量を得るため非標識hEGFの存在下又は非存在下で、様々な濃度の68Ga−DOTA−hEGF(A431細胞では0.26〜16.9nM及びU343細胞では0.14〜36nM)と共に氷上で2時間インキュベートした。データはGraphPad Prism 3.0で解析した。すべてのデータポイントは3以上のデータポイントの平均であり、最大偏差も示す。
【図3】癌腫A431細胞及び神経膠腫U343細胞に結合した後の68Ga−DOTA−EGFの内部移行を示す図。内部移行は、異なる2つの時点での酸洗浄によって測定した。酸性緩衝液で細胞から除かれたものは膜結合型であり、その残りは内部移行したものと考えた。図示したデータは3つの測定値の平均と標準偏差である。
【図4】68Ga−DOTA−EGFでのA431(実線)及びU343(破線)のインキュベーションを中断した後の時間の関数としての細胞結合68Ga放射能を示す図。インキュベーション中断後時間0での細胞結合放射能を100%とみなした。すべてのデータポイントは3つの測定値の平均と標準偏差である。A431及びU343の細胞培養液はいずれも68Ga−DOTA−hEGFで4時間インキュベートした。
【図5】図5Aは、担癌ヌードマウスにおける30分の時点での組織1グラム当りの注入量%として表される68Ga−DOTA−EGFの体内分布の図である。図5Bは、担癌ヌードマウスにおける30分の時点での68Ga−DOTA−EGFの腫瘍対組織比を示す図である。マウスには、0.016nmol又は0.16nmolのいずれかの量の放射性トレーサーを静脈内注射した。データは平均±標準偏差(n=4)として示す。
【図6】図6左は、フレーム20〜24の相加を示す画像(x−注入30分後)である。頭の両側に腫瘍が明瞭に認められる。図6右はマウスの配置の写真である。
【図7】68Ga−DOTA−EGFの(0.16nmol注入)の肝臓、腎臓及び腫瘍への急速な分布を示す薬物動態曲線である。尿中への排出が観測期間を通して継続する。
【特許請求の範囲】
【請求項1】
放射性標識ガリウム錯体の標識合成方法であって、
(a)68Ga3+放射性同位体を用意し、
(b)68Ga3+放射性同位体をマイクロ波活性化を用いてキレート剤と反応させ、
(c)得られた放射性標識ガリウム錯体を回収する
ことを含んでなる方法。
【請求項2】
キレート剤が大環状キレート剤である、請求項1記載の方法。
【請求項3】
キレート剤が硬いドナー原子、好ましくはO原子及びN原子を含む、請求項1記載の方法。
【請求項4】
キレート剤が二官能性キレート剤である、請求項1記載の方法。
【請求項5】
キレート剤が、ターゲティングベクターを含む二官能性キレート剤である、請求項1記載の方法。
【請求項6】
ターゲティングベクターがEGF又はその一部、断片、誘導体もしくは錯体である、請求項5記載の方法。
【請求項7】
EGFがhEGFである、請求項6記載の方法。
【請求項8】
マイクロ波活性化が80〜120W、好ましくは90〜110Wで実施される、請求項1記載の方法。
【請求項9】
マイクロ波活性化が20秒〜2分間、好ましくは30秒〜90秒間実施される、請求項1記載の方法。
【請求項10】
68Ge/68Gaジェネレータからの溶出液を陰イオン交換体と接触させ、陰イオン交換体から68Ga3+を溶出することによって68Ga3+を得る、請求項1記載の方法。
【請求項11】
68Ge/68Gaジェネレータが、二酸化チタンを含むカラムを備える、請求項10記載の方法。
【請求項12】
前記陰イオン交換体がHCO3−を対イオンとして含む、請求項11記載の方法。
【請求項13】
前記陰イオン交換体が強陰イオン交換体である、請求項10記載の方法。
【請求項14】
請求項1記載の方法で合成される放射性標識ガリウム錯体。
【請求項15】
式68Ga−DOTA−hEGを有する、請求項14記載の放射性標識ガリウム錯体。
【請求項16】
放射性標識ガリウム錯体をヒトに投与することを含んでなる、腫瘍におけるEGFR過剰発現のイメージング方法であって、上記放射性標識ガリウム錯体がPETでイメージングできるものであり、PETを行って腫瘍におけるEGFR過剰発現を検出する方法。
【請求項17】
前記放射性標識ガリウム錯体が68Ga−DOTA−hEGFである、請求項16記載の方法。
【請求項1】
放射性標識ガリウム錯体の標識合成方法であって、
(a)68Ga3+放射性同位体を用意し、
(b)68Ga3+放射性同位体をマイクロ波活性化を用いてキレート剤と反応させ、
(c)得られた放射性標識ガリウム錯体を回収する
ことを含んでなる方法。
【請求項2】
キレート剤が大環状キレート剤である、請求項1記載の方法。
【請求項3】
キレート剤が硬いドナー原子、好ましくはO原子及びN原子を含む、請求項1記載の方法。
【請求項4】
キレート剤が二官能性キレート剤である、請求項1記載の方法。
【請求項5】
キレート剤が、ターゲティングベクターを含む二官能性キレート剤である、請求項1記載の方法。
【請求項6】
ターゲティングベクターがEGF又はその一部、断片、誘導体もしくは錯体である、請求項5記載の方法。
【請求項7】
EGFがhEGFである、請求項6記載の方法。
【請求項8】
マイクロ波活性化が80〜120W、好ましくは90〜110Wで実施される、請求項1記載の方法。
【請求項9】
マイクロ波活性化が20秒〜2分間、好ましくは30秒〜90秒間実施される、請求項1記載の方法。
【請求項10】
68Ge/68Gaジェネレータからの溶出液を陰イオン交換体と接触させ、陰イオン交換体から68Ga3+を溶出することによって68Ga3+を得る、請求項1記載の方法。
【請求項11】
68Ge/68Gaジェネレータが、二酸化チタンを含むカラムを備える、請求項10記載の方法。
【請求項12】
前記陰イオン交換体がHCO3−を対イオンとして含む、請求項11記載の方法。
【請求項13】
前記陰イオン交換体が強陰イオン交換体である、請求項10記載の方法。
【請求項14】
請求項1記載の方法で合成される放射性標識ガリウム錯体。
【請求項15】
式68Ga−DOTA−hEGを有する、請求項14記載の放射性標識ガリウム錯体。
【請求項16】
放射性標識ガリウム錯体をヒトに投与することを含んでなる、腫瘍におけるEGFR過剰発現のイメージング方法であって、上記放射性標識ガリウム錯体がPETでイメージングできるものであり、PETを行って腫瘍におけるEGFR過剰発現を検出する方法。
【請求項17】
前記放射性標識ガリウム錯体が68Ga−DOTA−hEGFである、請求項16記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2008−531988(P2008−531988A)
【公表日】平成20年8月14日(2008.8.14)
【国際特許分類】
【出願番号】特願2007−555725(P2007−555725)
【出願日】平成18年2月21日(2006.2.21)
【国際出願番号】PCT/IB2006/000345
【国際公開番号】WO2006/090232
【国際公開日】平成18年8月31日(2006.8.31)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.サランラップ
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
【公表日】平成20年8月14日(2008.8.14)
【国際特許分類】
【出願日】平成18年2月21日(2006.2.21)
【国際出願番号】PCT/IB2006/000345
【国際公開番号】WO2006/090232
【国際公開日】平成18年8月31日(2006.8.31)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.サランラップ
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
[ Back to top ]

