放射性薬品化合物
【課題】テクネチウムまたはレニウムで放射線標識したドーパミントランスポータ(PAT)画像化剤で、血液脳関門を追加出来、PATに対し高い結合親和性と、選択性とを有する物質を与える。
【解決手段】放射性薬品化合物は、トロパン化合物をテクネチウムまたはレニウムを錯体化出来るキレート配位子に8位置でN原子を介して連結し、10以上の比率でセロトニントランスポータと選択的に結合する中性標識した錯体を調製することにより得る。また放射性薬品化合物は個別のジアステレオアイソマーしておよびジアステレオアイソマーの混合物としても調剤出来る。また標識放射性薬品化合物を調合するための放射性薬品キットも開示されている。
【解決手段】放射性薬品化合物は、トロパン化合物をテクネチウムまたはレニウムを錯体化出来るキレート配位子に8位置でN原子を介して連結し、10以上の比率でセロトニントランスポータと選択的に結合する中性標識した錯体を調製することにより得る。また放射性薬品化合物は個別のジアステレオアイソマーしておよびジアステレオアイソマーの混合物としても調剤出来る。また標識放射性薬品化合物を調合するための放射性薬品キットも開示されている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ドーパミントランスポータ(DAT)に対し高い親和性と優れた選択性を有する放射性物質で標識した配位子より成る配位錯体であって、神経変質性疾患用の早期診断と治療に有効使用出来る。配位錯体による放射性薬品化合物に関する。
【背景技術】
【0002】
ドーパミントランスポータ(DAT)は、脳内の生理学的、薬理学的及び病理学的プロセスにおいて決定的な役割を演じる。輸送系は接合ドーパミンの効果を終端させる主要なメカニズムであり、ドーパミンシステムにおける恒常性の維持に貢献する。これは、又、脳内コカインの主ターゲットであると考えられる。(KennedyとHandauer、ニューロ化学、1983年、41、172-178;Shoemaker他、Naunyn-Schmeideberg’s Arch.薬理学、1985年、329、227-235;Reith他、生化学薬物学、1986年、35、1123-1129; Ritz他、科学、1987年、237、1219-1223; Madras他、薬理試験治療、1989a、251、131-141; Bergman他、薬理試験治療、1889、251、150-155;MadrasとKaufman、シナプス、1994年、18、261-275)。
【0003】
さらに、ドーパミントランスポータは神経毒がドーパミン含有細胞に入り込む導管でもある。線条は脳内ドーパミンの最高レベルの終端を有する。高密度のDATは線条におけるドーパミンニューロンに位置し、多数の生理学的及び薬理学的状態に対するマーカであると考えられる。例えば、パーキンソン病において、ドーパミンは急激に減少するので、線条中のDATの消耗はパーキンソン病の指標であった(Shoemaker他、Naunyn-Schmeideberg’s Arch.薬理学,1985年、329、227-235; KaufmanとMadras 、シナプス、1991年、9、43-49)。従って、パーキンソン病の早期及び予症候診断は、線条内のDATの消耗を量的に測定することにより達成出来る(KaufmanとMadras 、シナプス、1991年、9、43-49)。
【0004】
簡単で非侵襲的なDAT監視方法は、非常に重要である。消耗は、シンチレーションカメラシステムと、適当な画像化物質を用いた脳内画像化のような非侵襲的な手段により測定できる(Frost他、神経学会紀要、1993年、34、423-431;Hantray他、神経学報告、1992年、3、265-268)。ドーパミントランスポータの画像化は、病気の進行及びドーパミンニューロン又は病気の進行を遅らせる薬剤の注入治療による病気の逆転を観察することを可能にする。Tourrette症候群、LeschNyhan症候群及び多分Rette症候群を含む他の神経精神障害もDAT密度の変化によって指標付けることが出来る。
【0005】
また、DATは、最も広範に使用されている注意力欠損障害用薬剤、メチルフェニデート(methylphenidate)のターゲットでもある。この病気の患者でのこのトランスポータを監視出来れば、診断及び治療することが可能になる。さらに、ドーパミンニューロンの年齢による減少は、ドーパミントランスポータの減少にその反映を見ることが出来る(KaufmanとMadras 、Brain Res.、1993年、611、322-328;vanDyck他、核医学、1995年、36、1175-1181)又、神経精神障害の領域外のドーパミンの不足に関する画像を提供することが出来る。
【0006】
物質乱用者の脳内のDAT密度は、正常な脳内のDAT密度と著しく異なることも示されている。例えば、コカイン乱用者の死後の細胞においてその密度が高い(Little他、 Brain Res.、1993年、628、17-25)。一方、慢性の非暴力性アルコール乱用者内のDAT密度は著しく低下する(Tiihonen他、Nature Medicine、1995年、1、654-657)。物質乱用者の脳の画像化は、コカインおよびアルコールの乱用の病理プロセスの把握と治療期間における脳機能の回復の監視に役立つ。従って、DATと結合する放射性薬剤は、これらの種々の病気の診断と治療を支援する重要な情報を供給することが出来る。
【0007】
上記疾患用の画像化剤として有用であるためには、ターゲットとされるトランスポータ、例えばDATに特殊な結合親和性および選択性を有する物質でなければならない。また、脳画像化剤は、血液脳関門(BBB)を通過する透過性を有しなければならない。しかしながら、レセプタ部位に対する結合親和性と選択性を維持しながら血液脳関門を通過出来る金属キレートを生成することは困難であった。よって、これらの条件を満たし、99mTcのような所望の放射核種と錯体を形成し得る適当な物質を発見することが強く求められている。
【0008】
さらに、有用な画像化薬剤であるためには、特別なターゲット/非ターゲット率を有しなければならない。DATに対し選択的な物質の場合、最高密度のドーパミントランスポータを有する脳領域である線条は、セロトニントランスポータ(SET)も含んでいることを考慮しなければならない。このSETは、ドーパミントランスポータの濃度の1/10から1/15の範囲で通常存在している。DATに強固に結合する画像化物質は、或る程度のSETへの結合を示すことがある。
【0009】
上述のごとくの非ターゲットへの結合は、正常な脳の画像化の場合は、SETと比較しDATが多数であるので大した問題は生じないが、DATが選択的に減少する(或いは、SETが選択的に増加する)病的な状態の場合は、SETとの結合がDATの量の測定を困難にする。さらに、視床下部および視床のような脳の他の領域におけるSETとの結合は、線条の限局化および画像化における線条コントラストと精度を減少させる。そのために、ターゲット対非ターゲットの結合比(DAT:SET)は重要である。現在、DATの数量化と可視化に最も有効な化合物は、11Cと18Fのような陽電子エミッタおよび123Iのようなガンマ線エミッタで標識されたフェニルトロパン誘導体である。
【0010】
テクネチウム-99m(99mTc:T1/26.9h、140KeVガンマ線光子放出)は、物理的な崩壊特性と化学特性が優れている故に画像化に使用するのに好適な放射核種である。例えば、半減期は約6時間であり、崩壊速度と画像研究に適した時間の調和が得られる。これは、半減期が長い123Iや半減期は短いが使用が難しい18Fのような他の放射性核種に比べ、優れている。放出特性も画像化に適し容易である。さらに、使用場所で好便に発生させることが出来る。99mTc は、現在、世界中の診断センタで選択できる放射性核種である。DAT画像化のためにテクネチウムとの配位錯体を得られることが望ましい。かような錯体は、DATがマーカとして有効な状態を検出出来る。
【0011】
しかしながら、テクネチウムを放射線画像化剤として使用するには、その化学特性の故に、多くの困難が生じる。例えば、99mTc は、通常キレート剤で結合されねばならない。従って、配位子に共有結合で付加できる123Iのような他の放射性核種を用いて放射性配位子を生成するより99mTcを設計し生成するほうがはるかに難しい。テクネチウム用のキレート剤のサイズは、この放射性核種を画像化剤に用いる際に問題を生じる。これは、Tcを用いるレセプタに基づく画像化剤を設計する上で特に難しい問題となる。
【0012】
神経変性疾患の診断手段としての能力を決定するために試験された代表的な画像化剤として、ヨウ素(123I)標識分子がある。例えば、RTI-55(Boja、J.W.他、欧州誌”薬学、1991年、194、133-134; KaufmanとMadras 、シナプシス、1992年、12、99-111)またはβ-CIT(Neumeyer、J.L.他、医療化学、1991年、34、3144-3146)およびヨードアリルトロパン、アルトロパン(Elmalech、D.R.他、米国特許N0.5、493、926)が挙げられる。
【0013】
トロパン系の化合物は、ドーパミントランスポータに結合することが知られているが、テクネチウムまたはレニウムを結合させるために粉粒体キレート配位子を添加することは、標識錯体が血液脳関門を通過する潜在能力及び能力に悪影響を与えると予測される。Kung他は、化学及び核医学(Chemistry and Nuclear Medicine)(M.Nicolini、G.Banoli、U.Mazzi,Swrvizi編、GraficiEditoriali、Padua、1995年)に掲載の論文”テクネチウムおよびレニウム(Technetium and Rhenium)”において、セロトニン1Aとの選択結合が知られているアリルピペラジンと複合した99mTc標識N2S2配位子が生体外試験では緩やかな結合親和性を示したが、完全な血液脳関門を透過出来なかったことを報告している。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許N0.5、493、926
【非特許文献】
【0015】
【非特許文献1】Boja、J.W.他、欧州誌”薬学、1991年、194、133-134
【非特許文献2】KaufmanとMadras 、シナプシス、1992年、12、99-111
【非特許文献3】Neumeyer、J.L.他、医療化学、1991年、34、3144-3146
【非特許文献4】Technetium and Rhenium、Chemistry and Nuclear Medicine、M.Nicolini、G.Banoli、U.Mazzi,Swrvizi編、GraficiEditoriali、Padua、1995年
【発明の概要】
【発明が解決しようとする課題】
【0016】
本発明は、上述のごとき実情に鑑みてなされたもので、テクネチウムまたはレニウムで放射線標識したDAT画像化剤で、血液脳関門を通過出来、DATに対し高い結合親和性と選択性を有する放射性薬品化合物を提供すること、及びその放射性薬品化合物を用いたトロパン認識部位の密度検出方法、神経変性または神経性疾患の監視方法、及び放射性薬品を調合するキット提供することを目的とするものである。
【課題を解決するための手段】
【0017】
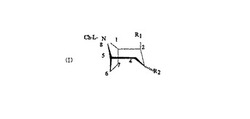
請求項1の発明は、下記(I)式の構造を有する化合物であって、
【0018】
【数1】

【0019】
前記(I)式において、R1は、βであって、かつ、CORaおよびCON(CH3)ORaからなる群から選択されており、R2は、αであって、かつ、X及び/またはYで置換したフェニルまたはナフチルであるC6H4X、C6H3XY、C10H7XおよびC10H6XYより成る群から選択されており、Raは、C1-C5のアルキル基であり、XおよびYは、Ra、H、Br、Cl、I、F、OHおよびOCH3より成る群からそれぞれ選択されており、Lは、-(CH2)n(nは1から6までの整数)、または-(CH2)n-(アリル,アルキル,エテニルまたはエチニル)-(CH2)m(mとnは整数で、nとmとの和は1から6までの整数)であり、Chは、三座または四座キレート配位子、またはテクネチウムまたはレニウムとの前記化合物の中性錯体であることを特徴としたものである。
【発明の効果】
【0020】
以上の説明から明らかなように、本発明によれば、テクネチウム及びレニウムで放射線標識したDAT画像化剤により、血液脳関門を通過でき、ドーパミントランスポータ(DAT)に対し高い結合親和性を有する物質を提供することができる。本発明の画像化剤は、DATのような神経細胞を含むトロパン認識部位を検出するのに有用である。また本発明の化合物は、神経変性疾患の診断剤、予後検査剤および治療剤として使用できる。
【0021】
また、本発明は、DATまたはドーパミンニューロンの密度変化により、特徴付けられる神経変性または神経精神障害を検出するための画像化剤として配位錯体を用いる方法を提供する。例えば、パーキンソン病のような神経性疾患によるDAT密度の変化を検出する方法は、特定の哺乳類中のDAT密度を検出するために、本発明の標識化された化合物の有効量を注入し、DATに結合した標識化化合物の画像を撮影するステップを有し、レニウムで標識した化合物は、治療のためにも有効に使用することができる。
【0022】
また、本発明は、テクネチウムまたはレニウムで標識した本発明の化合物を生成するキットを提供する。このキットは、凍結乾燥させた化合物とテクネチウムまたはレニウムとの錯体を形成する無菌性容器よりなるもので、放射性核種を含有する水溶液により容易に再構成して標識させることができる。
【図面の簡単な説明】
【0023】
【図1】本発明に用いて好適な放射性薬品化合物を表現する構造式の一例を示す図である。
【図2】本発明に用いて好適なトロパン化合物の一例の構造式を示す図である。
【図3】本発明に用いて好適なキレート配位子の例の構造式を示す図である。
【図4】本発明に用いて好適なキレート配位子であってテクネチウムと共に形成される錯体の構造式を示す図である。
【図5】NSキレート配位子をノルトロパン類似体に連結し、テクネチウムまたはレニウムであり得る金属“M”で標識するための選択一般反応図式を示す図である。
【図6】本発明によるアリルオクテン(ArylOctene)より成る2-カルボメトキシトロパンを生成し(スキーム1)、続いてその3αおよび3βジアステレオマーを生成する一般図式を示す図である。
【図7】本発明による好適な実施形態による放射性薬品化合物の2-エチルケト類似体を生成する一般図式の一例(スキーム2)を示す図である。
【図8】本発明による好適な実施形態による放射性薬品化合物の2-エチルケト類似体を生成する一般図式の他の例(スキーム3)を示す図である。
【図9】本発明の好適な実施形態による放射性薬品化合物の2-カルボキサミド3α-または3β-アリル類似体を生成する一般図式(スキーム4)を示す図である。
【図10】本発明の好適な実施形態による放射性薬品化合物の3-アリル-2-エチルケト-2、3-エン類似体を生成する一般反応図式(スキーム5)を示す図である。
【図11】本発明の好適な実施形態による放射性薬品化合物の3-アリル-2-カルボメトキシ-2、3-エン類似体を生成する一般反応図式(スキーム6)を示す図である。
【図12】図2の 3αおよび3βジアステレオマーをビストリチル保護N2S2トロパンに転化し、テクネチウムまたはレニウムで標識するための一般図式(スキーム7)を示す図である。
【図13】本発明の好適な実施形態による放射性薬品化合物の3-アリル-2-エチルケト-2、3-エン類似体を生成する代替一般反応図式(スキーム8)を示す図である。
【図14】本発明の好適な実施形態による放射性薬品化合物の3-ナフチル-2-カルボメトキシ-2、3-エンと3α-ナフチルまたは3β-ナフチル類似体を生成する一般反応図式(スキーム9)を示す図である。
【図15】ドーパミントランスポータ用特定化合物の結合親和性と選択性を決定する試験に用いた化合物の組成を示す図である。
【図16】ドーパミントランスポータ用特定化合物の結合親和性と選択性を決定する試験に用いた他の化合物の組成を示す図である。
【図17】ドーパミントランスポータ用特定化合物の結合親和性と選択性を決定する試験の結果を示す表である。
【図18】0-1505Tで標識した99mTcのHPLCクロマトグラムを示す図である。
【図19】0-1508Tで標識した99mTcのHPLCクロマトグラムを示す図である。
【図20】0-1561Tで標識した99mTcのHPLCクロマトグラムを示す図である。
【図21】0-1560Tで標識した99mTcのHPLCクロマトグラムを示す図である。
【図22】HPLCによる分析による4つの特別99mTc標識化合物の滞留時間を示す表である。
【発明を実施するための形態】
【0024】
本発明は、テクネチウムまたはレニウム放射性核種と配位錯体を形成し、ドーパミントランスポータに選択的に結合し、新規な放射線標識剤を供給する放射性薬品化合物を提供する。好適なかような薬剤は、脳内のDATを画像化するために血液脳関門を通過出来る放射性画像化物質を含んでいる。
【0025】
本発明の化合物は、テクネチウムまたはレニウム放射性核種と複合し、ドーパミントランスポータに選択的に結合して放射線標識錯体を生成するキレート配位子に8座のN原子を介して連結したトロパン化合物より成る。これらの化合物は、個別のジアステレオマーとして、およびジアステレオマーの混合物として調合出来る。
【0026】
本発明の実施に有効なトロパン化合物は、ドーパミントランスポータに結合する。本発明の好適な放射性薬品化合物は、図1に示す構造式で表現することが出来る。図1に示す式中、R1はαまたはβであり、COORa、CORaおよびCON(CH3)ORaから選択され、R2はαまたはβであり、C6H4X、C6H3XY、C10H7X、C10H6XYから選択され、RaはC1-C5のアルキル基、例えば、メチル、エチル、プロピル、イソプロピル等であり、XおよびYは、Ra、H、Br、Cl、I、F、OHおよびOCH3から個別に選択され、Lは-(CH2)n(nは1から6までの整数)または-(CH2)n-(アルキル、アリルアルキル、エテニルまたはエチニル)-(CH2)m(mとnは整数で、nとmとの和は1から6までの整数)で、Chはテクネチウムまたはレニウムとの中性錯体を形成する三座または四座キレート配位子である。さらに、 C2とC3の間の結合は単結合または二重結合である。
【0027】
かように、R1とR2はαまたはβ配位である。さらに、R1は好ましくは、トロパンが1Rまたは1S配位を有している場合はC2またはC4で置換することが出来る。キレート配位子は、キラルであれば、R、SまたはRSとsyn(類似)またはanti(反対)である。
【0028】
本発明の画像化物質は、ドーパミントランスポータのような神経細胞を含むトロパン認識部位を検出するのに有用である。本発明の諸目的のために、トロパン認識部位は、トロパン化合物に結合するレセプタまたはトランスポータである。かように、本発明の化合物は、神経変性疾患の診断剤、予後検査剤および治療剤として使用できる。
【0029】
本発明は、DATまたはドーパミンニューロンの密度の変化により特徴付けられる神経変性または神経精神障害を検出するための画像化剤として配位錯体を用いる方法を提供する。例えば、パーキンソン病のような神経変性疾患によるDAT密度の変化を検出する方法は、特定の哺乳類中のDAT密度を検出するために、本発明の標識された化合物の有効量を注入し、DATに結合した標識化合物の画像を撮影するステップを有する。レニウムで標識した化合物は、治療のためにも有効に使用できる。
【0030】
本発明は、テクネチウムまたはレニウムで標識した本発明の化合物を生成するキットを提供する。このキットは、凍結乾燥させた化合物とテクネチウムまたはレニウムとの錯体を形成するための還元剤とを格納する無菌無熱性の容器より成る。このキットは、放射性核種、例えば、好ましくは約5から約8までの範囲のpHを有するペルテクネチウムを含有する水溶液で容易に再構成し標識させることが出来る。
【0031】
本発明の化合物は、例えばDATのようなニューロントランスポータのトロパン認識部位に選択的に結合するトロパン化合物又は配位子より成る。トロパン配位子は、トロパン配位子にリンカーで付加されたキレート配位子により放射性テクネチウムまたはレニウムで標識される。本発明の未標識化合物は、構造式Ch-L-Trによって概略表現される。式中のChはキレート配位子、Lはリンカー、Trはトロパン配位子である。
【0032】
本発明の実施に用いて有効なトロパン化合物または配位子は、一般に、図2に示す構造式(II)で表示される。式中、 R1とR2は前記の様に規定され、R1はトロパンリングのC4位置で置換され得る。
【0033】
図2に示す一般構造式(II)のトロパン化合物は何れも、DATと結合する限り、本発明において有用である。DATに対し特異性を有し(Meltzer、P.C.他、医化学、1993年、36、855-862)、DATと強固に結合(IC50X=11.0nM)する2-カルボメトキシ-3-(4-フルオロフェニル)-N-メチルトロパン(“WIN35,428”)(Clarke、R.L.他、医化学、1973年、16、1260-1267)と、カルボメトキシ-3-(3,4-ジクロロフェニル)-N-メチルトロパン(“O-401”; IC50X=1.09nM)(Meltzer、P.C.他、医化学、1993年、36、855-862)は特に有用なトロパンの例である。3α基を有するトロパン類似体は舟形である。3β方向基を持つその他のトロパンは椅子形である。
【0034】
本発明の実施において有用なキレート配位子は、三座または四座の配位子であり、テクネチウムまたはレニウムと結合して中性の錯体を形成する。このキレート配位子は、下記に記すように、リンカーに共有付加される。好適なキレート配位子は,放射性核種と錯体を形成するための複数のNまたはS原子を含んでいる。
【0035】
適当な配位子例は、図3(A)〜図3(F)に示す構造式(III)から(VIII)で表されるN2S2である。式中、R,R6およびR10は水素,置換または未置換の下位アルキル,アルキルR9または-COR9から各々選択する。ここで、R9はヒドロキシ,置換した下位アルコキシ,置換または未置換アミノ,グリシンエステル,ハロゲン化物(クロロ,ブロム,ヨード)またはOR(ORはメシル化物,トリフ化物またはトシル化物のような残基である)または活性の残基であり、 R1は水素または置換または未置換の下位アルキルから選択され、R2とR3は、各々、水素またはチオール保護基または分子間または分子内ジスルフィドから選択し、R4、R5、R7およびR8は、各々、水素または下位アルキルから選択する。
【0036】
R,R6およびR10がカルボン酸誘導体である場合、R9は活性残基であり得る。この発明の諸目的のために、残基R9は(化合物)-COR9がアシル化剤であるように定義される。
【0037】
本発明の実施に適した活性残基の例は、例えば、ハロゲン化物、ペンタクロロフェノキシ等のような置換または未置換のアリルオキシ、N-オキシ-スクシンイミド等のようなオキシ複素環基、メルカプト、下位アルキルチオ、アリルチオ、オキシホスホニウム、および当業者には周知の残基として有用な他の基が挙げられる。
【0038】
R2およびR3は、水素または周知のチオール保護基であり得る。かような基の例には、エチルアミノカルボニルのような下位アルキルアミノカルボニル、下位アルカノイルアミノメチル、アロイルアミノメチル、t-ブチル、アセトアミドメチル、トリフェニルメチル(トリチル)およびジフェニルメチルのようなアリルメチル、ベンゾイルのようなアロイル、フェノキシカルボニルのようなアリルオキシカルボニル、アリル下位アルコキシカルボニル、好ましくはアリルメトキシカルボニル、ベンジルオキシカルボニル、およびt-ブトキシカルボニルのような下位アルコキシカルボニルが含まれる。好ましいチオール保護基はトリチル、t-ブチル、ジフェニルメチル、アセトアミドメチルおよびベンゾイルおよび分子間または分子内ジスルフィドを含んでいる。
【0039】
ここで使用した用語“下位アルキルは”、メチル、エチル、イソプロピル、n-プロピル、n-ブチル等のような1個から6個までの炭素原子、より好ましくは1個から4個までの炭素原子を含む、脂肪族飽和分岐または直鎖の炭化水素の一価置換体を意味する。用語“下位アルコキシ”は、メトキシ、エトキシ、イソプロポキシ等のような1個から6個までの炭素原子、より好ましくは1個から4個までの炭素原子を含む下位アルコキシ置換体を意味する。ここで使用した用語“置換下位アルキルおよび置換下位アルコキシ”は、例えば、-CH2OH、-CH2CH2COOH、-CH2CONH2、-OCH2CH2OH、-OCH2COOH、-OCH2CH2CONH2等のようなハロゲン化物、ヒドロキシ、カルボキシまたはカルボキシアミド基等で置換したアルキルおよびアルコキシ基を含んでいる。
【0040】
ここで使用した用語“置換アミノ”は、下位アルキルで置換した1または2および3置換基、および-NH3+または薬剤的に適したアニオンを有する下位アルキルで置換した1、2および3置換基を含む。使用用語“グリシンエステル”は、グリシンの下位アルキルエステル、好ましくはメチル及びエチルエステルを意味する。
【0041】
これらのキレート配位子は、放射性核種、例えばテクネチウムと共に図4(A)〜図4(B)の化学構造式(XI〜XIV)にて示される下記の錯体を形成する。なお、式中の、R基は前述したごとくに規定される。
【0042】
本発明の好適な実施態様は、図3に示す化学構造式(V),(VI)または(VII)のモノアミノモノアミド化合物から形成されるキレート配位子、例えば、N-{2-((2-((トリフェニルメチル)-チオ)-エチル)アミノ)アセチル)-S-(トリフェニルメチル)-2-アミノエタンチオール(“MAMA”)を使用する。
【0043】
1から約6のバックボーン鎖長を有する炭素原子の有機リンカーは、窒素、硫黄、R、R1またはR6を介してキレート配位子を、(ドーパミントランスポータを結合させる)トロパン配位子の8窒素原子に取り付ける。リンカーの例として、-(CH2)n(nは1-6の整数)または -(CH2)n-(アリル、アリルアルキル、エテニルまたはエチニル)-(CH2)m(nとmとの合計が1-6の整数)が挙げられる。
【0044】
本発明の好適な放射線標識化合物は、血液脳関門を通過し、所望の“ターゲット:非ターゲット”特異性を示す。好ましくは、(DAT:SET)の結合選択比は約30またはそれ以上、さらに好ましくは50またはそれ以上である。かように、これらの化合物は、例えば、DATの画像化のための脳画像化剤として有効である。
【0045】
トロパン配位子は、最初のノルトロパンへの転化によってキレート配位子に連結出来る。ノルトロパンの合成は、この技術分野において公知であり、例えば、Meltzer、P.C.他、医化学、1993、36、855-862およびMeltzer,P.C.他、医化学、1994、37、2001-2010に開示されている(開示内容を本明細書において参照する)。トロパンは、当技術において公知の技法を用いてトロピノンまたはコカインから合成出来る。ノルトロパンの合成は、トロパンのN-脱メチル化によって達成することが出来る。これは、例えば、αクロロエチルクロロギ酸エステル(ACE-Cl)による、当技術ににおいて周知の種々の方法によって容易に達成出来る。
【0046】
キレート配位子は、好ましくは個別に生成し、ノルトロパンに付加して金属化するか、或いは最初に金属化してから適当なノルトロパンに付加する。本発明による放射線標識化合物を血液脳関門を通過させる必要がある場合、本発明に用いられるキレート配位子は、放射性核種と共に自然錯体を形成し、脂質可溶である。本発明に用いる自然99mTc(V)錯体を形成するキレート配位子は、置換オキシム(Loberg、M.D.他、核医学、1997年、20、1181-1188)と、N2S2化合物(Davison、A.他、無機化学、1981年、20、1629-1632; Davison、A.他、核医学、1979年、20、641(アブストラクト))と、ビスアミノエタンチオール(“BAT”)(Kung、H.F.他、医化学、1984年、28、1280-1284; Kung、H.F.他、核医学、1986年、27、433-437; Kung、H.F.他、核医学、1984年、25、326-332;Francesconi、L.C.他、無機化学、1993年、32、3114-3124)と、ジアミノジチオール(“DADT”) (lever、S.Z.他、核医学、1985年、26、1284-1294)を含んでいる。
【0047】
有用なキレート配位子のその他の例には、N,N’-ビス(2-メルカプト-1-メチル)-2-アミノベンジルアミン(“U-BAT”)(Francesconi、L.C.他、医化学、1994年、37、3282-3288)、プロピレンアミンオキシマー(“HMPAO”)、ジアミドジチオ−ル(“DADS)(Rao、T.L.他、米国化学会、1990年、112、5798-5804;Stepniak-Biniakiewicz、D.他、医化学、1992年、35、274-279)、フェニルエネジアミン-チオ−ル-チオエーテル(“PhAT”)(McBride、B.J.他、医化学、1993年、36、81-86)、ビス(メルカプトエチル)-2-アミノエチルアミン(“SNS”)またはビス(メルカプトエチル)-2-チオエチルアミン(Mastrostamatis,S.G.他、医化学、1994年、37、3212-3218)、モノアミンアミド(“MAMA”)(Gustavson、L.M.他、Tet.Lett.、1991年、32、5485-5488)およびN-{2-((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル}-S-(トリフェニルメチル)-2-アミノエタンチオール(“MAMA’”)(O’Neil,J.P.他、無機化学、1994年、33、319-323)が含まれる。例えば、本発明によりリンカーでMAMA’を親油性トロパンに付加すると、放射性標識に適した中性中庸な親油性で水性で安定した化合物が形成される。
【0048】
図3(A)及び図3(B)に示す化学構造式(III)および(IV)の化合物は、本願で参照引用する米国特許No.4、673、562に記述の方法に基づき合成することが出来る。図3(C)に示す化学構造式(V)の化合物は、当技術において周知の方法(Fritzberg他、核医学、1981年、22、258-263参照)で合成出来る。
【0049】
本発明による放射線標識錯体は、図5に概略を示したように、3つの全体的な調製手順で合成出来る。この全体的な調製スキームではSH(スルフヒドリル)用トリチル保護基を使用しているが、SH保護用に有用であると知られているその他の保護基、例えば、エチルアミノカルボニルのような下位アルキルアミノカルボニル、下位アルカノイルアミノエチル、アリルアミノエチル、t-ブチル、アセトアミドメチル、トリフェニルメチル(トリチル)とジフェニルメチルのようなアリルメチル、ベンゾイルのようなアリル、フェノキシカルボニルのようなアリルオキシカルボニル、ベンジルオキシカルボニルのようなアリル下位アルコキシカルボニル、好ましくはアリルメトキシカルボニル、t-ブトキシカルボニルのような下位アルコキシカルボニルも使用できる。好適なSH保護基は、トリチル、t-ブチル、ジフェニルメチル、アセトアミドメチル、ジスルフィド(二硫化物)およびベンゾイルを含んでいる。
【0050】
本発明の化合物は、本開示に基づき公知の手段で調製出来る。例えば、図5の全体図にN-2{2-((2-((トリフェニルメチル)チオノエチル)アミノ)アセチル)}-S-(トリフェニルメチル)-2-アミノエタンチオール(MAMA’:Katzenellenborgen他、無機化学、1994年33、319)として示したN2S2のような適当なキレート配位子より開始し、このN2S2をハロアルキルトリフレートまたは(Meltzer他、医化学、1993年、36、855に記載のノルトロパンより調製した)ハロアルキルノルトロパンの何れかでアルキル化出来、クロロアルキル(プロピルを図示)MAMA’またはトロパンアルキル(プロピルを図示)MAMA’の化合物を各々生成する。
【0051】
上記のクロロアルキル(プロピルを図示)MAMA’の化合物を、次に、適当なノルトロパンに付加してトロパンアルキル(プロピルを図示)MAMA’化合物を図示する通り生成出来る。この代わりに、クロロアルキル(プロピルを図示)MAMA’の化合物を金属原子、好ましくは(99Tc、99mTc、188Reまたは186Reのような)放射性核種を含むように処理してM標識錯体を生成することが出来る。この得られた錯体を、適当なノルトロパンに付加して本発明の放射線薬剤化合物を図示する通り供給することが出来る。
【0052】
別案では、トロパンアルキル(プロピルを図示)MAMA’の化合物を(99Tc、99mTc、188Reまたは186Reのような)放射性核種を含むように処理して本発明の放射線薬剤化合物を図示する通り形成することが出来る。
【0053】
本発明の化合物は、ジアステレオ異性体およびジアステレオマーとの混合物の何れであってもよい。ジアステレオ異性体は、カラムクロマトグラフィによって分離出来る。さらに特殊には、ハロアルキルトリフレートで N2S2をアルキル化してクロロアルキル(プロピル図示)MAMA’を生成して、キレート配位子を、ドーパミントランスポータと選択的に結合するトロパン配位子に結合させるため用いることが出来る。このアルキル化ステップは、有機化学に普通の技術を有する者ならば、前述の様に1個乃至約6個迄の炭素原子のバックボーン鎖長を有する種々のリンカーを生成するように変更することが出来る。
【0054】
クロロアルキル化合物の保護解除は、当技術において公知の標準の諸方法、例えば、H2S/Hg(OAc)2(O’Neil、J.P.他、無機化学、1994年、33、319-323)またはAgNO3/Py(DiZio、J.P.他、Bioconj.Chem.、1991年、2、353-366)、TFAとフェノールまたは酢酸中のHBr(Zervas,L.他、米国化学学会誌、1993年、84、3887-3897)を用いて無保護ビスチルを得、直ちにすず(II)塩(SnCL2)と過レニウムナトリウム(Na2ReO7)の溶液またはNa(99mTcO4)/第1すず酒石酸塩(Francesconi,L.C.他、無機化学、1993年、32、3114-3124;Canney、D.C.他、医化学、1993年、36、1034-1040)で処理して、標識錯体を生成する。
【0055】
これらのキレートの精製は、O’Neil(O’Neil、 J.P.他、無機化学、1994年、33、319-323)により開示されているフラッシュクロマトグラフィによって達成出来る。このクロロアルキルキレートは反応可能であり( O’Neil、 J.P.他、Bioconj.Chem.、1994年、5、182-193)、これを次に適当なノルトロパンと反応させて本発明の標識配位錯体を供給する。ノルトロパンのアルキル化は、当技術において周知の標準の諸方法、例えば、アセトニトリル (CH3CN)、ヨウ化カリウム(KI)および炭酸カリウム(K2CO3)を用いて達成出来る。強塩基を使用すると、C-2におけるカルボメトキシ基のエピマー化を生じるが、ジメチルフォルムアミド(DMF)のような溶液中において炭酸塩は適度な収量のアルキル化生成物を生成し得る。
【0056】
これらの化合物は、遊離塩基または、塩酸塩、酒石酸塩、硫酸塩、ナフタリン-1.5-ジスルホン酸塩等のような薬理的に活性な塩の何れかとして調製出来る。
本発明の種々な等級の化合物の調製反応スキームについて図面を参照して説明する。図6に示すスキーム1において、ケトエステル1(Meltzer他、医化学、1994年、37、2001)をN-フェニルトリフルオロメタンスルホンイミドとナトリウムビス(トリメチルシリル)アミドとテトラフラン中で反応させてエノールトリフレート2に転化する。このエノールトリフレート2を次に適当な一般のまたは鈴木結合(Suzuki coupling)で予備形成したアリルホウ素酸と、塩化リチウム、炭酸ナトリウムおよびトリス(ジベンジリデンアセトン)ジパラジウム(O)を共に結合させ、アリルオクテン(ArylOctenes)3を優秀な収量で生産する。
【0057】
テトラヒドロフラン/メタノール中でサマリウム・ヨウ化物を用いてアリルオクテン3を低温(-780C)で還元し、3β-および3αのジアステレオマー4,12の混合物を得る。これらのジアステレオマーはフラッシュクロマトグラフィで容易に分離出来る。
【0058】
図12に示すスキーム7において、3β-および3αのジアステオマー4,12を次にビストリチル保護N2S2トロパン33,36へ同様に各々転化処理し、さらにレニウム類似体34R,37Rおよびテクネチウム類似体34T,37Tに各々転化処理する。かようにして、トロパンをACE-塩化物でN-脱アルキル化し(Meltzer他、医化学、1993年、36、855)、ノルトロパン32,35を得る。次に、ノルトロパンを、予備形成したN-[[[2-[2-(トリフェニルメチル)チオ]-エチル]N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニルメチル)-2-アミノエタンチオール(MAMA’-Cl){ Meltzer他、医化学、40、1835、1997)と、ヨウ化カリウム炭酸カリウムと共に反応させてN2S2保護配位子を導入する。レニウムは、
0.05MのHcl中ですず(III)塩化物と反応させ、続いて0.05MのHcl中ですず(II)過レニウム酸塩と反応させて導入する。この生成物を、シリカゲルカラムクロマトグラフィで精製し、ジアステレオマーの混合物を得る。他の方法は、ノルトロパンを予備形成したN-[(2-((3’-クロロプロピル)2-メルカルプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]レニウム(V)酸化物( Meltzer他、医化学、40、1835、1997)でN-アリキル化する方法である。金属キレートの両方のジアステレオマーが調製される。
【0059】
図7に示すのスキーム2および図8に示すスキーム3において、3αと3βの両方の2-エチルケト-類似体が図示の如く調製される。ここでは、図7の3βのジアステレオマーの方を例にとって説明する。3βのジアステレオマ-4をジオキサン/水またはリチウム水酸化物で加水分解して酸5を供給し、これを、オキシアリル塩化物での酸塩化物への転化を経てアミドに転化し、次に、(MeO)MeNH.HC1と反応させて生成物6を得る。さらに、低温でのアルキルグリニャールとの反応によって所望のエチルまたはアルキルケトン7を得る。
【0060】
アルキルケトン7は、エステル-トロパン(4または12)を適当なアルキル-グリニャール(この場合は、臭化エチルマグネシウム)と反応させることによっても生成出来る(参考文献1:KikkawaおよびT.Vorifuji、“Synthesis”(1980)、877頁)。ACE-Clで標準処理して脱メチル化し、生成物8を得る。生成物8を、炭酸カリウムまたは重炭酸カリウム及びヨウ化カリウムのような塩基と共にMAMA’-Clと反応させてキレート単位を付加する。テクネチウムヘプトグルコン酸塩(heptogluconate)の還元条件下で過レニウム酸塩ナトリウムを用いてレニウムまたはテクネチウムを挿入し、生成物10又は11を得る。金属キレートの両ジアステレオマーは、同様な方法で調製出来る。スキーム2とスキーム3を比較すれば明らかなように、トロパンの3α-ジアステレオマーも同様な方法で調製出来る。
【0061】
図9に示すスキーム4において、2-カルボキシアミド類似体22,22Aは、先述したようにACE-Clを用いたN-脱メチル化により生成物14から調製される。MAMA’基の付加と金属(レニウムまたはテクネチウム)の挿入は、スキーム2とスキーム3につき記述したようにして行なう。
【0062】
図10に示すスキーム5について説明する。2-エチルケトトロプ-2-エン類似体をスキームに示すようにして調製する。エステル3をジオキサン/水またはリチウム水酸化物で加水分解して酸23を供給し、これを、オキシアリル塩化物での酸塩化物への転化を経てアミドに転化し、次に、(MeO)MeNH.Hclと反応させ生成物24を得る。さらに、低温でのアルキルグリニャールとの反応によって所望のエチルまたはアルキルケトン25を得る。このアルキルケトン25は、エステル-トロパン(4または12)を適当なアルキル-グリニャール-(臭化エチルマグネシウム)と反応させることによっても生成出来る(参考文献1:KikkawaおよびT.Vorifuji、合成(1980)、877頁)。ACE-Clで標準処理して脱メチル化し、生成物26を得る。生成物26を、炭酸カリウムまたは重炭酸カリウム及びヨウ化カリウムのような塩基と共にMAMA’-Clと反応させてキレート単位を付加する。テクネチウムヘプトグルコン酸塩(heptogluconate)の還元条件下で過レニウム酸塩ナトリウムを用いてレニウムまたはテクネチウムを挿入し生成物として金属キレート28の両ジアステレオマーが調製される。
【0063】
図11に示すスキーム6について説明する。2-カルボメトキシトロプ-2-エン類似体をスキームに示すようにして調製する。化合物3をACE-Clで標準処理して脱メチル化し、化合物29を得る。この化合物29を、炭酸カリウムまたは重炭酸カリウム及びヨウ化カリウムのような塩基と共にMAMA’-Clと反応させてキレート単位を付加する。テクネチウムヘプトグルコン酸塩(heptogluconate)の還元条件下で過レニウム酸塩ナトリウムを用いてレニウムまたはテクネチウムを挿入し、生成化合物として、金属キレート31の両ジアステレオマーが調製される。
【0064】
図13に示すスキーム8について説明する。2-エチルケトトロプ-2-エン類似体をスキームに示すようにして調製する。化合物3をLAHで還元し、再び酸化させてアルデヒド39を得る。このアルデヒド39をエチルリチウムまたはエチルグリニャールと反応させてアルコール40を得、これをさらに1回酸化し、エチルケトン26を得る。そして化合物27,28を次に上記のようにして調製する。
【0065】
図14に示すスキーム9について説明する。3-ナフチルトロプ-2-エンおよび3αと3βのトロパンを先述の化学プロセスと同様にして生成する。トロプ-2-エン38は、ACE-Clで処理してN-脱メチル化し、MAMA’-Clを付加して化合物40を得る。レニウムまたはテクネチウムを前述のようにして挿入してジアステレオマー41を得る。別の方法では、化合物38を最初にサマリウムのヨウ化物で還元し、舟形及び椅子形構造化合物43,42を得る。同じ反応順序で3α,3βの両トロパンのレニウムとテクネチウムのジアステレオマー49,48を得る。
【0066】
本発明のテクネチウムまたはレニウム放射性核種錯体は、適当な前駆物質を過テクネチウム酸塩(pertechnetate)または過レニウム酸塩(Perrhenate)の何れかと、適当な還元剤と共に通常の方法で反応させることにより形成出来る。例えば、この化合物を適当な溶媒中で還元剤と共に溶解させてから過テクネチウム酸塩を添加する。混合物を適当時間加熱し、完全に反応させる。代表的な例では、沸騰水浴中で約10分加熱すれば、十分に良い収量の放射性核種錯体を得られることが判明している。レニウム錯体を形成するためには、(Ph3P2)2ReOCl3を、塩基(NaOAc)メタノールに加える。本発明の実施に用いて有効な還元剤は、例えば、塩化第1スズのような第1スズ塩、亜ジチオン酸ナトリウム、および硫酸第1鉄のような第1鉄塩を含む。
【0067】
レニウム(Re)は、テクネチウム(Tc)と同様の挙動をする。かように、ReまたはTcのN2S2錯体は、等しく安定している。両金属はN2S2配位子と方形ピラミッド状の錯体を形成する(Francesconi、L.C.他、無機化学、1993年、32、3114-3124)。レニウムは、短い半減期の放射線標識を必要としない場合に好適な金属である。テクネチウムおよびレニウムの両錯体の場合、頂端位置を酸素が占領し、従って、金属錯体のシン異性体(syn-isomer)およびアンチ異性体(anti-isomer)の両方が可能である。TcとReキレートの生物学的活動は、全体的に類似である。(O’Neil、 J.P.他、Bioconj.Chem.、1994年、5、182-193)。99mTcは、画像化剤として使用するのに好適な放射性核種である。レニウムは、99mTc用の優れたモデルであり、治療用剤としても有用である。
【0068】
テクネチウム放射性核種の好適な導入方法は、ビストルチチル(bistrtityl)保護化合物を無水トリフルオル酢酸と共に反応させ、次にトリエチルシランと共に反応させる方法であった。かようにして得た水溶液の一部を99mTc-グルコヘプト塩酸溶液で温置処理した(グルコスキャンキットは、デュポン社、ビレリカ、マサチューセッツ州より入手を使用)。C8の逆相カラムを備えたHPLCでの分離により、99mTc標識生成物が供給され、これを注入用無菌生理食塩水中で再構成した。
【0069】
本発明の化合物は、キラルキレート配位子にキラルリンカーで付加した(1Sまたは1R構造の)代表的鏡像異性体として純粋なトロパンである。このキラルキレート配位子は、金属オキソとリンカーに関しシスまたはトランス異性体で有り得るが、好ましくはシスである。シスとトランスキレート配位子の各々は、2鏡像異性体の対として存在する。キラル配位子が2鏡像異性体形で存在出来るので、全分子の各々もジアステレオマーとして存在する。本発明の放射線薬剤成分は、個別の各ジアステレオマー対およびジアステレオマー対の混合物を含んでいる。
【0070】
本発明の化合物は、非ターゲット、例えばセロトニントランスポータに対する薬品の追跡レベルの結合を最小にするために、好ましくは10を越え、さらに好ましくは最低30のDAT:SET選択比のようなターゲット/非ターゲット率を有している。
【0071】
本発明は、また、好ましくは非発熱性無菌容器または小瓶に凍結乾燥状態で格納した還元剤と構造式(I)の化合物より成る薬剤調製キットを提供する。この形状で、凍結乾燥成分は、水と生理食塩水または好ましくはpH5-8、さらに好ましくは生理pHの緩衝液を加えるだけで、容易に再構成出来る。放射性核種として使用する金属がテクネチウムである場合、テクネチウム発生器からの過テクネチウム酸塩溶液を再構成のために使用出来る。
【0072】
一般に、放射性薬品の調製キットは、図1に示す構造式(I)の精製済み化合物とテクネチウム用の好ましくは凍結乾燥させた還元剤を格納した殺菌ずみの単位定量(または多定量)瓶より成る。各定量成分は、画像撮影する哺乳類の体重に依存するが通常約30mCiの99mTc画像化に必要な線量を供給するのに十分な量の化合物と還元剤から構成されねばならない。使用時、テクネチウム、好ましくは、生理食塩水に入れた99mTc-ペルテクネチウム酸塩(pertechnetate)を瓶に無菌状態で注入し、混合物を十分な時間反応させて標識錯体を形成させる。反応後、生成された放射性薬剤はすぐ使用出来る。
【0073】
所望の目標を画像化するために、本発明による特定の哺乳類用の有効放射能線量を有する放射性調合剤は、規定食塩水のような適当な薬理学的キャリア内で調製する。好ましくは、放射性薬剤を静脈注射で哺乳類の体内に注入する。ガンマ線カメラまたは他の適当な装置の下に哺乳類を位置決めして、目標、例えば脳を撮像する。
【0074】
高画質の画像を得るために、所望の放射性薬剤中の結合テクネチウムの放射化学収量は、凍結乾燥混合物を再構成し標識した後で好ましくは70%を越えるべきである。低い収量では画像の質が低く、高画質の画像とするために望ましくない精製ステップをさらに必要とすることになる。
【0075】
本発明の実施例について以下に説明する。但し、実施例は、本発明の請求範囲を制限するものではない。最終化合物は、生物学的評価の前に特性と純度が分析された。高磁場の核磁気共鳴(NMR)スペクトルと低分解能と高分解能質量分析(MS)スペクトルと赤外線(IR)スペクトルを測定した。元素分析には、薄膜クロマトグラフィ(TLC)および/または高性能液体クロマトグラフィ(HPLC)を使用して純度の測定値とした。これらの化合物の生物学的評価を実施する前に、98%を越える純度を得た。
【0076】
下記の例において、NMRスペクトルは、Bruker社の100型、Varian社のXL400型またはBruker社の300型またはJeol社の300型のNMRスペクトロメータの何れかで測定記録した。TMSは、内部基準として使用した。溶解点は補正せず、ガレンカンプ(Gallenkamp)溶解点測定装置で測定した。旋光は、JASCO社のDIP320型旋光計(1dcmセル)を用い210Cの温度におけるナトリウムのDラインで測定した。薄膜クロマトグラフィ(TLC)は、Baker社のSi250F型プレート上で実施した。視覚化は、ヨウ素蒸気または紫外線(UV)照射またはリンモリブデン酸(PMA)処理の何れかによって達成した。予備TCLは、シリカゲルGF2000ミクロンのAnaltech社のユニプレートを用いて実施した。フラッシュクロマトグラフィは、Baker社のシリカゲル40M(SiO2)を用いて実施した。元素分析は、Atrantic Microlab社(アトランタ、GA)が行なった。Beckman社の1801型シンチレーションカウンターを、シンチレーションスペクトルの測定に使用した。0.1%のウシ血清アルブミンと(-)-コカインをSigma Chemical社より購入した。全ての反応は乾燥窒素雰囲気中で行われた。
【0077】
[3H]WIN35,428および2β-カルボメトキシ-3β-(4-フルオロフェニル)-N-[3H]メチルトロパン(79.4-87.0Ci/mmol)と[3H]シタロプラム(86.8Ci/mmol)をDuPon-New-England Nuclear社(マサチューセッツ州ボストン市)から購入した。TEAはトリエチルアミンである。薬理学的研究用として、(-)-コカイン塩酸塩が薬物乱用に関する国立研究所(NIDA)から供与された。フルオキセチン(Fluoxetine)は、E.Lilly社から供与された。HPLC分析は、Waters社の510型システムを用い、Waters 8mmC-18形10m逆相カラムを用い254nmの検出感度で実施した。Pd2dba3はトリスジベンジリデンアセトン・ジパラジウムであり、TFAはトリフルオル酢酸であり、THFはテトラヒドロフランであり、EtOAcは酢酸エチルである。
【0078】
例1: (1R)-(-)-2-(メトキシカルボニル)-3-[[(トリフルオロメチル)スルホニル]オキシ]トロプ-2-エン(図6の化合物2)
(1R)-(-)-2-(メトキシカルボニル)-3-トロピノン1(Meltzer他、医化学、1994年、37、2001)(1g、5.07mmol)を無水THF(20ml)に溶解し、溶解液を-780Cまで冷却した。この溶解液に、ビストリメチルシリルアミドナトリウム(1M、5.58ml、5.58mmol)の溶液を徐々に加えた。30分後、Nーフェニルトリフルオロメタンスルホンアミド(1.94g、5.43mmol)を加えた。混合液を-780Cの温度でさらに45分間撹拌し、室温になるまで放置し、その後室温で2時間撹拌した。溶液を全て蒸発させ、残留物をポンプで排気乾燥させた。残留物を(SiO-260g;酢酸エチル中に2%-16%のメタノールを用いた)カラムクロマトグラフィで分析した。1.62g(97%)の黄色い油が得られ、放置している間に結晶化した。
このときのデータは、Rf0.65(10%MeOH/EtOAc);1H-NMR(CDCl3)δ1.58(m、1H)、1.97(m、2H)、2.1-2.2(m、2H)、2.39(s、3H)、2.84(dd、J=18,4Hz、1H)、3.42(t、J=6Hz、1H)、3.8(s、3H)、3.92(d、J=5Hz、1H)である。
【0079】
例2: (1R)-N-メチル-2-メトキシカルボニル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1.]オクト-2-エン(図6の化合物3)
(1R)-2-(メトキシカルボニル)-3-[[(トリフルオロメチル)スルホニル]オキシ]トロペン2(620mg,1.88mmol)とLiCl(171mg,4.03mmol)とPd2dba3(69mg,0.075mmol)とNa2CO3水溶液(2.0M、2mL)とジエトキシメタン(6.2mL)を、全て1本のフラスコに入れ、強力に撹拌した。この溶液に、3,4-ジクロロフェニルホウ酸(474mg,2.49mmol)を加えた。反応させるために2時間還流させ、シーライトを通してろ過した。ケークをエーテルで洗浄し、有機溶液を濃縮NH4OHで洗浄した。洗浄溶液をK2CO3で乾燥させ、ろ過し、蒸発させた。残留物をカラム(Si20,60g,5-6%のEt3N/EtOAcで溶離)に入れ、512mg(83%)の黄色油を得た。放置の間にこの油は結晶化した。
【0080】
このときのデータは、Rf0.56(10% Et3N/EtOAc );IR(Kbr)2941、1724、1460、1418、1333、1250、1212、1124cm-1。1H-NMR(CDCl3)δ1.61(m、1H)、1.9-2.05(m、2H)、2.1-2.3(m、2H)、2.43(s、3H)、2.76(dd、J=19、4.7Hz、1H)、3.36(t、J=4.9Hz、1H)、3.52(s、3H)、3.86(d、J=5.5Hz、1H)、6.96(dd,J=8.3、1.9Hz、1H)、7.2(d、J=2.2Hz、1H)、7.37(d、J=8.2Hz、1H)。元素分析:計算値C、58.91、H、5.25、N、4.29;検出値:C、58.84、H、5.24、N、4.24である。
【0081】
例3: (1R)-N-メチル-2β-メトキシカルボニル-3β-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1.]オクタン(図6の化合物4(R=3,4-Cl2))および
(1R)-N-メチル-2β-メトキシカルボニル-3α-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1.]オクタン(図6の化合物12(R=3,4-Cl2))。
(1R)-N-メチル-2-メトキシカルボニル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1.]オクト-2-エン(化合物3、4g、12.3mmol)の-780CのTHF(43mL)液に、SmI2の溶液(THF中で0.1M、400mL、40mmol)を滴下して加えた。-780Cの温度で30分放置後、MeOH(140mL)を加え、溶液を-780Cの温度でさらに1時間撹拌した。反応をTFA(28mL)と水(285mL)を加えて抑制し、冷浴を除去し、溶液を室温になるまで放置した。NH4OHで塩基反応させ、エーテルで希釈し、シーライトでろ過した。フィルタ−ケークをエーテルで洗浄し、全有機相を集めてチオ硫酸ナトリウム溶液で洗浄し、次に食塩水液で洗浄した。Na2SO4で乾燥後、溶液をろ過し、濃縮し、3.8gの粗生成物を得た。標記の化合物4と12をカラムクロマトグラフィ(Si20,10g, CHCl3 中のEtOH 2.5%)で分離した。化合物12は無色の結晶(1.15g、29%)として分離された。
【0082】
このときのデータは、Mp.89-910C.Rf0.64(1% NH4OH/EtOAc);1H-NMR(CDCl3)δ1.28(ddd、J=1.6、10.4、14、1H)、1.4-1.6(m、2H)、2.23(s、3H)、2.05-2.3(m、2H)、2.35-2.5(m、2H)、3.2-3.47(m、3H)、3.59(s、3H)、7.04(dd、J=2.2、8.2Hz、1H)、7.27(d、J=2.2Hz、1H)、7.30(d、J=8.2Hz、1H)。元素分析:計算値(0.1C6H14)C、59.18、H、6.10、N、4.16、Cl、21.05;検出値: C、59.11、H、5.90、N、4.08、Cl、21.01である。
【0083】
化合物4(R=3,4-Cl2)(Meltzer他、医化学、1993年、36、855-862)は、黄色の固形物(1.04g、26%)として分離された。
このときのデータは、Mp.82.5-83.50C.Rf0.43(IPA/Et2O/ペンタン;3/30/67);1H-NMR(400MHz、CDCl3)δ1.6-1.7(m、3H)、2.0-2.1(m、2H)、2.21(s、3H)、2.50(ddd、1H、H-4)、2.86(m、1H)、2.92(m、1H)、3.33(m、1H、H-5)、3.52(s、3H)、3.55(m、1H)、7.07-7.32(m、3H)。[α]D21-27.00(c=1、CH3OH)。分析:(C16H19NO2Cl2)C、H、N、Clである。
【0084】
例4: (1R)-N-メチル-2β-メトキシカルボニル-3β-(4-フルオロフェニル)-8-アザビシクロ[3.2.1.]オクタン(図6の化合物4(R=4-F))および
(1R)-N-メチル-2β-メトキシカルボニル-3α-(4-フルオロフェニル)-8-アザビシクロ[3.2.1.]オクタン(図6の化合物12(R=4-F);O-1204)
(1R)-N-メチル-2-メトキシカルボニル-3-(3,4-フルオロフェニル)-8-アザビシクロ[3.2.1.]オクト-2-エン(化合物3)を取り替えることを除き、前記例3と全体として同じ手順を用いて、化合物4と12[R=4-F]を得た。
【0085】
化合物4[R=4-F]は、白色の固形物である。溶解温度(Mp)は93-940Cである。このときのデータは、Rf0.42(i-PrNH2:Et2O:ペンタン::5:30:65 );1H-NMR(400Mhz、CDCl3)δ1.57-1.75(m、3H)、2.0-2.2(m、2H)、2.23(s、3H)、2.54(ddd、1H)、2.84(t、1H)、2.95(ddd、1H、J=5.3、12.7Hz)、3.36(m、1H)、3.50(s、3H)、3.55(m、1H)、6.9-7.25(m、4H)。 [α]D21-45.60(c=1、CH3OH)。分析:(C16H20NO2F)C、H、Nである。
【0086】
化合物12[R=4-F]は、無色の油である。
このときのデータは、Rf0.5(EtOAc中のMeOH10% );元素分析:計算値C、69.29、H、7.27、N、5.05;検出値: C、69.35、H、7.26、N、5.00;IR2900、1750、1500cm-1、1H-NMR(100Mhz、CDCl3)δ1.1-1.8(m、4H)、1.9-2.6(m、3H)、2.25(s、3H)、3.1-3.7(m、3H)、3.59(s、3H)、6.8-7.3(m、4H)である。
【0087】
例5: 2β-カルボキシ-3β-(4-フルオロフェニル)トロパン(図7の化合物5(R=4-F))
2β-メトキシカルボニル-3β-(4-フルオロフェニル)トロパン(WIN35,428)(化合物4)(1.25g、4.54mmol)を1:1のジオキサン水溶液(80mL)に入れ24時間還流させた。溶媒を真空中で除去し、残留物をほぼ完全にCHCl3(275mL)中に溶解させた。非溶解固形残分をフィルタで除去し、トルエン(30mL)を加え、溶液を真空中で約75%還元した。白色懸濁液を冷凍器内で2時間冷却した後、白色の固形物をフィルタで分離し、1:1のCHCl3トルエン液で洗浄した。固形物を乾燥させ、白色の固形物(1.11g、95%)を生成物5として得た。
このときのデータは、1H-NMR(CDCl3)δ1.7-1.8(m、1H);1.94(dd、J=9Hz、2H)、2.24-2.34 (m、2H)、2.25 (m、3H)、2.57(ddd、J=13.7Hz、1H)、2.62-2.68 (m、1H)、3.16(ddd、J=13Hz、1H)、3.5-3.6 (m、2H)、6.8 (m、2H)、7.18-7.24(m、2H)である。
【0088】
例6: 2β-カルボキシ-3β-(3,4-ジクロロフェニル)トロパン(図7の化合物5(R=4-F))
2β-メトキシカルボニル-3β-(3,4-ジクロロフェニル)トロパン(化合物4)(1.14g、3.47mmol)をTHF:MeOH(1:1;46mL)に溶解し、LiOH.H2O(153g)の(15mL)水溶液を加えた。溶液を加熱し24時間還流させ、00Cまで冷却し、濃縮HClで中和(pH=7)させた。シリカ(1.75g)を直接溶液に加え、溶媒を真空中で除去した。この材料をフラッシュクロマトグラフのカラムで(先ず溶離剤20%MeOH/CHCl3(900mL)、次に溶離剤30%MeOH/CHCl3(2L)を用い)精製させた。生成物を含んでいる分画(fraction)を集めて一緒にし、真空中で蒸発させ、残留物を高真空で乾燥させた。(310mg;28%)の生成物を得た。このときのデータは、Rf0.08(30%MeOH/CHCl3);1H-NMR(CDCl3)δ1.8-1.9(m、1H)、2.1-2.2(m、2H)、2.3-2.5(m、2H)、2.6-2.9(m、2H)、2.78(s、3H)、3.3-3.4(m、1H)、3.93(m、2H)、7.25(dd、J=8.2Hz、2.2Hz、1H)、7.41(d、J=8.2Hz、1H)、7.48(d、J=2.2Hz、1H)である。
【0089】
例7: 2β-メトキシメチルカルバモイル-3β-(4-フルオロフェニル)トロパン(図7の化合物6(R=4-F))
DMF(50μL)を含む無水CH2Cl2(80mL)に酸5(1.1g)を撹拌懸濁させ、そこに、塩化オキサリル(1ml、11.4mmol)を滴加し、十分に泡立てて懸濁物を溶解させた。45分間撹拌して反応させ、その間に溶液は黄色くなった。この溶液を次に真空中で還元させ、夜通し高真空下に保持した。その際、回転部からポンプに移送する際に減圧排気されるフラスコに窒素が流れ込むように注意した。
【0090】
CH2Cl2(80mL)に溶解した酸塩化物に(MeO)MeNH HCl(450mg)を加えた。尚、この添加物は、使用直前に高真空下でP2O5で乾燥させてから直ちにピリジン(1.1mL)を加えた。反応物を1時間撹拌し、CHCl3(20mL)および2MNa2CO3(20mL)で分けた。水溶液層をCHCl3(2x10mL)と共に抽出し、結合有機抽出物をNa2SO4で乾燥させ、ろ過し、真空中で還元させて、1.09gの黄色固形物を得た。この粗生成物をCH2Cl2に溶解させ、フラッシュクロマトグラフィ(SiO2、43g;20%ヘキサン/EtOAc、5%Et3N)で精製した。分画を含む生成物を一緒にして濃縮し、淡黄色の固形物6(960mg;75%)を得た。
【0091】
このときのデータは、Mp.120.1-122.50C;Rf0.14(25% ヘキサン/EtOAc、5%TEA);元素分析:計算値C、66.65、H、7.57、N、9.14;検出値: C、66.78、H、7.63、N、9.01;IR(KBr)2900、1680、1500cm-1;1H-NMR(CDCl3)δ1.5-1.8(m、3H)、2.0-2.3(m、2H)、2.24(m、3H)、2.79(ddd、1H)、3.0(m、1H)、3.05(s、3H)、3.1(m、1H)、3.4(m、1H)、3.47(m、1H)、3.57(s、3H) 6.9(m、2H)、7.25(m、2H)である。
【0092】
例8: 2β-メトキシメチルカルバモイル-3β-(3,4-ジクロロフェニル)トロパン(図7の化合物6(R=3,4-Cl2))
無水CH2Cl2(30mL)に2β-カルボキシ-3β-(3,4-ジクロロフェニル)トロパン(化合物5)(300mg、9.55mmol)を入れ撹拌した溶液に、無水DMF(40μL)と塩化オキサリル(450μL)を滴加した。この溶液を室温で40分間撹拌した。溶媒を真空中で除去し、残留物を高真空中で1夜乾燥させた。
【0093】
乾燥残留物に、メトキシメチルアミン塩酸塩(103mg、1.05mmol)を加えた。フラスコを窒素でフラッシュ洗浄し、CH2CL2(30mL)をカニューレを通して加え、その直後にピリジン(400μL)を加え、2.5時間撹拌反応した。混合物はCH2CL2(40mL)と1MのNa2CO3(25mL)の間で分けられた。水溶液層をCHCl3で抽出し、結合有機抽出物を乾燥させ濃縮して黄色の固形物(298mg)を得た。固形分をクロマトグラフのカラム(溶離剤50%EtOAc/ヘクタン/5%Et3N)を通して精製した。同様の分画を一緒にし、溶媒を除去し、生成物を高真空で乾燥させ、化合物6(39mg;11%)を得た。このときのデータは、Rf0.1(50%EtOAc/ヘキサン/5%Et3N);1H-NMR(CDCl3)δ1.5-1.74(m、3H)、2.0-2.3(m、2H)、2.21(m、3H)、2.72(ddd、1H)、2.93(m、1H)、3.04(s、3H)、3.13(m、1H)、3.38(m、1H)、3.5(m、1H)、3.62(s、3H)、7.13(dd、1H)、7.30(d、1H)、7.31(d、3H)である。
【0094】
例9: 2β-(1-プロパノイル)-3β-(4-フルオロフェニル)トロパン
(図7の化合物7(R=4-F))
THF(10mL)に2β-(N-メチルオキシ-N-メチルカルバモイル)-3β-(4-フルオロフェニル)トロパン(化合物6)(823mg、2.7mmol)を入れた溶液を、00Cまで冷却し、EtMgBr/Et2O(3M;3mL)を4分を越える間滴加した。室温まで加熱し30分間、次に650Cに加熱し45分間反応させた。混合液を00Cまで冷却し、HClエーテル(3M)を加えて反応を抑制した。曇り溶液を2MのNa2CO3で塩基化した。エーテル(5mL)を加え、層を分離させ、水溶液層をEt2O(1x10mL)とCHCl3(2x10mL)で洗浄した。結合有機抽出物をNa2SO4で乾燥させ、ろ過し濃縮した。生成物をフラッシュクロマトグラフィ(溶離剤25%EtOAc/ヘクタン/5%TEA)で精製させ、化合物7(485mg;65%)を得た。
【0095】
このときのデータは、Rf0.3(20%EtOAc/ヘキサン/5%Et3N);mp118-119.50C;元素分析:計算値C、74.15、H、8.05、N、5.09;検出値: C、74.05、H、8.09、N、5.00;IR(KBr)2900、1710、1500、1250cm-1;1H-NMR(CDCl3)δ0.85(t、3H)、1.5-1.8(m、4H)、2.0-2.4(m、3H)、2.23(m、3H)、2.5-2.6(m、1H)、2.9-3.0(m、2H)、3.36(m、1H)、3.48(m、1H)、6.69(m、2H)、7.17(m、2H)である。
【0096】
例10: 2β-(1-プロパノイル)-3β-(3,4-ジクロロフェニル)トロパン
(図7の化合物7(R=3,4-Cl2))
THF(30mL)に2β-メチルオキシメチルカルバモイル-3β-(3,4-ジクロロフェニル)(化合物6)(168mg、0.47mmol)を入れた溶液を、00Cまで冷却し、EtMgBr/Et2O(3M;1mL)を3分を越える間滴加した。室温まで加熱して60分間保持し、次に加熱して10分間還流させた。混合液を室温まで冷却し、HClエーテル(3M、20mL)を加えて反応を抑制した。曇り溶液をNaHCO3の飽和水溶液で塩基化し、Na2CO3を加えてpH=10にした。エーテルを加え、層を分離させ、水溶液層をEt2O(3x25mL)で洗浄した。結合有機抽出物をNa2SO4で乾燥させ、ろ過し濃縮した。生成物(166mg)をフラッシュカラムクロマトグラフィ(溶離剤30%EtOAc/ヘクタン/5%Et3N)で精製させ、化合物7(108mg;71%)を得た。
【0097】
このときのデータは、Rf0.32(50%EtOAc/ヘキサン/5%Et3N);1H-NMR(CDCl3)δ0.9(t、3H)、1.5-1.8(m、4H)、2.0-2.3(m、3H)、2.2(m、3H)、2.35-2.55(m、2H)、2.82-2.92(m、1H)、2.96(m、1H)、3.34(m、1H)、3.54(m、1H)、7.75(dd、1H) 、7.27(d、1H)、 7.29(d、1H)である。
【0098】
例11: 2β-(1-プロパノイル)-3β-(4-フルオロフェニル)-ノルトロパン
(図7の化合物8(R=4-F))
2β-(1-プロパノイル)-3β-(4-フルオロフェニル)トロパン(化合物7)(335mg)を1-クロロエチルクロロホルム酸塩(5mL)を混合させ、溶液を加熱して5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノール中で1.5時間還流させた。メタノールを真空中で除去し、残留物をCHCl3(15mL)に溶解し、2MのNa2CO3を加え振り混ぜた。水溶液層をCHCl3(2x15mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して369mgの生成物を得た。この残留物をクロマトグラフで分析した(溶離剤:100mL EtOAc、150mL 5% Et3N/EtOAc、100mL 10% Et3N/EtOAc、300mL 20% Et3N/EtOAc、300mL 30% Et3N/EtOAc)。同様の分画を合せて化合物8(104mg、33%)を得た。このときのデータは、Rf0.36(10%Et3N /EtOAc);1H-NMR(CDCl3)δ0.70(t、3H)、1.4-1.8(m、5H)、1.9-2.3(m、3H)、2.4(m、1H)、2.88(m、1H)、3.18(m、1H)、3.56 (m、1H)、3.70(m、1H)、6.94(m、2H)、7.10 (m、2H)である。
【0099】
例12: 2β-(1-プロパノイル)-3β-(3,4-ジクロロフェニル)-ノルトロパン
(図7の化合物8(R=3,4-Cl2))
2β-(1-プロパノイル)-3β-(3,4-ジクロロフェニル)トロパン(化合物7)(107mg、0.32mmol)を1-クロロエチルクロロホルム酸塩(2mL)を合せ、溶液を加熱して5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノール中で45分間還流させた。メタノールを真空中で除去し、残留物をCH2Cl2に溶解し、NaHCO3/ Na2CO3(PH=9)を加え振り混ぜた。水溶液層をCH2Cl2(4x10mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して127mgの生成物を得た。この残留物をクロマトグラフで精製した(溶離剤:100mL 5% Et3N/EtOAc;3x100mL 10% Et3N/EtOAc)。同様の分画を合せて化合物8(30mg、29%)を得た。このときのデータは、1H-NMR(CDCl3)δ0.76(t、3H)、1.4-2.5(m、9H)、2.92(m、1H)、3.09-3.2(m、1H)、3.6(m、1H)、3.72(m、1H)、7.0 (m、1H)、7.25(d、1H)、7.32(d、1H)である。
【0100】
例13: N-[2-(3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図7の化合物9(R=4-F))
2β-(1-プロパノイル)-3β-(4-フルオロフェニル)ノルトロパン(化合物8)(27mg)をMAMA’-Cl(86mg)、KI(34mg、2.0当量)およびNaHCO3(43mg、5当量)と共に無水MeCN(4mL)に入れて4時間還流させた。溶媒を真空中で除去し、残留物をCHCl3とNaHCO3の飽和水溶液の間で分けた。水溶液層をCHCl3(2x5mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して茶褐色の泡を得た。この泡をクロマトグラフのカラム(10gシリカ;40%EtOAc/ヘキサン/1%TEA)に入れて分析した。生成物を含んでいる分画を合わせ濃縮して軽い泡として化合物9(47mg、46%)を得た。このときのデータは、Rf0.09(60% EtOAc/ヘキサン、1%Et3N)、元素分析:計算値C、72.15、H、6.34、N、3.96;検出値: C、71.99、H、6.41、N、3.92;1H-NMR(CDCl3)δ0.77(t、3H)、1.2-3.1(m、29H)、3.3-3.5(m、2H)、6.9-7.0(m、2H)、7.1-7.6(m、32H)である。
【0101】
例14: N-[2-(3’-N’-プロピル-(1”R)-3”β-(3,4-ジクロロフェニル)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図7の化合物9(R=3,4-Cl2))
2β-(1-プロパノイル)-3β-(3,4-ジクロロフェニル)-ノルトロパン(化合物8)(30mg、0.096mmol)をMAMA’-Cl(87mg、0.115mmol)、KI(32mg、0.19mmol、2.0当量)およびNaHCO3(40mg、0.48mmol、5当量)と共に無水MeCN(4mL)に入れて4時間還流させ、次に、室温まで冷却し、夜通し撹拌した。溶媒を真空中で除去し、残留物をCH2Cl2(15mL)とNaHCO3の飽和水溶液(15mL)の間で分けた。水溶液層をCH2Cl2(3x10mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して黄色の油を得た。この油をクロマトグラフのカラム(10gSiO2;30%EtOAC/ヘキサン/1%Et3N)に入れて分析した。生成物を含んでいる分画を合わせて濃縮し、軽い泡として化合物9(41mg、41%)を得た。このときのデータは、Rf0.14(60% EtOAc/ヘキサン、1%Et3N);1H-NMR(CDCl3)δ0.81(t、3H)、1.2-3.1(m、29H)、3.34(m、1H)、3.52(m、1H)、7.0-7.6(m、33H)である。
【0102】
例15: N-[(2-((3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)-トロパン-2”β-1-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図7の化合物10(R=4-F))(O-1508R)
N-[2-(3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(22mg、0.023mmol)を、EtOH(絶対量4mL)とSnCl2(0.5mLの0.05MHCl中に8.5mg)の沸騰溶液中に溶解させた。さらに6時間還流させて反応させ、シリカを加え、溶媒を蒸発させて除去した。シリカ吸着生成物をシリカカラム(3g溶離剤:5%Et3Nを含むヘキサン中に30% のEtOAC)に入れて分離した。化合物は、泡(6.7mg、44%)として得られた。
Rf0.07(60% EtOAc/ヘキサン+NH4OH(0.5%);C25H35FN3O3ReS2の正確な質量:計算値は695.172であり検出値:は695.162であった。また、1H-NMR(CDCl3)δ0.7-0.9(2t、2H)、1.4-4.1(m、26H)、4.5-4.6(m、1H)、4.73(d、J=16.5Hz、0.5H)、4.87(d、J=16.5Hz、0.5H)、6.93(m、2H)、7.14(m、2H)である。
【0103】
例16: 2β-(カルボン酸)-3α-(4-フルオロフェニル)-トロパン
(図8の化合物13(R=4-F))
2β-メトキシカルボニル-3α-(4-フルオロフェニル)-トロパン(化合物12)の(1.0g、3.6mmol)溶液を80mLのジオキサン水(1:1)に入れて24時間還流させた。溶媒を真空中で除去し、茶褐色の固形物をカラムクロマトグラフィで精製した(溶離剤:30%MeOH/CHCl3)。白色の泡として生成物(890mg、94%)を得た。
このときのデータは、Rf0.43(30%MeOH /CHCl3);NMR:1H-NMR(CDCl3)δ1.48-1.62(m、1H)、1.75-2.1(m、3H)、2.36-2.46(m、1H)、2.60(s、3H)、2.7-2.82(m、1H)、3.22(brs、1H)、3.5-3.62(m、2H)、3.76-3.84(m、1H)、6.9-7.1(m、2H)、7.4-7.5(m、2H)である。
【0104】
例17: 2β-(カルボン酸)-3α-(3,4-ジクロロフェニル)-トロパン
(図8の化合物13(R=3,4-Cl2))
2β-メトキシカルボニル-3α-(3,4-ジクロロフェニル)-トロパン(化合物12)の(750mg、2.29mmol)とLiOH(335mg、8.0mmol)の溶液を、水(10mL)とTHF:MeOH(33mL;1:1)に入れて4時間還流させた。濃縮HClを滴下して反応液を中和させた。溶媒を真空中で除去し、生成物をカラムクロマトグラフィで精製した(溶離剤:15%MeOH/CHCl3)。固形の生成物13(521mg、72%)を得た。
このときのデータは、Rf0.15(30%MeOH /CHCl3);1H-NMR(CDCl3)δ1.59(m、1H)、1.8-1.9(m、1H)、2.1-2.2(m、2H)、2.6-2.7(m、2H)、2.76(s、3H)、3.25(brs、1H)、3.35(brs、1H)、3.85(m、1H)、3.93(m、1H)、7.5(d、1H)、7.53(dd、1H)、7.8(d、1H)である。
【0105】
例18: 2β-メトオキシメチルカルバモイル-3α-(4-フルオロフェニル)-トロパン(図8の化合物14(R=4-F))(O-1403)
DMF(50μL)を含む無水CH2Cl2(80mL)に撹拌懸濁させた化合物13(930mg、3.6モル)に塩化オキサリル(1mL、11.4mmol)を滴加し、十分に泡立てて懸濁物を溶解させた。45分間撹拌して反応させ、その間に溶液は黄色くなった。この溶液を次に真空中で還元させ、夜通し高真空下に保持した。その際、窒素が回転部からポンプに移送する際に真空フラスコに流れ込むように注意した。
【0106】
CH2Cl2(70mL)に溶解した酸塩化物に(MeO)MeNH ・HCl(382mg、3.9mmol)を加えてから直ちにピリジン(1mL)を加えた。1時間撹拌して反応させ、CHCl3(20mL)と2MのNa2CO3(20mL)の間で分けた。水溶液層をCHCl3(2x10mL)と共に抽出し、結合有機抽出物をNa2SO4で乾燥させ、ろ過し、真空中で還元させて、黄色の油を得た。この油をトルエンに溶解させ、濃縮して黄色の固形物(653g)を得た。この粗生成物を最小量のCHCl3に溶解し、クロマトグラフのカラム(SiO2、28g;溶離剤25%ヘキサン/EtOAc、5%Et3Nおよび後続25%MeOH/CHCl3)で精製した。分画を含む生成物を一緒にして濃縮し、アミド(540mg;50%)を得た。
【0107】
このときのデータは、Rf0.25(25% ヘキサン/EtOAc、5%Et3N);溶解温度(mp):139.8-141.70C;1H-NMR(CDCl3)δ1.24(dd、1H)、1.4-1.8(m、3H)、2.1-2.3(m、2H)、2.23(s、3H)、2.4-2.6(m、1H)、2.7(brd、1H)、3.05(s、3H)、3..05-3.1(m、1H)、3.25-3.5(m,2H)3.41(s、3H)、6.86-6.96(m、2H)、7.13-7.22(m、2H);IR(Kbr)2900、1656、1500cm-1;元素分析:計算値C、66.65、H、7.57、N、9.14;検出値: C、66.37、H、7.59、N、9.0である。
【0108】
例19: 2β-メトキシメチルカルバモイル-3α-(3,4-ジクロロフェニル)-トロパン(図8の化合物14(R=3,4-Cl2))
DMF(30μL)を含む無水CH2Cl2(10mL)に酸13(210mg、0.67mmol)を入れ撹拌した懸濁液に、塩化オキサリル(0.3mL、2.0mmol)を滴加した。この溶液を1時間撹拌反応させ、次に真空中で還元し、一夜ポンプで高真空化に維持した。その際、回転部からポンプに移送する際に減圧フラスコに窒素が流れ込むように注意した。
【0109】
CH2Cl2(10mL)中の酸塩化物に(MeO)MeNH・HCl(72mg、0.74mmol)を加えてから直ちにピリジン(0.3mL)を加えた。1.5時間撹拌して反応させ、反応物をCH2Cl2(20mL)と1MのNa2CO3(20mL)溶液の間で分けた。水溶液層をCH2Cl2(10mL)と共に抽出し、結合有機抽出物をNa2SO4で乾燥させ、ろ過し、真空中で還元させて、黄色の固形物を得た。この固形物を、カラムクロマトグラフィ(SiO2、14g;溶離剤25%ヘキサン/EtOAc、5%Et3N)で精製した。分画を含む生成物を一緒にして濃縮し、アミド(115mg;48%)を得た。
【0110】
このときのデータは、Rf0.14(40%ヘキサン/EtOAc、5%Et3N);1H-NMR(CDCl3)δ1.17(ddd、1H)、1.48(ddd、1H)、1.63(ddd、1H)、2.1-2.34(m、2H)、2.21(s、3H)、2.42-2.54(m、1H)、2.65(brd、1H)、3.06(s、3H)、3.08(brs、1H)、3.22-3.32(m、1H)、3.34-3.46(m、1H)、3.48(s、3H)、7.05(dd、1H)、7.25(d、1H)、7.27(d、1H)である。
【0111】
例20: 2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-トロパン
(図8の化合物15(R=4-F))(O-1369)
2β-メトキシメチルカルバモイル-3α-(4-フルオロフェニル)-トロパン(化合物14)(471mg)を入れた250mLの丸底フラスコを窒素でフラッシングして、無水THF(70mL)を加えた。室温で、EtMgBr/Et2O(3.0mL;3.0M)を3分を越える間滴加した。室温で30分間撹拌し、次に650Cに加熱して1時間保持した。この温度で、TLCにより反応を開始する物質は観察されなかった。(TLCサンプルは反応物アリコートをHCLエーテルに加え、2MのNa2CO3で塩基化することにより調製された。Rf(生成物)0.42;Rf(開始物質)0.13。(20%EtOAc/ヘキサン、5%Et3N)。)反応フラスコを氷浴で冷却し、HClエーテル(3M)を緩やかに加えて急冷した。曇り溶液を2MのNa2CO3で塩基化し、エーテル(25mL)で希釈した。層が分離し、水溶液層をエーテル(1x10mL)とCHCl3(2x20mL)で抽出した。結合有機抽出物を乾燥させ(Na2SO4)、ろ過し真空中で還元し粗残留物(484mg)を得た。この残留物をクロマトグラフで分離した(25gのSiO2と溶離剤25%EtOAc/ヘクタン、5%Et3N)。生成物を含んでいる分画を合わせて濃縮し化合物15(300mg、70%)を得た。
【0112】
このときのデータは、Mp.60.5-61.30C;Rf0.49(33%EtOAc/ヘキサン/5%Et3N);1H-NMR(CDCl3)δ0.86(t、3H)、1.27(ddd、1H)、1.4-1.6(m、2H)、2.0-2.50(m、6H)、2.23(s、3H)、3.12(brd、1H)、3.2-3.3(m、2H)、6.85-7.0(m、2H)、7.05-7.15(m、2H);IR(KBr)2900、1740、1500cm-1;元素分析:計算値C、74.15、H、8.05、N、5.09;検出値: C、74.00、H、8.13、N、4.98である。
【0113】
例21: 2β-(1-プロパノイル)-3α-(3,4-ジクロロフェニル)-トロパン
(図8の化合物15(R=3,4-Cl2))
2β-メトキシメチルカルバモイル-3α-(3,4-ジクロロフェニル)-トロパン(化合物14)(105mg、0.29mmol)を窒素でフラッシングして、無水THF(15mL)を加えた。室温で、EtMgBr/Et2O(0.8mL;3.0M)を3分を越える間滴加した。室温で1時間撹拌し、次に550Cに加熱し30分間保持した。この温度で、TLCにより反応を開始する物質は観察されなかった。反応を氷浴で冷却し、HClエーテルを緩やかに加えて急冷した。曇り溶液を2MのNa2CO3で塩基化し、エーテル(15mL)と水(15mL)で希釈した。層を分離させ、水溶液層CHCl3(2×15mL)で抽出した。結合有機抽出物を乾燥させ(Na2SO4)、ろ過し真空中で還元し残留物(95mg)を得、これをクロマトグラフで分離した(5gのSiO2と溶離剤25%EtOAc/ヘキサン、5%Et3N)。生成物を含んでいる画分を一緒にして濃縮し化合物15(80mg、80%)を得た。このときのデータは、Rf0.28(30%EtOAc/ヘキサン/5%Et3N);1H-NMR(CDCl3)δ0.93(t、J=7.4Hz、3H)、1.27(ddd、1H)、1.42-1.62(m、2H)、2.06-2.30(m、6H)、2.21(s、3H)、3.32-2.52(m、3H)、3.14(brd、1H)、3.2-3.36(m、2H)、7.10(dd、1H)、7.24(d、1H)、7.29(d、1H)である。
【0114】
例21a: 2β-(1-プロパモイル-3α-(3,4-ジクロロフェニル)-トロパン
(図8の化合物15(R=3,4-Cl2))
窒素用追加漏斗を装備したフラスコに入れた市販の臭化エチルマグネシウム(THF中に1M、12.6mL、12.6mmol)にトリエチルアミン(5.0mg、50.4mmol)を加えた。この混合液に、ベンゼン(10mL)に溶かした化合物12(R=Cl2、750mL、2.29mmol)を5-100Cの温度で1時間を越える間で滴加した。この反応混合液を5-100Cの温度でさらに5時間撹拌し、次に4MのHCl(2.9mL、11.6mmol)で処理した。有機層を水(1x50mL)、5%NaHCO3(水溶液)(1x50mL)および水(2x50mL)で洗浄した。有機相を次に乾燥させ(K2CO3)、ろ過して濃縮した。残留物をクロマトグラフ(SiO2、5%Et3Nを含むヘキサン中で25%のEtOAc)で分離し、670mg(85%)の化合物15を得た。この化合物の物理及び分光分析特性は、前記例20で報告したものと同じであった。
【0115】
例22: 2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-ノルトロパン
(図8の化合物16(R=4-F))(O-1370)
2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-トロパン(化合物15)(O-1369)(556mg、2mmol)とACE-C1(7mL)を一緒にして4時間還流させた。全ての揮発分を蒸発させ、残留物にメタノール(100mL)を加えた。この混合液を90分間還流させた。揮発分を除去し、残留物をCHCl3に入れ、2MのNa2CO3の水溶液で洗浄した。この水溶性混合物をCHCl3(2x10mL)と共に抽出し、結合有機留分を乾燥し(Na2SO4)、ろ過し、還元した。暗褐色の油(615mL)をクロマトグラフ(SiO2を20g、溶離剤は0-10%Et3N/EtOAc)で分離し390mg(74%)の黄色油を得た。
【0116】
このときのデータは、Rf0.25(EtOAc中で5%のEt3N);1H-NMR(CDCl3)δ0.86(t、3H)、1.27(ddd、1H)、1.50-1.72(m、2H)、1.8-2.1(m、3H)、2.2-2.4(m、2H)、2.56(dd、J=10.7、1H21H)、3.07(ddd、J=11.3、10.9、7.1Hz、1H)、3.43(brd、1H)、3.62(brt、1H)、6.89-6.99(m、2H) 、7.09-7.16(m、2H);IR(KBr) 2900、1711、1500cm-1;元素分析:計算値(0.2H2O)C、72.52、H、7.77、N、5.25;検出値: C、72.65、H、7.81、N、5.27である。
【0117】
例23: 2β-(1-プロパノイル)-3α-(3,4-ジクロロフェニル)ノルトロパン
(図8の化合物16(R=3,4-Cl2))
2β-(1-プロパノイル)-3α-(3,4-ジクロロフェニル)-トロパン(化合物15)(80mg、2.45mmol)を1-クロロエチルクロロホルム酸塩(3mL)と一緒にし、その溶液を加熱して5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物にメタノールを加えて1時間還流させた。メタノールを真空中で除去し、残留物をCHCl3に溶解させ、2MのNa2CO3で洗浄した。水溶液層をCHCl3(2x5mL)と共に抽出し、結合有機抽出物を乾燥し(Na2SO4)、ろ過して濃縮し、純粋な化合物(77mg;100%)を得た。このときのデータは、Rf0.3(5% Et3N /EtOAc);1H-NMR(CDCl3)δ0.91(t、3H)、1.25(ddd、1H1.52-1.74(m、2H)、1.8-2.56(m、7H)、3.06-3.2(m、1H)、3.45(d、1H)、3.62(brt、1H)、7.01(dd、1H)、7.25(d、1H)、7.31(d、1H)である。
【0118】
例24: N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図8の化合物17(R=4-F))(O-1506)
2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-ノルトロパン(化合物16)(24mg、0.09mmol)をMAMA’-Cl(147mg、0.19mmol)、KI(31mg、19mmol)を全てCH3CN(3mL)に溶解させ3時間還流させた。溶媒を真空中で除去し、残留物をCHCl3とNaHCO3の飽和水溶液の間で分けた。水溶液層をさらにCHCl3で抽出し、全ての有機留分を一緒にして乾燥させ(Na2SO4)、ろ過して濃縮した。カラムクロマトグラフィ(20%EtOAc、79%ヘキサン、1%Et3N)により、金色泡状の純粋な生成物(11.5mg、13%)を得た。このときのデータは、Rf0.15(50% EtOAc/ヘキサン+5%Et3N);元素分析:計算値C、75.79、H、6.87、N、4.21;検出値: C、75.35、H、6.81、N、4.13;1H-NMR(CDCl3)δ0.85(t、3H)、1.19(ddd、1H)、1.3-1.5(m、6H)、1.8-2.6(m、14H)、2.85(brs、2H)、3.0(m、2H)、3.08-3.30(m、3H)、6.88-6.96(m、2H)、7.06-7.42(m、32H)である。
【0119】
例25: N-[2-(3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)-トロパン-2”β-(1’’’-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図8の化合物17(R=3,4-Cl2))(O-1546)
2β-(1-プロパノイル)-3α-(3,4-ジクロロフェニル)-ノルトロパン(化合物16)(75mg、0.24mmol)を N-(((2-(2-(トリフェニルメチル)チオ)エチル)(N’-3-クロロプロピル)アミノ)アセチル)-S-(トリフェニルメチル)-2-アミノエタンチオール(MAMA’-Cl)(218mg、0.29mmol)とKI(80mg、0.48mmol)とNaHCO3(101mg、1.2mmol)と共に無水MeCN(20mL)に入れて4時間還流させ、次に、室温まで冷却した。
【0120】
溶媒を真空中で除去し、残留物をCH2Cl2(20mL)とNaHCO3の飽和水溶液(15mL)の間で分けた。水溶液層をCH2Cl2(1x10mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して茶褐色の油を得た。この油ををクロマトグラフのカラム(30gSiO2;溶離剤25%EtOAc/ヘキサン/1%Et3N)に入れて分離した。生成物を含んでいる分画を合わせ濃縮して化合物17(51mg、17%)を得た。このときのデータは、Rf0.3(60% EtOAc/ヘキサン、1%Et3N);元素分析:計算値(1.33H2O)C、71.71、H、6.46、N、3.98;検出値: C、71.85、H、6.52、N、3.91;1H-NMR(CDCl3)δ0.89(t、3H)、1.0-1.7(m、8H)、1.8-2.5(m、14H)、2.6-3.4(m、6H)、6.9-7.6(m、33H)である。
【0121】
例26: N-[2-((3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-トロパン-2”β-1’’’-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図8の化合物18(R=4-F))(O-1505)
N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)トロパン-2”β-(1’’’-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(化合物17)(22mg)をEtOH(4mL)に入れて加熱還流させた。0.005MのHCl(0.5mL)を含むSnCl2(7.8mg、0.04mmol)の溶液を迅速に加え、続けて直ちに0.005MのHCl(0.5mL)を含むNaReO4(12.4mg,0.04mmol)を加えた。曇り溶液を6時間還流させ、次に、0.5gのシリカに供給し一夜ポンプで減圧排気した。シリカ吸着生成物をクロマトグラフのカラム(3g溶離剤:30%EtOAc/ヘキサン/5%TEA)に入れて分離した。得られた茶紫色の固形物をペンタンと共にすりつぶし、一夜高真空で乾燥させて、泡状の化合物18(9.9mg、71%)を収穫した。
【0122】
このときのデータは、正確な質量計算値:695.161(検出値:695.172);Rf0.30(75%EtOAc/ヘキサン+0.5%NH4OH);1H-NMR(CDCl3)δ0.75-0.95(2t、3H)、1.0-2.0(m、8H)、2.0-2.5(m、6H)、2.8-3.0(m、1H)、3.0-3.5(m、7H)、3.6-3.8(m、1H)、3.9-4.2(m、3H)、4.5-4.65(m、1H)、4.73-5.12(2d、J=16.7Hz)、6.9-7.0(m、2H)、7.08-7.15(m、2H)である。
【0123】
例27: N-[(2-((3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)-トロパン-2”β-1’’’-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図8の化合物18(R=3,4-Cl2))
EtOH(5mL)に入れたN-[2-(3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)トロパン-2”β-(1-プロパノイル))(2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(化合物17)(24mg、0.024mmol)を加熱還流させた。0.005MのHcl(0.5mL)に入れたSnCl2(9mg、0.05mmol)の溶液を迅速に加え、続けて直ちに0.005MのHCl(0.5mL)に入れたNaReO(14.5mg、0.005mmol)を加えた。この溶液を4時間還流させ、次に0.5gのシリカに供給し、一夜高真空に維持した。シリカ吸着物質をクロマトグラフのカラム(4gのSiO2;溶離剤30%EtOAC/ヘキサン/5%Et3N)に入れて精製した。得られた固形物を濃縮して化合物18(4.6mg、27%)を得た。このときのデータは、1H-NMR(CDCl3)δ0.8-1.0(2t、3H)、1.1-2.5(m、14H)、2.8-3.0(m、1H)、3.0-3.5(m、7H)、3.6-3.8(m、1H)、3.9-4.2(m、1H)、4.4-4.65(m、1H)、4.70-5.06(2d、2xJ=16.7Hz、1H)、7.0(dd、1H)、7.3(d、1H)、7.34(d、1H)である。
【0124】
例28: 2β-(メトキシメチルカルバモイル-3α-(4-フルオロフェニル)-ノルトロパン(図9の化合物20(R=4-F))
2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-トロパン(化合物14)(112mg、0.37mmol)を1-クロロエチルクロロホルム酸塩(2.2mL)と一緒にし、その溶液を加熱して5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物にメタノールを加えて45分間加熱還流させた。MeOHを真空中で除去し、残留物をCHCl3とNaHCO3/Na2CO3(pH=9)に溶解した。水溶液層をCHCl3(3x10mL)と共に抽出し、結合有機抽出物を乾燥し(Na2SO4)、ろ過して濃縮し、104mgの生成物を得た。この残留物をクロマトグラフ(溶離剤:10-20% Et3N /EtOAc)で精製し、化合物20(65mg、60%)を得た。このときのデータは、Rf0.13(10% Et3N/EtOAc);1H-NMR(CDCl3)δ1.30(ddd、1H)、1.5-1.75(m、2H)、1.85-2.15(m、2H)、2.2-2.35(m、1H)、2.7-2.9(m、1H)、3.05(s、3H)、3.1-3.22(m、1H)、3.38(s、3H)、3.4-3.5(m、1H)、3.6-3.7(m、1H)、6.9-7.0(m、2H)、7.13-7.23(m、2H)である。
【0125】
例29: N-[2-(3’-N’-プロピル-(1”R’)-3”α-(4-フルオロフェニル)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図9の化合物21(R=4-F))(O-1450)
2β-(1-プロパノイル)-3α-(4-フルオロフェニル)ノルトロパン(化合物20)(65mg、0.22mmol)をMAMA’-Cl(203mg、0.27mmol、1.2当量)、KI(74mg、0.45mmol)およびK2CO3(309、2.2mmol)を全て無水MeCN(10mL)に入れ、6時間還流させてから室温にまで冷却した。溶媒を真空中で除去し、残留物をCHCl3と水の間に分けた。水溶液層をCHCl3(3x5mL)で抽出し、結合有機抽出分を(Na2SO4)で乾燥させ、ろ過して黄色の油を得た。これをカラムクロマトグラフィ(15gのSiO2と50%EtOAC120ml/ヘキサン/5%Et3N)で精製した。淡黄色の油である化合物21(142mg、41%)を得た。このときのデータは、Rf0.7(5%Et3N/ EtOAc);元素分析:計算値C、71.02、H、6.96、N、5.26;検出値: C、71.20、H、6.45、N、5.14;1H-NMR(CDCl3)δ1.2-3.5(m、24H)、2.85(s、2H)、3.02(s、3H)、3.42(s、3H)、6.85-7.0(m、2H)、7.1-7.7(m、32H)である。
【0126】
例30: N-[(2-((3’-N’-プロピル-(1”R’)-3”α-(4-フルオロフェニル)-トロパン-2”β-メトキシメチルカルバモイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図9の化合物22(R=4-F))(O-1451)
N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(化合物21)(21mg、0.02mmol)をEtOH(4mL)に入れて加熱還流させた。0.005MのHCl(0.5mL)を含むSnCl2(8.4mg、0.04mmol)の溶液を迅速に加え、続けて直ちに0.05MのHCl(0.5mL)を含むNaReO4(13mg、0.04mmol)を加えた。溶液を10時間還流させ、次に、0.5gのシリカに供給し一夜ポンプで減圧排気した。シリカ吸着生成物をクロマトグラフのカラム(3g溶離剤:30%EtOAc/ヘキサン/5%Et3N)に入れて分離した。同様の画分を合わせて濃縮し、紫色の泡状精製物(3.7mg、26%)を収穫した。このときのデータは、Rf0.5(25%ヘキサン/EtOAc);1H-NMR(CDCl3)δ1.1-4.2(m、30H)、4.5-4.6(m、1H)、4.75-5.12(2d、J=16.7Hz,2x6β、1H)、6.8-7.0(m、2H)、7.1-7.2(m、2H)である。
【0127】
例31: 2β-(メトキシメチルカルバモイル-3β-(4-フルオロフェニル)-ノルトロパン(図9の化合物20A(R=4-F))
2β-(1-プロパノイル)-3β-(4-フルオロフェニル)-トロパン(143mg、0.50mmol)を1-クロロエチルクロロホルム酸塩(2mL)と一緒にし、その溶液を加熱して2時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物にメタノール(30ml)を加えて45分間加熱還流させた。メタノールを真空中で除去し、残留物をCHCl3とNaHCO3/Na2CO3(pH=9)に溶解した。水溶液層をCHCl3(3x10mL)と共に抽出し、結合有機抽出物を乾燥し(Na2SO4)、ろ過して濃縮した。この残留物をクロマトグラフ(溶離剤:10-20% Et3N /EtOAc)で分離した。同様に分画を結合し、80mg(58%)の生成物を得た。このときのデータは、1H-NMR(CDCl3)δ1.50(m、1H)、1.7(m、2H)、1.95-2.22(m、2H)、2.5(ddd、1H)、2.92(s、3H)、3.1-3.4(m、2H)、3.3(s、3H)、3.6(m、1H)、3.72(m、1H)、6.9-7.0(m、2H)、7.1-7.3(m、2H)である。
【0128】
例32: N-[2-(3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図5の化合物21A(R=4-F))
2β-(1-プロパノイル)-3β-(4-フルオロフェニル)-ノルトロパン(80mg、0.28mmol)をMAMA’-Cl(244mg、0.32mmol)、KI(84mg、0.5mmol、2.0当量)およびK2CO3(322、2.3mmol)を無水MeCN(10mL)に入れ、一夜還流させてから室温にまで冷却した。溶媒を真空中で除去し、残留物をクロマトグラフのカラム(5%Et3N /EtOAc)で精製した。生成物を含む分画を集め、濃縮して、淡黄色の泡として生成物(80mg、29%)を得た。このときのデータは、Rf0.65(5%Et3N/ EtOAc);1H-NMR(CDCl3)δ1.2-3.1(m、28H)、3.37(m、1H)、3.51(s、3H)、3.55(m、1H)、6.9-7.0(m、2H)、7.1-7.5(m、32H)である。
【0129】
例33: N-((2-((3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)トロパン-2”β-メトキシメチルカルバモイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図9の化合物22A(R=4-F))(O-1451)
N-[2-(3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)トロパン-2”β-メトキシメチルカルバモイル)((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(22mg、0.02mmol)をEtOH(10mL)に入れて加熱還流させた。0.005MのHCl(1.0mL)に入れたSnCl2(8.4mg、0.05mmol)の溶液を迅速に加え、続けて直ちに0.05MのHCl(0.5mL)に入れたNaReO4(13mg、0.05mmol)を加えた。溶液を10時間還流させ、次に、クロマトグラフのカラム(65%EtOAc/ヘキサン/5%Et3N)に入れて分離した。同様の分画を合わせて濃縮し、泡状精製物(10mg、65%)を得た。このときのデータは、Rf0.44(5% Et3N/30%ヘキサン/EtOAc);1H-NMR(CDCl3)δ1.5-4.2(m、30H)、4.4-4.6(m、1H)、4.75、5.05(2d、J=16.5Hz、1H)、6.8-7.0(m、2H)、7.1-7.3(m、2H)である。
【0130】
例34: (1R)-N-メチル-2-ヒドロキシメチル-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物38(R=4-F))
(1R)-N-メチル-2-メトキシカルボニル-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(化合物3)(500mg、1.82mmol)をベンゼン(15mL)に溶解し、LAH(70mg、1.82mmol)を加えた。反応液を一夜600Cに加熱保持した。反応液を00Cに冷却し、水(70μL)、NaOHの15%溶液(70μL)、水(200μL)を順次加えた。反応液を15分間撹拌し、塩類をシーライトで濾し取った。ろ過物をNa2SO4で乾燥させ、ろ過濃縮して化合物38(454mg、90%)を得た。この化合物をカラムクロマトグラフィ(30gのSiO2と4%Et3N/10%MeOH/CHCl3)で精製した。同様の分画を合わせ還元し、一夜高真空に保持し、化合物38(336mg、74%)を得た。
【0131】
このときのデータは、Mp.106.6-108.70C;Rf0.2(10%MeOH/CHCl3;5%Et3N);1H-NMR(CDCl3)δ1.5-1.7(m、1H)、1.9-2.0(m、3H)、2.1-2.3(m、2H)、2.4(s、3H)、2.72(brd、J=18Hz、1H)、3.31(brs、1H)、3.55(d、J=4.1Hz、1H)、3.89(d、J=12.3Hz、1H)、4.02(d、J=12.3Hz、1H)、6.9-7.0(m、2H)、7.1-7.2(m、2H)、元素分析:計算値C、72.85、H、7.34、N、5.66;検出値:C、72.94、H、7.33、N、5.73である。
【0132】
例35: (1R)-N-メチル-2-ヒドロキシメチル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物38(R=3,4-Cl2))
(1R)-N-メチル-2-メトキシカルボニル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(化合物3)(508mg、1.56mmol)をベンゼン(20mL)に溶解し、LAH(62mg、1.56mmol)を加えた。反応液を一夜600Cに加熱還流した。反応液を00Cに冷却し、水(80μL)、10%KOH溶液(90μL)、水(300μL)を順次加えた。反応液を15分間撹拌し、塩類をシーライトで濾し取った。ろ過液をNa2SO4で乾燥させ、ろ過濃縮して黄色の泡(420mg、90%)を得て、これをカラムクロマトグラフ(3%Et3N/7%MeOH/CHCl3)で精製し280mg(60%)の生成物を得た。このときのデータは、Rf0.2(5%MeOH/CHCl3;3%Et3N);1H-NMR(CDCl3)δ1.5-1.66(m、1H)、1.84-1.98(m、2H)、2.0(m、2H)、2.08-2.24(m、2H)、2.39(s、3H)、2.7(dd、1H)、3.3(m、1H)、3.54(d、J=5.5Hz、1H)、3.89(d、J=11.8Hz、1H)、4.01(d、J=11.8Hz、1H)、6.99(dd、1H)、7.25(d、1H)、7.37(d、1H)である。
【0133】
例36: (1R)-N-メチル-2-カルボニル-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物39(R=4-F))
(COCl)2(55mg、40μL、0.43mmol)とCH2Cl2(2mL)の混合溶液を-780Cに冷却し、DMSO(65μL)を3分間を越える間に滴加した。反応液を-780C の温度でさらに5分間撹拌し、CH2Cl2(2mL)に溶かした化合物38(90mg、0.36mmol)を10分間を越える間に滴加した。さらに20分経ってから、Et3N(250μL、1.80mmol)を30分間を越える間滴加した。反応液をさらに10分間撹拌し、室温になるまで放置した。CH2Cl2(20mL)と1MのNaOHを加えた。層に分け取り、水溶液層をCH2Cl2(1x15mL)で洗った。結合有機抽出物をNa2SO4で乾燥させ、ろ過濃縮して高真空に排気した。得られた黄色油(86mg)をカラムクロマトグラフィ(4.5gのSiO2と30%EtOAc/ヘキサン/5%Et3N)で精製した。同様の分画を合わせ濃縮し、高真空で乾燥させて化合物39(62mg、63%)を得た。このときのデータは、Rf0.2(20%EtOAc/ヘキサン、5%Et3N);1H-NMR(CDCl3)δ1.55-1.65(m、1H)、1.72-1.82(m、2H)、2.14-2.3(m、2H)、2.40(s、3H)、2.9-3.0(m、1H)、3.36-3.44(m、1H)、4.02-4.30(m、1H)、7.0-7.1(m、2H)、7.16-7.24(m、2H)、9.45(s、1H)である。
【0134】
例37: (1R)-N-メチル-2-カルボニル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物39(R=3,4-Cl-2))
(COCl)2(125mg、87μL、1.0mmol)とCH2Cl2(20mL)の混合溶液を-780Cに冷却し、DMSO(150μL)を3分間を越える間に滴加した。反応液を-780Cの温度でさらに5分間撹拌し、CH2Cl2(5mL)に溶かした化合物38(245mg、0.82mmol)を7分間を越える間に滴加した。さらに30分経ってから、Et3N(600μL、4.0mmol)を約15分間を越える間に滴加した。反応液をさらに10分間撹拌し、室温になるまで放置した。 CH2Cl2(20mL)とNa2CO3(20mL;1M)を加えた。層に分けて採取し、水溶液層をCH2Cl2(1x20mL)で洗った。結合有機抽出物をNa2SO4で乾燥させ、ろ過濃縮して高真空に排気した。残留物をカラムクロマトグラフィ(25gのSiO2と60%EtOAc/ヘキサン/5%Et3N)で精製した。同様の分画を合わせ濃縮し、高真空で乾燥させて生成物39(154mg、63%)を得た。このときのデータは、Rf0.2(75%EtOAc/ヘキサン、5%Et3N);1H-NMR(CDCl3)δ1.5-1.7(m、1H)、1.7-1.85(m、1H)、2.1-2.3(m、2H)、2.38(s、3H)、2.93(dd、1H)、3.39(m、1H)、4.05(dd、1H)、7.08(dd、1H)、7.34(d、1H)、7.46(d、1H)、9.45(s、1H)である。
【0135】
例38: (1R)-N-メチル-2-(2-ヒドロキシプロピル)-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物40(R=4-F))
化合物39(62mg、0.26mmol)を無水THFに室温で溶解し、EtMgBr/Et2O(3M;900μL)を滴加した。反応液を室温で20分間撹拌し、次に650C の温度で一夜撹拌した。次に、1MのHCl(50mL)とEt2O(50mL)を650C の温度で徐々に加えた。この混合液をNaCO3の飽和水溶液で塩基化させて分離した。水溶液層をCHCL3(2x20mL)で抽出し、(Na2SO4で)乾燥させ、ろ過し蒸発させ高真空で乾燥させた。残留物(90mg)をカラムクロマトグラフィ(6gのSiO2と5%Et3N/ EtOAc)で精製した。同様の分画を合わせて蒸発させ、高真空で乾燥させて化合物40(82mg、52%)を得た。このときのデータは、Rf0.4(10%MeOH/CHCL3/5%Et3N);1H-NMR(CDCl3)δ0.83(t、J=7.6Hz、3H)、1.4-1.7(m、4H)、1.81(d、J=18Hz、1H)、2.0(m、1H)、2.1-2.3(m、2H)、2.42(s、3H)、2.7(m、1H)、3.3(m、1H)、3.53(m、1H)、4.1-4.2(m、1H)、6.9-7.1(m、4H)である。
【0136】
例39: (1R)-N-メチル-2-(2-ヒドロキシプロピル)-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物40(R=3,4-Cl2))
化合物39(150mg、0.5mmol)を無水THF(25mL)に室温で溶解し、EtMgBr/Et2O (3M;350μl,1.05mmol)を2分を越える時間をかけて滴加した。反応液を室温で2.75時間撹拌し、次に、1MのHCl(20mL)とEt2O(20mL)の溶液を徐々に加えた。この混合液をNa2CO3の飽和水溶液で塩基化させて分離した。水溶液層をCHCl3(3x20mL)で抽出し、(Na2SO4で)乾燥させ、ろ過し蒸発させ高真空で乾燥させた。残留物(197mg)をカラムクロマトグラフィ(20gのSiO2と5%Et3N/ EtOAc)で精製し化合物40(109mg、66%)を得た。このときのデータは、Rf0.07(5%Et3N、20%ヘキサン/EtOAc);1H-NMR(CDCl3)δ0.85(t、J=7.4Hz、3H)、1.4-1.7(m、4H)、1.79(d、J=17.6Hz、1H)、1.95-2.1(m、1H)、2.1-2.3(m、2H)、2.42(s、3H)、2.68(dd、 J=4.18Hz、1H )、3.3(m、1H)、3.38(d、1H)、3.52(d、J=5Hz、1H)、4.1-4.2(m、1H)、6.9(d、1H)、7.20(dd、1H)である。
【0137】
例40: (1R)-2-プロパノイル-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]-オクト-2-エン(図13の化合物26(R=F-4))
トロパン40(28mg、0.1mmol)をCH2Cl2に溶かし、(COCl)2(5.5μL、0.12mmol)とDMSO(20μL、0.26mmol)をCH2Cl2に溶かした低温(-780C)混合溶液に滴加し、-780Cの温度で30分間撹拌した後、Et3N(75μL、0.5mmol)加え、反応液を温度まで暖めた。CH2Cl2と1MのNaOHを加えて分層させた。有機層を(Na2SO4で)乾燥させ、ろ過、蒸発させ、生成物をクロマトグラフのカラム(5%Et3N,25%ヘキサン,70%EtOac)に入れて精製し、18.6mgの生成物(66%)を得た。このときのデータは、Rf0.2(5%Et3N /25%ヘキサン/70%EtOAc);1H-NMR(CDCl3)δ0.80(t、3H)、1.6(m、1H)、1.8-2.3(m、6H)、2.40(s、3H)、2.75(dd、1H)、3.35(m、1H)、3.73(m、1H)、7.0(m、2H)、7.05-7.15(m、2H)である。
【0138】
例41: (1R)-2-メトキシカルボニル-3-(4-フルオロフェニル)-8-ノルアザビシクロ[3.2.1]-オクト-2-エン(図11の化合物29(R=4-F))(O-1131)
2-メトキシカルボニル-3-(4-フルオロフェニル)トロパン3(362mg、1.3mmol)を1-クロロエチルクロロホルム酸塩(1mL)に入れ、その溶液を加熱して2時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノール(30ml)に入れ45分間加熱還流させた。メタノールを真空中で除去し、残留物をCHClとNaHCO3/Na2CO3(pH=9)に溶解した。水溶液層をCHCl(3x10mL)と共に抽出し、結合有機抽出物を(Na2SO4)で乾燥させ、ろ過し濃縮した。残留物をクロマトグラフ(溶離剤:1-3% Et3N /EtOAc+0.5%NH4OH)で分離した。同様画分を結合し、黄色の固形生成物(234mg、68%)を得た。このときのデータは、Rf0.7(10%MeOH/ヘキサン+0.5% NH4OH);mp.67-68℃;1H-NMR(CDCl3)δ1.50-3.0(m、6H)、3.8(m、1H)、4.2(m、1H)、6.8-7.2(m、4H)。元素分析:計算値:C、68.95、H、6.17、N、5.36:検出値: C、68.81、H、6.24、N、5.40である。
【0139】
例42: (1R)-2-メトキシカルボニル-3-(3,4-ジクロロフェニル)-8-ノルアザビシクロ[3.2.1.]オクト-2-エン(図11の化合物29(R=3,4-Cl2)(O-1130)
2-(メトキシカルボニル)-3-[3,4-ジクロロフェニル)トロパン(200mg、0.61mmol)を1-クロロエチルクロロホルム酸塩(4mg)に溶かし、溶液を2時間加熱還流させた。余剰クロロホルム酸塩を真空除去し、残留物をメタノール(30mL)に入れ45分間還流させた。残留物をCHCl3とNaHCO3/Na2CO3の溶液(pH=9)に溶解した。水液層をCHCl(3x10mL)と共に抽出し、結合有機抽出物を(Na2SO4)で乾燥させ、ろ過し濃縮した。残留物をクロマトグラフ(溶離液5-15%のEt3N/EtOAc)で精製した。同様な分画を一緒にして黄色の固形物を得た。このときのデータは、Rf0.3(10% Et3N/EtOAc);1H-NMR(CDCl3)δ1.50-2.3(m、5H)、2.5-2.9(m、1H)、3.53(s、3H)、3.8(m、1H)、4.2(m、1H)、6.9(dd、1H)、7.2(dd、1H)、7.4(d、1H)。元素分析:計算値C、57.71、H、4.84、N、4.49;検出値: C、57.45、H、4.87、N、4.47である。
【0140】
例43: N-[2-(3’-N’-プロピル-(1”R)-3”-(4-フルオロフェニル)トロプ-2-エン-2”-(メトキシカルボニル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図11の化合物30(R=4-F))
2-(1-メトキシカルボニル)-3-(4-フルオロフェニル)ノルトロプ-2-エン(134mg、0.5mmol)をMAMA’-Cl(387mg、0.5mmol)、KI(85mg、0.5mmol)およびK2CO3(707mg、5mmol)と共に無水MeCN(10mL)に入れて一夜還流させ、その後室温に冷却した。溶媒を真空中で除去し、残留物をクロマトグラフのカラム(1-6%Et3N/EtOAc)に入れ精製した。生成物を含んでいる分画を合わせ濃縮して軽い黄色の泡状の精製物(148mg、29%)を得た。このときのデータは、Rf0.18(10% Et3N/ヘキサン);1H-NMR(CDCl3)δ1.3-3.15(m、22H)、3.2-3.4(m、1H)、3.5(s、3H)、3.8-3.9(m、1H)、6.8-7.8(m、34H)である。
【0141】
例44: N-[2-(3’-N’-プロピル-(1”R)-3”-(3,4-ジクロロフェニル)トロプ-2-エン-2”-(メトキシカルボニル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図11の化合物30(R=3,4-Cl2))
2-(1-メトキシカルボニル)-3-(3,4-ジクロロフェニル)ノルトロプ-2-エン(107mg、0.34mmol)をMAMA’-Cl(258mg、0.34mmol)、KI(57mg、0.34mmol)およびK2CO3(472mg、3.4mmol)と共に無水MeCN(10mL)に入れて一夜還流させ、次に、室温まで冷却した。溶媒を真空中で除去し、残留物をクロマトグラフのカラム(1-6%Et3N/EtOAC)に入れて精製した。生成物を含んでいる分画を合わせ濃縮して泡状の生成物(111mg、31%)を得た。このときのデータは、Rf0.18(ヘキサン中5%Et3N);1H-NMR(CDCl3)δ1.4-3.2(m、22H)、3.2-3.4(m、1H)、3.5(s、3H)、3.8-3.9(m、1H)、6.8-7.6(m、33H)である。
【0142】
例45: N-[(2-((3’-N’-プロピル-(1”R)-3”-(4-フルオロフェニル)トロプ-2-エン-2”-(メトキシカルボニル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]レニウム(V)酸化物(図11の化合物31(R=4-F))(O-1135)
N-[2-(3’-N’-プロピル-(1”R)-3”-(4-フルオロフェニル)トロプ-2-エン-2”-(メトキシカルボニル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(130mg、0.13mmol)を、EtOH(10mL)に入れ、加熱還流させた。0.005MのHCl(1.0mL)に溶かしたSnCl2(28mg、0.1mmol)の溶液を迅速に加え、続けて0.005MのHCl(0.5mL)に溶かしたNaReO4(40mg、0.15mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(溶離剤:1-10%Et3N/EtOAC)に注入した。同様の分画を結合濃縮して、泡状の生成物(34mg、37%)を得た。このときのデータは、Rf0.09(10% Et3N/EtOAc;1H-NMR(CDCl3)δ1.4-4.3(m、23H)、3.5(s、3H)、4.5-4.9(m、2H)、6.9-7.2(m、4H)、元素分析:計算値C、41.49、H、4.50、N、6.05;検出値: C、41.77、H、4.44、N、5.93。正確な質量は、計算値で696.1348、検出値で696.1405であった。
【0143】
例46: N-[(2-((3’-N’-プロピル-(1”R)-3”-(3,4-ジクロロフェニル)トロプ-2-エン-2”-(メトキシカルボニル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)酸化物(図11の化合物31(R=3,4-Cl2))(0-1136)
N-[2-(3’-N’-プロピル-(1”R)-3”-(3,4-ジクロロフェニル)トロプ-2-エン-2”-(メトキシカルボニル)(2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(100mg、0.1mmol)をETOH(10mL)に入れ、加熱還流させた。0.005MのHCl(1.0mL)に溶かしたSnCl2(20mg、0.15mmol)の溶液を迅速に加え、続けて0.005MのHCl(0.5mL)に溶かしたNaReO4(29mg、0.11mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(溶離剤:1-10%Et3N/EtOAC)に注入した。同様の分画を結合濃縮して、泡状の生成物(56mg、78%)を得た。このときのデータは、Rf0.09(10% Et3N/EtOAc;1H-NMR(CDCl3)δ1.4-4.2(m、23H)、3.55(s、3H)、4.4-4.9(m、2H)、6.95(dd、1H)、7.2(d、1H) 、7.4(d、1H)、元素分析:計算値C、38.65、H、4.05、N、5.63;検出値: C、38.91、H、3.96、N、5.57。正確な質量は、計算値で746.0663、検出値で746.0689であった。
【0144】
例47: N-[2-(3’-N’-プロピル-(1”R-3”β-(4-フルオロフェニル)-2”β-メトキシカルボニルトロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-2-アミノエタンチオール(図12の化合物33(R=4-F))
乾アセトニトリル(10ml)に溶かしたノル-3β-(4-フルオロフェニル)-2β-(メトキシカルボニルトロパン(52.6mg、0.2mmol)の溶液に、N-[2-((3-クロロプロピル-(2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(151mg、0.2mmol)とKI(33mg、0.2mmol)とK2CO3(280mg、2.0mmol)を順次加えた。生成スラリーを一夜沸騰させた。反応終了後、溶液を室温まで冷却し、2グラムのシリカを加え、溶媒を蒸発させた。生成固形物をシリカカラムで分層させ、EtOAcとヘキサンの1:1溶液に入れた0.5%のNH4OHで溶離させた。標記化合物を、72%の収量(141mg)の泡として収穫した。これを、二塩酸塩に転化した。溶解温度(Mp.)166-1680Cで、IR(Kbr):1666cm-1、また1H-NMR(CDCl3)δ1.8-3.8(m、24H)、3.3(S,3H)、3.9-4.0(m、1H)、4.2-4.3(m、1H)、4.4-4.5(m、1H)、6.9-7.4(m、34H)、元素分析:計算値(2HCl・2H2O):C、68.24、H、6.47、N、3.85;検出値: C、38.03、H、6.40、N、3.82である。
【0145】
例48: (RS)-N-[2-((3’-N’-プロピル-(1”R-3”β-(3,4-ジクロロフェニル)-2”β-(メトキシカルボニルトロパン))(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオール(図12の化合物33(R=3,4-Cl2))
上記化合物を前記例47の化合物と同様にして生成した。このとき、溶解温度(Mp.)1080C、IR(Kbr):1724、1653、957cm-1、1H-NMR(CDCl3)δ1.5-3.9(m、22H)、3.55と3.50(2s、3H)、3.9-4.2(m、2H)、4.5-4.7(m、1H)、4.80(d、16.4Hz、1H)、7.0-7.4(m、3H)で、C24H33Cl2N3S2O4Re[MH]+の正確な質量は、計算値で748.0819、検出値で748.0856であった。また元素分析:計算値:C、38.55、H、4.31、N、5.62;検出値:C、38.79、H、4.38、N、5.41である。
【0146】
例49: (RS)-N-[2-((3’-N’-プロピル-(1”R-3”β-(4-フルオロフェニル)-2”β-メトキシメチルカルボニルトロパン))((2-((メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)酸化物(図12の化合物34(R=4-F))(O-861)
N-[2-((3’-N’-プロピル-3”β-(4-フルオロフェニル)トロパン-2”β-カルボン酸メチルエステル)(2-((トリフェニル)チオ)エチル)アミノ)アセチル)-S-(トリフェニルメチル)-2-アミノエタンチオール(98mg、0.1mmol)を沸騰しているエタノール(1.5mL)に溶解した。この溶解液に、SnCl2(0.05MのHCl200mLに21mgを溶かした)溶液を加え、続けてNaReO4(0.05MのHCl200mLに30mgを溶かした)溶液を加えた。一夜沸騰を継続し、沸騰CH3CN(10mL)を加え、生成溶液をシーライトのパッドによりろ過した。ケークを2回以上沸騰CH3CN(2x20mL)で洗浄した。ろ液にシリカゲル(1mg)を加え、溶媒を蒸発させた。固形物をシリカゲルのカラムに分層させ、EtOAcで溶離させた。標記化合物をジアステレオマーの混合物として90%の収率(608mg)で分離した。
【0147】
このとき、溶解温度(Mp.)101.90C、IR(KBr):1720、1666、957cm-1で、1H-NMR(CDCl3)δ1.4-4.2(m、24H)、3.46と3.5(2s、3H)、4.4-4.7(m、1H)、4.80と4.82(2d、16Hz、1H)、6.8-7.3(m、4H)で、C24H34FN3S2O4Re[MH]+の正確な質量は、計算値で698.1557、検出値で698.1557であった。これを、分析のために二塩酸塩に転化した。このときのデータは、元素分析:計算値(Hcl・2H2O):C、37.47、H、4.98、N、5.46;検出値: C、37.45、H、4.95、N、5.40である。
【0148】
例50: (RS)-N-[2-((3’-N’-プロピル-(1”R-3”β-(3,4-ジクロロフェニル)-2”β-メトキシカルボニルトロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)酸化物(図12の化合物34(R=3,4-Cl2))(O-863)
上記化合物を前記例49の化合物と同様にして作成した。
このとき、溶解温度(Mp.)1080C、IR(KBr):1724、1653、957cm-1で、1H-NMR(CDCl3)δ1.5-3.9(m、22H)、3.55と3.50(2s、3H)、3.9-4.2(m、2H)、4.5-4.7(m、1H)、4.80(d、16.4Hz、1H)、7.0-7.4(m、3H)で、C24H33Cl2N3S2O4Re[MH]+の正確な質量は、計算値で748.0819、検出値で748.0856であった。また元素分析:計算値:C、38.55、H、4.31、N、5.62;検出値: C、38.79、H、4.38、N、5.41である。
【0149】
例51: (1R)-2β-メトキシカルボニル-3α-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクタン(図12の化合物35(R=3,4-Cl2))
(1R)-N-メチル-2β-メトキシカルボニル-3α-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクタン(化合物12)(375mg、1.14mmol)とα-クロロエチルクロロホルム酸塩(ACE-Cl)(3mL)を結合し、1000Cの油浴温度で1時間加熱した。余剰ACE-Clを減圧して除去し、残留物にメタノール(50mL)を加えた。この混合液を30分間加熱還流させ、濃縮して乾燥させた。この得られた残留物をCH2Cl2(75mL)に溶解し、NH4OHの水溶液で洗浄し、Na2SO4で乾燥させ、ろ過濃縮して粗脱メチル化生成物を得た。これをフラッシュクロマトグラフィ(1%NHO4OH、50-0%ヘキサン、50-90%EtOAc、0-10%メタノール)で精製し、250mg(70%)の化合物35を得た。このときのデータは、Rf0.14(5%Et3N/EtOAc/ヘキサン1:1);1H-NMR(CDCl3)δ1.1-2.5(m、8H)、2.9-3.3(m、1H)、3.5-3.8(m、1H)、3.6(s、3H)、6.95-7.40(m、3H)である。
【0150】
例52: (1R)-2β-メトキシカルボニル-3α-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクタン(図12の化合物35(R=4-F))
(1R)-N-メチル-2β-メトキシカルボニル-3α-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクタン(95mg、0.34mmol)とACE-Cl(7mL)を結合し、1000Cのオイルバス温度で1時間加熱した。余剰ACE-Clを減圧して除去し、残留物にメタノール(50mL)を加えた。この混合液を30分間加熱還流させ、濃縮して乾燥させた。この得られた残留物をCH2Cl2(75mL)に溶解し、NH4OHの水溶液で洗浄し、Na2SO4で乾燥させ、ろ過濃縮して粗脱メチル化生成物を得た。これをフラッシュクロマトグラフィ(0-5%NHO4OH、10%MeOH/EtOAc)で精製し、86mg(95%)の化合物35を得た。このときのデータは、Rf0.66(10%MeOH/EtOAc+0.5%NH4OH);1H-NMR(CDCl3)81.2(ddd,1H)1.2-2.8(m、5H)、3.3-3.6(m、2H)、3.5(s、3H)、3.8-4.2(m、2H)、6.9-7.3(m、4H)である。
【0151】
例53: N-[2-(3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)-2’’β-メトキシカルボニルトロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図12の化合物36(R=3,4-Cl2))
(1R)-2β-メトキシカルボニル)-3α-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクタン(化合物35)(250mg、0.79mmol)と乾CH3CN(40mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニル-メチル)-2-アミノエタンチオール(601mg、0.79mmol)とKI(132mg)およびK2CO3(1.1g)を順次加えた。生成スラリーを一夜沸騰状態に維持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分かれさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過して濃縮させ、残留物をフラッシュクロマトグラフィ(15gSiO2;1:1のEtOAC/ヘキサン混合液中0-5%の Et3N)に入れて精製し、100mg(12%)の白色泡状の生成物を得た。
【0152】
このときのデータは、Rf0.18(EtOAc/ヘキサン中2.5%NH4OH);1H-NMR(CDCl3)δ1.20-1.54(m、5H)、1.80-2.50(m、15H)、2.81(d、J=17Hz、1H)、2.88(d,J=17H2,1H)3.00(m、2H)、3.16-3.40(m、3H)、3.54(s、3H)、7.03(dd、J=2.2、8.5Hz、1H)、7.14-7.53(m、32H)。 元素分析:計算値:C、72.07、H、6.15、N、4.07、Cl、6.86;検出値: C、72.18、H、6.21、N、3.97、 Cl、6.75である。
【0153】
例54: N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-2’’β-メトキシカルボニル-トロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図12の化合物36(R=4-F))
(1R)-2β-メトキシカルボニル-3α-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクタン(化合物35)(230mg、0.87mmol)と乾CH3CN(25mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニル-メチル)-2-アミノエタンチオール(660mg、0.87mmol)とKI(145mg、0.87mmol)およびK2CO3(1.21g、8.7mmol)を順次加えた。生成スラリーを一夜沸騰状態に保持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分かれさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過し濃縮させ、残留物をフラッシュクロマトグラフィ(50%の EtOAc /ヘキサン+1%NH4OH)に入れて精製し、435mg(51%)の泡状の生成物を得た。
【0154】
このときのデータは、Rf0.45(1%Et3N、50%EtOAc、49%ヘキサン);1H-NMR(CDCl3)δ1.20-1.3(m、1H)、1.3-2.5(m、19H)、2.81(d、J=17Hz、1H)、2.86(d、 J=17Hz、1H)、2.95-3.05(m、2H)、3.10-3.4(m、3H)、3.50(s、3H)、6.89-6.96(m、2H) 、7.1-7.5(m、32H)。 元素分析:計算値(0.75H2O):C、74.78、H、6.63、N、4.22;検出値: C、74.80、H、6.64、N、4.17である。
【0155】
例55: N-[(2-((3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-2”β-メトキシカルボニルトロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-レニウム(V)酸化物(図12の化合物37(R=4-F))(0-1186)
N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-2”β-メトキシカルボニルトロパン)(2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタン-チオール(226mg、0.23mmol)をEtOH(10mL)に入れ、加熱還流させた。0.05MのHCl(1.0mL)に溶かしたSnCl2(48mg、0.25mmol)の溶液を迅速に加え、続けて0.05MのHCl(0.5mL)に溶かしたNaReO4(69mg、0.25mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(5%Et3N/Et2O)に注入した。同様の分画を結合濃縮して、泡状の生成物(33mg、21%)を得た。このときのデータは、Rf0.38(10% Et3N/EtOAc;1H-NMR(CDCl3)δ0.9-4.3(m、24H)、3.53と3.56(2s、3H)、4.4-4.7(m、1H)、4.75と5.00(2s、1H)、6.8-7.4(m、4H)で、元素分析:計算値(2/7Et2O):C、42.06、H、5.03、N、5.85;検出値: C、42.08、H、4.93、N、5.85である。
【0156】
例56: N-[(2-((3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)-2”β-メトキシカルボニルトロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]レニウム(V)酸化物(図12の化合物37(R=3,4-Cl2))(O-1196)
上記化合物を前記例55の化合物と同様にして生成した。このときのデータは、Rf0.51(10% Et3N/EtOAc;1H-NMR(CDCl3)δ1.2-1.4(m、1H)、1.4-2.5(m、11H)、2.89(m、1H)、3.10-3.40(m、5H)、3.56と3.60(2s、3H)、3.6-3.8(m、0.5H)、3.90-4.15(m、3.5H)、4.60-(m、1H)、4.73と4.95(2d、J=16.2と16.2Hz、2x0.5H)、7.0-7.1(m、1H) 、7.24-7.36(m、2H)で、元素分析:計算値(H2O):C、37.64、H、4.48、N、5.49;検出値: C、37.59、H、4.31、N、5.55である。
【0157】
例57: (1R)-N-メチル-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン(図14の化合物50)
(1R)-2-(メトキシカルボニル)-3-[[(トリフルオロメチル)スルホニル)オキシ)トロプ-2-エン(化合物2)(500mg、1.52mmol)とLiCl(142mg、3.34mmol)とPd2dba3(56mg、0.06mmol)とNa2CO3(2.0Mの水溶液2mL)とジメトキシメタン(6mL)を全て1本のフラスコに入れ強力に撹拌した。この溶液に、2-ナフチルホウ酸(340mg、1.97mmol)を加えた。反応液を2時間還流させてからシーライトでろ過した。ケークをエーテルで洗い、全有機溶液を濃縮水酸化アンモニウム溶液で洗い出した。洗浄溶媒を炭酸カリウムで乾燥させ、ろ過し蒸発させた。残留物をカラム(1-4%Et3N/ EtOAc)で精製し、240mg(51%)の化合物50を得た。このときのデータは、Rf0.48(10% Et3N/EtOAc);1H-NMR(CDCl3)δ1.3-3.6(m、7H)、2.5(s、3H)、3.45(s、3H)、3.8-4.0(m、1H)、7.2-8.0(m、7H)。元素分析:計算値(0.5H2O):C、77.24、H、6.94、N、4.50;検出値: C、77.27、H、6.94、N、4.48である。
【0158】
例58: (1R)-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン(図14の化合物51)
(1R)-N-メチル-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]-オクト-2-エン(化合物50)(100mg、0.33mmol)をACE-Cl(0.25mL)に溶かし、この溶液を5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノールに入れ45分間還流させた。メタノールを真空中で除去し、残留物をCH2Cl2に溶解し、NaHCO3/Na2CO3 (pH=9)を加えて振り混ぜた。水溶液層をCH2Cl2で抽出し、結合有機抽出物を(Na2SO4で)乾燥させ、ろ過して濃縮した。残留物をクロマトグラフィ(1-10%Et3N/ EtOAc)で分離精製した。同様の分画を結合し化合物51(27mg、28%)を得た。このときのデータは、Rf0.15(10% Et3N/EtOAc);1H-NMR(CDCl3)δ1.6-2.5(m、5H)、2.7-3.1(m、1H)、3.45(s、3H)、3.8-3.9(m、1H)、4.2-4.35(m、1H)、7.1-8.0(m、7H)である。
【0159】
例59: N-[2-(3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3’’-(2-ナフチル)-トロプ-3-エン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図14の化合物52)
(1R)-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン(化合物51)(27mg、0.09mmol)と乾CH3CN(10mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニル-メチル)-2-アミノエタンチオール(70mg)とKI(15mg)とK2CO3(127mg)を順次加えた。生成スラリーを一夜沸騰状態に保持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分かれさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過して濃縮させ、残留物をフラッシュクロマトグラフィ(50-90%のEtOAc/ヘキサン+3%NH4OH)に入れて精製し、27mg(29%)の化合物52を得た。このときのデータは、Rf0.44(1%NH4OH/EtOAc);1H-NMR(CDCl3)δ1.5-3.2(m、20H)、2.87(s、2H)、3.3-3.4(m、1H)、3.4(s、3H)、3.9-4.0(m、1H)、7.0-7.8(m、37H)である。
【0160】
例60: N-[(2-((3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3”-(2-ナフチル)-トロプ-2-エン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]-レニウム(V)酸化物(図14の化合物41)(0-1185)
N-[2-(3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3”-(2-ナフチル)-トロプ-2-エン))((2-トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(化合物52)(27mg、0.027mmol)をETOH(10mL)に入れ、加熱還流させた。0.05MのHCl(1.0mL)に溶かしたSnCl2(5.7mg、0.03mmol)の溶液を迅速に加え、続けて0.05MのHCl(0.5mL)に溶かしたNaReO4(8.2mg、0.03mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(5%Et3N/Et2O)に注入した。同様の分画を結合濃縮して、ジアステレオマーの混合物(15mg、76%)を得た。このときのデータは、Rf0.15(10%Et3N/EtOAc;IR(KBr)967cm-1;正確な質量値:計算値728.15999、検出値728.1664;1H-NMR(CDCl3)δ1.3-4.3(m、23H)、3.45(s、3H)、4.5-4.9(m、2H)、7.1-8.0(m、7H)である。
【0161】
例61: (1R)-N-メチル-2β-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(図14の化合物42)(O-1229)および(1R)-N-メチル-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(図14の化合物43)(O-1228)
(1R)-N-メチル-2β-メトキシカルボニル)-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン(化合物50)(510mg、1.66mmol)とTHF(15mL)の溶液を-780Cの温度に冷却し、Sml2の溶液(THF中で0.1M、116mL、11.6mmol)を滴加した。-780C の温度で30分後にMeOH(42mL)加え溶液をさらに5分間-780C の温度で撹拌した。TFAと水を加えることにより反応を抑制し、冷浴を取り去り溶液を室温に戻した。溶液を、NH4OHで塩基反応させ、エーテルで希釈し、シーライトでろ過した。フィルタ・ケークをさらにエーテルで洗浄し、全ての有機相を結合し、チオ硫酸ナトリウム溶液で洗浄し、次に食塩水で洗浄した。硫酸ナトリウムで乾燥後、溶液をろ過し、濃縮して粗生成物を得た。この粗生成物をカラムクロマトグラフィ(0-2%Et3N/EtOAc)で分離した。化合物42が淡黄色の固形物(110mg、22%)として得られた。このときのデータは、溶解温度(Mp.)94-950C。 Rf0.28(10%MeOH/CHCl3);IR(KBr):2900、1750cm-1;1H-NMR(CDCl3)δ1.5-2.3(m、5H)、2.25(s、3H)、2.7(ddd、1H)、2.9-3.3(m、2H)、3.45(s、3H)、3.3-3.4(m、1H)、4.5-4.6(m、1H)、7.3-7.5(m、4H) 、7.7-7.9(m、4H)。元素分析:計算値(0.25HO2):C、76.52、H、7.55、N、4.46;検出値: C、76.63、H、7.57、N、4.44である。
【0162】
化合物43は、灰色がかった白色の固形物(113mg、23%)として得られた。
このときのデータは、Mp.113-1140C、Rf0.56(10%MeOH/CHCl3);IR(KBr):3000、1750cm-1;1HNMR(CDCl3)δ1.4-1.6(ddd、1H)、1.4-1.8(m、3H)、2.0-2.4(m、2H)、2.3(s、3H)、2.4-2.7(m、1H)、2.65(dd、1H)、3.2-3.4(m、3H)、3.57(s、3H)、7.2-7.5(m、3H)。元素分析:計算値:C、77.64、H、7.49、N、4.53;検出値: C、77.48、H、7.50、N、4.45である。
【0163】
例62: (1R)-2β-2-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(図14の化合物44)
(1R)-N-メチル-2β-(メトキシカルボニル)-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(化合物42)(146mg)をACE-Cl(5.5mL)と混合し、その溶液を5時間加熱還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノールに入れて45分間還流させた。メタノールを真空中で除去し、残留物をCH2Cl2に溶解し、NaHCO3/Na2CO3(pH=9)を入れて振り混ぜた。水溶液層をCH2Cl2で抽出し、結合有機抽出物を(Na2SO4)で乾燥させ、ろ過して濃縮した。残留物をクロマトグラフ(2%MeOH/ EtOAc)で分離した。同様の分画を合わせて化合物44(109mg、78%)を得た。このときのデータは、Rf0.27(10% MeOH/EtOAc);1H-NMR(CDCl3)δ1.5-2.4(m、5H)、2.68(ddd、1H)、4.8-4.9(m、1H)、3.30(s、3H)、3.3-3.4(m、1H)、3.7-3.9(m、2H)、7.1-8.0(m、7H)。 元素分析:計算値(0.25H2O):C、76.10、H、7.23、N、4.67;検出値: C、75.98、H、7.23、N、4.60である。
【0164】
例63: (1R)-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(図14の化合物45)
(1R)-N-メチル-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(化合物43)(90mg)をACE-Cl(4mL)と混合し、その溶液を5時間加熱還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノールに入れて45分間還流させた。メタノールを真空中で除去し、残留物をCH2Cl2に溶解し、NaHCO3/Na2CO3(pH=9)を入れて振り混ぜた。水溶液層をCH2Cl2で抽出し、結合有機抽出物を(Na2SO4)で乾燥させ、ろ過して濃縮した。残留物をクロマトグラフ(2%MeOH/ EtOAc)で分離した。同様の分画を合わせて化合物45(109mg、78%)を得た。このときのデータは、Rf0.27(10% MeOH/CHCl3)である。
【0165】
例64: N-[2-(3’-N’-プロピル-(1”R)-2” β-メトキシカルボニル-3’’β-(2-ナフチル)-トロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図14の化合物46)
(1R)-2β-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(化合物44)(81mg、0.27mmol)と乾CH3CN(20mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニルメチル)-2-アミノエタンチオール(207mg)とKI(46mg、0.27mmol)とK2CO3(378mg)を順次加えた。生成スラリーを一夜還流状態に維持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分れさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過し濃縮させ、残留物をフラッシュクロマトグラフィ(0-90%のEtOAc /ヘキサン+3%NH4OH)に入れて精製し、150mg(54%)の化合物46を得た。
このときのデータは、Rf0.36(10%Et3N/EtOAc);1H-NMR(CDCl3)δ1.4-3.8(m、24H)、2.85(s、2H)、3.38(s、3H)、7.0-7.8(m、37H)である。
【0166】
例65: N-[2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロパン))((2-トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図14の化合物47)
(1R)-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(化合物45)(17mg、0.06mmol)と乾CH3CN(10mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニルメチル)-2-アミノエタンチオール(4.3mg)とKI(9.4mg)とK2CO3(79mg)を順次加えた。生成スラリーを一夜還流状態に維持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分かれさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過して濃縮させ、残留物をフラッシュクロマトグラフィ(50-80%のEtOAc /ヘキサン+3%NH4OH)に入れて精製し、18mg(31%)の化合物47を得た。このときのデータは、Rf0.36(50%EtOAc、47%ヘキサン、3%NH4OH)である。
【0167】
例66: N-[(2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”β-(2-ナフチル)-トロパン)(2-メルカプトエチル)アミノ)アセチル]-2-アミノエタンチオラート]-レニウム(V)酸化物(図14の化合物48)(O-1339)
N-[2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”-(2-ナフチル)-トロプ-2-エン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(化合物46)(150mg、0.15mmol)をETOH(10mL)に入れ、加熱還流させた。0.05MのHCl(1.0mL)に溶かしたSnCl2(31mg、0.16mmol)の溶液を迅速に加え、続けて0.05MのHCl(0.5mL)に溶かしたNaReO4(45mg、0.16mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(5%Et3N/EtOAc)に注入した。同様の分画を結合濃縮して、ジアステレオマーの混合物(34mg、41%)を得た。このときのデータは、Rf0.39(10%Et3N/EtOAc);1H-NMR(CDCl3)δ1.4-4.2(m、24H)、3.40、3.48(2s、3H)、4.4-4.7(m、1H)、8.25、8.30(2d、1H)、7.1-8.0(m、7H)で、元素分析:計算値(0.5EtOAc):C、46.97、H、5.30、N、5.39;検出値: C、46.91、H、5.12、N、5.19である。
【0168】
例67: N-[(2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロパン)(2-メルカプトエチル)アミノ)アセチル]-2-アミノエタンチオラート]-レニウム(V)酸化物(図14の化合物48)(O-1339)
N-[2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロプ-2-エン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(化合物47)(18mg、0.02mmol)をETOH(10mL)に入れ、加熱還流させた。0.05MのHCl(1.0mL)に溶かしたSnCl2(5.3mg)の溶液を迅速に加え、続けて0.05MのHCl(0.5mL)に溶かしたNaReO4(3.7mg)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(5%Et3N/Et2O)に注入した。同様の分画を結合濃縮して、ジアステレオマーの混合物(40%)を得た。
【0169】
このときのデータは、Rf0.46(5%Et3N/EtOAc);1H-NMR(CDCl3)δ1.4-1.8(m、24H)、1.8-2.0(m、2H)、2.02-2.20(m、1H)、2.3-2.5(m、3H)、2.69、2.71(2s、3H)、2.9-3.0(2dd、1H)、3.1-3.4(m、3H)、3.4-3.6(m、1H)、3.5、3.55(2s、3H)、3.6-3.8(2ddd、1H)、3.9-4.2(m、3H)、4.5-4.7(m、1H)、4.75、4.98(2d、1H)、7.32(d、1H)、7.3-7.5(m、2H)、7.64(s、1H)、7.7-7.8(m、3H)である。
【0170】
例68-80
ドーパミントランスポータ用特定化合物の結合親和性と選択性を決定する試験を実施した。試験に用いた化合物の組成を図15及び図16に、試験結果を図17に示す。
【0171】
例81-91:99MTc標識
下記の化合物を下述の同一方法で調製する。
例81:N-[(2-((3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(3,4-ジクロロフェニル)-トロパン)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図12の化合物37(R=3,4-Cl2))(0-1196)
例82:N-[(2-((3’-N’-プロピル-(1”R)-2”β-1-プロパノイル-3”α-(4-フルオロフェニル)-トロパン)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図8の化合物19(R=4-F))
【0172】
例83:N-[(2-((3’-N’-プロピル-(1”R)-2”β-1-プロパノイル-3”α-(3,4-ジクロロフェニル)-トロパン)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図8の化合物19(R=3,4-Cl2))
例84:N-[(2-((3’-N’-プロピル-(1”R)-2”β-メトキシメチルカルバモイル-3”α-(4-フルオロフェニル)-トロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図9の化合物22(R=4-F))(O-1351)
【0173】
例85:(RS)-N-[(2-((3’-N’-プロピル-(1”R-2”β-カルボメトキシ-3”β-(4-フルオロフェニル)-トロパン))-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図12の化合物34(R=4-F))
例86:(RS)-N-[(2-((3’-N’-プロピル-(1”R-2”β-カルボメトキシ-3”β-(3,4-ジクロロフェニル)-トロパン))-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図12の化合物34(R=3,4-Cl2))
例87:N-[(2-((3’-N’-プロピル-(1”R)-2”-カルボメトキシ-3”-(4-フルオロフェニル)-トロペン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-テクネチウム(V)酸化物(図11の化合物31(R=4-F))
【0174】
例88:N-[(2-((3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3”-(3,4-ジクロロフェニル)-トロペン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-テクネチウム(V)酸化物(図11の化合物31(R=3,4-Cl2))
例89:N-[(2-((3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(4-フルオロフェニル)-トロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-テクネチウム(V)酸化物(図12の化合物37(R=4-F))
【0175】
例90:N-[(2-((3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)トロパン)-2”β-1プロパノイル)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図7の化合物11(R=4-F))
例91:N-[(2-((3’-N’-プロピル-(1”R)-2”β-1-プロパノイル-3”β-(3,4-ジクロロフェニル)-トロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-テクネチウム(V)酸化物(図7の化合物11(R=3,4-Cl2))
【0176】
(放射線標識用トロパン類似体の保護解除)
採用した手順を以下に説明する。
TFA、CH2Cl2および(C2H5)3SiHの20マイクロリットルのアプリコットをチオール保護基を開裂させるために各トリチル保護前駆体5.0mgに加えた。20分間温置後に、200μLの1.0MのHCl/エーテル溶液を加えチオールを陽子化した。溶媒を蒸発させ、次にヘキサンで連続洗浄してトリチル基を除去した。脱保護化合物をDMSOに溶解し、1ミリリットル当たり1ミリグラムの濃度で貯蔵液を調製した。
【0177】
(トロパン類似体の放射線標識)
約200mCiの99mTcペルテクネタートナトリウムをグルコヘプトナート・キット(Glucoheptonate Kit)(米国、マサチューセッツ州ビレリカ市のデュポン製薬会社製)に加え、室温で15分間温置した。150mCiの99mTc-グルコヘプトナート生成物を等量の50mMの酢酸塩緩衝液(pH5.2,約2mL)と50μLの脱保護前駆体貯蔵溶液(DMS0中で1mg/mL、50μg)に加えた。この溶液を室温20分間温置した。放射線標識の過程を、逆相VydacC8カラム(4.6x250mm、5μm)を使用したRainin形高性能液体クロマトグラフ(HPLC)システムで監視した。カラムは0.1Mの酢酸アンモニウム/アセトニリルの可動相で溶出させた。流量は毎分1.5mL、5-100%アセトニトリルのグラジエントは15分を越えた。放射線は、Frisk-Tech レートメータ(Bicron社製)を用いて検出した。最終放射線標識生成物を、エタノールで溶出するC18型Sep-Pak装置(Waters社製)を用いて精製した。全ての化合物につき、標識収量および放射化学純度は各々、85%と98%を越えていた。各生成物を無菌生理食塩水で希釈し、10%未満のエタノール溶液を得た。注射前に、この溶液を0.22μmのフィルタでろ過した。代表的なHPLCのクロマトグラムを図18乃至図21に示す。
【0178】
(HPLCでの分析結果の要約)
上記の方法により、滞留時間は類似体の2つの特徴、即ち、配座と置換に依ることがわかる。予測した様に、ジクロロ類似体は、1フッ化化合物より遅れて溶出し、ボート配座異性体は各々の椅子形化合物より遅れて溶出した。4つの特別99mTc標識化合物の滞留時間を図22に示す。再現性は、±0.1分であった。
【0179】
(パーキンソン病の動物モデル)
ニューロトキシンMPTP(N-メチル-1,2,3,6-テトラヒドロピリジン)を猿に服用させると、げっ歯類では反復試験できない運動、認知、生化学および形態的変化のスペクトルが生じる。MPTPを投与した猿達は、神経欠損(静止時の震え、硬直、失動、異常姿勢)、形態学的変化(黒質、腹側被蓋部の細胞損失)および生化学的変化(著しいDAの消耗、ノルエピネフリンとセロトニンの減少)を示し、突発性パーキンソン病(PD)、脳炎後のパーキンソン症候群とよく類似している。
【0180】
2匹の猿に0.6mg/kgのMPTPを3-5滴、10日以上投与して処置した。この処置は、ケタミン(15mg/kg)で麻酔して実施した。MPTPの量はパーキンソン症候群を2-3週間以内に、 CFT結合部位の3Hまたは11Cの消耗を1ケ月以内に発生させるために前以て使用した。このように処置した猿達が、SPECTの結合トレーサーと運動機能障害間の逆関係を示すことが期待された。この処置によって発生したDA終端の顕著な消耗により、神経終末の完全な減損を検出するためのSPECTトレーサーの選択性と感度の確実な証拠が提供される。
【0181】
(SPECTの画像化)
全SPECT画像は、ファン・ビーム照準器を装備したマルチSPECT2型ガンマ線カメラ(ジーメンス社、ホフマン・エステート、IL)を用い、99mTcの光電ピーク140KeV(15%窓)にピークを合わせ撮像した。このカメラの本来の分解能は4.6mm(FWHM)で、感度は-240cps/mCiであった。画像は、連続モードで360度(60プロジェクション/ヘッド、128x128マトリクス)に渡り撮影された。画像の再構成は、通常の10mmFWHM面内解像度とチャング法による減衰補正による通常のろ光バックプロジェクションのアルゴリズムを用いて実施された。
【0182】
アカゲ猿達の体重は約7kgで、ケタミン/キシラジン(15.0および1.5mg/kg)を麻酔しSPECTカメラの撮影ベッドにうつ伏せに寝かせた。撮像開始前に、放射性薬剤を投入するために末梢静脈に静脈カテーテルを挿入した。猿の頭を特別注文のヘッドホルダーを用いて固定した。約20-25mCiの99mTcで標識したO-1505T、O-1508T、O-1561TまたはO-1560Tを60秒以上の時間で静脈注射した。SPECTの動的撮影は注入終了時点から開始し、最初の1時間の間は2分間、それ以後は5分間づつ撮影した。
【0183】
(猿の脳内におけるDAT部位に対する選択性)
この研究では、一匹の猿を、マルチSPECT2型ガンマ線カメラの撮影ベッドに仰向けに寝かせ、前記の様にして、-20mCiの99mTcで標識したO-1560Tを注射した。放射性薬剤投入後約20分経過してから、この猿にCFT(1.0mg/kg)を注射し、画像撮影をさらに70分間継続した。
【0184】
(画像分析)
SPECTを最大の線条放射能または後頭部の皮質がよく視覚化されたSPECTの切片を総計し、主要対象領域(ROI)を構成する。線条面において、ROIは右線条と左線条は尾状核+被核)に置いた。左右の線条の放射能を平均した。ROIの放射能(cpm/cc)は注入時間に応じ崩壊時間を補正した。線条と後頭部皮質の放射能(結合比)の差を各画像毎に計算し、時間の関数としてグラフを作成した。分散フラクションと部分量効果に対する補正は実施しなかった。
【0185】
(放射線の計量)
Sparague-Dawleyの雄ラット群に〜10mCiの99mTc標識O-1505TとO-1561Tを注射した。注射後24時間5分間隔で、6匹づつのラット群に各放射性薬剤を注射し、犠牲にして生体内の分布を測定した。血液、心臓、肺、肝臓、脾臓、腎臓、副腎、胃腸(GI)管、精巣、骨、骨髄、骨格筋を計量し、井戸形ガンマ線カウンタ(フィンランドWallacOy社製LKB#1282型)を用いて放射能を測定した。放射性崩壊に対し補正し、各器官内の放射能の濃度を摂取線量のフラクションとして計算出来る様に、注射量のアリコットを同時に計数した。結果をグラム当たりの注射量(ID)比(%I.D.・g)で示し、放射線量はMIR線量法で計算した。
【0186】
(結果)
99mTcで標識したO-1505T、O-1508T、O-1561TおよびO-1560Tを用いたSPECT画像の撮影:
99mTc O-1505Tと99mTc O-1561Tを注射後初期に撮影した画像の場合、放射能の拡散蓄積が脳全体にわたり観察された。注射後の最初の数分間は、線条へのトレーサの蓄積が激しく、全ての他の構成部の放射能レベルは低下した。注射後30分近くになると、脳の線条と他の部分との間にはっきりとしたコントラストが生じた。猿の脳のトランス軸状、矢状および冠状の画像を99mTc で標識したO-1505T、O-1508T、O-1561TおよびO-1560Tを注射後30分から50分の間撮影した。これらのデータから明らかになったことは、99mTc O-1505Tと 99mTc O-1561T(各々ボート形のモノフロロ及びジクロロ化合物)を注射後撮影した画像は、脳の線条において高い薬剤濃度を示し、脳の他領域では最小の蓄積を示している。
【0187】
特に、視床、視床下部または中脳、5-HTトランスポータが豊富に存在する領域に蓄積しないことが、DAT部位用のこのトレーサの特異性を支えている。主要対象領域の分析では、線条対後頭部皮質の比は、約2.5対1であった。この実験において、99mTc O-1508T および99mTc O-1560T(各々ボート形のモノフロロ及びジクロロ化合物)を注射後に撮影した画像は、99mTc O-1508Tの場合、脳内の線条または他のどの領域にも顕著な放射能の蓄積を示し得ず、一方、99mTc O-1560Tの場合は、 O-1505TとO-1561Tにより近い結果を提供した。
【0188】
(MPTPで処理した猿達のSPECT)
アカゲ猿をMPTPで処理してから1ケ月後に、99mTc O-1508Tを注射して猿の脳の(中線条)トランス軸状、矢状および冠状の画像を撮影した。健常な猿と比較し、MPTPで処理後の猿は、蓄積レベルは著しく減少し、線条は周辺構造と区別出来なかった。
【0189】
(猿の脳内のDAT部位に対する99mTc O-1505Tの選択性)
猿の脳のSPECT画像は、線条に99mTc O-1505Tが顕著に蓄積することを示した。初期の画像では、脳の全体にわたって放射能が分散蓄積されていた。注射後数分経過すると、線条へのトレーサの蓄積が激しくなり、全ての他の構造域で放射能レベルが低下した。注射後30分近くになると、脳の線条部と残り部分との間に明確なコントラストが生じた。標識されていないCFTを受容体が飽和する用量を注射後、線条への放射能の蓄積が減少し、注射後60分近くで線条への集中的な蓄積は見られなくなった。
【0190】
(放射線量の計測)
生体内分布を調べた結果、99mTc O-1505Tと99mTc O-1561Tは、両方とも、ラットの全ての細胞から迅速に消え失せた。99mTc O-1505T の場合、MIR線量計算値は、ターゲット器官である膀胱で0.29rem/mCiであった。全体内有効線量の計算値は、0.037rem/mCiであった。
【0191】
これらの結果は、99mTcがラベルされたO-1505TとO-1561Tは、両方とも、DAT部位に対する優れたSPECT配位子であることを示している。これらの放射性薬剤は、有効な診断画像を得るために重要な特徴、即ち、(1)後頭部皮質に対する線条の比率が高く、(2)5-HTトランスポータ(SET)部位に対するDAT部位の選択性が高く、(3)高い比放射性と化学純度で好便に調製出来、(4)好ましい放射線量の計測が出来、(5)99mTcの物理的半減期(t-1/2)に適した線条への局在速度を有している。
【0192】
本発明について、好適な実施例により詳述してきたが、当業者であれば、特許請求範囲に記述した本発明の範囲と精神から逸脱することなく本開示を考慮して本発明に変更および/または改善を加えることが出来ることが理解されよう。
【符号の説明】
【0193】
1…化合物((1R)-2-(メトキシカルボニル)-3-トロピノン)、2…化合物((1R)-2-(メトキシカルボニル)-3-[[(トリフルオロメチル)スルホニル]オキシトロプ-2-エン)、3…化合物((1R)-N-メチル-2-メトキシカルボニル-3-(R)-8-アザビシクロ[3.2.1.]オクト-2-エン)、4…化合物((1R)-N-メチル-2β-メトキシカルボニル-3β-(R)-8-アザビシクロ[3.2.1.]オクタン)、5…化合物(2β-カルボキシ-3β-(R)トロパン)、6…化合物(2β-メトキシメチルカルバモイル-3β-(R)トロパン)、7…化合物(2β-(1-プロパノイル)-3β-(R)トロパン)、8…化合物(2β-(1-プロパノイル)-3β-(R)-ノルトロパン)、9…化合物(N-[2-(3’-N’-プロピル-(1”R)-3”β-(R)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、10,11…化合物(N-[(2-((3’-N’-プロピル-(1”R)-3”β-(R)-トロパン-2”β-1-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)オキサイド)、12…化合物((1R)-N-メチル-2β-メトキシカルボニル-3α-(R)-8-アザビシクロ[3.2.1.]オクタン)、13…化合物(2β-(カルボン酸)-3α-(R)-トロパン)、14…化合物(2β-メトオキシメチルカルバモイル-3α-(R)-トロパン)、15…化合物(2β-(1-プロパノイル)-3α-(R)-トロパン)、16…化合物(2β-(1-プロパノイル)-3α-(R)ノルトロパン)、17…化合物(N-[2-(3’-N’-プロピル-(1”R)-3”α-(R)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、18…化合物(N-[(2-((3’-N’-プロピル-(1”R)-3”α-(R)-トロパン-2”β-1’’’-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド)、19…化合物(N-[(2-((3’-N’-プロピル-(1”R’)-2”β-1-プロパノイル-3”α-(R)-トロパン)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物)、20…化合物(2β-(メトキシメチルカルバモイル-3α-(R)-ノルトロパン)、20A…化合物(2β-(メトキシメチルカルバモイル-3β-(R)-ノルトロパン)、21…化合物(N-[2-(3’-N’-プロピル-(1”R’)-3”α-(R)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、21A…(N-[2-(3’-N’-プロピル-(1”R’)-3”β-(R)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、22…化合物(N-[(2-((3’-N’-プロピル-(1”R’)-3”α-(R)-トロパン-2”β-メトキシメチルカルバモイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド)、22A…(N-((2-((3’-N’-プロピル-(1”R’)-3”β-(R)トロパン-2”β-メトキシメチルカルバモイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド)、23…化合物(2β-カルボキシ-3β-(R)トロパン)、24…化合物(2β-メトキシメチルカルバモイル-3β-(R)トロパン)、25…化合物(2β-(1-プロパノイル)-3β-(R)トロパン)、26…化合物((1R)-2-プロパノイル-3-(R)-8-アザビシクロ[3.2.1]-オクト-2-エン)、27…化合物(N-[2-(3’-N’-プロピル-(1”R)-3”β-(R)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、28…化合物(N-[(2-((3’-N’-プロピル-(1”R)-3”β-(R)-トロパン-2”β-1-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド)、29…化合物((1R’)-2-メトキシカルボニル-3-(R)-8-ノルアザビシクロ[3.2.1.]オクト-2-エン)、30…化合物(N-[2-(3’-N’-プロピル-(1”R’)-3”-(R)トロプ-2-エン-2”-(メトキシカルボニル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、31…化合物(N-[(2-((3’-N’-プロピル-(1”R’)-3”-(R)トロプ-2-エン-2”-(メトキシカルボニル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]レニウム(V)酸化物)、32,35…化合物((1R’)-2β-メトキシカルボニル-3α-(R)-8-アザビシクロ[3.2.1]オクタン)、33…化合物(N-[2-(3’-N’-プロピル-(1”R’-3”β-(R)-2”β-メトキシカルボニルトロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-2-アミノエタンチオール)、34…化合物((RS)-N-[2-((3’-N’-プロピル-(1”R’-3”β-(R)-2”β-メトキシメチルカルボニルトロパン))((2-((メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)酸化物)、36…化合物(N-[2-(3’-N’-プロピル-(1”R’)-3”α-(R)-2’’β-メトキシカルボニルトロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、37…化合物(N-[(2-((3’-N’-プロピル-(1”R’)-3”α-(R)-2”β-メトキシカルボニルトロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-レニウム(V)酸化物)、38…化合物((1R)-N-メチル-2-ヒドロキシメチル-3-(R)-8-アザビシクロ[3.2.1]オクト-2-エン)、39…化合物((1R)-N-メチル-2-カルボニル-3-(R)-8-アザビシクロ[3.2.1]オクト-2-エン)、40…化合物((1R)-N-メチル-2-(2-ヒドロキシプロピル)-3-(R)-8-アザビシクロ[3.2.1]オクト-2-エン)、41…化合物(N-[(2-((3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3”-(2-ナフチル)-トロプ-2-エン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-レニウム(V)酸化物)、42…化合物((1R)-N-メチル-2β-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン)、43…化合物((1R)-N-メチル-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン)、44…化合物((1R)-2β-2-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン)、45…化合物((1R)-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン)、46…化合物(N-[2-(3’-N’-プロピル-(1”R)-2” β-メトキシカルボニル-3’’β-(2-ナフチル)-トロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール)、47…化合物(N-[2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロパン))((2-トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール)、48…化合物(N-[(2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”β-(2-ナフチル)-トロパン)(2-メルカプトエチル)アミノ)アセチル]-2-アミノエタンチオラート]-レニウム(V)酸化物)、49…化合物(N-[(2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロパン)(2-メルカプトエチル)アミノ)アセチル]-2-アミノエタンチオラート]-レニウム(V)酸化物)、50…化合物((1R)-N-メチル-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン)、51…化合物(1R)-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン)、52…化合物(N-[2-(3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3’’-(2-ナフチル)-トロプ-3-エン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール)。
【技術分野】
【0001】
本発明は、ドーパミントランスポータ(DAT)に対し高い親和性と優れた選択性を有する放射性物質で標識した配位子より成る配位錯体であって、神経変質性疾患用の早期診断と治療に有効使用出来る。配位錯体による放射性薬品化合物に関する。
【背景技術】
【0002】
ドーパミントランスポータ(DAT)は、脳内の生理学的、薬理学的及び病理学的プロセスにおいて決定的な役割を演じる。輸送系は接合ドーパミンの効果を終端させる主要なメカニズムであり、ドーパミンシステムにおける恒常性の維持に貢献する。これは、又、脳内コカインの主ターゲットであると考えられる。(KennedyとHandauer、ニューロ化学、1983年、41、172-178;Shoemaker他、Naunyn-Schmeideberg’s Arch.薬理学、1985年、329、227-235;Reith他、生化学薬物学、1986年、35、1123-1129; Ritz他、科学、1987年、237、1219-1223; Madras他、薬理試験治療、1989a、251、131-141; Bergman他、薬理試験治療、1889、251、150-155;MadrasとKaufman、シナプス、1994年、18、261-275)。
【0003】
さらに、ドーパミントランスポータは神経毒がドーパミン含有細胞に入り込む導管でもある。線条は脳内ドーパミンの最高レベルの終端を有する。高密度のDATは線条におけるドーパミンニューロンに位置し、多数の生理学的及び薬理学的状態に対するマーカであると考えられる。例えば、パーキンソン病において、ドーパミンは急激に減少するので、線条中のDATの消耗はパーキンソン病の指標であった(Shoemaker他、Naunyn-Schmeideberg’s Arch.薬理学,1985年、329、227-235; KaufmanとMadras 、シナプス、1991年、9、43-49)。従って、パーキンソン病の早期及び予症候診断は、線条内のDATの消耗を量的に測定することにより達成出来る(KaufmanとMadras 、シナプス、1991年、9、43-49)。
【0004】
簡単で非侵襲的なDAT監視方法は、非常に重要である。消耗は、シンチレーションカメラシステムと、適当な画像化物質を用いた脳内画像化のような非侵襲的な手段により測定できる(Frost他、神経学会紀要、1993年、34、423-431;Hantray他、神経学報告、1992年、3、265-268)。ドーパミントランスポータの画像化は、病気の進行及びドーパミンニューロン又は病気の進行を遅らせる薬剤の注入治療による病気の逆転を観察することを可能にする。Tourrette症候群、LeschNyhan症候群及び多分Rette症候群を含む他の神経精神障害もDAT密度の変化によって指標付けることが出来る。
【0005】
また、DATは、最も広範に使用されている注意力欠損障害用薬剤、メチルフェニデート(methylphenidate)のターゲットでもある。この病気の患者でのこのトランスポータを監視出来れば、診断及び治療することが可能になる。さらに、ドーパミンニューロンの年齢による減少は、ドーパミントランスポータの減少にその反映を見ることが出来る(KaufmanとMadras 、Brain Res.、1993年、611、322-328;vanDyck他、核医学、1995年、36、1175-1181)又、神経精神障害の領域外のドーパミンの不足に関する画像を提供することが出来る。
【0006】
物質乱用者の脳内のDAT密度は、正常な脳内のDAT密度と著しく異なることも示されている。例えば、コカイン乱用者の死後の細胞においてその密度が高い(Little他、 Brain Res.、1993年、628、17-25)。一方、慢性の非暴力性アルコール乱用者内のDAT密度は著しく低下する(Tiihonen他、Nature Medicine、1995年、1、654-657)。物質乱用者の脳の画像化は、コカインおよびアルコールの乱用の病理プロセスの把握と治療期間における脳機能の回復の監視に役立つ。従って、DATと結合する放射性薬剤は、これらの種々の病気の診断と治療を支援する重要な情報を供給することが出来る。
【0007】
上記疾患用の画像化剤として有用であるためには、ターゲットとされるトランスポータ、例えばDATに特殊な結合親和性および選択性を有する物質でなければならない。また、脳画像化剤は、血液脳関門(BBB)を通過する透過性を有しなければならない。しかしながら、レセプタ部位に対する結合親和性と選択性を維持しながら血液脳関門を通過出来る金属キレートを生成することは困難であった。よって、これらの条件を満たし、99mTcのような所望の放射核種と錯体を形成し得る適当な物質を発見することが強く求められている。
【0008】
さらに、有用な画像化薬剤であるためには、特別なターゲット/非ターゲット率を有しなければならない。DATに対し選択的な物質の場合、最高密度のドーパミントランスポータを有する脳領域である線条は、セロトニントランスポータ(SET)も含んでいることを考慮しなければならない。このSETは、ドーパミントランスポータの濃度の1/10から1/15の範囲で通常存在している。DATに強固に結合する画像化物質は、或る程度のSETへの結合を示すことがある。
【0009】
上述のごとくの非ターゲットへの結合は、正常な脳の画像化の場合は、SETと比較しDATが多数であるので大した問題は生じないが、DATが選択的に減少する(或いは、SETが選択的に増加する)病的な状態の場合は、SETとの結合がDATの量の測定を困難にする。さらに、視床下部および視床のような脳の他の領域におけるSETとの結合は、線条の限局化および画像化における線条コントラストと精度を減少させる。そのために、ターゲット対非ターゲットの結合比(DAT:SET)は重要である。現在、DATの数量化と可視化に最も有効な化合物は、11Cと18Fのような陽電子エミッタおよび123Iのようなガンマ線エミッタで標識されたフェニルトロパン誘導体である。
【0010】
テクネチウム-99m(99mTc:T1/26.9h、140KeVガンマ線光子放出)は、物理的な崩壊特性と化学特性が優れている故に画像化に使用するのに好適な放射核種である。例えば、半減期は約6時間であり、崩壊速度と画像研究に適した時間の調和が得られる。これは、半減期が長い123Iや半減期は短いが使用が難しい18Fのような他の放射性核種に比べ、優れている。放出特性も画像化に適し容易である。さらに、使用場所で好便に発生させることが出来る。99mTc は、現在、世界中の診断センタで選択できる放射性核種である。DAT画像化のためにテクネチウムとの配位錯体を得られることが望ましい。かような錯体は、DATがマーカとして有効な状態を検出出来る。
【0011】
しかしながら、テクネチウムを放射線画像化剤として使用するには、その化学特性の故に、多くの困難が生じる。例えば、99mTc は、通常キレート剤で結合されねばならない。従って、配位子に共有結合で付加できる123Iのような他の放射性核種を用いて放射性配位子を生成するより99mTcを設計し生成するほうがはるかに難しい。テクネチウム用のキレート剤のサイズは、この放射性核種を画像化剤に用いる際に問題を生じる。これは、Tcを用いるレセプタに基づく画像化剤を設計する上で特に難しい問題となる。
【0012】
神経変性疾患の診断手段としての能力を決定するために試験された代表的な画像化剤として、ヨウ素(123I)標識分子がある。例えば、RTI-55(Boja、J.W.他、欧州誌”薬学、1991年、194、133-134; KaufmanとMadras 、シナプシス、1992年、12、99-111)またはβ-CIT(Neumeyer、J.L.他、医療化学、1991年、34、3144-3146)およびヨードアリルトロパン、アルトロパン(Elmalech、D.R.他、米国特許N0.5、493、926)が挙げられる。
【0013】
トロパン系の化合物は、ドーパミントランスポータに結合することが知られているが、テクネチウムまたはレニウムを結合させるために粉粒体キレート配位子を添加することは、標識錯体が血液脳関門を通過する潜在能力及び能力に悪影響を与えると予測される。Kung他は、化学及び核医学(Chemistry and Nuclear Medicine)(M.Nicolini、G.Banoli、U.Mazzi,Swrvizi編、GraficiEditoriali、Padua、1995年)に掲載の論文”テクネチウムおよびレニウム(Technetium and Rhenium)”において、セロトニン1Aとの選択結合が知られているアリルピペラジンと複合した99mTc標識N2S2配位子が生体外試験では緩やかな結合親和性を示したが、完全な血液脳関門を透過出来なかったことを報告している。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許N0.5、493、926
【非特許文献】
【0015】
【非特許文献1】Boja、J.W.他、欧州誌”薬学、1991年、194、133-134
【非特許文献2】KaufmanとMadras 、シナプシス、1992年、12、99-111
【非特許文献3】Neumeyer、J.L.他、医療化学、1991年、34、3144-3146
【非特許文献4】Technetium and Rhenium、Chemistry and Nuclear Medicine、M.Nicolini、G.Banoli、U.Mazzi,Swrvizi編、GraficiEditoriali、Padua、1995年
【発明の概要】
【発明が解決しようとする課題】
【0016】
本発明は、上述のごとき実情に鑑みてなされたもので、テクネチウムまたはレニウムで放射線標識したDAT画像化剤で、血液脳関門を通過出来、DATに対し高い結合親和性と選択性を有する放射性薬品化合物を提供すること、及びその放射性薬品化合物を用いたトロパン認識部位の密度検出方法、神経変性または神経性疾患の監視方法、及び放射性薬品を調合するキット提供することを目的とするものである。
【課題を解決するための手段】
【0017】
請求項1の発明は、下記(I)式の構造を有する化合物であって、
【0018】
【数1】

【0019】
前記(I)式において、R1は、βであって、かつ、CORaおよびCON(CH3)ORaからなる群から選択されており、R2は、αであって、かつ、X及び/またはYで置換したフェニルまたはナフチルであるC6H4X、C6H3XY、C10H7XおよびC10H6XYより成る群から選択されており、Raは、C1-C5のアルキル基であり、XおよびYは、Ra、H、Br、Cl、I、F、OHおよびOCH3より成る群からそれぞれ選択されており、Lは、-(CH2)n(nは1から6までの整数)、または-(CH2)n-(アリル,アルキル,エテニルまたはエチニル)-(CH2)m(mとnは整数で、nとmとの和は1から6までの整数)であり、Chは、三座または四座キレート配位子、またはテクネチウムまたはレニウムとの前記化合物の中性錯体であることを特徴としたものである。
【発明の効果】
【0020】
以上の説明から明らかなように、本発明によれば、テクネチウム及びレニウムで放射線標識したDAT画像化剤により、血液脳関門を通過でき、ドーパミントランスポータ(DAT)に対し高い結合親和性を有する物質を提供することができる。本発明の画像化剤は、DATのような神経細胞を含むトロパン認識部位を検出するのに有用である。また本発明の化合物は、神経変性疾患の診断剤、予後検査剤および治療剤として使用できる。
【0021】
また、本発明は、DATまたはドーパミンニューロンの密度変化により、特徴付けられる神経変性または神経精神障害を検出するための画像化剤として配位錯体を用いる方法を提供する。例えば、パーキンソン病のような神経性疾患によるDAT密度の変化を検出する方法は、特定の哺乳類中のDAT密度を検出するために、本発明の標識化された化合物の有効量を注入し、DATに結合した標識化化合物の画像を撮影するステップを有し、レニウムで標識した化合物は、治療のためにも有効に使用することができる。
【0022】
また、本発明は、テクネチウムまたはレニウムで標識した本発明の化合物を生成するキットを提供する。このキットは、凍結乾燥させた化合物とテクネチウムまたはレニウムとの錯体を形成する無菌性容器よりなるもので、放射性核種を含有する水溶液により容易に再構成して標識させることができる。
【図面の簡単な説明】
【0023】
【図1】本発明に用いて好適な放射性薬品化合物を表現する構造式の一例を示す図である。
【図2】本発明に用いて好適なトロパン化合物の一例の構造式を示す図である。
【図3】本発明に用いて好適なキレート配位子の例の構造式を示す図である。
【図4】本発明に用いて好適なキレート配位子であってテクネチウムと共に形成される錯体の構造式を示す図である。
【図5】NSキレート配位子をノルトロパン類似体に連結し、テクネチウムまたはレニウムであり得る金属“M”で標識するための選択一般反応図式を示す図である。
【図6】本発明によるアリルオクテン(ArylOctene)より成る2-カルボメトキシトロパンを生成し(スキーム1)、続いてその3αおよび3βジアステレオマーを生成する一般図式を示す図である。
【図7】本発明による好適な実施形態による放射性薬品化合物の2-エチルケト類似体を生成する一般図式の一例(スキーム2)を示す図である。
【図8】本発明による好適な実施形態による放射性薬品化合物の2-エチルケト類似体を生成する一般図式の他の例(スキーム3)を示す図である。
【図9】本発明の好適な実施形態による放射性薬品化合物の2-カルボキサミド3α-または3β-アリル類似体を生成する一般図式(スキーム4)を示す図である。
【図10】本発明の好適な実施形態による放射性薬品化合物の3-アリル-2-エチルケト-2、3-エン類似体を生成する一般反応図式(スキーム5)を示す図である。
【図11】本発明の好適な実施形態による放射性薬品化合物の3-アリル-2-カルボメトキシ-2、3-エン類似体を生成する一般反応図式(スキーム6)を示す図である。
【図12】図2の 3αおよび3βジアステレオマーをビストリチル保護N2S2トロパンに転化し、テクネチウムまたはレニウムで標識するための一般図式(スキーム7)を示す図である。
【図13】本発明の好適な実施形態による放射性薬品化合物の3-アリル-2-エチルケト-2、3-エン類似体を生成する代替一般反応図式(スキーム8)を示す図である。
【図14】本発明の好適な実施形態による放射性薬品化合物の3-ナフチル-2-カルボメトキシ-2、3-エンと3α-ナフチルまたは3β-ナフチル類似体を生成する一般反応図式(スキーム9)を示す図である。
【図15】ドーパミントランスポータ用特定化合物の結合親和性と選択性を決定する試験に用いた化合物の組成を示す図である。
【図16】ドーパミントランスポータ用特定化合物の結合親和性と選択性を決定する試験に用いた他の化合物の組成を示す図である。
【図17】ドーパミントランスポータ用特定化合物の結合親和性と選択性を決定する試験の結果を示す表である。
【図18】0-1505Tで標識した99mTcのHPLCクロマトグラムを示す図である。
【図19】0-1508Tで標識した99mTcのHPLCクロマトグラムを示す図である。
【図20】0-1561Tで標識した99mTcのHPLCクロマトグラムを示す図である。
【図21】0-1560Tで標識した99mTcのHPLCクロマトグラムを示す図である。
【図22】HPLCによる分析による4つの特別99mTc標識化合物の滞留時間を示す表である。
【発明を実施するための形態】
【0024】
本発明は、テクネチウムまたはレニウム放射性核種と配位錯体を形成し、ドーパミントランスポータに選択的に結合し、新規な放射線標識剤を供給する放射性薬品化合物を提供する。好適なかような薬剤は、脳内のDATを画像化するために血液脳関門を通過出来る放射性画像化物質を含んでいる。
【0025】
本発明の化合物は、テクネチウムまたはレニウム放射性核種と複合し、ドーパミントランスポータに選択的に結合して放射線標識錯体を生成するキレート配位子に8座のN原子を介して連結したトロパン化合物より成る。これらの化合物は、個別のジアステレオマーとして、およびジアステレオマーの混合物として調合出来る。
【0026】
本発明の実施に有効なトロパン化合物は、ドーパミントランスポータに結合する。本発明の好適な放射性薬品化合物は、図1に示す構造式で表現することが出来る。図1に示す式中、R1はαまたはβであり、COORa、CORaおよびCON(CH3)ORaから選択され、R2はαまたはβであり、C6H4X、C6H3XY、C10H7X、C10H6XYから選択され、RaはC1-C5のアルキル基、例えば、メチル、エチル、プロピル、イソプロピル等であり、XおよびYは、Ra、H、Br、Cl、I、F、OHおよびOCH3から個別に選択され、Lは-(CH2)n(nは1から6までの整数)または-(CH2)n-(アルキル、アリルアルキル、エテニルまたはエチニル)-(CH2)m(mとnは整数で、nとmとの和は1から6までの整数)で、Chはテクネチウムまたはレニウムとの中性錯体を形成する三座または四座キレート配位子である。さらに、 C2とC3の間の結合は単結合または二重結合である。
【0027】
かように、R1とR2はαまたはβ配位である。さらに、R1は好ましくは、トロパンが1Rまたは1S配位を有している場合はC2またはC4で置換することが出来る。キレート配位子は、キラルであれば、R、SまたはRSとsyn(類似)またはanti(反対)である。
【0028】
本発明の画像化物質は、ドーパミントランスポータのような神経細胞を含むトロパン認識部位を検出するのに有用である。本発明の諸目的のために、トロパン認識部位は、トロパン化合物に結合するレセプタまたはトランスポータである。かように、本発明の化合物は、神経変性疾患の診断剤、予後検査剤および治療剤として使用できる。
【0029】
本発明は、DATまたはドーパミンニューロンの密度の変化により特徴付けられる神経変性または神経精神障害を検出するための画像化剤として配位錯体を用いる方法を提供する。例えば、パーキンソン病のような神経変性疾患によるDAT密度の変化を検出する方法は、特定の哺乳類中のDAT密度を検出するために、本発明の標識された化合物の有効量を注入し、DATに結合した標識化合物の画像を撮影するステップを有する。レニウムで標識した化合物は、治療のためにも有効に使用できる。
【0030】
本発明は、テクネチウムまたはレニウムで標識した本発明の化合物を生成するキットを提供する。このキットは、凍結乾燥させた化合物とテクネチウムまたはレニウムとの錯体を形成するための還元剤とを格納する無菌無熱性の容器より成る。このキットは、放射性核種、例えば、好ましくは約5から約8までの範囲のpHを有するペルテクネチウムを含有する水溶液で容易に再構成し標識させることが出来る。
【0031】
本発明の化合物は、例えばDATのようなニューロントランスポータのトロパン認識部位に選択的に結合するトロパン化合物又は配位子より成る。トロパン配位子は、トロパン配位子にリンカーで付加されたキレート配位子により放射性テクネチウムまたはレニウムで標識される。本発明の未標識化合物は、構造式Ch-L-Trによって概略表現される。式中のChはキレート配位子、Lはリンカー、Trはトロパン配位子である。
【0032】
本発明の実施に用いて有効なトロパン化合物または配位子は、一般に、図2に示す構造式(II)で表示される。式中、 R1とR2は前記の様に規定され、R1はトロパンリングのC4位置で置換され得る。
【0033】
図2に示す一般構造式(II)のトロパン化合物は何れも、DATと結合する限り、本発明において有用である。DATに対し特異性を有し(Meltzer、P.C.他、医化学、1993年、36、855-862)、DATと強固に結合(IC50X=11.0nM)する2-カルボメトキシ-3-(4-フルオロフェニル)-N-メチルトロパン(“WIN35,428”)(Clarke、R.L.他、医化学、1973年、16、1260-1267)と、カルボメトキシ-3-(3,4-ジクロロフェニル)-N-メチルトロパン(“O-401”; IC50X=1.09nM)(Meltzer、P.C.他、医化学、1993年、36、855-862)は特に有用なトロパンの例である。3α基を有するトロパン類似体は舟形である。3β方向基を持つその他のトロパンは椅子形である。
【0034】
本発明の実施において有用なキレート配位子は、三座または四座の配位子であり、テクネチウムまたはレニウムと結合して中性の錯体を形成する。このキレート配位子は、下記に記すように、リンカーに共有付加される。好適なキレート配位子は,放射性核種と錯体を形成するための複数のNまたはS原子を含んでいる。
【0035】
適当な配位子例は、図3(A)〜図3(F)に示す構造式(III)から(VIII)で表されるN2S2である。式中、R,R6およびR10は水素,置換または未置換の下位アルキル,アルキルR9または-COR9から各々選択する。ここで、R9はヒドロキシ,置換した下位アルコキシ,置換または未置換アミノ,グリシンエステル,ハロゲン化物(クロロ,ブロム,ヨード)またはOR(ORはメシル化物,トリフ化物またはトシル化物のような残基である)または活性の残基であり、 R1は水素または置換または未置換の下位アルキルから選択され、R2とR3は、各々、水素またはチオール保護基または分子間または分子内ジスルフィドから選択し、R4、R5、R7およびR8は、各々、水素または下位アルキルから選択する。
【0036】
R,R6およびR10がカルボン酸誘導体である場合、R9は活性残基であり得る。この発明の諸目的のために、残基R9は(化合物)-COR9がアシル化剤であるように定義される。
【0037】
本発明の実施に適した活性残基の例は、例えば、ハロゲン化物、ペンタクロロフェノキシ等のような置換または未置換のアリルオキシ、N-オキシ-スクシンイミド等のようなオキシ複素環基、メルカプト、下位アルキルチオ、アリルチオ、オキシホスホニウム、および当業者には周知の残基として有用な他の基が挙げられる。
【0038】
R2およびR3は、水素または周知のチオール保護基であり得る。かような基の例には、エチルアミノカルボニルのような下位アルキルアミノカルボニル、下位アルカノイルアミノメチル、アロイルアミノメチル、t-ブチル、アセトアミドメチル、トリフェニルメチル(トリチル)およびジフェニルメチルのようなアリルメチル、ベンゾイルのようなアロイル、フェノキシカルボニルのようなアリルオキシカルボニル、アリル下位アルコキシカルボニル、好ましくはアリルメトキシカルボニル、ベンジルオキシカルボニル、およびt-ブトキシカルボニルのような下位アルコキシカルボニルが含まれる。好ましいチオール保護基はトリチル、t-ブチル、ジフェニルメチル、アセトアミドメチルおよびベンゾイルおよび分子間または分子内ジスルフィドを含んでいる。
【0039】
ここで使用した用語“下位アルキルは”、メチル、エチル、イソプロピル、n-プロピル、n-ブチル等のような1個から6個までの炭素原子、より好ましくは1個から4個までの炭素原子を含む、脂肪族飽和分岐または直鎖の炭化水素の一価置換体を意味する。用語“下位アルコキシ”は、メトキシ、エトキシ、イソプロポキシ等のような1個から6個までの炭素原子、より好ましくは1個から4個までの炭素原子を含む下位アルコキシ置換体を意味する。ここで使用した用語“置換下位アルキルおよび置換下位アルコキシ”は、例えば、-CH2OH、-CH2CH2COOH、-CH2CONH2、-OCH2CH2OH、-OCH2COOH、-OCH2CH2CONH2等のようなハロゲン化物、ヒドロキシ、カルボキシまたはカルボキシアミド基等で置換したアルキルおよびアルコキシ基を含んでいる。
【0040】
ここで使用した用語“置換アミノ”は、下位アルキルで置換した1または2および3置換基、および-NH3+または薬剤的に適したアニオンを有する下位アルキルで置換した1、2および3置換基を含む。使用用語“グリシンエステル”は、グリシンの下位アルキルエステル、好ましくはメチル及びエチルエステルを意味する。
【0041】
これらのキレート配位子は、放射性核種、例えばテクネチウムと共に図4(A)〜図4(B)の化学構造式(XI〜XIV)にて示される下記の錯体を形成する。なお、式中の、R基は前述したごとくに規定される。
【0042】
本発明の好適な実施態様は、図3に示す化学構造式(V),(VI)または(VII)のモノアミノモノアミド化合物から形成されるキレート配位子、例えば、N-{2-((2-((トリフェニルメチル)-チオ)-エチル)アミノ)アセチル)-S-(トリフェニルメチル)-2-アミノエタンチオール(“MAMA”)を使用する。
【0043】
1から約6のバックボーン鎖長を有する炭素原子の有機リンカーは、窒素、硫黄、R、R1またはR6を介してキレート配位子を、(ドーパミントランスポータを結合させる)トロパン配位子の8窒素原子に取り付ける。リンカーの例として、-(CH2)n(nは1-6の整数)または -(CH2)n-(アリル、アリルアルキル、エテニルまたはエチニル)-(CH2)m(nとmとの合計が1-6の整数)が挙げられる。
【0044】
本発明の好適な放射線標識化合物は、血液脳関門を通過し、所望の“ターゲット:非ターゲット”特異性を示す。好ましくは、(DAT:SET)の結合選択比は約30またはそれ以上、さらに好ましくは50またはそれ以上である。かように、これらの化合物は、例えば、DATの画像化のための脳画像化剤として有効である。
【0045】
トロパン配位子は、最初のノルトロパンへの転化によってキレート配位子に連結出来る。ノルトロパンの合成は、この技術分野において公知であり、例えば、Meltzer、P.C.他、医化学、1993、36、855-862およびMeltzer,P.C.他、医化学、1994、37、2001-2010に開示されている(開示内容を本明細書において参照する)。トロパンは、当技術において公知の技法を用いてトロピノンまたはコカインから合成出来る。ノルトロパンの合成は、トロパンのN-脱メチル化によって達成することが出来る。これは、例えば、αクロロエチルクロロギ酸エステル(ACE-Cl)による、当技術ににおいて周知の種々の方法によって容易に達成出来る。
【0046】
キレート配位子は、好ましくは個別に生成し、ノルトロパンに付加して金属化するか、或いは最初に金属化してから適当なノルトロパンに付加する。本発明による放射線標識化合物を血液脳関門を通過させる必要がある場合、本発明に用いられるキレート配位子は、放射性核種と共に自然錯体を形成し、脂質可溶である。本発明に用いる自然99mTc(V)錯体を形成するキレート配位子は、置換オキシム(Loberg、M.D.他、核医学、1997年、20、1181-1188)と、N2S2化合物(Davison、A.他、無機化学、1981年、20、1629-1632; Davison、A.他、核医学、1979年、20、641(アブストラクト))と、ビスアミノエタンチオール(“BAT”)(Kung、H.F.他、医化学、1984年、28、1280-1284; Kung、H.F.他、核医学、1986年、27、433-437; Kung、H.F.他、核医学、1984年、25、326-332;Francesconi、L.C.他、無機化学、1993年、32、3114-3124)と、ジアミノジチオール(“DADT”) (lever、S.Z.他、核医学、1985年、26、1284-1294)を含んでいる。
【0047】
有用なキレート配位子のその他の例には、N,N’-ビス(2-メルカプト-1-メチル)-2-アミノベンジルアミン(“U-BAT”)(Francesconi、L.C.他、医化学、1994年、37、3282-3288)、プロピレンアミンオキシマー(“HMPAO”)、ジアミドジチオ−ル(“DADS)(Rao、T.L.他、米国化学会、1990年、112、5798-5804;Stepniak-Biniakiewicz、D.他、医化学、1992年、35、274-279)、フェニルエネジアミン-チオ−ル-チオエーテル(“PhAT”)(McBride、B.J.他、医化学、1993年、36、81-86)、ビス(メルカプトエチル)-2-アミノエチルアミン(“SNS”)またはビス(メルカプトエチル)-2-チオエチルアミン(Mastrostamatis,S.G.他、医化学、1994年、37、3212-3218)、モノアミンアミド(“MAMA”)(Gustavson、L.M.他、Tet.Lett.、1991年、32、5485-5488)およびN-{2-((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル}-S-(トリフェニルメチル)-2-アミノエタンチオール(“MAMA’”)(O’Neil,J.P.他、無機化学、1994年、33、319-323)が含まれる。例えば、本発明によりリンカーでMAMA’を親油性トロパンに付加すると、放射性標識に適した中性中庸な親油性で水性で安定した化合物が形成される。
【0048】
図3(A)及び図3(B)に示す化学構造式(III)および(IV)の化合物は、本願で参照引用する米国特許No.4、673、562に記述の方法に基づき合成することが出来る。図3(C)に示す化学構造式(V)の化合物は、当技術において周知の方法(Fritzberg他、核医学、1981年、22、258-263参照)で合成出来る。
【0049】
本発明による放射線標識錯体は、図5に概略を示したように、3つの全体的な調製手順で合成出来る。この全体的な調製スキームではSH(スルフヒドリル)用トリチル保護基を使用しているが、SH保護用に有用であると知られているその他の保護基、例えば、エチルアミノカルボニルのような下位アルキルアミノカルボニル、下位アルカノイルアミノエチル、アリルアミノエチル、t-ブチル、アセトアミドメチル、トリフェニルメチル(トリチル)とジフェニルメチルのようなアリルメチル、ベンゾイルのようなアリル、フェノキシカルボニルのようなアリルオキシカルボニル、ベンジルオキシカルボニルのようなアリル下位アルコキシカルボニル、好ましくはアリルメトキシカルボニル、t-ブトキシカルボニルのような下位アルコキシカルボニルも使用できる。好適なSH保護基は、トリチル、t-ブチル、ジフェニルメチル、アセトアミドメチル、ジスルフィド(二硫化物)およびベンゾイルを含んでいる。
【0050】
本発明の化合物は、本開示に基づき公知の手段で調製出来る。例えば、図5の全体図にN-2{2-((2-((トリフェニルメチル)チオノエチル)アミノ)アセチル)}-S-(トリフェニルメチル)-2-アミノエタンチオール(MAMA’:Katzenellenborgen他、無機化学、1994年33、319)として示したN2S2のような適当なキレート配位子より開始し、このN2S2をハロアルキルトリフレートまたは(Meltzer他、医化学、1993年、36、855に記載のノルトロパンより調製した)ハロアルキルノルトロパンの何れかでアルキル化出来、クロロアルキル(プロピルを図示)MAMA’またはトロパンアルキル(プロピルを図示)MAMA’の化合物を各々生成する。
【0051】
上記のクロロアルキル(プロピルを図示)MAMA’の化合物を、次に、適当なノルトロパンに付加してトロパンアルキル(プロピルを図示)MAMA’化合物を図示する通り生成出来る。この代わりに、クロロアルキル(プロピルを図示)MAMA’の化合物を金属原子、好ましくは(99Tc、99mTc、188Reまたは186Reのような)放射性核種を含むように処理してM標識錯体を生成することが出来る。この得られた錯体を、適当なノルトロパンに付加して本発明の放射線薬剤化合物を図示する通り供給することが出来る。
【0052】
別案では、トロパンアルキル(プロピルを図示)MAMA’の化合物を(99Tc、99mTc、188Reまたは186Reのような)放射性核種を含むように処理して本発明の放射線薬剤化合物を図示する通り形成することが出来る。
【0053】
本発明の化合物は、ジアステレオ異性体およびジアステレオマーとの混合物の何れであってもよい。ジアステレオ異性体は、カラムクロマトグラフィによって分離出来る。さらに特殊には、ハロアルキルトリフレートで N2S2をアルキル化してクロロアルキル(プロピル図示)MAMA’を生成して、キレート配位子を、ドーパミントランスポータと選択的に結合するトロパン配位子に結合させるため用いることが出来る。このアルキル化ステップは、有機化学に普通の技術を有する者ならば、前述の様に1個乃至約6個迄の炭素原子のバックボーン鎖長を有する種々のリンカーを生成するように変更することが出来る。
【0054】
クロロアルキル化合物の保護解除は、当技術において公知の標準の諸方法、例えば、H2S/Hg(OAc)2(O’Neil、J.P.他、無機化学、1994年、33、319-323)またはAgNO3/Py(DiZio、J.P.他、Bioconj.Chem.、1991年、2、353-366)、TFAとフェノールまたは酢酸中のHBr(Zervas,L.他、米国化学学会誌、1993年、84、3887-3897)を用いて無保護ビスチルを得、直ちにすず(II)塩(SnCL2)と過レニウムナトリウム(Na2ReO7)の溶液またはNa(99mTcO4)/第1すず酒石酸塩(Francesconi,L.C.他、無機化学、1993年、32、3114-3124;Canney、D.C.他、医化学、1993年、36、1034-1040)で処理して、標識錯体を生成する。
【0055】
これらのキレートの精製は、O’Neil(O’Neil、 J.P.他、無機化学、1994年、33、319-323)により開示されているフラッシュクロマトグラフィによって達成出来る。このクロロアルキルキレートは反応可能であり( O’Neil、 J.P.他、Bioconj.Chem.、1994年、5、182-193)、これを次に適当なノルトロパンと反応させて本発明の標識配位錯体を供給する。ノルトロパンのアルキル化は、当技術において周知の標準の諸方法、例えば、アセトニトリル (CH3CN)、ヨウ化カリウム(KI)および炭酸カリウム(K2CO3)を用いて達成出来る。強塩基を使用すると、C-2におけるカルボメトキシ基のエピマー化を生じるが、ジメチルフォルムアミド(DMF)のような溶液中において炭酸塩は適度な収量のアルキル化生成物を生成し得る。
【0056】
これらの化合物は、遊離塩基または、塩酸塩、酒石酸塩、硫酸塩、ナフタリン-1.5-ジスルホン酸塩等のような薬理的に活性な塩の何れかとして調製出来る。
本発明の種々な等級の化合物の調製反応スキームについて図面を参照して説明する。図6に示すスキーム1において、ケトエステル1(Meltzer他、医化学、1994年、37、2001)をN-フェニルトリフルオロメタンスルホンイミドとナトリウムビス(トリメチルシリル)アミドとテトラフラン中で反応させてエノールトリフレート2に転化する。このエノールトリフレート2を次に適当な一般のまたは鈴木結合(Suzuki coupling)で予備形成したアリルホウ素酸と、塩化リチウム、炭酸ナトリウムおよびトリス(ジベンジリデンアセトン)ジパラジウム(O)を共に結合させ、アリルオクテン(ArylOctenes)3を優秀な収量で生産する。
【0057】
テトラヒドロフラン/メタノール中でサマリウム・ヨウ化物を用いてアリルオクテン3を低温(-780C)で還元し、3β-および3αのジアステレオマー4,12の混合物を得る。これらのジアステレオマーはフラッシュクロマトグラフィで容易に分離出来る。
【0058】
図12に示すスキーム7において、3β-および3αのジアステオマー4,12を次にビストリチル保護N2S2トロパン33,36へ同様に各々転化処理し、さらにレニウム類似体34R,37Rおよびテクネチウム類似体34T,37Tに各々転化処理する。かようにして、トロパンをACE-塩化物でN-脱アルキル化し(Meltzer他、医化学、1993年、36、855)、ノルトロパン32,35を得る。次に、ノルトロパンを、予備形成したN-[[[2-[2-(トリフェニルメチル)チオ]-エチル]N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニルメチル)-2-アミノエタンチオール(MAMA’-Cl){ Meltzer他、医化学、40、1835、1997)と、ヨウ化カリウム炭酸カリウムと共に反応させてN2S2保護配位子を導入する。レニウムは、
0.05MのHcl中ですず(III)塩化物と反応させ、続いて0.05MのHcl中ですず(II)過レニウム酸塩と反応させて導入する。この生成物を、シリカゲルカラムクロマトグラフィで精製し、ジアステレオマーの混合物を得る。他の方法は、ノルトロパンを予備形成したN-[(2-((3’-クロロプロピル)2-メルカルプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]レニウム(V)酸化物( Meltzer他、医化学、40、1835、1997)でN-アリキル化する方法である。金属キレートの両方のジアステレオマーが調製される。
【0059】
図7に示すのスキーム2および図8に示すスキーム3において、3αと3βの両方の2-エチルケト-類似体が図示の如く調製される。ここでは、図7の3βのジアステレオマーの方を例にとって説明する。3βのジアステレオマ-4をジオキサン/水またはリチウム水酸化物で加水分解して酸5を供給し、これを、オキシアリル塩化物での酸塩化物への転化を経てアミドに転化し、次に、(MeO)MeNH.HC1と反応させて生成物6を得る。さらに、低温でのアルキルグリニャールとの反応によって所望のエチルまたはアルキルケトン7を得る。
【0060】
アルキルケトン7は、エステル-トロパン(4または12)を適当なアルキル-グリニャール(この場合は、臭化エチルマグネシウム)と反応させることによっても生成出来る(参考文献1:KikkawaおよびT.Vorifuji、“Synthesis”(1980)、877頁)。ACE-Clで標準処理して脱メチル化し、生成物8を得る。生成物8を、炭酸カリウムまたは重炭酸カリウム及びヨウ化カリウムのような塩基と共にMAMA’-Clと反応させてキレート単位を付加する。テクネチウムヘプトグルコン酸塩(heptogluconate)の還元条件下で過レニウム酸塩ナトリウムを用いてレニウムまたはテクネチウムを挿入し、生成物10又は11を得る。金属キレートの両ジアステレオマーは、同様な方法で調製出来る。スキーム2とスキーム3を比較すれば明らかなように、トロパンの3α-ジアステレオマーも同様な方法で調製出来る。
【0061】
図9に示すスキーム4において、2-カルボキシアミド類似体22,22Aは、先述したようにACE-Clを用いたN-脱メチル化により生成物14から調製される。MAMA’基の付加と金属(レニウムまたはテクネチウム)の挿入は、スキーム2とスキーム3につき記述したようにして行なう。
【0062】
図10に示すスキーム5について説明する。2-エチルケトトロプ-2-エン類似体をスキームに示すようにして調製する。エステル3をジオキサン/水またはリチウム水酸化物で加水分解して酸23を供給し、これを、オキシアリル塩化物での酸塩化物への転化を経てアミドに転化し、次に、(MeO)MeNH.Hclと反応させ生成物24を得る。さらに、低温でのアルキルグリニャールとの反応によって所望のエチルまたはアルキルケトン25を得る。このアルキルケトン25は、エステル-トロパン(4または12)を適当なアルキル-グリニャール-(臭化エチルマグネシウム)と反応させることによっても生成出来る(参考文献1:KikkawaおよびT.Vorifuji、合成(1980)、877頁)。ACE-Clで標準処理して脱メチル化し、生成物26を得る。生成物26を、炭酸カリウムまたは重炭酸カリウム及びヨウ化カリウムのような塩基と共にMAMA’-Clと反応させてキレート単位を付加する。テクネチウムヘプトグルコン酸塩(heptogluconate)の還元条件下で過レニウム酸塩ナトリウムを用いてレニウムまたはテクネチウムを挿入し生成物として金属キレート28の両ジアステレオマーが調製される。
【0063】
図11に示すスキーム6について説明する。2-カルボメトキシトロプ-2-エン類似体をスキームに示すようにして調製する。化合物3をACE-Clで標準処理して脱メチル化し、化合物29を得る。この化合物29を、炭酸カリウムまたは重炭酸カリウム及びヨウ化カリウムのような塩基と共にMAMA’-Clと反応させてキレート単位を付加する。テクネチウムヘプトグルコン酸塩(heptogluconate)の還元条件下で過レニウム酸塩ナトリウムを用いてレニウムまたはテクネチウムを挿入し、生成化合物として、金属キレート31の両ジアステレオマーが調製される。
【0064】
図13に示すスキーム8について説明する。2-エチルケトトロプ-2-エン類似体をスキームに示すようにして調製する。化合物3をLAHで還元し、再び酸化させてアルデヒド39を得る。このアルデヒド39をエチルリチウムまたはエチルグリニャールと反応させてアルコール40を得、これをさらに1回酸化し、エチルケトン26を得る。そして化合物27,28を次に上記のようにして調製する。
【0065】
図14に示すスキーム9について説明する。3-ナフチルトロプ-2-エンおよび3αと3βのトロパンを先述の化学プロセスと同様にして生成する。トロプ-2-エン38は、ACE-Clで処理してN-脱メチル化し、MAMA’-Clを付加して化合物40を得る。レニウムまたはテクネチウムを前述のようにして挿入してジアステレオマー41を得る。別の方法では、化合物38を最初にサマリウムのヨウ化物で還元し、舟形及び椅子形構造化合物43,42を得る。同じ反応順序で3α,3βの両トロパンのレニウムとテクネチウムのジアステレオマー49,48を得る。
【0066】
本発明のテクネチウムまたはレニウム放射性核種錯体は、適当な前駆物質を過テクネチウム酸塩(pertechnetate)または過レニウム酸塩(Perrhenate)の何れかと、適当な還元剤と共に通常の方法で反応させることにより形成出来る。例えば、この化合物を適当な溶媒中で還元剤と共に溶解させてから過テクネチウム酸塩を添加する。混合物を適当時間加熱し、完全に反応させる。代表的な例では、沸騰水浴中で約10分加熱すれば、十分に良い収量の放射性核種錯体を得られることが判明している。レニウム錯体を形成するためには、(Ph3P2)2ReOCl3を、塩基(NaOAc)メタノールに加える。本発明の実施に用いて有効な還元剤は、例えば、塩化第1スズのような第1スズ塩、亜ジチオン酸ナトリウム、および硫酸第1鉄のような第1鉄塩を含む。
【0067】
レニウム(Re)は、テクネチウム(Tc)と同様の挙動をする。かように、ReまたはTcのN2S2錯体は、等しく安定している。両金属はN2S2配位子と方形ピラミッド状の錯体を形成する(Francesconi、L.C.他、無機化学、1993年、32、3114-3124)。レニウムは、短い半減期の放射線標識を必要としない場合に好適な金属である。テクネチウムおよびレニウムの両錯体の場合、頂端位置を酸素が占領し、従って、金属錯体のシン異性体(syn-isomer)およびアンチ異性体(anti-isomer)の両方が可能である。TcとReキレートの生物学的活動は、全体的に類似である。(O’Neil、 J.P.他、Bioconj.Chem.、1994年、5、182-193)。99mTcは、画像化剤として使用するのに好適な放射性核種である。レニウムは、99mTc用の優れたモデルであり、治療用剤としても有用である。
【0068】
テクネチウム放射性核種の好適な導入方法は、ビストルチチル(bistrtityl)保護化合物を無水トリフルオル酢酸と共に反応させ、次にトリエチルシランと共に反応させる方法であった。かようにして得た水溶液の一部を99mTc-グルコヘプト塩酸溶液で温置処理した(グルコスキャンキットは、デュポン社、ビレリカ、マサチューセッツ州より入手を使用)。C8の逆相カラムを備えたHPLCでの分離により、99mTc標識生成物が供給され、これを注入用無菌生理食塩水中で再構成した。
【0069】
本発明の化合物は、キラルキレート配位子にキラルリンカーで付加した(1Sまたは1R構造の)代表的鏡像異性体として純粋なトロパンである。このキラルキレート配位子は、金属オキソとリンカーに関しシスまたはトランス異性体で有り得るが、好ましくはシスである。シスとトランスキレート配位子の各々は、2鏡像異性体の対として存在する。キラル配位子が2鏡像異性体形で存在出来るので、全分子の各々もジアステレオマーとして存在する。本発明の放射線薬剤成分は、個別の各ジアステレオマー対およびジアステレオマー対の混合物を含んでいる。
【0070】
本発明の化合物は、非ターゲット、例えばセロトニントランスポータに対する薬品の追跡レベルの結合を最小にするために、好ましくは10を越え、さらに好ましくは最低30のDAT:SET選択比のようなターゲット/非ターゲット率を有している。
【0071】
本発明は、また、好ましくは非発熱性無菌容器または小瓶に凍結乾燥状態で格納した還元剤と構造式(I)の化合物より成る薬剤調製キットを提供する。この形状で、凍結乾燥成分は、水と生理食塩水または好ましくはpH5-8、さらに好ましくは生理pHの緩衝液を加えるだけで、容易に再構成出来る。放射性核種として使用する金属がテクネチウムである場合、テクネチウム発生器からの過テクネチウム酸塩溶液を再構成のために使用出来る。
【0072】
一般に、放射性薬品の調製キットは、図1に示す構造式(I)の精製済み化合物とテクネチウム用の好ましくは凍結乾燥させた還元剤を格納した殺菌ずみの単位定量(または多定量)瓶より成る。各定量成分は、画像撮影する哺乳類の体重に依存するが通常約30mCiの99mTc画像化に必要な線量を供給するのに十分な量の化合物と還元剤から構成されねばならない。使用時、テクネチウム、好ましくは、生理食塩水に入れた99mTc-ペルテクネチウム酸塩(pertechnetate)を瓶に無菌状態で注入し、混合物を十分な時間反応させて標識錯体を形成させる。反応後、生成された放射性薬剤はすぐ使用出来る。
【0073】
所望の目標を画像化するために、本発明による特定の哺乳類用の有効放射能線量を有する放射性調合剤は、規定食塩水のような適当な薬理学的キャリア内で調製する。好ましくは、放射性薬剤を静脈注射で哺乳類の体内に注入する。ガンマ線カメラまたは他の適当な装置の下に哺乳類を位置決めして、目標、例えば脳を撮像する。
【0074】
高画質の画像を得るために、所望の放射性薬剤中の結合テクネチウムの放射化学収量は、凍結乾燥混合物を再構成し標識した後で好ましくは70%を越えるべきである。低い収量では画像の質が低く、高画質の画像とするために望ましくない精製ステップをさらに必要とすることになる。
【0075】
本発明の実施例について以下に説明する。但し、実施例は、本発明の請求範囲を制限するものではない。最終化合物は、生物学的評価の前に特性と純度が分析された。高磁場の核磁気共鳴(NMR)スペクトルと低分解能と高分解能質量分析(MS)スペクトルと赤外線(IR)スペクトルを測定した。元素分析には、薄膜クロマトグラフィ(TLC)および/または高性能液体クロマトグラフィ(HPLC)を使用して純度の測定値とした。これらの化合物の生物学的評価を実施する前に、98%を越える純度を得た。
【0076】
下記の例において、NMRスペクトルは、Bruker社の100型、Varian社のXL400型またはBruker社の300型またはJeol社の300型のNMRスペクトロメータの何れかで測定記録した。TMSは、内部基準として使用した。溶解点は補正せず、ガレンカンプ(Gallenkamp)溶解点測定装置で測定した。旋光は、JASCO社のDIP320型旋光計(1dcmセル)を用い210Cの温度におけるナトリウムのDラインで測定した。薄膜クロマトグラフィ(TLC)は、Baker社のSi250F型プレート上で実施した。視覚化は、ヨウ素蒸気または紫外線(UV)照射またはリンモリブデン酸(PMA)処理の何れかによって達成した。予備TCLは、シリカゲルGF2000ミクロンのAnaltech社のユニプレートを用いて実施した。フラッシュクロマトグラフィは、Baker社のシリカゲル40M(SiO2)を用いて実施した。元素分析は、Atrantic Microlab社(アトランタ、GA)が行なった。Beckman社の1801型シンチレーションカウンターを、シンチレーションスペクトルの測定に使用した。0.1%のウシ血清アルブミンと(-)-コカインをSigma Chemical社より購入した。全ての反応は乾燥窒素雰囲気中で行われた。
【0077】
[3H]WIN35,428および2β-カルボメトキシ-3β-(4-フルオロフェニル)-N-[3H]メチルトロパン(79.4-87.0Ci/mmol)と[3H]シタロプラム(86.8Ci/mmol)をDuPon-New-England Nuclear社(マサチューセッツ州ボストン市)から購入した。TEAはトリエチルアミンである。薬理学的研究用として、(-)-コカイン塩酸塩が薬物乱用に関する国立研究所(NIDA)から供与された。フルオキセチン(Fluoxetine)は、E.Lilly社から供与された。HPLC分析は、Waters社の510型システムを用い、Waters 8mmC-18形10m逆相カラムを用い254nmの検出感度で実施した。Pd2dba3はトリスジベンジリデンアセトン・ジパラジウムであり、TFAはトリフルオル酢酸であり、THFはテトラヒドロフランであり、EtOAcは酢酸エチルである。
【0078】
例1: (1R)-(-)-2-(メトキシカルボニル)-3-[[(トリフルオロメチル)スルホニル]オキシ]トロプ-2-エン(図6の化合物2)
(1R)-(-)-2-(メトキシカルボニル)-3-トロピノン1(Meltzer他、医化学、1994年、37、2001)(1g、5.07mmol)を無水THF(20ml)に溶解し、溶解液を-780Cまで冷却した。この溶解液に、ビストリメチルシリルアミドナトリウム(1M、5.58ml、5.58mmol)の溶液を徐々に加えた。30分後、Nーフェニルトリフルオロメタンスルホンアミド(1.94g、5.43mmol)を加えた。混合液を-780Cの温度でさらに45分間撹拌し、室温になるまで放置し、その後室温で2時間撹拌した。溶液を全て蒸発させ、残留物をポンプで排気乾燥させた。残留物を(SiO-260g;酢酸エチル中に2%-16%のメタノールを用いた)カラムクロマトグラフィで分析した。1.62g(97%)の黄色い油が得られ、放置している間に結晶化した。
このときのデータは、Rf0.65(10%MeOH/EtOAc);1H-NMR(CDCl3)δ1.58(m、1H)、1.97(m、2H)、2.1-2.2(m、2H)、2.39(s、3H)、2.84(dd、J=18,4Hz、1H)、3.42(t、J=6Hz、1H)、3.8(s、3H)、3.92(d、J=5Hz、1H)である。
【0079】
例2: (1R)-N-メチル-2-メトキシカルボニル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1.]オクト-2-エン(図6の化合物3)
(1R)-2-(メトキシカルボニル)-3-[[(トリフルオロメチル)スルホニル]オキシ]トロペン2(620mg,1.88mmol)とLiCl(171mg,4.03mmol)とPd2dba3(69mg,0.075mmol)とNa2CO3水溶液(2.0M、2mL)とジエトキシメタン(6.2mL)を、全て1本のフラスコに入れ、強力に撹拌した。この溶液に、3,4-ジクロロフェニルホウ酸(474mg,2.49mmol)を加えた。反応させるために2時間還流させ、シーライトを通してろ過した。ケークをエーテルで洗浄し、有機溶液を濃縮NH4OHで洗浄した。洗浄溶液をK2CO3で乾燥させ、ろ過し、蒸発させた。残留物をカラム(Si20,60g,5-6%のEt3N/EtOAcで溶離)に入れ、512mg(83%)の黄色油を得た。放置の間にこの油は結晶化した。
【0080】
このときのデータは、Rf0.56(10% Et3N/EtOAc );IR(Kbr)2941、1724、1460、1418、1333、1250、1212、1124cm-1。1H-NMR(CDCl3)δ1.61(m、1H)、1.9-2.05(m、2H)、2.1-2.3(m、2H)、2.43(s、3H)、2.76(dd、J=19、4.7Hz、1H)、3.36(t、J=4.9Hz、1H)、3.52(s、3H)、3.86(d、J=5.5Hz、1H)、6.96(dd,J=8.3、1.9Hz、1H)、7.2(d、J=2.2Hz、1H)、7.37(d、J=8.2Hz、1H)。元素分析:計算値C、58.91、H、5.25、N、4.29;検出値:C、58.84、H、5.24、N、4.24である。
【0081】
例3: (1R)-N-メチル-2β-メトキシカルボニル-3β-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1.]オクタン(図6の化合物4(R=3,4-Cl2))および
(1R)-N-メチル-2β-メトキシカルボニル-3α-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1.]オクタン(図6の化合物12(R=3,4-Cl2))。
(1R)-N-メチル-2-メトキシカルボニル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1.]オクト-2-エン(化合物3、4g、12.3mmol)の-780CのTHF(43mL)液に、SmI2の溶液(THF中で0.1M、400mL、40mmol)を滴下して加えた。-780Cの温度で30分放置後、MeOH(140mL)を加え、溶液を-780Cの温度でさらに1時間撹拌した。反応をTFA(28mL)と水(285mL)を加えて抑制し、冷浴を除去し、溶液を室温になるまで放置した。NH4OHで塩基反応させ、エーテルで希釈し、シーライトでろ過した。フィルタ−ケークをエーテルで洗浄し、全有機相を集めてチオ硫酸ナトリウム溶液で洗浄し、次に食塩水液で洗浄した。Na2SO4で乾燥後、溶液をろ過し、濃縮し、3.8gの粗生成物を得た。標記の化合物4と12をカラムクロマトグラフィ(Si20,10g, CHCl3 中のEtOH 2.5%)で分離した。化合物12は無色の結晶(1.15g、29%)として分離された。
【0082】
このときのデータは、Mp.89-910C.Rf0.64(1% NH4OH/EtOAc);1H-NMR(CDCl3)δ1.28(ddd、J=1.6、10.4、14、1H)、1.4-1.6(m、2H)、2.23(s、3H)、2.05-2.3(m、2H)、2.35-2.5(m、2H)、3.2-3.47(m、3H)、3.59(s、3H)、7.04(dd、J=2.2、8.2Hz、1H)、7.27(d、J=2.2Hz、1H)、7.30(d、J=8.2Hz、1H)。元素分析:計算値(0.1C6H14)C、59.18、H、6.10、N、4.16、Cl、21.05;検出値: C、59.11、H、5.90、N、4.08、Cl、21.01である。
【0083】
化合物4(R=3,4-Cl2)(Meltzer他、医化学、1993年、36、855-862)は、黄色の固形物(1.04g、26%)として分離された。
このときのデータは、Mp.82.5-83.50C.Rf0.43(IPA/Et2O/ペンタン;3/30/67);1H-NMR(400MHz、CDCl3)δ1.6-1.7(m、3H)、2.0-2.1(m、2H)、2.21(s、3H)、2.50(ddd、1H、H-4)、2.86(m、1H)、2.92(m、1H)、3.33(m、1H、H-5)、3.52(s、3H)、3.55(m、1H)、7.07-7.32(m、3H)。[α]D21-27.00(c=1、CH3OH)。分析:(C16H19NO2Cl2)C、H、N、Clである。
【0084】
例4: (1R)-N-メチル-2β-メトキシカルボニル-3β-(4-フルオロフェニル)-8-アザビシクロ[3.2.1.]オクタン(図6の化合物4(R=4-F))および
(1R)-N-メチル-2β-メトキシカルボニル-3α-(4-フルオロフェニル)-8-アザビシクロ[3.2.1.]オクタン(図6の化合物12(R=4-F);O-1204)
(1R)-N-メチル-2-メトキシカルボニル-3-(3,4-フルオロフェニル)-8-アザビシクロ[3.2.1.]オクト-2-エン(化合物3)を取り替えることを除き、前記例3と全体として同じ手順を用いて、化合物4と12[R=4-F]を得た。
【0085】
化合物4[R=4-F]は、白色の固形物である。溶解温度(Mp)は93-940Cである。このときのデータは、Rf0.42(i-PrNH2:Et2O:ペンタン::5:30:65 );1H-NMR(400Mhz、CDCl3)δ1.57-1.75(m、3H)、2.0-2.2(m、2H)、2.23(s、3H)、2.54(ddd、1H)、2.84(t、1H)、2.95(ddd、1H、J=5.3、12.7Hz)、3.36(m、1H)、3.50(s、3H)、3.55(m、1H)、6.9-7.25(m、4H)。 [α]D21-45.60(c=1、CH3OH)。分析:(C16H20NO2F)C、H、Nである。
【0086】
化合物12[R=4-F]は、無色の油である。
このときのデータは、Rf0.5(EtOAc中のMeOH10% );元素分析:計算値C、69.29、H、7.27、N、5.05;検出値: C、69.35、H、7.26、N、5.00;IR2900、1750、1500cm-1、1H-NMR(100Mhz、CDCl3)δ1.1-1.8(m、4H)、1.9-2.6(m、3H)、2.25(s、3H)、3.1-3.7(m、3H)、3.59(s、3H)、6.8-7.3(m、4H)である。
【0087】
例5: 2β-カルボキシ-3β-(4-フルオロフェニル)トロパン(図7の化合物5(R=4-F))
2β-メトキシカルボニル-3β-(4-フルオロフェニル)トロパン(WIN35,428)(化合物4)(1.25g、4.54mmol)を1:1のジオキサン水溶液(80mL)に入れ24時間還流させた。溶媒を真空中で除去し、残留物をほぼ完全にCHCl3(275mL)中に溶解させた。非溶解固形残分をフィルタで除去し、トルエン(30mL)を加え、溶液を真空中で約75%還元した。白色懸濁液を冷凍器内で2時間冷却した後、白色の固形物をフィルタで分離し、1:1のCHCl3トルエン液で洗浄した。固形物を乾燥させ、白色の固形物(1.11g、95%)を生成物5として得た。
このときのデータは、1H-NMR(CDCl3)δ1.7-1.8(m、1H);1.94(dd、J=9Hz、2H)、2.24-2.34 (m、2H)、2.25 (m、3H)、2.57(ddd、J=13.7Hz、1H)、2.62-2.68 (m、1H)、3.16(ddd、J=13Hz、1H)、3.5-3.6 (m、2H)、6.8 (m、2H)、7.18-7.24(m、2H)である。
【0088】
例6: 2β-カルボキシ-3β-(3,4-ジクロロフェニル)トロパン(図7の化合物5(R=4-F))
2β-メトキシカルボニル-3β-(3,4-ジクロロフェニル)トロパン(化合物4)(1.14g、3.47mmol)をTHF:MeOH(1:1;46mL)に溶解し、LiOH.H2O(153g)の(15mL)水溶液を加えた。溶液を加熱し24時間還流させ、00Cまで冷却し、濃縮HClで中和(pH=7)させた。シリカ(1.75g)を直接溶液に加え、溶媒を真空中で除去した。この材料をフラッシュクロマトグラフのカラムで(先ず溶離剤20%MeOH/CHCl3(900mL)、次に溶離剤30%MeOH/CHCl3(2L)を用い)精製させた。生成物を含んでいる分画(fraction)を集めて一緒にし、真空中で蒸発させ、残留物を高真空で乾燥させた。(310mg;28%)の生成物を得た。このときのデータは、Rf0.08(30%MeOH/CHCl3);1H-NMR(CDCl3)δ1.8-1.9(m、1H)、2.1-2.2(m、2H)、2.3-2.5(m、2H)、2.6-2.9(m、2H)、2.78(s、3H)、3.3-3.4(m、1H)、3.93(m、2H)、7.25(dd、J=8.2Hz、2.2Hz、1H)、7.41(d、J=8.2Hz、1H)、7.48(d、J=2.2Hz、1H)である。
【0089】
例7: 2β-メトキシメチルカルバモイル-3β-(4-フルオロフェニル)トロパン(図7の化合物6(R=4-F))
DMF(50μL)を含む無水CH2Cl2(80mL)に酸5(1.1g)を撹拌懸濁させ、そこに、塩化オキサリル(1ml、11.4mmol)を滴加し、十分に泡立てて懸濁物を溶解させた。45分間撹拌して反応させ、その間に溶液は黄色くなった。この溶液を次に真空中で還元させ、夜通し高真空下に保持した。その際、回転部からポンプに移送する際に減圧排気されるフラスコに窒素が流れ込むように注意した。
【0090】
CH2Cl2(80mL)に溶解した酸塩化物に(MeO)MeNH HCl(450mg)を加えた。尚、この添加物は、使用直前に高真空下でP2O5で乾燥させてから直ちにピリジン(1.1mL)を加えた。反応物を1時間撹拌し、CHCl3(20mL)および2MNa2CO3(20mL)で分けた。水溶液層をCHCl3(2x10mL)と共に抽出し、結合有機抽出物をNa2SO4で乾燥させ、ろ過し、真空中で還元させて、1.09gの黄色固形物を得た。この粗生成物をCH2Cl2に溶解させ、フラッシュクロマトグラフィ(SiO2、43g;20%ヘキサン/EtOAc、5%Et3N)で精製した。分画を含む生成物を一緒にして濃縮し、淡黄色の固形物6(960mg;75%)を得た。
【0091】
このときのデータは、Mp.120.1-122.50C;Rf0.14(25% ヘキサン/EtOAc、5%TEA);元素分析:計算値C、66.65、H、7.57、N、9.14;検出値: C、66.78、H、7.63、N、9.01;IR(KBr)2900、1680、1500cm-1;1H-NMR(CDCl3)δ1.5-1.8(m、3H)、2.0-2.3(m、2H)、2.24(m、3H)、2.79(ddd、1H)、3.0(m、1H)、3.05(s、3H)、3.1(m、1H)、3.4(m、1H)、3.47(m、1H)、3.57(s、3H) 6.9(m、2H)、7.25(m、2H)である。
【0092】
例8: 2β-メトキシメチルカルバモイル-3β-(3,4-ジクロロフェニル)トロパン(図7の化合物6(R=3,4-Cl2))
無水CH2Cl2(30mL)に2β-カルボキシ-3β-(3,4-ジクロロフェニル)トロパン(化合物5)(300mg、9.55mmol)を入れ撹拌した溶液に、無水DMF(40μL)と塩化オキサリル(450μL)を滴加した。この溶液を室温で40分間撹拌した。溶媒を真空中で除去し、残留物を高真空中で1夜乾燥させた。
【0093】
乾燥残留物に、メトキシメチルアミン塩酸塩(103mg、1.05mmol)を加えた。フラスコを窒素でフラッシュ洗浄し、CH2CL2(30mL)をカニューレを通して加え、その直後にピリジン(400μL)を加え、2.5時間撹拌反応した。混合物はCH2CL2(40mL)と1MのNa2CO3(25mL)の間で分けられた。水溶液層をCHCl3で抽出し、結合有機抽出物を乾燥させ濃縮して黄色の固形物(298mg)を得た。固形分をクロマトグラフのカラム(溶離剤50%EtOAc/ヘクタン/5%Et3N)を通して精製した。同様の分画を一緒にし、溶媒を除去し、生成物を高真空で乾燥させ、化合物6(39mg;11%)を得た。このときのデータは、Rf0.1(50%EtOAc/ヘキサン/5%Et3N);1H-NMR(CDCl3)δ1.5-1.74(m、3H)、2.0-2.3(m、2H)、2.21(m、3H)、2.72(ddd、1H)、2.93(m、1H)、3.04(s、3H)、3.13(m、1H)、3.38(m、1H)、3.5(m、1H)、3.62(s、3H)、7.13(dd、1H)、7.30(d、1H)、7.31(d、3H)である。
【0094】
例9: 2β-(1-プロパノイル)-3β-(4-フルオロフェニル)トロパン
(図7の化合物7(R=4-F))
THF(10mL)に2β-(N-メチルオキシ-N-メチルカルバモイル)-3β-(4-フルオロフェニル)トロパン(化合物6)(823mg、2.7mmol)を入れた溶液を、00Cまで冷却し、EtMgBr/Et2O(3M;3mL)を4分を越える間滴加した。室温まで加熱し30分間、次に650Cに加熱し45分間反応させた。混合液を00Cまで冷却し、HClエーテル(3M)を加えて反応を抑制した。曇り溶液を2MのNa2CO3で塩基化した。エーテル(5mL)を加え、層を分離させ、水溶液層をEt2O(1x10mL)とCHCl3(2x10mL)で洗浄した。結合有機抽出物をNa2SO4で乾燥させ、ろ過し濃縮した。生成物をフラッシュクロマトグラフィ(溶離剤25%EtOAc/ヘクタン/5%TEA)で精製させ、化合物7(485mg;65%)を得た。
【0095】
このときのデータは、Rf0.3(20%EtOAc/ヘキサン/5%Et3N);mp118-119.50C;元素分析:計算値C、74.15、H、8.05、N、5.09;検出値: C、74.05、H、8.09、N、5.00;IR(KBr)2900、1710、1500、1250cm-1;1H-NMR(CDCl3)δ0.85(t、3H)、1.5-1.8(m、4H)、2.0-2.4(m、3H)、2.23(m、3H)、2.5-2.6(m、1H)、2.9-3.0(m、2H)、3.36(m、1H)、3.48(m、1H)、6.69(m、2H)、7.17(m、2H)である。
【0096】
例10: 2β-(1-プロパノイル)-3β-(3,4-ジクロロフェニル)トロパン
(図7の化合物7(R=3,4-Cl2))
THF(30mL)に2β-メチルオキシメチルカルバモイル-3β-(3,4-ジクロロフェニル)(化合物6)(168mg、0.47mmol)を入れた溶液を、00Cまで冷却し、EtMgBr/Et2O(3M;1mL)を3分を越える間滴加した。室温まで加熱して60分間保持し、次に加熱して10分間還流させた。混合液を室温まで冷却し、HClエーテル(3M、20mL)を加えて反応を抑制した。曇り溶液をNaHCO3の飽和水溶液で塩基化し、Na2CO3を加えてpH=10にした。エーテルを加え、層を分離させ、水溶液層をEt2O(3x25mL)で洗浄した。結合有機抽出物をNa2SO4で乾燥させ、ろ過し濃縮した。生成物(166mg)をフラッシュカラムクロマトグラフィ(溶離剤30%EtOAc/ヘクタン/5%Et3N)で精製させ、化合物7(108mg;71%)を得た。
【0097】
このときのデータは、Rf0.32(50%EtOAc/ヘキサン/5%Et3N);1H-NMR(CDCl3)δ0.9(t、3H)、1.5-1.8(m、4H)、2.0-2.3(m、3H)、2.2(m、3H)、2.35-2.55(m、2H)、2.82-2.92(m、1H)、2.96(m、1H)、3.34(m、1H)、3.54(m、1H)、7.75(dd、1H) 、7.27(d、1H)、 7.29(d、1H)である。
【0098】
例11: 2β-(1-プロパノイル)-3β-(4-フルオロフェニル)-ノルトロパン
(図7の化合物8(R=4-F))
2β-(1-プロパノイル)-3β-(4-フルオロフェニル)トロパン(化合物7)(335mg)を1-クロロエチルクロロホルム酸塩(5mL)を混合させ、溶液を加熱して5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノール中で1.5時間還流させた。メタノールを真空中で除去し、残留物をCHCl3(15mL)に溶解し、2MのNa2CO3を加え振り混ぜた。水溶液層をCHCl3(2x15mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して369mgの生成物を得た。この残留物をクロマトグラフで分析した(溶離剤:100mL EtOAc、150mL 5% Et3N/EtOAc、100mL 10% Et3N/EtOAc、300mL 20% Et3N/EtOAc、300mL 30% Et3N/EtOAc)。同様の分画を合せて化合物8(104mg、33%)を得た。このときのデータは、Rf0.36(10%Et3N /EtOAc);1H-NMR(CDCl3)δ0.70(t、3H)、1.4-1.8(m、5H)、1.9-2.3(m、3H)、2.4(m、1H)、2.88(m、1H)、3.18(m、1H)、3.56 (m、1H)、3.70(m、1H)、6.94(m、2H)、7.10 (m、2H)である。
【0099】
例12: 2β-(1-プロパノイル)-3β-(3,4-ジクロロフェニル)-ノルトロパン
(図7の化合物8(R=3,4-Cl2))
2β-(1-プロパノイル)-3β-(3,4-ジクロロフェニル)トロパン(化合物7)(107mg、0.32mmol)を1-クロロエチルクロロホルム酸塩(2mL)を合せ、溶液を加熱して5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノール中で45分間還流させた。メタノールを真空中で除去し、残留物をCH2Cl2に溶解し、NaHCO3/ Na2CO3(PH=9)を加え振り混ぜた。水溶液層をCH2Cl2(4x10mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して127mgの生成物を得た。この残留物をクロマトグラフで精製した(溶離剤:100mL 5% Et3N/EtOAc;3x100mL 10% Et3N/EtOAc)。同様の分画を合せて化合物8(30mg、29%)を得た。このときのデータは、1H-NMR(CDCl3)δ0.76(t、3H)、1.4-2.5(m、9H)、2.92(m、1H)、3.09-3.2(m、1H)、3.6(m、1H)、3.72(m、1H)、7.0 (m、1H)、7.25(d、1H)、7.32(d、1H)である。
【0100】
例13: N-[2-(3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図7の化合物9(R=4-F))
2β-(1-プロパノイル)-3β-(4-フルオロフェニル)ノルトロパン(化合物8)(27mg)をMAMA’-Cl(86mg)、KI(34mg、2.0当量)およびNaHCO3(43mg、5当量)と共に無水MeCN(4mL)に入れて4時間還流させた。溶媒を真空中で除去し、残留物をCHCl3とNaHCO3の飽和水溶液の間で分けた。水溶液層をCHCl3(2x5mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して茶褐色の泡を得た。この泡をクロマトグラフのカラム(10gシリカ;40%EtOAc/ヘキサン/1%TEA)に入れて分析した。生成物を含んでいる分画を合わせ濃縮して軽い泡として化合物9(47mg、46%)を得た。このときのデータは、Rf0.09(60% EtOAc/ヘキサン、1%Et3N)、元素分析:計算値C、72.15、H、6.34、N、3.96;検出値: C、71.99、H、6.41、N、3.92;1H-NMR(CDCl3)δ0.77(t、3H)、1.2-3.1(m、29H)、3.3-3.5(m、2H)、6.9-7.0(m、2H)、7.1-7.6(m、32H)である。
【0101】
例14: N-[2-(3’-N’-プロピル-(1”R)-3”β-(3,4-ジクロロフェニル)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図7の化合物9(R=3,4-Cl2))
2β-(1-プロパノイル)-3β-(3,4-ジクロロフェニル)-ノルトロパン(化合物8)(30mg、0.096mmol)をMAMA’-Cl(87mg、0.115mmol)、KI(32mg、0.19mmol、2.0当量)およびNaHCO3(40mg、0.48mmol、5当量)と共に無水MeCN(4mL)に入れて4時間還流させ、次に、室温まで冷却し、夜通し撹拌した。溶媒を真空中で除去し、残留物をCH2Cl2(15mL)とNaHCO3の飽和水溶液(15mL)の間で分けた。水溶液層をCH2Cl2(3x10mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して黄色の油を得た。この油をクロマトグラフのカラム(10gSiO2;30%EtOAC/ヘキサン/1%Et3N)に入れて分析した。生成物を含んでいる分画を合わせて濃縮し、軽い泡として化合物9(41mg、41%)を得た。このときのデータは、Rf0.14(60% EtOAc/ヘキサン、1%Et3N);1H-NMR(CDCl3)δ0.81(t、3H)、1.2-3.1(m、29H)、3.34(m、1H)、3.52(m、1H)、7.0-7.6(m、33H)である。
【0102】
例15: N-[(2-((3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)-トロパン-2”β-1-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図7の化合物10(R=4-F))(O-1508R)
N-[2-(3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(22mg、0.023mmol)を、EtOH(絶対量4mL)とSnCl2(0.5mLの0.05MHCl中に8.5mg)の沸騰溶液中に溶解させた。さらに6時間還流させて反応させ、シリカを加え、溶媒を蒸発させて除去した。シリカ吸着生成物をシリカカラム(3g溶離剤:5%Et3Nを含むヘキサン中に30% のEtOAC)に入れて分離した。化合物は、泡(6.7mg、44%)として得られた。
Rf0.07(60% EtOAc/ヘキサン+NH4OH(0.5%);C25H35FN3O3ReS2の正確な質量:計算値は695.172であり検出値:は695.162であった。また、1H-NMR(CDCl3)δ0.7-0.9(2t、2H)、1.4-4.1(m、26H)、4.5-4.6(m、1H)、4.73(d、J=16.5Hz、0.5H)、4.87(d、J=16.5Hz、0.5H)、6.93(m、2H)、7.14(m、2H)である。
【0103】
例16: 2β-(カルボン酸)-3α-(4-フルオロフェニル)-トロパン
(図8の化合物13(R=4-F))
2β-メトキシカルボニル-3α-(4-フルオロフェニル)-トロパン(化合物12)の(1.0g、3.6mmol)溶液を80mLのジオキサン水(1:1)に入れて24時間還流させた。溶媒を真空中で除去し、茶褐色の固形物をカラムクロマトグラフィで精製した(溶離剤:30%MeOH/CHCl3)。白色の泡として生成物(890mg、94%)を得た。
このときのデータは、Rf0.43(30%MeOH /CHCl3);NMR:1H-NMR(CDCl3)δ1.48-1.62(m、1H)、1.75-2.1(m、3H)、2.36-2.46(m、1H)、2.60(s、3H)、2.7-2.82(m、1H)、3.22(brs、1H)、3.5-3.62(m、2H)、3.76-3.84(m、1H)、6.9-7.1(m、2H)、7.4-7.5(m、2H)である。
【0104】
例17: 2β-(カルボン酸)-3α-(3,4-ジクロロフェニル)-トロパン
(図8の化合物13(R=3,4-Cl2))
2β-メトキシカルボニル-3α-(3,4-ジクロロフェニル)-トロパン(化合物12)の(750mg、2.29mmol)とLiOH(335mg、8.0mmol)の溶液を、水(10mL)とTHF:MeOH(33mL;1:1)に入れて4時間還流させた。濃縮HClを滴下して反応液を中和させた。溶媒を真空中で除去し、生成物をカラムクロマトグラフィで精製した(溶離剤:15%MeOH/CHCl3)。固形の生成物13(521mg、72%)を得た。
このときのデータは、Rf0.15(30%MeOH /CHCl3);1H-NMR(CDCl3)δ1.59(m、1H)、1.8-1.9(m、1H)、2.1-2.2(m、2H)、2.6-2.7(m、2H)、2.76(s、3H)、3.25(brs、1H)、3.35(brs、1H)、3.85(m、1H)、3.93(m、1H)、7.5(d、1H)、7.53(dd、1H)、7.8(d、1H)である。
【0105】
例18: 2β-メトオキシメチルカルバモイル-3α-(4-フルオロフェニル)-トロパン(図8の化合物14(R=4-F))(O-1403)
DMF(50μL)を含む無水CH2Cl2(80mL)に撹拌懸濁させた化合物13(930mg、3.6モル)に塩化オキサリル(1mL、11.4mmol)を滴加し、十分に泡立てて懸濁物を溶解させた。45分間撹拌して反応させ、その間に溶液は黄色くなった。この溶液を次に真空中で還元させ、夜通し高真空下に保持した。その際、窒素が回転部からポンプに移送する際に真空フラスコに流れ込むように注意した。
【0106】
CH2Cl2(70mL)に溶解した酸塩化物に(MeO)MeNH ・HCl(382mg、3.9mmol)を加えてから直ちにピリジン(1mL)を加えた。1時間撹拌して反応させ、CHCl3(20mL)と2MのNa2CO3(20mL)の間で分けた。水溶液層をCHCl3(2x10mL)と共に抽出し、結合有機抽出物をNa2SO4で乾燥させ、ろ過し、真空中で還元させて、黄色の油を得た。この油をトルエンに溶解させ、濃縮して黄色の固形物(653g)を得た。この粗生成物を最小量のCHCl3に溶解し、クロマトグラフのカラム(SiO2、28g;溶離剤25%ヘキサン/EtOAc、5%Et3Nおよび後続25%MeOH/CHCl3)で精製した。分画を含む生成物を一緒にして濃縮し、アミド(540mg;50%)を得た。
【0107】
このときのデータは、Rf0.25(25% ヘキサン/EtOAc、5%Et3N);溶解温度(mp):139.8-141.70C;1H-NMR(CDCl3)δ1.24(dd、1H)、1.4-1.8(m、3H)、2.1-2.3(m、2H)、2.23(s、3H)、2.4-2.6(m、1H)、2.7(brd、1H)、3.05(s、3H)、3..05-3.1(m、1H)、3.25-3.5(m,2H)3.41(s、3H)、6.86-6.96(m、2H)、7.13-7.22(m、2H);IR(Kbr)2900、1656、1500cm-1;元素分析:計算値C、66.65、H、7.57、N、9.14;検出値: C、66.37、H、7.59、N、9.0である。
【0108】
例19: 2β-メトキシメチルカルバモイル-3α-(3,4-ジクロロフェニル)-トロパン(図8の化合物14(R=3,4-Cl2))
DMF(30μL)を含む無水CH2Cl2(10mL)に酸13(210mg、0.67mmol)を入れ撹拌した懸濁液に、塩化オキサリル(0.3mL、2.0mmol)を滴加した。この溶液を1時間撹拌反応させ、次に真空中で還元し、一夜ポンプで高真空化に維持した。その際、回転部からポンプに移送する際に減圧フラスコに窒素が流れ込むように注意した。
【0109】
CH2Cl2(10mL)中の酸塩化物に(MeO)MeNH・HCl(72mg、0.74mmol)を加えてから直ちにピリジン(0.3mL)を加えた。1.5時間撹拌して反応させ、反応物をCH2Cl2(20mL)と1MのNa2CO3(20mL)溶液の間で分けた。水溶液層をCH2Cl2(10mL)と共に抽出し、結合有機抽出物をNa2SO4で乾燥させ、ろ過し、真空中で還元させて、黄色の固形物を得た。この固形物を、カラムクロマトグラフィ(SiO2、14g;溶離剤25%ヘキサン/EtOAc、5%Et3N)で精製した。分画を含む生成物を一緒にして濃縮し、アミド(115mg;48%)を得た。
【0110】
このときのデータは、Rf0.14(40%ヘキサン/EtOAc、5%Et3N);1H-NMR(CDCl3)δ1.17(ddd、1H)、1.48(ddd、1H)、1.63(ddd、1H)、2.1-2.34(m、2H)、2.21(s、3H)、2.42-2.54(m、1H)、2.65(brd、1H)、3.06(s、3H)、3.08(brs、1H)、3.22-3.32(m、1H)、3.34-3.46(m、1H)、3.48(s、3H)、7.05(dd、1H)、7.25(d、1H)、7.27(d、1H)である。
【0111】
例20: 2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-トロパン
(図8の化合物15(R=4-F))(O-1369)
2β-メトキシメチルカルバモイル-3α-(4-フルオロフェニル)-トロパン(化合物14)(471mg)を入れた250mLの丸底フラスコを窒素でフラッシングして、無水THF(70mL)を加えた。室温で、EtMgBr/Et2O(3.0mL;3.0M)を3分を越える間滴加した。室温で30分間撹拌し、次に650Cに加熱して1時間保持した。この温度で、TLCにより反応を開始する物質は観察されなかった。(TLCサンプルは反応物アリコートをHCLエーテルに加え、2MのNa2CO3で塩基化することにより調製された。Rf(生成物)0.42;Rf(開始物質)0.13。(20%EtOAc/ヘキサン、5%Et3N)。)反応フラスコを氷浴で冷却し、HClエーテル(3M)を緩やかに加えて急冷した。曇り溶液を2MのNa2CO3で塩基化し、エーテル(25mL)で希釈した。層が分離し、水溶液層をエーテル(1x10mL)とCHCl3(2x20mL)で抽出した。結合有機抽出物を乾燥させ(Na2SO4)、ろ過し真空中で還元し粗残留物(484mg)を得た。この残留物をクロマトグラフで分離した(25gのSiO2と溶離剤25%EtOAc/ヘクタン、5%Et3N)。生成物を含んでいる分画を合わせて濃縮し化合物15(300mg、70%)を得た。
【0112】
このときのデータは、Mp.60.5-61.30C;Rf0.49(33%EtOAc/ヘキサン/5%Et3N);1H-NMR(CDCl3)δ0.86(t、3H)、1.27(ddd、1H)、1.4-1.6(m、2H)、2.0-2.50(m、6H)、2.23(s、3H)、3.12(brd、1H)、3.2-3.3(m、2H)、6.85-7.0(m、2H)、7.05-7.15(m、2H);IR(KBr)2900、1740、1500cm-1;元素分析:計算値C、74.15、H、8.05、N、5.09;検出値: C、74.00、H、8.13、N、4.98である。
【0113】
例21: 2β-(1-プロパノイル)-3α-(3,4-ジクロロフェニル)-トロパン
(図8の化合物15(R=3,4-Cl2))
2β-メトキシメチルカルバモイル-3α-(3,4-ジクロロフェニル)-トロパン(化合物14)(105mg、0.29mmol)を窒素でフラッシングして、無水THF(15mL)を加えた。室温で、EtMgBr/Et2O(0.8mL;3.0M)を3分を越える間滴加した。室温で1時間撹拌し、次に550Cに加熱し30分間保持した。この温度で、TLCにより反応を開始する物質は観察されなかった。反応を氷浴で冷却し、HClエーテルを緩やかに加えて急冷した。曇り溶液を2MのNa2CO3で塩基化し、エーテル(15mL)と水(15mL)で希釈した。層を分離させ、水溶液層CHCl3(2×15mL)で抽出した。結合有機抽出物を乾燥させ(Na2SO4)、ろ過し真空中で還元し残留物(95mg)を得、これをクロマトグラフで分離した(5gのSiO2と溶離剤25%EtOAc/ヘキサン、5%Et3N)。生成物を含んでいる画分を一緒にして濃縮し化合物15(80mg、80%)を得た。このときのデータは、Rf0.28(30%EtOAc/ヘキサン/5%Et3N);1H-NMR(CDCl3)δ0.93(t、J=7.4Hz、3H)、1.27(ddd、1H)、1.42-1.62(m、2H)、2.06-2.30(m、6H)、2.21(s、3H)、3.32-2.52(m、3H)、3.14(brd、1H)、3.2-3.36(m、2H)、7.10(dd、1H)、7.24(d、1H)、7.29(d、1H)である。
【0114】
例21a: 2β-(1-プロパモイル-3α-(3,4-ジクロロフェニル)-トロパン
(図8の化合物15(R=3,4-Cl2))
窒素用追加漏斗を装備したフラスコに入れた市販の臭化エチルマグネシウム(THF中に1M、12.6mL、12.6mmol)にトリエチルアミン(5.0mg、50.4mmol)を加えた。この混合液に、ベンゼン(10mL)に溶かした化合物12(R=Cl2、750mL、2.29mmol)を5-100Cの温度で1時間を越える間で滴加した。この反応混合液を5-100Cの温度でさらに5時間撹拌し、次に4MのHCl(2.9mL、11.6mmol)で処理した。有機層を水(1x50mL)、5%NaHCO3(水溶液)(1x50mL)および水(2x50mL)で洗浄した。有機相を次に乾燥させ(K2CO3)、ろ過して濃縮した。残留物をクロマトグラフ(SiO2、5%Et3Nを含むヘキサン中で25%のEtOAc)で分離し、670mg(85%)の化合物15を得た。この化合物の物理及び分光分析特性は、前記例20で報告したものと同じであった。
【0115】
例22: 2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-ノルトロパン
(図8の化合物16(R=4-F))(O-1370)
2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-トロパン(化合物15)(O-1369)(556mg、2mmol)とACE-C1(7mL)を一緒にして4時間還流させた。全ての揮発分を蒸発させ、残留物にメタノール(100mL)を加えた。この混合液を90分間還流させた。揮発分を除去し、残留物をCHCl3に入れ、2MのNa2CO3の水溶液で洗浄した。この水溶性混合物をCHCl3(2x10mL)と共に抽出し、結合有機留分を乾燥し(Na2SO4)、ろ過し、還元した。暗褐色の油(615mL)をクロマトグラフ(SiO2を20g、溶離剤は0-10%Et3N/EtOAc)で分離し390mg(74%)の黄色油を得た。
【0116】
このときのデータは、Rf0.25(EtOAc中で5%のEt3N);1H-NMR(CDCl3)δ0.86(t、3H)、1.27(ddd、1H)、1.50-1.72(m、2H)、1.8-2.1(m、3H)、2.2-2.4(m、2H)、2.56(dd、J=10.7、1H21H)、3.07(ddd、J=11.3、10.9、7.1Hz、1H)、3.43(brd、1H)、3.62(brt、1H)、6.89-6.99(m、2H) 、7.09-7.16(m、2H);IR(KBr) 2900、1711、1500cm-1;元素分析:計算値(0.2H2O)C、72.52、H、7.77、N、5.25;検出値: C、72.65、H、7.81、N、5.27である。
【0117】
例23: 2β-(1-プロパノイル)-3α-(3,4-ジクロロフェニル)ノルトロパン
(図8の化合物16(R=3,4-Cl2))
2β-(1-プロパノイル)-3α-(3,4-ジクロロフェニル)-トロパン(化合物15)(80mg、2.45mmol)を1-クロロエチルクロロホルム酸塩(3mL)と一緒にし、その溶液を加熱して5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物にメタノールを加えて1時間還流させた。メタノールを真空中で除去し、残留物をCHCl3に溶解させ、2MのNa2CO3で洗浄した。水溶液層をCHCl3(2x5mL)と共に抽出し、結合有機抽出物を乾燥し(Na2SO4)、ろ過して濃縮し、純粋な化合物(77mg;100%)を得た。このときのデータは、Rf0.3(5% Et3N /EtOAc);1H-NMR(CDCl3)δ0.91(t、3H)、1.25(ddd、1H1.52-1.74(m、2H)、1.8-2.56(m、7H)、3.06-3.2(m、1H)、3.45(d、1H)、3.62(brt、1H)、7.01(dd、1H)、7.25(d、1H)、7.31(d、1H)である。
【0118】
例24: N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図8の化合物17(R=4-F))(O-1506)
2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-ノルトロパン(化合物16)(24mg、0.09mmol)をMAMA’-Cl(147mg、0.19mmol)、KI(31mg、19mmol)を全てCH3CN(3mL)に溶解させ3時間還流させた。溶媒を真空中で除去し、残留物をCHCl3とNaHCO3の飽和水溶液の間で分けた。水溶液層をさらにCHCl3で抽出し、全ての有機留分を一緒にして乾燥させ(Na2SO4)、ろ過して濃縮した。カラムクロマトグラフィ(20%EtOAc、79%ヘキサン、1%Et3N)により、金色泡状の純粋な生成物(11.5mg、13%)を得た。このときのデータは、Rf0.15(50% EtOAc/ヘキサン+5%Et3N);元素分析:計算値C、75.79、H、6.87、N、4.21;検出値: C、75.35、H、6.81、N、4.13;1H-NMR(CDCl3)δ0.85(t、3H)、1.19(ddd、1H)、1.3-1.5(m、6H)、1.8-2.6(m、14H)、2.85(brs、2H)、3.0(m、2H)、3.08-3.30(m、3H)、6.88-6.96(m、2H)、7.06-7.42(m、32H)である。
【0119】
例25: N-[2-(3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)-トロパン-2”β-(1’’’-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図8の化合物17(R=3,4-Cl2))(O-1546)
2β-(1-プロパノイル)-3α-(3,4-ジクロロフェニル)-ノルトロパン(化合物16)(75mg、0.24mmol)を N-(((2-(2-(トリフェニルメチル)チオ)エチル)(N’-3-クロロプロピル)アミノ)アセチル)-S-(トリフェニルメチル)-2-アミノエタンチオール(MAMA’-Cl)(218mg、0.29mmol)とKI(80mg、0.48mmol)とNaHCO3(101mg、1.2mmol)と共に無水MeCN(20mL)に入れて4時間還流させ、次に、室温まで冷却した。
【0120】
溶媒を真空中で除去し、残留物をCH2Cl2(20mL)とNaHCO3の飽和水溶液(15mL)の間で分けた。水溶液層をCH2Cl2(1x10mL)と共に抽出し、結合有機抽出物を乾燥させ(Na2SO4)、ろ過し濃縮して茶褐色の油を得た。この油ををクロマトグラフのカラム(30gSiO2;溶離剤25%EtOAc/ヘキサン/1%Et3N)に入れて分離した。生成物を含んでいる分画を合わせ濃縮して化合物17(51mg、17%)を得た。このときのデータは、Rf0.3(60% EtOAc/ヘキサン、1%Et3N);元素分析:計算値(1.33H2O)C、71.71、H、6.46、N、3.98;検出値: C、71.85、H、6.52、N、3.91;1H-NMR(CDCl3)δ0.89(t、3H)、1.0-1.7(m、8H)、1.8-2.5(m、14H)、2.6-3.4(m、6H)、6.9-7.6(m、33H)である。
【0121】
例26: N-[2-((3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-トロパン-2”β-1’’’-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図8の化合物18(R=4-F))(O-1505)
N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)トロパン-2”β-(1’’’-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(化合物17)(22mg)をEtOH(4mL)に入れて加熱還流させた。0.005MのHCl(0.5mL)を含むSnCl2(7.8mg、0.04mmol)の溶液を迅速に加え、続けて直ちに0.005MのHCl(0.5mL)を含むNaReO4(12.4mg,0.04mmol)を加えた。曇り溶液を6時間還流させ、次に、0.5gのシリカに供給し一夜ポンプで減圧排気した。シリカ吸着生成物をクロマトグラフのカラム(3g溶離剤:30%EtOAc/ヘキサン/5%TEA)に入れて分離した。得られた茶紫色の固形物をペンタンと共にすりつぶし、一夜高真空で乾燥させて、泡状の化合物18(9.9mg、71%)を収穫した。
【0122】
このときのデータは、正確な質量計算値:695.161(検出値:695.172);Rf0.30(75%EtOAc/ヘキサン+0.5%NH4OH);1H-NMR(CDCl3)δ0.75-0.95(2t、3H)、1.0-2.0(m、8H)、2.0-2.5(m、6H)、2.8-3.0(m、1H)、3.0-3.5(m、7H)、3.6-3.8(m、1H)、3.9-4.2(m、3H)、4.5-4.65(m、1H)、4.73-5.12(2d、J=16.7Hz)、6.9-7.0(m、2H)、7.08-7.15(m、2H)である。
【0123】
例27: N-[(2-((3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)-トロパン-2”β-1’’’-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図8の化合物18(R=3,4-Cl2))
EtOH(5mL)に入れたN-[2-(3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)トロパン-2”β-(1-プロパノイル))(2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(化合物17)(24mg、0.024mmol)を加熱還流させた。0.005MのHcl(0.5mL)に入れたSnCl2(9mg、0.05mmol)の溶液を迅速に加え、続けて直ちに0.005MのHCl(0.5mL)に入れたNaReO(14.5mg、0.005mmol)を加えた。この溶液を4時間還流させ、次に0.5gのシリカに供給し、一夜高真空に維持した。シリカ吸着物質をクロマトグラフのカラム(4gのSiO2;溶離剤30%EtOAC/ヘキサン/5%Et3N)に入れて精製した。得られた固形物を濃縮して化合物18(4.6mg、27%)を得た。このときのデータは、1H-NMR(CDCl3)δ0.8-1.0(2t、3H)、1.1-2.5(m、14H)、2.8-3.0(m、1H)、3.0-3.5(m、7H)、3.6-3.8(m、1H)、3.9-4.2(m、1H)、4.4-4.65(m、1H)、4.70-5.06(2d、2xJ=16.7Hz、1H)、7.0(dd、1H)、7.3(d、1H)、7.34(d、1H)である。
【0124】
例28: 2β-(メトキシメチルカルバモイル-3α-(4-フルオロフェニル)-ノルトロパン(図9の化合物20(R=4-F))
2β-(1-プロパノイル)-3α-(4-フルオロフェニル)-トロパン(化合物14)(112mg、0.37mmol)を1-クロロエチルクロロホルム酸塩(2.2mL)と一緒にし、その溶液を加熱して5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物にメタノールを加えて45分間加熱還流させた。MeOHを真空中で除去し、残留物をCHCl3とNaHCO3/Na2CO3(pH=9)に溶解した。水溶液層をCHCl3(3x10mL)と共に抽出し、結合有機抽出物を乾燥し(Na2SO4)、ろ過して濃縮し、104mgの生成物を得た。この残留物をクロマトグラフ(溶離剤:10-20% Et3N /EtOAc)で精製し、化合物20(65mg、60%)を得た。このときのデータは、Rf0.13(10% Et3N/EtOAc);1H-NMR(CDCl3)δ1.30(ddd、1H)、1.5-1.75(m、2H)、1.85-2.15(m、2H)、2.2-2.35(m、1H)、2.7-2.9(m、1H)、3.05(s、3H)、3.1-3.22(m、1H)、3.38(s、3H)、3.4-3.5(m、1H)、3.6-3.7(m、1H)、6.9-7.0(m、2H)、7.13-7.23(m、2H)である。
【0125】
例29: N-[2-(3’-N’-プロピル-(1”R’)-3”α-(4-フルオロフェニル)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図9の化合物21(R=4-F))(O-1450)
2β-(1-プロパノイル)-3α-(4-フルオロフェニル)ノルトロパン(化合物20)(65mg、0.22mmol)をMAMA’-Cl(203mg、0.27mmol、1.2当量)、KI(74mg、0.45mmol)およびK2CO3(309、2.2mmol)を全て無水MeCN(10mL)に入れ、6時間還流させてから室温にまで冷却した。溶媒を真空中で除去し、残留物をCHCl3と水の間に分けた。水溶液層をCHCl3(3x5mL)で抽出し、結合有機抽出分を(Na2SO4)で乾燥させ、ろ過して黄色の油を得た。これをカラムクロマトグラフィ(15gのSiO2と50%EtOAC120ml/ヘキサン/5%Et3N)で精製した。淡黄色の油である化合物21(142mg、41%)を得た。このときのデータは、Rf0.7(5%Et3N/ EtOAc);元素分析:計算値C、71.02、H、6.96、N、5.26;検出値: C、71.20、H、6.45、N、5.14;1H-NMR(CDCl3)δ1.2-3.5(m、24H)、2.85(s、2H)、3.02(s、3H)、3.42(s、3H)、6.85-7.0(m、2H)、7.1-7.7(m、32H)である。
【0126】
例30: N-[(2-((3’-N’-プロピル-(1”R’)-3”α-(4-フルオロフェニル)-トロパン-2”β-メトキシメチルカルバモイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図9の化合物22(R=4-F))(O-1451)
N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(化合物21)(21mg、0.02mmol)をEtOH(4mL)に入れて加熱還流させた。0.005MのHCl(0.5mL)を含むSnCl2(8.4mg、0.04mmol)の溶液を迅速に加え、続けて直ちに0.05MのHCl(0.5mL)を含むNaReO4(13mg、0.04mmol)を加えた。溶液を10時間還流させ、次に、0.5gのシリカに供給し一夜ポンプで減圧排気した。シリカ吸着生成物をクロマトグラフのカラム(3g溶離剤:30%EtOAc/ヘキサン/5%Et3N)に入れて分離した。同様の画分を合わせて濃縮し、紫色の泡状精製物(3.7mg、26%)を収穫した。このときのデータは、Rf0.5(25%ヘキサン/EtOAc);1H-NMR(CDCl3)δ1.1-4.2(m、30H)、4.5-4.6(m、1H)、4.75-5.12(2d、J=16.7Hz,2x6β、1H)、6.8-7.0(m、2H)、7.1-7.2(m、2H)である。
【0127】
例31: 2β-(メトキシメチルカルバモイル-3β-(4-フルオロフェニル)-ノルトロパン(図9の化合物20A(R=4-F))
2β-(1-プロパノイル)-3β-(4-フルオロフェニル)-トロパン(143mg、0.50mmol)を1-クロロエチルクロロホルム酸塩(2mL)と一緒にし、その溶液を加熱して2時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物にメタノール(30ml)を加えて45分間加熱還流させた。メタノールを真空中で除去し、残留物をCHCl3とNaHCO3/Na2CO3(pH=9)に溶解した。水溶液層をCHCl3(3x10mL)と共に抽出し、結合有機抽出物を乾燥し(Na2SO4)、ろ過して濃縮した。この残留物をクロマトグラフ(溶離剤:10-20% Et3N /EtOAc)で分離した。同様に分画を結合し、80mg(58%)の生成物を得た。このときのデータは、1H-NMR(CDCl3)δ1.50(m、1H)、1.7(m、2H)、1.95-2.22(m、2H)、2.5(ddd、1H)、2.92(s、3H)、3.1-3.4(m、2H)、3.3(s、3H)、3.6(m、1H)、3.72(m、1H)、6.9-7.0(m、2H)、7.1-7.3(m、2H)である。
【0128】
例32: N-[2-(3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図5の化合物21A(R=4-F))
2β-(1-プロパノイル)-3β-(4-フルオロフェニル)-ノルトロパン(80mg、0.28mmol)をMAMA’-Cl(244mg、0.32mmol)、KI(84mg、0.5mmol、2.0当量)およびK2CO3(322、2.3mmol)を無水MeCN(10mL)に入れ、一夜還流させてから室温にまで冷却した。溶媒を真空中で除去し、残留物をクロマトグラフのカラム(5%Et3N /EtOAc)で精製した。生成物を含む分画を集め、濃縮して、淡黄色の泡として生成物(80mg、29%)を得た。このときのデータは、Rf0.65(5%Et3N/ EtOAc);1H-NMR(CDCl3)δ1.2-3.1(m、28H)、3.37(m、1H)、3.51(s、3H)、3.55(m、1H)、6.9-7.0(m、2H)、7.1-7.5(m、32H)である。
【0129】
例33: N-((2-((3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)トロパン-2”β-メトキシメチルカルバモイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド(図9の化合物22A(R=4-F))(O-1451)
N-[2-(3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)トロパン-2”β-メトキシメチルカルバモイル)((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(22mg、0.02mmol)をEtOH(10mL)に入れて加熱還流させた。0.005MのHCl(1.0mL)に入れたSnCl2(8.4mg、0.05mmol)の溶液を迅速に加え、続けて直ちに0.05MのHCl(0.5mL)に入れたNaReO4(13mg、0.05mmol)を加えた。溶液を10時間還流させ、次に、クロマトグラフのカラム(65%EtOAc/ヘキサン/5%Et3N)に入れて分離した。同様の分画を合わせて濃縮し、泡状精製物(10mg、65%)を得た。このときのデータは、Rf0.44(5% Et3N/30%ヘキサン/EtOAc);1H-NMR(CDCl3)δ1.5-4.2(m、30H)、4.4-4.6(m、1H)、4.75、5.05(2d、J=16.5Hz、1H)、6.8-7.0(m、2H)、7.1-7.3(m、2H)である。
【0130】
例34: (1R)-N-メチル-2-ヒドロキシメチル-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物38(R=4-F))
(1R)-N-メチル-2-メトキシカルボニル-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(化合物3)(500mg、1.82mmol)をベンゼン(15mL)に溶解し、LAH(70mg、1.82mmol)を加えた。反応液を一夜600Cに加熱保持した。反応液を00Cに冷却し、水(70μL)、NaOHの15%溶液(70μL)、水(200μL)を順次加えた。反応液を15分間撹拌し、塩類をシーライトで濾し取った。ろ過物をNa2SO4で乾燥させ、ろ過濃縮して化合物38(454mg、90%)を得た。この化合物をカラムクロマトグラフィ(30gのSiO2と4%Et3N/10%MeOH/CHCl3)で精製した。同様の分画を合わせ還元し、一夜高真空に保持し、化合物38(336mg、74%)を得た。
【0131】
このときのデータは、Mp.106.6-108.70C;Rf0.2(10%MeOH/CHCl3;5%Et3N);1H-NMR(CDCl3)δ1.5-1.7(m、1H)、1.9-2.0(m、3H)、2.1-2.3(m、2H)、2.4(s、3H)、2.72(brd、J=18Hz、1H)、3.31(brs、1H)、3.55(d、J=4.1Hz、1H)、3.89(d、J=12.3Hz、1H)、4.02(d、J=12.3Hz、1H)、6.9-7.0(m、2H)、7.1-7.2(m、2H)、元素分析:計算値C、72.85、H、7.34、N、5.66;検出値:C、72.94、H、7.33、N、5.73である。
【0132】
例35: (1R)-N-メチル-2-ヒドロキシメチル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物38(R=3,4-Cl2))
(1R)-N-メチル-2-メトキシカルボニル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(化合物3)(508mg、1.56mmol)をベンゼン(20mL)に溶解し、LAH(62mg、1.56mmol)を加えた。反応液を一夜600Cに加熱還流した。反応液を00Cに冷却し、水(80μL)、10%KOH溶液(90μL)、水(300μL)を順次加えた。反応液を15分間撹拌し、塩類をシーライトで濾し取った。ろ過液をNa2SO4で乾燥させ、ろ過濃縮して黄色の泡(420mg、90%)を得て、これをカラムクロマトグラフ(3%Et3N/7%MeOH/CHCl3)で精製し280mg(60%)の生成物を得た。このときのデータは、Rf0.2(5%MeOH/CHCl3;3%Et3N);1H-NMR(CDCl3)δ1.5-1.66(m、1H)、1.84-1.98(m、2H)、2.0(m、2H)、2.08-2.24(m、2H)、2.39(s、3H)、2.7(dd、1H)、3.3(m、1H)、3.54(d、J=5.5Hz、1H)、3.89(d、J=11.8Hz、1H)、4.01(d、J=11.8Hz、1H)、6.99(dd、1H)、7.25(d、1H)、7.37(d、1H)である。
【0133】
例36: (1R)-N-メチル-2-カルボニル-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物39(R=4-F))
(COCl)2(55mg、40μL、0.43mmol)とCH2Cl2(2mL)の混合溶液を-780Cに冷却し、DMSO(65μL)を3分間を越える間に滴加した。反応液を-780C の温度でさらに5分間撹拌し、CH2Cl2(2mL)に溶かした化合物38(90mg、0.36mmol)を10分間を越える間に滴加した。さらに20分経ってから、Et3N(250μL、1.80mmol)を30分間を越える間滴加した。反応液をさらに10分間撹拌し、室温になるまで放置した。CH2Cl2(20mL)と1MのNaOHを加えた。層に分け取り、水溶液層をCH2Cl2(1x15mL)で洗った。結合有機抽出物をNa2SO4で乾燥させ、ろ過濃縮して高真空に排気した。得られた黄色油(86mg)をカラムクロマトグラフィ(4.5gのSiO2と30%EtOAc/ヘキサン/5%Et3N)で精製した。同様の分画を合わせ濃縮し、高真空で乾燥させて化合物39(62mg、63%)を得た。このときのデータは、Rf0.2(20%EtOAc/ヘキサン、5%Et3N);1H-NMR(CDCl3)δ1.55-1.65(m、1H)、1.72-1.82(m、2H)、2.14-2.3(m、2H)、2.40(s、3H)、2.9-3.0(m、1H)、3.36-3.44(m、1H)、4.02-4.30(m、1H)、7.0-7.1(m、2H)、7.16-7.24(m、2H)、9.45(s、1H)である。
【0134】
例37: (1R)-N-メチル-2-カルボニル-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物39(R=3,4-Cl-2))
(COCl)2(125mg、87μL、1.0mmol)とCH2Cl2(20mL)の混合溶液を-780Cに冷却し、DMSO(150μL)を3分間を越える間に滴加した。反応液を-780Cの温度でさらに5分間撹拌し、CH2Cl2(5mL)に溶かした化合物38(245mg、0.82mmol)を7分間を越える間に滴加した。さらに30分経ってから、Et3N(600μL、4.0mmol)を約15分間を越える間に滴加した。反応液をさらに10分間撹拌し、室温になるまで放置した。 CH2Cl2(20mL)とNa2CO3(20mL;1M)を加えた。層に分けて採取し、水溶液層をCH2Cl2(1x20mL)で洗った。結合有機抽出物をNa2SO4で乾燥させ、ろ過濃縮して高真空に排気した。残留物をカラムクロマトグラフィ(25gのSiO2と60%EtOAc/ヘキサン/5%Et3N)で精製した。同様の分画を合わせ濃縮し、高真空で乾燥させて生成物39(154mg、63%)を得た。このときのデータは、Rf0.2(75%EtOAc/ヘキサン、5%Et3N);1H-NMR(CDCl3)δ1.5-1.7(m、1H)、1.7-1.85(m、1H)、2.1-2.3(m、2H)、2.38(s、3H)、2.93(dd、1H)、3.39(m、1H)、4.05(dd、1H)、7.08(dd、1H)、7.34(d、1H)、7.46(d、1H)、9.45(s、1H)である。
【0135】
例38: (1R)-N-メチル-2-(2-ヒドロキシプロピル)-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物40(R=4-F))
化合物39(62mg、0.26mmol)を無水THFに室温で溶解し、EtMgBr/Et2O(3M;900μL)を滴加した。反応液を室温で20分間撹拌し、次に650C の温度で一夜撹拌した。次に、1MのHCl(50mL)とEt2O(50mL)を650C の温度で徐々に加えた。この混合液をNaCO3の飽和水溶液で塩基化させて分離した。水溶液層をCHCL3(2x20mL)で抽出し、(Na2SO4で)乾燥させ、ろ過し蒸発させ高真空で乾燥させた。残留物(90mg)をカラムクロマトグラフィ(6gのSiO2と5%Et3N/ EtOAc)で精製した。同様の分画を合わせて蒸発させ、高真空で乾燥させて化合物40(82mg、52%)を得た。このときのデータは、Rf0.4(10%MeOH/CHCL3/5%Et3N);1H-NMR(CDCl3)δ0.83(t、J=7.6Hz、3H)、1.4-1.7(m、4H)、1.81(d、J=18Hz、1H)、2.0(m、1H)、2.1-2.3(m、2H)、2.42(s、3H)、2.7(m、1H)、3.3(m、1H)、3.53(m、1H)、4.1-4.2(m、1H)、6.9-7.1(m、4H)である。
【0136】
例39: (1R)-N-メチル-2-(2-ヒドロキシプロピル)-3-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクト-2-エン(図13の化合物40(R=3,4-Cl2))
化合物39(150mg、0.5mmol)を無水THF(25mL)に室温で溶解し、EtMgBr/Et2O (3M;350μl,1.05mmol)を2分を越える時間をかけて滴加した。反応液を室温で2.75時間撹拌し、次に、1MのHCl(20mL)とEt2O(20mL)の溶液を徐々に加えた。この混合液をNa2CO3の飽和水溶液で塩基化させて分離した。水溶液層をCHCl3(3x20mL)で抽出し、(Na2SO4で)乾燥させ、ろ過し蒸発させ高真空で乾燥させた。残留物(197mg)をカラムクロマトグラフィ(20gのSiO2と5%Et3N/ EtOAc)で精製し化合物40(109mg、66%)を得た。このときのデータは、Rf0.07(5%Et3N、20%ヘキサン/EtOAc);1H-NMR(CDCl3)δ0.85(t、J=7.4Hz、3H)、1.4-1.7(m、4H)、1.79(d、J=17.6Hz、1H)、1.95-2.1(m、1H)、2.1-2.3(m、2H)、2.42(s、3H)、2.68(dd、 J=4.18Hz、1H )、3.3(m、1H)、3.38(d、1H)、3.52(d、J=5Hz、1H)、4.1-4.2(m、1H)、6.9(d、1H)、7.20(dd、1H)である。
【0137】
例40: (1R)-2-プロパノイル-3-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]-オクト-2-エン(図13の化合物26(R=F-4))
トロパン40(28mg、0.1mmol)をCH2Cl2に溶かし、(COCl)2(5.5μL、0.12mmol)とDMSO(20μL、0.26mmol)をCH2Cl2に溶かした低温(-780C)混合溶液に滴加し、-780Cの温度で30分間撹拌した後、Et3N(75μL、0.5mmol)加え、反応液を温度まで暖めた。CH2Cl2と1MのNaOHを加えて分層させた。有機層を(Na2SO4で)乾燥させ、ろ過、蒸発させ、生成物をクロマトグラフのカラム(5%Et3N,25%ヘキサン,70%EtOac)に入れて精製し、18.6mgの生成物(66%)を得た。このときのデータは、Rf0.2(5%Et3N /25%ヘキサン/70%EtOAc);1H-NMR(CDCl3)δ0.80(t、3H)、1.6(m、1H)、1.8-2.3(m、6H)、2.40(s、3H)、2.75(dd、1H)、3.35(m、1H)、3.73(m、1H)、7.0(m、2H)、7.05-7.15(m、2H)である。
【0138】
例41: (1R)-2-メトキシカルボニル-3-(4-フルオロフェニル)-8-ノルアザビシクロ[3.2.1]-オクト-2-エン(図11の化合物29(R=4-F))(O-1131)
2-メトキシカルボニル-3-(4-フルオロフェニル)トロパン3(362mg、1.3mmol)を1-クロロエチルクロロホルム酸塩(1mL)に入れ、その溶液を加熱して2時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノール(30ml)に入れ45分間加熱還流させた。メタノールを真空中で除去し、残留物をCHClとNaHCO3/Na2CO3(pH=9)に溶解した。水溶液層をCHCl(3x10mL)と共に抽出し、結合有機抽出物を(Na2SO4)で乾燥させ、ろ過し濃縮した。残留物をクロマトグラフ(溶離剤:1-3% Et3N /EtOAc+0.5%NH4OH)で分離した。同様画分を結合し、黄色の固形生成物(234mg、68%)を得た。このときのデータは、Rf0.7(10%MeOH/ヘキサン+0.5% NH4OH);mp.67-68℃;1H-NMR(CDCl3)δ1.50-3.0(m、6H)、3.8(m、1H)、4.2(m、1H)、6.8-7.2(m、4H)。元素分析:計算値:C、68.95、H、6.17、N、5.36:検出値: C、68.81、H、6.24、N、5.40である。
【0139】
例42: (1R)-2-メトキシカルボニル-3-(3,4-ジクロロフェニル)-8-ノルアザビシクロ[3.2.1.]オクト-2-エン(図11の化合物29(R=3,4-Cl2)(O-1130)
2-(メトキシカルボニル)-3-[3,4-ジクロロフェニル)トロパン(200mg、0.61mmol)を1-クロロエチルクロロホルム酸塩(4mg)に溶かし、溶液を2時間加熱還流させた。余剰クロロホルム酸塩を真空除去し、残留物をメタノール(30mL)に入れ45分間還流させた。残留物をCHCl3とNaHCO3/Na2CO3の溶液(pH=9)に溶解した。水液層をCHCl(3x10mL)と共に抽出し、結合有機抽出物を(Na2SO4)で乾燥させ、ろ過し濃縮した。残留物をクロマトグラフ(溶離液5-15%のEt3N/EtOAc)で精製した。同様な分画を一緒にして黄色の固形物を得た。このときのデータは、Rf0.3(10% Et3N/EtOAc);1H-NMR(CDCl3)δ1.50-2.3(m、5H)、2.5-2.9(m、1H)、3.53(s、3H)、3.8(m、1H)、4.2(m、1H)、6.9(dd、1H)、7.2(dd、1H)、7.4(d、1H)。元素分析:計算値C、57.71、H、4.84、N、4.49;検出値: C、57.45、H、4.87、N、4.47である。
【0140】
例43: N-[2-(3’-N’-プロピル-(1”R)-3”-(4-フルオロフェニル)トロプ-2-エン-2”-(メトキシカルボニル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図11の化合物30(R=4-F))
2-(1-メトキシカルボニル)-3-(4-フルオロフェニル)ノルトロプ-2-エン(134mg、0.5mmol)をMAMA’-Cl(387mg、0.5mmol)、KI(85mg、0.5mmol)およびK2CO3(707mg、5mmol)と共に無水MeCN(10mL)に入れて一夜還流させ、その後室温に冷却した。溶媒を真空中で除去し、残留物をクロマトグラフのカラム(1-6%Et3N/EtOAc)に入れ精製した。生成物を含んでいる分画を合わせ濃縮して軽い黄色の泡状の精製物(148mg、29%)を得た。このときのデータは、Rf0.18(10% Et3N/ヘキサン);1H-NMR(CDCl3)δ1.3-3.15(m、22H)、3.2-3.4(m、1H)、3.5(s、3H)、3.8-3.9(m、1H)、6.8-7.8(m、34H)である。
【0141】
例44: N-[2-(3’-N’-プロピル-(1”R)-3”-(3,4-ジクロロフェニル)トロプ-2-エン-2”-(メトキシカルボニル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図11の化合物30(R=3,4-Cl2))
2-(1-メトキシカルボニル)-3-(3,4-ジクロロフェニル)ノルトロプ-2-エン(107mg、0.34mmol)をMAMA’-Cl(258mg、0.34mmol)、KI(57mg、0.34mmol)およびK2CO3(472mg、3.4mmol)と共に無水MeCN(10mL)に入れて一夜還流させ、次に、室温まで冷却した。溶媒を真空中で除去し、残留物をクロマトグラフのカラム(1-6%Et3N/EtOAC)に入れて精製した。生成物を含んでいる分画を合わせ濃縮して泡状の生成物(111mg、31%)を得た。このときのデータは、Rf0.18(ヘキサン中5%Et3N);1H-NMR(CDCl3)δ1.4-3.2(m、22H)、3.2-3.4(m、1H)、3.5(s、3H)、3.8-3.9(m、1H)、6.8-7.6(m、33H)である。
【0142】
例45: N-[(2-((3’-N’-プロピル-(1”R)-3”-(4-フルオロフェニル)トロプ-2-エン-2”-(メトキシカルボニル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]レニウム(V)酸化物(図11の化合物31(R=4-F))(O-1135)
N-[2-(3’-N’-プロピル-(1”R)-3”-(4-フルオロフェニル)トロプ-2-エン-2”-(メトキシカルボニル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(130mg、0.13mmol)を、EtOH(10mL)に入れ、加熱還流させた。0.005MのHCl(1.0mL)に溶かしたSnCl2(28mg、0.1mmol)の溶液を迅速に加え、続けて0.005MのHCl(0.5mL)に溶かしたNaReO4(40mg、0.15mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(溶離剤:1-10%Et3N/EtOAC)に注入した。同様の分画を結合濃縮して、泡状の生成物(34mg、37%)を得た。このときのデータは、Rf0.09(10% Et3N/EtOAc;1H-NMR(CDCl3)δ1.4-4.3(m、23H)、3.5(s、3H)、4.5-4.9(m、2H)、6.9-7.2(m、4H)、元素分析:計算値C、41.49、H、4.50、N、6.05;検出値: C、41.77、H、4.44、N、5.93。正確な質量は、計算値で696.1348、検出値で696.1405であった。
【0143】
例46: N-[(2-((3’-N’-プロピル-(1”R)-3”-(3,4-ジクロロフェニル)トロプ-2-エン-2”-(メトキシカルボニル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)酸化物(図11の化合物31(R=3,4-Cl2))(0-1136)
N-[2-(3’-N’-プロピル-(1”R)-3”-(3,4-ジクロロフェニル)トロプ-2-エン-2”-(メトキシカルボニル)(2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(100mg、0.1mmol)をETOH(10mL)に入れ、加熱還流させた。0.005MのHCl(1.0mL)に溶かしたSnCl2(20mg、0.15mmol)の溶液を迅速に加え、続けて0.005MのHCl(0.5mL)に溶かしたNaReO4(29mg、0.11mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(溶離剤:1-10%Et3N/EtOAC)に注入した。同様の分画を結合濃縮して、泡状の生成物(56mg、78%)を得た。このときのデータは、Rf0.09(10% Et3N/EtOAc;1H-NMR(CDCl3)δ1.4-4.2(m、23H)、3.55(s、3H)、4.4-4.9(m、2H)、6.95(dd、1H)、7.2(d、1H) 、7.4(d、1H)、元素分析:計算値C、38.65、H、4.05、N、5.63;検出値: C、38.91、H、3.96、N、5.57。正確な質量は、計算値で746.0663、検出値で746.0689であった。
【0144】
例47: N-[2-(3’-N’-プロピル-(1”R-3”β-(4-フルオロフェニル)-2”β-メトキシカルボニルトロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-2-アミノエタンチオール(図12の化合物33(R=4-F))
乾アセトニトリル(10ml)に溶かしたノル-3β-(4-フルオロフェニル)-2β-(メトキシカルボニルトロパン(52.6mg、0.2mmol)の溶液に、N-[2-((3-クロロプロピル-(2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(151mg、0.2mmol)とKI(33mg、0.2mmol)とK2CO3(280mg、2.0mmol)を順次加えた。生成スラリーを一夜沸騰させた。反応終了後、溶液を室温まで冷却し、2グラムのシリカを加え、溶媒を蒸発させた。生成固形物をシリカカラムで分層させ、EtOAcとヘキサンの1:1溶液に入れた0.5%のNH4OHで溶離させた。標記化合物を、72%の収量(141mg)の泡として収穫した。これを、二塩酸塩に転化した。溶解温度(Mp.)166-1680Cで、IR(Kbr):1666cm-1、また1H-NMR(CDCl3)δ1.8-3.8(m、24H)、3.3(S,3H)、3.9-4.0(m、1H)、4.2-4.3(m、1H)、4.4-4.5(m、1H)、6.9-7.4(m、34H)、元素分析:計算値(2HCl・2H2O):C、68.24、H、6.47、N、3.85;検出値: C、38.03、H、6.40、N、3.82である。
【0145】
例48: (RS)-N-[2-((3’-N’-プロピル-(1”R-3”β-(3,4-ジクロロフェニル)-2”β-(メトキシカルボニルトロパン))(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオール(図12の化合物33(R=3,4-Cl2))
上記化合物を前記例47の化合物と同様にして生成した。このとき、溶解温度(Mp.)1080C、IR(Kbr):1724、1653、957cm-1、1H-NMR(CDCl3)δ1.5-3.9(m、22H)、3.55と3.50(2s、3H)、3.9-4.2(m、2H)、4.5-4.7(m、1H)、4.80(d、16.4Hz、1H)、7.0-7.4(m、3H)で、C24H33Cl2N3S2O4Re[MH]+の正確な質量は、計算値で748.0819、検出値で748.0856であった。また元素分析:計算値:C、38.55、H、4.31、N、5.62;検出値:C、38.79、H、4.38、N、5.41である。
【0146】
例49: (RS)-N-[2-((3’-N’-プロピル-(1”R-3”β-(4-フルオロフェニル)-2”β-メトキシメチルカルボニルトロパン))((2-((メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)酸化物(図12の化合物34(R=4-F))(O-861)
N-[2-((3’-N’-プロピル-3”β-(4-フルオロフェニル)トロパン-2”β-カルボン酸メチルエステル)(2-((トリフェニル)チオ)エチル)アミノ)アセチル)-S-(トリフェニルメチル)-2-アミノエタンチオール(98mg、0.1mmol)を沸騰しているエタノール(1.5mL)に溶解した。この溶解液に、SnCl2(0.05MのHCl200mLに21mgを溶かした)溶液を加え、続けてNaReO4(0.05MのHCl200mLに30mgを溶かした)溶液を加えた。一夜沸騰を継続し、沸騰CH3CN(10mL)を加え、生成溶液をシーライトのパッドによりろ過した。ケークを2回以上沸騰CH3CN(2x20mL)で洗浄した。ろ液にシリカゲル(1mg)を加え、溶媒を蒸発させた。固形物をシリカゲルのカラムに分層させ、EtOAcで溶離させた。標記化合物をジアステレオマーの混合物として90%の収率(608mg)で分離した。
【0147】
このとき、溶解温度(Mp.)101.90C、IR(KBr):1720、1666、957cm-1で、1H-NMR(CDCl3)δ1.4-4.2(m、24H)、3.46と3.5(2s、3H)、4.4-4.7(m、1H)、4.80と4.82(2d、16Hz、1H)、6.8-7.3(m、4H)で、C24H34FN3S2O4Re[MH]+の正確な質量は、計算値で698.1557、検出値で698.1557であった。これを、分析のために二塩酸塩に転化した。このときのデータは、元素分析:計算値(Hcl・2H2O):C、37.47、H、4.98、N、5.46;検出値: C、37.45、H、4.95、N、5.40である。
【0148】
例50: (RS)-N-[2-((3’-N’-プロピル-(1”R-3”β-(3,4-ジクロロフェニル)-2”β-メトキシカルボニルトロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)酸化物(図12の化合物34(R=3,4-Cl2))(O-863)
上記化合物を前記例49の化合物と同様にして作成した。
このとき、溶解温度(Mp.)1080C、IR(KBr):1724、1653、957cm-1で、1H-NMR(CDCl3)δ1.5-3.9(m、22H)、3.55と3.50(2s、3H)、3.9-4.2(m、2H)、4.5-4.7(m、1H)、4.80(d、16.4Hz、1H)、7.0-7.4(m、3H)で、C24H33Cl2N3S2O4Re[MH]+の正確な質量は、計算値で748.0819、検出値で748.0856であった。また元素分析:計算値:C、38.55、H、4.31、N、5.62;検出値: C、38.79、H、4.38、N、5.41である。
【0149】
例51: (1R)-2β-メトキシカルボニル-3α-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクタン(図12の化合物35(R=3,4-Cl2))
(1R)-N-メチル-2β-メトキシカルボニル-3α-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクタン(化合物12)(375mg、1.14mmol)とα-クロロエチルクロロホルム酸塩(ACE-Cl)(3mL)を結合し、1000Cの油浴温度で1時間加熱した。余剰ACE-Clを減圧して除去し、残留物にメタノール(50mL)を加えた。この混合液を30分間加熱還流させ、濃縮して乾燥させた。この得られた残留物をCH2Cl2(75mL)に溶解し、NH4OHの水溶液で洗浄し、Na2SO4で乾燥させ、ろ過濃縮して粗脱メチル化生成物を得た。これをフラッシュクロマトグラフィ(1%NHO4OH、50-0%ヘキサン、50-90%EtOAc、0-10%メタノール)で精製し、250mg(70%)の化合物35を得た。このときのデータは、Rf0.14(5%Et3N/EtOAc/ヘキサン1:1);1H-NMR(CDCl3)δ1.1-2.5(m、8H)、2.9-3.3(m、1H)、3.5-3.8(m、1H)、3.6(s、3H)、6.95-7.40(m、3H)である。
【0150】
例52: (1R)-2β-メトキシカルボニル-3α-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクタン(図12の化合物35(R=4-F))
(1R)-N-メチル-2β-メトキシカルボニル-3α-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクタン(95mg、0.34mmol)とACE-Cl(7mL)を結合し、1000Cのオイルバス温度で1時間加熱した。余剰ACE-Clを減圧して除去し、残留物にメタノール(50mL)を加えた。この混合液を30分間加熱還流させ、濃縮して乾燥させた。この得られた残留物をCH2Cl2(75mL)に溶解し、NH4OHの水溶液で洗浄し、Na2SO4で乾燥させ、ろ過濃縮して粗脱メチル化生成物を得た。これをフラッシュクロマトグラフィ(0-5%NHO4OH、10%MeOH/EtOAc)で精製し、86mg(95%)の化合物35を得た。このときのデータは、Rf0.66(10%MeOH/EtOAc+0.5%NH4OH);1H-NMR(CDCl3)81.2(ddd,1H)1.2-2.8(m、5H)、3.3-3.6(m、2H)、3.5(s、3H)、3.8-4.2(m、2H)、6.9-7.3(m、4H)である。
【0151】
例53: N-[2-(3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)-2’’β-メトキシカルボニルトロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(図12の化合物36(R=3,4-Cl2))
(1R)-2β-メトキシカルボニル)-3α-(3,4-ジクロロフェニル)-8-アザビシクロ[3.2.1]オクタン(化合物35)(250mg、0.79mmol)と乾CH3CN(40mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニル-メチル)-2-アミノエタンチオール(601mg、0.79mmol)とKI(132mg)およびK2CO3(1.1g)を順次加えた。生成スラリーを一夜沸騰状態に維持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分かれさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過して濃縮させ、残留物をフラッシュクロマトグラフィ(15gSiO2;1:1のEtOAC/ヘキサン混合液中0-5%の Et3N)に入れて精製し、100mg(12%)の白色泡状の生成物を得た。
【0152】
このときのデータは、Rf0.18(EtOAc/ヘキサン中2.5%NH4OH);1H-NMR(CDCl3)δ1.20-1.54(m、5H)、1.80-2.50(m、15H)、2.81(d、J=17Hz、1H)、2.88(d,J=17H2,1H)3.00(m、2H)、3.16-3.40(m、3H)、3.54(s、3H)、7.03(dd、J=2.2、8.5Hz、1H)、7.14-7.53(m、32H)。 元素分析:計算値:C、72.07、H、6.15、N、4.07、Cl、6.86;検出値: C、72.18、H、6.21、N、3.97、 Cl、6.75である。
【0153】
例54: N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-2’’β-メトキシカルボニル-トロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図12の化合物36(R=4-F))
(1R)-2β-メトキシカルボニル-3α-(4-フルオロフェニル)-8-アザビシクロ[3.2.1]オクタン(化合物35)(230mg、0.87mmol)と乾CH3CN(25mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニル-メチル)-2-アミノエタンチオール(660mg、0.87mmol)とKI(145mg、0.87mmol)およびK2CO3(1.21g、8.7mmol)を順次加えた。生成スラリーを一夜沸騰状態に保持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分かれさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過し濃縮させ、残留物をフラッシュクロマトグラフィ(50%の EtOAc /ヘキサン+1%NH4OH)に入れて精製し、435mg(51%)の泡状の生成物を得た。
【0154】
このときのデータは、Rf0.45(1%Et3N、50%EtOAc、49%ヘキサン);1H-NMR(CDCl3)δ1.20-1.3(m、1H)、1.3-2.5(m、19H)、2.81(d、J=17Hz、1H)、2.86(d、 J=17Hz、1H)、2.95-3.05(m、2H)、3.10-3.4(m、3H)、3.50(s、3H)、6.89-6.96(m、2H) 、7.1-7.5(m、32H)。 元素分析:計算値(0.75H2O):C、74.78、H、6.63、N、4.22;検出値: C、74.80、H、6.64、N、4.17である。
【0155】
例55: N-[(2-((3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-2”β-メトキシカルボニルトロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-レニウム(V)酸化物(図12の化合物37(R=4-F))(0-1186)
N-[2-(3’-N’-プロピル-(1”R)-3”α-(4-フルオロフェニル)-2”β-メトキシカルボニルトロパン)(2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタン-チオール(226mg、0.23mmol)をEtOH(10mL)に入れ、加熱還流させた。0.05MのHCl(1.0mL)に溶かしたSnCl2(48mg、0.25mmol)の溶液を迅速に加え、続けて0.05MのHCl(0.5mL)に溶かしたNaReO4(69mg、0.25mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(5%Et3N/Et2O)に注入した。同様の分画を結合濃縮して、泡状の生成物(33mg、21%)を得た。このときのデータは、Rf0.38(10% Et3N/EtOAc;1H-NMR(CDCl3)δ0.9-4.3(m、24H)、3.53と3.56(2s、3H)、4.4-4.7(m、1H)、4.75と5.00(2s、1H)、6.8-7.4(m、4H)で、元素分析:計算値(2/7Et2O):C、42.06、H、5.03、N、5.85;検出値: C、42.08、H、4.93、N、5.85である。
【0156】
例56: N-[(2-((3’-N’-プロピル-(1”R)-3”α-(3,4-ジクロロフェニル)-2”β-メトキシカルボニルトロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]レニウム(V)酸化物(図12の化合物37(R=3,4-Cl2))(O-1196)
上記化合物を前記例55の化合物と同様にして生成した。このときのデータは、Rf0.51(10% Et3N/EtOAc;1H-NMR(CDCl3)δ1.2-1.4(m、1H)、1.4-2.5(m、11H)、2.89(m、1H)、3.10-3.40(m、5H)、3.56と3.60(2s、3H)、3.6-3.8(m、0.5H)、3.90-4.15(m、3.5H)、4.60-(m、1H)、4.73と4.95(2d、J=16.2と16.2Hz、2x0.5H)、7.0-7.1(m、1H) 、7.24-7.36(m、2H)で、元素分析:計算値(H2O):C、37.64、H、4.48、N、5.49;検出値: C、37.59、H、4.31、N、5.55である。
【0157】
例57: (1R)-N-メチル-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン(図14の化合物50)
(1R)-2-(メトキシカルボニル)-3-[[(トリフルオロメチル)スルホニル)オキシ)トロプ-2-エン(化合物2)(500mg、1.52mmol)とLiCl(142mg、3.34mmol)とPd2dba3(56mg、0.06mmol)とNa2CO3(2.0Mの水溶液2mL)とジメトキシメタン(6mL)を全て1本のフラスコに入れ強力に撹拌した。この溶液に、2-ナフチルホウ酸(340mg、1.97mmol)を加えた。反応液を2時間還流させてからシーライトでろ過した。ケークをエーテルで洗い、全有機溶液を濃縮水酸化アンモニウム溶液で洗い出した。洗浄溶媒を炭酸カリウムで乾燥させ、ろ過し蒸発させた。残留物をカラム(1-4%Et3N/ EtOAc)で精製し、240mg(51%)の化合物50を得た。このときのデータは、Rf0.48(10% Et3N/EtOAc);1H-NMR(CDCl3)δ1.3-3.6(m、7H)、2.5(s、3H)、3.45(s、3H)、3.8-4.0(m、1H)、7.2-8.0(m、7H)。元素分析:計算値(0.5H2O):C、77.24、H、6.94、N、4.50;検出値: C、77.27、H、6.94、N、4.48である。
【0158】
例58: (1R)-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン(図14の化合物51)
(1R)-N-メチル-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]-オクト-2-エン(化合物50)(100mg、0.33mmol)をACE-Cl(0.25mL)に溶かし、この溶液を5時間還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノールに入れ45分間還流させた。メタノールを真空中で除去し、残留物をCH2Cl2に溶解し、NaHCO3/Na2CO3 (pH=9)を加えて振り混ぜた。水溶液層をCH2Cl2で抽出し、結合有機抽出物を(Na2SO4で)乾燥させ、ろ過して濃縮した。残留物をクロマトグラフィ(1-10%Et3N/ EtOAc)で分離精製した。同様の分画を結合し化合物51(27mg、28%)を得た。このときのデータは、Rf0.15(10% Et3N/EtOAc);1H-NMR(CDCl3)δ1.6-2.5(m、5H)、2.7-3.1(m、1H)、3.45(s、3H)、3.8-3.9(m、1H)、4.2-4.35(m、1H)、7.1-8.0(m、7H)である。
【0159】
例59: N-[2-(3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3’’-(2-ナフチル)-トロプ-3-エン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図14の化合物52)
(1R)-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン(化合物51)(27mg、0.09mmol)と乾CH3CN(10mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニル-メチル)-2-アミノエタンチオール(70mg)とKI(15mg)とK2CO3(127mg)を順次加えた。生成スラリーを一夜沸騰状態に保持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分かれさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過して濃縮させ、残留物をフラッシュクロマトグラフィ(50-90%のEtOAc/ヘキサン+3%NH4OH)に入れて精製し、27mg(29%)の化合物52を得た。このときのデータは、Rf0.44(1%NH4OH/EtOAc);1H-NMR(CDCl3)δ1.5-3.2(m、20H)、2.87(s、2H)、3.3-3.4(m、1H)、3.4(s、3H)、3.9-4.0(m、1H)、7.0-7.8(m、37H)である。
【0160】
例60: N-[(2-((3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3”-(2-ナフチル)-トロプ-2-エン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]-レニウム(V)酸化物(図14の化合物41)(0-1185)
N-[2-(3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3”-(2-ナフチル)-トロプ-2-エン))((2-トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール(化合物52)(27mg、0.027mmol)をETOH(10mL)に入れ、加熱還流させた。0.05MのHCl(1.0mL)に溶かしたSnCl2(5.7mg、0.03mmol)の溶液を迅速に加え、続けて0.05MのHCl(0.5mL)に溶かしたNaReO4(8.2mg、0.03mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(5%Et3N/Et2O)に注入した。同様の分画を結合濃縮して、ジアステレオマーの混合物(15mg、76%)を得た。このときのデータは、Rf0.15(10%Et3N/EtOAc;IR(KBr)967cm-1;正確な質量値:計算値728.15999、検出値728.1664;1H-NMR(CDCl3)δ1.3-4.3(m、23H)、3.45(s、3H)、4.5-4.9(m、2H)、7.1-8.0(m、7H)である。
【0161】
例61: (1R)-N-メチル-2β-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(図14の化合物42)(O-1229)および(1R)-N-メチル-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(図14の化合物43)(O-1228)
(1R)-N-メチル-2β-メトキシカルボニル)-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン(化合物50)(510mg、1.66mmol)とTHF(15mL)の溶液を-780Cの温度に冷却し、Sml2の溶液(THF中で0.1M、116mL、11.6mmol)を滴加した。-780C の温度で30分後にMeOH(42mL)加え溶液をさらに5分間-780C の温度で撹拌した。TFAと水を加えることにより反応を抑制し、冷浴を取り去り溶液を室温に戻した。溶液を、NH4OHで塩基反応させ、エーテルで希釈し、シーライトでろ過した。フィルタ・ケークをさらにエーテルで洗浄し、全ての有機相を結合し、チオ硫酸ナトリウム溶液で洗浄し、次に食塩水で洗浄した。硫酸ナトリウムで乾燥後、溶液をろ過し、濃縮して粗生成物を得た。この粗生成物をカラムクロマトグラフィ(0-2%Et3N/EtOAc)で分離した。化合物42が淡黄色の固形物(110mg、22%)として得られた。このときのデータは、溶解温度(Mp.)94-950C。 Rf0.28(10%MeOH/CHCl3);IR(KBr):2900、1750cm-1;1H-NMR(CDCl3)δ1.5-2.3(m、5H)、2.25(s、3H)、2.7(ddd、1H)、2.9-3.3(m、2H)、3.45(s、3H)、3.3-3.4(m、1H)、4.5-4.6(m、1H)、7.3-7.5(m、4H) 、7.7-7.9(m、4H)。元素分析:計算値(0.25HO2):C、76.52、H、7.55、N、4.46;検出値: C、76.63、H、7.57、N、4.44である。
【0162】
化合物43は、灰色がかった白色の固形物(113mg、23%)として得られた。
このときのデータは、Mp.113-1140C、Rf0.56(10%MeOH/CHCl3);IR(KBr):3000、1750cm-1;1HNMR(CDCl3)δ1.4-1.6(ddd、1H)、1.4-1.8(m、3H)、2.0-2.4(m、2H)、2.3(s、3H)、2.4-2.7(m、1H)、2.65(dd、1H)、3.2-3.4(m、3H)、3.57(s、3H)、7.2-7.5(m、3H)。元素分析:計算値:C、77.64、H、7.49、N、4.53;検出値: C、77.48、H、7.50、N、4.45である。
【0163】
例62: (1R)-2β-2-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(図14の化合物44)
(1R)-N-メチル-2β-(メトキシカルボニル)-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(化合物42)(146mg)をACE-Cl(5.5mL)と混合し、その溶液を5時間加熱還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノールに入れて45分間還流させた。メタノールを真空中で除去し、残留物をCH2Cl2に溶解し、NaHCO3/Na2CO3(pH=9)を入れて振り混ぜた。水溶液層をCH2Cl2で抽出し、結合有機抽出物を(Na2SO4)で乾燥させ、ろ過して濃縮した。残留物をクロマトグラフ(2%MeOH/ EtOAc)で分離した。同様の分画を合わせて化合物44(109mg、78%)を得た。このときのデータは、Rf0.27(10% MeOH/EtOAc);1H-NMR(CDCl3)δ1.5-2.4(m、5H)、2.68(ddd、1H)、4.8-4.9(m、1H)、3.30(s、3H)、3.3-3.4(m、1H)、3.7-3.9(m、2H)、7.1-8.0(m、7H)。 元素分析:計算値(0.25H2O):C、76.10、H、7.23、N、4.67;検出値: C、75.98、H、7.23、N、4.60である。
【0164】
例63: (1R)-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(図14の化合物45)
(1R)-N-メチル-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(化合物43)(90mg)をACE-Cl(4mL)と混合し、その溶液を5時間加熱還流させた。余剰クロロホルム酸塩を真空中で除去し、残留物をメタノールに入れて45分間還流させた。メタノールを真空中で除去し、残留物をCH2Cl2に溶解し、NaHCO3/Na2CO3(pH=9)を入れて振り混ぜた。水溶液層をCH2Cl2で抽出し、結合有機抽出物を(Na2SO4)で乾燥させ、ろ過して濃縮した。残留物をクロマトグラフ(2%MeOH/ EtOAc)で分離した。同様の分画を合わせて化合物45(109mg、78%)を得た。このときのデータは、Rf0.27(10% MeOH/CHCl3)である。
【0165】
例64: N-[2-(3’-N’-プロピル-(1”R)-2” β-メトキシカルボニル-3’’β-(2-ナフチル)-トロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図14の化合物46)
(1R)-2β-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(化合物44)(81mg、0.27mmol)と乾CH3CN(20mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニルメチル)-2-アミノエタンチオール(207mg)とKI(46mg、0.27mmol)とK2CO3(378mg)を順次加えた。生成スラリーを一夜還流状態に維持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分れさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過し濃縮させ、残留物をフラッシュクロマトグラフィ(0-90%のEtOAc /ヘキサン+3%NH4OH)に入れて精製し、150mg(54%)の化合物46を得た。
このときのデータは、Rf0.36(10%Et3N/EtOAc);1H-NMR(CDCl3)δ1.4-3.8(m、24H)、2.85(s、2H)、3.38(s、3H)、7.0-7.8(m、37H)である。
【0166】
例65: N-[2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロパン))((2-トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(図14の化合物47)
(1R)-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン(化合物45)(17mg、0.06mmol)と乾CH3CN(10mL)の溶液に、N-[[[2-[2-(トリフェニルメチル) チオ]エチル](N’-3’-クロロプロピル)アミノ]アセチル]-S-(トリフェニルメチル)-2-アミノエタンチオール(4.3mg)とKI(9.4mg)とK2CO3(79mg)を順次加えた。生成スラリーを一夜還流状態に維持した。反応終了後、溶液を室温まで冷却し、濃縮したNH4OH水溶液とCH2Cl2水溶液の間に分かれさせた。層を分離し、有機相をNa2SO4で乾燥させた。溶液をろ過して濃縮させ、残留物をフラッシュクロマトグラフィ(50-80%のEtOAc /ヘキサン+3%NH4OH)に入れて精製し、18mg(31%)の化合物47を得た。このときのデータは、Rf0.36(50%EtOAc、47%ヘキサン、3%NH4OH)である。
【0167】
例66: N-[(2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”β-(2-ナフチル)-トロパン)(2-メルカプトエチル)アミノ)アセチル]-2-アミノエタンチオラート]-レニウム(V)酸化物(図14の化合物48)(O-1339)
N-[2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”-(2-ナフチル)-トロプ-2-エン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(化合物46)(150mg、0.15mmol)をETOH(10mL)に入れ、加熱還流させた。0.05MのHCl(1.0mL)に溶かしたSnCl2(31mg、0.16mmol)の溶液を迅速に加え、続けて0.05MのHCl(0.5mL)に溶かしたNaReO4(45mg、0.16mmol)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(5%Et3N/EtOAc)に注入した。同様の分画を結合濃縮して、ジアステレオマーの混合物(34mg、41%)を得た。このときのデータは、Rf0.39(10%Et3N/EtOAc);1H-NMR(CDCl3)δ1.4-4.2(m、24H)、3.40、3.48(2s、3H)、4.4-4.7(m、1H)、8.25、8.30(2d、1H)、7.1-8.0(m、7H)で、元素分析:計算値(0.5EtOAc):C、46.97、H、5.30、N、5.39;検出値: C、46.91、H、5.12、N、5.19である。
【0168】
例67: N-[(2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロパン)(2-メルカプトエチル)アミノ)アセチル]-2-アミノエタンチオラート]-レニウム(V)酸化物(図14の化合物48)(O-1339)
N-[2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロプ-2-エン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール(化合物47)(18mg、0.02mmol)をETOH(10mL)に入れ、加熱還流させた。0.05MのHCl(1.0mL)に溶かしたSnCl2(5.3mg)の溶液を迅速に加え、続けて0.05MのHCl(0.5mL)に溶かしたNaReO4(3.7mg)を加えた。溶液を10時間還流させ、その後、クロマトグラフのカラム(5%Et3N/Et2O)に注入した。同様の分画を結合濃縮して、ジアステレオマーの混合物(40%)を得た。
【0169】
このときのデータは、Rf0.46(5%Et3N/EtOAc);1H-NMR(CDCl3)δ1.4-1.8(m、24H)、1.8-2.0(m、2H)、2.02-2.20(m、1H)、2.3-2.5(m、3H)、2.69、2.71(2s、3H)、2.9-3.0(2dd、1H)、3.1-3.4(m、3H)、3.4-3.6(m、1H)、3.5、3.55(2s、3H)、3.6-3.8(2ddd、1H)、3.9-4.2(m、3H)、4.5-4.7(m、1H)、4.75、4.98(2d、1H)、7.32(d、1H)、7.3-7.5(m、2H)、7.64(s、1H)、7.7-7.8(m、3H)である。
【0170】
例68-80
ドーパミントランスポータ用特定化合物の結合親和性と選択性を決定する試験を実施した。試験に用いた化合物の組成を図15及び図16に、試験結果を図17に示す。
【0171】
例81-91:99MTc標識
下記の化合物を下述の同一方法で調製する。
例81:N-[(2-((3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(3,4-ジクロロフェニル)-トロパン)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図12の化合物37(R=3,4-Cl2))(0-1196)
例82:N-[(2-((3’-N’-プロピル-(1”R)-2”β-1-プロパノイル-3”α-(4-フルオロフェニル)-トロパン)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図8の化合物19(R=4-F))
【0172】
例83:N-[(2-((3’-N’-プロピル-(1”R)-2”β-1-プロパノイル-3”α-(3,4-ジクロロフェニル)-トロパン)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図8の化合物19(R=3,4-Cl2))
例84:N-[(2-((3’-N’-プロピル-(1”R)-2”β-メトキシメチルカルバモイル-3”α-(4-フルオロフェニル)-トロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図9の化合物22(R=4-F))(O-1351)
【0173】
例85:(RS)-N-[(2-((3’-N’-プロピル-(1”R-2”β-カルボメトキシ-3”β-(4-フルオロフェニル)-トロパン))-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図12の化合物34(R=4-F))
例86:(RS)-N-[(2-((3’-N’-プロピル-(1”R-2”β-カルボメトキシ-3”β-(3,4-ジクロロフェニル)-トロパン))-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図12の化合物34(R=3,4-Cl2))
例87:N-[(2-((3’-N’-プロピル-(1”R)-2”-カルボメトキシ-3”-(4-フルオロフェニル)-トロペン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-テクネチウム(V)酸化物(図11の化合物31(R=4-F))
【0174】
例88:N-[(2-((3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3”-(3,4-ジクロロフェニル)-トロペン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-テクネチウム(V)酸化物(図11の化合物31(R=3,4-Cl2))
例89:N-[(2-((3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(4-フルオロフェニル)-トロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-テクネチウム(V)酸化物(図12の化合物37(R=4-F))
【0175】
例90:N-[(2-((3’-N’-プロピル-(1”R)-3”β-(4-フルオロフェニル)トロパン)-2”β-1プロパノイル)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物(図7の化合物11(R=4-F))
例91:N-[(2-((3’-N’-プロピル-(1”R)-2”β-1-プロパノイル-3”β-(3,4-ジクロロフェニル)-トロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-テクネチウム(V)酸化物(図7の化合物11(R=3,4-Cl2))
【0176】
(放射線標識用トロパン類似体の保護解除)
採用した手順を以下に説明する。
TFA、CH2Cl2および(C2H5)3SiHの20マイクロリットルのアプリコットをチオール保護基を開裂させるために各トリチル保護前駆体5.0mgに加えた。20分間温置後に、200μLの1.0MのHCl/エーテル溶液を加えチオールを陽子化した。溶媒を蒸発させ、次にヘキサンで連続洗浄してトリチル基を除去した。脱保護化合物をDMSOに溶解し、1ミリリットル当たり1ミリグラムの濃度で貯蔵液を調製した。
【0177】
(トロパン類似体の放射線標識)
約200mCiの99mTcペルテクネタートナトリウムをグルコヘプトナート・キット(Glucoheptonate Kit)(米国、マサチューセッツ州ビレリカ市のデュポン製薬会社製)に加え、室温で15分間温置した。150mCiの99mTc-グルコヘプトナート生成物を等量の50mMの酢酸塩緩衝液(pH5.2,約2mL)と50μLの脱保護前駆体貯蔵溶液(DMS0中で1mg/mL、50μg)に加えた。この溶液を室温20分間温置した。放射線標識の過程を、逆相VydacC8カラム(4.6x250mm、5μm)を使用したRainin形高性能液体クロマトグラフ(HPLC)システムで監視した。カラムは0.1Mの酢酸アンモニウム/アセトニリルの可動相で溶出させた。流量は毎分1.5mL、5-100%アセトニトリルのグラジエントは15分を越えた。放射線は、Frisk-Tech レートメータ(Bicron社製)を用いて検出した。最終放射線標識生成物を、エタノールで溶出するC18型Sep-Pak装置(Waters社製)を用いて精製した。全ての化合物につき、標識収量および放射化学純度は各々、85%と98%を越えていた。各生成物を無菌生理食塩水で希釈し、10%未満のエタノール溶液を得た。注射前に、この溶液を0.22μmのフィルタでろ過した。代表的なHPLCのクロマトグラムを図18乃至図21に示す。
【0178】
(HPLCでの分析結果の要約)
上記の方法により、滞留時間は類似体の2つの特徴、即ち、配座と置換に依ることがわかる。予測した様に、ジクロロ類似体は、1フッ化化合物より遅れて溶出し、ボート配座異性体は各々の椅子形化合物より遅れて溶出した。4つの特別99mTc標識化合物の滞留時間を図22に示す。再現性は、±0.1分であった。
【0179】
(パーキンソン病の動物モデル)
ニューロトキシンMPTP(N-メチル-1,2,3,6-テトラヒドロピリジン)を猿に服用させると、げっ歯類では反復試験できない運動、認知、生化学および形態的変化のスペクトルが生じる。MPTPを投与した猿達は、神経欠損(静止時の震え、硬直、失動、異常姿勢)、形態学的変化(黒質、腹側被蓋部の細胞損失)および生化学的変化(著しいDAの消耗、ノルエピネフリンとセロトニンの減少)を示し、突発性パーキンソン病(PD)、脳炎後のパーキンソン症候群とよく類似している。
【0180】
2匹の猿に0.6mg/kgのMPTPを3-5滴、10日以上投与して処置した。この処置は、ケタミン(15mg/kg)で麻酔して実施した。MPTPの量はパーキンソン症候群を2-3週間以内に、 CFT結合部位の3Hまたは11Cの消耗を1ケ月以内に発生させるために前以て使用した。このように処置した猿達が、SPECTの結合トレーサーと運動機能障害間の逆関係を示すことが期待された。この処置によって発生したDA終端の顕著な消耗により、神経終末の完全な減損を検出するためのSPECTトレーサーの選択性と感度の確実な証拠が提供される。
【0181】
(SPECTの画像化)
全SPECT画像は、ファン・ビーム照準器を装備したマルチSPECT2型ガンマ線カメラ(ジーメンス社、ホフマン・エステート、IL)を用い、99mTcの光電ピーク140KeV(15%窓)にピークを合わせ撮像した。このカメラの本来の分解能は4.6mm(FWHM)で、感度は-240cps/mCiであった。画像は、連続モードで360度(60プロジェクション/ヘッド、128x128マトリクス)に渡り撮影された。画像の再構成は、通常の10mmFWHM面内解像度とチャング法による減衰補正による通常のろ光バックプロジェクションのアルゴリズムを用いて実施された。
【0182】
アカゲ猿達の体重は約7kgで、ケタミン/キシラジン(15.0および1.5mg/kg)を麻酔しSPECTカメラの撮影ベッドにうつ伏せに寝かせた。撮像開始前に、放射性薬剤を投入するために末梢静脈に静脈カテーテルを挿入した。猿の頭を特別注文のヘッドホルダーを用いて固定した。約20-25mCiの99mTcで標識したO-1505T、O-1508T、O-1561TまたはO-1560Tを60秒以上の時間で静脈注射した。SPECTの動的撮影は注入終了時点から開始し、最初の1時間の間は2分間、それ以後は5分間づつ撮影した。
【0183】
(猿の脳内におけるDAT部位に対する選択性)
この研究では、一匹の猿を、マルチSPECT2型ガンマ線カメラの撮影ベッドに仰向けに寝かせ、前記の様にして、-20mCiの99mTcで標識したO-1560Tを注射した。放射性薬剤投入後約20分経過してから、この猿にCFT(1.0mg/kg)を注射し、画像撮影をさらに70分間継続した。
【0184】
(画像分析)
SPECTを最大の線条放射能または後頭部の皮質がよく視覚化されたSPECTの切片を総計し、主要対象領域(ROI)を構成する。線条面において、ROIは右線条と左線条は尾状核+被核)に置いた。左右の線条の放射能を平均した。ROIの放射能(cpm/cc)は注入時間に応じ崩壊時間を補正した。線条と後頭部皮質の放射能(結合比)の差を各画像毎に計算し、時間の関数としてグラフを作成した。分散フラクションと部分量効果に対する補正は実施しなかった。
【0185】
(放射線の計量)
Sparague-Dawleyの雄ラット群に〜10mCiの99mTc標識O-1505TとO-1561Tを注射した。注射後24時間5分間隔で、6匹づつのラット群に各放射性薬剤を注射し、犠牲にして生体内の分布を測定した。血液、心臓、肺、肝臓、脾臓、腎臓、副腎、胃腸(GI)管、精巣、骨、骨髄、骨格筋を計量し、井戸形ガンマ線カウンタ(フィンランドWallacOy社製LKB#1282型)を用いて放射能を測定した。放射性崩壊に対し補正し、各器官内の放射能の濃度を摂取線量のフラクションとして計算出来る様に、注射量のアリコットを同時に計数した。結果をグラム当たりの注射量(ID)比(%I.D.・g)で示し、放射線量はMIR線量法で計算した。
【0186】
(結果)
99mTcで標識したO-1505T、O-1508T、O-1561TおよびO-1560Tを用いたSPECT画像の撮影:
99mTc O-1505Tと99mTc O-1561Tを注射後初期に撮影した画像の場合、放射能の拡散蓄積が脳全体にわたり観察された。注射後の最初の数分間は、線条へのトレーサの蓄積が激しく、全ての他の構成部の放射能レベルは低下した。注射後30分近くになると、脳の線条と他の部分との間にはっきりとしたコントラストが生じた。猿の脳のトランス軸状、矢状および冠状の画像を99mTc で標識したO-1505T、O-1508T、O-1561TおよびO-1560Tを注射後30分から50分の間撮影した。これらのデータから明らかになったことは、99mTc O-1505Tと 99mTc O-1561T(各々ボート形のモノフロロ及びジクロロ化合物)を注射後撮影した画像は、脳の線条において高い薬剤濃度を示し、脳の他領域では最小の蓄積を示している。
【0187】
特に、視床、視床下部または中脳、5-HTトランスポータが豊富に存在する領域に蓄積しないことが、DAT部位用のこのトレーサの特異性を支えている。主要対象領域の分析では、線条対後頭部皮質の比は、約2.5対1であった。この実験において、99mTc O-1508T および99mTc O-1560T(各々ボート形のモノフロロ及びジクロロ化合物)を注射後に撮影した画像は、99mTc O-1508Tの場合、脳内の線条または他のどの領域にも顕著な放射能の蓄積を示し得ず、一方、99mTc O-1560Tの場合は、 O-1505TとO-1561Tにより近い結果を提供した。
【0188】
(MPTPで処理した猿達のSPECT)
アカゲ猿をMPTPで処理してから1ケ月後に、99mTc O-1508Tを注射して猿の脳の(中線条)トランス軸状、矢状および冠状の画像を撮影した。健常な猿と比較し、MPTPで処理後の猿は、蓄積レベルは著しく減少し、線条は周辺構造と区別出来なかった。
【0189】
(猿の脳内のDAT部位に対する99mTc O-1505Tの選択性)
猿の脳のSPECT画像は、線条に99mTc O-1505Tが顕著に蓄積することを示した。初期の画像では、脳の全体にわたって放射能が分散蓄積されていた。注射後数分経過すると、線条へのトレーサの蓄積が激しくなり、全ての他の構造域で放射能レベルが低下した。注射後30分近くになると、脳の線条部と残り部分との間に明確なコントラストが生じた。標識されていないCFTを受容体が飽和する用量を注射後、線条への放射能の蓄積が減少し、注射後60分近くで線条への集中的な蓄積は見られなくなった。
【0190】
(放射線量の計測)
生体内分布を調べた結果、99mTc O-1505Tと99mTc O-1561Tは、両方とも、ラットの全ての細胞から迅速に消え失せた。99mTc O-1505T の場合、MIR線量計算値は、ターゲット器官である膀胱で0.29rem/mCiであった。全体内有効線量の計算値は、0.037rem/mCiであった。
【0191】
これらの結果は、99mTcがラベルされたO-1505TとO-1561Tは、両方とも、DAT部位に対する優れたSPECT配位子であることを示している。これらの放射性薬剤は、有効な診断画像を得るために重要な特徴、即ち、(1)後頭部皮質に対する線条の比率が高く、(2)5-HTトランスポータ(SET)部位に対するDAT部位の選択性が高く、(3)高い比放射性と化学純度で好便に調製出来、(4)好ましい放射線量の計測が出来、(5)99mTcの物理的半減期(t-1/2)に適した線条への局在速度を有している。
【0192】
本発明について、好適な実施例により詳述してきたが、当業者であれば、特許請求範囲に記述した本発明の範囲と精神から逸脱することなく本開示を考慮して本発明に変更および/または改善を加えることが出来ることが理解されよう。
【符号の説明】
【0193】
1…化合物((1R)-2-(メトキシカルボニル)-3-トロピノン)、2…化合物((1R)-2-(メトキシカルボニル)-3-[[(トリフルオロメチル)スルホニル]オキシトロプ-2-エン)、3…化合物((1R)-N-メチル-2-メトキシカルボニル-3-(R)-8-アザビシクロ[3.2.1.]オクト-2-エン)、4…化合物((1R)-N-メチル-2β-メトキシカルボニル-3β-(R)-8-アザビシクロ[3.2.1.]オクタン)、5…化合物(2β-カルボキシ-3β-(R)トロパン)、6…化合物(2β-メトキシメチルカルバモイル-3β-(R)トロパン)、7…化合物(2β-(1-プロパノイル)-3β-(R)トロパン)、8…化合物(2β-(1-プロパノイル)-3β-(R)-ノルトロパン)、9…化合物(N-[2-(3’-N’-プロピル-(1”R)-3”β-(R)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、10,11…化合物(N-[(2-((3’-N’-プロピル-(1”R)-3”β-(R)-トロパン-2”β-1-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)オキサイド)、12…化合物((1R)-N-メチル-2β-メトキシカルボニル-3α-(R)-8-アザビシクロ[3.2.1.]オクタン)、13…化合物(2β-(カルボン酸)-3α-(R)-トロパン)、14…化合物(2β-メトオキシメチルカルバモイル-3α-(R)-トロパン)、15…化合物(2β-(1-プロパノイル)-3α-(R)-トロパン)、16…化合物(2β-(1-プロパノイル)-3α-(R)ノルトロパン)、17…化合物(N-[2-(3’-N’-プロピル-(1”R)-3”α-(R)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、18…化合物(N-[(2-((3’-N’-プロピル-(1”R)-3”α-(R)-トロパン-2”β-1’’’-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド)、19…化合物(N-[(2-((3’-N’-プロピル-(1”R’)-2”β-1-プロパノイル-3”α-(R)-トロパン)-(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]テクネチウム(V)酸化物)、20…化合物(2β-(メトキシメチルカルバモイル-3α-(R)-ノルトロパン)、20A…化合物(2β-(メトキシメチルカルバモイル-3β-(R)-ノルトロパン)、21…化合物(N-[2-(3’-N’-プロピル-(1”R’)-3”α-(R)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、21A…(N-[2-(3’-N’-プロピル-(1”R’)-3”β-(R)-トロパン-2”β-(メトキシメチルカルバモイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、22…化合物(N-[(2-((3’-N’-プロピル-(1”R’)-3”α-(R)-トロパン-2”β-メトキシメチルカルバモイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド)、22A…(N-((2-((3’-N’-プロピル-(1”R’)-3”β-(R)トロパン-2”β-メトキシメチルカルバモイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド)、23…化合物(2β-カルボキシ-3β-(R)トロパン)、24…化合物(2β-メトキシメチルカルバモイル-3β-(R)トロパン)、25…化合物(2β-(1-プロパノイル)-3β-(R)トロパン)、26…化合物((1R)-2-プロパノイル-3-(R)-8-アザビシクロ[3.2.1]-オクト-2-エン)、27…化合物(N-[2-(3’-N’-プロピル-(1”R)-3”β-(R)-トロパン-2”β-(1-プロパノイル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、28…化合物(N-[(2-((3’-N’-プロピル-(1”R)-3”β-(R)-トロパン-2”β-1-プロパノイル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)オキサイド)、29…化合物((1R’)-2-メトキシカルボニル-3-(R)-8-ノルアザビシクロ[3.2.1.]オクト-2-エン)、30…化合物(N-[2-(3’-N’-プロピル-(1”R’)-3”-(R)トロプ-2-エン-2”-(メトキシカルボニル))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、31…化合物(N-[(2-((3’-N’-プロピル-(1”R’)-3”-(R)トロプ-2-エン-2”-(メトキシカルボニル)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタン-チオラート]レニウム(V)酸化物)、32,35…化合物((1R’)-2β-メトキシカルボニル-3α-(R)-8-アザビシクロ[3.2.1]オクタン)、33…化合物(N-[2-(3’-N’-プロピル-(1”R’-3”β-(R)-2”β-メトキシカルボニルトロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-2-アミノエタンチオール)、34…化合物((RS)-N-[2-((3’-N’-プロピル-(1”R’-3”β-(R)-2”β-メトキシメチルカルボニルトロパン))((2-((メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]レニウム(V)酸化物)、36…化合物(N-[2-(3’-N’-プロピル-(1”R’)-3”α-(R)-2’’β-メトキシカルボニルトロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル)-S-(トリフェニル)-2-アミノエタンチオール)、37…化合物(N-[(2-((3’-N’-プロピル-(1”R’)-3”α-(R)-2”β-メトキシカルボニルトロパン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-レニウム(V)酸化物)、38…化合物((1R)-N-メチル-2-ヒドロキシメチル-3-(R)-8-アザビシクロ[3.2.1]オクト-2-エン)、39…化合物((1R)-N-メチル-2-カルボニル-3-(R)-8-アザビシクロ[3.2.1]オクト-2-エン)、40…化合物((1R)-N-メチル-2-(2-ヒドロキシプロピル)-3-(R)-8-アザビシクロ[3.2.1]オクト-2-エン)、41…化合物(N-[(2-((3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3”-(2-ナフチル)-トロプ-2-エン)(2-メルカプトエチル)アミノ)アセチル)-2-アミノエタンチオラート]-レニウム(V)酸化物)、42…化合物((1R)-N-メチル-2β-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン)、43…化合物((1R)-N-メチル-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン)、44…化合物((1R)-2β-2-メトキシカルボニル-3β-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン)、45…化合物((1R)-2β-メトキシカルボニル-3α-(2-ナフチル)-8-アザビシクロ[3.2.1]オクタン)、46…化合物(N-[2-(3’-N’-プロピル-(1”R)-2” β-メトキシカルボニル-3’’β-(2-ナフチル)-トロパン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール)、47…化合物(N-[2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロパン))((2-トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール)、48…化合物(N-[(2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”β-(2-ナフチル)-トロパン)(2-メルカプトエチル)アミノ)アセチル]-2-アミノエタンチオラート]-レニウム(V)酸化物)、49…化合物(N-[(2-(3’-N’-プロピル-(1”R)-2”β-メトキシカルボニル-3”α-(2-ナフチル)-トロパン)(2-メルカプトエチル)アミノ)アセチル]-2-アミノエタンチオラート]-レニウム(V)酸化物)、50…化合物((1R)-N-メチル-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン)、51…化合物(1R)-2-メトキシカルボニル-3-(2-ナフチル)-8-アザビシクロ[3.2.1]オクト-2-エン)、52…化合物(N-[2-(3’-N’-プロピル-(1”R)-2”-メトキシカルボニル-3’’-(2-ナフチル)-トロプ-3-エン))((2-((トリフェニルメチル)チオ)エチル)アミノ)アセチル]-S-(トリフェニル)-2-アミノエタンチオール)。
【特許請求の範囲】
【請求項1】
下記(I)式の構造を有する化合物であって、
【数1】

前記(I)式において、R1は、βであって、かつ、CORaおよびCON(CH3)ORaからなる群から選択されており、R2は、αであって、かつ、X及び/またはYで置換したフェニルまたはナフチルであるC6H4X、C6H3XY、C10H7XおよびC10H6XYより成る群から選択されており、Raは、C1-C5のアルキル基であり、XおよびYは、Ra、H、Br、Cl、I、F、OHおよびOCH3より成る群からそれぞれ選択されており、Lは、-(CH2)n(nは1から6までの整数)、または-(CH2)n-(アリル,アルキル,エテニルまたはエチニル)-(CH2)m(mとnは整数で、nとmとの和は1から6までの整数)であり、Chは、三座または四座キレート配位子、またはテクネチウムまたはレニウムとの前記化合物の中性錯体であることを特徴とする放射性薬品化合物。
【請求項1】
下記(I)式の構造を有する化合物であって、
【数1】

前記(I)式において、R1は、βであって、かつ、CORaおよびCON(CH3)ORaからなる群から選択されており、R2は、αであって、かつ、X及び/またはYで置換したフェニルまたはナフチルであるC6H4X、C6H3XY、C10H7XおよびC10H6XYより成る群から選択されており、Raは、C1-C5のアルキル基であり、XおよびYは、Ra、H、Br、Cl、I、F、OHおよびOCH3より成る群からそれぞれ選択されており、Lは、-(CH2)n(nは1から6までの整数)、または-(CH2)n-(アリル,アルキル,エテニルまたはエチニル)-(CH2)m(mとnは整数で、nとmとの和は1から6までの整数)であり、Chは、三座または四座キレート配位子、またはテクネチウムまたはレニウムとの前記化合物の中性錯体であることを特徴とする放射性薬品化合物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【公開番号】特開2012−67135(P2012−67135A)
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願番号】特願2012−560(P2012−560)
【出願日】平成24年1月5日(2012.1.5)
【分割の表示】特願平11−309599の分割
【原出願日】平成11年10月29日(1999.10.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成11年5月発行の「A SUPPLEMENT TO The Journal of Nuclear Medicine ABSTRACT BOOK」に発表
【出願人】(599154629)プレジデント アンド フェロウズ オブ ハーバードカレッジ (2)
【出願人】(599152876)オーガニクス インコーポレーテッド (1)
【出願人】(599154630)ザ ジェネラル ホスピタル コーポレーション (2)
【Fターム(参考)】
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願日】平成24年1月5日(2012.1.5)
【分割の表示】特願平11−309599の分割
【原出願日】平成11年10月29日(1999.10.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成11年5月発行の「A SUPPLEMENT TO The Journal of Nuclear Medicine ABSTRACT BOOK」に発表
【出願人】(599154629)プレジデント アンド フェロウズ オブ ハーバードカレッジ (2)
【出願人】(599152876)オーガニクス インコーポレーテッド (1)
【出願人】(599154630)ザ ジェネラル ホスピタル コーポレーション (2)
【Fターム(参考)】
[ Back to top ]

