放射線増感剤
【課題】 近年ガンの放射線療法において、腫瘍の増殖に血管の成長が追いつかなくなることから生じる低酸素性ガン細胞が、放射線に対して、常圧酸素性ガン細胞の2〜3倍の抵抗性を示し、これが、治癒率低下、再発の原因になっている。放射線の生物的効果を相乗的に増加させ、しかも蓄積による神経毒性の発現等の副作用のない、安全性の高い細胞放射線増感剤の開発が要望されている。
【解決手段】 鉄化合物を含有してなる放射線増感剤、より詳しくは、例えば塩化鉄、酸化鉄、水酸化鉄及び硫酸鉄等の無機鉄化合物、例えば含糖酸化鉄、クエン酸鉄、グルコン酸鉄、酢酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物等の有機鉄化合物から選択される鉄化合物を含有する放射線増感剤を提供する。
【解決手段】 鉄化合物を含有してなる放射線増感剤、より詳しくは、例えば塩化鉄、酸化鉄、水酸化鉄及び硫酸鉄等の無機鉄化合物、例えば含糖酸化鉄、クエン酸鉄、グルコン酸鉄、酢酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物等の有機鉄化合物から選択される鉄化合物を含有する放射線増感剤を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、悪性腫瘍に対する放射線治療の奏功率を向上させる放射線増感剤に関する。
【背景技術】
【0002】
従来から悪性腫瘍、例えば白血病、リンパ腫、ガン腫、肉腫等に対する治療として外科的療法、化学療法、免疫療法、温熱療法等と共に、放射線療法が行われている。なかでも放射線療法は、多くの悪性腫瘍において高い局所制御率を示しており、有効な治療法として現在使用されている。放射線化学、放射線生物学の最近の進歩にしたがって、放射線抵抗性腫瘍の治療に放射線の作用を増強する薬剤が併用されるようになってきた。ガン放射線治療においては、放射線に対して抵抗性を示す細胞の存在は、放射線治療の奏功率の妨げとなり、ガン再発の原因となっている。
【0003】
放射線療法は、放射線の生物的効果を相乗的に増加させる薬剤の選択に大きく依存しており、近年多くの放射線増感剤の開発についての報告がなされている。例えば、テキサフィリンを用いる放射線増感剤(特許文献1)、クロリンe6を含有する放射線増感剤(特許文献2)、ニトロ−5−デアザフラビン誘導体を含有する放射線増感剤(特許文献3)、2−ニトロイミダゾール誘導体を有効成分とする低酸素性細胞放射線増感剤(特許文献4)、ホウ素化メタロポルフィリンを含有する放射線増感剤(特許文献5)などが報告されている。
【0004】
【特許文献1】特表平09−508616号
【特許文献2】特開平5−194268号
【特許文献3】特開2000−212087号
【特許文献4】特開平6−298739号
【特許文献5】特表2005−504012号
【発明の開示】
【発明が解決しようとする課題】
【0005】
近年ガンの放射線療法において、腫瘍の増殖に血管の成長が追いつかなくなることから生じる低酸素性ガン細胞が、放射線に対して、常圧酸素性ガン細胞の2〜3倍の抵抗性を示し、これが、治癒率低下、再発の原因になっている。放射線の生物的効果を相乗的に増加させ、しかも蓄積による神経毒性の発現等の副作用のない、安全性の高い細胞放射線増感剤の開発が要望されている。
【課題を解決するための手段】
【0006】
本発明者等は、放射線に対する感受性を増大させる作用、即ちガン細胞に対する放射線増感作用が強い薬剤について研究していたところ、意外にもヘム化合物(フェロポルフィリンもしくはフェロフェム、フェリポルフィリンもしくはフェリフェム)がガン細胞に対して親和性の高い放射線増感作用を示すことを見いだした。さらに鉄元素を分子内に有する化合物が、放射線増感作用を示すことを見いだし、本発明者等は、これらの知見に基づき種々検討した結果、本発明を完成するに至った。
【0007】
即ち、本発明は、
(1)鉄化合物を含有してなる放射線増感剤、
(2)鉄化合物が無機鉄化合物、または含糖酸化鉄、クエン酸鉄、酢酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物から選択される有機鉄化合物である上記(1)記載の放射線増感剤、
(3)無機鉄化合物が塩化鉄、酸化鉄、水酸化鉄及び硫酸鉄から選択される上記(2)記載の放射線増感剤、
(4)鉄化合物が含糖酸化鉄、クエン酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物から選択される有機鉄化合物である上記(1)記載の放射線増感剤、
(5)鉄化合物が含糖酸化鉄、コンドロイチン硫酸・鉄コロイド、ポルフィリン鉄錯体またはポルフィリン鉄錯体包接アルブミン化合物である上記(1)記載の放射線増感剤、
(6)ポルフィリン鉄錯体の鉄が2価である上記(4)または(5)記載の放射線増感剤、
(7)ポルフィリン環上にホウ素原子を有する置換基で置換されたフェニル基を有しないポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物である上記(4)または(5)記載の放射線増感剤、
(8)ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物のポルフィリン鉄錯体が非ホウ素化ポルフィリン鉄錯体である上記(4)または(5)記載の放射線増感剤、
(9)鉄化合物がポルフィリン鉄錯体包接アルブミン化合物である上記(1)記載の放射線増感剤、
(10)アルブミンが遺伝子組換えアルブミンである上記(9)記載の放射線増感剤、
(11)上記(1)に記載の放射線増感剤及び化学療法剤を含む薬剤キット、
(12)放射線増感剤と化学療法剤とが個々に包装される上記(11)記載の薬剤キット、及び
(13)化学療法剤を投与後1時間以内に上記(1)に記載の放射線増感剤を投与して放射線照射することを特徴とする上記(11)記載の薬剤キット。
【発明の効果】
【0008】
本発明の放射線増感剤は、安全性が高く、放射線療法に抵抗性を示す低酸素性ガン細胞に対して放射線感受性を増強する効果に優れ、各種悪性腫瘍に対する放射線療法の放射線増感剤として有用である。本発明の放射線増感剤は、電子親和性が高く、しかもガン細胞に対しても親和性の高い優れた薬剤である。
【発明を実施するための最良の形態】
【0009】
放射線増感剤とは、通常細胞レベルの放射線感受性を高めるが、それ自体、制ガン作用のないもので、その薬剤自体は制ガン剤とは称さない。
本発明の放射線増感剤に用いられる鉄化合物としては、分子内に鉄イオン(2価または3価)を有する無機または有機の化合物が挙げられる。
分子内に鉄イオンを有する無機化合物としては、例えば、塩化鉄、臭化鉄、ヨウ化鉄、酸化鉄、水酸化鉄、硫酸鉄、硝酸鉄、黄酸化鉄、黄色三二酸化鉄、黒酸化鉄、三二酸化鉄、錯イオン(例、ハロゲノ、シアノ、チオシアナト、オクサラト等)と鉄イオンとのキレート化合物等が挙げられる。このうち好ましくは、塩化鉄、酸化鉄、水酸化鉄、硫酸鉄である。
【0010】
分子内に鉄(Fe)イオンを有する有機化合物としては、例えば、含糖酸化鉄、クエン酸鉄、酢酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体、ポルフィリン鉄錯体アルブミン包接化合物等が挙げられる。このうち好ましくは、含糖酸化鉄、コンドロイチン硫酸・鉄コロイド、ポルフィリン鉄錯体、ポルフィリン鉄錯体アルブミン包接化合物である。特に好ましくは、ポルフィリン鉄錯体アルブミン包接化合物である。ポルフィリン鉄錯体及びポルフィリン鉄錯体アルブミン包接化合物におけるポルフィリンは、望ましくは非ホウ素化ポルフィリンが用いられる。
【0011】
ポルフィリンの基本骨格である大環状テトラピロール環(本明細書ではポルフィリン環と称することがある)は、下式で示される(ナンバーリング付記)。ポルフィリンとは、4つのピロール環がα位置で4つのメチン基と交互に結合した大環状化合物とその誘導体である。
【0012】
【化1】

ポルフィリン鉄錯体の具体例としては、一般式(1)
【0013】
【化2】

(式中、R1 は1−メチル−1−シクロヘキシル基等の1−(飽和鎖状炭化水素基)−1−脂環式基、R2 は置換基、MはFeイオン、X- はハロゲンイオンを表わし、X- の個数はFeイオンの価数から2を差し引いた数を示す)で表される化合物が挙げられる。
【0014】
上記一般式(1)で表される化合物は、好ましくは、一般式(2)
【0015】
【化3】

(式中の記号は前記と同意義)で表される化合物である。
【0016】
上記一般式(1)において、R2 としては、例えば一般式(3)、
【0017】
【化4】

(式中、R3 はC1 〜C18のアルキル基を示す)で表される基、または一般式(4)、
【0018】
【化5】

(式中、R4 はこれが結合しているイミダゾールの中心金属鉄への配位を阻害しない基、R5 はアルキレン基を示す)で表される基が挙げられる。
【0019】
前記一般式(4)において、R4 は水素、またはC1 〜C3アルキル基が好ましく、R5 はC1 〜C10のアルキレン基が好ましい。
【0020】
一般式(1)で示されるテトラフェニルポルフィリン鉄錯体において、好ましくは、中心金属(M)のFeが2価の状態にあり、かつ塩基が1つ配位した錯体であり、これらは一般式(5)または一般式(6)で示される。
一般式(5)
【0021】
【化6】

(式中、Lは塩基(例えば、イミダール誘導体の窒素系軸配位子等)を、その他の記号は前記と同意義を示す)
一般式(6)
【0022】
【化7】

(式中の記号は、前記と同意義を示す)
【0023】
ポルフィリン鉄錯体としては、一般式(7)で示されるテトラフェニルポルフィリン鉄錯体が特に好ましい。
一般式(7)
【0024】
【化8】

(式中、Mは鉄イオン、R4 はこれが結合しているイミダゾール環内の窒素原子が中心鉄金属への配位を阻害しない基、R5 はアルキレン基を示す)
【0025】
この一般式(7)で示されるポルフィリン鉄錯体の中でも、式(8)で示される、2−[8−(2−メチル−1−イミダゾリル)オクタノイルオキシメチル]−5,10,15,20−テトラキス{[α,α,α,α−o−(1−メチルシクロヘキサノイルアミノ)]フェニル}ポルフィナト鉄錯体が特に好ましい。
式(8)
【0026】
【化9】

(式中、Mは鉄イオンを示す)
さらに、
式(9)
【0027】
【化10】

で表されるポルフィリン鉄錯体、
動植物に存在する公知のポルフィリン誘導体、例えばエチオポルフィリン、メソポルフィリン、プロトポルフィリン、ジューテロポルフィリン、ヘマトポルフィリン、コプロポルフィリン、ウロポルフィリン、テトラベンゾポルフィリン、ジベンゾ〔b,l〕ポルフィリン、シクロペンタ〔at〕ポルフィリンもしくは3H−ベンゾ〔at〕ポルフィリン等との鉄錯体、さらに特開2004−277329号に記載のポルフィリン鉄錯体、特開2004−10495号に記載のポルフィリン鉄錯体、特開平6−271577号に記載のポルフィリン鉄錯体が用いられる。
【0028】
ポルフィリン鉄錯体包接アルブミン化合物、即ち上記したポルフィリン鉄錯体とアルブミンとの包接化合物は、アルブミンによって形成される内部疎水領域内にポルフィリン鉄錯体が包埋・固定・包接されたものである。アルブミン(例えば、ヒト血清アルブミン)1モルに対するポルフィリン鉄錯体の結合数は、通常約1〜8である。アルブミン1モルに包接・結合されたポルフィリン鉄錯体の数は、例えば、スカチャード・プロット(Scatchard plot)(C. J.Halfman ,T. Nishida ,Biochemistry 11巻,3493頁 (1972年)参照)等を作成することにより決定できる。
【0029】
本発明で用いられるポルフィリン鉄錯体は、公知の方法または自体公知の方法、例えば、特開平6−271577号、特開2004−277329号、特開2004−10495号等に記載の製造方法により容易に製造できる。
例えば、一般式(1)で示されるテトラフェニルポルフィリン鉄錯体は、式(8)で示される2−[8−(2−メチル−1−イミダゾリル)オクタノイルオキシメチル]−5,10,15,20−テトラキス{[α,α,α,α−o−(1−メチルシクロヘキサノイルアミノ)]フェニル}ポルフィナト鉄錯体の製造方法(T. Komatsu et al. Bioconjugate Chemistry 13巻,397−402頁 (2002年)に記載の方法)と同様にして製造することができる。
【0030】
ポルフィリン鉄錯体とアルブミンとの包接化合物は、公知の方法(T. Komatsu et al. Bioconjugate Chemistry 13巻,397−402頁 (2002年)に記載)または自体公知の方法にしたがって製造することができる。さらに該包接化合物は、例えば下記の方法により製造することができる。
最初に、ポルフィリン鉄錯体を溶媒(例えば、エタノール)に溶解し、これにアルブミン(例えば、ヒト血清アルブミン)の水溶液(溶媒として、例えば水、リン酸緩衝液(pH5〜9)、生理食塩水、クレーブス−リンガー液等)を加えた後、軽く振盪する。得られた水分散液を限外ろ過(例えば、限外分子量20,000〜40,000の限外ろ過膜を使用)により総量の10%程度まで濃縮した後、再び水、リン酸緩衝液(pH5〜9)、生理食塩水、クレーブス−リンガー液等を加え、分散液中のエタノール濃度が100ppm以下になるまで限外ろ過を行う操作を繰り返すと、ポルフィリン鉄錯体−アルブミン包接化合物が得られる。この分散液は、4〜35℃で数ヵ月間保存後でも沈殿、凝集等は認められず安定である。
【0031】
ポルフィリン鉄錯体は、還元剤(例えば、亜二チオン酸ナトリウム、アスコルビン酸等の水溶液)を添加する等の常法により中心鉄を3価から2価へ還元することができる。
この還元反応は、還元剤の添加によるばかりでなく、パラジウムカーボン/水素ガスによっても行うことができる。例えば、ポルフィリン鉄(3価)錯体を乾燥ジクロロメタン、ベンゼン、トルエン等に溶解し、少量のパラジウムカーボンを添加した後、水素ガスを室温で十分に吹き込むことにより中心鉄を還元することができる。還元後、パラジウムカーボンをろ別し、ろ液を真空乾燥した後用いることができる。この還元反応は、アルブミンによる包接反応の前に行うことが好ましい。
【0032】
本発明に用いるアルブミンは、ヒト血清アルブミン、組換えヒト血清アルブミン、ウシ血清アルブミン等その由来に制限はない。ヒトへの適用を考えた場合、ヒト血清アルブミンまたは遺伝子組換え技術により製造されたヒト血清アルブミン(以下、組換えヒト血清アルブミン)が好ましく、特に組換えヒト血清アルブミンが好ましい。
【0033】
近年、遺伝子組換え技術の発展により、構造・組成及び物理化学的特徴がヒト血清アルブミンと全く同一である高純度の組換えヒト血清アルブミンが開発されてきており(K. Kobayashi et al., Therapeutic Apheresis,2(4)巻, 257−262頁(1998年)参照)、この組換えヒト血清アルブミンに置換ポルフィリン鉄錯体を包接させてなる、ポルフィリン鉄錯体−組換えヒト血清アルブミン包接化合物は、全合成系として提供できるので、工業的規模での製造も比較的容易である。
【0034】
放射線療法では、ガン細胞のDNAを放射線が直接損傷させるだけでなく、ヒドロキシラジカル等の活性酸素種の発生によっても損傷させる。鉄はヒドロキシラジカルを発生させるフェントン反応を触媒するため、この触媒作用が優れた放射線増感作用をもたらす。
本発明製剤で用いられる鉄化合物は、通常の方法で、注射剤、坐剤、錠剤、散剤、顆粒剤、カプセル剤、丸剤、軟膏剤、液剤、貼付剤、バップ剤、エアゾール剤などの種々の剤形にすることができる。注射剤を製造する場合は、適当な溶剤、必要に応じて、pH調整剤、緩衝剤、安定化剤、懸濁剤、溶解補助剤、担体等を添加し、常法により注射剤にすることができる。
【0035】
安定化剤としては、亜硫酸ナトリウム、メタ亜硫酸ナトリウムなどが用いられる。懸濁剤としては、例えば、メチルセルロース、ポリソルベート80、アラビアゴム等が用いられる。溶解補助剤としては、ポリオキシエチレン硬化ヒマシ油、ニコチン酸アミド、ポリオキシエチレンソルビタンモノラウレートなどが用いられる。
【0036】
注射剤は、例えば、鉄化合物を注射用生理食塩水などの水性担体にあらかじめ、溶解、分散、乳化等するか、または注射用の粉末にして、用時に溶解、分散、乳化等することにより製造することができる。
鉄化合物としてポルフィリン鉄錯体包接アルブミン化合物を用いる場合、生理学的に許容される水系媒体、例えば、リン酸系緩衝生理食塩水のような生理食塩水に分散させて用いるのがよい。
【0037】
注射剤の投与方法としては、静脈内投与、動脈内投与、門脈内投与、筋肉内投与、腹腔内投与、皮下投与、病巣内直接投与等が挙げられる。
錠剤、散剤、顆粒剤、カプセル剤、丸剤、坐剤等の固形製剤、またはシロップ剤等の液剤は、鉄化合物に賦形剤、結合剤、崩壊剤、滑沢剤、着色剤、矯味剤、矯臭剤、増量剤、被覆剤等を加え、常法に従い製造することができる。例えば、鉄化合物としてポルフィリン鉄錯体を用いる場合、常法に従い錠剤、散剤、顆粒剤、カプセル剤、丸剤、シロップ剤に製剤化し、経口投与してもよい。
軟膏剤、液剤、貼付剤、バップ剤、エアゾール剤は、鉄化合物と適当な担体とから、常法により製造することができ、外用剤として病巣部に直接適用してもよい。本発明の放射線増感剤は、1種または2種以上適宜組み合わせて用いてもよい。
【0038】
鉄化合物を含有する放射線増感剤を用いる放射線治療は、通常、化学療法剤でガン細胞を減少させてから用いられる。このため本発明の放射線増感剤は、化学療法剤とキット型の組み合わせ製剤になっていてもよい。キット型の組み合わせ製剤の場合、両方とも非経口投与製剤でもよく、一方が非経口投与製剤で、もう一方が経口投与製剤でもよく、また両方とも経口投与製剤でもよい。
化学療法剤としては、ガン治療のため一般に用いられている抗ガン剤、例えば、シクロフォスアミド,イホスファミド,メルファラン等の抗ガン性アルキル化剤、メトトレキサート,ゲムシタビン,5−フルオロウラシル(5−FU)等の抗ガン性代謝拮抗物質、アクチノマイシンD(ダクチノマイシン),ドキソルビシン(アドリアマイシン),ダウノルビシン(ダウノマイシン),エピルビシン等の抗ガン性抗生物質、ビンクリスチン,エトポシド,ドセタキセル,パクリタキセル等の植物由来抗ガン剤、カンプトテシン等の抗ガン性カンプトテシン誘導体、シスプラチン,カルボプラチン,オキサリプラチン等の抗ガン性白金化合物、ゲフィチニブ等の抗ガン性チロシンキナーゼ阻害剤、クレスチン,ピシバニール等の生物学的応答調節剤(Biological Response Modifier)等が用いられる。これらの抗ガン剤は、公知の方法にしたがって投与することができるが、ゲムシタビン、パクリタキセル、カルボプラチン等放射線増感作用をも有する薬剤の投与に際して、本発明の放射線増感剤の投与量を適宜減らして投与することができる。
【0039】
本発明の放射線増感剤の投与量は、患者の年齢、体重、性別、投与方法、症状によって異なるが、通常成人1人1日あたり、鉄として非経口投与で1〜150mg、経口投与で10〜250mgが適当である。通常本発明の放射線増感剤の投与後12時間以内に放射線照射するが、1時間以内に放射線照射を受けるのがより望ましい。
静脈注射用コンドロイチン硫酸・鉄コロイドのマウス単回静脈内投与によるLD50値は、鉄として250mg/kg以上(藤本等、薬学雑誌 87巻,677−681頁 (1967年))であり安全域は高い。
【0040】
以下に、実施例を示して、本発明をさらに具体的に説明する。
実施例では、ポルフィリン鉄錯体−アルブミン包接化合物、含糖酸化鉄及びコンドロイチン硫酸・鉄コロイドは、鉄として1.7mg/kgの動脈内投与で放射線増感作用を調べた。
【実施例】
【0041】
以下の実施例で用いる、2−[8−(2−メチル−1−イミダゾリル)オクタノイルオキシメチル]−5,10,15,20−テトラキス{[α,α,α,α−o−(1−メチルシクロヘキサノイルアミノ)]フェニル}ポルフィナト鉄錯体は、T. Komatsu et al. Bioconjugate Chemistry 13巻, 397−402頁 (2002年)に記載の方法により製造した。
【0042】
製造例1 ポルフィリン鉄錯体のアルブミン包接体の製造
一酸化炭素雰囲気下で、2−[8−(2−メチル−1−イミダゾリル)オクタノイルオキシメチル]−5,10,15,20−テトラキス{[α,α,α,α−o−(1−メチルシクロヘキサノイルアミノ)]フェニル}ポルフィナト鉄錯体1.07mmolのエタノール溶液1.5Lに0.6MのL−アスコルビン酸水溶液1.5Lを添加して還元し、この液を組換えヒト血清アルブミン(以下rHSA)0.27mmolを含有するリン酸緩衝水溶液(pH7.4、1/30mM)6.5Lに加え、撹拌した。その混合液にリン酸緩衝水溶液(pH7.4、1/30mM)60Lを加えながら、限外ろ過装置(ミリポア製限外濾過膜:限外分子量30,000)を用いて定容量限外ろ過透析を行い、混合液中に含まれるエタノールを除去した。この混合液を300mLに濃縮後、rHSA濃度が終濃度0.75mM(5w/v%)となるようにリン酸緩衝水溶液(pH7.4、1/30mM)を用いて調製し、所望のポルフィリン鉄錯体−アルブミン包接化合物の分散液(以下、rHSA−FecycPと略する)を得た。
rHSA−FecycPを酸素ガス(100%)通気下に、500Wハロゲンランプを用いて20分間光照射し、酸素化したものを実験例1で使用した。なお、rHSAは(株)バイファ社製(25%製剤)を用いた。
【0043】
実験例1
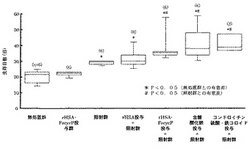
(方法)Donryu系ラットの腹腔内で継代培養した腫瘍細胞(Ascites hepatoma LY80)を、同系統のラットの右大腿筋膜直下に、約1.0×106細胞移植した。腫瘍移植6日後、5%(w/v%、以下同様)rHSA、rHSA−FecycP、含糖酸化鉄溶液あるいはコンドロイチン硫酸・鉄コロイド溶液を総腸骨動脈内に10mL/kg投与した(1群6匹、但しコンドロイチン硫酸・鉄コロイド溶液は1群3匹)。なおrHSA−FecycP、含糖酸化鉄溶液およびコンドロイチン硫酸・鉄コロイド溶液はそれぞれ鉄濃度として3mMに調製した。投与後、速やかに、腫瘍移植部位にX線20Gyを照射した。また比較のためX線を照射しない無処置群およびrHSA−FecycP投与群を設けた(1群6匹)。
腫瘍移植日を0日とし、最大60日後まで生死を観察した。各群の生存日数は箱ヒゲ図で表し、有意差検定はLogrank検定(有意水準5%)を実施した。
なお、rHSAは、(株)バイファ社製(25%製剤)、含糖酸化鉄は、フェジン〔商品名、日本医薬品工業(株)(現在日医工(株)と改名)製〕、コンドロイチン硫酸・鉄コロイドは、ブルタール〔商品名、大日本製薬(株)(現在大日本住友製薬(株)と改名)製〕を用いた。
(結果)
得られた結果を図1に示す。
また、腫瘍移植後6、7、9、12、15、20、25、32、39、46、53および60日に腫瘍長径および短径を計測し、以下の式に従い腫瘍重量を算出した。
腫瘍重量(g)= 長径(mm)×〈短径(mm)〉2÷2÷1000
各群の腫瘍重量は平均値±標準偏差で表し、有意差検定はTukey−Kramerの多重比較検定(有意水準5%)を実施した。得られた結果を図2に示す。
【0044】
無処置群の生存日数の中央値は21.5日であった。無処置群と比較しrHSA−FecycP投与群(照射なし)では生存日数は延長しなかったが、X線を照射した全ての群で生存日数が有意に延長した。また照射群と比較しrHSA投与+照射群では生存日数は延長しなかったが、rHSA−FecycP投与+照射群、含糖酸化鉄投与+照射群およびコンドロイチン硫酸・鉄コロイド溶液投与+照射群では生存日数がさらに有意に延長した。なおrHSA−FecycP投与+照射群および含糖酸化鉄投与+照射群では移植60日後も、それぞれ1例および2例が生存していた。
腫瘍重量は、無処置群では経日的に増加し、rHSA−FecycP投与群(照射なし)も無処置群と同様な推移を示した。一方、X線を照射した群では、無処置群と比較し腫瘍重量は有意に減少した。照射群に比べてrHSA投与+照射群では差はみられなかったが、rHSA−FecycP投与+照射群、含糖酸化鉄投与+照射群およびコンドロイチン硫酸・鉄コロイド溶液投与+照射群では、腫瘍重量を有意に低下させた。なおrHSA−FecycP投与+照射群および含糖酸化鉄投与+照射群において、移植60日後も生存している例では、移植12〜20日後に腫瘍の消失が認められた。
【0045】
以上のことから、rHSA−FecycPは単独では抗腫瘍効果を示さないが、X線と併用することにより、X線照射による延命及び腫瘍縮小効果を増強させることが明らかとなった。また、この効果は同濃度の鉄を含む、含糖酸化鉄及びコンドロイチン硫酸・鉄コロイドでも同様に認められたことから、化学構造式内で共通する鉄が増強に関与していることが判明し、鉄含有化合物は放射線増強剤として有用であることは明らかである。
【0046】
製造例2 ポルフィリン鉄錯体のアルブミン包接体のメト化(Fe2+→Fe3+)
rHSA−FecycPを酸素ガス(100%)通気下、500Wハロゲンランプを用いて20分間光照射し、酸素化した後、37℃で約5日間保温し、自動酸化によりメト化(Fe2+→Fe3+、Emil L. Smith等、生化学・第7版〔II〕−哺乳動物の生化学−668〜689頁、廣川書店、東京(1990年)参照)したrHSA−FecycPを得た(以下、Met−rHSA−FecycPと略する)。なお、rHSA−FecycPのメト化は、吸収極大波長λmax539.0nmにおける吸光度の減少で確認した。
【0047】
実験例2
(方法)Donryu系ラットの腹腔内で継代培養した腫瘍細胞(Ascites hepatoma LY80)を、同系統のラットの右大腿筋膜直下に、約1.0×106細胞移植した。腫瘍移植6日後、5%rHSAあるいはMet−rHSA−FecycPを総腸骨動脈内に10mL/kg投与した(1群6匹)。なおMet−rHSA−FecycPは鉄濃度として3mMに調製した。投与後、速やかに、腫瘍移植部位にX線20Gyを照射した。また比較のためX線を照射しない無処置群およびMet−rHSA−FecycP投与群を設けた(1群6匹)。
腫瘍移植日を0日とし、腫瘍移植6、7、9、12、15、20、25、32、39、46、53および60日後の腫瘍長径および短径を計測し、以下の式に従い腫瘍重量を算出した。
腫瘍重量(g)= 長径(mm)×〈短径(mm)〉2÷2÷1000
各群の腫瘍重量は平均値±標準偏差で表し、有意差検定はTukey−Kramerの多重比較検定(有意水準5%)を実施した。得られた結果を図3に示す。
【0048】
腫瘍重量は、無処置群では経日的に増加し、Met−rHSA−FecycP投与群(照射なし)では無処置群とほぼ同様な推移がみられた。一方、X線を照射した群では、腫瘍重量は有意に減少した。rHSA+照射群と比べてMet−rHSA−FecycP投与+照射群では腫瘍重量を有意に低下させた。なおMet−rHSA−FecycP投与+照射群において、移植60日後も1例が生存していた。この生存例では、移植15日後に腫瘍が消失していた。従って、Met−rHSA−FecycPには、腫瘍組織のX線照射による腫瘍縮小効果を増強させることが明らかとなった。
【0049】
以上のことから、Met−rHSA−FecycPにもX線と併用することにより、同濃度の鉄を含むrHSA−FecycPおよび含糖酸化鉄と同じく、X線照射による腫瘍縮小効果を増強させることが認められたことから、化学構造式内の鉄が2価(rHSA−FecycPの鉄の価数)あるいは3価(含糖酸化鉄およびMet−rHSA−FecycPの鉄の価数)に関係なく放射線感受性増強作用があることが判明し、鉄含有化合物は放射線増強剤として有用であることは明らかである。
【産業上の利用可能性】
【0050】
本発明の放射線増感剤は、高い放射線増感効果を示し、毒性も低く安定である。ガン化学療法における放射線増感剤として有用である。
【図面の簡単な説明】
【0051】
【図1】(1)rHSA−FecycPとX線との併用、(2)含糖酸化鉄とX線との併用、(3)コンドロイチン硫酸・鉄コロイドとX線との併用と、対照として(4)無処置、(5)rHSA−FecycP単独投与のみ、(6)X線照射のみ、(7)rHSA投与とX線との併用の場合のラットの生存日数を比較した図である。
【図2】(1)rHSA−FecycPとX線との併用、(2)含糖酸化鉄とX線との併用、(3)コンドロイチン硫酸・鉄コロイドとX線との併用と、対照として(4)無処置、(5)rHSA−FecycP単独投与のみ、(6)X線照射のみ、(7)rHSA投与とX線との併用の場合のラットの腫瘍重量の縮小効果を比較した図である。
【図3】(1)Met−rHSA−FecycPとX線との併用、対照として(2)無処置、(3)Met−rHSA−FecycP単独投与のみ、(4)rHSA投与とX線との併用の場合のラットの腫瘍重量の縮小効果を比較した図である。
【技術分野】
【0001】
本発明は、悪性腫瘍に対する放射線治療の奏功率を向上させる放射線増感剤に関する。
【背景技術】
【0002】
従来から悪性腫瘍、例えば白血病、リンパ腫、ガン腫、肉腫等に対する治療として外科的療法、化学療法、免疫療法、温熱療法等と共に、放射線療法が行われている。なかでも放射線療法は、多くの悪性腫瘍において高い局所制御率を示しており、有効な治療法として現在使用されている。放射線化学、放射線生物学の最近の進歩にしたがって、放射線抵抗性腫瘍の治療に放射線の作用を増強する薬剤が併用されるようになってきた。ガン放射線治療においては、放射線に対して抵抗性を示す細胞の存在は、放射線治療の奏功率の妨げとなり、ガン再発の原因となっている。
【0003】
放射線療法は、放射線の生物的効果を相乗的に増加させる薬剤の選択に大きく依存しており、近年多くの放射線増感剤の開発についての報告がなされている。例えば、テキサフィリンを用いる放射線増感剤(特許文献1)、クロリンe6を含有する放射線増感剤(特許文献2)、ニトロ−5−デアザフラビン誘導体を含有する放射線増感剤(特許文献3)、2−ニトロイミダゾール誘導体を有効成分とする低酸素性細胞放射線増感剤(特許文献4)、ホウ素化メタロポルフィリンを含有する放射線増感剤(特許文献5)などが報告されている。
【0004】
【特許文献1】特表平09−508616号
【特許文献2】特開平5−194268号
【特許文献3】特開2000−212087号
【特許文献4】特開平6−298739号
【特許文献5】特表2005−504012号
【発明の開示】
【発明が解決しようとする課題】
【0005】
近年ガンの放射線療法において、腫瘍の増殖に血管の成長が追いつかなくなることから生じる低酸素性ガン細胞が、放射線に対して、常圧酸素性ガン細胞の2〜3倍の抵抗性を示し、これが、治癒率低下、再発の原因になっている。放射線の生物的効果を相乗的に増加させ、しかも蓄積による神経毒性の発現等の副作用のない、安全性の高い細胞放射線増感剤の開発が要望されている。
【課題を解決するための手段】
【0006】
本発明者等は、放射線に対する感受性を増大させる作用、即ちガン細胞に対する放射線増感作用が強い薬剤について研究していたところ、意外にもヘム化合物(フェロポルフィリンもしくはフェロフェム、フェリポルフィリンもしくはフェリフェム)がガン細胞に対して親和性の高い放射線増感作用を示すことを見いだした。さらに鉄元素を分子内に有する化合物が、放射線増感作用を示すことを見いだし、本発明者等は、これらの知見に基づき種々検討した結果、本発明を完成するに至った。
【0007】
即ち、本発明は、
(1)鉄化合物を含有してなる放射線増感剤、
(2)鉄化合物が無機鉄化合物、または含糖酸化鉄、クエン酸鉄、酢酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物から選択される有機鉄化合物である上記(1)記載の放射線増感剤、
(3)無機鉄化合物が塩化鉄、酸化鉄、水酸化鉄及び硫酸鉄から選択される上記(2)記載の放射線増感剤、
(4)鉄化合物が含糖酸化鉄、クエン酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物から選択される有機鉄化合物である上記(1)記載の放射線増感剤、
(5)鉄化合物が含糖酸化鉄、コンドロイチン硫酸・鉄コロイド、ポルフィリン鉄錯体またはポルフィリン鉄錯体包接アルブミン化合物である上記(1)記載の放射線増感剤、
(6)ポルフィリン鉄錯体の鉄が2価である上記(4)または(5)記載の放射線増感剤、
(7)ポルフィリン環上にホウ素原子を有する置換基で置換されたフェニル基を有しないポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物である上記(4)または(5)記載の放射線増感剤、
(8)ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物のポルフィリン鉄錯体が非ホウ素化ポルフィリン鉄錯体である上記(4)または(5)記載の放射線増感剤、
(9)鉄化合物がポルフィリン鉄錯体包接アルブミン化合物である上記(1)記載の放射線増感剤、
(10)アルブミンが遺伝子組換えアルブミンである上記(9)記載の放射線増感剤、
(11)上記(1)に記載の放射線増感剤及び化学療法剤を含む薬剤キット、
(12)放射線増感剤と化学療法剤とが個々に包装される上記(11)記載の薬剤キット、及び
(13)化学療法剤を投与後1時間以内に上記(1)に記載の放射線増感剤を投与して放射線照射することを特徴とする上記(11)記載の薬剤キット。
【発明の効果】
【0008】
本発明の放射線増感剤は、安全性が高く、放射線療法に抵抗性を示す低酸素性ガン細胞に対して放射線感受性を増強する効果に優れ、各種悪性腫瘍に対する放射線療法の放射線増感剤として有用である。本発明の放射線増感剤は、電子親和性が高く、しかもガン細胞に対しても親和性の高い優れた薬剤である。
【発明を実施するための最良の形態】
【0009】
放射線増感剤とは、通常細胞レベルの放射線感受性を高めるが、それ自体、制ガン作用のないもので、その薬剤自体は制ガン剤とは称さない。
本発明の放射線増感剤に用いられる鉄化合物としては、分子内に鉄イオン(2価または3価)を有する無機または有機の化合物が挙げられる。
分子内に鉄イオンを有する無機化合物としては、例えば、塩化鉄、臭化鉄、ヨウ化鉄、酸化鉄、水酸化鉄、硫酸鉄、硝酸鉄、黄酸化鉄、黄色三二酸化鉄、黒酸化鉄、三二酸化鉄、錯イオン(例、ハロゲノ、シアノ、チオシアナト、オクサラト等)と鉄イオンとのキレート化合物等が挙げられる。このうち好ましくは、塩化鉄、酸化鉄、水酸化鉄、硫酸鉄である。
【0010】
分子内に鉄(Fe)イオンを有する有機化合物としては、例えば、含糖酸化鉄、クエン酸鉄、酢酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体、ポルフィリン鉄錯体アルブミン包接化合物等が挙げられる。このうち好ましくは、含糖酸化鉄、コンドロイチン硫酸・鉄コロイド、ポルフィリン鉄錯体、ポルフィリン鉄錯体アルブミン包接化合物である。特に好ましくは、ポルフィリン鉄錯体アルブミン包接化合物である。ポルフィリン鉄錯体及びポルフィリン鉄錯体アルブミン包接化合物におけるポルフィリンは、望ましくは非ホウ素化ポルフィリンが用いられる。
【0011】
ポルフィリンの基本骨格である大環状テトラピロール環(本明細書ではポルフィリン環と称することがある)は、下式で示される(ナンバーリング付記)。ポルフィリンとは、4つのピロール環がα位置で4つのメチン基と交互に結合した大環状化合物とその誘導体である。
【0012】
【化1】

ポルフィリン鉄錯体の具体例としては、一般式(1)
【0013】
【化2】

(式中、R1 は1−メチル−1−シクロヘキシル基等の1−(飽和鎖状炭化水素基)−1−脂環式基、R2 は置換基、MはFeイオン、X- はハロゲンイオンを表わし、X- の個数はFeイオンの価数から2を差し引いた数を示す)で表される化合物が挙げられる。
【0014】
上記一般式(1)で表される化合物は、好ましくは、一般式(2)
【0015】
【化3】

(式中の記号は前記と同意義)で表される化合物である。
【0016】
上記一般式(1)において、R2 としては、例えば一般式(3)、
【0017】
【化4】

(式中、R3 はC1 〜C18のアルキル基を示す)で表される基、または一般式(4)、
【0018】
【化5】

(式中、R4 はこれが結合しているイミダゾールの中心金属鉄への配位を阻害しない基、R5 はアルキレン基を示す)で表される基が挙げられる。
【0019】
前記一般式(4)において、R4 は水素、またはC1 〜C3アルキル基が好ましく、R5 はC1 〜C10のアルキレン基が好ましい。
【0020】
一般式(1)で示されるテトラフェニルポルフィリン鉄錯体において、好ましくは、中心金属(M)のFeが2価の状態にあり、かつ塩基が1つ配位した錯体であり、これらは一般式(5)または一般式(6)で示される。
一般式(5)
【0021】
【化6】

(式中、Lは塩基(例えば、イミダール誘導体の窒素系軸配位子等)を、その他の記号は前記と同意義を示す)
一般式(6)
【0022】
【化7】

(式中の記号は、前記と同意義を示す)
【0023】
ポルフィリン鉄錯体としては、一般式(7)で示されるテトラフェニルポルフィリン鉄錯体が特に好ましい。
一般式(7)
【0024】
【化8】

(式中、Mは鉄イオン、R4 はこれが結合しているイミダゾール環内の窒素原子が中心鉄金属への配位を阻害しない基、R5 はアルキレン基を示す)
【0025】
この一般式(7)で示されるポルフィリン鉄錯体の中でも、式(8)で示される、2−[8−(2−メチル−1−イミダゾリル)オクタノイルオキシメチル]−5,10,15,20−テトラキス{[α,α,α,α−o−(1−メチルシクロヘキサノイルアミノ)]フェニル}ポルフィナト鉄錯体が特に好ましい。
式(8)
【0026】
【化9】

(式中、Mは鉄イオンを示す)
さらに、
式(9)
【0027】
【化10】

で表されるポルフィリン鉄錯体、
動植物に存在する公知のポルフィリン誘導体、例えばエチオポルフィリン、メソポルフィリン、プロトポルフィリン、ジューテロポルフィリン、ヘマトポルフィリン、コプロポルフィリン、ウロポルフィリン、テトラベンゾポルフィリン、ジベンゾ〔b,l〕ポルフィリン、シクロペンタ〔at〕ポルフィリンもしくは3H−ベンゾ〔at〕ポルフィリン等との鉄錯体、さらに特開2004−277329号に記載のポルフィリン鉄錯体、特開2004−10495号に記載のポルフィリン鉄錯体、特開平6−271577号に記載のポルフィリン鉄錯体が用いられる。
【0028】
ポルフィリン鉄錯体包接アルブミン化合物、即ち上記したポルフィリン鉄錯体とアルブミンとの包接化合物は、アルブミンによって形成される内部疎水領域内にポルフィリン鉄錯体が包埋・固定・包接されたものである。アルブミン(例えば、ヒト血清アルブミン)1モルに対するポルフィリン鉄錯体の結合数は、通常約1〜8である。アルブミン1モルに包接・結合されたポルフィリン鉄錯体の数は、例えば、スカチャード・プロット(Scatchard plot)(C. J.Halfman ,T. Nishida ,Biochemistry 11巻,3493頁 (1972年)参照)等を作成することにより決定できる。
【0029】
本発明で用いられるポルフィリン鉄錯体は、公知の方法または自体公知の方法、例えば、特開平6−271577号、特開2004−277329号、特開2004−10495号等に記載の製造方法により容易に製造できる。
例えば、一般式(1)で示されるテトラフェニルポルフィリン鉄錯体は、式(8)で示される2−[8−(2−メチル−1−イミダゾリル)オクタノイルオキシメチル]−5,10,15,20−テトラキス{[α,α,α,α−o−(1−メチルシクロヘキサノイルアミノ)]フェニル}ポルフィナト鉄錯体の製造方法(T. Komatsu et al. Bioconjugate Chemistry 13巻,397−402頁 (2002年)に記載の方法)と同様にして製造することができる。
【0030】
ポルフィリン鉄錯体とアルブミンとの包接化合物は、公知の方法(T. Komatsu et al. Bioconjugate Chemistry 13巻,397−402頁 (2002年)に記載)または自体公知の方法にしたがって製造することができる。さらに該包接化合物は、例えば下記の方法により製造することができる。
最初に、ポルフィリン鉄錯体を溶媒(例えば、エタノール)に溶解し、これにアルブミン(例えば、ヒト血清アルブミン)の水溶液(溶媒として、例えば水、リン酸緩衝液(pH5〜9)、生理食塩水、クレーブス−リンガー液等)を加えた後、軽く振盪する。得られた水分散液を限外ろ過(例えば、限外分子量20,000〜40,000の限外ろ過膜を使用)により総量の10%程度まで濃縮した後、再び水、リン酸緩衝液(pH5〜9)、生理食塩水、クレーブス−リンガー液等を加え、分散液中のエタノール濃度が100ppm以下になるまで限外ろ過を行う操作を繰り返すと、ポルフィリン鉄錯体−アルブミン包接化合物が得られる。この分散液は、4〜35℃で数ヵ月間保存後でも沈殿、凝集等は認められず安定である。
【0031】
ポルフィリン鉄錯体は、還元剤(例えば、亜二チオン酸ナトリウム、アスコルビン酸等の水溶液)を添加する等の常法により中心鉄を3価から2価へ還元することができる。
この還元反応は、還元剤の添加によるばかりでなく、パラジウムカーボン/水素ガスによっても行うことができる。例えば、ポルフィリン鉄(3価)錯体を乾燥ジクロロメタン、ベンゼン、トルエン等に溶解し、少量のパラジウムカーボンを添加した後、水素ガスを室温で十分に吹き込むことにより中心鉄を還元することができる。還元後、パラジウムカーボンをろ別し、ろ液を真空乾燥した後用いることができる。この還元反応は、アルブミンによる包接反応の前に行うことが好ましい。
【0032】
本発明に用いるアルブミンは、ヒト血清アルブミン、組換えヒト血清アルブミン、ウシ血清アルブミン等その由来に制限はない。ヒトへの適用を考えた場合、ヒト血清アルブミンまたは遺伝子組換え技術により製造されたヒト血清アルブミン(以下、組換えヒト血清アルブミン)が好ましく、特に組換えヒト血清アルブミンが好ましい。
【0033】
近年、遺伝子組換え技術の発展により、構造・組成及び物理化学的特徴がヒト血清アルブミンと全く同一である高純度の組換えヒト血清アルブミンが開発されてきており(K. Kobayashi et al., Therapeutic Apheresis,2(4)巻, 257−262頁(1998年)参照)、この組換えヒト血清アルブミンに置換ポルフィリン鉄錯体を包接させてなる、ポルフィリン鉄錯体−組換えヒト血清アルブミン包接化合物は、全合成系として提供できるので、工業的規模での製造も比較的容易である。
【0034】
放射線療法では、ガン細胞のDNAを放射線が直接損傷させるだけでなく、ヒドロキシラジカル等の活性酸素種の発生によっても損傷させる。鉄はヒドロキシラジカルを発生させるフェントン反応を触媒するため、この触媒作用が優れた放射線増感作用をもたらす。
本発明製剤で用いられる鉄化合物は、通常の方法で、注射剤、坐剤、錠剤、散剤、顆粒剤、カプセル剤、丸剤、軟膏剤、液剤、貼付剤、バップ剤、エアゾール剤などの種々の剤形にすることができる。注射剤を製造する場合は、適当な溶剤、必要に応じて、pH調整剤、緩衝剤、安定化剤、懸濁剤、溶解補助剤、担体等を添加し、常法により注射剤にすることができる。
【0035】
安定化剤としては、亜硫酸ナトリウム、メタ亜硫酸ナトリウムなどが用いられる。懸濁剤としては、例えば、メチルセルロース、ポリソルベート80、アラビアゴム等が用いられる。溶解補助剤としては、ポリオキシエチレン硬化ヒマシ油、ニコチン酸アミド、ポリオキシエチレンソルビタンモノラウレートなどが用いられる。
【0036】
注射剤は、例えば、鉄化合物を注射用生理食塩水などの水性担体にあらかじめ、溶解、分散、乳化等するか、または注射用の粉末にして、用時に溶解、分散、乳化等することにより製造することができる。
鉄化合物としてポルフィリン鉄錯体包接アルブミン化合物を用いる場合、生理学的に許容される水系媒体、例えば、リン酸系緩衝生理食塩水のような生理食塩水に分散させて用いるのがよい。
【0037】
注射剤の投与方法としては、静脈内投与、動脈内投与、門脈内投与、筋肉内投与、腹腔内投与、皮下投与、病巣内直接投与等が挙げられる。
錠剤、散剤、顆粒剤、カプセル剤、丸剤、坐剤等の固形製剤、またはシロップ剤等の液剤は、鉄化合物に賦形剤、結合剤、崩壊剤、滑沢剤、着色剤、矯味剤、矯臭剤、増量剤、被覆剤等を加え、常法に従い製造することができる。例えば、鉄化合物としてポルフィリン鉄錯体を用いる場合、常法に従い錠剤、散剤、顆粒剤、カプセル剤、丸剤、シロップ剤に製剤化し、経口投与してもよい。
軟膏剤、液剤、貼付剤、バップ剤、エアゾール剤は、鉄化合物と適当な担体とから、常法により製造することができ、外用剤として病巣部に直接適用してもよい。本発明の放射線増感剤は、1種または2種以上適宜組み合わせて用いてもよい。
【0038】
鉄化合物を含有する放射線増感剤を用いる放射線治療は、通常、化学療法剤でガン細胞を減少させてから用いられる。このため本発明の放射線増感剤は、化学療法剤とキット型の組み合わせ製剤になっていてもよい。キット型の組み合わせ製剤の場合、両方とも非経口投与製剤でもよく、一方が非経口投与製剤で、もう一方が経口投与製剤でもよく、また両方とも経口投与製剤でもよい。
化学療法剤としては、ガン治療のため一般に用いられている抗ガン剤、例えば、シクロフォスアミド,イホスファミド,メルファラン等の抗ガン性アルキル化剤、メトトレキサート,ゲムシタビン,5−フルオロウラシル(5−FU)等の抗ガン性代謝拮抗物質、アクチノマイシンD(ダクチノマイシン),ドキソルビシン(アドリアマイシン),ダウノルビシン(ダウノマイシン),エピルビシン等の抗ガン性抗生物質、ビンクリスチン,エトポシド,ドセタキセル,パクリタキセル等の植物由来抗ガン剤、カンプトテシン等の抗ガン性カンプトテシン誘導体、シスプラチン,カルボプラチン,オキサリプラチン等の抗ガン性白金化合物、ゲフィチニブ等の抗ガン性チロシンキナーゼ阻害剤、クレスチン,ピシバニール等の生物学的応答調節剤(Biological Response Modifier)等が用いられる。これらの抗ガン剤は、公知の方法にしたがって投与することができるが、ゲムシタビン、パクリタキセル、カルボプラチン等放射線増感作用をも有する薬剤の投与に際して、本発明の放射線増感剤の投与量を適宜減らして投与することができる。
【0039】
本発明の放射線増感剤の投与量は、患者の年齢、体重、性別、投与方法、症状によって異なるが、通常成人1人1日あたり、鉄として非経口投与で1〜150mg、経口投与で10〜250mgが適当である。通常本発明の放射線増感剤の投与後12時間以内に放射線照射するが、1時間以内に放射線照射を受けるのがより望ましい。
静脈注射用コンドロイチン硫酸・鉄コロイドのマウス単回静脈内投与によるLD50値は、鉄として250mg/kg以上(藤本等、薬学雑誌 87巻,677−681頁 (1967年))であり安全域は高い。
【0040】
以下に、実施例を示して、本発明をさらに具体的に説明する。
実施例では、ポルフィリン鉄錯体−アルブミン包接化合物、含糖酸化鉄及びコンドロイチン硫酸・鉄コロイドは、鉄として1.7mg/kgの動脈内投与で放射線増感作用を調べた。
【実施例】
【0041】
以下の実施例で用いる、2−[8−(2−メチル−1−イミダゾリル)オクタノイルオキシメチル]−5,10,15,20−テトラキス{[α,α,α,α−o−(1−メチルシクロヘキサノイルアミノ)]フェニル}ポルフィナト鉄錯体は、T. Komatsu et al. Bioconjugate Chemistry 13巻, 397−402頁 (2002年)に記載の方法により製造した。
【0042】
製造例1 ポルフィリン鉄錯体のアルブミン包接体の製造
一酸化炭素雰囲気下で、2−[8−(2−メチル−1−イミダゾリル)オクタノイルオキシメチル]−5,10,15,20−テトラキス{[α,α,α,α−o−(1−メチルシクロヘキサノイルアミノ)]フェニル}ポルフィナト鉄錯体1.07mmolのエタノール溶液1.5Lに0.6MのL−アスコルビン酸水溶液1.5Lを添加して還元し、この液を組換えヒト血清アルブミン(以下rHSA)0.27mmolを含有するリン酸緩衝水溶液(pH7.4、1/30mM)6.5Lに加え、撹拌した。その混合液にリン酸緩衝水溶液(pH7.4、1/30mM)60Lを加えながら、限外ろ過装置(ミリポア製限外濾過膜:限外分子量30,000)を用いて定容量限外ろ過透析を行い、混合液中に含まれるエタノールを除去した。この混合液を300mLに濃縮後、rHSA濃度が終濃度0.75mM(5w/v%)となるようにリン酸緩衝水溶液(pH7.4、1/30mM)を用いて調製し、所望のポルフィリン鉄錯体−アルブミン包接化合物の分散液(以下、rHSA−FecycPと略する)を得た。
rHSA−FecycPを酸素ガス(100%)通気下に、500Wハロゲンランプを用いて20分間光照射し、酸素化したものを実験例1で使用した。なお、rHSAは(株)バイファ社製(25%製剤)を用いた。
【0043】
実験例1
(方法)Donryu系ラットの腹腔内で継代培養した腫瘍細胞(Ascites hepatoma LY80)を、同系統のラットの右大腿筋膜直下に、約1.0×106細胞移植した。腫瘍移植6日後、5%(w/v%、以下同様)rHSA、rHSA−FecycP、含糖酸化鉄溶液あるいはコンドロイチン硫酸・鉄コロイド溶液を総腸骨動脈内に10mL/kg投与した(1群6匹、但しコンドロイチン硫酸・鉄コロイド溶液は1群3匹)。なおrHSA−FecycP、含糖酸化鉄溶液およびコンドロイチン硫酸・鉄コロイド溶液はそれぞれ鉄濃度として3mMに調製した。投与後、速やかに、腫瘍移植部位にX線20Gyを照射した。また比較のためX線を照射しない無処置群およびrHSA−FecycP投与群を設けた(1群6匹)。
腫瘍移植日を0日とし、最大60日後まで生死を観察した。各群の生存日数は箱ヒゲ図で表し、有意差検定はLogrank検定(有意水準5%)を実施した。
なお、rHSAは、(株)バイファ社製(25%製剤)、含糖酸化鉄は、フェジン〔商品名、日本医薬品工業(株)(現在日医工(株)と改名)製〕、コンドロイチン硫酸・鉄コロイドは、ブルタール〔商品名、大日本製薬(株)(現在大日本住友製薬(株)と改名)製〕を用いた。
(結果)
得られた結果を図1に示す。
また、腫瘍移植後6、7、9、12、15、20、25、32、39、46、53および60日に腫瘍長径および短径を計測し、以下の式に従い腫瘍重量を算出した。
腫瘍重量(g)= 長径(mm)×〈短径(mm)〉2÷2÷1000
各群の腫瘍重量は平均値±標準偏差で表し、有意差検定はTukey−Kramerの多重比較検定(有意水準5%)を実施した。得られた結果を図2に示す。
【0044】
無処置群の生存日数の中央値は21.5日であった。無処置群と比較しrHSA−FecycP投与群(照射なし)では生存日数は延長しなかったが、X線を照射した全ての群で生存日数が有意に延長した。また照射群と比較しrHSA投与+照射群では生存日数は延長しなかったが、rHSA−FecycP投与+照射群、含糖酸化鉄投与+照射群およびコンドロイチン硫酸・鉄コロイド溶液投与+照射群では生存日数がさらに有意に延長した。なおrHSA−FecycP投与+照射群および含糖酸化鉄投与+照射群では移植60日後も、それぞれ1例および2例が生存していた。
腫瘍重量は、無処置群では経日的に増加し、rHSA−FecycP投与群(照射なし)も無処置群と同様な推移を示した。一方、X線を照射した群では、無処置群と比較し腫瘍重量は有意に減少した。照射群に比べてrHSA投与+照射群では差はみられなかったが、rHSA−FecycP投与+照射群、含糖酸化鉄投与+照射群およびコンドロイチン硫酸・鉄コロイド溶液投与+照射群では、腫瘍重量を有意に低下させた。なおrHSA−FecycP投与+照射群および含糖酸化鉄投与+照射群において、移植60日後も生存している例では、移植12〜20日後に腫瘍の消失が認められた。
【0045】
以上のことから、rHSA−FecycPは単独では抗腫瘍効果を示さないが、X線と併用することにより、X線照射による延命及び腫瘍縮小効果を増強させることが明らかとなった。また、この効果は同濃度の鉄を含む、含糖酸化鉄及びコンドロイチン硫酸・鉄コロイドでも同様に認められたことから、化学構造式内で共通する鉄が増強に関与していることが判明し、鉄含有化合物は放射線増強剤として有用であることは明らかである。
【0046】
製造例2 ポルフィリン鉄錯体のアルブミン包接体のメト化(Fe2+→Fe3+)
rHSA−FecycPを酸素ガス(100%)通気下、500Wハロゲンランプを用いて20分間光照射し、酸素化した後、37℃で約5日間保温し、自動酸化によりメト化(Fe2+→Fe3+、Emil L. Smith等、生化学・第7版〔II〕−哺乳動物の生化学−668〜689頁、廣川書店、東京(1990年)参照)したrHSA−FecycPを得た(以下、Met−rHSA−FecycPと略する)。なお、rHSA−FecycPのメト化は、吸収極大波長λmax539.0nmにおける吸光度の減少で確認した。
【0047】
実験例2
(方法)Donryu系ラットの腹腔内で継代培養した腫瘍細胞(Ascites hepatoma LY80)を、同系統のラットの右大腿筋膜直下に、約1.0×106細胞移植した。腫瘍移植6日後、5%rHSAあるいはMet−rHSA−FecycPを総腸骨動脈内に10mL/kg投与した(1群6匹)。なおMet−rHSA−FecycPは鉄濃度として3mMに調製した。投与後、速やかに、腫瘍移植部位にX線20Gyを照射した。また比較のためX線を照射しない無処置群およびMet−rHSA−FecycP投与群を設けた(1群6匹)。
腫瘍移植日を0日とし、腫瘍移植6、7、9、12、15、20、25、32、39、46、53および60日後の腫瘍長径および短径を計測し、以下の式に従い腫瘍重量を算出した。
腫瘍重量(g)= 長径(mm)×〈短径(mm)〉2÷2÷1000
各群の腫瘍重量は平均値±標準偏差で表し、有意差検定はTukey−Kramerの多重比較検定(有意水準5%)を実施した。得られた結果を図3に示す。
【0048】
腫瘍重量は、無処置群では経日的に増加し、Met−rHSA−FecycP投与群(照射なし)では無処置群とほぼ同様な推移がみられた。一方、X線を照射した群では、腫瘍重量は有意に減少した。rHSA+照射群と比べてMet−rHSA−FecycP投与+照射群では腫瘍重量を有意に低下させた。なおMet−rHSA−FecycP投与+照射群において、移植60日後も1例が生存していた。この生存例では、移植15日後に腫瘍が消失していた。従って、Met−rHSA−FecycPには、腫瘍組織のX線照射による腫瘍縮小効果を増強させることが明らかとなった。
【0049】
以上のことから、Met−rHSA−FecycPにもX線と併用することにより、同濃度の鉄を含むrHSA−FecycPおよび含糖酸化鉄と同じく、X線照射による腫瘍縮小効果を増強させることが認められたことから、化学構造式内の鉄が2価(rHSA−FecycPの鉄の価数)あるいは3価(含糖酸化鉄およびMet−rHSA−FecycPの鉄の価数)に関係なく放射線感受性増強作用があることが判明し、鉄含有化合物は放射線増強剤として有用であることは明らかである。
【産業上の利用可能性】
【0050】
本発明の放射線増感剤は、高い放射線増感効果を示し、毒性も低く安定である。ガン化学療法における放射線増感剤として有用である。
【図面の簡単な説明】
【0051】
【図1】(1)rHSA−FecycPとX線との併用、(2)含糖酸化鉄とX線との併用、(3)コンドロイチン硫酸・鉄コロイドとX線との併用と、対照として(4)無処置、(5)rHSA−FecycP単独投与のみ、(6)X線照射のみ、(7)rHSA投与とX線との併用の場合のラットの生存日数を比較した図である。
【図2】(1)rHSA−FecycPとX線との併用、(2)含糖酸化鉄とX線との併用、(3)コンドロイチン硫酸・鉄コロイドとX線との併用と、対照として(4)無処置、(5)rHSA−FecycP単独投与のみ、(6)X線照射のみ、(7)rHSA投与とX線との併用の場合のラットの腫瘍重量の縮小効果を比較した図である。
【図3】(1)Met−rHSA−FecycPとX線との併用、対照として(2)無処置、(3)Met−rHSA−FecycP単独投与のみ、(4)rHSA投与とX線との併用の場合のラットの腫瘍重量の縮小効果を比較した図である。
【特許請求の範囲】
【請求項1】
鉄化合物を含有してなる放射線増感剤。
【請求項2】
鉄化合物が無機鉄化合物、または含糖酸化鉄、クエン酸鉄、酢酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物から選択される有機鉄化合物である請求項1記載の放射線増感剤。
【請求項3】
無機鉄化合物が塩化鉄、酸化鉄、水酸化鉄及び硫酸鉄から選択される請求項2記載の放射線増感剤。
【請求項4】
鉄化合物が含糖酸化鉄、クエン酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物から選択される有機鉄化合物である請求項1記載の放射線増感剤。
【請求項5】
鉄化合物が含糖酸化鉄、コンドロイチン硫酸・鉄コロイド、ポルフィリン鉄錯体またはポルフィリン鉄錯体包接アルブミン化合物である請求項1記載の放射線増感剤。
【請求項6】
ポルフィリン鉄錯体の鉄が2価である請求項4または5記載の放射線増感剤。
【請求項7】
ポルフィリン鉄錯体のポルフィリン環上にホウ素原子を有する置換基で置換されたフェニル基を有しない請求項4または5記載の放射線増感剤。
【請求項8】
ポルフィリン鉄錯体が非ホウ素化ポルフィリン鉄錯体である請求項4または5記載の放射線増感剤。
【請求項9】
鉄化合物がポルフィリン鉄錯体包接アルブミン化合物である請求項1記載の放射線増感剤。
【請求項10】
アルブミンが遺伝子組換えアルブミンである請求項9記載の放射線増感剤。
【請求項11】
請求項1に記載の放射線増感剤及び化学療法剤を含む薬剤キット。
【請求項12】
放射線増感剤と化学療法剤とが個々に包装される請求項11記載の薬剤キット。
【請求項13】
化学療法剤を投与後1時間以内に請求項1に記載の放射線増感剤を投与して放射線照射することを特徴とする請求項11記載の薬剤キット。
【請求項1】
鉄化合物を含有してなる放射線増感剤。
【請求項2】
鉄化合物が無機鉄化合物、または含糖酸化鉄、クエン酸鉄、酢酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物から選択される有機鉄化合物である請求項1記載の放射線増感剤。
【請求項3】
無機鉄化合物が塩化鉄、酸化鉄、水酸化鉄及び硫酸鉄から選択される請求項2記載の放射線増感剤。
【請求項4】
鉄化合物が含糖酸化鉄、クエン酸鉄、グルコン酸鉄、コンドロイチン硫酸・鉄コロイド、シデフェロン、スレオニン鉄、フマル酸鉄、ピロリン酸鉄、ポルフィリン鉄錯体及びポルフィリン鉄錯体包接アルブミン化合物から選択される有機鉄化合物である請求項1記載の放射線増感剤。
【請求項5】
鉄化合物が含糖酸化鉄、コンドロイチン硫酸・鉄コロイド、ポルフィリン鉄錯体またはポルフィリン鉄錯体包接アルブミン化合物である請求項1記載の放射線増感剤。
【請求項6】
ポルフィリン鉄錯体の鉄が2価である請求項4または5記載の放射線増感剤。
【請求項7】
ポルフィリン鉄錯体のポルフィリン環上にホウ素原子を有する置換基で置換されたフェニル基を有しない請求項4または5記載の放射線増感剤。
【請求項8】
ポルフィリン鉄錯体が非ホウ素化ポルフィリン鉄錯体である請求項4または5記載の放射線増感剤。
【請求項9】
鉄化合物がポルフィリン鉄錯体包接アルブミン化合物である請求項1記載の放射線増感剤。
【請求項10】
アルブミンが遺伝子組換えアルブミンである請求項9記載の放射線増感剤。
【請求項11】
請求項1に記載の放射線増感剤及び化学療法剤を含む薬剤キット。
【請求項12】
放射線増感剤と化学療法剤とが個々に包装される請求項11記載の薬剤キット。
【請求項13】
化学療法剤を投与後1時間以内に請求項1に記載の放射線増感剤を投与して放射線照射することを特徴とする請求項11記載の薬剤キット。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2006−298897(P2006−298897A)
【公開日】平成18年11月2日(2006.11.2)
【国際特許分類】
【出願番号】特願2005−368933(P2005−368933)
【出願日】平成17年12月22日(2005.12.22)
【出願人】(000135036)ニプロ株式会社 (583)
【Fターム(参考)】
【公開日】平成18年11月2日(2006.11.2)
【国際特許分類】
【出願日】平成17年12月22日(2005.12.22)
【出願人】(000135036)ニプロ株式会社 (583)
【Fターム(参考)】
[ Back to top ]

