放射線架橋されたカルボキシメチルセルロースの分解剤
【課題】 放射線架橋されたカルボキシメチルセルロースの分解剤を提供する。
【解決手段】 セルロモナス・ゲリダFERM P-20932、スタフィロコッカス・エスピー
C1(NITE AP-366)株、バチルス・エスピー C4(NITE AP-367)株などの微生物を用いて放射線架橋されたカルボキシメチルセルロースを分解し、排水処理や廃棄物処理に用いる。
【解決手段】 セルロモナス・ゲリダFERM P-20932、スタフィロコッカス・エスピー
C1(NITE AP-366)株、バチルス・エスピー C4(NITE AP-367)株などの微生物を用いて放射線架橋されたカルボキシメチルセルロースを分解し、排水処理や廃棄物処理に用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、放射線架橋されたカルボキシメチルセルロースの分解剤並びにそれを用いた排水処理方法および廃棄物分解方法に関する。
【背景技術】
【0002】
セルロースは地球上に最も大量に存在する生分解性の有機化合物であり、その有効利用が古くから研究されてきた。近年の環境問題への社会的な関心の高まりとともに、セルロース誘導体は、再び注目されるようになってきた。
カルボキシメチルセルロース(以下、CMCと略称する)は、セルロース誘導体の1種である。CMCに放射線を照射することでCMCの架橋を行い、ゲル化させる技術が報告されている(特許文献1、2および非特許文献1)。このようにして放射線架橋されたCMCゲルは、膨潤性と保水性とを併せ持っており、農業や医療分野での用途が期待されている。吸水後の放射線架橋CMCゲルは、産業廃棄物として処理する必要があるが、従来、不要な放射線架橋CMCゲルは焼却処理されている。使用後の放射線架橋CMCゲルは、その大部分が水分であり、大量のエネルギーを要する焼却処理はよい方法とはいえない。しかしながら、これまで、放射線架橋されたCMCゲルを微生物を用いて分解することについては報告されておらず、微生物によって分解できるか不明であった。
【特許文献1】特開2006-102227号公報
【特許文献2】特開2001-002703号公報
【非特許文献1】Nuclear Instruments and Methods in Physics Research B208, p320-324, 2003
【発明の開示】
【発明が解決しようとする課題】
【0003】
本発明は、放射線架橋されたCMCを効率よく分解するための微生物およびそれを用いた放射線架橋CMCの分解剤を提供することを課題とする。
【課題を解決するための手段】
【0004】
本発明者は上記課題を解決すべく鋭意検討を行った。その結果、土壌より単離されたセルロモナス・ゲリダNKCM7206(FERM P-20932)株、スタフィロコッカス・エスピー C1(NITE AP-366)株、バチルス・エスピー C4(NITE AP-367)株などの菌が架橋されたCMCゲルを効率よく分解することを見出し、これが排水処理や廃棄物処理などに応用できることを見出し、本発明を完成するに至った。
【0005】
すなわち、本発明は以下の通りである。
(1)セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される1種類以上の微生物を含む、放射線架橋されたカルボキシメチルセルロースの分解剤。
(2)前記微生物がセルロモナス属細菌である、(1)の分解剤。
(3)セルロモナス属細菌がセルロモナス・ゲリダである、(2)の分解剤。
(4)セルロモナス・ゲリダがセルロモナス・ゲリダFERM P-20932株である、(3)の分解剤。
(5)前記微生物がスタフィロコッカス属細菌である、(1)の分解剤。
(6)スタフィロコッカス属細菌がスタフィロコッカス・エスピー C1(NITE AP-366)株である、(5)の分解剤。
(7)前記微生物がバチルス属細菌である、(1)の分解剤。
(8)バチルス属細菌がバチルス・エスピー C4(NITE AP-367)株である、(7)の
分解剤。
(9)放射線架橋されたカルボキシメチルセルロースに排水を吸収させ、排水を吸収した放射線架橋されたカルボキシメチルセルロースを(1)〜(8)のいずれかの分解剤を用いて分解することを特徴とする、排水の処理方法。
(10)放射線架橋されたカルボキシメチルセルロースを含む廃棄物に(1)〜(8)のいずれかの分解剤を添加して該廃棄物を分解することを特徴とする、放射線架橋されたカルボキシメチルセルロースを含む廃棄物の処理方法。
(11)(1)〜(8)のいずれかの分解剤を含む、排泄物の堆肥化促進補助剤。
(12)セルロモナス・ゲリダFERM P-20932株。
(13)スタフィロコッカス・エスピー C1(NITE AP-366)株。
(14)バチルス・エスピー C4(NITE AP-367)株。
【発明の効果】
【0006】
本発明の放射線架橋CMC分解剤を用いることにより、し尿等の排水を吸収させた放射線架橋CMCゲルを効率よく分解することができるため、環境に負荷をかけることなく排水の処理ができる。生成したCMCゲル液化物質は、分解剤に含まれる微生物によって無機化されるため、排水内において、生物学的酸素要求量(BOD値)を増加させない。
また、放射線架橋CMCゲルは、畜産排泄物に投入すると、それを脱水し、排泄物の堆肥化を促進する。堆肥中でのCMCゲルが消失せずに残った場合、堆肥中に再び水が流出し、微生物の好気的醗酵を阻害し、堆肥化が進まない。本発明によるCMCゲル分解生物製剤を投入することにより、放射線架橋CMCを分解して十分な醗酵熱を得るとともに乾燥状態を保持し、排泄物の堆肥化を十分に進行させることができる。
また、放射線架橋CMCゲルを吸水材として用いた、水分を含む使用後のオムツや生理用品の処理剤としても本発明の分解剤は利用可能である。
【発明を実施するための最良の形態】
【0007】
以下に本発明を詳しく説明する。
本発明は、セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される微生物を用いた、放射線架橋されたCMC(放射線架橋CMC、放射線架橋CMCゲルまたは単にCMCゲルとも呼ぶ)の分解剤に関する。
ここで、放射線架橋CMCゲルとしては、例えば、特開2001-002703号公報に記載の方法によって作製されたCMCゲルが挙げられる。具体的には、CMC100重量部及び水5〜2,000重量部からなる混合物に放射線を照射することによって得られる架橋CMCであることが好ましい。CMCの平均重合度には特に制限はないが、例えば、10〜2,000、好ましくは50〜1,000である。カルボキシメチル基の導入率は、例えば、0.5以上、好ましくは0.8以上、さらに好ましくは1.0以上である。本発明の微生物を用いることにより、カルボキシメチル基の導入率の高い(導入率が1.0以上の)放射線架橋CMCゲルでも効率よく分解することができる。放射線照射処理に使用される放射線としては、α線、β線、γ線、X線、電子線、紫外線等を使用することができるが、コバルト60からのγ線、工業的に利用されている加速器からの電子線、X線がより好ましい。放射線の照射量はγ線換算0.1〜50kGyであり、好ましくは0.3〜20kGyである。放射線架橋CMCゲルのゲル分率は、例えば、10〜100%、好ましくは50〜100%、より好ましくは70〜100%である。
【0008】
なお、本発明において、「放射線架橋CMCゲルを分解する」とは、単に放射線架橋CMCゲルを切断して低分子に断片化することを意味するのではなく、放射線架橋CMCゲルを低分子に断片化し、さらに、資化して無機化することまでを意味する。
微生物が放射線架橋CMCゲルを資化して無機化することは、例えば、放射線架橋CMCゲルを唯一の炭素源とする培地において微生物が生育できることによって確認できる。
セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される微生物は、放射線架橋CMCゲルを断片化する能力とともに資化する能力も有しているため、放射線架橋CMCゲルの分解剤として優れている。
【0009】
分解剤として使用しうるセルロモナス属細菌としては、放射線架橋CMC分解能を有するセルロモナス属に属する細菌であれば特に制限されないが、セルロモナス ゲリダ(Cellulomonas gelida)、セルロモナス フィミ(Cellulomonas fimi)、セルロモナス フラビゲナ(Cellulomonas flavigena)、セルロモナス ウダ(Cellulomonas uda)などが挙げられ、この中では、セルロモナス・ゲリダ(Cellulomonas gelida)が好ましい。
セルロモナス・ゲリダとしては、例えば、セルロモナス・ゲリダNKCM7206株を使用することができる。
【0010】
セルロモナス・ゲリダNKCM7206株は、群馬県高崎市の土壌より分離された細菌で、産業枝術総合研究所特許生物寄託センター(茨城県つくば市東1-1-1 つくばセンター 中央第6)に受託番号FERM P-20932として寄託された(寄託日は平成18年6月8日)。
【0011】
セルロモナス・ゲリダNKCM7206株の菌学的性質を以下に示した。
尚、本菌株の同定の当たっては、新細菌培地学講座(第2版、近代出版)、医学細菌同定の手引き(第2版、近代出版)、細菌学実習提要(丸善)に準じて実験を行い、実験結果をBergey's Manual of Systematic Bacteriology VOL. 1(1984)を参考にして同定した。
【0012】
<セルロモナス・ゲリダNKCM7206株の菌学的性質>
(a) 形態的特徴
(1)細胞形態:桿菌
(2)運動性:−(懸滴法)
(3)普通寒天培地上での生育:生育は良好。色調は淡黄色
(b)生理生化学的性状
(1)グラム染色: 陽性
(2)好気条件での生育: +
(3)嫌気条件での生育: −
(4)生育温度: 25℃+30℃ +
(5)生育pH: pH7.0 +
(6)色素の産生: LB培地 なし
(7)アミノペプチダーゼ: +
(8)硝酸塩還元性: +
(9)グルコース酸化: −
(10)インドールの産生: −
(11)アルギニンデヒドロラーゼ: −
(12)ウレアーゼ: −
(13)エスクリンの液化: +
(14)ゼラチンの液化: +
(15)β−グルコシダーゼ:+
(16)炭素源の資化性:グルコース +、L−アラビノース +、D−マンノース +、D-マンニトール −、N-アセチル-D-グルコサミン −、マルトース +、グルコン酸 −、n-カプリン酸 −、アジピン酸−、dl-マレイン酸 − 、クエン酸 − 、フェニル酢酸 −
【0013】
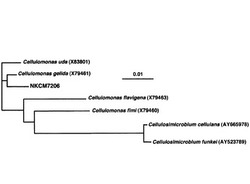
さらに16Sリボゾームの塩基配列解析結果から、セルロモナス属細菌特有の高いG+C含率を示した。また、本菌株の16Sリボゾーム塩基配列は、特にセルロモナス・ゲリダX79461株と高い一致(98.9%)を示した。これにより、セルロモナス・ゲリダNKCM7206株と名づ
けた(図1)。
この菌株の脂肪酸組成の第一成分は、a-C 15:0であり、第二成分は、C 13:0であった。また、イソプレノイドキノン解析結果よりMK-9が主成分であることがわかった。
【0014】
分解剤として使用しうるスタフィロコッカス属細菌としては、放射線架橋CMC分解能を有するスタフィロコッカス属に属する細菌であれば特に制限されないが、スタフィロコッカス・エスピー C1株が好ましい。
【0015】
スタフィロコッカス・エスピー C1株は、群馬県桐生市の土壌より分離された細菌で、製品評価技術基盤機構特許微生物寄託センター(千葉県木更津市かずさ鎌足2-5-8)に受領番号NITE AP-366として寄託された(寄託日は平成19年5月18日)。
【0016】
スタフィロコッカス・エスピー C1株の菌学的性質を以下に示した。
尚、本菌株の同定の当たっては、新細菌培地学講座(第2版、近代出版)、医学細菌同定の手引き(第2版、近代出版)、細菌学実習提要(丸善)に準じて実験を行い、実験結果をBergey's Manual of Systematic Bacteriology VOL. 1(1984)を参考にして同定した。
【0017】
<スタフィロコッカス・エスピー C1株の菌学的性質>
(a) 形態的特徴
(1)細胞形態:桿菌
(2)運動性:−(懸滴法)
(3)普通寒天培地上での生育:生育は良好。色調は淡黄色
(b)生理生化学的性状
(1)グラム染色: 陽性
(2)好気条件での生育: +
(3)嫌気条件での生育: −
(4)生育温度: 25℃+30℃ +
(5)生育pH: pH7.0 +
(6)色素の産生: LB培地 なし
(7)アミノペプチダーゼ: +
(8)硝酸塩還元性: +
(9)グルコース酸化: −
(10)インドールの産生: −
(11)アルギニンデヒドロラーゼ: −
(12)ウレアーゼ: +
(13)エスクリンの液化: +
(14)ゼラチンの液化: −
(15)β−グルコシダーゼ:+
(16)炭素源の資化性:グルコース +、L−アラビノース +、D−マンノース +、D-マンニトール +、N-アセチル-D-グルコサミン +、マルトース +、グルコン酸 +、n-カプリン酸 −、アジピン酸−、dl-マレイン酸 +、クエン酸 −、フェニル酢酸 −
【0018】
分解剤として使用しうるバチルス属細菌としては、放射線架橋CMC分解能を有するバチルス属に属する細菌であれば特に制限されないが、バチルス・エスピー C4株が好ましい。
【0019】
バチルス・エスピー C4株は、群馬県桐生市の土壌より分離された細菌で、製品評価技術基盤機構特許微生物寄託センター(千葉県木更津市かずさ鎌足2-5-8)に受領番号NITE AP-367として寄託された(寄託日は平成19年5月18日)。
【0020】
バチルス・エスピー C4株の菌学的性質を以下に示した。
尚、本菌株の同定の当たっては、新細菌培地学講座(第2版、近代出版)、医学細菌同定の手引き(第2版、近代出版)、細菌学実習提要(丸善)に準じて実験を行い、実験結果をBergey's Manual of Systematic Bacteriology VOL. 1(1984)を参考にして同定した。
【0021】
<バチルス・エスピー C4株の菌学的性質>
(a) 形態的特徴
(1)細胞形態:桿菌
(2)運動性:−(懸滴法)
(3)普通寒天培地上での生育:生育は良好。色調は淡黄色
(b)生理生化学的性状
(1)グラム染色: 陽性
(2)好気条件での生育: +
(3)嫌気条件での生育: −
(4)生育温度: 25℃+30℃ +
(5)生育pH: pH7.0 +
(6)色素の産生: LB培地 なし
(7)アミノペプチダーゼ: +
(8)硝酸塩還元性: +
(9)グルコース酸化: −
(10)インドールの産生: −
(11)アルギニンデヒドロラーゼ: −
(12)ウレアーゼ: −
(13)エスクリンの液化: +
(14)ゼラチンの液化: +
(15)β−グルコシダーゼ:+
(16)炭素源の資化性:グルコース +、L−アラビノース −、D−マンノース +、D-マンニトール −、N-アセチル-D-グルコサミン −、マルトース +、グルコン酸 +、n-カプリン酸 −、アジピン酸−、dl-マレイン酸 +、クエン酸 +、フェニル酢酸 −
【0022】
これらの菌株を放射線架橋CMCの分解剤として用いる場合、適当な培養条件で増殖させて得られた菌体を用いることが好ましい。セルロモナス・ゲリダNKCM7206株、スタフィロコッカス・エスピー C1株、バチルス・エスピー C4株は、例えば、CMCゲルを含む表1の培地で、25〜30℃で培養することができる。
なお、セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される微生物の処理物を本発明の分解剤として使用してもよい。菌体の処理物としては、例えば、菌体をアクリルアミド、カラギーナン等で固定化した固定化菌体、菌体を破砕した破砕物、放射線架橋CMC分解酵素を含む遠心分離上清、又はその上清を硫安処理等で部分精製した画分等が挙げられる。
【0023】
なお、セルロモナス・ゲリダNKCM7206株、スタフィロコッカス・エスピー C1株、バチルス・エスピー C4株の変異株や、遺伝子組み換え株などの派生株を使用することもできる。例えば、これらの株をX線や紫外線の照射、またはN−メチル−N'−ニトロ−N−ニトロソグアニジン(NTG)、エチルメタンスルフォネート(EMS)等の変異剤で処理し、放射線架橋CMCの分解能がさらに高められた株を選択し、それを用いてもよい。また、セルラーゼなどの遺伝子を導入して放射線架橋CMCの分解能がさらに高められる用に改変された株を用いてもよい。
【0024】
なお、本発明の分解剤として使用しうる微生物、上記の株に限定されず、その他のセルロモナス属に属する株、バチルス属に属する株およびスタフィロコッカス属に属する株を使用することもできる。例えば、土壌などから単離された微生物について、後述の実施例に示すように、放射線架橋CMCを含む培地で培養し、さらに培地にCMC沈殿剤(例えば、へキサデシルメチルアンモニウムブロマイド)を加え、コロニー周辺にクリアゾーンを形成することのできる微生物を選択し、それを用いてもよい。
【0025】
本発明の分解剤は、セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される少なくとも1種類の微生物、またはその処理物を、水等の液体に単に懸濁することにより製造することもできるが、他の成分を配合し、液剤、粉剤、粒剤等の製剤として製造することもできる。他の配合成分としては、液体担体、固体担体、界面活性剤(乳化剤、分散剤、消泡剤等)、補助剤等が挙げられ、これらの1種又は2種以上を混合して使用することもできる。
本発明の分解剤に含まれる放線菌の濃度は、本発明の効果を損なわない限り特に制限はないが、製剤として104〜1011 CFU/g(コロニー形成単位)、好ましくは105〜1010 CFU/g(コロニー形成単位)である。
【0026】
本発明の分解剤は、排水処理に適用することができる。すなわち、放射線架橋されたCMCに排水を吸収させ、排水を吸収した放射線架橋CMCを本発明の分解剤を用いて分解することによって、環境に負荷をかけることなく効率よく排水の処理ができる。
本発明の分解剤は、放射線架橋CMCを含む廃棄物の分解に使用することができる。放射線架橋されたCMCを含む廃棄物としては、放射線架橋されたCMCを吸水剤として含むオムツや生理用品の使用後の廃棄物、放射線架橋されたCMCを含む生ごみなどが挙げられる。
また、本発明の分解剤は、排泄物の堆肥化促進補助剤として使用することもできる。放射線架橋CMCゲルは、畜産排泄物に投入すると、それを脱水し、排泄物の堆肥化を促進する。堆肥中でのCMCゲルが消失せずに残った場合、堆肥中に再び水が流出し、微生物の好気的醗酵を阻害し、堆肥化が進まない。そこで、本発明によるゲル分解生物製剤を投入することにより、放射線架橋CMCを分解して十分な醗酵熱を得るとともに乾燥状態を保持し、排泄物の堆肥化を十分に進行させることができる。
【実施例】
【0027】
以下に実施例を示し、本発明をさらに具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0028】
1-1.試薬
CMCゲルは、置換度1.36、分子量110万のCMC1380(ダイセル化学社製)を特開2001-002703号公報に記載された方法によって放射線架橋し作製した。
【0029】
1-2. 放射線架橋CMCゲル分解菌の集積培養
放射線架橋CMCゲル分解菌の単離は、日本原子力研究開発機構高崎量子応用研究所の土壌などを微生物接種源として集積培養法を用いて行った。集積培養は0.3%放射線架橋CMCゲルを加えた基本培地100mL(表1)に採取した土等を入れ、1段目として30℃で振とう培養を行ない、さらに2段目、3段目と同様の操作を行い、放射線架橋CMCゲル分解菌の濃縮を行った。
【0030】
【表1】

【0031】
1-3. 放射線架橋CMCゲル分解菌の単離
集積培養液を、10-3〜10-8 倍希釈した。希釈液100μLをLB培地に塗布した。微生物の純化は、画線培養法によった。0.3% 放射線架橋CMCと0.2%寒天を添加した基本培地(表1)に、単離微生物を接種した。培地にCMC沈殿剤(1%へキサデシルメチルアンモニウムブロマイド)を加え、コロニー周辺のクリアゾーン形成の有無を観察した。
【0032】
1-4.単離株の生化学的、生理学的性質
単離した12株の中で、放射線架橋CMCプレート上で最も明確なクリアゾーンを形成したNKCM7206株と、対照株としてセルロモナス・ゲリダNBRC3748株について、アミノペプチダーゼの生産をアミノペプチダーゼテスト(メルク社製)を使用して調べた。その他の生化学的テスト、および炭素源資化性テストは、グラム陰性菌同定キットAPI 20NE(ビオメリューバイオテック社製)を用いた。
【0033】
1-5.酵素プロファイル
酵素プロファイルは、半定量性酵素活性キット APIZYM(ビオメリューバイオテック社製)を使用して作成した。
【0034】
1-6.ゲノムDNA抽出
NKCM7206株とセルロモナス・ゲリダNBRC3748株を各々LB培地100mLに植菌し、30℃で一晩振とう培養した。対数増殖期初期にある菌体を遠心分離(5000rpm、10分間、4℃)により回収した。得られた菌体を、TEバッファー8.505mLに懸濁した。懸濁液にリゾチーム85mgを加え、37℃で9時間保温した。その後、10% SDS 450μL、Proteinase K 45μLを加え、50℃で1晩保温した。続いて等量のフェノール:クロロホルム:イソアミルアルコール(25:24:1, v/v)を加え室温で30分間穏やかに振とうした。その後、遠心分離(8000rpm、30分間、室温)により上層を回収した。回収した上層に、等量のイソプロパノール、1/10倍量の5M NaClを加え、ゲノムDNAを沈殿させて回収し、70%エタノール1mLですすいだ。ゲノムDNAを減圧乾燥させた後、TEバッファー9mLに溶かした。続いて、Ribonuclease A (シグマ社製)1μLを加え、37℃で1時間保温し、RNAを分解した。再度フェノール/クロロホルム抽出を行い、イソプロパノール沈殿によりゲノムDNAを回収し、減圧乾燥させた後、TEバッファー500μLに溶かした。
【0035】
1-7. G+C含率
1-7-1.ヌクレオシド試料の作製
0.4mg/mLに調製したゲノムDNA溶液(1-6参照)20μlを100℃で5分間保ち、氷水中で急冷した。このゲノム溶液に、ヌクレアーゼP1溶液20μLを加え、この50℃で1時間保ち、ヌクレオチドとした。これにエビアルカリフォスファターゼ(べーリンガー社製)1μLを加えて、37℃で1時間保ち、脱リン酸化することにより、ヌクレオシド試料とした。ヌクレオシド試料を、すみやかに高性能液体クロマトグラフイー(HPLC)分析に供した。
【0036】
1-7-2.高性能液体クロマトグラフイー(HPLC)による分析
HPLCシステムは島津社製のものを使用した。カラムは、LICHROSPHER 100 RP-8 (CS、メルク社製、0.4×25cm)を用いた。試料は、島津社製のオートインジェクター(SIL-10AD)を用いて、50μLずつ注入した。溶出は、流速 1mL/minで、溶媒として0.02M NH4H2PO4 溶液(pH無調整)−アセトニトリル(20:1, v/v)を用いて行った。検出は、島津社製のSPD-10Aを用いて、260nmにて行った。ゲノム DNAのG+C含率は以下の式(1)、また基準となるλDNA を用いて明確なピークが出たAとCから理論値と比較し、補正を行なうことで正確な G+C 含率を式(2)を用いて算出した。
【数1】

【0037】
1-8.イソプレノイドキノン解析
1-8-1.菌体からのキノン抽出
NKCM7206株を、各々LB培地200mLに植菌し、30℃で一晩振とう培養した。遠心分離 (5000rpm、10分間、4℃)により菌体を回収した。滅菌生理的食塩水に菌体を再懸濁し、遠心分離(5000rpm、10分間、4℃)により菌体を回収した。これを2回繰り返し、菌体を洗浄した。得られた菌体を凍結乾燥させた。凍結乾燥菌体約200mgを、十分粉砕した。この粉砕菌体に、20mLのクロロホルム−メタノール(2:1, v/v)を加えて浸漬し、一晩暗所に放置した。その後、これをろ過し、ろ紙上の菌体をクロロホルム−メタノールですすいだのち、そのろ液を集めた。続いて、このろ液をロータリーエバポレーターで濃縮乾固した。このとき、ウォーターバスの温度は40℃以下に設定した。残漬にアセトン1.5mLを加え、抽出した。これを2回繰り返し、アセトン画分を、窒素ガス気流下で、200μLに濃縮した。次に、TLCによる精製を行った。濃縮したアセトン溶液全量を、蛍光剤入りシリカゲル TLC(Kiesel-gel 60F254、メルク社製)にアプライした。このとき、標準物質として、ビタミン K1 をあわせて展開し展開溶媒にはへキサン−べンゼン−クロロホルム(5:2:1,v/v)を使用した。紫外線照射装置(310nm) を用いてスポットを確認し、ビタミン K1の少し上にでてきたメナキノンのスポットのシリカゲルをかきとった。これを2mLのアセトンで2回抽出した。還心分離により、上清を回収し、窒素ガス気流下で 20μLに濃縮した。
【0038】
1-8-2 分子種の同定
精製した試料を、逆相型 TLC (KC8 Octyl reversed phase 、Whatman 社製)を用いて、展開した。展開溶媒には、アセトン−水(99:1, v/v)を用いた。紫外線照射装置(310nm)を用いて、スポットを確認した。
【0039】
1-9.菌体脂肪酸組成解析1-9-1.脂肪酸メチルエステルの調製
NKCM7206株、セルロモナス・ゲリダをLB培地 200mLに植菌し、30℃で一晩振とう培養した。遠心分離(5000rpm、10分間、4℃)により菌体を回収した。滅菌生理的食塩水に菌体を再懸濁し、遠心分離 (5000rpm、10分間、4℃)により菌体を回収した。これを2回繰り返し、菌体を洗浄した。この湿菌体40mgにアルカリけん化液 1mLを加えた。これを100℃で5分間保った後、5〜10秒間よく振り、さらに100℃で25分間保温した。その後、流水で温度を下げ、メチル化試薬 2mlを加え、80℃で10分間保温した。流水で温度を下げた後、抽出用溶媒 1.25mlを加え、室温で 10分間ゆっくり攪拌した。その後、水相を取り除き、残った溶媒相に洗浄液 3mlを加え、室温で5分間ゆっくり攪拌した。この溶媒相の 2/3を取り、ガスクロマトグラフイー(GC)用の分析試料とした。
【0040】
1-9-2.ガスクロマトグラフィー(GC)解析
GC による測定条件は、ディテクター温度260℃、インジェクター温度255℃、カラムオーブン初期温度150℃、初期温度保持時間 4min、力ラム昇温速度 4℃/min、カラム最終温度 250℃、昇温最終温度保持時間 20min である。カラムは、ニュートラボンド−1(GLサイエンス社製、30×0.25mm)を使用した。ピークの検出はFID法によった。ピークの同定には、バクテリア同定用標準物質バクテリア酸メチルエステル(BAME) ミックス(スペルコ社製)を用いた。
【0041】
1-10. NKCM7206 のリボソーマル DNA 配列解析
16Sリボソーマル DNA (rDNA)を PCR 法により増幅した。使用したプライマーは 16Sf (5'-GTTTGATCATGGCTCAG-3':配列番号1)、16Sr (5'-TACCTTGTTACGATTCA-3':配列番号2)であり、これらを各々20pmol用いた。テンプレートは、後、急冷することにより変性させ、コロニーを 5μL の滅菌 MilliiQ 水に懸濁し、98℃、10分間保温し、これを鋳型とした。サーマルサイクルは、94℃5分→(94℃20秒、55℃30 秒、72 ℃2分)×25回、72℃10分の条件で実行された。酵素は ExTaq polymerase (TaKaRa社製)を用いた。PCR産物を、pGEM-T Easy Vector(プロメガ社製)に連結した。この組み換えプラスミドを Ecoli DH5αに形質転換した。LAプレートに生えて来たコロニーをレプリカしインサートを確認した。得られた組み換えプラスミドをシークエンシング解析した。シークエンシングサンプルは PCR法により調製された。シークエンシングには、CEQ2000(べックマン・コールター社製)を用いた。塩基配列及び相同性解析は、プログラム GENETYXあるいはプログラムblastnを用いて行った。得られた塩基配列を基に、CLUSTALW法を用いてアライメントし、NJ法により系統樹を作成した。
【0042】
1-11. ゲル濃度と増殖曲線
100mLの基本培地(液体)に0.1、0.2、あるいは0.3%の放射線架橋CMCゲルを添加し、さらにNKCM7206株を植菌し、その増殖程度を調べた。振盪培養は、120ストローク/分、30℃で行われた。初期の菌数は、LB培地で前培養し、それを50μL添加することにより、初期菌量を一定にした。菌体の増殖は、分子吸光度計(日立U2000)で、一定時間ごとに測定した。
【0043】
1-12. 培地中のイーストエキス濃度とNKCM7206株の上清中のCMCゲル分解活性発現
基本培地中のイーストエキス濃度を0から1%の間で変えて培地を作製した。NKCM7206株を植菌し、72時間、各培地で120ストローク/分、30℃で培養後、その培養上清を回収した。この培養上清中の放射線架橋CMCゲル分解活性を測定するために、上清1mLと0.1Mリン酸緩衝液および10mg放射線架橋CMCゲルを混ぜ、10時間30℃で静置した。その後、水溶性分解物を全有機炭素測定装置(島津社製)を用いて、定量した。水溶液中の全有機炭素量からゲル分解率を計算した。
【0044】
2.結果
2-1. 放射線架橋CMC分解微生物の単離
1-2で記述した土壌を摂取源として、CMC寒天培地にクリアゾーンを形成する細菌 10株を単離した。単離株を NKCM7203〜7212株と命名した。10株のうち、NKCM7206株が最も明瞭なクリアゾーンを形成したので、この株を以下、詳細に解析した。
【0045】
2-2. 放射線架橋CMCゲル分解微生物 NKCM7206 株の生理学的・生化学的性質
表2にNKCM7206株の生理・生化学的性質解析の実験結果を示す。NKCM7206株の対照株には、16SrDNA解析で相同性が98.9%であったセルロモナス・ゲリダX79461株を用いた。
【0046】
【表2】

【0047】
2-3. 放射線架橋CMCゲル分解菌NKCM7206株の酵素生産能力測定
表3にNKCM7206株のAPIAYMによる酵素プロファイルを示す。 NKCM7206株はβ−glucosidase 活性を示した。このことにより放射線架橋CMCゲルが分解されていることが示唆された。
【0048】
【表3】

【0049】
2-4. CMC分解菌 NKCM7206株のG+C含率
表4にNKCM7206株と対象株セルロモナス・ゲリダNBRC3748株についてのG+C含率の結果を示した。単離株、対照株ともセルロモナス属特有の高いG+C含率を示した。
【0050】
【表4】

【0051】
2-5. 放射線架橋CMC分解菌NKCM7206株の菌体脂肪酸解析
表5に NKCM7206株と対照株セルロモナス・ゲリダNBRC3748株についての菌体脂肪酸解析の結果を示した。単離株、対照株ともに、脂肪酸組成の第一成分は、 a-C 15:0であった
。単離株の第二成分は、 C 13:0であった。
【0052】
【表5】

【0053】
2-6. 放射線架橋CMC分解菌NKCM7206株のイソプレノイドキノン解析
表6 にNKCM7206株と対照株セルロモナス・ゲリダNBRC3748株についてのイソプレノイドキノン解析の結果を示した。単離株、対照株とも MK-9 が主成分であった。
【0054】
【表6】

【0055】
2-7. 放射線架橋CMC分解菌 NKCM7206株の16S rDNA配列解析
放射線架橋CMCゲル分解菌であるNKCM7206の16S rDNA解析を 1−10に従った。図1に、進化系統樹を示す。NKCM7206株の16S rDNA 配列(配列番号3)は、セルロモナス・ゲリダNBRC3748株のそれと98.9%の相同性が見られた。
【0056】
2-8. ゲル濃度と増殖曲線
0.1、0.2、あるいは0.3%の放射線架橋CMCゲルを含む培地中の増殖曲線を図2に示した。NKCM7206株は、0.1%放射線架橋CMCゲルを含む培地で最も生育速度が大きかった。0.2、0.3%となるごとに、誘導期の始まりの時間は遅れた。一方、最大増殖程度は、ゲルの濃度に関係なく、ほぼ同じであった。
【0057】
2-9. 培地中のイーストエキス濃度とNKCM7206株の上清中の放射線架橋CMCゲル分解活性発現
イーストエキス濃度を0から1%の間で変えたときのNKCM7206株の放射線架橋CMCゲル分解活性を図3に示した。上清中の放射線架橋CMCゲル分解活性は、培地中に0.05%イーストエキスを含むときに最大となることが判明した。また、その際の、10時間ゲル分解率は
、約40%に達した。
【0058】
なお、NKCM7206株は結晶セルロース(アビセル:旭化成社製)および非架橋CMCの分解能も有していることが確認された。
さらに、それ以外の放射線架橋CMC分解菌NKCM7203〜7205、7207〜7212株についても解析した結果、そのうちのNKCM7210株とNKCM7211株がセルロモナス・ゲリダであると同定された。
【0059】
さらなる種類のCMCゲル分解菌を得るために、群馬県桐生市の山の土壌を微生物接種源として更なるスクリーニングを行った。
集積培養は1%のCMC加水分解物およびCMCゲル加水分解物を用いて、0.2% CMC加水分解物およびCMCゲル加水分解物を加えた基本培地100mLに採取した土壌を1g加え、30℃で10日培養した(1段階目)。その後、培養液1mLを同様の培地に植え継ぎ、さらに10日培養した(2段階目)。さらに同様の操作を行った(3段階目)。
CMCゲル分解菌の単離は、集積培養法によって得られた3段階目培養液を希釈系列(10-1〜10-6)で希釈し、100mLをLB培地に塗布し、微生物の純化を行った後、分解菌を単離した。
得られた微生物の中から、C1株とC4株の2種類を選択し、さらに以下の解析を行った。
【0060】
上記1-6の手順に従って、3段階目集積培養液からゲノムDNAの抽出を行った。
得られたゲノムDNAを鋳型とし、PCR法により、上記1-10の手順に従って、ゲノムDNA上の16SrDNAを解析した。使用したプライマーは16Sf (5'-GTTTGATCATGGCTCAG -3')(配列番号1)/16Sr (5'-TACCTTGTTACGATTCA-3')(配列番号2)、あるいは27f (5'-AGAGTTTGATCCTGGCTCAG-3')(配列番号4)/1525r (5'-AAAGGAGGTGATCCAGCC-3')(配列番号5)であり、これらを各々20pmol用いた。
塩基配列および相同性解析は、プログラムGENETYXあるいはプログラムBLASTを用いて行った。得られた塩基配列(C1株:配列番号6、C4株:配列番号7)を基に、CLUSTALW法を用いてアライメントし、NJ法により系統樹を作成した(図4)。なお、図4において、C2、C3、C5、CGはC1およびC4と同時に単離された微生物である。図4から、C1株の16SrRNA配列は Staphylococcus、C2株,C4株,CG株はBacillus、C3株はAcinetobacter、C5株は Flavobacteriumと近い菌種である事がわかった。
【0061】
C1株とC4株についてのアミノペプチダーゼの生産をアミノペプチダーゼテスト(メルク社製)を使用して調べた。その他の生化学的テスト、および炭素源資化性テストは、グラム陰性菌同定キットAPI 20NE(ビオメリューバイテック社製)を用いた。結果をNKCM7206株と比較して表7に示す。
【0062】
【表7】

【0063】
酵素プロファイルは、半定量性酵素活性キット APIZYM(ビオメリューバイテック社製)を使用して作成した。結果をNKCM7206株と比較して表8に示す。C1株、C4株ともβ−glucosidase活性を示し、さらにセルロースの分解物であるグルコースの同化を示した。
【0064】
【表8】

【0065】
CMCゲル資化能力の評価
C1、C4およびNKCM7206株を接種源とし、膨潤交換処理を行ったCMCゲルをステンレス金網(200メッシュ)入れた、0.1% CMCゲル基本培地で30℃、60時間振とう培養を行った。その後、濁度法で培養液の菌体増殖(OD600)およびステンレス金網内のCMCゲルの重量減少を調べる事により、それぞれ3株によるCMCゲルの資化を調べた。
【0066】
CMCゲル分解活性は以下のようにして測定した。
C1、C4およびNKCM7206株を接種源とし、0.1% CMC基本培地で30℃、60時間振とう培養を行った。培養上清を遠心分離(4℃、10000rpm、10分間)し、そのうち100℃、10分間で失活させたものをネガティブコントロールとした。100mMリン酸緩衝液を19.5mL、膨潤交換処理CMCゲル20mg、培養上清を500μL加え、37℃で15時間酵素分解させた。その後、CMCゲル分解活性をTOC(total organic carbon)計を用いて測定した。
蛋白質定量はBradford法を用い、牛血清アルブミン(BSA)を基準物質とした。
【0067】
C1、C4およびNKCM7206株のCMCゲル資化性とCMCゲル分解活性を表9にまとめた。
いずれの株もCMCゲル資化性とCMCゲル分解活性の両方を持っていることがわかり、資化性はC4株が最も高く、分解活性はC1株が最も高いことがわかった。
【0068】
【表9】

【図面の簡単な説明】
【0069】
【図1】NKCM7206株の進化系統樹を示す図。
【図2】NKCM7206株の放射線架橋CMCゲルを含む培地中での増殖曲線を示す図。
【図3】イーストエキス濃度を変えたときのNKCM7206株の放射線架橋CMCゲル分解活性を示す図。
【図4】C1株とC4株の進化系統樹を示す図。
【技術分野】
【0001】
本発明は、放射線架橋されたカルボキシメチルセルロースの分解剤並びにそれを用いた排水処理方法および廃棄物分解方法に関する。
【背景技術】
【0002】
セルロースは地球上に最も大量に存在する生分解性の有機化合物であり、その有効利用が古くから研究されてきた。近年の環境問題への社会的な関心の高まりとともに、セルロース誘導体は、再び注目されるようになってきた。
カルボキシメチルセルロース(以下、CMCと略称する)は、セルロース誘導体の1種である。CMCに放射線を照射することでCMCの架橋を行い、ゲル化させる技術が報告されている(特許文献1、2および非特許文献1)。このようにして放射線架橋されたCMCゲルは、膨潤性と保水性とを併せ持っており、農業や医療分野での用途が期待されている。吸水後の放射線架橋CMCゲルは、産業廃棄物として処理する必要があるが、従来、不要な放射線架橋CMCゲルは焼却処理されている。使用後の放射線架橋CMCゲルは、その大部分が水分であり、大量のエネルギーを要する焼却処理はよい方法とはいえない。しかしながら、これまで、放射線架橋されたCMCゲルを微生物を用いて分解することについては報告されておらず、微生物によって分解できるか不明であった。
【特許文献1】特開2006-102227号公報
【特許文献2】特開2001-002703号公報
【非特許文献1】Nuclear Instruments and Methods in Physics Research B208, p320-324, 2003
【発明の開示】
【発明が解決しようとする課題】
【0003】
本発明は、放射線架橋されたCMCを効率よく分解するための微生物およびそれを用いた放射線架橋CMCの分解剤を提供することを課題とする。
【課題を解決するための手段】
【0004】
本発明者は上記課題を解決すべく鋭意検討を行った。その結果、土壌より単離されたセルロモナス・ゲリダNKCM7206(FERM P-20932)株、スタフィロコッカス・エスピー C1(NITE AP-366)株、バチルス・エスピー C4(NITE AP-367)株などの菌が架橋されたCMCゲルを効率よく分解することを見出し、これが排水処理や廃棄物処理などに応用できることを見出し、本発明を完成するに至った。
【0005】
すなわち、本発明は以下の通りである。
(1)セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される1種類以上の微生物を含む、放射線架橋されたカルボキシメチルセルロースの分解剤。
(2)前記微生物がセルロモナス属細菌である、(1)の分解剤。
(3)セルロモナス属細菌がセルロモナス・ゲリダである、(2)の分解剤。
(4)セルロモナス・ゲリダがセルロモナス・ゲリダFERM P-20932株である、(3)の分解剤。
(5)前記微生物がスタフィロコッカス属細菌である、(1)の分解剤。
(6)スタフィロコッカス属細菌がスタフィロコッカス・エスピー C1(NITE AP-366)株である、(5)の分解剤。
(7)前記微生物がバチルス属細菌である、(1)の分解剤。
(8)バチルス属細菌がバチルス・エスピー C4(NITE AP-367)株である、(7)の
分解剤。
(9)放射線架橋されたカルボキシメチルセルロースに排水を吸収させ、排水を吸収した放射線架橋されたカルボキシメチルセルロースを(1)〜(8)のいずれかの分解剤を用いて分解することを特徴とする、排水の処理方法。
(10)放射線架橋されたカルボキシメチルセルロースを含む廃棄物に(1)〜(8)のいずれかの分解剤を添加して該廃棄物を分解することを特徴とする、放射線架橋されたカルボキシメチルセルロースを含む廃棄物の処理方法。
(11)(1)〜(8)のいずれかの分解剤を含む、排泄物の堆肥化促進補助剤。
(12)セルロモナス・ゲリダFERM P-20932株。
(13)スタフィロコッカス・エスピー C1(NITE AP-366)株。
(14)バチルス・エスピー C4(NITE AP-367)株。
【発明の効果】
【0006】
本発明の放射線架橋CMC分解剤を用いることにより、し尿等の排水を吸収させた放射線架橋CMCゲルを効率よく分解することができるため、環境に負荷をかけることなく排水の処理ができる。生成したCMCゲル液化物質は、分解剤に含まれる微生物によって無機化されるため、排水内において、生物学的酸素要求量(BOD値)を増加させない。
また、放射線架橋CMCゲルは、畜産排泄物に投入すると、それを脱水し、排泄物の堆肥化を促進する。堆肥中でのCMCゲルが消失せずに残った場合、堆肥中に再び水が流出し、微生物の好気的醗酵を阻害し、堆肥化が進まない。本発明によるCMCゲル分解生物製剤を投入することにより、放射線架橋CMCを分解して十分な醗酵熱を得るとともに乾燥状態を保持し、排泄物の堆肥化を十分に進行させることができる。
また、放射線架橋CMCゲルを吸水材として用いた、水分を含む使用後のオムツや生理用品の処理剤としても本発明の分解剤は利用可能である。
【発明を実施するための最良の形態】
【0007】
以下に本発明を詳しく説明する。
本発明は、セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される微生物を用いた、放射線架橋されたCMC(放射線架橋CMC、放射線架橋CMCゲルまたは単にCMCゲルとも呼ぶ)の分解剤に関する。
ここで、放射線架橋CMCゲルとしては、例えば、特開2001-002703号公報に記載の方法によって作製されたCMCゲルが挙げられる。具体的には、CMC100重量部及び水5〜2,000重量部からなる混合物に放射線を照射することによって得られる架橋CMCであることが好ましい。CMCの平均重合度には特に制限はないが、例えば、10〜2,000、好ましくは50〜1,000である。カルボキシメチル基の導入率は、例えば、0.5以上、好ましくは0.8以上、さらに好ましくは1.0以上である。本発明の微生物を用いることにより、カルボキシメチル基の導入率の高い(導入率が1.0以上の)放射線架橋CMCゲルでも効率よく分解することができる。放射線照射処理に使用される放射線としては、α線、β線、γ線、X線、電子線、紫外線等を使用することができるが、コバルト60からのγ線、工業的に利用されている加速器からの電子線、X線がより好ましい。放射線の照射量はγ線換算0.1〜50kGyであり、好ましくは0.3〜20kGyである。放射線架橋CMCゲルのゲル分率は、例えば、10〜100%、好ましくは50〜100%、より好ましくは70〜100%である。
【0008】
なお、本発明において、「放射線架橋CMCゲルを分解する」とは、単に放射線架橋CMCゲルを切断して低分子に断片化することを意味するのではなく、放射線架橋CMCゲルを低分子に断片化し、さらに、資化して無機化することまでを意味する。
微生物が放射線架橋CMCゲルを資化して無機化することは、例えば、放射線架橋CMCゲルを唯一の炭素源とする培地において微生物が生育できることによって確認できる。
セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される微生物は、放射線架橋CMCゲルを断片化する能力とともに資化する能力も有しているため、放射線架橋CMCゲルの分解剤として優れている。
【0009】
分解剤として使用しうるセルロモナス属細菌としては、放射線架橋CMC分解能を有するセルロモナス属に属する細菌であれば特に制限されないが、セルロモナス ゲリダ(Cellulomonas gelida)、セルロモナス フィミ(Cellulomonas fimi)、セルロモナス フラビゲナ(Cellulomonas flavigena)、セルロモナス ウダ(Cellulomonas uda)などが挙げられ、この中では、セルロモナス・ゲリダ(Cellulomonas gelida)が好ましい。
セルロモナス・ゲリダとしては、例えば、セルロモナス・ゲリダNKCM7206株を使用することができる。
【0010】
セルロモナス・ゲリダNKCM7206株は、群馬県高崎市の土壌より分離された細菌で、産業枝術総合研究所特許生物寄託センター(茨城県つくば市東1-1-1 つくばセンター 中央第6)に受託番号FERM P-20932として寄託された(寄託日は平成18年6月8日)。
【0011】
セルロモナス・ゲリダNKCM7206株の菌学的性質を以下に示した。
尚、本菌株の同定の当たっては、新細菌培地学講座(第2版、近代出版)、医学細菌同定の手引き(第2版、近代出版)、細菌学実習提要(丸善)に準じて実験を行い、実験結果をBergey's Manual of Systematic Bacteriology VOL. 1(1984)を参考にして同定した。
【0012】
<セルロモナス・ゲリダNKCM7206株の菌学的性質>
(a) 形態的特徴
(1)細胞形態:桿菌
(2)運動性:−(懸滴法)
(3)普通寒天培地上での生育:生育は良好。色調は淡黄色
(b)生理生化学的性状
(1)グラム染色: 陽性
(2)好気条件での生育: +
(3)嫌気条件での生育: −
(4)生育温度: 25℃+30℃ +
(5)生育pH: pH7.0 +
(6)色素の産生: LB培地 なし
(7)アミノペプチダーゼ: +
(8)硝酸塩還元性: +
(9)グルコース酸化: −
(10)インドールの産生: −
(11)アルギニンデヒドロラーゼ: −
(12)ウレアーゼ: −
(13)エスクリンの液化: +
(14)ゼラチンの液化: +
(15)β−グルコシダーゼ:+
(16)炭素源の資化性:グルコース +、L−アラビノース +、D−マンノース +、D-マンニトール −、N-アセチル-D-グルコサミン −、マルトース +、グルコン酸 −、n-カプリン酸 −、アジピン酸−、dl-マレイン酸 − 、クエン酸 − 、フェニル酢酸 −
【0013】
さらに16Sリボゾームの塩基配列解析結果から、セルロモナス属細菌特有の高いG+C含率を示した。また、本菌株の16Sリボゾーム塩基配列は、特にセルロモナス・ゲリダX79461株と高い一致(98.9%)を示した。これにより、セルロモナス・ゲリダNKCM7206株と名づ
けた(図1)。
この菌株の脂肪酸組成の第一成分は、a-C 15:0であり、第二成分は、C 13:0であった。また、イソプレノイドキノン解析結果よりMK-9が主成分であることがわかった。
【0014】
分解剤として使用しうるスタフィロコッカス属細菌としては、放射線架橋CMC分解能を有するスタフィロコッカス属に属する細菌であれば特に制限されないが、スタフィロコッカス・エスピー C1株が好ましい。
【0015】
スタフィロコッカス・エスピー C1株は、群馬県桐生市の土壌より分離された細菌で、製品評価技術基盤機構特許微生物寄託センター(千葉県木更津市かずさ鎌足2-5-8)に受領番号NITE AP-366として寄託された(寄託日は平成19年5月18日)。
【0016】
スタフィロコッカス・エスピー C1株の菌学的性質を以下に示した。
尚、本菌株の同定の当たっては、新細菌培地学講座(第2版、近代出版)、医学細菌同定の手引き(第2版、近代出版)、細菌学実習提要(丸善)に準じて実験を行い、実験結果をBergey's Manual of Systematic Bacteriology VOL. 1(1984)を参考にして同定した。
【0017】
<スタフィロコッカス・エスピー C1株の菌学的性質>
(a) 形態的特徴
(1)細胞形態:桿菌
(2)運動性:−(懸滴法)
(3)普通寒天培地上での生育:生育は良好。色調は淡黄色
(b)生理生化学的性状
(1)グラム染色: 陽性
(2)好気条件での生育: +
(3)嫌気条件での生育: −
(4)生育温度: 25℃+30℃ +
(5)生育pH: pH7.0 +
(6)色素の産生: LB培地 なし
(7)アミノペプチダーゼ: +
(8)硝酸塩還元性: +
(9)グルコース酸化: −
(10)インドールの産生: −
(11)アルギニンデヒドロラーゼ: −
(12)ウレアーゼ: +
(13)エスクリンの液化: +
(14)ゼラチンの液化: −
(15)β−グルコシダーゼ:+
(16)炭素源の資化性:グルコース +、L−アラビノース +、D−マンノース +、D-マンニトール +、N-アセチル-D-グルコサミン +、マルトース +、グルコン酸 +、n-カプリン酸 −、アジピン酸−、dl-マレイン酸 +、クエン酸 −、フェニル酢酸 −
【0018】
分解剤として使用しうるバチルス属細菌としては、放射線架橋CMC分解能を有するバチルス属に属する細菌であれば特に制限されないが、バチルス・エスピー C4株が好ましい。
【0019】
バチルス・エスピー C4株は、群馬県桐生市の土壌より分離された細菌で、製品評価技術基盤機構特許微生物寄託センター(千葉県木更津市かずさ鎌足2-5-8)に受領番号NITE AP-367として寄託された(寄託日は平成19年5月18日)。
【0020】
バチルス・エスピー C4株の菌学的性質を以下に示した。
尚、本菌株の同定の当たっては、新細菌培地学講座(第2版、近代出版)、医学細菌同定の手引き(第2版、近代出版)、細菌学実習提要(丸善)に準じて実験を行い、実験結果をBergey's Manual of Systematic Bacteriology VOL. 1(1984)を参考にして同定した。
【0021】
<バチルス・エスピー C4株の菌学的性質>
(a) 形態的特徴
(1)細胞形態:桿菌
(2)運動性:−(懸滴法)
(3)普通寒天培地上での生育:生育は良好。色調は淡黄色
(b)生理生化学的性状
(1)グラム染色: 陽性
(2)好気条件での生育: +
(3)嫌気条件での生育: −
(4)生育温度: 25℃+30℃ +
(5)生育pH: pH7.0 +
(6)色素の産生: LB培地 なし
(7)アミノペプチダーゼ: +
(8)硝酸塩還元性: +
(9)グルコース酸化: −
(10)インドールの産生: −
(11)アルギニンデヒドロラーゼ: −
(12)ウレアーゼ: −
(13)エスクリンの液化: +
(14)ゼラチンの液化: +
(15)β−グルコシダーゼ:+
(16)炭素源の資化性:グルコース +、L−アラビノース −、D−マンノース +、D-マンニトール −、N-アセチル-D-グルコサミン −、マルトース +、グルコン酸 +、n-カプリン酸 −、アジピン酸−、dl-マレイン酸 +、クエン酸 +、フェニル酢酸 −
【0022】
これらの菌株を放射線架橋CMCの分解剤として用いる場合、適当な培養条件で増殖させて得られた菌体を用いることが好ましい。セルロモナス・ゲリダNKCM7206株、スタフィロコッカス・エスピー C1株、バチルス・エスピー C4株は、例えば、CMCゲルを含む表1の培地で、25〜30℃で培養することができる。
なお、セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される微生物の処理物を本発明の分解剤として使用してもよい。菌体の処理物としては、例えば、菌体をアクリルアミド、カラギーナン等で固定化した固定化菌体、菌体を破砕した破砕物、放射線架橋CMC分解酵素を含む遠心分離上清、又はその上清を硫安処理等で部分精製した画分等が挙げられる。
【0023】
なお、セルロモナス・ゲリダNKCM7206株、スタフィロコッカス・エスピー C1株、バチルス・エスピー C4株の変異株や、遺伝子組み換え株などの派生株を使用することもできる。例えば、これらの株をX線や紫外線の照射、またはN−メチル−N'−ニトロ−N−ニトロソグアニジン(NTG)、エチルメタンスルフォネート(EMS)等の変異剤で処理し、放射線架橋CMCの分解能がさらに高められた株を選択し、それを用いてもよい。また、セルラーゼなどの遺伝子を導入して放射線架橋CMCの分解能がさらに高められる用に改変された株を用いてもよい。
【0024】
なお、本発明の分解剤として使用しうる微生物、上記の株に限定されず、その他のセルロモナス属に属する株、バチルス属に属する株およびスタフィロコッカス属に属する株を使用することもできる。例えば、土壌などから単離された微生物について、後述の実施例に示すように、放射線架橋CMCを含む培地で培養し、さらに培地にCMC沈殿剤(例えば、へキサデシルメチルアンモニウムブロマイド)を加え、コロニー周辺にクリアゾーンを形成することのできる微生物を選択し、それを用いてもよい。
【0025】
本発明の分解剤は、セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される少なくとも1種類の微生物、またはその処理物を、水等の液体に単に懸濁することにより製造することもできるが、他の成分を配合し、液剤、粉剤、粒剤等の製剤として製造することもできる。他の配合成分としては、液体担体、固体担体、界面活性剤(乳化剤、分散剤、消泡剤等)、補助剤等が挙げられ、これらの1種又は2種以上を混合して使用することもできる。
本発明の分解剤に含まれる放線菌の濃度は、本発明の効果を損なわない限り特に制限はないが、製剤として104〜1011 CFU/g(コロニー形成単位)、好ましくは105〜1010 CFU/g(コロニー形成単位)である。
【0026】
本発明の分解剤は、排水処理に適用することができる。すなわち、放射線架橋されたCMCに排水を吸収させ、排水を吸収した放射線架橋CMCを本発明の分解剤を用いて分解することによって、環境に負荷をかけることなく効率よく排水の処理ができる。
本発明の分解剤は、放射線架橋CMCを含む廃棄物の分解に使用することができる。放射線架橋されたCMCを含む廃棄物としては、放射線架橋されたCMCを吸水剤として含むオムツや生理用品の使用後の廃棄物、放射線架橋されたCMCを含む生ごみなどが挙げられる。
また、本発明の分解剤は、排泄物の堆肥化促進補助剤として使用することもできる。放射線架橋CMCゲルは、畜産排泄物に投入すると、それを脱水し、排泄物の堆肥化を促進する。堆肥中でのCMCゲルが消失せずに残った場合、堆肥中に再び水が流出し、微生物の好気的醗酵を阻害し、堆肥化が進まない。そこで、本発明によるゲル分解生物製剤を投入することにより、放射線架橋CMCを分解して十分な醗酵熱を得るとともに乾燥状態を保持し、排泄物の堆肥化を十分に進行させることができる。
【実施例】
【0027】
以下に実施例を示し、本発明をさらに具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0028】
1-1.試薬
CMCゲルは、置換度1.36、分子量110万のCMC1380(ダイセル化学社製)を特開2001-002703号公報に記載された方法によって放射線架橋し作製した。
【0029】
1-2. 放射線架橋CMCゲル分解菌の集積培養
放射線架橋CMCゲル分解菌の単離は、日本原子力研究開発機構高崎量子応用研究所の土壌などを微生物接種源として集積培養法を用いて行った。集積培養は0.3%放射線架橋CMCゲルを加えた基本培地100mL(表1)に採取した土等を入れ、1段目として30℃で振とう培養を行ない、さらに2段目、3段目と同様の操作を行い、放射線架橋CMCゲル分解菌の濃縮を行った。
【0030】
【表1】

【0031】
1-3. 放射線架橋CMCゲル分解菌の単離
集積培養液を、10-3〜10-8 倍希釈した。希釈液100μLをLB培地に塗布した。微生物の純化は、画線培養法によった。0.3% 放射線架橋CMCと0.2%寒天を添加した基本培地(表1)に、単離微生物を接種した。培地にCMC沈殿剤(1%へキサデシルメチルアンモニウムブロマイド)を加え、コロニー周辺のクリアゾーン形成の有無を観察した。
【0032】
1-4.単離株の生化学的、生理学的性質
単離した12株の中で、放射線架橋CMCプレート上で最も明確なクリアゾーンを形成したNKCM7206株と、対照株としてセルロモナス・ゲリダNBRC3748株について、アミノペプチダーゼの生産をアミノペプチダーゼテスト(メルク社製)を使用して調べた。その他の生化学的テスト、および炭素源資化性テストは、グラム陰性菌同定キットAPI 20NE(ビオメリューバイオテック社製)を用いた。
【0033】
1-5.酵素プロファイル
酵素プロファイルは、半定量性酵素活性キット APIZYM(ビオメリューバイオテック社製)を使用して作成した。
【0034】
1-6.ゲノムDNA抽出
NKCM7206株とセルロモナス・ゲリダNBRC3748株を各々LB培地100mLに植菌し、30℃で一晩振とう培養した。対数増殖期初期にある菌体を遠心分離(5000rpm、10分間、4℃)により回収した。得られた菌体を、TEバッファー8.505mLに懸濁した。懸濁液にリゾチーム85mgを加え、37℃で9時間保温した。その後、10% SDS 450μL、Proteinase K 45μLを加え、50℃で1晩保温した。続いて等量のフェノール:クロロホルム:イソアミルアルコール(25:24:1, v/v)を加え室温で30分間穏やかに振とうした。その後、遠心分離(8000rpm、30分間、室温)により上層を回収した。回収した上層に、等量のイソプロパノール、1/10倍量の5M NaClを加え、ゲノムDNAを沈殿させて回収し、70%エタノール1mLですすいだ。ゲノムDNAを減圧乾燥させた後、TEバッファー9mLに溶かした。続いて、Ribonuclease A (シグマ社製)1μLを加え、37℃で1時間保温し、RNAを分解した。再度フェノール/クロロホルム抽出を行い、イソプロパノール沈殿によりゲノムDNAを回収し、減圧乾燥させた後、TEバッファー500μLに溶かした。
【0035】
1-7. G+C含率
1-7-1.ヌクレオシド試料の作製
0.4mg/mLに調製したゲノムDNA溶液(1-6参照)20μlを100℃で5分間保ち、氷水中で急冷した。このゲノム溶液に、ヌクレアーゼP1溶液20μLを加え、この50℃で1時間保ち、ヌクレオチドとした。これにエビアルカリフォスファターゼ(べーリンガー社製)1μLを加えて、37℃で1時間保ち、脱リン酸化することにより、ヌクレオシド試料とした。ヌクレオシド試料を、すみやかに高性能液体クロマトグラフイー(HPLC)分析に供した。
【0036】
1-7-2.高性能液体クロマトグラフイー(HPLC)による分析
HPLCシステムは島津社製のものを使用した。カラムは、LICHROSPHER 100 RP-8 (CS、メルク社製、0.4×25cm)を用いた。試料は、島津社製のオートインジェクター(SIL-10AD)を用いて、50μLずつ注入した。溶出は、流速 1mL/minで、溶媒として0.02M NH4H2PO4 溶液(pH無調整)−アセトニトリル(20:1, v/v)を用いて行った。検出は、島津社製のSPD-10Aを用いて、260nmにて行った。ゲノム DNAのG+C含率は以下の式(1)、また基準となるλDNA を用いて明確なピークが出たAとCから理論値と比較し、補正を行なうことで正確な G+C 含率を式(2)を用いて算出した。
【数1】

【0037】
1-8.イソプレノイドキノン解析
1-8-1.菌体からのキノン抽出
NKCM7206株を、各々LB培地200mLに植菌し、30℃で一晩振とう培養した。遠心分離 (5000rpm、10分間、4℃)により菌体を回収した。滅菌生理的食塩水に菌体を再懸濁し、遠心分離(5000rpm、10分間、4℃)により菌体を回収した。これを2回繰り返し、菌体を洗浄した。得られた菌体を凍結乾燥させた。凍結乾燥菌体約200mgを、十分粉砕した。この粉砕菌体に、20mLのクロロホルム−メタノール(2:1, v/v)を加えて浸漬し、一晩暗所に放置した。その後、これをろ過し、ろ紙上の菌体をクロロホルム−メタノールですすいだのち、そのろ液を集めた。続いて、このろ液をロータリーエバポレーターで濃縮乾固した。このとき、ウォーターバスの温度は40℃以下に設定した。残漬にアセトン1.5mLを加え、抽出した。これを2回繰り返し、アセトン画分を、窒素ガス気流下で、200μLに濃縮した。次に、TLCによる精製を行った。濃縮したアセトン溶液全量を、蛍光剤入りシリカゲル TLC(Kiesel-gel 60F254、メルク社製)にアプライした。このとき、標準物質として、ビタミン K1 をあわせて展開し展開溶媒にはへキサン−べンゼン−クロロホルム(5:2:1,v/v)を使用した。紫外線照射装置(310nm) を用いてスポットを確認し、ビタミン K1の少し上にでてきたメナキノンのスポットのシリカゲルをかきとった。これを2mLのアセトンで2回抽出した。還心分離により、上清を回収し、窒素ガス気流下で 20μLに濃縮した。
【0038】
1-8-2 分子種の同定
精製した試料を、逆相型 TLC (KC8 Octyl reversed phase 、Whatman 社製)を用いて、展開した。展開溶媒には、アセトン−水(99:1, v/v)を用いた。紫外線照射装置(310nm)を用いて、スポットを確認した。
【0039】
1-9.菌体脂肪酸組成解析1-9-1.脂肪酸メチルエステルの調製
NKCM7206株、セルロモナス・ゲリダをLB培地 200mLに植菌し、30℃で一晩振とう培養した。遠心分離(5000rpm、10分間、4℃)により菌体を回収した。滅菌生理的食塩水に菌体を再懸濁し、遠心分離 (5000rpm、10分間、4℃)により菌体を回収した。これを2回繰り返し、菌体を洗浄した。この湿菌体40mgにアルカリけん化液 1mLを加えた。これを100℃で5分間保った後、5〜10秒間よく振り、さらに100℃で25分間保温した。その後、流水で温度を下げ、メチル化試薬 2mlを加え、80℃で10分間保温した。流水で温度を下げた後、抽出用溶媒 1.25mlを加え、室温で 10分間ゆっくり攪拌した。その後、水相を取り除き、残った溶媒相に洗浄液 3mlを加え、室温で5分間ゆっくり攪拌した。この溶媒相の 2/3を取り、ガスクロマトグラフイー(GC)用の分析試料とした。
【0040】
1-9-2.ガスクロマトグラフィー(GC)解析
GC による測定条件は、ディテクター温度260℃、インジェクター温度255℃、カラムオーブン初期温度150℃、初期温度保持時間 4min、力ラム昇温速度 4℃/min、カラム最終温度 250℃、昇温最終温度保持時間 20min である。カラムは、ニュートラボンド−1(GLサイエンス社製、30×0.25mm)を使用した。ピークの検出はFID法によった。ピークの同定には、バクテリア同定用標準物質バクテリア酸メチルエステル(BAME) ミックス(スペルコ社製)を用いた。
【0041】
1-10. NKCM7206 のリボソーマル DNA 配列解析
16Sリボソーマル DNA (rDNA)を PCR 法により増幅した。使用したプライマーは 16Sf (5'-GTTTGATCATGGCTCAG-3':配列番号1)、16Sr (5'-TACCTTGTTACGATTCA-3':配列番号2)であり、これらを各々20pmol用いた。テンプレートは、後、急冷することにより変性させ、コロニーを 5μL の滅菌 MilliiQ 水に懸濁し、98℃、10分間保温し、これを鋳型とした。サーマルサイクルは、94℃5分→(94℃20秒、55℃30 秒、72 ℃2分)×25回、72℃10分の条件で実行された。酵素は ExTaq polymerase (TaKaRa社製)を用いた。PCR産物を、pGEM-T Easy Vector(プロメガ社製)に連結した。この組み換えプラスミドを Ecoli DH5αに形質転換した。LAプレートに生えて来たコロニーをレプリカしインサートを確認した。得られた組み換えプラスミドをシークエンシング解析した。シークエンシングサンプルは PCR法により調製された。シークエンシングには、CEQ2000(べックマン・コールター社製)を用いた。塩基配列及び相同性解析は、プログラム GENETYXあるいはプログラムblastnを用いて行った。得られた塩基配列を基に、CLUSTALW法を用いてアライメントし、NJ法により系統樹を作成した。
【0042】
1-11. ゲル濃度と増殖曲線
100mLの基本培地(液体)に0.1、0.2、あるいは0.3%の放射線架橋CMCゲルを添加し、さらにNKCM7206株を植菌し、その増殖程度を調べた。振盪培養は、120ストローク/分、30℃で行われた。初期の菌数は、LB培地で前培養し、それを50μL添加することにより、初期菌量を一定にした。菌体の増殖は、分子吸光度計(日立U2000)で、一定時間ごとに測定した。
【0043】
1-12. 培地中のイーストエキス濃度とNKCM7206株の上清中のCMCゲル分解活性発現
基本培地中のイーストエキス濃度を0から1%の間で変えて培地を作製した。NKCM7206株を植菌し、72時間、各培地で120ストローク/分、30℃で培養後、その培養上清を回収した。この培養上清中の放射線架橋CMCゲル分解活性を測定するために、上清1mLと0.1Mリン酸緩衝液および10mg放射線架橋CMCゲルを混ぜ、10時間30℃で静置した。その後、水溶性分解物を全有機炭素測定装置(島津社製)を用いて、定量した。水溶液中の全有機炭素量からゲル分解率を計算した。
【0044】
2.結果
2-1. 放射線架橋CMC分解微生物の単離
1-2で記述した土壌を摂取源として、CMC寒天培地にクリアゾーンを形成する細菌 10株を単離した。単離株を NKCM7203〜7212株と命名した。10株のうち、NKCM7206株が最も明瞭なクリアゾーンを形成したので、この株を以下、詳細に解析した。
【0045】
2-2. 放射線架橋CMCゲル分解微生物 NKCM7206 株の生理学的・生化学的性質
表2にNKCM7206株の生理・生化学的性質解析の実験結果を示す。NKCM7206株の対照株には、16SrDNA解析で相同性が98.9%であったセルロモナス・ゲリダX79461株を用いた。
【0046】
【表2】

【0047】
2-3. 放射線架橋CMCゲル分解菌NKCM7206株の酵素生産能力測定
表3にNKCM7206株のAPIAYMによる酵素プロファイルを示す。 NKCM7206株はβ−glucosidase 活性を示した。このことにより放射線架橋CMCゲルが分解されていることが示唆された。
【0048】
【表3】

【0049】
2-4. CMC分解菌 NKCM7206株のG+C含率
表4にNKCM7206株と対象株セルロモナス・ゲリダNBRC3748株についてのG+C含率の結果を示した。単離株、対照株ともセルロモナス属特有の高いG+C含率を示した。
【0050】
【表4】

【0051】
2-5. 放射線架橋CMC分解菌NKCM7206株の菌体脂肪酸解析
表5に NKCM7206株と対照株セルロモナス・ゲリダNBRC3748株についての菌体脂肪酸解析の結果を示した。単離株、対照株ともに、脂肪酸組成の第一成分は、 a-C 15:0であった
。単離株の第二成分は、 C 13:0であった。
【0052】
【表5】

【0053】
2-6. 放射線架橋CMC分解菌NKCM7206株のイソプレノイドキノン解析
表6 にNKCM7206株と対照株セルロモナス・ゲリダNBRC3748株についてのイソプレノイドキノン解析の結果を示した。単離株、対照株とも MK-9 が主成分であった。
【0054】
【表6】

【0055】
2-7. 放射線架橋CMC分解菌 NKCM7206株の16S rDNA配列解析
放射線架橋CMCゲル分解菌であるNKCM7206の16S rDNA解析を 1−10に従った。図1に、進化系統樹を示す。NKCM7206株の16S rDNA 配列(配列番号3)は、セルロモナス・ゲリダNBRC3748株のそれと98.9%の相同性が見られた。
【0056】
2-8. ゲル濃度と増殖曲線
0.1、0.2、あるいは0.3%の放射線架橋CMCゲルを含む培地中の増殖曲線を図2に示した。NKCM7206株は、0.1%放射線架橋CMCゲルを含む培地で最も生育速度が大きかった。0.2、0.3%となるごとに、誘導期の始まりの時間は遅れた。一方、最大増殖程度は、ゲルの濃度に関係なく、ほぼ同じであった。
【0057】
2-9. 培地中のイーストエキス濃度とNKCM7206株の上清中の放射線架橋CMCゲル分解活性発現
イーストエキス濃度を0から1%の間で変えたときのNKCM7206株の放射線架橋CMCゲル分解活性を図3に示した。上清中の放射線架橋CMCゲル分解活性は、培地中に0.05%イーストエキスを含むときに最大となることが判明した。また、その際の、10時間ゲル分解率は
、約40%に達した。
【0058】
なお、NKCM7206株は結晶セルロース(アビセル:旭化成社製)および非架橋CMCの分解能も有していることが確認された。
さらに、それ以外の放射線架橋CMC分解菌NKCM7203〜7205、7207〜7212株についても解析した結果、そのうちのNKCM7210株とNKCM7211株がセルロモナス・ゲリダであると同定された。
【0059】
さらなる種類のCMCゲル分解菌を得るために、群馬県桐生市の山の土壌を微生物接種源として更なるスクリーニングを行った。
集積培養は1%のCMC加水分解物およびCMCゲル加水分解物を用いて、0.2% CMC加水分解物およびCMCゲル加水分解物を加えた基本培地100mLに採取した土壌を1g加え、30℃で10日培養した(1段階目)。その後、培養液1mLを同様の培地に植え継ぎ、さらに10日培養した(2段階目)。さらに同様の操作を行った(3段階目)。
CMCゲル分解菌の単離は、集積培養法によって得られた3段階目培養液を希釈系列(10-1〜10-6)で希釈し、100mLをLB培地に塗布し、微生物の純化を行った後、分解菌を単離した。
得られた微生物の中から、C1株とC4株の2種類を選択し、さらに以下の解析を行った。
【0060】
上記1-6の手順に従って、3段階目集積培養液からゲノムDNAの抽出を行った。
得られたゲノムDNAを鋳型とし、PCR法により、上記1-10の手順に従って、ゲノムDNA上の16SrDNAを解析した。使用したプライマーは16Sf (5'-GTTTGATCATGGCTCAG -3')(配列番号1)/16Sr (5'-TACCTTGTTACGATTCA-3')(配列番号2)、あるいは27f (5'-AGAGTTTGATCCTGGCTCAG-3')(配列番号4)/1525r (5'-AAAGGAGGTGATCCAGCC-3')(配列番号5)であり、これらを各々20pmol用いた。
塩基配列および相同性解析は、プログラムGENETYXあるいはプログラムBLASTを用いて行った。得られた塩基配列(C1株:配列番号6、C4株:配列番号7)を基に、CLUSTALW法を用いてアライメントし、NJ法により系統樹を作成した(図4)。なお、図4において、C2、C3、C5、CGはC1およびC4と同時に単離された微生物である。図4から、C1株の16SrRNA配列は Staphylococcus、C2株,C4株,CG株はBacillus、C3株はAcinetobacter、C5株は Flavobacteriumと近い菌種である事がわかった。
【0061】
C1株とC4株についてのアミノペプチダーゼの生産をアミノペプチダーゼテスト(メルク社製)を使用して調べた。その他の生化学的テスト、および炭素源資化性テストは、グラム陰性菌同定キットAPI 20NE(ビオメリューバイテック社製)を用いた。結果をNKCM7206株と比較して表7に示す。
【0062】
【表7】

【0063】
酵素プロファイルは、半定量性酵素活性キット APIZYM(ビオメリューバイテック社製)を使用して作成した。結果をNKCM7206株と比較して表8に示す。C1株、C4株ともβ−glucosidase活性を示し、さらにセルロースの分解物であるグルコースの同化を示した。
【0064】
【表8】

【0065】
CMCゲル資化能力の評価
C1、C4およびNKCM7206株を接種源とし、膨潤交換処理を行ったCMCゲルをステンレス金網(200メッシュ)入れた、0.1% CMCゲル基本培地で30℃、60時間振とう培養を行った。その後、濁度法で培養液の菌体増殖(OD600)およびステンレス金網内のCMCゲルの重量減少を調べる事により、それぞれ3株によるCMCゲルの資化を調べた。
【0066】
CMCゲル分解活性は以下のようにして測定した。
C1、C4およびNKCM7206株を接種源とし、0.1% CMC基本培地で30℃、60時間振とう培養を行った。培養上清を遠心分離(4℃、10000rpm、10分間)し、そのうち100℃、10分間で失活させたものをネガティブコントロールとした。100mMリン酸緩衝液を19.5mL、膨潤交換処理CMCゲル20mg、培養上清を500μL加え、37℃で15時間酵素分解させた。その後、CMCゲル分解活性をTOC(total organic carbon)計を用いて測定した。
蛋白質定量はBradford法を用い、牛血清アルブミン(BSA)を基準物質とした。
【0067】
C1、C4およびNKCM7206株のCMCゲル資化性とCMCゲル分解活性を表9にまとめた。
いずれの株もCMCゲル資化性とCMCゲル分解活性の両方を持っていることがわかり、資化性はC4株が最も高く、分解活性はC1株が最も高いことがわかった。
【0068】
【表9】

【図面の簡単な説明】
【0069】
【図1】NKCM7206株の進化系統樹を示す図。
【図2】NKCM7206株の放射線架橋CMCゲルを含む培地中での増殖曲線を示す図。
【図3】イーストエキス濃度を変えたときのNKCM7206株の放射線架橋CMCゲル分解活性を示す図。
【図4】C1株とC4株の進化系統樹を示す図。
【特許請求の範囲】
【請求項1】
セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される1種類以上の微生物を含む、放射線架橋されたカルボキシメチルセルロースの分解剤。
【請求項2】
前記微生物がセルロモナス属細菌である、請求項1に記載の分解剤。
【請求項3】
セルロモナス属細菌がセルロモナス・ゲリダである、請求項2に記載の分解剤。
【請求項4】
セルロモナス・ゲリダがセルロモナス・ゲリダFERM P-20932株である、請求項3に記載の分解剤。
【請求項5】
前記微生物がスタフィロコッカス属細菌である、請求項1に記載の分解剤。
【請求項6】
スタフィロコッカス属細菌がスタフィロコッカス・エスピー C1(NITE AP-366)株である、請求項5に記載の分解剤。
【請求項7】
前記微生物がバチルス属細菌である、請求項1に記載の分解剤。
【請求項8】
バチルス属細菌がバチルス・エスピー C4(NITE AP-367)株である、請求項7に記載の分解剤。
【請求項9】
放射線架橋されたカルボキシメチルセルロースに排水を吸収させ、排水を吸収した放射線架橋されたカルボキシメチルセルロースを請求項1〜8のいずれか一項に記載の分解剤を用いて分解することを特徴とする、排水の処理方法。
【請求項10】
放射線架橋されたカルボキシメチルセルロースを含む廃棄物に請求項1〜8のいずれか一項に記載の分解剤を添加して該廃棄物を分解することを特徴とする、放射線架橋されたカルボキシメチルセルロースを含む廃棄物の処理方法。
【請求項11】
請求項1〜8のいずれか一項に記載の分解剤を含む、排泄物の堆肥化促進補助剤。
【請求項12】
セルロモナス・ゲリダFERM P-20932株。
【請求項13】
スタフィロコッカス・エスピー C1(NITE AP-366)株。
【請求項14】
バチルス・エスピー C4(NITE AP-367)株。
【請求項1】
セルロモナス属細菌、スタフィロコッカス属細菌およびバチルス属細菌から選択される1種類以上の微生物を含む、放射線架橋されたカルボキシメチルセルロースの分解剤。
【請求項2】
前記微生物がセルロモナス属細菌である、請求項1に記載の分解剤。
【請求項3】
セルロモナス属細菌がセルロモナス・ゲリダである、請求項2に記載の分解剤。
【請求項4】
セルロモナス・ゲリダがセルロモナス・ゲリダFERM P-20932株である、請求項3に記載の分解剤。
【請求項5】
前記微生物がスタフィロコッカス属細菌である、請求項1に記載の分解剤。
【請求項6】
スタフィロコッカス属細菌がスタフィロコッカス・エスピー C1(NITE AP-366)株である、請求項5に記載の分解剤。
【請求項7】
前記微生物がバチルス属細菌である、請求項1に記載の分解剤。
【請求項8】
バチルス属細菌がバチルス・エスピー C4(NITE AP-367)株である、請求項7に記載の分解剤。
【請求項9】
放射線架橋されたカルボキシメチルセルロースに排水を吸収させ、排水を吸収した放射線架橋されたカルボキシメチルセルロースを請求項1〜8のいずれか一項に記載の分解剤を用いて分解することを特徴とする、排水の処理方法。
【請求項10】
放射線架橋されたカルボキシメチルセルロースを含む廃棄物に請求項1〜8のいずれか一項に記載の分解剤を添加して該廃棄物を分解することを特徴とする、放射線架橋されたカルボキシメチルセルロースを含む廃棄物の処理方法。
【請求項11】
請求項1〜8のいずれか一項に記載の分解剤を含む、排泄物の堆肥化促進補助剤。
【請求項12】
セルロモナス・ゲリダFERM P-20932株。
【請求項13】
スタフィロコッカス・エスピー C1(NITE AP-366)株。
【請求項14】
バチルス・エスピー C4(NITE AP-367)株。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2008−11857(P2008−11857A)
【公開日】平成20年1月24日(2008.1.24)
【国際特許分類】
【出願番号】特願2007−154338(P2007−154338)
【出願日】平成19年6月11日(2007.6.11)
【出願人】(504145364)国立大学法人群馬大学 (352)
【出願人】(505374783)独立行政法人 日本原子力研究開発機構 (727)
【Fターム(参考)】
【公開日】平成20年1月24日(2008.1.24)
【国際特許分類】
【出願日】平成19年6月11日(2007.6.11)
【出願人】(504145364)国立大学法人群馬大学 (352)
【出願人】(505374783)独立行政法人 日本原子力研究開発機構 (727)
【Fターム(参考)】
[ Back to top ]

