放射線照射コラーゲン様ペプチドを用いた核酸導入法
【課題】核酸を細胞内へ効率的に導入する手段を提供する。
【解決手段】放射線を照射する処理をされたコラーゲン様ペプチドを含む、核酸の細胞内への導入促進剤、放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、核酸/コラーゲン様ペプチド複合体、並びに放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、医薬組成物。
【解決手段】放射線を照射する処理をされたコラーゲン様ペプチドを含む、核酸の細胞内への導入促進剤、放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、核酸/コラーゲン様ペプチド複合体、並びに放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、医薬組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸を細胞内へ効率的に導入する手段に関する。
【背景技術】
【0002】
近年、疾病に関与する遺伝子の機能を補う、あるいは抑えることによって疾病を治療する、いわゆる遺伝子治療が注目を集めており、既に種々の遺伝子疾患やガン等において、遺伝子治療の臨床研究が行われている。ここで、遺伝子治療に用いられる医薬として実用化が期待されているものとして、RNA干渉(RNAi)を利用する核酸医薬が挙げられる。
【0003】
RNA干渉とは、二本鎖RNAにより引き起こされる、配列特異的な遺伝子発現抑制現象であり、二本鎖RNAのいずれかの配列と相補的な配列を有するmRNAが特異的に分解されることに基づく。すなわち、生体内に導入された二本鎖RNAは、RNaseIIIに属するDicerと呼ばれる酵素により、21塩基程度の短い3’末端突出型の二本鎖RNAであるsiRNA(small interfering RNA)に分解される。生じたsiRNAは、一本鎖に解離して、RNA誘導型サイレンシング複合体(RISC(RNA induced silencing complex))に取り込まれ、取り込まれた一本鎖と相補的な配列を有するmRNAが特異的に分解されると言われている。RNA干渉は、生体内のさまざまな局面で重要な役割を担っていると考えられ、例えば、ウイルス感染に対する防御機構や、ゲノム上を転移する遺伝因子であるレトロトランスポゾンの転移を抑制し、ゲノムの安定性を保つことにも関わっているようである。
【0004】
RNA干渉は、標的遺伝子に対する高い特異性を有し、任意の遺伝子の機能を人為的に抑制できることから、遺伝子機能解析の汎用性の高いツールとして注目され、また、遺伝子治療への応用が期待されている。
【0005】
ここで、RNA干渉を臨床応用するために解決しなければならない課題の1つは、siRNAの生体内への導入法の開発である。すなわち、siRNA単独では、細胞膜を抜けて細胞質には導入されない。これは、siRNAの高い分子量と、核酸の主鎖を構成するリン酸基に基づく強い負電荷が原因である。siRNAを細胞内に導入する方法としては、エレクトロポレーションによる方法、及びリポソーム、特に正電荷リポソームをキャリアとして利用する方法等が知られている。また、その他にも、コラーゲン又はコラーゲン誘導体をキャリアとして利用し、核酸との複合体を形成させることを特徴とする、核酸の細胞内への効率的な導入技術が既に知られている(特許文献1)。
【0006】
生体内及び生体外で効率的な遺伝子発現抑制を達成するための有望なsiRNA導入キャリアの1つはアテロコラーゲン(ATCOL)である(非特許文献1)。ATCOLは、ウシ真皮から得られたI型コラーゲンをペプシンにより処理し高純度に精製すること等により得られる。コラーゲン分子は、N、C両末端にコラーゲンの主要抗原部位であるテロペプチドを有するが、ATCOLは、ペプシン処理によりテロペプチドが除去されており、免疫原性が低く抑えられている。そのため、ATCOLは、生体適合性の高い生体材料であり、創傷治療、人工血管、代用軟骨、止血剤等の広範囲の用途で、臨床上利用されている。
【0007】
本発明者らは、骨格筋の成長を抑制する因子をコードするミオスタチンをターゲットとするsiRNAをATCOLとともにマウスの骨格筋に導入することで、導入から数週間後には筋量が顕著に増大したことを報告しており、ATCOLは核酸の細胞内への導入を促進することが明らかとなっている(非特許文献2)。
【0008】
以上のように、核酸を細胞内へ導入する技術はこれまでに知られているが、コラーゲン様ペプチドを導入キャリアとして用いる核酸の導入法は知られていない。コラーゲン様ペプチドについては、例えば、特許文献2に記載されている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第03/000297号
【特許文献2】特開2005−053878
【非特許文献】
【0010】
【非特許文献1】ヌクレイック・アシッド・リサーチ(Nucl.Acids Res.)2004; 32: e109
【非特許文献2】ジーン・セラピー(Gene Ther)2008; 15: 1126−1130
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、核酸を細胞内へ効率的に導入する手段を提供することを課題とする。
【課題を解決するための手段】
【0012】
本発明者は、コラーゲン様ペプチドの性質を詳細に検討した結果、放射線を照射したコラーゲン様ペプチドを核酸の細胞内への導入キャリアとして利用することで、核酸を効率的に細胞内に導入できることを見出し、本発明を完成させた。
【0013】
すなわち本発明は、以下の通りである。
【0014】
第1の発明は、放射線を照射する処理をされたコラーゲン様ペプチドを含む、核酸の細胞内への導入促進剤であって、コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、導入促進剤である。第1の発明の好ましい態様において、コラーゲン様ペプチドは、ポリ(Pro−Hyp−Gly)である。また、第1の発明の好ましい態様において、放射線は電子線である。また、第1の発明の好ましい態様において、核酸は、siRNAである。
【0015】
第2の発明は、放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、核酸/コラーゲン様ペプチド複合体であって、コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、複合体である。第2の発明におけるコラーゲン様ペプチド、放射線、及び核酸の好ましい態様は、第1の発明と同様である。
【0016】
第3の発明は、放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、医薬組成物であって、コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、医薬組成物である。第3の発明におけるコラーゲン様ペプチド、放射線、及び核酸の好ましい態様は、第1の発明と同様である。
【0017】
第4の発明は、第2の発明の核酸/コラーゲン様ペプチド複合体を保持する医療用又は実験用器具である。
【0018】
第5の発明は、放射線を照射する処理をされたコラーゲン様ペプチドを核酸の細胞内導入キャリアとして用いることを特徴とする、核酸を細胞内に導入する方法であって、コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、方法である。第5の発明におけるコラーゲン様ペプチド、放射線、及び核酸の好ましい態様は、第1の発明と同様である。
【発明の効果】
【0019】
本発明に用いられるコラーゲン様ペプチドは、核酸を細胞内へ導入する際の導入キャリアとして機能する。よって、本発明により、任意の核酸を効率的に細胞内に導入することができる。また、核酸として、特にsiRNAを用いることで、RNA干渉により特定の遺伝子を効率的にノックダウンできる。
【図面の簡単な説明】
【0020】
【図1】図1は、siRNAと各導入キャリアとの複合体を形成した際の、RNaseA共存下でのsiRNA残存量の推移を示すグラフである。
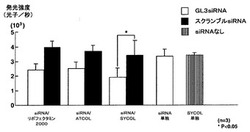
【図2】図2は、GL3siRNA及びスクランブルsiRNAのそれぞれと各導入キャリアとの複合体を形成して細胞に導入した際の、ルシフェラーゼの発現量(発光強度)を示すグラフである。結果は、平均値±標準誤差で示す。
【図3A】図3Aは、ミオスタチンsiRNA及びスクランブルsiRNAのそれぞれをSYCOLと複合体を形成させて咬筋に投与した際の、咬筋の重量を示すグラフである。
【図3B】図3Bは、同条件での、咬筋におけるミオフィブリル(筋原線維)の断面積を示すグラフである。
【図3C】図3Cは、同条件での、咬筋におけるミオスタチンmRNAの量を示すグラフである。
【図4A】図4Aは、GL3siRNAと各導入キャリアとの複合体を形成してマウス頭部に投与した際の、頭部におけるルシフェラーゼの発現量(発光強度)を示すグラフである。
【図4B】図4Bは、同条件での、腹部におけるルシフェラーゼの発現量(発光強度)を示すグラフである。
【発明を実施するための形態】
【0021】
以下、本発明を詳細に説明する。
【0022】
本発明において、コラーゲン様ペプチドは、核酸を細胞内に導入するためのキャリア(輸送担体)として用いられる。すなわち、本発明の核酸を細胞内に導入する方法は、コラーゲン様ペプチドを核酸の細胞内導入キャリアとして用いることを特徴とする。
【0023】
本発明において用いられるコラーゲン様ペプチドとは、機能性ペプチドとしてアミノ酸配列Pro−X−Gly(以下、配列Aとも言う)からなるペプチドユニットを含むペプチドである。配列Aは後述する3重らせん構造の安定性に寄与し、配列Aの割合が少ないと3重らせん構造の安定性が減少する。ここで、XはPro又はHypであり、3重らせん構造の安定性の点からHypであるのが好ましい。なお、Hypは、通常、4Hyp(例えば、trans−4−ヒドロキシ−L−プロリン)残基である。コラーゲン様ペプチドは、(−Pro−X−Gly−)nで表される繰り返し構造を含み、よって、好ましくは(−Pro−Hyp−Gly−)nで表される繰り返し構造を含む。すなわち、コラーゲン様ペプチドの一態様は、(−Pro−Hyp−Gly−)nからなるポリ(Pro−Hyp−Gly)である。なお、(−Pro−X−Gly−)nで表される繰り返し構造において、それぞれのXは独立にPro又はHypであってよい。繰り返し数nは、目的の分子量や、共存する配列に応じて適宜設定することができる。繰り返し数nは、例えば10〜50000であり、20〜5000であるのが好ましく、200〜4000であるのがより好ましい。
【0024】
また、コラーゲン様ペプチドは、機能性ペプチドを含有させることにより機能設計が可能である。例えば、コラーゲン様ペプチドを、特定の細胞や組織に対して特異的に取り込まれるよう改変することもできる。
【0025】
コラーゲン様ペプチドに含有させることのできる機能性ペプチドとしては、アミノ酸配列Pro−Y−Gly−Z−Ala−Gly(配列番号2)(以下、配列Bとも言う)を含むペプチドが挙げられる。ここで、YはGln、Asn、Leu、Ile、Val又はAlaであり、Gln、Asn、Leu、Val、又はAlaであるのが好ましく、Gln又はLeuであるのが特に好ましい。また、ZはIle又はLeuであり、Ileであるのが好ましい。配列Bの存在は、コラゲナーゼによるコラーゲン様ペプチドの分解性を向上させる。よって、配列Bの存在は、コラーゲン様ペプチドを導入キャリアとして用いて、生体内、例えば哺乳動物の生体内に核酸を導入する際に、コラーゲン様ペプチドが分解吸収されるのを補助する。
【0026】
コラーゲン様ペプチドに含有させることのできるその他の機能性ペプチドとしては、例えば、コラーゲン様ペプチドが酵素分解されるのを抑制するアミノ酸配列Gln−Gly−Ile−Ara(配列番号2)、熱応答性を付与するアミノ酸配列Val−Pro−Gly−Val−Gly(配列番号3)、細胞接着性を付与するアミノ酸配列Arg−Gly−Asp、神経分化を促進するアミノ酸配列Tyr−Ile−Gly−Ser−Arg(配列番号4)及びIle−Lys−Val−Ara−Val(配列番号5)等が挙げられる。
【0027】
配列Aと配列Bの比率(モル比)は、例えばA:B=100:0〜30:70であり、100:0〜50:50が好ましく、100:0〜70:30がより好ましく、100:0〜90:10がさらに好ましく、100:0〜95:5が特に好ましい。また、配列Aと配列Bの合計量と、配列A又はB以外のその他の機能性ペプチドの比率(モル比)は、例えばA+B:A+B以外の機能性ペプチド=100:0〜50:50であり、100:0〜70:30が好ましく、100:0〜80:20がより好ましく、100:0〜90:10がさらに好ましく、100:0〜95:5が特に好ましい。
【0028】
また、コラーゲン様ペプチドは、核酸の細胞内への導入キャリアとしての機能を損なわない限り、その他の任意のアミノ酸配列を含んでいてもよい。その他の任意のアミノ酸配列の含有量は、コラーゲン様ペプチド全体に対して、例えばアミノ酸残基数として20%以下であり、好ましくは10%以下、より好ましくは5%以下、さらに好ましくは2%以下、特に好ましくは1%以下である。
【0029】
また、コラーゲン様ペプチドは、上述のペプチドにさらに核酸等が付加されたペプチドであってもよい。
【0030】
コラーゲン様ペプチドの分子量は、好ましくは5×103〜1×107、より好ましくは1×104〜1×106、より好ましくは1×105〜1×106である。例えば、本発明の一態様において、分子量105以上のコラーゲン様ペプチドを用いることができる。分子量は、高分子化合物の分子量を測定する一般的な方法で測定することができる。高分子化合物の分子量を測定する一般的な方法としては、例えば、サイズエクスクルージョンクロマトグラフィー(SEC)が挙げられ、SECとしては、ゲルパーミエーションクロマトグラフィー(GPC)が好適に用いられる。ゲルパーミエーションクロマトグラフィーにより分子量を測定する場合の一態様としては、分離カラムとしてTSKgel G6000PWXL(I.D.7.8mm x L30cm)(東ソー製)を、分子量標準として分子量既知のプルラン、デキストラン、又はポリエチレンオキサイド等を用い、緩衝液を移動相として測定が行われる。
【0031】
コラーゲン様ペプチドは、その一態様において、三重らせん構造を形成し、当該三重らせん構造が複数集合し、直径10nm〜300nmのコラーゲン原繊維を構成し、コラーゲン原繊維がさらに集合して、直径0.5nm〜3nmのコラーゲン様繊維を形成する。
【0032】
コラーゲン様ペプチドを製造する方法は特に限定されず、例えば、アミノ酸やペプチドを縮重合することにより製造できる。例えば、アミノ酸配列Pro−Hyp−Glyからなるトリペプチドを縮重合させることによりポリ(Pro−Hyp−Gly)を製造できる。なお、例えば、ポリ(Pro−Hyp−Gly)を製造する場合には、縮重合に用いられるトリペプチドはHyp−Gly−Proや−GlyPro−Hypからなるトリペプチドであってもよいことは言うまでもない。ペプチドの縮重合は、公知の手法(特開2005−53878等)により行うことができる。また、目的の物性や目的の分子量に応じて、反応条件や共重合させる機能性ペプチドを適宜選択できる。機能性ペプチドを共重合させることにより、機能性の高分子としてコラーゲン様ペプチドを製造できる。
【0033】
コラーゲン様ペプチドは、通常のコラーゲンのような免疫原性を示さないため、例えば医療用素材として優秀である。また、アミノ酸やペプチドの縮重合等の化学合成によりコラーゲン様ペプチドを製造した場合には、動物由来の成分を含まないことから、未知の病原体や病原因子による汚染の可能性がない点で好ましい。
【0034】
本発明において、コラーゲン様ペプチドは、放射線を照射する処理をされて用いられる。コラーゲン様ペプチドは、放射線を照射する処理により、核酸を細胞内に導入するキャリアとしての機能を示すようになる。放射線を照射する処理の態様は特に限定されず、任意の手法により行うことができる。放射線を照射する処理に用いられる放射線の線量は特に限定されないが、例えば、好ましくは1kGy以上、より好ましくは5kGy以上、特に好ましくは10kGy以上の放射線が用いられる。また、放射線の線量の好ましい範囲としては、例えば、1〜1000kGy、50〜500kGy、10〜200kGy等が挙げられる。放射線としては、例えば電子線が好適に用いられる。放射線を照射する処理は、例えば、コラーゲン様ペプチドを含有する溶液に40kGyの電子線を2分間照射することにより行うことができる。
【0035】
本発明において、核酸は、特に限定されず、DNAであってもよく、RNAであってもよい。また、核酸は、DNAとRNAの両方により複合的に構成されていてもよい。核酸は、1本鎖であってもよく、二本鎖であってもよい。また部分的に、1本鎖部分と二本鎖部分が共存していてもよい。また、核酸の配列は、特に制限されず、目的に応じて適宜設定することができる。また、核酸は線状であってもよく、環状であってもよい。例えば、核酸としては、ゲノムDNA、cDNA、プラスミド、ポリヌクレオチド、オリゴヌクレオチド、アンチセンスRNA、siRNA等が挙げられる。また、本発明において、核酸には、核酸として機能するもの、例えばウイルスが含まれる。ウイルスとしては、DNAウイルスでもRNAウイルスでもよい。また、本発明において、核酸は、任意の修飾がなされた核酸を含む。任意の修飾がなされた核酸を、まとめて、核酸誘導体と称する。核酸誘導体としては、蛍光標識された核酸等が挙げられる。本発明において、複数の態様の核酸が同時に存在していてもよく、複数の態様の核酸が同時に細胞内に導入されてもよい。
【0036】
本発明において、核酸としては、siRNAが特に好ましく用いられる。siRNAとは、遺伝子のノックダウン、すなわち遺伝子発現の抑制に用いられる二本鎖RNAであり、その片方の鎖は、ノックダウン対象の遺伝子から転写されるmRNAの少なくとも一部分の塩基配列と相補的な塩基配列を含む。siRNAとしては、通常21〜27塩基程度の3’末端突出型の二本鎖RNAを用いる。また、3’末端は片側あるいは両側とも突出しない場合がある。
【0037】
本発明において、コラーゲン様ペプチドは、核酸と複合体を形成することにより、核酸の細胞内導入キャリアとして機能する。
【0038】
コラーゲン様ペプチドと核酸は、溶媒中で接触することにより、コラーゲン様ペプチド及び核酸を含む核酸/コラーゲン様ペプチド複合体(以下、単に複合体とも言う)を形成する。溶媒としては、特に限定されないが、例えば、水、緩衝液等の水系溶媒が好ましく用いられる。溶媒は、核酸が細胞内に導入されるのを阻害しない限り、任意の成分を含有していてよい。なお、コラーゲン様ペプチドと核酸を接触させ複合体を形成する工程は、特に限定されず、例えば、コラーゲン様ペプチドを含む溶液と核酸を含む溶液を混合することにより行われてもよく、コラーゲン様ペプチド及び核酸の一方を含む溶液にコラーゲン様ペプチド及び核酸のもう一方をさらに溶解させることにより行われてもよく、また、あらかじめコラーゲン様ペプチド及び核酸を混合したものを任意の溶媒に溶解することにより行われてもよい。
【0039】
なお、複合体を形成するとは、コラーゲン様ペプチド及び核酸の少なくとも一部が核酸/コラーゲン様ペプチド複合体を形成すればよい。よって、コラーゲン様ペプチド及び核酸の少なくとも一部は、核酸/コラーゲン様ペプチド複合体を形成せず、単独で存在していてもよい。
【0040】
上記のように核酸とコラーゲン様ペプチドを含む核酸/コラーゲン様ペプチド複合体を形成することで、任意の細胞に、核酸を効率よく導入することができる。核酸/コラーゲン様ペプチド複合体は細胞と混合すること等によって接触させることにより、あるいは、生体に投与することにより、細胞内に核酸が導入される。すなわち、本発明は、合成コラーゲンを核酸の細胞内導入キャリアとして用いることを特徴とする、核酸を細胞内に導入する方法を提供する。なお、当該方法は、in vivoで用いてもよく、in vitroで用いてもよい。また、特定の細胞や組織に特異的に取り込まれるよう改変されたコラーゲン様ペプチドを用いることで、特定の細胞や組織に特異的に核酸を導入することができる。
【0041】
本発明において、コラーゲン様ペプチドと核酸の比率は、特に限定されず、コラーゲン様ペプチドの態様、核酸の態様、核酸を導入する細胞の態様、核酸/コラーゲン様ペプチド複合体の存在態様等に応じて適宜設定できる。コラーゲン様ペプチドの濃度としては、細胞あるいは生体に導入する際の濃度として、0.001%〜5%が好ましく、0.005%〜2%がより好ましく、0.01%〜1%が特に好ましい。コラーゲン様ペプチドは、例えば、0.03%で用いることができる。核酸の濃度としては、核酸の態様、核酸を導入する細胞の態様、核酸/コラーゲン様ペプチド複合体の存在態様等に応じて適宜設定できるが、例えば、0.01mM〜1Mが好ましく、0.1mM〜500mMがより好ましく、1mM〜100mMが特に好ましい。例えば、終濃度10mMでsiRNAを用いることができる。また、例えば核酸/コラーゲン様ペプチド複合体を器具の表面に保持する態様においては、保持される核酸の量としては、核酸の態様、核酸を導入する細胞の態様等に応じて適宜設定できる。例えばアレイ化する場合には、保持される核酸の量が、ウェル当たり好ましくは0.1pmol〜10μmol、より好ましくは1pmol〜1μmolとなるよう核酸/コラーゲン様ペプチド複合体を保持させることができる。このような範囲濃度で核酸を保持するウェルに、例えば3.5x104の細胞を播種することで、セルトランスフェクションアレイを行える。
【0042】
本発明は、コラーゲン様ペプチドを有効成分として含む、核酸の細胞への導入促進剤を提供する。導入促進剤としては、コラーゲン様ペプチドを含む限り特に限定されず、核酸やコラーゲン様ペプチドの態様、及び導入促進剤の利用目的(例えば、疾患の治療に用いるのであれば対象となる疾患の態様等)等に応じて、適宜態様を設定できる。本発明の導入促進剤は、核酸と混合して用いることができる。核酸と混合することにより、少なくとも核酸が細胞内あるいは生体内等に導入される時点において、コラーゲン様ペプチド及び核酸は核酸/コラーゲン様ペプチド複合体を形成する。
【0043】
なお、本発明の導入促進剤は、その一実施態様において、さらに核酸を含んでいてもよい。本発明の導入促進剤が核酸を含む場合に、本発明の導入促進剤に含まれるコラーゲン様ペプチド及び核酸はそれぞれ別個に存在していてもよく、核酸/コラーゲン様ペプチド複合体を形成していてもよいが、少なくとも核酸が細胞内あるいは生体内等に導入される時点において、核酸/コラーゲン様ペプチド複合体を形成する。
【0044】
本発明は、コラーゲン様ペプチド及び核酸を含む医薬組成物(以下、本発明の医薬とも言う)を提供する。本発明の医薬は、核酸及びコラーゲン様ペプチドを含む限り特に限定されず、核酸やコラーゲン様ペプチドの態様、対象となる疾患の態様等に応じて、適宜態様を設定できる。なお、本発明の医薬は、本発明の導入促進剤と核酸を混合することにより調製されたものであってもよい。本発明の医薬を投与することにより、本発明の医薬に含まれる核酸が、細胞内あるいは生体内等に導入される。本発明の医薬に含まれるコラーゲン様ペプチド及び核酸は、それぞれ別個に存在していてもよく、核酸/コラーゲン様ペプチド複合体を形成していてもよいが、少なくとも核酸が細胞内あるいは生体内等に導入される時点において、核酸/コラーゲン様ペプチド複合体を形成する。本発明の医薬を用いることにより、例えば任意の遺伝子の発現プラスミドを導入し、遺伝子機能を補うことができる。また、本発明の医薬を用いることにより、例えば任意の遺伝子に対するsiRNAを導入し、遺伝子発現を抑制することができる。よって、本発明の医薬により、任意の疾病について、遺伝子治療を行うことができる。
【0045】
本発明の医薬の剤形は特に制限されず、具体的には、錠剤、丸剤、散剤、液剤、懸濁剤、乳剤、顆粒剤、カプセル剤、シロップ剤、坐剤、注射剤、軟膏剤、貼付剤、点眼剤、及び点鼻剤等を例示できる。また、製剤化にあたっては、製剤担体として通常使用される賦形剤、結合剤、崩壊剤、滑沢剤、安定剤、矯味矯臭剤、希釈剤、界面活性剤、又は注射剤用溶剤等の添加剤を使用することができる。本発明の医薬は、そのまま、あるいは水、生理食塩水、緩衝液等を用いて希釈又は溶解し、細胞あるいは生体に投与できる。このように希釈あるいは溶解等した場合にも、本発明の医薬の範囲内であることは言うまでもない。なお、本発明の導入促進剤においても、本発明の医薬と同様の剤形や製剤担体を利用できる。また、本発明の導入促進剤においても、本発明の医薬と同様に、希釈あるいは溶解等した場合にも、本発明の導入促進剤の範囲内である。
【0046】
本発明の医薬を生体に投与する方法としては、特に制限されず、例えば経口、注射、点眼、点鼻、経肺、皮膚を介した吸収等の任意の方法により行うことができる。本発明の医薬を生体に投与する方法としては、経口又は注射が好ましい。投与部位は、対象とする疾患等に応じて適宜設定できる。また、本発明の医薬は、例えば、外科的手法により投与部位に直接留置することで使用されてもよい。
【0047】
本発明の導入促進剤や本発明の医薬におけるコラーゲン様ペプチド及び核酸の濃度や比率は特に限定されないが、細胞に導入又は生体に投与する際に、上記の好ましい比率及び濃度範囲に収まるよう調整されるのが好ましい。
【0048】
また、本発明は、本発明の核酸/コラーゲン様ペプチド複合体を保持する器具を提供する。器具としては、特に限定されないが、例えば医療用器具及び実験用器具が挙げられる。器具としては、例えば、セルトランスフェクションアレイに用いられるプレートが挙げられる。セルトランスフェクションアレイとは、あらかじめ導入可能な状態の核酸を基板上にアレイ化しておき、そこに細胞を播種して、細胞内に取り込ませる手法である。よって、本発明の核酸を、基板上に、すなわち例えば細胞を播種するためのウェル上にアレイ化することができる。アレイ化は公知の手法(ヌクレイック・アシッド・リサーチ(Nucl.Acids Res.)2004; 32: e109、等)により行うことができる。こうして得られたアレイを用いることで、効率よく遺伝子機能の解析等を行うことができる。後述する実施例で示すように、固相表面に保持された核酸/コラーゲン様ペプチド複合体に細胞を接触させることで、核酸は細胞内に効率的に導入される。本発明で用いられるコラーゲン様ペプチドは、リポソームと比較し保存性が高く、コラーゲン様ペプチドを含む複合体を表面に保持した器具は、長期間の保存に耐え得る。また、本発明の核酸/コラーゲン様ペプチド複合体を保持する器具とは、例えば、外科的手法等により生体内に留置され、本発明の核酸/コラーゲン様ペプチド複合体を徐々に放出するような器具であってもよい。
【0049】
また、本発明に基づき核酸を効率的に細胞内に導入することで、遺伝子又はタンパク質の細胞内での機能を効率的に解析できる。例えば、機能を解析したい遺伝子を組み込んだ発現プラスミドを細胞内に導入し、当該遺伝子を発現させることにより遺伝子の機能を解析することができる。また、機能を解析したい遺伝子の発現を抑制するアンチセンスRNAやsiRNAを細胞内に導入し、当該遺伝子の発現を抑制することにより遺伝子の機能を解析することができる。導入及び解析は、例えば、セルトランスフェクションアレイ技術によりハイスループットに行うことができる。
【0050】
また、本発明に基づき核酸を効率的に細胞内に導入することで、種々の疾患、例えば遺伝子疾患、癌、AIDS、慢性関節リウマチ、生活習慣病等の治療に用いることのできる核酸医薬をスクリーニングできる。例えば、スクリーニングは、任意の病態を示す細胞に核酸を導入し、任意の遺伝子を発現させることにより、あるいは任意の遺伝子発現を抑制することにより、当該病態に与える効果を解析することにより行われる。導入及び解析は、例えば、セルトランスフェクションアレイ技術によりハイスループットに行うことができる。
【0051】
以下、実施例により、本発明をさらに具体的に説明するが、本発明の範囲は以下の実施例に限定されるものではない。
【実施例1】
【0052】
〔実施例1〕安定性試験(in vitro)
本実施例では、核酸とコラーゲン様ペプチドとの複合体を形成させることによる、核酸の安定性に与える影響について評価した。
【0053】
<材料>
核酸の細胞内への導入キャリアとしては、コラーゲン様ペプチド、及びATCOLを用いた。コラーゲン様ペプチドとしては、Pro−Hyp−Glyのアミノ酸配列からなるトリペプチドを縮重合して生産したポリ(Pro−Hyp−Gly)を、40kGyの電子線を2分間照射して使用した。当該コラーゲン様ペプチドの分子量は105以上であった。なお、当該コラーゲン様ペプチドを、合成コラーゲン(SYCOL)とも称する。当該コラーゲン様ペプチドは、チッソ株式会社より入手した。ATCOLは、株式会社高研より、生体内siRNA導入キットとして購入し、製造元の指示に従い使用した。
【0054】
また、SYCOL、ATCOL以外の導入キャリアとして、リポフェクタミン2000(インビトロジェン製)を用いた。リポフェクタミン2000は、正電荷リポソームを含む試薬であり、負電荷を有する核酸と複合体を形成し安定化する。リポフェクタミン2000は、製造元の指示に従い使用した。
【0055】
核酸としては、ホタルルシフェラーゼGL3をコードする遺伝子を発現抑制の対象とするsiRNAを、株式会社ニッポンジーンより購入して用いた。当該siRNAを、GL3siRNAと称する。
【0056】
また、スクランブルsiRNAとして、5’−AUCGAAUAACCGUAACGUUGA−3’(配列番号6)及び5’−UCAACGUUACGGUUAUUCGAU−3’(配列番号7)の塩基配列からなる二本鎖RNAを、株式会社ニッポンジーンより購入して用いた。スクランブルsiRNAとは、対照実験に用いるsiRNAであり、試験対象のsiRNAと塩基の構成比が等しく、使用する細胞又は個体に相同な塩基配列が存在しない二本鎖RNAである。
【0057】
<複合体の調製>
滅菌水にSYCOLを溶解し、0.06%SYCOL溶液を調製した。SYCOL溶液とsiRNA溶液を等量ずつ合わせ、ピペッティングにより混合し、siRNA/0.03%SYCOL複合体を形成した。同様に、siRNA/0.05%ATCOL複合体、及びsiRNA/0.5%ATCOL複合体を調製した。なお、0.03%SYCOL、0.05%ATCOL、及び0.5%ATCOLとは、いずれもsiRNAと混合した後の終濃度を示す(以下、同じ)。調製した複合体は、4℃で16時間置いてから、以降の実験に用いた。
【0058】
<安定性試験>
各導入キャリアと複合体を形成させた0.9μgのGL3siRNAを、0.1μg/μlのRNaseA(ニッポンジーン製)の共存下で、37℃、0、5、15、30、45、及び60分の各時間インキュベートした。インキュベート後の溶液を、フェノール処理、及びフェノール:クロロホルム:イソアミルアルコール(25:24:1、容量比)処理に供し、残存するGL3siRNAをエタノール沈殿により回収した。回収したGL3siRNAを、15%ポリアクリルアミドゲル電気泳動により分離し、臭化エチジウムにより染色した。染色後のゲルをImageJ(アメリカ国立衛生研究所(NIH)で配布)により解析し、蛍光強度を数値化した。
【0059】
<結果>
各複合体形成時のGL3siRNA残存率の推移を図1に示す。siRNA単独の場合と比較し、siRNA/リポフェクタミン2000複合体及びsiRNA/0.5%ATCOL複合体においては、顕著に高いsiRNA残存率が認められた。また、siRNA/0.03%SYCOL複合体及びsiRNA/0.05%ATCOL複合体においても、リポフェクタミン2000や0.5%ATCOLと複合体を形成した場合には劣るが、siRNA単独の場合と比較し高いsiRNA残存率が認められた。よって、siRNAはSYCOLと複合体を形成することにより、RNaseによる分解を受けにくくなることが示された。
【0060】
以上より、核酸とSYCOLを組み合わせることで、核酸の安定性を高めることができると考えられる。これは、SYCOLを核酸の細胞内への導入キャリアとして用いることによる効果の1つである。
【実施例2】
【0061】
〔実施例2〕細胞への導入試験(in vitro)
本実施例では、核酸とコラーゲン様ペプチドとの複合体を形成させることによる、核酸の細胞への導入効率に与える影響について評価した。
【0062】
<材料>
細胞としては、恒常的にルシフェラーゼを発現したB16−F10−luc−G5メラノーマ細胞(以下、単に細胞とも言う)を用いた。細胞は、10%非働化ウシ胎児血清(FBS)及び0.2mg/mlのゼオシン(登録商標)を含むダルベッコ変法イーグル培地(DMEM)により維持した。培養細胞は、トリプシン処理により回収し、以降の実験に用いた。
【0063】
核酸としては、GL3siRNAを用いた。また、対照として、実施例1に記載のスクランブルsiRNAを用いた。核酸の細胞内への導入キャリアとしては、SYCOL、ATCOL、及びリポフェクタミン2000を用いた。各siRNAと各導入キャリアとの複合体の形成は、実施例1と同様に行った。
【0064】
<導入効率試験>
GL3siRNA単独、SYCOL単独、及び各siRNA/コラーゲン複合体を、公知の手法(ヌクレイック・アシッド・リサーチ(Nucl.Acids Res.)2004; 32: e109)により24ウェルプレートに結合させた。siRNAの結合量は、10〜173pmol/50μl/ウェルとした。培養細胞を、3.5x104細胞/ウェルとなるよう24ウェルプレートに播種し、siRNAの導入を行った。また、リポフェクタミン2000を用いた際のsiRNA導入は、製造元の指示に従い行った。導入効率はルシフェラーゼを利用したレポーターアッセイにより測定した。siRNA導入後2日で細胞(n=3)を溶解させ、マイクロプレートリーダー モデル680(BioRad製)を用いてルシフェラーゼ活性を測定した。統計処理は、ボンフェローニ補正法による多重比較検定を行い、危険率は5%とした。
【0065】
図2は、各条件で導入試験を行った際の発光強度を示したものである。0.05%ATCOLやリポフェクタミン2000と複合体を形成させた際と同様に、0.03%SYCOLと複合体を形成させたGL3siRNAを導入することで、同じく複合体を形成させたスクランブルsiRNAを導入した場合と比較して、蛍光強度の有意な減少が認められた。なお、GL3siRNA単独あるいはSYCOL単独で細胞を処理した場合には、複合体を形成させたスクランブルsiRNAを導入した場合と比較して、蛍光強度に有意差は認められなかった。よって、GL3siRNA/0.03%SYCOLの導入による蛍光強度の減少は、SYCOLを導入キャリアとして用いたことに基づく効果であると考えられる。以上より、GL3siRNA/0.03%SYCOL複合体は細胞内に取り込まれ、siRNAはルシフェラーゼGL3の発現を、0.05%ATCOLやリポフェクタミン2000を導入キャリアとして用いた際と同等の効率で抑制したと示唆された。実施例1の結果も考慮すると、SYCOLはsiRNAをRNaseによる分解から保護し、それによって、siRNAが効率的にRNA干渉の効果を発揮することができると考えられる。
【実施例3】
【0066】
〔実施例3〕局所投与試験(in vivo)
本実施例では、核酸とコラーゲン様ペプチドとの複合体を形成させることによる、核酸のマウス咬筋への局所投与の効果に与える影響について評価した。
【0067】
<材料>
被験体としては、C57BL/6系統マウス(20週齢、オス)を各試験群に4匹ずつ用いた。
【0068】
核酸としては、ミオスタチンをコードする遺伝子を発現抑制の対象とするsiRNAを、株式会社高研より購入して用いた。当該siRNAを、ミオスタチンsiRNAと称する。ミオスタチンは、GDF−8として知られる成長分化因子(growth differentiation factor:GDF)であり、筋肉の成長を抑制する機能を有する。すなわち、ミオスタチンの発現が抑制されれば筋肉の成長が促進されると考えられる。用いたミオスタチンsiRNAは、5’−AAGAUGACGAUUAUCACGCUA−3’(配列番号8)及び5’−UAGCGUGAUAAUCGUCAUCUU−3’(配列番号9)の塩基配列からなる二本鎖RNAである。また、対照として、実施例1に記載のスクランブルsiRNAを用いた。核酸の細胞内への導入キャリアとしては、SYCOLを用いた。siRNAは、SYCOLと混合し、siRNA/0.03%SYCOLを形成した。siRNAの終濃度は10mMとした。
【0069】
<導入試験>
ネンブタール(25mg/kg、腹腔内注射)によりマウスを麻酔し、ミオスタチンsiRNA/SYCOL複合体を左側咬筋に、スクランブルsiRNA/SYCOL複合体を右側咬筋に、それぞれ100μl注射した。2週間後、両側の咬筋を単離し、分析に供した。左側咬筋を試験群、右側咬筋を対照群とした。
【0070】
図3Aは、単離した咬筋の重量を示す。試験群の重量は、対照群の重量に対し、顕著に大きいことが認められる。また、図3Bは、各群200本ずつのミオフィブリル(筋原線維)の断面積の平均値を示す。試験群では、対照群と比較し、ミオフィブリルの断面積が1.8倍程度に増大していることが明らかとなった。以上より、ミオスタチンsiRNAを導入することによる筋肉の増強が認められ、ミオスタチンの発現が有効に抑制されていることが示唆された。
【0071】
<mRNAの定量>
総RNAをマウス咬筋から抽出し、ミオスタチンmRNAの定量を行った。mRNAの定量は、SYBR Premix Ex Taq(宝酒造製)とDNAエンジンOPTICONシステム(Bio−Rad製)によりミオスタチンmRNAから逆転写を行い、転写量をモニターすることで行った。用いた特異的プライマーの配列は、5’−CAGCCTGAATCCAACTTAGG−3’(フォワード)(配列番号10)、5’−CTGAAACCCGAACTGACGCT−3’(リバース)(配列番号11)とした。結果を図3Cに示す。ミオスタチンsiRNA/SYCOL複合体で処理した試験群においては、スクランブルsiRNA/SYCOL複合体で処理した対照と比較し、ミオスタチンmRNAの量が48%程度まで減少していた。よって、ミオスタチンsiRNAによりRNA干渉が起こったものと考えられる。
【0072】
なお、本実施例において、咬筋以外の組織には、siRNA/SYCOL複合体を投与することによる形態上の明らかな変化は認められなかった。また、本実施例において、siRNA/SYCOL複合体を投与することによる、マウスにおける健康障害や死亡の兆候等の副作用も認められなかった。
【0073】
以上より、SYCOLを導入キャリアとして用いることにより、siRNAを組織に導入し、RNA干渉を引き起こすことが可能であると明らかになった。また、その際、目立った副作用は認められないことから、SYCOLを導入キャリアとして用いる核酸導入技術は臨床上有用であると考えられる。
【実施例4】
【0074】
〔実施例4〕全身投与試験(in vivo)
本実施例では、核酸とコラーゲン様ペプチドとの複合体を形成させることによる、核酸のマウスへの全身投与の効果に与える影響について評価した。
【0075】
<材料>
被験体としては、無胸腺ヌードマウスを、各試験群に2匹ずつ用いた。
【0076】
核酸としては、GL3siRNAを用いた。核酸の細胞内への導入キャリアとしては、SYCOL及びATCOLを用いた。GL3siRNA/0.03%SYCOL複合体は、0.06%SYCOLとsiRNA溶液を等量ずつ混合し、4℃、20分遠心して調製した。同様に、GL3siRNA/0.05%ATCOL複合体を調製した。
【0077】
<導入試験>
リン酸緩衝生理食塩水(PBS)に懸濁したB16−F10−luc−G5メラノーマ細胞を、無胸腺ヌードマウスの左心室に皮下注射し(1x106細胞/100μl PBS/箇所)、腫瘍の転移モデルを作成した。メラノーマ細胞を注射してから2日後、GL3siRNA単独、SYCOL単独、並びにGL3siRNAとSYCOL及びATCOLそれぞれとの複合体をマウスの頭部に注射して投与した。投与量は、4nmol/50μl/50mm3腫瘍とした。siRNAの投与日を0日目とし、0日目と3日目に、極低温冷却されたIVISシステムを用いた非侵襲バイオイメージングにより導入効果を測定した。導入効果はバイオイメージングの結果を基に発光強度として数値化した。なお、IVISシステムによる測定によっては、腫瘍の成長は影響を受けなかった。
【0078】
図4A、Bは、それぞれ頭部及び腹部における発光強度の推移を示す。腫瘍の形成に基づく発光が、0日目に、頭部及び腹部に認められた。siRNA単独やSYCOL単独で投与した群では、投与してから3日後には、0日目と比較して、頭部及び腹部とも発光強度が増大した。一方、siRNA/0.05%ATCOL投与群では、投与してから3日後には、頭部及び腹部ともに発光強度が減少した。また、siRNA/0.03%SYCOL投与群では、腹部の発光強度は増大したが、siRNA/0.03%SYCOL複合体の投与部位である頭部においては減少しており、頭部においてはルシフェラーゼの発現が持続的に阻害されていることが明らかとなった。よって、SYCOLを導入キャリアとして用いたsiRNAの導入は、少なくともsiRNA投与箇所の付近において有効であることが示唆された。
【0079】
以上の実施例より、SYCOLを導入キャリアとして用いることにより、in vitro及びin vivoのいずれにおいてもsiRNAの導入効率を向上させることができると明らかとなった。すなわち、放射線照射コラーゲン様ペプチドを導入キャリアとして利用することにより、核酸を細胞内に効率的に導入できる。
【0080】
なお、コラーゲンを導入キャリアとして用いる核酸導入法は公知である(国際公開第03/000297号)が、これは、生理条件下では核酸が負電荷、コラーゲンが正電荷を有するため、静電気的結合することにより複合体を形成するためであると考えられていた。すなわち、コラーゲンが導入キャリアとして機能するには、コラーゲンが正電荷を有することが重要であるとされていた。これは、ATCOLでも同様である。それに対し、実施例で用いたSYCOLは、Pro−Hyp−Glyのアミノ酸配列の繰り返しからなり、一般的なコラーゲンのようには正電荷を有さない。それにも関わらず、ATCOLや正電荷リポソームと同様に、核酸の分解を抑制し、核酸の細胞内への導入効率を高めることができたのは、驚くべき結果であった。さらに、SYCOL等のコラーゲン様ペプチドが核酸の細胞への導入キャリアとして機能するには放射線の照射が必要である。放射線の照射によりコラーゲン様ペプチドが導入キャリアとしての機能を発揮するようになることは、予想できない新規な知見であった。
【産業上の利用可能性】
【0081】
本発明により、in vitro及びin vivoのいずれにおいても、任意の核酸を効率的に細胞内に導入することができる。よって、本発明は、特に遺伝子の機能の解析や遺伝子治療に有効である。すなわち、本発明は、基礎研究や臨床応用に極めて有効に利用することができる。
【技術分野】
【0001】
本発明は、核酸を細胞内へ効率的に導入する手段に関する。
【背景技術】
【0002】
近年、疾病に関与する遺伝子の機能を補う、あるいは抑えることによって疾病を治療する、いわゆる遺伝子治療が注目を集めており、既に種々の遺伝子疾患やガン等において、遺伝子治療の臨床研究が行われている。ここで、遺伝子治療に用いられる医薬として実用化が期待されているものとして、RNA干渉(RNAi)を利用する核酸医薬が挙げられる。
【0003】
RNA干渉とは、二本鎖RNAにより引き起こされる、配列特異的な遺伝子発現抑制現象であり、二本鎖RNAのいずれかの配列と相補的な配列を有するmRNAが特異的に分解されることに基づく。すなわち、生体内に導入された二本鎖RNAは、RNaseIIIに属するDicerと呼ばれる酵素により、21塩基程度の短い3’末端突出型の二本鎖RNAであるsiRNA(small interfering RNA)に分解される。生じたsiRNAは、一本鎖に解離して、RNA誘導型サイレンシング複合体(RISC(RNA induced silencing complex))に取り込まれ、取り込まれた一本鎖と相補的な配列を有するmRNAが特異的に分解されると言われている。RNA干渉は、生体内のさまざまな局面で重要な役割を担っていると考えられ、例えば、ウイルス感染に対する防御機構や、ゲノム上を転移する遺伝因子であるレトロトランスポゾンの転移を抑制し、ゲノムの安定性を保つことにも関わっているようである。
【0004】
RNA干渉は、標的遺伝子に対する高い特異性を有し、任意の遺伝子の機能を人為的に抑制できることから、遺伝子機能解析の汎用性の高いツールとして注目され、また、遺伝子治療への応用が期待されている。
【0005】
ここで、RNA干渉を臨床応用するために解決しなければならない課題の1つは、siRNAの生体内への導入法の開発である。すなわち、siRNA単独では、細胞膜を抜けて細胞質には導入されない。これは、siRNAの高い分子量と、核酸の主鎖を構成するリン酸基に基づく強い負電荷が原因である。siRNAを細胞内に導入する方法としては、エレクトロポレーションによる方法、及びリポソーム、特に正電荷リポソームをキャリアとして利用する方法等が知られている。また、その他にも、コラーゲン又はコラーゲン誘導体をキャリアとして利用し、核酸との複合体を形成させることを特徴とする、核酸の細胞内への効率的な導入技術が既に知られている(特許文献1)。
【0006】
生体内及び生体外で効率的な遺伝子発現抑制を達成するための有望なsiRNA導入キャリアの1つはアテロコラーゲン(ATCOL)である(非特許文献1)。ATCOLは、ウシ真皮から得られたI型コラーゲンをペプシンにより処理し高純度に精製すること等により得られる。コラーゲン分子は、N、C両末端にコラーゲンの主要抗原部位であるテロペプチドを有するが、ATCOLは、ペプシン処理によりテロペプチドが除去されており、免疫原性が低く抑えられている。そのため、ATCOLは、生体適合性の高い生体材料であり、創傷治療、人工血管、代用軟骨、止血剤等の広範囲の用途で、臨床上利用されている。
【0007】
本発明者らは、骨格筋の成長を抑制する因子をコードするミオスタチンをターゲットとするsiRNAをATCOLとともにマウスの骨格筋に導入することで、導入から数週間後には筋量が顕著に増大したことを報告しており、ATCOLは核酸の細胞内への導入を促進することが明らかとなっている(非特許文献2)。
【0008】
以上のように、核酸を細胞内へ導入する技術はこれまでに知られているが、コラーゲン様ペプチドを導入キャリアとして用いる核酸の導入法は知られていない。コラーゲン様ペプチドについては、例えば、特許文献2に記載されている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第03/000297号
【特許文献2】特開2005−053878
【非特許文献】
【0010】
【非特許文献1】ヌクレイック・アシッド・リサーチ(Nucl.Acids Res.)2004; 32: e109
【非特許文献2】ジーン・セラピー(Gene Ther)2008; 15: 1126−1130
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、核酸を細胞内へ効率的に導入する手段を提供することを課題とする。
【課題を解決するための手段】
【0012】
本発明者は、コラーゲン様ペプチドの性質を詳細に検討した結果、放射線を照射したコラーゲン様ペプチドを核酸の細胞内への導入キャリアとして利用することで、核酸を効率的に細胞内に導入できることを見出し、本発明を完成させた。
【0013】
すなわち本発明は、以下の通りである。
【0014】
第1の発明は、放射線を照射する処理をされたコラーゲン様ペプチドを含む、核酸の細胞内への導入促進剤であって、コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、導入促進剤である。第1の発明の好ましい態様において、コラーゲン様ペプチドは、ポリ(Pro−Hyp−Gly)である。また、第1の発明の好ましい態様において、放射線は電子線である。また、第1の発明の好ましい態様において、核酸は、siRNAである。
【0015】
第2の発明は、放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、核酸/コラーゲン様ペプチド複合体であって、コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、複合体である。第2の発明におけるコラーゲン様ペプチド、放射線、及び核酸の好ましい態様は、第1の発明と同様である。
【0016】
第3の発明は、放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、医薬組成物であって、コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、医薬組成物である。第3の発明におけるコラーゲン様ペプチド、放射線、及び核酸の好ましい態様は、第1の発明と同様である。
【0017】
第4の発明は、第2の発明の核酸/コラーゲン様ペプチド複合体を保持する医療用又は実験用器具である。
【0018】
第5の発明は、放射線を照射する処理をされたコラーゲン様ペプチドを核酸の細胞内導入キャリアとして用いることを特徴とする、核酸を細胞内に導入する方法であって、コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、方法である。第5の発明におけるコラーゲン様ペプチド、放射線、及び核酸の好ましい態様は、第1の発明と同様である。
【発明の効果】
【0019】
本発明に用いられるコラーゲン様ペプチドは、核酸を細胞内へ導入する際の導入キャリアとして機能する。よって、本発明により、任意の核酸を効率的に細胞内に導入することができる。また、核酸として、特にsiRNAを用いることで、RNA干渉により特定の遺伝子を効率的にノックダウンできる。
【図面の簡単な説明】
【0020】
【図1】図1は、siRNAと各導入キャリアとの複合体を形成した際の、RNaseA共存下でのsiRNA残存量の推移を示すグラフである。
【図2】図2は、GL3siRNA及びスクランブルsiRNAのそれぞれと各導入キャリアとの複合体を形成して細胞に導入した際の、ルシフェラーゼの発現量(発光強度)を示すグラフである。結果は、平均値±標準誤差で示す。
【図3A】図3Aは、ミオスタチンsiRNA及びスクランブルsiRNAのそれぞれをSYCOLと複合体を形成させて咬筋に投与した際の、咬筋の重量を示すグラフである。
【図3B】図3Bは、同条件での、咬筋におけるミオフィブリル(筋原線維)の断面積を示すグラフである。
【図3C】図3Cは、同条件での、咬筋におけるミオスタチンmRNAの量を示すグラフである。
【図4A】図4Aは、GL3siRNAと各導入キャリアとの複合体を形成してマウス頭部に投与した際の、頭部におけるルシフェラーゼの発現量(発光強度)を示すグラフである。
【図4B】図4Bは、同条件での、腹部におけるルシフェラーゼの発現量(発光強度)を示すグラフである。
【発明を実施するための形態】
【0021】
以下、本発明を詳細に説明する。
【0022】
本発明において、コラーゲン様ペプチドは、核酸を細胞内に導入するためのキャリア(輸送担体)として用いられる。すなわち、本発明の核酸を細胞内に導入する方法は、コラーゲン様ペプチドを核酸の細胞内導入キャリアとして用いることを特徴とする。
【0023】
本発明において用いられるコラーゲン様ペプチドとは、機能性ペプチドとしてアミノ酸配列Pro−X−Gly(以下、配列Aとも言う)からなるペプチドユニットを含むペプチドである。配列Aは後述する3重らせん構造の安定性に寄与し、配列Aの割合が少ないと3重らせん構造の安定性が減少する。ここで、XはPro又はHypであり、3重らせん構造の安定性の点からHypであるのが好ましい。なお、Hypは、通常、4Hyp(例えば、trans−4−ヒドロキシ−L−プロリン)残基である。コラーゲン様ペプチドは、(−Pro−X−Gly−)nで表される繰り返し構造を含み、よって、好ましくは(−Pro−Hyp−Gly−)nで表される繰り返し構造を含む。すなわち、コラーゲン様ペプチドの一態様は、(−Pro−Hyp−Gly−)nからなるポリ(Pro−Hyp−Gly)である。なお、(−Pro−X−Gly−)nで表される繰り返し構造において、それぞれのXは独立にPro又はHypであってよい。繰り返し数nは、目的の分子量や、共存する配列に応じて適宜設定することができる。繰り返し数nは、例えば10〜50000であり、20〜5000であるのが好ましく、200〜4000であるのがより好ましい。
【0024】
また、コラーゲン様ペプチドは、機能性ペプチドを含有させることにより機能設計が可能である。例えば、コラーゲン様ペプチドを、特定の細胞や組織に対して特異的に取り込まれるよう改変することもできる。
【0025】
コラーゲン様ペプチドに含有させることのできる機能性ペプチドとしては、アミノ酸配列Pro−Y−Gly−Z−Ala−Gly(配列番号2)(以下、配列Bとも言う)を含むペプチドが挙げられる。ここで、YはGln、Asn、Leu、Ile、Val又はAlaであり、Gln、Asn、Leu、Val、又はAlaであるのが好ましく、Gln又はLeuであるのが特に好ましい。また、ZはIle又はLeuであり、Ileであるのが好ましい。配列Bの存在は、コラゲナーゼによるコラーゲン様ペプチドの分解性を向上させる。よって、配列Bの存在は、コラーゲン様ペプチドを導入キャリアとして用いて、生体内、例えば哺乳動物の生体内に核酸を導入する際に、コラーゲン様ペプチドが分解吸収されるのを補助する。
【0026】
コラーゲン様ペプチドに含有させることのできるその他の機能性ペプチドとしては、例えば、コラーゲン様ペプチドが酵素分解されるのを抑制するアミノ酸配列Gln−Gly−Ile−Ara(配列番号2)、熱応答性を付与するアミノ酸配列Val−Pro−Gly−Val−Gly(配列番号3)、細胞接着性を付与するアミノ酸配列Arg−Gly−Asp、神経分化を促進するアミノ酸配列Tyr−Ile−Gly−Ser−Arg(配列番号4)及びIle−Lys−Val−Ara−Val(配列番号5)等が挙げられる。
【0027】
配列Aと配列Bの比率(モル比)は、例えばA:B=100:0〜30:70であり、100:0〜50:50が好ましく、100:0〜70:30がより好ましく、100:0〜90:10がさらに好ましく、100:0〜95:5が特に好ましい。また、配列Aと配列Bの合計量と、配列A又はB以外のその他の機能性ペプチドの比率(モル比)は、例えばA+B:A+B以外の機能性ペプチド=100:0〜50:50であり、100:0〜70:30が好ましく、100:0〜80:20がより好ましく、100:0〜90:10がさらに好ましく、100:0〜95:5が特に好ましい。
【0028】
また、コラーゲン様ペプチドは、核酸の細胞内への導入キャリアとしての機能を損なわない限り、その他の任意のアミノ酸配列を含んでいてもよい。その他の任意のアミノ酸配列の含有量は、コラーゲン様ペプチド全体に対して、例えばアミノ酸残基数として20%以下であり、好ましくは10%以下、より好ましくは5%以下、さらに好ましくは2%以下、特に好ましくは1%以下である。
【0029】
また、コラーゲン様ペプチドは、上述のペプチドにさらに核酸等が付加されたペプチドであってもよい。
【0030】
コラーゲン様ペプチドの分子量は、好ましくは5×103〜1×107、より好ましくは1×104〜1×106、より好ましくは1×105〜1×106である。例えば、本発明の一態様において、分子量105以上のコラーゲン様ペプチドを用いることができる。分子量は、高分子化合物の分子量を測定する一般的な方法で測定することができる。高分子化合物の分子量を測定する一般的な方法としては、例えば、サイズエクスクルージョンクロマトグラフィー(SEC)が挙げられ、SECとしては、ゲルパーミエーションクロマトグラフィー(GPC)が好適に用いられる。ゲルパーミエーションクロマトグラフィーにより分子量を測定する場合の一態様としては、分離カラムとしてTSKgel G6000PWXL(I.D.7.8mm x L30cm)(東ソー製)を、分子量標準として分子量既知のプルラン、デキストラン、又はポリエチレンオキサイド等を用い、緩衝液を移動相として測定が行われる。
【0031】
コラーゲン様ペプチドは、その一態様において、三重らせん構造を形成し、当該三重らせん構造が複数集合し、直径10nm〜300nmのコラーゲン原繊維を構成し、コラーゲン原繊維がさらに集合して、直径0.5nm〜3nmのコラーゲン様繊維を形成する。
【0032】
コラーゲン様ペプチドを製造する方法は特に限定されず、例えば、アミノ酸やペプチドを縮重合することにより製造できる。例えば、アミノ酸配列Pro−Hyp−Glyからなるトリペプチドを縮重合させることによりポリ(Pro−Hyp−Gly)を製造できる。なお、例えば、ポリ(Pro−Hyp−Gly)を製造する場合には、縮重合に用いられるトリペプチドはHyp−Gly−Proや−GlyPro−Hypからなるトリペプチドであってもよいことは言うまでもない。ペプチドの縮重合は、公知の手法(特開2005−53878等)により行うことができる。また、目的の物性や目的の分子量に応じて、反応条件や共重合させる機能性ペプチドを適宜選択できる。機能性ペプチドを共重合させることにより、機能性の高分子としてコラーゲン様ペプチドを製造できる。
【0033】
コラーゲン様ペプチドは、通常のコラーゲンのような免疫原性を示さないため、例えば医療用素材として優秀である。また、アミノ酸やペプチドの縮重合等の化学合成によりコラーゲン様ペプチドを製造した場合には、動物由来の成分を含まないことから、未知の病原体や病原因子による汚染の可能性がない点で好ましい。
【0034】
本発明において、コラーゲン様ペプチドは、放射線を照射する処理をされて用いられる。コラーゲン様ペプチドは、放射線を照射する処理により、核酸を細胞内に導入するキャリアとしての機能を示すようになる。放射線を照射する処理の態様は特に限定されず、任意の手法により行うことができる。放射線を照射する処理に用いられる放射線の線量は特に限定されないが、例えば、好ましくは1kGy以上、より好ましくは5kGy以上、特に好ましくは10kGy以上の放射線が用いられる。また、放射線の線量の好ましい範囲としては、例えば、1〜1000kGy、50〜500kGy、10〜200kGy等が挙げられる。放射線としては、例えば電子線が好適に用いられる。放射線を照射する処理は、例えば、コラーゲン様ペプチドを含有する溶液に40kGyの電子線を2分間照射することにより行うことができる。
【0035】
本発明において、核酸は、特に限定されず、DNAであってもよく、RNAであってもよい。また、核酸は、DNAとRNAの両方により複合的に構成されていてもよい。核酸は、1本鎖であってもよく、二本鎖であってもよい。また部分的に、1本鎖部分と二本鎖部分が共存していてもよい。また、核酸の配列は、特に制限されず、目的に応じて適宜設定することができる。また、核酸は線状であってもよく、環状であってもよい。例えば、核酸としては、ゲノムDNA、cDNA、プラスミド、ポリヌクレオチド、オリゴヌクレオチド、アンチセンスRNA、siRNA等が挙げられる。また、本発明において、核酸には、核酸として機能するもの、例えばウイルスが含まれる。ウイルスとしては、DNAウイルスでもRNAウイルスでもよい。また、本発明において、核酸は、任意の修飾がなされた核酸を含む。任意の修飾がなされた核酸を、まとめて、核酸誘導体と称する。核酸誘導体としては、蛍光標識された核酸等が挙げられる。本発明において、複数の態様の核酸が同時に存在していてもよく、複数の態様の核酸が同時に細胞内に導入されてもよい。
【0036】
本発明において、核酸としては、siRNAが特に好ましく用いられる。siRNAとは、遺伝子のノックダウン、すなわち遺伝子発現の抑制に用いられる二本鎖RNAであり、その片方の鎖は、ノックダウン対象の遺伝子から転写されるmRNAの少なくとも一部分の塩基配列と相補的な塩基配列を含む。siRNAとしては、通常21〜27塩基程度の3’末端突出型の二本鎖RNAを用いる。また、3’末端は片側あるいは両側とも突出しない場合がある。
【0037】
本発明において、コラーゲン様ペプチドは、核酸と複合体を形成することにより、核酸の細胞内導入キャリアとして機能する。
【0038】
コラーゲン様ペプチドと核酸は、溶媒中で接触することにより、コラーゲン様ペプチド及び核酸を含む核酸/コラーゲン様ペプチド複合体(以下、単に複合体とも言う)を形成する。溶媒としては、特に限定されないが、例えば、水、緩衝液等の水系溶媒が好ましく用いられる。溶媒は、核酸が細胞内に導入されるのを阻害しない限り、任意の成分を含有していてよい。なお、コラーゲン様ペプチドと核酸を接触させ複合体を形成する工程は、特に限定されず、例えば、コラーゲン様ペプチドを含む溶液と核酸を含む溶液を混合することにより行われてもよく、コラーゲン様ペプチド及び核酸の一方を含む溶液にコラーゲン様ペプチド及び核酸のもう一方をさらに溶解させることにより行われてもよく、また、あらかじめコラーゲン様ペプチド及び核酸を混合したものを任意の溶媒に溶解することにより行われてもよい。
【0039】
なお、複合体を形成するとは、コラーゲン様ペプチド及び核酸の少なくとも一部が核酸/コラーゲン様ペプチド複合体を形成すればよい。よって、コラーゲン様ペプチド及び核酸の少なくとも一部は、核酸/コラーゲン様ペプチド複合体を形成せず、単独で存在していてもよい。
【0040】
上記のように核酸とコラーゲン様ペプチドを含む核酸/コラーゲン様ペプチド複合体を形成することで、任意の細胞に、核酸を効率よく導入することができる。核酸/コラーゲン様ペプチド複合体は細胞と混合すること等によって接触させることにより、あるいは、生体に投与することにより、細胞内に核酸が導入される。すなわち、本発明は、合成コラーゲンを核酸の細胞内導入キャリアとして用いることを特徴とする、核酸を細胞内に導入する方法を提供する。なお、当該方法は、in vivoで用いてもよく、in vitroで用いてもよい。また、特定の細胞や組織に特異的に取り込まれるよう改変されたコラーゲン様ペプチドを用いることで、特定の細胞や組織に特異的に核酸を導入することができる。
【0041】
本発明において、コラーゲン様ペプチドと核酸の比率は、特に限定されず、コラーゲン様ペプチドの態様、核酸の態様、核酸を導入する細胞の態様、核酸/コラーゲン様ペプチド複合体の存在態様等に応じて適宜設定できる。コラーゲン様ペプチドの濃度としては、細胞あるいは生体に導入する際の濃度として、0.001%〜5%が好ましく、0.005%〜2%がより好ましく、0.01%〜1%が特に好ましい。コラーゲン様ペプチドは、例えば、0.03%で用いることができる。核酸の濃度としては、核酸の態様、核酸を導入する細胞の態様、核酸/コラーゲン様ペプチド複合体の存在態様等に応じて適宜設定できるが、例えば、0.01mM〜1Mが好ましく、0.1mM〜500mMがより好ましく、1mM〜100mMが特に好ましい。例えば、終濃度10mMでsiRNAを用いることができる。また、例えば核酸/コラーゲン様ペプチド複合体を器具の表面に保持する態様においては、保持される核酸の量としては、核酸の態様、核酸を導入する細胞の態様等に応じて適宜設定できる。例えばアレイ化する場合には、保持される核酸の量が、ウェル当たり好ましくは0.1pmol〜10μmol、より好ましくは1pmol〜1μmolとなるよう核酸/コラーゲン様ペプチド複合体を保持させることができる。このような範囲濃度で核酸を保持するウェルに、例えば3.5x104の細胞を播種することで、セルトランスフェクションアレイを行える。
【0042】
本発明は、コラーゲン様ペプチドを有効成分として含む、核酸の細胞への導入促進剤を提供する。導入促進剤としては、コラーゲン様ペプチドを含む限り特に限定されず、核酸やコラーゲン様ペプチドの態様、及び導入促進剤の利用目的(例えば、疾患の治療に用いるのであれば対象となる疾患の態様等)等に応じて、適宜態様を設定できる。本発明の導入促進剤は、核酸と混合して用いることができる。核酸と混合することにより、少なくとも核酸が細胞内あるいは生体内等に導入される時点において、コラーゲン様ペプチド及び核酸は核酸/コラーゲン様ペプチド複合体を形成する。
【0043】
なお、本発明の導入促進剤は、その一実施態様において、さらに核酸を含んでいてもよい。本発明の導入促進剤が核酸を含む場合に、本発明の導入促進剤に含まれるコラーゲン様ペプチド及び核酸はそれぞれ別個に存在していてもよく、核酸/コラーゲン様ペプチド複合体を形成していてもよいが、少なくとも核酸が細胞内あるいは生体内等に導入される時点において、核酸/コラーゲン様ペプチド複合体を形成する。
【0044】
本発明は、コラーゲン様ペプチド及び核酸を含む医薬組成物(以下、本発明の医薬とも言う)を提供する。本発明の医薬は、核酸及びコラーゲン様ペプチドを含む限り特に限定されず、核酸やコラーゲン様ペプチドの態様、対象となる疾患の態様等に応じて、適宜態様を設定できる。なお、本発明の医薬は、本発明の導入促進剤と核酸を混合することにより調製されたものであってもよい。本発明の医薬を投与することにより、本発明の医薬に含まれる核酸が、細胞内あるいは生体内等に導入される。本発明の医薬に含まれるコラーゲン様ペプチド及び核酸は、それぞれ別個に存在していてもよく、核酸/コラーゲン様ペプチド複合体を形成していてもよいが、少なくとも核酸が細胞内あるいは生体内等に導入される時点において、核酸/コラーゲン様ペプチド複合体を形成する。本発明の医薬を用いることにより、例えば任意の遺伝子の発現プラスミドを導入し、遺伝子機能を補うことができる。また、本発明の医薬を用いることにより、例えば任意の遺伝子に対するsiRNAを導入し、遺伝子発現を抑制することができる。よって、本発明の医薬により、任意の疾病について、遺伝子治療を行うことができる。
【0045】
本発明の医薬の剤形は特に制限されず、具体的には、錠剤、丸剤、散剤、液剤、懸濁剤、乳剤、顆粒剤、カプセル剤、シロップ剤、坐剤、注射剤、軟膏剤、貼付剤、点眼剤、及び点鼻剤等を例示できる。また、製剤化にあたっては、製剤担体として通常使用される賦形剤、結合剤、崩壊剤、滑沢剤、安定剤、矯味矯臭剤、希釈剤、界面活性剤、又は注射剤用溶剤等の添加剤を使用することができる。本発明の医薬は、そのまま、あるいは水、生理食塩水、緩衝液等を用いて希釈又は溶解し、細胞あるいは生体に投与できる。このように希釈あるいは溶解等した場合にも、本発明の医薬の範囲内であることは言うまでもない。なお、本発明の導入促進剤においても、本発明の医薬と同様の剤形や製剤担体を利用できる。また、本発明の導入促進剤においても、本発明の医薬と同様に、希釈あるいは溶解等した場合にも、本発明の導入促進剤の範囲内である。
【0046】
本発明の医薬を生体に投与する方法としては、特に制限されず、例えば経口、注射、点眼、点鼻、経肺、皮膚を介した吸収等の任意の方法により行うことができる。本発明の医薬を生体に投与する方法としては、経口又は注射が好ましい。投与部位は、対象とする疾患等に応じて適宜設定できる。また、本発明の医薬は、例えば、外科的手法により投与部位に直接留置することで使用されてもよい。
【0047】
本発明の導入促進剤や本発明の医薬におけるコラーゲン様ペプチド及び核酸の濃度や比率は特に限定されないが、細胞に導入又は生体に投与する際に、上記の好ましい比率及び濃度範囲に収まるよう調整されるのが好ましい。
【0048】
また、本発明は、本発明の核酸/コラーゲン様ペプチド複合体を保持する器具を提供する。器具としては、特に限定されないが、例えば医療用器具及び実験用器具が挙げられる。器具としては、例えば、セルトランスフェクションアレイに用いられるプレートが挙げられる。セルトランスフェクションアレイとは、あらかじめ導入可能な状態の核酸を基板上にアレイ化しておき、そこに細胞を播種して、細胞内に取り込ませる手法である。よって、本発明の核酸を、基板上に、すなわち例えば細胞を播種するためのウェル上にアレイ化することができる。アレイ化は公知の手法(ヌクレイック・アシッド・リサーチ(Nucl.Acids Res.)2004; 32: e109、等)により行うことができる。こうして得られたアレイを用いることで、効率よく遺伝子機能の解析等を行うことができる。後述する実施例で示すように、固相表面に保持された核酸/コラーゲン様ペプチド複合体に細胞を接触させることで、核酸は細胞内に効率的に導入される。本発明で用いられるコラーゲン様ペプチドは、リポソームと比較し保存性が高く、コラーゲン様ペプチドを含む複合体を表面に保持した器具は、長期間の保存に耐え得る。また、本発明の核酸/コラーゲン様ペプチド複合体を保持する器具とは、例えば、外科的手法等により生体内に留置され、本発明の核酸/コラーゲン様ペプチド複合体を徐々に放出するような器具であってもよい。
【0049】
また、本発明に基づき核酸を効率的に細胞内に導入することで、遺伝子又はタンパク質の細胞内での機能を効率的に解析できる。例えば、機能を解析したい遺伝子を組み込んだ発現プラスミドを細胞内に導入し、当該遺伝子を発現させることにより遺伝子の機能を解析することができる。また、機能を解析したい遺伝子の発現を抑制するアンチセンスRNAやsiRNAを細胞内に導入し、当該遺伝子の発現を抑制することにより遺伝子の機能を解析することができる。導入及び解析は、例えば、セルトランスフェクションアレイ技術によりハイスループットに行うことができる。
【0050】
また、本発明に基づき核酸を効率的に細胞内に導入することで、種々の疾患、例えば遺伝子疾患、癌、AIDS、慢性関節リウマチ、生活習慣病等の治療に用いることのできる核酸医薬をスクリーニングできる。例えば、スクリーニングは、任意の病態を示す細胞に核酸を導入し、任意の遺伝子を発現させることにより、あるいは任意の遺伝子発現を抑制することにより、当該病態に与える効果を解析することにより行われる。導入及び解析は、例えば、セルトランスフェクションアレイ技術によりハイスループットに行うことができる。
【0051】
以下、実施例により、本発明をさらに具体的に説明するが、本発明の範囲は以下の実施例に限定されるものではない。
【実施例1】
【0052】
〔実施例1〕安定性試験(in vitro)
本実施例では、核酸とコラーゲン様ペプチドとの複合体を形成させることによる、核酸の安定性に与える影響について評価した。
【0053】
<材料>
核酸の細胞内への導入キャリアとしては、コラーゲン様ペプチド、及びATCOLを用いた。コラーゲン様ペプチドとしては、Pro−Hyp−Glyのアミノ酸配列からなるトリペプチドを縮重合して生産したポリ(Pro−Hyp−Gly)を、40kGyの電子線を2分間照射して使用した。当該コラーゲン様ペプチドの分子量は105以上であった。なお、当該コラーゲン様ペプチドを、合成コラーゲン(SYCOL)とも称する。当該コラーゲン様ペプチドは、チッソ株式会社より入手した。ATCOLは、株式会社高研より、生体内siRNA導入キットとして購入し、製造元の指示に従い使用した。
【0054】
また、SYCOL、ATCOL以外の導入キャリアとして、リポフェクタミン2000(インビトロジェン製)を用いた。リポフェクタミン2000は、正電荷リポソームを含む試薬であり、負電荷を有する核酸と複合体を形成し安定化する。リポフェクタミン2000は、製造元の指示に従い使用した。
【0055】
核酸としては、ホタルルシフェラーゼGL3をコードする遺伝子を発現抑制の対象とするsiRNAを、株式会社ニッポンジーンより購入して用いた。当該siRNAを、GL3siRNAと称する。
【0056】
また、スクランブルsiRNAとして、5’−AUCGAAUAACCGUAACGUUGA−3’(配列番号6)及び5’−UCAACGUUACGGUUAUUCGAU−3’(配列番号7)の塩基配列からなる二本鎖RNAを、株式会社ニッポンジーンより購入して用いた。スクランブルsiRNAとは、対照実験に用いるsiRNAであり、試験対象のsiRNAと塩基の構成比が等しく、使用する細胞又は個体に相同な塩基配列が存在しない二本鎖RNAである。
【0057】
<複合体の調製>
滅菌水にSYCOLを溶解し、0.06%SYCOL溶液を調製した。SYCOL溶液とsiRNA溶液を等量ずつ合わせ、ピペッティングにより混合し、siRNA/0.03%SYCOL複合体を形成した。同様に、siRNA/0.05%ATCOL複合体、及びsiRNA/0.5%ATCOL複合体を調製した。なお、0.03%SYCOL、0.05%ATCOL、及び0.5%ATCOLとは、いずれもsiRNAと混合した後の終濃度を示す(以下、同じ)。調製した複合体は、4℃で16時間置いてから、以降の実験に用いた。
【0058】
<安定性試験>
各導入キャリアと複合体を形成させた0.9μgのGL3siRNAを、0.1μg/μlのRNaseA(ニッポンジーン製)の共存下で、37℃、0、5、15、30、45、及び60分の各時間インキュベートした。インキュベート後の溶液を、フェノール処理、及びフェノール:クロロホルム:イソアミルアルコール(25:24:1、容量比)処理に供し、残存するGL3siRNAをエタノール沈殿により回収した。回収したGL3siRNAを、15%ポリアクリルアミドゲル電気泳動により分離し、臭化エチジウムにより染色した。染色後のゲルをImageJ(アメリカ国立衛生研究所(NIH)で配布)により解析し、蛍光強度を数値化した。
【0059】
<結果>
各複合体形成時のGL3siRNA残存率の推移を図1に示す。siRNA単独の場合と比較し、siRNA/リポフェクタミン2000複合体及びsiRNA/0.5%ATCOL複合体においては、顕著に高いsiRNA残存率が認められた。また、siRNA/0.03%SYCOL複合体及びsiRNA/0.05%ATCOL複合体においても、リポフェクタミン2000や0.5%ATCOLと複合体を形成した場合には劣るが、siRNA単独の場合と比較し高いsiRNA残存率が認められた。よって、siRNAはSYCOLと複合体を形成することにより、RNaseによる分解を受けにくくなることが示された。
【0060】
以上より、核酸とSYCOLを組み合わせることで、核酸の安定性を高めることができると考えられる。これは、SYCOLを核酸の細胞内への導入キャリアとして用いることによる効果の1つである。
【実施例2】
【0061】
〔実施例2〕細胞への導入試験(in vitro)
本実施例では、核酸とコラーゲン様ペプチドとの複合体を形成させることによる、核酸の細胞への導入効率に与える影響について評価した。
【0062】
<材料>
細胞としては、恒常的にルシフェラーゼを発現したB16−F10−luc−G5メラノーマ細胞(以下、単に細胞とも言う)を用いた。細胞は、10%非働化ウシ胎児血清(FBS)及び0.2mg/mlのゼオシン(登録商標)を含むダルベッコ変法イーグル培地(DMEM)により維持した。培養細胞は、トリプシン処理により回収し、以降の実験に用いた。
【0063】
核酸としては、GL3siRNAを用いた。また、対照として、実施例1に記載のスクランブルsiRNAを用いた。核酸の細胞内への導入キャリアとしては、SYCOL、ATCOL、及びリポフェクタミン2000を用いた。各siRNAと各導入キャリアとの複合体の形成は、実施例1と同様に行った。
【0064】
<導入効率試験>
GL3siRNA単独、SYCOL単独、及び各siRNA/コラーゲン複合体を、公知の手法(ヌクレイック・アシッド・リサーチ(Nucl.Acids Res.)2004; 32: e109)により24ウェルプレートに結合させた。siRNAの結合量は、10〜173pmol/50μl/ウェルとした。培養細胞を、3.5x104細胞/ウェルとなるよう24ウェルプレートに播種し、siRNAの導入を行った。また、リポフェクタミン2000を用いた際のsiRNA導入は、製造元の指示に従い行った。導入効率はルシフェラーゼを利用したレポーターアッセイにより測定した。siRNA導入後2日で細胞(n=3)を溶解させ、マイクロプレートリーダー モデル680(BioRad製)を用いてルシフェラーゼ活性を測定した。統計処理は、ボンフェローニ補正法による多重比較検定を行い、危険率は5%とした。
【0065】
図2は、各条件で導入試験を行った際の発光強度を示したものである。0.05%ATCOLやリポフェクタミン2000と複合体を形成させた際と同様に、0.03%SYCOLと複合体を形成させたGL3siRNAを導入することで、同じく複合体を形成させたスクランブルsiRNAを導入した場合と比較して、蛍光強度の有意な減少が認められた。なお、GL3siRNA単独あるいはSYCOL単独で細胞を処理した場合には、複合体を形成させたスクランブルsiRNAを導入した場合と比較して、蛍光強度に有意差は認められなかった。よって、GL3siRNA/0.03%SYCOLの導入による蛍光強度の減少は、SYCOLを導入キャリアとして用いたことに基づく効果であると考えられる。以上より、GL3siRNA/0.03%SYCOL複合体は細胞内に取り込まれ、siRNAはルシフェラーゼGL3の発現を、0.05%ATCOLやリポフェクタミン2000を導入キャリアとして用いた際と同等の効率で抑制したと示唆された。実施例1の結果も考慮すると、SYCOLはsiRNAをRNaseによる分解から保護し、それによって、siRNAが効率的にRNA干渉の効果を発揮することができると考えられる。
【実施例3】
【0066】
〔実施例3〕局所投与試験(in vivo)
本実施例では、核酸とコラーゲン様ペプチドとの複合体を形成させることによる、核酸のマウス咬筋への局所投与の効果に与える影響について評価した。
【0067】
<材料>
被験体としては、C57BL/6系統マウス(20週齢、オス)を各試験群に4匹ずつ用いた。
【0068】
核酸としては、ミオスタチンをコードする遺伝子を発現抑制の対象とするsiRNAを、株式会社高研より購入して用いた。当該siRNAを、ミオスタチンsiRNAと称する。ミオスタチンは、GDF−8として知られる成長分化因子(growth differentiation factor:GDF)であり、筋肉の成長を抑制する機能を有する。すなわち、ミオスタチンの発現が抑制されれば筋肉の成長が促進されると考えられる。用いたミオスタチンsiRNAは、5’−AAGAUGACGAUUAUCACGCUA−3’(配列番号8)及び5’−UAGCGUGAUAAUCGUCAUCUU−3’(配列番号9)の塩基配列からなる二本鎖RNAである。また、対照として、実施例1に記載のスクランブルsiRNAを用いた。核酸の細胞内への導入キャリアとしては、SYCOLを用いた。siRNAは、SYCOLと混合し、siRNA/0.03%SYCOLを形成した。siRNAの終濃度は10mMとした。
【0069】
<導入試験>
ネンブタール(25mg/kg、腹腔内注射)によりマウスを麻酔し、ミオスタチンsiRNA/SYCOL複合体を左側咬筋に、スクランブルsiRNA/SYCOL複合体を右側咬筋に、それぞれ100μl注射した。2週間後、両側の咬筋を単離し、分析に供した。左側咬筋を試験群、右側咬筋を対照群とした。
【0070】
図3Aは、単離した咬筋の重量を示す。試験群の重量は、対照群の重量に対し、顕著に大きいことが認められる。また、図3Bは、各群200本ずつのミオフィブリル(筋原線維)の断面積の平均値を示す。試験群では、対照群と比較し、ミオフィブリルの断面積が1.8倍程度に増大していることが明らかとなった。以上より、ミオスタチンsiRNAを導入することによる筋肉の増強が認められ、ミオスタチンの発現が有効に抑制されていることが示唆された。
【0071】
<mRNAの定量>
総RNAをマウス咬筋から抽出し、ミオスタチンmRNAの定量を行った。mRNAの定量は、SYBR Premix Ex Taq(宝酒造製)とDNAエンジンOPTICONシステム(Bio−Rad製)によりミオスタチンmRNAから逆転写を行い、転写量をモニターすることで行った。用いた特異的プライマーの配列は、5’−CAGCCTGAATCCAACTTAGG−3’(フォワード)(配列番号10)、5’−CTGAAACCCGAACTGACGCT−3’(リバース)(配列番号11)とした。結果を図3Cに示す。ミオスタチンsiRNA/SYCOL複合体で処理した試験群においては、スクランブルsiRNA/SYCOL複合体で処理した対照と比較し、ミオスタチンmRNAの量が48%程度まで減少していた。よって、ミオスタチンsiRNAによりRNA干渉が起こったものと考えられる。
【0072】
なお、本実施例において、咬筋以外の組織には、siRNA/SYCOL複合体を投与することによる形態上の明らかな変化は認められなかった。また、本実施例において、siRNA/SYCOL複合体を投与することによる、マウスにおける健康障害や死亡の兆候等の副作用も認められなかった。
【0073】
以上より、SYCOLを導入キャリアとして用いることにより、siRNAを組織に導入し、RNA干渉を引き起こすことが可能であると明らかになった。また、その際、目立った副作用は認められないことから、SYCOLを導入キャリアとして用いる核酸導入技術は臨床上有用であると考えられる。
【実施例4】
【0074】
〔実施例4〕全身投与試験(in vivo)
本実施例では、核酸とコラーゲン様ペプチドとの複合体を形成させることによる、核酸のマウスへの全身投与の効果に与える影響について評価した。
【0075】
<材料>
被験体としては、無胸腺ヌードマウスを、各試験群に2匹ずつ用いた。
【0076】
核酸としては、GL3siRNAを用いた。核酸の細胞内への導入キャリアとしては、SYCOL及びATCOLを用いた。GL3siRNA/0.03%SYCOL複合体は、0.06%SYCOLとsiRNA溶液を等量ずつ混合し、4℃、20分遠心して調製した。同様に、GL3siRNA/0.05%ATCOL複合体を調製した。
【0077】
<導入試験>
リン酸緩衝生理食塩水(PBS)に懸濁したB16−F10−luc−G5メラノーマ細胞を、無胸腺ヌードマウスの左心室に皮下注射し(1x106細胞/100μl PBS/箇所)、腫瘍の転移モデルを作成した。メラノーマ細胞を注射してから2日後、GL3siRNA単独、SYCOL単独、並びにGL3siRNAとSYCOL及びATCOLそれぞれとの複合体をマウスの頭部に注射して投与した。投与量は、4nmol/50μl/50mm3腫瘍とした。siRNAの投与日を0日目とし、0日目と3日目に、極低温冷却されたIVISシステムを用いた非侵襲バイオイメージングにより導入効果を測定した。導入効果はバイオイメージングの結果を基に発光強度として数値化した。なお、IVISシステムによる測定によっては、腫瘍の成長は影響を受けなかった。
【0078】
図4A、Bは、それぞれ頭部及び腹部における発光強度の推移を示す。腫瘍の形成に基づく発光が、0日目に、頭部及び腹部に認められた。siRNA単独やSYCOL単独で投与した群では、投与してから3日後には、0日目と比較して、頭部及び腹部とも発光強度が増大した。一方、siRNA/0.05%ATCOL投与群では、投与してから3日後には、頭部及び腹部ともに発光強度が減少した。また、siRNA/0.03%SYCOL投与群では、腹部の発光強度は増大したが、siRNA/0.03%SYCOL複合体の投与部位である頭部においては減少しており、頭部においてはルシフェラーゼの発現が持続的に阻害されていることが明らかとなった。よって、SYCOLを導入キャリアとして用いたsiRNAの導入は、少なくともsiRNA投与箇所の付近において有効であることが示唆された。
【0079】
以上の実施例より、SYCOLを導入キャリアとして用いることにより、in vitro及びin vivoのいずれにおいてもsiRNAの導入効率を向上させることができると明らかとなった。すなわち、放射線照射コラーゲン様ペプチドを導入キャリアとして利用することにより、核酸を細胞内に効率的に導入できる。
【0080】
なお、コラーゲンを導入キャリアとして用いる核酸導入法は公知である(国際公開第03/000297号)が、これは、生理条件下では核酸が負電荷、コラーゲンが正電荷を有するため、静電気的結合することにより複合体を形成するためであると考えられていた。すなわち、コラーゲンが導入キャリアとして機能するには、コラーゲンが正電荷を有することが重要であるとされていた。これは、ATCOLでも同様である。それに対し、実施例で用いたSYCOLは、Pro−Hyp−Glyのアミノ酸配列の繰り返しからなり、一般的なコラーゲンのようには正電荷を有さない。それにも関わらず、ATCOLや正電荷リポソームと同様に、核酸の分解を抑制し、核酸の細胞内への導入効率を高めることができたのは、驚くべき結果であった。さらに、SYCOL等のコラーゲン様ペプチドが核酸の細胞への導入キャリアとして機能するには放射線の照射が必要である。放射線の照射によりコラーゲン様ペプチドが導入キャリアとしての機能を発揮するようになることは、予想できない新規な知見であった。
【産業上の利用可能性】
【0081】
本発明により、in vitro及びin vivoのいずれにおいても、任意の核酸を効率的に細胞内に導入することができる。よって、本発明は、特に遺伝子の機能の解析や遺伝子治療に有効である。すなわち、本発明は、基礎研究や臨床応用に極めて有効に利用することができる。
【特許請求の範囲】
【請求項1】
放射線を照射する処理をされたコラーゲン様ペプチドを含む、核酸の細胞内への導入促進剤であって、
前記コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、導入促進剤。
【請求項2】
前記コラーゲン様ペプチドが、ポリ(Pro−Hyp−Gly)である、請求項1に記載の導入促進剤。
【請求項3】
前記放射線が、電子線である、請求項1又は2に記載の導入促進剤。
【請求項4】
前記核酸が、siRNAである、請求項1〜3のいずれか1項に記載の導入促進剤。
【請求項5】
放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、核酸/コラーゲン様ペプチド複合体であって、
前記コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、複合体。
【請求項6】
前記コラーゲン様ペプチドが、ポリ(Pro−Hyp−Gly)である、請求項5に記載の複合体。
【請求項7】
前記放射線が、電子線である、請求項5又は6に記載の複合体。
【請求項8】
前記核酸が、siRNAである、請求項5〜7のいずれか1項に記載の複合体。
【請求項9】
放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、医薬組成物であって、
前記コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、医薬組成物。
【請求項10】
前記コラーゲン様ペプチドが、ポリ(Pro−Hyp−Gly)である、請求項9に記載の医薬組成物。
【請求項11】
前記放射線が、電子線である、請求項9又は10に記載の医薬組成物。
【請求項12】
前記核酸が、siRNAである、請求項9〜11のいずれか1項に記載の医薬組成物。
【請求項13】
請求項5〜8のいずれか1項に記載の核酸/コラーゲン様ペプチド複合体を保持する医療用又は実験用器具。
【請求項14】
放射線を照射する処理をされたコラーゲン様ペプチドを核酸の細胞内導入キャリアとして用いることを特徴とする、核酸を細胞内に導入する方法であって、
前記コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、方法。
【請求項15】
前記コラーゲン様ペプチドが、ポリ(Pro−Hyp−Gly)である、請求項14に記載の方法。
【請求項16】
前記放射線が、電子線である、請求項14又は15に記載の方法。
【請求項17】
前記核酸が、siRNAである、請求項14〜16のいずれか1項に記載の方法。
【請求項1】
放射線を照射する処理をされたコラーゲン様ペプチドを含む、核酸の細胞内への導入促進剤であって、
前記コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、導入促進剤。
【請求項2】
前記コラーゲン様ペプチドが、ポリ(Pro−Hyp−Gly)である、請求項1に記載の導入促進剤。
【請求項3】
前記放射線が、電子線である、請求項1又は2に記載の導入促進剤。
【請求項4】
前記核酸が、siRNAである、請求項1〜3のいずれか1項に記載の導入促進剤。
【請求項5】
放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、核酸/コラーゲン様ペプチド複合体であって、
前記コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、複合体。
【請求項6】
前記コラーゲン様ペプチドが、ポリ(Pro−Hyp−Gly)である、請求項5に記載の複合体。
【請求項7】
前記放射線が、電子線である、請求項5又は6に記載の複合体。
【請求項8】
前記核酸が、siRNAである、請求項5〜7のいずれか1項に記載の複合体。
【請求項9】
放射線を照射する処理をされたコラーゲン様ペプチド及び核酸を含む、医薬組成物であって、
前記コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、医薬組成物。
【請求項10】
前記コラーゲン様ペプチドが、ポリ(Pro−Hyp−Gly)である、請求項9に記載の医薬組成物。
【請求項11】
前記放射線が、電子線である、請求項9又は10に記載の医薬組成物。
【請求項12】
前記核酸が、siRNAである、請求項9〜11のいずれか1項に記載の医薬組成物。
【請求項13】
請求項5〜8のいずれか1項に記載の核酸/コラーゲン様ペプチド複合体を保持する医療用又は実験用器具。
【請求項14】
放射線を照射する処理をされたコラーゲン様ペプチドを核酸の細胞内導入キャリアとして用いることを特徴とする、核酸を細胞内に導入する方法であって、
前記コラーゲン様ペプチドが、アミノ酸配列Pro−X−Glyの繰り返しからなるアミノ酸配列を含むペプチドであり、Xは繰り返しにおいて独立にHyp又はProである、方法。
【請求項15】
前記コラーゲン様ペプチドが、ポリ(Pro−Hyp−Gly)である、請求項14に記載の方法。
【請求項16】
前記放射線が、電子線である、請求項14又は15に記載の方法。
【請求項17】
前記核酸が、siRNAである、請求項14〜16のいずれか1項に記載の方法。
【図1】


【図2】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】




【図2】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】


【公開番号】特開2012−29651(P2012−29651A)
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願番号】特願2010−172711(P2010−172711)
【出願日】平成22年7月30日(2010.7.30)
【出願人】(311002067)JNC株式会社 (208)
【Fターム(参考)】
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願日】平成22年7月30日(2010.7.30)
【出願人】(311002067)JNC株式会社 (208)
【Fターム(参考)】
[ Back to top ]

