放射線療法及び温熱療法を組み合わせた治療装置
【課題】癌患者を治療するための改良された治療装置を提供する。
【解決手段】本発明は、患者の治療用、特に癌治療用の治療装置1であって、患者に対して電離放射線を印加するための放射線治療装置2を備え、さらに患者に対して局所ハイパーサーミアを施すための一体型温熱療法用加温装置3を備えることを特徴とする治療装置に関する。
【解決手段】本発明は、患者の治療用、特に癌治療用の治療装置1であって、患者に対して電離放射線を印加するための放射線治療装置2を備え、さらに患者に対して局所ハイパーサーミアを施すための一体型温熱療法用加温装置3を備えることを特徴とする治療装置に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は患者を治療するための治療装置、特に癌治療用の治療装置に関する。
【背景技術】
【0002】
従来の癌治療法の一として、電離放射線(ionizing radiation)を用いて癌細胞を殺し、腫瘍を縮小させる放射線療法が知られている。体外から外照射(EBRT:external beam radiotherapy)によって、又は体内でいわゆる小線源療法によって放射線を施すことができる。
【0003】
この外部ビーム照射療法をさらに発展させたものが、いわゆるトモセラピー(Tomotherapy)である。トモセラピーでは、患者の周囲で回転する放射線源によって、放射線が患者に対して螺旋状に照射される。トモセラピーの利点は、癌性腫瘍に放射線を正確に照射しながら、腫瘍周辺における正常組織を回避できる点である。
【0004】
他の癌の治療法としては、いわゆる温熱療法がある。この温熱療法では、患者に対して癌性腫瘍の部位に局所又は領域ハイパーサーミア(localized or regional hyperthermia)を施す。
【0005】
温熱療法における効能の一は、癌性腫瘍への血行が改善され、それに従って酸素供給も改善されるので、腫瘍細胞が直後の放射線療法又は化学療法に対して感応性が良くなることが挙げられる。
【0006】
また温熱療法では、直前の放射線療法が与えたダメージを癌性腫瘍の細胞が修復する能力を損なわせる作用も得られる。
【0007】
さらに、治療効果を高めるため放射線療法及び温熱療法を組み合わせることも知られている。しかしながら、温熱療法を放射線療法よりも先に施すべきか、後で施すべきかについては議論のあるところである。
【0008】
臨床現場によっては、癌患者にまず温熱療法を受けさせ、次に癌患者を別室に移動させてから、特殊な放射線治療装置、例えばトモセラピー装置で患者に放射線療法を施しているところがある。
【0009】
また、他の臨床現場では、例えばトモセラピー装置を使って癌患者にまず放射線療法を受けさせ、次に癌患者を別室に移動させてから、直前の放射線療法が与えたダメージを癌性腫瘍の細胞が修復する能力を損なわせるために癌患者に温熱療法を施しているところもある。
【0010】
しかしながら、これら従来の癌療法はいずれも完全に満足できるレベルのものでない。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】国際公開WO2007/067830A号
【発明の概要】
【発明が解決しようとする課題】
【0012】
したがって、本発明の主な目的は、癌患者を治療するための改良された治療装置を提供することにある。
【0013】
また本発明の他の目的は、このような治療装置の動作を制御する方法を提供することにある。
【課題を解決するための手段及び発明の効果】
【0014】
上記の目的は、独立請求項に記載した新規の治療装置及びこれに関する操作方法によって達成される。
【0015】
本発明は、癌細胞に対して放射線療法と温熱療法を空間的及び時間的に同時に施すべきという技術的に重要な教示を含んでいる。したがって本発明は、癌患者に対して温熱療法が放射線療法よりも先に施されるか、又は後で施されるかの相違に過ぎない上述した従来型の組み合わせ療法とは峻別されるものである。
【0016】
したがって、本発明に係る治療装置は、放射線治療装置及びこれと一体化した温熱療法用加温装置を備えている。放射線治療装置は患者に対して電離放射線を印加し、温熱療法用加温装置は患者に対して局所ハイパーサーミアを施す。
【0017】
ここで「ハイパーサーミア」とは、治療部位における体細胞を40℃〜46℃の温度に加温する処置のことである。また温熱療法用加温装置は局所ハイパーサーミアだけを施すものである。したがって、ハイパーサーミアは空間的に治療部位に限定されており、治療部位外の体細胞は平熱に近い低温に置かれる。
【0018】
さらに、放射線治療装置及び温熱療法用加温装置を同時に動作させるように構成するのが好ましい。これにより、放射線療法と局所ハイパーサーミアを同時に患者の治療部位に施すことができるようになる。
【0019】
また放射線治療装置は、患者に対して外照射(EBRT)を施すのが好ましい。ただ本発明は、外照射に限定されるものでない。電離放射線照射を他の方法、例えば患者の中に挿入されるプローブによって患者に照射することもできる。
【0020】
さらに放射線治療装置は、患者に対して強度変調放射線療法(IMRT)を施すのが好ましい。該技術は当該技術分野において周知である。したがって放射線治療装置は、標的体積(例えば腫瘍)に良く適合して放射線生物学的な観点に従って、健常な組織を回避するような線量分布を生成する。
【0021】
さらに放射線治療装置は、患者の体内画像を用いて、患者に対してイメージガイド放射線治療(IGRT:image-guided radiation therapy)を施すのが好ましい。これらの画像は、ボディスキャナ、例えばコンピュータトモグラフィ(CT)によって生成される。好ましくは、放射線療法を開始する前にX線ビームを用いて、いわゆるMV−CT(メガボルトコンピュータトモグラフィ)又は円錐状ビームCTを生成する。このMV−CTは、先に生成された計画用CTと整合され、実際の放射線療法のために患者の位置を修正することが好ましい。この方法は、線量分割間イメージガイド(interfractional image guidance)と呼ばれている。
【0022】
また放射線治療装置は、スライス毎に患者の周囲を回転させることにより、全方向に適用して電離放射線のビームをイメージガイド式及び/又は強度変調式に照射するように構成されたトモセラピー装置であることが好ましい。
【0023】
さらにトモセラピー装置は、腫瘍形状に従って線量分布を変調することで、照射野を腫瘍形状に整合させるための多分割コリメータを備えることが好ましい。これに適したトモセラピー装置は、米トモセラピー社(Tomotheraphy Inc.)から市販されている。
【0024】
温熱療法用加温装置は、好ましくは患者の体内に超音波、電磁波、特にRF波(radio frequency waves)又はマイクロ波を印加することにより、患者の体内に局所ハイパーサーミアを施す。前述の放射線は、環状又はリング状であって患者を取り囲んでいるアンテナ体によって照射されるのが好ましい。このアンテナ体は干渉の原理を用いて患者を取り囲むのが好ましい。これに適する温熱療法用加温装置は米BSDメディカル社(BSD Medical Corporation)より市販されている。
【0025】
あるいは、癌細胞は患者の体内の治療部位に挿入できるプローブで加温でき、このプローブが患者を治療部位において局所的又は領域的に加温し、これにより局所ハイパーサーミアが治療部位内の細胞において施される。
【0026】
放射線療法のイメージガイド用装置、例えばメガボルトコンピュータトモグラフィ(MV−CT)も加温治療の分布を制御するのに有用である。基本的に、MV−CTは、組織の吸収係数μと直接関連する、いわゆるハウンズフィールド単位(Hounsfield units:HU)によって特性が決定される、患者に関する三次元の密度分布を生成し、HU(x、y)=1000(μ(x,y)/μ0−1)。この式中、基準組織μ0は水である。密度HUは温度に依存し、すなわち筋肉組織においては0.45HU/℃である。したがって、一連のMV−CTは、例えば加温治療前、昇温フェーズの終了点(例えば20分後)、さらにその後のプラトー状態において、温度分布に関する貴重な情報も提供する。
【0027】
また本発明に係る治療装置は、制御部内で実行される所定のプログラムに従って放射線治療装置の動作及び温熱療法用加温装置の動作を制御するための少なくとも一の制御部を備えることが好ましい。この所定のプログラムは、計画用システムにおいて生成されるのが好ましい治療計画に対応するものである。
【0028】
例えば所定のプログラムは、温熱療法用加温装置及び/又は放射線治療装置による治療部位の位置及び形状を画成できる。これにより治療部位を治療対象の癌性腫瘍の位置及び形状に整合させることが可能となる。
【0029】
それにはまず計画用CTのデータセットにおいて、標的体積(腫瘍部位及び危険部位)と危険器官を特定する。強度変調を求めるためマルチリーフコリメータ(MLC)を用いた最適な線量分布は放射線療法計画用システム内で算出される。
【0030】
次にハイパーサーミア計画用システムにおいて、アンテナに関して任意所定の位相及び振幅のセットについて印加パターンとその後に温度分布が算出される。次いで特定の位相及び振幅が予測され、特定腫瘍のトポグラフィに関する最善の解が得られる。
【0031】
この結果、所定のプログラムは放射線治療装置及び/又は温熱療法用加温装置に関する動作シーケンスを画成できる。本発明の好ましい実施形態において、所定のプログラムは、放射線治療装置及び温熱療法用加温装置における異なる動作特性によって特徴付けられる、連続した3つの治療フェーズを画成している。
【0032】
第1の治療フェーズにおいて、患者のMV−CTを用いて患者及びアプリケータを幾何形状的に正しく位置決めすることが好ましい。次に温熱療法用加温装置のスイッチをONにして、放射線治療装置のスイッチをOFFにする。したがって、適切なアンテナパラメータを用いた第1の治療フェーズにおいて癌細胞に対して施された温熱療法の結果、癌細胞における血行及び酸素供給が改善され、これにより癌細胞は直後の放射線療法に対して感応性が良くなる。
【0033】
第2の治療フェーズにおいて、温熱療法用加温装置及び放射線治療装置の両方のスイッチがONにされ、癌細胞に対して電離放射線及びハイパーサーミアの両方を施すのが好ましい。このように放射線療法及び温熱療法を同時に施すことにより、細胞内において放射及び温度の特に高い相乗効果が得られる。
【0034】
第3の治療フェーズにおいて、温熱療法用加温装置のスイッチをONにして、放射線治療装置のスイッチをOFFにする。第3の治療フェーズの間に患者に対して施された温熱療法は、好適にも、直前の放射線療法が与えたダメージを癌細胞が修復する能力を損なわせる。
【0035】
上記3つの治療フェーズはそれぞれ5分〜30分、さらに好ましくは15分〜25分の経過時間であることが好ましい。また、これら3つのフェーズを総合計した経過時間は30分〜90分であることが好ましい。
【0036】
さらにまた前記所定のプログラムは、放射線療法における線量分布及び/又は強度、及び/又は温熱療法の制御を画成でき、強度は治療時における特定の経時プロファイルに応じて変動できる。
【0037】
さらに制御部は、放射線治療装置による治療領域が温熱療法用加温装置による治療領域と空間的に重なるような態様で、放射線治療装置による治療領域と温熱療法用加温装置による治療領域の位置を制御することが好ましいことに留意すべきである。それ故に、重複した領域(例えば腫瘍が浸潤した組織)における細胞は放射線療法と温熱療法の両方を同時に受ける。
【0038】
また本発明に係る治療装置は、患者の体内画像を生成するための一体型ボディスキャナを備えることが好ましく、これは前述のイメージガイド放射線治療(IGRT)にとって重要なことである。このボディスキャナはコンピュータトモグラフィ(CT)であることが好ましいが、他に従来のボディスキャナ、例えば磁気共鳴トモグラフィ(MRT)、陽電子放出トモグラフィ(PET)、X線装置、超音波検査機、超音波トモグラフィなどを用いてもよい。さらにボディスキャナは、異なる撮像装置による画像が融像されるような上記撮像装置を組み合わせたものとすることもできる。例えば、コンピュータトモグラフィ(CT)により生成された一方の画像と、それに対応して磁気共鳴トモグラフィ(MRT)による他方の画像を融像することが可能である。
【0039】
また一体化したMV−CTは2〜15mmのスライス厚さで実行できる。一のスライス(半回転)分のデータ取得には10sを要する。したがって、10〜30cm長さに相当する体積は、15mmという大きなスライス厚さの場合、1〜3分で(また、より良好な空間分解能を得るには相応に多い取得回数で)スキャンできる。放射線治療のイメージガイド(IGRT;分割線間のオンライン補正)のために最初のMV−CTが用いられるが、MV−CTの経時的シーケンスを用いて温度分布を監視し制御できる。MV−CTのためにトモセラピーを中断しなくてはならないが、数分間であれば照射をしっかりと画成したうえで中断することは可能であることに留意されたい。任意のCT(kV−CT又はMV−CT)において、空間的な分解能と時間的な分解能との間は競合関係にある。明かに、HU(したがって濃度分解能)の標準偏差は、MV−CT(3MVにおいて1〜2cm大のピクセルに対して±15HU)の場合よりもkV−CT(140kVにおいて2mm大のピクセルに対して±5HU)の場合のほうが遙かに良好である。
【0040】
1ピクセル大である任意の対象物の場合、低い濃度分解能は(0.45HU/℃から導出した)妥当な温度分解能を得るのに遙かに不十分である。しかしながら、数葉のスライスに亘るピクセル、また各スライス、すなわち3つの座標軸全てにおけるピクセルを空間的に統合すれば、濃度分解能の標準偏差を相当程度、減少させることができる。本発明者らは統計学的な考察から以下の可能性に関する知見を得た。
a)3〜5cm大のボクセルの場合、±6℃の温度分解能を得たが、これは>50℃(ホットスポット検出)にて3〜5cmの拡張領域を得ることができたことを意味する。
b)5〜10cm大のボクセルの場合、より良好な±3℃の温度分解能を得たが、これは腫瘍領域において43℃の平均有効温度を立証でき、筋肉や脂肪のような正常組織における43℃前後の高い(恐らく高すぎる)温度水準をトレースできたことを意味する。このようにして、標準のDICOM(Digital Images and Communications in Medicine)のフォーマットでハイパーサーミア計画用プログラムに変換されたMV−CTのデータセットを後処理することによって温度分析を行った。
【0041】
さらにまた本発明は、上述した癌治療用の治療装置に関連して、この装置の動作を制御する方法も包含するものである。
【0042】
最後に本発明は、異なる2種類の照射を組み合わせた治療用照射も包含するものである。第1の種類の照射は、患者を従来の放射線治療するのに適合させた電離照射である。第2の種類の照射は、患者内に局所ハイパーサーミアを含む温熱療法として施すのに適合させたRF照射である。
【0043】
本発明とその特定の特長及び利点は、添付図面を参照しつつなされる以下の詳細な説明からさらに明かとなる。
【図面の簡単な説明】
【0044】
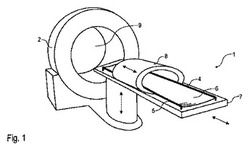
【図1】トモセラピー装置及び温熱療法用加温装置を組み合わせた、本発明に係る治療装置を示す概略斜視図である。
【図2】図1の治療装置を示す概略断面図である。
【図3】図1に示す治療装置に関する概略ブロック図である。
【図4A】図1〜図3に示す治療装置を動作制御するモードを例示するフロー図である。
【図4B】図1〜図3に示す治療装置を動作制御するモードを例示するフロー図である。
【発明を実施するための形態】
【0045】
図1〜図3は、癌治療のために放射線療法と温熱療法を組み合わせた新規の治療装置1を示す。
【0046】
まず治療装置1は腫瘍に対してトモセラピーを施すトモセラピー装置2を備えている。このトモセラピー装置2は米トモセラピー社から市販されている従来型のトモセラピー装置を利用できる。
【0047】
トモセラピー装置2は治療台3の上面に2つの側方金属ロッド4、5を有する治療台3を備えており、マット6がロッド4、5間に張り渡されているので、治療中に患者7をマット6上に寝かせることができる。
【0048】
さらに温熱療法用加温装置8が治療台3に摺動自在に装着されている。治療開始前に温熱療法用加温装置8はトモセラピー装置2に面する治療台3の足許端部へ移動され、患者7を治療台3のマット6上に簡単に寝かせることができる。次に温熱療法用加温装置8は治療位置へ戻され、マット6上に寝かされている患者7を囲む。
【0049】
上述のように患者7を位置決めした後、治療台3はトモセラピー装置2の開口部9内へ移動され、温熱療法用加温装置8は同軸状態で心合され、トモセラピー装置2の開口部9内の中心に配置される。このような実施形態において、開口部9はd=85cmの直径を有しており、患者7を載せた治療台3全体と温熱療法用加温装置8をトモセラピー装置2の開口部9内へ移動できる。
【0050】
一体型の温熱療法用加温装置8は癌患者7に対して温熱療法を施し、局所ハイパーサーミアが患者7の治療部位に施される。温熱療法用加温装置8は、米BSDメディカル社から市販されている従来型の温熱療法用加温装置を利用できる。
【0051】
ここで図2の断面図を参照すれば、図2に温熱療法用加温装置8及びトモセラピー装置2がさらに詳細に示されている。
【0052】
トモセラピー装置2は、互いに対向して配置され患者7の周囲で回転する放射部10及び放射線検出部11を備えている。放射部10は高密度の金属製ターゲット12(例えばタングステン)を備えており、このターゲット12に対して、リニアアクセラレータ(LINAC;linear accelerator)によって生成された6MeVの電子ビーム13が衝突し、これにより6MeVのX線ビームが生成される。さらに放射部10は、主コリメータ14、フラットニングフィルタ15、電離箱16、マルチリーフコリメータ17(MLC;multi-leaf collimator)を備えている。主コリメータ14はX線ビームを長手方向へ平行させ、フラットニングフィルタ15はX線ビームを均質化する。また、多分割コリメータ17はx−z平面における線量分布を変調する。
【0053】
また、トモセラピー装置2における開口部9の内周壁は静電シールド材18、例えば薄厚銅箔又はメッシュで被覆されており、このシールド材がトモセラピー装置の電子部品をシールドしている。
【0054】
さらにまた、温熱療法用加温装置8はローラー19上に支持されており、温熱療法用加温装置8は治療台3に沿って転動でき、患者7をマット6上に位置決めしやすくなることが判る。
【0055】
また高周波ケーブル(図示せず)を介して送信されるアンテナ体20が温熱療法用加温装置8に設けられていることも判る。さらに水パイプ(図示せず)が温熱療法用加温装置8の内部に排水して、この内部を水ボーラス21で充満させる。
【0056】
ここで、患者7を癌治療するための治療装置1に関する概略ブロック図を示す図3を参照する。
【0057】
このブロック図は、トモセラピー装置2が本質的に放射線治療装置22と、患者7の断面画像をスライス毎に生成するメガボルトコンピュータトモグラフィ(MV−CT)23とで構成されることを示している。
【0058】
メガボルトコンピュータトモグラフィ23は、治療中に回避すべき患者7の熱的ホットスポットを検出するのに適合させている。
【0059】
さらに治療装置1は、スライス毎に患者7の断面画像も生成するキロボルトコンピュータトモグラフィ(kV−CT)24も備えている。ただ、このキロボルトコンピュータトモグラフィ24はメガボルトコンピュータトモグラフィ23よりも遙かに高い空間分解能を有しているので、患者7における温度分布を高精度で測定できる。
【0060】
また治療装置1は、放射線治療装置22及び温熱療法用加温装置8の動作を制御する制御部25も備えている。例えばこの制御部25は、放射線治療装置22及び温熱療法用加温装置8それぞれを作動させたり不作動にする。さらに制御部25は放射線治療装置22及び温熱療法用加温装置8の治療部位に関する位置及び形状を画成するので、治療部位を腫瘍の位置及び形状と整合させることができる。さらにまた制御部25は放射線治療装置22及び温熱療法用加温装置8により印加される放射線の強度を変調できる。
【0061】
制御部25は、放射線治療装置22及び温熱療法用加温装置8のイメージガイド制御を実行し、患者7の画像がキロボルトコンピュータトモグラフィ24及びメガボルトコンピュータトモグラフィ23によって作成される。
【0062】
以下、図4A及び図4Bに示すフローチャートを参照して説明する。
【0063】
治療開始前に患者7は前述の治療台3上で位置決めされ、温熱療法用加温装置8が患者7の身体を囲む。
【0064】
次に患者7及び温熱療法用加温装置8と共に治療台3はトモセラピー装置2の開口部9内へ移動され、温熱療法用加温装置8がトモセラピー装置2の開口部9内に位置決めされる。
【0065】
これらの準備作業の後、以下の治療が開始され、トモセラピー装置2及び温熱療法用加温装置8の動作制御は制御部25内で実行される所定のプログラムに基づいて行われる。
【0066】
治療開始前の第1の工程S1において、タイマtがリセットされる。
【0067】
次いで工程S2において、第1のメガボルトコンピュータトモグラフィMV−CT1が実行される。
【0068】
第1のメガボルトコンピュータトモグラフィMV−CT1によって生成された画像が次に工程S3で用いられ、患者7及び温熱療法用加温装置8の位置を互いに対して及びトモセラピー装置2に対して制御及び調整する。
【0069】
次の工程S4において、制御部25は温熱療法用加温装置8を作動させ、放射線治療装置22は不作動のままにしておく。
【0070】
さらに次の工程S5において、制御部25は、t=20分に設定した第1の治療フェーズが既に過ぎたかどうかを連続的にチェックする。
【0071】
t=20分に設定した第1フェーズが過ぎていなければ、制御部25は工程S4を継続し、温熱療法用加温装置8のスイッチをONにして、放射線治療装置22のスイッチをOFFにする。
【0072】
t=20分を超えたら、動作制御は工程S6に進み、第2のメガボルトコンピュータトモグラフィMV−CT2が実行される。この第2のメガボルトコンピュータトモグラフィMV−CT2で生成された画像は次に工程S7において利用され、治療装置1におけるチャンネルのアンテナ機能及び位相/振幅を適用する。
【0073】
次に工程S8において、放射線治療装置22のスイッチはONにされ、温熱療法用加温装置8を作動状態のままにしておく。したがって、治療用加温装置1は温熱療法及び放射線療法の両方を患者7に対して施す。
【0074】
次の工程S9において、制御部25は、t=40分に設定した第2の治療フェーズが既に過ぎているかどうかを連続的にチェックする。
【0075】
t=40分を超えていれば、制御部25は工程S10に進み、第3のメガボルトコンピュータトモグラフィMV−CT3が実行される。
【0076】
この第3のメガボルトコンピュータトモグラフィMV−CT3の結果を次の工程S11で利用して、チャンネルのアンテナ機能及び位相/振幅を適用する。
【0077】
次に工程S12において、放射線治療装置22のスイッチをOFFにして、温熱療法用加温装置8を作動状態のままにしておく。
【0078】
さらに工程S13において、制御部25はt=60分に設定した第3の治療フェーズが既に過ぎたかどうかを連続的にチェックする。
【0079】
t=60分を超えていれば、制御部25は工程S14に進み、放射線治療装置22及び温熱療法用加温装置8の両方のスイッチがOFFにされる。
【0080】
最終工程S15において、第4のメガボルトコンピュータトモグラフィMV−CT4が実行される。
【0081】
次に、本発明をさらに明確にするため、治療装置1の動作を以下説明する。
【0082】
癌の多モード治療では、始めに標的(ここでは局所的に進行した腫瘍病変)に対して線量を最適に集中させた状態で、また正常組織及び特定の枢要な器官を首尾良く画成したうえで回避して、イメージガイド式であって強度変調式の放射線療法を施す。ここで、LINACの治療ヘッド、すなわち放射部10は(RFアプリケータにおいて)患者7の周囲を回転するが、1回転当り約1分を要し、5°毎に(分割用)リーフのスイッチをON/OFFにすることで線量を変調する。多分割コリメータ17は64枚のリーフで構成されており、アイソセンタにおける各リーフの幅6.25mmが40cmの照射野をカバーする。線量分布は1回転当り1枚のスライス内に生成され、スライス厚さを0.5〜5cmに調整する。したがって、長手方向の30cmに相当する体積に対して6分(5cmのスライス)から60分(0.5cmのスライス)で照射できる。
【0083】
LINACに対する患者7の正確な位置は、メガボルトコンピュータトモグラフィ(MV−CT)を用いて制御される。撮像は、LINACの中央ビームに対向した738個のキセノン検出器からなる検出器アレイを使って行われる。治療用CTは、1スライス当り12s、すなわち体積全体に対して1〜5分を要する。次に計画用キロボルトコンピュータトモグラフィ(kV−CT)のデータセットは、治療用MV−CTのデータセットと融像され、位置を補正するためのシフトベクトルが決定される。ただ、患者7に対する計画用CTのデータセットは、治療位置、すなわちRFアプリケータ内で実行する必要がある。放射線療法計画に用いられている近年のCTスキャナは、85cmのガントリも有しており、RFアプリケータ内に位置決めされた患者をスキャンするために十分なスペースを有している。
【0084】
位置決めし直した後、局所ハイパーサーミアは楕円形のRFアプリケータ(モダリティ1)において実行され、IGRT及びIMRT(モダリティ2)は熱送達(熱照射)と同時に実行される。一般に、温度分布に関するプラトー状態を得るのに、20分の加温フェーズを必要とする。次に第2のMV−CTが実行でき、温度分布の特性を定めるために熱送達(熱照射)中にさらにMV−CTが続けられる。したがってMV−CTは、放射線療法に対する分割線間の位置決めの制御に有用のみならず、温度分布をオンラインで制御し最適化するためにも有用である。
【0085】
最後に、重要なこととして、放射線療法は従来の線量分割、例えば30x20Gyにおいて施されることに留意されたい。その結果、同時に温熱療法を30回まで施すことができる。勿論、放射線療法と温熱療法に関して他の組み合わせも考えられる。さらに、放射線化学療法との組み合わせも考えられる。
【0086】
以下、本発明に関連するkV−CT及びMV−CTにおける具体的な特性について説明する。
【0087】
kV−CTにおいて、濃度分解能は2mm大のボクセルに対して5HU(ハウンズフィールド単位)に略等しい。HUは吸収係数HU=1000(μ/μ0−1)に直接関連している。密度の温度依存は、筋肉(又は腫瘍)において0.45HU/℃に変換する。1ボクセルにおける標準ゆらぎは、NボクセルにおけるσN=σ(1+N)-3/4だけの標準ゆらぎに関連している。
【0088】
その結果、従来のCTスキャナ(140kV)において2mm大の典型的なボクセルにおいて15℃だけの温度分解能であると思われる。しかし、1cm大のボクセルでは、分解能は126-3/4倍、すなわち37倍分改善される。したがって、従来のCTを使った場合、温度分解能は1cm大のボクセルにおいてより良好な0.5℃である(また2cm大のボクセルにおいてより良好な0.1℃であり得る)。
【0089】
MV−CT(3MVのX線)における濃度分解能は、10〜12cGy(100〜120mSv)という無視できないほどの曝露に対して、3cm大のボクセルにおいて15HU(1.5%)として表わされる。これは30℃だけの温度分解能である。6cmの対象物に対して、本発明者らは6.5℃の温度分解能を得ており、37〜44℃の領域と>44℃の領域間で区別できる。これはいくらかの延長(>5cm)における>44℃のホットスポットを検出するには十分である。
【0090】
9cm延長の大きな対象物に関して、本発明者らは平均温度の温度分解能を<3℃まで改善することさえもでき、すなわち(≒9cmの大きな領域に関して)37〜40℃、40〜43℃、43℃超に区別できる。これでハイパーサーミアアプリケータのアンテナ機能を適用するために開発されたコードを利用するには十分であり、また任意所定の客観的な機能に従って温度分布を改善(最適化)するにも十分である。このアルゴリズムは、元来MR制御局所ハイパーサーミアのために開発されたものである(ヴァイラウッハ他「医学物理学」(Med.Phys.)2007年を参照)が、CT系の制御にも然るべく利用できる。
【0091】
次に、マルチアンテナ式RFハイパーサーミア用のCT制御を実行するには、以下のような選択肢がある。
【0092】
まず熱的なホットスポットを検出でき、3MVにてMV−CTを用いて温度分布を最適化できる(例えば9cm大の対象物に対して3℃)。
【0093】
別の選択肢としては、計画用kV−CT(140kV)を用いて、遙かに良好な分解能(1cm大の対象物において<0.5℃)で、熱処理をオンラインで(リアルタイムに)最適化することである。
【0094】
最後に、kV−CTをトモセラピー装置内に一体化できる。次に、オンボード型CTを用いて、上記したようにリアルタイムで最適化できる。
【符号の説明】
【0095】
1…治療装置
2…トモセラピー装置
3…治療台
4…ロッド
5…ロッド
6…マット
7…患者
8…温熱療法用加温装置
9…開口部
10…放射部
11…放射線検出部
12…金属製ターゲット
13…電子ビーム
14…主コリメータ
15…フラットニングフィルタ
16…電離箱
17…多分割コリメータ
18…電気シールド材
19…ローラー
20…アンテナ体
21…水ボーラス
22…放射線治療装置
23…メガボルトコンピュータトモグラフィ
24…キロボルトコンピュータトモグラフィ
25…制御部
【技術分野】
【0001】
本発明は患者を治療するための治療装置、特に癌治療用の治療装置に関する。
【背景技術】
【0002】
従来の癌治療法の一として、電離放射線(ionizing radiation)を用いて癌細胞を殺し、腫瘍を縮小させる放射線療法が知られている。体外から外照射(EBRT:external beam radiotherapy)によって、又は体内でいわゆる小線源療法によって放射線を施すことができる。
【0003】
この外部ビーム照射療法をさらに発展させたものが、いわゆるトモセラピー(Tomotherapy)である。トモセラピーでは、患者の周囲で回転する放射線源によって、放射線が患者に対して螺旋状に照射される。トモセラピーの利点は、癌性腫瘍に放射線を正確に照射しながら、腫瘍周辺における正常組織を回避できる点である。
【0004】
他の癌の治療法としては、いわゆる温熱療法がある。この温熱療法では、患者に対して癌性腫瘍の部位に局所又は領域ハイパーサーミア(localized or regional hyperthermia)を施す。
【0005】
温熱療法における効能の一は、癌性腫瘍への血行が改善され、それに従って酸素供給も改善されるので、腫瘍細胞が直後の放射線療法又は化学療法に対して感応性が良くなることが挙げられる。
【0006】
また温熱療法では、直前の放射線療法が与えたダメージを癌性腫瘍の細胞が修復する能力を損なわせる作用も得られる。
【0007】
さらに、治療効果を高めるため放射線療法及び温熱療法を組み合わせることも知られている。しかしながら、温熱療法を放射線療法よりも先に施すべきか、後で施すべきかについては議論のあるところである。
【0008】
臨床現場によっては、癌患者にまず温熱療法を受けさせ、次に癌患者を別室に移動させてから、特殊な放射線治療装置、例えばトモセラピー装置で患者に放射線療法を施しているところがある。
【0009】
また、他の臨床現場では、例えばトモセラピー装置を使って癌患者にまず放射線療法を受けさせ、次に癌患者を別室に移動させてから、直前の放射線療法が与えたダメージを癌性腫瘍の細胞が修復する能力を損なわせるために癌患者に温熱療法を施しているところもある。
【0010】
しかしながら、これら従来の癌療法はいずれも完全に満足できるレベルのものでない。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】国際公開WO2007/067830A号
【発明の概要】
【発明が解決しようとする課題】
【0012】
したがって、本発明の主な目的は、癌患者を治療するための改良された治療装置を提供することにある。
【0013】
また本発明の他の目的は、このような治療装置の動作を制御する方法を提供することにある。
【課題を解決するための手段及び発明の効果】
【0014】
上記の目的は、独立請求項に記載した新規の治療装置及びこれに関する操作方法によって達成される。
【0015】
本発明は、癌細胞に対して放射線療法と温熱療法を空間的及び時間的に同時に施すべきという技術的に重要な教示を含んでいる。したがって本発明は、癌患者に対して温熱療法が放射線療法よりも先に施されるか、又は後で施されるかの相違に過ぎない上述した従来型の組み合わせ療法とは峻別されるものである。
【0016】
したがって、本発明に係る治療装置は、放射線治療装置及びこれと一体化した温熱療法用加温装置を備えている。放射線治療装置は患者に対して電離放射線を印加し、温熱療法用加温装置は患者に対して局所ハイパーサーミアを施す。
【0017】
ここで「ハイパーサーミア」とは、治療部位における体細胞を40℃〜46℃の温度に加温する処置のことである。また温熱療法用加温装置は局所ハイパーサーミアだけを施すものである。したがって、ハイパーサーミアは空間的に治療部位に限定されており、治療部位外の体細胞は平熱に近い低温に置かれる。
【0018】
さらに、放射線治療装置及び温熱療法用加温装置を同時に動作させるように構成するのが好ましい。これにより、放射線療法と局所ハイパーサーミアを同時に患者の治療部位に施すことができるようになる。
【0019】
また放射線治療装置は、患者に対して外照射(EBRT)を施すのが好ましい。ただ本発明は、外照射に限定されるものでない。電離放射線照射を他の方法、例えば患者の中に挿入されるプローブによって患者に照射することもできる。
【0020】
さらに放射線治療装置は、患者に対して強度変調放射線療法(IMRT)を施すのが好ましい。該技術は当該技術分野において周知である。したがって放射線治療装置は、標的体積(例えば腫瘍)に良く適合して放射線生物学的な観点に従って、健常な組織を回避するような線量分布を生成する。
【0021】
さらに放射線治療装置は、患者の体内画像を用いて、患者に対してイメージガイド放射線治療(IGRT:image-guided radiation therapy)を施すのが好ましい。これらの画像は、ボディスキャナ、例えばコンピュータトモグラフィ(CT)によって生成される。好ましくは、放射線療法を開始する前にX線ビームを用いて、いわゆるMV−CT(メガボルトコンピュータトモグラフィ)又は円錐状ビームCTを生成する。このMV−CTは、先に生成された計画用CTと整合され、実際の放射線療法のために患者の位置を修正することが好ましい。この方法は、線量分割間イメージガイド(interfractional image guidance)と呼ばれている。
【0022】
また放射線治療装置は、スライス毎に患者の周囲を回転させることにより、全方向に適用して電離放射線のビームをイメージガイド式及び/又は強度変調式に照射するように構成されたトモセラピー装置であることが好ましい。
【0023】
さらにトモセラピー装置は、腫瘍形状に従って線量分布を変調することで、照射野を腫瘍形状に整合させるための多分割コリメータを備えることが好ましい。これに適したトモセラピー装置は、米トモセラピー社(Tomotheraphy Inc.)から市販されている。
【0024】
温熱療法用加温装置は、好ましくは患者の体内に超音波、電磁波、特にRF波(radio frequency waves)又はマイクロ波を印加することにより、患者の体内に局所ハイパーサーミアを施す。前述の放射線は、環状又はリング状であって患者を取り囲んでいるアンテナ体によって照射されるのが好ましい。このアンテナ体は干渉の原理を用いて患者を取り囲むのが好ましい。これに適する温熱療法用加温装置は米BSDメディカル社(BSD Medical Corporation)より市販されている。
【0025】
あるいは、癌細胞は患者の体内の治療部位に挿入できるプローブで加温でき、このプローブが患者を治療部位において局所的又は領域的に加温し、これにより局所ハイパーサーミアが治療部位内の細胞において施される。
【0026】
放射線療法のイメージガイド用装置、例えばメガボルトコンピュータトモグラフィ(MV−CT)も加温治療の分布を制御するのに有用である。基本的に、MV−CTは、組織の吸収係数μと直接関連する、いわゆるハウンズフィールド単位(Hounsfield units:HU)によって特性が決定される、患者に関する三次元の密度分布を生成し、HU(x、y)=1000(μ(x,y)/μ0−1)。この式中、基準組織μ0は水である。密度HUは温度に依存し、すなわち筋肉組織においては0.45HU/℃である。したがって、一連のMV−CTは、例えば加温治療前、昇温フェーズの終了点(例えば20分後)、さらにその後のプラトー状態において、温度分布に関する貴重な情報も提供する。
【0027】
また本発明に係る治療装置は、制御部内で実行される所定のプログラムに従って放射線治療装置の動作及び温熱療法用加温装置の動作を制御するための少なくとも一の制御部を備えることが好ましい。この所定のプログラムは、計画用システムにおいて生成されるのが好ましい治療計画に対応するものである。
【0028】
例えば所定のプログラムは、温熱療法用加温装置及び/又は放射線治療装置による治療部位の位置及び形状を画成できる。これにより治療部位を治療対象の癌性腫瘍の位置及び形状に整合させることが可能となる。
【0029】
それにはまず計画用CTのデータセットにおいて、標的体積(腫瘍部位及び危険部位)と危険器官を特定する。強度変調を求めるためマルチリーフコリメータ(MLC)を用いた最適な線量分布は放射線療法計画用システム内で算出される。
【0030】
次にハイパーサーミア計画用システムにおいて、アンテナに関して任意所定の位相及び振幅のセットについて印加パターンとその後に温度分布が算出される。次いで特定の位相及び振幅が予測され、特定腫瘍のトポグラフィに関する最善の解が得られる。
【0031】
この結果、所定のプログラムは放射線治療装置及び/又は温熱療法用加温装置に関する動作シーケンスを画成できる。本発明の好ましい実施形態において、所定のプログラムは、放射線治療装置及び温熱療法用加温装置における異なる動作特性によって特徴付けられる、連続した3つの治療フェーズを画成している。
【0032】
第1の治療フェーズにおいて、患者のMV−CTを用いて患者及びアプリケータを幾何形状的に正しく位置決めすることが好ましい。次に温熱療法用加温装置のスイッチをONにして、放射線治療装置のスイッチをOFFにする。したがって、適切なアンテナパラメータを用いた第1の治療フェーズにおいて癌細胞に対して施された温熱療法の結果、癌細胞における血行及び酸素供給が改善され、これにより癌細胞は直後の放射線療法に対して感応性が良くなる。
【0033】
第2の治療フェーズにおいて、温熱療法用加温装置及び放射線治療装置の両方のスイッチがONにされ、癌細胞に対して電離放射線及びハイパーサーミアの両方を施すのが好ましい。このように放射線療法及び温熱療法を同時に施すことにより、細胞内において放射及び温度の特に高い相乗効果が得られる。
【0034】
第3の治療フェーズにおいて、温熱療法用加温装置のスイッチをONにして、放射線治療装置のスイッチをOFFにする。第3の治療フェーズの間に患者に対して施された温熱療法は、好適にも、直前の放射線療法が与えたダメージを癌細胞が修復する能力を損なわせる。
【0035】
上記3つの治療フェーズはそれぞれ5分〜30分、さらに好ましくは15分〜25分の経過時間であることが好ましい。また、これら3つのフェーズを総合計した経過時間は30分〜90分であることが好ましい。
【0036】
さらにまた前記所定のプログラムは、放射線療法における線量分布及び/又は強度、及び/又は温熱療法の制御を画成でき、強度は治療時における特定の経時プロファイルに応じて変動できる。
【0037】
さらに制御部は、放射線治療装置による治療領域が温熱療法用加温装置による治療領域と空間的に重なるような態様で、放射線治療装置による治療領域と温熱療法用加温装置による治療領域の位置を制御することが好ましいことに留意すべきである。それ故に、重複した領域(例えば腫瘍が浸潤した組織)における細胞は放射線療法と温熱療法の両方を同時に受ける。
【0038】
また本発明に係る治療装置は、患者の体内画像を生成するための一体型ボディスキャナを備えることが好ましく、これは前述のイメージガイド放射線治療(IGRT)にとって重要なことである。このボディスキャナはコンピュータトモグラフィ(CT)であることが好ましいが、他に従来のボディスキャナ、例えば磁気共鳴トモグラフィ(MRT)、陽電子放出トモグラフィ(PET)、X線装置、超音波検査機、超音波トモグラフィなどを用いてもよい。さらにボディスキャナは、異なる撮像装置による画像が融像されるような上記撮像装置を組み合わせたものとすることもできる。例えば、コンピュータトモグラフィ(CT)により生成された一方の画像と、それに対応して磁気共鳴トモグラフィ(MRT)による他方の画像を融像することが可能である。
【0039】
また一体化したMV−CTは2〜15mmのスライス厚さで実行できる。一のスライス(半回転)分のデータ取得には10sを要する。したがって、10〜30cm長さに相当する体積は、15mmという大きなスライス厚さの場合、1〜3分で(また、より良好な空間分解能を得るには相応に多い取得回数で)スキャンできる。放射線治療のイメージガイド(IGRT;分割線間のオンライン補正)のために最初のMV−CTが用いられるが、MV−CTの経時的シーケンスを用いて温度分布を監視し制御できる。MV−CTのためにトモセラピーを中断しなくてはならないが、数分間であれば照射をしっかりと画成したうえで中断することは可能であることに留意されたい。任意のCT(kV−CT又はMV−CT)において、空間的な分解能と時間的な分解能との間は競合関係にある。明かに、HU(したがって濃度分解能)の標準偏差は、MV−CT(3MVにおいて1〜2cm大のピクセルに対して±15HU)の場合よりもkV−CT(140kVにおいて2mm大のピクセルに対して±5HU)の場合のほうが遙かに良好である。
【0040】
1ピクセル大である任意の対象物の場合、低い濃度分解能は(0.45HU/℃から導出した)妥当な温度分解能を得るのに遙かに不十分である。しかしながら、数葉のスライスに亘るピクセル、また各スライス、すなわち3つの座標軸全てにおけるピクセルを空間的に統合すれば、濃度分解能の標準偏差を相当程度、減少させることができる。本発明者らは統計学的な考察から以下の可能性に関する知見を得た。
a)3〜5cm大のボクセルの場合、±6℃の温度分解能を得たが、これは>50℃(ホットスポット検出)にて3〜5cmの拡張領域を得ることができたことを意味する。
b)5〜10cm大のボクセルの場合、より良好な±3℃の温度分解能を得たが、これは腫瘍領域において43℃の平均有効温度を立証でき、筋肉や脂肪のような正常組織における43℃前後の高い(恐らく高すぎる)温度水準をトレースできたことを意味する。このようにして、標準のDICOM(Digital Images and Communications in Medicine)のフォーマットでハイパーサーミア計画用プログラムに変換されたMV−CTのデータセットを後処理することによって温度分析を行った。
【0041】
さらにまた本発明は、上述した癌治療用の治療装置に関連して、この装置の動作を制御する方法も包含するものである。
【0042】
最後に本発明は、異なる2種類の照射を組み合わせた治療用照射も包含するものである。第1の種類の照射は、患者を従来の放射線治療するのに適合させた電離照射である。第2の種類の照射は、患者内に局所ハイパーサーミアを含む温熱療法として施すのに適合させたRF照射である。
【0043】
本発明とその特定の特長及び利点は、添付図面を参照しつつなされる以下の詳細な説明からさらに明かとなる。
【図面の簡単な説明】
【0044】
【図1】トモセラピー装置及び温熱療法用加温装置を組み合わせた、本発明に係る治療装置を示す概略斜視図である。
【図2】図1の治療装置を示す概略断面図である。
【図3】図1に示す治療装置に関する概略ブロック図である。
【図4A】図1〜図3に示す治療装置を動作制御するモードを例示するフロー図である。
【図4B】図1〜図3に示す治療装置を動作制御するモードを例示するフロー図である。
【発明を実施するための形態】
【0045】
図1〜図3は、癌治療のために放射線療法と温熱療法を組み合わせた新規の治療装置1を示す。
【0046】
まず治療装置1は腫瘍に対してトモセラピーを施すトモセラピー装置2を備えている。このトモセラピー装置2は米トモセラピー社から市販されている従来型のトモセラピー装置を利用できる。
【0047】
トモセラピー装置2は治療台3の上面に2つの側方金属ロッド4、5を有する治療台3を備えており、マット6がロッド4、5間に張り渡されているので、治療中に患者7をマット6上に寝かせることができる。
【0048】
さらに温熱療法用加温装置8が治療台3に摺動自在に装着されている。治療開始前に温熱療法用加温装置8はトモセラピー装置2に面する治療台3の足許端部へ移動され、患者7を治療台3のマット6上に簡単に寝かせることができる。次に温熱療法用加温装置8は治療位置へ戻され、マット6上に寝かされている患者7を囲む。
【0049】
上述のように患者7を位置決めした後、治療台3はトモセラピー装置2の開口部9内へ移動され、温熱療法用加温装置8は同軸状態で心合され、トモセラピー装置2の開口部9内の中心に配置される。このような実施形態において、開口部9はd=85cmの直径を有しており、患者7を載せた治療台3全体と温熱療法用加温装置8をトモセラピー装置2の開口部9内へ移動できる。
【0050】
一体型の温熱療法用加温装置8は癌患者7に対して温熱療法を施し、局所ハイパーサーミアが患者7の治療部位に施される。温熱療法用加温装置8は、米BSDメディカル社から市販されている従来型の温熱療法用加温装置を利用できる。
【0051】
ここで図2の断面図を参照すれば、図2に温熱療法用加温装置8及びトモセラピー装置2がさらに詳細に示されている。
【0052】
トモセラピー装置2は、互いに対向して配置され患者7の周囲で回転する放射部10及び放射線検出部11を備えている。放射部10は高密度の金属製ターゲット12(例えばタングステン)を備えており、このターゲット12に対して、リニアアクセラレータ(LINAC;linear accelerator)によって生成された6MeVの電子ビーム13が衝突し、これにより6MeVのX線ビームが生成される。さらに放射部10は、主コリメータ14、フラットニングフィルタ15、電離箱16、マルチリーフコリメータ17(MLC;multi-leaf collimator)を備えている。主コリメータ14はX線ビームを長手方向へ平行させ、フラットニングフィルタ15はX線ビームを均質化する。また、多分割コリメータ17はx−z平面における線量分布を変調する。
【0053】
また、トモセラピー装置2における開口部9の内周壁は静電シールド材18、例えば薄厚銅箔又はメッシュで被覆されており、このシールド材がトモセラピー装置の電子部品をシールドしている。
【0054】
さらにまた、温熱療法用加温装置8はローラー19上に支持されており、温熱療法用加温装置8は治療台3に沿って転動でき、患者7をマット6上に位置決めしやすくなることが判る。
【0055】
また高周波ケーブル(図示せず)を介して送信されるアンテナ体20が温熱療法用加温装置8に設けられていることも判る。さらに水パイプ(図示せず)が温熱療法用加温装置8の内部に排水して、この内部を水ボーラス21で充満させる。
【0056】
ここで、患者7を癌治療するための治療装置1に関する概略ブロック図を示す図3を参照する。
【0057】
このブロック図は、トモセラピー装置2が本質的に放射線治療装置22と、患者7の断面画像をスライス毎に生成するメガボルトコンピュータトモグラフィ(MV−CT)23とで構成されることを示している。
【0058】
メガボルトコンピュータトモグラフィ23は、治療中に回避すべき患者7の熱的ホットスポットを検出するのに適合させている。
【0059】
さらに治療装置1は、スライス毎に患者7の断面画像も生成するキロボルトコンピュータトモグラフィ(kV−CT)24も備えている。ただ、このキロボルトコンピュータトモグラフィ24はメガボルトコンピュータトモグラフィ23よりも遙かに高い空間分解能を有しているので、患者7における温度分布を高精度で測定できる。
【0060】
また治療装置1は、放射線治療装置22及び温熱療法用加温装置8の動作を制御する制御部25も備えている。例えばこの制御部25は、放射線治療装置22及び温熱療法用加温装置8それぞれを作動させたり不作動にする。さらに制御部25は放射線治療装置22及び温熱療法用加温装置8の治療部位に関する位置及び形状を画成するので、治療部位を腫瘍の位置及び形状と整合させることができる。さらにまた制御部25は放射線治療装置22及び温熱療法用加温装置8により印加される放射線の強度を変調できる。
【0061】
制御部25は、放射線治療装置22及び温熱療法用加温装置8のイメージガイド制御を実行し、患者7の画像がキロボルトコンピュータトモグラフィ24及びメガボルトコンピュータトモグラフィ23によって作成される。
【0062】
以下、図4A及び図4Bに示すフローチャートを参照して説明する。
【0063】
治療開始前に患者7は前述の治療台3上で位置決めされ、温熱療法用加温装置8が患者7の身体を囲む。
【0064】
次に患者7及び温熱療法用加温装置8と共に治療台3はトモセラピー装置2の開口部9内へ移動され、温熱療法用加温装置8がトモセラピー装置2の開口部9内に位置決めされる。
【0065】
これらの準備作業の後、以下の治療が開始され、トモセラピー装置2及び温熱療法用加温装置8の動作制御は制御部25内で実行される所定のプログラムに基づいて行われる。
【0066】
治療開始前の第1の工程S1において、タイマtがリセットされる。
【0067】
次いで工程S2において、第1のメガボルトコンピュータトモグラフィMV−CT1が実行される。
【0068】
第1のメガボルトコンピュータトモグラフィMV−CT1によって生成された画像が次に工程S3で用いられ、患者7及び温熱療法用加温装置8の位置を互いに対して及びトモセラピー装置2に対して制御及び調整する。
【0069】
次の工程S4において、制御部25は温熱療法用加温装置8を作動させ、放射線治療装置22は不作動のままにしておく。
【0070】
さらに次の工程S5において、制御部25は、t=20分に設定した第1の治療フェーズが既に過ぎたかどうかを連続的にチェックする。
【0071】
t=20分に設定した第1フェーズが過ぎていなければ、制御部25は工程S4を継続し、温熱療法用加温装置8のスイッチをONにして、放射線治療装置22のスイッチをOFFにする。
【0072】
t=20分を超えたら、動作制御は工程S6に進み、第2のメガボルトコンピュータトモグラフィMV−CT2が実行される。この第2のメガボルトコンピュータトモグラフィMV−CT2で生成された画像は次に工程S7において利用され、治療装置1におけるチャンネルのアンテナ機能及び位相/振幅を適用する。
【0073】
次に工程S8において、放射線治療装置22のスイッチはONにされ、温熱療法用加温装置8を作動状態のままにしておく。したがって、治療用加温装置1は温熱療法及び放射線療法の両方を患者7に対して施す。
【0074】
次の工程S9において、制御部25は、t=40分に設定した第2の治療フェーズが既に過ぎているかどうかを連続的にチェックする。
【0075】
t=40分を超えていれば、制御部25は工程S10に進み、第3のメガボルトコンピュータトモグラフィMV−CT3が実行される。
【0076】
この第3のメガボルトコンピュータトモグラフィMV−CT3の結果を次の工程S11で利用して、チャンネルのアンテナ機能及び位相/振幅を適用する。
【0077】
次に工程S12において、放射線治療装置22のスイッチをOFFにして、温熱療法用加温装置8を作動状態のままにしておく。
【0078】
さらに工程S13において、制御部25はt=60分に設定した第3の治療フェーズが既に過ぎたかどうかを連続的にチェックする。
【0079】
t=60分を超えていれば、制御部25は工程S14に進み、放射線治療装置22及び温熱療法用加温装置8の両方のスイッチがOFFにされる。
【0080】
最終工程S15において、第4のメガボルトコンピュータトモグラフィMV−CT4が実行される。
【0081】
次に、本発明をさらに明確にするため、治療装置1の動作を以下説明する。
【0082】
癌の多モード治療では、始めに標的(ここでは局所的に進行した腫瘍病変)に対して線量を最適に集中させた状態で、また正常組織及び特定の枢要な器官を首尾良く画成したうえで回避して、イメージガイド式であって強度変調式の放射線療法を施す。ここで、LINACの治療ヘッド、すなわち放射部10は(RFアプリケータにおいて)患者7の周囲を回転するが、1回転当り約1分を要し、5°毎に(分割用)リーフのスイッチをON/OFFにすることで線量を変調する。多分割コリメータ17は64枚のリーフで構成されており、アイソセンタにおける各リーフの幅6.25mmが40cmの照射野をカバーする。線量分布は1回転当り1枚のスライス内に生成され、スライス厚さを0.5〜5cmに調整する。したがって、長手方向の30cmに相当する体積に対して6分(5cmのスライス)から60分(0.5cmのスライス)で照射できる。
【0083】
LINACに対する患者7の正確な位置は、メガボルトコンピュータトモグラフィ(MV−CT)を用いて制御される。撮像は、LINACの中央ビームに対向した738個のキセノン検出器からなる検出器アレイを使って行われる。治療用CTは、1スライス当り12s、すなわち体積全体に対して1〜5分を要する。次に計画用キロボルトコンピュータトモグラフィ(kV−CT)のデータセットは、治療用MV−CTのデータセットと融像され、位置を補正するためのシフトベクトルが決定される。ただ、患者7に対する計画用CTのデータセットは、治療位置、すなわちRFアプリケータ内で実行する必要がある。放射線療法計画に用いられている近年のCTスキャナは、85cmのガントリも有しており、RFアプリケータ内に位置決めされた患者をスキャンするために十分なスペースを有している。
【0084】
位置決めし直した後、局所ハイパーサーミアは楕円形のRFアプリケータ(モダリティ1)において実行され、IGRT及びIMRT(モダリティ2)は熱送達(熱照射)と同時に実行される。一般に、温度分布に関するプラトー状態を得るのに、20分の加温フェーズを必要とする。次に第2のMV−CTが実行でき、温度分布の特性を定めるために熱送達(熱照射)中にさらにMV−CTが続けられる。したがってMV−CTは、放射線療法に対する分割線間の位置決めの制御に有用のみならず、温度分布をオンラインで制御し最適化するためにも有用である。
【0085】
最後に、重要なこととして、放射線療法は従来の線量分割、例えば30x20Gyにおいて施されることに留意されたい。その結果、同時に温熱療法を30回まで施すことができる。勿論、放射線療法と温熱療法に関して他の組み合わせも考えられる。さらに、放射線化学療法との組み合わせも考えられる。
【0086】
以下、本発明に関連するkV−CT及びMV−CTにおける具体的な特性について説明する。
【0087】
kV−CTにおいて、濃度分解能は2mm大のボクセルに対して5HU(ハウンズフィールド単位)に略等しい。HUは吸収係数HU=1000(μ/μ0−1)に直接関連している。密度の温度依存は、筋肉(又は腫瘍)において0.45HU/℃に変換する。1ボクセルにおける標準ゆらぎは、NボクセルにおけるσN=σ(1+N)-3/4だけの標準ゆらぎに関連している。
【0088】
その結果、従来のCTスキャナ(140kV)において2mm大の典型的なボクセルにおいて15℃だけの温度分解能であると思われる。しかし、1cm大のボクセルでは、分解能は126-3/4倍、すなわち37倍分改善される。したがって、従来のCTを使った場合、温度分解能は1cm大のボクセルにおいてより良好な0.5℃である(また2cm大のボクセルにおいてより良好な0.1℃であり得る)。
【0089】
MV−CT(3MVのX線)における濃度分解能は、10〜12cGy(100〜120mSv)という無視できないほどの曝露に対して、3cm大のボクセルにおいて15HU(1.5%)として表わされる。これは30℃だけの温度分解能である。6cmの対象物に対して、本発明者らは6.5℃の温度分解能を得ており、37〜44℃の領域と>44℃の領域間で区別できる。これはいくらかの延長(>5cm)における>44℃のホットスポットを検出するには十分である。
【0090】
9cm延長の大きな対象物に関して、本発明者らは平均温度の温度分解能を<3℃まで改善することさえもでき、すなわち(≒9cmの大きな領域に関して)37〜40℃、40〜43℃、43℃超に区別できる。これでハイパーサーミアアプリケータのアンテナ機能を適用するために開発されたコードを利用するには十分であり、また任意所定の客観的な機能に従って温度分布を改善(最適化)するにも十分である。このアルゴリズムは、元来MR制御局所ハイパーサーミアのために開発されたものである(ヴァイラウッハ他「医学物理学」(Med.Phys.)2007年を参照)が、CT系の制御にも然るべく利用できる。
【0091】
次に、マルチアンテナ式RFハイパーサーミア用のCT制御を実行するには、以下のような選択肢がある。
【0092】
まず熱的なホットスポットを検出でき、3MVにてMV−CTを用いて温度分布を最適化できる(例えば9cm大の対象物に対して3℃)。
【0093】
別の選択肢としては、計画用kV−CT(140kV)を用いて、遙かに良好な分解能(1cm大の対象物において<0.5℃)で、熱処理をオンラインで(リアルタイムに)最適化することである。
【0094】
最後に、kV−CTをトモセラピー装置内に一体化できる。次に、オンボード型CTを用いて、上記したようにリアルタイムで最適化できる。
【符号の説明】
【0095】
1…治療装置
2…トモセラピー装置
3…治療台
4…ロッド
5…ロッド
6…マット
7…患者
8…温熱療法用加温装置
9…開口部
10…放射部
11…放射線検出部
12…金属製ターゲット
13…電子ビーム
14…主コリメータ
15…フラットニングフィルタ
16…電離箱
17…多分割コリメータ
18…電気シールド材
19…ローラー
20…アンテナ体
21…水ボーラス
22…放射線治療装置
23…メガボルトコンピュータトモグラフィ
24…キロボルトコンピュータトモグラフィ
25…制御部
【特許請求の範囲】
【請求項1】
患者(7)の治療用、特に癌治療用の治療装置(1)であって、
a)電離放射線を患者(7)に対して印加するための放射線治療装置(2、22)を備え、
b)さらに、患者(7)に対して局所ハイパーサーミアを施すための一体型温熱療法用加温装置(8)を備えることを特徴とする治療装置。
【請求項2】
請求項1に記載の治療装置(1)であって、
放射線治療装置(2、22)及び温熱療法用加温装置(8)が同時に作動するように構成され、これにより患者(7)内の治療部位に放射線療法及び局所ハイパーサーミアを同時に施せるようにしてなることを特徴とする治療装置。
【請求項3】
請求項1又は2に記載の治療装置(1)であって、放射線治療装置(2、22)が
a)患者(7)に対して外部ビーム照射療法を施し、及び/又は
b)患者(7)に対して強度変調放射線療法を施し、及び/又は
c)患者(7)に対してイメージガイド式放射線療法を施し、及び/又は
d)照射野を腫瘍形状に整合させるための多分割コリメータ(17)を備え、及び/又は
e)異なる方向から患者(7)に対して螺旋状に電離放射線のビームをイメージガイド式で照射するためのトモセラピー装置(2)であることを特徴とする治療装置。
【請求項4】
請求項1〜3のいずれか一に記載の治療装置(1)であって、温熱療法用加温装置(8)が
a)患者(7)内に超音波、電磁波、特にRF波又はマイクロ波を照射することによって局所ハイパーサーミアを施し、及び/又は
b)患者(7)内に電磁波を照射するためのアンテナ体(20)であって、好ましくは環状又はリング状であり患者(7)を包囲するアンテナ体を備え、又は
c)患者(7)内へ治療部位に対して挿入可能なプローブであって、患者(7)を治療部位において局所的に加温するプローブを備えることを特徴とする治療装置。
【請求項5】
請求項1〜4のいずれか一に記載の治療装置(1)であって、さらに
制御部(25)で実行される所定のプログラムに従って、放射線治療装置(2、22)及び温熱療法用加温装置を制御するための制御部(25)を備えることを特徴とする治療装置。
【請求項6】
請求項5に記載の治療装置(1)であって、
a)前記プログラムにより第1のフェーズが提供され、該第1のフェーズにおいて温熱療法用加温装置(8)のスイッチがON、放射線治療装置(2、22)のスイッチがOFFであり、
b)該プログラムにより第1のフェーズに続いて第2のフェーズが提供され、該第2のフェーズにおいて温熱療法用加温装置(8)及び放射線治療装置(2、22)の両方ともスイッチがONであり、
c)該プログラムにより第2のフェーズに続いて第3のフェーズが提供され、該第3のフェーズにおいて温熱療法用加温装置(8)のスイッチがON、放射線治療装置(2、22)のスイッチがOFFであることを特徴とする治療装置。
【請求項7】
請求項6に記載の治療装置(1)であって、
a)治療における前記第1のフェーズ、第2のフェーズ、第3のフェーズそれぞれの経過時間が5分〜30分、さらに好ましくは15分〜25分であり、及び/又は
b)該第1のフェーズ、第2のフェーズ、第3のフェーズを合計した経過時間が30分〜90分であることを特徴とする治療装置。
【請求項8】
請求項6及び7のいずれか一に記載の治療装置(1)であって、
前記制御部(25)は、放射線治療装置における治療領域が温熱療法用加温装置(8)における治療領域と空間的に重複する態様で、放射線治療装置(2、22)及び温熱療法用加温装置(8)の治療領域の位置を制御することを特徴とする治療装置。
【請求項9】
請求項1〜8のいずれか一に記載の治療装置(1)であって、さらに
患者(7)の体内の画像を生成するためのボディスキャナ(23、24)を備えることを特徴とする治療装置。
【請求項10】
請求項9に記載の治療装置(1)であって、前記ボディスキャナ(23、24)は
a)コンピュータトモグラフィ、特にキロボルトコンピュータトモグラフィ(24)又はメガボルトコンピュータトモグラフィ(23)、
b)磁気共鳴トモグラフィ、
c)陽電子放出トモグラフィ、
d)X線装置、
e)超音波検査機、
f)超音波トモグラフィ、又は
g)前記のa〜fに記載の異なる撮像装置の組み合わせであって、異なる撮像装置の画像が融像されることを特徴とする治療装置。
【請求項11】
請求項1〜10のいずれか一に記載の治療装置(1)であって、さらに
a)温熱療法用加温装置(8)により引き起こされた熱的ホットスポットを検出するため、患者(7)の身体画像を生成するメガボルトコンピュータトモグラフィ(23)、及び/又は
b)患者(7)内の温度分布を高分解能で決定するために患者(7)の身体画像を生成するキロボルトコンピュータトモグラフィを備えることを特徴とする治療装置。
【請求項12】
請求項11に記載の治療装置(1)であって、
a)制御部(25)は、メガボルトコンピュータトモグラフィ(23)及び/又はキロボルトコンピュータトモグラフィ(24)によって生成された画像に基づいて、温熱療法用加温装置(8)及び/又は放射線治療装置(2、22)を制御し、及び/又は
b)制御部(25)は、熱的ホットスポットが回避されるか、又は少なくとも分解される態様で、温熱療法用加温装置(8)のイメージガイド制御を実行し、及び/又は
c)制御部(25)は、実際の空間的温度分布が所望の空間的温度分布に近似する態様で、温熱療法用加温装置(8)のイメージガイド制御を実行し、及び/又は
d)制御部(25)は、実際の空間的線量分布が所望の空間的線量分布に近似する態様で、放射線治療装置(2、22)のイメージガイド制御を実行することを特徴とする治療装置。
【請求項13】
請求項12に記載の治療装置(1)であって、温熱療法用加温装置(8)及び/又は放射線治療装置(2、22)がリアルタイムに及び/又は治療中に制御されることを特徴とする治療装置。
【請求項14】
患者(7)の治療用、特に癌治療用の治療装置(1)を作動させるための制御方法であって、
a)患者(7)に放射線治療を受けさせるよう放射線治療装置を作動させ、該放射線治療装置が制御部(25)によって制御される工程を含み、さらに
b)患者(7)に局所ハイパーサーミアを施すための一体型温熱療法用加温装置(8)を作動させ、該温熱療法用加温装置(8)が制御部(25)によって制御される工程を含むことを特徴とする治療装置(1)の制御方法。
【請求項15】
請求項14に記載の治療装置(1)の制御方法であって、制御部(25)は
a)制御部(25)上で動く所定のプログラムに従って、放射線治療装置及び温熱療法用加温装置(8)の作動及び不作動、及び/又は
b)放射線治療装置及び温熱療法用加温装置(8)の治療領域の位置を制御することを特徴とする治療装置の制御方法。
【請求項16】
請求項15に記載の治療装置(1)の制御方法であって、
a)前記プログラムにより第1のフェーズが提供され、該第1のフェーズにおいて温熱療法用加温装置(8)のスイッチがON、放射線治療装置(2、22)のスイッチがOFFであり、
b)該プログラムにより第1のフェーズに続いて第2のフェーズが提供され、該第2のフェーズにおいて温熱療法用加温装置(8)及び放射線治療装置(2、22)の両方ともスイッチがONであり、
c)該プログラムにより第2のフェーズに続いて第3のフェーズが提供され、該第3のフェーズにおいて温熱療法用加温装置(8)のスイッチがON、放射線治療装置(2、22)のスイッチがOFFであることを特徴とする治療装置の制御方法。
【請求項17】
請求項16に記載の治療装置(1)の制御方法であって、
a)治療における前記第1のフェーズ、第2のフェーズ、第3のフェーズそれぞれの経過時間が5分〜30分、さらに好ましくは15分〜25分であり、及び/又は
b)該第1のフェーズ、第2のフェーズ、第3のフェーズを総合計した経過時間が30分〜90分であることを特徴とする治療装置の制御方法。
【請求項18】
請求項15〜17のいずれか一に記載の治療装置(1)の制御方法であって、
前記制御部(25)は、放射線治療装置における治療領域が温熱療法用加温装置(8)における治療領域と空間的に重複する態様で、放射線治療装置(2、22)及び温熱療法用加温装置(8)の治療領域の位置を制御することを特徴とする治療装置の制御方法。
【請求項19】
請求項15〜17のいずれか一に記載の治療装置(1)の制御方法であって、さらに
a)メガボルトコンピュータトモグラフィ(23)を用いて患者(7)の身体画像を生成する工程、及び/又は
b)キロボルトコンピュータトモグラフィ(24)を用いて患者(7)の身体画像を生成する工程を含むことを特徴とする治療装置の制御方法。
【請求項20】
請求項19に記載の治療装置(1)の制御方法であって、さらに
a)メガボルトコンピュータトモグラフィ(23)及び/又はキロボルトコンピュータトモグラフィ(24)によって生成された画像に基づいて、温熱療法用加温装置(8)及び/又は放射線治療装置(2、22)を制御する工程、及び/又は
b)熱的ホットスポットが回避されるか、又は少なくとも分解される態様で、温熱療法用加温装置(8)のイメージガイド制御を実行する工程、及び/又は
c)実際の空間的温度分布が所望の空間的温度分布に近似する態様で、温熱療法用加温装置(8)のイメージガイド制御を実行し、及び/又は
d)実際の空間的線量分布が所望の空間的線量分布に近似する態様で、放射線治療装置(2、22)のイメージガイド制御を実行する工程を含むことを特徴とする治療装置の制御方法。
【請求項21】
患者(7)を放射線治療するのに適した電離照射を含む治療用照射方法であって、
温熱療法として、患者(7)内に局所ハイパーサーミアを施すのに適合させたRF照射を含むことを特徴とする治療用照射方法。
【請求項1】
患者(7)の治療用、特に癌治療用の治療装置(1)であって、
a)電離放射線を患者(7)に対して印加するための放射線治療装置(2、22)を備え、
b)さらに、患者(7)に対して局所ハイパーサーミアを施すための一体型温熱療法用加温装置(8)を備えることを特徴とする治療装置。
【請求項2】
請求項1に記載の治療装置(1)であって、
放射線治療装置(2、22)及び温熱療法用加温装置(8)が同時に作動するように構成され、これにより患者(7)内の治療部位に放射線療法及び局所ハイパーサーミアを同時に施せるようにしてなることを特徴とする治療装置。
【請求項3】
請求項1又は2に記載の治療装置(1)であって、放射線治療装置(2、22)が
a)患者(7)に対して外部ビーム照射療法を施し、及び/又は
b)患者(7)に対して強度変調放射線療法を施し、及び/又は
c)患者(7)に対してイメージガイド式放射線療法を施し、及び/又は
d)照射野を腫瘍形状に整合させるための多分割コリメータ(17)を備え、及び/又は
e)異なる方向から患者(7)に対して螺旋状に電離放射線のビームをイメージガイド式で照射するためのトモセラピー装置(2)であることを特徴とする治療装置。
【請求項4】
請求項1〜3のいずれか一に記載の治療装置(1)であって、温熱療法用加温装置(8)が
a)患者(7)内に超音波、電磁波、特にRF波又はマイクロ波を照射することによって局所ハイパーサーミアを施し、及び/又は
b)患者(7)内に電磁波を照射するためのアンテナ体(20)であって、好ましくは環状又はリング状であり患者(7)を包囲するアンテナ体を備え、又は
c)患者(7)内へ治療部位に対して挿入可能なプローブであって、患者(7)を治療部位において局所的に加温するプローブを備えることを特徴とする治療装置。
【請求項5】
請求項1〜4のいずれか一に記載の治療装置(1)であって、さらに
制御部(25)で実行される所定のプログラムに従って、放射線治療装置(2、22)及び温熱療法用加温装置を制御するための制御部(25)を備えることを特徴とする治療装置。
【請求項6】
請求項5に記載の治療装置(1)であって、
a)前記プログラムにより第1のフェーズが提供され、該第1のフェーズにおいて温熱療法用加温装置(8)のスイッチがON、放射線治療装置(2、22)のスイッチがOFFであり、
b)該プログラムにより第1のフェーズに続いて第2のフェーズが提供され、該第2のフェーズにおいて温熱療法用加温装置(8)及び放射線治療装置(2、22)の両方ともスイッチがONであり、
c)該プログラムにより第2のフェーズに続いて第3のフェーズが提供され、該第3のフェーズにおいて温熱療法用加温装置(8)のスイッチがON、放射線治療装置(2、22)のスイッチがOFFであることを特徴とする治療装置。
【請求項7】
請求項6に記載の治療装置(1)であって、
a)治療における前記第1のフェーズ、第2のフェーズ、第3のフェーズそれぞれの経過時間が5分〜30分、さらに好ましくは15分〜25分であり、及び/又は
b)該第1のフェーズ、第2のフェーズ、第3のフェーズを合計した経過時間が30分〜90分であることを特徴とする治療装置。
【請求項8】
請求項6及び7のいずれか一に記載の治療装置(1)であって、
前記制御部(25)は、放射線治療装置における治療領域が温熱療法用加温装置(8)における治療領域と空間的に重複する態様で、放射線治療装置(2、22)及び温熱療法用加温装置(8)の治療領域の位置を制御することを特徴とする治療装置。
【請求項9】
請求項1〜8のいずれか一に記載の治療装置(1)であって、さらに
患者(7)の体内の画像を生成するためのボディスキャナ(23、24)を備えることを特徴とする治療装置。
【請求項10】
請求項9に記載の治療装置(1)であって、前記ボディスキャナ(23、24)は
a)コンピュータトモグラフィ、特にキロボルトコンピュータトモグラフィ(24)又はメガボルトコンピュータトモグラフィ(23)、
b)磁気共鳴トモグラフィ、
c)陽電子放出トモグラフィ、
d)X線装置、
e)超音波検査機、
f)超音波トモグラフィ、又は
g)前記のa〜fに記載の異なる撮像装置の組み合わせであって、異なる撮像装置の画像が融像されることを特徴とする治療装置。
【請求項11】
請求項1〜10のいずれか一に記載の治療装置(1)であって、さらに
a)温熱療法用加温装置(8)により引き起こされた熱的ホットスポットを検出するため、患者(7)の身体画像を生成するメガボルトコンピュータトモグラフィ(23)、及び/又は
b)患者(7)内の温度分布を高分解能で決定するために患者(7)の身体画像を生成するキロボルトコンピュータトモグラフィを備えることを特徴とする治療装置。
【請求項12】
請求項11に記載の治療装置(1)であって、
a)制御部(25)は、メガボルトコンピュータトモグラフィ(23)及び/又はキロボルトコンピュータトモグラフィ(24)によって生成された画像に基づいて、温熱療法用加温装置(8)及び/又は放射線治療装置(2、22)を制御し、及び/又は
b)制御部(25)は、熱的ホットスポットが回避されるか、又は少なくとも分解される態様で、温熱療法用加温装置(8)のイメージガイド制御を実行し、及び/又は
c)制御部(25)は、実際の空間的温度分布が所望の空間的温度分布に近似する態様で、温熱療法用加温装置(8)のイメージガイド制御を実行し、及び/又は
d)制御部(25)は、実際の空間的線量分布が所望の空間的線量分布に近似する態様で、放射線治療装置(2、22)のイメージガイド制御を実行することを特徴とする治療装置。
【請求項13】
請求項12に記載の治療装置(1)であって、温熱療法用加温装置(8)及び/又は放射線治療装置(2、22)がリアルタイムに及び/又は治療中に制御されることを特徴とする治療装置。
【請求項14】
患者(7)の治療用、特に癌治療用の治療装置(1)を作動させるための制御方法であって、
a)患者(7)に放射線治療を受けさせるよう放射線治療装置を作動させ、該放射線治療装置が制御部(25)によって制御される工程を含み、さらに
b)患者(7)に局所ハイパーサーミアを施すための一体型温熱療法用加温装置(8)を作動させ、該温熱療法用加温装置(8)が制御部(25)によって制御される工程を含むことを特徴とする治療装置(1)の制御方法。
【請求項15】
請求項14に記載の治療装置(1)の制御方法であって、制御部(25)は
a)制御部(25)上で動く所定のプログラムに従って、放射線治療装置及び温熱療法用加温装置(8)の作動及び不作動、及び/又は
b)放射線治療装置及び温熱療法用加温装置(8)の治療領域の位置を制御することを特徴とする治療装置の制御方法。
【請求項16】
請求項15に記載の治療装置(1)の制御方法であって、
a)前記プログラムにより第1のフェーズが提供され、該第1のフェーズにおいて温熱療法用加温装置(8)のスイッチがON、放射線治療装置(2、22)のスイッチがOFFであり、
b)該プログラムにより第1のフェーズに続いて第2のフェーズが提供され、該第2のフェーズにおいて温熱療法用加温装置(8)及び放射線治療装置(2、22)の両方ともスイッチがONであり、
c)該プログラムにより第2のフェーズに続いて第3のフェーズが提供され、該第3のフェーズにおいて温熱療法用加温装置(8)のスイッチがON、放射線治療装置(2、22)のスイッチがOFFであることを特徴とする治療装置の制御方法。
【請求項17】
請求項16に記載の治療装置(1)の制御方法であって、
a)治療における前記第1のフェーズ、第2のフェーズ、第3のフェーズそれぞれの経過時間が5分〜30分、さらに好ましくは15分〜25分であり、及び/又は
b)該第1のフェーズ、第2のフェーズ、第3のフェーズを総合計した経過時間が30分〜90分であることを特徴とする治療装置の制御方法。
【請求項18】
請求項15〜17のいずれか一に記載の治療装置(1)の制御方法であって、
前記制御部(25)は、放射線治療装置における治療領域が温熱療法用加温装置(8)における治療領域と空間的に重複する態様で、放射線治療装置(2、22)及び温熱療法用加温装置(8)の治療領域の位置を制御することを特徴とする治療装置の制御方法。
【請求項19】
請求項15〜17のいずれか一に記載の治療装置(1)の制御方法であって、さらに
a)メガボルトコンピュータトモグラフィ(23)を用いて患者(7)の身体画像を生成する工程、及び/又は
b)キロボルトコンピュータトモグラフィ(24)を用いて患者(7)の身体画像を生成する工程を含むことを特徴とする治療装置の制御方法。
【請求項20】
請求項19に記載の治療装置(1)の制御方法であって、さらに
a)メガボルトコンピュータトモグラフィ(23)及び/又はキロボルトコンピュータトモグラフィ(24)によって生成された画像に基づいて、温熱療法用加温装置(8)及び/又は放射線治療装置(2、22)を制御する工程、及び/又は
b)熱的ホットスポットが回避されるか、又は少なくとも分解される態様で、温熱療法用加温装置(8)のイメージガイド制御を実行する工程、及び/又は
c)実際の空間的温度分布が所望の空間的温度分布に近似する態様で、温熱療法用加温装置(8)のイメージガイド制御を実行し、及び/又は
d)実際の空間的線量分布が所望の空間的線量分布に近似する態様で、放射線治療装置(2、22)のイメージガイド制御を実行する工程を含むことを特徴とする治療装置の制御方法。
【請求項21】
患者(7)を放射線治療するのに適した電離照射を含む治療用照射方法であって、
温熱療法として、患者(7)内に局所ハイパーサーミアを施すのに適合させたRF照射を含むことを特徴とする治療用照射方法。
【図1】


【図2】


【図3】


【図4A】


【図4B】




【図2】


【図3】


【図4A】


【図4B】


【公表番号】特表2012−504977(P2012−504977A)
【公表日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願番号】特願2011−530367(P2011−530367)
【出願日】平成20年10月8日(2008.10.8)
【国際出願番号】PCT/EP2008/008488
【国際公開番号】WO2010/040364
【国際公開日】平成22年4月15日(2010.4.15)
【出願人】(398061245)ヘルムホルツ・ツェントルム・ミュンヒェン・ドイチェス・フォルシュンクスツェントルム・フューア・ゲズントハイト・ウント・ウムベルト(ゲーエムベーハー) (19)
【氏名又は名称原語表記】Helmholtz Zentrum Muenchen Deutsches Forschungszentrum fuer Gesundheit und Umwelt (GmbH)
【Fターム(参考)】
【公表日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願日】平成20年10月8日(2008.10.8)
【国際出願番号】PCT/EP2008/008488
【国際公開番号】WO2010/040364
【国際公開日】平成22年4月15日(2010.4.15)
【出願人】(398061245)ヘルムホルツ・ツェントルム・ミュンヒェン・ドイチェス・フォルシュンクスツェントルム・フューア・ゲズントハイト・ウント・ウムベルト(ゲーエムベーハー) (19)
【氏名又は名称原語表記】Helmholtz Zentrum Muenchen Deutsches Forschungszentrum fuer Gesundheit und Umwelt (GmbH)
【Fターム(参考)】
[ Back to top ]

