断片化抗体固定化担体及びその製造方法
【課題】短時間で精度よくかつ簡便に、目的とする分子を検出することができ、洗浄後も繰り返し使用可能な担体を提供する。
【解決手段】担体と、少なくとも1セットの断片化抗体を含み、各セットの断片化抗体が、少なくとも2種の独立した断片化抗体を含み、前記少なくとも2種の独立した断片化抗体が、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と、当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含み、前記少なくとも1種の標識断片化抗体と前記少なくとも1種の認識断片化抗体が、1種の抗原を認識すると共に前記同じ抗原に結合可能な位置関係でそれぞれ独立に固定化されている断片化抗体固定化担体。
【解決手段】担体と、少なくとも1セットの断片化抗体を含み、各セットの断片化抗体が、少なくとも2種の独立した断片化抗体を含み、前記少なくとも2種の独立した断片化抗体が、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と、当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含み、前記少なくとも1種の標識断片化抗体と前記少なくとも1種の認識断片化抗体が、1種の抗原を認識すると共に前記同じ抗原に結合可能な位置関係でそれぞれ独立に固定化されている断片化抗体固定化担体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、断片化抗体固定化担体及びその製造方法に関する。
【背景技術】
【0002】
種々のタンパク質を対象物質として精度よく検出する系として、免疫測定法、例えばELISA法がよく知られている。この免疫測定法では、タンパク質と、このタンパク質に対する特異的な抗体とを、それぞれ対象物質と検出物質とし、これらの特異的な相互作用に基づいて対象物質を感度よく検出するものである。ELISA法は、感度や操作性の観点から種々改良されているが、大量の試料を短時間で簡便にかつ感度よく検出することに対する要求が、近年ますます高くなっている。
【0003】
このような対象物質と検出物質間の特異的な結合反応を効果的に利用する他の系としては、分子インプリンティングという技術が存在する。
例えば特許文献1では、対象分子に対するリガンドを導入したモノマー又はポリマーと対象分子との複合体を、高分子架橋剤と反応させて、リガンドと対象分子との複合体を含有するゲルを作成してから、対象分子をこのゲルから除去することにより得られた分子インプリントゲルを開示している。この特許文献1では、抗AFP抗体及びレクチンを含むゲル担体に抗原としてのAFPを添加すると、抗AFP抗体及びレクチンがAFPに結合することによりゲルが収縮することが開示されており、このようなゲルの膨潤収縮によりAFP(対象分子)の存在を感知することができると記載されている。
しかしながら、上記の分子インプリンティング法においては、固定化担体は、抗原抗体複合体を重合することにより作製されるため、被検出抗原が抗体に辿り着くためには、架橋されたゲルマトリックス構造中を拡散しなければならない。このため、抗原が抗体と反応を起こすのには時間がかかり、物質が確実に認識されるのに非常に高濃度の抗原を2〜4時間接触させなければならない。更に、抗原の洗浄除去の際にも同様の理由から、効率よく除去できず、更に応答性が悪くなる傾向がある。従って、迅速かつ高感度に検出することができない、という問題がある。
【0004】
上記の技術と同様に抗原抗体反応による特異的な結合を利用した系として、特許文献2には、2種の蛍光標識した断片化抗体による蛍光共鳴エネルギー移動を用いた免疫測定用試薬が開示されている。この免疫測定用試薬では、抗原が存在しない場合には、抗原抗体複合体が形成されず、蛍光共鳴エネルギー転移(FRET)が生じず、抗原が存在する場合には、抗原抗体複合体が形成され、FRETが生じることになる。この結果、迅速かつ簡便に抗原の有無を検出することができると記載されている。しかしながら、抗原と断片化抗体が担体へ固定されていないため、洗浄操作等で流出・拡散してしまい、一回しか利用できず、繰り返し利用するといった用途には用いることが難しかった。繰り返し利用するために、この断片化抗体を単純に担体に固定化したのでは発光物質と発光認識物質間距離が近接することが出来ず、近接させるために固定量を増大させると発光物質と発光認識物質が多量に近接し、S/N比が極端に悪くなってしまう、という問題がある。
【0005】
上記の問題を回避する方法として特許文献3に見られるようにリンカーを介して2つの断片化抗体を繋ぐことで、断片化抗体を近接に固定することが可能であるが、2種の断片化抗体が効果的に作用できるようにリンカーをその断片化抗体と抗原毎に設計しなければならず、そのために汎用性はなくなり、製造コストが高くなる、という問題がある。
【0006】
また、繰り返し利用可能で簡便な検出系として、特許文献4には、分子認識素子とナノ粒子を用いることで再利用可能なバイオセンサが開示されている。この技術もリンカー設計を行わなければならず、汎用性がなく、手間がかかる問題を回避できない。
【0007】
さらに繰り返し利用可能で簡便な検出系として、非特許文献1には、疎水場応答性蛍光物質を標識した抗体を固定化した担体を利用する検出系が開示されている。しかしながらこの系では、抗原の認識により抗原抗体の界面が疎水場を形成する必要があり、抗原と抗体の組み合わせが特殊なものに限られ、汎用性がない。また、蛍光物質も抗体の抗原認識部位近傍に標識しなければならず、高度に設計する必要があり、製造の面でコストと手間がかかるという問題がある。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2006−138656号公報
【特許文献2】特開平10−78436号公報
【特許文献3】特開2007−40834号公報
【特許文献4】特開2008−83042号公報
【非特許文献】
【0009】
【非特許文献1】日本分析化学会第57年会 講演要旨集 (2008) p97 E3017
【発明の概要】
【発明が解決しようとする課題】
【0010】
このように、上記の技術のいずれにおいても、目的とする分子を、短時間、精度よくかつ簡便に検出でき、洗浄後も繰り返し使用できる被験物検出用担体としては不十分である。
また、バイオセンサーとして用いる際に、製造コストの観点から汎用性の高い製造法が望まれていた。
【0011】
本発明はこのような事情に鑑みなされたものであって、短時間で精度よくかつ簡便に、目的とする分子を検出することができ、洗浄後も繰り返し使用可能な断片化抗体固定化担体を提供することを目的とする。
また本発明は、このような断片化抗体固定化担体を汎用性が高く、効率よく製造することができる製造方法を提供することも目的とする。
【課題を解決するための手段】
【0012】
本発明は以下の通りである。
<1> 担体と、少なくとも1セットの断片化抗体を含み、各セットの断片化抗体が、少なくとも2種の独立した断片化抗体を含み、前記少なくとも2種の独立した断片化抗体が、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と、当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含み、前記少なくとも1種の標識断片化抗体と前記少なくとも1種の認識断片化抗体が、1種の抗原を認識すると共に前記同じ抗原に結合可能な位置関係でそれぞれ独立に固定化されている断片化抗体固定化担体。
<2> 前記少なくとも2種の断片化抗体が、VH領域ポリペプチドと、VL領域ポリペプチドである<1>に記載の断片化抗体固定化担体。
<3> 前記担体がポリマー層を有し、前記少なくとも2種の断片化抗体が該ポリマー層に固定化されている<1>又は<2>記載の断片化抗体固定化担体。
<4> 該ポリマー層の膜厚が1nm以上0.5mm以下である<3>に記載の断片化抗体固定化担体。
<5> 該ポリマー層が自己組織化膜を介して担体上に結合している<3>又は<4>に記載の断片化抗体固定化担体。
<6> 該自己組織化膜の膜厚が0.2nm以上10μm以下である<5>に記載の断片化抗体固定化担体。
<7>前記ポリマーが多糖類である<3>〜<6>のいずれかに記載の断片化抗体固定化担体。
<8> 前記発光物質が、蛍光色素及び蛍光タンパク質からなる群より選択されたものである<1>〜<7>のいずれかに記載の断片化抗体固定化担体。
<9> 前記標識部位と前記認識部位との間で蛍光共鳴エネルギー転移反応が生じうる<1>〜<8>のいずれかに記載の断片化抗体固定化担体。
<10> 前記少なくとも2種の断片化抗体と前記抗原との結合反応に基づくバイオリアクター又はバイオセンサーに用いられる固定化担体である<1>〜<9>のいずれかに記載の断片化抗体固定化担体。
<11> 発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の独立した断片化抗体と、当該抗原とを接触させて、前記少なくとも2種の断片化抗体と前記抗原とが結合した複合体を形成する形成工程と、前記複合体を、当該複合体中の断片化抗体を介して担体に固定化する固定化工程と、前記複合体から前記抗原を除去して、前記抗原に結合しうる位置で前記担体上に前記断片化抗体がそれぞれ固定化されている断片化抗体固定化担体を得る除去工程と、を含む断片化抗体固定化担体の製造方法。
<12> 前記少なくとも2種の断片化抗体が、抗体分子のVH領域ポリペプチドと、抗体分子のVL領域ポリペプチドである<11>に記載の断片化抗体固定化担体の製造方法。
<13> 前記形成工程が、前記少なくとも2種の断片化抗体と前記抗原とを、当該断片化抗体単独又は組み合わせで構成される分子の結合価1に対して抗原0.1倍量から10倍量の個数比で混合することを含む<11>又は<12>記載の断片化抗体固定化担体の製造方法。
<14> 前記除去工程が、複合体及び抗原の結合力を低下させる条件下で行われる<11>〜<13>のいずれかに記載の断片化抗体固定化担体の製造方法。
【発明の効果】
【0013】
本発明によれば、短時間で精度よくかつ簡便に、目的とする分子を検出することができ、洗浄後も繰り返し使用可能であり、また汎用性が高く、効率よく製造することができる断片化抗体固定化担体及びその製造方法を提供することができる。
【図面の簡単な説明】
【0014】
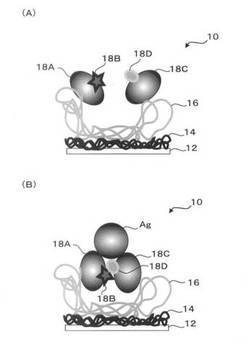
【図1】本発明の断片化抗体固定化担体の一例を説明する概念図であり、(A)は抗原不存在のときの固定化担体の概念図であり、(B)は抗原存在時の固定化担体の概念図である。
【図2】本発明の実施例にかかる発現ベクターの作成スキームである。
【発明を実施するための形態】
【0015】
本発明の断片化抗体固定化担体は、担体と、少なくとも1セットの断片化抗体を含み、各セットの断片化抗体が、少なくとも2種の独立した断片化抗体を含み、前記少なくとも2種の独立した断片化抗体が、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と、当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含み、前記少なくとも1種の標識断片化抗体と前記少なくとも1種の認識断片化抗体が、1種の抗原を認識すると共に前記同じ抗原に結合可能な位置関係でそれぞれ独立に固定化されている断片化抗体固定化担体である。
即ち、担体上に、発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の断片化抗体が、当該抗原に共に結合し得る位置でそれぞれ独立して固定化されている断片化抗体固定化担体である。
より具体的には、例えば、抗体断片固定化担体は、担体と;1つの抗原を認識し、1つの抗原物質(antigen-bearing entity)を形成する同じ抗原分子などに結合可能な位置関係で担体上にそれぞれ独立に固定化され、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含む2以上の異なった独立した断片化抗体からなる少なくとも1つ(例えば、2以上)の断片化抗体セットとを含んでいてもよい。したがって、本発明の抗体断片固定化担体は、同じ抗原物質もしくはそれぞれが異なった抗原物質に結合する2以上の断片化抗体セットを含んでいてもよい。
ここで、独立した断片化抗体とは、お互いが、(例えばジスルフィド結合等により)結合していない断片化抗体を意味する。
【0016】
本発明の断片化抗体固定化担体では、1種の抗原を認識する少なくとも2種の独立した断片化抗体が、1つのセット中の少なくとも2種の断片化抗体が同じ抗原に共に結合し得る位置で担体上にそれぞれ独立に固定化されているので、1つのセット中の断片化抗体同士が互いに独立していると共に近接した位置で担体上に存在する。このような断片化抗体は単独で存在するときよりも協働して抗原を認識するときの方が高いアフィニティーを示す。また、それぞれの断片化抗体は、抗原に結合し得る位置で独立して固定化されており、各断片化抗体の一部で担体と結合しているため、抗原認識部位を備えた部分が抗原に対して結合可能な範囲で動く。このため、各断片化抗体は、抗原が存在するときには抗原に接近し、短時間で容易に協働して抗原に結合する。個々の断片化抗体については洗浄操作を行っても拡散・流出がおこらず、繰り返し測定が可能となる。さらには、1つセット中の断片化抗体同士を抗原に結合させた状態(複合体)で固定化するので、別の複合体を構成した断片化抗体とは近接しない。このため、多項目の被験物を同時に測定可能な断片化抗体固定化担体であっても、異なる抗原を認識しうる他の断片化抗体とは接近せず、通常ELISA等で問題となるクロストークの発生を抑制する。
【0017】
また、本発明の断片化抗体固定化担体(以下、単に「固定化担体」ということがある)には、発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の断片化抗体が固定化されている。このため、ここに上記のように抗原が存在して、標識断片化抗体と認識断片化抗体とが接近すると、発光に基づく反応、例えばFRETやBRETなどの反応がこれらの抗体間で生じやすく、このような反応に基づいて、短時間で精度よくかつ簡便に抗原の検出を行うことができる。
【0018】
先行技術には2種の抗体をリンカーで連結したものがあるが、抗原と抗体の組み合わせによって2種の抗体間の距離が変わってくるため、抗原の種類によって最適なリンカーの設計を行わなければならない。また、発光物質標識においても、同一分子に選択的に発光物質、発光認識物質を標識する必要があり、製造の面で非常に手間とコストがかかっていた。本発明は、2種の抗体をリンカーで連結する必要がなく、従ってどのような抗原抗体の組み合わせに対しても適用することができ、標識も別々に行うことができるため、非常に汎用性が高く、製造適性に優れた手法と言える。
以下、本発明について更に説明する。
【0019】
(I)固定化担体
(1)担体
本発明の担体は、一般的にはBK7等の光学ガラスや、シリカ、アルミナ、チタニア、ジルコニア、インジウムスズ酸化物(ITO)等の金属酸化物、窒化ケイ素、窒化ガリウム、窒化アルミニウム、窒化インジウム等の金属窒化物、あるいは合成樹脂、具体的にはセファロース、ポリエチレン、ポリスチレン、ポリ(メタ)アクリル酸、ポリ(メタ)アクリルアミド、ポリメチル(メタ)クリレート、ポリエチレンテレフタレート、ポリカーボネート、シクロオレフィンポリマーに官能基が付与されたものが望ましい。特にガラスやITO、ポリメチル(メタ)クリレート、ポリエチレンテレフタレート、ポリカーボネート、シクロオレフィンポリマーなどの光源に対して透明な材料からなるものがより望ましい。官能基は例えば、アミノ基、カルボキシル基、マレイミド基、アルデヒド基、スクシンイミド基、チオール基、ヒドラジン基、イソシアネ−ト基、エポキシ基、ビニルスルホン基、ビニル基、シアン基などを挙げることができる。
このような担体は、さらに好ましくは、偏光に対して異方性を示さずかつ加工性の優れた材料が望ましい。
【0020】
これらの官能基を付与する方法は、プラズマ処理、オゾン処理、酸・アルカリによるエッチング処理や自己組織化膜などを用いた公知の表面処理方法を採ることができるが、製造適性の観点から自己組織化膜を使用することが好ましい。
【0021】
(2)ポリマー層
担体上には、ポリマー層が結合される。ポリマー層は、親水性ポリマー、疎水性ポリマー、又はその組み合わせから構成することができるが、親水性ポリマーのみを使用することが好ましい。ポリマー層は担体上に直接結合されても、間接的に結合されていてもよい。直接結合する場合は、例えば、担体からグラフト重合を介してポリマーを結合する方法が挙げられ、間接的に結合する方法としては、担体上に疎水性ポリマーを塗布後、親水性ポリマーを結合させたり、担体、及びポリマーと結合可能な化合物(以下、リンカーと称する)を担体表面に付与した後、ポリマーを結合させてもよい。特に好ましい態様によれば、リンカーとして自己組織化膜を使用し、ガラス担体上に、自己組織化膜を介して親水性ポリマーを結合させる態様をとることができる。以下、この態様について説明する。自己組織化膜の形成方法としては、(2−1)シランカップリング剤を使用する方法、(2−2)アルカンチオールを使用する方法、などが挙げられる。以下に、それぞれの方法について説明する。
【0022】
(2−1)シランカップリング剤を使用する方法
シランカップリング剤を使用する方法では、上述した担体に、以下に記すシランカップリング剤を付与することで、シランカップリング剤による自己組織化膜が形成され、担体上に官能基を付与することができる。
【0023】
本発明に使用可能なシランカップリング剤としては、一般式A−1(一般式A−1において、Xaは官能基を示し、Laは直鎖、分岐鎖、環状鎖の炭素鎖を含むリンカー部位を示し、Raは水素、もしくは炭素数1〜6のアルキル基を示し、Yaは加水分解性基を示す。また、m,nはそれぞれ0〜3の整数を示しm+n=3とする。)に示すケイ素含有化合物を利用することにより、担体−酸素−ケイ素−炭素といった共有結合を形成させることにより、担体表面に官能基を付与することができる。
【0024】
【化1】

【0025】
ここで、加水分解性基(Ya)とは、アルコキシ基、ハロゲン原子、アシロキシ基などが挙げ
られ、より具体的にはメトキシ基、エトキシ基、塩素などが挙げられる。シランカップリング剤として具体的には、γ−アミノプロピルトリメトキシシラン、N−β(アミノエチル)γ−アミノプロピルトリメトキシシラン、γ−アミノプロピルメチルジエトキシシラン、γ−メルカプトプロピルトリメトキシシラン、γ−グリシドキシプロピルトリエトキシシランなどが挙げられる。シランカップリング剤の反応方法としては一般的な方法に従えば良く、例えば書籍、シランカップリング剤の効果と使用法(サイエンス&テクノロジー社)に記載の方法を利用することができる。
【0026】
シランカップリング剤などが有する官能基(Xa)としては、後述のポリマーや錯体と
結合すれば特に限定はされず、アミノ基、カルボキシル基、ヒドロキシル基、アルデヒド基、チオール基、イソシアネート基、イソチオシアネート基、エポキシ基、シアノ基、ヒドラジノ基、ヒドラジド基、ビニルスルホン基、ビニル基、マレイミド基など任意の官能基とその組み合わせやその誘導体を利用することができるが、中でも好ましい官能基(Xa)はアミノ基とエポキシ基である。
【0027】
(2−2)アルカンチオールを使用する方法
アルカンチオールを使用する方法では、上述した担体表面上に、金属膜が配置され、その後、アルカンチオールが付与される。ここで、「担体表面上に配置される」とは、金属膜が担体表面上に直接接触するように配置されている場合のほか、金属膜が担体に直接接触することなく、他の層を介して配置されている場合をも含む意味である。それらの金属は単独又は組み合わせて使用することができる。また、上記担体への付着性を考慮して、担体と金属からなる層との間にはクロム等からなる介在層を設けてもよい。
【0028】
金属膜の膜厚は任意であるが、0.1nm以上1mm以下であることが好ましく、特に1nm以上1μm以下であることが好ましい。1mmを超えると、製造コストの観点から不利になる。クロム等からなる介在層を設ける場合、その介在層の厚さは、0.1nm以上10nm以下であることが好ましい。
【0029】
アルカンチオールを用いた金属膜の被覆法は、ハーバード大のWhitesides教授らにより精力的に展開されており、その詳細は例えばChemical Review,105,1103−1169(2005)に報告されている。金属として金を用いた場合、有機層形成化合物として一般式A−2(一般式A−2において、nは3から20の整数を示し、Xbは官能基を示す)に示すアルカンチオールを用いることにより、Au−S結合とアルキル基同士のvan der Waals力に基づき、配向性を持つ単分子膜が自己組織的に形成される。自己組織化膜は、アルカンチオール誘導体の溶液中に金担体を浸漬するという極めて簡便な手法で作製される。具体的には、例えば、一般式A−2においてXbがアミノ基、カルボキシル基、ヒドロキシル基、アルデヒド基、チオール基、イソシアネート基、イソチオシアネート基、エポキシ基、シアノ基、ヒドラジノ基、ヒドラジド基、ビニルスルホン基、ビニル基、マレイミド基である化合物を用いて自己組織化膜を形成させることで、担体表面に官能基を付与することが可能となる。
【0030】
【化2】

【0031】
なお、上記一般式A−2において、アルキレン基の繰り返し数nは3〜16の整数がさらに好ましく、4〜8の整数が特に好ましい。また、アルキレン基部分は多重結合や窒素や酸素などのヘテロ元素で置換されていてもよい。アルカンチオール誘導体のアルキル基が短いと自己組織化膜を形成しにくく、アルキル基が長いと水溶性が低下し、ハンドリングが困難になる。
【0032】
また、上記一般式A−2のアルカンチオールは、単独で、即ち1種類の官能基Xbで自己組織化膜を形成することも可能であり、また、複数種のアルカンチオールと混合して自己組織化膜を形成することも可能である。
【0033】
このような自己組織化膜の膜厚は任意であるが、0.2nm以上10μm以下であることが好ましく、特に1nm以上500nm以下であることが好ましく、さらに5nm以上50nm以下であることが好ましい。10μm以下とすれば、被検体物質が膜内を拡散しやすくでき、0.2nm以上とすれば、固定目的物質の固定量を多くすることができる。
【0034】
また、本発明では、上述した自己組織化膜に断片化抗体を直接固定することも可能であるが、断片化抗体の抗原結合率向上の観点から、自己組織化膜を形成した上にポリマー層を形成して、担体表面に断片化抗体を固定するための官能基を付与することが好ましい。本発明で用いることができるポリマーとしては、親水性ポリマーを好ましく使用することができ、具体的にはゼラチン、アガロース、キトサン、デキストラン、カラゲナン、アルギン酸、澱粉、セルロース、又はこれらの誘導体、例えばカルボキシメチル誘導体、又は水膨潤性有機ポリマー、例えばポリビニルアルコール、ポリアクリル酸、ポリアクリルアミド、ポリエチレングリコール又はこれらの誘導体などを挙げることができる。
【0035】
本発明で用いる親水性ポリマーとしてはさらに、カルボキシル基含有合成ポリマーおよびカルボキシル基含有多糖類を用いることが好ましい。カルボキシル基含有合成ポリマーとしては、ポリアクリル酸、ポリメタクリル酸、およびこれらの共重合体、例えば特開昭59−53836号明細書第3頁右上欄第2行目〜第6頁左下欄第9行目、特開昭59−71048号明細書第3頁左下欄第1行目〜第5頁左上欄第3行目に記載されているようなメタクリル酸共重合体、アクリル酸共重合体、イタコン酸共重合体、クロトン酸共重合体、マレイン酸共重合体、部分エステル化マレイン酸共重合、水酸基を有するポリマーに酸無水物を付加させたものなどが挙げられる。カルボキシル基含有多糖類は、天然植物からの抽出物、微生物発酵の生産物、酵素による合成物、または化学合成物の何れであってもよく、具体的には、ヒアルロン酸、コンドロイチン硫酸、ヘパリン、デルマタン酸硫酸、カルボキシメチルセルロース、カルボキシエチルセルロース、セロウロン酸、カルボキシメチルキチン、カルボキシメチルデキストラン、カルボキシメチルデンプン等が挙げられる。カルボキシル基含有多糖類は、市販の化合物を用いることが可能であり、具体的には、カルボキシメチルデキストランであるCMD、CMD−L、CMD−D40(名糖産業社製)、カルボキシメチルセルロースナトリウム(和光純薬社製)、アルギン酸ナトリウム(和光純薬社製)、等を挙げることができる。
【0036】
本発明で用いる親水性ポリマーの分子量は特に限定されないが、一般的には重量平均分子量が2×102以上5×106以下であることが好ましい。さらに好ましい親水性ポリマーの分子量は1×104以上2×106以下である。この範囲より重量平均分子量が小さい場合には断片化抗体の固定量が小さくなることがあり、この範囲より重量平均分子量が大きい場合には高い溶液粘度のため取り扱いが困難となることがある。
【0037】
このようなポリマー層の膜厚は、水溶液中の膜厚として1nm以上0.5mm以下であることが好ましく、より好ましくは1nm以上1μm以下であり、さらに好ましくは100nm以上500nm以下である。膜厚が薄いと生理活性物質固定量が減少し、被検体物質との相互作用が起こりにくくなる。一方、膜厚が厚いと親水性ポリマーの均一性が保てなくなる可能性があり、また被検体物質が膜内に拡散する障害となり、また特にセンサー基板の親水性ポリマー固定面の反対側から相互作用を検出する場合は検出表面から相互作用形成部までの距離が長くなり、検出感度が低くなる可能性がある。水溶液中の親水性ポリマー膜厚はAFM、エリプソメトリーなどで評価することができる。
【0038】
カルボキシル基を含有するポリマーを使用する場合、カルボキシル基を活性化することによって、担体表面に付与された官能基を介して複合体を固定することができる。カルボキシル基を含有するポリマーを活性化する方法としては、公知の手法、例えば、水溶性カルボジイミドである1-(3-Dimethylaminopropyl)-3 ethylcarbodiimide(EDC)とN-Hydroxysuccinimide(NHS)により活性化する方法、又はEDC単独により活性化する方法を好ましく用いることができる。この手法で活性化されたカルボキシル基を含有するポリマーを、アミノ基を有する担体と反応させることで、担体上に親水性ポリマーを結合させることが可能となる。
【0039】
また、カルボキシル基を含有するポリマーを活性化する方法として含窒素化合物を用いる方法があり、具体的には、下記一般式(Ia)又は(Ib)(式中、R1及びR2は、互いに独立して置換基を有してもよいカルボニル基、炭素原子、窒素原子を表し、R1及びR2は結合により5〜6員環を形成してもよく、Aは置換基を有する炭素原子またはリン原子を表し、Mは、Xと共に全体として(n−1)価の対イオンを形成する元素を表し、Xはハロゲン原子を表す)に示される含窒素化合物を用いることもできる。
【0040】
【化3】

【0041】
ここで、R1及びR2は、互いに独立して置換基を有しても良いカルボニル基、炭素原子、窒素原子を表すが、好ましくはR1及びR2は結合により5〜6員環を形成する。含窒素化合物の好ましい例には、ヒドロキシコハク酸イミド、ヒドロキシフタル酸イミド、1−ヒドロキシベンゾトリアゾール、3,4−ジヒドロキシ−3−ヒドロキシ−4−オキソ−1,2,3−ベンゾトリアジン、及びその誘導体が含まれる。
また、好ましくは下記に示される含窒素化合物(Ic)(Id)(Ie)を用いることもできる。
【0042】
【化4】

【0043】
また、好ましくは含窒素化合物としては、下記一般式(II)(式中、Y及びZは、互いに独立してCH、または窒素原子を表す)で表される化合物を用いることもできる。
【0044】
【化5】

【0045】
一般式(II)の具体的化合物としては、下記の化合物(II−1)〜(II−3)等が好ましく挙げられる。
【0046】
【化6】

【0047】
また、含窒素化合物としては、下記の化合物(II−4)等も好ましくあげられる。
【0048】
【化7】

【0049】
また好ましくは、含窒素化合物としては、下記一般式(III)(式中、Aは置換基を有する炭素原子またはリン原子を表し、Y及びZは、互いに独立してCH、または窒素原子を表し、Mは、Xと共に全体として(n−1)価の対イオンを形成する元素を表し、Xはハロゲン原子を表す)を用いることもできる。
【0050】
【化8】

【0051】
ここで、Aで表される炭素原子またはリン原子が有する置換基としては、置換基を有するアミノ基が好ましく、ジメチルアミノ基やピロリジノ基の様なジアルキルアミノ基が好ましい。Mで表される元素は、リン原子、ホウ素原子、ヒ素原子などが挙げられるが、好ましくはリン原子があげられる。Xで表されるハロゲン原子は、フッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられるが、好ましくはフッ素原子が挙げられる。
一般式(III)の具体的化合物としては、下記の化合物(III−1)〜(III−6)等が好ましく挙げられる。
【0052】
【化9】

【0053】
また、含窒素化合物としては、下記一般式(IV)(式中、Aは置換基を有する炭素原子またはリン原子を表し、Mは、Xと共に全体として(n−1)価の対イオンを形成する元素を表し、Xはハロゲン原子を表す)を用いることもできる。
【0054】
【化10】

【0055】
一般式(IV)の具体的化合物としては、下記の化合物(IV−1)等が好ましくあげられる。
【0056】
【化11】

【0057】
また、カルボキシル基を含有するポリマーを活性化する方法として、電子吸引性基を有するフェノール誘導体を使用することも好ましく、更に電子吸引性基のσ値が0.3以上であることが好ましい。具体的には、下記化合物(V−1)〜(V−4)などを用いることができる。
【0058】
【化12】

【0059】
上述のカルボジイミド誘導体及び、含窒素化合物、またはフェノール誘導体は併用して使用するだけではなく、所望により、それぞれ、単独で用いることもできる。好ましくはカルボジイミド誘導体と含窒素化合物との併用である。
【0060】
また、カルボキシル基を含有するポリマーを活性化する方法として、下記化合物(V−6)を用いることもできる。該化合物(V−6)は単独で用いることもできるが、カルボジイミド誘導体、含窒素化合物、フェノール誘導体と併用してもよい。
【0061】
【化13】

【0062】
さらに、カルボキシル基を含有するポリマーにおけるカルボキシル基を活性化する手法としては、特開2006−58071号公報「0011」〜「0022」に記載の方法(即ち、担体の表面に存在するカルボキシル基を特定の構造を有するウロニウム塩、ホスホニウム塩、又はトリアジン誘導体のいずれかの化合物を用いて活性化することによりカルボン酸アミド基を形成する方法)、並びに特開2006−90781号公報「0011」〜「0019」に記載の方法(即ち、担体の表面に存在するカルボキシル基を、カルボジイミド誘導体又はその塩で活性化し、水酸基を有する含窒素ヘテロ芳香族化合物、電子吸引性基を有するフェノール誘導体又はチオール基を有する芳香族化合物のいずれかの化合物でエステルとした後、アミンと反応させることによりカルボン酸アミド基を形成する方法)を好ましく用いることもできる。
【0063】
本発明において活性化されたカルボキシル基を含有するポリマーは、溶液として担体と反応させてもよく、また、スピンコート等の手法を用いて担体上に薄膜を形成させた状態で反応させてもよい。好ましくは、薄膜を形成させた状態での反応である。
【0064】
上記の通り、本発明において活性化されたカルボキシル基を含有するポリマーは、薄膜状態で担体と反応させることが好ましい。担体上に薄膜を形成させる方法は、公知の方法を用いることが可能であるが、具体的には、エクストルージョンコート法、カーテンコート法、キャスティング法、スクリーン印刷法、スピンコート法、スプレーコート法、スライドビードコート法、スリットアンドスピン方式、スリットコート方式、ダイコート法、ディップコート法、ナイフコート法、ブレードコート法、フローコート法、ロールコート法、ワイヤバーコート方式、転写印刷法、等を用いることが可能である。これらの薄膜形成法については、「コーティング技術の進歩」原崎勇次著、総合技術センター(1988)、「コーティング技術」技術情報協会(1999)、「水性コーティングの技術」シーエムシー(2001)、「進化する有機薄膜 成膜編」住べテクノリサーチ(2004)、「高分子表面加工学」岩森暁著、技報堂出版(2005)、等に説明されている。膜厚制御された塗布膜を簡便に作製可能であることから、本発明において担体上に薄膜を形成させる方法としては、スプレーコート法またはスピンコート法が好ましく、スピンコート法がさらに好ましい。
【0065】
(2)断片化抗体
本発明における断片化抗体は、発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識するものである。
ここで担体には、1種の抗原を認識できる上記の標識断片化抗体及び認識断片化抗体が固定化されていればよく、このような断片化抗体のセットが複数固定化されていてもよい。これにより、一つの固定化担体で複数の抗原を認識することができる。
なお、抗原の種類には、抗体と相互作用可能なものであれば特に制限はなく、目的とする検出物質に応じて適宜選択することができる。また断片化抗体も、このような抗原と相互作用可能なものとして適宜選択される。
【0066】
また2種以上の断片化抗体は、それぞれ単独で又は協働して1の抗原を認識し、結合可能であればいかなるものであってよい。このような複数の断片化抗体の例示としては、例えば、1種の抗原上の1のエピトープに対する抗原認識部位を有する2種以上の断片化抗体、1種の抗原上の異なるエピトープに対する抗原認識部位を有する2種以上の断片化抗体、1のエピトープに対する複数の超可変領域のいずれか1つのみを有する断片化抗体等を挙げることができ、1の抗原を認識可能であれば、このような複数の断片化抗体を更に組み合わせ使用することもできる。
【0067】
本発明における断片化抗体としては、抗原結合能の観点から、VH領域ポリペプチドやVL領域ポリペプチド等を好ましく挙げることができ、VH領域ポリペプチド及びVL領域ポリペプチドの組み合わせであることが、抗原結合能及び汎用性の観点からさらに好ましい。この場合、VH領域ポリペプチド及びVL領域ポリペプチドのいずれか一方を標識断片化抗体とし、他方を認識断片化抗体とすればよく、特に制限はない。
【0068】
VH領域ポリペプチド及びVL領域ポリペプチドは、それらが対合した状態で対象抗原を結合することのできる長さであれば、抗体のVH領域およびVL領域よりも長くても短くてもよい。これらのポリペプチドは、ハイブリドーマ技術により作成されたモノクローナル抗体から常法により作製することができる。例えば、以下のようにして得ることができる。
【0069】
すなわち、目的とする検体物質を認識可能なモノクローナル抗体を公知の方法によって作製し、この抗体の可変領域をコードする遺伝子を、cDNAライブラリーとハイブリダイゼーションを用いる方法により特定し、この遺伝子をベクターにクローニングする。そして、この組換え体ベクターからVHおよび/またはVL領域をコードする配列を得、この断片を発現ベクターにサブクローニングし、この遺伝子を宿主細胞内で発現させることにより、必要量のVHおよび/またはVLを得ることができる。
抗体遺伝子からVH/VLコード配列を得るためには、所望の配列領域を制限酵素で切り出し、これをクローニングベクターで増幅させてもよく、あるいは所望の配列をPCR法で増幅してもよい。VHおよび/またはVLを宿主細胞で発現させる場合には、任意のレポーター分子をコードする遺伝子をも発現ベクターにクローニングし、VHおよび/またはVLをレポーター分子との融合蛋白またはキメラ蛋白として発現させることができる。
【0070】
VHおよび/またはVLは、以上の方法によらず、抗体分子を蛋白質分解酵素によって分解することによっても得ることもできる。この場合には、遺伝子クローニングの手間を省くことができるという利点を有している。
【0071】
またVH領域ポリペプチドやVL領域ポリペプチドは、生体分子との融合体でもよい。このような融合体にすることによって、安定性が向上するという利点を有する。
VH領域ポリペプチド及びVL領域ポリペプチドと融合可能な生体分子としては、特に制限がなく、アルカリフォスフォターゼ、protein G、eGFP、eYFP、βガラクトシダーゼ、GST、chitin binding protein(CBP)、NusA、Thioredoxin、DsbA、DsbC、マルトース結合蛋白質(MBP)等をあげることができる。中でも安定性を高めたい場合には、MBP等を用いることが好ましい。
これらの融合体は、常法により作製することができ、例えば、上述した遺伝子クローニングの際に同時発現可能に生体分子の遺伝子をベクターに組み込むことにより得てもよく、VH領域ポリペプチド又はVL領域ポリペプチドにリンカーを設けて生体分子と結合してもよい。融合体の作製方法は、融合しようとする生体分子の種類やサイズに応じて、適宜選択することができる。
【0072】
なお、VL領域ポリペプチド及びVH領域ポリペプチド以外の断片化抗体の作製方法は、VL領域ポリペプチド及びVH領域ポリペプチドについての上記作製方法と同様に行うことができ、当業者であれば容易に適用可能である。
【0073】
担体に固定化する2種以上の断片化抗体は、1種の抗原を認識する標識断片化抗体及び認識断片化抗体のセット(組み合わせ)を構成するものである。担体上に固定化される断片化抗体が、このようなセットを構成することができれば、2種に限らず、3種又はそれ以上の断片化抗体を用いてもよい。このような複数種の断片化抗体を用いることにより、1種の抗原を挟んで、標識断片化抗体と認識断片化抗体とが接近する。この結果、標識抗体上の発光物質からの発光を、認識断片化抗体の認識部位が容易に認識することができる。認識効率の観点から、1つのセットには、1種類の発光物質で標識された標識断片化抗体と1種類の発光認識物質で構成された認識断片化抗体とが含まれることが好ましい。
【0074】
本発明において「発光物質」とは、励起光や酸化反応等によって生じた励起状態から基底状態に遷移する過程で光を発生することができる物質を広く包含する。発光を認識するとは、励起状態の発光物質により直接励起される、または間接的に励起され発光もしくは化学反応を起こすことを広く包含する。本発明における標識断片化抗体及び認識断片化抗体は、いずれも発光物質で標識されたものであってもよく、標識抗体のみが発光物質で標識されたものであってもよい。標識断片化抗体及び認識断片化抗体が発光物質で標識されたものである場合には、抗原との結合や担体との結合を阻害しない部位に標識されていればいずれの部位にあってもよい。発光物質の発光を認識することができる認識断片化抗体の標識は、発光物質に限らず、繰り返し使用可能なものあれば、特に制限しない。例えば、一重項酸素の発生により蛍光物質を発光させることが出来るAlpha Screen(Perkinelmer社製)キットを使用することができる。
【0075】
発光物質を断片化抗体に標識する方法は、用いる発光物質の種類によって適宜選択される。発光物質が非ペプチド性の化合物である場合には、抗体のチオール基やアミノ基にマレイミドやスクシンイミドなどの官能基を用いて化学修飾する等の公知の方法により標識できる。発光物質が蛍光タンパク質などのペプチド性の化合物である場合には、断片化抗体との融合タンパク質として作製することができる。融合タンパク質の作製方法は、公知のいかなる方法を用いても作製することができる。
なお、断片化抗体に標識される発光物質は、上記標識断片化抗体と発光認識断片化抗体が抗原抗体反応により抗原と結合した際に発光が認識できる位置で断片化抗体上に結合されていればいずれの位置であってもよく、発光物質を断片化抗体に直接結合してもよいしスペーサーを介して結合してもよい。このようなスペーサーを用いることにより、上記断片化抗体と発光認識断片化抗体が抗原抗体反応により抗原と結合した際に発光認識が起きるように、発光物質の位置を適宜調節することも可能である。このようなスペーサーとしては、ポリエチレングリコール誘導体やペプチド等のフレキシブルな親水性分子を挙げることができ、発光認識効率の観点からポリエチレングリコールが好ましい。
【0076】
好ましくは、標識断片化抗体及び認識断片化抗体にそれぞれ標識される発光物質は、検出の精度、簡便性等の観点から、標識断片化抗体上の発光物質と認識断片化抗体上の発光物質との間で、蛍光共鳴エネルギー転移反応(FRET)を生じうる蛍光ドナー物質及びアクセプター物質、生物発光共鳴エネルギー転移(BRET)を生じうる発光ドナー物質及びアクセプター物質とすることができる。標識断片化抗体及び認識断片化抗体のいずれもが、両者間でFRETを生じうる発光物質(即ち、蛍光物質)で標識された抗体であることがより好ましい。
【0077】
上述した蛍光共鳴エネルギー転移は、特表2007−523754[0158]〜[0161]、特表2001−519525[0025]にも示されているように周知であり、蛍光共鳴エネルギー転移のためのドナー及びアクセプターも種々市販されている。ドナー及びアクセプターとしては、両者間に蛍光共鳴エネルギー転移が起こる組み合わせであれば、いずれの組み合わせでも利用可能であり、文献等の情報、又は市販品から自由に選択できる。蛍光色素及び蛍光タンパク質からなる群より選択されたものを用いることできる。例えば、フルオレセイン誘導体、ローダミン誘導体、アミノクマリン誘導体、ヒドロキシクマリン誘導体、BODIPY誘導体、アントラセン誘導体、ベンゾフラン誘導体、ポルフィリン誘導体、Cy Dye、Alexa Fluor、ユーロピウムクリプテート、DyLight、HiLyte Fluor、Oyster、MegaStokes Dye、IRDye、QSY、DFP、YFP、GFP、BFPなどや特開2001−089482号公報記載のアザメチン化合物などを挙げることができる。
【0078】
本発明において蛍光共鳴エネルギー転移を利用する場合にはそれらの蛍光物質間でエネルギー転移が起こり、かつ安定なものが望ましく、CFP-YFP、Alexa Fluor555-Alexa Fluor 647、FITC-Alexa Fluor 555、HiLyte Fluor 555-Alexa Fluor 647、のような蛍光タンパク質又は蛍光色素の組み合わせを好ましく用いることができる。これらの組み合わせは蛍光タンパク質のみ、又は蛍光色素のみ、もしくは蛍光色素と蛍光タンパク質の組み合わせでもよく、これらの例に限定されない。蛍光発光の安定性の観点からはAlexa Fluor、HiLyte Flourが好ましく、さらにAlexa Fluorがより好ましい。
【0079】
なお、CFP−YFP間の蛍光共鳴エネルギー転移やGFP−BFP間、並びにこれらの改変体間の蛍光共鳴エネルギー転移においても広く知られており、これらの蛍光タンパク質は市販もされている。蛍光タンパク質を用いれば、標識する抗体等と連結させて一分子の融合タンパク質として生産でき、生細胞中で抗体を用いる場合には該融合タンパク質をコードする遺伝子を導入すればよいため、生細胞中で抗体を利用する場合には蛍光タンパク質が便利である。これらの蛍光タンパク質をコードする核酸も周知であり、それらを含むベクターも種々市販もされているので、所望のポリペプチドに蛍光タンパク質を融合させた蛍光標識タンパク質は、それらの市販のベクターを利用して容易に調製することができる。
【0080】
またBRETを生じ得る生物学的発光ドナー物質としては、例えば、ホタル(Photinus pyralis)ルシフェリン、ウミホタル(Cypridina)ルシフェリン、ウミシイタケ(Renilla reniformis)ルシフェリン、発光ミミズ(Diplocardia)ルシフェリン、ラチア(Latia neritoides)ルシフェリン、ホタルイカ(Wataseniae)ルシフェリンやバクテリアルシフェリン(還元型フラビンモノヌクレオチド)のような発光生物由来のルシフェリンの外、オワンクラゲ由来のエクオリンなどを用いることができる。アクセプター物質としては、上記のFRETでアクセプター物質として使用可能な蛍光タンパク質及び蛍光色素をそのまま利用することができる。
【0081】
FRET又はBRETによる発光認識・検知機構は、当業界では周知であり、例えば、生物物理 Vol.42(1), pp.28-31 (2002)に開示された方法を用いて検知することができる。この方法では、FRET又はBRETのドナー物質に励起光を照射又は酵素反応下に付すことによって得られた発光を測定、検知することにより、FRET又はBRETの有無を確認することができる。これにより、断片化抗体固定化担体上に固定化された抗体に対する抗原結合の有無を検出することができる。
【0082】
(3)断片化抗体固定化担体の製造方法
本発明における断片化抗体固定化担体の製造方法は、前述した標識断片化抗体の少なくとも1種及び認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の断片化抗体と、当該抗原とを接触させて、前記少なくとも2種断片化抗体と前記抗原とが結合した複合体を形成する形成工程と、前記複合体を、当該複合体中の断片化抗体を介して担体に固定化する固定化工程と、前記複合体から前記抗原を除去して、前記抗原に結合し得る位置で前記担体上に前記断片化抗体がそれぞれ固定化されている断片化抗体固定化担体を得る除去工程と、を含む。
この製造方法によれば、少なくとも2種の独立した断片化抗体と抗原とで構成された複合体を担体上に固定化した後に抗原を除去するので、抗原が存在する際にはそれぞれ抗原に結合し得る位置で、これらの断片化抗体が担体上に独立に固定化された本発明の断片化抗体固定化担体を容易に作製することができる。
本発明の製造方法によれば、担体と、少なくとも1セット(例えば、2以上のセット)の断片化抗体を含み、それぞれのセットの断片化抗体は上記のように担体上に固定された少なくとも2種の独立した断片化抗体を含む抗体断片固定化担体を得ることができる。
【0083】
複合体を形成する形成工程では、断片化抗体と抗原からなる複合体は、公知の手法により形成することができ、具体的には、上述した断片化抗体と抗原とを混合させることによって容易に得ることができる。
2種以上の断片化抗体と抗原との混合比は、抗原に対する結合形態に応じて適宜設定することができる。効率性と過剰な抗原が固定化されることを防ぐ観点から好ましくは、抗原の個数と、当該断片化抗体の組み合わせで構成される分子の結合価との比は、0.1:1〜10:1である。
【0084】
また、断片化抗体と抗原との混合比は、断片化抗体の抗原に対するアフィニティーや、抗原そのものの担体へ直接的な固定しやすさ等に応じて適宜調整が可能である。充分なアフィニティーが予想される抗原である場合には、一般に、抗原の個数と、当該断片化抗体の組み合わせで構成される分子の結合価との比は、0.1:1〜1:1とすることがより好ましく、0.1:1〜0.2:1であることが更に好ましい。一方、アフィニティーが一般的に低い又は担体へ直接的に固定化され難いと予想される抗原、例えば低分子化合物等を抗原とする場合には、抗原の量を多くすることがより好ましく、例えば抗原の個数と、当該断片化抗体の組み合わせで構成される分子の結合価との比は0.5:1〜5:1とすることが更に好ましい。
【0085】
ここで、断片化抗体の組み合わせで構成される分子の結合価とは、断片化抗体の組み合わせで構成された分子が有する抗原結合部位の数を意味する。即ち、断片化抗体が組み合わされることにより構成された分子が抗体分子そのものである場合には、抗体分子の結合価と一致し、断片化抗体の組み合わされることにより構成された分子が完全な抗体分子を構成しない場合であっても、抗原結合部位が1存在すれば1価となる。
【0086】
このとき、抗原は低分子でもタンパク質等の高分子でもよい。また、複合体の形成分子数はいくつでもよいが、量比の制御を容易にする観点から、複合体を形成する分子数は、2種の断片化抗体と1種の抗原のように、3分子数であることが好ましい。
【0087】
例えば、抗リゾチームVH領域ポリペプチド、抗リゾチームVL領域ポリペプチド及びリゾチームを用いた場合には、VH領域ポリペプチドとVL領域ポリペプチドとは、それぞれ1:1の関係で抗原と相互作用することから、VH領域ポリペプチドとVL領域ポリペプチドとは組み合わせて1の結合価を有する。従って、水溶液中において個数比で等量、すなわちVH領域ポリペプチドとVL領域ポリペプチドと抗原とを1:1:1の割合で混合することにより容易に複合体を得ることができる。リゾチームが直接担体に固定されて、断片化抗体に対する結合率が低下するのを防ぐために、抗原の個数比は、断片化抗体の結合価に対して少ないことが好ましく、VH領域ポリペプチドとVL領域ポリペプチドと抗原との混合比を10:10:1から10:10:9にすることがより好ましく、10:10:1から10:10:2にすることがさらに好ましい。
【0088】
また、標識断片化抗体と認識断片化抗体との量比は、上述したように結合価1の抗体分子を形成する観点から一般的には1:1としてもよく、抗原に対するアフィニティーに応じて適宜調整してもよい。例えば、標識後の断片化抗体の固定化効率の観点から、ドナー物質で標識化された標識断片化抗体と、アクセプター物質で標識化された認識断片化抗体との量比を15:1〜1:15とすることが好ましく、10:1〜1:10とすることがより好ましく、5:1〜1:5することがさらに好ましい。
【0089】
固定化工程では、上記の手法により形成された複合体を、担体に付与された官能基の種類に応じて適宜反応させ、担体へ結合することにより固定化を行う。このとき断片化抗体の抗原認識部位は、抗原が結合することにより保護されているので、特別な保護処理を別途行う必要がない。複合体の担体への結合方法は当業者に自明である。例えば、上述したEDC等でカルボキシル基を活性化しアミノ基を介して複合体を結合する方法や、マレイミド基−チオール基の反応により複合体を担体に結合させる方法があるが、本発明はこの方法に限定されない。
【0090】
固定化担体上に結合した断片化抗体の固定量(密度)については、本発明の断片化抗体固定化担体をバイオセンサーに使用する場合、標識断片化抗体と認識断片化抗体とが、これら両者間で発光の認識が可能な距離、例えば10nm程度又はそれ以下で存在する量(密度)で固定化されていればよい。断片化抗体の固定量としては、好ましくは、1×105個/mm3以上1×1018個/mm3以下とすることができ、より好ましくは1×109個/mm3以上1×1015個/mm3以下、さらに好ましくは、1×1010個/mm3以上1×1014個/mm3以下である。1×105個/mm3以上の固定量であれば、発光の測定が容易であり、1×1018個/mm3以下であれば蛍光物質間を適切な距離に保って良好なFRETのS/Nとすることができると共に製造コストの観点から、それぞれ好ましい。
【0091】
この密度は以下の方法により求めることができる。実際に測定を行って求める場合は、各断片化抗体を担体上に固定化後、被験物を洗浄し、標識断片化抗体の標識量と認識断片化抗体の発光認識量を測定し、AFMやエリプソメトリーにより膜厚を測定して、算出することにより求められる。標識断片化抗体上の発光物質と、認識断片化抗体上の発光認識物質が共に蛍光分子の場合、それぞれ蛍光量を蛍光量測定装置で測定し、固定前の既知の蛍光分子標識率から固定された分子の数を求めて、固定化された分子の測定体積から固定密度を算出できる。
【0092】
除去工程では、複合体を担体上に固定化後、抗原が除去される。このとき、断片化抗体はそれぞれ独立に担体上に固定化されているので、抗原を容易に除去することができ、固定化担体として使用したときの抗原との結合再現性を低下させることがない。
抗原の除去は、適当な洗浄液を用いることにより容易に行うことができる。ここで用いられる洗浄液は、複合体中の抗原と各断片化抗体との結合力を低下させるものであればよい。このような結合力の低下の条件としては、pHを酸性側又はアルカリ側へ変更することや、塩濃度を高くすることなどを上げることができる。断片化抗体及び抗原の種類等によって異なるが、例えば、pHを2以下又は10以上にするための酸性グリシンバッファーやアルカリ性のNaOH溶液や、0.5M以上の塩濃度とするためのホウ酸塩バッファーを挙げることができる。
他にもアルギニン含有酸性バッファーや、グアニジン、尿素含有バッファー等を適宜用いることが可能である。
【0093】
ここで、洗浄液による洗浄処理の条件は、適宜調整することができるが、断片化抗体の活性を損なわない観点から、一般に10分以下、好ましくは、1分以下とすることができる。再現性の観点から5秒以上が好ましい。
【0094】
これにより、担体上に断片化抗体が、1つのセット中の断片化抗体が同じ抗原に結合し得る位置で、それぞれ独立に固定化された断片化抗体固定化担体を得ることができる。本断片化抗体固定化担体では、断片化抗体は、抗原と結合可能な状態でかつ自由度を持って独立して担体上に固定化されている。即ち、1つのセット中の標識断片化抗体と認識断片化抗体とは、抗原と結合した場合と同一の位置関係で互いに担体上に固定化されている。また、各断片化抗体の一部で担体と結合し、抗原認識部位が存在する先端部が自由に移動していてもよく、1つのセット中の断片化抗体が1の抗原と結合可能であれば、断片化抗体が結合する担体上の位置(結合点)の位置や結合点を有する担体の種類(例えば、親水性ポリマーの種類)に応じて、固定化後の断片化抗体全体が自由に移動可能であってもよい。
このため、抗原が接近して結合可能な状態になると、断片化抗体は互いに接近して抗原と結合する。本発明では、このとき断片化抗体に標識されている発光物質と発光を認識する認識物質間の相互作用を測定することにより、抗原濃度を迅速に測定でき、かつ再利用可能な断片化抗体固定化担体を簡便に得ることができる。
【0095】
例えば、図1には、本発明の断片化抗体固定化担体の一例となる固定化担体10が示されている。固定化担体10には、自己組織化膜14及びポリマー層16を介して、担体12上に、断片化抗体18A、断片化抗体18Cがそれぞれ、その一端でかつ互いに独立して固定化されている。断片化抗体18Aは、発光物質18Bによる標識部位を有しており、一方、断片化抗体18Cは、発光認識部位18Dを有している。断片化抗体18Aと断片化抗体18Cの相対位置は、抗原Agが存在するときに協働して抗原Agに結合可能な位置関係となっており、それぞれ一端が担体12に固定され且つ他端が自由に動くように、担体12上に独立して固定化されている(図1(A)参照)。
このとき、抗原Agが固定化担体10に接近すると、断片化抗体18A、断片化抗体18Cは、抗原Agを認識して結合する。結合時には、断片化抗体18Aと断片化抗体18Cは抗原を中心にして互いに接近し、結合するため、断片化抗体18A上の発光物質18Bと断片化抗体18C上の発光認識部位18Dとが接近して相互作用し、この相互作用に起因した変化を測定することにより、抗原検出を行うことができる(図1(B)参照)。
【0096】
このように、2つ以上の断片化抗体と1つ以上の抗原からなる複合体を、該2つ以上の断片化抗体を介して担体に固定し、抗原のみ取り外す、という操作を行うと、抗原抗体反応を利用した免疫測定法に使用することができる断片化抗体固定化担体を得ることができる。
なお、このように断片化抗体が独立して担体に固定化されるので、個々の断片化抗体同士のアフィニティーが弱い場合には互いに結合せず、容易に独立して動くので、抗原結合時における形態変化が起こりやすくなる。この形態変化は蛍光エネルギー転移効率を高めることにつながる。個々の断片化抗体同士のアフィニティーは解離定数(Kd)が10−12から108が好ましく、10−7から108がより好ましく、10−5から10−1がさらに好ましい。
【0097】
(II)本発明の断片化抗体固定化担体の適用
本発明の断片化抗体固定化担体は、断片化抗体と抗原との結合反応性に基づくバイオセンサーやバイオリアクター(例えば「バイオリアクター技術」、1988年、(株)シーエムシー、「バイオチップとバイオセンサー」、2006年、共立出版(株))に適用することができる。バイオリアクターとは、酵素、菌体、細胞、オルガネラなどの生体触媒による生化学的反応を利用して、有用物質の生産、エネルギーの発生、環境汚染物質の分解などに応用する反応器であり、バイオセンサーとは最も広義に解釈され、生体分子間の相互作用を電気的信号等の信号に変換して、対象となる物質を測定・検出するセンサーを意味する。以下、それぞれについての適用について説明する。
【0098】
(1)バイオリアクターへの適用
酵素を固定化した不溶性担体を用いて有用物質の生成、反応等を行うことが可能なバイオリアクター(例えば実公平4−18398号、実公平4−18399号等)においては、上記不溶性担体として、本発明の担体、例えば担体(例えばセラミックやポリスルホン等の多孔質体)と、この担体表面上に結合された高分子膜と、この高分子膜に結合された酵素と酵素活性補助物質とを備えた担体に適用することができる。
【0099】
(2)バイオセンサーへの適用
通常のバイオセンサーは、検出対象とする化学物質を認識するレセプター部位と、そこに発生する物理的変化又は化学的変化を電気信号に変換するトランスデューサー部位とから構成される。生体内には、互いに親和性のある物質の組み合わせとして、酵素/基質、酵素/補酵素、抗原/抗体、ホルモン/レセプターなどがある。バイオセンサーでは、これら互いに親和性のある物質の一方を担体に固定化して分子認識物質として用いることによって、対応させるもう一方の物質を選択的に計測するという原理を利用している。本発明の担体、例えば担体(例えばセラミックやポリスルホン等の多孔質体)と、この担体表面上に結合された高分子膜と、この高分子膜に結合された2種類の断片化抗体を備えた担体に適用することで従来のバイオセンサーよりも迅速かつ再利用可能であり、さらに汎用性をもたせることができる。
以下に本発明の断片化抗体固定化担体についての実施例を示す。なお、特に断わらない限り、「部」、「%」は、それぞれ「質量部」、「質量%」を表す。
【実施例】
【0100】
[実施例1]
(1)抗リゾチームVH領域ポリペプチド、抗リゾチームVL領域ポリペプチドの作製
以下の実施例で使われる略語は以下の通りである。
LB:1%バクト(登録商標、以下同じ)トリプトン、0.5%イーストエクストラクト、0.5%NaClを含む培地
LBA:100μg/mlアンピシリンを含むLB
LBAG:100μg/mlアンピシリン及び0.1%グルコースを含むLB
LBAGプレート:100μg/mlアンピシリン及び0.1%グルコースを含むLB寒天培地
SOC:2%バクトトリプトン、0.5%イーストエクストラクト、0.05% NaCl、2.5mM KCl、20mMグルコース、10mM MgCl2を含む培地
PBS:137mM NaClと2.7mM KClを含む10mM phosphate buffer(pH7.2)
5% IBPBS:5%(v/v)イムノブロック(大日本住友製薬,大阪)を含むPBS
20% IBPBS:20%(v/v)イムノブロックを含むPBS
PBST:0.1% Triton−X100を含むPBS
TAEバッファー:1mM EDTAを含む40mMTris−acetate(pH8.3)
TALONバッファー:300mM NaClを含む50mMリン酸ナトリウム(pH7.0)
TALON溶出液:500mMイミダゾールを含むTALONバッファー(pH7.0)
IPTG:イソプロピル−β−チオガラクトピラノシド
HBS−Nバッファー(10mM HEPES,150mM NaCl、pH7.4)
【0101】
すべての実験において、Milli-Q (Millipore Co., Billerica, MA)にて精製した水を用いた。以下、milliQ水と表記する。通常の試薬は特に表記のあるもの以外は、シグマ(St. Louis, MO)、ナカライテスク(京都)、和光純薬(大阪)、関東化学(東京)のものを使用した。オリゴDNAはテキサスジェノミクスジャパン(東京)、またはInvitrogen(東京)にて合成した。
【0102】
使用した大腸菌XL10−Gold及びOverExpress C41の遺伝子型を表1に、PCRに用いたプライマー配列を表2に示す。
【0103】
【表1】

【0104】
【表2】

【0105】
(A)発現プラスミドのコンストラクション
(a)実験に使用したベクター
pET-MBPp-His6: ヒスチジン6残基のHis-Tag(His6)が付加されたマルトース結合蛋白質(MBP)の遺伝子が挿入されたpET15bベクター(Merck Chemicals Ltd., Darmstadt, Germany)。(配列番号7)
pIT2-LxE16: 東京大学大学院工学系研究科化学生命工学専攻蛋白質工学研究室で単離された抗ニワトリ卵白リゾチーム(HEL)抗体LxE16の一本鎖抗体(scFv)遺伝子(配列番号8、アミノ酸:配列番号9)が挿入されたpIT2 ベクター(MRC Cambridge, UKより提供)。
【0106】
(b)発現ベクター作製の概略
抗リゾチーム抗体LxE16の重鎖及び軽鎖の可変領域ドメインであるVH(HEL)とVL(HEL)のN末端側及びC末端側に、それぞれMBPとヒスチジン10残基のHis-tag(His10)が融合した蛋白質MBP-VH(HEL)-His10及びMBP-VL(HEL)-His10をコードする発現ベクター(pET-MBPp-VH(HEL)-His10、pET-MBPp-VL(HEL)-His10)は、図2のスキームに示す通り、pET-MBPp-His6を元に作成された。まずpET-MBPp- His6のHis6を含むDNA断片(1)を切り出し、そこにHis10をコードするDNA断片(2)を挿入してpET-MBPp-His10を作成した。さらにpET-MBPp-His10に、VH(HEL)遺伝子(配列番号10、表3)もしくはVL(HEL)遺伝子(配列番号11、表4)を挿入することで、pET-MBPp-VH(HEL)-His10及びpET-MBPp-VL(HEL)-His10を完成させた。
【0107】
【表3】

【0108】
【表4】

【0109】
(b)pET-MBPp-His6からのDNA断片(1)の切り出し
約10μgのpET-MBPp-His6を含む74μlの水溶液に、3μl Sca I (Roche Applied Science, Basel, Switzerland, 10 U)、3μl Not I (Roche Applied Science 10 U)、10μl 10x BSA溶液、10μl 10x Hバッファー(Roche Applied Science)を添加し、37℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、4100bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up System (Promega Co., Madison, WI)を用いて抽出し、50μlのmilliQ水に溶解した。
【0110】
(c)DNA断片(2)の作製
pET-MBPp-His6を鋳型として、プライマー(1)(配列番号1)とプライマー(2)(配列番号2)を用いてPCRを行った。プライマー(1)は、His6をコードする領域の下流側にアニールサイトを持ち、ヒスチジン10残基に対応する塩基配列と、NotIサイトを有するリバースプライマーである。またプライマー(2)は、pETベクター上に存在するScaIサイトの約500塩基下流にアニールサイトを持つフォワードプライマーである。
PCRの条件は、以下の通りである。
【0111】
反応液組成
pET-MBPp-His6 (約100μg/ml) 0.5μl
プライマー(1)(50μM) 0.5μl
プライマー(2)(50μM) 0.5μl
10x Pfu buffer (Mg2+20 mM) (Agilent Technologies, Inc. Santa Clara, CA)
5μl
dNTP Mixture (2.5mM each) 4μl
2.5 U/μl Pfu DNA polymerase (Agilent Technologies, Inc.)
0.5μl
milliQ 水 39μl
【0112】
反応サイクル
1. 94℃ 1 min
2. 94℃ 30 sec
3. 58℃ 30 sec
4. 72℃ 30 sec
(2から4を25回)
5. 72℃ 10 min
6. 16℃ ∞
【0113】
PCR産物は、Wizard SV Gel and PCR Clean-Up Systemを用いて精製し、50μlのmilliQ水に溶解し、1μl Sca I (Roche Applied Science 10 U)、1 μl Not I (Roche Applied Science 10 U)、7μl 10x BSA溶液、7μl 10x Hバッファー(Roche Applied Science)、4μl milliQ水を添加し、37℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、約1080bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up Systemを用いて抽出し、50μlのmilliQ水に溶解して、DNA断片(2)を含む溶液を得た。
【0114】
(d)pET-MBPp-His10の作製
DNA断片(1)を切除したpET-MBPp-His6を含む溶液とDNA断片(2)溶液は、それぞれ0.5μlと5μlずつ混合し、さらに5.5μlのDNA Ligation high ver2溶液(TOYOBO CO., LTD, 大阪)を加えて、16℃30分間ライゲーション反応を行った。約1μlのライゲーション反応液を、約50μlの大腸菌XL10-Goldケミカルコンピテントセルに加えて形質転換した。形質転換株をLBAG寒天培地にて37℃一晩培養し、シングルコロニーをLBAG 50mlにてさらに一晩培養した菌体よりWizard Plus Minipreps DNA Purification kit (Promega Co.)にてプラスミドDNAを抽出し、pET-MBPp-His10を得た。His10をコードするDNA配列は、Beckman Coulter社のプロトコールに従って確認した。
【0115】
(e)pET-MBPp-His10の制限酵素処理
約7μgのpET-MBPp-His10を含む46μlの水溶液に、2μl Sfi I (Roche Applied Science 10 U/μl)、6μl 10x BSA溶液、6μl 10x Mバッファー(Roche Applied Science)を添加し、50℃で約3時間静置した。Wizard SV Gel and PCR Clean-Up Systemを用いて精製後、50μlの水溶液に溶解し、2μl Not I (Roche Applied Science 10 U)、7μl 10x BSA溶液、7μl 10x Hバッファー(Roche Applied Science)、4μl milliQ水を添加し、37℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、4800bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up Systemを用いて抽出し、50μlのmilliQ水に溶解した。
【0116】
(f)VH(HEL)遺伝子断片の作製
pIT2-LxE16を鋳型として、プライマー(3)及び(4)を用いてPCRを行い、VH(HEL)遺伝子断片を増幅した。プライマー(3)は、VH(HEL)遺伝子断片の5’側にアニールサイトを持ち、SfiIサイトを有するリバースプライマーである。またプライマー(4)は、VH(HEL)遺伝子断片の3’側にアニールサイトを持ち、NotIサイトを有するフォワードプライマーである。
PCRの条件は、以下の通りである。
【0117】
反応液組成
pIT2-LxE16 (約100 μg/ml) 0.5μl
プライマー(3)(50 μM) 0.5μl
プライマー(4)(50 μM) 0.5μl
10x Pfu buffer (Mg2+20 mM) (Agilent Technologies, Inc.) 5μl
dNTP Mixture (2.5 mM each) 4μl
2.5 U/μl Pfu DNA polymerase (Agilent Technologies, Inc.) 0.5μl
milliQ 水 39μl
【0118】
反応サイクル
1. 94℃ 1 min
2. 94℃ 30 sec
3. 58℃ 30 sec
4. 72℃ 30 sec
(2から4を25回)
5. 72℃ 10 min
6. 16℃ ∞
【0119】
PCR産物は、Wizard SV Gel and PCR Clean-Up Systemを用いて精製し、50μlのmilliQ水に溶解し、2μl Sfi I (Roche Applied Science 10 U/μl)、7μl 10x BSA溶液、7μl 10x Mバッファー(Roche Applied Science)、4μl milliQ水を添加し、50℃で約3時間静置した。Wizard SV Gel and PCR Clean-Up Systemを用いて精製後、50μlの水溶液に溶解し、2μl Not I (Roche Applied Science 10 U)、7μl 10x BSA溶液、7μl 10x Hバッファー(Roche Applied Science)、4μl milliQ水を添加し、37℃で約3時間静置した。その後、Wizard SV Gel and PCR Clean-Up Systemを用いて精製し、50μlのmilliQ水に溶解して、VH(LxE16)遺伝子断片を含む溶液(VH(LxE16)溶液)を得た。
【0120】
(g)VL(HEL)遺伝子断片の作製
pIT2-LxE16を鋳型として、プライマー(5)及び(6)を用いてPCRを行い、VL(HEL)遺伝子断片を増幅した。プライマー(5)は、VL(HEL)遺伝子断片の5’側にアニールサイトを持ち、SfiIサイトを有するリバースプライマーである。またプライマー(6)は、VL(HEL)遺伝子断片の3’側にアニールサイトを持ち、NotIサイトを有するフォワードプライマーである。PCRや制限酵素処理、精製を、VH(LxE16)遺伝子断片の場合と同様に行い、VL(LxE16)遺伝子断片を含む溶液(VL(LxE16)溶液)を得た。
【0121】
(h)pET-MBPp-VH(HEL)-His10及びpET-MBPp-VL(HEL)-His10の作製
制限酵素処理pET-MBPp-His10を含む溶液とVH(LxE16)溶液もしくはVL(LxE16)溶液は、それぞれ0.5μlと5μlずつ混合し、さらに5.5μlのDNA Ligation high ver2(TOYOBO CO.)を加えて、16℃30分間ライゲーション反応を行った。約1μlのライゲーション反応液を、約50μlの大腸菌XL10-Goldケミカルコンピテントセルに加えて形質転換し、形質転換株をLBAG寒天培地にて37℃一晩培養し、さらにシングルコロニーをLBAG 50mlにてさらに一晩培養した菌体よりWizard Plus Midipreps DNA Purification kit (Promega Co.)にてプラスミドDNAを抽出した。pET-MBPp-VH(HEL)-His10及びpET-MBPp-VL(HEL)-His10のDNA配列は、Beckman Coulter社のプロトコールに従って確認した。
【0122】
(B)MBP-VH(HEL)-His10及びMBP-VL(HEL)-His10蛋白質の調製
プラスミドpET-MBPp-VH(HEL)-His10及びpET-MBPp-VL(HEL)-His10を大腸菌OverExpress C41(DE3)にヒートショック法で形質転換し、発現させた。プラスミド1μl(約100ng)とOverExpress C41(DE3)コンピテントセル100μlを混合し氷上30min静置した後、42℃45秒ヒートショックしすぐに2分氷上静置した。その後、SOC培地200μlを加え30分キュアリングし、LBAプレートに塗布して37℃で一晩培養した。
【0123】
生じたコロニーを4mlのLBAGに植菌し、30℃で一晩振とう培養を行った。少量培養した培養液4mlを800mlのLBAに加え、30℃で振とうし大量培養を行った。O.D.600が0.5〜0.6になったところで1000mMのIPTG 400μlを加え、さらに30℃で一晩時間振とう培養した。菌体培養液を遠心分離機でそれぞれ上清と大腸菌のペレットに分離した後、上清からは硫安沈殿法で、ペレットからは超音波菌体破砕で、それぞれ下記のMBP-VH(HEL)-His10(配列番号12、表5)及びMBP-VL(HEL)-His10(配列番号13、表6)を以下のように回収した。
【0124】
【表5】

【0125】
【表6】

【0126】
約800mlの培養上清に硫安344gを加えて、4℃で一晩攪拌した後、遠心分離によってMBP-VH(HEL)-His10もしくはMBP-VL(HEL)-His10を含む不溶物を回収し、30mlのTALONバッファーに懸濁した。一方、大腸菌ペレットは、30mlのTALONバッファーに懸濁後、超音波処理を行い、遠心分離によってMBP-VH(HEL)-His10もしくはMBP-VL(HEL)-His10を含む上清を回収した。上清はTALONバッファーに対して透析した。それぞれのTALONバッファー中に回収した蛋白質を、TALON affinity resin (Clontech Laboratories, Inc., Mountain View, CA) を充填したカラム(直径16mmx高さ約15mm)に添加し、蛋白質の吸着したTALON affinity resinは TALONバッファーで洗浄した。その後、TALON溶出液を加えて、MBP-VH(HEL)-His10もしくはMBP-VL(HEL)-His10を溶出させた。精製蛋白質は、SDS-PAGEより確認を行った後に、HBS-Nにバッファー交換し終濃度16%となるようにグリセロールを加えて−80℃にて保存した。
【0127】
(C)VL(HEL)-His10の作製
精製した1mlのMBP-VL(HEL)-His10溶液(HBS-N、約1000μg/ml)に対して、20μlのGenenase溶液(New England BioLabs, Inc., Ipswich, MA)を加えて、室温にて約5時間反応を行った。反応後、上記と同様にTALON affinity resinを用いてVL(HEL)-His10を精製し、HBS−Nにバッファー交換した。
【0128】
(D)Alexa Fluor 555標識MBP-VH(HEL)-His10の作製
上記で得たMBP-VH(HEL)-His10溶液(HBS−N、約430μg/ml)440μLをAlexa Fluor(登録商標) 555(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0129】
(E)Alexa Fluor 647標識VL(HEL)-His10の作製
上記で得たVL(HEL)-His10溶液(HBS-N、約1679μg/ml)27μLをAlexa Fluor(登録商標) 647(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0130】
(2)カルボキシル基を付与した担体の作製
(A)担体の洗浄
UV照射した松浪硝子工業社製のスライドグラスをアセトンに浸漬し、5分間超音波洗浄した。その後、アセトンからスライドグラスを取り出し、純水で洗浄した。
【0131】
(B)アミノ(APS)基の付与
100mlのガラスバイアルにエタノール72mlと純水8mlを混合し、60℃で15分間程度、恒温槽(アズワン社製)で加温し、エタノールと純水の混合溶液を温めた。温めたエタノールと純水の混合溶液に、APS(γ−アミノプロピルトリエトキシシラン、東京化成工業製)を80μl混合し(0.1% v/v)溶解した。この溶液に、洗浄したスライドグラスを浸漬し、恒温槽(アズワン社製)内で60℃、15分間反応させることで、アミノ基が付与されたスライドグラスを得た。反応終了後のスライドグラスを取り出し、エタノール:純水=9:1の溶液に浸漬し、取り出す、という工程により洗浄を行った。この洗浄工程を3度行った。洗浄後のスライドグラスを窒素ブローし、120℃で1時間ベーキングした。ベーキング後のスライドグラスは、エタノール、純水の順に、浸漬洗浄を行った。
【0132】
(C)CMDの活性エステル化
超純水に0.5質量%となるようにCMD(カルボキシメチルデキストラン、名糖産業製:分子量100万)を溶解した後、全量反応した場合にカルボキシル基の2%が活性化される計算量の0.4MのEDC(1−(3−Dimethylaminopropyl)−3−ethylcarbodiimide)および0.1MのNHS(N−Hydroxysuccinimide)混合溶液を加え、室温で5分間攪拌した。
【0133】
(D)CMD膜の作製
上記アミノ基を形成したガラス基板上に、活性エステル化したCMD溶液を滴下し30秒後に除去することで、アミノ基を有する担体上に活性エステル化されたカルボキシメチルデキストラン薄膜を形成させた。室温で1時間反応させた後、0.1N NaOHで1回、超純水で1回洗浄した。
【0134】
(3)複合体の作製
上記で作製したAlexa Fluor 555標識MBP-VH(HEL)-His10、Alexa Fluor 647標識VL(HEL)-His10及びリゾチームを1:1:1の個数比で混合し、1.5μMのHEPESバッファー溶液を作製し、室温に3時間静置して、複合体試料液を作製した。
【0135】
(4)複合体の固定
作製したCMDガラス基板を、Biacore社製の表面プラズモン共鳴装置であるBiacore3000のsurface prep unitにセットした。Surface prep unitを用いて、10μl/minの流速下において、ガラス基板に0.2mMのEDCと0.04mMのNHS混合水溶液を70μl添加した。その後、上記複合体試料液をpH4.5アセテートバッファーで半分に希釈した希釈後の複合体試料液30μlをCMDガラス基板に供給し、その後、エタノールアミン溶液によってブロッキング処理を施して、固定化を行った。
【0136】
(5)抗原の洗浄
複合体を固定化後、pH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、本実施例の固定化担体Aを得た。洗浄後の試料をFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
【0137】
(6)抗原による蛍光量変化評価
上記で得られた固体化担体Aに、1μMのリゾチームを1分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。この得られた570nm付近の発光と675nm付近の発光の強度比を(5)で得られた570nm付近の発光と675nm付近の発光の強度比で除して、リゾチーム添加前後での発光強度比変化を求めた。
【0138】
[実施例2]
実施例1で使用した固定化担体AをpH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、固定化担体Bを得た。
再度、固定化担体BをFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
その後、1μMのリゾチームを1分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0139】
[実施例3]
複合体の作製において、Alexa Fluor 555標識MBP-VH(HEL)-His10、Alexa Fluor 647標識VL(HEL)-His10及びリゾチームの混合比を10:10:1にした以外は実施例1と同様にして、固定化担体Cを得た。実施例1と同様にして固定化担体Cにおけるリゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0140】
[比較例1]
複合体の作製において、Alexa Fluor 555標識MBP-VH(HEL)-His10、Alexa Fluor 647標識VL(HEL)-His10を交互に同濃度、同時間添加した以外は実施例1と同様にして、固定化担体Dを得た。実施例1と同様にして固定化担体Dにおけるリゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0141】
リゾチーム添加前後の蛍光量変化率算出
実施例1〜3及び比較例1の結果について、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比から強度比変化率を算出して、比較した。結果を表7に示す。
【0142】
【表7】

【0143】
表7から明らかなように断片化抗体と抗原との複合体を形成させないで作製され、担体上の断片化抗体の位置が制御されていない固定化担体(比較例1)では強度比変化率の変化を観測できなかったのに比べ、実施例1、2、3のものでは、蛍光強度比変化率が増加しており、断片化抗体が、蛍光共鳴エネルギー転移が起こり得る近距離にあることを示唆している。これにより、本発明によれば、3者以上での複合体反応が効率よく検出可能であり、検出感度や精度を高くすることができる。
【0144】
また、実施例3の結果から、抗リゾチームVH領域ポリペプチド、抗リゾチームVL領域ポリペプチド、リゾチームの混合比が10:10:1にしたものでも実施例1とほぼ同等の値になっており、混合比が等量でなくとも複合体を効率よく形成することができる。
【0145】
なお、実施例と比較例では、同じ濃度のリゾチームを添加した前後での強度比変化率の差が、数値上では5%程度の差となっているが、比較例(固定化担体D)においては、リゾチームの濃度が1000倍(1mM)であっても検出はできなかった(データ示さず)。このことは、比較例の固定化基板では被検物の検出が不能であるのに対して、本実施例にかかる固定化担体では、蛍光共鳴エネルギー転移を固相に適用して被験物を検出可能であることを示している。
【0146】
[実施例4]
(1)HiLyte Fluor 555標識MBP-VL(HEL)-His10の作製
上記で得たMBP-VL(HEL)-His10溶液(HBS−N、約796μg/ml)100μLをHiLyte Fluor(登録商標) 555(同仁化学社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0147】
(2)Alexa Fluor 647標識MBP-VH(HEL)-His10の作製
上記で得たMBP-VH(HEL)-His10溶液(HBS-N、約150μg/ml)300μLをAlexa Fluor(登録商標) 647(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
上記で作製したHiLyte Fluor 555標識MBP-VL(HEL)-His10、Alexa Fluor 647標識MBP-VH(HEL)-His10及びリゾチームを10:10:2の個数比で混合した以外は、実施例1と同様にして、本実施例の固定化担体Eを得た。その後、実施例1と同様にして、1μMのリゾチームを10分間添加した前後の570nm付近の発光と675nm付近の発光の強度変化率を求めた。
【0148】
[実施例5]
実施例4で使用した固定化担体EをpH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、固定化担体Fを得た。再度、固定化担体FをFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
その後、1μMのリゾチームを10分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0149】
[実施例6]
実施例5で使用した固定化担体FをpH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、固定化担体Gを得た。再度、固定化担体GをFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
その後、100nMのリゾチームを10分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0150】
[比較例2]
複合体の固定において、HiLyte Fluor 555標識MBP-VL(HEL)-His10、Alexa Fluor 647標識MBP-VH(HEL)-His10を交互に同濃度、同時間添加した以外は実施例4と同様にして、固定化担体Hを得た。実施例4と同様にして固定化担体Hにおけるリゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度変化率を求めた。
【0151】
リゾチーム添加前後の蛍光量変化率算出
実施例4〜6及び比較例2の結果について、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比変化率を算出して、比較した。結果を表8に示す。
【0152】
【表8】

【0153】
表8から明らかなようにドナーであるHiLyte fluor 555をMBP-VL、アクセプターであるAlexa fluor 647をMBP-VHに標識しても、本発明にかかる固定化担体を作製することが可能であった。このことから、MBP-VH、MBP-VLのどちらにドナー又はアクセプター色素を標識しても同様に測定が可能であることが分かる。
また、実施例5,6より本発明にかかる固定化担体は、洗浄後においても繰り返し抗原検出可能であり、抗原濃度依存的に発光強度比が変化することから、抗原濃度を定量することも可能である。
さらに、本発明にかかる固定化担体は、MBP-VH(HEL)-His10、MBP-VL(HEL)-His10 のいずれをMBP融合体としても、また双方をMBP融合体としても、同様に測定可能であり、MBP融合体であることに拘わらず測定可能であることが分かる。
【0154】
[実施例7]
(1) 抗オステオカルシン(BGP)VH領域ポリペプチド(VH(BGP))とMBPとの融合蛋白質(MBP-VH(BGP))、抗BGP VL領域ポリペプチドとMBPとの融合蛋白質(MBP-VL(BGP))の作製
以下の実施例で使われる略語は以下の通りである。
LB:実施例1で用いたものと同一
LBA:実施例1で用いたものと同一
LBAG:実施例1で用いたものと同一
LBAプレート:実施例1で用いたものと同一
SOC:実施例1で用いたものと同一
PBS:137mM NaClと2.7mM KClを含む10mM phosphate buffer(pH7.2)
5% IBPBS:5%(v/v)イムノブロック(大日本住友製薬,大阪)を含むPBS
20% IBPBS:20%(v/v)イムノブロックを含むPBS
PBST:0.1% Triton−X100を含むPBS
TAEバッファー:実施例1で用いたものと同一
TALONバッファー:実施例1で用いたものと同一
TALON溶出液:実施例1で用いたものと同一
IPTG:実施例1で用いたものと同一
HBS−Nバッファー:実施例1で用いたものと同一
【0155】
実施例1〜6と同様に、すべての実験において、Milli-Q (Millipore Co., Billerica, MA)にて精製した水を用いた。以下、milliQ水と表記する。通常の試薬は特に表記のあるもの以外は、シグマ(St. Louis, MO)、ナカライテスク(京都)、和光純薬(大阪)、関東化学(東京)のものを使用した。オリゴDNAはテキサスジェノミクスジャパン(東京)、またはInvitrogen(東京)にて合成した。
【0156】
使用した大腸菌XL10−Gold及びOverExpress C41、HB2151の遺伝子型を表9に示す。
【0157】
【表9】

【0158】
(A)MBP-VH(BGP)発現プラスミドのコンストラクション
(a)実験に使用したベクター
pET-MBPp-His6: ヒスチジン6残基のHis-Tag(His6)が付加されたマルトース結合蛋白質(MBP)の遺伝子が挿入されたpET15bベクター(Merck Chemicals Ltd., Darmstadt, Germany)。(前述、配列番号7)
pIT2-VH(BGP): 抗BGP抗体のVH領域ポリペプチド(VH(BGP))遺伝子(配列番号14、表10、アミノ酸:配列番号15)が挿入されたpIT2ベクター。
pMAL-VL(BGP): 抗BGP抗体KTM219のVL領域ポリペプチドとMBPとの融合蛋白質(MBP-VL(BGP))の発現用ベクター (文献Lim et al. Anal.Chem. 79, 6193 (2007))
【0159】
【表10】

【0160】
(b)pET-MBPp-His6の制限酵素処理
約10μgのpET-MBPp-His6を含む77μlの水溶液に、3μl Not I (Roche Applied Science, Basel, Switzerland, 10 U)、10μl 10x BSA溶液、10μl 10x Hバッファー(Roche Applied Science)を添加し、37℃で約3時間静置した。その後、Wizard SV Gel and PCR Clean-Up System (Promega Co., Madison, WI)を用いて抽出し、50μlのmilliQ水に溶解し、3μl Sfi I (Roche Applied Science, 10 U)、7μl 10x BSA溶液、7μl 10xMバッファー(Roche Applied Science)を添加し、50℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、約4100bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up System (Promega Co.)を用いて抽出し、50μlのmilliQ水に溶解した。
【0161】
(c)pIT2-VH(BGP)からのVH(BGP)遺伝子断片の切り出し
約10μgのpIT2-VH(BGP)を含む77μlの水溶液に、3μl Not I (Roche Applied Science, 10 U)、10μl 10x BSA溶液、10μl 10x Hバッファー(Roche Applied Science)を添加し、37℃で約3時間静置した。その後、Wizard SV Gel and PCR Clean-Up System (Promega Co.)を用いて抽出し、50μlのmilliQ水に溶解し、3μl Sfi I (Roche Applied Science, 10 U)、7μl 10x BSA溶液、7μl 10xMバッファー(Roche Applied Science)を添加し、50℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、約450bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up System (Promega Co.)を用いて抽出し、50μlのmilliQ水に溶解した。
【0162】
(d)VH(BGP)のpET-MBPp-His6への組込み
上記で精製した制限酵素処理済pET-MBPp-His6とVH(BGP)遺伝子断片の溶液は、それぞれ0.5μlと5μlずつ混合し、さらに5.5μlのDNA Ligation high ver2溶液(TOYOBO CO., LTD, 大阪)を加えて、16℃30分間ライゲーション反応を行った。約1μlのライゲーション反応液を、約50μlの大腸菌XL10-Goldケミカルコンピテントセルに加えて形質転換した。形質転換株をLBAG寒天培地にて37℃一晩培養し、シングルコロニーをLBAG 50mlにてさらに一晩培養した菌体よりWizard Plus Minipreps DNA Purification kit (Promega Co.)にてプラスミドDNAを抽出し、pET-MBPp-VH(BGP)を得た。DNA配列は、Beckman Coulter社のプロトコールに従って確認した。
【0163】
(B)MBP-VH(BGP)及びMBP-VL(BGP)蛋白質の調製
プラスミドpET-MBPp-VH(BGP)及びpMAL-VL(BGP)を大腸菌OverExpress C41(DE3)にヒートショック法で形質転換し、発現させた。プラスミド1μl(約100ng)とOverExpress C41(DE3)コンピテントセル100μlを混合し氷上30min静置した後、42℃45秒ヒートショックしすぐに2分氷上静置した。その後、SOC培地200μlを加え30分キュアリングし、LBAプレートに塗布して37℃で一晩培養した。
【0164】
生じたコロニーを4mlのLBAGに植菌し、30℃で一晩振とう培養を行った。少量培養した培養液4mlを800mlのLBAに加え、30℃で振とうし大量培養を行った。O.D.が0.5〜0.6になったところで1000mMのIPTG 400μlを加え、さらに20℃で一晩時間振とう培養した。菌体培養液を遠心分離機でそれぞれ上清と大腸菌のペレットに分離した後、上清からは硫安沈殿法で、ペレットからは超音波菌体破砕で、それぞれ下記のMBP-VH(BGP)(配列番号16、表11)及びMBP-VL(BGP)(配列番号17、表12)を以下のように回収した。
【0165】
【表11】

【0166】
【表12】

【0167】
約800mlの培養上清に硫安344gを加えて、4℃で一晩攪拌した後、遠心分離によってMBP-VH(BGP)もしくはMBP-VL(BGP)を含む不溶物を回収し、30mlのTALONバッファーに懸濁した。一方、大腸菌ペレットは、30mlのTALONバッファーに懸濁後、超音波処理を行い、遠心分離によってMBP-VH(BGP)もしくはMBP-VL(BGP)を含む上清を回収した。上清はTALONバッファーに対して透析した。それぞれのTALONバッファー中に回収した蛋白質を、TALON affinity resin (Clontech Laboratories, Inc., Mountain View, CA) を充填したカラム(直径16mmx高さ約15mm)に添加し、蛋白質の吸着したTALON affinity resinは TALONバッファーで洗浄した。その後、TALON溶出液を加えて、MBP-VH(BGP)もしくはMBP-VL(BGP)を溶出させた。精製蛋白質は、SDS-PAGEより確認を行った後に、HBS-Nにバッファー交換し終濃度16%となるようにグリセロールを加えて−80℃にて保存した。
【0168】
(C)Alexa Fluor 555標識MBP-VH(BGP)の作製
上記で得たMBP-VH(BGP)溶液(HBS−N、約1.2mg/ml)100μLをAlexa Fluor(登録商標) 555(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0169】
(D)Alexa Fluor 647標識MBP-VL(BGP)の作成
上記で得たMBP-VL(BGP)溶液(HBS-N、約150μg/ml)430μLをAlexa Fluor(登録商標) 647(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0170】
(2)カルボキシル基を付与した担体の作製
(A)担体の洗浄
UV照射した松浪硝子工業社製のスライドグラスをアセトンに浸漬し、5分間超音波洗浄した。その後、アセトンからスライドグラスを取り出し、純水で洗浄した。
【0171】
(B)アミノ(APS)基の付与
100mlのガラスバイアルにエタノール72mlと純水8mlを混合し、60℃で15分間程度、恒温槽(アズワン社製)で加温し、エタノールと純水の混合溶液を温めた。温めたエタノールと純水の混合溶液に、APS(γ−アミノプロピルトリエトキシシラン、東京化成工業製)を80μl混合し(0.1% v/v)溶解した。この溶液に、洗浄したスライドグラスを浸漬し、恒温槽(アズワン社製)内で60℃、15分間反応させることで、アミノ基が付与されたスライドグラスを得た。反応終了後のスライドグラスを取り出し、エタノール:純水=9:1の溶液に浸漬し、取り出す、という工程により洗浄を行った。この洗浄工程を3度行った。洗浄後のスライドグラスを窒素ブローし、120℃で1時間ベーキングした。ベーキング後のスライドグラスは、エタノール、純水の順に、浸漬洗浄を行った。
【0172】
(C)CMDの活性エステル化
超純水に0.5質量%となるようにCMD(カルボキシメチルデキストラン、名糖産業製:分子量100万)を溶解した後、全量反応した場合にカルボキシル基の2%が活性化される計算量の0.4MのEDC(1−(3−Dimethylaminopropyl)−3−ethylcarbodiimide)および0.1MのNHS(N−Hydroxysuccinimide)混合溶液を加え、室温で5分間攪拌した。
【0173】
(D)CMD膜の作製
上記アミノ基を形成した金膜上に、活性エステル化したCMD溶液を滴下し30秒後に除去することで、アミノ基を有する担体上に活性エステル化されたカルボキシメチルデキストラン薄膜を形成させた。室温で1時間反応させた後、0.1N NaOHで1回、超純水で1回洗浄した。
【0174】
(3)複合体の作製
上記で作製したAlexa Fluor 555標識MBP-VH(BGP)、Alexa Fluor 647標識MBP-VL(BGP)及びBGPのC末端アミノ酸断片(RRFYGPY:配列番号18、以下、断片化BGP)を4:1:4の個数比で混合し、Alexa Fluor 555標識MBP-VH(BGP)が2μMのHEPESバッファー溶液となるように作製し、室温に3時間静置して、複合体試料液を作製した。
【0175】
(4)複合体の固定
作製したCMDガラス基板をBiacore社製の表面プラズモン共鳴装置であるBiacore3000のsurface prep unitにセットした。Surface prep unitを用いて、10μl/minの流速下において、ガラス基板に0.2mMのEDCと0.04mMのNHS混合水溶液を70μl添加した。その後、上記複合体試料液をpH4.5アセテートバッファーで半分に希釈した希釈後の複合体試料液70μlをCMDガラス基板に供給し、その後、エタノールアミン溶液によってブロッキング処理を施して、固定化を行った。
【0176】
(5)抗原の洗浄
複合体の固定化後、pH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、本実施例の抗体固定化担体Iを得た。洗浄後の試料をFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
【0177】
(6)抗原による蛍光量変化評価
上記で得られた固体化担体Iに、100nMのBGPのC末端アミノ酸断片(RRFYGPY)を10分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。この得られた570nm付近の発光と675nm付近の発光の強度比を上記(5)で得られた570nm付近の発光と675nm付近の発光の強度比で除して、断片化BGPアミノ酸(RRFYGPY)添加前後での発光強度比の変化を求めた。
【0178】
[実施例8]
実施例7で使用した固定化担体IをpH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、固定化担体Jを得た。再度、固定化担体JをFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
その後、1μMの断片化BGPアミノ酸(RRFYGPY)を10分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、断片化BGPアミノ酸添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0179】
[比較例3]
複合体の固定において、Alexa Fluor 555標識MBP-VH(BGP)、Alexa Fluor 647標識MBP-VL(BGP)を交互に同濃度、同時間添加した以外は実施例7と同様にして、固定化担体Kを得た。実施例7と同様にして、固定化担体Kにおける断片化BGPアミノ酸(RRFYGPY)添加前後での570nm付近の発光と675nm付近の発光の強度変化率を求めた。
【0180】
断片化BGPアミノ酸(RRFYGPY)添加前後の蛍光量変化率算出
実施例7〜8及び比較例3の結果について、断片化BGPアミノ酸(RRFYGPY)添加前後での570nm付近の発光と675nm付近の発光の強度比変化率を算出して、比較した。結果を表13に示す。
【0181】
【表13】

【0182】
表13から明らかなように本発明にかかる固定化担体を用いることで、低分子の抗原も検出することが可能であり、抗原の汎用性が非常に広いことが分かる。実施例7,8より本発明にかかる固定化担体は、低分子の抗原においても濃度依存的に発光強度比が変化することから、抗原濃度を定量可能である。
なお、固定化担体K(比較例3)について、リゾチームの時と同様に断片化BGPアミノ酸(RRFYGPY)濃度を10000倍(1mM)に増やしても検出はできなかった。(データ示さず)
【0183】
従って本発明によれば、短時間で精度よくかつ簡便に、目的とする分子を検出することができ、洗浄後も繰り返し使用可能な断片化抗体固定化担体を提供することができる。またリンカー設計等が必要ないことから、汎用性が高い製造方法も提供することができる。
【符号の説明】
【0184】
10 固定化担体
12 担体
14 自己組織化膜
16 ポリマー層
18A 断片化抗体
18B 発光物質
18C 断片化抗体
18D 発光認識部位
Ag 抗原
【技術分野】
【0001】
本発明は、断片化抗体固定化担体及びその製造方法に関する。
【背景技術】
【0002】
種々のタンパク質を対象物質として精度よく検出する系として、免疫測定法、例えばELISA法がよく知られている。この免疫測定法では、タンパク質と、このタンパク質に対する特異的な抗体とを、それぞれ対象物質と検出物質とし、これらの特異的な相互作用に基づいて対象物質を感度よく検出するものである。ELISA法は、感度や操作性の観点から種々改良されているが、大量の試料を短時間で簡便にかつ感度よく検出することに対する要求が、近年ますます高くなっている。
【0003】
このような対象物質と検出物質間の特異的な結合反応を効果的に利用する他の系としては、分子インプリンティングという技術が存在する。
例えば特許文献1では、対象分子に対するリガンドを導入したモノマー又はポリマーと対象分子との複合体を、高分子架橋剤と反応させて、リガンドと対象分子との複合体を含有するゲルを作成してから、対象分子をこのゲルから除去することにより得られた分子インプリントゲルを開示している。この特許文献1では、抗AFP抗体及びレクチンを含むゲル担体に抗原としてのAFPを添加すると、抗AFP抗体及びレクチンがAFPに結合することによりゲルが収縮することが開示されており、このようなゲルの膨潤収縮によりAFP(対象分子)の存在を感知することができると記載されている。
しかしながら、上記の分子インプリンティング法においては、固定化担体は、抗原抗体複合体を重合することにより作製されるため、被検出抗原が抗体に辿り着くためには、架橋されたゲルマトリックス構造中を拡散しなければならない。このため、抗原が抗体と反応を起こすのには時間がかかり、物質が確実に認識されるのに非常に高濃度の抗原を2〜4時間接触させなければならない。更に、抗原の洗浄除去の際にも同様の理由から、効率よく除去できず、更に応答性が悪くなる傾向がある。従って、迅速かつ高感度に検出することができない、という問題がある。
【0004】
上記の技術と同様に抗原抗体反応による特異的な結合を利用した系として、特許文献2には、2種の蛍光標識した断片化抗体による蛍光共鳴エネルギー移動を用いた免疫測定用試薬が開示されている。この免疫測定用試薬では、抗原が存在しない場合には、抗原抗体複合体が形成されず、蛍光共鳴エネルギー転移(FRET)が生じず、抗原が存在する場合には、抗原抗体複合体が形成され、FRETが生じることになる。この結果、迅速かつ簡便に抗原の有無を検出することができると記載されている。しかしながら、抗原と断片化抗体が担体へ固定されていないため、洗浄操作等で流出・拡散してしまい、一回しか利用できず、繰り返し利用するといった用途には用いることが難しかった。繰り返し利用するために、この断片化抗体を単純に担体に固定化したのでは発光物質と発光認識物質間距離が近接することが出来ず、近接させるために固定量を増大させると発光物質と発光認識物質が多量に近接し、S/N比が極端に悪くなってしまう、という問題がある。
【0005】
上記の問題を回避する方法として特許文献3に見られるようにリンカーを介して2つの断片化抗体を繋ぐことで、断片化抗体を近接に固定することが可能であるが、2種の断片化抗体が効果的に作用できるようにリンカーをその断片化抗体と抗原毎に設計しなければならず、そのために汎用性はなくなり、製造コストが高くなる、という問題がある。
【0006】
また、繰り返し利用可能で簡便な検出系として、特許文献4には、分子認識素子とナノ粒子を用いることで再利用可能なバイオセンサが開示されている。この技術もリンカー設計を行わなければならず、汎用性がなく、手間がかかる問題を回避できない。
【0007】
さらに繰り返し利用可能で簡便な検出系として、非特許文献1には、疎水場応答性蛍光物質を標識した抗体を固定化した担体を利用する検出系が開示されている。しかしながらこの系では、抗原の認識により抗原抗体の界面が疎水場を形成する必要があり、抗原と抗体の組み合わせが特殊なものに限られ、汎用性がない。また、蛍光物質も抗体の抗原認識部位近傍に標識しなければならず、高度に設計する必要があり、製造の面でコストと手間がかかるという問題がある。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2006−138656号公報
【特許文献2】特開平10−78436号公報
【特許文献3】特開2007−40834号公報
【特許文献4】特開2008−83042号公報
【非特許文献】
【0009】
【非特許文献1】日本分析化学会第57年会 講演要旨集 (2008) p97 E3017
【発明の概要】
【発明が解決しようとする課題】
【0010】
このように、上記の技術のいずれにおいても、目的とする分子を、短時間、精度よくかつ簡便に検出でき、洗浄後も繰り返し使用できる被験物検出用担体としては不十分である。
また、バイオセンサーとして用いる際に、製造コストの観点から汎用性の高い製造法が望まれていた。
【0011】
本発明はこのような事情に鑑みなされたものであって、短時間で精度よくかつ簡便に、目的とする分子を検出することができ、洗浄後も繰り返し使用可能な断片化抗体固定化担体を提供することを目的とする。
また本発明は、このような断片化抗体固定化担体を汎用性が高く、効率よく製造することができる製造方法を提供することも目的とする。
【課題を解決するための手段】
【0012】
本発明は以下の通りである。
<1> 担体と、少なくとも1セットの断片化抗体を含み、各セットの断片化抗体が、少なくとも2種の独立した断片化抗体を含み、前記少なくとも2種の独立した断片化抗体が、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と、当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含み、前記少なくとも1種の標識断片化抗体と前記少なくとも1種の認識断片化抗体が、1種の抗原を認識すると共に前記同じ抗原に結合可能な位置関係でそれぞれ独立に固定化されている断片化抗体固定化担体。
<2> 前記少なくとも2種の断片化抗体が、VH領域ポリペプチドと、VL領域ポリペプチドである<1>に記載の断片化抗体固定化担体。
<3> 前記担体がポリマー層を有し、前記少なくとも2種の断片化抗体が該ポリマー層に固定化されている<1>又は<2>記載の断片化抗体固定化担体。
<4> 該ポリマー層の膜厚が1nm以上0.5mm以下である<3>に記載の断片化抗体固定化担体。
<5> 該ポリマー層が自己組織化膜を介して担体上に結合している<3>又は<4>に記載の断片化抗体固定化担体。
<6> 該自己組織化膜の膜厚が0.2nm以上10μm以下である<5>に記載の断片化抗体固定化担体。
<7>前記ポリマーが多糖類である<3>〜<6>のいずれかに記載の断片化抗体固定化担体。
<8> 前記発光物質が、蛍光色素及び蛍光タンパク質からなる群より選択されたものである<1>〜<7>のいずれかに記載の断片化抗体固定化担体。
<9> 前記標識部位と前記認識部位との間で蛍光共鳴エネルギー転移反応が生じうる<1>〜<8>のいずれかに記載の断片化抗体固定化担体。
<10> 前記少なくとも2種の断片化抗体と前記抗原との結合反応に基づくバイオリアクター又はバイオセンサーに用いられる固定化担体である<1>〜<9>のいずれかに記載の断片化抗体固定化担体。
<11> 発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の独立した断片化抗体と、当該抗原とを接触させて、前記少なくとも2種の断片化抗体と前記抗原とが結合した複合体を形成する形成工程と、前記複合体を、当該複合体中の断片化抗体を介して担体に固定化する固定化工程と、前記複合体から前記抗原を除去して、前記抗原に結合しうる位置で前記担体上に前記断片化抗体がそれぞれ固定化されている断片化抗体固定化担体を得る除去工程と、を含む断片化抗体固定化担体の製造方法。
<12> 前記少なくとも2種の断片化抗体が、抗体分子のVH領域ポリペプチドと、抗体分子のVL領域ポリペプチドである<11>に記載の断片化抗体固定化担体の製造方法。
<13> 前記形成工程が、前記少なくとも2種の断片化抗体と前記抗原とを、当該断片化抗体単独又は組み合わせで構成される分子の結合価1に対して抗原0.1倍量から10倍量の個数比で混合することを含む<11>又は<12>記載の断片化抗体固定化担体の製造方法。
<14> 前記除去工程が、複合体及び抗原の結合力を低下させる条件下で行われる<11>〜<13>のいずれかに記載の断片化抗体固定化担体の製造方法。
【発明の効果】
【0013】
本発明によれば、短時間で精度よくかつ簡便に、目的とする分子を検出することができ、洗浄後も繰り返し使用可能であり、また汎用性が高く、効率よく製造することができる断片化抗体固定化担体及びその製造方法を提供することができる。
【図面の簡単な説明】
【0014】
【図1】本発明の断片化抗体固定化担体の一例を説明する概念図であり、(A)は抗原不存在のときの固定化担体の概念図であり、(B)は抗原存在時の固定化担体の概念図である。
【図2】本発明の実施例にかかる発現ベクターの作成スキームである。
【発明を実施するための形態】
【0015】
本発明の断片化抗体固定化担体は、担体と、少なくとも1セットの断片化抗体を含み、各セットの断片化抗体が、少なくとも2種の独立した断片化抗体を含み、前記少なくとも2種の独立した断片化抗体が、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と、当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含み、前記少なくとも1種の標識断片化抗体と前記少なくとも1種の認識断片化抗体が、1種の抗原を認識すると共に前記同じ抗原に結合可能な位置関係でそれぞれ独立に固定化されている断片化抗体固定化担体である。
即ち、担体上に、発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の断片化抗体が、当該抗原に共に結合し得る位置でそれぞれ独立して固定化されている断片化抗体固定化担体である。
より具体的には、例えば、抗体断片固定化担体は、担体と;1つの抗原を認識し、1つの抗原物質(antigen-bearing entity)を形成する同じ抗原分子などに結合可能な位置関係で担体上にそれぞれ独立に固定化され、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含む2以上の異なった独立した断片化抗体からなる少なくとも1つ(例えば、2以上)の断片化抗体セットとを含んでいてもよい。したがって、本発明の抗体断片固定化担体は、同じ抗原物質もしくはそれぞれが異なった抗原物質に結合する2以上の断片化抗体セットを含んでいてもよい。
ここで、独立した断片化抗体とは、お互いが、(例えばジスルフィド結合等により)結合していない断片化抗体を意味する。
【0016】
本発明の断片化抗体固定化担体では、1種の抗原を認識する少なくとも2種の独立した断片化抗体が、1つのセット中の少なくとも2種の断片化抗体が同じ抗原に共に結合し得る位置で担体上にそれぞれ独立に固定化されているので、1つのセット中の断片化抗体同士が互いに独立していると共に近接した位置で担体上に存在する。このような断片化抗体は単独で存在するときよりも協働して抗原を認識するときの方が高いアフィニティーを示す。また、それぞれの断片化抗体は、抗原に結合し得る位置で独立して固定化されており、各断片化抗体の一部で担体と結合しているため、抗原認識部位を備えた部分が抗原に対して結合可能な範囲で動く。このため、各断片化抗体は、抗原が存在するときには抗原に接近し、短時間で容易に協働して抗原に結合する。個々の断片化抗体については洗浄操作を行っても拡散・流出がおこらず、繰り返し測定が可能となる。さらには、1つセット中の断片化抗体同士を抗原に結合させた状態(複合体)で固定化するので、別の複合体を構成した断片化抗体とは近接しない。このため、多項目の被験物を同時に測定可能な断片化抗体固定化担体であっても、異なる抗原を認識しうる他の断片化抗体とは接近せず、通常ELISA等で問題となるクロストークの発生を抑制する。
【0017】
また、本発明の断片化抗体固定化担体(以下、単に「固定化担体」ということがある)には、発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の断片化抗体が固定化されている。このため、ここに上記のように抗原が存在して、標識断片化抗体と認識断片化抗体とが接近すると、発光に基づく反応、例えばFRETやBRETなどの反応がこれらの抗体間で生じやすく、このような反応に基づいて、短時間で精度よくかつ簡便に抗原の検出を行うことができる。
【0018】
先行技術には2種の抗体をリンカーで連結したものがあるが、抗原と抗体の組み合わせによって2種の抗体間の距離が変わってくるため、抗原の種類によって最適なリンカーの設計を行わなければならない。また、発光物質標識においても、同一分子に選択的に発光物質、発光認識物質を標識する必要があり、製造の面で非常に手間とコストがかかっていた。本発明は、2種の抗体をリンカーで連結する必要がなく、従ってどのような抗原抗体の組み合わせに対しても適用することができ、標識も別々に行うことができるため、非常に汎用性が高く、製造適性に優れた手法と言える。
以下、本発明について更に説明する。
【0019】
(I)固定化担体
(1)担体
本発明の担体は、一般的にはBK7等の光学ガラスや、シリカ、アルミナ、チタニア、ジルコニア、インジウムスズ酸化物(ITO)等の金属酸化物、窒化ケイ素、窒化ガリウム、窒化アルミニウム、窒化インジウム等の金属窒化物、あるいは合成樹脂、具体的にはセファロース、ポリエチレン、ポリスチレン、ポリ(メタ)アクリル酸、ポリ(メタ)アクリルアミド、ポリメチル(メタ)クリレート、ポリエチレンテレフタレート、ポリカーボネート、シクロオレフィンポリマーに官能基が付与されたものが望ましい。特にガラスやITO、ポリメチル(メタ)クリレート、ポリエチレンテレフタレート、ポリカーボネート、シクロオレフィンポリマーなどの光源に対して透明な材料からなるものがより望ましい。官能基は例えば、アミノ基、カルボキシル基、マレイミド基、アルデヒド基、スクシンイミド基、チオール基、ヒドラジン基、イソシアネ−ト基、エポキシ基、ビニルスルホン基、ビニル基、シアン基などを挙げることができる。
このような担体は、さらに好ましくは、偏光に対して異方性を示さずかつ加工性の優れた材料が望ましい。
【0020】
これらの官能基を付与する方法は、プラズマ処理、オゾン処理、酸・アルカリによるエッチング処理や自己組織化膜などを用いた公知の表面処理方法を採ることができるが、製造適性の観点から自己組織化膜を使用することが好ましい。
【0021】
(2)ポリマー層
担体上には、ポリマー層が結合される。ポリマー層は、親水性ポリマー、疎水性ポリマー、又はその組み合わせから構成することができるが、親水性ポリマーのみを使用することが好ましい。ポリマー層は担体上に直接結合されても、間接的に結合されていてもよい。直接結合する場合は、例えば、担体からグラフト重合を介してポリマーを結合する方法が挙げられ、間接的に結合する方法としては、担体上に疎水性ポリマーを塗布後、親水性ポリマーを結合させたり、担体、及びポリマーと結合可能な化合物(以下、リンカーと称する)を担体表面に付与した後、ポリマーを結合させてもよい。特に好ましい態様によれば、リンカーとして自己組織化膜を使用し、ガラス担体上に、自己組織化膜を介して親水性ポリマーを結合させる態様をとることができる。以下、この態様について説明する。自己組織化膜の形成方法としては、(2−1)シランカップリング剤を使用する方法、(2−2)アルカンチオールを使用する方法、などが挙げられる。以下に、それぞれの方法について説明する。
【0022】
(2−1)シランカップリング剤を使用する方法
シランカップリング剤を使用する方法では、上述した担体に、以下に記すシランカップリング剤を付与することで、シランカップリング剤による自己組織化膜が形成され、担体上に官能基を付与することができる。
【0023】
本発明に使用可能なシランカップリング剤としては、一般式A−1(一般式A−1において、Xaは官能基を示し、Laは直鎖、分岐鎖、環状鎖の炭素鎖を含むリンカー部位を示し、Raは水素、もしくは炭素数1〜6のアルキル基を示し、Yaは加水分解性基を示す。また、m,nはそれぞれ0〜3の整数を示しm+n=3とする。)に示すケイ素含有化合物を利用することにより、担体−酸素−ケイ素−炭素といった共有結合を形成させることにより、担体表面に官能基を付与することができる。
【0024】
【化1】

【0025】
ここで、加水分解性基(Ya)とは、アルコキシ基、ハロゲン原子、アシロキシ基などが挙げ
られ、より具体的にはメトキシ基、エトキシ基、塩素などが挙げられる。シランカップリング剤として具体的には、γ−アミノプロピルトリメトキシシラン、N−β(アミノエチル)γ−アミノプロピルトリメトキシシラン、γ−アミノプロピルメチルジエトキシシラン、γ−メルカプトプロピルトリメトキシシラン、γ−グリシドキシプロピルトリエトキシシランなどが挙げられる。シランカップリング剤の反応方法としては一般的な方法に従えば良く、例えば書籍、シランカップリング剤の効果と使用法(サイエンス&テクノロジー社)に記載の方法を利用することができる。
【0026】
シランカップリング剤などが有する官能基(Xa)としては、後述のポリマーや錯体と
結合すれば特に限定はされず、アミノ基、カルボキシル基、ヒドロキシル基、アルデヒド基、チオール基、イソシアネート基、イソチオシアネート基、エポキシ基、シアノ基、ヒドラジノ基、ヒドラジド基、ビニルスルホン基、ビニル基、マレイミド基など任意の官能基とその組み合わせやその誘導体を利用することができるが、中でも好ましい官能基(Xa)はアミノ基とエポキシ基である。
【0027】
(2−2)アルカンチオールを使用する方法
アルカンチオールを使用する方法では、上述した担体表面上に、金属膜が配置され、その後、アルカンチオールが付与される。ここで、「担体表面上に配置される」とは、金属膜が担体表面上に直接接触するように配置されている場合のほか、金属膜が担体に直接接触することなく、他の層を介して配置されている場合をも含む意味である。それらの金属は単独又は組み合わせて使用することができる。また、上記担体への付着性を考慮して、担体と金属からなる層との間にはクロム等からなる介在層を設けてもよい。
【0028】
金属膜の膜厚は任意であるが、0.1nm以上1mm以下であることが好ましく、特に1nm以上1μm以下であることが好ましい。1mmを超えると、製造コストの観点から不利になる。クロム等からなる介在層を設ける場合、その介在層の厚さは、0.1nm以上10nm以下であることが好ましい。
【0029】
アルカンチオールを用いた金属膜の被覆法は、ハーバード大のWhitesides教授らにより精力的に展開されており、その詳細は例えばChemical Review,105,1103−1169(2005)に報告されている。金属として金を用いた場合、有機層形成化合物として一般式A−2(一般式A−2において、nは3から20の整数を示し、Xbは官能基を示す)に示すアルカンチオールを用いることにより、Au−S結合とアルキル基同士のvan der Waals力に基づき、配向性を持つ単分子膜が自己組織的に形成される。自己組織化膜は、アルカンチオール誘導体の溶液中に金担体を浸漬するという極めて簡便な手法で作製される。具体的には、例えば、一般式A−2においてXbがアミノ基、カルボキシル基、ヒドロキシル基、アルデヒド基、チオール基、イソシアネート基、イソチオシアネート基、エポキシ基、シアノ基、ヒドラジノ基、ヒドラジド基、ビニルスルホン基、ビニル基、マレイミド基である化合物を用いて自己組織化膜を形成させることで、担体表面に官能基を付与することが可能となる。
【0030】
【化2】

【0031】
なお、上記一般式A−2において、アルキレン基の繰り返し数nは3〜16の整数がさらに好ましく、4〜8の整数が特に好ましい。また、アルキレン基部分は多重結合や窒素や酸素などのヘテロ元素で置換されていてもよい。アルカンチオール誘導体のアルキル基が短いと自己組織化膜を形成しにくく、アルキル基が長いと水溶性が低下し、ハンドリングが困難になる。
【0032】
また、上記一般式A−2のアルカンチオールは、単独で、即ち1種類の官能基Xbで自己組織化膜を形成することも可能であり、また、複数種のアルカンチオールと混合して自己組織化膜を形成することも可能である。
【0033】
このような自己組織化膜の膜厚は任意であるが、0.2nm以上10μm以下であることが好ましく、特に1nm以上500nm以下であることが好ましく、さらに5nm以上50nm以下であることが好ましい。10μm以下とすれば、被検体物質が膜内を拡散しやすくでき、0.2nm以上とすれば、固定目的物質の固定量を多くすることができる。
【0034】
また、本発明では、上述した自己組織化膜に断片化抗体を直接固定することも可能であるが、断片化抗体の抗原結合率向上の観点から、自己組織化膜を形成した上にポリマー層を形成して、担体表面に断片化抗体を固定するための官能基を付与することが好ましい。本発明で用いることができるポリマーとしては、親水性ポリマーを好ましく使用することができ、具体的にはゼラチン、アガロース、キトサン、デキストラン、カラゲナン、アルギン酸、澱粉、セルロース、又はこれらの誘導体、例えばカルボキシメチル誘導体、又は水膨潤性有機ポリマー、例えばポリビニルアルコール、ポリアクリル酸、ポリアクリルアミド、ポリエチレングリコール又はこれらの誘導体などを挙げることができる。
【0035】
本発明で用いる親水性ポリマーとしてはさらに、カルボキシル基含有合成ポリマーおよびカルボキシル基含有多糖類を用いることが好ましい。カルボキシル基含有合成ポリマーとしては、ポリアクリル酸、ポリメタクリル酸、およびこれらの共重合体、例えば特開昭59−53836号明細書第3頁右上欄第2行目〜第6頁左下欄第9行目、特開昭59−71048号明細書第3頁左下欄第1行目〜第5頁左上欄第3行目に記載されているようなメタクリル酸共重合体、アクリル酸共重合体、イタコン酸共重合体、クロトン酸共重合体、マレイン酸共重合体、部分エステル化マレイン酸共重合、水酸基を有するポリマーに酸無水物を付加させたものなどが挙げられる。カルボキシル基含有多糖類は、天然植物からの抽出物、微生物発酵の生産物、酵素による合成物、または化学合成物の何れであってもよく、具体的には、ヒアルロン酸、コンドロイチン硫酸、ヘパリン、デルマタン酸硫酸、カルボキシメチルセルロース、カルボキシエチルセルロース、セロウロン酸、カルボキシメチルキチン、カルボキシメチルデキストラン、カルボキシメチルデンプン等が挙げられる。カルボキシル基含有多糖類は、市販の化合物を用いることが可能であり、具体的には、カルボキシメチルデキストランであるCMD、CMD−L、CMD−D40(名糖産業社製)、カルボキシメチルセルロースナトリウム(和光純薬社製)、アルギン酸ナトリウム(和光純薬社製)、等を挙げることができる。
【0036】
本発明で用いる親水性ポリマーの分子量は特に限定されないが、一般的には重量平均分子量が2×102以上5×106以下であることが好ましい。さらに好ましい親水性ポリマーの分子量は1×104以上2×106以下である。この範囲より重量平均分子量が小さい場合には断片化抗体の固定量が小さくなることがあり、この範囲より重量平均分子量が大きい場合には高い溶液粘度のため取り扱いが困難となることがある。
【0037】
このようなポリマー層の膜厚は、水溶液中の膜厚として1nm以上0.5mm以下であることが好ましく、より好ましくは1nm以上1μm以下であり、さらに好ましくは100nm以上500nm以下である。膜厚が薄いと生理活性物質固定量が減少し、被検体物質との相互作用が起こりにくくなる。一方、膜厚が厚いと親水性ポリマーの均一性が保てなくなる可能性があり、また被検体物質が膜内に拡散する障害となり、また特にセンサー基板の親水性ポリマー固定面の反対側から相互作用を検出する場合は検出表面から相互作用形成部までの距離が長くなり、検出感度が低くなる可能性がある。水溶液中の親水性ポリマー膜厚はAFM、エリプソメトリーなどで評価することができる。
【0038】
カルボキシル基を含有するポリマーを使用する場合、カルボキシル基を活性化することによって、担体表面に付与された官能基を介して複合体を固定することができる。カルボキシル基を含有するポリマーを活性化する方法としては、公知の手法、例えば、水溶性カルボジイミドである1-(3-Dimethylaminopropyl)-3 ethylcarbodiimide(EDC)とN-Hydroxysuccinimide(NHS)により活性化する方法、又はEDC単独により活性化する方法を好ましく用いることができる。この手法で活性化されたカルボキシル基を含有するポリマーを、アミノ基を有する担体と反応させることで、担体上に親水性ポリマーを結合させることが可能となる。
【0039】
また、カルボキシル基を含有するポリマーを活性化する方法として含窒素化合物を用いる方法があり、具体的には、下記一般式(Ia)又は(Ib)(式中、R1及びR2は、互いに独立して置換基を有してもよいカルボニル基、炭素原子、窒素原子を表し、R1及びR2は結合により5〜6員環を形成してもよく、Aは置換基を有する炭素原子またはリン原子を表し、Mは、Xと共に全体として(n−1)価の対イオンを形成する元素を表し、Xはハロゲン原子を表す)に示される含窒素化合物を用いることもできる。
【0040】
【化3】

【0041】
ここで、R1及びR2は、互いに独立して置換基を有しても良いカルボニル基、炭素原子、窒素原子を表すが、好ましくはR1及びR2は結合により5〜6員環を形成する。含窒素化合物の好ましい例には、ヒドロキシコハク酸イミド、ヒドロキシフタル酸イミド、1−ヒドロキシベンゾトリアゾール、3,4−ジヒドロキシ−3−ヒドロキシ−4−オキソ−1,2,3−ベンゾトリアジン、及びその誘導体が含まれる。
また、好ましくは下記に示される含窒素化合物(Ic)(Id)(Ie)を用いることもできる。
【0042】
【化4】

【0043】
また、好ましくは含窒素化合物としては、下記一般式(II)(式中、Y及びZは、互いに独立してCH、または窒素原子を表す)で表される化合物を用いることもできる。
【0044】
【化5】

【0045】
一般式(II)の具体的化合物としては、下記の化合物(II−1)〜(II−3)等が好ましく挙げられる。
【0046】
【化6】

【0047】
また、含窒素化合物としては、下記の化合物(II−4)等も好ましくあげられる。
【0048】
【化7】

【0049】
また好ましくは、含窒素化合物としては、下記一般式(III)(式中、Aは置換基を有する炭素原子またはリン原子を表し、Y及びZは、互いに独立してCH、または窒素原子を表し、Mは、Xと共に全体として(n−1)価の対イオンを形成する元素を表し、Xはハロゲン原子を表す)を用いることもできる。
【0050】
【化8】

【0051】
ここで、Aで表される炭素原子またはリン原子が有する置換基としては、置換基を有するアミノ基が好ましく、ジメチルアミノ基やピロリジノ基の様なジアルキルアミノ基が好ましい。Mで表される元素は、リン原子、ホウ素原子、ヒ素原子などが挙げられるが、好ましくはリン原子があげられる。Xで表されるハロゲン原子は、フッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられるが、好ましくはフッ素原子が挙げられる。
一般式(III)の具体的化合物としては、下記の化合物(III−1)〜(III−6)等が好ましく挙げられる。
【0052】
【化9】

【0053】
また、含窒素化合物としては、下記一般式(IV)(式中、Aは置換基を有する炭素原子またはリン原子を表し、Mは、Xと共に全体として(n−1)価の対イオンを形成する元素を表し、Xはハロゲン原子を表す)を用いることもできる。
【0054】
【化10】

【0055】
一般式(IV)の具体的化合物としては、下記の化合物(IV−1)等が好ましくあげられる。
【0056】
【化11】

【0057】
また、カルボキシル基を含有するポリマーを活性化する方法として、電子吸引性基を有するフェノール誘導体を使用することも好ましく、更に電子吸引性基のσ値が0.3以上であることが好ましい。具体的には、下記化合物(V−1)〜(V−4)などを用いることができる。
【0058】
【化12】

【0059】
上述のカルボジイミド誘導体及び、含窒素化合物、またはフェノール誘導体は併用して使用するだけではなく、所望により、それぞれ、単独で用いることもできる。好ましくはカルボジイミド誘導体と含窒素化合物との併用である。
【0060】
また、カルボキシル基を含有するポリマーを活性化する方法として、下記化合物(V−6)を用いることもできる。該化合物(V−6)は単独で用いることもできるが、カルボジイミド誘導体、含窒素化合物、フェノール誘導体と併用してもよい。
【0061】
【化13】

【0062】
さらに、カルボキシル基を含有するポリマーにおけるカルボキシル基を活性化する手法としては、特開2006−58071号公報「0011」〜「0022」に記載の方法(即ち、担体の表面に存在するカルボキシル基を特定の構造を有するウロニウム塩、ホスホニウム塩、又はトリアジン誘導体のいずれかの化合物を用いて活性化することによりカルボン酸アミド基を形成する方法)、並びに特開2006−90781号公報「0011」〜「0019」に記載の方法(即ち、担体の表面に存在するカルボキシル基を、カルボジイミド誘導体又はその塩で活性化し、水酸基を有する含窒素ヘテロ芳香族化合物、電子吸引性基を有するフェノール誘導体又はチオール基を有する芳香族化合物のいずれかの化合物でエステルとした後、アミンと反応させることによりカルボン酸アミド基を形成する方法)を好ましく用いることもできる。
【0063】
本発明において活性化されたカルボキシル基を含有するポリマーは、溶液として担体と反応させてもよく、また、スピンコート等の手法を用いて担体上に薄膜を形成させた状態で反応させてもよい。好ましくは、薄膜を形成させた状態での反応である。
【0064】
上記の通り、本発明において活性化されたカルボキシル基を含有するポリマーは、薄膜状態で担体と反応させることが好ましい。担体上に薄膜を形成させる方法は、公知の方法を用いることが可能であるが、具体的には、エクストルージョンコート法、カーテンコート法、キャスティング法、スクリーン印刷法、スピンコート法、スプレーコート法、スライドビードコート法、スリットアンドスピン方式、スリットコート方式、ダイコート法、ディップコート法、ナイフコート法、ブレードコート法、フローコート法、ロールコート法、ワイヤバーコート方式、転写印刷法、等を用いることが可能である。これらの薄膜形成法については、「コーティング技術の進歩」原崎勇次著、総合技術センター(1988)、「コーティング技術」技術情報協会(1999)、「水性コーティングの技術」シーエムシー(2001)、「進化する有機薄膜 成膜編」住べテクノリサーチ(2004)、「高分子表面加工学」岩森暁著、技報堂出版(2005)、等に説明されている。膜厚制御された塗布膜を簡便に作製可能であることから、本発明において担体上に薄膜を形成させる方法としては、スプレーコート法またはスピンコート法が好ましく、スピンコート法がさらに好ましい。
【0065】
(2)断片化抗体
本発明における断片化抗体は、発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識するものである。
ここで担体には、1種の抗原を認識できる上記の標識断片化抗体及び認識断片化抗体が固定化されていればよく、このような断片化抗体のセットが複数固定化されていてもよい。これにより、一つの固定化担体で複数の抗原を認識することができる。
なお、抗原の種類には、抗体と相互作用可能なものであれば特に制限はなく、目的とする検出物質に応じて適宜選択することができる。また断片化抗体も、このような抗原と相互作用可能なものとして適宜選択される。
【0066】
また2種以上の断片化抗体は、それぞれ単独で又は協働して1の抗原を認識し、結合可能であればいかなるものであってよい。このような複数の断片化抗体の例示としては、例えば、1種の抗原上の1のエピトープに対する抗原認識部位を有する2種以上の断片化抗体、1種の抗原上の異なるエピトープに対する抗原認識部位を有する2種以上の断片化抗体、1のエピトープに対する複数の超可変領域のいずれか1つのみを有する断片化抗体等を挙げることができ、1の抗原を認識可能であれば、このような複数の断片化抗体を更に組み合わせ使用することもできる。
【0067】
本発明における断片化抗体としては、抗原結合能の観点から、VH領域ポリペプチドやVL領域ポリペプチド等を好ましく挙げることができ、VH領域ポリペプチド及びVL領域ポリペプチドの組み合わせであることが、抗原結合能及び汎用性の観点からさらに好ましい。この場合、VH領域ポリペプチド及びVL領域ポリペプチドのいずれか一方を標識断片化抗体とし、他方を認識断片化抗体とすればよく、特に制限はない。
【0068】
VH領域ポリペプチド及びVL領域ポリペプチドは、それらが対合した状態で対象抗原を結合することのできる長さであれば、抗体のVH領域およびVL領域よりも長くても短くてもよい。これらのポリペプチドは、ハイブリドーマ技術により作成されたモノクローナル抗体から常法により作製することができる。例えば、以下のようにして得ることができる。
【0069】
すなわち、目的とする検体物質を認識可能なモノクローナル抗体を公知の方法によって作製し、この抗体の可変領域をコードする遺伝子を、cDNAライブラリーとハイブリダイゼーションを用いる方法により特定し、この遺伝子をベクターにクローニングする。そして、この組換え体ベクターからVHおよび/またはVL領域をコードする配列を得、この断片を発現ベクターにサブクローニングし、この遺伝子を宿主細胞内で発現させることにより、必要量のVHおよび/またはVLを得ることができる。
抗体遺伝子からVH/VLコード配列を得るためには、所望の配列領域を制限酵素で切り出し、これをクローニングベクターで増幅させてもよく、あるいは所望の配列をPCR法で増幅してもよい。VHおよび/またはVLを宿主細胞で発現させる場合には、任意のレポーター分子をコードする遺伝子をも発現ベクターにクローニングし、VHおよび/またはVLをレポーター分子との融合蛋白またはキメラ蛋白として発現させることができる。
【0070】
VHおよび/またはVLは、以上の方法によらず、抗体分子を蛋白質分解酵素によって分解することによっても得ることもできる。この場合には、遺伝子クローニングの手間を省くことができるという利点を有している。
【0071】
またVH領域ポリペプチドやVL領域ポリペプチドは、生体分子との融合体でもよい。このような融合体にすることによって、安定性が向上するという利点を有する。
VH領域ポリペプチド及びVL領域ポリペプチドと融合可能な生体分子としては、特に制限がなく、アルカリフォスフォターゼ、protein G、eGFP、eYFP、βガラクトシダーゼ、GST、chitin binding protein(CBP)、NusA、Thioredoxin、DsbA、DsbC、マルトース結合蛋白質(MBP)等をあげることができる。中でも安定性を高めたい場合には、MBP等を用いることが好ましい。
これらの融合体は、常法により作製することができ、例えば、上述した遺伝子クローニングの際に同時発現可能に生体分子の遺伝子をベクターに組み込むことにより得てもよく、VH領域ポリペプチド又はVL領域ポリペプチドにリンカーを設けて生体分子と結合してもよい。融合体の作製方法は、融合しようとする生体分子の種類やサイズに応じて、適宜選択することができる。
【0072】
なお、VL領域ポリペプチド及びVH領域ポリペプチド以外の断片化抗体の作製方法は、VL領域ポリペプチド及びVH領域ポリペプチドについての上記作製方法と同様に行うことができ、当業者であれば容易に適用可能である。
【0073】
担体に固定化する2種以上の断片化抗体は、1種の抗原を認識する標識断片化抗体及び認識断片化抗体のセット(組み合わせ)を構成するものである。担体上に固定化される断片化抗体が、このようなセットを構成することができれば、2種に限らず、3種又はそれ以上の断片化抗体を用いてもよい。このような複数種の断片化抗体を用いることにより、1種の抗原を挟んで、標識断片化抗体と認識断片化抗体とが接近する。この結果、標識抗体上の発光物質からの発光を、認識断片化抗体の認識部位が容易に認識することができる。認識効率の観点から、1つのセットには、1種類の発光物質で標識された標識断片化抗体と1種類の発光認識物質で構成された認識断片化抗体とが含まれることが好ましい。
【0074】
本発明において「発光物質」とは、励起光や酸化反応等によって生じた励起状態から基底状態に遷移する過程で光を発生することができる物質を広く包含する。発光を認識するとは、励起状態の発光物質により直接励起される、または間接的に励起され発光もしくは化学反応を起こすことを広く包含する。本発明における標識断片化抗体及び認識断片化抗体は、いずれも発光物質で標識されたものであってもよく、標識抗体のみが発光物質で標識されたものであってもよい。標識断片化抗体及び認識断片化抗体が発光物質で標識されたものである場合には、抗原との結合や担体との結合を阻害しない部位に標識されていればいずれの部位にあってもよい。発光物質の発光を認識することができる認識断片化抗体の標識は、発光物質に限らず、繰り返し使用可能なものあれば、特に制限しない。例えば、一重項酸素の発生により蛍光物質を発光させることが出来るAlpha Screen(Perkinelmer社製)キットを使用することができる。
【0075】
発光物質を断片化抗体に標識する方法は、用いる発光物質の種類によって適宜選択される。発光物質が非ペプチド性の化合物である場合には、抗体のチオール基やアミノ基にマレイミドやスクシンイミドなどの官能基を用いて化学修飾する等の公知の方法により標識できる。発光物質が蛍光タンパク質などのペプチド性の化合物である場合には、断片化抗体との融合タンパク質として作製することができる。融合タンパク質の作製方法は、公知のいかなる方法を用いても作製することができる。
なお、断片化抗体に標識される発光物質は、上記標識断片化抗体と発光認識断片化抗体が抗原抗体反応により抗原と結合した際に発光が認識できる位置で断片化抗体上に結合されていればいずれの位置であってもよく、発光物質を断片化抗体に直接結合してもよいしスペーサーを介して結合してもよい。このようなスペーサーを用いることにより、上記断片化抗体と発光認識断片化抗体が抗原抗体反応により抗原と結合した際に発光認識が起きるように、発光物質の位置を適宜調節することも可能である。このようなスペーサーとしては、ポリエチレングリコール誘導体やペプチド等のフレキシブルな親水性分子を挙げることができ、発光認識効率の観点からポリエチレングリコールが好ましい。
【0076】
好ましくは、標識断片化抗体及び認識断片化抗体にそれぞれ標識される発光物質は、検出の精度、簡便性等の観点から、標識断片化抗体上の発光物質と認識断片化抗体上の発光物質との間で、蛍光共鳴エネルギー転移反応(FRET)を生じうる蛍光ドナー物質及びアクセプター物質、生物発光共鳴エネルギー転移(BRET)を生じうる発光ドナー物質及びアクセプター物質とすることができる。標識断片化抗体及び認識断片化抗体のいずれもが、両者間でFRETを生じうる発光物質(即ち、蛍光物質)で標識された抗体であることがより好ましい。
【0077】
上述した蛍光共鳴エネルギー転移は、特表2007−523754[0158]〜[0161]、特表2001−519525[0025]にも示されているように周知であり、蛍光共鳴エネルギー転移のためのドナー及びアクセプターも種々市販されている。ドナー及びアクセプターとしては、両者間に蛍光共鳴エネルギー転移が起こる組み合わせであれば、いずれの組み合わせでも利用可能であり、文献等の情報、又は市販品から自由に選択できる。蛍光色素及び蛍光タンパク質からなる群より選択されたものを用いることできる。例えば、フルオレセイン誘導体、ローダミン誘導体、アミノクマリン誘導体、ヒドロキシクマリン誘導体、BODIPY誘導体、アントラセン誘導体、ベンゾフラン誘導体、ポルフィリン誘導体、Cy Dye、Alexa Fluor、ユーロピウムクリプテート、DyLight、HiLyte Fluor、Oyster、MegaStokes Dye、IRDye、QSY、DFP、YFP、GFP、BFPなどや特開2001−089482号公報記載のアザメチン化合物などを挙げることができる。
【0078】
本発明において蛍光共鳴エネルギー転移を利用する場合にはそれらの蛍光物質間でエネルギー転移が起こり、かつ安定なものが望ましく、CFP-YFP、Alexa Fluor555-Alexa Fluor 647、FITC-Alexa Fluor 555、HiLyte Fluor 555-Alexa Fluor 647、のような蛍光タンパク質又は蛍光色素の組み合わせを好ましく用いることができる。これらの組み合わせは蛍光タンパク質のみ、又は蛍光色素のみ、もしくは蛍光色素と蛍光タンパク質の組み合わせでもよく、これらの例に限定されない。蛍光発光の安定性の観点からはAlexa Fluor、HiLyte Flourが好ましく、さらにAlexa Fluorがより好ましい。
【0079】
なお、CFP−YFP間の蛍光共鳴エネルギー転移やGFP−BFP間、並びにこれらの改変体間の蛍光共鳴エネルギー転移においても広く知られており、これらの蛍光タンパク質は市販もされている。蛍光タンパク質を用いれば、標識する抗体等と連結させて一分子の融合タンパク質として生産でき、生細胞中で抗体を用いる場合には該融合タンパク質をコードする遺伝子を導入すればよいため、生細胞中で抗体を利用する場合には蛍光タンパク質が便利である。これらの蛍光タンパク質をコードする核酸も周知であり、それらを含むベクターも種々市販もされているので、所望のポリペプチドに蛍光タンパク質を融合させた蛍光標識タンパク質は、それらの市販のベクターを利用して容易に調製することができる。
【0080】
またBRETを生じ得る生物学的発光ドナー物質としては、例えば、ホタル(Photinus pyralis)ルシフェリン、ウミホタル(Cypridina)ルシフェリン、ウミシイタケ(Renilla reniformis)ルシフェリン、発光ミミズ(Diplocardia)ルシフェリン、ラチア(Latia neritoides)ルシフェリン、ホタルイカ(Wataseniae)ルシフェリンやバクテリアルシフェリン(還元型フラビンモノヌクレオチド)のような発光生物由来のルシフェリンの外、オワンクラゲ由来のエクオリンなどを用いることができる。アクセプター物質としては、上記のFRETでアクセプター物質として使用可能な蛍光タンパク質及び蛍光色素をそのまま利用することができる。
【0081】
FRET又はBRETによる発光認識・検知機構は、当業界では周知であり、例えば、生物物理 Vol.42(1), pp.28-31 (2002)に開示された方法を用いて検知することができる。この方法では、FRET又はBRETのドナー物質に励起光を照射又は酵素反応下に付すことによって得られた発光を測定、検知することにより、FRET又はBRETの有無を確認することができる。これにより、断片化抗体固定化担体上に固定化された抗体に対する抗原結合の有無を検出することができる。
【0082】
(3)断片化抗体固定化担体の製造方法
本発明における断片化抗体固定化担体の製造方法は、前述した標識断片化抗体の少なくとも1種及び認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の断片化抗体と、当該抗原とを接触させて、前記少なくとも2種断片化抗体と前記抗原とが結合した複合体を形成する形成工程と、前記複合体を、当該複合体中の断片化抗体を介して担体に固定化する固定化工程と、前記複合体から前記抗原を除去して、前記抗原に結合し得る位置で前記担体上に前記断片化抗体がそれぞれ固定化されている断片化抗体固定化担体を得る除去工程と、を含む。
この製造方法によれば、少なくとも2種の独立した断片化抗体と抗原とで構成された複合体を担体上に固定化した後に抗原を除去するので、抗原が存在する際にはそれぞれ抗原に結合し得る位置で、これらの断片化抗体が担体上に独立に固定化された本発明の断片化抗体固定化担体を容易に作製することができる。
本発明の製造方法によれば、担体と、少なくとも1セット(例えば、2以上のセット)の断片化抗体を含み、それぞれのセットの断片化抗体は上記のように担体上に固定された少なくとも2種の独立した断片化抗体を含む抗体断片固定化担体を得ることができる。
【0083】
複合体を形成する形成工程では、断片化抗体と抗原からなる複合体は、公知の手法により形成することができ、具体的には、上述した断片化抗体と抗原とを混合させることによって容易に得ることができる。
2種以上の断片化抗体と抗原との混合比は、抗原に対する結合形態に応じて適宜設定することができる。効率性と過剰な抗原が固定化されることを防ぐ観点から好ましくは、抗原の個数と、当該断片化抗体の組み合わせで構成される分子の結合価との比は、0.1:1〜10:1である。
【0084】
また、断片化抗体と抗原との混合比は、断片化抗体の抗原に対するアフィニティーや、抗原そのものの担体へ直接的な固定しやすさ等に応じて適宜調整が可能である。充分なアフィニティーが予想される抗原である場合には、一般に、抗原の個数と、当該断片化抗体の組み合わせで構成される分子の結合価との比は、0.1:1〜1:1とすることがより好ましく、0.1:1〜0.2:1であることが更に好ましい。一方、アフィニティーが一般的に低い又は担体へ直接的に固定化され難いと予想される抗原、例えば低分子化合物等を抗原とする場合には、抗原の量を多くすることがより好ましく、例えば抗原の個数と、当該断片化抗体の組み合わせで構成される分子の結合価との比は0.5:1〜5:1とすることが更に好ましい。
【0085】
ここで、断片化抗体の組み合わせで構成される分子の結合価とは、断片化抗体の組み合わせで構成された分子が有する抗原結合部位の数を意味する。即ち、断片化抗体が組み合わされることにより構成された分子が抗体分子そのものである場合には、抗体分子の結合価と一致し、断片化抗体の組み合わされることにより構成された分子が完全な抗体分子を構成しない場合であっても、抗原結合部位が1存在すれば1価となる。
【0086】
このとき、抗原は低分子でもタンパク質等の高分子でもよい。また、複合体の形成分子数はいくつでもよいが、量比の制御を容易にする観点から、複合体を形成する分子数は、2種の断片化抗体と1種の抗原のように、3分子数であることが好ましい。
【0087】
例えば、抗リゾチームVH領域ポリペプチド、抗リゾチームVL領域ポリペプチド及びリゾチームを用いた場合には、VH領域ポリペプチドとVL領域ポリペプチドとは、それぞれ1:1の関係で抗原と相互作用することから、VH領域ポリペプチドとVL領域ポリペプチドとは組み合わせて1の結合価を有する。従って、水溶液中において個数比で等量、すなわちVH領域ポリペプチドとVL領域ポリペプチドと抗原とを1:1:1の割合で混合することにより容易に複合体を得ることができる。リゾチームが直接担体に固定されて、断片化抗体に対する結合率が低下するのを防ぐために、抗原の個数比は、断片化抗体の結合価に対して少ないことが好ましく、VH領域ポリペプチドとVL領域ポリペプチドと抗原との混合比を10:10:1から10:10:9にすることがより好ましく、10:10:1から10:10:2にすることがさらに好ましい。
【0088】
また、標識断片化抗体と認識断片化抗体との量比は、上述したように結合価1の抗体分子を形成する観点から一般的には1:1としてもよく、抗原に対するアフィニティーに応じて適宜調整してもよい。例えば、標識後の断片化抗体の固定化効率の観点から、ドナー物質で標識化された標識断片化抗体と、アクセプター物質で標識化された認識断片化抗体との量比を15:1〜1:15とすることが好ましく、10:1〜1:10とすることがより好ましく、5:1〜1:5することがさらに好ましい。
【0089】
固定化工程では、上記の手法により形成された複合体を、担体に付与された官能基の種類に応じて適宜反応させ、担体へ結合することにより固定化を行う。このとき断片化抗体の抗原認識部位は、抗原が結合することにより保護されているので、特別な保護処理を別途行う必要がない。複合体の担体への結合方法は当業者に自明である。例えば、上述したEDC等でカルボキシル基を活性化しアミノ基を介して複合体を結合する方法や、マレイミド基−チオール基の反応により複合体を担体に結合させる方法があるが、本発明はこの方法に限定されない。
【0090】
固定化担体上に結合した断片化抗体の固定量(密度)については、本発明の断片化抗体固定化担体をバイオセンサーに使用する場合、標識断片化抗体と認識断片化抗体とが、これら両者間で発光の認識が可能な距離、例えば10nm程度又はそれ以下で存在する量(密度)で固定化されていればよい。断片化抗体の固定量としては、好ましくは、1×105個/mm3以上1×1018個/mm3以下とすることができ、より好ましくは1×109個/mm3以上1×1015個/mm3以下、さらに好ましくは、1×1010個/mm3以上1×1014個/mm3以下である。1×105個/mm3以上の固定量であれば、発光の測定が容易であり、1×1018個/mm3以下であれば蛍光物質間を適切な距離に保って良好なFRETのS/Nとすることができると共に製造コストの観点から、それぞれ好ましい。
【0091】
この密度は以下の方法により求めることができる。実際に測定を行って求める場合は、各断片化抗体を担体上に固定化後、被験物を洗浄し、標識断片化抗体の標識量と認識断片化抗体の発光認識量を測定し、AFMやエリプソメトリーにより膜厚を測定して、算出することにより求められる。標識断片化抗体上の発光物質と、認識断片化抗体上の発光認識物質が共に蛍光分子の場合、それぞれ蛍光量を蛍光量測定装置で測定し、固定前の既知の蛍光分子標識率から固定された分子の数を求めて、固定化された分子の測定体積から固定密度を算出できる。
【0092】
除去工程では、複合体を担体上に固定化後、抗原が除去される。このとき、断片化抗体はそれぞれ独立に担体上に固定化されているので、抗原を容易に除去することができ、固定化担体として使用したときの抗原との結合再現性を低下させることがない。
抗原の除去は、適当な洗浄液を用いることにより容易に行うことができる。ここで用いられる洗浄液は、複合体中の抗原と各断片化抗体との結合力を低下させるものであればよい。このような結合力の低下の条件としては、pHを酸性側又はアルカリ側へ変更することや、塩濃度を高くすることなどを上げることができる。断片化抗体及び抗原の種類等によって異なるが、例えば、pHを2以下又は10以上にするための酸性グリシンバッファーやアルカリ性のNaOH溶液や、0.5M以上の塩濃度とするためのホウ酸塩バッファーを挙げることができる。
他にもアルギニン含有酸性バッファーや、グアニジン、尿素含有バッファー等を適宜用いることが可能である。
【0093】
ここで、洗浄液による洗浄処理の条件は、適宜調整することができるが、断片化抗体の活性を損なわない観点から、一般に10分以下、好ましくは、1分以下とすることができる。再現性の観点から5秒以上が好ましい。
【0094】
これにより、担体上に断片化抗体が、1つのセット中の断片化抗体が同じ抗原に結合し得る位置で、それぞれ独立に固定化された断片化抗体固定化担体を得ることができる。本断片化抗体固定化担体では、断片化抗体は、抗原と結合可能な状態でかつ自由度を持って独立して担体上に固定化されている。即ち、1つのセット中の標識断片化抗体と認識断片化抗体とは、抗原と結合した場合と同一の位置関係で互いに担体上に固定化されている。また、各断片化抗体の一部で担体と結合し、抗原認識部位が存在する先端部が自由に移動していてもよく、1つのセット中の断片化抗体が1の抗原と結合可能であれば、断片化抗体が結合する担体上の位置(結合点)の位置や結合点を有する担体の種類(例えば、親水性ポリマーの種類)に応じて、固定化後の断片化抗体全体が自由に移動可能であってもよい。
このため、抗原が接近して結合可能な状態になると、断片化抗体は互いに接近して抗原と結合する。本発明では、このとき断片化抗体に標識されている発光物質と発光を認識する認識物質間の相互作用を測定することにより、抗原濃度を迅速に測定でき、かつ再利用可能な断片化抗体固定化担体を簡便に得ることができる。
【0095】
例えば、図1には、本発明の断片化抗体固定化担体の一例となる固定化担体10が示されている。固定化担体10には、自己組織化膜14及びポリマー層16を介して、担体12上に、断片化抗体18A、断片化抗体18Cがそれぞれ、その一端でかつ互いに独立して固定化されている。断片化抗体18Aは、発光物質18Bによる標識部位を有しており、一方、断片化抗体18Cは、発光認識部位18Dを有している。断片化抗体18Aと断片化抗体18Cの相対位置は、抗原Agが存在するときに協働して抗原Agに結合可能な位置関係となっており、それぞれ一端が担体12に固定され且つ他端が自由に動くように、担体12上に独立して固定化されている(図1(A)参照)。
このとき、抗原Agが固定化担体10に接近すると、断片化抗体18A、断片化抗体18Cは、抗原Agを認識して結合する。結合時には、断片化抗体18Aと断片化抗体18Cは抗原を中心にして互いに接近し、結合するため、断片化抗体18A上の発光物質18Bと断片化抗体18C上の発光認識部位18Dとが接近して相互作用し、この相互作用に起因した変化を測定することにより、抗原検出を行うことができる(図1(B)参照)。
【0096】
このように、2つ以上の断片化抗体と1つ以上の抗原からなる複合体を、該2つ以上の断片化抗体を介して担体に固定し、抗原のみ取り外す、という操作を行うと、抗原抗体反応を利用した免疫測定法に使用することができる断片化抗体固定化担体を得ることができる。
なお、このように断片化抗体が独立して担体に固定化されるので、個々の断片化抗体同士のアフィニティーが弱い場合には互いに結合せず、容易に独立して動くので、抗原結合時における形態変化が起こりやすくなる。この形態変化は蛍光エネルギー転移効率を高めることにつながる。個々の断片化抗体同士のアフィニティーは解離定数(Kd)が10−12から108が好ましく、10−7から108がより好ましく、10−5から10−1がさらに好ましい。
【0097】
(II)本発明の断片化抗体固定化担体の適用
本発明の断片化抗体固定化担体は、断片化抗体と抗原との結合反応性に基づくバイオセンサーやバイオリアクター(例えば「バイオリアクター技術」、1988年、(株)シーエムシー、「バイオチップとバイオセンサー」、2006年、共立出版(株))に適用することができる。バイオリアクターとは、酵素、菌体、細胞、オルガネラなどの生体触媒による生化学的反応を利用して、有用物質の生産、エネルギーの発生、環境汚染物質の分解などに応用する反応器であり、バイオセンサーとは最も広義に解釈され、生体分子間の相互作用を電気的信号等の信号に変換して、対象となる物質を測定・検出するセンサーを意味する。以下、それぞれについての適用について説明する。
【0098】
(1)バイオリアクターへの適用
酵素を固定化した不溶性担体を用いて有用物質の生成、反応等を行うことが可能なバイオリアクター(例えば実公平4−18398号、実公平4−18399号等)においては、上記不溶性担体として、本発明の担体、例えば担体(例えばセラミックやポリスルホン等の多孔質体)と、この担体表面上に結合された高分子膜と、この高分子膜に結合された酵素と酵素活性補助物質とを備えた担体に適用することができる。
【0099】
(2)バイオセンサーへの適用
通常のバイオセンサーは、検出対象とする化学物質を認識するレセプター部位と、そこに発生する物理的変化又は化学的変化を電気信号に変換するトランスデューサー部位とから構成される。生体内には、互いに親和性のある物質の組み合わせとして、酵素/基質、酵素/補酵素、抗原/抗体、ホルモン/レセプターなどがある。バイオセンサーでは、これら互いに親和性のある物質の一方を担体に固定化して分子認識物質として用いることによって、対応させるもう一方の物質を選択的に計測するという原理を利用している。本発明の担体、例えば担体(例えばセラミックやポリスルホン等の多孔質体)と、この担体表面上に結合された高分子膜と、この高分子膜に結合された2種類の断片化抗体を備えた担体に適用することで従来のバイオセンサーよりも迅速かつ再利用可能であり、さらに汎用性をもたせることができる。
以下に本発明の断片化抗体固定化担体についての実施例を示す。なお、特に断わらない限り、「部」、「%」は、それぞれ「質量部」、「質量%」を表す。
【実施例】
【0100】
[実施例1]
(1)抗リゾチームVH領域ポリペプチド、抗リゾチームVL領域ポリペプチドの作製
以下の実施例で使われる略語は以下の通りである。
LB:1%バクト(登録商標、以下同じ)トリプトン、0.5%イーストエクストラクト、0.5%NaClを含む培地
LBA:100μg/mlアンピシリンを含むLB
LBAG:100μg/mlアンピシリン及び0.1%グルコースを含むLB
LBAGプレート:100μg/mlアンピシリン及び0.1%グルコースを含むLB寒天培地
SOC:2%バクトトリプトン、0.5%イーストエクストラクト、0.05% NaCl、2.5mM KCl、20mMグルコース、10mM MgCl2を含む培地
PBS:137mM NaClと2.7mM KClを含む10mM phosphate buffer(pH7.2)
5% IBPBS:5%(v/v)イムノブロック(大日本住友製薬,大阪)を含むPBS
20% IBPBS:20%(v/v)イムノブロックを含むPBS
PBST:0.1% Triton−X100を含むPBS
TAEバッファー:1mM EDTAを含む40mMTris−acetate(pH8.3)
TALONバッファー:300mM NaClを含む50mMリン酸ナトリウム(pH7.0)
TALON溶出液:500mMイミダゾールを含むTALONバッファー(pH7.0)
IPTG:イソプロピル−β−チオガラクトピラノシド
HBS−Nバッファー(10mM HEPES,150mM NaCl、pH7.4)
【0101】
すべての実験において、Milli-Q (Millipore Co., Billerica, MA)にて精製した水を用いた。以下、milliQ水と表記する。通常の試薬は特に表記のあるもの以外は、シグマ(St. Louis, MO)、ナカライテスク(京都)、和光純薬(大阪)、関東化学(東京)のものを使用した。オリゴDNAはテキサスジェノミクスジャパン(東京)、またはInvitrogen(東京)にて合成した。
【0102】
使用した大腸菌XL10−Gold及びOverExpress C41の遺伝子型を表1に、PCRに用いたプライマー配列を表2に示す。
【0103】
【表1】

【0104】
【表2】

【0105】
(A)発現プラスミドのコンストラクション
(a)実験に使用したベクター
pET-MBPp-His6: ヒスチジン6残基のHis-Tag(His6)が付加されたマルトース結合蛋白質(MBP)の遺伝子が挿入されたpET15bベクター(Merck Chemicals Ltd., Darmstadt, Germany)。(配列番号7)
pIT2-LxE16: 東京大学大学院工学系研究科化学生命工学専攻蛋白質工学研究室で単離された抗ニワトリ卵白リゾチーム(HEL)抗体LxE16の一本鎖抗体(scFv)遺伝子(配列番号8、アミノ酸:配列番号9)が挿入されたpIT2 ベクター(MRC Cambridge, UKより提供)。
【0106】
(b)発現ベクター作製の概略
抗リゾチーム抗体LxE16の重鎖及び軽鎖の可変領域ドメインであるVH(HEL)とVL(HEL)のN末端側及びC末端側に、それぞれMBPとヒスチジン10残基のHis-tag(His10)が融合した蛋白質MBP-VH(HEL)-His10及びMBP-VL(HEL)-His10をコードする発現ベクター(pET-MBPp-VH(HEL)-His10、pET-MBPp-VL(HEL)-His10)は、図2のスキームに示す通り、pET-MBPp-His6を元に作成された。まずpET-MBPp- His6のHis6を含むDNA断片(1)を切り出し、そこにHis10をコードするDNA断片(2)を挿入してpET-MBPp-His10を作成した。さらにpET-MBPp-His10に、VH(HEL)遺伝子(配列番号10、表3)もしくはVL(HEL)遺伝子(配列番号11、表4)を挿入することで、pET-MBPp-VH(HEL)-His10及びpET-MBPp-VL(HEL)-His10を完成させた。
【0107】
【表3】

【0108】
【表4】

【0109】
(b)pET-MBPp-His6からのDNA断片(1)の切り出し
約10μgのpET-MBPp-His6を含む74μlの水溶液に、3μl Sca I (Roche Applied Science, Basel, Switzerland, 10 U)、3μl Not I (Roche Applied Science 10 U)、10μl 10x BSA溶液、10μl 10x Hバッファー(Roche Applied Science)を添加し、37℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、4100bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up System (Promega Co., Madison, WI)を用いて抽出し、50μlのmilliQ水に溶解した。
【0110】
(c)DNA断片(2)の作製
pET-MBPp-His6を鋳型として、プライマー(1)(配列番号1)とプライマー(2)(配列番号2)を用いてPCRを行った。プライマー(1)は、His6をコードする領域の下流側にアニールサイトを持ち、ヒスチジン10残基に対応する塩基配列と、NotIサイトを有するリバースプライマーである。またプライマー(2)は、pETベクター上に存在するScaIサイトの約500塩基下流にアニールサイトを持つフォワードプライマーである。
PCRの条件は、以下の通りである。
【0111】
反応液組成
pET-MBPp-His6 (約100μg/ml) 0.5μl
プライマー(1)(50μM) 0.5μl
プライマー(2)(50μM) 0.5μl
10x Pfu buffer (Mg2+20 mM) (Agilent Technologies, Inc. Santa Clara, CA)
5μl
dNTP Mixture (2.5mM each) 4μl
2.5 U/μl Pfu DNA polymerase (Agilent Technologies, Inc.)
0.5μl
milliQ 水 39μl
【0112】
反応サイクル
1. 94℃ 1 min
2. 94℃ 30 sec
3. 58℃ 30 sec
4. 72℃ 30 sec
(2から4を25回)
5. 72℃ 10 min
6. 16℃ ∞
【0113】
PCR産物は、Wizard SV Gel and PCR Clean-Up Systemを用いて精製し、50μlのmilliQ水に溶解し、1μl Sca I (Roche Applied Science 10 U)、1 μl Not I (Roche Applied Science 10 U)、7μl 10x BSA溶液、7μl 10x Hバッファー(Roche Applied Science)、4μl milliQ水を添加し、37℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、約1080bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up Systemを用いて抽出し、50μlのmilliQ水に溶解して、DNA断片(2)を含む溶液を得た。
【0114】
(d)pET-MBPp-His10の作製
DNA断片(1)を切除したpET-MBPp-His6を含む溶液とDNA断片(2)溶液は、それぞれ0.5μlと5μlずつ混合し、さらに5.5μlのDNA Ligation high ver2溶液(TOYOBO CO., LTD, 大阪)を加えて、16℃30分間ライゲーション反応を行った。約1μlのライゲーション反応液を、約50μlの大腸菌XL10-Goldケミカルコンピテントセルに加えて形質転換した。形質転換株をLBAG寒天培地にて37℃一晩培養し、シングルコロニーをLBAG 50mlにてさらに一晩培養した菌体よりWizard Plus Minipreps DNA Purification kit (Promega Co.)にてプラスミドDNAを抽出し、pET-MBPp-His10を得た。His10をコードするDNA配列は、Beckman Coulter社のプロトコールに従って確認した。
【0115】
(e)pET-MBPp-His10の制限酵素処理
約7μgのpET-MBPp-His10を含む46μlの水溶液に、2μl Sfi I (Roche Applied Science 10 U/μl)、6μl 10x BSA溶液、6μl 10x Mバッファー(Roche Applied Science)を添加し、50℃で約3時間静置した。Wizard SV Gel and PCR Clean-Up Systemを用いて精製後、50μlの水溶液に溶解し、2μl Not I (Roche Applied Science 10 U)、7μl 10x BSA溶液、7μl 10x Hバッファー(Roche Applied Science)、4μl milliQ水を添加し、37℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、4800bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up Systemを用いて抽出し、50μlのmilliQ水に溶解した。
【0116】
(f)VH(HEL)遺伝子断片の作製
pIT2-LxE16を鋳型として、プライマー(3)及び(4)を用いてPCRを行い、VH(HEL)遺伝子断片を増幅した。プライマー(3)は、VH(HEL)遺伝子断片の5’側にアニールサイトを持ち、SfiIサイトを有するリバースプライマーである。またプライマー(4)は、VH(HEL)遺伝子断片の3’側にアニールサイトを持ち、NotIサイトを有するフォワードプライマーである。
PCRの条件は、以下の通りである。
【0117】
反応液組成
pIT2-LxE16 (約100 μg/ml) 0.5μl
プライマー(3)(50 μM) 0.5μl
プライマー(4)(50 μM) 0.5μl
10x Pfu buffer (Mg2+20 mM) (Agilent Technologies, Inc.) 5μl
dNTP Mixture (2.5 mM each) 4μl
2.5 U/μl Pfu DNA polymerase (Agilent Technologies, Inc.) 0.5μl
milliQ 水 39μl
【0118】
反応サイクル
1. 94℃ 1 min
2. 94℃ 30 sec
3. 58℃ 30 sec
4. 72℃ 30 sec
(2から4を25回)
5. 72℃ 10 min
6. 16℃ ∞
【0119】
PCR産物は、Wizard SV Gel and PCR Clean-Up Systemを用いて精製し、50μlのmilliQ水に溶解し、2μl Sfi I (Roche Applied Science 10 U/μl)、7μl 10x BSA溶液、7μl 10x Mバッファー(Roche Applied Science)、4μl milliQ水を添加し、50℃で約3時間静置した。Wizard SV Gel and PCR Clean-Up Systemを用いて精製後、50μlの水溶液に溶解し、2μl Not I (Roche Applied Science 10 U)、7μl 10x BSA溶液、7μl 10x Hバッファー(Roche Applied Science)、4μl milliQ水を添加し、37℃で約3時間静置した。その後、Wizard SV Gel and PCR Clean-Up Systemを用いて精製し、50μlのmilliQ水に溶解して、VH(LxE16)遺伝子断片を含む溶液(VH(LxE16)溶液)を得た。
【0120】
(g)VL(HEL)遺伝子断片の作製
pIT2-LxE16を鋳型として、プライマー(5)及び(6)を用いてPCRを行い、VL(HEL)遺伝子断片を増幅した。プライマー(5)は、VL(HEL)遺伝子断片の5’側にアニールサイトを持ち、SfiIサイトを有するリバースプライマーである。またプライマー(6)は、VL(HEL)遺伝子断片の3’側にアニールサイトを持ち、NotIサイトを有するフォワードプライマーである。PCRや制限酵素処理、精製を、VH(LxE16)遺伝子断片の場合と同様に行い、VL(LxE16)遺伝子断片を含む溶液(VL(LxE16)溶液)を得た。
【0121】
(h)pET-MBPp-VH(HEL)-His10及びpET-MBPp-VL(HEL)-His10の作製
制限酵素処理pET-MBPp-His10を含む溶液とVH(LxE16)溶液もしくはVL(LxE16)溶液は、それぞれ0.5μlと5μlずつ混合し、さらに5.5μlのDNA Ligation high ver2(TOYOBO CO.)を加えて、16℃30分間ライゲーション反応を行った。約1μlのライゲーション反応液を、約50μlの大腸菌XL10-Goldケミカルコンピテントセルに加えて形質転換し、形質転換株をLBAG寒天培地にて37℃一晩培養し、さらにシングルコロニーをLBAG 50mlにてさらに一晩培養した菌体よりWizard Plus Midipreps DNA Purification kit (Promega Co.)にてプラスミドDNAを抽出した。pET-MBPp-VH(HEL)-His10及びpET-MBPp-VL(HEL)-His10のDNA配列は、Beckman Coulter社のプロトコールに従って確認した。
【0122】
(B)MBP-VH(HEL)-His10及びMBP-VL(HEL)-His10蛋白質の調製
プラスミドpET-MBPp-VH(HEL)-His10及びpET-MBPp-VL(HEL)-His10を大腸菌OverExpress C41(DE3)にヒートショック法で形質転換し、発現させた。プラスミド1μl(約100ng)とOverExpress C41(DE3)コンピテントセル100μlを混合し氷上30min静置した後、42℃45秒ヒートショックしすぐに2分氷上静置した。その後、SOC培地200μlを加え30分キュアリングし、LBAプレートに塗布して37℃で一晩培養した。
【0123】
生じたコロニーを4mlのLBAGに植菌し、30℃で一晩振とう培養を行った。少量培養した培養液4mlを800mlのLBAに加え、30℃で振とうし大量培養を行った。O.D.600が0.5〜0.6になったところで1000mMのIPTG 400μlを加え、さらに30℃で一晩時間振とう培養した。菌体培養液を遠心分離機でそれぞれ上清と大腸菌のペレットに分離した後、上清からは硫安沈殿法で、ペレットからは超音波菌体破砕で、それぞれ下記のMBP-VH(HEL)-His10(配列番号12、表5)及びMBP-VL(HEL)-His10(配列番号13、表6)を以下のように回収した。
【0124】
【表5】

【0125】
【表6】

【0126】
約800mlの培養上清に硫安344gを加えて、4℃で一晩攪拌した後、遠心分離によってMBP-VH(HEL)-His10もしくはMBP-VL(HEL)-His10を含む不溶物を回収し、30mlのTALONバッファーに懸濁した。一方、大腸菌ペレットは、30mlのTALONバッファーに懸濁後、超音波処理を行い、遠心分離によってMBP-VH(HEL)-His10もしくはMBP-VL(HEL)-His10を含む上清を回収した。上清はTALONバッファーに対して透析した。それぞれのTALONバッファー中に回収した蛋白質を、TALON affinity resin (Clontech Laboratories, Inc., Mountain View, CA) を充填したカラム(直径16mmx高さ約15mm)に添加し、蛋白質の吸着したTALON affinity resinは TALONバッファーで洗浄した。その後、TALON溶出液を加えて、MBP-VH(HEL)-His10もしくはMBP-VL(HEL)-His10を溶出させた。精製蛋白質は、SDS-PAGEより確認を行った後に、HBS-Nにバッファー交換し終濃度16%となるようにグリセロールを加えて−80℃にて保存した。
【0127】
(C)VL(HEL)-His10の作製
精製した1mlのMBP-VL(HEL)-His10溶液(HBS-N、約1000μg/ml)に対して、20μlのGenenase溶液(New England BioLabs, Inc., Ipswich, MA)を加えて、室温にて約5時間反応を行った。反応後、上記と同様にTALON affinity resinを用いてVL(HEL)-His10を精製し、HBS−Nにバッファー交換した。
【0128】
(D)Alexa Fluor 555標識MBP-VH(HEL)-His10の作製
上記で得たMBP-VH(HEL)-His10溶液(HBS−N、約430μg/ml)440μLをAlexa Fluor(登録商標) 555(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0129】
(E)Alexa Fluor 647標識VL(HEL)-His10の作製
上記で得たVL(HEL)-His10溶液(HBS-N、約1679μg/ml)27μLをAlexa Fluor(登録商標) 647(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0130】
(2)カルボキシル基を付与した担体の作製
(A)担体の洗浄
UV照射した松浪硝子工業社製のスライドグラスをアセトンに浸漬し、5分間超音波洗浄した。その後、アセトンからスライドグラスを取り出し、純水で洗浄した。
【0131】
(B)アミノ(APS)基の付与
100mlのガラスバイアルにエタノール72mlと純水8mlを混合し、60℃で15分間程度、恒温槽(アズワン社製)で加温し、エタノールと純水の混合溶液を温めた。温めたエタノールと純水の混合溶液に、APS(γ−アミノプロピルトリエトキシシラン、東京化成工業製)を80μl混合し(0.1% v/v)溶解した。この溶液に、洗浄したスライドグラスを浸漬し、恒温槽(アズワン社製)内で60℃、15分間反応させることで、アミノ基が付与されたスライドグラスを得た。反応終了後のスライドグラスを取り出し、エタノール:純水=9:1の溶液に浸漬し、取り出す、という工程により洗浄を行った。この洗浄工程を3度行った。洗浄後のスライドグラスを窒素ブローし、120℃で1時間ベーキングした。ベーキング後のスライドグラスは、エタノール、純水の順に、浸漬洗浄を行った。
【0132】
(C)CMDの活性エステル化
超純水に0.5質量%となるようにCMD(カルボキシメチルデキストラン、名糖産業製:分子量100万)を溶解した後、全量反応した場合にカルボキシル基の2%が活性化される計算量の0.4MのEDC(1−(3−Dimethylaminopropyl)−3−ethylcarbodiimide)および0.1MのNHS(N−Hydroxysuccinimide)混合溶液を加え、室温で5分間攪拌した。
【0133】
(D)CMD膜の作製
上記アミノ基を形成したガラス基板上に、活性エステル化したCMD溶液を滴下し30秒後に除去することで、アミノ基を有する担体上に活性エステル化されたカルボキシメチルデキストラン薄膜を形成させた。室温で1時間反応させた後、0.1N NaOHで1回、超純水で1回洗浄した。
【0134】
(3)複合体の作製
上記で作製したAlexa Fluor 555標識MBP-VH(HEL)-His10、Alexa Fluor 647標識VL(HEL)-His10及びリゾチームを1:1:1の個数比で混合し、1.5μMのHEPESバッファー溶液を作製し、室温に3時間静置して、複合体試料液を作製した。
【0135】
(4)複合体の固定
作製したCMDガラス基板を、Biacore社製の表面プラズモン共鳴装置であるBiacore3000のsurface prep unitにセットした。Surface prep unitを用いて、10μl/minの流速下において、ガラス基板に0.2mMのEDCと0.04mMのNHS混合水溶液を70μl添加した。その後、上記複合体試料液をpH4.5アセテートバッファーで半分に希釈した希釈後の複合体試料液30μlをCMDガラス基板に供給し、その後、エタノールアミン溶液によってブロッキング処理を施して、固定化を行った。
【0136】
(5)抗原の洗浄
複合体を固定化後、pH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、本実施例の固定化担体Aを得た。洗浄後の試料をFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
【0137】
(6)抗原による蛍光量変化評価
上記で得られた固体化担体Aに、1μMのリゾチームを1分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。この得られた570nm付近の発光と675nm付近の発光の強度比を(5)で得られた570nm付近の発光と675nm付近の発光の強度比で除して、リゾチーム添加前後での発光強度比変化を求めた。
【0138】
[実施例2]
実施例1で使用した固定化担体AをpH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、固定化担体Bを得た。
再度、固定化担体BをFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
その後、1μMのリゾチームを1分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0139】
[実施例3]
複合体の作製において、Alexa Fluor 555標識MBP-VH(HEL)-His10、Alexa Fluor 647標識VL(HEL)-His10及びリゾチームの混合比を10:10:1にした以外は実施例1と同様にして、固定化担体Cを得た。実施例1と同様にして固定化担体Cにおけるリゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0140】
[比較例1]
複合体の作製において、Alexa Fluor 555標識MBP-VH(HEL)-His10、Alexa Fluor 647標識VL(HEL)-His10を交互に同濃度、同時間添加した以外は実施例1と同様にして、固定化担体Dを得た。実施例1と同様にして固定化担体Dにおけるリゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0141】
リゾチーム添加前後の蛍光量変化率算出
実施例1〜3及び比較例1の結果について、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比から強度比変化率を算出して、比較した。結果を表7に示す。
【0142】
【表7】

【0143】
表7から明らかなように断片化抗体と抗原との複合体を形成させないで作製され、担体上の断片化抗体の位置が制御されていない固定化担体(比較例1)では強度比変化率の変化を観測できなかったのに比べ、実施例1、2、3のものでは、蛍光強度比変化率が増加しており、断片化抗体が、蛍光共鳴エネルギー転移が起こり得る近距離にあることを示唆している。これにより、本発明によれば、3者以上での複合体反応が効率よく検出可能であり、検出感度や精度を高くすることができる。
【0144】
また、実施例3の結果から、抗リゾチームVH領域ポリペプチド、抗リゾチームVL領域ポリペプチド、リゾチームの混合比が10:10:1にしたものでも実施例1とほぼ同等の値になっており、混合比が等量でなくとも複合体を効率よく形成することができる。
【0145】
なお、実施例と比較例では、同じ濃度のリゾチームを添加した前後での強度比変化率の差が、数値上では5%程度の差となっているが、比較例(固定化担体D)においては、リゾチームの濃度が1000倍(1mM)であっても検出はできなかった(データ示さず)。このことは、比較例の固定化基板では被検物の検出が不能であるのに対して、本実施例にかかる固定化担体では、蛍光共鳴エネルギー転移を固相に適用して被験物を検出可能であることを示している。
【0146】
[実施例4]
(1)HiLyte Fluor 555標識MBP-VL(HEL)-His10の作製
上記で得たMBP-VL(HEL)-His10溶液(HBS−N、約796μg/ml)100μLをHiLyte Fluor(登録商標) 555(同仁化学社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0147】
(2)Alexa Fluor 647標識MBP-VH(HEL)-His10の作製
上記で得たMBP-VH(HEL)-His10溶液(HBS-N、約150μg/ml)300μLをAlexa Fluor(登録商標) 647(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
上記で作製したHiLyte Fluor 555標識MBP-VL(HEL)-His10、Alexa Fluor 647標識MBP-VH(HEL)-His10及びリゾチームを10:10:2の個数比で混合した以外は、実施例1と同様にして、本実施例の固定化担体Eを得た。その後、実施例1と同様にして、1μMのリゾチームを10分間添加した前後の570nm付近の発光と675nm付近の発光の強度変化率を求めた。
【0148】
[実施例5]
実施例4で使用した固定化担体EをpH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、固定化担体Fを得た。再度、固定化担体FをFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
その後、1μMのリゾチームを10分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0149】
[実施例6]
実施例5で使用した固定化担体FをpH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、固定化担体Gを得た。再度、固定化担体GをFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
その後、100nMのリゾチームを10分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0150】
[比較例2]
複合体の固定において、HiLyte Fluor 555標識MBP-VL(HEL)-His10、Alexa Fluor 647標識MBP-VH(HEL)-His10を交互に同濃度、同時間添加した以外は実施例4と同様にして、固定化担体Hを得た。実施例4と同様にして固定化担体Hにおけるリゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度変化率を求めた。
【0151】
リゾチーム添加前後の蛍光量変化率算出
実施例4〜6及び比較例2の結果について、リゾチーム添加前後での570nm付近の発光と675nm付近の発光の強度比変化率を算出して、比較した。結果を表8に示す。
【0152】
【表8】

【0153】
表8から明らかなようにドナーであるHiLyte fluor 555をMBP-VL、アクセプターであるAlexa fluor 647をMBP-VHに標識しても、本発明にかかる固定化担体を作製することが可能であった。このことから、MBP-VH、MBP-VLのどちらにドナー又はアクセプター色素を標識しても同様に測定が可能であることが分かる。
また、実施例5,6より本発明にかかる固定化担体は、洗浄後においても繰り返し抗原検出可能であり、抗原濃度依存的に発光強度比が変化することから、抗原濃度を定量することも可能である。
さらに、本発明にかかる固定化担体は、MBP-VH(HEL)-His10、MBP-VL(HEL)-His10 のいずれをMBP融合体としても、また双方をMBP融合体としても、同様に測定可能であり、MBP融合体であることに拘わらず測定可能であることが分かる。
【0154】
[実施例7]
(1) 抗オステオカルシン(BGP)VH領域ポリペプチド(VH(BGP))とMBPとの融合蛋白質(MBP-VH(BGP))、抗BGP VL領域ポリペプチドとMBPとの融合蛋白質(MBP-VL(BGP))の作製
以下の実施例で使われる略語は以下の通りである。
LB:実施例1で用いたものと同一
LBA:実施例1で用いたものと同一
LBAG:実施例1で用いたものと同一
LBAプレート:実施例1で用いたものと同一
SOC:実施例1で用いたものと同一
PBS:137mM NaClと2.7mM KClを含む10mM phosphate buffer(pH7.2)
5% IBPBS:5%(v/v)イムノブロック(大日本住友製薬,大阪)を含むPBS
20% IBPBS:20%(v/v)イムノブロックを含むPBS
PBST:0.1% Triton−X100を含むPBS
TAEバッファー:実施例1で用いたものと同一
TALONバッファー:実施例1で用いたものと同一
TALON溶出液:実施例1で用いたものと同一
IPTG:実施例1で用いたものと同一
HBS−Nバッファー:実施例1で用いたものと同一
【0155】
実施例1〜6と同様に、すべての実験において、Milli-Q (Millipore Co., Billerica, MA)にて精製した水を用いた。以下、milliQ水と表記する。通常の試薬は特に表記のあるもの以外は、シグマ(St. Louis, MO)、ナカライテスク(京都)、和光純薬(大阪)、関東化学(東京)のものを使用した。オリゴDNAはテキサスジェノミクスジャパン(東京)、またはInvitrogen(東京)にて合成した。
【0156】
使用した大腸菌XL10−Gold及びOverExpress C41、HB2151の遺伝子型を表9に示す。
【0157】
【表9】

【0158】
(A)MBP-VH(BGP)発現プラスミドのコンストラクション
(a)実験に使用したベクター
pET-MBPp-His6: ヒスチジン6残基のHis-Tag(His6)が付加されたマルトース結合蛋白質(MBP)の遺伝子が挿入されたpET15bベクター(Merck Chemicals Ltd., Darmstadt, Germany)。(前述、配列番号7)
pIT2-VH(BGP): 抗BGP抗体のVH領域ポリペプチド(VH(BGP))遺伝子(配列番号14、表10、アミノ酸:配列番号15)が挿入されたpIT2ベクター。
pMAL-VL(BGP): 抗BGP抗体KTM219のVL領域ポリペプチドとMBPとの融合蛋白質(MBP-VL(BGP))の発現用ベクター (文献Lim et al. Anal.Chem. 79, 6193 (2007))
【0159】
【表10】

【0160】
(b)pET-MBPp-His6の制限酵素処理
約10μgのpET-MBPp-His6を含む77μlの水溶液に、3μl Not I (Roche Applied Science, Basel, Switzerland, 10 U)、10μl 10x BSA溶液、10μl 10x Hバッファー(Roche Applied Science)を添加し、37℃で約3時間静置した。その後、Wizard SV Gel and PCR Clean-Up System (Promega Co., Madison, WI)を用いて抽出し、50μlのmilliQ水に溶解し、3μl Sfi I (Roche Applied Science, 10 U)、7μl 10x BSA溶液、7μl 10xMバッファー(Roche Applied Science)を添加し、50℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、約4100bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up System (Promega Co.)を用いて抽出し、50μlのmilliQ水に溶解した。
【0161】
(c)pIT2-VH(BGP)からのVH(BGP)遺伝子断片の切り出し
約10μgのpIT2-VH(BGP)を含む77μlの水溶液に、3μl Not I (Roche Applied Science, 10 U)、10μl 10x BSA溶液、10μl 10x Hバッファー(Roche Applied Science)を添加し、37℃で約3時間静置した。その後、Wizard SV Gel and PCR Clean-Up System (Promega Co.)を用いて抽出し、50μlのmilliQ水に溶解し、3μl Sfi I (Roche Applied Science, 10 U)、7μl 10x BSA溶液、7μl 10xMバッファー(Roche Applied Science)を添加し、50℃で約3時間静置した。その後、1%アガロースゲル(TAEバッファー)で電気泳動した後、約450bp付近のバンドを切り出して、Wizard SV Gel and PCR Clean-Up System (Promega Co.)を用いて抽出し、50μlのmilliQ水に溶解した。
【0162】
(d)VH(BGP)のpET-MBPp-His6への組込み
上記で精製した制限酵素処理済pET-MBPp-His6とVH(BGP)遺伝子断片の溶液は、それぞれ0.5μlと5μlずつ混合し、さらに5.5μlのDNA Ligation high ver2溶液(TOYOBO CO., LTD, 大阪)を加えて、16℃30分間ライゲーション反応を行った。約1μlのライゲーション反応液を、約50μlの大腸菌XL10-Goldケミカルコンピテントセルに加えて形質転換した。形質転換株をLBAG寒天培地にて37℃一晩培養し、シングルコロニーをLBAG 50mlにてさらに一晩培養した菌体よりWizard Plus Minipreps DNA Purification kit (Promega Co.)にてプラスミドDNAを抽出し、pET-MBPp-VH(BGP)を得た。DNA配列は、Beckman Coulter社のプロトコールに従って確認した。
【0163】
(B)MBP-VH(BGP)及びMBP-VL(BGP)蛋白質の調製
プラスミドpET-MBPp-VH(BGP)及びpMAL-VL(BGP)を大腸菌OverExpress C41(DE3)にヒートショック法で形質転換し、発現させた。プラスミド1μl(約100ng)とOverExpress C41(DE3)コンピテントセル100μlを混合し氷上30min静置した後、42℃45秒ヒートショックしすぐに2分氷上静置した。その後、SOC培地200μlを加え30分キュアリングし、LBAプレートに塗布して37℃で一晩培養した。
【0164】
生じたコロニーを4mlのLBAGに植菌し、30℃で一晩振とう培養を行った。少量培養した培養液4mlを800mlのLBAに加え、30℃で振とうし大量培養を行った。O.D.が0.5〜0.6になったところで1000mMのIPTG 400μlを加え、さらに20℃で一晩時間振とう培養した。菌体培養液を遠心分離機でそれぞれ上清と大腸菌のペレットに分離した後、上清からは硫安沈殿法で、ペレットからは超音波菌体破砕で、それぞれ下記のMBP-VH(BGP)(配列番号16、表11)及びMBP-VL(BGP)(配列番号17、表12)を以下のように回収した。
【0165】
【表11】

【0166】
【表12】

【0167】
約800mlの培養上清に硫安344gを加えて、4℃で一晩攪拌した後、遠心分離によってMBP-VH(BGP)もしくはMBP-VL(BGP)を含む不溶物を回収し、30mlのTALONバッファーに懸濁した。一方、大腸菌ペレットは、30mlのTALONバッファーに懸濁後、超音波処理を行い、遠心分離によってMBP-VH(BGP)もしくはMBP-VL(BGP)を含む上清を回収した。上清はTALONバッファーに対して透析した。それぞれのTALONバッファー中に回収した蛋白質を、TALON affinity resin (Clontech Laboratories, Inc., Mountain View, CA) を充填したカラム(直径16mmx高さ約15mm)に添加し、蛋白質の吸着したTALON affinity resinは TALONバッファーで洗浄した。その後、TALON溶出液を加えて、MBP-VH(BGP)もしくはMBP-VL(BGP)を溶出させた。精製蛋白質は、SDS-PAGEより確認を行った後に、HBS-Nにバッファー交換し終濃度16%となるようにグリセロールを加えて−80℃にて保存した。
【0168】
(C)Alexa Fluor 555標識MBP-VH(BGP)の作製
上記で得たMBP-VH(BGP)溶液(HBS−N、約1.2mg/ml)100μLをAlexa Fluor(登録商標) 555(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0169】
(D)Alexa Fluor 647標識MBP-VL(BGP)の作成
上記で得たMBP-VL(BGP)溶液(HBS-N、約150μg/ml)430μLをAlexa Fluor(登録商標) 647(Molecular Probes社製)を用いて、標識した。この標識時のpHは7.0の条件下で行った。
【0170】
(2)カルボキシル基を付与した担体の作製
(A)担体の洗浄
UV照射した松浪硝子工業社製のスライドグラスをアセトンに浸漬し、5分間超音波洗浄した。その後、アセトンからスライドグラスを取り出し、純水で洗浄した。
【0171】
(B)アミノ(APS)基の付与
100mlのガラスバイアルにエタノール72mlと純水8mlを混合し、60℃で15分間程度、恒温槽(アズワン社製)で加温し、エタノールと純水の混合溶液を温めた。温めたエタノールと純水の混合溶液に、APS(γ−アミノプロピルトリエトキシシラン、東京化成工業製)を80μl混合し(0.1% v/v)溶解した。この溶液に、洗浄したスライドグラスを浸漬し、恒温槽(アズワン社製)内で60℃、15分間反応させることで、アミノ基が付与されたスライドグラスを得た。反応終了後のスライドグラスを取り出し、エタノール:純水=9:1の溶液に浸漬し、取り出す、という工程により洗浄を行った。この洗浄工程を3度行った。洗浄後のスライドグラスを窒素ブローし、120℃で1時間ベーキングした。ベーキング後のスライドグラスは、エタノール、純水の順に、浸漬洗浄を行った。
【0172】
(C)CMDの活性エステル化
超純水に0.5質量%となるようにCMD(カルボキシメチルデキストラン、名糖産業製:分子量100万)を溶解した後、全量反応した場合にカルボキシル基の2%が活性化される計算量の0.4MのEDC(1−(3−Dimethylaminopropyl)−3−ethylcarbodiimide)および0.1MのNHS(N−Hydroxysuccinimide)混合溶液を加え、室温で5分間攪拌した。
【0173】
(D)CMD膜の作製
上記アミノ基を形成した金膜上に、活性エステル化したCMD溶液を滴下し30秒後に除去することで、アミノ基を有する担体上に活性エステル化されたカルボキシメチルデキストラン薄膜を形成させた。室温で1時間反応させた後、0.1N NaOHで1回、超純水で1回洗浄した。
【0174】
(3)複合体の作製
上記で作製したAlexa Fluor 555標識MBP-VH(BGP)、Alexa Fluor 647標識MBP-VL(BGP)及びBGPのC末端アミノ酸断片(RRFYGPY:配列番号18、以下、断片化BGP)を4:1:4の個数比で混合し、Alexa Fluor 555標識MBP-VH(BGP)が2μMのHEPESバッファー溶液となるように作製し、室温に3時間静置して、複合体試料液を作製した。
【0175】
(4)複合体の固定
作製したCMDガラス基板をBiacore社製の表面プラズモン共鳴装置であるBiacore3000のsurface prep unitにセットした。Surface prep unitを用いて、10μl/minの流速下において、ガラス基板に0.2mMのEDCと0.04mMのNHS混合水溶液を70μl添加した。その後、上記複合体試料液をpH4.5アセテートバッファーで半分に希釈した希釈後の複合体試料液70μlをCMDガラス基板に供給し、その後、エタノールアミン溶液によってブロッキング処理を施して、固定化を行った。
【0176】
(5)抗原の洗浄
複合体の固定化後、pH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、本実施例の抗体固定化担体Iを得た。洗浄後の試料をFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
【0177】
(6)抗原による蛍光量変化評価
上記で得られた固体化担体Iに、100nMのBGPのC末端アミノ酸断片(RRFYGPY)を10分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。この得られた570nm付近の発光と675nm付近の発光の強度比を上記(5)で得られた570nm付近の発光と675nm付近の発光の強度比で除して、断片化BGPアミノ酸(RRFYGPY)添加前後での発光強度比の変化を求めた。
【0178】
[実施例8]
実施例7で使用した固定化担体IをpH1.5 グリシンバッファーと10mM NaOHにより1分間の洗浄を5回交互に繰り返して、抗原を除去し、固定化担体Jを得た。再度、固定化担体JをFLA−8000(富士フイルム社製)により蛍光測定し、570nm付近の発光と675nm付近の発光の強度比を求めた。
その後、1μMの断片化BGPアミノ酸(RRFYGPY)を10分間添加し、HEPESバッファー溶液で洗浄後、同様にFLA−8000で蛍光測定し、断片化BGPアミノ酸添加前後での570nm付近の発光と675nm付近の発光の強度比を求めた。
【0179】
[比較例3]
複合体の固定において、Alexa Fluor 555標識MBP-VH(BGP)、Alexa Fluor 647標識MBP-VL(BGP)を交互に同濃度、同時間添加した以外は実施例7と同様にして、固定化担体Kを得た。実施例7と同様にして、固定化担体Kにおける断片化BGPアミノ酸(RRFYGPY)添加前後での570nm付近の発光と675nm付近の発光の強度変化率を求めた。
【0180】
断片化BGPアミノ酸(RRFYGPY)添加前後の蛍光量変化率算出
実施例7〜8及び比較例3の結果について、断片化BGPアミノ酸(RRFYGPY)添加前後での570nm付近の発光と675nm付近の発光の強度比変化率を算出して、比較した。結果を表13に示す。
【0181】
【表13】

【0182】
表13から明らかなように本発明にかかる固定化担体を用いることで、低分子の抗原も検出することが可能であり、抗原の汎用性が非常に広いことが分かる。実施例7,8より本発明にかかる固定化担体は、低分子の抗原においても濃度依存的に発光強度比が変化することから、抗原濃度を定量可能である。
なお、固定化担体K(比較例3)について、リゾチームの時と同様に断片化BGPアミノ酸(RRFYGPY)濃度を10000倍(1mM)に増やしても検出はできなかった。(データ示さず)
【0183】
従って本発明によれば、短時間で精度よくかつ簡便に、目的とする分子を検出することができ、洗浄後も繰り返し使用可能な断片化抗体固定化担体を提供することができる。またリンカー設計等が必要ないことから、汎用性が高い製造方法も提供することができる。
【符号の説明】
【0184】
10 固定化担体
12 担体
14 自己組織化膜
16 ポリマー層
18A 断片化抗体
18B 発光物質
18C 断片化抗体
18D 発光認識部位
Ag 抗原
【特許請求の範囲】
【請求項1】
担体と、少なくとも1セットの断片化抗体を含み、
各セットの断片化抗体が、少なくとも2種の独立した断片化抗体を含み、
前記少なくとも2種の独立した断片化抗体が、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と、当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含み、
前記少なくとも1種の標識断片化抗体と前記少なくとも1種の認識断片化抗体が、1種の抗原を認識すると共に前記同じ抗原に結合可能な位置関係でそれぞれ独立に固定化されている断片化抗体固定化担体。
【請求項2】
前記少なくとも2種の断片化抗体が、VH領域ポリペプチドと、VL領域ポリペプチドである請求項1に記載の断片化抗体固定化担体。
【請求項3】
前記担体がポリマー層を有し、前記少なくとも2種の断片化抗体が該ポリマー層に固定化されている請求項1又は請求項2に記載の断片化抗体固定化担体。
【請求項4】
該ポリマー層の膜厚が1nm以上0.5mm以下である請求項3に記載の断片化抗体固定化担体。
【請求項5】
該ポリマー層が自己組織化膜を介して担体上に結合している請求項3又は請求項4に記載の断片化抗体固定化担体。
【請求項6】
該自己組織化膜の膜厚が0.2nm以上10μm以下である請求項5に記載の断片化抗体固定化担体。
【請求項7】
前記ポリマーが多糖類である請求項3ないし請求項6のいずれか1項に記載の断片化抗体固定化担体。
【請求項8】
前記発光物質が、蛍光色素及び蛍光タンパク質からなる群より選択されたものである請求項1ないし請求項7のいずれか1項記載の断片化抗体固定化担体。
【請求項9】
前記標識部位と前記認識部位との間で蛍光共鳴エネルギー転移反応が生じうる請求項1ないし請求項8のいずれか1項に記載の断片化抗体固定化担体。
【請求項10】
前記少なくとも2種の断片化抗体と前記抗原との結合反応に基づくバイオリアクター又はバイオセンサーに用いられる固定化担体である請求項1ないし請求項9のいずれか1項に記載の断片化抗体固定化担体。
【請求項11】
発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の独立した断片化抗体と、当該抗原とを接触させて、前記少なくとも2種の断片化抗体と前記抗原とが結合した複合体を形成する形成工程と、
前記複合体を、当該複合体中の断片化抗体を介して担体に固定化する固定化工程と、
前記複合体から前記抗原を除去して、前記抗原に結合し得る位置で前記担体上に前記断片化抗体がそれぞれ固定化されている断片化抗体固定化担体を得る除去工程と、
を含む断片化抗体固定化担体の製造方法。
【請求項12】
前記少なくとも2種の断片化抗体が、VH領域ポリペプチドと、VL領域ポリペプチドである請求項11に記載の断片化抗体固定化担体の製造方法。
【請求項13】
前記形成工程が、前記少なくとも2種の断片化抗体と前記抗原とを、当該断片化抗体単独又は組み合わせで構成される分子の結合価1に対して抗原0.1倍量から10倍量の個数比で混合することを含む請求項11又は請求項12記載の断片化抗体固定化担体の製造方法。
【請求項14】
前記除去工程が、複合体及び抗原の結合力を低下させる条件下で行われる請求項11ないし13のいずれか1項に記載の断片化抗体固定化担体の製造方法。
【請求項1】
担体と、少なくとも1セットの断片化抗体を含み、
各セットの断片化抗体が、少なくとも2種の独立した断片化抗体を含み、
前記少なくとも2種の独立した断片化抗体が、発光物質で標識された標識部位を有する少なくとも1種の標識断片化抗体と、当該標識断片化抗体からの発光を認識する認識部位を有する少なくとも1種の認識断片化抗体とを含み、
前記少なくとも1種の標識断片化抗体と前記少なくとも1種の認識断片化抗体が、1種の抗原を認識すると共に前記同じ抗原に結合可能な位置関係でそれぞれ独立に固定化されている断片化抗体固定化担体。
【請求項2】
前記少なくとも2種の断片化抗体が、VH領域ポリペプチドと、VL領域ポリペプチドである請求項1に記載の断片化抗体固定化担体。
【請求項3】
前記担体がポリマー層を有し、前記少なくとも2種の断片化抗体が該ポリマー層に固定化されている請求項1又は請求項2に記載の断片化抗体固定化担体。
【請求項4】
該ポリマー層の膜厚が1nm以上0.5mm以下である請求項3に記載の断片化抗体固定化担体。
【請求項5】
該ポリマー層が自己組織化膜を介して担体上に結合している請求項3又は請求項4に記載の断片化抗体固定化担体。
【請求項6】
該自己組織化膜の膜厚が0.2nm以上10μm以下である請求項5に記載の断片化抗体固定化担体。
【請求項7】
前記ポリマーが多糖類である請求項3ないし請求項6のいずれか1項に記載の断片化抗体固定化担体。
【請求項8】
前記発光物質が、蛍光色素及び蛍光タンパク質からなる群より選択されたものである請求項1ないし請求項7のいずれか1項記載の断片化抗体固定化担体。
【請求項9】
前記標識部位と前記認識部位との間で蛍光共鳴エネルギー転移反応が生じうる請求項1ないし請求項8のいずれか1項に記載の断片化抗体固定化担体。
【請求項10】
前記少なくとも2種の断片化抗体と前記抗原との結合反応に基づくバイオリアクター又はバイオセンサーに用いられる固定化担体である請求項1ないし請求項9のいずれか1項に記載の断片化抗体固定化担体。
【請求項11】
発光物質で標識された標識部位を有する標識断片化抗体の少なくとも1種及び当該標識断片化抗体からの発光を認識する認識部位を有する認識断片化抗体の少なくとも1種の組み合わせで1種の抗原を認識する少なくとも2種の独立した断片化抗体と、当該抗原とを接触させて、前記少なくとも2種の断片化抗体と前記抗原とが結合した複合体を形成する形成工程と、
前記複合体を、当該複合体中の断片化抗体を介して担体に固定化する固定化工程と、
前記複合体から前記抗原を除去して、前記抗原に結合し得る位置で前記担体上に前記断片化抗体がそれぞれ固定化されている断片化抗体固定化担体を得る除去工程と、
を含む断片化抗体固定化担体の製造方法。
【請求項12】
前記少なくとも2種の断片化抗体が、VH領域ポリペプチドと、VL領域ポリペプチドである請求項11に記載の断片化抗体固定化担体の製造方法。
【請求項13】
前記形成工程が、前記少なくとも2種の断片化抗体と前記抗原とを、当該断片化抗体単独又は組み合わせで構成される分子の結合価1に対して抗原0.1倍量から10倍量の個数比で混合することを含む請求項11又は請求項12記載の断片化抗体固定化担体の製造方法。
【請求項14】
前記除去工程が、複合体及び抗原の結合力を低下させる条件下で行われる請求項11ないし13のいずれか1項に記載の断片化抗体固定化担体の製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2010−286467(P2010−286467A)
【公開日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願番号】特願2009−274632(P2009−274632)
【出願日】平成21年12月2日(2009.12.2)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願日】平成21年12月2日(2009.12.2)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

