新規なプロテインA固定化担体の製造方法
【課題】
抗体アフィニティクロマトグラフィに用いられて抗体を吸着するプロテインA固定化担体に含まれるプロテインAが、IgG抗体を精製する場合に大量にリークすることを低減できるプロテインA固定化担体の製造方法を提供する。
【解決手段】
担体1と、リンカー前駆体10としての末端エポキシ基2を含むエポキシ基含有化合物とを、担体の比表面積あたりのエポキシ基含有化合物の量が1.5μmol/m2以上になるように反応させ、ついでジアミンを反応させてリンカー20とし、さらにプロテインAを担持させるプロテインA固定化担体を製造する。プロテインA固定化担体は、IgG抗体を精製する場合に、プロテインAのリーク量を低減するとともに、アルカリCIPに対する耐性をも向上させる。
抗体アフィニティクロマトグラフィに用いられて抗体を吸着するプロテインA固定化担体に含まれるプロテインAが、IgG抗体を精製する場合に大量にリークすることを低減できるプロテインA固定化担体の製造方法を提供する。
【解決手段】
担体1と、リンカー前駆体10としての末端エポキシ基2を含むエポキシ基含有化合物とを、担体の比表面積あたりのエポキシ基含有化合物の量が1.5μmol/m2以上になるように反応させ、ついでジアミンを反応させてリンカー20とし、さらにプロテインAを担持させるプロテインA固定化担体を製造する。プロテインA固定化担体は、IgG抗体を精製する場合に、プロテインAのリーク量を低減するとともに、アルカリCIPに対する耐性をも向上させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、特定のタンパク質を吸着分離するためのアフィニティクロマトグラフィの技術分野に属し、特に新規なプロテインA固定化担体の製造方法に関する。
【背景技術】
【0002】
近年、特定のタンパク質を高精度に精製又は除去することが、医薬分野及び医療分野において重要視されている。例えば、特定の機能を有する薬品を精製する場合には、特定のタンパク質を高精度に精製することが必要とされる。
【0003】
特定のタンパク質を精製又は除去する手段として、アフィニティクロマトグラフィが広く利用されている。アフィニティクロマトグラフィでは、特定物質に親和性を有する物質(リガンド)を不溶性担体に固定した抗体アフィニティ担体を用いて、特定物質を当該リガンドに特異的に吸着させることにより、特定物質を混合物から分離する。また、吸着された特定物質は、リガンドとの親和性を下げることにより溶出され、これを回収することにより精製が可能となる。
【0004】
アフィニティクロマトグラフィでは、リガンドとして特異的な結合性を有するプロテインAが広く利用されている。プロテインAは、グラム陽性球菌である真正細菌のブドウ球菌(Staphylococcus)に由来するタンパク質であり、様々な動物由来のIgGのFc領域と特異的に結合する性質を有し、IgG精製に広く利用されている。プロテインAを不溶性担体に固定化させ、当該不溶性担体を用いたアフィニティクロマトグラフィによりIgGを特異的に分離精製する手法が広く知られている。
【0005】
アフィニティクロマトグラフィに用いられる抗体アフィニティ担体においては、一般に、リンカーと称される構造を不溶性担体とリガンドの間に介在させ、リンカーの一端を担体に結合させ、且つリンカーの他端をリガンドに結合させることにより、リガンドを不溶性担体に固定化している。
【0006】
これまで種々の結合を利用してリンカーとリガンドを結合させる担体が開発されてきており、最近、固定化されたプロテインAを担体上で配向させて一点で担体と結合させ、結合したプロテインA量に対する見掛けの活性が低下する問題点を解消したプロテインA固定化担体が開発された。
【0007】
これらの担体においては、1級アミノ基を含むリンカーを用い、抗体分子に結合能を有するタンパク質もしくはペプチドのカルボキシ末端とアミド結合で固定化されて抗体アフィニティ担体を形成するものがある。その中で、3−アミノプロピルトリメトキシシランを用いて、ガラスビーズなどにアミノプロピル基を導入したプロテインA固定化担体も例示されている(例えば、特許文献1参照)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2005−112827号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
上述したように、従来のプロテインA固定化担体には、シリカゲルやガラスビーズ等の担体に、アミノプロピル基を介してプロテインAを担持させた担体が汎用される。
しかし、当該アミノプロピル基を介して固定化されるプロテインAが、IgG抗体を精製する場合に大量にリークしてしまう。このため、リークしたプロテインAを除去するという余分な作業が発生し、次精製工程での作業効率を低下させてしまうという課題を有する。また、アルカリCIP(Cleaning In Place、定置洗浄)に対する耐性も乏しいという課題を有する。
【0010】
本発明は前記課題を解消するためになされたもので、抗体を特異的に吸着するプロテインA固定化担体がIgG抗体を精製する場合にプロテインAのリークを低減するとともに、アルカリCIPに対する耐性を向上させるプロテインA固定化担体の製造方法の提供を目的とする。
【課題を解決するための手段】
【0011】
本発明者は、従来のものとは全く別異の末端構造を有するリンカーを用いることにより、上記の目的が達成されることを見出し、本発明を導き出した。かくして、本発明に従えば、担体とエポキシ基含有化合物とを、担体の比表面積あたりのエポキシ基含有化合物の量が1.5μmol/m2以上になるように反応させ、ついでジアミンを反応させてリンカーとし、さらにプロテインAを担持させるプロテインA固定化担体の製造方法が提供される。
【発明の効果】
【0012】
本発明の製造方法で得られるプロテインA固定化担体は、IgG抗体を精製する場合にも、プロテインAのリークを低減するとともに、アルカリCIPに対する耐性を向上させることができる。
【図面の簡単な説明】
【0013】
【図1】本発明によって得られるプロテインA固定化担体におけるリンカーを説明する模式図
【図2】本発明に従うプロテインA固定化担体のアフィニティ性能に関する実験結果
【図3】本発明に従うプロテインA固定化担体のプロテインAリーク量及びアルカリ溶出に関する実験結果
【図4】本発明に従うプロテインA固定化担体のアルカリCIP耐久試験結果
【発明を実施するための形態】
【0014】
本発明のプロテインA固定化担体の製造方法は、担体とエポキシ基含有化合物とを、担体の比表面積あたりのエポキシ基含有化合物の量が1.5μmol/m2以上になるように反応させ、ついでジアミンを反応させ、さらにプロテインAを反応させて固定化する方法である。
【0015】
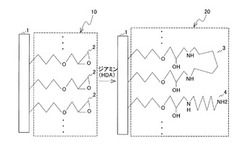
図1は、本発明のプロテインA固定化担体の製造方法において、プロテインAの固定化前までの工程(すなわち担体にリンカーを形成するまでの工程)を説明するための模式図である。図1の左側は、担体にエポキシ基含有化合物を反応させた後の状態を示す。この状態において、リンカー前駆体10は末端に末端エポキシ基2を有する。続いて、該末端エポキシ基2部位にジアミンを反応させる。この結果、図1の右側に示すように、ジアミンに含まれる2つのアミノ基が、2つの末端エポキシ基2を開環して架橋した架橋部位3と、末端エポキシ基2とジアミンとが直鎖状に付加し、末端部にアミノ基を有する直鎖部位4と、を備えるリンカー20が形成されるものと考えられる。図1では、リンカー前駆体10における末端エポキシ基2に1,6−ヘキシレンジアミン(HDA)を付加し、複数の架橋部位3及び直鎖部位4を備えるリンカー20が生成する場合を示している。
【0016】
このように、リンカー20は、架橋部位3及び直鎖部位4を含み、直鎖部位4の末端部にアミノ基が存在すると考えられる。この直鎖部位の末端部に存在するアミノ基によりリガンドであるプロテインAの末端部のカルボキシル基とアミド結合を行うことにより結合することができると考えられる。
【0017】
担体1としては、従来使用されている無機材料を主体とするものであれば特に限定されない。例えば、金属酸化物からなるものを用いることができる。金属酸化物としては、シリカ、アルミナ、酸化ジルコニウム、ガラス等を挙げることができ、シリカが好ましい。また、担体1は多孔質であることが好ましい。このように、担体1としては、シリカゲルが特に好ましい。
【0018】
シリカゲルとしては、従来より知られている種々のものを用いることができる。細孔径は、分離精製する目的タンパク質の大きさよりも大きいことが必要である。粒子の平均細孔径(D、nm)と、比表面積(S、cm2/g)と細孔容積(V、cm3/g)とは下式(1)に示す相関がある。
【0019】
D=4000×V/S (1)
従って、平均細孔径を大きくするためには細孔容積を大きくするか、比表面積を小さくすることが必要である。ところが、細孔容積を大きくすると、一般的には粒子強度が低下するので好ましくない。また、比表面積を小さくするとリガンドを付加させる面積が小さくなってリガンド量が低減し、目的タンパク質を吸着する能力が小さくなるので好ましくない。目的に合わせてこれらの物性を最適化することが必要であり、一般的には平均細孔径が30〜500nm、好ましくは70〜300nm、のものを使用する。また、細孔容積としては、0.5〜2.5cm3/g、好ましくは、0.7〜2.0cm3/g、のものを使用する。これらの細孔物性を測定するには公知の方法を用いることができ、例えば、水銀圧入法により測定することができる。
【0020】
シリカゲルの平均凝集粒子径は、小さいほど分離特性が向上するが、カラム使用時の圧力損失が大きくなるので、使用する装置の仕様も勘案して適切な値のものを採用する。一般的には5〜500μmであり、7〜200μmが好ましく、10〜100μmが特に好ましい。また、粒子径分布が揃っているほど、分離性能が向上するので好ましい。
【0021】
粒子径の小さいものから累積して、質量もしくは体積基準の累積量が全粒子量の10%になる粒子径を10%径(D10)、90%になる粒子径を90%径(D90)とするとき、D90/D10の値が3以下、好ましくは2以下、より好ましくは1.6以下のものを使用する。平均粒子径、粒子径分布は公知の方法で測定することができ、例えば、電気抵抗法や動的光散乱法などの原理を用いた装置で測定できる。
粒子の形状も特に限定されない。いわゆる破砕状のものも使用できるが、カラムへの充填性、使用時の圧力損失の抑制の観点から、球状のものが好適に使用できる。
【0022】
シリカゲルとしては、通常99%以上、好ましくは99.9%以上、より好ましくは99.99%以上の純度の酸化ケイ素からなるものが使用される。耐アルカリ性を向上させるなどの観点から、有機物と複合させたものや、表面をコーティングしたものも使用できる。
【0023】
本発明においては、上記担体とエポキシ基含有化合物とを反応させる。この操作により担体表面にエポキシ基含有化合物を固定化し、リンカー前駆体10を形成する。リンカー前駆体10は末端にエポキシ基を有する。
【0024】
エポキシ基含有化合物としては、エポキシ基を有するシランカップリング剤が好ましく用いられる。エポキシ基含有シランカップリング剤としては、γ−グリシドキシプロピルトリメトキシシラン、γ−グリシドキシプロピルメチルジエトキシシラン、β−(3,4−エポキシシクロヘキシル)エチルトリメトキシシラン等が使用できる。
【0025】
担体とエポキシ基含有化合物とを反応させる方法としては、既知の方法によることができ、例えば、担体とエポキシ基含有化合物とを溶媒中で加温する方法が採用できる。反応温度は30〜400℃程度であり、100〜300℃が好ましい。反応時間は0.5〜40時間程度であり、3〜20時間が好ましい。
【0026】
溶媒としては、エポキシ基含有化合物と反応せず、かつ、反応温度下で安定なものであれば、特に限定することなくいかなるものも使用可能である。エポキシ基本含有化合物の溶解性、沸点、さらには他の溶媒との親和性(すなわち洗浄時における除去性)などの観点から、通常、ベンゼン、トルエン、キシレン、オクタン、イソオクタン、テトラクロロエチレン、クロロベンゼン、ブロモベンゼン等が好適に使用される。また、反応操作は当該使用溶媒の還流下に行うことが望ましい。
【0027】
エポキシ基含有化合物の固定化量は、一般的には多いほど、つまり、担体表面全体を緻密に覆う量であることが、担体の耐アルカリ性を向上させる観点から好ましい。具体的には、担体の比表面積あたりのエポキシ基含有化合物の量(エポキシ基含有化合物の固定化量を担体の比表面積で除した値)が1.5μmol/m2以上となるように反応させる。エポキシ基含有化合物の固定化量は、1.5〜50μmol/m2が好ましく、2.5〜50μmol/m2が特に好ましい。
【0028】
なお、エポキシ基含有化合物の固定化量は公知の方法に基づいて求められる。例えば、エポキシ基含有化合物を固定化した後のシリカゲルについて元素分析法により測定した炭素含有率をもとに、エポキシ基含有化合物1分子に含まれる炭素量、および、担体として用いたシリカゲルの比表面積を用いて、エポキシ基含有化合物の固定化量を算出できる。
【0029】
ついで、ジアミンを反応させる。ジアミンは、リンカー前駆体10の末端エポキシ基2と反応し、前記架橋部位3および前記直鎖部位4が形成されるものと推測される。
【0030】
ジアミンとしては、原理的には、各種のジアミンが使用できるが、炭素数2〜10(好ましくは炭素数2〜6)のアルキレン基またはアルケニレン基の両末端にアミノ基を有する化合物が好ましい。
【0031】
具体的には、式NH2−(CH2)n−NH2で表される化合物(nは2〜10の整数)が好ましく、nが2である場合の化合物(1,2−エチレンジアミン、以下EDAともいう)又はnが6である場合の化合物(1,6−ヘキシレンジアミン、以下HDAともいう)が特に好ましい。
【0032】
ジアミンを末端エポキシ基2と反応させるのは既知の方法を用いることができる。例えば、リンカー前駆体10が形成された担体とジアミンとを溶媒中で加温する方法を採用できる。反応温度は30〜200℃程度であり、30〜100℃が好ましい。反応時間は0.5〜50時間程度であり、0.5〜20時間が好ましい。
【0033】
反応溶媒としては、末端エポキシ基2と反応せず、ジアミンを溶解させるものが好ましい。例えば、トルエン、イソプロピルアルコール、メタノール、水、重炭酸ナトリウム水溶液等が好適である。直鎖部位4を形成させるためには、ジアミンの量を末端エポキシ基2に対して1当量以上使用することが好ましく、10〜200当量使用することが特に好ましい。
【0034】
ジアミンの固定化量は、耐アルカリ性を向上させる観点から、担体の比表面積あたりの量として、0.5μmol/m2以上とすることが好ましく、0.8〜1.6μmol/m2とすることが特に好ましい。
【0035】
ジアミンの固定化量は公知の方法に基づいて求められる。例えば、ジアミンを反応させた後に、元素分析法により窒素含有率を測定して窒素量を求め、同様にして求めた固定化する前の窒素量を差し引き、この値と、ジアミン1分子あたりの窒素量、担体として用いたシリカゲルの比表面積を用いて、ジアミンの固定化量が算出できる。
【0036】
リンカー前駆体10における末端エポキシ基2とジアミンとを反応させことにより耐アルカリ性が向上する機構は明確にはなっていないが、一部のジアミンが2つの末端エポキシ基2と反応し、架橋構造3を形成することで、アルカリが担体に進入するのを抑制しているためではないかと推測される。
【0037】
本発明においては、下式(2)により算出される架橋構造3の割合が、50%以上100%未満であることが好ましく、70〜99%であることが特に好ましい。架橋構造3の割合が100%になるとプロテインAと結合できるアミノ基が存在しなくなるので、好ましくない。
【0038】
(E0−Da)/Da (2)
ここで、E0はジアミンを反応させる前の末端エポキシ基量(μmol/m2)、Daはジアミン固定化量(μmol/m2)である。末端エポキシ量は公知の方法で測定できる。例えば、試料を水に懸濁させ、Na2S2O3を反応させ、遊離してきたNaOH量をHClで滴定する方法で求めることができる。
【0039】
つぎに、プロテインAを担持させる。プロテインAとしては、カルボキシル末端を結合基として有するものを用いることができる。中でも、カルボキシル末端にシステイン残基と低等電点のペプチド鎖を有する組換え型プロテインA(例えば、特開2004−345956号公報参照。以下「r−プロテインA」と略記する)を好適に使用できる。
【0040】
本発明においてプロテインAを担持させる方法としては、r−プロテインAを室温でリン酸緩衝液に溶解させて当該リンカーに吸着させる吸着工程と、r−プロテインAのシステインのスルフヒドリル基を、シアノ化溶液によりシアノ化し、シアノシステインに変換して活性化させる活性化工程と、当該活性化工程により活性化された前記r−プロテインAをホウ酸緩衝液によりリンカー2に固定化する固定化反応を行う固定化工程とを含むことでプロテインA固定化担体を形成することができる。
【0041】
具体的には、前記吸着工程では、リン酸緩衝液(pH7.0)に溶解させたr−プロテインAを室温で2時間以上作用させる。この際、r−プロテインAの末端部のペプチド部位がマイナス帯電を有するために、フリーの1級アミノ基を有するリンカー(直鎖構造4)に対して、r−プロテインAが静電的に吸着するものと考えられる。
【0042】
また、前記活性化工程では、シアノ化溶液としての2−ニトロ−5−チオシアノ安息香酸(NTCB)試薬を前記吸着工程の完了後に投入し、室温で4時間反応させる。この反応により、r−プロテインAのシステインのスルフヒドリル基(SH)はシアノ化し、シアノシステインに変換される。
【0043】
また、前記固定化工程では、10mmol/Lのホウ酸緩衝液を用いてpH9.5の弱アルカリ性にし、室温で24時間、r−プロテインAをリンカーに固定化させる固定化反応を行う。このように、溶液を弱アルカリ性とすることで、リンカーの1級アミノ基とシアノシステイン残基直前のアミノ酸残基のカルボキシル基との間にアミド結合を生じることとなり、r−プロテインAの所定のポリペプチドが開裂する。この後、高濃度のKCl水溶液で洗浄し、開裂したポリペプチドを除去する。
【0044】
r−プロテインAの固定化量は公知の方法に基づいて求められる。例えば、前記吸着工程に用いるr−プロテインA溶液の濃度と、該溶液に担体を浸漬してr−プロテインAを吸着させた後、担体を分離して得られるr−プロテインA溶液の濃度との差分から、担体に固定化された量を計算できる。溶液濃度は光学的に測定できる。
【実施例】
【0045】
以下、本発明を実施例によりさらに詳細に説明する。ただし、当業者には明らかなように、本発明はこれらの実施例に限定されるものではない。
[1]プロテインA固定化担体の調製
(実施例1)
シリカゲル(AGCエスアイテック社製、M.S.GEL.SIL D−50−1000AW;比表面積=74m2/g、平均粒径=44.8μm、平均細孔径=97.5nm)(50g)と、γ−グリシドキシプロピルトリメトキシシラン(34mL)とを90〜95℃で4.5時間加熱した。このとき、γ−グリシドキシプロピルトリメトキシシランの量は、シリカゲルに対して、固定化量が3.0μmol/m2となる量であった。また、エポキシ基量を測定したところ、2.72μmol/m2となる量であった。
【0046】
続いて、1,6−ヘキシレンジアミン(44g)を加え、60〜65℃で2時間加熱した。ジアミンの固定化量は1.43μmol/m2となる量であった。
前記式(2)で表される架橋構造の割合を算出すると、90%であった。
【0047】
つぎに、r−プロテインA(天野エンザイム社製IBP“Amano”2、商品名:IBP−2、ロット番号:IBPG0250301R)を、上記の方法に従って、前記シリカゲル表面に形成されたリンカーに結合させ、プロテインA固定化担体(1)を調製した。また、r−プロテイン修飾量は5.6mg/mL-bedと公知の方法より見積もられた。
【0048】
(実施例2)
1,6−ヘキシレンジアミン(44g)を1,2−エチレンジアミン(22g)に変更する以外は実施例1と同様にして、プロテインA固定化担体(2)を調製した。ジアミンの固定化量は1.55μmol/m2となる量で、架橋構造の割合は式(2)より、76%と算出された。また、r−プロテイン修飾量は5.8mg/mL-bedと公知の方法より見積もられた。
【0049】
(比較例1)
γ−グリシドキシプロピルトリメトキシシランを用いる替わりに、3−アミノプロピルメトキシシラン(12g)を用い、1,6−ヘキシレンジアミンを反応させる工程を省略したほかは実施例1と同様にして、アミノプロピル基を介して固定化されたr−プロテインA固定化担体(以下、AP担体という)を得た。r−プロテイン修飾量は5.5mg/mL-bedと公知の方法より見積もられた。
【0050】
[2]プロテインA固定化担体のアフィニティ性能の評価(AP担体との同等性の評価1)
実施例1、2で調製したプロテインA固定化担体と、比較例1で調製したAP担体について、(1)動的吸着量(Dynamic Binding Capacity、DBC)、(2)静的吸着量(Static Binding Capacity、SBC)(3)IgG回収率、(4)非特異吸着量の評価を行った。
【0051】
DBCについては、測定した破過曲線の10%破過点の溶出容量から算出した値をDBCと定義して評価を行った。また、非特異吸着量は、プロテインA以外の他のタンパク質の吸着を避ける能力を示すものであり、ここでは、真正細菌の細胞壁を構成する多糖類を加水分解する酵素であるリゾチーム(Lysozyme)、エンドペプチダーゼ、セリンプロテアーゼの一種であるトリプシン(trypsin)、牛血清アルブミン(BSA)の各タンパク質に対して測定した。
【0052】
DBCは、プロテインA固定化担体を5mmφ×25mmのガラスカラム(GE Healthcare社製 Tricorn 5/20 Column)に充填し、PBS緩衝液(pH7.4)に溶解させたポリクローナルhuman IgG溶液(濃度0.5mg/mL)を流速0.6mL/minでこのカラムに送液し、破過曲線を得ることによって評価した。図2(a)に破過曲線を示す。この測定結果から、本発明によるプロテインA固定化担体(1)が37mg/mL-bedを示し、対照であるAP担体が40mg/mL-bedを示すことから、動的吸着の能力に関して同等の性能を保持することが示された。
【0053】
この後、このカラムをPBS緩衝液で洗浄し、溶出緩衝液(酢酸バッファ,pH4.5)を流速0.6mL/minで送液してIgGを溶出し、取得した液滴であるフラクション(Fraction)を中和後、ゲル浸透クロマトグラフィ(Gel Permeation Chromatography、GPC)を用いてIgG回収率(%)を測定した。その結果、ともに90%以上の高回収率となり、IgG回収率に関しても同等な性能を示した。
【0054】
SBC評価は、次の方法で行った。プロテインA固定化担体0.1mL-bedに初発濃度で0〜1.82mg/mLのポリクローナルhuman IgG溶液を加え、室温で一昼夜ロータリーミキサーにて撹拌した。遠心分離後、上澄液の280nm吸光度測定により残存IgG濃度を定量し、ラングミュアプロットを用いてSBCを算出した。その結果、本発明によるプロテインA固定化担体(1)が82mg/mL-bedを示し、対照であるAP担体が85mg/mL-bedを示すことから、タンパク質の吸着総量に関しても同等の性能を保持することが示された。
【0055】
また、非特異吸着量は、次の方法で測定した。プロテインA固定化担体を5mmφ×25mmのガラスカラムに充填し、PBS緩衝溶液(pH7.4)を流速1.0mL/minでこのカラムに送液した。次いで、PBSで0.08mg/mL濃度に調製したリゾチーム、トリプシン、牛血清アルブミンの各タンパク質溶液20μLをそれぞれ注入し、不溶出な非特異吸着量を測定した。その結果、リゾチーム、トリプシン、牛血清アルブミンに対しても、本発明によるプロテインA固定化担体(1)と対照であるAP担体は、同等の性能を示した。以上の結果をまとめ、図2(b)に示す。
【0056】
[3]プロテインA固定化担体のアフィニティ性能の評価(AP担体との同等性の評価2)
次に、プロテインA固定化担体について、アフィニティ性能としてのDBCに関し、カラムへの送液速度に応じた評価を、カラムの滞留時間(Residence time)を変えて測定した。このDBC評価は、プロテインA固定化担体を5mmφ×25mmのガラスカラムに充填し、ポリクローナルhuman IgG溶液(濃度0.5mg/mL)をこのカラムに送液して行った。
【0057】
その結果、図2(c)に示すように、滞留時間に応じたDBC曲線を得た。同図において、曲線aは、従来のAP担体に関する測定結果であり、曲線bは、本発明によるプロテインA固定化担体(1)に関する測定結果である。
【0058】
この測定結果から、本発明の製造方法によって得られたプロテインA固定化担体(1)が、対照であるAP担体に近い曲線を示したことから、カラムへの流速特性に関しても同等の性能を保持することが示された。
【0059】
[4]プロテインA固定化担体のリーク量の評価
Assay Designs 社製TiterZyme EIA Kitを用いてELISA (Enzyme-Linked ImmunoSorbent Assay、エライザ) 測定を行い、プロテインAのリーク量を評価した。具体敵には、溶出バッファに0.1mol/LグリシンHCl緩衝液(pH2.0)を使用し、各フラクション(Fraction)を1mol/Lの炭酸ナトリウム水溶液で中和し(pH8.0)、被覆した96マイクロウェルのELISA測定を行った。測定結果を図3に示す。従来のAP担体が約700ng/mg-IgGを示したのに対して、本発明によるプロテインA固定化担体は、ジアミンとして1,6−ヘキシレンジアミン(HDA)を用いた場合、1,2−エチレンジアミン(EDA)を用いた場合、共に約80ng/mg-IgGを示したことから、プロテインAのリーク量を大幅に低減できることが示された。
【0060】
[5]プロテインA固定化担体のアルカリ耐性の評価(アルカリCIP耐久試験)
次に、より実際の産業的使用に近い状況でアルカリCIP耐久試験を行った。ここでは、アルカリCIPによる繰返し洗浄を行い、この繰返し洗浄による能力劣化(キャパシティ劣化)の度合いを確認した。
【0061】
より具体的には、プロテインA固定化担体(1)を4.6mmφ×10mmのステンレスカラムに充填し、ポリクローナルhuman IgG溶液(濃度0.5mg/mL-bed)を流速0.83mL/minでこのカラムに送液し(Loading工程)、次に、PBS緩衝液(pH7.4)溶液を送液してこのカラムを洗浄した(Wash工程)。この後、クエン酸緩衝液(pH2.2)8.3mLによる溶出(Elution工程)、50mMのNaOH水溶液(pH12.7)による20分間の洗浄(アルカリCIP工程)、PBS緩衝液(pH7.4)による平衡化(Conditioning工程)を行った。10サイクルに1回の割合でポリクローナル human IgGのLoadingを繰り返し、DBCを評価した。なお、このDBC評価結果としては、図4に示すように、最初のDBCを100とした場合のこの各サイクル数でのDBCを相対DBC(Relative DBC)(%)として算出した。同図において、曲線aは、本発明によるプロテインA固定化担体(1)の測定結果であり、曲線bは、従来のAP担体の測定結果である。
【0062】
同図から、AP担体では、約20回のアルカリCIPにより相対DBCが80%以下に低下したが、本発明によるプロテインA固定化担体(1)では、アルカリCIPを約120回行った場合でも相対DBCが80%を維持することができ、従来と比較して格段に強いアルカリCIP耐性を有することが示された。
【産業上の利用可能性】
【0063】
本発明の製造方法によって得られるプロテインA固定化担体は、タンパク質の精製に適用できる。その他に、溶出(Elution工程)時の酸性溶液のpH値を変化させることによりタンパク質のサブクラスを分離する用途にも適用できる。
【符号の説明】
【0064】
10 リンカー前駆体
1 担体
2 末端エポキシ基
3 架橋部位
4 直鎖部位
20 リンカー
【技術分野】
【0001】
本発明は、特定のタンパク質を吸着分離するためのアフィニティクロマトグラフィの技術分野に属し、特に新規なプロテインA固定化担体の製造方法に関する。
【背景技術】
【0002】
近年、特定のタンパク質を高精度に精製又は除去することが、医薬分野及び医療分野において重要視されている。例えば、特定の機能を有する薬品を精製する場合には、特定のタンパク質を高精度に精製することが必要とされる。
【0003】
特定のタンパク質を精製又は除去する手段として、アフィニティクロマトグラフィが広く利用されている。アフィニティクロマトグラフィでは、特定物質に親和性を有する物質(リガンド)を不溶性担体に固定した抗体アフィニティ担体を用いて、特定物質を当該リガンドに特異的に吸着させることにより、特定物質を混合物から分離する。また、吸着された特定物質は、リガンドとの親和性を下げることにより溶出され、これを回収することにより精製が可能となる。
【0004】
アフィニティクロマトグラフィでは、リガンドとして特異的な結合性を有するプロテインAが広く利用されている。プロテインAは、グラム陽性球菌である真正細菌のブドウ球菌(Staphylococcus)に由来するタンパク質であり、様々な動物由来のIgGのFc領域と特異的に結合する性質を有し、IgG精製に広く利用されている。プロテインAを不溶性担体に固定化させ、当該不溶性担体を用いたアフィニティクロマトグラフィによりIgGを特異的に分離精製する手法が広く知られている。
【0005】
アフィニティクロマトグラフィに用いられる抗体アフィニティ担体においては、一般に、リンカーと称される構造を不溶性担体とリガンドの間に介在させ、リンカーの一端を担体に結合させ、且つリンカーの他端をリガンドに結合させることにより、リガンドを不溶性担体に固定化している。
【0006】
これまで種々の結合を利用してリンカーとリガンドを結合させる担体が開発されてきており、最近、固定化されたプロテインAを担体上で配向させて一点で担体と結合させ、結合したプロテインA量に対する見掛けの活性が低下する問題点を解消したプロテインA固定化担体が開発された。
【0007】
これらの担体においては、1級アミノ基を含むリンカーを用い、抗体分子に結合能を有するタンパク質もしくはペプチドのカルボキシ末端とアミド結合で固定化されて抗体アフィニティ担体を形成するものがある。その中で、3−アミノプロピルトリメトキシシランを用いて、ガラスビーズなどにアミノプロピル基を導入したプロテインA固定化担体も例示されている(例えば、特許文献1参照)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2005−112827号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
上述したように、従来のプロテインA固定化担体には、シリカゲルやガラスビーズ等の担体に、アミノプロピル基を介してプロテインAを担持させた担体が汎用される。
しかし、当該アミノプロピル基を介して固定化されるプロテインAが、IgG抗体を精製する場合に大量にリークしてしまう。このため、リークしたプロテインAを除去するという余分な作業が発生し、次精製工程での作業効率を低下させてしまうという課題を有する。また、アルカリCIP(Cleaning In Place、定置洗浄)に対する耐性も乏しいという課題を有する。
【0010】
本発明は前記課題を解消するためになされたもので、抗体を特異的に吸着するプロテインA固定化担体がIgG抗体を精製する場合にプロテインAのリークを低減するとともに、アルカリCIPに対する耐性を向上させるプロテインA固定化担体の製造方法の提供を目的とする。
【課題を解決するための手段】
【0011】
本発明者は、従来のものとは全く別異の末端構造を有するリンカーを用いることにより、上記の目的が達成されることを見出し、本発明を導き出した。かくして、本発明に従えば、担体とエポキシ基含有化合物とを、担体の比表面積あたりのエポキシ基含有化合物の量が1.5μmol/m2以上になるように反応させ、ついでジアミンを反応させてリンカーとし、さらにプロテインAを担持させるプロテインA固定化担体の製造方法が提供される。
【発明の効果】
【0012】
本発明の製造方法で得られるプロテインA固定化担体は、IgG抗体を精製する場合にも、プロテインAのリークを低減するとともに、アルカリCIPに対する耐性を向上させることができる。
【図面の簡単な説明】
【0013】
【図1】本発明によって得られるプロテインA固定化担体におけるリンカーを説明する模式図
【図2】本発明に従うプロテインA固定化担体のアフィニティ性能に関する実験結果
【図3】本発明に従うプロテインA固定化担体のプロテインAリーク量及びアルカリ溶出に関する実験結果
【図4】本発明に従うプロテインA固定化担体のアルカリCIP耐久試験結果
【発明を実施するための形態】
【0014】
本発明のプロテインA固定化担体の製造方法は、担体とエポキシ基含有化合物とを、担体の比表面積あたりのエポキシ基含有化合物の量が1.5μmol/m2以上になるように反応させ、ついでジアミンを反応させ、さらにプロテインAを反応させて固定化する方法である。
【0015】
図1は、本発明のプロテインA固定化担体の製造方法において、プロテインAの固定化前までの工程(すなわち担体にリンカーを形成するまでの工程)を説明するための模式図である。図1の左側は、担体にエポキシ基含有化合物を反応させた後の状態を示す。この状態において、リンカー前駆体10は末端に末端エポキシ基2を有する。続いて、該末端エポキシ基2部位にジアミンを反応させる。この結果、図1の右側に示すように、ジアミンに含まれる2つのアミノ基が、2つの末端エポキシ基2を開環して架橋した架橋部位3と、末端エポキシ基2とジアミンとが直鎖状に付加し、末端部にアミノ基を有する直鎖部位4と、を備えるリンカー20が形成されるものと考えられる。図1では、リンカー前駆体10における末端エポキシ基2に1,6−ヘキシレンジアミン(HDA)を付加し、複数の架橋部位3及び直鎖部位4を備えるリンカー20が生成する場合を示している。
【0016】
このように、リンカー20は、架橋部位3及び直鎖部位4を含み、直鎖部位4の末端部にアミノ基が存在すると考えられる。この直鎖部位の末端部に存在するアミノ基によりリガンドであるプロテインAの末端部のカルボキシル基とアミド結合を行うことにより結合することができると考えられる。
【0017】
担体1としては、従来使用されている無機材料を主体とするものであれば特に限定されない。例えば、金属酸化物からなるものを用いることができる。金属酸化物としては、シリカ、アルミナ、酸化ジルコニウム、ガラス等を挙げることができ、シリカが好ましい。また、担体1は多孔質であることが好ましい。このように、担体1としては、シリカゲルが特に好ましい。
【0018】
シリカゲルとしては、従来より知られている種々のものを用いることができる。細孔径は、分離精製する目的タンパク質の大きさよりも大きいことが必要である。粒子の平均細孔径(D、nm)と、比表面積(S、cm2/g)と細孔容積(V、cm3/g)とは下式(1)に示す相関がある。
【0019】
D=4000×V/S (1)
従って、平均細孔径を大きくするためには細孔容積を大きくするか、比表面積を小さくすることが必要である。ところが、細孔容積を大きくすると、一般的には粒子強度が低下するので好ましくない。また、比表面積を小さくするとリガンドを付加させる面積が小さくなってリガンド量が低減し、目的タンパク質を吸着する能力が小さくなるので好ましくない。目的に合わせてこれらの物性を最適化することが必要であり、一般的には平均細孔径が30〜500nm、好ましくは70〜300nm、のものを使用する。また、細孔容積としては、0.5〜2.5cm3/g、好ましくは、0.7〜2.0cm3/g、のものを使用する。これらの細孔物性を測定するには公知の方法を用いることができ、例えば、水銀圧入法により測定することができる。
【0020】
シリカゲルの平均凝集粒子径は、小さいほど分離特性が向上するが、カラム使用時の圧力損失が大きくなるので、使用する装置の仕様も勘案して適切な値のものを採用する。一般的には5〜500μmであり、7〜200μmが好ましく、10〜100μmが特に好ましい。また、粒子径分布が揃っているほど、分離性能が向上するので好ましい。
【0021】
粒子径の小さいものから累積して、質量もしくは体積基準の累積量が全粒子量の10%になる粒子径を10%径(D10)、90%になる粒子径を90%径(D90)とするとき、D90/D10の値が3以下、好ましくは2以下、より好ましくは1.6以下のものを使用する。平均粒子径、粒子径分布は公知の方法で測定することができ、例えば、電気抵抗法や動的光散乱法などの原理を用いた装置で測定できる。
粒子の形状も特に限定されない。いわゆる破砕状のものも使用できるが、カラムへの充填性、使用時の圧力損失の抑制の観点から、球状のものが好適に使用できる。
【0022】
シリカゲルとしては、通常99%以上、好ましくは99.9%以上、より好ましくは99.99%以上の純度の酸化ケイ素からなるものが使用される。耐アルカリ性を向上させるなどの観点から、有機物と複合させたものや、表面をコーティングしたものも使用できる。
【0023】
本発明においては、上記担体とエポキシ基含有化合物とを反応させる。この操作により担体表面にエポキシ基含有化合物を固定化し、リンカー前駆体10を形成する。リンカー前駆体10は末端にエポキシ基を有する。
【0024】
エポキシ基含有化合物としては、エポキシ基を有するシランカップリング剤が好ましく用いられる。エポキシ基含有シランカップリング剤としては、γ−グリシドキシプロピルトリメトキシシラン、γ−グリシドキシプロピルメチルジエトキシシラン、β−(3,4−エポキシシクロヘキシル)エチルトリメトキシシラン等が使用できる。
【0025】
担体とエポキシ基含有化合物とを反応させる方法としては、既知の方法によることができ、例えば、担体とエポキシ基含有化合物とを溶媒中で加温する方法が採用できる。反応温度は30〜400℃程度であり、100〜300℃が好ましい。反応時間は0.5〜40時間程度であり、3〜20時間が好ましい。
【0026】
溶媒としては、エポキシ基含有化合物と反応せず、かつ、反応温度下で安定なものであれば、特に限定することなくいかなるものも使用可能である。エポキシ基本含有化合物の溶解性、沸点、さらには他の溶媒との親和性(すなわち洗浄時における除去性)などの観点から、通常、ベンゼン、トルエン、キシレン、オクタン、イソオクタン、テトラクロロエチレン、クロロベンゼン、ブロモベンゼン等が好適に使用される。また、反応操作は当該使用溶媒の還流下に行うことが望ましい。
【0027】
エポキシ基含有化合物の固定化量は、一般的には多いほど、つまり、担体表面全体を緻密に覆う量であることが、担体の耐アルカリ性を向上させる観点から好ましい。具体的には、担体の比表面積あたりのエポキシ基含有化合物の量(エポキシ基含有化合物の固定化量を担体の比表面積で除した値)が1.5μmol/m2以上となるように反応させる。エポキシ基含有化合物の固定化量は、1.5〜50μmol/m2が好ましく、2.5〜50μmol/m2が特に好ましい。
【0028】
なお、エポキシ基含有化合物の固定化量は公知の方法に基づいて求められる。例えば、エポキシ基含有化合物を固定化した後のシリカゲルについて元素分析法により測定した炭素含有率をもとに、エポキシ基含有化合物1分子に含まれる炭素量、および、担体として用いたシリカゲルの比表面積を用いて、エポキシ基含有化合物の固定化量を算出できる。
【0029】
ついで、ジアミンを反応させる。ジアミンは、リンカー前駆体10の末端エポキシ基2と反応し、前記架橋部位3および前記直鎖部位4が形成されるものと推測される。
【0030】
ジアミンとしては、原理的には、各種のジアミンが使用できるが、炭素数2〜10(好ましくは炭素数2〜6)のアルキレン基またはアルケニレン基の両末端にアミノ基を有する化合物が好ましい。
【0031】
具体的には、式NH2−(CH2)n−NH2で表される化合物(nは2〜10の整数)が好ましく、nが2である場合の化合物(1,2−エチレンジアミン、以下EDAともいう)又はnが6である場合の化合物(1,6−ヘキシレンジアミン、以下HDAともいう)が特に好ましい。
【0032】
ジアミンを末端エポキシ基2と反応させるのは既知の方法を用いることができる。例えば、リンカー前駆体10が形成された担体とジアミンとを溶媒中で加温する方法を採用できる。反応温度は30〜200℃程度であり、30〜100℃が好ましい。反応時間は0.5〜50時間程度であり、0.5〜20時間が好ましい。
【0033】
反応溶媒としては、末端エポキシ基2と反応せず、ジアミンを溶解させるものが好ましい。例えば、トルエン、イソプロピルアルコール、メタノール、水、重炭酸ナトリウム水溶液等が好適である。直鎖部位4を形成させるためには、ジアミンの量を末端エポキシ基2に対して1当量以上使用することが好ましく、10〜200当量使用することが特に好ましい。
【0034】
ジアミンの固定化量は、耐アルカリ性を向上させる観点から、担体の比表面積あたりの量として、0.5μmol/m2以上とすることが好ましく、0.8〜1.6μmol/m2とすることが特に好ましい。
【0035】
ジアミンの固定化量は公知の方法に基づいて求められる。例えば、ジアミンを反応させた後に、元素分析法により窒素含有率を測定して窒素量を求め、同様にして求めた固定化する前の窒素量を差し引き、この値と、ジアミン1分子あたりの窒素量、担体として用いたシリカゲルの比表面積を用いて、ジアミンの固定化量が算出できる。
【0036】
リンカー前駆体10における末端エポキシ基2とジアミンとを反応させことにより耐アルカリ性が向上する機構は明確にはなっていないが、一部のジアミンが2つの末端エポキシ基2と反応し、架橋構造3を形成することで、アルカリが担体に進入するのを抑制しているためではないかと推測される。
【0037】
本発明においては、下式(2)により算出される架橋構造3の割合が、50%以上100%未満であることが好ましく、70〜99%であることが特に好ましい。架橋構造3の割合が100%になるとプロテインAと結合できるアミノ基が存在しなくなるので、好ましくない。
【0038】
(E0−Da)/Da (2)
ここで、E0はジアミンを反応させる前の末端エポキシ基量(μmol/m2)、Daはジアミン固定化量(μmol/m2)である。末端エポキシ量は公知の方法で測定できる。例えば、試料を水に懸濁させ、Na2S2O3を反応させ、遊離してきたNaOH量をHClで滴定する方法で求めることができる。
【0039】
つぎに、プロテインAを担持させる。プロテインAとしては、カルボキシル末端を結合基として有するものを用いることができる。中でも、カルボキシル末端にシステイン残基と低等電点のペプチド鎖を有する組換え型プロテインA(例えば、特開2004−345956号公報参照。以下「r−プロテインA」と略記する)を好適に使用できる。
【0040】
本発明においてプロテインAを担持させる方法としては、r−プロテインAを室温でリン酸緩衝液に溶解させて当該リンカーに吸着させる吸着工程と、r−プロテインAのシステインのスルフヒドリル基を、シアノ化溶液によりシアノ化し、シアノシステインに変換して活性化させる活性化工程と、当該活性化工程により活性化された前記r−プロテインAをホウ酸緩衝液によりリンカー2に固定化する固定化反応を行う固定化工程とを含むことでプロテインA固定化担体を形成することができる。
【0041】
具体的には、前記吸着工程では、リン酸緩衝液(pH7.0)に溶解させたr−プロテインAを室温で2時間以上作用させる。この際、r−プロテインAの末端部のペプチド部位がマイナス帯電を有するために、フリーの1級アミノ基を有するリンカー(直鎖構造4)に対して、r−プロテインAが静電的に吸着するものと考えられる。
【0042】
また、前記活性化工程では、シアノ化溶液としての2−ニトロ−5−チオシアノ安息香酸(NTCB)試薬を前記吸着工程の完了後に投入し、室温で4時間反応させる。この反応により、r−プロテインAのシステインのスルフヒドリル基(SH)はシアノ化し、シアノシステインに変換される。
【0043】
また、前記固定化工程では、10mmol/Lのホウ酸緩衝液を用いてpH9.5の弱アルカリ性にし、室温で24時間、r−プロテインAをリンカーに固定化させる固定化反応を行う。このように、溶液を弱アルカリ性とすることで、リンカーの1級アミノ基とシアノシステイン残基直前のアミノ酸残基のカルボキシル基との間にアミド結合を生じることとなり、r−プロテインAの所定のポリペプチドが開裂する。この後、高濃度のKCl水溶液で洗浄し、開裂したポリペプチドを除去する。
【0044】
r−プロテインAの固定化量は公知の方法に基づいて求められる。例えば、前記吸着工程に用いるr−プロテインA溶液の濃度と、該溶液に担体を浸漬してr−プロテインAを吸着させた後、担体を分離して得られるr−プロテインA溶液の濃度との差分から、担体に固定化された量を計算できる。溶液濃度は光学的に測定できる。
【実施例】
【0045】
以下、本発明を実施例によりさらに詳細に説明する。ただし、当業者には明らかなように、本発明はこれらの実施例に限定されるものではない。
[1]プロテインA固定化担体の調製
(実施例1)
シリカゲル(AGCエスアイテック社製、M.S.GEL.SIL D−50−1000AW;比表面積=74m2/g、平均粒径=44.8μm、平均細孔径=97.5nm)(50g)と、γ−グリシドキシプロピルトリメトキシシラン(34mL)とを90〜95℃で4.5時間加熱した。このとき、γ−グリシドキシプロピルトリメトキシシランの量は、シリカゲルに対して、固定化量が3.0μmol/m2となる量であった。また、エポキシ基量を測定したところ、2.72μmol/m2となる量であった。
【0046】
続いて、1,6−ヘキシレンジアミン(44g)を加え、60〜65℃で2時間加熱した。ジアミンの固定化量は1.43μmol/m2となる量であった。
前記式(2)で表される架橋構造の割合を算出すると、90%であった。
【0047】
つぎに、r−プロテインA(天野エンザイム社製IBP“Amano”2、商品名:IBP−2、ロット番号:IBPG0250301R)を、上記の方法に従って、前記シリカゲル表面に形成されたリンカーに結合させ、プロテインA固定化担体(1)を調製した。また、r−プロテイン修飾量は5.6mg/mL-bedと公知の方法より見積もられた。
【0048】
(実施例2)
1,6−ヘキシレンジアミン(44g)を1,2−エチレンジアミン(22g)に変更する以外は実施例1と同様にして、プロテインA固定化担体(2)を調製した。ジアミンの固定化量は1.55μmol/m2となる量で、架橋構造の割合は式(2)より、76%と算出された。また、r−プロテイン修飾量は5.8mg/mL-bedと公知の方法より見積もられた。
【0049】
(比較例1)
γ−グリシドキシプロピルトリメトキシシランを用いる替わりに、3−アミノプロピルメトキシシラン(12g)を用い、1,6−ヘキシレンジアミンを反応させる工程を省略したほかは実施例1と同様にして、アミノプロピル基を介して固定化されたr−プロテインA固定化担体(以下、AP担体という)を得た。r−プロテイン修飾量は5.5mg/mL-bedと公知の方法より見積もられた。
【0050】
[2]プロテインA固定化担体のアフィニティ性能の評価(AP担体との同等性の評価1)
実施例1、2で調製したプロテインA固定化担体と、比較例1で調製したAP担体について、(1)動的吸着量(Dynamic Binding Capacity、DBC)、(2)静的吸着量(Static Binding Capacity、SBC)(3)IgG回収率、(4)非特異吸着量の評価を行った。
【0051】
DBCについては、測定した破過曲線の10%破過点の溶出容量から算出した値をDBCと定義して評価を行った。また、非特異吸着量は、プロテインA以外の他のタンパク質の吸着を避ける能力を示すものであり、ここでは、真正細菌の細胞壁を構成する多糖類を加水分解する酵素であるリゾチーム(Lysozyme)、エンドペプチダーゼ、セリンプロテアーゼの一種であるトリプシン(trypsin)、牛血清アルブミン(BSA)の各タンパク質に対して測定した。
【0052】
DBCは、プロテインA固定化担体を5mmφ×25mmのガラスカラム(GE Healthcare社製 Tricorn 5/20 Column)に充填し、PBS緩衝液(pH7.4)に溶解させたポリクローナルhuman IgG溶液(濃度0.5mg/mL)を流速0.6mL/minでこのカラムに送液し、破過曲線を得ることによって評価した。図2(a)に破過曲線を示す。この測定結果から、本発明によるプロテインA固定化担体(1)が37mg/mL-bedを示し、対照であるAP担体が40mg/mL-bedを示すことから、動的吸着の能力に関して同等の性能を保持することが示された。
【0053】
この後、このカラムをPBS緩衝液で洗浄し、溶出緩衝液(酢酸バッファ,pH4.5)を流速0.6mL/minで送液してIgGを溶出し、取得した液滴であるフラクション(Fraction)を中和後、ゲル浸透クロマトグラフィ(Gel Permeation Chromatography、GPC)を用いてIgG回収率(%)を測定した。その結果、ともに90%以上の高回収率となり、IgG回収率に関しても同等な性能を示した。
【0054】
SBC評価は、次の方法で行った。プロテインA固定化担体0.1mL-bedに初発濃度で0〜1.82mg/mLのポリクローナルhuman IgG溶液を加え、室温で一昼夜ロータリーミキサーにて撹拌した。遠心分離後、上澄液の280nm吸光度測定により残存IgG濃度を定量し、ラングミュアプロットを用いてSBCを算出した。その結果、本発明によるプロテインA固定化担体(1)が82mg/mL-bedを示し、対照であるAP担体が85mg/mL-bedを示すことから、タンパク質の吸着総量に関しても同等の性能を保持することが示された。
【0055】
また、非特異吸着量は、次の方法で測定した。プロテインA固定化担体を5mmφ×25mmのガラスカラムに充填し、PBS緩衝溶液(pH7.4)を流速1.0mL/minでこのカラムに送液した。次いで、PBSで0.08mg/mL濃度に調製したリゾチーム、トリプシン、牛血清アルブミンの各タンパク質溶液20μLをそれぞれ注入し、不溶出な非特異吸着量を測定した。その結果、リゾチーム、トリプシン、牛血清アルブミンに対しても、本発明によるプロテインA固定化担体(1)と対照であるAP担体は、同等の性能を示した。以上の結果をまとめ、図2(b)に示す。
【0056】
[3]プロテインA固定化担体のアフィニティ性能の評価(AP担体との同等性の評価2)
次に、プロテインA固定化担体について、アフィニティ性能としてのDBCに関し、カラムへの送液速度に応じた評価を、カラムの滞留時間(Residence time)を変えて測定した。このDBC評価は、プロテインA固定化担体を5mmφ×25mmのガラスカラムに充填し、ポリクローナルhuman IgG溶液(濃度0.5mg/mL)をこのカラムに送液して行った。
【0057】
その結果、図2(c)に示すように、滞留時間に応じたDBC曲線を得た。同図において、曲線aは、従来のAP担体に関する測定結果であり、曲線bは、本発明によるプロテインA固定化担体(1)に関する測定結果である。
【0058】
この測定結果から、本発明の製造方法によって得られたプロテインA固定化担体(1)が、対照であるAP担体に近い曲線を示したことから、カラムへの流速特性に関しても同等の性能を保持することが示された。
【0059】
[4]プロテインA固定化担体のリーク量の評価
Assay Designs 社製TiterZyme EIA Kitを用いてELISA (Enzyme-Linked ImmunoSorbent Assay、エライザ) 測定を行い、プロテインAのリーク量を評価した。具体敵には、溶出バッファに0.1mol/LグリシンHCl緩衝液(pH2.0)を使用し、各フラクション(Fraction)を1mol/Lの炭酸ナトリウム水溶液で中和し(pH8.0)、被覆した96マイクロウェルのELISA測定を行った。測定結果を図3に示す。従来のAP担体が約700ng/mg-IgGを示したのに対して、本発明によるプロテインA固定化担体は、ジアミンとして1,6−ヘキシレンジアミン(HDA)を用いた場合、1,2−エチレンジアミン(EDA)を用いた場合、共に約80ng/mg-IgGを示したことから、プロテインAのリーク量を大幅に低減できることが示された。
【0060】
[5]プロテインA固定化担体のアルカリ耐性の評価(アルカリCIP耐久試験)
次に、より実際の産業的使用に近い状況でアルカリCIP耐久試験を行った。ここでは、アルカリCIPによる繰返し洗浄を行い、この繰返し洗浄による能力劣化(キャパシティ劣化)の度合いを確認した。
【0061】
より具体的には、プロテインA固定化担体(1)を4.6mmφ×10mmのステンレスカラムに充填し、ポリクローナルhuman IgG溶液(濃度0.5mg/mL-bed)を流速0.83mL/minでこのカラムに送液し(Loading工程)、次に、PBS緩衝液(pH7.4)溶液を送液してこのカラムを洗浄した(Wash工程)。この後、クエン酸緩衝液(pH2.2)8.3mLによる溶出(Elution工程)、50mMのNaOH水溶液(pH12.7)による20分間の洗浄(アルカリCIP工程)、PBS緩衝液(pH7.4)による平衡化(Conditioning工程)を行った。10サイクルに1回の割合でポリクローナル human IgGのLoadingを繰り返し、DBCを評価した。なお、このDBC評価結果としては、図4に示すように、最初のDBCを100とした場合のこの各サイクル数でのDBCを相対DBC(Relative DBC)(%)として算出した。同図において、曲線aは、本発明によるプロテインA固定化担体(1)の測定結果であり、曲線bは、従来のAP担体の測定結果である。
【0062】
同図から、AP担体では、約20回のアルカリCIPにより相対DBCが80%以下に低下したが、本発明によるプロテインA固定化担体(1)では、アルカリCIPを約120回行った場合でも相対DBCが80%を維持することができ、従来と比較して格段に強いアルカリCIP耐性を有することが示された。
【産業上の利用可能性】
【0063】
本発明の製造方法によって得られるプロテインA固定化担体は、タンパク質の精製に適用できる。その他に、溶出(Elution工程)時の酸性溶液のpH値を変化させることによりタンパク質のサブクラスを分離する用途にも適用できる。
【符号の説明】
【0064】
10 リンカー前駆体
1 担体
2 末端エポキシ基
3 架橋部位
4 直鎖部位
20 リンカー
【特許請求の範囲】
【請求項1】
担体とエポキシ基含有化合物とを、担体の比表面積あたりのエポキシ基含有化合物の量が1.5μmol/m2以上になるように反応させ、ついでジアミンを反応させ、さらにプロテインAを担持させることを特徴とするプロテインA固定化担体の製造方法。
【請求項2】
前記担体が無機酸化物からなる担体である請求項1に記載の製造方法。
【請求項3】
前記エポキシ基含有化合物が、エポキシ基含有シランカップリング剤である請求項1または2に記載の製造方法。
【請求項4】
前記ジアミンが、炭素数2〜10のアルキレン基またはアルケニレン基の両末端にアミノ基を有する化合物である請求項1〜3のいずれかに記載の製造方法。
【請求項1】
担体とエポキシ基含有化合物とを、担体の比表面積あたりのエポキシ基含有化合物の量が1.5μmol/m2以上になるように反応させ、ついでジアミンを反応させ、さらにプロテインAを担持させることを特徴とするプロテインA固定化担体の製造方法。
【請求項2】
前記担体が無機酸化物からなる担体である請求項1に記載の製造方法。
【請求項3】
前記エポキシ基含有化合物が、エポキシ基含有シランカップリング剤である請求項1または2に記載の製造方法。
【請求項4】
前記ジアミンが、炭素数2〜10のアルキレン基またはアルケニレン基の両末端にアミノ基を有する化合物である請求項1〜3のいずれかに記載の製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−1336(P2011−1336A)
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願番号】特願2009−147990(P2009−147990)
【出願日】平成21年6月22日(2009.6.22)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度独立行政法人新エネルギー・産業技術総合開発機構「新機能抗体創製技術開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(390005728)AGCエスアイテック株式会社 (16)
【Fターム(参考)】
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願日】平成21年6月22日(2009.6.22)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度独立行政法人新エネルギー・産業技術総合開発機構「新機能抗体創製技術開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(390005728)AGCエスアイテック株式会社 (16)
【Fターム(参考)】
[ Back to top ]

