新規な光学分割方法
【課題】操作が簡便で多くの物質に適用可能な、高い分割能力を持つ新たな光学分割法および当該光学分割方法に利用可能なゲルを提供する。
【解決手段】親水基中に不斉炭素原子を有する両親媒性分子の集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記両親媒性分子集合体に吸着させることを特徴とする光学分割方法、ならびに、両親媒性分子の集合体が均一に分散されており、かつ、当該集合体の体積分率が20%以上であることを特徴とするゲル。
【解決手段】親水基中に不斉炭素原子を有する両親媒性分子の集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記両親媒性分子集合体に吸着させることを特徴とする光学分割方法、ならびに、両親媒性分子の集合体が均一に分散されており、かつ、当該集合体の体積分率が20%以上であることを特徴とするゲル。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、光学分割方法に関するものであり、詳細には、リポソーム等の両親媒性分子集合体を用いる光学分割方法および当該光学分割方法に利用可能な両親媒性分子集合体含有ゲルに関するものである。
【背景技術】
【0002】
有機化合物には不斉炭素を中心としたキラル体(エナンチオマー)が存在し、それぞれで生理活性が異なる場合がある。医薬品合成などの分野においては、エナンチオマーの分離(光学分割)や選択的な生成(不斉合成)が重要であり、これまで多くの研究が行われている。現在、光学分割では光学分割クロマトグラフィー、ジアステレオマー塩法、優先晶析法などが実用化されている。光学分割クロマトグラフィーは、固定相にフェニルカルバメート誘導体などの光学認識部位を持つ高分子を用いて速度論的に光学分割を行うものである(非特許文献1)。光学分割クロマトグラフィーは、精密分析に広く用いられているが、大規模化に不向きで、高次構造の安定化が分離に必須となるなどの問題がある。ジアステレオマー塩法は、L−酒石酸などのキラル分子で塩を作って物性の異なるジアステレオマーにして分離する操作である。ジアステレオマー塩法は、工業プロセスでも活用されているが、分割対象に対し個別の条件設定が必要であり、塩の分離が反応ステップを増やしてしまうといった課題が存在している。優先晶析法に関しては未だ知見は少なく、分割可能な物質も限られている。こうした中、操作が簡便で多くの物質に適用可能な、高い分割能力を持つ新たな光学分割法の開発が求められている。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】Kaida, J. Okamoto, Y. J., Chromatogr., 641, 267(1993)
【非特許文献2】Jaques, J., “Enantiomers, Racemates, and Resolutions” ; Wiley ; 1981, pp.328-354
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、操作が簡便で多くの物質に適用可能な、高い分割能力を持つ新たな光学分割法を提供することを課題とする。また、当該光学分割方法に利用可能なゲルを提供することを課題とする。
【課題を解決するための手段】
【0005】
本発明は、上記課題を解決するために以下の各発明を包含する。
[1]親水基中に不斉炭素原子を有する両親媒性分子の集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させることを特徴とする光学分割方法。
[2]前記集合体が、リポソーム、ベシクル、ミセル、生体膜の脂質構成部位、平面脂質膜または基材上に形成された両親媒性分子膜である前記[1]に記載の光学分割方法。
[3]前記集合体がリポソームである前記[2]に記載の光学分割方法。
[4]前記親水基中に不斉炭素原子を有する両親媒性分子がグリセロ脂質である前記[1]〜[3]のいずれかに記載の光学分割方法。
[5]グリセロ脂質がグリセロリン脂質である前記[4]に記載の光学分割方法。
[6]前記集合体を含有するゲルを用いることを特徴とする前記[1]〜[5]のいずれかに記載の光学分割方法。
[7]両親媒性分子の集合体が均一に分散されており、かつ、当該集合体の体積分率が20%以上であることを特徴とするゲル。
[8]前記集合体がリポソームである前記[7]に記載のゲル。
[9]前記[7]または[8]に記載のゲルの製造方法であって、両親媒性分子の集合体の懸濁液を調製する工程と、得られた懸濁液を濃縮し両親媒性分子の集合体の濃縮液を調製する工程と、得られた濃縮液とゲル調製試薬との混合液を調製する工程と、得られた混合液をゲル化させる工程と、を包含することを特徴とするゲルの製造方法。
[10]親水基中に不斉炭素原子を有する両親媒性分子の集合体を酸化触媒機能を有する金属錯体で修飾した集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させ、さらに酸化させることを特徴とする不斉合成方法。
【発明の効果】
【0006】
本発明により、操作が簡便で多くの物質に適用可能な、高い分割能力を持つ新たな光学分割法を提供することができる。また、本発明により、両親媒性分子の集合体が均一に高い体積分率で含有されるゲルを提供することができる。
【図面の簡単な説明】
【0007】
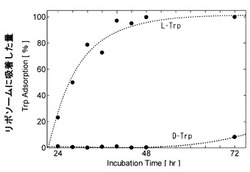
【図1】L,D−TrpをDPPCリポソームへ吸着させた結果を示す図である。
【図2】各種L,D−アミノ酸をDPPCリポソームへ吸着させた結果を示す図である。
【図3】L,D−TrpをDPPCリポソームへ吸着させた前後のCDスペクトルの変化を示す図である。
【図4】リポソーム固定化ゲルとリポソームを含有しないポリアクリルアミドゲルの強度を比較した結果を示す図である。
【図5】リポソーム固定化ゲルを用いて光学分割を行うための装置を示す図である。
【図6】図5の装置を用いてL,D−Trpの光学分割を行った結果を示す図である。
【発明を実施するための形態】
【0008】
〔光学分割方法〕
本発明の光学分割方法は、親水基中に不斉炭素原子を有する両親媒性分子の集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させる方法である。本発明の光学分割方法に用いる両親媒性分子は、親水基中に不斉炭素原子を有するものであればよい。このような両親媒性分子として、グリセロ脂質、スフィンゴ脂質、コレステロール、カチオン性脂質、アニオン性脂質、界面活性剤、水溶性高分子の脂質または脂肪酸誘導体などが挙げられ、これらのなかで親水基中に不斉炭素原子を有するものを好適に用いることができる。なかでも、グリセロ脂質、スフィンゴ脂質が好ましく、より好ましくはグリセロ脂質である。
【0009】
グリセロ脂質としては、ジアシルグリセロール、グリセロリン脂質、グリセロ糖脂質などが挙げられ、なかでもジアシルグリセロール、グリセロリン脂質が好ましい。グリセロリン脂質としては、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジン酸、ホスファチジルセリン、ホスファチジルグリセロール、ホスファチジルイノシトール、リゾホスファチジルコリンなどが挙げられる。
【0010】
本発明の光学分割方法に用いられる親水基中に不斉炭素原子を有する両親媒性分子の集合体(以下「不斉炭素原子を有する両親媒性分子集合体」という。)は、親水基中に不斉炭素原子を有する両親媒性分子を含むものであればよく、親水基中に不斉炭素原子を有する両親媒性分子のみからなるものであることを要しない。不斉炭素原子を有する両親媒性分子集合体の形態は特に限定されず、例えば、リポソーム、ベシクル、ミセル、生体膜の脂質構成部位、平面脂質膜、基材上に形成された両親媒性分子膜などが挙げられる。なかでも、安定な分子集合体であり、応用範囲が広い点でリポソームが好ましい。不斉炭素原子を有する両親媒性分子集合体は、人工的に調製されたものでもよく、天然に存在するものでもよい。両親媒性分子膜を形成させる基材は、その表面に両親媒性分子膜を形成できるものであれば特に限定されない。例えば、金属板、ガラス板、高分子膜などが挙げられる。
【0011】
本発明の光学分割方法の対象は光学異性体混合物であればよい。光学異性体混合物はラセミ体でもよく、ラセミ体でない混合物でもよい。本発明の光学分割方法の対象としては、例えば、アラニン、バリン、ロイシン、イソロイシン、セリン、トレオニン、システイン、シスチン、メチオニン、アスパラギン酸、グルタミン酸、リシン、アルギニン、フェニルアラニン、チロシン、ヒスチジン、トリプトファン等のアミノ酸類;イブプロフェン等の医薬などが挙げられるが、これらに限定されない。
【0012】
不斉炭素原子を有する両親媒性分子集合体と光学異性体混合物との接触はどのような方法で行ってもよい。例えば、不斉炭素原子を有する両親媒性分子集合体が平面脂質膜の場合には、平面膜の一方の水相に光学異性体混合物の水溶液を添加する方法が挙げられる。また、不斉炭素原子を有する両親媒性分子集合体が平面脂質膜以外(リポソーム等)の場合には、光学異性体混合物溶液に両親媒性分子集合体を浸漬または懸濁して攪拌する方法が挙げられる。接触時間、接触温度等の条件も特に限定されず、用いる両親媒性分子集合体と光学分割対象の光学異性体混合物に応じて、個々に具体的な至適条件を設定すればよい。
【0013】
不斉炭素原子を有する両親媒性分子集合体に吸着しない光学異性体は、接触後の光学異性体混合物溶液から回収することができる。不斉炭素原子を有する両親媒性分子集合体に吸着する光学異性体は、例えば、水溶液の温度を変化させて、両親媒性分子集合体の相状態をゲル相から液晶相に変化させることにより回収することができる。
【0014】
本発明の光学分割方法は、光学異性体混合物中の一方の光学異性体が不斉炭素原子を有する両親媒性分子集合体に吸着するものであるので、操作が非常に簡便である。また、両親媒性分子集合体の表面の相状態に依存するため、温度変化など、両親媒性分子の化学構造に変化を伴わない非侵襲な操作条件で、光学異性体の吸着・脱着を簡便に操作できる。また、上記の光学分割能を保持させつつ、集合体表層に触媒機能を付与すれば、不斉合成にも活用できる。したがって、本発明の光学分割方法は、医薬、農薬、食品等の分野において非常に有用である。
【0015】
〔不斉合成方法〕
本発明の光学分割方法において、不斉炭素原子を有する両親媒性分子集合体を酸化触媒機能を有する金属錯体で修飾した集合体を用いることにより、光学異性体混合物中の一方の光学異性体を両親媒性分子集合体に吸着させた後に、さらに酸化させることができる。すなわち、本発明は、親水基中に不斉炭素原子を有する両親媒性分子の集合体を酸化触媒機能を有する金属錯体で修飾した集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させ、さらに酸化させることを特徴とする不斉合成方法を提供する。
【0016】
酸化触媒機能を有する金属錯体としては、ポルフィリン型リガンド(H. Umakoshi et al., Langmuir, 24(9), 4451-4455 (2008))、ヒスチジン型リガンド(H. Umakoshi et al., J. Biotechnol., 147(1), 59-63 (2010))、ペプチド型リガンド(L.Q.Tuan et al., Langmuir, 24(3), 350-354 (2008)、J Biosci Bioeng., 100, 455-459 (2005))などが挙げられる。両親媒性分子集合体と光学異性体混合物との接触方法は、上記本発明の光学分割方法と同様に行うことができる。リポソーム界面で酸化された分子は、親水性が増加し、膜から、水溶液中に移行する。残存した生成物は、リポソームの相状態を制御して、水溶液中に回収することができる。
【0017】
〔ゲルおよびゲルの製造方法〕
本発明は、両親媒性分子の集合体が均一に分散されており、かつ、当該集合体の体積分率が20%以上であるゲルを提供する。本発明のゲルに含有される両親媒性分子の集合体は、親水基中に不斉炭素原子を有する両親媒性分子の集合体に限定されない。したがって、親水基中に不斉炭素原子を有しない両親媒性分子のみの集合体でもよく、親水基中に不斉炭素原子を有する両親媒性分子のみの集合体でもよく、両方の両親媒性分子が混在した集合体でもよい。少なくとも親水基中に不斉炭素原子を有する両親媒性分子を含む集合体を含有する本発明のゲルは、上記本発明の光学分割方法に好適に用いることができる。上記本発明の光学分割方法において、親水基中に不斉炭素原子を有する両親媒性分子を含む集合体を含有させたゲルを用いることにより、上記本発明の光学分割方法を非常に簡便に実施することが可能となる。
【0018】
集合体を構成する両親媒性分子は特に限定されず、グリセロ脂質、スフィンゴ脂質、コレステロール、カチオン性脂質、アニオン性脂質、界面活性剤、水溶性高分子の脂質または脂肪酸誘導体などが挙げられる。両親媒性分子の集合体の形態は特に限定されず、例えば、リポソーム、ベシクル、ミセル、生体膜の脂質構成部位、平面脂質膜などが挙げられる。なかでもリポソームが好ましい。
【0019】
本発明のゲルは、以下の工程(1)〜(4)を包含する製造方法により製造することができる。すなわち、本発明は、以下の工程(1)〜(4)を包含するゲルの製造方法を提供する。
工程(1):両親媒性分子の集合体の懸濁液を調製する工程
工程(2):得られた懸濁液を濃縮し両親媒性分子の集合体の濃縮液を調製する工程
工程(3):得られた濃縮液とゲル調製試薬との混合液を調製する工程
工程(4):得られた混合液をゲル化させる工程
以下、両親媒性分子の集合体がリポソームである本発明のゲルを代表例として説明するが、他の両親媒性分子の集合体についても同様である。
【0020】
工程(1)では、例えば、リン脂質の有機溶媒溶液から溶媒を留去してリン脂質薄膜を調製し、そこに水を加えることによりリポソームの懸濁液を調製する。
工程(2)では、例えば、(1)で得られたリポソームの懸濁液を超遠心分離、濾過等に供し、リポソームの濃縮液を調製する。濃縮液の濃度を測定し、適宜希釈して所望の濃度の濃縮液を調製してもよい。濃縮液の濃度は、例えばリポソーム濃縮液のリン脂質濃度を公知の方法で測定することにより求めることができる。
工程(3)では、リポソーム濃縮液とゲル調製試薬とを混合し、混合液を調製する。ゲル調製試薬は特に限定されないが、例えば、アガロース、アクリルアミドなどが挙げられる。
工程(4)では、混合液をゲル化させる。具体的には、例えば、アガロースの場合は、アガロースを溶解させた混合液を冷却することでゲル化させることができる。例えば、アクリルアミドの場合は、架橋剤(N,N,N’,N’−テトラメチルエチレンジアミン(TEMED)および過硫酸アンモニウム(APS))を添加してゲル化させる。
【0021】
上記の製造方法で作製されたゲルは、リポソームが均一に分散されたゲルとなる。リポソームが均一に分散されていることは、例えば、蛍光標識されたリポソームを用いて上記の製造方法でゲルを作製し、共焦点顕微鏡を用いて観察することにより確認することができる。リポソームがゲル中に均一に分散されていることにより、固体材料の調製時に見られる、構造欠陥・ピンホールなどの欠点を克服することができ、より精密な光学分割も可能となる。
【0022】
本発明のゲルは、リポソームの体積分率が20%以上である。好ましくは30%以上、より好ましくは40%以上、さらに好ましくは50%以上、特に好ましくは60%〜90%である。リポソームの体積分率は、上記工程(2)でリポソーム濃縮液の濃度を調製することにより所望の体積分率を有するゲルを製造することができる。また、実施例2に記載の方法により計算することができる。上記工程(2)でリポソーム濃縮液の濃度は、約60mM以上が好ましく、より好ましくは約100mM以上、さらに好ましくは約130〜180mMである。本発明のゲルは、高い体積分率でリポソームを含有しても、強度の低下が少ないという特徴を有している(実施例2参照)。
【0023】
従来のリポソーム固定化ゲルは、固定化材料にリポソームを物理的または化学的に固定化する方法が採用されていたが、リポソーム固定化量が少なく、場合によっては安定性の低いものであった(馬越大ら「リポソーム応用の新展開」第8章バイオエンジニアリングにおけるリポソーム第3節リポソームの固定化、エヌティーエス、2005、p.415-p.424)。最近、本発明者らはリポソーム固定化量を大幅に改善する手法を開発した(H. Sugaya et al., Membrane, 34(5), 272-280 (2009))。これは、リポソームを通さない傾斜膜に
リポソームを充填し、その後ハイドロゲルポリマーを充填する手法である。しかし、高濃度に濃縮されたリポソーム同志が相互作用し、リポソーム表層の有効な分子認識部分がマスキング・変質してしまう可能性がある。
一方、本発明のゲルは、水溶液中に分散懸濁した状態で、ゲル化する戦略を用いているため、上記の様な欠点は生じない。また、ゲルを調製する容器を変えれば、様々な形のゲル材料を作製することも可能である。さらにゲル材料は、従来の工業分離技術(クロマトグラフィー、電気泳動装置など)にも活用してされており、本発明のゲルを用いて、従来の技術の付加価値を大幅に改善することも可能である。
【実施例】
【0024】
以下、実施例により本発明を詳細に説明するが、本発明はこれらに限定されるものではない。
【0025】
〔実施例1:光学分割方法〕
1.実験材料および実験方法
(1-1) リポソームの調製
DPPC(dipalmitoylphosphatidylcholine)からなる脂質薄膜を蒸留水で水和させ、凍結融解法およびエクストルージョン法により粒径約100nmのリポソームを調製した。
(1-2) アミノ酸
L,D−トリプトファン(Trp)、L,D−ヒスチジン(His)、L,D−チロシン(Tyr)、L,D−フェニルアラニン(Phe)、L,D−ロイシン(Leu)を用いた。
(1-3) 吸着率の測定
L,D−アミノ酸とリポソームを濃度比1:9で共存させた水溶液を25℃で恒温静置し、24時間以後経時的にサンプリングして、限外ろ過(孔径50kDa)によりリポソームに吸着しなかったアミノ酸を分離した。リポソーム非共存下との漏出液の濃度差をアミノ酸の種類に応じてUVスペクトル(A280、A220)、CDスペクトル(θ222)、フルオレスカミン蛍光(λex=390nm、λem=475nm)により測定し、物質収支を考慮することにより吸着率を評価した。
【0026】
2.結果
(2-1) L,D−Trpの吸着率
L,D−TrpをDPPCリポソームへ吸着させた結果を図1に示した。図1から明らかなように、24時間以上静置したときに、L−TrpのみDPPCリポソームへの吸着が始まり、48時間後にはほぼ100%の吸着率を示し、飽和に達したと認められた。その間、D−Trpは全く吸着されなかった。この結果から、DPPCリポソームに吸着されるL−Trpと、吸着されずに溶液中に残るD−Trpに分離できることが明らかとなった。
(2-2) 各種L,D−アミノ酸の吸着率
5種類のL,D−アミノ酸(L,D−Trp、L,D−His、L,D−Tyr、L,D−Phe、L,D−Leu)をDPPCリポソーム共存下で48時間静置した後の吸着率を図2に示した。図2から明らかなように、試験に供した5種類のL,D−アミノ酸は、いずれもL体のほうが大きな吸着率を示した。
【0027】
(2-3) 吸着前後のCDスペクトルの変化
L,D−TrpとDPPCリポソームとの共存溶液を48時間静置し、その前後にSDスペクトル測定した。結果を図3に示した。図3から明らかなように、48時間静置の溶液中にはD−Trpのみが存在した。
(2-4) 吸着前後のCDスペクトルの変化
図3のデータに基づいて、L,D−Trpの吸着選択度を以下の式で求めた。
SA(L/D)={(L-Trp)/(D-Trp)}/{[L-Trp]/[D-Trp]}
ここで、(L-Trp)、(D-Trp)は平衡後にリポソームに吸着されたD-TrpならびにD-Trpの吸着量を、また、[L-Trp]、[D-Trp]は試料と平衡している溶液中のL-TrpならびにD-Trpの濃度を示す。
結果を表1に示した。表1の参考1は、Yoshikawaらの文献(M. Yoshikawa et al., Polymer, 49, 21(2008))に記載の光学分離用膜を用いたトリプトファンの吸着選択度(SA(L/D))の数値、参考2は、文献(『キラル分離の理論と実際』 学会出版センター p.194)に記載のキラルカラムを用いたトリプトファンの吸着選択度(SA(L/D))の数値、参考3は、特開2007−297356号公報に記載の光学分離用膜を用いたトリプトファンの吸着選択度(SA(L/D))の数値をそれぞれ示す。表1の数値から、本発明の光学分離方法は、従来の膜やカラムを用いる光学分離方法より吸着選択性が顕著に高いことが明らかとなった。
【0028】
【表1】

【0029】
〔実施例2:リポソーム固定化ゲル〕
1.リポソーム固定化ゲルの調製
所定量のPOPC(palmitoyloleoylphosphatidylcholine)を溶解したクロロホルム溶液を溶媒留去してリン脂質薄膜を調製し、最終濃度60mMになる様に純水を加えて、リポソーム懸濁液を調製した。リポソームの粒径を増加させるために凍結(−80℃)および融解(恒温槽(相転移温度以上))操作を5回繰り返した。得られたリポソーム懸濁液を超遠心分離(50000rpm、4℃、2時間)して濃縮した。エクストルージョン法により、粒径約200nmのリポソームを得た。得られてリポソーム懸濁液について、リン脂質テストワコーC(和光純薬製)を用いてリン脂質濃度を測定した。
アクリルアミド溶液は、アクリルアミド29.2に対して、0.8のN,N’−メチレンビス(アクリルアミド)−HG(BIS)を混合して調製した。緩衝液は、Tris 0.3gとGlycien 1.44gを100mlの純水に溶解し、12N HClでpHを8.3に調整して、調製した。
濃縮リポソーム懸濁液(約110mMまたは約140mM)6.5mlに、アクリルアミド溶液2.5mlおよび緩衝液2.5mlを混合し、真空中で撹拌しながら約30分間脱気した。その後、触媒(過硫酸アンモニウム(10wt%)50μlおよびN,N,N’,N’−テトラメチルエチレンジアミン(TEMED)10μl)を添加し、自作のゲル調製装置(2mmの間隔で設置した2枚のガラス板)に流し込んで、2種類のリポソーム固定化ゲルを調製した。
【0030】
2.リポソーム体積分率(%)の算出
調製した2種類のリポソーム固定化ゲルについて、リポソーム体積分率(%)を計算で求めた。計算方法は以下のとおりである。
(1) リポソームを含有しないポリアクリルアミドゲル(以下「PAゲル」という。)について、PAゲルのみの重量分率を求める。
(2) リポソームを含有しないPAゲルの含水率と、リポソーム固定化ゲルの含水率を比較し、リポソーム膜のみの重量分率を求める。
(3) 上記(2)で求めたリポソーム膜のみの重量分率から、リポソームの体積を求める。
(4) ゲル全体の体積に対するリポソームの体積を計算し、リポソーム体積分率(%)を求める。
【0031】
計算により得られた2種類のリポソーム固定化ゲルのリポソーム体積分率(%)を表2に示した。いずれのゲルも、リポソーム体積分率(%)が非常に高いことが示された。
【表2】

【0032】
3.リポソーム固定化ゲルの強度測定
リポソーム固定化ゲルの圧縮臨界点を測定し、リポソームを含有しないPAゲルの圧縮臨界点と比較した。ゲルをノギスで挟み、壊れるまで少しずつ押してゆき、壊れた長さを記録した。圧縮臨界点は以下の式で求めた。
圧縮臨界点(δ)=(L0−L)/L0×100
ここで、Lは壊れた時点の厚みを、L0は元の厚みを示す。
リポソームを含有しないPAゲルは、PAゲル濃度が5wt%、8wt%、12.5wt%、15wt%、20wt%、30wt%、40wt%および50wt%の8種類を使用した。
リポソーム固定化ゲルは、上記ゲル1およびゲル2以外に、3種類を用いた。具体的には、ゲル3は粒径100nmのリポソーム懸濁液(POPC濃度約7mM)を用いて調製したリポソーム固定化ゲル、ゲル4は粒径100nmのリポソーム懸濁液(POPC濃度約36mM)を用いて調製したリポソーム固定化ゲル、ゲル5は粒径100nmのリポソーム懸濁液(POPC濃度約107mM)を用いて調製したリポソーム固定化ゲルである。リポソーム固定化ゲルのPAゲル濃度は、以下の式で求めた。
PAゲル濃度(wt%)=12.5×V/(V−VL)
ここで、Vはリポソームなしの場合のゲル中の水の体積を、VLはゲル中のリポソームの体積を示す。
【0033】
各リポソーム固定化ゲルにおけるリポソームの体積分率(%)、PAゲル濃度(wt%)および圧縮臨界点(%)を表3に示した。また、リポソームを含有しないPAゲルの圧縮臨界点(%)との比較を図4に示した。図4から明らかなように、リポソームを含有しないPAゲルはPAゲル濃度が高くなると圧縮臨界点(%)が大幅に低下するが、リポソーム固定化ゲルはPAゲル濃度が高くなっても圧縮臨界点(%)低下の程度が少なかった。この結果から、リポソーム固定化ゲルは、リポソームの体積分率が高くなっても高い強度を維持することが示された。
【0034】
【表3】

【0035】
4.リポソーム固定化ゲルによるL,D−Trpの光学分離
図5に示した装置を自作し、上記ゲル1を用いてL,D−Trpの光学分離を試みた。すなわち、セルロース膜(孔径100kDa)で挟んだゲル1を装着したチャンバーに10mMのL,D−Trp溶液を100μl添加し、チャンバーを純水中に入れ、室温または50℃で24時間以上(平衡状態に達するまで)攪拌した。ゲル1を透過してチャンバー外の純水中に流出したL−TrpおよびD−Trp量を測定し、流出率を計算した。
【0036】
結果を図6に示した。図6から明らかなように、室温ではD−Trpはゲル1を透過して純水中に流出し、L−Trpはゲル1に吸着してほとんど透過しないことが示された。また、50℃では、L−Trpもゲル1を透過し、両者の流出率はほぼ同じであった。この結果から、POPCリポソーム固定化ゲルが光学分離に利用できること、温度を制御することにより、吸脱着モードを制御可能であることが示された。
【0037】
なお本発明は上述した各実施形態および実施例に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。また、本明細書中に記載された学術文献および特許文献の全てが、本明細書中において参考として援用される。
【技術分野】
【0001】
本発明は、光学分割方法に関するものであり、詳細には、リポソーム等の両親媒性分子集合体を用いる光学分割方法および当該光学分割方法に利用可能な両親媒性分子集合体含有ゲルに関するものである。
【背景技術】
【0002】
有機化合物には不斉炭素を中心としたキラル体(エナンチオマー)が存在し、それぞれで生理活性が異なる場合がある。医薬品合成などの分野においては、エナンチオマーの分離(光学分割)や選択的な生成(不斉合成)が重要であり、これまで多くの研究が行われている。現在、光学分割では光学分割クロマトグラフィー、ジアステレオマー塩法、優先晶析法などが実用化されている。光学分割クロマトグラフィーは、固定相にフェニルカルバメート誘導体などの光学認識部位を持つ高分子を用いて速度論的に光学分割を行うものである(非特許文献1)。光学分割クロマトグラフィーは、精密分析に広く用いられているが、大規模化に不向きで、高次構造の安定化が分離に必須となるなどの問題がある。ジアステレオマー塩法は、L−酒石酸などのキラル分子で塩を作って物性の異なるジアステレオマーにして分離する操作である。ジアステレオマー塩法は、工業プロセスでも活用されているが、分割対象に対し個別の条件設定が必要であり、塩の分離が反応ステップを増やしてしまうといった課題が存在している。優先晶析法に関しては未だ知見は少なく、分割可能な物質も限られている。こうした中、操作が簡便で多くの物質に適用可能な、高い分割能力を持つ新たな光学分割法の開発が求められている。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】Kaida, J. Okamoto, Y. J., Chromatogr., 641, 267(1993)
【非特許文献2】Jaques, J., “Enantiomers, Racemates, and Resolutions” ; Wiley ; 1981, pp.328-354
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、操作が簡便で多くの物質に適用可能な、高い分割能力を持つ新たな光学分割法を提供することを課題とする。また、当該光学分割方法に利用可能なゲルを提供することを課題とする。
【課題を解決するための手段】
【0005】
本発明は、上記課題を解決するために以下の各発明を包含する。
[1]親水基中に不斉炭素原子を有する両親媒性分子の集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させることを特徴とする光学分割方法。
[2]前記集合体が、リポソーム、ベシクル、ミセル、生体膜の脂質構成部位、平面脂質膜または基材上に形成された両親媒性分子膜である前記[1]に記載の光学分割方法。
[3]前記集合体がリポソームである前記[2]に記載の光学分割方法。
[4]前記親水基中に不斉炭素原子を有する両親媒性分子がグリセロ脂質である前記[1]〜[3]のいずれかに記載の光学分割方法。
[5]グリセロ脂質がグリセロリン脂質である前記[4]に記載の光学分割方法。
[6]前記集合体を含有するゲルを用いることを特徴とする前記[1]〜[5]のいずれかに記載の光学分割方法。
[7]両親媒性分子の集合体が均一に分散されており、かつ、当該集合体の体積分率が20%以上であることを特徴とするゲル。
[8]前記集合体がリポソームである前記[7]に記載のゲル。
[9]前記[7]または[8]に記載のゲルの製造方法であって、両親媒性分子の集合体の懸濁液を調製する工程と、得られた懸濁液を濃縮し両親媒性分子の集合体の濃縮液を調製する工程と、得られた濃縮液とゲル調製試薬との混合液を調製する工程と、得られた混合液をゲル化させる工程と、を包含することを特徴とするゲルの製造方法。
[10]親水基中に不斉炭素原子を有する両親媒性分子の集合体を酸化触媒機能を有する金属錯体で修飾した集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させ、さらに酸化させることを特徴とする不斉合成方法。
【発明の効果】
【0006】
本発明により、操作が簡便で多くの物質に適用可能な、高い分割能力を持つ新たな光学分割法を提供することができる。また、本発明により、両親媒性分子の集合体が均一に高い体積分率で含有されるゲルを提供することができる。
【図面の簡単な説明】
【0007】
【図1】L,D−TrpをDPPCリポソームへ吸着させた結果を示す図である。
【図2】各種L,D−アミノ酸をDPPCリポソームへ吸着させた結果を示す図である。
【図3】L,D−TrpをDPPCリポソームへ吸着させた前後のCDスペクトルの変化を示す図である。
【図4】リポソーム固定化ゲルとリポソームを含有しないポリアクリルアミドゲルの強度を比較した結果を示す図である。
【図5】リポソーム固定化ゲルを用いて光学分割を行うための装置を示す図である。
【図6】図5の装置を用いてL,D−Trpの光学分割を行った結果を示す図である。
【発明を実施するための形態】
【0008】
〔光学分割方法〕
本発明の光学分割方法は、親水基中に不斉炭素原子を有する両親媒性分子の集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させる方法である。本発明の光学分割方法に用いる両親媒性分子は、親水基中に不斉炭素原子を有するものであればよい。このような両親媒性分子として、グリセロ脂質、スフィンゴ脂質、コレステロール、カチオン性脂質、アニオン性脂質、界面活性剤、水溶性高分子の脂質または脂肪酸誘導体などが挙げられ、これらのなかで親水基中に不斉炭素原子を有するものを好適に用いることができる。なかでも、グリセロ脂質、スフィンゴ脂質が好ましく、より好ましくはグリセロ脂質である。
【0009】
グリセロ脂質としては、ジアシルグリセロール、グリセロリン脂質、グリセロ糖脂質などが挙げられ、なかでもジアシルグリセロール、グリセロリン脂質が好ましい。グリセロリン脂質としては、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジン酸、ホスファチジルセリン、ホスファチジルグリセロール、ホスファチジルイノシトール、リゾホスファチジルコリンなどが挙げられる。
【0010】
本発明の光学分割方法に用いられる親水基中に不斉炭素原子を有する両親媒性分子の集合体(以下「不斉炭素原子を有する両親媒性分子集合体」という。)は、親水基中に不斉炭素原子を有する両親媒性分子を含むものであればよく、親水基中に不斉炭素原子を有する両親媒性分子のみからなるものであることを要しない。不斉炭素原子を有する両親媒性分子集合体の形態は特に限定されず、例えば、リポソーム、ベシクル、ミセル、生体膜の脂質構成部位、平面脂質膜、基材上に形成された両親媒性分子膜などが挙げられる。なかでも、安定な分子集合体であり、応用範囲が広い点でリポソームが好ましい。不斉炭素原子を有する両親媒性分子集合体は、人工的に調製されたものでもよく、天然に存在するものでもよい。両親媒性分子膜を形成させる基材は、その表面に両親媒性分子膜を形成できるものであれば特に限定されない。例えば、金属板、ガラス板、高分子膜などが挙げられる。
【0011】
本発明の光学分割方法の対象は光学異性体混合物であればよい。光学異性体混合物はラセミ体でもよく、ラセミ体でない混合物でもよい。本発明の光学分割方法の対象としては、例えば、アラニン、バリン、ロイシン、イソロイシン、セリン、トレオニン、システイン、シスチン、メチオニン、アスパラギン酸、グルタミン酸、リシン、アルギニン、フェニルアラニン、チロシン、ヒスチジン、トリプトファン等のアミノ酸類;イブプロフェン等の医薬などが挙げられるが、これらに限定されない。
【0012】
不斉炭素原子を有する両親媒性分子集合体と光学異性体混合物との接触はどのような方法で行ってもよい。例えば、不斉炭素原子を有する両親媒性分子集合体が平面脂質膜の場合には、平面膜の一方の水相に光学異性体混合物の水溶液を添加する方法が挙げられる。また、不斉炭素原子を有する両親媒性分子集合体が平面脂質膜以外(リポソーム等)の場合には、光学異性体混合物溶液に両親媒性分子集合体を浸漬または懸濁して攪拌する方法が挙げられる。接触時間、接触温度等の条件も特に限定されず、用いる両親媒性分子集合体と光学分割対象の光学異性体混合物に応じて、個々に具体的な至適条件を設定すればよい。
【0013】
不斉炭素原子を有する両親媒性分子集合体に吸着しない光学異性体は、接触後の光学異性体混合物溶液から回収することができる。不斉炭素原子を有する両親媒性分子集合体に吸着する光学異性体は、例えば、水溶液の温度を変化させて、両親媒性分子集合体の相状態をゲル相から液晶相に変化させることにより回収することができる。
【0014】
本発明の光学分割方法は、光学異性体混合物中の一方の光学異性体が不斉炭素原子を有する両親媒性分子集合体に吸着するものであるので、操作が非常に簡便である。また、両親媒性分子集合体の表面の相状態に依存するため、温度変化など、両親媒性分子の化学構造に変化を伴わない非侵襲な操作条件で、光学異性体の吸着・脱着を簡便に操作できる。また、上記の光学分割能を保持させつつ、集合体表層に触媒機能を付与すれば、不斉合成にも活用できる。したがって、本発明の光学分割方法は、医薬、農薬、食品等の分野において非常に有用である。
【0015】
〔不斉合成方法〕
本発明の光学分割方法において、不斉炭素原子を有する両親媒性分子集合体を酸化触媒機能を有する金属錯体で修飾した集合体を用いることにより、光学異性体混合物中の一方の光学異性体を両親媒性分子集合体に吸着させた後に、さらに酸化させることができる。すなわち、本発明は、親水基中に不斉炭素原子を有する両親媒性分子の集合体を酸化触媒機能を有する金属錯体で修飾した集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させ、さらに酸化させることを特徴とする不斉合成方法を提供する。
【0016】
酸化触媒機能を有する金属錯体としては、ポルフィリン型リガンド(H. Umakoshi et al., Langmuir, 24(9), 4451-4455 (2008))、ヒスチジン型リガンド(H. Umakoshi et al., J. Biotechnol., 147(1), 59-63 (2010))、ペプチド型リガンド(L.Q.Tuan et al., Langmuir, 24(3), 350-354 (2008)、J Biosci Bioeng., 100, 455-459 (2005))などが挙げられる。両親媒性分子集合体と光学異性体混合物との接触方法は、上記本発明の光学分割方法と同様に行うことができる。リポソーム界面で酸化された分子は、親水性が増加し、膜から、水溶液中に移行する。残存した生成物は、リポソームの相状態を制御して、水溶液中に回収することができる。
【0017】
〔ゲルおよびゲルの製造方法〕
本発明は、両親媒性分子の集合体が均一に分散されており、かつ、当該集合体の体積分率が20%以上であるゲルを提供する。本発明のゲルに含有される両親媒性分子の集合体は、親水基中に不斉炭素原子を有する両親媒性分子の集合体に限定されない。したがって、親水基中に不斉炭素原子を有しない両親媒性分子のみの集合体でもよく、親水基中に不斉炭素原子を有する両親媒性分子のみの集合体でもよく、両方の両親媒性分子が混在した集合体でもよい。少なくとも親水基中に不斉炭素原子を有する両親媒性分子を含む集合体を含有する本発明のゲルは、上記本発明の光学分割方法に好適に用いることができる。上記本発明の光学分割方法において、親水基中に不斉炭素原子を有する両親媒性分子を含む集合体を含有させたゲルを用いることにより、上記本発明の光学分割方法を非常に簡便に実施することが可能となる。
【0018】
集合体を構成する両親媒性分子は特に限定されず、グリセロ脂質、スフィンゴ脂質、コレステロール、カチオン性脂質、アニオン性脂質、界面活性剤、水溶性高分子の脂質または脂肪酸誘導体などが挙げられる。両親媒性分子の集合体の形態は特に限定されず、例えば、リポソーム、ベシクル、ミセル、生体膜の脂質構成部位、平面脂質膜などが挙げられる。なかでもリポソームが好ましい。
【0019】
本発明のゲルは、以下の工程(1)〜(4)を包含する製造方法により製造することができる。すなわち、本発明は、以下の工程(1)〜(4)を包含するゲルの製造方法を提供する。
工程(1):両親媒性分子の集合体の懸濁液を調製する工程
工程(2):得られた懸濁液を濃縮し両親媒性分子の集合体の濃縮液を調製する工程
工程(3):得られた濃縮液とゲル調製試薬との混合液を調製する工程
工程(4):得られた混合液をゲル化させる工程
以下、両親媒性分子の集合体がリポソームである本発明のゲルを代表例として説明するが、他の両親媒性分子の集合体についても同様である。
【0020】
工程(1)では、例えば、リン脂質の有機溶媒溶液から溶媒を留去してリン脂質薄膜を調製し、そこに水を加えることによりリポソームの懸濁液を調製する。
工程(2)では、例えば、(1)で得られたリポソームの懸濁液を超遠心分離、濾過等に供し、リポソームの濃縮液を調製する。濃縮液の濃度を測定し、適宜希釈して所望の濃度の濃縮液を調製してもよい。濃縮液の濃度は、例えばリポソーム濃縮液のリン脂質濃度を公知の方法で測定することにより求めることができる。
工程(3)では、リポソーム濃縮液とゲル調製試薬とを混合し、混合液を調製する。ゲル調製試薬は特に限定されないが、例えば、アガロース、アクリルアミドなどが挙げられる。
工程(4)では、混合液をゲル化させる。具体的には、例えば、アガロースの場合は、アガロースを溶解させた混合液を冷却することでゲル化させることができる。例えば、アクリルアミドの場合は、架橋剤(N,N,N’,N’−テトラメチルエチレンジアミン(TEMED)および過硫酸アンモニウム(APS))を添加してゲル化させる。
【0021】
上記の製造方法で作製されたゲルは、リポソームが均一に分散されたゲルとなる。リポソームが均一に分散されていることは、例えば、蛍光標識されたリポソームを用いて上記の製造方法でゲルを作製し、共焦点顕微鏡を用いて観察することにより確認することができる。リポソームがゲル中に均一に分散されていることにより、固体材料の調製時に見られる、構造欠陥・ピンホールなどの欠点を克服することができ、より精密な光学分割も可能となる。
【0022】
本発明のゲルは、リポソームの体積分率が20%以上である。好ましくは30%以上、より好ましくは40%以上、さらに好ましくは50%以上、特に好ましくは60%〜90%である。リポソームの体積分率は、上記工程(2)でリポソーム濃縮液の濃度を調製することにより所望の体積分率を有するゲルを製造することができる。また、実施例2に記載の方法により計算することができる。上記工程(2)でリポソーム濃縮液の濃度は、約60mM以上が好ましく、より好ましくは約100mM以上、さらに好ましくは約130〜180mMである。本発明のゲルは、高い体積分率でリポソームを含有しても、強度の低下が少ないという特徴を有している(実施例2参照)。
【0023】
従来のリポソーム固定化ゲルは、固定化材料にリポソームを物理的または化学的に固定化する方法が採用されていたが、リポソーム固定化量が少なく、場合によっては安定性の低いものであった(馬越大ら「リポソーム応用の新展開」第8章バイオエンジニアリングにおけるリポソーム第3節リポソームの固定化、エヌティーエス、2005、p.415-p.424)。最近、本発明者らはリポソーム固定化量を大幅に改善する手法を開発した(H. Sugaya et al., Membrane, 34(5), 272-280 (2009))。これは、リポソームを通さない傾斜膜に
リポソームを充填し、その後ハイドロゲルポリマーを充填する手法である。しかし、高濃度に濃縮されたリポソーム同志が相互作用し、リポソーム表層の有効な分子認識部分がマスキング・変質してしまう可能性がある。
一方、本発明のゲルは、水溶液中に分散懸濁した状態で、ゲル化する戦略を用いているため、上記の様な欠点は生じない。また、ゲルを調製する容器を変えれば、様々な形のゲル材料を作製することも可能である。さらにゲル材料は、従来の工業分離技術(クロマトグラフィー、電気泳動装置など)にも活用してされており、本発明のゲルを用いて、従来の技術の付加価値を大幅に改善することも可能である。
【実施例】
【0024】
以下、実施例により本発明を詳細に説明するが、本発明はこれらに限定されるものではない。
【0025】
〔実施例1:光学分割方法〕
1.実験材料および実験方法
(1-1) リポソームの調製
DPPC(dipalmitoylphosphatidylcholine)からなる脂質薄膜を蒸留水で水和させ、凍結融解法およびエクストルージョン法により粒径約100nmのリポソームを調製した。
(1-2) アミノ酸
L,D−トリプトファン(Trp)、L,D−ヒスチジン(His)、L,D−チロシン(Tyr)、L,D−フェニルアラニン(Phe)、L,D−ロイシン(Leu)を用いた。
(1-3) 吸着率の測定
L,D−アミノ酸とリポソームを濃度比1:9で共存させた水溶液を25℃で恒温静置し、24時間以後経時的にサンプリングして、限外ろ過(孔径50kDa)によりリポソームに吸着しなかったアミノ酸を分離した。リポソーム非共存下との漏出液の濃度差をアミノ酸の種類に応じてUVスペクトル(A280、A220)、CDスペクトル(θ222)、フルオレスカミン蛍光(λex=390nm、λem=475nm)により測定し、物質収支を考慮することにより吸着率を評価した。
【0026】
2.結果
(2-1) L,D−Trpの吸着率
L,D−TrpをDPPCリポソームへ吸着させた結果を図1に示した。図1から明らかなように、24時間以上静置したときに、L−TrpのみDPPCリポソームへの吸着が始まり、48時間後にはほぼ100%の吸着率を示し、飽和に達したと認められた。その間、D−Trpは全く吸着されなかった。この結果から、DPPCリポソームに吸着されるL−Trpと、吸着されずに溶液中に残るD−Trpに分離できることが明らかとなった。
(2-2) 各種L,D−アミノ酸の吸着率
5種類のL,D−アミノ酸(L,D−Trp、L,D−His、L,D−Tyr、L,D−Phe、L,D−Leu)をDPPCリポソーム共存下で48時間静置した後の吸着率を図2に示した。図2から明らかなように、試験に供した5種類のL,D−アミノ酸は、いずれもL体のほうが大きな吸着率を示した。
【0027】
(2-3) 吸着前後のCDスペクトルの変化
L,D−TrpとDPPCリポソームとの共存溶液を48時間静置し、その前後にSDスペクトル測定した。結果を図3に示した。図3から明らかなように、48時間静置の溶液中にはD−Trpのみが存在した。
(2-4) 吸着前後のCDスペクトルの変化
図3のデータに基づいて、L,D−Trpの吸着選択度を以下の式で求めた。
SA(L/D)={(L-Trp)/(D-Trp)}/{[L-Trp]/[D-Trp]}
ここで、(L-Trp)、(D-Trp)は平衡後にリポソームに吸着されたD-TrpならびにD-Trpの吸着量を、また、[L-Trp]、[D-Trp]は試料と平衡している溶液中のL-TrpならびにD-Trpの濃度を示す。
結果を表1に示した。表1の参考1は、Yoshikawaらの文献(M. Yoshikawa et al., Polymer, 49, 21(2008))に記載の光学分離用膜を用いたトリプトファンの吸着選択度(SA(L/D))の数値、参考2は、文献(『キラル分離の理論と実際』 学会出版センター p.194)に記載のキラルカラムを用いたトリプトファンの吸着選択度(SA(L/D))の数値、参考3は、特開2007−297356号公報に記載の光学分離用膜を用いたトリプトファンの吸着選択度(SA(L/D))の数値をそれぞれ示す。表1の数値から、本発明の光学分離方法は、従来の膜やカラムを用いる光学分離方法より吸着選択性が顕著に高いことが明らかとなった。
【0028】
【表1】

【0029】
〔実施例2:リポソーム固定化ゲル〕
1.リポソーム固定化ゲルの調製
所定量のPOPC(palmitoyloleoylphosphatidylcholine)を溶解したクロロホルム溶液を溶媒留去してリン脂質薄膜を調製し、最終濃度60mMになる様に純水を加えて、リポソーム懸濁液を調製した。リポソームの粒径を増加させるために凍結(−80℃)および融解(恒温槽(相転移温度以上))操作を5回繰り返した。得られたリポソーム懸濁液を超遠心分離(50000rpm、4℃、2時間)して濃縮した。エクストルージョン法により、粒径約200nmのリポソームを得た。得られてリポソーム懸濁液について、リン脂質テストワコーC(和光純薬製)を用いてリン脂質濃度を測定した。
アクリルアミド溶液は、アクリルアミド29.2に対して、0.8のN,N’−メチレンビス(アクリルアミド)−HG(BIS)を混合して調製した。緩衝液は、Tris 0.3gとGlycien 1.44gを100mlの純水に溶解し、12N HClでpHを8.3に調整して、調製した。
濃縮リポソーム懸濁液(約110mMまたは約140mM)6.5mlに、アクリルアミド溶液2.5mlおよび緩衝液2.5mlを混合し、真空中で撹拌しながら約30分間脱気した。その後、触媒(過硫酸アンモニウム(10wt%)50μlおよびN,N,N’,N’−テトラメチルエチレンジアミン(TEMED)10μl)を添加し、自作のゲル調製装置(2mmの間隔で設置した2枚のガラス板)に流し込んで、2種類のリポソーム固定化ゲルを調製した。
【0030】
2.リポソーム体積分率(%)の算出
調製した2種類のリポソーム固定化ゲルについて、リポソーム体積分率(%)を計算で求めた。計算方法は以下のとおりである。
(1) リポソームを含有しないポリアクリルアミドゲル(以下「PAゲル」という。)について、PAゲルのみの重量分率を求める。
(2) リポソームを含有しないPAゲルの含水率と、リポソーム固定化ゲルの含水率を比較し、リポソーム膜のみの重量分率を求める。
(3) 上記(2)で求めたリポソーム膜のみの重量分率から、リポソームの体積を求める。
(4) ゲル全体の体積に対するリポソームの体積を計算し、リポソーム体積分率(%)を求める。
【0031】
計算により得られた2種類のリポソーム固定化ゲルのリポソーム体積分率(%)を表2に示した。いずれのゲルも、リポソーム体積分率(%)が非常に高いことが示された。
【表2】

【0032】
3.リポソーム固定化ゲルの強度測定
リポソーム固定化ゲルの圧縮臨界点を測定し、リポソームを含有しないPAゲルの圧縮臨界点と比較した。ゲルをノギスで挟み、壊れるまで少しずつ押してゆき、壊れた長さを記録した。圧縮臨界点は以下の式で求めた。
圧縮臨界点(δ)=(L0−L)/L0×100
ここで、Lは壊れた時点の厚みを、L0は元の厚みを示す。
リポソームを含有しないPAゲルは、PAゲル濃度が5wt%、8wt%、12.5wt%、15wt%、20wt%、30wt%、40wt%および50wt%の8種類を使用した。
リポソーム固定化ゲルは、上記ゲル1およびゲル2以外に、3種類を用いた。具体的には、ゲル3は粒径100nmのリポソーム懸濁液(POPC濃度約7mM)を用いて調製したリポソーム固定化ゲル、ゲル4は粒径100nmのリポソーム懸濁液(POPC濃度約36mM)を用いて調製したリポソーム固定化ゲル、ゲル5は粒径100nmのリポソーム懸濁液(POPC濃度約107mM)を用いて調製したリポソーム固定化ゲルである。リポソーム固定化ゲルのPAゲル濃度は、以下の式で求めた。
PAゲル濃度(wt%)=12.5×V/(V−VL)
ここで、Vはリポソームなしの場合のゲル中の水の体積を、VLはゲル中のリポソームの体積を示す。
【0033】
各リポソーム固定化ゲルにおけるリポソームの体積分率(%)、PAゲル濃度(wt%)および圧縮臨界点(%)を表3に示した。また、リポソームを含有しないPAゲルの圧縮臨界点(%)との比較を図4に示した。図4から明らかなように、リポソームを含有しないPAゲルはPAゲル濃度が高くなると圧縮臨界点(%)が大幅に低下するが、リポソーム固定化ゲルはPAゲル濃度が高くなっても圧縮臨界点(%)低下の程度が少なかった。この結果から、リポソーム固定化ゲルは、リポソームの体積分率が高くなっても高い強度を維持することが示された。
【0034】
【表3】

【0035】
4.リポソーム固定化ゲルによるL,D−Trpの光学分離
図5に示した装置を自作し、上記ゲル1を用いてL,D−Trpの光学分離を試みた。すなわち、セルロース膜(孔径100kDa)で挟んだゲル1を装着したチャンバーに10mMのL,D−Trp溶液を100μl添加し、チャンバーを純水中に入れ、室温または50℃で24時間以上(平衡状態に達するまで)攪拌した。ゲル1を透過してチャンバー外の純水中に流出したL−TrpおよびD−Trp量を測定し、流出率を計算した。
【0036】
結果を図6に示した。図6から明らかなように、室温ではD−Trpはゲル1を透過して純水中に流出し、L−Trpはゲル1に吸着してほとんど透過しないことが示された。また、50℃では、L−Trpもゲル1を透過し、両者の流出率はほぼ同じであった。この結果から、POPCリポソーム固定化ゲルが光学分離に利用できること、温度を制御することにより、吸脱着モードを制御可能であることが示された。
【0037】
なお本発明は上述した各実施形態および実施例に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。また、本明細書中に記載された学術文献および特許文献の全てが、本明細書中において参考として援用される。
【特許請求の範囲】
【請求項1】
親水基中に不斉炭素原子を有する両親媒性分子の集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させることを特徴とする光学分割方法。
【請求項2】
前記集合体が、リポソーム、ベシクル、ミセル、生体膜の脂質構成部位、平面脂質膜または基材上に形成された両親媒性分子膜である請求項1に記載の光学分割方法。
【請求項3】
前記集合体がリポソームである請求項2に記載の光学分割方法。
【請求項4】
前記親水基中に不斉炭素原子を有する両親媒性分子がグリセロ脂質である請求項1〜3のいずれかに記載の光学分割方法。
【請求項5】
グリセロ脂質がグリセロリン脂質である請求項4に記載の光学分割方法。
【請求項6】
前記集合体を含有するゲルを用いることを特徴とする請求項1〜5のいずれかに記載の光学分割方法。
【請求項7】
両親媒性分子の集合体が均一に分散されており、かつ、当該集合体の体積分率が20%以上であることを特徴とするゲル。
【請求項8】
前記集合体がリポソームである請求項7に記載のゲル。
【請求項9】
請求項7または8に記載のゲルの製造方法であって、
両親媒性分子の集合体の懸濁液を調製する工程と、
得られた懸濁液を濃縮し両親媒性分子の集合体の濃縮液を調製する工程と、
得られた濃縮液とゲル調製試薬との混合液を調製する工程と、
得られた混合液をゲル化させる工程と、
を包含することを特徴とするゲルの製造方法。
【請求項10】
親水基中に不斉炭素原子を有する両親媒性分子の集合体を酸化触媒機能を有する金属錯体で修飾した集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させ、さらに酸化させることを特徴とする不斉合成方法。
【請求項1】
親水基中に不斉炭素原子を有する両親媒性分子の集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させることを特徴とする光学分割方法。
【請求項2】
前記集合体が、リポソーム、ベシクル、ミセル、生体膜の脂質構成部位、平面脂質膜または基材上に形成された両親媒性分子膜である請求項1に記載の光学分割方法。
【請求項3】
前記集合体がリポソームである請求項2に記載の光学分割方法。
【請求項4】
前記親水基中に不斉炭素原子を有する両親媒性分子がグリセロ脂質である請求項1〜3のいずれかに記載の光学分割方法。
【請求項5】
グリセロ脂質がグリセロリン脂質である請求項4に記載の光学分割方法。
【請求項6】
前記集合体を含有するゲルを用いることを特徴とする請求項1〜5のいずれかに記載の光学分割方法。
【請求項7】
両親媒性分子の集合体が均一に分散されており、かつ、当該集合体の体積分率が20%以上であることを特徴とするゲル。
【請求項8】
前記集合体がリポソームである請求項7に記載のゲル。
【請求項9】
請求項7または8に記載のゲルの製造方法であって、
両親媒性分子の集合体の懸濁液を調製する工程と、
得られた懸濁液を濃縮し両親媒性分子の集合体の濃縮液を調製する工程と、
得られた濃縮液とゲル調製試薬との混合液を調製する工程と、
得られた混合液をゲル化させる工程と、
を包含することを特徴とするゲルの製造方法。
【請求項10】
親水基中に不斉炭素原子を有する両親媒性分子の集合体を酸化触媒機能を有する金属錯体で修飾した集合体と、光学異性体混合物とを接触させ、前記光学異性体混合物中の一方の光学異性体を前記集合体に吸着させ、さらに酸化させることを特徴とする不斉合成方法。
【図1】


【図3】


【図2】


【図4】


【図5】


【図6】




【図3】


【図2】


【図4】


【図5】


【図6】


【公開番号】特開2012−171920(P2012−171920A)
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願番号】特願2011−35539(P2011−35539)
【出願日】平成23年2月22日(2011.2.22)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願日】平成23年2月22日(2011.2.22)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
[ Back to top ]

