新規な安定化固形製剤
【課題】高血圧治療薬であるカンデサルタンシレキセチルを有効成分として含有する、不純物の増加が抑制され、保存安定性に優れた固形製剤の提供。
【解決手段】カンデサルタンシレキセチル及びクエン酸トリエチルを含有する固形製剤。該クエン酸トリエチルの含有量は、0.1〜6.0質量%であることが好ましい。該固形製剤は、該カンデサルタンシレキセチルおよび該クエン酸トリエチルを含有する組成物を、圧縮成形することにより得られる固形製剤であることが好ましい。
【解決手段】カンデサルタンシレキセチル及びクエン酸トリエチルを含有する固形製剤。該クエン酸トリエチルの含有量は、0.1〜6.0質量%であることが好ましい。該固形製剤は、該カンデサルタンシレキセチルおよび該クエン酸トリエチルを含有する組成物を、圧縮成形することにより得られる固形製剤であることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、長期保存した場合における経時的な不純物の増加が抑制された、カンデサルタンシレキセチルを含有する固形製剤に関する。
【背景技術】
【0002】
アンンジオテンシンII受容体拮抗薬は臨床上有用な高血圧症治療薬である。中でもカンデサルタンシレキセチルは少ない投与量で優れた治療効果を持つ有用な薬物である。
しかし、カンデサルタンシレキセチルは単独固体状態では安定であるが、製剤化により経時的な含量低下が加速される。この含量低下の改善法として、高級アルコール、多価アルコールの脂肪酸エステルおよびアルキレンオキサイドの重合体または共重合体から選ばれた低融点油脂状物質を配合する方法が有効であり、中でもポリエチレングリコール6000を配合することにより安定化する方法が開示されている(特許文献1)。
【0003】
一方、カンデサルタンシレキセチル製剤の含量低下に伴い、種々の不純物が増加することが報告されており、医薬品としての安全性の観点から不純物の単離、同定が行われている(非特許文献1,2)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第2682353号公報
【非特許文献】
【0005】
【非特許文献1】Chromatographia2009,69,1211−1220
【非特許文献2】Collect.Czech.Chem.Commun.2009,74,347−362
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の課題は、カンデサルタンシレキセチルを含有する固形製剤、特に圧縮成形した固形製剤において、長期保存した場合における経時的な不純物の増加を抑制した製剤を提供することである。
【課題を解決するための手段】
【0007】
本発明者は、前記課題を解決するため鋭意検討した結果、カンデサルタンシレキセチルを有効成分とする固形製剤中に通常の使用法として固形製剤内に配合することのないクエン酸トリエチルを配合することで、カンデサルタンシレキセチルの経時的な不純物の増加を顕著に抑制できることを見出した。
【0008】
すなわち本発明は、(1)カンデサルタンシレキセチルおよびクエン酸トリエチルを含有することを特徴とする固形製剤、(2)クエン酸トリエチルを0.1〜6.0質量%含有することを特徴とする前記(1)の固形製剤、(3)カンデサルタンシレキセチルおよびクエン酸トリエチルを含有する組成物を圧縮成形することにより得られることを特徴とする前記(1)または(2)の固形製剤に関する。
【0009】
また、本発明は、クエン酸トリエチルによる、圧縮成形により得られる固形製剤(圧縮成形固形製剤)中のカンデサルタンシレキセチルの分解抑制方法、および、上記圧縮成形固形製剤の製造方法を包含する。
【発明の効果】
【0010】
本発明により、カンデサルタンシレキセチルを製剤化した後も、長期保存した場合における経時的な不純物の増加が抑制され、治療を必要とする患者の安全性、治療現場への安定的な供給に優れた固形製剤の提供が可能となった。
【図面の簡単な説明】
【0011】
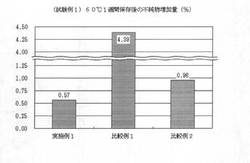
【図1】図1は、実施例1で得た錠剤、比較例1及び2で得た各錠剤を60℃で1週間保存した後の不純物の増加量を示したグラフである。
【図2】図2は、実施例2及び3で得た各錠剤、比較例3で得た錠剤を60℃で2週間保存した後の不純物の増加量を示したグラフである。
【図3】図3は、実施例4で得た錠剤、比較例4で得た錠剤を60℃で2週間保存した後の不純物の増加量を示したグラフである。
【図4】図4は、実施例5及び6で得た各錠剤、比較例5で得た錠剤、並びにカンデサルタンシレキセチル錠の市販製剤を60℃で2週間保存した後の不純物の増加量を示したグラフである。
【発明を実施するための形態】
【0012】
本実施形態は、カンデサルタンシレキセチルおよびクエン酸トリエチルを含有することを特徴とする固形製剤である。カンデサルタンシレキセチルは結晶の形態を有することが好ましく、なかでも融点163℃の結晶が好ましい。
【0013】
また、本実施形態において、カンデサルタンシレキセチルの固形製剤中における含有量は特に限定されず、当業者が適宜設定できる。
【0014】
本実施形態における固形製剤の形態は、例えば、カプセル剤、散剤、顆粒剤、錠剤、口腔内崩壊剤などとすることができる。なかでも、圧縮成形により成形されて得られる固形製剤(圧縮成形固形製剤)において特に不純物の増加を抑制することができ、当該圧縮成形固形製剤の例としては、錠剤、口腔内崩壊錠が挙げられる。
【0015】
本実施形態における固形製剤を製造するにあたっては、通常用いられる賦形剤、崩壊剤、結合剤、滑沢剤、着色剤、pH調整剤、界面活性剤、安定化剤、酸味料、香料、流動化剤などの添加剤を任意に用いることができる。
【0016】
本明細書において、「賦形剤」としては、乳糖、白糖、果糖、粉末還元麦芽糖水あめ、ブドウ糖、トレハロース、D−マンニトール、キシリトール、エリスリトール、D−ソルビトール、キシリトール、マルチトース、結晶セルロース、デキストリン、トウモロコシデンプン、バレイショデンプン、コムギデンプン、ヒドロキシプロピルスターチ、アルファー化デンプン、部分アルファー化デンプン、リン酸水素カルシウム、リン酸二水素カルシウム、沈降炭酸カルシウム、軽質無水ケイ酸などが挙げられ、特に乳糖、トウモロコシデンプン、マンニトールまたは結晶セルロースが好ましい。
【0017】
本明細書において「崩壊剤」としては、低置換度ヒドロキシプロピルセルロース、カルメロース、カルメロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、部分アルファー化デンプン、デンプングリコール酸ナトリウム、などが挙げられ、特に低置換度ヒドロキシプロピルセルロース、カルメロースカルシウムが好ましい。
【0018】
本明細書において「結合剤」としては、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、メチルセルロース、バレイショデンプン、トウモロコシデンプン、ポリビニルアルコール部分ケン化物、ポリビニルアルコール完全ケン化物、ポリビニルピロリドン、部分アルファー化デンプン、デンプングリコール酸ナトリウム、などが挙げられ、特にヒドロキシプロピルセルロースが好ましい。
【0019】
本明細書において「滑沢剤」としては、ステアリン酸、ステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、硬化油、フマル酸ステアリルナトリウム、ショ糖脂肪酸エステルなどが挙げられ、特にステアリン酸マグネシウムが好ましい。
【0020】
本明細書における「着色剤」の例としては、食用黄色5号、食用赤色2号、食用青色2号などの食用レーキ色素、三二酸化鉄、黄色三二酸化鉄などが挙げられる。
【0021】
本明細書における「pH調整剤」の例としては、塩酸、クエン酸、クエン酸ナトリウム、酢酸、酒石酸、水酸化ナトリウム、炭酸水素ナトリウム、炭酸ナトリウム、乳酸などが挙げられる。
【0022】
本明細書における「界面活性剤」の例としては、ラウリル硫酸ナトリウム、ポリオキシエチレン、ポリオキシプロピレン、ポリソルベート類などが挙げられる。
【0023】
本明細書における「安定化剤」の例としては、トコフェロール、エデト酸四ナトリウム、ニコチン酸アミド、シクロデキストリン類などが挙げられる。本明細書における酸味料の例としては、クエン酸、酒石酸、リンゴ酸、アスコルビン酸などが挙げられる。
【0024】
本明細書における「香料」の例としては、メントール、ハッカ油、オレンジ油、レモン油などが挙げられる。
【0025】
本明細書における「流動化剤」の例としては、軽質無水ケイ酸、含水二酸化ケイ素などが挙げられる。
【0026】
上記した添加剤は、2種以上を任意の割合で混合して用いても良い。
【0027】
本実施形態における固形製剤を製造する際には、乾式法、湿式法などの固形製剤を製造する任意の方法によって製造することができる。
【0028】
本明細書において乾式法とは、製造プロセス中に乾燥工程を含まない方法を意味する。
【0029】
一例としては、有効成分及びその他の添加剤を均一に混合した後、打錠機で圧縮成形し錠剤を製造する方法が挙げられる。また、有効成分を含む混合物を、圧縮体とし、これを適当な整粒機にて顆粒とした後、圧縮成形し錠剤を製造することもできる。必要に応じて得られた造粒物に更に添加剤を添加することもできる。
【0030】
本明細書において湿式法とは、製造プロセス中に乾燥工程を含む方法を意味する。一例として有効成分,及び添加剤を混合しながら、適当な溶媒を用いて造粒し、この造粒物を乾燥し、圧縮成形して錠剤を製造する方法である。必要に応じて、得られた造粒物に更に添加剤を添加することもできる。
【0031】
(クエン酸トリエチル)
クエン酸トリエチルは融点−55℃の、常温(15〜25℃)で液状の形態を有する物質であり、一般的には可塑剤またはコーティング剤として用いられる(医薬品添加物事典2007)。
【0032】
クエン酸トリエチルは、固形製剤中のカンデサルタンシレキセチルの分解を抑制するという観点から、本実施形態の固形製剤中に0.1〜6.0質量%、好ましくは0.2〜5.0質量%、より好ましくは0.2〜4.0質量%含有される。
【0033】
クエン酸トリエチルの他の含有成分との配合方法としては、直接添加する方法、または溶媒に混和または混濁して添加する方法など、任意の方法により行われる。
【0034】
クエン酸トリエチル含有溶液の混和または混濁する場合に用いることができる溶媒としては、水、メタノール、エタノール、アセトン、2−プロパノール、ジエチルエーテルなどが挙げられ、好ましくは水またはエタノールが挙げられる。
【0035】
溶媒に混和または混濁する際の、クエン酸トリエチルの濃度は任意に設定することができるが、好ましくは0.5〜10w/w%、更に好ましくは2〜8w/w%である。
【0036】
クエン酸トリエチルは、製剤製造工程中、任意の工程で添加することができるが、固形製剤中のカンデサルタンシレキセチルの分解を抑制するという観点から、カンデサルタンシレキセチルとクエン酸トリエチルが接触する態様での添加が好ましい。例えば、(1)カンデサルタンシレキセチル原薬とクエン酸トリエチルを混和させる方法、(2)カンデサルタンシレキセチルと賦形剤等を混和した後にクエン酸トリエチルを添加する方法、(3)カンデサルタンシレキセチルを単独で、またはカンデサルタンシレキセチルと賦形剤等とを混合した後、クエン酸トリエチル含有溶液に添加する方法等が挙げられる。
【0037】
また、製造工程中に圧縮成形工程が含まれる場合には、圧縮成形工程によるカンデサルタンシレキセチルの分解抑制のため、圧縮成形工程前にクエン酸トリエチルを添加することが好ましい。言い換えれば、当該好ましい態様において、固形製剤は、カンデサルタンシレキセチルおよびクエン酸トリエチルを含む組成物を圧縮成形することにより得られる。また、カンデサルタンシレキセチルおよびクエン酸トリエチルを含む組成物は、固形組成物とすることができる。ここで、本明細書において、固形組成物とは、複数の成分により構成される常温において固体状である形態を有する組成物をいい、例えば混合により得られる粉末や造粒により得られる顆粒などを挙げることができる。
【0038】
錠剤の場合の好ましい製造方法の一例は、以下のとおりである。
(工程1)カンデサルタンシレキセチルと賦形剤を混合後、得られた混合物にクエン酸トリエチルの混和液または混濁液(例えばクエン酸トリエチル含有水溶液)を添加しながら造粒することにより固形組成物である顆粒を得る。
(工程2)工程1で得られた顆粒に残りの成分(例えば賦形剤、結合剤、崩壊剤、潤沢剤および流動化剤から1つ以上選ばれる任意の成分)を混合し、打錠する。
【0039】
また、他の例として、工程1において、賦形剤に、カンデサルタンシレキセチルおよびクエン酸トリエチルの混和液または混濁液を添加しながら造粒することにより顆粒を調製するようにしてもよい。
【0040】
また、口腔内崩壊錠についても、錠剤と同様に製造することができる。
【実施例】
【0041】
以下、本実施形態の固形製剤を実施例によりさらに具体的に説明するが、本発明は以下の実施例により限定されるものではない。
【0042】
(実施例1)
カンデサルタンシレキセチル3.8g、乳糖水和物366.3g及びトウモロコシデンプン76.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)15.2gを精製水491.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)9.9gを混和した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0043】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)21.3g及びステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0044】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 1.0
乳糖水和物 96.4
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
クエン酸トリエチル 2.6
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0045】
(比較例1)(特許文献1実施例1対照)
カンデサルタンシレキセチル3.8g、乳糖水和物376.2g及びトウモロコシデンプン76.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)15.2gを精製水491.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0046】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)21.3g及びステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0047】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 1.0
乳糖水和物 99.0
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0048】
(比較例2)(特許文献1実施例1)
カンデサルタンシレキセチル3.8g、乳糖水和物353.4g、トウモロコシデンプン76.0g及びマクロゴール6000 22.8gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)15.2gを精製水491.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0049】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)21.3g及びステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0050】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 1.0
乳糖水和物 93.0
トウモロコシデンプン 20.0
マクロゴール6000 6.0
ヒドロキシプロピルセルロース 4.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0051】
(試験例1)
(試験例:苛酷試験による製剤の保存安定性比較)
60℃で1週間保存した後の、実施例1で得た錠剤、同条件における比較例1及び2で得た各錠剤について、不純物の増加量を比較した。
【0052】
不純物の測定は高速液体クロマトグラフ法により行い、クロマトグラム上に確認された全不純物ピークの面積値を合計し、それをクロマトグラム上に確認されたピーク面積値の合計で除し、100を乗じて求めた(面積百分率)。
(測定条件)
検出器 :紫外吸光光度計(波長:254nm)
カラム :内径3.9mm、長さ15cmのステンレス管に5μmオクタデシリル化シリカゲルを充填したもの。
カラム温度:25℃付近の一定温度
移動相 :移動相A:アセトニトリル/水/氷酢酸混液(57:43:1)
移動相B:アセトニトリル/水/氷酢酸混液(90:10:1)
移動相の送液:移動相Aと移動相Bの混合比を表1に示すように変えて濃度勾配制御する。
流量 :0.8mL/分
【0053】
(結果)
60℃で1週間保存した後の不純物増加量の測定結果を図1に示す。実施例1で得た錠剤は、比較例1及び2で得た各錠剤より不純物の増加量が少なく、保存における経時的な不純物の増加が抑制されていることが示された。
【0054】
(実施例2)
カンデサルタンシレキセチル24.0g、乳糖水和物268.2g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)7.8gを混和した液をスプレーし、造粒した。得られた造粒物を乾燥し、JIS24メッシュの篩にて篩過した。
【0055】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0056】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 89.4
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
クエン酸トリエチル 2.6
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0057】
(実施例3)
カンデサルタンシレキセチル24.0g、乳糖水和物260.4g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)15.6gを混和した液をスプレーし、造粒した。得られた造粒物を乾燥し、JIS24メッシュの篩にて篩過した。
【0058】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0059】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 86.8
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
クエン酸トリエチル 5.2
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0060】
(比較例3)
カンデサルタンシレキセチル24.0g、乳糖水和物276.0g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、JIS24メッシュの篩にて篩過した。得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0061】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 92.0
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0062】
(試験例2)
(試験例:苛酷試験による製剤の保存安定性比較)
60℃で2週間保存した後の、実施例2及び3で得た各錠剤、同条件における比較例3で得た錠剤について、不純物の増加量を比較した。
【0063】
(結果)
60℃で2週間保存した後の不純物増加量の測定結果を図2に示す。実施例2及び3で得た各錠剤は、比較例3で得た錠剤より不純物の増加量が少なく、保存における経時的な不純物の増加が抑制されていることが示された。
【0064】
(実施例4)
カンデサルタンシレキセチル24.0g、乳糖水和物190.2g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)7.8gを混和した液をスプレーし、造粒した。得られた造粒物を乾燥し、JIS24メッシュの篩にて篩過した。
【0065】
得られた整粒品に結晶セルロース(セオラスUF−711、旭化成ケミカルズ製)78.0g、カルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0066】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 63.4
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
クエン酸トリエチル 2.6
結晶セルロース(UF−711) 26.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0067】
(比較例4)
カンデサルタンシレキセチル24.0g、乳糖水和物198.0g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。得られた整粒品に結晶セルロース(セオラスUF−711、旭化成ケミカルズ製)45.0g、カルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0068】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 66.0
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
結晶セルロース(UF−711) 26.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0069】
(試験例3)
(試験例:苛酷試験による製剤の保存安定性比較)
60℃で2週間保存した後の、実施例4で得た錠剤、同条件における比較例4で得た錠剤について、不純物の増加量を比較した。
【0070】
(結果)
60℃で2週間保存した後の不純物増加量の測定結果を図3に示す。実施例4で得た錠剤は、比較例4で得た錠剤より不純物の増加量が少なく、保存における経時的な不純物の増加が抑制されていることが示された。
【0071】
(実施例5)
カンデサルタンシレキセチル30.4g、乳糖水和物121.6g及びトウモロコシデンプン74.1gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)11.0gを精製水355.7gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)9.9gを混和した液をスプレーし、造粒した。
得られた造粒物を乾燥した顆粒に、乳糖水和物148.2g、トウモロコシデンプン40.3g及び低置換度ヒドロキシプロピルセルロース(LH−11、信越化学製)37.2gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)19.8gを精製水375.4gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0072】
得られた整粒品にステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0073】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 70.9
トウモロコシデンプン 30.1
ヒドロキシプロピルセルロース 8.2
クエン酸トリエチル 2.6
低置換度ヒドロキシプロピルセルロース 9.8
ステアリン酸マグネシウム 0.4
【0074】
(実施例6)
カンデサルタンシレキセチル50.0g、乳糖水和物199.4g及びトウモロコシデンプン121.8gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)18.7gを精製水604.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)16.3gを混和した液をスプレーし、造粒した。
得られた造粒物を乾燥した顆粒169.0gに、乳糖水和物112.2g及び低置換度ヒドロキシプロピルセルロース(LH−11、信越化学製)42.3gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)13.5gを精製水257.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0075】
得られた整粒品にステアリン酸マグネシウム1.0gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0076】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 75.0
トウモロコシデンプン 19.5
ヒドロキシプロピルセルロース 8.2
クエン酸トリエチル 2.6
低置換度ヒドロキシプロピルセルロース 16.3
ステアリン酸マグネシウム 0.4
【0077】
(比較例5)
カンデサルタンシレキセチル30.4g、乳糖水和物131.0g及びトウモロコシデンプン74.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)11.4gを精製水367.8gに溶解した液をスプレーし、造粒した。
得られた造粒物を乾燥した顆粒に、乳糖水和物148.3g、トウモロコシデンプン40.4g及び低置換度ヒドロキシプロピルセルロース(LH−11、信越化学製)37.2gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)19.8gを精製水375.9gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0078】
得られた整粒品にステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0079】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 73.5
トウモロコシデンプン 30.1
ヒドロキシプロピルセルロース 8.2
低置換度ヒドロキシプロピルセルロース 9.8
ステアリン酸マグネシウム 0.4
【0080】
(試験例4)
(試験例:苛酷試験による製剤の保存安定性比較)
60℃で2週間保存した後の、実施例5及び6で得た各錠剤、同条件における比較例5で得た錠剤並びにカンデサルタンシレキセチル錠の市販製剤について、不純物の増加量を比較した。
【0081】
(結果)
60℃で2週間保存した後の不純物増加量の測定結果を図4に示す。実施例5及び6で得た各錠剤は、比較例5で得た錠剤並びにカンデサルタンシレキセチル錠の市販製剤より不純物の増加量が少なく、保存における経時的な不純物の増加が抑制されていることが示された。
【産業上の利用可能性】
【0082】
本発明は、医薬として有用なカンデサルタンシレキセチルを含み、不純物の増加が抑制される固形製剤を提供するものであり、産業上利用可能である。
【技術分野】
【0001】
本発明は、長期保存した場合における経時的な不純物の増加が抑制された、カンデサルタンシレキセチルを含有する固形製剤に関する。
【背景技術】
【0002】
アンンジオテンシンII受容体拮抗薬は臨床上有用な高血圧症治療薬である。中でもカンデサルタンシレキセチルは少ない投与量で優れた治療効果を持つ有用な薬物である。
しかし、カンデサルタンシレキセチルは単独固体状態では安定であるが、製剤化により経時的な含量低下が加速される。この含量低下の改善法として、高級アルコール、多価アルコールの脂肪酸エステルおよびアルキレンオキサイドの重合体または共重合体から選ばれた低融点油脂状物質を配合する方法が有効であり、中でもポリエチレングリコール6000を配合することにより安定化する方法が開示されている(特許文献1)。
【0003】
一方、カンデサルタンシレキセチル製剤の含量低下に伴い、種々の不純物が増加することが報告されており、医薬品としての安全性の観点から不純物の単離、同定が行われている(非特許文献1,2)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第2682353号公報
【非特許文献】
【0005】
【非特許文献1】Chromatographia2009,69,1211−1220
【非特許文献2】Collect.Czech.Chem.Commun.2009,74,347−362
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の課題は、カンデサルタンシレキセチルを含有する固形製剤、特に圧縮成形した固形製剤において、長期保存した場合における経時的な不純物の増加を抑制した製剤を提供することである。
【課題を解決するための手段】
【0007】
本発明者は、前記課題を解決するため鋭意検討した結果、カンデサルタンシレキセチルを有効成分とする固形製剤中に通常の使用法として固形製剤内に配合することのないクエン酸トリエチルを配合することで、カンデサルタンシレキセチルの経時的な不純物の増加を顕著に抑制できることを見出した。
【0008】
すなわち本発明は、(1)カンデサルタンシレキセチルおよびクエン酸トリエチルを含有することを特徴とする固形製剤、(2)クエン酸トリエチルを0.1〜6.0質量%含有することを特徴とする前記(1)の固形製剤、(3)カンデサルタンシレキセチルおよびクエン酸トリエチルを含有する組成物を圧縮成形することにより得られることを特徴とする前記(1)または(2)の固形製剤に関する。
【0009】
また、本発明は、クエン酸トリエチルによる、圧縮成形により得られる固形製剤(圧縮成形固形製剤)中のカンデサルタンシレキセチルの分解抑制方法、および、上記圧縮成形固形製剤の製造方法を包含する。
【発明の効果】
【0010】
本発明により、カンデサルタンシレキセチルを製剤化した後も、長期保存した場合における経時的な不純物の増加が抑制され、治療を必要とする患者の安全性、治療現場への安定的な供給に優れた固形製剤の提供が可能となった。
【図面の簡単な説明】
【0011】
【図1】図1は、実施例1で得た錠剤、比較例1及び2で得た各錠剤を60℃で1週間保存した後の不純物の増加量を示したグラフである。
【図2】図2は、実施例2及び3で得た各錠剤、比較例3で得た錠剤を60℃で2週間保存した後の不純物の増加量を示したグラフである。
【図3】図3は、実施例4で得た錠剤、比較例4で得た錠剤を60℃で2週間保存した後の不純物の増加量を示したグラフである。
【図4】図4は、実施例5及び6で得た各錠剤、比較例5で得た錠剤、並びにカンデサルタンシレキセチル錠の市販製剤を60℃で2週間保存した後の不純物の増加量を示したグラフである。
【発明を実施するための形態】
【0012】
本実施形態は、カンデサルタンシレキセチルおよびクエン酸トリエチルを含有することを特徴とする固形製剤である。カンデサルタンシレキセチルは結晶の形態を有することが好ましく、なかでも融点163℃の結晶が好ましい。
【0013】
また、本実施形態において、カンデサルタンシレキセチルの固形製剤中における含有量は特に限定されず、当業者が適宜設定できる。
【0014】
本実施形態における固形製剤の形態は、例えば、カプセル剤、散剤、顆粒剤、錠剤、口腔内崩壊剤などとすることができる。なかでも、圧縮成形により成形されて得られる固形製剤(圧縮成形固形製剤)において特に不純物の増加を抑制することができ、当該圧縮成形固形製剤の例としては、錠剤、口腔内崩壊錠が挙げられる。
【0015】
本実施形態における固形製剤を製造するにあたっては、通常用いられる賦形剤、崩壊剤、結合剤、滑沢剤、着色剤、pH調整剤、界面活性剤、安定化剤、酸味料、香料、流動化剤などの添加剤を任意に用いることができる。
【0016】
本明細書において、「賦形剤」としては、乳糖、白糖、果糖、粉末還元麦芽糖水あめ、ブドウ糖、トレハロース、D−マンニトール、キシリトール、エリスリトール、D−ソルビトール、キシリトール、マルチトース、結晶セルロース、デキストリン、トウモロコシデンプン、バレイショデンプン、コムギデンプン、ヒドロキシプロピルスターチ、アルファー化デンプン、部分アルファー化デンプン、リン酸水素カルシウム、リン酸二水素カルシウム、沈降炭酸カルシウム、軽質無水ケイ酸などが挙げられ、特に乳糖、トウモロコシデンプン、マンニトールまたは結晶セルロースが好ましい。
【0017】
本明細書において「崩壊剤」としては、低置換度ヒドロキシプロピルセルロース、カルメロース、カルメロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、部分アルファー化デンプン、デンプングリコール酸ナトリウム、などが挙げられ、特に低置換度ヒドロキシプロピルセルロース、カルメロースカルシウムが好ましい。
【0018】
本明細書において「結合剤」としては、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、メチルセルロース、バレイショデンプン、トウモロコシデンプン、ポリビニルアルコール部分ケン化物、ポリビニルアルコール完全ケン化物、ポリビニルピロリドン、部分アルファー化デンプン、デンプングリコール酸ナトリウム、などが挙げられ、特にヒドロキシプロピルセルロースが好ましい。
【0019】
本明細書において「滑沢剤」としては、ステアリン酸、ステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、硬化油、フマル酸ステアリルナトリウム、ショ糖脂肪酸エステルなどが挙げられ、特にステアリン酸マグネシウムが好ましい。
【0020】
本明細書における「着色剤」の例としては、食用黄色5号、食用赤色2号、食用青色2号などの食用レーキ色素、三二酸化鉄、黄色三二酸化鉄などが挙げられる。
【0021】
本明細書における「pH調整剤」の例としては、塩酸、クエン酸、クエン酸ナトリウム、酢酸、酒石酸、水酸化ナトリウム、炭酸水素ナトリウム、炭酸ナトリウム、乳酸などが挙げられる。
【0022】
本明細書における「界面活性剤」の例としては、ラウリル硫酸ナトリウム、ポリオキシエチレン、ポリオキシプロピレン、ポリソルベート類などが挙げられる。
【0023】
本明細書における「安定化剤」の例としては、トコフェロール、エデト酸四ナトリウム、ニコチン酸アミド、シクロデキストリン類などが挙げられる。本明細書における酸味料の例としては、クエン酸、酒石酸、リンゴ酸、アスコルビン酸などが挙げられる。
【0024】
本明細書における「香料」の例としては、メントール、ハッカ油、オレンジ油、レモン油などが挙げられる。
【0025】
本明細書における「流動化剤」の例としては、軽質無水ケイ酸、含水二酸化ケイ素などが挙げられる。
【0026】
上記した添加剤は、2種以上を任意の割合で混合して用いても良い。
【0027】
本実施形態における固形製剤を製造する際には、乾式法、湿式法などの固形製剤を製造する任意の方法によって製造することができる。
【0028】
本明細書において乾式法とは、製造プロセス中に乾燥工程を含まない方法を意味する。
【0029】
一例としては、有効成分及びその他の添加剤を均一に混合した後、打錠機で圧縮成形し錠剤を製造する方法が挙げられる。また、有効成分を含む混合物を、圧縮体とし、これを適当な整粒機にて顆粒とした後、圧縮成形し錠剤を製造することもできる。必要に応じて得られた造粒物に更に添加剤を添加することもできる。
【0030】
本明細書において湿式法とは、製造プロセス中に乾燥工程を含む方法を意味する。一例として有効成分,及び添加剤を混合しながら、適当な溶媒を用いて造粒し、この造粒物を乾燥し、圧縮成形して錠剤を製造する方法である。必要に応じて、得られた造粒物に更に添加剤を添加することもできる。
【0031】
(クエン酸トリエチル)
クエン酸トリエチルは融点−55℃の、常温(15〜25℃)で液状の形態を有する物質であり、一般的には可塑剤またはコーティング剤として用いられる(医薬品添加物事典2007)。
【0032】
クエン酸トリエチルは、固形製剤中のカンデサルタンシレキセチルの分解を抑制するという観点から、本実施形態の固形製剤中に0.1〜6.0質量%、好ましくは0.2〜5.0質量%、より好ましくは0.2〜4.0質量%含有される。
【0033】
クエン酸トリエチルの他の含有成分との配合方法としては、直接添加する方法、または溶媒に混和または混濁して添加する方法など、任意の方法により行われる。
【0034】
クエン酸トリエチル含有溶液の混和または混濁する場合に用いることができる溶媒としては、水、メタノール、エタノール、アセトン、2−プロパノール、ジエチルエーテルなどが挙げられ、好ましくは水またはエタノールが挙げられる。
【0035】
溶媒に混和または混濁する際の、クエン酸トリエチルの濃度は任意に設定することができるが、好ましくは0.5〜10w/w%、更に好ましくは2〜8w/w%である。
【0036】
クエン酸トリエチルは、製剤製造工程中、任意の工程で添加することができるが、固形製剤中のカンデサルタンシレキセチルの分解を抑制するという観点から、カンデサルタンシレキセチルとクエン酸トリエチルが接触する態様での添加が好ましい。例えば、(1)カンデサルタンシレキセチル原薬とクエン酸トリエチルを混和させる方法、(2)カンデサルタンシレキセチルと賦形剤等を混和した後にクエン酸トリエチルを添加する方法、(3)カンデサルタンシレキセチルを単独で、またはカンデサルタンシレキセチルと賦形剤等とを混合した後、クエン酸トリエチル含有溶液に添加する方法等が挙げられる。
【0037】
また、製造工程中に圧縮成形工程が含まれる場合には、圧縮成形工程によるカンデサルタンシレキセチルの分解抑制のため、圧縮成形工程前にクエン酸トリエチルを添加することが好ましい。言い換えれば、当該好ましい態様において、固形製剤は、カンデサルタンシレキセチルおよびクエン酸トリエチルを含む組成物を圧縮成形することにより得られる。また、カンデサルタンシレキセチルおよびクエン酸トリエチルを含む組成物は、固形組成物とすることができる。ここで、本明細書において、固形組成物とは、複数の成分により構成される常温において固体状である形態を有する組成物をいい、例えば混合により得られる粉末や造粒により得られる顆粒などを挙げることができる。
【0038】
錠剤の場合の好ましい製造方法の一例は、以下のとおりである。
(工程1)カンデサルタンシレキセチルと賦形剤を混合後、得られた混合物にクエン酸トリエチルの混和液または混濁液(例えばクエン酸トリエチル含有水溶液)を添加しながら造粒することにより固形組成物である顆粒を得る。
(工程2)工程1で得られた顆粒に残りの成分(例えば賦形剤、結合剤、崩壊剤、潤沢剤および流動化剤から1つ以上選ばれる任意の成分)を混合し、打錠する。
【0039】
また、他の例として、工程1において、賦形剤に、カンデサルタンシレキセチルおよびクエン酸トリエチルの混和液または混濁液を添加しながら造粒することにより顆粒を調製するようにしてもよい。
【0040】
また、口腔内崩壊錠についても、錠剤と同様に製造することができる。
【実施例】
【0041】
以下、本実施形態の固形製剤を実施例によりさらに具体的に説明するが、本発明は以下の実施例により限定されるものではない。
【0042】
(実施例1)
カンデサルタンシレキセチル3.8g、乳糖水和物366.3g及びトウモロコシデンプン76.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)15.2gを精製水491.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)9.9gを混和した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0043】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)21.3g及びステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0044】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 1.0
乳糖水和物 96.4
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
クエン酸トリエチル 2.6
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0045】
(比較例1)(特許文献1実施例1対照)
カンデサルタンシレキセチル3.8g、乳糖水和物376.2g及びトウモロコシデンプン76.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)15.2gを精製水491.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0046】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)21.3g及びステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0047】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 1.0
乳糖水和物 99.0
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0048】
(比較例2)(特許文献1実施例1)
カンデサルタンシレキセチル3.8g、乳糖水和物353.4g、トウモロコシデンプン76.0g及びマクロゴール6000 22.8gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)15.2gを精製水491.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0049】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)21.3g及びステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0050】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 1.0
乳糖水和物 93.0
トウモロコシデンプン 20.0
マクロゴール6000 6.0
ヒドロキシプロピルセルロース 4.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0051】
(試験例1)
(試験例:苛酷試験による製剤の保存安定性比較)
60℃で1週間保存した後の、実施例1で得た錠剤、同条件における比較例1及び2で得た各錠剤について、不純物の増加量を比較した。
【0052】
不純物の測定は高速液体クロマトグラフ法により行い、クロマトグラム上に確認された全不純物ピークの面積値を合計し、それをクロマトグラム上に確認されたピーク面積値の合計で除し、100を乗じて求めた(面積百分率)。
(測定条件)
検出器 :紫外吸光光度計(波長:254nm)
カラム :内径3.9mm、長さ15cmのステンレス管に5μmオクタデシリル化シリカゲルを充填したもの。
カラム温度:25℃付近の一定温度
移動相 :移動相A:アセトニトリル/水/氷酢酸混液(57:43:1)
移動相B:アセトニトリル/水/氷酢酸混液(90:10:1)
移動相の送液:移動相Aと移動相Bの混合比を表1に示すように変えて濃度勾配制御する。
流量 :0.8mL/分
【0053】
(結果)
60℃で1週間保存した後の不純物増加量の測定結果を図1に示す。実施例1で得た錠剤は、比較例1及び2で得た各錠剤より不純物の増加量が少なく、保存における経時的な不純物の増加が抑制されていることが示された。
【0054】
(実施例2)
カンデサルタンシレキセチル24.0g、乳糖水和物268.2g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)7.8gを混和した液をスプレーし、造粒した。得られた造粒物を乾燥し、JIS24メッシュの篩にて篩過した。
【0055】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0056】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 89.4
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
クエン酸トリエチル 2.6
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0057】
(実施例3)
カンデサルタンシレキセチル24.0g、乳糖水和物260.4g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)15.6gを混和した液をスプレーし、造粒した。得られた造粒物を乾燥し、JIS24メッシュの篩にて篩過した。
【0058】
得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0059】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 86.8
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
クエン酸トリエチル 5.2
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0060】
(比較例3)
カンデサルタンシレキセチル24.0g、乳糖水和物276.0g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、JIS24メッシュの篩にて篩過した。得られた整粒品にカルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0061】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 92.0
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0062】
(試験例2)
(試験例:苛酷試験による製剤の保存安定性比較)
60℃で2週間保存した後の、実施例2及び3で得た各錠剤、同条件における比較例3で得た錠剤について、不純物の増加量を比較した。
【0063】
(結果)
60℃で2週間保存した後の不純物増加量の測定結果を図2に示す。実施例2及び3で得た各錠剤は、比較例3で得た錠剤より不純物の増加量が少なく、保存における経時的な不純物の増加が抑制されていることが示された。
【0064】
(実施例4)
カンデサルタンシレキセチル24.0g、乳糖水和物190.2g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)7.8gを混和した液をスプレーし、造粒した。得られた造粒物を乾燥し、JIS24メッシュの篩にて篩過した。
【0065】
得られた整粒品に結晶セルロース(セオラスUF−711、旭化成ケミカルズ製)78.0g、カルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0066】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 63.4
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
クエン酸トリエチル 2.6
結晶セルロース(UF−711) 26.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0067】
(比較例4)
カンデサルタンシレキセチル24.0g、乳糖水和物198.0g及びトウモロコシデンプン60.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)12.0gを精製水388.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。得られた整粒品に結晶セルロース(セオラスUF−711、旭化成ケミカルズ製)45.0g、カルメロースカルシウム(E.C.G−505、ニチリン化学工業製)16.8g及びステアリン酸マグネシウム1.2gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0068】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 66.0
トウモロコシデンプン 20.0
ヒドロキシプロピルセルロース 4.0
結晶セルロース(UF−711) 26.0
カルメロースカルシウム 5.6
ステアリン酸マグネシウム 0.4
【0069】
(試験例3)
(試験例:苛酷試験による製剤の保存安定性比較)
60℃で2週間保存した後の、実施例4で得た錠剤、同条件における比較例4で得た錠剤について、不純物の増加量を比較した。
【0070】
(結果)
60℃で2週間保存した後の不純物増加量の測定結果を図3に示す。実施例4で得た錠剤は、比較例4で得た錠剤より不純物の増加量が少なく、保存における経時的な不純物の増加が抑制されていることが示された。
【0071】
(実施例5)
カンデサルタンシレキセチル30.4g、乳糖水和物121.6g及びトウモロコシデンプン74.1gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)11.0gを精製水355.7gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)9.9gを混和した液をスプレーし、造粒した。
得られた造粒物を乾燥した顆粒に、乳糖水和物148.2g、トウモロコシデンプン40.3g及び低置換度ヒドロキシプロピルセルロース(LH−11、信越化学製)37.2gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)19.8gを精製水375.4gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0072】
得られた整粒品にステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0073】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 70.9
トウモロコシデンプン 30.1
ヒドロキシプロピルセルロース 8.2
クエン酸トリエチル 2.6
低置換度ヒドロキシプロピルセルロース 9.8
ステアリン酸マグネシウム 0.4
【0074】
(実施例6)
カンデサルタンシレキセチル50.0g、乳糖水和物199.4g及びトウモロコシデンプン121.8gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)18.7gを精製水604.0gに溶解した液にクエン酸トリエチル(シトロフレックス2、森村商事)16.3gを混和した液をスプレーし、造粒した。
得られた造粒物を乾燥した顆粒169.0gに、乳糖水和物112.2g及び低置換度ヒドロキシプロピルセルロース(LH−11、信越化学製)42.3gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)13.5gを精製水257.0gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0075】
得られた整粒品にステアリン酸マグネシウム1.0gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0076】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 75.0
トウモロコシデンプン 19.5
ヒドロキシプロピルセルロース 8.2
クエン酸トリエチル 2.6
低置換度ヒドロキシプロピルセルロース 16.3
ステアリン酸マグネシウム 0.4
【0077】
(比較例5)
カンデサルタンシレキセチル30.4g、乳糖水和物131.0g及びトウモロコシデンプン74.0gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)11.4gを精製水367.8gに溶解した液をスプレーし、造粒した。
得られた造粒物を乾燥した顆粒に、乳糖水和物148.3g、トウモロコシデンプン40.4g及び低置換度ヒドロキシプロピルセルロース(LH−11、信越化学製)37.2gを流動層造粒機(パウレック製:MP−01型)に投入した。次に、ヒドロキシプロピルセルロース(HPC−L、日本曹達製)19.8gを精製水375.9gに溶解した液をスプレーし、造粒した。得られた造粒物を乾燥し、整粒機(パウレック製:QC−197S)で整粒した。
【0078】
得られた整粒品にステアリン酸マグネシウム1.5gを混合し、ロータリー式打錠機(畑鐵工所製:HT−EX18型)を用い、直径7mmで圧縮成形し、1錠130mgの錠剤を得た。
【0079】
[成 分] [1錠130mg当たりの重量(mg)]
カンデサルタンシレキセチル 8.0
乳糖水和物 73.5
トウモロコシデンプン 30.1
ヒドロキシプロピルセルロース 8.2
低置換度ヒドロキシプロピルセルロース 9.8
ステアリン酸マグネシウム 0.4
【0080】
(試験例4)
(試験例:苛酷試験による製剤の保存安定性比較)
60℃で2週間保存した後の、実施例5及び6で得た各錠剤、同条件における比較例5で得た錠剤並びにカンデサルタンシレキセチル錠の市販製剤について、不純物の増加量を比較した。
【0081】
(結果)
60℃で2週間保存した後の不純物増加量の測定結果を図4に示す。実施例5及び6で得た各錠剤は、比較例5で得た錠剤並びにカンデサルタンシレキセチル錠の市販製剤より不純物の増加量が少なく、保存における経時的な不純物の増加が抑制されていることが示された。
【産業上の利用可能性】
【0082】
本発明は、医薬として有用なカンデサルタンシレキセチルを含み、不純物の増加が抑制される固形製剤を提供するものであり、産業上利用可能である。
【特許請求の範囲】
【請求項1】
カンデサルタンシレキセチルおよびクエン酸トリエチルを含有することを特徴とする固形製剤。
【請求項2】
前記クエン酸トリエチルの含有量が0.1〜6.0質量%であることを特徴とする請求項1に記載の固形製剤。
【請求項3】
前記固形製剤は、前記カンデサルタンシレキセチルおよび前記クエン酸トリエチルを含有する組成物を圧縮成形することにより得られることを特徴とする請求項1または2に記載の固形製剤。
【請求項4】
クエン酸トリエチルを固形製剤中に含有させることによる、圧縮成形固形製剤中のカンデサルタンシレキセチルの分解抑制方法。
【請求項5】
前記クエン酸トリエチルを含有させる量が0.1〜6.0質量%である請求項4に記載の分解抑制方法。
【請求項6】
カンデサルタンシレキセチルとクエン酸トリエチルとを用いて、固形組成物を得る第1の工程と、
前記第1の工程で得られた、カンデサルタンシレキセチルおよびクエン酸トリエチルを含有する前記固形組成物を圧縮する第2の工程とを備える、カンデサルタンシレキセチルを含有する圧縮成形固形製剤の製造方法。
【請求項7】
前記圧縮成形固形製剤は賦形剤をさらに含有しており、
前記第1の工程において、前記組成物は、前記カンデサルタンシレキセチルと前記賦形剤とを混合して得られる混合物にクエン酸トリエチルの混和液または混濁液を添加しながら造粒することにより前記固形組成物を得る請求項6に記載の製造方法。
【請求項8】
前記圧縮成形固形製剤は賦形剤をさらに含有しており、
前記第1の工程において、前記賦形剤に、カンデサルタンシレキセチルおよびクエン酸トリエチルの混和液または混濁液を添加しながら造粒することにより前記固形組成物を得る請求項6に記載の製造方法。
【請求項9】
前記第1の工程において得られた前記固形組成物に、前記第2の工程を行う前に更に他の成分を添加する請求項6から8の何れか一項に記載の製造方法。
【請求項10】
前記他の成分が、賦形剤、結合剤、崩壊剤、滑沢剤および流動化剤から選ばれる任意の成分である、請求項9に記載の製造方法。
【請求項11】
前記クエン酸トリエチルの含有量が、0.1〜6.0質量%である、請求項6から請求項10の何れか一項に記載の製造方法。
【請求項1】
カンデサルタンシレキセチルおよびクエン酸トリエチルを含有することを特徴とする固形製剤。
【請求項2】
前記クエン酸トリエチルの含有量が0.1〜6.0質量%であることを特徴とする請求項1に記載の固形製剤。
【請求項3】
前記固形製剤は、前記カンデサルタンシレキセチルおよび前記クエン酸トリエチルを含有する組成物を圧縮成形することにより得られることを特徴とする請求項1または2に記載の固形製剤。
【請求項4】
クエン酸トリエチルを固形製剤中に含有させることによる、圧縮成形固形製剤中のカンデサルタンシレキセチルの分解抑制方法。
【請求項5】
前記クエン酸トリエチルを含有させる量が0.1〜6.0質量%である請求項4に記載の分解抑制方法。
【請求項6】
カンデサルタンシレキセチルとクエン酸トリエチルとを用いて、固形組成物を得る第1の工程と、
前記第1の工程で得られた、カンデサルタンシレキセチルおよびクエン酸トリエチルを含有する前記固形組成物を圧縮する第2の工程とを備える、カンデサルタンシレキセチルを含有する圧縮成形固形製剤の製造方法。
【請求項7】
前記圧縮成形固形製剤は賦形剤をさらに含有しており、
前記第1の工程において、前記組成物は、前記カンデサルタンシレキセチルと前記賦形剤とを混合して得られる混合物にクエン酸トリエチルの混和液または混濁液を添加しながら造粒することにより前記固形組成物を得る請求項6に記載の製造方法。
【請求項8】
前記圧縮成形固形製剤は賦形剤をさらに含有しており、
前記第1の工程において、前記賦形剤に、カンデサルタンシレキセチルおよびクエン酸トリエチルの混和液または混濁液を添加しながら造粒することにより前記固形組成物を得る請求項6に記載の製造方法。
【請求項9】
前記第1の工程において得られた前記固形組成物に、前記第2の工程を行う前に更に他の成分を添加する請求項6から8の何れか一項に記載の製造方法。
【請求項10】
前記他の成分が、賦形剤、結合剤、崩壊剤、滑沢剤および流動化剤から選ばれる任意の成分である、請求項9に記載の製造方法。
【請求項11】
前記クエン酸トリエチルの含有量が、0.1〜6.0質量%である、請求項6から請求項10の何れか一項に記載の製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−149056(P2012−149056A)
【公開日】平成24年8月9日(2012.8.9)
【国際特許分類】
【出願番号】特願2011−285212(P2011−285212)
【出願日】平成23年12月27日(2011.12.27)
【出願人】(307020615)キョーリンリメディオ株式会社 (2)
【Fターム(参考)】
【公開日】平成24年8月9日(2012.8.9)
【国際特許分類】
【出願日】平成23年12月27日(2011.12.27)
【出願人】(307020615)キョーリンリメディオ株式会社 (2)
【Fターム(参考)】
[ Back to top ]

