新規なIL−17結合化合物およびその医薬用途
本発明は、新規なIL−17阻害ポリペプチド、対応する融合タンパク質、組成物およびそれらの医薬用途に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規なIL−17阻害ポリペプチド、対応する融合タンパク質、組成物およびそれらの医薬用途に関する。
【背景技術】
【0002】
CD4+ T細胞は、適応免疫系または自然免疫系の他の細胞を支援することによって、免疫応答の調整において中心的な役割を果たす。初期の研究では、CD4+ T細胞の2つのクラス(Th1およびTh2)が特定された。より最近では、CD4+ T細胞の新規サブセットであるTh17系が特定された。Th17細胞は、Th1またはTh2免疫が充分に及ばない、いくつかの菌類および微生物に加えて、細胞外の細菌に対する増強された宿主保護を担当する、適応免疫系の1部門として発生したと見られる。
【0003】
Th17細胞は、新規なサイトカインファミリーであるIL−17ファミリーの発見との関連で特定されたが、現在は、このファミリーは6種(IL−17A〜F)を含むことが知られている。IL−17(旧称CTLA−8)は主としてTh17細胞によって発現され、IL−17Aと規定されたが、これはこのサイトカインファミリーの創設種であることを示す。IL−17の構成種は、他の現在知られている哺乳類タンパク質と配列相同性を持たず、従って、独特なサイトカインファミリーを構成する。構造類似性からヘテロダイマーが存在する可能性が暗示されるが、IL−17Fの結晶構造から推定されるIL−17ファミリーの構成員の構造的特徴により、多数のサイトカインと同様に、それぞれのファミリーの構成員はおそらくホモダイマーとして産生されることが提示される。極最近、活性化ヒトCD4+ T細胞によって発現されたIL−17AおよびIL−17Fのヘテロダイマーが、IL−17RA/IL−17RC複合体を介してシグナルを送ることが特定された(ライト(Wright)J.F.ら(2008年)J.of Immunol.,181,2799−2805頁)。
【0004】
以前はTh1を介すると考えられていた、慢性炎症性疾患における中心的メディエーターおよびいくつかのタイプの自己免疫状態における主要な病原性エフェクターとして、Th17細胞が特定されたことにより、新たな治療アプローチが期待される(ウェーバー(Weaver)T.ら(2008年)Annu.Rev.Immunol.,25,821−852頁)。実際に、炎症促進サイトカインであるIL−17は主にTh17細胞によって発現され、関節リウマチ(RA)患者では滑液中のレベルが上昇しており、初期RA発症に関与することが示されている。加えて、IL−17は、TNF−αおよびIL−1の強力な誘導物質であるが、後者は骨侵食の主要原因であり、罹患患者にはひどい痛みをもたらす(ルバーツ(Lubberts)E.(2008年)Cytokine,41,84−91頁)。さらに、IL−17の不適切または過剰な産生は、種々の他の疾病および障害の病理と関係するが、例えば、これらの疾病および障害としては、変形性関節症、骨インプラントの弛緩、急性移植拒絶反応(アントニサミー(Antonysamy)ら、(1999年)J.Immunol,162,577−584頁;ヴァン・コーテン(van Kooten)ら(1998年)J.Am.Soc.Nephrol.,9,1526−1534頁)、敗血症、敗血性または内毒素性ショック、アレルギー、喘息(モレット(Molet)ら(2001年)J.AllergyClin.Immunol.,108,430−438頁)、骨量の減少、乾癬(テウニッセン(Teunissen)ら(1998年)J.Invest.Dermatol,111,645−649頁)、虚血、全身性硬化症(クラサワ(Kurasawa)ら(2000年)Arthritis Rheum.,43,2455−2463頁)、脳卒中、および他の炎症性疾患が挙げられる。
【0005】
結果として、抗IL−17化合物は、抗炎症薬としての可能性があり、多数のインビボ試験に沿った治療アプローチによって、IL−17の中和が、関節炎等の炎症過程を減ずることが示される。例えば、関節炎の初期段階の間、免疫方法の後に開始する、IL−17受容体IgG1−Fc融合タンパク質による内因性IL−17の早期中和により、実験的関節炎の発症が抑制される(ルバーツ(Lubberts)ら(2001年)J.Immunol.,167,1004−1013頁)。さらに、動物モデルにおいて、コラーゲン誘導関節炎の発症後、中和抗IL−17抗体による治療により、関節の炎症、軟骨破壊および骨侵食が減少した(ルバーツら(2004年)Arthritis and Rheumatism,50;650−659頁)。組織学的分析により、関節の炎症の抑制が確認され、抗IL−17抗体による治療後、全身性IL−6レベルが有意に減少した。対照的に、マウスIL−17を発現しているアデノウイルスベクターを用いた全身性および局所性IL−17の過剰発現により、コラーゲン誘導関節炎(CIA)の発症が加速され、その部位での滑膜炎が悪化した(ルバーツら(2001年)J.Immunol.,167,1004−1013頁およびルバーツら(2002年),Inflamm.Res.51,102−104頁)。
【0006】
抗体は、その製造し易さ、実質的にあらゆる所望の標的抗原に対して親和性および特異性が高いため、分析、精製、診断および治療目的に日常的に使用されるが、なおも多数の重大な欠点があり、例えば、複雑な哺乳類細胞の産生系が必要なこと、ジスルフィド結合の安定性への依存、ある抗体断片の凝集傾向、低溶解性、および最後に大切なことだが、抗体はヒト化した場合であっても望まない免疫反応を引き起こす可能性がある。結果として、最近、新規な分類の万能結合タンパク質を産生するための骨格として、小さな球状タンパク質の開発が注目されるようになった。多様性および標的特異性を与えるため、典型的には、好適な生物物理学的特性を有するタンパク質骨格の表面成分(例えば細胞外ループ)は組み合わせて変化させて、興味のある標的結合特異性をスクリーニングするタンパク質ライブラリーを製造する(ビンツ(Binz),H.K.,およびプルックスン(Pluckthun),A.(2005年)Curr.Opin.Biotechnol.16,459−469頁)。
【0007】
これらの非免疫グロブリン由来結合試薬は、集合的に規定された「骨格」である(スケッラ(Skerra)A.(2000年)J.Mol.Recognit.13,167−187頁)。50を超える異なるタンパク質骨格が、過去10〜15年にわたって提案され、この分野の最先端のアプローチは(ゲバウアー(Gebauer)MおよびスケッラA.(2009年)Curr Opinion in Chemical Biology 13:245−255頁に要約):アフィボディ(ブドウ球菌プロテインAのZドメインに基づく)、クニッツ型ドメイン、アドネクチン(ヒトフィブロネクチンの第10ドメインに基づく)、アンチカリン(リポカリン由来)、DARPin(アンキリン反復タンパク質由来)、アビマー(多量体化LDLR−Aに基づく)、アフィチン(affitin)(超高熱古細菌由来のSac7dに基づく)、およびヒトFyn SH3ドメインに由来するフィノマー(Fynomer)である。
【0008】
一般に、SH3ドメインは、細胞間情報伝達に関与する、多種多様のタンパク質中に存在する(ムサッキオ(Musacchio)ら(1994年)Prog.Biophys.Mol.Biol.61;283−297頁)。このドメインは、タンパク質中で一定の位置を占有せず、独立して発現および精製され得る。現在、約300のヒトSH3ドメインを有する1000を超えるドメインの存在が知られている(ムサッキオA.(2003年)Advances in Protein Chemistry.61;211−268頁)。SH3ドメインには広範な配列多様性があるが、全てのSH3ドメインは保存された折りたたみ構造:2つの逆平行βシートで形成されるコンパクトなβバレルを共有する(ムサッキオA.(2003年)Advances in Protein Chemistry.61;211−268頁)。代表的には、SH3ドメインは、PXXPコア結合モチーフを含有する高プロリン含有ペプチドに結合する(レン(Ren)ら(1993年)Science 259;1157−1161頁)が、非従来型のSH3結合部位の例も記載されている(カークカイネン(Kark−kainen)ら(2006年)EMBO Rep.7;186−191頁)。これまでに配列決定したSH3ドメインの多くは、およそ60〜65個のアミノ酸の全長を有するが、それらのいくつかは、二次構造の主要な保存エレメントに接続するループ中に挿入することにより、85個のアミノ酸の特徴を有するかもしれない(コヤマ(Koyama)ら(1993年)Cell 72(6);945−952頁)。種々のSH3ドメインのアライメントにより、適切な構造形成および標準的な高プロリン含有モチーフの認識に関与する、保存アミノ酸残基が明らかになった(ラーソン(Larson)ら(2000年)Protein Science 9;2170−2180頁)。
【0009】
最近、本発明者らは、Fyn SH3ドメインが、結合タンパク質産生に特に魅力的な骨格(「フィノマー(Fynomer)」)であることを実証したが、これは、このドメインが、(i)細菌中、溶解形態で多量発現され得ること、(ii)単量体であり、溶液中で保存した際に凝集しないこと、(iii)非常に安定であること(Tm 70.5℃)、(iii)システイン残基がないこと、および(iv)マウスからヒトへ完全に保存されたアミノ酸配列を特徴とするヒト由来のものであり、従って非免疫原性であることによる(グラブロフスキ(Grabulovski)ら(2007年)JBC,282,3196−3204頁)。
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、新規なIL−17A結合分子を提供することであり、特に、IL−17Aに対して特異性および親和性が高い新規なIL−17A結合分子を提供することである。さらなる目的は、好ましくはIL−17Aが介在する疾患および医学的症状の治療および/または予防用の医薬品における使用のための、研究、診断および医学的処置に好適な、IL−17A結合分子、好ましくは、IL−17阻害剤を提供することである。
【課題を解決するための手段】
【0011】
驚くべきことに、上記の目的は、以下よりなる群から選択されるアミノ酸配列を含むポリペプチドによって解決された:
(i)(G/E)VTLFVALYDY−(X)a−D−(X)b−SFHKGEKF−(X)c−I−(X)d−G−(X)e−WW−(X)f−A−(X)g−SLTTG−(X)hGYIPSNYVAPVDSIQ (I)
式中、a〜hは0〜20であり、
好ましくは、aは1〜10であり、より好ましくは2〜8であり、最も好ましくは6であり;
好ましくは、bは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、cは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、dは1〜10であり、より好ましくは3〜9であり、最も好ましくは5または7であり;
好ましくは、eは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、fは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、gは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、hは0〜6であり、より好ましくは1〜3であり、最も好ましくは1または2である;
(ii)(i)に対して、少なくとも70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%のアミノ酸配列同一性を有する、アミノ酸配列;
(iii)好ましくはストリンジェントな条件下で、(i)をコードする核酸の相補鎖にハイブリダイズする核酸によってコードされる、アミノ酸配列;
(iv)少なくとも1つのアミノ酸の置換、付加および/または欠失によって誘導し得る、(i)〜(iii)の断片または機能性誘導体、
ここで、前記のポリペプチドはIL−17Aに結合する。
【0012】
上記一般式(I)は、ヒトFyn SH13骨格の反復的および広範囲の突然変異解析およびIL−17A結合に基づく選択の結果である。
【0013】
Xで規定する位置は、アミノ酸のタイプおよびアミノ酸の数によっても広範に変化し得る。好ましくは、Xはいずれもシステインではない。Xによるアミノ酸の好ましい数は、下付き文字a〜hで示され、これらは全て、好ましくは0〜20であり、より好ましくは0または1〜10である。
【0014】
天然のヒトFyn SH3において、(X)aおよび(X)dは、それぞれ、RT−およびSrcループと相関する可能性がある。必須ではないが、(X)aおよび(X)dはループ構造を提供することが好ましい。典型的なループ構造は、2から20を超えるアミノ酸を含むことが知られている(ラーソン(Larson)ら(2000年)Protein Science 9;2170−2180頁)。従って、(X)aおよび/または(X)dは、2〜20のアミノ酸を有することが好ましい。好ましくは、aは1〜10であり、より好ましくは2〜8であり、最も好ましくは6である。好ましくはdは1〜10であり、より好ましくは3〜9であり、最も好ましくは5または7である。好ましくは(X)aはTAFWPGであり、より好ましくはVAFWPGであり、最も好ましくはKAFWPGである。好ましくは(X)dはLNSSEであり、より好ましくはTRTSDまたはLHTSDであり、最も好ましくはLRTSDである。
【0015】
(X)b、(X)c、(X)e、(X)fおよび(X)gは、互いに独立して、好ましくは0〜5であり、より好ましくは1〜3であり、最も好ましくは1である。(X)hは好ましくは0〜6であり、より好ましくは1〜3であり、最も好ましくは1である。
【0016】
最も好ましい態様において、式(I)は以下である:
(G/E)VTLFVALYDY−(X)6−D−(X)1−SFHKGEKF−(X)1−I−(X)5−7−G−(X)1−WW−(X)1−A−(X)1−SLTTG−(X)1−2GYIPSNYVAPVDSIQ (Ia)
【0017】
勿論、式(I)のアミノ酸配列には大多数のバリエーションがあり、それらは依然として本発明のポリペプチドのIL−17A結合を可能にするであろう。従って、本発明は、(i)に対して、少なくとも50、60または70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%のアミノ酸配列同一性を有する、ポリペプチドも包含する。
【0018】
本書で使用する場合、アミノ酸配列間の「アミノ酸配列同一性」という用語は、生化学の当業者が通常広く使用するアラインメントおよび比較技術に関連することが意図される。2つのアミノ酸配列のアミノ酸配列同一性は、通常のアラインメント方法およびツールによって測定し得る。例えば、式(I)のアミノ酸配列に対する、任意のポリペプチドのアミノ酸配列同一性の程度を測定には、SIM局所相似性プログラムを使用し得る(シャオキン・ファン(Xiaoquin Huang)およびウェッブ・ミラー(Webb Miller)、「時間効率のよい線形空間局所相似性アルゴリズム(A Time−Efficient, Linear−Space Local Similarity Algorithm)」 Advances in Applied Mathematics, 12巻: 337−357頁, 1991年)が、これは著者らおよびその機関から自由に入手可能であり(ワールドワイドウェブ:http://www.expasy.org/tools/sim−prot.htmlも参照)、多重アラインメント分析には、ClustalWを使用し得る(トンプソン(Thompson)ら、「CLUSTAL W:配列加重、位置特異的ギャップペナルティおよび加重マトリックス選択による進行性多重配列アラインメント感度の改善(improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position−specific gap penalties and weight matrix choice)」,Nucleic Acids Res.,22(22):4673−4680頁,1994年)。好ましくは、本発明のポリペプチド、断片または機能性誘導体の、式(I)のアミノ酸配列に対するアミノ酸配列同一性の程度は、式(I)の完全な配列に対して定量する。
【0019】
さらに、本発明は、好ましくはストリンジェントな条件の下で、(i)をコードする核酸の相補鎖にハイブリダイズする核酸によってコードされるアミノ酸配列を含むポリペプチドも包含する。換言すれば、本発明によるポリペプチドに包含されるアミノ酸配列は、好ましくは、式(I)のアミノ酸配列をコードする核酸の相補鎖にハイブリダイズする能力をなお有するべき核酸をコードすることによって、間接的に規定される。核酸が互いにハイブリダイズするかどうかは、特異的アラインメントおよび比較ツールにより、また実験的に、当該技術において規則的に測定される。1つの核酸がストリンジェントな条件下で特異的な参照核酸配列にハイブリダイズする能力を測定する、従来技術の一般的および/または標準的なプロトコル(例えば、サムブルック(Sambrook)およびルセル(Russell)、分子クローニング:実験室マニュアル(Molecular cloning: A laboratory manual)(3巻),2001年)の次に、興味のあるポリペプチドをコードする任意の核酸がストリンジェントな条件下で式(I)のアミノ酸配列をコードする核酸配列の相補鎖にハイブリダイズする能力を、アラインメントツールを用いてこれら2つのヌクレオチド配列を比較することによって分析および測定することが好ましく、アラインメントツールとしては、例えば、BLASTN(アルチュル(Altschul)ら、J.Mol.Biol.,215,403−410頁,1990年)およびLALIGNアラインメントツール等が挙げられる。より好ましくは、本発明のポリペプチドであることが疑われる、興味のあるポリペプチドをコードする核酸が式(I)のアミノ酸配列をコードする核酸の相補鎖にハイブリダイズする能力は、以下の条件下でのサザンブロット分析で確認される:45℃で、6x 塩化ナトリウム/クエン酸ナトリウム(SSC)、その後、65℃で、0.2x SSC、0.1% SDS中で洗浄。
【0020】
さらに、本発明は、上記の本発明のアミノ酸配列全ての断片、好ましくは機能性断片、または機能性誘導体を含む、ポリペプチドを包含する。
【0021】
従って、「本発明によるポリペプチドまたはアミノ酸配列」という用語は、上記で特定された性質を有する、即ちIL−17Aに結合する、本発明のポリペプチドまたはアミノ酸配列の機能性断片および誘導体も包含する。本発明のポリペプチドまたはアミノ酸配列の機能性誘導体は、IL−17Aへの結合を実証する、実質的に充分入手しやすいアミノ酸残基または非天然等価体を有する、あらゆるアミノ酸配列および/またはその化学誘導体(非天然アミノ酸等価体、グリコシル化、化学誘導)を包含することが意図される。本発明のポリペプチドまたはアミノ酸配列の機能性誘導体において、1以上のアミノ酸が、欠失、修飾、挿入および/または置換されてもよい。さらに、「機能性誘導体」との関連で、挿入とは、1以上のアミノ酸の上述の非誘導体化結合タンパク質中への挿入を言う。機能性誘導体は、5、4、3、2を超える、または1を超えるアミノ酸の変更(即ち、欠失、修飾、挿入および/または置換されたアミノ酸)を含まないことが、さらに好ましい。別の態様において、ポリペプチドまたはアミノ酸配列の全てのアミノ酸の、10%、9%、8%、7%、6%、5%、4%、3%、2%、または1%以下が変更される(即ち、欠失、修飾、挿入および/または置換されたアミノ酸である)ことが、さらに好ましい。誘導体における置換は、保存的または非保存的置換であってもよいが、好ましくは保存的置換である。いくつかの態様において、置換として、天然に存在するアミノ酸の、天然に存在しないアミノ酸での交換も挙げられる。保存的置換は、アミノ酸の、置換されるアミノ酸に類似した化学的性質を有する別のアミノ酸での置換を含む。好ましくは、保存的置換は、(i)塩基性アミノ酸の、別の塩基性アミノ酸での置換;(ii)酸性アミノ酸の、別の酸性アミノ酸での置換;(iii)芳香族アミノ酸の、別の芳香族アミノ酸での置換;(iv)非極性脂肪族アミノ酸の、別の非極性脂肪族アミノ酸での置換;および(v)極性非荷電アミノ酸の、別の極性非荷電アミノ酸での置換よりなる群から選択される置換である。塩基性アミノ酸は、アルギニン、ヒスチジン、およびリシンよりなる群から選択される。酸性アミノ酸は、アスパラギン酸塩またはグルタミン酸塩より選択される。芳香族アミノ酸は、フェニルアラニン、チロシンおよびトリプトファンよりなる群から選択される。非極性脂肪族アミノ酸は、グリシン、アラニン、バリン、ロイシン、メチオニンおよびイソロイシンよりなる群から選択される。極性非荷電アミノ酸は、セリン、スレオニン、システイン、プロリン、アスパラギンおよびグルタミンよりなる群から選択される。保存的アミノ酸置換と対照的に、非保存的アミノ酸置換は、1つのアミノ酸の、上記で概説した保存的置換(i)〜(v)に該当しない、あらゆるアミノ酸との交換である。機能性誘導体が欠失を含む場合には、誘導体中、参照ポリペプチド中に存在する1つまたはいくつかのアミノ酸が除去されている。しかし、欠失は、誘導体中に、全部でアミノ酸3つ未満、好ましくは4つ未満、より好ましくは5つ未満、および最も好ましくは6つ未満であるよう、多数であるべきではない。上記の通り、本発明のポリペプチドまたはアミノ酸配列のアミノ酸は修飾されてもよく、例えば化学的に修飾されてもよい。例えば、ポリペプチドのアミノ酸の側鎖または遊離アミノまたはカルボキシ末端は、例えば、グリコシル化、アミド化、リン酸化、ユビキチン化等によって修飾されてもよい。化学的修飾はインビボでも、例えば宿主細胞中でも起こり得るが、これは当該技術においてよく知られている。例えば、好適な化学的修飾モチーフ、例えばポリペプチドのアミノ酸配列中に存在するグリコシル化配列モチーフは、ポリペプチドをグリコシル化させるであろう。本発明の機能性誘導体に言及する全ての態様において、本書の上記で規定した式(I)を有するアミノ酸配列は、機能性誘導体が導入される出発分子であることを理解しなければならない。挿入の場合、2つの出発分子において、第一の分子でXaが4であり、第二の分子でXaが5である以外は同一の配列を有する場合、例えばXaのC末端への挿入が、第一の分子では2つのアミノ酸であり、第二の分子では1つのアミノ酸であるならば、同一の長さで、おそらく同一のアミノ酸配列の分子が得られるであろう。
【0022】
本発明のポリペプチドはIL−17Aに結合し、好ましくはヒトIL−17Aに結合する。好ましくは、IL−17Aに特異的に結合し、即ち、他のサイトカインには結合しないか、それらにははるかにより少ない程度に結合し、好ましくは少なくとも2、5、10、50、100、500または1000倍少なく結合する。本発明のポリペプチドの結合特異性を定量するための典型的で好ましいELISA分析を、実施例6および7に示す。
【0023】
好ましい態様において、本発明のポリペプチドは、ヒトおよびカニクイザルIL−17Aに、特異的および高結合親和性で結合する。
【0024】
さらに好ましい態様において、本発明のポリペプチドは、ヒトIL−17Aに対して特異的な(インビボおよび/またはインビトロ)結合親和性を有し、好ましくはKDが10−7〜10−12Mであり、より好ましくは10−8〜10−12Mであり、最も好ましくは10−12M未満である。例として、および好ましくは、本発明のポリペプチドの結合親和性は、以下の実施例2によって定量し得る。
【0025】
最も好ましい態様において、本発明のポリペプチドは、明細書に付記した通りの配列番号1〜119またはそれらの機能性誘導体よりなる群から選択される。
【0026】
好ましい態様において、本発明のポリペプチドは、IL−17Aに結合するだけではなく、実際にIL−17A(機能)を阻害する。この容量は、実施例3および10に実証されており、ここで、IL−17Aの添加に対する応答において、ポリペプチドがヒト皮膚線維芽細胞中のIL−6の誘導を阻害する能力が実証された。
【0027】
さらに、本発明のポリペプチドは、溶液中で高い安定性を有し、例えば、単純なリン酸緩衝生理食塩水中、少なくとも6ヶ月間、4℃で安定である(実施例4参照)。
【0028】
しかし、安定性はインビトロの組成物に限らず、本発明のポリペプチドを静注したマウスにおいて、既に明らかである(実施例5および12参照)。
【0029】
結論として、本発明のポリペプチドは、研究、診断および医学的応用に非常に適している。
【0030】
IL−17A抗体を置換することの他に、本発明のポリペプチドはインビボおよびインビトロの薬学的および診断的応用のための、新規で免疫原性がより低い融合タンパク質の設計も可能にする。従って、第二の様相において、本発明は、薬学的および/または診断的有効成分に融合した本発明のポリペプチドを含む融合タンパク質に関する。
【0031】
上記の通り、本発明の融合タンパク質は、非ポリペプチド成分を含んでいてもよく、例えば治療的または診断的関連放射性核種に対する、例えば非ペプチド性リンカー、非ペプチド性リガンドを含んでいてもよい。
【0032】
好ましくは、前記の活性成分は、IL−2、IL−12、TNF−α、IFNα、IFNβ、IFNγ、IL−10、IL−15、IL−24、GM−CSF、IL−3、IL−4、IL−5、IL−6、IL−7、IL−9、IL−11、IL−13、LIF、CD80、B70、TNFβ、LT−β、CD−40リガンド、Fas−リガンド、TGF−β、IL−1αおよびIL−1βよりなる群から選択されるサイトカインである。
【0033】
別の好ましい態様において、前記の活性成分は毒性化合物であり、好ましくは有機小分子またはポリペプチドであり、より好ましくは、カリケアマイシン、マンタンシノイド、ネオカルチノスタチン、エスペラマイシン、ダイネミシン、ケダルシジン、マデュロペプチン、ドキソルビシン、ダウノルビシン、アウリスタチン、リシン−A鎖、モデシン、トランケートした緑膿菌エンドトキシンA、ジフテリア毒素および組み換えゲロニンよりなる群から選択される毒性化合物である。
【0034】
別の好ましい態様において、本発明による融合タンパク質は、前記の活性成分がケモカインであり、好ましくは、IL−8、GROα、GROβ、GROγ、ENA−78、LDGF−PBP、GCP−2、PF4、Mig、IP−10、SDF−1α/β、BUNZO/STRC33、I−TAC、BLC/BCA−1、MIP−1α、MIP−1β、MDC、TECK、TARC、RANTES、HCC−1、HCC−4、DC−CK1、MIP−3α、MIP−3β、MCP−1−5、エオタキシン、エオタキシン−2、I−309、MPIF−1、6Ckine、CTACK、MEC、リンホタクチンおよびフラクタルカインよりなる群から選択されるケモカインである、融合タンパク質である。
【0035】
さらに好ましい態様において、本発明によるポリペプチドまたは融合タンパク質は人工アミノ酸を含有する。
【0036】
本発明の融合タンパク質のさらに好ましい態様において、前記の活性成分は蛍光色素であり、好ましくは、アレクサフルオルまたはCy色素(ベルリエ(Berlier)ら、「長波長アレクサフルオル色素のCy色素との定量比較:色素およびそれらのバイオコンジュゲートの蛍光(Quantitative Comparison of Long−wavelength Alexa Fluor Dyes to Cy Dyes:Fluorescence of the Dyes and Their Bioconjugates)」,J.Histochem. Cytochem.51(12):1699−1722頁,2003年);光増感剤、好ましくは光毒性赤色蛍光タンパク質キラーレッド(ブリナ(Bulina)ら(2006年)Nat Biotechnol.,24,95−99頁)またはヘマトポルフィリン;凝血促進因子、好ましくは組織因子;プロドラッグ活性化酵素、好ましくは、カルボキシペプチダーゼ、グルクロニダーゼおよびグルコシダーゼよりなる群から選択される酵素;γ放射性アイソトープの群からの放射性核種、好ましくは99mTc、123I、111In、または、ポジトロン放射体の群からの放射性核種、好ましくは18F、64Cu、68Ga、86Y、124I、または、β放射体の群からの放射性核種、好ましくは131I、90Y、177Lu、67Cu、または、α放射体の群からの放射性核種、好ましくは213Bi、211Atよりなる群から選択される成分である。
【0037】
別の好ましい態様において、本発明のポリペプチドは、本書において上記で規定した通りの1以上の非ポリペプチド成分に、直接または化学リンカーを介して結合してもよい。
【0038】
本発明の融合タンパク質のより好ましい態様において、前記の活性成分は1以上の機能性Fcドメインであり、好ましくは1以上のヒト機能性ドメインであり(例えば、配列番号117〜119および配列番号130を参照)、それ(ら)は、本発明のIL−17A結合ポリペプチドのインビボの半減期を延長することが可能であり、それらのいくつかは、例えば治療的、予防的および/または診断的適応において、哺乳類の免疫反応を、融合タンパク質の本発明のポリペプチド成分の特異的標的結合部位に向ける。本発明のポリペプチドは、1以上の機能性FcドメインのN−またはC−末端のいずれか、または、1以上のFcドメインのN−およびC−末端の両者に融合し得る。本発明の融合タンパク質は、1つ以上、好ましくは1つのFcドメインの、少なくとも片側、好ましくはN−末端に融合した、本発明のポリペプチドの多量体、好ましくは四量体、三量体、または最も好ましくは二量体を含むことが好ましい。この点において、(2C1)2−Fcと規定されるフィノマー−フィノマー−Fc融合タンパク質が多量体ポリペプチドFc融合体の有利点を実証することが知られており、以下の実施例2の図3eおよび3fおよび表IIに示す通り、この融合体は、対応する単量体2C1−Fc融合タンパク質よりも、IL−17Aに対する親和性が高い。従って、本発明の好ましい態様は、多量体ポリペプチドFc融合タンパク質を対象にする。
【0039】
抗体の「機能性Fcドメイン」は、当業者によく知られている用語であり、抗体のパパイン消化に基づいて規定される。重鎖の定常領域のアミノ酸配列によって、免疫グロブリンは以下のクラス:IgA、IgD、IgE、IgGおよびIgMに分類され、これらのうちのいくつかは、さらにサブクラス(アイソタイプ)、例えばIgG1、IgG2、IgG3、およびIgG4、IgA1、およびIgA2に分類される。重鎖の定常領域によって、免疫グロブリンの種々のクラスはそれぞれ[α]、[δ]、[ε]、[γ]、および[μ]と呼ばれる。抗体の機能性Fcドメインは、補体活性化、C1q結合およびFc受容体結合に基づいて、ADCC(抗体依存性細胞媒介性細胞傷害)およびCDC(補体依存性細胞傷害)に直接的に関与する。4つのヒトIgGアイソタイプは、新生児Fc受容体、活性化Fcγ受容体、FcγRI、FcγRIIa、およびFcγRIIIa、抑制性受容体FcγRIIb、およびC1q等の、親和性の異なる種々の受容体に結合し、非常に異なる活性を与える。ヒト抗体のFcドメインの活性化および抑制性受容体への親和性は、操作および修飾し得る(ストロール(Strohl)W.(2009年)Curr Opin Biotechnol,20,685−691頁参照)。従って、上記の通り、本発明は、本発明のIL−17A結合ポリペプチドのインビボでの半減期を延長することができ、ヒト由来の機能性Fcドメイン、好ましくはIgG1抗体のヒト機能性Fcドメイン(例えば、配列番号117〜119および配列番号130参照)を含有する、Fc融合体を含む。
【0040】
本発明の融合タンパク質のより好ましい態様において、活性成分は、活性化またはサイレンシングされたエフェクター機能を有するIgG1の1以上の改変ヒト機能性Fcドメインであり、好ましくは、サイレンシングされたエフェクター機能を有するIgG1の1以上の改変ヒト機能性Fcドメインであり、最も好ましくは、L234およびL235に突然変異を有する、サイレンシングされたエフェクター機能を有するIgG1の1以上の改変ヒト機能性Fcドメインであり(例えば、配列番号131〜135参照)、カバト(Kabat)のEUインデックスに従って番号を付ける(ジョンソン(Johson)G.およびウ(Wu)T.T.(2000年)Nucleic Acids Res.28,214−218頁参照)。
【0041】
さらに好ましい態様は、上記の通りの本発明によるポリペプチドまたは融合タンパク質であって、さらに、血中半減期を調節する成分を含み、好ましくは、ポリエチレングリコール(PEG)、免疫グロブリンおよびアルブミン結合ペプチドよりなる群から選択される成分を含む、ポリペプチドまたは融合タンパク質に関する。
【0042】
さらに、本発明の融合タンパク質があらゆる上記の本発明のIL−17A結合ポリペプチドを含み、好ましくは、配列番号117〜119および配列番号130〜135またはその機能性誘導体からなる群から選択されるものを含むことが好ましい。
【0043】
本発明のポリペプチドまたは融合タンパク質は、好ましくは単量体であるが、また本発明のポリペプチドの多量体も包含し、好ましくは四量体、より好ましくは三量体、または最も好ましくは二量体を包含することが注目される。
【0044】
本発明のポリペプチドおよび融合タンパク質は、単純な有機合成戦略、固相支援合成技術等の、多数の従来からの周知技術のいずれかにより、または、市販の自動合成装置により、調製してもよい。他方で、従来の組み換え技術単独で、または従来の合成技術との組み合わせにより調製してもよい。
【0045】
この点において、本発明のさらなる様相は、(i)本発明のポリペプチドまたは融合タンパク質をコードする核酸、(ii)前記の核酸を含むベクター、および(iii)前記のポリヌクレオチドおよび/または前記のベクターを含む宿主細胞を対象とする。
【0046】
好ましくは、本発明は、
(i)本発明のポリペプチドをコードする核酸、好ましくは式(I)のアミノ酸配列をコードする核酸、より好ましくは
(G/E)VTLFVALYDY−(X)6−D−(X)−SFHKGEKF−(X)1−I−(X)5−7−G−(X)1−WW−(X)−A−(X)−SLTTG−(X)1−2−GYIPSNYVAPVDSIQ
をコードする核酸;
(ii)(i)の核酸配列に対して、少なくとも60%または70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%の配列同一性を持つ配列を有する核酸;
(iii)(i)または(ii)の核酸の相補鎖にハイブリダイズする核酸;
(iv)核酸であって、前記の核酸が、(i)、(ii)または(iii)の核酸のうちの1つの置換、付加および/または欠失によって誘導し得る、核酸;
(v)(i)〜(iv)の核酸のいずれか1つの断片であって、本発明によるポリペプチドをコードする(i)の核酸の相補鎖にハイブリダイズする、断片
を含む、単離または精製核酸を対象とする。
【0047】
より好ましくは、本発明の核酸は、上述の通りのポリペプチドまたは融合タンパク質をコードする核酸を含む。この点において、上記の核酸(i)〜(v)のいずれも、好ましくはIL−17Aに結合するポリペプチドをコード化し、より好ましくはIL−17Aの機能を阻害することが理解される。
【0048】
本発明の核酸は、DNA、RNA、PNAおよびそれらのあらゆる他のアナログであり得る。ベクターおよび宿主細胞は、例えば、本発明のポリペプチドおよび/または融合タンパク質の製造、例えば遺伝子治療用の治療に有用なベクターおよび宿主細胞の製造などの目的に適合するあらゆる従来のタイプであってもよい。当業者は、多くの従来技術からそのような核酸、ベクターおよび宿主細胞を選択し、通常の方法により過度の負担なく、それらが所望の目的に特に適合することを確認できるであろう。
【0049】
好ましくは、核酸はプロモーターに動作可能に結合し、好ましくは、T5プロモーター/lacオペレーターエレメント、T7プロモーター/lacオペレーターエレメントよりなる原核生物プロモータの群、またはhEF1−HTLV、CMV enh/hFerLプロモーターよりなる真核生物プロモーターの群から選択されるプロモーターに結合する。
【0050】
また、本発明の組み換えベクターは、本発明の核酸を含むものであって、好ましくは本発明のポリペプチドまたは融合タンパク質を産生する能力があるものが好ましい。好ましくは、このようなベクターは、pQEベクター、pETベクター、pFUSEベクター、pUCベクター、YACベクター、ファージミドベクター、ファージベクター、レトロウイルス、アデノウイルス、アデノ随伴ウイルス等の遺伝子治療に使用されるベクターよりなる群から選択される。
【0051】
加えて、本発明は、本発明の核酸および/またはベクターを含む宿主細胞に関する。
【0052】
さらに、本発明は、本発明のポリペプチドまたは融合タンパク質に特異的に結合する抗体を包含する。抗体が融合タンパク質に結合する場合、融合タンパク質の、本発明のポリペプチドまたは融合エピトープよりなる部分に特異的に結合し、即ち、一部は本発明のポリペプチドよりなり、一部は薬学的および/または診断的活性成分よりなる抗体の結合部位に結合するが、この活性成分は好ましくはポリペプチドまたはペプチドである。抗体は、ポリクローナル抗体またはモノクローナル抗体であってもよい。本書で使用される場合、「抗体」という用語は、抗体分子全体だけではなく、例えば、Fab、F(ab’)2、Fv、および単鎖Fv断片等の抗原結合断片にも言及する。また、キメラ抗体、好ましくはヒト化抗体も含まれる。このような抗体は、任意のタンパク質と本発明のポリペプチドとを判別する研究ツールとして有用である。さらなる様相は、本発明によるモノクローナル抗体を発現する、ハイブリドーマ細胞株に関する。
【0053】
本発明のポリペプチドおよび融合タンパク質は、IL−17A結合および阻害特性、ならびに保存安定性およびインビボ安定性を実証することから、本発明のさらなる様相は、本発明のポリペプチドまたは融合タンパク質、核酸および/または組み換えベクター、および任意に薬学的に許容される担体を含む、医薬組成物に関する。医薬組成物という用語は、インビボで使用する診断用組成物も包含することが意図される。
【0054】
本発明の医薬組成物は、従来のあらゆる方法で製造してもよい。以下に示す疾患に罹患する患者の治療において、本発明の少なくとも1つの化合物は、経口または非経口経路を含む、治療的ポリペプチドまたはその治療的断片を有効量で生物学的に利用可能にするあらゆる形態または様式で投与し得る。例えば、本発明の組成物は、吸入等により、皮下、筋肉内、静脈内に投与し得る。製剤調製分野における当業者は、選択された製品の特別の性質、治療される疾患または病状、疾患または病状の病期、および他の関連する状況に応じて、適宜の形態および様式を容易に選択し得る(例えばレミントンの薬科学(Remington’s Pharmaceutical Sciences),Mack Publishing Co.(1990年)参照)。好適な担体または賦形剤は、活性成分のビヒクルまたは媒体として働き得る、液体材料であってもよい。好適な担体または賦形剤は、当技術分野においてよく知られており、例えば、安定剤、抗酸化剤、pH調整物質、放出制御賦形剤等が挙げられる。本発明による組成物は、好ましくは凍結乾燥形態で提供される。速やかな投与のためには、好適な水性担体中、例えば注射用滅菌水または滅菌緩衝生理食塩水中に溶解する。ボーラス注入法としてよりは点滴による投与のため、より高容量を製造することが望まれる場合は、最終製剤の時点でヒト血清アルブミンまたは患者自身のヘパリン添加血液を溶媒中に取り込むことが有利である。あるいは、製剤は皮下投与し得る。ヒト血清アルブミン等の生理学的に不活性なタンパク質が過剰に存在することにより、輸液用の容器およびチューブ壁への吸着による薬学的に有効なポリペプチドの損失を防ぐ。アルブミンを使用する場合、好適な濃度は、食塩水の重量の0.5〜4.5%である。
【0055】
本発明のIL−17A結合および阻害ポリペプチドは、IL−17Aおよび/またはTh17に関連する疾患または医学的状態の治療および/または予防に特に有用である。したがって、本発明のさらなる様相は、医薬用途のため、即ち、医薬の製造のため、好ましくは、疾患または医学的状態の治療および/または予防のための医薬の製造のためであって、好ましくは疾患または医学的状態がIL−17A−およびTh17に関連する疾患または医学的状態よりなる群から選択されるものである、本発明のポリペプチドまたは融合タンパク質、核酸および/または組換えベクターの使用を対象とする。
【0056】
好ましい態様において、本発明の医薬用途は、炎症性、自己免疫および/または骨量減少関連疾患または状態から選択される、疾患または医学的状態の治療および/または予防に関する。
【0057】
最も好ましい態様において、前記の炎症性、自己免疫および/または骨量減少関連疾患または状態は、関節炎、好ましくは関節リウマチ、慢性進行性関節炎、反応性関節炎、乾癬性関節炎、腸疾患性関節炎および変形性関節炎、リウマチ性疾患、脊椎関節症、強直性脊椎炎、ライター症候群、過敏症(気道過敏症および皮膚過敏症の両者を含む)、アレルギー、全身性エリテマトーデス、炎症性筋疾患、多発性軟骨炎、浮腫性硬化症、ヴェーゲナー肉芽腫、皮膚筋炎、スティーブンス・ジョンソン症候群、慢性活動性肝炎、重症筋無力症、乾癬、特発性スプルー、自己免疫性炎症性腸疾患、潰瘍性大腸炎、クローン病、過敏性腸症候群、内分泌性眼症、グレーブス病、サルコイドーシス、虚血、全身性硬化症、多発性硬化症、原発性胆汁性肝硬変、若年性糖尿病(1型糖尿病)、自己免疫性血液疾患、溶血性貧血、再生不良性貧血、真性赤血球性貧血、特発性血小板減少症、ブドウ膜炎(前部および後部)、乾性角結膜炎、春季カタル、間質性肺線維症、糸宮体腎炎(ネフローゼ症候群を伴う、および、伴わず)、特発性ネフローゼ症候群または微小変化ネフロパシー、腫瘍、皮膚炎症の炎症性疾患、角膜炎、筋炎、骨インプラントの弛緩、急性移植拒絶反応、代謝異常、アテローム性動脈硬化症、糖尿病、および脂質異常症、骨量の減少、変形性関節症、骨粗しょう症、閉塞性または炎症性気道疾患の歯周病、喘息、気管支炎、塵肺、肺気腫、急性および超急性炎症反応、IL−17A介在性TNF−α関連疾患、急性感染症、敗血症、敗血性ショック、内毒素性ショック、成人呼吸窮迫症候群、髄膜炎、肺炎、重度の熱傷、悪液質、消耗症候群、脳卒中、ヘルペス性間質性角膜炎およびドライアイ疾患から選択される。上記で特定された疾患および医学的状態の全ては、共通して、それらの起源および/または症状がIL−17Aおよび/またはTh−17に関連する。
【0058】
好ましくはIL−17Aおよび/またはTh17に関連する疾患または医学的状態よりなる群から選択され、より好ましくは上記に具体的に列挙したものからなる群から選択される、疾患または医学的状態の治療および/または予防のための本発明の化合物、即ちポリペプチド、融合タンパク質、核酸、ベクターおよび宿主細胞の投与量および投与形態は、勿論、本発明の特定のポリペプチドまたは融合タンパク質阻害剤、個々の患者群または患者、さらなる医療的活性化合物の存在および治療している病状の重篤度によって変わるであろう。しかし、予防的および/または治療的使用のために投与すべき量は、体重1kg当たり約0.01mg〜約20mg、好ましくは体重1kg当たり約0.1mg〜約5mgであることが、現在のところ好ましい。好ましくは、予防的および/または治療的使用のための投与頻度は、およそ1週間に2回からおよそ3ヶ月毎に1回の範囲内であり、好ましくはおよそ2週間毎に1回からおよそ10週間毎に1回、より好ましくは4〜8週間毎に1回の範囲内である。本発明のIL−17A結合ポリペプチドおよび融合タンパク質は、非経口的、静脈内に便利かつ好ましく投与されるが、好ましくは肘正中静脈または他の末梢静脈、筋肉内または皮下に投与される。IL−17A結合ポリペプチドは、点眼剤としても局所的に送達され得る。患者の好ましい予防的および/または治療的処置としては、本発明のポリペプチドを月に1回から2〜3ヶ月毎に1回、またはより低頻度で投与することが挙げられる。
【0059】
結論として、本発明は治療方法にも関し、ここで上記の医薬組成物の薬理学的有効量が、それを必要とする患者に投与され、好ましくはIL−17Aおよび/またはTh17に関連する疾患または医学的状態を罹患する患者に、より好ましくは、上記で特定した疾患または医学的状態のうちの1つを罹患する患者に投与される。本書で使用される場合、「処置」という用語は、疾患または医学的状態の予防的および/または治療的処置に関する。
【0060】
本発明のIL−17A結合ポリペプチドおよび融合タンパク質は、活性成分単独で投与してもよく、または、例えば補助剤として併用して、または他の薬剤と組み合わせて投与してもよく、他の薬剤としては、例えば上記の疾患の治療または予防のための、例えば免疫抑制剤または免疫調整剤、または他の抗炎症剤が挙げられる。例えば、本発明のIL−17A結合ポリペプチドおよび融合タンパク質は、免疫抑制性モノクローナル抗体と組み合わせて使用してもよく、例えば、白血球受容体に親和性を有するモノクローナル抗体、例えばMHC、CD2、CD3、CD4、CD7、CD8、CD25、CD28、CD40、CD45、CD58、CD80、CD86または他のリガンド;他の免疫調整化合物、例えばCTLA4またはその変異体の細胞外ドメインの少なくとも一部を有する組み換え結合分子、例えば非CTLA4タンパク質配列に結合する、CTLA4またはその変異体の少なくとも細胞外部分、例えばCTLA4Ig(例えばATCC 68629)またはその変異体、例えばLEA29Y;接着分子阻害剤、例えばLFA−I拮抗剤、ICAM−Iまたは−3拮抗剤、VCAM−4拮抗剤またはVLA−4拮抗剤と組み合わせて使用してもよい。加えて、本発明のポリペプチドおよび融合タンパク質は、DMARD、例えば金塩、スルファサァラジン、抗マラリア薬、メトトレキサート、D−ペニシラミン、アザチオプリン、ミコフェノール酸、シクロスポリンA、タクロリムス、シロリムス、ミノサイクリン、レフルノミド、グルココルチコイド;カルシニューリン阻害剤、例えばシクロスポリンAまたはFK 506;リンパ球再循環のモジュレーター、例えばFTY720およびFTY720アナログ;mTOR阻害剤、例えばラパマイシン、40−O−(2−ヒドロキシエチル)−ラパマイシン、CCI779、ABT578、AP23573またはTAFA−93;免疫抑制性を有するアスコマイシン、例えばABT−281、ASM981等;コルチコステロイド;シクロホスファミド;アザチオプレン(azathioprene);メトトレキサート;レフルノミド;ミゾリビン;ミコフェノール酸;ミコフェノール酸モフェチル;15−デオキシスペルグアリンまたは免疫抑制性ホモログ、そのアナログまたは誘導体;または化学療法剤、例えばパクリタキセル、ゲムシタビン、シスプラチナム、ドキソルビシンまたは5−フルオロウラシル;抗TNF剤、例えばTNFに対するモノクローナル抗体、例えばインフリキシマブ、アダリムマブ、CDP870、またはTNF−RIまたはTNF−RIIに対する受容体構築物、例えばエタネルセプト、PEG−TNF−RI;炎症性サイトカイン阻害剤、IL−1阻害剤、例えばアナキンラまたはIL−1トラップ、AAL160、ACZ 885、IL−6阻害剤;プロテアーゼの阻害剤または活性化剤、例えばメタロプロテアーゼ、抗IL−15抗体、抗IL−6抗体、抗IL−23抗体、抗IL−22抗体、抗IL−21抗体、抗IL−12抗体、抗IFNγ抗体、抗IFNα抗体、抗CD20抗体、アスピリン等のNSAIDまたは抗感染症薬と組み合わせて使用してもよい。当然のことながら、この併用薬のリストは限定的ではなく、完全でもない。
【0061】
以下の実施例において、例示により、本発明をさらに記載するが、いずれも添付の特許請求の範囲に概説した通りの本発明の範囲を制限するものと解釈すべきではない。
【図面の簡単な説明】
【0062】
【図1】図1は、本発明のIL−17結合ポリペプチドの具体例のSDS PAGE分析を示す:(a)B1_2(配列番号39)のSDS PAGE(レーン1)、E4(配列番号57)(レーン2)、2C1(配列番号107)(レーン3)、E4−Fc(配列番号117)(レーン4:非還元的条件、レーン5:還元的条件)、2C1−Fc(配列番号118)(レーン6:非還元的条件、レーン7:還元的条件);(b)[(2C1)2−Fc](配列番号119)のSDS PAGE(レーン1:非還元的条件、レーン2:還元的条件)。(2C1)2−Fcの分子量は、リファレンス分子量全帯域マーカー(示さず)より推定される。
【図2】図2は、本発明のIL−17A結合ポリペプチドのサイズ排除クロマトグラム(SEC)を示す:(a)クローンB1_2(配列番号39)、(b)E4(配列番号57)、(c)2C1(配列番号107)、(d)E4−Fc(配列番号117)、(e)SECピーク精製E4−Fc、精製およびPBS中4℃で40日間保存した後分析、(f)2C1−Fc(配列番号118)、(g)(2C1)2−Fc(配列番号119)。
【図3】図3は、本発明のIL−17A結合ポリペプチドのビアコア(BIAcore)センサーグラムを図示する:(a)クローンB1_2(配列番号39)、(b)E4(配列番号57)、(c)2C1(配列番号107)、(d)E4−Fc(配列番号117)、(e)2C1−Fc(配列番号118)、(f)(2C1)2−Fc(配列番号119)。
【図4】図4は、IL−17A阻害細胞分析の結果を図示する:(a)NHDF細胞をIL−17Aと共にインキュベーションした後の、IL−6の容量依存性誘導。(b)Fyn SH3由来IL−17バインダーおよびIL−17A受容体−Fcキメラによる、NHDF細胞におけるIL−17A誘導IL−6産生の容量依存性阻害。(c)b)と同様であるが、IL−17A結合親和性を有しない対照タンパク質として、Fyn SH3 wtタンパク質を使用した。(d)XTT分析:生存細胞は、テトラゾリウム塩XTTを着色産物に代謝することができる。我々の実験において、全ての細胞は、IL−17A、IL−17AおよびFyn SH3バインダー、またはIL−17AおよびIL−17R−Fcキメラと共に24時間インキュベーションした後、生存していた。
【図5】図5は、G3と規定した本発明のIL−17A結合ポリペプチド(配列番号34)の、精製1日後(PBS中、4℃で保存)のサイズ排除クロマトグラフィーを図示する。クロマトグラフィーはスーパーデックス75(GE ヘルスケア(Healthcare))カラムを使用して実施した。
【図6】図6は、4℃(a)または−20℃(b)で6ヶ月を超えて保存した、G3と規定した本発明のIL−17A結合ポリペプチド(配列番号34)の、サイズ排除クロマトグラフィーを図示する。
【図7】図7は、マウスにおける、E4−Fcと規定した本発明のIL−17A結合ポリペプチド(配列番号117)の薬物動態データを示す:(a)血清中のE4−Fc濃度を、静注後の時間に対してプロットする、(b)(a)と同様であるが、反対数表示でプロットする。最後の4点を用いて終末相半減期を計算したところ、50.6時間であった。
【図8】図8は、2C1と規定した本発明のポリペプチド(配列番号107)の、結合特異性の表を示す。吸光度の結果は、種々の標的タンパク質:ヒトIL−17A、ヒトIL−17F、mlL−17A(マウスIL−17A)、TNFα(ヒト腫瘍壊死因子α)、BSA(ウシ血清アルブミン)、オボアルブミン(鶏卵白)、IL−6(ヒトインターロイキン6)を使用して実施されるELISAに関係する。
【図9】図9は、本発明のFyn SH3由来のポリペプチド2C1(配列番号107)の特異性を示す。ELISAにおいて、結合剤としての本発明のFyn SH3由来のポリペプチド2C1(配列番号107)と共に、種々のIL−17ファミリーメンバー、異なる種のIL−17Aおよび他の無関係な抗原を使用した。本発明のFyn SH3由来のポリペプチド2C1(配列番号107)のみがヒトおよびカニクイザルIL−17Aに結合する。他の抗原のいずれに対しても、結合を検出できなかった。図の右側(破線の右側)には、ヒトIL−17CのELISAシグナルが見られるが、これはヒトIL−17A対照を用いて、別の日に定量した。説明:hIL−17A:ヒトインターロイキン17A、hIL−17B:ヒトインターロイキン17B、hIL−17D: ヒトインターロイキン17D、hIL−17E:ヒトインターロイキン17E、hIL−17F: ヒトインターロイキン17F、マウスIL−17A:マウスインターロイキン17A、ラットIL−17A:ラットインターロイキン17A、イヌIL−17A:イヌインターロイキン17A、cyno Il−17A:カニクイザルインターロイキン17A、EDB:フィブロネクチンの追加ドメインB、hIL−6:ヒトインターロイキン 6、hTNFα:ヒト腫瘍壊死因子α、オボアルブミン:鶏卵黄由来のアルブミン、BSA:ウシ血清アルブミン、neg ctrl:コーティングに抗原を使用せず、hIL−17C:ヒトインターロイキン17C。
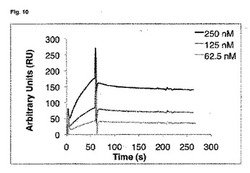
【図10】図10は、封入体からリフォールディングされたカニクイザルIL−17Aでコートしたチップ上での、本発明のFyn SH3由来のポリペプチド2C1(配列番号107)のビアコア(Biacore)センサーグラムを図示する。
【図11】図11は、Fc融合タンパク質のSDS PAGE分析を示す。レーン1:全帯域レインボーマーカー(GEヘルスケア(Healthcare))、レーン2:2C1−Fc(配列番号130)、レーン3:全帯域レインボーマーカー(GEヘルスケア)、レーン4:2C1−m5−Fc(LALA)(配列番号133)、レーン5:2C1−m10−Fc(LALA)(配列番号134)、レーン6:2C1−m15−Fc(LALA)(配列番号135)、レーン7:2C1−m5E−Fc(LALA)(配列番号132)、レーン8:2C1−Fc(LALA)(配列番号131)。
【図12】図12は、PBS中4℃で保管した標準対照2C1−Fc(配列番号130)(×)と比較した、ヒト血清中37℃で5日間保管した後の、IL−17Aに結合する2C1−Fc(配列番号130)(■)のELISAを示す。
【図13】図13は、マウスに単回静注した後の、2C1−Fc(LALA)(配列番号131)の種々の時点での血清濃度を示す。哺乳類細胞において産生された2C1−Fc(LALA)融合タンパク質(配列番号131)を、マウス(n=5)に静脈注射(iv)した(動物当り40μg)。PKプロファイルの最後の4点を用いて、2C1−Fc融合タンパク質の終末相半減期を計算したところ、53時間であった。
【図14】図14は、急性炎症モデルにおける、本発明の抗IL−17 Fyn SH3由来ポリペプチド2C1(配列番号107)による、ヒトIL−17A誘導KC産生の阻害を示す。3μgのヒトIL−17A(IL−17)、PBS(PBS)、3μgのヒトIL−17Aと17μgの本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)(IL−17+2C1)、3μgのヒトIL−17Aと16μgの野生型Fyn SH3モノマー(IL−17+wt)、17μgの本発明の単量体Fyn SH3由来のポリペプチド2C1(配列番号107)単独(2C1)、または16μgの野生型Fyn SH3単量体単独(wt)の皮下注射の2時間後に、血液サンプルを採取し、マウス血清中のKCレベルを定量した。各群4匹のマウスの平均KCレベルを示すが(±SD)、例外として野生型対照群(IL−17Aを含まない、または含む、Fyn SH3)では、3匹のマウスの平均レベルを示す(±SD)。
【図15】図15は、急性炎症モデルにおける、2C1−Fc融合タンパク質(配列番号130)による、ヒトIL−17A誘導KC産生の阻害を図示する。2C1−Fc/Il−17:44μgの2C1−Fc(配列番号130)を静注した後、3μgのヒトIL−17Aの皮下注射した。IL−17A投与から2時間後、マウスから血液サンプルを採取し、KC血清レベルをELISAで測定した。対照実験を以下の通り実施した:PBS/IL−17:PBSの静注の後、IL−17の皮下注射;2C1−Fc/PBS:2C1−Fc(配列番号130)の静注の後、PBSの皮下注射;PBS/PBS:PBSの静注の後、PBSの皮下注射;各群3〜5匹のマウスの平均KCレベルを示す(±SD)。
【実施例】
【0063】
実施例1:モノクローナルファージELISAで定量された通り、本発明のFyn SH−3由来ポリペプチドはIL−17Aに結合する。
方法
配列番号1〜116で示されるアミノ酸配列をコードするDNAを、グラブロフスキ(Grabulovski)らにおけるFYN SH3ライブラリについて記載された通り(グラブロフスキら、(2007年)JBC,282,3196−3204頁)ファージミドベクターpHEN1にクローニングした。ファージ産生は、標準的プロトコル(ヴィティ(Viti),Fら(2000年)Methods Enzymol.326,480−505頁)に従って実施した。ファージを含有するモノクローナル細菌上澄をELISAに使用した:ビオチン化IL−17A(R&Dシステムズ(Systems)より購入、ビオチン化は、NHS−PEO4−ビオチン(ピアス(Pierce))を用い、メーカーの使用説明書に従って実施した)を、ストレプトアビジンでコートしたウェル(ストレプタウェルズ(StreptaWells)、ハイバインド(High Bind)、ロシュ(Roche))上に固定化し、PBS、2%ミルク(ラピライト(Rapilait)、ミグロス(Migros)、スイス)でブロッキングした後、20μlのPBS、10%ミルクおよび80μlのファージ上澄を適用した。1時間インキュベーションし、洗浄した後、結合したファージを抗M13−HRP抗体複合体(GEヘルスケア(Healthcare))で検出した。ペルオキシダーゼ活性の検出は、BMブルーPOD基質(ロシュ)を加えることによって行い、1M H2SO4を加えて反応を停止した。バインダーのDNA配列は、DNAシークエンシングによって検証した(ビッグダイ・ターミネーター(BigDye Terminator) v3.1 サイクル・シークエンシング・キット、ABI PRISM 3130遺伝子分析器、アプライドバイオシステムズ(Applied Biosystems))。
【0064】
結果
Fny SH3−由来IL−17Aバインダーのアミノ酸配列は、配列表中に付記した通りの、配列番号1〜116で示される。
【0065】
実施例2:本発明のFyn SH3由来のポリペプチドは、組み換えヒトIL−17Aに高親和性で結合する。
この実施例は、種々の形態のFyn SH3由来IL−17A結合ポリペプチドのクローニングおよび発現、および、これらのポリペプチドのサイズ排除クロマトグラフィーおよび表面プラスモン共鳴による特性評価を示す。
【0066】
a)Fyn SH3由来IL−17A結合ポリペプチドのクローニングおよび発現
選択したFyn SH3由来IL−17A結合ポリペプチド(クローンB1_2:配列番号39、クローンE4:配列番号57およびクローン2C1:配列番号107)を、グラブロフスキ(Grabulovski)ら(グラブロフスキら(2007年)JBC,282,3196−3204頁)に記載の通り、細胞質発現ベクターにクローニングし、発現および精製した。
【0067】
b)ヒトIgG1抗体のFc部分に融合した、Fyn SH3由来IL−17A結合ポリペプチドのクローニングおよび発現
クローンE4および2C1(配列番号57および107)をクローニングし、ヒトIgG1抗体のFc部分との融合タンパク質として発現させた(手順は、以下参照;配列番号117および118)。さらに、10個のアミノ酸リンカーを有する2C1二量体[(2C1)2−Fc]をクローニングし、Fc融合タンパク質として発現させた(配列番号119)。
【0068】
ヒトIgG1のFc部分を、プライマーfm5(5’ATCGGGATCCGACAAAACTCACACATGCC 3’、配列番号121)およびfm6(5’TACGAAGCTTTCATTTACCCGGAGACAGGG 3’、配列番号122)を用い、および、テンプレートとして市販のpFUSE−hlgG1−Fc2(インビボジェン(Invivogen))真核性ベクターを用いて
PCR増幅した。得られたPCR産物をBamHI/HindIIIで消化し、以前に同じ酵素で消化したpASK−IBA2ベクター(IBA−バイオタグノロジー(Biotagnology))と連結し、新たなベクターpAFを得た。
【0069】
クローンE4および2C1(配列番号57および107)の遺伝子情報を、fm7(5’ATATCACCATGGGGCCGGAGTGACACTCTTTGTGGCCCTTTATG 3’、配列番号123)およびfm8(5’CGTAGGATCCCTGGATAGAGTCAACTGGAGC 3’、配列番号124)を用いてPCR増幅した。Fcに融合した2C1二量体の調製には、2C1 DNAテンプレートを2つの独立したPCRに使用した。第一の反応では、プライマー47b.fo(5’AGA GCC ACC TCC GCC TGA ACC GCC TCC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号125)および52.ba(5’GAC TAA CGA GAT CGC GGA TCC GGA GTG ACA CTC TTT GTG GCC CTT TAT 3’、配列番号126)を使用し、第二のPCRでは、プライマー48b.ba(5’GGT GGA GGC GGT TCA GGC GGA GGT GGC TCT GGA GTG ACA CTC TTT GTG GCC CTT TAT 3’、配列番号127)および51.fo(5’ATC CCA AGC TTA GTG ATG GTG ATG GTG ATG CAG ATC CTC TTC TGA GAT GAG TTT TTG TTC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号128)を使用した。
【0070】
2つのDNA断片をPCRによって組み立て、2つのドメインの間に10個のアミノ酸のリンカー(GGGGSGGGGS、配列番号120)を有する2C1ホモ二量体を得た。得られたDNA断片を、プライマーfm7およびfm8を用いた2C1単量体について記載した通りに、さらに増幅した。次に、得られたPCR産物をNcol/BamHIで消化し、二重消化したペリプラズム発現ベクターpAFにクローニングした。プラスミドをE.coli TG1中に電気穿孔し、0.2μg/mlのアンヒドロテトラサイクリンでタンパク質発現を誘導した。細菌培養物を、ロータリーシェーカー中、25℃で一晩成長させ、フィノマー−Fc融合タンパク質を、単一プロテインA親和性クロマトグラフィー工程のペリプラズム分画から精製した。20μlのタンパク質溶液を用いて、SDS PAGE(インビトロジェン(Invitrogen))分析を実施した。
【0071】
c)サイズ排除クロマトグラフィー(SEC)
サイズ排除クロマトグラフィー(SEC)を、AEKTA FPLCシステムで、スーパーデックス75カラム(10/300)またはスーパーデックス75ショートカラム(5/150)(GEヘルスケア(Healthcare))を用いて実施した。
【0072】
d)親和性測定
親和性測定は、バイアコア(BIAcore)3000装置(バイアコア)を用いて実施した。ビオチン化IL−17Aと単量体Fyn SH3由来IL−17A結合ポリペプチドとの間の相互作用分析、およびビオチン化IL−17AおよびE4−Fc(配列番号117)との間の相互作用分析には、ストレプトアビジンSAチップ(バイアコア(Biacore))を、それぞれ固定化した1300および510 RUビオチン化IL−17Aと共に使用した。ランニングバッファーは、PBS、0.1%NaN3および界面活性剤P20(バイアコア)であった。相互作用は、流速20ml/分で、種々の濃度のFyn SH3由来IL−17A結合ポリペプチドを注入して測定した。IL−17Aと2C1−Fc融合体との間、およびIL−17Aと(2C1)2−Fc融合体との間の相互作用分析のため、CM5チップ(バイアコア)を、2900 RUのヤギ抗ヒトIgG Fc特異的抗体(ジャクソン・イムノリサーチ(Jackson Immunoresearch))でコートした。ランニングバッファーは、HBS−EP(バイアコア)であった。相互作用は、約250〜275 RUのFc融合タンパク質を流速10μl/分で注入し、その後、種々の濃度のIL−17A(R&Dシステムズ(R&D Systems))を流速30μl/分で注入することによって測定した。相互作用の速度論的データ(個別のkon/koff)は全て、BIAエバリュエーション3.2RC1ソフトウェアを用いて評価した。
【0073】
e)結果
本発明の単量体Fyn SH3由来IL−17A結合ポリペプチドの発現収率は、振とうフラスコ中、非最適化条件下で、細菌培養物1リットル中60〜85mgであった。Fc融合タンパク質は、収率0.2〜0.4mg/l(表I)で発現した。Fc融合タンパク質の配列は、付記の通りの配列番号117〜119に列記する。
【0074】
【表1】

【0075】
図1は、表示された精製タンパク質のSDS PAGE分析を示す。
【0076】
サイズ排除クロマトグラフィー(SEC)プロファイルにより、全ての構築物が主として単一の単量体ピークとして溶出したことが実証された(図2参照)。Fyn SH3由来結合タンパク質についてのこれまでの研究で既に観察された通り(グラブロフスキ(Grabulovski)ら(2007年)JBC,282,3196−3204頁)、主要なピークは、約8kDaのタンパク質について予想されるものより遅く溶出した。本発明のFc融合タンパク質については、サイズ排除クロマトグラフィーによる第二の精製工程を、単回工程のタンパク質A−セファロース精製の後に実施して、図2e中、融合タンパク質E4−Fc(配列番号117)に示される通りの単量体タンパク質を得た。E4−Fc(配列番号117)はPBS中4℃で保存した場合、少なくとも40日間は安定であった。
【0077】
結合特性は、バイアコア(BIAcore)チップ上でのリアルタイム相互作用分析によって分析し(図3)、選択されたIL−17A結合ポリペプチドおよび融合タンパク質について、以下の解離定数(KD)が明らかになった:
【0078】
【表2】

【0079】
実施例3:IL−17A阻害細胞分析
IL−17Aは、線維芽細胞においてIL−6の産生を投与量依存的に誘導する(ヤオ(Yao)ら(1995年)Immunity,3,811−821頁)。表示したFyn SH3−誘導IL−17A結合ポリペプチドおよび融合タンパク質の阻害活性は、ヒト皮膚線維芽細胞を、種々の濃度のFyn SH3変異体またはヒトIL−17A受容体Fcキメラの非存在または存在下、組み換えIL−17Aで刺激することによって試験した。刺激の24時間後に、細胞培養上澄を採取し、ELISAでIL−6について分析した。加えて、細胞が、IL−17A単独、またはIL−17Aおよび本発明のFyn SH3由来阻害IL−17A結合ポリペプチド、またはIL−17AおよびIL−17R−Fcキメラと共に24時間インキュベーションした後に、生存していたことを実証するために、XTT試薬を用いて比色試験を実施した。生存し、代謝的に活性な細胞のみが、テトラゾリウム塩XTTを、橙色化合物であるホルマザンに還元する能力がある(スクディエロ(Scudiero)ら(1988年),Cancer Res.48,4827−4833頁)。
【0080】
方法
エンドトキシンを除去するため、表示したタンパク質溶液を、アクロディスク・ムスタング(Acrodisc Mustang)Eメンブレン(VWR)で3回濾過した。濾過の後、本発明の阻害性Fyn SH3由来IL−17A結合ポリペプチドを含有するタンパク質溶液のエンドトキシンレベルは、カブトガニ血球抽出物(LAL)試験(パイロジェント(PYROGENT)単一検査ゲル凝集LAL分析(ロンザ(Lonza)))によって定量したところ、0.1EU/ml未満であった。
【0081】
約1x104個の正常ヒト皮膚線維芽細胞(プロモセル(PromoCell),NHDF−c, C12300)を含有する400μlの細胞懸濁液を各ウェルに分配し(24穴プレート、NuncまたはTPP)、37℃で24時間培養した(培地:線維芽細胞成長培地C−23010、プロモセル)。上澄を吸引し、種々の濃度の本発明のFyn SH3由来IL−17A結合ポリペプチドまたはIL−17A受容体Fcキメラ(RnDシステムズ(Systems))を、IL−17A(RnDシステムズ)含有培地(最終濃度50ng/ml)と混合した後、350μlの対応する溶液を各ウェルに添加した(阻害剤溶液とIL−17A含有培地の混合比は1:3であった)。陽性対照として、PBSをIL−17A含有培地(「阻害剤なし」)と1:3の割合で混合し、陰性対照として、PBSを培地のみ(「IL−17Aなし」)と1:3の割合で混合した。IL−17A依存性IL−6産生を定量するため、IL−17A含有培地を使用し(IL−17Aの最終濃度:10、25および50ng/ml)、PBSと3:1の比で混合した。37℃で24時間インキュベーションした後、上澄を吸引し、IL−6濃度をELISAによりメーカーの使用説明書に従って定量した(IL−6 ELISAキット、R&Dシステムズ(Systems))。上澄の吸引の直後に、XTT含有培地を添加し(細胞増殖(Cell Proliferation)キットII、ロシュ(Roche))、メーカーの使用説明書に従って、細胞生存性を定量した。
【0082】
IL−17A阻害率は、以下の式を用いて定量した:
【0083】
【化1】

【0084】
結果
正常ヒト皮膚線維芽細胞(NHDF)をIL−17Aと種々の濃度でインキュベーションした。図4(a)は、IL−6のIL−17A用量依存性誘導を示す。次の工程において、NHDF細胞を、IL−17A(50ng/ml)および種々の濃度の表示した本発明のFyn SH3誘導IL−17A結合ポリペプチドまたはIL−17A受容体−Fcキメラと共にインキュベーションした(図4(b))。クローン2C1(配列番号107)およびE4(配列番号57)の両者がIL−17A誘導IL−6産生を阻害し、IC50値はそれぞれ約1nMおよび6nMであったことが観察された。IL−17A受容体−Fcキメラは、IC50値が500pMであることが報告されている(R&Dシステムズ(Systems))。この実験では、約1nMの値が得られた。この分析は、3つの独立した実験の代表的な結果を表す。IL−6産生の阻害が特異的なIL−17A中和の結果であることをさらに実証するために、細胞を、IL−17Aの存在下で結合特異性に無関係のタンパク質としてFyn SH3wtドメイン(グラブロフスキ(Grabulovski)ら(2007年)JBC,282,3196−3204頁)と共にインキュベーションした(図4(c))。予想した通り、IL−6産生の阻害は観察されず、一方、クローン2C1(配列番号107)はIL−17A−誘導IL−6産生を阻害する能力があった。図4(d)にXTT分析を示すが、これは、全ての細胞が、本発明のFyn SH3−由来IL−17A結合ポリペプチド(濃度750nM)およびIL−17受容体(10nM)と共に24時間インキュベーションした後、生存能力があったことを確認する。
【0085】
実施例4:安定性
治療的適応を目的とする全ての生体化合物の極めて重要な様相は、溶液中に保管した場合の、その安定性および凝集耐性である。本発明のFyn SH3由来IL−17A結合ポリペプチドは、単純なリン酸緩衝生理食塩水中、4℃または−20℃で少なくとも6ヶ月間保管した際に安定であることが判っていることから、特に有用な薬剤および診断薬候補である。
【0086】
方法
本発明のIL−17A結合ポリペプチドのタンパク質溶液を、精製後、4℃または−20℃で6ヶ月間保管した。タンパク質の安定性および凝集状態を分析するため、タンパク質溶液を濾過し(ミレックス(Millex)GP、0.22μm、ミリポア(Millipore))、サイズ排除クロマトグラフィー(SEC)を、AEKTA FPLCシステムでスーパーデックス75ショートカラム(5/150)(GEヘルスケア(Healthcare))を用いて実施した。
【0087】
結果
Fyn SH3由来IL−17A結合ポリペプチドG3(配列番号34)が発現収率123mg/Lで産生され、サイズ排除クロマトグラフィーカラムから主に単一のピークとして溶出された(図5参照)。
【0088】
G3(配列番号34)の安定性および凝集抵抗を、タンパク質をPBS中、4℃または−20℃で保管して評価した。6ヵ月後、タンパク質の状態を、サイズ排除クロマトグラフィーによって調べた。測定により、凝集または分解の兆候は全く見られなかった。6ヶ月間の貯蔵後の溶出プロファイルを図6に示す。
【0089】
実施例5:インビボ半減期
本発明の融合タンパク質E4−Fc(配列番号117)のインビボ半減期を、ELISAにより、単回静注後の種々の時点でマウス血清中のE4−Fc(配列番号117)濃度を測定することによって定量した。
【0090】
方法
E4−Fc(配列番号117)のクローニングおよび発現を実施例2に記載する。E4−Fc(配列番号117)の3.3μM(0.22mg/ml)溶液200μlを5匹のマウス(C57BL/6、チャールス・リバー(Charles River))に静注射した。7分後、20分後、1、2、4、8、24および48時間後に、約20μlの血液を伏在静脈からキャピラリーであるマイクロベッテ(Microvette)CB300(サーステッド(Sarstedt))で採取した。血液サンプルを9500xgで10分間遠心分離し、ELISAを実施するまで、血清を−20℃で保管した。濃度が分っているE4−Fc(配列番号117)の希釈系列を用いて、血清中のE4−Fc(配列番号117)濃度をELISAによって定量した:50μlのビオチン化IL−17A(30nM)(R&Dシステムズ(Systems)、メーカーの使用説明書に従って、NHS−PEO4−ビオチン(ピアス(Pierce))を用いてビオチン化)を、ストレプトアビミンでコートしたウェル(リアクチバインド(Reactibind)、ピアス)に添加し、PBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros)、スイス)でブロッキングした後、45μlのPBS、4%ミルクおよび5μlの血清サンプルを添加した。1時間インキュベーションし、洗浄した後、結合したFc融合タンパク質をプロテインA−HRP複合体(シグマ(Sigma))で検出した。ペルオキシダーゼ活性は、クアンタレッドを強化した化学蛍光HRP基質(ピアス)を添加することによって検出した。蛍光強度は、544nm(励起)および590nm(発光)で5〜10分後に測定した。種々の時点で血清中(各時点n≧3、最終時点:n=1を除く)定量したE4−Fc(配列番号117)濃度および得られた排出相の傾きk(片対数目盛りにプロット)から、E4−Fc(配列番号117)の半減期を、式t1/2=ln2/−kを用いて計算した。
【0091】
結果
排出相(β相、最後の4回の測定時点)から計算した、本発明の融合タンパク質E4−Fc(配列番号117)の半減期は、50.6時間であった(図7参照)。
【0092】
実施例6:IL−17A結合ポリペプチドおよび融合タンパク質の結合特異性を定量するためのELISA
方法
標的タンパク質である、ヒトIL−17F(R&Dシステムズ(Systems))、マウスIL−17A(R&Dシステムズ)、ヒトTNFα(サーモ・サイエンティフィック(Thermo Scientific))、ヒトIL−6(R&Dシステムズ)、ウシ血清アルブミン(シグマ(Sigma))およびオボアルブミン(シグマ)を、マキシソープ(MaxiSorp)プレート(ヌンク(Nunc))に一晩コートした(濃度5μg/mlの各標的を100μl)。ウェルをPBSで3回洗浄し、200μlのPBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros))でブロッキングし、PBSでの洗浄工程(上記の通り)の後、50μlの2C1(配列番号107)を最終濃度50nMで、50μlの抗myc抗体(9E10、自家製造、OD=2の貯蔵溶液をPBS、2%ミルクで1:250に希釈)と共にウェルに添加した。インキュベーションした後、ウェルをPBSで3回洗浄し、PBS、2%ミルクで1:1000に希釈した、100μlの抗マウスHRP免疫抱合体(シグマ)をウェルに添加した。96穴プレートを室温で1時間インキュベーションした後、PBS、0.1%Tweenで3回洗浄し、その後、PBSのみで3回洗浄した。100μlのBMブルーPOD基質(ロシュ)を加えて比色検出を行い、60μlの1M H2SO4で反応を停止した。
【0093】
結果
クローン2C1(配列番号107)は高特異性でヒトIL−17Aに結合し、ELISAで示した通り、他の被験タンパク質のいずれとも交差反応しなかった(図8)。IL−17Fについてバックグラウンド上に小さなシグナルが観察されたが、2C1がIL−17Fをコートしたバイアコア(BIAcore)チップにプローブ結合した場合、検出可能な結合は測定されなかった(データは示さず)。
【0094】
実施例7:本発明のFyn SH3由来ポリペプチドは、ヒトおよびカニクリザルIL−17Aに特異的および高親和性で結合する
方法
a)特異性
本発明のIL−17A結合ポリペプチドの結合特異性を定量するため、以下の標的タンパク質を使用した(実施例6より多い標的タンパク質)。
- ヒトIL−17A(R&Dシステムズ(Systems))
- ヒトIL−17B(ペプロテック(Peprotech))
- ヒトIL−17C(R&Dシステムズ)
- ヒトIL−17D(ペプロテック)
- ヒトIL−17E(ペプロテック)
- ヒトIL−17F(アブド・セロテック(Abd Serotec))
- マウスIL−17A(R&Dシステムズ)
- ラットIL−17A(アクロン・バイオテック(Akron Biotech))
- イヌIL−17A(R&Dシステムズ)
- カニクイザル(macaca fascicularis)IL−17A(E.Coliにおいて自家製造、単一ペプチドなし、C−末端グリシン残基の後、ヘキサヒスチジンタグを用いる、抱合体からリフォールディング、配列番号129)
- フィブロネクチンのエクストラドメインB(自家製造、E.coli;カルネモッラ(Carnemolla)ら(1996年)Int J Cancer,68(3),397−405頁参照)
- ヒトIL−6(R&Dシステムズ)
- ヒトTNFα(サーモ・サイエンティフィック(Thermo Scientific))
- オボアルブミン(シグマ(Sigma))
- BSA(シグマ)
【0095】
標的タンパク質を、マキシソープ(MaxiSorp)(ヌンク(Nunc))上に一晩コートした(濃度10μg/mlの各標的100μl)。ウェルをPBSで3回洗浄し、200μlのPBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros))で室温で1時間ブロッキングし、その後PBSでの洗浄工程(上記の通り)の後、50μlの本発明のFyn SH3由来ポリペプチド2C1(配列番号107)を最終濃度80nMで、50μlの抗myc抗体9E10(自家製造、OD=2の貯蔵溶液をPBS、2%ミルクで1:250に希釈)と共にセルに添加した。インキュベーションした後、ウェルをPBSで3回洗浄し、PBS、2%ミルクで1:1000に希釈した、100μlの抗マウスHRP免疫抱合体(シグマ(Sigma))をウェルに添加した。96穴プレートを室温で1時間インキュベーションした後、0.1%TweenのPBSで3回洗浄し、その後、PBSのみで3回洗浄した。100μlのBMブルーPOD基質(ロシュ(Roche))を加えることによって比色検出を行い、60μlの1M H2SO4で反応を停止した。
【0096】
b)カニクイザルIL−17Aに対する親和性の測定
親和性測定は、バイアコア(BIAcore)3000装置(バイアコア)を用いて実施した。カニクイザルIL−17Aと本発明のFyn SH3由来ポリペプチド2C1(配列番号107)との間の相互作用分析のため、CM5チップ(バイアコア)を6900 RUのカニクイザルIL−17Aでコートした。ランニングバッファーはHBS−EP(バイアコア)であった。相互作用は、流速20μl/分で種々の濃度の本発明のFyn SH3由来IL−17A結合ポリペプチド2C1(配列番号107)を注入することによって測定した。相互作用の速度論的データ(個別のkon/koff)は全て、BIAエバリュエーション3.2RC1ソフトウェアを用いて評価した。
【0097】
結果
本発明のFyn SH3由来ポリペプチド2C1(配列番号107)は、ヒトおよびカニクイザルIL−17Aに高特異性で結合し、ELISAで示した通り、他の被験タンパク質のいずれとも交差反応しなかった(図9)。
【0098】
本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)のカニクイザルIL−17Aに対する親和性をE.coli(抱合体からリフォールディング)で産生されたカニクイザルIL−17Aを用いて、バイアコア(Biacore)で測定した。2C1は、KD 11 nMでカニクイザルIL−17Aに結合したことが分った(図10)。
【0099】
実施例8:哺乳類細胞における、ヒトIgG1抗体のFc部分および修飾Fc部分に融合した本発明のFyn SH3由来ポリペプチドの発現
本発明のFyn SH3由来ポリペプチド2C1(配列番号107)を、IgG1のFc部分(2C1−Fc、配列番号130)に遺伝子的に融合させ、HEK EBNA細胞で発現させた。本発明のFyn SH3由来ポリペプチド2C1(配列番号107)は、変異体L234A(アミノ酸234位のロイシンに代わりアラニン)およびL235Aを含む、ヒトIgG1の修飾Fc部分への遺伝的融合としてもクローニングし、HEK EBNA細胞で発現した(2C1−Fc(LALA)、配列番号131)。さらに、本発明のFyn SH3由来ポリペプチドとFc部分との間のリンカーの長さが異なる、2C1−Fc(LALA)融合タンパク質の以下の4つの変異体を産生した:
【0100】
・(配列番号132)“2C1−m5E−Fc(LALA)”;5個のアミノ酸によるヒンジ領域の伸長:EPKSSリンカー
・(配列番号133)“2C1−m5−Fc(LALA)”;5個のアミノ酸の伸長:GGGGSリンカー
・(配列番号134)“2C1−m10−Fc(LALA)”;10個のアミノ酸の伸長:(GGGGS)2リンカー
・(配列番号135)“2C1−m15E−Fc(LALA)”;15個のアミノ酸の伸長:(GGGGS)3リンカー
【0101】
方法
“2C1−Fc”のクローニング:ヒトIgG1抗体のFc部分に融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)、(配列番号130):クローン2C1(配列番号107)をコードする遺伝子をテンプレートとして用い、プライマーSB3(5’CGA ATT CGG GAG TGA CAC TCT TTG TGG CCC 3’、配列番号136)およびSB4(5’GAA GAT CTC TGG ATA GAG TCA ACT GGA GCC 3’、配列番号137)を用いて増幅して、制限部位EcoRIおよびBgIIIを導入した。得られたPCR産物を、EcoRIおよびBgIIIで消化し、先に二重消化したpFUSE−hlgG1−Fc2ベクター(インビボジェン(Invivogen))中にクローニングした。このFc融合体をpCEP4ベクター(インビトロジェン(Invitrogen))中にクローニングするため、2C1−Fc融合体をコードする遺伝子を含有する、得られたpFUSEベクターをテンプレートとして用い、プライマーSB5(5’CCC AAG CTT GGG ATG GGC TAC AGG ATG CAA CTC CTG TC 3’、配列番号138)およびSB6(5’CGG GAT CCT CAT TTA CCC GGA GAC AGG GAG 3’、配列番号139)を用いて増幅して、HindIIIおよびBamHI制限部位を導入した。HindIII/BamHIで消化した後、挿入物を、先に二重消化したpCEP4ベクターに連結して、配列番号130の遺伝情報を含有するプラスミドを得た。
【0102】
“2C1−Fc(LALA)”のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)、(配列番号131を得る):
2C1−Fc(配列番号130)の遺伝情報を含有する上記のプラスミドを2つのPCR反応のテンプレートとして使用した。第一の反応では、プライマーSB5およびSB7(5’ACT GAC GGT CCC CCC GCG GCT TCA GGT GCT GGG CAC 3’、配列番号140)を使用した。第二のPCRでは、プライマーSB8(5’GCC GCG GGG GGA CCG TCA GTC TTC CTC TTC CC 3’、配列番号141)およびSB6を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0103】
“2C1−m5E−Fc(LALA)”(配列番号132)のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に5個のアミノ酸のリンカーEPKSSで融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)
2C1−Fc(LALA)(配列番号131)の遺伝情報を含有する上記のプラスミドを、2回のPCRにテンプレートとして使用した。第一の反応では、プライマーSB5および“Ba_2C1_R_EPKSS”(5’GCT GCT TTT CGG TTC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号142)を使用した。第二の反応では、プライマーSB6および“Ba_Hinge_F_EPKSS”(5’GAA CCG AAA AGC AGC GAC AAA ACT CAC ACA TGC CCA CCG 3’、配列番号143)を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0104】
“2C1−m5−Fc(LALA)”(配列番号133)のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に5個のアミノ酸のリンカーGGGGSで融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)
2C1−Fc(LALA)(配列番号131)の遺伝情報を含有する上記のプラスミドを、2回のPCRにテンプレートとして使用した。第一の反応では、プライマーSB5および47c.fo(5’TGA ACC GCC TCC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号144)を使用した。第二の反応では、プライマーSB6および“Ba_Hinge_F_5aaGS−リンカー”(5’GGT GGA GGC GGT TCA GAC AAA ACT CAC ACA TGC CCA CCG 3’、配列番号145)を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0105】
“2C1−m10−Fc(LALA)”(配列番号134)のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に10個のアミノ酸のリンカー(GGGGS)2で融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)
2C1−Fc(LALA)(配列番号131)の遺伝情報を含有する上記のプラスミドを、2回のPCRにテンプレートとして使用した。第一の反応では、プライマーSB5および47b.fo(5’AGA GCC ACC TCC GCC TGA ACC GCC TCC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号146)を使用した。第二の反応では、プライマーSB6および“Ba_Hinge_F_10aaGS−リンカー”(5’GGT GGA GGC GGT TCA GGC GGA GGT GGC TCT GAC AAA ACT CAC ACA TGC CCA CCG 3’、配列番号147)を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0106】
“2C1−m15−Fc(LALA)”(配列番号135)のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に15個のアミノ酸のリンカー(GGGGS)3で融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)
2C1−Fc(LALA)(配列番号131)の遺伝情報を含有する上記のプラスミドを、2回のPCRにテンプレートとして使用した。第一の反応では、プライマーSB5および47.fo.corr(5’TGA TCC GCC ACC GCC AGA GCC ACC TCC GCC TGA ACC GCC TCC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号148)を使用した。第二の反応では、プライマーSB6および“Ba_Hinge_F_15aaGS−リンカー”(5’GGT GGA GGC GGT TCA GGC GGA GGT GGC TCT GGC GGT GGC GGA TCA GAC AAA ACT CAC ACA TGC CCA CCG 3’、配列番号149)を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0107】
この融合タンパク質の発現には、対応するプラスミドを、エンドトキシンを含まないメガプレップ(Megaprep)キット(キアゲン(Qiagen))を用いて精製し、HEK EBNA細胞(ATCC No CRL−10852)の一過性のトランスフェクションに使用した。HEK EBNA細胞は、トランスフェクションの24時間前に30%のコンフルエンスで播種した。培地は、トランスフェクションの直前に、DMEM/5% FCS/ペンストレップ(penstrep)(インビトロジェン(Invitrogen))で置換した。60μgのDNAを使用して、150cm2の接着細胞をトランスフェクションした。DNAおよびPEI(25kDa、ポリサイエンシーズ(Polysciences))を1:3の割合で混合し、10秒間ボルテックスした。その後、DNA/PEI混合物を室温で10分間インキュベーションした後、HEK EBNA細胞に加えた。24時間後、培地をCD−CHO/HT/L−グルタミン/ペンストレップ(インビトロジェン)で置換し、5%CO2と共に37℃でインキュベーションした。96時間後に細胞培養物上澄を採取した。
【0108】
タンパク質精製のため、細胞培養物上澄を、プロテインA−セファロースアフィニティーカラムに適用した。その後、カラムをPBSで洗浄し、pH2.7の0.1Mグリシンを用いてタンパク質を溶出した。その後溶出されたタンパク質をPBS中に透析した。要すれば、エンドトキシンの除去のため、トリトン(Triton)−X114を用いた第二の精製工程を実施した(マガリャイス(Magalhaes)ら(2007年)J Pharm Pharmaceut Sci,10(3),388−404頁)。
【0109】
結果
本発明のFyn SH3由来Fc融合体を発現および精製することができた。図11は、Fc融合タンパク質のSDS PAGE分析を示す。
【0110】
実施例9:本発明のFyn SH3由来ポリペプチドは、ヒト血清中で安定である
タンパク質薬は、患者に薬力学的効果を与え得るため、一定期間、血清中で安定であるべきである。この実施例では、2C1−Fc(配列番号130)の血清安定性を試験する。
【0111】
方法
10μg/mlの2C1−Fc(配列番号130)を含有するヒト血清(シグマ(Sigma))の3mlの溶液を調製し、37℃のインキュベーター中に置いた。指示した時点で200μlのサンプルを除き、実験の終了まで−20℃に凍結させた。5日後、回収したサンプルでELISAを実施したが、対照標準としてPBS中4℃で保管した2C1−Fcサンプル(配列番号130)を使用した。
【0112】
ELISAを実施するため、IL−17A(R&Dシステムズ(Systems))をマキシソープ(MaxiSorp)プレート(ヌンク(Nunc))上に一晩コートした(5μg/mlを100μl)。ウェルをPBSで3回洗浄し、200μlのPBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros))でブロッキングし、PBSでの洗浄工程(上記の通り)の後、PBS、2%ミルクで希釈した2C1−Fc(配列番号130)(指示した濃度で)を含む、100μlの試験サンプルを加えた。インキュベーションした後、ウェルをPBSで3回洗浄し、PBS、2%ミルクで1:1000に希釈した、100μlのプロテインA−HRP(シグマ(Sigma))を添加した。96穴プレートを室温で1時間インキュベーションした後、PBS、0.1%Tweenで3回洗浄し、その後、PBSのみで3回洗浄した。100μlのBMブルーPOD基質(ロシュ(Roche))を加えて比色検出を行い、60μlの1M H2SO4で反応を停止した。
【0113】
結果
ヒト血清中、37℃で5日間の保管期間の後、2C1−Fc(配列番号130)は、PBS中4℃で保管した2C1−Fc(配列番号130)と同様に、実質的にその標的であるIL−17Aに結合することができたが、このことは、2C1−Fc(配列番号130)がヒト血清中37℃で安定であることを示唆する(図12)。
【0114】
実施例10:本発明のFyn SH3由来ポリペプチドはインビトロでIL−17Aを阻害する
この分析では、本発明の指示したFyn SH3由来ポリペプチドについて、インビトロでIL−17Aを阻害する能力を試験した。細胞分析は、本発明の実施例3に記載した細胞分析と同様であり、主な違いは、IL−17Aを1ng/mlの低濃度(実施例3の50ng/mlと比較して)でTNFαと共に用いることである。
【0115】
方法
試験した本発明のFyn−SH3由来IL−17A結合ポリペプチドのエンドトキシンレベルは、カブトガニ血球抽出物(LAL)試験(パイロジェント(PYROGENT)単一検査ゲル凝集LAL(ロンザ(Lonza)))によって測定したところ、0.1EU/ml未満であった。
【0116】
正常ヒト皮膚線維芽細胞(NHDF,プロモセル社(PromoCell Inc.),NHDF−c,C12300)をIL−17A阻害細胞分析に使用する。ヒトIL−17F(R&Dシステムズ(Systems))を、ヒト腫瘍壊死因子α(TNFα(サーモ・フィッシャー・サイエンティフィック(Thermo Fisher Scientific))と組み合わせて細胞培養培地に添加すると、用量依存性のNHDF細胞によるIL−6産生を引き起こす。細胞培養培地(プロモセル(PromoCell),C−23010)中に放出されるIL−6を、市販のELISAキット(R&Dシステムズ、デュオセット(DuoSet)ELISAシステムキット(DY206))を用いたELISAによって、細胞培養物上澄中で定量する。
【0117】
104個の正常ヒト皮膚線維芽細胞(プロモセル(PromoCell),NHDF−c,C12300)を各ウェルに分配し(24穴プレート、ヌンク(Nunc)またはTPP)、37℃で24時間培養した(培地:線維芽細胞成長培地C−23010、プロモセル)。上澄を吸引し、種々の濃度の本発明のFyn SH3由来IL−17A結合ポリペプチドまたはIL−17A受容体Fcキメラ(RnDシステムズ(Systems))を、IL−17A(RnDシステムズ)およびTNFα(サーモ・サイエンティフィック(Thermo Scientific))含有培地(最終IL−17A濃度1ng/mlおよび最終TNFα濃度50pg/ml)と混合した後、三重に、350μlの対応する溶液を各ウェルに添加した(阻害剤溶液とサイトカイン含有培地の混合比は1:23であった)。対照のウェルとしては、Fyn−SH3由来ポリペプチドを用いない(PBSのみ)インキュベーション、IL−17Aのみ、TNFαのみ、および培地のみのインキュベーションを用いた。37℃で24時間インキュベーションした後、上澄を吸引し、ELISA吸光度(IL−6濃度に相関)を、メーカーの使用説明書に従って定量した(IL−6 ELISAキット、R&Dシステムズ(Systems))。
【0118】
結果
NHDF細胞を、一定の濃度のIL−17A(1ng/ml)およびTNFα(50pg/ml)、並びに種々の濃度の市販のIL−17A受容体Fcキメラまたは種々の濃度の以下の本発明のFyn SH3由来ポリペプチドと共にインキュベーションした:
- 2C1(配列番号107)
- 2C1−Fc(配列番号130)
- 2C1−Fc(LALA)(配列番号131)
- 2C1−m5E(LALA)(配列番号132)
- 2C1−m5−Fc(LALA)(配列番号133)
- 2C1−m10−Fc(LALA)(配列番号134)
- 2C1−m15−Fc(LALA)(配列番号135)
【0119】
表IIIは、本発明の指示したFyn SH3由来ポリペプチドを用いて実施した、いくつかの細胞分析より得られたIC50値の平均を示す。最良のIC50値(0.11nM)は、2C1−m15−Fc(LALA)(配列番号135)を用いて得られた。
【0120】
【表3】

【0121】
実施例11:2C1−Fc(LALA)(配列番号131)のインビボ半減期
本発明の融合タンパク質2C1−Fc(LALA)(配列番号131)のインビボの半減期を、単回静注後の種々の時点でマウス血清中の2C1−Fc(LALA)(配列番号131)の濃度を測定することにより定量した。
【0122】
方法
2C1−Fc(LALA)(配列番号131)溶液(0.2mg/ml)を、5匹のマウス(C57BL/6、チャールス・リバー(Charles River))に、各マウス200μlを静注した。指示した時点で、約20μlの血液を伏在静脈からキャピラリーであるマイクロベッテ(Microvette)CB300(サーステッド(Sarstedt))で採取した。血液サンプルを9500xgで10分間遠心分離し、ELISA分析を実施するまで、血清を−20℃で保管した。濃度が分っている2C1−Fc(LALA)(配列番号131)希釈系列を用いて、2C1−Fc(LALA)(配列番号131)の血清中の濃度をELISAによって定量した:50μlのビオチン化IL−17A(30nM)(R&Dシステムズ(Systems)、メーカーの使用説明書に従って、NHS−PEO4−ビオチン(ピアス(Pierce))を用いてビオチン化)を、ストレプトアビミンでコートしたウェル(リアクチバインド(Reactibind)、ピアス)に添加し、PBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros)、スイス)でブロッキングした後、45μlのPBS、4%ミルクおよび5μlの血清サンプルを添加した。1時間インキュベーションし、洗浄した後、結合したFc融合タンパク質をプロテインA−HRP複合体(シグマ(Sigma))で検出した。ペルオキシダーゼ活性は、クアンタレッド(QuantaRed)を強化した化学蛍光HRP基質(ピアス)を添加することによって検出した。蛍光強度は、544nm(励起)および590nm(発光)で5〜10分後に測定した。種々の時点で血清中(各時点でマウス数n=5)定量した2C1−Fc(LALA)(配列番号131)の濃度および得られた排出相の傾きk(片対数目盛りにプロット)から、2C1−Fc(LALA)(配列番号131)の半減期を、式t1/2=ln2/−kを用いて計算した。
【0123】
結果
排出相(β相、最後から4回目の時点)から計算された、本発明の融合タンパク質2C1−Fc(LALA)(配列番号131)の半減期は、53時間であった(図13参照)。
【0124】
実施例12 本発明のFyn SH3由来ポリペプチドは、インビボでヒトIL−17Aを中和する
ヒトIL−17Aは、マウスIL−17受容体に結合および刺激することができ、マウスKC(CXCL1)ケモカインの上昇およびその後の分泌を導く(アラン(Allan)B.ら(2007年)WO2007/070750,米国イーライ・リリー(Eli Lilly))。KC基礎レベルがおよそ100pg/mlであることと比較して、皮下IL−17A注射(3μg)の2時間後に観察されたKCレベルは、血清中、500および1000pg/mlの間であった。
【0125】
方法
a)本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)を用いる、インビボでのIL−17Aの中和
本発明のFyn SH3由来ポリペプチド2C1(配列番号107)(17μg)を、3μgのヒトIL−17A(R&Dシステムズ(Systems))とC57BL/6マウスに混注(皮下)し、注射の2時間後に、血液サンプルを、伏在静脈からキャピラリーであるマイクロベッテ(Microvette)CB300(サーステッド(Sarstedt))で採取した。血液サンプルを9500xgで10分間遠心分離し、ELISA分析を実施するまで、血清を−20℃で保管した。血清中のKCレベルは、市販のクアンティカイン(Quantikine)マウスCLCL1/KCキット(R&Dシステムズ)を用いて定量した。対照群は、結合特異性に関与しないタンパク質としてIL−17AおよびFyn SH3wtドメインを注射したマウス(グラブロフスキ(Grabulovski)ら(2007年)JBC,282,3196−3204頁参照)、PBSのみ、IL−17Aのみ、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)のみを注射したマウス、またはFyn SH3wtタンパク質のみを投与したマウスであった。
【0126】
b)2C1−Fc融合体(配列番号130)を用いたインビボの中和:
本発明のFyn SH3由来ポリペプチド2C1−Fc(配列番号130)(44μg/マウス)を、C57BL/6マウスに静注した。20〜60分後、ヒトIL−17A(R&Dシステムズ(Systems))を3μg/マウス皮下注射し、IL−17A注射の2時間後に、血液サンプルを、伏在静脈からキャピラリーであるマイクロベッテ(Microvette)CB300(サーステッド(Sarstedt))で採取した。血液サンプルを9500xgで10分間遠心分離し、ELISA分析を実施するまで、血清を−20℃で保管した。血清中のKCレベルは、市販のクアンティカイン(Quantikine)マウスCLCL1/KCキット(R&Dシステムズ)を用いて定量した。対照群は、PBS(静注)およびIL−17A(皮下注)、PBSのみ(静注および皮下注)、および、本発明のFyn SH3由来ポリペプチド2C1−Fc(配列番号130)静注の後PBS(皮下注)したマウスであった。
【0127】
結果
ヒトIL−17Aをマウスに皮下注射した後、動物はKCと呼ばれるケモカインを過剰発現する。マウスの血清中、KCレベルの上昇はELISAによって測定し得る。本発明のFyn SH3由来ポリペプチドの注射により、KCのアップレギュレーションが阻止された。
【0128】
a)
IL−17Aおよび本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)をマウス(C57BL/6)に混注した。本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)の阻害特性のため、KCレベルはこの群において上昇せず、低いままであって、ほぼ基礎レベルと同等であった。KC産生の阻害が特異的IL−17A中和によることを実証するため、マウスにIL−17Aと野生型Fyn SH3ドメイン(IL−17Aに対する結合活性を有しない)を混注したが;これらのマウスでは、KCレベルはIL−17Aのみを投与した群と同程度の高さであった。図14は、この実験で得られた結果を示す。
【0129】
b)
この第二の急性炎症実験において、本発明のFyn SH3由来ポリペプチド2C1−Fc(配列番号130)を静注し、その後、IL−17Aを皮下注射した。上記a)の通り、本発明のFyn SH3由来ポリペプチドは、血清中のKCレベルのアップレギュレーションを阻止した。図15は、2C1−Fc(配列番号130)によるインビボでのIL−17Aの阻害を示す。
【技術分野】
【0001】
本発明は、新規なIL−17阻害ポリペプチド、対応する融合タンパク質、組成物およびそれらの医薬用途に関する。
【背景技術】
【0002】
CD4+ T細胞は、適応免疫系または自然免疫系の他の細胞を支援することによって、免疫応答の調整において中心的な役割を果たす。初期の研究では、CD4+ T細胞の2つのクラス(Th1およびTh2)が特定された。より最近では、CD4+ T細胞の新規サブセットであるTh17系が特定された。Th17細胞は、Th1またはTh2免疫が充分に及ばない、いくつかの菌類および微生物に加えて、細胞外の細菌に対する増強された宿主保護を担当する、適応免疫系の1部門として発生したと見られる。
【0003】
Th17細胞は、新規なサイトカインファミリーであるIL−17ファミリーの発見との関連で特定されたが、現在は、このファミリーは6種(IL−17A〜F)を含むことが知られている。IL−17(旧称CTLA−8)は主としてTh17細胞によって発現され、IL−17Aと規定されたが、これはこのサイトカインファミリーの創設種であることを示す。IL−17の構成種は、他の現在知られている哺乳類タンパク質と配列相同性を持たず、従って、独特なサイトカインファミリーを構成する。構造類似性からヘテロダイマーが存在する可能性が暗示されるが、IL−17Fの結晶構造から推定されるIL−17ファミリーの構成員の構造的特徴により、多数のサイトカインと同様に、それぞれのファミリーの構成員はおそらくホモダイマーとして産生されることが提示される。極最近、活性化ヒトCD4+ T細胞によって発現されたIL−17AおよびIL−17Fのヘテロダイマーが、IL−17RA/IL−17RC複合体を介してシグナルを送ることが特定された(ライト(Wright)J.F.ら(2008年)J.of Immunol.,181,2799−2805頁)。
【0004】
以前はTh1を介すると考えられていた、慢性炎症性疾患における中心的メディエーターおよびいくつかのタイプの自己免疫状態における主要な病原性エフェクターとして、Th17細胞が特定されたことにより、新たな治療アプローチが期待される(ウェーバー(Weaver)T.ら(2008年)Annu.Rev.Immunol.,25,821−852頁)。実際に、炎症促進サイトカインであるIL−17は主にTh17細胞によって発現され、関節リウマチ(RA)患者では滑液中のレベルが上昇しており、初期RA発症に関与することが示されている。加えて、IL−17は、TNF−αおよびIL−1の強力な誘導物質であるが、後者は骨侵食の主要原因であり、罹患患者にはひどい痛みをもたらす(ルバーツ(Lubberts)E.(2008年)Cytokine,41,84−91頁)。さらに、IL−17の不適切または過剰な産生は、種々の他の疾病および障害の病理と関係するが、例えば、これらの疾病および障害としては、変形性関節症、骨インプラントの弛緩、急性移植拒絶反応(アントニサミー(Antonysamy)ら、(1999年)J.Immunol,162,577−584頁;ヴァン・コーテン(van Kooten)ら(1998年)J.Am.Soc.Nephrol.,9,1526−1534頁)、敗血症、敗血性または内毒素性ショック、アレルギー、喘息(モレット(Molet)ら(2001年)J.AllergyClin.Immunol.,108,430−438頁)、骨量の減少、乾癬(テウニッセン(Teunissen)ら(1998年)J.Invest.Dermatol,111,645−649頁)、虚血、全身性硬化症(クラサワ(Kurasawa)ら(2000年)Arthritis Rheum.,43,2455−2463頁)、脳卒中、および他の炎症性疾患が挙げられる。
【0005】
結果として、抗IL−17化合物は、抗炎症薬としての可能性があり、多数のインビボ試験に沿った治療アプローチによって、IL−17の中和が、関節炎等の炎症過程を減ずることが示される。例えば、関節炎の初期段階の間、免疫方法の後に開始する、IL−17受容体IgG1−Fc融合タンパク質による内因性IL−17の早期中和により、実験的関節炎の発症が抑制される(ルバーツ(Lubberts)ら(2001年)J.Immunol.,167,1004−1013頁)。さらに、動物モデルにおいて、コラーゲン誘導関節炎の発症後、中和抗IL−17抗体による治療により、関節の炎症、軟骨破壊および骨侵食が減少した(ルバーツら(2004年)Arthritis and Rheumatism,50;650−659頁)。組織学的分析により、関節の炎症の抑制が確認され、抗IL−17抗体による治療後、全身性IL−6レベルが有意に減少した。対照的に、マウスIL−17を発現しているアデノウイルスベクターを用いた全身性および局所性IL−17の過剰発現により、コラーゲン誘導関節炎(CIA)の発症が加速され、その部位での滑膜炎が悪化した(ルバーツら(2001年)J.Immunol.,167,1004−1013頁およびルバーツら(2002年),Inflamm.Res.51,102−104頁)。
【0006】
抗体は、その製造し易さ、実質的にあらゆる所望の標的抗原に対して親和性および特異性が高いため、分析、精製、診断および治療目的に日常的に使用されるが、なおも多数の重大な欠点があり、例えば、複雑な哺乳類細胞の産生系が必要なこと、ジスルフィド結合の安定性への依存、ある抗体断片の凝集傾向、低溶解性、および最後に大切なことだが、抗体はヒト化した場合であっても望まない免疫反応を引き起こす可能性がある。結果として、最近、新規な分類の万能結合タンパク質を産生するための骨格として、小さな球状タンパク質の開発が注目されるようになった。多様性および標的特異性を与えるため、典型的には、好適な生物物理学的特性を有するタンパク質骨格の表面成分(例えば細胞外ループ)は組み合わせて変化させて、興味のある標的結合特異性をスクリーニングするタンパク質ライブラリーを製造する(ビンツ(Binz),H.K.,およびプルックスン(Pluckthun),A.(2005年)Curr.Opin.Biotechnol.16,459−469頁)。
【0007】
これらの非免疫グロブリン由来結合試薬は、集合的に規定された「骨格」である(スケッラ(Skerra)A.(2000年)J.Mol.Recognit.13,167−187頁)。50を超える異なるタンパク質骨格が、過去10〜15年にわたって提案され、この分野の最先端のアプローチは(ゲバウアー(Gebauer)MおよびスケッラA.(2009年)Curr Opinion in Chemical Biology 13:245−255頁に要約):アフィボディ(ブドウ球菌プロテインAのZドメインに基づく)、クニッツ型ドメイン、アドネクチン(ヒトフィブロネクチンの第10ドメインに基づく)、アンチカリン(リポカリン由来)、DARPin(アンキリン反復タンパク質由来)、アビマー(多量体化LDLR−Aに基づく)、アフィチン(affitin)(超高熱古細菌由来のSac7dに基づく)、およびヒトFyn SH3ドメインに由来するフィノマー(Fynomer)である。
【0008】
一般に、SH3ドメインは、細胞間情報伝達に関与する、多種多様のタンパク質中に存在する(ムサッキオ(Musacchio)ら(1994年)Prog.Biophys.Mol.Biol.61;283−297頁)。このドメインは、タンパク質中で一定の位置を占有せず、独立して発現および精製され得る。現在、約300のヒトSH3ドメインを有する1000を超えるドメインの存在が知られている(ムサッキオA.(2003年)Advances in Protein Chemistry.61;211−268頁)。SH3ドメインには広範な配列多様性があるが、全てのSH3ドメインは保存された折りたたみ構造:2つの逆平行βシートで形成されるコンパクトなβバレルを共有する(ムサッキオA.(2003年)Advances in Protein Chemistry.61;211−268頁)。代表的には、SH3ドメインは、PXXPコア結合モチーフを含有する高プロリン含有ペプチドに結合する(レン(Ren)ら(1993年)Science 259;1157−1161頁)が、非従来型のSH3結合部位の例も記載されている(カークカイネン(Kark−kainen)ら(2006年)EMBO Rep.7;186−191頁)。これまでに配列決定したSH3ドメインの多くは、およそ60〜65個のアミノ酸の全長を有するが、それらのいくつかは、二次構造の主要な保存エレメントに接続するループ中に挿入することにより、85個のアミノ酸の特徴を有するかもしれない(コヤマ(Koyama)ら(1993年)Cell 72(6);945−952頁)。種々のSH3ドメインのアライメントにより、適切な構造形成および標準的な高プロリン含有モチーフの認識に関与する、保存アミノ酸残基が明らかになった(ラーソン(Larson)ら(2000年)Protein Science 9;2170−2180頁)。
【0009】
最近、本発明者らは、Fyn SH3ドメインが、結合タンパク質産生に特に魅力的な骨格(「フィノマー(Fynomer)」)であることを実証したが、これは、このドメインが、(i)細菌中、溶解形態で多量発現され得ること、(ii)単量体であり、溶液中で保存した際に凝集しないこと、(iii)非常に安定であること(Tm 70.5℃)、(iii)システイン残基がないこと、および(iv)マウスからヒトへ完全に保存されたアミノ酸配列を特徴とするヒト由来のものであり、従って非免疫原性であることによる(グラブロフスキ(Grabulovski)ら(2007年)JBC,282,3196−3204頁)。
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、新規なIL−17A結合分子を提供することであり、特に、IL−17Aに対して特異性および親和性が高い新規なIL−17A結合分子を提供することである。さらなる目的は、好ましくはIL−17Aが介在する疾患および医学的症状の治療および/または予防用の医薬品における使用のための、研究、診断および医学的処置に好適な、IL−17A結合分子、好ましくは、IL−17阻害剤を提供することである。
【課題を解決するための手段】
【0011】
驚くべきことに、上記の目的は、以下よりなる群から選択されるアミノ酸配列を含むポリペプチドによって解決された:
(i)(G/E)VTLFVALYDY−(X)a−D−(X)b−SFHKGEKF−(X)c−I−(X)d−G−(X)e−WW−(X)f−A−(X)g−SLTTG−(X)hGYIPSNYVAPVDSIQ (I)
式中、a〜hは0〜20であり、
好ましくは、aは1〜10であり、より好ましくは2〜8であり、最も好ましくは6であり;
好ましくは、bは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、cは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、dは1〜10であり、より好ましくは3〜9であり、最も好ましくは5または7であり;
好ましくは、eは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、fは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、gは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、hは0〜6であり、より好ましくは1〜3であり、最も好ましくは1または2である;
(ii)(i)に対して、少なくとも70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%のアミノ酸配列同一性を有する、アミノ酸配列;
(iii)好ましくはストリンジェントな条件下で、(i)をコードする核酸の相補鎖にハイブリダイズする核酸によってコードされる、アミノ酸配列;
(iv)少なくとも1つのアミノ酸の置換、付加および/または欠失によって誘導し得る、(i)〜(iii)の断片または機能性誘導体、
ここで、前記のポリペプチドはIL−17Aに結合する。
【0012】
上記一般式(I)は、ヒトFyn SH13骨格の反復的および広範囲の突然変異解析およびIL−17A結合に基づく選択の結果である。
【0013】
Xで規定する位置は、アミノ酸のタイプおよびアミノ酸の数によっても広範に変化し得る。好ましくは、Xはいずれもシステインではない。Xによるアミノ酸の好ましい数は、下付き文字a〜hで示され、これらは全て、好ましくは0〜20であり、より好ましくは0または1〜10である。
【0014】
天然のヒトFyn SH3において、(X)aおよび(X)dは、それぞれ、RT−およびSrcループと相関する可能性がある。必須ではないが、(X)aおよび(X)dはループ構造を提供することが好ましい。典型的なループ構造は、2から20を超えるアミノ酸を含むことが知られている(ラーソン(Larson)ら(2000年)Protein Science 9;2170−2180頁)。従って、(X)aおよび/または(X)dは、2〜20のアミノ酸を有することが好ましい。好ましくは、aは1〜10であり、より好ましくは2〜8であり、最も好ましくは6である。好ましくはdは1〜10であり、より好ましくは3〜9であり、最も好ましくは5または7である。好ましくは(X)aはTAFWPGであり、より好ましくはVAFWPGであり、最も好ましくはKAFWPGである。好ましくは(X)dはLNSSEであり、より好ましくはTRTSDまたはLHTSDであり、最も好ましくはLRTSDである。
【0015】
(X)b、(X)c、(X)e、(X)fおよび(X)gは、互いに独立して、好ましくは0〜5であり、より好ましくは1〜3であり、最も好ましくは1である。(X)hは好ましくは0〜6であり、より好ましくは1〜3であり、最も好ましくは1である。
【0016】
最も好ましい態様において、式(I)は以下である:
(G/E)VTLFVALYDY−(X)6−D−(X)1−SFHKGEKF−(X)1−I−(X)5−7−G−(X)1−WW−(X)1−A−(X)1−SLTTG−(X)1−2GYIPSNYVAPVDSIQ (Ia)
【0017】
勿論、式(I)のアミノ酸配列には大多数のバリエーションがあり、それらは依然として本発明のポリペプチドのIL−17A結合を可能にするであろう。従って、本発明は、(i)に対して、少なくとも50、60または70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%のアミノ酸配列同一性を有する、ポリペプチドも包含する。
【0018】
本書で使用する場合、アミノ酸配列間の「アミノ酸配列同一性」という用語は、生化学の当業者が通常広く使用するアラインメントおよび比較技術に関連することが意図される。2つのアミノ酸配列のアミノ酸配列同一性は、通常のアラインメント方法およびツールによって測定し得る。例えば、式(I)のアミノ酸配列に対する、任意のポリペプチドのアミノ酸配列同一性の程度を測定には、SIM局所相似性プログラムを使用し得る(シャオキン・ファン(Xiaoquin Huang)およびウェッブ・ミラー(Webb Miller)、「時間効率のよい線形空間局所相似性アルゴリズム(A Time−Efficient, Linear−Space Local Similarity Algorithm)」 Advances in Applied Mathematics, 12巻: 337−357頁, 1991年)が、これは著者らおよびその機関から自由に入手可能であり(ワールドワイドウェブ:http://www.expasy.org/tools/sim−prot.htmlも参照)、多重アラインメント分析には、ClustalWを使用し得る(トンプソン(Thompson)ら、「CLUSTAL W:配列加重、位置特異的ギャップペナルティおよび加重マトリックス選択による進行性多重配列アラインメント感度の改善(improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position−specific gap penalties and weight matrix choice)」,Nucleic Acids Res.,22(22):4673−4680頁,1994年)。好ましくは、本発明のポリペプチド、断片または機能性誘導体の、式(I)のアミノ酸配列に対するアミノ酸配列同一性の程度は、式(I)の完全な配列に対して定量する。
【0019】
さらに、本発明は、好ましくはストリンジェントな条件の下で、(i)をコードする核酸の相補鎖にハイブリダイズする核酸によってコードされるアミノ酸配列を含むポリペプチドも包含する。換言すれば、本発明によるポリペプチドに包含されるアミノ酸配列は、好ましくは、式(I)のアミノ酸配列をコードする核酸の相補鎖にハイブリダイズする能力をなお有するべき核酸をコードすることによって、間接的に規定される。核酸が互いにハイブリダイズするかどうかは、特異的アラインメントおよび比較ツールにより、また実験的に、当該技術において規則的に測定される。1つの核酸がストリンジェントな条件下で特異的な参照核酸配列にハイブリダイズする能力を測定する、従来技術の一般的および/または標準的なプロトコル(例えば、サムブルック(Sambrook)およびルセル(Russell)、分子クローニング:実験室マニュアル(Molecular cloning: A laboratory manual)(3巻),2001年)の次に、興味のあるポリペプチドをコードする任意の核酸がストリンジェントな条件下で式(I)のアミノ酸配列をコードする核酸配列の相補鎖にハイブリダイズする能力を、アラインメントツールを用いてこれら2つのヌクレオチド配列を比較することによって分析および測定することが好ましく、アラインメントツールとしては、例えば、BLASTN(アルチュル(Altschul)ら、J.Mol.Biol.,215,403−410頁,1990年)およびLALIGNアラインメントツール等が挙げられる。より好ましくは、本発明のポリペプチドであることが疑われる、興味のあるポリペプチドをコードする核酸が式(I)のアミノ酸配列をコードする核酸の相補鎖にハイブリダイズする能力は、以下の条件下でのサザンブロット分析で確認される:45℃で、6x 塩化ナトリウム/クエン酸ナトリウム(SSC)、その後、65℃で、0.2x SSC、0.1% SDS中で洗浄。
【0020】
さらに、本発明は、上記の本発明のアミノ酸配列全ての断片、好ましくは機能性断片、または機能性誘導体を含む、ポリペプチドを包含する。
【0021】
従って、「本発明によるポリペプチドまたはアミノ酸配列」という用語は、上記で特定された性質を有する、即ちIL−17Aに結合する、本発明のポリペプチドまたはアミノ酸配列の機能性断片および誘導体も包含する。本発明のポリペプチドまたはアミノ酸配列の機能性誘導体は、IL−17Aへの結合を実証する、実質的に充分入手しやすいアミノ酸残基または非天然等価体を有する、あらゆるアミノ酸配列および/またはその化学誘導体(非天然アミノ酸等価体、グリコシル化、化学誘導)を包含することが意図される。本発明のポリペプチドまたはアミノ酸配列の機能性誘導体において、1以上のアミノ酸が、欠失、修飾、挿入および/または置換されてもよい。さらに、「機能性誘導体」との関連で、挿入とは、1以上のアミノ酸の上述の非誘導体化結合タンパク質中への挿入を言う。機能性誘導体は、5、4、3、2を超える、または1を超えるアミノ酸の変更(即ち、欠失、修飾、挿入および/または置換されたアミノ酸)を含まないことが、さらに好ましい。別の態様において、ポリペプチドまたはアミノ酸配列の全てのアミノ酸の、10%、9%、8%、7%、6%、5%、4%、3%、2%、または1%以下が変更される(即ち、欠失、修飾、挿入および/または置換されたアミノ酸である)ことが、さらに好ましい。誘導体における置換は、保存的または非保存的置換であってもよいが、好ましくは保存的置換である。いくつかの態様において、置換として、天然に存在するアミノ酸の、天然に存在しないアミノ酸での交換も挙げられる。保存的置換は、アミノ酸の、置換されるアミノ酸に類似した化学的性質を有する別のアミノ酸での置換を含む。好ましくは、保存的置換は、(i)塩基性アミノ酸の、別の塩基性アミノ酸での置換;(ii)酸性アミノ酸の、別の酸性アミノ酸での置換;(iii)芳香族アミノ酸の、別の芳香族アミノ酸での置換;(iv)非極性脂肪族アミノ酸の、別の非極性脂肪族アミノ酸での置換;および(v)極性非荷電アミノ酸の、別の極性非荷電アミノ酸での置換よりなる群から選択される置換である。塩基性アミノ酸は、アルギニン、ヒスチジン、およびリシンよりなる群から選択される。酸性アミノ酸は、アスパラギン酸塩またはグルタミン酸塩より選択される。芳香族アミノ酸は、フェニルアラニン、チロシンおよびトリプトファンよりなる群から選択される。非極性脂肪族アミノ酸は、グリシン、アラニン、バリン、ロイシン、メチオニンおよびイソロイシンよりなる群から選択される。極性非荷電アミノ酸は、セリン、スレオニン、システイン、プロリン、アスパラギンおよびグルタミンよりなる群から選択される。保存的アミノ酸置換と対照的に、非保存的アミノ酸置換は、1つのアミノ酸の、上記で概説した保存的置換(i)〜(v)に該当しない、あらゆるアミノ酸との交換である。機能性誘導体が欠失を含む場合には、誘導体中、参照ポリペプチド中に存在する1つまたはいくつかのアミノ酸が除去されている。しかし、欠失は、誘導体中に、全部でアミノ酸3つ未満、好ましくは4つ未満、より好ましくは5つ未満、および最も好ましくは6つ未満であるよう、多数であるべきではない。上記の通り、本発明のポリペプチドまたはアミノ酸配列のアミノ酸は修飾されてもよく、例えば化学的に修飾されてもよい。例えば、ポリペプチドのアミノ酸の側鎖または遊離アミノまたはカルボキシ末端は、例えば、グリコシル化、アミド化、リン酸化、ユビキチン化等によって修飾されてもよい。化学的修飾はインビボでも、例えば宿主細胞中でも起こり得るが、これは当該技術においてよく知られている。例えば、好適な化学的修飾モチーフ、例えばポリペプチドのアミノ酸配列中に存在するグリコシル化配列モチーフは、ポリペプチドをグリコシル化させるであろう。本発明の機能性誘導体に言及する全ての態様において、本書の上記で規定した式(I)を有するアミノ酸配列は、機能性誘導体が導入される出発分子であることを理解しなければならない。挿入の場合、2つの出発分子において、第一の分子でXaが4であり、第二の分子でXaが5である以外は同一の配列を有する場合、例えばXaのC末端への挿入が、第一の分子では2つのアミノ酸であり、第二の分子では1つのアミノ酸であるならば、同一の長さで、おそらく同一のアミノ酸配列の分子が得られるであろう。
【0022】
本発明のポリペプチドはIL−17Aに結合し、好ましくはヒトIL−17Aに結合する。好ましくは、IL−17Aに特異的に結合し、即ち、他のサイトカインには結合しないか、それらにははるかにより少ない程度に結合し、好ましくは少なくとも2、5、10、50、100、500または1000倍少なく結合する。本発明のポリペプチドの結合特異性を定量するための典型的で好ましいELISA分析を、実施例6および7に示す。
【0023】
好ましい態様において、本発明のポリペプチドは、ヒトおよびカニクイザルIL−17Aに、特異的および高結合親和性で結合する。
【0024】
さらに好ましい態様において、本発明のポリペプチドは、ヒトIL−17Aに対して特異的な(インビボおよび/またはインビトロ)結合親和性を有し、好ましくはKDが10−7〜10−12Mであり、より好ましくは10−8〜10−12Mであり、最も好ましくは10−12M未満である。例として、および好ましくは、本発明のポリペプチドの結合親和性は、以下の実施例2によって定量し得る。
【0025】
最も好ましい態様において、本発明のポリペプチドは、明細書に付記した通りの配列番号1〜119またはそれらの機能性誘導体よりなる群から選択される。
【0026】
好ましい態様において、本発明のポリペプチドは、IL−17Aに結合するだけではなく、実際にIL−17A(機能)を阻害する。この容量は、実施例3および10に実証されており、ここで、IL−17Aの添加に対する応答において、ポリペプチドがヒト皮膚線維芽細胞中のIL−6の誘導を阻害する能力が実証された。
【0027】
さらに、本発明のポリペプチドは、溶液中で高い安定性を有し、例えば、単純なリン酸緩衝生理食塩水中、少なくとも6ヶ月間、4℃で安定である(実施例4参照)。
【0028】
しかし、安定性はインビトロの組成物に限らず、本発明のポリペプチドを静注したマウスにおいて、既に明らかである(実施例5および12参照)。
【0029】
結論として、本発明のポリペプチドは、研究、診断および医学的応用に非常に適している。
【0030】
IL−17A抗体を置換することの他に、本発明のポリペプチドはインビボおよびインビトロの薬学的および診断的応用のための、新規で免疫原性がより低い融合タンパク質の設計も可能にする。従って、第二の様相において、本発明は、薬学的および/または診断的有効成分に融合した本発明のポリペプチドを含む融合タンパク質に関する。
【0031】
上記の通り、本発明の融合タンパク質は、非ポリペプチド成分を含んでいてもよく、例えば治療的または診断的関連放射性核種に対する、例えば非ペプチド性リンカー、非ペプチド性リガンドを含んでいてもよい。
【0032】
好ましくは、前記の活性成分は、IL−2、IL−12、TNF−α、IFNα、IFNβ、IFNγ、IL−10、IL−15、IL−24、GM−CSF、IL−3、IL−4、IL−5、IL−6、IL−7、IL−9、IL−11、IL−13、LIF、CD80、B70、TNFβ、LT−β、CD−40リガンド、Fas−リガンド、TGF−β、IL−1αおよびIL−1βよりなる群から選択されるサイトカインである。
【0033】
別の好ましい態様において、前記の活性成分は毒性化合物であり、好ましくは有機小分子またはポリペプチドであり、より好ましくは、カリケアマイシン、マンタンシノイド、ネオカルチノスタチン、エスペラマイシン、ダイネミシン、ケダルシジン、マデュロペプチン、ドキソルビシン、ダウノルビシン、アウリスタチン、リシン−A鎖、モデシン、トランケートした緑膿菌エンドトキシンA、ジフテリア毒素および組み換えゲロニンよりなる群から選択される毒性化合物である。
【0034】
別の好ましい態様において、本発明による融合タンパク質は、前記の活性成分がケモカインであり、好ましくは、IL−8、GROα、GROβ、GROγ、ENA−78、LDGF−PBP、GCP−2、PF4、Mig、IP−10、SDF−1α/β、BUNZO/STRC33、I−TAC、BLC/BCA−1、MIP−1α、MIP−1β、MDC、TECK、TARC、RANTES、HCC−1、HCC−4、DC−CK1、MIP−3α、MIP−3β、MCP−1−5、エオタキシン、エオタキシン−2、I−309、MPIF−1、6Ckine、CTACK、MEC、リンホタクチンおよびフラクタルカインよりなる群から選択されるケモカインである、融合タンパク質である。
【0035】
さらに好ましい態様において、本発明によるポリペプチドまたは融合タンパク質は人工アミノ酸を含有する。
【0036】
本発明の融合タンパク質のさらに好ましい態様において、前記の活性成分は蛍光色素であり、好ましくは、アレクサフルオルまたはCy色素(ベルリエ(Berlier)ら、「長波長アレクサフルオル色素のCy色素との定量比較:色素およびそれらのバイオコンジュゲートの蛍光(Quantitative Comparison of Long−wavelength Alexa Fluor Dyes to Cy Dyes:Fluorescence of the Dyes and Their Bioconjugates)」,J.Histochem. Cytochem.51(12):1699−1722頁,2003年);光増感剤、好ましくは光毒性赤色蛍光タンパク質キラーレッド(ブリナ(Bulina)ら(2006年)Nat Biotechnol.,24,95−99頁)またはヘマトポルフィリン;凝血促進因子、好ましくは組織因子;プロドラッグ活性化酵素、好ましくは、カルボキシペプチダーゼ、グルクロニダーゼおよびグルコシダーゼよりなる群から選択される酵素;γ放射性アイソトープの群からの放射性核種、好ましくは99mTc、123I、111In、または、ポジトロン放射体の群からの放射性核種、好ましくは18F、64Cu、68Ga、86Y、124I、または、β放射体の群からの放射性核種、好ましくは131I、90Y、177Lu、67Cu、または、α放射体の群からの放射性核種、好ましくは213Bi、211Atよりなる群から選択される成分である。
【0037】
別の好ましい態様において、本発明のポリペプチドは、本書において上記で規定した通りの1以上の非ポリペプチド成分に、直接または化学リンカーを介して結合してもよい。
【0038】
本発明の融合タンパク質のより好ましい態様において、前記の活性成分は1以上の機能性Fcドメインであり、好ましくは1以上のヒト機能性ドメインであり(例えば、配列番号117〜119および配列番号130を参照)、それ(ら)は、本発明のIL−17A結合ポリペプチドのインビボの半減期を延長することが可能であり、それらのいくつかは、例えば治療的、予防的および/または診断的適応において、哺乳類の免疫反応を、融合タンパク質の本発明のポリペプチド成分の特異的標的結合部位に向ける。本発明のポリペプチドは、1以上の機能性FcドメインのN−またはC−末端のいずれか、または、1以上のFcドメインのN−およびC−末端の両者に融合し得る。本発明の融合タンパク質は、1つ以上、好ましくは1つのFcドメインの、少なくとも片側、好ましくはN−末端に融合した、本発明のポリペプチドの多量体、好ましくは四量体、三量体、または最も好ましくは二量体を含むことが好ましい。この点において、(2C1)2−Fcと規定されるフィノマー−フィノマー−Fc融合タンパク質が多量体ポリペプチドFc融合体の有利点を実証することが知られており、以下の実施例2の図3eおよび3fおよび表IIに示す通り、この融合体は、対応する単量体2C1−Fc融合タンパク質よりも、IL−17Aに対する親和性が高い。従って、本発明の好ましい態様は、多量体ポリペプチドFc融合タンパク質を対象にする。
【0039】
抗体の「機能性Fcドメイン」は、当業者によく知られている用語であり、抗体のパパイン消化に基づいて規定される。重鎖の定常領域のアミノ酸配列によって、免疫グロブリンは以下のクラス:IgA、IgD、IgE、IgGおよびIgMに分類され、これらのうちのいくつかは、さらにサブクラス(アイソタイプ)、例えばIgG1、IgG2、IgG3、およびIgG4、IgA1、およびIgA2に分類される。重鎖の定常領域によって、免疫グロブリンの種々のクラスはそれぞれ[α]、[δ]、[ε]、[γ]、および[μ]と呼ばれる。抗体の機能性Fcドメインは、補体活性化、C1q結合およびFc受容体結合に基づいて、ADCC(抗体依存性細胞媒介性細胞傷害)およびCDC(補体依存性細胞傷害)に直接的に関与する。4つのヒトIgGアイソタイプは、新生児Fc受容体、活性化Fcγ受容体、FcγRI、FcγRIIa、およびFcγRIIIa、抑制性受容体FcγRIIb、およびC1q等の、親和性の異なる種々の受容体に結合し、非常に異なる活性を与える。ヒト抗体のFcドメインの活性化および抑制性受容体への親和性は、操作および修飾し得る(ストロール(Strohl)W.(2009年)Curr Opin Biotechnol,20,685−691頁参照)。従って、上記の通り、本発明は、本発明のIL−17A結合ポリペプチドのインビボでの半減期を延長することができ、ヒト由来の機能性Fcドメイン、好ましくはIgG1抗体のヒト機能性Fcドメイン(例えば、配列番号117〜119および配列番号130参照)を含有する、Fc融合体を含む。
【0040】
本発明の融合タンパク質のより好ましい態様において、活性成分は、活性化またはサイレンシングされたエフェクター機能を有するIgG1の1以上の改変ヒト機能性Fcドメインであり、好ましくは、サイレンシングされたエフェクター機能を有するIgG1の1以上の改変ヒト機能性Fcドメインであり、最も好ましくは、L234およびL235に突然変異を有する、サイレンシングされたエフェクター機能を有するIgG1の1以上の改変ヒト機能性Fcドメインであり(例えば、配列番号131〜135参照)、カバト(Kabat)のEUインデックスに従って番号を付ける(ジョンソン(Johson)G.およびウ(Wu)T.T.(2000年)Nucleic Acids Res.28,214−218頁参照)。
【0041】
さらに好ましい態様は、上記の通りの本発明によるポリペプチドまたは融合タンパク質であって、さらに、血中半減期を調節する成分を含み、好ましくは、ポリエチレングリコール(PEG)、免疫グロブリンおよびアルブミン結合ペプチドよりなる群から選択される成分を含む、ポリペプチドまたは融合タンパク質に関する。
【0042】
さらに、本発明の融合タンパク質があらゆる上記の本発明のIL−17A結合ポリペプチドを含み、好ましくは、配列番号117〜119および配列番号130〜135またはその機能性誘導体からなる群から選択されるものを含むことが好ましい。
【0043】
本発明のポリペプチドまたは融合タンパク質は、好ましくは単量体であるが、また本発明のポリペプチドの多量体も包含し、好ましくは四量体、より好ましくは三量体、または最も好ましくは二量体を包含することが注目される。
【0044】
本発明のポリペプチドおよび融合タンパク質は、単純な有機合成戦略、固相支援合成技術等の、多数の従来からの周知技術のいずれかにより、または、市販の自動合成装置により、調製してもよい。他方で、従来の組み換え技術単独で、または従来の合成技術との組み合わせにより調製してもよい。
【0045】
この点において、本発明のさらなる様相は、(i)本発明のポリペプチドまたは融合タンパク質をコードする核酸、(ii)前記の核酸を含むベクター、および(iii)前記のポリヌクレオチドおよび/または前記のベクターを含む宿主細胞を対象とする。
【0046】
好ましくは、本発明は、
(i)本発明のポリペプチドをコードする核酸、好ましくは式(I)のアミノ酸配列をコードする核酸、より好ましくは
(G/E)VTLFVALYDY−(X)6−D−(X)−SFHKGEKF−(X)1−I−(X)5−7−G−(X)1−WW−(X)−A−(X)−SLTTG−(X)1−2−GYIPSNYVAPVDSIQ
をコードする核酸;
(ii)(i)の核酸配列に対して、少なくとも60%または70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%の配列同一性を持つ配列を有する核酸;
(iii)(i)または(ii)の核酸の相補鎖にハイブリダイズする核酸;
(iv)核酸であって、前記の核酸が、(i)、(ii)または(iii)の核酸のうちの1つの置換、付加および/または欠失によって誘導し得る、核酸;
(v)(i)〜(iv)の核酸のいずれか1つの断片であって、本発明によるポリペプチドをコードする(i)の核酸の相補鎖にハイブリダイズする、断片
を含む、単離または精製核酸を対象とする。
【0047】
より好ましくは、本発明の核酸は、上述の通りのポリペプチドまたは融合タンパク質をコードする核酸を含む。この点において、上記の核酸(i)〜(v)のいずれも、好ましくはIL−17Aに結合するポリペプチドをコード化し、より好ましくはIL−17Aの機能を阻害することが理解される。
【0048】
本発明の核酸は、DNA、RNA、PNAおよびそれらのあらゆる他のアナログであり得る。ベクターおよび宿主細胞は、例えば、本発明のポリペプチドおよび/または融合タンパク質の製造、例えば遺伝子治療用の治療に有用なベクターおよび宿主細胞の製造などの目的に適合するあらゆる従来のタイプであってもよい。当業者は、多くの従来技術からそのような核酸、ベクターおよび宿主細胞を選択し、通常の方法により過度の負担なく、それらが所望の目的に特に適合することを確認できるであろう。
【0049】
好ましくは、核酸はプロモーターに動作可能に結合し、好ましくは、T5プロモーター/lacオペレーターエレメント、T7プロモーター/lacオペレーターエレメントよりなる原核生物プロモータの群、またはhEF1−HTLV、CMV enh/hFerLプロモーターよりなる真核生物プロモーターの群から選択されるプロモーターに結合する。
【0050】
また、本発明の組み換えベクターは、本発明の核酸を含むものであって、好ましくは本発明のポリペプチドまたは融合タンパク質を産生する能力があるものが好ましい。好ましくは、このようなベクターは、pQEベクター、pETベクター、pFUSEベクター、pUCベクター、YACベクター、ファージミドベクター、ファージベクター、レトロウイルス、アデノウイルス、アデノ随伴ウイルス等の遺伝子治療に使用されるベクターよりなる群から選択される。
【0051】
加えて、本発明は、本発明の核酸および/またはベクターを含む宿主細胞に関する。
【0052】
さらに、本発明は、本発明のポリペプチドまたは融合タンパク質に特異的に結合する抗体を包含する。抗体が融合タンパク質に結合する場合、融合タンパク質の、本発明のポリペプチドまたは融合エピトープよりなる部分に特異的に結合し、即ち、一部は本発明のポリペプチドよりなり、一部は薬学的および/または診断的活性成分よりなる抗体の結合部位に結合するが、この活性成分は好ましくはポリペプチドまたはペプチドである。抗体は、ポリクローナル抗体またはモノクローナル抗体であってもよい。本書で使用される場合、「抗体」という用語は、抗体分子全体だけではなく、例えば、Fab、F(ab’)2、Fv、および単鎖Fv断片等の抗原結合断片にも言及する。また、キメラ抗体、好ましくはヒト化抗体も含まれる。このような抗体は、任意のタンパク質と本発明のポリペプチドとを判別する研究ツールとして有用である。さらなる様相は、本発明によるモノクローナル抗体を発現する、ハイブリドーマ細胞株に関する。
【0053】
本発明のポリペプチドおよび融合タンパク質は、IL−17A結合および阻害特性、ならびに保存安定性およびインビボ安定性を実証することから、本発明のさらなる様相は、本発明のポリペプチドまたは融合タンパク質、核酸および/または組み換えベクター、および任意に薬学的に許容される担体を含む、医薬組成物に関する。医薬組成物という用語は、インビボで使用する診断用組成物も包含することが意図される。
【0054】
本発明の医薬組成物は、従来のあらゆる方法で製造してもよい。以下に示す疾患に罹患する患者の治療において、本発明の少なくとも1つの化合物は、経口または非経口経路を含む、治療的ポリペプチドまたはその治療的断片を有効量で生物学的に利用可能にするあらゆる形態または様式で投与し得る。例えば、本発明の組成物は、吸入等により、皮下、筋肉内、静脈内に投与し得る。製剤調製分野における当業者は、選択された製品の特別の性質、治療される疾患または病状、疾患または病状の病期、および他の関連する状況に応じて、適宜の形態および様式を容易に選択し得る(例えばレミントンの薬科学(Remington’s Pharmaceutical Sciences),Mack Publishing Co.(1990年)参照)。好適な担体または賦形剤は、活性成分のビヒクルまたは媒体として働き得る、液体材料であってもよい。好適な担体または賦形剤は、当技術分野においてよく知られており、例えば、安定剤、抗酸化剤、pH調整物質、放出制御賦形剤等が挙げられる。本発明による組成物は、好ましくは凍結乾燥形態で提供される。速やかな投与のためには、好適な水性担体中、例えば注射用滅菌水または滅菌緩衝生理食塩水中に溶解する。ボーラス注入法としてよりは点滴による投与のため、より高容量を製造することが望まれる場合は、最終製剤の時点でヒト血清アルブミンまたは患者自身のヘパリン添加血液を溶媒中に取り込むことが有利である。あるいは、製剤は皮下投与し得る。ヒト血清アルブミン等の生理学的に不活性なタンパク質が過剰に存在することにより、輸液用の容器およびチューブ壁への吸着による薬学的に有効なポリペプチドの損失を防ぐ。アルブミンを使用する場合、好適な濃度は、食塩水の重量の0.5〜4.5%である。
【0055】
本発明のIL−17A結合および阻害ポリペプチドは、IL−17Aおよび/またはTh17に関連する疾患または医学的状態の治療および/または予防に特に有用である。したがって、本発明のさらなる様相は、医薬用途のため、即ち、医薬の製造のため、好ましくは、疾患または医学的状態の治療および/または予防のための医薬の製造のためであって、好ましくは疾患または医学的状態がIL−17A−およびTh17に関連する疾患または医学的状態よりなる群から選択されるものである、本発明のポリペプチドまたは融合タンパク質、核酸および/または組換えベクターの使用を対象とする。
【0056】
好ましい態様において、本発明の医薬用途は、炎症性、自己免疫および/または骨量減少関連疾患または状態から選択される、疾患または医学的状態の治療および/または予防に関する。
【0057】
最も好ましい態様において、前記の炎症性、自己免疫および/または骨量減少関連疾患または状態は、関節炎、好ましくは関節リウマチ、慢性進行性関節炎、反応性関節炎、乾癬性関節炎、腸疾患性関節炎および変形性関節炎、リウマチ性疾患、脊椎関節症、強直性脊椎炎、ライター症候群、過敏症(気道過敏症および皮膚過敏症の両者を含む)、アレルギー、全身性エリテマトーデス、炎症性筋疾患、多発性軟骨炎、浮腫性硬化症、ヴェーゲナー肉芽腫、皮膚筋炎、スティーブンス・ジョンソン症候群、慢性活動性肝炎、重症筋無力症、乾癬、特発性スプルー、自己免疫性炎症性腸疾患、潰瘍性大腸炎、クローン病、過敏性腸症候群、内分泌性眼症、グレーブス病、サルコイドーシス、虚血、全身性硬化症、多発性硬化症、原発性胆汁性肝硬変、若年性糖尿病(1型糖尿病)、自己免疫性血液疾患、溶血性貧血、再生不良性貧血、真性赤血球性貧血、特発性血小板減少症、ブドウ膜炎(前部および後部)、乾性角結膜炎、春季カタル、間質性肺線維症、糸宮体腎炎(ネフローゼ症候群を伴う、および、伴わず)、特発性ネフローゼ症候群または微小変化ネフロパシー、腫瘍、皮膚炎症の炎症性疾患、角膜炎、筋炎、骨インプラントの弛緩、急性移植拒絶反応、代謝異常、アテローム性動脈硬化症、糖尿病、および脂質異常症、骨量の減少、変形性関節症、骨粗しょう症、閉塞性または炎症性気道疾患の歯周病、喘息、気管支炎、塵肺、肺気腫、急性および超急性炎症反応、IL−17A介在性TNF−α関連疾患、急性感染症、敗血症、敗血性ショック、内毒素性ショック、成人呼吸窮迫症候群、髄膜炎、肺炎、重度の熱傷、悪液質、消耗症候群、脳卒中、ヘルペス性間質性角膜炎およびドライアイ疾患から選択される。上記で特定された疾患および医学的状態の全ては、共通して、それらの起源および/または症状がIL−17Aおよび/またはTh−17に関連する。
【0058】
好ましくはIL−17Aおよび/またはTh17に関連する疾患または医学的状態よりなる群から選択され、より好ましくは上記に具体的に列挙したものからなる群から選択される、疾患または医学的状態の治療および/または予防のための本発明の化合物、即ちポリペプチド、融合タンパク質、核酸、ベクターおよび宿主細胞の投与量および投与形態は、勿論、本発明の特定のポリペプチドまたは融合タンパク質阻害剤、個々の患者群または患者、さらなる医療的活性化合物の存在および治療している病状の重篤度によって変わるであろう。しかし、予防的および/または治療的使用のために投与すべき量は、体重1kg当たり約0.01mg〜約20mg、好ましくは体重1kg当たり約0.1mg〜約5mgであることが、現在のところ好ましい。好ましくは、予防的および/または治療的使用のための投与頻度は、およそ1週間に2回からおよそ3ヶ月毎に1回の範囲内であり、好ましくはおよそ2週間毎に1回からおよそ10週間毎に1回、より好ましくは4〜8週間毎に1回の範囲内である。本発明のIL−17A結合ポリペプチドおよび融合タンパク質は、非経口的、静脈内に便利かつ好ましく投与されるが、好ましくは肘正中静脈または他の末梢静脈、筋肉内または皮下に投与される。IL−17A結合ポリペプチドは、点眼剤としても局所的に送達され得る。患者の好ましい予防的および/または治療的処置としては、本発明のポリペプチドを月に1回から2〜3ヶ月毎に1回、またはより低頻度で投与することが挙げられる。
【0059】
結論として、本発明は治療方法にも関し、ここで上記の医薬組成物の薬理学的有効量が、それを必要とする患者に投与され、好ましくはIL−17Aおよび/またはTh17に関連する疾患または医学的状態を罹患する患者に、より好ましくは、上記で特定した疾患または医学的状態のうちの1つを罹患する患者に投与される。本書で使用される場合、「処置」という用語は、疾患または医学的状態の予防的および/または治療的処置に関する。
【0060】
本発明のIL−17A結合ポリペプチドおよび融合タンパク質は、活性成分単独で投与してもよく、または、例えば補助剤として併用して、または他の薬剤と組み合わせて投与してもよく、他の薬剤としては、例えば上記の疾患の治療または予防のための、例えば免疫抑制剤または免疫調整剤、または他の抗炎症剤が挙げられる。例えば、本発明のIL−17A結合ポリペプチドおよび融合タンパク質は、免疫抑制性モノクローナル抗体と組み合わせて使用してもよく、例えば、白血球受容体に親和性を有するモノクローナル抗体、例えばMHC、CD2、CD3、CD4、CD7、CD8、CD25、CD28、CD40、CD45、CD58、CD80、CD86または他のリガンド;他の免疫調整化合物、例えばCTLA4またはその変異体の細胞外ドメインの少なくとも一部を有する組み換え結合分子、例えば非CTLA4タンパク質配列に結合する、CTLA4またはその変異体の少なくとも細胞外部分、例えばCTLA4Ig(例えばATCC 68629)またはその変異体、例えばLEA29Y;接着分子阻害剤、例えばLFA−I拮抗剤、ICAM−Iまたは−3拮抗剤、VCAM−4拮抗剤またはVLA−4拮抗剤と組み合わせて使用してもよい。加えて、本発明のポリペプチドおよび融合タンパク質は、DMARD、例えば金塩、スルファサァラジン、抗マラリア薬、メトトレキサート、D−ペニシラミン、アザチオプリン、ミコフェノール酸、シクロスポリンA、タクロリムス、シロリムス、ミノサイクリン、レフルノミド、グルココルチコイド;カルシニューリン阻害剤、例えばシクロスポリンAまたはFK 506;リンパ球再循環のモジュレーター、例えばFTY720およびFTY720アナログ;mTOR阻害剤、例えばラパマイシン、40−O−(2−ヒドロキシエチル)−ラパマイシン、CCI779、ABT578、AP23573またはTAFA−93;免疫抑制性を有するアスコマイシン、例えばABT−281、ASM981等;コルチコステロイド;シクロホスファミド;アザチオプレン(azathioprene);メトトレキサート;レフルノミド;ミゾリビン;ミコフェノール酸;ミコフェノール酸モフェチル;15−デオキシスペルグアリンまたは免疫抑制性ホモログ、そのアナログまたは誘導体;または化学療法剤、例えばパクリタキセル、ゲムシタビン、シスプラチナム、ドキソルビシンまたは5−フルオロウラシル;抗TNF剤、例えばTNFに対するモノクローナル抗体、例えばインフリキシマブ、アダリムマブ、CDP870、またはTNF−RIまたはTNF−RIIに対する受容体構築物、例えばエタネルセプト、PEG−TNF−RI;炎症性サイトカイン阻害剤、IL−1阻害剤、例えばアナキンラまたはIL−1トラップ、AAL160、ACZ 885、IL−6阻害剤;プロテアーゼの阻害剤または活性化剤、例えばメタロプロテアーゼ、抗IL−15抗体、抗IL−6抗体、抗IL−23抗体、抗IL−22抗体、抗IL−21抗体、抗IL−12抗体、抗IFNγ抗体、抗IFNα抗体、抗CD20抗体、アスピリン等のNSAIDまたは抗感染症薬と組み合わせて使用してもよい。当然のことながら、この併用薬のリストは限定的ではなく、完全でもない。
【0061】
以下の実施例において、例示により、本発明をさらに記載するが、いずれも添付の特許請求の範囲に概説した通りの本発明の範囲を制限するものと解釈すべきではない。
【図面の簡単な説明】
【0062】
【図1】図1は、本発明のIL−17結合ポリペプチドの具体例のSDS PAGE分析を示す:(a)B1_2(配列番号39)のSDS PAGE(レーン1)、E4(配列番号57)(レーン2)、2C1(配列番号107)(レーン3)、E4−Fc(配列番号117)(レーン4:非還元的条件、レーン5:還元的条件)、2C1−Fc(配列番号118)(レーン6:非還元的条件、レーン7:還元的条件);(b)[(2C1)2−Fc](配列番号119)のSDS PAGE(レーン1:非還元的条件、レーン2:還元的条件)。(2C1)2−Fcの分子量は、リファレンス分子量全帯域マーカー(示さず)より推定される。
【図2】図2は、本発明のIL−17A結合ポリペプチドのサイズ排除クロマトグラム(SEC)を示す:(a)クローンB1_2(配列番号39)、(b)E4(配列番号57)、(c)2C1(配列番号107)、(d)E4−Fc(配列番号117)、(e)SECピーク精製E4−Fc、精製およびPBS中4℃で40日間保存した後分析、(f)2C1−Fc(配列番号118)、(g)(2C1)2−Fc(配列番号119)。
【図3】図3は、本発明のIL−17A結合ポリペプチドのビアコア(BIAcore)センサーグラムを図示する:(a)クローンB1_2(配列番号39)、(b)E4(配列番号57)、(c)2C1(配列番号107)、(d)E4−Fc(配列番号117)、(e)2C1−Fc(配列番号118)、(f)(2C1)2−Fc(配列番号119)。
【図4】図4は、IL−17A阻害細胞分析の結果を図示する:(a)NHDF細胞をIL−17Aと共にインキュベーションした後の、IL−6の容量依存性誘導。(b)Fyn SH3由来IL−17バインダーおよびIL−17A受容体−Fcキメラによる、NHDF細胞におけるIL−17A誘導IL−6産生の容量依存性阻害。(c)b)と同様であるが、IL−17A結合親和性を有しない対照タンパク質として、Fyn SH3 wtタンパク質を使用した。(d)XTT分析:生存細胞は、テトラゾリウム塩XTTを着色産物に代謝することができる。我々の実験において、全ての細胞は、IL−17A、IL−17AおよびFyn SH3バインダー、またはIL−17AおよびIL−17R−Fcキメラと共に24時間インキュベーションした後、生存していた。
【図5】図5は、G3と規定した本発明のIL−17A結合ポリペプチド(配列番号34)の、精製1日後(PBS中、4℃で保存)のサイズ排除クロマトグラフィーを図示する。クロマトグラフィーはスーパーデックス75(GE ヘルスケア(Healthcare))カラムを使用して実施した。
【図6】図6は、4℃(a)または−20℃(b)で6ヶ月を超えて保存した、G3と規定した本発明のIL−17A結合ポリペプチド(配列番号34)の、サイズ排除クロマトグラフィーを図示する。
【図7】図7は、マウスにおける、E4−Fcと規定した本発明のIL−17A結合ポリペプチド(配列番号117)の薬物動態データを示す:(a)血清中のE4−Fc濃度を、静注後の時間に対してプロットする、(b)(a)と同様であるが、反対数表示でプロットする。最後の4点を用いて終末相半減期を計算したところ、50.6時間であった。
【図8】図8は、2C1と規定した本発明のポリペプチド(配列番号107)の、結合特異性の表を示す。吸光度の結果は、種々の標的タンパク質:ヒトIL−17A、ヒトIL−17F、mlL−17A(マウスIL−17A)、TNFα(ヒト腫瘍壊死因子α)、BSA(ウシ血清アルブミン)、オボアルブミン(鶏卵白)、IL−6(ヒトインターロイキン6)を使用して実施されるELISAに関係する。
【図9】図9は、本発明のFyn SH3由来のポリペプチド2C1(配列番号107)の特異性を示す。ELISAにおいて、結合剤としての本発明のFyn SH3由来のポリペプチド2C1(配列番号107)と共に、種々のIL−17ファミリーメンバー、異なる種のIL−17Aおよび他の無関係な抗原を使用した。本発明のFyn SH3由来のポリペプチド2C1(配列番号107)のみがヒトおよびカニクイザルIL−17Aに結合する。他の抗原のいずれに対しても、結合を検出できなかった。図の右側(破線の右側)には、ヒトIL−17CのELISAシグナルが見られるが、これはヒトIL−17A対照を用いて、別の日に定量した。説明:hIL−17A:ヒトインターロイキン17A、hIL−17B:ヒトインターロイキン17B、hIL−17D: ヒトインターロイキン17D、hIL−17E:ヒトインターロイキン17E、hIL−17F: ヒトインターロイキン17F、マウスIL−17A:マウスインターロイキン17A、ラットIL−17A:ラットインターロイキン17A、イヌIL−17A:イヌインターロイキン17A、cyno Il−17A:カニクイザルインターロイキン17A、EDB:フィブロネクチンの追加ドメインB、hIL−6:ヒトインターロイキン 6、hTNFα:ヒト腫瘍壊死因子α、オボアルブミン:鶏卵黄由来のアルブミン、BSA:ウシ血清アルブミン、neg ctrl:コーティングに抗原を使用せず、hIL−17C:ヒトインターロイキン17C。
【図10】図10は、封入体からリフォールディングされたカニクイザルIL−17Aでコートしたチップ上での、本発明のFyn SH3由来のポリペプチド2C1(配列番号107)のビアコア(Biacore)センサーグラムを図示する。
【図11】図11は、Fc融合タンパク質のSDS PAGE分析を示す。レーン1:全帯域レインボーマーカー(GEヘルスケア(Healthcare))、レーン2:2C1−Fc(配列番号130)、レーン3:全帯域レインボーマーカー(GEヘルスケア)、レーン4:2C1−m5−Fc(LALA)(配列番号133)、レーン5:2C1−m10−Fc(LALA)(配列番号134)、レーン6:2C1−m15−Fc(LALA)(配列番号135)、レーン7:2C1−m5E−Fc(LALA)(配列番号132)、レーン8:2C1−Fc(LALA)(配列番号131)。
【図12】図12は、PBS中4℃で保管した標準対照2C1−Fc(配列番号130)(×)と比較した、ヒト血清中37℃で5日間保管した後の、IL−17Aに結合する2C1−Fc(配列番号130)(■)のELISAを示す。
【図13】図13は、マウスに単回静注した後の、2C1−Fc(LALA)(配列番号131)の種々の時点での血清濃度を示す。哺乳類細胞において産生された2C1−Fc(LALA)融合タンパク質(配列番号131)を、マウス(n=5)に静脈注射(iv)した(動物当り40μg)。PKプロファイルの最後の4点を用いて、2C1−Fc融合タンパク質の終末相半減期を計算したところ、53時間であった。
【図14】図14は、急性炎症モデルにおける、本発明の抗IL−17 Fyn SH3由来ポリペプチド2C1(配列番号107)による、ヒトIL−17A誘導KC産生の阻害を示す。3μgのヒトIL−17A(IL−17)、PBS(PBS)、3μgのヒトIL−17Aと17μgの本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)(IL−17+2C1)、3μgのヒトIL−17Aと16μgの野生型Fyn SH3モノマー(IL−17+wt)、17μgの本発明の単量体Fyn SH3由来のポリペプチド2C1(配列番号107)単独(2C1)、または16μgの野生型Fyn SH3単量体単独(wt)の皮下注射の2時間後に、血液サンプルを採取し、マウス血清中のKCレベルを定量した。各群4匹のマウスの平均KCレベルを示すが(±SD)、例外として野生型対照群(IL−17Aを含まない、または含む、Fyn SH3)では、3匹のマウスの平均レベルを示す(±SD)。
【図15】図15は、急性炎症モデルにおける、2C1−Fc融合タンパク質(配列番号130)による、ヒトIL−17A誘導KC産生の阻害を図示する。2C1−Fc/Il−17:44μgの2C1−Fc(配列番号130)を静注した後、3μgのヒトIL−17Aの皮下注射した。IL−17A投与から2時間後、マウスから血液サンプルを採取し、KC血清レベルをELISAで測定した。対照実験を以下の通り実施した:PBS/IL−17:PBSの静注の後、IL−17の皮下注射;2C1−Fc/PBS:2C1−Fc(配列番号130)の静注の後、PBSの皮下注射;PBS/PBS:PBSの静注の後、PBSの皮下注射;各群3〜5匹のマウスの平均KCレベルを示す(±SD)。
【実施例】
【0063】
実施例1:モノクローナルファージELISAで定量された通り、本発明のFyn SH−3由来ポリペプチドはIL−17Aに結合する。
方法
配列番号1〜116で示されるアミノ酸配列をコードするDNAを、グラブロフスキ(Grabulovski)らにおけるFYN SH3ライブラリについて記載された通り(グラブロフスキら、(2007年)JBC,282,3196−3204頁)ファージミドベクターpHEN1にクローニングした。ファージ産生は、標準的プロトコル(ヴィティ(Viti),Fら(2000年)Methods Enzymol.326,480−505頁)に従って実施した。ファージを含有するモノクローナル細菌上澄をELISAに使用した:ビオチン化IL−17A(R&Dシステムズ(Systems)より購入、ビオチン化は、NHS−PEO4−ビオチン(ピアス(Pierce))を用い、メーカーの使用説明書に従って実施した)を、ストレプトアビジンでコートしたウェル(ストレプタウェルズ(StreptaWells)、ハイバインド(High Bind)、ロシュ(Roche))上に固定化し、PBS、2%ミルク(ラピライト(Rapilait)、ミグロス(Migros)、スイス)でブロッキングした後、20μlのPBS、10%ミルクおよび80μlのファージ上澄を適用した。1時間インキュベーションし、洗浄した後、結合したファージを抗M13−HRP抗体複合体(GEヘルスケア(Healthcare))で検出した。ペルオキシダーゼ活性の検出は、BMブルーPOD基質(ロシュ)を加えることによって行い、1M H2SO4を加えて反応を停止した。バインダーのDNA配列は、DNAシークエンシングによって検証した(ビッグダイ・ターミネーター(BigDye Terminator) v3.1 サイクル・シークエンシング・キット、ABI PRISM 3130遺伝子分析器、アプライドバイオシステムズ(Applied Biosystems))。
【0064】
結果
Fny SH3−由来IL−17Aバインダーのアミノ酸配列は、配列表中に付記した通りの、配列番号1〜116で示される。
【0065】
実施例2:本発明のFyn SH3由来のポリペプチドは、組み換えヒトIL−17Aに高親和性で結合する。
この実施例は、種々の形態のFyn SH3由来IL−17A結合ポリペプチドのクローニングおよび発現、および、これらのポリペプチドのサイズ排除クロマトグラフィーおよび表面プラスモン共鳴による特性評価を示す。
【0066】
a)Fyn SH3由来IL−17A結合ポリペプチドのクローニングおよび発現
選択したFyn SH3由来IL−17A結合ポリペプチド(クローンB1_2:配列番号39、クローンE4:配列番号57およびクローン2C1:配列番号107)を、グラブロフスキ(Grabulovski)ら(グラブロフスキら(2007年)JBC,282,3196−3204頁)に記載の通り、細胞質発現ベクターにクローニングし、発現および精製した。
【0067】
b)ヒトIgG1抗体のFc部分に融合した、Fyn SH3由来IL−17A結合ポリペプチドのクローニングおよび発現
クローンE4および2C1(配列番号57および107)をクローニングし、ヒトIgG1抗体のFc部分との融合タンパク質として発現させた(手順は、以下参照;配列番号117および118)。さらに、10個のアミノ酸リンカーを有する2C1二量体[(2C1)2−Fc]をクローニングし、Fc融合タンパク質として発現させた(配列番号119)。
【0068】
ヒトIgG1のFc部分を、プライマーfm5(5’ATCGGGATCCGACAAAACTCACACATGCC 3’、配列番号121)およびfm6(5’TACGAAGCTTTCATTTACCCGGAGACAGGG 3’、配列番号122)を用い、および、テンプレートとして市販のpFUSE−hlgG1−Fc2(インビボジェン(Invivogen))真核性ベクターを用いて
PCR増幅した。得られたPCR産物をBamHI/HindIIIで消化し、以前に同じ酵素で消化したpASK−IBA2ベクター(IBA−バイオタグノロジー(Biotagnology))と連結し、新たなベクターpAFを得た。
【0069】
クローンE4および2C1(配列番号57および107)の遺伝子情報を、fm7(5’ATATCACCATGGGGCCGGAGTGACACTCTTTGTGGCCCTTTATG 3’、配列番号123)およびfm8(5’CGTAGGATCCCTGGATAGAGTCAACTGGAGC 3’、配列番号124)を用いてPCR増幅した。Fcに融合した2C1二量体の調製には、2C1 DNAテンプレートを2つの独立したPCRに使用した。第一の反応では、プライマー47b.fo(5’AGA GCC ACC TCC GCC TGA ACC GCC TCC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号125)および52.ba(5’GAC TAA CGA GAT CGC GGA TCC GGA GTG ACA CTC TTT GTG GCC CTT TAT 3’、配列番号126)を使用し、第二のPCRでは、プライマー48b.ba(5’GGT GGA GGC GGT TCA GGC GGA GGT GGC TCT GGA GTG ACA CTC TTT GTG GCC CTT TAT 3’、配列番号127)および51.fo(5’ATC CCA AGC TTA GTG ATG GTG ATG GTG ATG CAG ATC CTC TTC TGA GAT GAG TTT TTG TTC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号128)を使用した。
【0070】
2つのDNA断片をPCRによって組み立て、2つのドメインの間に10個のアミノ酸のリンカー(GGGGSGGGGS、配列番号120)を有する2C1ホモ二量体を得た。得られたDNA断片を、プライマーfm7およびfm8を用いた2C1単量体について記載した通りに、さらに増幅した。次に、得られたPCR産物をNcol/BamHIで消化し、二重消化したペリプラズム発現ベクターpAFにクローニングした。プラスミドをE.coli TG1中に電気穿孔し、0.2μg/mlのアンヒドロテトラサイクリンでタンパク質発現を誘導した。細菌培養物を、ロータリーシェーカー中、25℃で一晩成長させ、フィノマー−Fc融合タンパク質を、単一プロテインA親和性クロマトグラフィー工程のペリプラズム分画から精製した。20μlのタンパク質溶液を用いて、SDS PAGE(インビトロジェン(Invitrogen))分析を実施した。
【0071】
c)サイズ排除クロマトグラフィー(SEC)
サイズ排除クロマトグラフィー(SEC)を、AEKTA FPLCシステムで、スーパーデックス75カラム(10/300)またはスーパーデックス75ショートカラム(5/150)(GEヘルスケア(Healthcare))を用いて実施した。
【0072】
d)親和性測定
親和性測定は、バイアコア(BIAcore)3000装置(バイアコア)を用いて実施した。ビオチン化IL−17Aと単量体Fyn SH3由来IL−17A結合ポリペプチドとの間の相互作用分析、およびビオチン化IL−17AおよびE4−Fc(配列番号117)との間の相互作用分析には、ストレプトアビジンSAチップ(バイアコア(Biacore))を、それぞれ固定化した1300および510 RUビオチン化IL−17Aと共に使用した。ランニングバッファーは、PBS、0.1%NaN3および界面活性剤P20(バイアコア)であった。相互作用は、流速20ml/分で、種々の濃度のFyn SH3由来IL−17A結合ポリペプチドを注入して測定した。IL−17Aと2C1−Fc融合体との間、およびIL−17Aと(2C1)2−Fc融合体との間の相互作用分析のため、CM5チップ(バイアコア)を、2900 RUのヤギ抗ヒトIgG Fc特異的抗体(ジャクソン・イムノリサーチ(Jackson Immunoresearch))でコートした。ランニングバッファーは、HBS−EP(バイアコア)であった。相互作用は、約250〜275 RUのFc融合タンパク質を流速10μl/分で注入し、その後、種々の濃度のIL−17A(R&Dシステムズ(R&D Systems))を流速30μl/分で注入することによって測定した。相互作用の速度論的データ(個別のkon/koff)は全て、BIAエバリュエーション3.2RC1ソフトウェアを用いて評価した。
【0073】
e)結果
本発明の単量体Fyn SH3由来IL−17A結合ポリペプチドの発現収率は、振とうフラスコ中、非最適化条件下で、細菌培養物1リットル中60〜85mgであった。Fc融合タンパク質は、収率0.2〜0.4mg/l(表I)で発現した。Fc融合タンパク質の配列は、付記の通りの配列番号117〜119に列記する。
【0074】
【表1】

【0075】
図1は、表示された精製タンパク質のSDS PAGE分析を示す。
【0076】
サイズ排除クロマトグラフィー(SEC)プロファイルにより、全ての構築物が主として単一の単量体ピークとして溶出したことが実証された(図2参照)。Fyn SH3由来結合タンパク質についてのこれまでの研究で既に観察された通り(グラブロフスキ(Grabulovski)ら(2007年)JBC,282,3196−3204頁)、主要なピークは、約8kDaのタンパク質について予想されるものより遅く溶出した。本発明のFc融合タンパク質については、サイズ排除クロマトグラフィーによる第二の精製工程を、単回工程のタンパク質A−セファロース精製の後に実施して、図2e中、融合タンパク質E4−Fc(配列番号117)に示される通りの単量体タンパク質を得た。E4−Fc(配列番号117)はPBS中4℃で保存した場合、少なくとも40日間は安定であった。
【0077】
結合特性は、バイアコア(BIAcore)チップ上でのリアルタイム相互作用分析によって分析し(図3)、選択されたIL−17A結合ポリペプチドおよび融合タンパク質について、以下の解離定数(KD)が明らかになった:
【0078】
【表2】

【0079】
実施例3:IL−17A阻害細胞分析
IL−17Aは、線維芽細胞においてIL−6の産生を投与量依存的に誘導する(ヤオ(Yao)ら(1995年)Immunity,3,811−821頁)。表示したFyn SH3−誘導IL−17A結合ポリペプチドおよび融合タンパク質の阻害活性は、ヒト皮膚線維芽細胞を、種々の濃度のFyn SH3変異体またはヒトIL−17A受容体Fcキメラの非存在または存在下、組み換えIL−17Aで刺激することによって試験した。刺激の24時間後に、細胞培養上澄を採取し、ELISAでIL−6について分析した。加えて、細胞が、IL−17A単独、またはIL−17Aおよび本発明のFyn SH3由来阻害IL−17A結合ポリペプチド、またはIL−17AおよびIL−17R−Fcキメラと共に24時間インキュベーションした後に、生存していたことを実証するために、XTT試薬を用いて比色試験を実施した。生存し、代謝的に活性な細胞のみが、テトラゾリウム塩XTTを、橙色化合物であるホルマザンに還元する能力がある(スクディエロ(Scudiero)ら(1988年),Cancer Res.48,4827−4833頁)。
【0080】
方法
エンドトキシンを除去するため、表示したタンパク質溶液を、アクロディスク・ムスタング(Acrodisc Mustang)Eメンブレン(VWR)で3回濾過した。濾過の後、本発明の阻害性Fyn SH3由来IL−17A結合ポリペプチドを含有するタンパク質溶液のエンドトキシンレベルは、カブトガニ血球抽出物(LAL)試験(パイロジェント(PYROGENT)単一検査ゲル凝集LAL分析(ロンザ(Lonza)))によって定量したところ、0.1EU/ml未満であった。
【0081】
約1x104個の正常ヒト皮膚線維芽細胞(プロモセル(PromoCell),NHDF−c, C12300)を含有する400μlの細胞懸濁液を各ウェルに分配し(24穴プレート、NuncまたはTPP)、37℃で24時間培養した(培地:線維芽細胞成長培地C−23010、プロモセル)。上澄を吸引し、種々の濃度の本発明のFyn SH3由来IL−17A結合ポリペプチドまたはIL−17A受容体Fcキメラ(RnDシステムズ(Systems))を、IL−17A(RnDシステムズ)含有培地(最終濃度50ng/ml)と混合した後、350μlの対応する溶液を各ウェルに添加した(阻害剤溶液とIL−17A含有培地の混合比は1:3であった)。陽性対照として、PBSをIL−17A含有培地(「阻害剤なし」)と1:3の割合で混合し、陰性対照として、PBSを培地のみ(「IL−17Aなし」)と1:3の割合で混合した。IL−17A依存性IL−6産生を定量するため、IL−17A含有培地を使用し(IL−17Aの最終濃度:10、25および50ng/ml)、PBSと3:1の比で混合した。37℃で24時間インキュベーションした後、上澄を吸引し、IL−6濃度をELISAによりメーカーの使用説明書に従って定量した(IL−6 ELISAキット、R&Dシステムズ(Systems))。上澄の吸引の直後に、XTT含有培地を添加し(細胞増殖(Cell Proliferation)キットII、ロシュ(Roche))、メーカーの使用説明書に従って、細胞生存性を定量した。
【0082】
IL−17A阻害率は、以下の式を用いて定量した:
【0083】
【化1】

【0084】
結果
正常ヒト皮膚線維芽細胞(NHDF)をIL−17Aと種々の濃度でインキュベーションした。図4(a)は、IL−6のIL−17A用量依存性誘導を示す。次の工程において、NHDF細胞を、IL−17A(50ng/ml)および種々の濃度の表示した本発明のFyn SH3誘導IL−17A結合ポリペプチドまたはIL−17A受容体−Fcキメラと共にインキュベーションした(図4(b))。クローン2C1(配列番号107)およびE4(配列番号57)の両者がIL−17A誘導IL−6産生を阻害し、IC50値はそれぞれ約1nMおよび6nMであったことが観察された。IL−17A受容体−Fcキメラは、IC50値が500pMであることが報告されている(R&Dシステムズ(Systems))。この実験では、約1nMの値が得られた。この分析は、3つの独立した実験の代表的な結果を表す。IL−6産生の阻害が特異的なIL−17A中和の結果であることをさらに実証するために、細胞を、IL−17Aの存在下で結合特異性に無関係のタンパク質としてFyn SH3wtドメイン(グラブロフスキ(Grabulovski)ら(2007年)JBC,282,3196−3204頁)と共にインキュベーションした(図4(c))。予想した通り、IL−6産生の阻害は観察されず、一方、クローン2C1(配列番号107)はIL−17A−誘導IL−6産生を阻害する能力があった。図4(d)にXTT分析を示すが、これは、全ての細胞が、本発明のFyn SH3−由来IL−17A結合ポリペプチド(濃度750nM)およびIL−17受容体(10nM)と共に24時間インキュベーションした後、生存能力があったことを確認する。
【0085】
実施例4:安定性
治療的適応を目的とする全ての生体化合物の極めて重要な様相は、溶液中に保管した場合の、その安定性および凝集耐性である。本発明のFyn SH3由来IL−17A結合ポリペプチドは、単純なリン酸緩衝生理食塩水中、4℃または−20℃で少なくとも6ヶ月間保管した際に安定であることが判っていることから、特に有用な薬剤および診断薬候補である。
【0086】
方法
本発明のIL−17A結合ポリペプチドのタンパク質溶液を、精製後、4℃または−20℃で6ヶ月間保管した。タンパク質の安定性および凝集状態を分析するため、タンパク質溶液を濾過し(ミレックス(Millex)GP、0.22μm、ミリポア(Millipore))、サイズ排除クロマトグラフィー(SEC)を、AEKTA FPLCシステムでスーパーデックス75ショートカラム(5/150)(GEヘルスケア(Healthcare))を用いて実施した。
【0087】
結果
Fyn SH3由来IL−17A結合ポリペプチドG3(配列番号34)が発現収率123mg/Lで産生され、サイズ排除クロマトグラフィーカラムから主に単一のピークとして溶出された(図5参照)。
【0088】
G3(配列番号34)の安定性および凝集抵抗を、タンパク質をPBS中、4℃または−20℃で保管して評価した。6ヵ月後、タンパク質の状態を、サイズ排除クロマトグラフィーによって調べた。測定により、凝集または分解の兆候は全く見られなかった。6ヶ月間の貯蔵後の溶出プロファイルを図6に示す。
【0089】
実施例5:インビボ半減期
本発明の融合タンパク質E4−Fc(配列番号117)のインビボ半減期を、ELISAにより、単回静注後の種々の時点でマウス血清中のE4−Fc(配列番号117)濃度を測定することによって定量した。
【0090】
方法
E4−Fc(配列番号117)のクローニングおよび発現を実施例2に記載する。E4−Fc(配列番号117)の3.3μM(0.22mg/ml)溶液200μlを5匹のマウス(C57BL/6、チャールス・リバー(Charles River))に静注射した。7分後、20分後、1、2、4、8、24および48時間後に、約20μlの血液を伏在静脈からキャピラリーであるマイクロベッテ(Microvette)CB300(サーステッド(Sarstedt))で採取した。血液サンプルを9500xgで10分間遠心分離し、ELISAを実施するまで、血清を−20℃で保管した。濃度が分っているE4−Fc(配列番号117)の希釈系列を用いて、血清中のE4−Fc(配列番号117)濃度をELISAによって定量した:50μlのビオチン化IL−17A(30nM)(R&Dシステムズ(Systems)、メーカーの使用説明書に従って、NHS−PEO4−ビオチン(ピアス(Pierce))を用いてビオチン化)を、ストレプトアビミンでコートしたウェル(リアクチバインド(Reactibind)、ピアス)に添加し、PBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros)、スイス)でブロッキングした後、45μlのPBS、4%ミルクおよび5μlの血清サンプルを添加した。1時間インキュベーションし、洗浄した後、結合したFc融合タンパク質をプロテインA−HRP複合体(シグマ(Sigma))で検出した。ペルオキシダーゼ活性は、クアンタレッドを強化した化学蛍光HRP基質(ピアス)を添加することによって検出した。蛍光強度は、544nm(励起)および590nm(発光)で5〜10分後に測定した。種々の時点で血清中(各時点n≧3、最終時点:n=1を除く)定量したE4−Fc(配列番号117)濃度および得られた排出相の傾きk(片対数目盛りにプロット)から、E4−Fc(配列番号117)の半減期を、式t1/2=ln2/−kを用いて計算した。
【0091】
結果
排出相(β相、最後の4回の測定時点)から計算した、本発明の融合タンパク質E4−Fc(配列番号117)の半減期は、50.6時間であった(図7参照)。
【0092】
実施例6:IL−17A結合ポリペプチドおよび融合タンパク質の結合特異性を定量するためのELISA
方法
標的タンパク質である、ヒトIL−17F(R&Dシステムズ(Systems))、マウスIL−17A(R&Dシステムズ)、ヒトTNFα(サーモ・サイエンティフィック(Thermo Scientific))、ヒトIL−6(R&Dシステムズ)、ウシ血清アルブミン(シグマ(Sigma))およびオボアルブミン(シグマ)を、マキシソープ(MaxiSorp)プレート(ヌンク(Nunc))に一晩コートした(濃度5μg/mlの各標的を100μl)。ウェルをPBSで3回洗浄し、200μlのPBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros))でブロッキングし、PBSでの洗浄工程(上記の通り)の後、50μlの2C1(配列番号107)を最終濃度50nMで、50μlの抗myc抗体(9E10、自家製造、OD=2の貯蔵溶液をPBS、2%ミルクで1:250に希釈)と共にウェルに添加した。インキュベーションした後、ウェルをPBSで3回洗浄し、PBS、2%ミルクで1:1000に希釈した、100μlの抗マウスHRP免疫抱合体(シグマ)をウェルに添加した。96穴プレートを室温で1時間インキュベーションした後、PBS、0.1%Tweenで3回洗浄し、その後、PBSのみで3回洗浄した。100μlのBMブルーPOD基質(ロシュ)を加えて比色検出を行い、60μlの1M H2SO4で反応を停止した。
【0093】
結果
クローン2C1(配列番号107)は高特異性でヒトIL−17Aに結合し、ELISAで示した通り、他の被験タンパク質のいずれとも交差反応しなかった(図8)。IL−17Fについてバックグラウンド上に小さなシグナルが観察されたが、2C1がIL−17Fをコートしたバイアコア(BIAcore)チップにプローブ結合した場合、検出可能な結合は測定されなかった(データは示さず)。
【0094】
実施例7:本発明のFyn SH3由来ポリペプチドは、ヒトおよびカニクリザルIL−17Aに特異的および高親和性で結合する
方法
a)特異性
本発明のIL−17A結合ポリペプチドの結合特異性を定量するため、以下の標的タンパク質を使用した(実施例6より多い標的タンパク質)。
- ヒトIL−17A(R&Dシステムズ(Systems))
- ヒトIL−17B(ペプロテック(Peprotech))
- ヒトIL−17C(R&Dシステムズ)
- ヒトIL−17D(ペプロテック)
- ヒトIL−17E(ペプロテック)
- ヒトIL−17F(アブド・セロテック(Abd Serotec))
- マウスIL−17A(R&Dシステムズ)
- ラットIL−17A(アクロン・バイオテック(Akron Biotech))
- イヌIL−17A(R&Dシステムズ)
- カニクイザル(macaca fascicularis)IL−17A(E.Coliにおいて自家製造、単一ペプチドなし、C−末端グリシン残基の後、ヘキサヒスチジンタグを用いる、抱合体からリフォールディング、配列番号129)
- フィブロネクチンのエクストラドメインB(自家製造、E.coli;カルネモッラ(Carnemolla)ら(1996年)Int J Cancer,68(3),397−405頁参照)
- ヒトIL−6(R&Dシステムズ)
- ヒトTNFα(サーモ・サイエンティフィック(Thermo Scientific))
- オボアルブミン(シグマ(Sigma))
- BSA(シグマ)
【0095】
標的タンパク質を、マキシソープ(MaxiSorp)(ヌンク(Nunc))上に一晩コートした(濃度10μg/mlの各標的100μl)。ウェルをPBSで3回洗浄し、200μlのPBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros))で室温で1時間ブロッキングし、その後PBSでの洗浄工程(上記の通り)の後、50μlの本発明のFyn SH3由来ポリペプチド2C1(配列番号107)を最終濃度80nMで、50μlの抗myc抗体9E10(自家製造、OD=2の貯蔵溶液をPBS、2%ミルクで1:250に希釈)と共にセルに添加した。インキュベーションした後、ウェルをPBSで3回洗浄し、PBS、2%ミルクで1:1000に希釈した、100μlの抗マウスHRP免疫抱合体(シグマ(Sigma))をウェルに添加した。96穴プレートを室温で1時間インキュベーションした後、0.1%TweenのPBSで3回洗浄し、その後、PBSのみで3回洗浄した。100μlのBMブルーPOD基質(ロシュ(Roche))を加えることによって比色検出を行い、60μlの1M H2SO4で反応を停止した。
【0096】
b)カニクイザルIL−17Aに対する親和性の測定
親和性測定は、バイアコア(BIAcore)3000装置(バイアコア)を用いて実施した。カニクイザルIL−17Aと本発明のFyn SH3由来ポリペプチド2C1(配列番号107)との間の相互作用分析のため、CM5チップ(バイアコア)を6900 RUのカニクイザルIL−17Aでコートした。ランニングバッファーはHBS−EP(バイアコア)であった。相互作用は、流速20μl/分で種々の濃度の本発明のFyn SH3由来IL−17A結合ポリペプチド2C1(配列番号107)を注入することによって測定した。相互作用の速度論的データ(個別のkon/koff)は全て、BIAエバリュエーション3.2RC1ソフトウェアを用いて評価した。
【0097】
結果
本発明のFyn SH3由来ポリペプチド2C1(配列番号107)は、ヒトおよびカニクイザルIL−17Aに高特異性で結合し、ELISAで示した通り、他の被験タンパク質のいずれとも交差反応しなかった(図9)。
【0098】
本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)のカニクイザルIL−17Aに対する親和性をE.coli(抱合体からリフォールディング)で産生されたカニクイザルIL−17Aを用いて、バイアコア(Biacore)で測定した。2C1は、KD 11 nMでカニクイザルIL−17Aに結合したことが分った(図10)。
【0099】
実施例8:哺乳類細胞における、ヒトIgG1抗体のFc部分および修飾Fc部分に融合した本発明のFyn SH3由来ポリペプチドの発現
本発明のFyn SH3由来ポリペプチド2C1(配列番号107)を、IgG1のFc部分(2C1−Fc、配列番号130)に遺伝子的に融合させ、HEK EBNA細胞で発現させた。本発明のFyn SH3由来ポリペプチド2C1(配列番号107)は、変異体L234A(アミノ酸234位のロイシンに代わりアラニン)およびL235Aを含む、ヒトIgG1の修飾Fc部分への遺伝的融合としてもクローニングし、HEK EBNA細胞で発現した(2C1−Fc(LALA)、配列番号131)。さらに、本発明のFyn SH3由来ポリペプチドとFc部分との間のリンカーの長さが異なる、2C1−Fc(LALA)融合タンパク質の以下の4つの変異体を産生した:
【0100】
・(配列番号132)“2C1−m5E−Fc(LALA)”;5個のアミノ酸によるヒンジ領域の伸長:EPKSSリンカー
・(配列番号133)“2C1−m5−Fc(LALA)”;5個のアミノ酸の伸長:GGGGSリンカー
・(配列番号134)“2C1−m10−Fc(LALA)”;10個のアミノ酸の伸長:(GGGGS)2リンカー
・(配列番号135)“2C1−m15E−Fc(LALA)”;15個のアミノ酸の伸長:(GGGGS)3リンカー
【0101】
方法
“2C1−Fc”のクローニング:ヒトIgG1抗体のFc部分に融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)、(配列番号130):クローン2C1(配列番号107)をコードする遺伝子をテンプレートとして用い、プライマーSB3(5’CGA ATT CGG GAG TGA CAC TCT TTG TGG CCC 3’、配列番号136)およびSB4(5’GAA GAT CTC TGG ATA GAG TCA ACT GGA GCC 3’、配列番号137)を用いて増幅して、制限部位EcoRIおよびBgIIIを導入した。得られたPCR産物を、EcoRIおよびBgIIIで消化し、先に二重消化したpFUSE−hlgG1−Fc2ベクター(インビボジェン(Invivogen))中にクローニングした。このFc融合体をpCEP4ベクター(インビトロジェン(Invitrogen))中にクローニングするため、2C1−Fc融合体をコードする遺伝子を含有する、得られたpFUSEベクターをテンプレートとして用い、プライマーSB5(5’CCC AAG CTT GGG ATG GGC TAC AGG ATG CAA CTC CTG TC 3’、配列番号138)およびSB6(5’CGG GAT CCT CAT TTA CCC GGA GAC AGG GAG 3’、配列番号139)を用いて増幅して、HindIIIおよびBamHI制限部位を導入した。HindIII/BamHIで消化した後、挿入物を、先に二重消化したpCEP4ベクターに連結して、配列番号130の遺伝情報を含有するプラスミドを得た。
【0102】
“2C1−Fc(LALA)”のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)、(配列番号131を得る):
2C1−Fc(配列番号130)の遺伝情報を含有する上記のプラスミドを2つのPCR反応のテンプレートとして使用した。第一の反応では、プライマーSB5およびSB7(5’ACT GAC GGT CCC CCC GCG GCT TCA GGT GCT GGG CAC 3’、配列番号140)を使用した。第二のPCRでは、プライマーSB8(5’GCC GCG GGG GGA CCG TCA GTC TTC CTC TTC CC 3’、配列番号141)およびSB6を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0103】
“2C1−m5E−Fc(LALA)”(配列番号132)のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に5個のアミノ酸のリンカーEPKSSで融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)
2C1−Fc(LALA)(配列番号131)の遺伝情報を含有する上記のプラスミドを、2回のPCRにテンプレートとして使用した。第一の反応では、プライマーSB5および“Ba_2C1_R_EPKSS”(5’GCT GCT TTT CGG TTC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号142)を使用した。第二の反応では、プライマーSB6および“Ba_Hinge_F_EPKSS”(5’GAA CCG AAA AGC AGC GAC AAA ACT CAC ACA TGC CCA CCG 3’、配列番号143)を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0104】
“2C1−m5−Fc(LALA)”(配列番号133)のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に5個のアミノ酸のリンカーGGGGSで融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)
2C1−Fc(LALA)(配列番号131)の遺伝情報を含有する上記のプラスミドを、2回のPCRにテンプレートとして使用した。第一の反応では、プライマーSB5および47c.fo(5’TGA ACC GCC TCC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号144)を使用した。第二の反応では、プライマーSB6および“Ba_Hinge_F_5aaGS−リンカー”(5’GGT GGA GGC GGT TCA GAC AAA ACT CAC ACA TGC CCA CCG 3’、配列番号145)を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0105】
“2C1−m10−Fc(LALA)”(配列番号134)のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に10個のアミノ酸のリンカー(GGGGS)2で融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)
2C1−Fc(LALA)(配列番号131)の遺伝情報を含有する上記のプラスミドを、2回のPCRにテンプレートとして使用した。第一の反応では、プライマーSB5および47b.fo(5’AGA GCC ACC TCC GCC TGA ACC GCC TCC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号146)を使用した。第二の反応では、プライマーSB6および“Ba_Hinge_F_10aaGS−リンカー”(5’GGT GGA GGC GGT TCA GGC GGA GGT GGC TCT GAC AAA ACT CAC ACA TGC CCA CCG 3’、配列番号147)を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0106】
“2C1−m15−Fc(LALA)”(配列番号135)のクローニング:ヒトIgG1抗体の修飾Fc部分(L234A、L235A)に15個のアミノ酸のリンカー(GGGGS)3で融合した、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)
2C1−Fc(LALA)(配列番号131)の遺伝情報を含有する上記のプラスミドを、2回のPCRにテンプレートとして使用した。第一の反応では、プライマーSB5および47.fo.corr(5’TGA TCC GCC ACC GCC AGA GCC ACC TCC GCC TGA ACC GCC TCC ACC CTG GAT AGA GTC AAC TGG AGC CAC 3’、配列番号148)を使用した。第二の反応では、プライマーSB6および“Ba_Hinge_F_15aaGS−リンカー”(5’GGT GGA GGC GGT TCA GGC GGA GGT GGC TCT GGC GGT GGC GGA TCA GAC AAA ACT CAC ACA TGC CCA CCG 3’、配列番号149)を使用した。テンプレートとして両断片を有するPCRアセンブリを実施し、得られたPCR産物をBamHIおよびHindIIIで消化し、上述の通り、消化したpCEP4ベクターと連結した。
【0107】
この融合タンパク質の発現には、対応するプラスミドを、エンドトキシンを含まないメガプレップ(Megaprep)キット(キアゲン(Qiagen))を用いて精製し、HEK EBNA細胞(ATCC No CRL−10852)の一過性のトランスフェクションに使用した。HEK EBNA細胞は、トランスフェクションの24時間前に30%のコンフルエンスで播種した。培地は、トランスフェクションの直前に、DMEM/5% FCS/ペンストレップ(penstrep)(インビトロジェン(Invitrogen))で置換した。60μgのDNAを使用して、150cm2の接着細胞をトランスフェクションした。DNAおよびPEI(25kDa、ポリサイエンシーズ(Polysciences))を1:3の割合で混合し、10秒間ボルテックスした。その後、DNA/PEI混合物を室温で10分間インキュベーションした後、HEK EBNA細胞に加えた。24時間後、培地をCD−CHO/HT/L−グルタミン/ペンストレップ(インビトロジェン)で置換し、5%CO2と共に37℃でインキュベーションした。96時間後に細胞培養物上澄を採取した。
【0108】
タンパク質精製のため、細胞培養物上澄を、プロテインA−セファロースアフィニティーカラムに適用した。その後、カラムをPBSで洗浄し、pH2.7の0.1Mグリシンを用いてタンパク質を溶出した。その後溶出されたタンパク質をPBS中に透析した。要すれば、エンドトキシンの除去のため、トリトン(Triton)−X114を用いた第二の精製工程を実施した(マガリャイス(Magalhaes)ら(2007年)J Pharm Pharmaceut Sci,10(3),388−404頁)。
【0109】
結果
本発明のFyn SH3由来Fc融合体を発現および精製することができた。図11は、Fc融合タンパク質のSDS PAGE分析を示す。
【0110】
実施例9:本発明のFyn SH3由来ポリペプチドは、ヒト血清中で安定である
タンパク質薬は、患者に薬力学的効果を与え得るため、一定期間、血清中で安定であるべきである。この実施例では、2C1−Fc(配列番号130)の血清安定性を試験する。
【0111】
方法
10μg/mlの2C1−Fc(配列番号130)を含有するヒト血清(シグマ(Sigma))の3mlの溶液を調製し、37℃のインキュベーター中に置いた。指示した時点で200μlのサンプルを除き、実験の終了まで−20℃に凍結させた。5日後、回収したサンプルでELISAを実施したが、対照標準としてPBS中4℃で保管した2C1−Fcサンプル(配列番号130)を使用した。
【0112】
ELISAを実施するため、IL−17A(R&Dシステムズ(Systems))をマキシソープ(MaxiSorp)プレート(ヌンク(Nunc))上に一晩コートした(5μg/mlを100μl)。ウェルをPBSで3回洗浄し、200μlのPBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros))でブロッキングし、PBSでの洗浄工程(上記の通り)の後、PBS、2%ミルクで希釈した2C1−Fc(配列番号130)(指示した濃度で)を含む、100μlの試験サンプルを加えた。インキュベーションした後、ウェルをPBSで3回洗浄し、PBS、2%ミルクで1:1000に希釈した、100μlのプロテインA−HRP(シグマ(Sigma))を添加した。96穴プレートを室温で1時間インキュベーションした後、PBS、0.1%Tweenで3回洗浄し、その後、PBSのみで3回洗浄した。100μlのBMブルーPOD基質(ロシュ(Roche))を加えて比色検出を行い、60μlの1M H2SO4で反応を停止した。
【0113】
結果
ヒト血清中、37℃で5日間の保管期間の後、2C1−Fc(配列番号130)は、PBS中4℃で保管した2C1−Fc(配列番号130)と同様に、実質的にその標的であるIL−17Aに結合することができたが、このことは、2C1−Fc(配列番号130)がヒト血清中37℃で安定であることを示唆する(図12)。
【0114】
実施例10:本発明のFyn SH3由来ポリペプチドはインビトロでIL−17Aを阻害する
この分析では、本発明の指示したFyn SH3由来ポリペプチドについて、インビトロでIL−17Aを阻害する能力を試験した。細胞分析は、本発明の実施例3に記載した細胞分析と同様であり、主な違いは、IL−17Aを1ng/mlの低濃度(実施例3の50ng/mlと比較して)でTNFαと共に用いることである。
【0115】
方法
試験した本発明のFyn−SH3由来IL−17A結合ポリペプチドのエンドトキシンレベルは、カブトガニ血球抽出物(LAL)試験(パイロジェント(PYROGENT)単一検査ゲル凝集LAL(ロンザ(Lonza)))によって測定したところ、0.1EU/ml未満であった。
【0116】
正常ヒト皮膚線維芽細胞(NHDF,プロモセル社(PromoCell Inc.),NHDF−c,C12300)をIL−17A阻害細胞分析に使用する。ヒトIL−17F(R&Dシステムズ(Systems))を、ヒト腫瘍壊死因子α(TNFα(サーモ・フィッシャー・サイエンティフィック(Thermo Fisher Scientific))と組み合わせて細胞培養培地に添加すると、用量依存性のNHDF細胞によるIL−6産生を引き起こす。細胞培養培地(プロモセル(PromoCell),C−23010)中に放出されるIL−6を、市販のELISAキット(R&Dシステムズ、デュオセット(DuoSet)ELISAシステムキット(DY206))を用いたELISAによって、細胞培養物上澄中で定量する。
【0117】
104個の正常ヒト皮膚線維芽細胞(プロモセル(PromoCell),NHDF−c,C12300)を各ウェルに分配し(24穴プレート、ヌンク(Nunc)またはTPP)、37℃で24時間培養した(培地:線維芽細胞成長培地C−23010、プロモセル)。上澄を吸引し、種々の濃度の本発明のFyn SH3由来IL−17A結合ポリペプチドまたはIL−17A受容体Fcキメラ(RnDシステムズ(Systems))を、IL−17A(RnDシステムズ)およびTNFα(サーモ・サイエンティフィック(Thermo Scientific))含有培地(最終IL−17A濃度1ng/mlおよび最終TNFα濃度50pg/ml)と混合した後、三重に、350μlの対応する溶液を各ウェルに添加した(阻害剤溶液とサイトカイン含有培地の混合比は1:23であった)。対照のウェルとしては、Fyn−SH3由来ポリペプチドを用いない(PBSのみ)インキュベーション、IL−17Aのみ、TNFαのみ、および培地のみのインキュベーションを用いた。37℃で24時間インキュベーションした後、上澄を吸引し、ELISA吸光度(IL−6濃度に相関)を、メーカーの使用説明書に従って定量した(IL−6 ELISAキット、R&Dシステムズ(Systems))。
【0118】
結果
NHDF細胞を、一定の濃度のIL−17A(1ng/ml)およびTNFα(50pg/ml)、並びに種々の濃度の市販のIL−17A受容体Fcキメラまたは種々の濃度の以下の本発明のFyn SH3由来ポリペプチドと共にインキュベーションした:
- 2C1(配列番号107)
- 2C1−Fc(配列番号130)
- 2C1−Fc(LALA)(配列番号131)
- 2C1−m5E(LALA)(配列番号132)
- 2C1−m5−Fc(LALA)(配列番号133)
- 2C1−m10−Fc(LALA)(配列番号134)
- 2C1−m15−Fc(LALA)(配列番号135)
【0119】
表IIIは、本発明の指示したFyn SH3由来ポリペプチドを用いて実施した、いくつかの細胞分析より得られたIC50値の平均を示す。最良のIC50値(0.11nM)は、2C1−m15−Fc(LALA)(配列番号135)を用いて得られた。
【0120】
【表3】

【0121】
実施例11:2C1−Fc(LALA)(配列番号131)のインビボ半減期
本発明の融合タンパク質2C1−Fc(LALA)(配列番号131)のインビボの半減期を、単回静注後の種々の時点でマウス血清中の2C1−Fc(LALA)(配列番号131)の濃度を測定することにより定量した。
【0122】
方法
2C1−Fc(LALA)(配列番号131)溶液(0.2mg/ml)を、5匹のマウス(C57BL/6、チャールス・リバー(Charles River))に、各マウス200μlを静注した。指示した時点で、約20μlの血液を伏在静脈からキャピラリーであるマイクロベッテ(Microvette)CB300(サーステッド(Sarstedt))で採取した。血液サンプルを9500xgで10分間遠心分離し、ELISA分析を実施するまで、血清を−20℃で保管した。濃度が分っている2C1−Fc(LALA)(配列番号131)希釈系列を用いて、2C1−Fc(LALA)(配列番号131)の血清中の濃度をELISAによって定量した:50μlのビオチン化IL−17A(30nM)(R&Dシステムズ(Systems)、メーカーの使用説明書に従って、NHS−PEO4−ビオチン(ピアス(Pierce))を用いてビオチン化)を、ストレプトアビミンでコートしたウェル(リアクチバインド(Reactibind)、ピアス)に添加し、PBS、4%ミルク(ラピライト(Rapilait)、ミグロス(Migros)、スイス)でブロッキングした後、45μlのPBS、4%ミルクおよび5μlの血清サンプルを添加した。1時間インキュベーションし、洗浄した後、結合したFc融合タンパク質をプロテインA−HRP複合体(シグマ(Sigma))で検出した。ペルオキシダーゼ活性は、クアンタレッド(QuantaRed)を強化した化学蛍光HRP基質(ピアス)を添加することによって検出した。蛍光強度は、544nm(励起)および590nm(発光)で5〜10分後に測定した。種々の時点で血清中(各時点でマウス数n=5)定量した2C1−Fc(LALA)(配列番号131)の濃度および得られた排出相の傾きk(片対数目盛りにプロット)から、2C1−Fc(LALA)(配列番号131)の半減期を、式t1/2=ln2/−kを用いて計算した。
【0123】
結果
排出相(β相、最後から4回目の時点)から計算された、本発明の融合タンパク質2C1−Fc(LALA)(配列番号131)の半減期は、53時間であった(図13参照)。
【0124】
実施例12 本発明のFyn SH3由来ポリペプチドは、インビボでヒトIL−17Aを中和する
ヒトIL−17Aは、マウスIL−17受容体に結合および刺激することができ、マウスKC(CXCL1)ケモカインの上昇およびその後の分泌を導く(アラン(Allan)B.ら(2007年)WO2007/070750,米国イーライ・リリー(Eli Lilly))。KC基礎レベルがおよそ100pg/mlであることと比較して、皮下IL−17A注射(3μg)の2時間後に観察されたKCレベルは、血清中、500および1000pg/mlの間であった。
【0125】
方法
a)本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)を用いる、インビボでのIL−17Aの中和
本発明のFyn SH3由来ポリペプチド2C1(配列番号107)(17μg)を、3μgのヒトIL−17A(R&Dシステムズ(Systems))とC57BL/6マウスに混注(皮下)し、注射の2時間後に、血液サンプルを、伏在静脈からキャピラリーであるマイクロベッテ(Microvette)CB300(サーステッド(Sarstedt))で採取した。血液サンプルを9500xgで10分間遠心分離し、ELISA分析を実施するまで、血清を−20℃で保管した。血清中のKCレベルは、市販のクアンティカイン(Quantikine)マウスCLCL1/KCキット(R&Dシステムズ)を用いて定量した。対照群は、結合特異性に関与しないタンパク質としてIL−17AおよびFyn SH3wtドメインを注射したマウス(グラブロフスキ(Grabulovski)ら(2007年)JBC,282,3196−3204頁参照)、PBSのみ、IL−17Aのみ、本発明のFyn SH3由来ポリペプチド2C1(配列番号107)のみを注射したマウス、またはFyn SH3wtタンパク質のみを投与したマウスであった。
【0126】
b)2C1−Fc融合体(配列番号130)を用いたインビボの中和:
本発明のFyn SH3由来ポリペプチド2C1−Fc(配列番号130)(44μg/マウス)を、C57BL/6マウスに静注した。20〜60分後、ヒトIL−17A(R&Dシステムズ(Systems))を3μg/マウス皮下注射し、IL−17A注射の2時間後に、血液サンプルを、伏在静脈からキャピラリーであるマイクロベッテ(Microvette)CB300(サーステッド(Sarstedt))で採取した。血液サンプルを9500xgで10分間遠心分離し、ELISA分析を実施するまで、血清を−20℃で保管した。血清中のKCレベルは、市販のクアンティカイン(Quantikine)マウスCLCL1/KCキット(R&Dシステムズ)を用いて定量した。対照群は、PBS(静注)およびIL−17A(皮下注)、PBSのみ(静注および皮下注)、および、本発明のFyn SH3由来ポリペプチド2C1−Fc(配列番号130)静注の後PBS(皮下注)したマウスであった。
【0127】
結果
ヒトIL−17Aをマウスに皮下注射した後、動物はKCと呼ばれるケモカインを過剰発現する。マウスの血清中、KCレベルの上昇はELISAによって測定し得る。本発明のFyn SH3由来ポリペプチドの注射により、KCのアップレギュレーションが阻止された。
【0128】
a)
IL−17Aおよび本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)をマウス(C57BL/6)に混注した。本発明の単量体Fyn SH3由来ポリペプチド2C1(配列番号107)の阻害特性のため、KCレベルはこの群において上昇せず、低いままであって、ほぼ基礎レベルと同等であった。KC産生の阻害が特異的IL−17A中和によることを実証するため、マウスにIL−17Aと野生型Fyn SH3ドメイン(IL−17Aに対する結合活性を有しない)を混注したが;これらのマウスでは、KCレベルはIL−17Aのみを投与した群と同程度の高さであった。図14は、この実験で得られた結果を示す。
【0129】
b)
この第二の急性炎症実験において、本発明のFyn SH3由来ポリペプチド2C1−Fc(配列番号130)を静注し、その後、IL−17Aを皮下注射した。上記a)の通り、本発明のFyn SH3由来ポリペプチドは、血清中のKCレベルのアップレギュレーションを阻止した。図15は、2C1−Fc(配列番号130)によるインビボでのIL−17Aの阻害を示す。
【特許請求の範囲】
【請求項1】
下記よりなる群から選択されるアミノ酸配列を含むポリペプチドであって、前記のポリペプチドがIL−17Aに結合する、ポリペプチド:
(i)(G/E)VTLFVALYDY−(X)a−D−(X)b−SFHKGEKF−(X)c−I−(X)d−G−(X)e−WW−(X)f−A−(X)g−SLTTG−(X)hGYIPSNYVAPVDSIQ (I)
式中、a〜hは0〜20であり、
好ましくは、aは1〜10であり、より好ましくは2〜8であり、最も好ましくは6であり;
好ましくは、bは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、cは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、dは1〜10であり、より好ましくは3〜9であり、最も好ましくは5または7であり;
好ましくは、eは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、fは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、gは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、hは0〜6であり、より好ましくは1〜3であり、最も好ましくは1または2である;
(ii)(i)に対して、少なくとも70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%のアミノ酸配列同一性を有する、アミノ酸配列;
(iii)(i)をコードする核酸の相補鎖に、好ましくはストリンジェントな条件下で、ハイブリダイズする核酸によってコードされる、アミノ酸配列;
(iv)少なくとも1つのアミノ酸の置換、付加および/または欠失によって誘導し得る、(i)〜(iii)の断片または機能性誘導体。
【請求項2】
請求項1に記載のポリペプチドであって、ヒトIL−17Aに対する特異的な結合親和性を有し、好ましくはKDが10−7〜10−12M、より好ましくは10−8〜10−12M、最も好ましくは10−12M未満のヒトIL−17Aに対する特異的な結合親和性を有する、ポリペプチド。
【請求項3】
配列番号1〜119よりなる群またはその機能性誘導体から選択される、請求項1または2のポリペプチド。
【請求項4】
薬学的および/または診断学的有効成分に融合した請求項1〜3のいずれか一項に記載のポリペプチドを含む融合タンパク質。
【請求項5】
前記の成分がサイトカインであり、好ましくは、IL−2、IL−12、TNF−α、IFNα、IFNβ、IFNγ、IL−10、IL−15、IL−24、GM−CSF、IL−3、IL−4、IL−5、IL−6、IL−7、IL−9、IL−11、IL−13、LIF、CD80、B70、TNFβ、LT−β、CD−40リガンド、Fasリガンド、TGF−β、IL−1αおよびIL−1βよりなる群から選択される、請求項4に記載の融合タンパク質。
【請求項6】
前記の成分が毒性化合物であり、好ましくは低分子有機化合物またはポリペプチドであり、より好ましくは、カリケアマイシン、マイタンシノイド、ネオカルチノスタチン、エスペラマイシン、ジネマイシン、ケダルシジン、マデュロペプチン、ドキソルビシン、ダウノルビシン、アウリスタチン、リシンA鎖、モデクシン、切断性緑膿菌外毒素A、ジフテリア毒素および組換えゲロニンよりなる群から選択される毒性化合物である、請求項4に記載の融合タンパク質。
【請求項7】
前記の成分がケモカインであり、好ましくは、IL−8、GROα、GROβ、GROγ、ENA−78、LDGF−PBP、GCP−2、PF4、Mig、IP−10、SDF−1α/β、BUNZO/STRC33、I−TAC、BLC/BCA−1、MIP−1α、MIP−1β、MDC、TECK、TARC、RANTES、HCC−1、HCC−4、DN−CK1、MIP−3α、MIP−3β、MCP−1−5、エオタキシン、エオタキシン−2、I−309、MPIF−1、6Ckine、CTACK、MEC、リンホタクチンおよびフラクタルカインよりなる群から選択される、請求項4に記載の融合タンパク質。
【請求項8】
前記の成分が蛍光色素であり、好ましくはアレクサフルオルまたはCy色素から選択される成分である、請求項4に記載の融合タンパク質。
【請求項9】
前記の成分が光増感剤であり、好ましくは光毒性赤色蛍光タンパク質キラーレッドまたはヘマトポルフィリンである、請求項4に記載の融合タンパク質。
【請求項10】
前記の成分が凝血促進因子であり、好ましくは組織因子である、請求項4に記載の融合タンパク質。
【請求項11】
前記の成分がプロドラッグ活性化酵素であり、好ましくは、カルボキシペプチダーゼ、グルクロニダーゼおよびグルコシダーゼよりなる群から選択される酵素である、請求項4に記載の融合タンパク質。
【請求項12】
前記の成分が、γ放射性アイソトープの群からの放射性核種、好ましくは99mTc、123I、111Inであるか、または、ポジトロン放射体の群からの放射性核種、好ましくは18F、64Cu、68Ga、86Y、124Iであるか、または、β放射体の群からの放射性核種、好ましくは131I、90Y、177Lu、67Cuであるか、または、α放射体の群からの放射性核種、好ましくは213Bi、211Atである、請求項4に記載の融合タンパク質。
【請求項13】
前記の成分が機能性Fcドメインであり、好ましくはヒト機能性Fcドメインであり、より好ましくは、請求項1〜3のいずれかの多量体ポリペプチド、好ましくは二量体ポリペプチドを含むヒト機能性Fcドメインである、請求項4に記載の融合タンパク質。
【請求項14】
さらに、血中半減期を調節する成分、好ましくは、ポリエチレングリコール(PEG)、免疫グロブリンおよびアルブミン結合ペプチドよりなる群から選択される成分を含む、請求項1〜13のいずれかに記載のポリペプチドまたは融合タンパク質。
【請求項15】
請求項1〜3のいずれかに記載のポリペプチドを含む、請求項4〜14のいずれか一項に記載の融合タンパク質。
【請求項16】
配列番号1〜119からよりなる群から選択されるポリペプチドまたはその機能性誘導体を含む、融合タンパク質。
【請求項17】
請求項1〜3のいずれかのポリペプチドの多量体、好ましくは二量体または三量体を含む、請求項1〜3のいずれかのポリペプチドまたは請求項4〜16のいずれかの融合タンパク質。
【請求項18】
下記を含む、単離され、精製された核酸:
(i)請求項1または2に記載のポリペプチドをコードする核酸、好ましくは
(G/E)VTLFVALYDY−(X)6−D−(X)−SFHKGEKF−(X)1−I−(X)5−7−G−(X)1−WW−(X)−A−(X)−SLTTG−(X)1−2−GYIPSNYVAPVDSIQ
をコードする核酸;
(ii)(i)の核酸配列に対して、少なくとも70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%の配列同一性をもつ配列を有する核酸;
(iii)(i)または(ii)の核酸の相補鎖にハイブリダイズする核酸;
(iv)核酸であって、前記の核酸が、(i)、(ii)または(iii)の核酸のうちの1つの置換、付加および/または欠失によって誘導し得る、核酸;
(v)(i)〜(iv)の核酸のいずれか1つの断片であって、請求項1または2に記載のポリペプチドをコードする(i)の核酸の相補鎖にハイブリダイズする、断片。
【請求項19】
請求項1〜17のいずれか一項に記載のポリペプチドまたは融合タンパク質をコードする、請求項18の核酸。
【請求項20】
前記の核酸がDNA、PNAまたはRNAである、請求項18または19の核酸。
【請求項21】
前記の核酸がプロモータに、好ましくは、T5プロモータ/lacオペレータエレメント、T7プロモータ/lacオペレータエレメントよりなる原核生物プロモータの群、またはhEF1−HTLV、CMV enh/hFerLプロモータよりなる真核生物プロモータの群から選択されるプロモータに、動作可能に連結されている、請求項18〜20のいずれか一項の核酸。
【請求項22】
組換えベクターであって、請求項18〜21のいずれか一項の核酸を含み、ベクターは好ましくは請求項1〜17のいずれか一項に記載のポリペプチドまたは融合タンパク質を生産ことができる、組換えベクター。
【請求項23】
請求項22に記載の組換えベクターであって、pQEベクター、pETベクター、pFUSEベクター、pUCベクター、YACベクター、ファージミドベクター、ファージベクター、レトロウイルス、アデノウイルス、アデノ随伴ウイルス等の遺伝子治療に使用されるベクターよりなる群から選択される、組換えベクター。
【請求項24】
前記請求項のいずれかに記載の核酸および/またはベクターを含む、宿主細胞。
【請求項25】
請求項1〜3のいずれか一項に記載のポリペプチドに特異的に結合する、抗体。
【請求項26】
請求項26に記載のモノクローナル抗体を発現する、ハイブリドーマ細胞株。
【請求項27】
前記請求項のいずれかに記載のポリペプチド若しくは融合タンパク質、核酸および/または組換えベクター、および薬学的に許容される担体を含んでいてもよい、医薬組成物。
【請求項28】
前記請求項のいずれかに記載のポリペプチド若しくは融合タンパク質、核酸および/または組換えベクターの、医薬の、好ましくは、IL−17A−およびTh17−関連疾患または医学的状態よりなる群から選択される疾患または医学的状態の治療および/または予防のための医薬の製造のための、使用。
【請求項29】
疾患または医学的状態が、炎症性、自己免疫および/または骨量減少関連疾患および医学的状態から選択される、請求項28の使用。
【請求項30】
疾患または医学的状態が、関節炎、好ましくは関節リウマチ、慢性進行性関節炎、反応性関節炎、乾癬性関節炎、腸疾患性関節炎および変形性関節炎、リウマチ性疾患、脊椎関節症、強直性脊椎炎、ライター症候群、過敏症(気道過敏症および皮膚過敏症の両者を含む)、アレルギー、全身性エリテマトーデス、炎症性筋疾患、多発性軟骨炎、浮腫性硬化症、ヴェーゲナー肉芽腫、皮膚筋炎、スティーブンス・ジョンソン症候群、慢性活動性肝炎、重症筋無力症、乾癬、特発性スプルー、自己免疫性炎症性腸疾患、潰瘍性大腸炎、クローン病、過敏性腸症候群、内分泌性眼症、グレーブス病、サルコイドーシス、多発性硬化症、原発性胆汁性肝硬変、若年性糖尿病(1型糖尿病)、自己免疫性血液疾患、溶血性貧血、再生不良性貧血、真性赤血球性貧血、特発性血小板減少症、ブドウ膜炎(前部および後部)、乾性角結膜炎、春季カタル、間質性肺線維症、糸宮体腎炎(ネフローゼ症候群を伴う、および、伴わず)、特発性ネフローゼ症候群または微小変化ネフロパシー、腫瘍、皮膚の炎症性疾患、角膜炎、筋炎、骨インプラントの弛緩、代謝異常、アテローム性動脈硬化症、糖尿病、および脂質異常症、骨量の減少、変形性関節症、骨粗しょう症、閉塞性または炎症性気道疾患の歯周病、喘息、気管支炎、塵肺、肺気腫、急性および超急性炎症反応、IL−17A介在性TNF−α関連疾患、急性感染症、敗血性ショック、内毒素性ショック、成人呼吸窮迫症候群、髄膜炎、肺炎、重度の熱傷、悪液質消耗症候群、脳卒中、ヘルペス性間質性角膜炎およびドライアイ疾患よりなる群から選択される、請求項28および30に記載の使用。
【請求項1】
下記よりなる群から選択されるアミノ酸配列を含むポリペプチドであって、前記のポリペプチドがIL−17Aに結合する、ポリペプチド:
(i)(G/E)VTLFVALYDY−(X)a−D−(X)b−SFHKGEKF−(X)c−I−(X)d−G−(X)e−WW−(X)f−A−(X)g−SLTTG−(X)hGYIPSNYVAPVDSIQ (I)
式中、a〜hは0〜20であり、
好ましくは、aは1〜10であり、より好ましくは2〜8であり、最も好ましくは6であり;
好ましくは、bは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、cは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、dは1〜10であり、より好ましくは3〜9であり、最も好ましくは5または7であり;
好ましくは、eは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、fは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、gは0〜5であり、より好ましくは1〜3であり、最も好ましくは1であり;
好ましくは、hは0〜6であり、より好ましくは1〜3であり、最も好ましくは1または2である;
(ii)(i)に対して、少なくとも70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%のアミノ酸配列同一性を有する、アミノ酸配列;
(iii)(i)をコードする核酸の相補鎖に、好ましくはストリンジェントな条件下で、ハイブリダイズする核酸によってコードされる、アミノ酸配列;
(iv)少なくとも1つのアミノ酸の置換、付加および/または欠失によって誘導し得る、(i)〜(iii)の断片または機能性誘導体。
【請求項2】
請求項1に記載のポリペプチドであって、ヒトIL−17Aに対する特異的な結合親和性を有し、好ましくはKDが10−7〜10−12M、より好ましくは10−8〜10−12M、最も好ましくは10−12M未満のヒトIL−17Aに対する特異的な結合親和性を有する、ポリペプチド。
【請求項3】
配列番号1〜119よりなる群またはその機能性誘導体から選択される、請求項1または2のポリペプチド。
【請求項4】
薬学的および/または診断学的有効成分に融合した請求項1〜3のいずれか一項に記載のポリペプチドを含む融合タンパク質。
【請求項5】
前記の成分がサイトカインであり、好ましくは、IL−2、IL−12、TNF−α、IFNα、IFNβ、IFNγ、IL−10、IL−15、IL−24、GM−CSF、IL−3、IL−4、IL−5、IL−6、IL−7、IL−9、IL−11、IL−13、LIF、CD80、B70、TNFβ、LT−β、CD−40リガンド、Fasリガンド、TGF−β、IL−1αおよびIL−1βよりなる群から選択される、請求項4に記載の融合タンパク質。
【請求項6】
前記の成分が毒性化合物であり、好ましくは低分子有機化合物またはポリペプチドであり、より好ましくは、カリケアマイシン、マイタンシノイド、ネオカルチノスタチン、エスペラマイシン、ジネマイシン、ケダルシジン、マデュロペプチン、ドキソルビシン、ダウノルビシン、アウリスタチン、リシンA鎖、モデクシン、切断性緑膿菌外毒素A、ジフテリア毒素および組換えゲロニンよりなる群から選択される毒性化合物である、請求項4に記載の融合タンパク質。
【請求項7】
前記の成分がケモカインであり、好ましくは、IL−8、GROα、GROβ、GROγ、ENA−78、LDGF−PBP、GCP−2、PF4、Mig、IP−10、SDF−1α/β、BUNZO/STRC33、I−TAC、BLC/BCA−1、MIP−1α、MIP−1β、MDC、TECK、TARC、RANTES、HCC−1、HCC−4、DN−CK1、MIP−3α、MIP−3β、MCP−1−5、エオタキシン、エオタキシン−2、I−309、MPIF−1、6Ckine、CTACK、MEC、リンホタクチンおよびフラクタルカインよりなる群から選択される、請求項4に記載の融合タンパク質。
【請求項8】
前記の成分が蛍光色素であり、好ましくはアレクサフルオルまたはCy色素から選択される成分である、請求項4に記載の融合タンパク質。
【請求項9】
前記の成分が光増感剤であり、好ましくは光毒性赤色蛍光タンパク質キラーレッドまたはヘマトポルフィリンである、請求項4に記載の融合タンパク質。
【請求項10】
前記の成分が凝血促進因子であり、好ましくは組織因子である、請求項4に記載の融合タンパク質。
【請求項11】
前記の成分がプロドラッグ活性化酵素であり、好ましくは、カルボキシペプチダーゼ、グルクロニダーゼおよびグルコシダーゼよりなる群から選択される酵素である、請求項4に記載の融合タンパク質。
【請求項12】
前記の成分が、γ放射性アイソトープの群からの放射性核種、好ましくは99mTc、123I、111Inであるか、または、ポジトロン放射体の群からの放射性核種、好ましくは18F、64Cu、68Ga、86Y、124Iであるか、または、β放射体の群からの放射性核種、好ましくは131I、90Y、177Lu、67Cuであるか、または、α放射体の群からの放射性核種、好ましくは213Bi、211Atである、請求項4に記載の融合タンパク質。
【請求項13】
前記の成分が機能性Fcドメインであり、好ましくはヒト機能性Fcドメインであり、より好ましくは、請求項1〜3のいずれかの多量体ポリペプチド、好ましくは二量体ポリペプチドを含むヒト機能性Fcドメインである、請求項4に記載の融合タンパク質。
【請求項14】
さらに、血中半減期を調節する成分、好ましくは、ポリエチレングリコール(PEG)、免疫グロブリンおよびアルブミン結合ペプチドよりなる群から選択される成分を含む、請求項1〜13のいずれかに記載のポリペプチドまたは融合タンパク質。
【請求項15】
請求項1〜3のいずれかに記載のポリペプチドを含む、請求項4〜14のいずれか一項に記載の融合タンパク質。
【請求項16】
配列番号1〜119からよりなる群から選択されるポリペプチドまたはその機能性誘導体を含む、融合タンパク質。
【請求項17】
請求項1〜3のいずれかのポリペプチドの多量体、好ましくは二量体または三量体を含む、請求項1〜3のいずれかのポリペプチドまたは請求項4〜16のいずれかの融合タンパク質。
【請求項18】
下記を含む、単離され、精製された核酸:
(i)請求項1または2に記載のポリペプチドをコードする核酸、好ましくは
(G/E)VTLFVALYDY−(X)6−D−(X)−SFHKGEKF−(X)1−I−(X)5−7−G−(X)1−WW−(X)−A−(X)−SLTTG−(X)1−2−GYIPSNYVAPVDSIQ
をコードする核酸;
(ii)(i)の核酸配列に対して、少なくとも70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%の配列同一性をもつ配列を有する核酸;
(iii)(i)または(ii)の核酸の相補鎖にハイブリダイズする核酸;
(iv)核酸であって、前記の核酸が、(i)、(ii)または(iii)の核酸のうちの1つの置換、付加および/または欠失によって誘導し得る、核酸;
(v)(i)〜(iv)の核酸のいずれか1つの断片であって、請求項1または2に記載のポリペプチドをコードする(i)の核酸の相補鎖にハイブリダイズする、断片。
【請求項19】
請求項1〜17のいずれか一項に記載のポリペプチドまたは融合タンパク質をコードする、請求項18の核酸。
【請求項20】
前記の核酸がDNA、PNAまたはRNAである、請求項18または19の核酸。
【請求項21】
前記の核酸がプロモータに、好ましくは、T5プロモータ/lacオペレータエレメント、T7プロモータ/lacオペレータエレメントよりなる原核生物プロモータの群、またはhEF1−HTLV、CMV enh/hFerLプロモータよりなる真核生物プロモータの群から選択されるプロモータに、動作可能に連結されている、請求項18〜20のいずれか一項の核酸。
【請求項22】
組換えベクターであって、請求項18〜21のいずれか一項の核酸を含み、ベクターは好ましくは請求項1〜17のいずれか一項に記載のポリペプチドまたは融合タンパク質を生産ことができる、組換えベクター。
【請求項23】
請求項22に記載の組換えベクターであって、pQEベクター、pETベクター、pFUSEベクター、pUCベクター、YACベクター、ファージミドベクター、ファージベクター、レトロウイルス、アデノウイルス、アデノ随伴ウイルス等の遺伝子治療に使用されるベクターよりなる群から選択される、組換えベクター。
【請求項24】
前記請求項のいずれかに記載の核酸および/またはベクターを含む、宿主細胞。
【請求項25】
請求項1〜3のいずれか一項に記載のポリペプチドに特異的に結合する、抗体。
【請求項26】
請求項26に記載のモノクローナル抗体を発現する、ハイブリドーマ細胞株。
【請求項27】
前記請求項のいずれかに記載のポリペプチド若しくは融合タンパク質、核酸および/または組換えベクター、および薬学的に許容される担体を含んでいてもよい、医薬組成物。
【請求項28】
前記請求項のいずれかに記載のポリペプチド若しくは融合タンパク質、核酸および/または組換えベクターの、医薬の、好ましくは、IL−17A−およびTh17−関連疾患または医学的状態よりなる群から選択される疾患または医学的状態の治療および/または予防のための医薬の製造のための、使用。
【請求項29】
疾患または医学的状態が、炎症性、自己免疫および/または骨量減少関連疾患および医学的状態から選択される、請求項28の使用。
【請求項30】
疾患または医学的状態が、関節炎、好ましくは関節リウマチ、慢性進行性関節炎、反応性関節炎、乾癬性関節炎、腸疾患性関節炎および変形性関節炎、リウマチ性疾患、脊椎関節症、強直性脊椎炎、ライター症候群、過敏症(気道過敏症および皮膚過敏症の両者を含む)、アレルギー、全身性エリテマトーデス、炎症性筋疾患、多発性軟骨炎、浮腫性硬化症、ヴェーゲナー肉芽腫、皮膚筋炎、スティーブンス・ジョンソン症候群、慢性活動性肝炎、重症筋無力症、乾癬、特発性スプルー、自己免疫性炎症性腸疾患、潰瘍性大腸炎、クローン病、過敏性腸症候群、内分泌性眼症、グレーブス病、サルコイドーシス、多発性硬化症、原発性胆汁性肝硬変、若年性糖尿病(1型糖尿病)、自己免疫性血液疾患、溶血性貧血、再生不良性貧血、真性赤血球性貧血、特発性血小板減少症、ブドウ膜炎(前部および後部)、乾性角結膜炎、春季カタル、間質性肺線維症、糸宮体腎炎(ネフローゼ症候群を伴う、および、伴わず)、特発性ネフローゼ症候群または微小変化ネフロパシー、腫瘍、皮膚の炎症性疾患、角膜炎、筋炎、骨インプラントの弛緩、代謝異常、アテローム性動脈硬化症、糖尿病、および脂質異常症、骨量の減少、変形性関節症、骨粗しょう症、閉塞性または炎症性気道疾患の歯周病、喘息、気管支炎、塵肺、肺気腫、急性および超急性炎症反応、IL−17A介在性TNF−α関連疾患、急性感染症、敗血性ショック、内毒素性ショック、成人呼吸窮迫症候群、髄膜炎、肺炎、重度の熱傷、悪液質消耗症候群、脳卒中、ヘルペス性間質性角膜炎およびドライアイ疾患よりなる群から選択される、請求項28および30に記載の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公表番号】特表2013−502910(P2013−502910A)
【公表日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2012−526035(P2012−526035)
【出願日】平成22年8月24日(2010.8.24)
【国際出願番号】PCT/EP2010/062314
【国際公開番号】WO2011/023685
【国際公開日】平成23年3月3日(2011.3.3)
【出願人】(512046936)コヴァジェン アクチェン ゲゼルシャフト (1)
【Fターム(参考)】
【公表日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願日】平成22年8月24日(2010.8.24)
【国際出願番号】PCT/EP2010/062314
【国際公開番号】WO2011/023685
【国際公開日】平成23年3月3日(2011.3.3)
【出願人】(512046936)コヴァジェン アクチェン ゲゼルシャフト (1)
【Fターム(参考)】
[ Back to top ]

