新規のウサギ抗体ヒト化方法及びヒト化ウサギ抗体
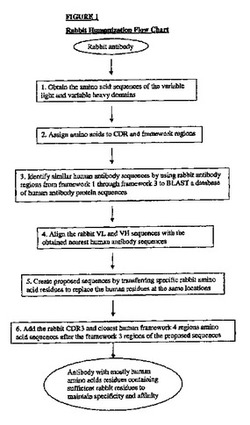
本発明は、ウサギの重鎖及び軽鎖可変領域をヒト化するための新規で改善された方法を提供する。得られるヒト化ウサギ重鎖及び軽鎖と抗体、並びに含有する抗体断片は、それらが親抗体の抗原結合親和性を保持するので、免疫療法及び免疫診断における使用に十分適していて、ヒト抗体配列に対するそのきわめて高いレベルの配列同一性に基づけば、ヒトにおいて本質的には非免疫原性であるはずである。本発明は、治療用のヒト化抗ヒトTNF−α及び抗ヒトIL−6抗体の製造のためのプロトコールを例示する。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
少なくとも1つの重鎖及び軽鎖ポリペプチドを含有するヒト化抗体又は抗体断片であって、ここで軽鎖ポリペプチドは、少なくとも以下:(i)FR1からFR3に至る中で選択されるアミノ酸残基の、所望の抗原への特異性を有するヒト化される親ウサギ抗体の軽鎖の対応するアミノ酸残基に対する(ヒト生殖細胞系配列のライブラリー中の他のヒト生殖細胞系配列に比べた)そのより大きな相同性(配列同一性パーセント)に基づいて該ライブラリーより選択されるヒト軽鎖生殖細胞系配列のCDR1及びCDR2領域が含まれる、FR1の第一残基からFR3の末端に至るアミノ酸残基;及び(ii)さらにここで、同じ親ウサギ抗体の軽鎖中の「選択性決定残基」に対応するCDR1及びCDR2中のCDR残基は、対応するウサギ選択性決定残基で置き換えられている;(iii)同じ親ウサギ抗体の全CDR3領域が含まれるアミノ酸残基;(iv)同じ親ウサギ抗体の軽鎖に含まれる対応するFR4領域に対するそのより大きな相同性(配列同一性)に基づいてヒト生殖細胞系配列のライブラリーから導かれる抗体軽鎖の全FR4領域が含まれるアミノ酸残基;及び(v)ここで、選択される相同的なヒトFR領域中のヒトFR1、FR2、FR3、及びFR4領域のFR残基の中で、対応するウサギFR残基で置換されているものは、ほとんど又はまったくないこと;を含有するヒト化軽鎖ポリペプチドである、前記ヒト化抗体又は抗体断片。
【請求項2】
親ウサギ抗体が、ヒト、ウイルス、又は細菌の抗原に特異的である、請求項1のヒト化抗体。
【請求項3】
ヒト抗原が、サイトカイン、増殖因子、ホルモン、又は癌抗原である、請求項2のヒト化抗体。
【請求項4】
IL−6、ヘプシジン、肝細胞増殖因子、又はTNFポリペプチドに特異的である、請求項1のヒト化抗体。
【請求項5】
請求項1、2、3、又は4のいずれかに引用されるヒト化抗体に含まれるヒト化抗体軽鎖をコードする核酸配列。
【請求項6】
請求項5に記載の核酸配列を含有するベクター。
【請求項7】
請求項6に記載のベクターを含有する細胞。
【請求項8】
酵母、細菌、及び哺乳動物の細胞より選択される、請求項7の細胞。
【請求項9】
二倍体の酵母細胞である、請求項8の細胞。
【請求項10】
ピキア属(Pichia)又は他のメタノール資化性二倍体酵母である、請求項9の細胞。
【請求項11】
少なくとも1つの重鎖及び軽鎖ポリペプチドを含有するヒト化抗体又は抗体断片であって、ここで重鎖は、少なくとも以下:(i)FR1からFR3に至る中で選択されるアミノ酸残基の、所望の抗原への特異性を有するヒト化される親ウサギ抗体の重鎖の対応するアミノ酸残基に対する(ヒト生殖細胞系配列のライブラリー中の他のヒト生殖細胞系配列に比べた)そのより大きな相同性(配列同一性パーセント)に基づいて該ライブラリーより選択されるヒト生殖細胞系配列によりコードされるCDR1及びCDR2領域が含まれる、FR1の第一残基からFR3の末端に至るアミノ酸残基;及び(ii)さらにここで、同じ親ウサギ抗体の重鎖のCDR1及びCDR2領域中の「選択性決定残基」に対応するヒト重鎖のCDR1及びCDR2中のCDR残基は、ウサギ重鎖のCDR1及びCDR2領域に含まれる対応する重鎖選択性決定残基で置き換えられている;(iii)同じ親ウサギ抗体の全CDR3領域が含まれるアミノ酸残基;(iv)同じ親ウサギ抗体の重鎖に含まれる対応するFR4領域に対するそのより大きな相同性(配列同一性)に基づいてヒト生殖細胞系配列のライブラリーから導かれるFR4領域;及び(v)ここでヒト重鎖FR1領域の最終の1〜3のアミノ酸は、対応するウサギ重鎖FR1残基の末端の1〜3のアミノ酸で置き換えられていてもよい;及び/又は、ヒト重鎖フレームワーク2領域の末端アミノ酸は、ウサギ重鎖フレームワーク2の対応する末端アミノ酸残基で置き換えられていてもよい;及び/又は、ウサギ重鎖CDR2の末端から4番目のアミノ酸(典型的には、トリプトファン)は、対応するヒトCDR2残基(典型的には、セリン)で置き換えられていてもよい;及び(vi)ここで、選択される相同的なヒトFR領域の残るFR残基の中で、対応するウサギFR残基で置換されているものは、ほとんど又はまったくないこと;を含有するヒト化重鎖ポリペプチドである、前記ヒト化抗体又は抗体断片。
【請求項12】
親ウサギ抗体が、ヒト、ウイルス、又は細菌の抗原に特異的である、請求項11のヒト化抗体。
【請求項13】
ヒト抗原が、サイトカイン、増殖因子、ホルモン、又は癌抗原である、請求項12のヒト化抗体。
【請求項14】
IL−6、ヘプシジン、肝細胞増殖因子、又はTNFポリペプチドに特異的である、請求項11のヒト化抗体。
【請求項15】
請求項11、12、13、又は14のいずれかに引用されるヒト化抗体に含まれるヒト化抗体重鎖をコードする核酸配列。
【請求項16】
請求項15に記載の核酸配列を含有するベクター。
【請求項17】
請求項16に記載のベクターを含有する細胞。
【請求項18】
酵母、細菌、及び哺乳動物の細胞より選択される、請求項17の細胞。
【請求項19】
二倍体の酵母細胞である、請求項18の細胞。
【請求項20】
ピキア属(Pichia)又は他のメタノール資化性二倍体酵母である、請求項19の細胞。
【請求項21】
少なくとも1つのヒト化軽鎖ポリペプチドを含有し、そしてさらに少なくとも1つの重鎖ポリペプチドを含んでなる請求項1のヒト化抗体であって、ここで少なくとも1つの重鎖は、少なくとも以下:(i)FR1からFR3に至る中で選択されるアミノ酸残基の、所望の抗原への特異性を有するヒト化される親ウサギ抗体の重鎖の対応するアミノ酸残基に対する(ヒト生殖細胞系配列のライブラリー中の他のヒト生殖細胞系配列に比べた)そのより大きな相同性(配列同一性パーセント)に基づいて該ライブラリーより選択されるヒト生殖細胞系配列によりコードされるCDR1及びCDR2領域が含まれる、FR1の第一残基からFR3の末端に至るアミノ酸残基;及び(ii)さらにここで、同じ親ウサギ抗体の重鎖のCDR1及びCDR2領域中の「選択性決定残基」に対応するヒト重鎖のCDR1及びCDR2中のCDR残基は、ウサギ重鎖のCDR1及びCDR2領域に含まれる対応する重鎖選択性決定残基で置き換えられている;(iii)同じ親ウサギ抗体の全CDR3領域が含まれるアミノ酸残基;(iv)同じ親ウサギ抗体の重鎖に含まれる対応するFR4領域に対するそのより大きな相同性(配列同一性)に基づいてヒト生殖細胞系配列のライブラリーから導かれるFR4領域;及び(v)ここでヒト重鎖FR1領域の最終の1〜3のアミノ酸は、対応するウサギ重鎖FR1残基の末端の1〜3のアミノ酸で置き換えられていてもよい;及び/又は、ヒト重鎖フレームワーク2領域の末端アミノ酸は、ウサギ重鎖フレームワーク2の対応する末端アミノ酸残基で置き換えられていてもよい;及び/又は、ウサギ重鎖CDR2の末端から4番目のアミノ酸(典型的には、トリプトファン)は、対応するヒトCDR2残基(典型的には、セリン)で置き換えられていてもよい;及び(vi)ここで、選択される相同的なヒトFR領域の残るFR残基の中で、対応するウサギFR残基で置換されているものは、ほとんど又はまったくないこと;を含有するヒト化重鎖ポリペプチドである、前記ヒト化抗体。
【請求項22】
IL−6、ヘプシジン、肝細胞増殖因子、又はTNFポリペプチドに特異的である、請求項21のヒト化抗体。
【請求項23】
以下の工程:
(i)所望の抗原へ特異的に結合するウサギ抗体からのウサギ軽鎖抗体配列をコードするDNAを入手して、フレームワーク1(FR1)の始まりからフレームワーク3(FR3)の終わりを含む範囲のアミノ酸残基を同定する工程;
(ii)FR1の始まりからFR3配列の終わりに至る前記ウサギ軽鎖抗体アミノ酸配列を用いて、ヒト軽鎖抗体配列を含有するライブラリーに対する相同性検索を実行して、他のヒト生殖細胞系抗体軽鎖配列に比べてそれに対する実質的な配列相同性を示すヒト軽鎖抗体配列を同定する工程;
(iii)ウサギとヒトの両方の軽鎖配列において、FR1、FR2、FR3、CDR1、CDR2の領域に対応する配置とその特異的残基(specific residues)を同定して、ウサギのこれらの離散領域と選択されるヒト抗体軽鎖を並置する工程;
(iv)選択される相同的なヒト軽鎖配列のCDR1及びCDR2領域が、ウサギ軽鎖配列のCDR1及びCDR2領域に含まれる対応する選択性決定残基によって置換されているDNA又はアミノ酸配列を構築する工程;
(v)工程(iv)によって得られるDNA又はアミノ酸配列へ、ウサギCDR3軽鎖抗体配列の対応するアミノ酸残基をコードするDNA配列又はそれを含有するポリペプチドをさらに付ける工程;
(vi)ウサギ軽鎖に含まれるFR4に相同的であり、好ましくは、多くても2〜4のアミノ酸残基だけそれから異なるヒト軽鎖フレームワーク4領域(FR4)をさらに選択して、前記ヒトFR4をコードするDNA配列又は前記ヒトFR4の対応するアミノ酸残基を、工程(v)の後で得られるDNA又はアミノ酸配列の上へ付ける工程;並びに
(vii)工程(i)〜(vi)より得られるヒト化ウサギ軽鎖配列をコードするか又は含有するDNA又はアミノ酸配列を合成する工程を含んでなる、ヒト化軽鎖抗体配列を産生するためのヒト化戦略。
【請求項24】
FR1を始めるアミノ酸がウサギ軽鎖シグナル配列の後で最初のアミノ酸である、請求項23のヒト化戦略。
【請求項25】
シグナル配列が約20〜22のアミノ酸残基を含む、請求項23のヒト化戦略。
【請求項26】
ヒト軽鎖配列がヒト生殖細胞系可変軽鎖配列を含有するライブラリーより同定される、請求項23のヒト化戦略。
【請求項27】
ウサギ配列中のFR1、FR2、FR3、及びCDR1、及びCDR2領域が、ウサギFR1、FR2、FR3、及びCDR1、及びCDR2領域を対応するヒト軽鎖FR1、FR2、FR3、CDR1、及びCDR2領域と並置することによって同定される、請求項23のヒト化戦略
【請求項28】
ウサギCDR3領域が9〜15のアミノ酸残基を含む、請求項23のヒト化戦略。
【請求項29】
ウサギ軽鎖FR4領域が11のアミノ酸残基を含む、請求項23のヒト化戦略。
【請求項30】
FR3がYYCで終わる、請求項23のヒト化戦略。
【請求項31】
ウサギ軽鎖中のFR4がFGGGGで始まる、請求項23のヒト化戦略。
【請求項32】
前記ウサギFR4領域がVVKRアミノ酸配列で始まる、請求項31のヒト化戦略。
【請求項33】
選択されるヒトFR4軽鎖配列がFGGGTKVEIKRを含む、請求項23のヒト化戦略。
【請求項34】
得られるヒト化ウサギ軽鎖を所望の抗原へ結合するヒト化抗体又はヒト化抗体断片の製造に使用する、請求項23のヒト化戦略。
【請求項35】
請求項23〜34のいずれか1項に従って産生される、ヒト化ウサギ軽鎖可変アミノ酸配列又はそれをコードするDNA。
【請求項36】
微生物抗原、ヒト抗原、ウイルス抗原、及びアレルゲンより選択される抗原に特異的である、請求項35のヒト化ウサギ軽鎖可変アミノ酸配列又はDNA配列。
【請求項37】
ヒト抗原が、ヒトの自己抗原、サイトカイン、受容体タンパク質、酵素、ホルモン、受容体リガンド、ステロイド、増殖因子、及び癌遺伝子より選択される、請求項36のヒト化ウサギ軽鎖可変アミノ酸又はDNA配列。
【請求項38】
請求項23〜34のいずれか1項に従って産生されるヒト化ウサギ軽鎖可変配列を含有する抗体又は抗体断片。
【請求項39】
請求項23〜34のいずれか1項に従って産生される、エフェクター部分へ付くヒト化ウサギ軽鎖又はそれを含有する抗体。
【請求項40】
エフェクター部分が、薬物、毒素、酵素、放射性核種、フルオロフォア、サイトカイン、アフィニティー標識、及び転座型ポリペプチドより選択される、請求項39のヒト化ウサギ軽鎖ポリペプチド。
【請求項41】
請求項23〜34のいずれか1項に従って産生される、サイトカイン、増殖因子、又は腫瘍特異的ポリペプチドへ特異的に結合するウサギ抗体から導かれる、ヒト化ウサギ軽鎖ポリペプチド又はそれを含有する抗体又はそれらをコードするDNA。
【請求項42】
IL−6、TNF、VEGF、IL−12、ヘプシジン、又は肝細胞増殖因子へ特異的に結合するウサギ抗体から導かれる、請求項41のヒト化ウサギ軽鎖ポリペプチド又は含有する抗体。
【請求項43】
以下の工程:
(i)所望の抗原へ特異的に結合するウサギ抗体からウサギ重鎖抗体配列を入手して、フレームワーク1(FR1)の始まりからフレームワーク3(FR3)の終わりを含む範囲のアミノ酸残基を同定する工程;
(ii)FR1の始まりからFR3配列の終わりに至る前記ウサギ重鎖抗体アミノ酸配列を使用する相同性検索を(例えば、ヒト生殖細胞系抗体配列含有ライブラリーのBLAST検索によって)実行して、それに対して相同的である、即ち、好ましくは、それに対してアミノ酸レベルで少なくとも80%〜90%の同一性を保有するヒト重鎖抗体配列を同定する工程;
(iii)ウサギとヒトの両方の重鎖配列において、FR1、FR2、FR3、CDR1、CDR2の領域に対応する配置とその特異的残基を同定して、ウサギのこれらの離散領域を選択される相同的なヒト抗体重鎖の対応領域に対して並置する工程;
(iv)選択される相同的なヒト重鎖配列のCDR1及びCDR2領域中の残基が、ウサギ重鎖配列の対応するCDR1及びCDR2領域に含まれる選択性決定残基によって置換されているDNA又はアミノ酸配列を構築して、ヒト重鎖FR1領域の末端の1〜3のアミノ酸をウサギ重鎖FR1の対応する末端の1〜3のアミノ酸で置き換えてもよい;及び/又は、ヒト重鎖フレームワーク2領域の末端アミノ酸をウサギ重鎖フレームワーク2の対応する末端アミノ酸残基で置き換えてもよい;及び/又は、ウサギ重鎖CDR2の末端から4番目のアミノ酸(典型的には、トリプトファン)を対応するヒトCDR2残基(典型的には、セリン)で置き換えてもよい工程;
(v)工程(iv)によって得られるDNA又はアミノ酸配列へ、同じウサギ重鎖抗体配列に含まれるウサギ重鎖CDR3の対応するアミノ酸残基をコードするDNA配列又はそれを有するポリペプチドをさらに付ける工程;
(vi)それに相同的である(好ましくは、ヒト化ウサギ抗体重鎖配列に含まれるFR4より、多くても4つのアミノ酸残基だけ異なる)ヒト重鎖フレームワーク4領域(FR4)をさらに選択して、前記選択された相同的なヒトFR4をコードするDNA配列又は前記ヒトFR4の対応するアミノ酸残基を、工程(v)の後で得られるDNA又はアミノ酸配列の上へ付ける工程;並びに
(vii)工程(i)〜(vi)より得られるヒト化ウサギ重鎖配列をコードするか又は含有するDNA又はアミノ酸配列を合成する工程を含んでなる、ヒト化重鎖抗体配列をウサギ重鎖抗体配列より産生するためのヒト化戦略。
【請求項44】
FR1を始めるアミノ酸がウサギ重鎖シグナル配列の後で最初のアミノ酸である、請求項43のヒト化戦略。
【請求項45】
FR3の終わりがFR1の第一残基の後の約95〜100番目のアミノ酸残基である、請求項43のヒト化戦略。
【請求項46】
シグナル配列が19以下のアミノ酸残基を含む、請求項43のヒト化戦略。
【請求項47】
相同的なヒト重鎖配列が抗体成熟化に先立って得られるヒト生殖細胞系配列のBLAST検索によって同定される、請求項43のヒト化戦略。
【請求項48】
選択される相同的なヒト重鎖がウサギ重鎖の対応領域に対して少なくとも90〜95%の配列同一性を保有する、請求項43のヒト化戦略
【請求項49】
ウサギ重鎖配列中のFR1、FR2、FR3、及びCDR1、及びCDR2領域がウサギFR1、FR2、FR3、及びCDR1、及びCDR2領域を対応するヒト重鎖FR1、FR2、FR3、CDR1、及びCDR2領域と並置することによって同定される、請求項43のヒト化戦略。
【請求項50】
ヒトFR1の最終の3つのアミノ酸残基をウサギFR1の対応する3つの残基で置き換える、請求項43のヒト化戦略。
【請求項51】
ウサギFR1中の前記3つの残基にser−glyが先行する、請求項50のヒト化戦略。
【請求項52】
ヒトFR2の末端アミノ酸残基をウサギFR2の対応する末端アミノ酸残基で置き換える工程をさらに含む、請求項43のヒト化戦略。
【請求項53】
末端のウサギFR2残基がイソロイシン残基に先行される場合もあるグリシンを含む、請求項52のヒト化戦略。
【請求項54】
ウサギCDR2の終わりより約4残基に位置するトリプトファン残基をセリン残基に変える工程をさらに含む、請求項43のヒト化戦略。
【請求項55】
ウサギCDR3が5〜19のアミノ酸残基を含む、請求項43の方法。
【請求項56】
ウサギCDR3に残基WG「X」Gが続き、ここで「X」は、好ましくはQ又はPである、請求項43のヒト化戦略。
【請求項57】
ウサギFR4が11のアミノ酸残基を含む、請求項43のヒト化戦略。
【請求項58】
ウサギFR4がWGQGTLVTVSSを含む、請求項57のヒト化戦略。
【請求項59】
請求項43〜58のいずれかにより産生される、微生物抗原、ヒト抗原、ウイルス抗原、及びアレルゲンより選択される抗原に特異的なウサギ抗体から導かれるヒト化ウサギ重鎖可変アミノ酸配列又はDNA配列。
【請求項60】
ヒト抗原に特異的である、請求項59のヒト化ウサギ重鎖可変アミノ酸配列又はDNA配列。
【請求項61】
ヒト抗原が、ヒトの自己抗原、サイトカイン、受容体タンパク質、酵素、ホルモン、受容体リガンド、ステロイド、増殖因子、及び癌遺伝子より選択される、請求項59のヒト化ウサギ重鎖可変アミノ酸配列又はDNA配列。
【請求項62】
請求項43〜58のいずれか1項に従って産生されるヒト化ウサギ重鎖可変配列を含有する抗体又は抗体断片。
【請求項63】
請求項43〜58のいずれか1項に従って産生される、エフェクター部分へ付くヒト化ウサギ重鎖。
【請求項64】
エフェクター部分が、薬物、毒素、酵素、放射性核種、フルオロフォア、サイトカイン、アフィニティー標識、及び転座型ポリペプチドより選択される、請求項63のヒト化ウサギ重鎖ポリペプチド。
【請求項65】
請求項43〜58のいずれか1項に従って産生される、サイトカイン、増殖因子、又は腫瘍特異的ポリペプチドへ特異的に結合するウサギ抗体から導かれるヒト化ウサギ重鎖ポリペプチド又はそれをコードするDNA。
【請求項66】
IL−6、TNF−α、VEGF−α、IL−12、ヘプシジン、又は肝細胞増殖因子へ特異的に結合するウサギ抗体から導かれる、請求項65のヒト化ウサギ重鎖ポリペプチド。
【請求項67】
非グリコシル化(aglycosylated)されている、請求項64のヒト化ウサギ重鎖ポリペプチド。
【請求項68】
請求項23〜34の少なくとも1項に従って産生される少なくとも1つのヒト化ウサギ軽鎖と請求項43〜58の1項に従って産生される少なくとも1つのヒト化ウサギ重鎖を含んでなるヒト化ウサギ抗体。
【請求項69】
ヒトの定常ドメインを含む、請求項68のヒト化ウサギ抗体。
【請求項70】
IgGl、IgG2、IgG3、及びIgG4より選択される、請求項69のヒト化ウサギ抗体。
【請求項71】
ヒト抗原、細菌抗原、ウイルス抗原、病原体、寄生虫、酵母抗原、及び真菌抗原より選択される抗原へ結合する、請求項68のヒト化ウサギ抗体。
【請求項72】
ヒト化抗体の投与を含む免疫療法又は免疫診断の方法であって、ここで改善は、請求項1〜5、11〜14、21、又は22のいずれか1項に記載のヒト化抗体又は抗体断片を投与することを含む、前記方法。
【請求項73】
IL−6又はTNFに関連した疾患又は障害の症状を改善又は抑制することを含む、請求項72の方法。
【請求項74】
IL−6又はTNF−αに関連した前記疾患又は障害が癌又は炎症性状態である、請求項73の方法。
【請求項75】
抗体が抗IL−6抗体であり、IL−6関連の疲労、悪液質、又は関節炎を治療するか又はその予後を診断するために使用される、請求項73の方法。
【請求項76】
IL−6に関連した前記疾患又は障害が、全身疲労、運動誘発性疲労、癌関連疲労、炎症性疾患関連疲労、慢性疲労症候群、癌関連悪液質、心臓関連悪液質、呼吸関連悪液質、腎臓関連悪液質、加齢関連悪液質、慢性関節リウマチ、全身性紅斑性狼瘡(SLE)、全身型若年性特発性関節炎、乾癬、乾癬性関節症、強直性脊椎炎、炎症性腸疾患(IBD)、リウマチ性多発性筋痛、巨細胞性動脈炎、自己免疫性脈管炎、移植片対宿主病(GVHD)、シェーグレン症候群、成人発症型スティル病、慢性関節リウマチ、全身型若年性特発性関節炎、骨関節炎、骨粗鬆症、骨ページェット病、骨関節炎、多発性骨髄腫、ホジキンリンパ腫、非ホジキンリンパ腫、前立腺癌、白血病、腎細胞癌、多中心型キャッスルマン病、卵巣癌、癌化学療法時の薬剤耐性、癌化学療法の毒性、虚血性心疾患、アテローム性動脈硬化症、肥満、糖尿病、喘息、多発性硬化症、アルツハイマー病、及び脳血管系疾患より選択される、請求項73の方法。
【請求項77】
前記疾患又は障害がTNFに関連していて、全身疲労、運動誘発性疲労、癌関連疲労、炎症性疾患関連疲労、慢性疲労症候群、癌関連悪液質、心臓関連悪液質、呼吸関連悪液質、腎臓関連悪液質、加齢関連悪液質、慢性関節リウマチ、全身性紅斑性狼瘡(SLE)、全身型若年性特発性関節炎、乾癬、乾癬性関節症、強直性脊椎炎、炎症性腸疾患(IBD)、リウマチ性多発性筋痛、巨細胞性動脈炎、自己免疫性脈管炎、移植片対宿主病(GVHD)、シェーグレン症候群、成人発症型スティル病、慢性関節リウマチ、全身型若年性特発性関節炎、骨関節炎、骨粗鬆症、骨ページェット病、骨関節炎、多発性骨髄腫、ホジキンリンパ腫、非ホジキンリンパ腫、前立腺癌、白血病、腎細胞癌、多中心型キャッスルマン病、卵巣癌、癌化学療法時の薬剤耐性、癌化学療法の毒性、虚血性心疾患、アテローム性動脈硬化症、肥満、糖尿病、喘息、多発性硬化症、アルツハイマー病、及び脳血管系疾患より選択される、請求項73の方法。
【請求項78】
ヒト化抗体又は抗体断片が、少なくとも10〜25mg/リットルの前記抗体を安定的に発現して培養基へ分泌する倍数体酵母培養物において発現される請求項72の方法であって:
(i)プロモーター及びシグナル配列へ機能可能的に連結した前記ヒト化抗体又は断片をコードする1以上の異種ポリヌクレオチドを含有する少なくとも1つの発現ベクターを一倍体酵母細胞へ導入する工程;
(ii)前記第一及び/又は第二の一倍体酵母細胞より、接合又はスフェロプラスト融合によって、倍数体酵母を産生する工程;
(iii)前記ヒト化抗体又は断片を安定的に発現する倍数体酵母細胞を選択する工程;及び
(iv)少なくとも10〜25mg/リットルの前記ヒト化抗体又は断片を培養基へ安定的に発現する前記倍数体酵母細胞より、安定した倍数体酵母培養物を産生する工程を含んでなる、前記方法。
【請求項79】
前記酵母が以下の属:アルキシオザイマ(Arxiozyma);アスコボトリオザイマ(Ascobotryozyma);シテロマイセス(Citeromyces);デバリオマイセス(Debaryomyces);デッケラ(Dekkera);エレモセシウム(Eremothecium);イサットヘンキア(Issatchenkia);カザクスタニア(Kazachstania);クルイベロマイセス(Kluyveromyces);コダマエア(Kodamaea);ロデロマイセス(Lodderomyces);パチソレン(Pachysolen);ピキア(Pichia);サッカロマイセス(Saccharomyces);サツニスポラ(Saturnispora);テトラピシスポラ(Tetrapisispora);トルラスポラ(Torulaspora);ウィリオプシス(Williopsis);及びザイゴサッカロマイセス(Zygosaccharomyces)より選択される、請求項78の方法。
【請求項80】
前記酵母属がピキアである、請求項79の方法。
【請求項81】
ピキアの種が、ピキア・パストリス(Pichia pastoris)、ピキア・メタノリカ(Pichia metanolica)、及びハンセヌラ・ポリモルファ(Hansenula polymorpha)(ピキア・アングスタ(Pichia angusta))より選択される、請求項80の方法。
【請求項82】
請求項23〜34又は43〜58のいずれか1項によって産生されるヒト化抗体ポリペプチドを含有するヒト化抗体又は抗体断片であって、5x10−7M−1、10−7M−1、5x10−8M−1、10−8M−1、5x10−9M−1、10−9M−1、5x10−10M−1、10−10M−1、5x10−11M−1、10−11M−1、5x10−12M−1、10−12M−1、5x10−13M−1、10−13M−1、又は5x10−14M−1以下の解離定数(KD)で抗原へ結合する、前記ヒト化抗体又は断片。
【請求項83】
5x10−10M−1以下の解離定数(KD)で抗原へ結合する、請求項82のヒト化抗体。
【請求項84】
10−4S−1、5x10−5S−1、10−5S−1、5x10−6S−1、10−6S−1、5x10−7S−1、又は10−7S−1以下の解離速度(Koff)で抗原へ結合する、請求項82のヒト化抗体。
【請求項85】
親ウサギ抗体が1以上のウサギB細胞集団に由来する、請求項82のヒト化抗体。
【請求項86】
IL−6のIL−6Rとの会合、又はTNFとその受容体との会合を阻害する、請求項82のヒト化抗体。
【請求項87】
IL−6Rが可溶性L−6R(sIL−6R)である、請求項86のヒト化抗体。
【請求項88】
TNF受容体(TNFR)が可溶性である、請求項86のヒト化抗体。
【請求項89】
請求項1〜22又は82〜88のいずれか1項に記載のヒト化ウサギ抗体を発現するベクター。
【請求項90】
請求項89のベクターを含んでなる宿主細胞。
【請求項91】
ピキア属に属する酵母細胞である、請求項90の宿主細胞。
【請求項1】
少なくとも1つの重鎖及び軽鎖ポリペプチドを含有するヒト化抗体又は抗体断片であって、ここで軽鎖ポリペプチドは、少なくとも以下:(i)FR1からFR3に至る中で選択されるアミノ酸残基の、所望の抗原への特異性を有するヒト化される親ウサギ抗体の軽鎖の対応するアミノ酸残基に対する(ヒト生殖細胞系配列のライブラリー中の他のヒト生殖細胞系配列に比べた)そのより大きな相同性(配列同一性パーセント)に基づいて該ライブラリーより選択されるヒト軽鎖生殖細胞系配列のCDR1及びCDR2領域が含まれる、FR1の第一残基からFR3の末端に至るアミノ酸残基;及び(ii)さらにここで、同じ親ウサギ抗体の軽鎖中の「選択性決定残基」に対応するCDR1及びCDR2中のCDR残基は、対応するウサギ選択性決定残基で置き換えられている;(iii)同じ親ウサギ抗体の全CDR3領域が含まれるアミノ酸残基;(iv)同じ親ウサギ抗体の軽鎖に含まれる対応するFR4領域に対するそのより大きな相同性(配列同一性)に基づいてヒト生殖細胞系配列のライブラリーから導かれる抗体軽鎖の全FR4領域が含まれるアミノ酸残基;及び(v)ここで、選択される相同的なヒトFR領域中のヒトFR1、FR2、FR3、及びFR4領域のFR残基の中で、対応するウサギFR残基で置換されているものは、ほとんど又はまったくないこと;を含有するヒト化軽鎖ポリペプチドである、前記ヒト化抗体又は抗体断片。
【請求項2】
親ウサギ抗体が、ヒト、ウイルス、又は細菌の抗原に特異的である、請求項1のヒト化抗体。
【請求項3】
ヒト抗原が、サイトカイン、増殖因子、ホルモン、又は癌抗原である、請求項2のヒト化抗体。
【請求項4】
IL−6、ヘプシジン、肝細胞増殖因子、又はTNFポリペプチドに特異的である、請求項1のヒト化抗体。
【請求項5】
請求項1、2、3、又は4のいずれかに引用されるヒト化抗体に含まれるヒト化抗体軽鎖をコードする核酸配列。
【請求項6】
請求項5に記載の核酸配列を含有するベクター。
【請求項7】
請求項6に記載のベクターを含有する細胞。
【請求項8】
酵母、細菌、及び哺乳動物の細胞より選択される、請求項7の細胞。
【請求項9】
二倍体の酵母細胞である、請求項8の細胞。
【請求項10】
ピキア属(Pichia)又は他のメタノール資化性二倍体酵母である、請求項9の細胞。
【請求項11】
少なくとも1つの重鎖及び軽鎖ポリペプチドを含有するヒト化抗体又は抗体断片であって、ここで重鎖は、少なくとも以下:(i)FR1からFR3に至る中で選択されるアミノ酸残基の、所望の抗原への特異性を有するヒト化される親ウサギ抗体の重鎖の対応するアミノ酸残基に対する(ヒト生殖細胞系配列のライブラリー中の他のヒト生殖細胞系配列に比べた)そのより大きな相同性(配列同一性パーセント)に基づいて該ライブラリーより選択されるヒト生殖細胞系配列によりコードされるCDR1及びCDR2領域が含まれる、FR1の第一残基からFR3の末端に至るアミノ酸残基;及び(ii)さらにここで、同じ親ウサギ抗体の重鎖のCDR1及びCDR2領域中の「選択性決定残基」に対応するヒト重鎖のCDR1及びCDR2中のCDR残基は、ウサギ重鎖のCDR1及びCDR2領域に含まれる対応する重鎖選択性決定残基で置き換えられている;(iii)同じ親ウサギ抗体の全CDR3領域が含まれるアミノ酸残基;(iv)同じ親ウサギ抗体の重鎖に含まれる対応するFR4領域に対するそのより大きな相同性(配列同一性)に基づいてヒト生殖細胞系配列のライブラリーから導かれるFR4領域;及び(v)ここでヒト重鎖FR1領域の最終の1〜3のアミノ酸は、対応するウサギ重鎖FR1残基の末端の1〜3のアミノ酸で置き換えられていてもよい;及び/又は、ヒト重鎖フレームワーク2領域の末端アミノ酸は、ウサギ重鎖フレームワーク2の対応する末端アミノ酸残基で置き換えられていてもよい;及び/又は、ウサギ重鎖CDR2の末端から4番目のアミノ酸(典型的には、トリプトファン)は、対応するヒトCDR2残基(典型的には、セリン)で置き換えられていてもよい;及び(vi)ここで、選択される相同的なヒトFR領域の残るFR残基の中で、対応するウサギFR残基で置換されているものは、ほとんど又はまったくないこと;を含有するヒト化重鎖ポリペプチドである、前記ヒト化抗体又は抗体断片。
【請求項12】
親ウサギ抗体が、ヒト、ウイルス、又は細菌の抗原に特異的である、請求項11のヒト化抗体。
【請求項13】
ヒト抗原が、サイトカイン、増殖因子、ホルモン、又は癌抗原である、請求項12のヒト化抗体。
【請求項14】
IL−6、ヘプシジン、肝細胞増殖因子、又はTNFポリペプチドに特異的である、請求項11のヒト化抗体。
【請求項15】
請求項11、12、13、又は14のいずれかに引用されるヒト化抗体に含まれるヒト化抗体重鎖をコードする核酸配列。
【請求項16】
請求項15に記載の核酸配列を含有するベクター。
【請求項17】
請求項16に記載のベクターを含有する細胞。
【請求項18】
酵母、細菌、及び哺乳動物の細胞より選択される、請求項17の細胞。
【請求項19】
二倍体の酵母細胞である、請求項18の細胞。
【請求項20】
ピキア属(Pichia)又は他のメタノール資化性二倍体酵母である、請求項19の細胞。
【請求項21】
少なくとも1つのヒト化軽鎖ポリペプチドを含有し、そしてさらに少なくとも1つの重鎖ポリペプチドを含んでなる請求項1のヒト化抗体であって、ここで少なくとも1つの重鎖は、少なくとも以下:(i)FR1からFR3に至る中で選択されるアミノ酸残基の、所望の抗原への特異性を有するヒト化される親ウサギ抗体の重鎖の対応するアミノ酸残基に対する(ヒト生殖細胞系配列のライブラリー中の他のヒト生殖細胞系配列に比べた)そのより大きな相同性(配列同一性パーセント)に基づいて該ライブラリーより選択されるヒト生殖細胞系配列によりコードされるCDR1及びCDR2領域が含まれる、FR1の第一残基からFR3の末端に至るアミノ酸残基;及び(ii)さらにここで、同じ親ウサギ抗体の重鎖のCDR1及びCDR2領域中の「選択性決定残基」に対応するヒト重鎖のCDR1及びCDR2中のCDR残基は、ウサギ重鎖のCDR1及びCDR2領域に含まれる対応する重鎖選択性決定残基で置き換えられている;(iii)同じ親ウサギ抗体の全CDR3領域が含まれるアミノ酸残基;(iv)同じ親ウサギ抗体の重鎖に含まれる対応するFR4領域に対するそのより大きな相同性(配列同一性)に基づいてヒト生殖細胞系配列のライブラリーから導かれるFR4領域;及び(v)ここでヒト重鎖FR1領域の最終の1〜3のアミノ酸は、対応するウサギ重鎖FR1残基の末端の1〜3のアミノ酸で置き換えられていてもよい;及び/又は、ヒト重鎖フレームワーク2領域の末端アミノ酸は、ウサギ重鎖フレームワーク2の対応する末端アミノ酸残基で置き換えられていてもよい;及び/又は、ウサギ重鎖CDR2の末端から4番目のアミノ酸(典型的には、トリプトファン)は、対応するヒトCDR2残基(典型的には、セリン)で置き換えられていてもよい;及び(vi)ここで、選択される相同的なヒトFR領域の残るFR残基の中で、対応するウサギFR残基で置換されているものは、ほとんど又はまったくないこと;を含有するヒト化重鎖ポリペプチドである、前記ヒト化抗体。
【請求項22】
IL−6、ヘプシジン、肝細胞増殖因子、又はTNFポリペプチドに特異的である、請求項21のヒト化抗体。
【請求項23】
以下の工程:
(i)所望の抗原へ特異的に結合するウサギ抗体からのウサギ軽鎖抗体配列をコードするDNAを入手して、フレームワーク1(FR1)の始まりからフレームワーク3(FR3)の終わりを含む範囲のアミノ酸残基を同定する工程;
(ii)FR1の始まりからFR3配列の終わりに至る前記ウサギ軽鎖抗体アミノ酸配列を用いて、ヒト軽鎖抗体配列を含有するライブラリーに対する相同性検索を実行して、他のヒト生殖細胞系抗体軽鎖配列に比べてそれに対する実質的な配列相同性を示すヒト軽鎖抗体配列を同定する工程;
(iii)ウサギとヒトの両方の軽鎖配列において、FR1、FR2、FR3、CDR1、CDR2の領域に対応する配置とその特異的残基(specific residues)を同定して、ウサギのこれらの離散領域と選択されるヒト抗体軽鎖を並置する工程;
(iv)選択される相同的なヒト軽鎖配列のCDR1及びCDR2領域が、ウサギ軽鎖配列のCDR1及びCDR2領域に含まれる対応する選択性決定残基によって置換されているDNA又はアミノ酸配列を構築する工程;
(v)工程(iv)によって得られるDNA又はアミノ酸配列へ、ウサギCDR3軽鎖抗体配列の対応するアミノ酸残基をコードするDNA配列又はそれを含有するポリペプチドをさらに付ける工程;
(vi)ウサギ軽鎖に含まれるFR4に相同的であり、好ましくは、多くても2〜4のアミノ酸残基だけそれから異なるヒト軽鎖フレームワーク4領域(FR4)をさらに選択して、前記ヒトFR4をコードするDNA配列又は前記ヒトFR4の対応するアミノ酸残基を、工程(v)の後で得られるDNA又はアミノ酸配列の上へ付ける工程;並びに
(vii)工程(i)〜(vi)より得られるヒト化ウサギ軽鎖配列をコードするか又は含有するDNA又はアミノ酸配列を合成する工程を含んでなる、ヒト化軽鎖抗体配列を産生するためのヒト化戦略。
【請求項24】
FR1を始めるアミノ酸がウサギ軽鎖シグナル配列の後で最初のアミノ酸である、請求項23のヒト化戦略。
【請求項25】
シグナル配列が約20〜22のアミノ酸残基を含む、請求項23のヒト化戦略。
【請求項26】
ヒト軽鎖配列がヒト生殖細胞系可変軽鎖配列を含有するライブラリーより同定される、請求項23のヒト化戦略。
【請求項27】
ウサギ配列中のFR1、FR2、FR3、及びCDR1、及びCDR2領域が、ウサギFR1、FR2、FR3、及びCDR1、及びCDR2領域を対応するヒト軽鎖FR1、FR2、FR3、CDR1、及びCDR2領域と並置することによって同定される、請求項23のヒト化戦略
【請求項28】
ウサギCDR3領域が9〜15のアミノ酸残基を含む、請求項23のヒト化戦略。
【請求項29】
ウサギ軽鎖FR4領域が11のアミノ酸残基を含む、請求項23のヒト化戦略。
【請求項30】
FR3がYYCで終わる、請求項23のヒト化戦略。
【請求項31】
ウサギ軽鎖中のFR4がFGGGGで始まる、請求項23のヒト化戦略。
【請求項32】
前記ウサギFR4領域がVVKRアミノ酸配列で始まる、請求項31のヒト化戦略。
【請求項33】
選択されるヒトFR4軽鎖配列がFGGGTKVEIKRを含む、請求項23のヒト化戦略。
【請求項34】
得られるヒト化ウサギ軽鎖を所望の抗原へ結合するヒト化抗体又はヒト化抗体断片の製造に使用する、請求項23のヒト化戦略。
【請求項35】
請求項23〜34のいずれか1項に従って産生される、ヒト化ウサギ軽鎖可変アミノ酸配列又はそれをコードするDNA。
【請求項36】
微生物抗原、ヒト抗原、ウイルス抗原、及びアレルゲンより選択される抗原に特異的である、請求項35のヒト化ウサギ軽鎖可変アミノ酸配列又はDNA配列。
【請求項37】
ヒト抗原が、ヒトの自己抗原、サイトカイン、受容体タンパク質、酵素、ホルモン、受容体リガンド、ステロイド、増殖因子、及び癌遺伝子より選択される、請求項36のヒト化ウサギ軽鎖可変アミノ酸又はDNA配列。
【請求項38】
請求項23〜34のいずれか1項に従って産生されるヒト化ウサギ軽鎖可変配列を含有する抗体又は抗体断片。
【請求項39】
請求項23〜34のいずれか1項に従って産生される、エフェクター部分へ付くヒト化ウサギ軽鎖又はそれを含有する抗体。
【請求項40】
エフェクター部分が、薬物、毒素、酵素、放射性核種、フルオロフォア、サイトカイン、アフィニティー標識、及び転座型ポリペプチドより選択される、請求項39のヒト化ウサギ軽鎖ポリペプチド。
【請求項41】
請求項23〜34のいずれか1項に従って産生される、サイトカイン、増殖因子、又は腫瘍特異的ポリペプチドへ特異的に結合するウサギ抗体から導かれる、ヒト化ウサギ軽鎖ポリペプチド又はそれを含有する抗体又はそれらをコードするDNA。
【請求項42】
IL−6、TNF、VEGF、IL−12、ヘプシジン、又は肝細胞増殖因子へ特異的に結合するウサギ抗体から導かれる、請求項41のヒト化ウサギ軽鎖ポリペプチド又は含有する抗体。
【請求項43】
以下の工程:
(i)所望の抗原へ特異的に結合するウサギ抗体からウサギ重鎖抗体配列を入手して、フレームワーク1(FR1)の始まりからフレームワーク3(FR3)の終わりを含む範囲のアミノ酸残基を同定する工程;
(ii)FR1の始まりからFR3配列の終わりに至る前記ウサギ重鎖抗体アミノ酸配列を使用する相同性検索を(例えば、ヒト生殖細胞系抗体配列含有ライブラリーのBLAST検索によって)実行して、それに対して相同的である、即ち、好ましくは、それに対してアミノ酸レベルで少なくとも80%〜90%の同一性を保有するヒト重鎖抗体配列を同定する工程;
(iii)ウサギとヒトの両方の重鎖配列において、FR1、FR2、FR3、CDR1、CDR2の領域に対応する配置とその特異的残基を同定して、ウサギのこれらの離散領域を選択される相同的なヒト抗体重鎖の対応領域に対して並置する工程;
(iv)選択される相同的なヒト重鎖配列のCDR1及びCDR2領域中の残基が、ウサギ重鎖配列の対応するCDR1及びCDR2領域に含まれる選択性決定残基によって置換されているDNA又はアミノ酸配列を構築して、ヒト重鎖FR1領域の末端の1〜3のアミノ酸をウサギ重鎖FR1の対応する末端の1〜3のアミノ酸で置き換えてもよい;及び/又は、ヒト重鎖フレームワーク2領域の末端アミノ酸をウサギ重鎖フレームワーク2の対応する末端アミノ酸残基で置き換えてもよい;及び/又は、ウサギ重鎖CDR2の末端から4番目のアミノ酸(典型的には、トリプトファン)を対応するヒトCDR2残基(典型的には、セリン)で置き換えてもよい工程;
(v)工程(iv)によって得られるDNA又はアミノ酸配列へ、同じウサギ重鎖抗体配列に含まれるウサギ重鎖CDR3の対応するアミノ酸残基をコードするDNA配列又はそれを有するポリペプチドをさらに付ける工程;
(vi)それに相同的である(好ましくは、ヒト化ウサギ抗体重鎖配列に含まれるFR4より、多くても4つのアミノ酸残基だけ異なる)ヒト重鎖フレームワーク4領域(FR4)をさらに選択して、前記選択された相同的なヒトFR4をコードするDNA配列又は前記ヒトFR4の対応するアミノ酸残基を、工程(v)の後で得られるDNA又はアミノ酸配列の上へ付ける工程;並びに
(vii)工程(i)〜(vi)より得られるヒト化ウサギ重鎖配列をコードするか又は含有するDNA又はアミノ酸配列を合成する工程を含んでなる、ヒト化重鎖抗体配列をウサギ重鎖抗体配列より産生するためのヒト化戦略。
【請求項44】
FR1を始めるアミノ酸がウサギ重鎖シグナル配列の後で最初のアミノ酸である、請求項43のヒト化戦略。
【請求項45】
FR3の終わりがFR1の第一残基の後の約95〜100番目のアミノ酸残基である、請求項43のヒト化戦略。
【請求項46】
シグナル配列が19以下のアミノ酸残基を含む、請求項43のヒト化戦略。
【請求項47】
相同的なヒト重鎖配列が抗体成熟化に先立って得られるヒト生殖細胞系配列のBLAST検索によって同定される、請求項43のヒト化戦略。
【請求項48】
選択される相同的なヒト重鎖がウサギ重鎖の対応領域に対して少なくとも90〜95%の配列同一性を保有する、請求項43のヒト化戦略
【請求項49】
ウサギ重鎖配列中のFR1、FR2、FR3、及びCDR1、及びCDR2領域がウサギFR1、FR2、FR3、及びCDR1、及びCDR2領域を対応するヒト重鎖FR1、FR2、FR3、CDR1、及びCDR2領域と並置することによって同定される、請求項43のヒト化戦略。
【請求項50】
ヒトFR1の最終の3つのアミノ酸残基をウサギFR1の対応する3つの残基で置き換える、請求項43のヒト化戦略。
【請求項51】
ウサギFR1中の前記3つの残基にser−glyが先行する、請求項50のヒト化戦略。
【請求項52】
ヒトFR2の末端アミノ酸残基をウサギFR2の対応する末端アミノ酸残基で置き換える工程をさらに含む、請求項43のヒト化戦略。
【請求項53】
末端のウサギFR2残基がイソロイシン残基に先行される場合もあるグリシンを含む、請求項52のヒト化戦略。
【請求項54】
ウサギCDR2の終わりより約4残基に位置するトリプトファン残基をセリン残基に変える工程をさらに含む、請求項43のヒト化戦略。
【請求項55】
ウサギCDR3が5〜19のアミノ酸残基を含む、請求項43の方法。
【請求項56】
ウサギCDR3に残基WG「X」Gが続き、ここで「X」は、好ましくはQ又はPである、請求項43のヒト化戦略。
【請求項57】
ウサギFR4が11のアミノ酸残基を含む、請求項43のヒト化戦略。
【請求項58】
ウサギFR4がWGQGTLVTVSSを含む、請求項57のヒト化戦略。
【請求項59】
請求項43〜58のいずれかにより産生される、微生物抗原、ヒト抗原、ウイルス抗原、及びアレルゲンより選択される抗原に特異的なウサギ抗体から導かれるヒト化ウサギ重鎖可変アミノ酸配列又はDNA配列。
【請求項60】
ヒト抗原に特異的である、請求項59のヒト化ウサギ重鎖可変アミノ酸配列又はDNA配列。
【請求項61】
ヒト抗原が、ヒトの自己抗原、サイトカイン、受容体タンパク質、酵素、ホルモン、受容体リガンド、ステロイド、増殖因子、及び癌遺伝子より選択される、請求項59のヒト化ウサギ重鎖可変アミノ酸配列又はDNA配列。
【請求項62】
請求項43〜58のいずれか1項に従って産生されるヒト化ウサギ重鎖可変配列を含有する抗体又は抗体断片。
【請求項63】
請求項43〜58のいずれか1項に従って産生される、エフェクター部分へ付くヒト化ウサギ重鎖。
【請求項64】
エフェクター部分が、薬物、毒素、酵素、放射性核種、フルオロフォア、サイトカイン、アフィニティー標識、及び転座型ポリペプチドより選択される、請求項63のヒト化ウサギ重鎖ポリペプチド。
【請求項65】
請求項43〜58のいずれか1項に従って産生される、サイトカイン、増殖因子、又は腫瘍特異的ポリペプチドへ特異的に結合するウサギ抗体から導かれるヒト化ウサギ重鎖ポリペプチド又はそれをコードするDNA。
【請求項66】
IL−6、TNF−α、VEGF−α、IL−12、ヘプシジン、又は肝細胞増殖因子へ特異的に結合するウサギ抗体から導かれる、請求項65のヒト化ウサギ重鎖ポリペプチド。
【請求項67】
非グリコシル化(aglycosylated)されている、請求項64のヒト化ウサギ重鎖ポリペプチド。
【請求項68】
請求項23〜34の少なくとも1項に従って産生される少なくとも1つのヒト化ウサギ軽鎖と請求項43〜58の1項に従って産生される少なくとも1つのヒト化ウサギ重鎖を含んでなるヒト化ウサギ抗体。
【請求項69】
ヒトの定常ドメインを含む、請求項68のヒト化ウサギ抗体。
【請求項70】
IgGl、IgG2、IgG3、及びIgG4より選択される、請求項69のヒト化ウサギ抗体。
【請求項71】
ヒト抗原、細菌抗原、ウイルス抗原、病原体、寄生虫、酵母抗原、及び真菌抗原より選択される抗原へ結合する、請求項68のヒト化ウサギ抗体。
【請求項72】
ヒト化抗体の投与を含む免疫療法又は免疫診断の方法であって、ここで改善は、請求項1〜5、11〜14、21、又は22のいずれか1項に記載のヒト化抗体又は抗体断片を投与することを含む、前記方法。
【請求項73】
IL−6又はTNFに関連した疾患又は障害の症状を改善又は抑制することを含む、請求項72の方法。
【請求項74】
IL−6又はTNF−αに関連した前記疾患又は障害が癌又は炎症性状態である、請求項73の方法。
【請求項75】
抗体が抗IL−6抗体であり、IL−6関連の疲労、悪液質、又は関節炎を治療するか又はその予後を診断するために使用される、請求項73の方法。
【請求項76】
IL−6に関連した前記疾患又は障害が、全身疲労、運動誘発性疲労、癌関連疲労、炎症性疾患関連疲労、慢性疲労症候群、癌関連悪液質、心臓関連悪液質、呼吸関連悪液質、腎臓関連悪液質、加齢関連悪液質、慢性関節リウマチ、全身性紅斑性狼瘡(SLE)、全身型若年性特発性関節炎、乾癬、乾癬性関節症、強直性脊椎炎、炎症性腸疾患(IBD)、リウマチ性多発性筋痛、巨細胞性動脈炎、自己免疫性脈管炎、移植片対宿主病(GVHD)、シェーグレン症候群、成人発症型スティル病、慢性関節リウマチ、全身型若年性特発性関節炎、骨関節炎、骨粗鬆症、骨ページェット病、骨関節炎、多発性骨髄腫、ホジキンリンパ腫、非ホジキンリンパ腫、前立腺癌、白血病、腎細胞癌、多中心型キャッスルマン病、卵巣癌、癌化学療法時の薬剤耐性、癌化学療法の毒性、虚血性心疾患、アテローム性動脈硬化症、肥満、糖尿病、喘息、多発性硬化症、アルツハイマー病、及び脳血管系疾患より選択される、請求項73の方法。
【請求項77】
前記疾患又は障害がTNFに関連していて、全身疲労、運動誘発性疲労、癌関連疲労、炎症性疾患関連疲労、慢性疲労症候群、癌関連悪液質、心臓関連悪液質、呼吸関連悪液質、腎臓関連悪液質、加齢関連悪液質、慢性関節リウマチ、全身性紅斑性狼瘡(SLE)、全身型若年性特発性関節炎、乾癬、乾癬性関節症、強直性脊椎炎、炎症性腸疾患(IBD)、リウマチ性多発性筋痛、巨細胞性動脈炎、自己免疫性脈管炎、移植片対宿主病(GVHD)、シェーグレン症候群、成人発症型スティル病、慢性関節リウマチ、全身型若年性特発性関節炎、骨関節炎、骨粗鬆症、骨ページェット病、骨関節炎、多発性骨髄腫、ホジキンリンパ腫、非ホジキンリンパ腫、前立腺癌、白血病、腎細胞癌、多中心型キャッスルマン病、卵巣癌、癌化学療法時の薬剤耐性、癌化学療法の毒性、虚血性心疾患、アテローム性動脈硬化症、肥満、糖尿病、喘息、多発性硬化症、アルツハイマー病、及び脳血管系疾患より選択される、請求項73の方法。
【請求項78】
ヒト化抗体又は抗体断片が、少なくとも10〜25mg/リットルの前記抗体を安定的に発現して培養基へ分泌する倍数体酵母培養物において発現される請求項72の方法であって:
(i)プロモーター及びシグナル配列へ機能可能的に連結した前記ヒト化抗体又は断片をコードする1以上の異種ポリヌクレオチドを含有する少なくとも1つの発現ベクターを一倍体酵母細胞へ導入する工程;
(ii)前記第一及び/又は第二の一倍体酵母細胞より、接合又はスフェロプラスト融合によって、倍数体酵母を産生する工程;
(iii)前記ヒト化抗体又は断片を安定的に発現する倍数体酵母細胞を選択する工程;及び
(iv)少なくとも10〜25mg/リットルの前記ヒト化抗体又は断片を培養基へ安定的に発現する前記倍数体酵母細胞より、安定した倍数体酵母培養物を産生する工程を含んでなる、前記方法。
【請求項79】
前記酵母が以下の属:アルキシオザイマ(Arxiozyma);アスコボトリオザイマ(Ascobotryozyma);シテロマイセス(Citeromyces);デバリオマイセス(Debaryomyces);デッケラ(Dekkera);エレモセシウム(Eremothecium);イサットヘンキア(Issatchenkia);カザクスタニア(Kazachstania);クルイベロマイセス(Kluyveromyces);コダマエア(Kodamaea);ロデロマイセス(Lodderomyces);パチソレン(Pachysolen);ピキア(Pichia);サッカロマイセス(Saccharomyces);サツニスポラ(Saturnispora);テトラピシスポラ(Tetrapisispora);トルラスポラ(Torulaspora);ウィリオプシス(Williopsis);及びザイゴサッカロマイセス(Zygosaccharomyces)より選択される、請求項78の方法。
【請求項80】
前記酵母属がピキアである、請求項79の方法。
【請求項81】
ピキアの種が、ピキア・パストリス(Pichia pastoris)、ピキア・メタノリカ(Pichia metanolica)、及びハンセヌラ・ポリモルファ(Hansenula polymorpha)(ピキア・アングスタ(Pichia angusta))より選択される、請求項80の方法。
【請求項82】
請求項23〜34又は43〜58のいずれか1項によって産生されるヒト化抗体ポリペプチドを含有するヒト化抗体又は抗体断片であって、5x10−7M−1、10−7M−1、5x10−8M−1、10−8M−1、5x10−9M−1、10−9M−1、5x10−10M−1、10−10M−1、5x10−11M−1、10−11M−1、5x10−12M−1、10−12M−1、5x10−13M−1、10−13M−1、又は5x10−14M−1以下の解離定数(KD)で抗原へ結合する、前記ヒト化抗体又は断片。
【請求項83】
5x10−10M−1以下の解離定数(KD)で抗原へ結合する、請求項82のヒト化抗体。
【請求項84】
10−4S−1、5x10−5S−1、10−5S−1、5x10−6S−1、10−6S−1、5x10−7S−1、又は10−7S−1以下の解離速度(Koff)で抗原へ結合する、請求項82のヒト化抗体。
【請求項85】
親ウサギ抗体が1以上のウサギB細胞集団に由来する、請求項82のヒト化抗体。
【請求項86】
IL−6のIL−6Rとの会合、又はTNFとその受容体との会合を阻害する、請求項82のヒト化抗体。
【請求項87】
IL−6Rが可溶性L−6R(sIL−6R)である、請求項86のヒト化抗体。
【請求項88】
TNF受容体(TNFR)が可溶性である、請求項86のヒト化抗体。
【請求項89】
請求項1〜22又は82〜88のいずれか1項に記載のヒト化ウサギ抗体を発現するベクター。
【請求項90】
請求項89のベクターを含んでなる宿主細胞。
【請求項91】
ピキア属に属する酵母細胞である、請求項90の宿主細胞。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2010−528589(P2010−528589A)
【公表日】平成22年8月26日(2010.8.26)
【国際特許分類】
【出願番号】特願2010−509535(P2010−509535)
【出願日】平成20年5月21日(2008.5.21)
【国際出願番号】PCT/US2008/064421
【国際公開番号】WO2008/144757
【国際公開日】平成20年11月27日(2008.11.27)
【出願人】(508343375)アルダー・バイオファーマシューティカルズ・インコーポレーテッド (3)
【Fターム(参考)】
【公表日】平成22年8月26日(2010.8.26)
【国際特許分類】
【出願日】平成20年5月21日(2008.5.21)
【国際出願番号】PCT/US2008/064421
【国際公開番号】WO2008/144757
【国際公開日】平成20年11月27日(2008.11.27)
【出願人】(508343375)アルダー・バイオファーマシューティカルズ・インコーポレーテッド (3)
【Fターム(参考)】
[ Back to top ]

