新規アジュバント
【課題】 アラム等の既存のアジュバントと比較して抗体産生能、安全性および利便性に優れた新規なアジュバントを提供することにある。
【解決手段】 生体内に存在する水溶性物質であるピロロキノリンキノン類(PQQ:Pyrroloquinoline Quinone)及び/またはその塩を含有するアジュバント、及び当該アジュバントと抗原を含有するワクチン、当該アジュバント及びワクチンの製造方法、及び当該アジュバント及びワクチンの投与方法を提供する。
【解決手段】 生体内に存在する水溶性物質であるピロロキノリンキノン類(PQQ:Pyrroloquinoline Quinone)及び/またはその塩を含有するアジュバント、及び当該アジュバントと抗原を含有するワクチン、当該アジュバント及びワクチンの製造方法、及び当該アジュバント及びワクチンの投与方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ピロロキノリンキノン(以下、PQQ:Pyrroloquinoline Quinone)のアジュバント用途に関する。
【背景技術】
【0002】
ワクチンは抗原性物質と同時に、アジュバント、希釈剤、保存剤、安定化剤および緩衝化剤のような物質を必要に応じて含みうる。特に、アジュバントは、抗原と共に投与され、投与した抗原に対する免疫応答を増強する物質であり、その作用は(1)抗原を吸着して抗原提示細胞への取り込みを高めたり、(2)抗原を局所に長時間とどめて、徐々に放出することにより抗原刺激を持続させたり、(3)直接免疫担当細胞を活性化するなどアジュバンドの種類によって様々である。従って、アジュバントはワクチンの用量や投与回数、ワクチン中の抗原量を低減させる点で非常に有用である。そのため、これまでワクチンの作用を増強させるアジュバントに関する様々な研究がなされているが、実際に医療現場で使用されているものは極めて少ない。代表的なアジュバントとして、多くのワクチンに利用されているのが水酸化アルミニウム(以下、アラムアジュバント)であるが、アジュバント活性の強さが十分でない点、可溶性でないために抗原との均一な混合化が困難であり、経鼻または経皮投与用デバイスとの組合せが難しい等の利便性の観点から、理想的なアジュバントとは言い難い。アラムアジュバント以外では、スクアレンやMPL(monophosphoryl lipid)などがあるが、アジュバント活性が強い反面、副反応も強く、水に溶けにくいという弱点を有している。そのため、医療現場では、人体へ高い免疫反応を惹起し、副作用が少なく、利便性の向上したアジュバントの開発が切望されている。
【0003】
一方、ピロロキノリンキノン(以下、PQQ:Pyrroloquinoline quinone)は、1964年にHaugeらにより、細菌のグルコース脱水素酵素に含まれる酸化還元補酵素として見出された物質である(非特許文献1:Hauge JG.et al)。その後、メタノール資化性細菌からも抽出され、その分子構造が決定されている(非特許文献2:Salisbury SA.et al)。PQQやその誘導体(以下、併せてPQQ類とする)やPQQ類の塩は、真核生物のカビ、酵母、さらには、哺乳動物にも存在することが確認されており、PQQを欠乏させたマウスでは繁殖能力の低下や成長障害、皮膚状態の悪化などが起こることも観察されている(非特許文献3:Killgore J .et al)。その他、哺乳動物体内におけるビタミン機能(非特許文献4:Kasahara T .et al)、脳機能改善作用(非特許文献5:J. Clin. Biochem. Nutr., 42, 29-34, 2008)、活性酸素除去作用(特許文献1:特開平5-078247号公報)、細胞の増殖促進作用(特許文献2:特開昭61-58584号公報)、抗アレルギー作用(特許文献3:特開昭63-17493号公報)、アルドース還元酵素阻害作用(特許文献4:特開平6-256191号公報)、メラニン産生抑制および美白作用(特許文献5:特開平8-020512号公報)、紫外線吸収作用(特許文献6:特許第3625493号公報)、神経成長因子産生促進作用(特許文献7:特開平6-211660号公報)、インターロイキン6産生抑制作用(特許文献8:特開2009−221154)、等が公知である。このような多様な作用の報告にも拘らず、上記PQQ類やその塩がアジュバント活性を有することは知られておらず、当該物質と抗原を含有させたワクチンや当該物質を含有するアジュバントの報告も未だなされていない。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平5-078247号公報
【特許文献2】特開昭61-58584号公報
【特許文献3】特開昭63-17493号公報
【特許文献4】特開平6-256191号公報
【特許文献5】特開平8-020512号公報
【特許文献6】特許第3625493号公報
【特許文献7】特開平6-211660号公報
【特許文献8】特開2009-221154号公報
【非特許文献】
【0005】
【非特許文献1】Hauge JG. Glucose dehydrogenase of bacterium anitratum: an enzyme with a novel prosthetic group. J Biol Chem 239: 3630-9. 1964
【非特許文献2】Salisbury SA, Forrest HS, Cruse WB, Kennard O. A novel coenzyme from bacterial primary alcohol dehydrogenases. Nature 280 (5725): 843-4. 1979
【非特許文献3】Killgore J, Smidt C, Duich L, Romero-Chapman N, Tinker D, Reiser K, Melko M, Hyde D, Rucker RB. Nutritional importance of pyrroloquinoline quinone. Science. Aug 25;245(4920):850-2. 1989
【非特許文献4】Kasahara T, Kato T. Nutritional biochemistry. A new redox-cofactor vitamin for mammals. Nature 422 (6934): 832. 2003
【非特許文献5】Kei Ohwada, Hironobu Takeda, Makiko Yamazaki, Hirosi Isogai, Masahiko Nakano, Masao Shimomura, Koji Fukui and Shiro Urano. Pyrroloquinoline Quinone (PQQ) Prevents Cognitive Deficit Caused by Oxidative Stress in Rats. J. Clin. Biochem. Nutr. 42, 29-34, 2008
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明者等は、従来から汎用されているアラムアジュバントの欠点(不溶性に伴う利便性の悪さやアジュバント力の弱さ)、スクアレンなどの新しいアジュバントの欠点(副反応の強さ)を克服するために、より強力で安全なアジュバントを検討した。本発明では抗原の免疫原性を高め、安全性に富み、利便性の向上したアジュバンドを提供することにある。
【課題を解決するための手段】
【0007】
斯かる実情を鑑みて、本発明者等は、十分な抗体産生能を発揮し、安全性に優れ、利便性の向上したワクチン組成物及びアジュバントを鋭意検討した結果、ピロロキノリンキノン(PQQ)が優れたアジュバント効果を発揮するという従来の報告に無い極めて新しい知見を見出した。加えて、PQQは水溶性物質であるため、抗原との調剤が容易であり、哺乳動物の体内や各種食料品にも含まれるため、人体への安全性も優れている。そのため、本発明では、PQQ類及び/またはその塩を用いることで、抗体産生能、安全性、及び利便性に優れる、ワクチンまたはアジュバントを提供することが可能になった。すなわち、本願発明は、以下に示す通りである。
【0008】
[1]下記一般式(1)で表されるピロロキノリン類及び/またはその塩、及び抗原を含有するワクチン。
一般式(1)
【0009】
【化1】

[式中、R1、R2、R3はそれぞれ独立して、アルキル基、アルケニル基、アラルキル基、アラアリ−ル基、フェニル基、水素原子、アルキルアリール基、アルキニル基、ベンジル基、プロパギル基、又はアルコキシカルボニルアルキル基を表す。]
[2]前記一般式(1)で表される化合物は、下記の一般式(2)で表されるピロロキノリンキノン及び/またはその塩であることを特徴とする、[1]に記載のワクチン。
一般式(2)
【0010】
【化2】

[3]前記ピロロキノリンキノンの塩がピロロキノリンキノン二ナトリウムであることを特徴とする、[2]に記載のワクチン。
[4]前記抗原がインフルエンザウイルス抗原であることを特徴とする[1]ないし[3]のいずれか1項に記載のワクチン。
[5]前記インフルエンザウイルス抗原がヘマグルチニン(HA)、ノイラミニダーゼ(NA)、マトリックス1(M1)、マトリックス2(M2)、核タンパク(NP)からなる群より選ばれた少なくとも1種又は2種以上の抗原であることを特徴とする[4]に記載のワクチン
[6]前記抗原が抗原を構成する全長のアミノ酸配列、または前記アミノ酸配列のうち1もしくは数個のアミノ酸が欠失、置換もしくは付加されたアミノ酸配列、または前記のいずれかのアミノ酸配列の部分配列、もしくは前記アミノ酸配列を含有するポリペプチドであることを特徴とする[5]に記載のワクチン。
[7]前記[1]から[6]のいずれか1項に記載のワクチンの製造方法。
[8]前記[1]から[6]のいずれか1項に記載のワクチンを用いた投与方法。
[9]前記一般式(1)で表されるピロロキノリン類及び/またはその塩を含有するアジュバント。
[10]前記一般式(1)で表される化合物は、前記一般式(2)で表されるピロロキノリンキノン及び/またはその塩であることを特徴とする、[9]に記載のアジュバント。
[11]前記ピロロキノリンキノンの塩がピロロキノリンキノン二ナトリウムであることを特徴とする、[10]に記載のアジュバント。
[12]前記[9]から[11]のいずれか1項に記載のアジュバントの製造方法。
[13]前記[9]から[11]のいずれか1項に記載のアジュバントを用いた投与方法。
【発明の効果】
【0011】
本発明によれば、PQQ類及び/またはその塩と抗原を共に投与することで、抗原単独で投与した場合と比較して、免疫原生を向上させることが可能となる。また、PQQ類やその塩は既存のアジュバント(アラムアジュバント)と比較しても、優れた抗体産生効果を奏する。
【0012】
PQQは生体内に元来存在する水溶性の物質であるため、従来のアラムアジュバントやオイル系アジュバントと比べて、副作用発生のリスクが軽減され、抗原との調剤も容易である。そのため、本発明のPQQ類及び/またはその塩を含有するワクチンやアジュバントは、従来のアジュバントを含有するワクチンやアジュバントと比べて、人体への安全性に優れ、利便性も向上している。また、PQQ類やその塩は微生物による量産化も可能であるため、医薬品の製造規模でワクチン用アジュバントとして提供することも可能である。
【発明を実施するための形態】
【0013】
本発明はピロロキノリンキノンまたはその誘導体(以下、PQQ類)及び/またはその塩、及び抗原を含有するワクチン、PQQ類及び/またはその塩を含有するアジュバント、当該ワクチンまたはアジュバントの製造方法、当該ワクチンまたはアジュバントによる免疫方法に関する。
【0014】
前記ワクチンとは、生体に免疫を作らせて疾患を予防及び/または治療するために用いられる医薬組成物を意味し、治療用ワクチン、予防用ワクチン、及び治療用途と予防用途の両用途を備えたワクチンを含みうる。
【0015】
前記アジュバントとは、抗原とともに生体に投与されることによって、投与した抗原に対する免疫応答を増強させる物質を意味する。
【0016】
前記抗原とは、宿主の免疫系を刺激して、その抗原が提示された場合に細胞抗原特異的免疫応答及び/または体液性抗体応答を行わせる1以上のエピトープを含む分子を意味する。
【0017】
前記PQQ類は、下記一般式(1)に表される化合物であることを特徴とする。
一般式(1)
【0018】
【化3】

一般式(1)において、R1、R2、R3はそれぞれ独立して、アルキル基、アルケニル基、アラルキル基、アラアリ−ル基、フェニル基、水素原子、アルキルアリール基、アルキニル基、ベンジル基、プロパギル基、又はアルコキシカルボニルアルキル基などが例示される。
【0019】
前記PQQ類の塩は、一般式(1)で表されるPQQ類の薬理学的に許容される塩であることを特徴とする。塩としては、ナトリウム塩、カリウム塩等のアルカリ金属塩、マグネシウム塩、カルシウム塩等のアルカリ土類金属塩、アンモニウム、トリエタノールアミン、トリメチルアミン等の有機アミン塩、リジン、アルギニン等の塩基性アミノ酸塩等が挙げられる。
【0020】
前記PQQ類やその塩のうち、好ましいものを具体的に例示すれば、R1、R2、R3が共に水素原子である下記のピロロキノリンキノン(化合物2)または、ピロロキノリンキノン二ナトリウムである。
【0021】
ピロロキノリンキノン(化合物2)
【0022】
【化4】

前記PQQ類やその塩の入手方法は、微生物(メタノール資化性菌など)を培養して精製し得る方法、化学合成により得る方法(例えば、特開平8−20512号公報)、市販品を購入する方法であっても良い。
【0023】
前記抗原の種類は、サブユニット抗原、不活性化抗原、弱毒化抗原、組換え体抗原であっても良い。
【0024】
前記抗原は化学的には、炭水化物、糖脂質、糖タンパク質、脂質、リポタンパク質、リン脂質、ポリペプチド、タンパク質、ポリヌクレオチド、オリゴヌクレオチド、またはこれらの化学的または組換え型結合体であっても良い。
【0025】
前記抗原は、ウイルス、細菌、真菌、寄生虫微生物、癌細胞、腫瘍細胞、アレルゲン、自己分子、細胞(例えば、腫瘍細胞または正常細胞)を感染することができる病原体、であっても良い。
【0026】
前記抗原の入手方法は、遺伝子組換え手段、化学合成、または天然物から得ても良い。
【0027】
前記細菌の種類は、例えば、アクチノバチラス プルロニューモニエ、アロイオコックス オティディティス、インフルエンザ菌(型分類可能および型分類不可能の双方)、エルシニア菌、オウム病クラミジア、キャンピロバクター、クラミジア肺炎病原体、クロストリジア種、コレラ菌、サルモネラ コレレシウス、ジアルジア、ジフテリア菌、シュードモナス種、ストレプトコッカス・ゴルドニ、ストレプトコッカス・サーモフィルス、ストレプトコッカス・ボビス、ストレプトコックス アガラクチエ、トラコーマクラミジア、トリ結核菌群、ネズミチフス菌、パスツレラ ヘモリチカ、パスツレラ マルトシダ、ヒト結核菌、ブタ連鎖球菌、プロテウス ブルガリス、プロテウス ミラビリス、ヘモフィルス ソムヌス、ヘリコバクター ピロリ、ボレリア ブルグドルフェリ、マイコプラスマ ガリセプチクム、モラクセラ カタラリス、レプトスピラ インテロガンス、黄色ブドウ球菌、化膿連鎖球菌、髄膜炎菌、赤痢菌、腺疫菌、大腸菌、炭疽菌、腸チフス菌、破傷風菌、肺炎連鎖球菌、百日咳菌、表皮ブドウ球菌、糞便連鎖球菌、緑色連鎖球菌、淋菌であっても良い。
【0028】
前記ウイルスの種類は、例えば、肝炎ウイルス、RSウイルス、アデノウイルス、アブラウイルス、イサウイルス、イヌジステンパーウイルス、インフルエンザウイルスA〜C、ウマ動脈炎ウイルス、エボラウイルス、エンテロウイルス、カリチウイルス、コロナウイルス、サル免疫不全ウイルス、ソゴトウイルス、デングウイルス、トガウイルス、トリ感染性滑液嚢疾患ウイルス、トリ肺炎ウイルス(以前はシチメンチョウ鼻気管炎ウイルス)、ニパーウイルス、ニューカッスル病ウイルス、ニューモウイルスネコ感染性腹膜炎ウイルス、ネコ白血病ウイルス、ノーウォークウイルス、パピローマウイルス、パポーバウイルス、パラインフルエンザウイルスタイプ1−3、パルボウイルス、ピコルナウイルスヒトサイトメガロウイルス、ヒト肺炎後ウイルス、ヒト免疫不全症ウイルス、ブタ呼吸傷害・繁殖症候群ウイルス、フラビウイルス、ヘニパウイルス、ヘパドナウイルス、ヘルペスウイルス、ヘンドラウイルス、ポリオウイルス、マラリア抗原、マレック病ウイルス、メタニューモウイルス 、モルビリウイルス、ライノウイルス、ルブラウイルス、レスピロウイルス、レトロウイルス、ロタウイルス、ワクシニア、黄熱ウイルス、感染性鼻気管炎ウイルス、牛疫ウイルス、狂犬病ウイルス、水痘ウイルス、脳炎ウイルス、風疹ウイルス、麻疹ウイルス、流行性耳下腺炎ウイルスであっても良い。
【0029】
前記寄生虫の種類は、例えば、赤痢アメーバ、プラスモジウム属、森林型熱帯リーシュマニア、回虫属、鞭虫属、ジアルジア属、住吸血虫属、クリプトスポリジウム属、トリコモナス属、トキソプラスマ、ニューモシスティス カリニであっても良い。
【0030】
前記インフルエンザウイルスは、オルソミクソウイルス科に属する直径約100nmの粒子径サイズを有するRNAエンベロープウイルスであり、内部タンパク質の抗原性に基づいて、A,B及びC型に分けられる。そのなかでヒトと動物の両方に感染するのがA型で多様性も多い。そのA型は、ヘマグルチニン(HA)及びノイラミニダーゼ(NA)の2種類のエンベロープ糖タンパク質を有し、抗原性の違いによってHAでは16種類、NAでは9種類が存在するために、その組み合わせにより多くのA型インフルエンザウイルスが存在する。過去に発生していない組み合わせのインフルエンザウイルスが出現したときには、それに対する免疫が我々にはないために大流行となる。所謂、インフルエンザパンデミックである。本発明では、インフルエンザウイルスの型や亜型は特に限定されず、その抗原もHA、NAだけでなく、M1、M2、NPなどのウイルスを構成するタンパクでもよい。代表例として挙げられるのが現状のインフルエンザワクチンで使用されているHAである。
【0031】
前記インフルエンザウイルス抗原の調製方法は、特に限定されるものではなく、公知の方法が限定なく使用できる。例えば、インフルエンザ感染動物またはインフルエンザの患者から単離されたウイルス株を鶏卵や細胞などに感染させて常法により培養し、精製したウイルス原液から抗原を調製しても良い。また、遺伝子工学的に組換えウイルス或は特定抗原を種々の細胞で産生或は発現させたものを材料として抗原を調製することも可能である。
【0032】
前記インフルエンザウイルス抗原は、抗原を構成する全長のアミノ酸配列、または前記アミノ酸配列のうち1もしくは数個のアミノ酸が欠失、置換もしくは付加されたアミノ酸配列、または前記のいずれかのアミノ酸配列の部分配列、もしくは前記アミノ酸配列を含有するポリペプチド鎖であっても良い。
【0033】
前記ワクチンは、単一の抗原を含む場合、または複数種の抗原を含む場合であっても良い。
【0034】
前記ワクチンの剤形は、PQQ類やその塩と抗原が単一容器にて製剤化された状態でも良く、PQQ類やその塩と抗原が個別の容器に製剤化された状態でも良い。なお、製剤化される際の剤形は、例えば、液状、粉末状(凍結乾燥粉末、乾燥粉末)、カプセル状、錠剤、凍結状態、等であっても良い。
【0035】
前記アジュバントの剤形は、例えば、液状、粉末状(凍結乾燥粉末、乾燥粉末)、カプセル状、錠剤、凍結状態、等であっても良い。
【0036】
前記ワクチンおよびアジュバントは、PQQおよび抗原以外に、医薬として許容されうる担体を含んでいてもよい。前記医薬として共用されうる単体としては、ワクチン製造に通常用いられる単体を限定なく使用することができ、具体的には、食塩水、緩衝食塩水、デキストロース、水、グリセロール、等張水性緩衝液及びそれらの組み合わせが挙げられる、また、これに乳化剤、保存剤(例、チメロサール)、等張化剤、pH調整剤及び不活化剤(例、ホルマリン)などが適宜配合される。
【0037】
前記ワクチン及びアジュバントの投与対象は、免疫可能な任意の生物であり得る。特に、ヒトおよび他の哺乳動物(例えば、家畜、ペット、および野生動物)、等であっても良い。
【0038】
前記ワクチン及びアジュバントの投与経路は、例えば、経皮投与、舌下投与、点眼投与、皮内投与、筋肉内投与、経口投与、経腸投与、経鼻投与、静脈内投与、皮下投与、腹腔内投与、口から肺への吸入投与、等であっても良い。
【0039】
前記ワクチン及びアジュバントの投与方法は、例えば、ステント、カテーテル、経皮的パッチ、マイクロニードル、移植可能な徐放性デバイス、シリンジ、マイクロニードルを付けたシリンジ、無針装置、スプレーによって投与する方法等であっても良い。また、抗原とアジュバントが個別の容器にて製剤されている場合には、製剤された抗原とアジュバントを同時に投与しても良く、抗原またはアジュバントを投与して一定期間後にもう一方を投与しても良い。
【0040】
以下、実施例により本発明を詳細に説明するが、本発明はこれらの実施例に何ら限定されるものではない。
【実施例1】
【0041】
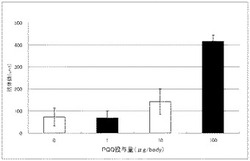
アジュバントとして使用したPQQ溶液は以下のようにして調製した。28%アンモニア水(ナカライテスク株式会社製、Code 025-12)を注射用蒸留水(大塚製薬株式会社製)で300倍に希釈した溶液を調製し、この希釈アンモニア溶液を用いてPQQ(ピロロキノリンキノン二ナトリウム、和光純薬工業株式会社、Code No. 168-17081)を溶解し、終濃度10mg/mLとした。
【0042】
抗原としては、インフルエンザウイルスHA抗原(A/ソロモン株)を用いた。本抗原のみを免疫した場合と、本抗原とPQQを共に免疫した場合とを比較した。抗原はマウス1匹あたり0.3μgとし、PQQはマウス1匹あたりの量を0μg、1μg、10μg、100μgと変えて抗原と共に投与した。マウス及び免疫方法は次のように行った。
【0043】
BALB/cマウス 6週齢の雌の体重を測定し、均等になるように1群3匹、4群に分けた。各個体はアニマルマーカーで個体識別した。被験物投与の当日、イソフルラン吸入麻酔下で眼窩静脈叢より、キャピラリーを用いて採血した。遠心分離後、血清をチューブに分取した。被験物はディスポーザブルの1mL用シリンジ(テルモ社製)に0.1mLとり、マウスの頸背部皮下に投与した。
【0044】
被験物投与後14日目にイソフルラン吸入麻酔下で開腹し、腹腔内後大静脈より全採血した。血液は室温で30分以上静置したのち、3000rpm 10分間遠心して血清を分離した。このようにして免疫および採血後にそれら血清中の抗原に対する抗体を下記のELISA法にて測定した。
【0045】
免疫した抗原と同じものを1μg/mL濃度で、ELISAプレートへ50μL/well投入し、自然吸着により4℃で一晩静置して固相化した。PBS(当日調製)にて3回洗浄後、BlockerTM Casein in PBS (Thermo社製)200μL/wellを投入し、室温で1時間反応させた。PBSにて3回洗浄後、抗血清(day0、14)をBlockerTM Casein in PBSにて200、400、800倍に希釈し、50μL/well投入し室温で、2時間反応させた。抗マウスIgG-POD標識抗体 (Thermo社製)をBlockerTM Casein in PBSで2,000倍に希釈したものを50μL/well投入し、室温で1時間反応させた。PBSにて4回洗浄後、基質TMB(BioFX社製)を50μL/well投入し、室温で15分反応後、1N H2SO4を50μL/well投入し反応を停止させた。450nmの吸光度を測定した。
【0046】
抗体価は、以下のようにして算出した。すなわち、抗原を固相化せず、ブロッキング操作を行ったELISAプレートに上記同様に抗血清を添加して、以降、同様に操作を行い抗血清のバックグラウンド値を測定した。このバックグラウンド値の3倍を越える吸光度を示した最大の希釈倍率の抗血清の吸光度にその希釈倍率を乗じて、その抗血清の抗体価とした。その結果、PQQと抗原を共に免疫した群では、抗原だけを免疫した群と比較して明らかにPQQのアジュバント効果が認められた(図1)。
【実施例2】
【0047】
実施例1の結果から、PQQのアジュバント効果が認められたので、その最適量と既存のアジュバントであるアラムアジュバントとの比較検討を行った。実施例1ではPQQの量を1〜100μg/bodyと変化させた結果、100μg/bodyが最も高いアジュバント効果を示したので、さらにPQQ量を増やした場合の効果を調べた。実験方法は実施例1と同じ方法で行った。PQQ量として100、300、900μg/bodyをHA抗原(0.3μg/body)と共に投与して、アラムアジュバント投与群と比較した。その結果、全てのPQQ投与群においてアジュバント効果が認められ、中でもPQQ量が300μg/bodyの投与群で高いアジュバント効果が認められた(図2)。
【0048】
さらに細かいPQQの最適量の設定と既存のアジュバントであるアラムアジュバントとの比較検討を行った。PQQ量として100μg/body〜600μg/bodyをHA抗原(0.3μg/body)と共に投与して、アラムアジュバント投与群と比較した。その結果、全てのPQQ投与群においてアジュバント効果が認められ、中でもPQQの量が100μg/body〜500μg/bodyの投与群では既存のアラムアジュバントと同等、あるいはそれ以上の高いアジュバント効果が認められた(図3)。PQQを投与されたマウスに異常は観察されなかった。
【0049】
実施例1および2の結果から、PQQには明らかなアジュバント効果が観察され、その効果は既存のアラムアジュバントより高くできることが明らかとなった。加えて、PQQを投与されたマウスには異常は認められなかったため、既存のアジュバントと比較して安全性に優れている。
【産業上の利用可能性】
【0050】
本発明ではPQQ類及び/またはその塩を含有するアジュバント、当該アジュバントを含有するワクチンを提供する。PQQ及びその塩は、生体にとっても有用であり、水溶性の物質であるため、従来のアラムアジュバントやオイル系アジュバントと比べて、安全性が高く、調剤面で利便性に優れたワクチン及びアジュバントを提供することが可能となる。
【図面の簡単な説明】
【0051】
【図1】PQQを1〜100μg/bodyでマウスへ投与した際の抗体価の測定結果である。
【図2】PQQを100〜900μg/bodyでマウスへ投与した際の抗体価の測定結果である。
【図3】PQQを100〜600μg/body、比較対照としてアラムアジュバントをマウスへ投与した際の抗体価の測定結果である。
【技術分野】
【0001】
本発明は、ピロロキノリンキノン(以下、PQQ:Pyrroloquinoline Quinone)のアジュバント用途に関する。
【背景技術】
【0002】
ワクチンは抗原性物質と同時に、アジュバント、希釈剤、保存剤、安定化剤および緩衝化剤のような物質を必要に応じて含みうる。特に、アジュバントは、抗原と共に投与され、投与した抗原に対する免疫応答を増強する物質であり、その作用は(1)抗原を吸着して抗原提示細胞への取り込みを高めたり、(2)抗原を局所に長時間とどめて、徐々に放出することにより抗原刺激を持続させたり、(3)直接免疫担当細胞を活性化するなどアジュバンドの種類によって様々である。従って、アジュバントはワクチンの用量や投与回数、ワクチン中の抗原量を低減させる点で非常に有用である。そのため、これまでワクチンの作用を増強させるアジュバントに関する様々な研究がなされているが、実際に医療現場で使用されているものは極めて少ない。代表的なアジュバントとして、多くのワクチンに利用されているのが水酸化アルミニウム(以下、アラムアジュバント)であるが、アジュバント活性の強さが十分でない点、可溶性でないために抗原との均一な混合化が困難であり、経鼻または経皮投与用デバイスとの組合せが難しい等の利便性の観点から、理想的なアジュバントとは言い難い。アラムアジュバント以外では、スクアレンやMPL(monophosphoryl lipid)などがあるが、アジュバント活性が強い反面、副反応も強く、水に溶けにくいという弱点を有している。そのため、医療現場では、人体へ高い免疫反応を惹起し、副作用が少なく、利便性の向上したアジュバントの開発が切望されている。
【0003】
一方、ピロロキノリンキノン(以下、PQQ:Pyrroloquinoline quinone)は、1964年にHaugeらにより、細菌のグルコース脱水素酵素に含まれる酸化還元補酵素として見出された物質である(非特許文献1:Hauge JG.et al)。その後、メタノール資化性細菌からも抽出され、その分子構造が決定されている(非特許文献2:Salisbury SA.et al)。PQQやその誘導体(以下、併せてPQQ類とする)やPQQ類の塩は、真核生物のカビ、酵母、さらには、哺乳動物にも存在することが確認されており、PQQを欠乏させたマウスでは繁殖能力の低下や成長障害、皮膚状態の悪化などが起こることも観察されている(非特許文献3:Killgore J .et al)。その他、哺乳動物体内におけるビタミン機能(非特許文献4:Kasahara T .et al)、脳機能改善作用(非特許文献5:J. Clin. Biochem. Nutr., 42, 29-34, 2008)、活性酸素除去作用(特許文献1:特開平5-078247号公報)、細胞の増殖促進作用(特許文献2:特開昭61-58584号公報)、抗アレルギー作用(特許文献3:特開昭63-17493号公報)、アルドース還元酵素阻害作用(特許文献4:特開平6-256191号公報)、メラニン産生抑制および美白作用(特許文献5:特開平8-020512号公報)、紫外線吸収作用(特許文献6:特許第3625493号公報)、神経成長因子産生促進作用(特許文献7:特開平6-211660号公報)、インターロイキン6産生抑制作用(特許文献8:特開2009−221154)、等が公知である。このような多様な作用の報告にも拘らず、上記PQQ類やその塩がアジュバント活性を有することは知られておらず、当該物質と抗原を含有させたワクチンや当該物質を含有するアジュバントの報告も未だなされていない。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平5-078247号公報
【特許文献2】特開昭61-58584号公報
【特許文献3】特開昭63-17493号公報
【特許文献4】特開平6-256191号公報
【特許文献5】特開平8-020512号公報
【特許文献6】特許第3625493号公報
【特許文献7】特開平6-211660号公報
【特許文献8】特開2009-221154号公報
【非特許文献】
【0005】
【非特許文献1】Hauge JG. Glucose dehydrogenase of bacterium anitratum: an enzyme with a novel prosthetic group. J Biol Chem 239: 3630-9. 1964
【非特許文献2】Salisbury SA, Forrest HS, Cruse WB, Kennard O. A novel coenzyme from bacterial primary alcohol dehydrogenases. Nature 280 (5725): 843-4. 1979
【非特許文献3】Killgore J, Smidt C, Duich L, Romero-Chapman N, Tinker D, Reiser K, Melko M, Hyde D, Rucker RB. Nutritional importance of pyrroloquinoline quinone. Science. Aug 25;245(4920):850-2. 1989
【非特許文献4】Kasahara T, Kato T. Nutritional biochemistry. A new redox-cofactor vitamin for mammals. Nature 422 (6934): 832. 2003
【非特許文献5】Kei Ohwada, Hironobu Takeda, Makiko Yamazaki, Hirosi Isogai, Masahiko Nakano, Masao Shimomura, Koji Fukui and Shiro Urano. Pyrroloquinoline Quinone (PQQ) Prevents Cognitive Deficit Caused by Oxidative Stress in Rats. J. Clin. Biochem. Nutr. 42, 29-34, 2008
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明者等は、従来から汎用されているアラムアジュバントの欠点(不溶性に伴う利便性の悪さやアジュバント力の弱さ)、スクアレンなどの新しいアジュバントの欠点(副反応の強さ)を克服するために、より強力で安全なアジュバントを検討した。本発明では抗原の免疫原性を高め、安全性に富み、利便性の向上したアジュバンドを提供することにある。
【課題を解決するための手段】
【0007】
斯かる実情を鑑みて、本発明者等は、十分な抗体産生能を発揮し、安全性に優れ、利便性の向上したワクチン組成物及びアジュバントを鋭意検討した結果、ピロロキノリンキノン(PQQ)が優れたアジュバント効果を発揮するという従来の報告に無い極めて新しい知見を見出した。加えて、PQQは水溶性物質であるため、抗原との調剤が容易であり、哺乳動物の体内や各種食料品にも含まれるため、人体への安全性も優れている。そのため、本発明では、PQQ類及び/またはその塩を用いることで、抗体産生能、安全性、及び利便性に優れる、ワクチンまたはアジュバントを提供することが可能になった。すなわち、本願発明は、以下に示す通りである。
【0008】
[1]下記一般式(1)で表されるピロロキノリン類及び/またはその塩、及び抗原を含有するワクチン。
一般式(1)
【0009】
【化1】

[式中、R1、R2、R3はそれぞれ独立して、アルキル基、アルケニル基、アラルキル基、アラアリ−ル基、フェニル基、水素原子、アルキルアリール基、アルキニル基、ベンジル基、プロパギル基、又はアルコキシカルボニルアルキル基を表す。]
[2]前記一般式(1)で表される化合物は、下記の一般式(2)で表されるピロロキノリンキノン及び/またはその塩であることを特徴とする、[1]に記載のワクチン。
一般式(2)
【0010】
【化2】

[3]前記ピロロキノリンキノンの塩がピロロキノリンキノン二ナトリウムであることを特徴とする、[2]に記載のワクチン。
[4]前記抗原がインフルエンザウイルス抗原であることを特徴とする[1]ないし[3]のいずれか1項に記載のワクチン。
[5]前記インフルエンザウイルス抗原がヘマグルチニン(HA)、ノイラミニダーゼ(NA)、マトリックス1(M1)、マトリックス2(M2)、核タンパク(NP)からなる群より選ばれた少なくとも1種又は2種以上の抗原であることを特徴とする[4]に記載のワクチン
[6]前記抗原が抗原を構成する全長のアミノ酸配列、または前記アミノ酸配列のうち1もしくは数個のアミノ酸が欠失、置換もしくは付加されたアミノ酸配列、または前記のいずれかのアミノ酸配列の部分配列、もしくは前記アミノ酸配列を含有するポリペプチドであることを特徴とする[5]に記載のワクチン。
[7]前記[1]から[6]のいずれか1項に記載のワクチンの製造方法。
[8]前記[1]から[6]のいずれか1項に記載のワクチンを用いた投与方法。
[9]前記一般式(1)で表されるピロロキノリン類及び/またはその塩を含有するアジュバント。
[10]前記一般式(1)で表される化合物は、前記一般式(2)で表されるピロロキノリンキノン及び/またはその塩であることを特徴とする、[9]に記載のアジュバント。
[11]前記ピロロキノリンキノンの塩がピロロキノリンキノン二ナトリウムであることを特徴とする、[10]に記載のアジュバント。
[12]前記[9]から[11]のいずれか1項に記載のアジュバントの製造方法。
[13]前記[9]から[11]のいずれか1項に記載のアジュバントを用いた投与方法。
【発明の効果】
【0011】
本発明によれば、PQQ類及び/またはその塩と抗原を共に投与することで、抗原単独で投与した場合と比較して、免疫原生を向上させることが可能となる。また、PQQ類やその塩は既存のアジュバント(アラムアジュバント)と比較しても、優れた抗体産生効果を奏する。
【0012】
PQQは生体内に元来存在する水溶性の物質であるため、従来のアラムアジュバントやオイル系アジュバントと比べて、副作用発生のリスクが軽減され、抗原との調剤も容易である。そのため、本発明のPQQ類及び/またはその塩を含有するワクチンやアジュバントは、従来のアジュバントを含有するワクチンやアジュバントと比べて、人体への安全性に優れ、利便性も向上している。また、PQQ類やその塩は微生物による量産化も可能であるため、医薬品の製造規模でワクチン用アジュバントとして提供することも可能である。
【発明を実施するための形態】
【0013】
本発明はピロロキノリンキノンまたはその誘導体(以下、PQQ類)及び/またはその塩、及び抗原を含有するワクチン、PQQ類及び/またはその塩を含有するアジュバント、当該ワクチンまたはアジュバントの製造方法、当該ワクチンまたはアジュバントによる免疫方法に関する。
【0014】
前記ワクチンとは、生体に免疫を作らせて疾患を予防及び/または治療するために用いられる医薬組成物を意味し、治療用ワクチン、予防用ワクチン、及び治療用途と予防用途の両用途を備えたワクチンを含みうる。
【0015】
前記アジュバントとは、抗原とともに生体に投与されることによって、投与した抗原に対する免疫応答を増強させる物質を意味する。
【0016】
前記抗原とは、宿主の免疫系を刺激して、その抗原が提示された場合に細胞抗原特異的免疫応答及び/または体液性抗体応答を行わせる1以上のエピトープを含む分子を意味する。
【0017】
前記PQQ類は、下記一般式(1)に表される化合物であることを特徴とする。
一般式(1)
【0018】
【化3】

一般式(1)において、R1、R2、R3はそれぞれ独立して、アルキル基、アルケニル基、アラルキル基、アラアリ−ル基、フェニル基、水素原子、アルキルアリール基、アルキニル基、ベンジル基、プロパギル基、又はアルコキシカルボニルアルキル基などが例示される。
【0019】
前記PQQ類の塩は、一般式(1)で表されるPQQ類の薬理学的に許容される塩であることを特徴とする。塩としては、ナトリウム塩、カリウム塩等のアルカリ金属塩、マグネシウム塩、カルシウム塩等のアルカリ土類金属塩、アンモニウム、トリエタノールアミン、トリメチルアミン等の有機アミン塩、リジン、アルギニン等の塩基性アミノ酸塩等が挙げられる。
【0020】
前記PQQ類やその塩のうち、好ましいものを具体的に例示すれば、R1、R2、R3が共に水素原子である下記のピロロキノリンキノン(化合物2)または、ピロロキノリンキノン二ナトリウムである。
【0021】
ピロロキノリンキノン(化合物2)
【0022】
【化4】

前記PQQ類やその塩の入手方法は、微生物(メタノール資化性菌など)を培養して精製し得る方法、化学合成により得る方法(例えば、特開平8−20512号公報)、市販品を購入する方法であっても良い。
【0023】
前記抗原の種類は、サブユニット抗原、不活性化抗原、弱毒化抗原、組換え体抗原であっても良い。
【0024】
前記抗原は化学的には、炭水化物、糖脂質、糖タンパク質、脂質、リポタンパク質、リン脂質、ポリペプチド、タンパク質、ポリヌクレオチド、オリゴヌクレオチド、またはこれらの化学的または組換え型結合体であっても良い。
【0025】
前記抗原は、ウイルス、細菌、真菌、寄生虫微生物、癌細胞、腫瘍細胞、アレルゲン、自己分子、細胞(例えば、腫瘍細胞または正常細胞)を感染することができる病原体、であっても良い。
【0026】
前記抗原の入手方法は、遺伝子組換え手段、化学合成、または天然物から得ても良い。
【0027】
前記細菌の種類は、例えば、アクチノバチラス プルロニューモニエ、アロイオコックス オティディティス、インフルエンザ菌(型分類可能および型分類不可能の双方)、エルシニア菌、オウム病クラミジア、キャンピロバクター、クラミジア肺炎病原体、クロストリジア種、コレラ菌、サルモネラ コレレシウス、ジアルジア、ジフテリア菌、シュードモナス種、ストレプトコッカス・ゴルドニ、ストレプトコッカス・サーモフィルス、ストレプトコッカス・ボビス、ストレプトコックス アガラクチエ、トラコーマクラミジア、トリ結核菌群、ネズミチフス菌、パスツレラ ヘモリチカ、パスツレラ マルトシダ、ヒト結核菌、ブタ連鎖球菌、プロテウス ブルガリス、プロテウス ミラビリス、ヘモフィルス ソムヌス、ヘリコバクター ピロリ、ボレリア ブルグドルフェリ、マイコプラスマ ガリセプチクム、モラクセラ カタラリス、レプトスピラ インテロガンス、黄色ブドウ球菌、化膿連鎖球菌、髄膜炎菌、赤痢菌、腺疫菌、大腸菌、炭疽菌、腸チフス菌、破傷風菌、肺炎連鎖球菌、百日咳菌、表皮ブドウ球菌、糞便連鎖球菌、緑色連鎖球菌、淋菌であっても良い。
【0028】
前記ウイルスの種類は、例えば、肝炎ウイルス、RSウイルス、アデノウイルス、アブラウイルス、イサウイルス、イヌジステンパーウイルス、インフルエンザウイルスA〜C、ウマ動脈炎ウイルス、エボラウイルス、エンテロウイルス、カリチウイルス、コロナウイルス、サル免疫不全ウイルス、ソゴトウイルス、デングウイルス、トガウイルス、トリ感染性滑液嚢疾患ウイルス、トリ肺炎ウイルス(以前はシチメンチョウ鼻気管炎ウイルス)、ニパーウイルス、ニューカッスル病ウイルス、ニューモウイルスネコ感染性腹膜炎ウイルス、ネコ白血病ウイルス、ノーウォークウイルス、パピローマウイルス、パポーバウイルス、パラインフルエンザウイルスタイプ1−3、パルボウイルス、ピコルナウイルスヒトサイトメガロウイルス、ヒト肺炎後ウイルス、ヒト免疫不全症ウイルス、ブタ呼吸傷害・繁殖症候群ウイルス、フラビウイルス、ヘニパウイルス、ヘパドナウイルス、ヘルペスウイルス、ヘンドラウイルス、ポリオウイルス、マラリア抗原、マレック病ウイルス、メタニューモウイルス 、モルビリウイルス、ライノウイルス、ルブラウイルス、レスピロウイルス、レトロウイルス、ロタウイルス、ワクシニア、黄熱ウイルス、感染性鼻気管炎ウイルス、牛疫ウイルス、狂犬病ウイルス、水痘ウイルス、脳炎ウイルス、風疹ウイルス、麻疹ウイルス、流行性耳下腺炎ウイルスであっても良い。
【0029】
前記寄生虫の種類は、例えば、赤痢アメーバ、プラスモジウム属、森林型熱帯リーシュマニア、回虫属、鞭虫属、ジアルジア属、住吸血虫属、クリプトスポリジウム属、トリコモナス属、トキソプラスマ、ニューモシスティス カリニであっても良い。
【0030】
前記インフルエンザウイルスは、オルソミクソウイルス科に属する直径約100nmの粒子径サイズを有するRNAエンベロープウイルスであり、内部タンパク質の抗原性に基づいて、A,B及びC型に分けられる。そのなかでヒトと動物の両方に感染するのがA型で多様性も多い。そのA型は、ヘマグルチニン(HA)及びノイラミニダーゼ(NA)の2種類のエンベロープ糖タンパク質を有し、抗原性の違いによってHAでは16種類、NAでは9種類が存在するために、その組み合わせにより多くのA型インフルエンザウイルスが存在する。過去に発生していない組み合わせのインフルエンザウイルスが出現したときには、それに対する免疫が我々にはないために大流行となる。所謂、インフルエンザパンデミックである。本発明では、インフルエンザウイルスの型や亜型は特に限定されず、その抗原もHA、NAだけでなく、M1、M2、NPなどのウイルスを構成するタンパクでもよい。代表例として挙げられるのが現状のインフルエンザワクチンで使用されているHAである。
【0031】
前記インフルエンザウイルス抗原の調製方法は、特に限定されるものではなく、公知の方法が限定なく使用できる。例えば、インフルエンザ感染動物またはインフルエンザの患者から単離されたウイルス株を鶏卵や細胞などに感染させて常法により培養し、精製したウイルス原液から抗原を調製しても良い。また、遺伝子工学的に組換えウイルス或は特定抗原を種々の細胞で産生或は発現させたものを材料として抗原を調製することも可能である。
【0032】
前記インフルエンザウイルス抗原は、抗原を構成する全長のアミノ酸配列、または前記アミノ酸配列のうち1もしくは数個のアミノ酸が欠失、置換もしくは付加されたアミノ酸配列、または前記のいずれかのアミノ酸配列の部分配列、もしくは前記アミノ酸配列を含有するポリペプチド鎖であっても良い。
【0033】
前記ワクチンは、単一の抗原を含む場合、または複数種の抗原を含む場合であっても良い。
【0034】
前記ワクチンの剤形は、PQQ類やその塩と抗原が単一容器にて製剤化された状態でも良く、PQQ類やその塩と抗原が個別の容器に製剤化された状態でも良い。なお、製剤化される際の剤形は、例えば、液状、粉末状(凍結乾燥粉末、乾燥粉末)、カプセル状、錠剤、凍結状態、等であっても良い。
【0035】
前記アジュバントの剤形は、例えば、液状、粉末状(凍結乾燥粉末、乾燥粉末)、カプセル状、錠剤、凍結状態、等であっても良い。
【0036】
前記ワクチンおよびアジュバントは、PQQおよび抗原以外に、医薬として許容されうる担体を含んでいてもよい。前記医薬として共用されうる単体としては、ワクチン製造に通常用いられる単体を限定なく使用することができ、具体的には、食塩水、緩衝食塩水、デキストロース、水、グリセロール、等張水性緩衝液及びそれらの組み合わせが挙げられる、また、これに乳化剤、保存剤(例、チメロサール)、等張化剤、pH調整剤及び不活化剤(例、ホルマリン)などが適宜配合される。
【0037】
前記ワクチン及びアジュバントの投与対象は、免疫可能な任意の生物であり得る。特に、ヒトおよび他の哺乳動物(例えば、家畜、ペット、および野生動物)、等であっても良い。
【0038】
前記ワクチン及びアジュバントの投与経路は、例えば、経皮投与、舌下投与、点眼投与、皮内投与、筋肉内投与、経口投与、経腸投与、経鼻投与、静脈内投与、皮下投与、腹腔内投与、口から肺への吸入投与、等であっても良い。
【0039】
前記ワクチン及びアジュバントの投与方法は、例えば、ステント、カテーテル、経皮的パッチ、マイクロニードル、移植可能な徐放性デバイス、シリンジ、マイクロニードルを付けたシリンジ、無針装置、スプレーによって投与する方法等であっても良い。また、抗原とアジュバントが個別の容器にて製剤されている場合には、製剤された抗原とアジュバントを同時に投与しても良く、抗原またはアジュバントを投与して一定期間後にもう一方を投与しても良い。
【0040】
以下、実施例により本発明を詳細に説明するが、本発明はこれらの実施例に何ら限定されるものではない。
【実施例1】
【0041】
アジュバントとして使用したPQQ溶液は以下のようにして調製した。28%アンモニア水(ナカライテスク株式会社製、Code 025-12)を注射用蒸留水(大塚製薬株式会社製)で300倍に希釈した溶液を調製し、この希釈アンモニア溶液を用いてPQQ(ピロロキノリンキノン二ナトリウム、和光純薬工業株式会社、Code No. 168-17081)を溶解し、終濃度10mg/mLとした。
【0042】
抗原としては、インフルエンザウイルスHA抗原(A/ソロモン株)を用いた。本抗原のみを免疫した場合と、本抗原とPQQを共に免疫した場合とを比較した。抗原はマウス1匹あたり0.3μgとし、PQQはマウス1匹あたりの量を0μg、1μg、10μg、100μgと変えて抗原と共に投与した。マウス及び免疫方法は次のように行った。
【0043】
BALB/cマウス 6週齢の雌の体重を測定し、均等になるように1群3匹、4群に分けた。各個体はアニマルマーカーで個体識別した。被験物投与の当日、イソフルラン吸入麻酔下で眼窩静脈叢より、キャピラリーを用いて採血した。遠心分離後、血清をチューブに分取した。被験物はディスポーザブルの1mL用シリンジ(テルモ社製)に0.1mLとり、マウスの頸背部皮下に投与した。
【0044】
被験物投与後14日目にイソフルラン吸入麻酔下で開腹し、腹腔内後大静脈より全採血した。血液は室温で30分以上静置したのち、3000rpm 10分間遠心して血清を分離した。このようにして免疫および採血後にそれら血清中の抗原に対する抗体を下記のELISA法にて測定した。
【0045】
免疫した抗原と同じものを1μg/mL濃度で、ELISAプレートへ50μL/well投入し、自然吸着により4℃で一晩静置して固相化した。PBS(当日調製)にて3回洗浄後、BlockerTM Casein in PBS (Thermo社製)200μL/wellを投入し、室温で1時間反応させた。PBSにて3回洗浄後、抗血清(day0、14)をBlockerTM Casein in PBSにて200、400、800倍に希釈し、50μL/well投入し室温で、2時間反応させた。抗マウスIgG-POD標識抗体 (Thermo社製)をBlockerTM Casein in PBSで2,000倍に希釈したものを50μL/well投入し、室温で1時間反応させた。PBSにて4回洗浄後、基質TMB(BioFX社製)を50μL/well投入し、室温で15分反応後、1N H2SO4を50μL/well投入し反応を停止させた。450nmの吸光度を測定した。
【0046】
抗体価は、以下のようにして算出した。すなわち、抗原を固相化せず、ブロッキング操作を行ったELISAプレートに上記同様に抗血清を添加して、以降、同様に操作を行い抗血清のバックグラウンド値を測定した。このバックグラウンド値の3倍を越える吸光度を示した最大の希釈倍率の抗血清の吸光度にその希釈倍率を乗じて、その抗血清の抗体価とした。その結果、PQQと抗原を共に免疫した群では、抗原だけを免疫した群と比較して明らかにPQQのアジュバント効果が認められた(図1)。
【実施例2】
【0047】
実施例1の結果から、PQQのアジュバント効果が認められたので、その最適量と既存のアジュバントであるアラムアジュバントとの比較検討を行った。実施例1ではPQQの量を1〜100μg/bodyと変化させた結果、100μg/bodyが最も高いアジュバント効果を示したので、さらにPQQ量を増やした場合の効果を調べた。実験方法は実施例1と同じ方法で行った。PQQ量として100、300、900μg/bodyをHA抗原(0.3μg/body)と共に投与して、アラムアジュバント投与群と比較した。その結果、全てのPQQ投与群においてアジュバント効果が認められ、中でもPQQ量が300μg/bodyの投与群で高いアジュバント効果が認められた(図2)。
【0048】
さらに細かいPQQの最適量の設定と既存のアジュバントであるアラムアジュバントとの比較検討を行った。PQQ量として100μg/body〜600μg/bodyをHA抗原(0.3μg/body)と共に投与して、アラムアジュバント投与群と比較した。その結果、全てのPQQ投与群においてアジュバント効果が認められ、中でもPQQの量が100μg/body〜500μg/bodyの投与群では既存のアラムアジュバントと同等、あるいはそれ以上の高いアジュバント効果が認められた(図3)。PQQを投与されたマウスに異常は観察されなかった。
【0049】
実施例1および2の結果から、PQQには明らかなアジュバント効果が観察され、その効果は既存のアラムアジュバントより高くできることが明らかとなった。加えて、PQQを投与されたマウスには異常は認められなかったため、既存のアジュバントと比較して安全性に優れている。
【産業上の利用可能性】
【0050】
本発明ではPQQ類及び/またはその塩を含有するアジュバント、当該アジュバントを含有するワクチンを提供する。PQQ及びその塩は、生体にとっても有用であり、水溶性の物質であるため、従来のアラムアジュバントやオイル系アジュバントと比べて、安全性が高く、調剤面で利便性に優れたワクチン及びアジュバントを提供することが可能となる。
【図面の簡単な説明】
【0051】
【図1】PQQを1〜100μg/bodyでマウスへ投与した際の抗体価の測定結果である。
【図2】PQQを100〜900μg/bodyでマウスへ投与した際の抗体価の測定結果である。
【図3】PQQを100〜600μg/body、比較対照としてアラムアジュバントをマウスへ投与した際の抗体価の測定結果である。
【特許請求の範囲】
【請求項1】
下記一般式(1)で表されるピロロキノリン類及び/またはその塩、及び抗原を含有するワクチン。
一般式(1)
【化1】

[式中、R1、R2、R3はそれぞれ独立して、アルキル基、アルケニル基、アラルキル基、アラアリ−ル基、フェニル基、水素原子、アルキルアリール基、アルキニル基、ベンジル基、プロパギル基、又はアルコキシカルボニルアルキル基を表す。]
【請求項2】
前記一般式(1)で表される化合物は、下記の一般式(2)で表されるピロロキノリンキノン及び/またはその塩であることを特徴とする、請求項1に記載のワクチン。
一般式(2)
【化2】

【請求項3】
前記ピロロキノリンキノンの塩がピロロキノリンキノン二ナトリウムであることを特徴とする、請求項2に記載のワクチン。
【請求項4】
前記抗原がインフルエンザウイルス抗原であることを特徴とする請求項1ないし請求項3のいずれか1項に記載のワクチン。
【請求項5】
前記インフルエンザウイルス抗原がヘマグルチニン(HA)、ノイラミニダーゼ(NA)、マトリックス1(M1)、マトリックス2(M2)、核タンパク(NP)からなる群より選ばれた少なくとも1種又は2種以上の抗原であることを特徴とする請求項4に記載のワクチン
【請求項6】
前記抗原が抗原を構成する全長のアミノ酸配列、または前記アミノ酸配列のうち1もしくは数個のアミノ酸が欠失、置換もしくは付加されたアミノ酸配列、または前記のいずれかのアミノ酸配列の部分配列、もしくは前記アミノ酸配列を含有するポリペプチドであることを特徴とする請求項5に記載のワクチン。
【請求項7】
前記請求項1から6のいずれか1項に記載のワクチンの製造方法。
【請求項8】
前記請求項1から6のいずれか1項に記載のワクチンを用いた投与方法。
【請求項9】
前記一般式(1)で表されるピロロキノリン類及び/またはその塩を含有するアジュバント。
【請求項10】
前記一般式(1)で表される化合物は、前記一般式(2)で表されるピロロキノリンキノン及び/またはその塩であることを特徴とする、請求項9に記載のアジュバント。
【請求項11】
前記ピロロキノリンキノンの塩がピロロキノリンキノン二ナトリウムであることを特徴とする、請求項10に記載のアジュバント。
【請求項12】
前記請求項9から11のいずれか1項に記載のアジュバントの製造方法。
【請求項13】
前記請求項9から11のいずれか1項に記載のアジュバントを用いた投与方法。
【請求項1】
下記一般式(1)で表されるピロロキノリン類及び/またはその塩、及び抗原を含有するワクチン。
一般式(1)
【化1】

[式中、R1、R2、R3はそれぞれ独立して、アルキル基、アルケニル基、アラルキル基、アラアリ−ル基、フェニル基、水素原子、アルキルアリール基、アルキニル基、ベンジル基、プロパギル基、又はアルコキシカルボニルアルキル基を表す。]
【請求項2】
前記一般式(1)で表される化合物は、下記の一般式(2)で表されるピロロキノリンキノン及び/またはその塩であることを特徴とする、請求項1に記載のワクチン。
一般式(2)
【化2】

【請求項3】
前記ピロロキノリンキノンの塩がピロロキノリンキノン二ナトリウムであることを特徴とする、請求項2に記載のワクチン。
【請求項4】
前記抗原がインフルエンザウイルス抗原であることを特徴とする請求項1ないし請求項3のいずれか1項に記載のワクチン。
【請求項5】
前記インフルエンザウイルス抗原がヘマグルチニン(HA)、ノイラミニダーゼ(NA)、マトリックス1(M1)、マトリックス2(M2)、核タンパク(NP)からなる群より選ばれた少なくとも1種又は2種以上の抗原であることを特徴とする請求項4に記載のワクチン
【請求項6】
前記抗原が抗原を構成する全長のアミノ酸配列、または前記アミノ酸配列のうち1もしくは数個のアミノ酸が欠失、置換もしくは付加されたアミノ酸配列、または前記のいずれかのアミノ酸配列の部分配列、もしくは前記アミノ酸配列を含有するポリペプチドであることを特徴とする請求項5に記載のワクチン。
【請求項7】
前記請求項1から6のいずれか1項に記載のワクチンの製造方法。
【請求項8】
前記請求項1から6のいずれか1項に記載のワクチンを用いた投与方法。
【請求項9】
前記一般式(1)で表されるピロロキノリン類及び/またはその塩を含有するアジュバント。
【請求項10】
前記一般式(1)で表される化合物は、前記一般式(2)で表されるピロロキノリンキノン及び/またはその塩であることを特徴とする、請求項9に記載のアジュバント。
【請求項11】
前記ピロロキノリンキノンの塩がピロロキノリンキノン二ナトリウムであることを特徴とする、請求項10に記載のアジュバント。
【請求項12】
前記請求項9から11のいずれか1項に記載のアジュバントの製造方法。
【請求項13】
前記請求項9から11のいずれか1項に記載のアジュバントを用いた投与方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−82165(P2012−82165A)
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願番号】特願2010−229981(P2010−229981)
【出願日】平成22年10月12日(2010.10.12)
【出願人】(000173555)一般財団法人化学及血清療法研究所 (86)
【Fターム(参考)】
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願日】平成22年10月12日(2010.10.12)
【出願人】(000173555)一般財団法人化学及血清療法研究所 (86)
【Fターム(参考)】
[ Back to top ]

