新規コンジュゲートおよびそれを用いたコルチゾールの分析方法、キット、ならびにそのための装置
【課題】唾液中のコルチゾールの迅速な定量分析が可能であり、かつ、当該分析を行うための装置を小型化できる新規な技術を提供する。
【解決手段】(1)コルチゾールと酸化還元酵素とが特定の構造を有するリンカーを介して連結されたコンジュゲート。(2)液体試料中のコルチゾールと、本発明のコンジュゲートとの競合反応による酵素免疫測定法を利用して液体試料中のコルチゾールを分析するコルチゾールの分析方法。(3)基板上に、コンジュゲートパッドとコルチゾールの抗体が予め固定された検出部とが形成され、コンジュゲートパッドからコルチゾールとコンジュゲートとをそれぞれ毛細管現象で検出部まで移動させ、検出部においてコルチゾールの抗体と競合反応させるキット。(4)作用極および対極からキットにて行われた競合反応の結果を電気化学的に測定するための装置。
【解決手段】(1)コルチゾールと酸化還元酵素とが特定の構造を有するリンカーを介して連結されたコンジュゲート。(2)液体試料中のコルチゾールと、本発明のコンジュゲートとの競合反応による酵素免疫測定法を利用して液体試料中のコルチゾールを分析するコルチゾールの分析方法。(3)基板上に、コンジュゲートパッドとコルチゾールの抗体が予め固定された検出部とが形成され、コンジュゲートパッドからコルチゾールとコンジュゲートとをそれぞれ毛細管現象で検出部まで移動させ、検出部においてコルチゾールの抗体と競合反応させるキット。(4)作用極および対極からキットにて行われた競合反応の結果を電気化学的に測定するための装置。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、コルチゾールを含むコンジュゲート、およびそれを用いたコルチゾールの分析方法、キット、ならびにそのための装置に関する。
【背景技術】
【0002】
近年、様々なストレスを受けた多くの人々が複雑な治療を要する各種疾患にかかっており、予防的に、ストレスの程度を簡易に判定できる方法、キットまたは装置の開発が注目されている。従来、被検者の心拍数、血圧などを測定することにより被検者のストレスを判定する方法が一般的であったが、このようにして判定されるストレスは一過性のものであり、長期的に続くいわゆる慢性ストレスについては判定することが困難であった。
【0003】
慢性ストレスを判定するための指標として、血液中のコルチゾールなどの副腎皮質ホルモンやアドレナリン、ノルアドレナリンなどの神経伝達物質が知られている。しかし、血液中の成分によってストレスを判定しようとすると、当該成分の採取自体がストレスを伴うという欠点がある。
【0004】
このため、血液に代えて、採取自体にストレスを伴わない唾液中の成分をストレスの判定の指標とすることが検討されている。たとえば上述したコルチゾールは、唾液中にも微量ではあるが含まれていることが知られている(通常、10〜15μg/dl程度)。一般に、生体試料中に含まれる微量タンパクを分析する技術としては、酵素免疫測定(ELISA:Enzyme-Linked Immunosorbent Asssay)法が多く用いられている。この酵素免疫測定法には、大きく分けて競合法とサンドイッチ法とがあるが、いずれも広く知られており、主に感度向上を主眼とし、標識自体の感度改良に関するものを中心とした種々の改良がなされている(たとえば特開2000−180448号公報(特許文献1)、特開2005−337960号公報(特許文献2)などを参照。)。
【0005】
コルチゾールの分析に関しても、上述した酵素免疫測定法を利用して、試料中のコルチゾールを定量分析するためのキットが既に市販されている。しかしながら、このような市販のキットを用いて唾液中のコルチゾールの分析を行う場合には、分析に先立ち、たとえば、遠心分離などによる唾液中の不純物の除去、キット含有試薬の調製および唾液の希釈などの工程数が多く煩雑な作業である前処理が必要であり、また、この前処理や抗原抗体反応を行うためのインキュベーションも長時間を要するため、通常、試料を採取してから定量分析の結果を得るまでに6〜8時間程度かかるという問題があった。また、従来の市販のキットの場合、分光分析を行うための比較的大型の装置が必要となるという問題もあった。
【特許文献1】特開2000−180448号公報
【特許文献2】特開2005−337960号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、上記課題を解決するためになされたものであって、その目的とするところは、唾液中のコルチゾールの迅速な定量分析が可能であり、かつ、当該分析を行うための装置を小型化できる新規な技術を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するためには、コルチゾールと酸化還元酵素とをリンカーで連結させたコンジュゲートを開発することによって、当該コンジュゲートと試料中のコルチゾールとの競合反応による酵素免疫測定法を利用することができ、これによって試料の前処理が不要となるとともに、抗原抗体反応自体も迅速に行い得、しかも酸化還元酵素で標識していることで、分光分析に代えて、コルチゾール濃度に比例した電気信号を電極測定する電気化学計測によりコルチゾールを定量分析できるため、唾液中のコルチゾールのリアルタイムな分析を小型化した装置を用いて行うことが可能となることを見出し、鋭意研究した結果、コルチゾールの新規なコンジュゲートの開発に成功し、本発明を完成させるに至った。すなわち、本発明は以下のとおりである。
【0008】
本発明のコンジュゲートは、コルチゾールと酸化還元酵素とが下記式(I)で表される構造を有するリンカーを介して連結されたものであることを特徴とする。
【0009】
【化1】

【0010】
(上記式(I)中、コルチゾール側に配置されるXはNH、NHNH、CONHNHであり、酸化還元酵素側に配置されるYはNH、NHN=、NHNH、CO、CONHN=、CONHNHであり、Rは酸素原子、硫黄原子または窒素原子で中断されていてもよい炭素数2〜20の炭化水素鎖である。)
本発明のコンジュゲートにおいて、上記式(I)中におけるRは炭素数2〜20のアルキル基であることが好ましい。
【0011】
また本発明のコンジュゲートにおけるリンカーは、下記式(II)で表される構造を有することがより好ましい。
【0012】
【化2】

【0013】
また、本発明のコンジュゲートにおいて、酸化還元酵素はグルコースオキシダーゼ、グルコースデヒドロゲナーゼ、アルコールオキシダーゼおよびガラクトースオキシダーゼから選ばれるいずれかであることが好ましく、グルコースオキシダーゼであることが特に好ましい。
【0014】
本発明はまた、液体試料中のコルチゾールと、上述した本発明のコンジュゲートとの競合反応による酵素免疫測定法を利用して液体試料中のコルチゾールを分析する、コルチゾールの分析方法についても提供する。
【0015】
本発明のコルチゾールの分析方法における液体試料は、唾液から採取したものであることが好ましい。
【0016】
本発明はさらに、毛細管現象によって液体が移動し得るように構成された基板上に、上述した本発明のコンジュゲートが予め含浸されたコンジュゲートパッドと、コルチゾールの抗体が予め固定された検出部とが形成され、コンジュゲートパッドから液体試料中のコルチゾールと前記コンジュゲートとをそれぞれ毛細管現象で検出部まで移動させ、検出部においてコルチゾールの抗体と競合反応させるコルチゾール分析用キットについても提供する。
【0017】
本発明のキットにおける液体試料は、唾液から採取したものであることが好ましい。
本発明のキットは、検出部に、電気絶縁性の電極系基板と、電極系基板上に互いに離間して配置された作用極と対極とを含む電極系が形成され、前記コルチゾールの抗体が作用極上に予め固定されていることが、好ましい。
【0018】
本発明はまた、本発明のキットが、検出部に、電気絶縁性の電極系基板と、電極系基板上に互いに離間して配置された作用極と対極とを含む電極系が形成され、前記コルチゾールの抗体が作用極上に予め固定されている場合、当該キットの検出部の作用極および対極をそれぞれ挿入するための挿入部と、挿入部に電気的に接続され、挿入部に挿入された作用極および対極から前記コルチゾール分析用キットにて行われた競合反応の結果を電気化学的に測定する測定部とを備える、コルチゾール分析用装置についても提供する。
【発明の効果】
【0019】
本発明によれば、コンジュゲートと液体試料中のコルチゾールとの競合反応による酵素免疫測定法を利用することができるようになるため、試料の前処理が不要となるとともに、抗原抗体反応自体も迅速に行い得るようになる。これによって、従来は試料の採取から分析結果を得るまでに6〜8時間ほど要していたのを分オーダー(10分程度)へと短縮することができ、コルチゾールの即時的で特異性の高い定量分析が可能となる。このような本発明により、唾液中のコルチゾールについても簡便・迅速に分析することができるため、ヒトの心身ストレスの研究に有用である。
【0020】
また本発明によれば、コルチゾールを酸化還元酵素で標識しているコンジュゲートを用いることで、コルチゾール濃度に比例した電気信号を電極測定する電気化学計測が可能となり、従来の分光分析を行う場合よりも格段に小型化された装置を用いたリアルタイムな分析の実現が可能となる。
【発明を実施するための最良の形態】
【0021】
<コンジュゲート>
本発明のコンジュゲートは、コルチゾール(CORT)と酸化還元酵素とが特定の構造を有するリンカーを介して連結されたものであることを特徴とする。コルチゾールは、ストレスによって発散される副腎皮質ホルモンのうちの糖質コルチコイドの1種であり、ヒドロコルチゾンとも呼ばれる。コルチゾールは分子量が300程度のハプテンであり、このコルチゾールに標識(マーカー)を連結させたコンジュゲートを用いてコルチゾールとの競合反応を利用した酵素免疫測定法を実現する場合には、高感度な標識を用いる必要がある。本発明のコンジュゲートは、この高感度な標識として酸化還元酵素を用い、コルチゾールと酸化還元酵素とを特定の構造を有するリンカーを介して連結させたものであることを特徴とする。
【0022】
本発明のコンジュゲートに用いられるリンカーが下記式(I)で表される構造を有することが好ましい。なお、下記式(I)で表されるリンカーは、Xがコルチゾール側に配置され、Yが酸化還元酵素側に配置されて連結され、Yと酸化還元酵素との間は、Yおよび酸化還元酵素の種類に応じて単結合または二重結合で結合され得る。
【0023】
【化3】

【0024】
上記式(I)中、コルチゾール側に配置されるXはNH、NHNH、CONHNHであり、中でも反応の工程数が少ない観点からNHまたはNHNHが好ましく、NHNHが特に好ましい。また、上記式(I)中、酸化還元酵素側に配置されるYはNH、NHN=、NHNH、CO、CONHN=、CONHNHであり、中でも反応の工程数が少ない観点からNH、NHN=またはNHNHが好ましく、NHN=が特に好ましい。
【0025】
上記式(I)中、Rは酸素原子、硫黄原子または窒素原子で中断されていてもよい炭素数2〜20(好ましくは炭素数5〜15)の炭化水素鎖である。Rにおける炭素数が1である場合には、酸化還元酵素の立体構造(二次構造)が崩れてしまう虞があり、また、Rにおける炭素数が20を超える場合には、反応性が悪くなる傾向にあるためである。またRは場合によっては二重結合および/または三重結合を含んでいてもよい。抗原抗体反応の効率性の観点からは、上記式(I)中におけるRは炭素数2〜20(より好ましくは炭素数5〜15)のアルキル基であることが好ましい。
【0026】
本発明のコンジュゲートに用いられるリンカーは、上記式(I)で表される構造の中でも、下記式(II)で表される構造を有することが好ましい。下記式(II)で表される構造を有するリンカーを用いることで、アミノ基、カルボキシル基を有しない酸化還元酵素であるグルコースオキシダーゼをコルチゾールとの連結に好適に用いることができるという利点があるためである。
【0027】
【化4】

【0028】
また本発明のコンジュゲートにおける酸化還元酵素は、酸化還元反応を触媒する酵素であれば特に制限されるものではないが、好適な例として、グルコースオキシダーゼ(GOD)、グルコースデヒドロゲナーゼ、アルコールオキシダーゼおよびガラクトースオキシダーゼから選ばれるいずれかを挙げることができる。中でも、酵素活性が高く、安価であることから、グルコースオキシダーゼが特に好ましい。
【0029】
上述したコルチゾールと酸化還元酵素とをリンカーを介して連結させたコンジュゲートは、その作成方法に特に制限はない。以下に好適な一例として、リンカーが上記式(II)で表される構造を有し、酸化還元酵素がグルコースオキシダーゼである場合のコンジュゲート(CORT−GODコンジュゲート)を作成する場合を挙げる。
【0030】
まず、下記スキーム1に示すように、GODに過ヨウ素酸塩および蒸留水を混合して室温でインキュベートすることで反応させ、GODにアルデヒド基を結合させる。なお、下記スキーム1におけるGODのR、R’は共にアルキル基を示す。得られたGOD−アルデヒドは、反応後の溶液を10mM 炭酸アンモニウム(pH9.3)で平衡化したカラム(具体的にはSephadex G−25カラム)に通し、不純物を除去する。
【0031】
【化5】

【0032】
次に、下記スキーム2に示すように、精製したGOD−アルデヒドにアジポジヒドラジド(ADH)を混合し、低温(たとえば4℃)でインキュベートした後、水酸化ナトリウムで調製したシアノ水素化ホウ素ナトリウムを混合し、同じく低温(たとえば4℃)でインキュベートする。得られたGOD−ADHは、反応後の溶液を10mM リン酸緩衝液で平衡化したカラム(具体的にはSephadex G−25カラム)に通し、不純物(ADHの両端にGODが結合したものも含む)を除去する。
【0033】
【化6】

【0034】
次に、下記スキーム3に示すように、GOD−ADHにおけるADHと、コルチゾール(コルチゾール−21−hemisuccinate)とを反応させ、CORT−GODコンジュゲートを作成する。なお、コルチゾールとADHとを結合させるためには、コルチゾールの反応性を高める必要性があるため、前処理として、コルチゾール−21−hemisuccinate、ジメチルホルムアルデヒド、ジオキサンおよび蒸留水を混合し、さらにN−ヒドロキシコハク酸イミド、1−エチル−3−カルボジイミド塩酸塩を混合し、低温(たとえば4℃)でインキュベートすることで、コルチゾールを予め活性化することが好ましい。このように活性化したコルチゾールを精製したGOD−ADHと混合し、低温(たとえば4℃)でインキュベートすることで、CORT−GODコンジュゲートが得られる。得られたCORT−GODコンジュゲートは、反応後の溶液を10mMリン酸緩衝液で平衡化したカラム(具体的にはSephadex G−25カラム)に通し、不純物を除去して、精製する。
【0035】
【化7】

【0036】
なお、当該CORT−GODコンジュゲート以外のコンジュゲートについても、以下の例に従来公知のコンジュゲート作成技術を適宜応用することで作成可能である。上述した例では、コンジュゲートにおけるリンカーを形成する材料としてADHを用いた場合を挙げたが、本発明のコンジュゲートを作成する際にリンカーを形成するための材料としては勿論これに限定されるものではない。
【0037】
ここで、リンカーの一方側の官能基は、コルチゾールのカルボキシル基と結合できる官能基である。このような官能基としては、たとえばアミノ基、ヒドラジン基が挙げられる。一方、リンカーの他方側の官能基は、酸化還元酵素と結合させるための官能基であり、酸化還元酵素の末端官能基の種類によって適宜選択される。たとえば、酸化還元酵素の末端官能基がアミノ基である場合、リンカーの他方側の官能基としてはカルボキシル基が選択される。またたとえば酸化還元酵素の末端官能基がカルボキシル基である場合には、リンカーの他方側の官能基はアミノ基またはヒドラジン基が選択される。また、たとえば酸化還元酵素の末端官能基がアルデヒド基である場合には、リンカー分子の他方側の官能基としてはヒドラジン基が選択される。
【0038】
このようなリンカーを形成するための材料としては、たとえばジアミノエタン、ジアミノプロパン、ジアミノブタン、ジアミノヘキサン、ジアミノオクタン、2,4−ジアミノキシレン、エチレンジヒドラジン、アディピック酸ジヒドラジン、p−フェニレンジヒドラジン、ジフェニル−オルソ−ジヒドラジン、6−アミノヘキサン酸、11−アミノウンデカン酸、各種アミノ酸(プロリンおよびヒドロキシプロリンを除く)、各種ジペプチド(N末端側はプロリンまたはヒドロキシプロリンではないもの)および各種トリペプチド(N末端側はプロリンまたはヒドロキシプロリンではないもの)が挙げられる。ただし、6−アミノヘキサン酸、11−アミノウンデカン酸、各種アミノ酸(プロリンおよびヒドロキシプロリンを除く)、各種ジペプチド(N末端側はプロリンまたはまたはヒドロキシプロリンではない)および各種トリペプチド(N末端側はプロリンまたはヒドロキシプロリンではない)などのカルボキシル基とアミノ基を有する分子をリンカーとして用いる場合、当該リンカー自体が縮合反応を起こさないようにするために、カルボキシル基またはアミノ基を保護する必要がある。カルボキシル基の保護基としては、たとえばメチル基、エチル基、ベンジル基およびtert−ブチル基などが挙げられる。一方、アミノ基の保護基としては、tert−ブトキシカルボニル基、ベンジルオキシカルボニル基、9−フルオレニルメチルオキシカルボニル基およびアリルオキシカルボニル基などが挙げられる。特に、脱保護の反応を容易に行うことができる観点から、カルボキシル基の保護基としてはベンジル基が、アミノ基の保護基としてはtert−ブトキシカルボニル基が好ましいが、本発明は、これらの保護基に限定されるものではない。
【0039】
このような本発明のコンジュゲートによれば、当該コンジュゲートを用いて、液体試料中のコルチゾールとの競合反応による酵素免疫測定法を利用することができるようになるため、これによって試料の前処理が不要となるとともに、抗原抗体反応自体も迅速に行い得るようになり、トータルで分オーダー(10分程度)へと短縮された、コルチゾールの即時的で特異性の高い定量分析が可能となる。また本発明のコンジュゲートは、コルチゾールを酸化還元酵素で標識したものであるため、コルチゾール濃度に比例した電気信号を電極測定する電気化学計測が可能となり、従来の分光分析を行う場合よりも格段に小型化された分析装置を用いたリアルタイムな分析の実現が可能となる(詳細は後述)。
【0040】
本発明のコンジュゲートは、上述した液体試料中のコルチゾールとの競合反応による酵素免疫測定法に特に好適に用いることができるものであるが、その用途についてはこれに制限されるものではなく、デヒドロアピアンドロステロン(DHEA)、エラトラジオールなどのステロイドホルモンの定量分析などの手法に応用可能である。また、本発明のコンジュゲートは、コルチゾールだけでなく他のホルモンの迅速分析にも寄与すると考えられ、化学分析・医療分野での応用範囲は広いと考えられる。
【0041】
<コルチゾール分析方法>
本発明は、液体試料中のコルチゾールと、上述した本発明のコンジュゲートとの競合反応による酵素免疫測定法を利用して液体試料中のコルチゾールを定量分析する、コルチゾールの分析方法についても提供する。本発明のコルチゾールの分析方法によれば、上述した本発明のコンジュゲートと、液体試料中のコルチゾールとの競合反応による酵素免疫測定法を利用することで、従来のコルチゾールの酵素免疫測定法による分析方法とは異なり、試料の前処理が不要となるとともに、抗原抗体反応自体も迅速に行い得るようになるため、トータルで分オーダー(10分程度)へと短縮された、コルチゾールの即時的で特異性の高い定量分析が可能となる。
【0042】
本発明のコルチゾールの分析方法において、液体試料中のコルチゾールと本発明のコンジュゲートとを競合反応させるために用いる抗体としては、コルチゾールに対する抗体(抗コルチゾール抗体)であれば特に制限されるものではなく、具体的には、Anti−Cortisol−3−CMO(American Research Products社製)、Anti−Cortisol−21(コスモバイオ社製)などの市販の抗コルチゾール抗体などが好適な例として挙げられる。
【0043】
本発明のコルチゾールの分析方法における液体試料は、唾液から得られたものであることが好ましい。ヒトのストレスを判定するために、唾液中のコルチゾールを分析することが従来から試みられてきたことは上述したとおりであるが、本発明のコルチゾールの分析方法はこのストレスの判定に特に有用である。ここで、本発明のコルチゾールの分析方法を応用して有無を判定するストレスは、心身ストレス(肉体的ストレス、精神的ストレスの両方を包含する)を意味し、また、急性ストレス、慢性ストレスの両方を包含するが、慢性ストレスについての判定に特に有用である。
【0044】
なお、ストレスの有無を判定するという目的上、液体試料の採取自体は、被験者の身体または精神にストレスをかけることなく行われることが望まれる。このため、液体試料が唾液から採取するものである場合には、液体試料が血液である場合などとは異なり、被験者にストレスを与えることなく短時間で採取することができるという利点がある。
【0045】
唾液の採取には、たとえば特開2006−345869号公報に開示されたような、毛細管現象を利用した器具(キャピラリー)を好適に用いることができる。このような器具を用いることで、1回で、本発明のコルチゾールの分析に十分な量(好ましくは1〜500μL、具体的には100μL程度)の唾液を採取することができる。なお、唾液を採取する被験者の口腔内の場所としては、舌下、舌上、頬肉などが挙げられ、特に制限されるものではない。
【0046】
<コルチゾール分析用キット>
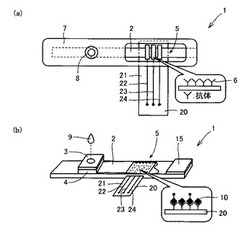
本発明はまた、液体試料中のコルチゾールと、上述した本発明のコンジュゲートとの競合反応による酵素免疫測定法を行うためのコルチゾール分析用キットについても提供する。ここで、図1は、本発明の好ましい一例のコルチゾール分析用キット1を模式的に示す図であり、図1(a)は上面図、図1(b)は斜視図である。図1に示す例の本発明のコルチゾール分析用キット1は、基板2と、基板2上に形成された、試料パッド3と、コンジュゲートパッド4と、検出部5と基本的に備え、検出部5から突出する電極系基板(後述)など、一部を除いたその全体がハウジング7にて覆われるように構成される。なお、図1(b)は、図1(a)に示すキット1からハウジング7を取り除いた状態の斜視図を示している。このような本発明のキット1は、免疫測定法、イムノクロマトグラフィ、電気化学測定を1つの試験紙上にドライケミストリーで構成することで、低廉なディスポーザブル・テストストリップを実現することができるという利点がある。
【0047】
本発明のキット1に用いられる基板2は、毛細管現象によって液体が移動し得るように構成される。これによって、試料パッド3に滴下された液体試料9中のコルチゾール10およびコンジュゲートパッド4に予め含浸された上述した本発明のコンジュゲート11とが、毛細管現象によって試料パッド3およびコンジュゲートパッド4から水平方向に概ね沿って検出部5にまで移動し、検出部5に予め固定された抗体6と競合反応させることによる酵素免疫測定が可能となる。また後述するように当該キット1による酵素免疫測定の結果の電気化学的な測定を可能とする観点からは、当該基板2としてベース基板上に、ニトロセルロース膜、セルロース膜などが形成されたものが好適に用いられる。なお、ベース基板を形成する材料としては、たとえばポリエチレン、ポリエステル、フッ素樹脂、ポリカーボネート、ポリプロピレン、ポリスチレンなどが挙げられるが、上述した性質を有する基板2を実現することができるのであれば、これらに限定されるものではない。上記中でも、耐衝撃性、耐寒性、耐水性、耐電性、絶縁性が良好であり、また化学的に安定で耐薬品性にも優れるという観点からはポリエチレンが好ましく、また、成型加工性が高く、さらに材料費が安価であるという観点から、ポリエステルが好ましい。また、本発明のキットにおける基板は、上述したベース基板の表面に溝が形成されることで、毛細管現象によって液体が移動し得るように構成されていても勿論よいが、液体試料が唾液から採取されたものである場合に液体試料の泡立ちを防止できる観点から、ベース基板上にニトロセルロース膜、セルロース膜などが形成されて実現されてなるのが特に好ましい。
【0048】
試料パッド3は、ハウジング7に形成された注入口8から液体試料9を注入した際に、当該液体試料9中に含まれる、分析対象であるコルチゾールが当該試料パッド3を通過し、基板2に到達するように構成される。より精度の高い競合反応を行うことができるようになる観点からは、試料パッド3は、液体試料9中に含まれる分子量が比較的大きい夾雑物をろ過し得るような材料で形成されることが好ましい。本発明のキット1においても、液体試料は唾液から採取したものであることが好ましいが、この場合には、ムチンなどがこの夾雑物に該当する。このような分子量が比較的大きい夾雑物をろ過し得るような試料パッド3の形成材料としては、たとえば、ガラス繊維、セルロースなどが挙げられるが、これらに制限されるものではない。なお、図1に示す例では、試料パッド3をコンジュゲートパッド4とは別に設けた例を示しているが、コンジュゲートパッド4に液体試料を直接注入して、コンジュゲートパッド4が試料パッドを兼ねるように構成されていても勿論よい。
【0049】
コンジュゲートパッド4には、上述した本発明のコンジュゲート11(好適にはCORT−GODコンジュゲート)が予め含浸され、上述した試料パッド3に液体試料9が注入された場合に、この液体試料9中のコルチゾール10とともに、コンジュゲート11が毛細管現象によって検出部5にまで移動するように構成される。なお、コンジュゲートパッド4は、図1(b)に示す例のように、基板2と試料パッド3との間に介在されるように形成されることが好ましい。これによって、注入口8から液体試料9が注入された際に、試料パッド3を通過した液体試料9がコンジュゲートパッド4を通過して基板2に到達することになり、液体試料9がコンジュゲートパッド4を通過する際に、当該コンジュゲートパッド4に含浸されていたコンジュゲート11が液体試料9に溶け込み、コルチゾール10とコンジュゲート11とが溶け込んだ液体試料9を検出部5に移動させ、より精度の高い競合反応を行うことができるようになるためである。このようなコンジュゲートパッド4を形成する材料としては、試料パッド3を形成する好適な材料として上述した材料を同様に好適に用いることができる。なお、コンジュゲート11をコンジュゲートパッド4に予め含浸させておく方法としては、従来公知の適宜の方法を適用でき、特に制限されないが、たとえばコンジュゲートの溶液にコンジュゲートパッドを入れ攪拌する方法、コンジュゲートパッド上にコンジュゲートの溶液を滴下する方法などが好適である。
【0050】
本発明のキット1における検出部5には、上述したようにコルチゾールの抗体(抗コルチゾール抗体)6が予め固定されている。抗体6としては、市販の抗コルチゾール抗体を特に制限なく用いることができ、具体的には、Anti−Cortisol−3−CMO(American Research Products社製)およびAnti− Cortisol−21(コスモバイオ社製)などが挙げられる。本発明のキット1の注入口8に液体試料9を注入することで、試料パッド3およびコンジュゲートパッド4から毛細管現象によって移動してきた液体試料中のコルチゾール10と、コンジュゲート11とが、検出部5において抗体6と競合反応する(図1(b))。
【0051】
ここで、上述したように、本発明のキット1で利用する本発明のコンジュゲートは、コルチゾールを酸化還元酵素で標識したものであるため、コルチゾール濃度に比例した電気信号を電極測定する電気化学測定を利用することができる。すなわち、上述したように、試料パッド3およびコンジュゲートパッド4から毛細管現象によって移動してきた試料中のコルチゾール10と、コンジュゲート11とが、検出部5において抗体6と競合反応する場合、検出部5にグルコース(C6H12O6)が十分量存在する場合には、抗体6にトラップされたコンジュゲート11の酸化還元酵素(好適にはグルコースオキシダーゼ(GOD))と以下のような反応が起こる。
【0052】
C6H12O6(グルコース)+O2→C6H10O6(グルコノラクトン)+H2O2 (1)
H2O2→2H++2e-+O2 (2)
上記式(2)における電子の生成量は、酸化還元酵素を含むコンジュゲート11の量に比例し、液体試料9中に含まれていたコルチゾール10の濃度には反比例することになる。このため、この電子の生成量を、コルチゾール濃度に比例した電気信号を電極測定することで、予め求めておいた検量線にプロットすることで、液体試料中のコルチゾールの濃度を算出することが可能となる。
【0053】
このような電気化学測定を利用する観点から、本発明のキット1は、図1に示す例のように、検出部5に、電気絶縁性の電極系基板20と、電極系基板20上に互いに離間して配置された作用極22と対極23とを含む電極系21が形成され、前記コルチゾールの抗体が作用極22上に予め固定されているように実現されることが、好ましい。このように実現されたキット1を用いることで、従来の分光分析を行う場合よりも、全体として格段に小型化された分析装置(後述)との組み合わせでの分析が可能となる。
【0054】
ここで、図2は、本発明のキット1に好適に用いられる電極系21の一例を模式的に示す上面図である。電極系21は、上述した電気化学的反応で生じた電流を流すことができ、後述する本発明の分析装置に電気的に接続され、液体試料(好適には、唾液より採取した液体試料)が存在することで、分析装置に電気的に接続された状態で当該分析装置と電気的な回路を形成するように実現される。このような電極系21は、少なくとも作用極22と対極23とを備え、さらには、液体試料の存在を確認するための参照的な電極(図1、2に示す参照電極24)、キット1を分析装置に挿入したことを確認するための電極(図示せず)などの付属的な電極を含んでいてもよい。
【0055】
電極系21における作用極22上には、上述したように抗体6が予め固定されている。これによって、当該抗体6とコルチゾール10およびコンジュゲート11との競合反応により抗体6にトラップされたコンジュゲート11の酸化還元酵素が上述した電気化学反応を起こした際には、発生した電流が作用極22に流れる。このような作用極22は、導電体で形成されているのであれば、その具体的な形成材料については特に制限されないが、たとえば炭素、白金、酸化ルテニウム、パラジウムなどが挙げられ、中でも、耐腐食性が高いという観点からは白金が好ましく、また、材料費が安いという観点からは黒鉛が好ましい。なお、作用極22は、電気絶縁性の電極系基板20(たとえばポリエチレン製)上に、蒸着または塗布などの方法によって形成される。
【0056】
また電極系21における対極23は、電極系基板20上に作用極22とは離間して配置され、液体試料(好適には、唾液より採取した液体試料)が存在することで、上述した作用極22および後述する分析装置と電気的な回路を形成する役割を果たす。このような対極23も導電体で形成されているのであれば、その具体的な形成材料については特に制限されるものではなく、上述した作用極22と同様にたとえば炭素、白金、酸化ルテニウム、パラジウムなどが挙げられ、同様の理由から白金が好ましい。また対極23も、作用極22と同様に、電気絶縁性の電極系基板20(たとえばポリエチレン製)上に、蒸着または塗布などの方法によって形成される。
【0057】
ここで、電極系基板20を形成する材料としては、たとえばポリエチレン、ポリエステル、フッ素樹脂、ポリカーボネート、ポリプロピレン、ポリスチレンなどが挙げられるが、電気絶縁性を有する電極系基板20を実現することができるのであれば、これらに限定されるものではない。上記中でも、耐衝撃性、耐寒性、耐水性、耐電性、絶縁性が良好であり、また化学的に安定で耐薬品性にも優れるという観点からはポリエチレンが好ましく、また、成型加工性が高く、さらに材料費が安価であるという観点から、ポリエステルが好ましい。
【0058】
電極系21における作用極22および対極23は、上述したような電極系基板20上において互いに離間しているのであれば、その配置は特に制限されるものではなく、作用極22と対極23とが対向するように配置されていてもよいし、また、同一平面上に配置されていてもよい。図2には、電極系基板20上に、円形状の作用極22を中心にして、対極23および参照極24が互いに離間して同心円状に配置され、作用極22の外周側に、当該作用極22の周方向に沿って対極23が対向して配置され、さらに、対極23の外周側に、当該対極23の周方向に沿って参照極24が対向するようにして、同一平面上に配置された例が示されている。すなわち、円形状の作用極22の外周に、周方向の一部に切欠部を有する円弧状に形成された対極23が、当該切欠部以外の部分で作用極22を包囲するように形成されている。また、対極23の外周側を周方向に包囲するように、略半円弧状の参照極24が形成されている。
【0059】
図2に示す例では、それぞれ上述した形状を有する作用極22、対極23および参照極24は、配線部が引き出され、その端部に、それぞれ作用極22、対極23および参照極24への電気的な接続を可能とする電極パッドが形成されている。図1に示す例の本発明のキット1は、基板2の検出部5に、電極系21が形成された電極系基板20が挿入され、電極系基板20の上記電極パッドが形成された部分が、キット1から突出するように形成されており、後述する本発明の分析装置への電気的な接続が可能なように実現されている。
【0060】
また、図1および図2に示す例のキット1において、作用極22には、上述したコルチゾールの抗体(抗コルチゾール抗体)6の他に、通常、電子メディエータも予め固定される。ここで、電子メディエータとは、還元することで電子の授受が発生し、液体試料9と作用極22との間の電子伝達を仲介する化合物をいい、ヨウ素、および、ルテニウム、オスミウム、鉄およびコバルトなどの遷移金属を含む化合物であれば、特に限定されるものではない。このような電子メディエータとして、たとえばヘキサシアノ鉄(II)酸カリウム、ヘキサシアノ鉄(III)酸カリウム、フェロセン、1,1’−ジメチルフェロセン、フェロセンカルボン酸、フォロセンカルボキシアルデヒド、ハイドロキノン、ブロマニル、オクタシアノタングステンおよびオクタシアノモリブデンなどが挙げられる。
【0061】
また電子メディエータは、ポリマーを含む構造であってもよく、たとえば(i)ポリ(ビニルフェロセン)、(ii)ポリカチオン−ヘキサシアノ鉄(II)酸塩、ポリカチオン−ヘキサシアノ鉄(III)酸塩などのイオン性ポリマー、ならびに、(iii)オスミウム−(2,2’−ビピリジン)錯体またはオスミウム−(1,10−フェナントロリン)錯体などのオスミウム錯体が、ポリ(1−ビニルイミダゾール)またはポリ(4−ビニルピリジン)などのポリマーに配位した化合物などの有機遷移金属錯体ポリマー(オスミウム系錯体ポリマー)などが挙げられる。これらの中でも、電子伝達性が高いことから、オスミウム系錯体ポリマーが好ましい。
【0062】
また、電子メディエーターは他の高分子との組成物とすることもできる。電子メディエーターと混合する他の高分子としては、たとえばポリビニルピロリドン、ポリ(1−ビニルイミダゾール)および変性アルブミンなどが挙げられる。これらの中でも、材料費が安価である観点からポリビニルピロリドンが好ましいが、これらの高分子に限定されるものではない。
【0063】
上述した電子メディエータは、抗体6とともに、作用極22上から流出することを防止できる程度の結合によって作用極22に固定されていればよく、たとえば共有結合、イオン結合、配位結合、ファンデルワールス力などの化学的な結合による固定、または、コーティングなどの被膜形成によって作用極22に固定される。また、電子メディエータを上述した作用極22を形成する金属と材料と混合し、これを電気絶縁性の電極系基板20上に蒸着または塗布するようにすることで、作用極22に電子メディエータを固定するようにしてもよい。中でも、安価にしかも容易に製造できるという観点からは、被膜形成により抗体6および電子メディエータを作用極22上に固定しておくことが好ましい。
【0064】
ここで、図3は、図2に示す電極系21における電気化学的反応の検出原理を模式的に示す図であり、図4は図3に示す電気化学的反応により検出され得る電流(検出電流)の一例を模式的に示すグラフである。本発明のキット1は、図2に示したように、検出部5に、電気絶縁性の電極系基板20と、電極系基板20上に互いに離間して配置された作用極22と対極23とを含む電極系21が形成され、かつ、作用極22に抗体6が予め固定されていることで、上述したコルチゾールとコンジュゲートとの競合反応によって、抗体6の一部にコンジュゲートがトラップされる。この際、十分な量のグルコースの存在下で、コンジュゲートの酸化還元酵素によって上述した電気化学的反応が起こり、図3に示したように作用極22で発生した電子が対極23へと流れることになる。このとき、図4に示すグラフ(縦軸は電流値(mA)、横軸は時間(秒))に示すように、作用極22から対極23へと流れる電流値が検出されることになる。
【0065】
なお、本発明の第1のキット1は、通常、図1に示すように、検出部5に関し、試料パッド3とは反対側の基板2の端部に吸収パッド15が設けられる。この吸収パッド15は、毛細管現象によって水平方向に概ね沿って移動し、検出部5を通過した後の液体試料を吸収するためのものであり、上述した試料パッド3を形成する好適な材料として上述した材料にて形成された吸収パッド15を好適に用いることができる。
【0066】
なお、上述した本発明のキット1は、市販品であるアッセンブリーキット(Assembly Kit)(ミリポア社製)を用いて好適に作成することができる。
【0067】
<コルチゾール分析用装置>
図5は、上述した本発明のキット1と組み合わせて用いられ得る好ましい一例の本発明のコルチゾール分析用装置31の模式的な概念図である。本発明はさらに、本発明のキットが上述したように、検出部5に、電気絶縁性の電極系基板20と、電極系基板20上に互いに離間して配置された作用極22と対極23とを含む電極系21が形成され、かつ、作用極22に抗体6が予め固定されているように実現される場合に、このキット1と好適に組み合わせて用いられる分析装置についても提供する。本発明の装置31は、キット1の検出部5の作用極22および対極23をそれぞれ挿入するための挿入部32と、挿入部32に電気的に接続され、挿入部32に挿入された作用極22および対極23から、本発明のキット1にて行われた競合反応の結果を電気化学的に測定する測定部33とを備えることを特徴とする。
【0068】
本発明の装置31における挿入部32は、キット1の電極系21を挿入できる構造であれば特に制限されるものではない。図5には、挿入部32が、キット1の電極系21を挿入した際に、作用極22および対極23にそれぞれ電気的に接続する端子32a,32bがそれぞれ設けられている例が示されている。勿論、上述したように、キット1の電極系21が、液体試料の存在を確認するための参照的な電極(図1および図2に示した例の参照電極24)、キット1が装置31の挿入部32に挿入されたことを確認するための電極などの付属的な電極を具備する場合には、これらの電極と電気的に接触する端子が挿入部32にさらに設けられる。
【0069】
なお、上述したように、抗体6にトラップされたコンジュゲート11の酸化還元酵素による電気化学的反応は、グルコースが十分量存在する場合に起こる。このため、本発明の装置31においては、キット1が挿入部32に挿入された際に、装置31内に予め仕込まれたグルコースが挿入部32に供給され、挿入部32からキット1の電極系21を介して検出部5に十分な量のグルコースが供給されるように実現されることが好ましい。
【0070】
また本発明の装置31における測定部33は、上述した挿入部32に設けられた各端子32a,32bの回路上に配置され、抗体6にトラップされたコンジュゲート11の酸化還元酵素による上述した電気化学的反応で得られた電流値または電気量を測定する手段である。当該測定部33は、具体的には、クーロメトリー、ポテンシオメトリーおよびアンペロメトリーなどを用いて好適に実現することができる。
【0071】
本発明の装置31はまた、測定部33により測定された電流値または電気量をコルチゾール濃度に換算する換算部34を備えることが好ましい。換算部34は、あらかじめ作成した検量線による算出によって、電流値または電気量をコルチゾール濃度に換算し得るようなプログラムを記録した媒体であれば特に制限されるものではなく、従来公知の適宜の手段を組み合わせて実現することができる。
【0072】
また本発明の装置31は、換算部34で算定された結果を表示部(図示せず)に表示するように実現されることが好ましい。この場合、表示部には、コルチゾール濃度の値をそのまま表示してもよいし、ストレス度と称した別のパラメーターにさらに換算して表示してもよい。また、数値に限らず、当該数値に対応したキャラクターを表示することもできる。
【0073】
以下、実験例を挙げて本発明をより詳細に説明するが、本発明はこれらに限定されるものではない。
【0074】
<実験例1:CORT−GODコンジュゲートの作成>
コルチゾール(CORT)との化学結合によるグルコースオキシダーゼ(GOD)の酵素活性の低下を抑えるために、アジポジヒドラジド(ADH)を介してGODとCORTを結合させ、リンカー分子が上記式(II)で表される構造を有し、酸化還元酵素がグルコースオキシダーゼであるCORT−GODコンジュゲートを作成した。
【0075】
まず、上記スキーム1に示したように、10mgのGOD、10μLの0.1M 過ヨウ素酸塩(Sodium meta-peropdate)および1mLの蒸留水を混合し、室温(約24℃)で30分間インキュベートし、GOD−アルデヒドを作成した。得られたGOD−アルデヒドを含む反応後の溶液を、10mM 炭酸アンモニウム(pH9.3)で平衡化したSephadex G−25カラムに通して不純物を除去し、GOD−アルデヒドを精製した。
【0076】
次に、精製されたGOD−アルデヒドに、上記スキーム2に示したように、100mgのアジポジヒドラジド(ADH)を混合し、4℃で一晩中インキュベートした後、1M 水酸化ナトリウムで調製した10μLの5M シアノ水素化ホウ素ナトリウムを混合し、4℃で3時間インキュベートし、GOD−ADHを作成した。得られたGOD−ADHを含む反応後の溶液を、10mM リン酸緩衝液で平衡化したSephadex G−25カラムに通して不純物を除去し、GOD−ADHを精製した。
【0077】
次に、コルチゾールとGOD−ADHとを反応させるために、5mgのコルチゾール−21−hemisuccinate、200μLのジメチルホルムアルデヒド、200μLのジオキサン、100μLの蒸留水を混合した後、10mgのN−ヒドロキシコハク酸イミド、20mgの1−エチル−3−カルボジイミド塩酸塩を混合し、4℃で一晩インキュベートしてコルチゾールを活性化する前処理を施した。その後、上記スキーム3に示したように、活性化させたコルチゾール500μLと、上述のようにして精製されたGOD−ADH1mLとを混合し、4℃で一晩インキュベートしてCORT−GODコンジュゲートを作成した。得られたCORT−GODコンジュゲートを含む反応後の溶液を、10mM リン酸緩衝液で平衡化したSephadex G−25カラムに通して不純物を除去し、CORT−GODコンジュゲートを精製した。(a)酵素免疫測定法、(b)電気泳動をそれぞれ以下のような手順で行い、上述のようにして作成されたのがCORT−GODコンジュゲートであることを確認した。
【0078】
(a)酵素免疫測定法を用いた確認
まず、予めプレートに抗コルチゾール抗体が固相化されているSalivary Cortisol Enzyme Immunoassay Kit(Salimetrics LLC製)に、上述のようにして作成した10mM リン酸緩衝液中のCORT−GODコンジュゲートを、1.06mg/mL、0.53mg/mL、0.21mg/mL、0.106mg/mL、0.053mg/mL、0.021mg/mL、0.0106mg/mLの濃度に調製して、それぞれ25mLずつ滴下し、37℃で1時間インキュベートした後、抗コルチゾール抗体と抗原抗体反応させた。反応後、プレートを洗浄した後に、GOD酵素活性溶液を300mL滴下し、490nmで吸光度の測定を行った。なお、コントロール条件としては、抗体未固相化プレートを用いた。
【0079】
図6は、実験例1で得られたCORT−GODコンジュゲートのGOD酵素活性の吸光度を示すグラフである。GOD酵素活性溶液滴下30分後の1.06mg/mLのCORT−GODコンジュゲートの吸光度は、抗体なしでは1.420、抗体ありでは2.338であり、抗体の有無により吸光度に顕著な差が見られた。また、全ての濃度のCORT−GODコンジュゲートにおいて、抗体なしと比較して、抗体ありの吸光度が高かったことから、特異的にCORT−GODコンジュゲートが抗コルチゾール抗体に結合したものと考えられる。
【0080】
(b)電気泳動を用いた確認
上述のようにして作成した10mM リン酸緩衝液中のCORT−GODコンジュゲート4.5mLに0.5mLの2−メルカプトエタノールと5mLのSample Bufferとを混ぜ、95℃の恒温槽で3分間ボイルしたものをSDS−PAGEのサンプルを調製した。コントロールとして市販のGOD(1mg/mL)を用い、当該GODをレーン1に、上述のように調製したSDS−PAGEのサンプルをレーン2にアプライし、泳動条件20mAでSDS−PAGE、Native−PAGEを行った。電気泳動後、ゲルを洗浄し、CBB染色液で染色を行った。
【0081】
図7は、実験例1に得られたCORT−GODコンジュゲートのSDS−PAGE電気泳動の結果を示す写真である。図7に示されるように、GODは75kDa、CORT−GODコンジュゲートは250kDaのバンドとして検出された。この結果から、上述のようにして得られたCORT−GODコンジュゲートは、グルコースオキシダーゼにコルチゾールが複数結合した酵素標識体であると考えられる。
【0082】
<実験例2:コルチゾール分析用キットの作成>
以下のようにして図1に示した例の本発明のコルチゾール分析用キット1を作成した。まず、ポリエチレン(PE)フィルム(厚み:500μm)を電極系基板20とし、その上に、電極系21として作用極22、対極23および参照極24を真空蒸着により形成した。具体的には、まず、レーザプリンタ(HP Laser Jet 4LJ Pro、ヒューレット・パッカード(株)製)を用いて、電極系基板20上の電極系21を形成する部分以外の部分にマスクを形成した。次に、電極系基板20と電極系21を形成する金属との密着性を向上するために、電極系基板20上にクロム(Cr)層を5nm真空蒸着させ、その上に、金属薄膜の導電率を向上するために、金(Au)層を40nm真空蒸着させた。さらにその上に、白金(Pt)層を40nm、銀(Ag)層を200nm真空蒸着させた。
【0083】
金属薄膜を蒸着させた部分以外のマスクを剥がし落とすために、上述した真空蒸着後の電極系基板20を100mLのアセトンに入れ、3〜5分程超音波洗浄を行ってマスクした部分の除去を行った。水で洗浄した後、エタノールを染み込ませた綿で軽く電極をこすって汚れを除去した。
【0084】
次に、電極系21を、ポテンショスタット/ガルバノスタット(1112型、(株)ビー・ビー・エス製)の参照極に銀/塩化銀、対極に白金(Pt)、そして作用極に銀(Ag)を溶かして白金にする2本の電極を繋いだ。次に、2%希硝酸70mLの中に電極系21の先端部分を2cm浸し、ポテンショスタット/ガルバノスタットを用いて+1mA、150秒で通電させ、最上層のAg層を溶解させPtを露出させた。反応後、電極系21を蒸留水で洗い流して洗浄した。AgClは、銀(Ag)を100mLのKCl溶液で酸化させ(銀塩化銀処理)、AgCl層を作成した。このようにして、図2に示したような形状を有する、白金(Pt)製の作用極22および対極23、ならびに、銀/塩化銀(AgCl)製の参照極24を有する電極系21を形成した。
【0085】
次に、作用極22上に、抗コルチゾール抗体6(Anti−Cortisol−21、コスモバイオ社製)および電子メディエータであるヘキサシアノ鉄イオン、ならびに、非酸化還元物質のグルコースを同時に固定した。なお、抗コルチゾール抗体6の固定は、以下の(1)〜(9)の手順で行った。
【0086】
(1)1.2mol/Lの水酸化ナトリウム水溶液に5分間親戚し、作用極22の表面を洗浄後、純水で洗浄する、
(2)1.2mol/Lの塩酸水溶液に5分間浸漬し、作用極22の表面を洗浄後、純水で洗浄する、
(3)濃塩酸を滴下し、1分後に純水で洗浄する、
(4)10mmol/L 11−メルカプトウンデカン酸のエタノール溶液で洗浄した後、純水で洗浄する、
(5)エタノール中で5分間超音波照射する、
(6)100mg/mL N−ヒドロキシスルホスクシンイミド水溶液100mL、100mg/mL 1−エチル−3−カルボジイミドヒドロクロライド水溶液100mLを滴下し、1時間反応させる、
(7)活性化した作用極22の表面を純水で洗浄し、0.1mol/L トリス−塩酸緩衝液(pH8.0)で洗浄する、
(8)0.1mol/L トリス−塩酸緩衝液(pH8.0)を作用極22に90mL滴下し、100秒後に0.1mol/L トリス−塩酸緩衝液(pH8.0)で希釈した抗体を10mL滴下する、
(9)30分間インキュベートした後に、緩衝液で洗浄する。
【0087】
次に、たとえば、アッセンブリーキット(Assembly Kit)(ミリポア社製)を用いて、以下のようにして本発明のキットを作成した。まず、アッセンブリーキットに付属のガラス繊維製パッドに実験例1で作成した10mM リン酸緩衝液中のCORT−GODコンジュゲートを数滴滴下し、コンジュゲートパッド4を形成した。これをアッセンブリーキットに付属の基板上に設置し、さらにその上に、付属のガラス繊維製パッドを設置して試料パッド3を形成した。また基板2に、上述のように電極系21を形成した電極系基板20を挿入し、検出部5を形成した。この検出部5に関し、試料パッド3とは反対側の基板2の端部には、キットに付属のガラス繊維製パッドを設置して吸収パッド15を形成した。このようにして、図1に示した本発明のキット1を作成した。
【0088】
今回開示された実施の形態および実験例は全ての点で例示であって、制限的なものではないと考えられるべきである。本発明の範囲は上記した説明ではなくて、特許請求の範囲によって示され、特許請求の範囲と均等の意味および範囲内で全ての変更が含まれることが意図される。
【図面の簡単な説明】
【0089】
【図1】本発明の好ましい一例のコルチゾール分析用キット1を模式的に示す図であり、図1(a)は上面図、図1(b)は斜視図である。
【図2】本発明のキット1に好適に用いられる電極系21の一例を模式的に示す上面図である。
【図3】図2に示す電極系21における電気化学的反応の検出原理を模式的に示す図である。
【図4】図3に示す電気化学的反応により検出され得る電流(検出電流)の一例を模式的に示すグラフである。
【図5】本発明のキット1と組み合わせて用いられ得る好ましい一例の本発明の分析装置31の模式的な概念図である。
【図6】実験例1で得られたCORT−GODコンジュゲートのGOD酵素活性の吸光度を示すグラフである。
【図7】実験例1に得られたCORT−GODコンジュゲートのSDS−PAGE電気泳動の結果を示す写真である。
【符号の説明】
【0090】
1 コルチゾール分析用キット、2 基板、3 試料パッド、4 コンジュゲートパッド、5 検出部、6 抗体、7 ハウジング、8 注入部、9 液体試料、10 コルチゾール、11 コンジュゲート、15 吸収パッド、20 電極系基板、21 電極系、22 作用極、23 対極、24 参照極、31 分析装置、32 挿入部、33 測定部、34 換算部。
【技術分野】
【0001】
本発明は、コルチゾールを含むコンジュゲート、およびそれを用いたコルチゾールの分析方法、キット、ならびにそのための装置に関する。
【背景技術】
【0002】
近年、様々なストレスを受けた多くの人々が複雑な治療を要する各種疾患にかかっており、予防的に、ストレスの程度を簡易に判定できる方法、キットまたは装置の開発が注目されている。従来、被検者の心拍数、血圧などを測定することにより被検者のストレスを判定する方法が一般的であったが、このようにして判定されるストレスは一過性のものであり、長期的に続くいわゆる慢性ストレスについては判定することが困難であった。
【0003】
慢性ストレスを判定するための指標として、血液中のコルチゾールなどの副腎皮質ホルモンやアドレナリン、ノルアドレナリンなどの神経伝達物質が知られている。しかし、血液中の成分によってストレスを判定しようとすると、当該成分の採取自体がストレスを伴うという欠点がある。
【0004】
このため、血液に代えて、採取自体にストレスを伴わない唾液中の成分をストレスの判定の指標とすることが検討されている。たとえば上述したコルチゾールは、唾液中にも微量ではあるが含まれていることが知られている(通常、10〜15μg/dl程度)。一般に、生体試料中に含まれる微量タンパクを分析する技術としては、酵素免疫測定(ELISA:Enzyme-Linked Immunosorbent Asssay)法が多く用いられている。この酵素免疫測定法には、大きく分けて競合法とサンドイッチ法とがあるが、いずれも広く知られており、主に感度向上を主眼とし、標識自体の感度改良に関するものを中心とした種々の改良がなされている(たとえば特開2000−180448号公報(特許文献1)、特開2005−337960号公報(特許文献2)などを参照。)。
【0005】
コルチゾールの分析に関しても、上述した酵素免疫測定法を利用して、試料中のコルチゾールを定量分析するためのキットが既に市販されている。しかしながら、このような市販のキットを用いて唾液中のコルチゾールの分析を行う場合には、分析に先立ち、たとえば、遠心分離などによる唾液中の不純物の除去、キット含有試薬の調製および唾液の希釈などの工程数が多く煩雑な作業である前処理が必要であり、また、この前処理や抗原抗体反応を行うためのインキュベーションも長時間を要するため、通常、試料を採取してから定量分析の結果を得るまでに6〜8時間程度かかるという問題があった。また、従来の市販のキットの場合、分光分析を行うための比較的大型の装置が必要となるという問題もあった。
【特許文献1】特開2000−180448号公報
【特許文献2】特開2005−337960号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、上記課題を解決するためになされたものであって、その目的とするところは、唾液中のコルチゾールの迅速な定量分析が可能であり、かつ、当該分析を行うための装置を小型化できる新規な技術を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するためには、コルチゾールと酸化還元酵素とをリンカーで連結させたコンジュゲートを開発することによって、当該コンジュゲートと試料中のコルチゾールとの競合反応による酵素免疫測定法を利用することができ、これによって試料の前処理が不要となるとともに、抗原抗体反応自体も迅速に行い得、しかも酸化還元酵素で標識していることで、分光分析に代えて、コルチゾール濃度に比例した電気信号を電極測定する電気化学計測によりコルチゾールを定量分析できるため、唾液中のコルチゾールのリアルタイムな分析を小型化した装置を用いて行うことが可能となることを見出し、鋭意研究した結果、コルチゾールの新規なコンジュゲートの開発に成功し、本発明を完成させるに至った。すなわち、本発明は以下のとおりである。
【0008】
本発明のコンジュゲートは、コルチゾールと酸化還元酵素とが下記式(I)で表される構造を有するリンカーを介して連結されたものであることを特徴とする。
【0009】
【化1】

【0010】
(上記式(I)中、コルチゾール側に配置されるXはNH、NHNH、CONHNHであり、酸化還元酵素側に配置されるYはNH、NHN=、NHNH、CO、CONHN=、CONHNHであり、Rは酸素原子、硫黄原子または窒素原子で中断されていてもよい炭素数2〜20の炭化水素鎖である。)
本発明のコンジュゲートにおいて、上記式(I)中におけるRは炭素数2〜20のアルキル基であることが好ましい。
【0011】
また本発明のコンジュゲートにおけるリンカーは、下記式(II)で表される構造を有することがより好ましい。
【0012】
【化2】

【0013】
また、本発明のコンジュゲートにおいて、酸化還元酵素はグルコースオキシダーゼ、グルコースデヒドロゲナーゼ、アルコールオキシダーゼおよびガラクトースオキシダーゼから選ばれるいずれかであることが好ましく、グルコースオキシダーゼであることが特に好ましい。
【0014】
本発明はまた、液体試料中のコルチゾールと、上述した本発明のコンジュゲートとの競合反応による酵素免疫測定法を利用して液体試料中のコルチゾールを分析する、コルチゾールの分析方法についても提供する。
【0015】
本発明のコルチゾールの分析方法における液体試料は、唾液から採取したものであることが好ましい。
【0016】
本発明はさらに、毛細管現象によって液体が移動し得るように構成された基板上に、上述した本発明のコンジュゲートが予め含浸されたコンジュゲートパッドと、コルチゾールの抗体が予め固定された検出部とが形成され、コンジュゲートパッドから液体試料中のコルチゾールと前記コンジュゲートとをそれぞれ毛細管現象で検出部まで移動させ、検出部においてコルチゾールの抗体と競合反応させるコルチゾール分析用キットについても提供する。
【0017】
本発明のキットにおける液体試料は、唾液から採取したものであることが好ましい。
本発明のキットは、検出部に、電気絶縁性の電極系基板と、電極系基板上に互いに離間して配置された作用極と対極とを含む電極系が形成され、前記コルチゾールの抗体が作用極上に予め固定されていることが、好ましい。
【0018】
本発明はまた、本発明のキットが、検出部に、電気絶縁性の電極系基板と、電極系基板上に互いに離間して配置された作用極と対極とを含む電極系が形成され、前記コルチゾールの抗体が作用極上に予め固定されている場合、当該キットの検出部の作用極および対極をそれぞれ挿入するための挿入部と、挿入部に電気的に接続され、挿入部に挿入された作用極および対極から前記コルチゾール分析用キットにて行われた競合反応の結果を電気化学的に測定する測定部とを備える、コルチゾール分析用装置についても提供する。
【発明の効果】
【0019】
本発明によれば、コンジュゲートと液体試料中のコルチゾールとの競合反応による酵素免疫測定法を利用することができるようになるため、試料の前処理が不要となるとともに、抗原抗体反応自体も迅速に行い得るようになる。これによって、従来は試料の採取から分析結果を得るまでに6〜8時間ほど要していたのを分オーダー(10分程度)へと短縮することができ、コルチゾールの即時的で特異性の高い定量分析が可能となる。このような本発明により、唾液中のコルチゾールについても簡便・迅速に分析することができるため、ヒトの心身ストレスの研究に有用である。
【0020】
また本発明によれば、コルチゾールを酸化還元酵素で標識しているコンジュゲートを用いることで、コルチゾール濃度に比例した電気信号を電極測定する電気化学計測が可能となり、従来の分光分析を行う場合よりも格段に小型化された装置を用いたリアルタイムな分析の実現が可能となる。
【発明を実施するための最良の形態】
【0021】
<コンジュゲート>
本発明のコンジュゲートは、コルチゾール(CORT)と酸化還元酵素とが特定の構造を有するリンカーを介して連結されたものであることを特徴とする。コルチゾールは、ストレスによって発散される副腎皮質ホルモンのうちの糖質コルチコイドの1種であり、ヒドロコルチゾンとも呼ばれる。コルチゾールは分子量が300程度のハプテンであり、このコルチゾールに標識(マーカー)を連結させたコンジュゲートを用いてコルチゾールとの競合反応を利用した酵素免疫測定法を実現する場合には、高感度な標識を用いる必要がある。本発明のコンジュゲートは、この高感度な標識として酸化還元酵素を用い、コルチゾールと酸化還元酵素とを特定の構造を有するリンカーを介して連結させたものであることを特徴とする。
【0022】
本発明のコンジュゲートに用いられるリンカーが下記式(I)で表される構造を有することが好ましい。なお、下記式(I)で表されるリンカーは、Xがコルチゾール側に配置され、Yが酸化還元酵素側に配置されて連結され、Yと酸化還元酵素との間は、Yおよび酸化還元酵素の種類に応じて単結合または二重結合で結合され得る。
【0023】
【化3】

【0024】
上記式(I)中、コルチゾール側に配置されるXはNH、NHNH、CONHNHであり、中でも反応の工程数が少ない観点からNHまたはNHNHが好ましく、NHNHが特に好ましい。また、上記式(I)中、酸化還元酵素側に配置されるYはNH、NHN=、NHNH、CO、CONHN=、CONHNHであり、中でも反応の工程数が少ない観点からNH、NHN=またはNHNHが好ましく、NHN=が特に好ましい。
【0025】
上記式(I)中、Rは酸素原子、硫黄原子または窒素原子で中断されていてもよい炭素数2〜20(好ましくは炭素数5〜15)の炭化水素鎖である。Rにおける炭素数が1である場合には、酸化還元酵素の立体構造(二次構造)が崩れてしまう虞があり、また、Rにおける炭素数が20を超える場合には、反応性が悪くなる傾向にあるためである。またRは場合によっては二重結合および/または三重結合を含んでいてもよい。抗原抗体反応の効率性の観点からは、上記式(I)中におけるRは炭素数2〜20(より好ましくは炭素数5〜15)のアルキル基であることが好ましい。
【0026】
本発明のコンジュゲートに用いられるリンカーは、上記式(I)で表される構造の中でも、下記式(II)で表される構造を有することが好ましい。下記式(II)で表される構造を有するリンカーを用いることで、アミノ基、カルボキシル基を有しない酸化還元酵素であるグルコースオキシダーゼをコルチゾールとの連結に好適に用いることができるという利点があるためである。
【0027】
【化4】

【0028】
また本発明のコンジュゲートにおける酸化還元酵素は、酸化還元反応を触媒する酵素であれば特に制限されるものではないが、好適な例として、グルコースオキシダーゼ(GOD)、グルコースデヒドロゲナーゼ、アルコールオキシダーゼおよびガラクトースオキシダーゼから選ばれるいずれかを挙げることができる。中でも、酵素活性が高く、安価であることから、グルコースオキシダーゼが特に好ましい。
【0029】
上述したコルチゾールと酸化還元酵素とをリンカーを介して連結させたコンジュゲートは、その作成方法に特に制限はない。以下に好適な一例として、リンカーが上記式(II)で表される構造を有し、酸化還元酵素がグルコースオキシダーゼである場合のコンジュゲート(CORT−GODコンジュゲート)を作成する場合を挙げる。
【0030】
まず、下記スキーム1に示すように、GODに過ヨウ素酸塩および蒸留水を混合して室温でインキュベートすることで反応させ、GODにアルデヒド基を結合させる。なお、下記スキーム1におけるGODのR、R’は共にアルキル基を示す。得られたGOD−アルデヒドは、反応後の溶液を10mM 炭酸アンモニウム(pH9.3)で平衡化したカラム(具体的にはSephadex G−25カラム)に通し、不純物を除去する。
【0031】
【化5】

【0032】
次に、下記スキーム2に示すように、精製したGOD−アルデヒドにアジポジヒドラジド(ADH)を混合し、低温(たとえば4℃)でインキュベートした後、水酸化ナトリウムで調製したシアノ水素化ホウ素ナトリウムを混合し、同じく低温(たとえば4℃)でインキュベートする。得られたGOD−ADHは、反応後の溶液を10mM リン酸緩衝液で平衡化したカラム(具体的にはSephadex G−25カラム)に通し、不純物(ADHの両端にGODが結合したものも含む)を除去する。
【0033】
【化6】

【0034】
次に、下記スキーム3に示すように、GOD−ADHにおけるADHと、コルチゾール(コルチゾール−21−hemisuccinate)とを反応させ、CORT−GODコンジュゲートを作成する。なお、コルチゾールとADHとを結合させるためには、コルチゾールの反応性を高める必要性があるため、前処理として、コルチゾール−21−hemisuccinate、ジメチルホルムアルデヒド、ジオキサンおよび蒸留水を混合し、さらにN−ヒドロキシコハク酸イミド、1−エチル−3−カルボジイミド塩酸塩を混合し、低温(たとえば4℃)でインキュベートすることで、コルチゾールを予め活性化することが好ましい。このように活性化したコルチゾールを精製したGOD−ADHと混合し、低温(たとえば4℃)でインキュベートすることで、CORT−GODコンジュゲートが得られる。得られたCORT−GODコンジュゲートは、反応後の溶液を10mMリン酸緩衝液で平衡化したカラム(具体的にはSephadex G−25カラム)に通し、不純物を除去して、精製する。
【0035】
【化7】

【0036】
なお、当該CORT−GODコンジュゲート以外のコンジュゲートについても、以下の例に従来公知のコンジュゲート作成技術を適宜応用することで作成可能である。上述した例では、コンジュゲートにおけるリンカーを形成する材料としてADHを用いた場合を挙げたが、本発明のコンジュゲートを作成する際にリンカーを形成するための材料としては勿論これに限定されるものではない。
【0037】
ここで、リンカーの一方側の官能基は、コルチゾールのカルボキシル基と結合できる官能基である。このような官能基としては、たとえばアミノ基、ヒドラジン基が挙げられる。一方、リンカーの他方側の官能基は、酸化還元酵素と結合させるための官能基であり、酸化還元酵素の末端官能基の種類によって適宜選択される。たとえば、酸化還元酵素の末端官能基がアミノ基である場合、リンカーの他方側の官能基としてはカルボキシル基が選択される。またたとえば酸化還元酵素の末端官能基がカルボキシル基である場合には、リンカーの他方側の官能基はアミノ基またはヒドラジン基が選択される。また、たとえば酸化還元酵素の末端官能基がアルデヒド基である場合には、リンカー分子の他方側の官能基としてはヒドラジン基が選択される。
【0038】
このようなリンカーを形成するための材料としては、たとえばジアミノエタン、ジアミノプロパン、ジアミノブタン、ジアミノヘキサン、ジアミノオクタン、2,4−ジアミノキシレン、エチレンジヒドラジン、アディピック酸ジヒドラジン、p−フェニレンジヒドラジン、ジフェニル−オルソ−ジヒドラジン、6−アミノヘキサン酸、11−アミノウンデカン酸、各種アミノ酸(プロリンおよびヒドロキシプロリンを除く)、各種ジペプチド(N末端側はプロリンまたはヒドロキシプロリンではないもの)および各種トリペプチド(N末端側はプロリンまたはヒドロキシプロリンではないもの)が挙げられる。ただし、6−アミノヘキサン酸、11−アミノウンデカン酸、各種アミノ酸(プロリンおよびヒドロキシプロリンを除く)、各種ジペプチド(N末端側はプロリンまたはまたはヒドロキシプロリンではない)および各種トリペプチド(N末端側はプロリンまたはヒドロキシプロリンではない)などのカルボキシル基とアミノ基を有する分子をリンカーとして用いる場合、当該リンカー自体が縮合反応を起こさないようにするために、カルボキシル基またはアミノ基を保護する必要がある。カルボキシル基の保護基としては、たとえばメチル基、エチル基、ベンジル基およびtert−ブチル基などが挙げられる。一方、アミノ基の保護基としては、tert−ブトキシカルボニル基、ベンジルオキシカルボニル基、9−フルオレニルメチルオキシカルボニル基およびアリルオキシカルボニル基などが挙げられる。特に、脱保護の反応を容易に行うことができる観点から、カルボキシル基の保護基としてはベンジル基が、アミノ基の保護基としてはtert−ブトキシカルボニル基が好ましいが、本発明は、これらの保護基に限定されるものではない。
【0039】
このような本発明のコンジュゲートによれば、当該コンジュゲートを用いて、液体試料中のコルチゾールとの競合反応による酵素免疫測定法を利用することができるようになるため、これによって試料の前処理が不要となるとともに、抗原抗体反応自体も迅速に行い得るようになり、トータルで分オーダー(10分程度)へと短縮された、コルチゾールの即時的で特異性の高い定量分析が可能となる。また本発明のコンジュゲートは、コルチゾールを酸化還元酵素で標識したものであるため、コルチゾール濃度に比例した電気信号を電極測定する電気化学計測が可能となり、従来の分光分析を行う場合よりも格段に小型化された分析装置を用いたリアルタイムな分析の実現が可能となる(詳細は後述)。
【0040】
本発明のコンジュゲートは、上述した液体試料中のコルチゾールとの競合反応による酵素免疫測定法に特に好適に用いることができるものであるが、その用途についてはこれに制限されるものではなく、デヒドロアピアンドロステロン(DHEA)、エラトラジオールなどのステロイドホルモンの定量分析などの手法に応用可能である。また、本発明のコンジュゲートは、コルチゾールだけでなく他のホルモンの迅速分析にも寄与すると考えられ、化学分析・医療分野での応用範囲は広いと考えられる。
【0041】
<コルチゾール分析方法>
本発明は、液体試料中のコルチゾールと、上述した本発明のコンジュゲートとの競合反応による酵素免疫測定法を利用して液体試料中のコルチゾールを定量分析する、コルチゾールの分析方法についても提供する。本発明のコルチゾールの分析方法によれば、上述した本発明のコンジュゲートと、液体試料中のコルチゾールとの競合反応による酵素免疫測定法を利用することで、従来のコルチゾールの酵素免疫測定法による分析方法とは異なり、試料の前処理が不要となるとともに、抗原抗体反応自体も迅速に行い得るようになるため、トータルで分オーダー(10分程度)へと短縮された、コルチゾールの即時的で特異性の高い定量分析が可能となる。
【0042】
本発明のコルチゾールの分析方法において、液体試料中のコルチゾールと本発明のコンジュゲートとを競合反応させるために用いる抗体としては、コルチゾールに対する抗体(抗コルチゾール抗体)であれば特に制限されるものではなく、具体的には、Anti−Cortisol−3−CMO(American Research Products社製)、Anti−Cortisol−21(コスモバイオ社製)などの市販の抗コルチゾール抗体などが好適な例として挙げられる。
【0043】
本発明のコルチゾールの分析方法における液体試料は、唾液から得られたものであることが好ましい。ヒトのストレスを判定するために、唾液中のコルチゾールを分析することが従来から試みられてきたことは上述したとおりであるが、本発明のコルチゾールの分析方法はこのストレスの判定に特に有用である。ここで、本発明のコルチゾールの分析方法を応用して有無を判定するストレスは、心身ストレス(肉体的ストレス、精神的ストレスの両方を包含する)を意味し、また、急性ストレス、慢性ストレスの両方を包含するが、慢性ストレスについての判定に特に有用である。
【0044】
なお、ストレスの有無を判定するという目的上、液体試料の採取自体は、被験者の身体または精神にストレスをかけることなく行われることが望まれる。このため、液体試料が唾液から採取するものである場合には、液体試料が血液である場合などとは異なり、被験者にストレスを与えることなく短時間で採取することができるという利点がある。
【0045】
唾液の採取には、たとえば特開2006−345869号公報に開示されたような、毛細管現象を利用した器具(キャピラリー)を好適に用いることができる。このような器具を用いることで、1回で、本発明のコルチゾールの分析に十分な量(好ましくは1〜500μL、具体的には100μL程度)の唾液を採取することができる。なお、唾液を採取する被験者の口腔内の場所としては、舌下、舌上、頬肉などが挙げられ、特に制限されるものではない。
【0046】
<コルチゾール分析用キット>
本発明はまた、液体試料中のコルチゾールと、上述した本発明のコンジュゲートとの競合反応による酵素免疫測定法を行うためのコルチゾール分析用キットについても提供する。ここで、図1は、本発明の好ましい一例のコルチゾール分析用キット1を模式的に示す図であり、図1(a)は上面図、図1(b)は斜視図である。図1に示す例の本発明のコルチゾール分析用キット1は、基板2と、基板2上に形成された、試料パッド3と、コンジュゲートパッド4と、検出部5と基本的に備え、検出部5から突出する電極系基板(後述)など、一部を除いたその全体がハウジング7にて覆われるように構成される。なお、図1(b)は、図1(a)に示すキット1からハウジング7を取り除いた状態の斜視図を示している。このような本発明のキット1は、免疫測定法、イムノクロマトグラフィ、電気化学測定を1つの試験紙上にドライケミストリーで構成することで、低廉なディスポーザブル・テストストリップを実現することができるという利点がある。
【0047】
本発明のキット1に用いられる基板2は、毛細管現象によって液体が移動し得るように構成される。これによって、試料パッド3に滴下された液体試料9中のコルチゾール10およびコンジュゲートパッド4に予め含浸された上述した本発明のコンジュゲート11とが、毛細管現象によって試料パッド3およびコンジュゲートパッド4から水平方向に概ね沿って検出部5にまで移動し、検出部5に予め固定された抗体6と競合反応させることによる酵素免疫測定が可能となる。また後述するように当該キット1による酵素免疫測定の結果の電気化学的な測定を可能とする観点からは、当該基板2としてベース基板上に、ニトロセルロース膜、セルロース膜などが形成されたものが好適に用いられる。なお、ベース基板を形成する材料としては、たとえばポリエチレン、ポリエステル、フッ素樹脂、ポリカーボネート、ポリプロピレン、ポリスチレンなどが挙げられるが、上述した性質を有する基板2を実現することができるのであれば、これらに限定されるものではない。上記中でも、耐衝撃性、耐寒性、耐水性、耐電性、絶縁性が良好であり、また化学的に安定で耐薬品性にも優れるという観点からはポリエチレンが好ましく、また、成型加工性が高く、さらに材料費が安価であるという観点から、ポリエステルが好ましい。また、本発明のキットにおける基板は、上述したベース基板の表面に溝が形成されることで、毛細管現象によって液体が移動し得るように構成されていても勿論よいが、液体試料が唾液から採取されたものである場合に液体試料の泡立ちを防止できる観点から、ベース基板上にニトロセルロース膜、セルロース膜などが形成されて実現されてなるのが特に好ましい。
【0048】
試料パッド3は、ハウジング7に形成された注入口8から液体試料9を注入した際に、当該液体試料9中に含まれる、分析対象であるコルチゾールが当該試料パッド3を通過し、基板2に到達するように構成される。より精度の高い競合反応を行うことができるようになる観点からは、試料パッド3は、液体試料9中に含まれる分子量が比較的大きい夾雑物をろ過し得るような材料で形成されることが好ましい。本発明のキット1においても、液体試料は唾液から採取したものであることが好ましいが、この場合には、ムチンなどがこの夾雑物に該当する。このような分子量が比較的大きい夾雑物をろ過し得るような試料パッド3の形成材料としては、たとえば、ガラス繊維、セルロースなどが挙げられるが、これらに制限されるものではない。なお、図1に示す例では、試料パッド3をコンジュゲートパッド4とは別に設けた例を示しているが、コンジュゲートパッド4に液体試料を直接注入して、コンジュゲートパッド4が試料パッドを兼ねるように構成されていても勿論よい。
【0049】
コンジュゲートパッド4には、上述した本発明のコンジュゲート11(好適にはCORT−GODコンジュゲート)が予め含浸され、上述した試料パッド3に液体試料9が注入された場合に、この液体試料9中のコルチゾール10とともに、コンジュゲート11が毛細管現象によって検出部5にまで移動するように構成される。なお、コンジュゲートパッド4は、図1(b)に示す例のように、基板2と試料パッド3との間に介在されるように形成されることが好ましい。これによって、注入口8から液体試料9が注入された際に、試料パッド3を通過した液体試料9がコンジュゲートパッド4を通過して基板2に到達することになり、液体試料9がコンジュゲートパッド4を通過する際に、当該コンジュゲートパッド4に含浸されていたコンジュゲート11が液体試料9に溶け込み、コルチゾール10とコンジュゲート11とが溶け込んだ液体試料9を検出部5に移動させ、より精度の高い競合反応を行うことができるようになるためである。このようなコンジュゲートパッド4を形成する材料としては、試料パッド3を形成する好適な材料として上述した材料を同様に好適に用いることができる。なお、コンジュゲート11をコンジュゲートパッド4に予め含浸させておく方法としては、従来公知の適宜の方法を適用でき、特に制限されないが、たとえばコンジュゲートの溶液にコンジュゲートパッドを入れ攪拌する方法、コンジュゲートパッド上にコンジュゲートの溶液を滴下する方法などが好適である。
【0050】
本発明のキット1における検出部5には、上述したようにコルチゾールの抗体(抗コルチゾール抗体)6が予め固定されている。抗体6としては、市販の抗コルチゾール抗体を特に制限なく用いることができ、具体的には、Anti−Cortisol−3−CMO(American Research Products社製)およびAnti− Cortisol−21(コスモバイオ社製)などが挙げられる。本発明のキット1の注入口8に液体試料9を注入することで、試料パッド3およびコンジュゲートパッド4から毛細管現象によって移動してきた液体試料中のコルチゾール10と、コンジュゲート11とが、検出部5において抗体6と競合反応する(図1(b))。
【0051】
ここで、上述したように、本発明のキット1で利用する本発明のコンジュゲートは、コルチゾールを酸化還元酵素で標識したものであるため、コルチゾール濃度に比例した電気信号を電極測定する電気化学測定を利用することができる。すなわち、上述したように、試料パッド3およびコンジュゲートパッド4から毛細管現象によって移動してきた試料中のコルチゾール10と、コンジュゲート11とが、検出部5において抗体6と競合反応する場合、検出部5にグルコース(C6H12O6)が十分量存在する場合には、抗体6にトラップされたコンジュゲート11の酸化還元酵素(好適にはグルコースオキシダーゼ(GOD))と以下のような反応が起こる。
【0052】
C6H12O6(グルコース)+O2→C6H10O6(グルコノラクトン)+H2O2 (1)
H2O2→2H++2e-+O2 (2)
上記式(2)における電子の生成量は、酸化還元酵素を含むコンジュゲート11の量に比例し、液体試料9中に含まれていたコルチゾール10の濃度には反比例することになる。このため、この電子の生成量を、コルチゾール濃度に比例した電気信号を電極測定することで、予め求めておいた検量線にプロットすることで、液体試料中のコルチゾールの濃度を算出することが可能となる。
【0053】
このような電気化学測定を利用する観点から、本発明のキット1は、図1に示す例のように、検出部5に、電気絶縁性の電極系基板20と、電極系基板20上に互いに離間して配置された作用極22と対極23とを含む電極系21が形成され、前記コルチゾールの抗体が作用極22上に予め固定されているように実現されることが、好ましい。このように実現されたキット1を用いることで、従来の分光分析を行う場合よりも、全体として格段に小型化された分析装置(後述)との組み合わせでの分析が可能となる。
【0054】
ここで、図2は、本発明のキット1に好適に用いられる電極系21の一例を模式的に示す上面図である。電極系21は、上述した電気化学的反応で生じた電流を流すことができ、後述する本発明の分析装置に電気的に接続され、液体試料(好適には、唾液より採取した液体試料)が存在することで、分析装置に電気的に接続された状態で当該分析装置と電気的な回路を形成するように実現される。このような電極系21は、少なくとも作用極22と対極23とを備え、さらには、液体試料の存在を確認するための参照的な電極(図1、2に示す参照電極24)、キット1を分析装置に挿入したことを確認するための電極(図示せず)などの付属的な電極を含んでいてもよい。
【0055】
電極系21における作用極22上には、上述したように抗体6が予め固定されている。これによって、当該抗体6とコルチゾール10およびコンジュゲート11との競合反応により抗体6にトラップされたコンジュゲート11の酸化還元酵素が上述した電気化学反応を起こした際には、発生した電流が作用極22に流れる。このような作用極22は、導電体で形成されているのであれば、その具体的な形成材料については特に制限されないが、たとえば炭素、白金、酸化ルテニウム、パラジウムなどが挙げられ、中でも、耐腐食性が高いという観点からは白金が好ましく、また、材料費が安いという観点からは黒鉛が好ましい。なお、作用極22は、電気絶縁性の電極系基板20(たとえばポリエチレン製)上に、蒸着または塗布などの方法によって形成される。
【0056】
また電極系21における対極23は、電極系基板20上に作用極22とは離間して配置され、液体試料(好適には、唾液より採取した液体試料)が存在することで、上述した作用極22および後述する分析装置と電気的な回路を形成する役割を果たす。このような対極23も導電体で形成されているのであれば、その具体的な形成材料については特に制限されるものではなく、上述した作用極22と同様にたとえば炭素、白金、酸化ルテニウム、パラジウムなどが挙げられ、同様の理由から白金が好ましい。また対極23も、作用極22と同様に、電気絶縁性の電極系基板20(たとえばポリエチレン製)上に、蒸着または塗布などの方法によって形成される。
【0057】
ここで、電極系基板20を形成する材料としては、たとえばポリエチレン、ポリエステル、フッ素樹脂、ポリカーボネート、ポリプロピレン、ポリスチレンなどが挙げられるが、電気絶縁性を有する電極系基板20を実現することができるのであれば、これらに限定されるものではない。上記中でも、耐衝撃性、耐寒性、耐水性、耐電性、絶縁性が良好であり、また化学的に安定で耐薬品性にも優れるという観点からはポリエチレンが好ましく、また、成型加工性が高く、さらに材料費が安価であるという観点から、ポリエステルが好ましい。
【0058】
電極系21における作用極22および対極23は、上述したような電極系基板20上において互いに離間しているのであれば、その配置は特に制限されるものではなく、作用極22と対極23とが対向するように配置されていてもよいし、また、同一平面上に配置されていてもよい。図2には、電極系基板20上に、円形状の作用極22を中心にして、対極23および参照極24が互いに離間して同心円状に配置され、作用極22の外周側に、当該作用極22の周方向に沿って対極23が対向して配置され、さらに、対極23の外周側に、当該対極23の周方向に沿って参照極24が対向するようにして、同一平面上に配置された例が示されている。すなわち、円形状の作用極22の外周に、周方向の一部に切欠部を有する円弧状に形成された対極23が、当該切欠部以外の部分で作用極22を包囲するように形成されている。また、対極23の外周側を周方向に包囲するように、略半円弧状の参照極24が形成されている。
【0059】
図2に示す例では、それぞれ上述した形状を有する作用極22、対極23および参照極24は、配線部が引き出され、その端部に、それぞれ作用極22、対極23および参照極24への電気的な接続を可能とする電極パッドが形成されている。図1に示す例の本発明のキット1は、基板2の検出部5に、電極系21が形成された電極系基板20が挿入され、電極系基板20の上記電極パッドが形成された部分が、キット1から突出するように形成されており、後述する本発明の分析装置への電気的な接続が可能なように実現されている。
【0060】
また、図1および図2に示す例のキット1において、作用極22には、上述したコルチゾールの抗体(抗コルチゾール抗体)6の他に、通常、電子メディエータも予め固定される。ここで、電子メディエータとは、還元することで電子の授受が発生し、液体試料9と作用極22との間の電子伝達を仲介する化合物をいい、ヨウ素、および、ルテニウム、オスミウム、鉄およびコバルトなどの遷移金属を含む化合物であれば、特に限定されるものではない。このような電子メディエータとして、たとえばヘキサシアノ鉄(II)酸カリウム、ヘキサシアノ鉄(III)酸カリウム、フェロセン、1,1’−ジメチルフェロセン、フェロセンカルボン酸、フォロセンカルボキシアルデヒド、ハイドロキノン、ブロマニル、オクタシアノタングステンおよびオクタシアノモリブデンなどが挙げられる。
【0061】
また電子メディエータは、ポリマーを含む構造であってもよく、たとえば(i)ポリ(ビニルフェロセン)、(ii)ポリカチオン−ヘキサシアノ鉄(II)酸塩、ポリカチオン−ヘキサシアノ鉄(III)酸塩などのイオン性ポリマー、ならびに、(iii)オスミウム−(2,2’−ビピリジン)錯体またはオスミウム−(1,10−フェナントロリン)錯体などのオスミウム錯体が、ポリ(1−ビニルイミダゾール)またはポリ(4−ビニルピリジン)などのポリマーに配位した化合物などの有機遷移金属錯体ポリマー(オスミウム系錯体ポリマー)などが挙げられる。これらの中でも、電子伝達性が高いことから、オスミウム系錯体ポリマーが好ましい。
【0062】
また、電子メディエーターは他の高分子との組成物とすることもできる。電子メディエーターと混合する他の高分子としては、たとえばポリビニルピロリドン、ポリ(1−ビニルイミダゾール)および変性アルブミンなどが挙げられる。これらの中でも、材料費が安価である観点からポリビニルピロリドンが好ましいが、これらの高分子に限定されるものではない。
【0063】
上述した電子メディエータは、抗体6とともに、作用極22上から流出することを防止できる程度の結合によって作用極22に固定されていればよく、たとえば共有結合、イオン結合、配位結合、ファンデルワールス力などの化学的な結合による固定、または、コーティングなどの被膜形成によって作用極22に固定される。また、電子メディエータを上述した作用極22を形成する金属と材料と混合し、これを電気絶縁性の電極系基板20上に蒸着または塗布するようにすることで、作用極22に電子メディエータを固定するようにしてもよい。中でも、安価にしかも容易に製造できるという観点からは、被膜形成により抗体6および電子メディエータを作用極22上に固定しておくことが好ましい。
【0064】
ここで、図3は、図2に示す電極系21における電気化学的反応の検出原理を模式的に示す図であり、図4は図3に示す電気化学的反応により検出され得る電流(検出電流)の一例を模式的に示すグラフである。本発明のキット1は、図2に示したように、検出部5に、電気絶縁性の電極系基板20と、電極系基板20上に互いに離間して配置された作用極22と対極23とを含む電極系21が形成され、かつ、作用極22に抗体6が予め固定されていることで、上述したコルチゾールとコンジュゲートとの競合反応によって、抗体6の一部にコンジュゲートがトラップされる。この際、十分な量のグルコースの存在下で、コンジュゲートの酸化還元酵素によって上述した電気化学的反応が起こり、図3に示したように作用極22で発生した電子が対極23へと流れることになる。このとき、図4に示すグラフ(縦軸は電流値(mA)、横軸は時間(秒))に示すように、作用極22から対極23へと流れる電流値が検出されることになる。
【0065】
なお、本発明の第1のキット1は、通常、図1に示すように、検出部5に関し、試料パッド3とは反対側の基板2の端部に吸収パッド15が設けられる。この吸収パッド15は、毛細管現象によって水平方向に概ね沿って移動し、検出部5を通過した後の液体試料を吸収するためのものであり、上述した試料パッド3を形成する好適な材料として上述した材料にて形成された吸収パッド15を好適に用いることができる。
【0066】
なお、上述した本発明のキット1は、市販品であるアッセンブリーキット(Assembly Kit)(ミリポア社製)を用いて好適に作成することができる。
【0067】
<コルチゾール分析用装置>
図5は、上述した本発明のキット1と組み合わせて用いられ得る好ましい一例の本発明のコルチゾール分析用装置31の模式的な概念図である。本発明はさらに、本発明のキットが上述したように、検出部5に、電気絶縁性の電極系基板20と、電極系基板20上に互いに離間して配置された作用極22と対極23とを含む電極系21が形成され、かつ、作用極22に抗体6が予め固定されているように実現される場合に、このキット1と好適に組み合わせて用いられる分析装置についても提供する。本発明の装置31は、キット1の検出部5の作用極22および対極23をそれぞれ挿入するための挿入部32と、挿入部32に電気的に接続され、挿入部32に挿入された作用極22および対極23から、本発明のキット1にて行われた競合反応の結果を電気化学的に測定する測定部33とを備えることを特徴とする。
【0068】
本発明の装置31における挿入部32は、キット1の電極系21を挿入できる構造であれば特に制限されるものではない。図5には、挿入部32が、キット1の電極系21を挿入した際に、作用極22および対極23にそれぞれ電気的に接続する端子32a,32bがそれぞれ設けられている例が示されている。勿論、上述したように、キット1の電極系21が、液体試料の存在を確認するための参照的な電極(図1および図2に示した例の参照電極24)、キット1が装置31の挿入部32に挿入されたことを確認するための電極などの付属的な電極を具備する場合には、これらの電極と電気的に接触する端子が挿入部32にさらに設けられる。
【0069】
なお、上述したように、抗体6にトラップされたコンジュゲート11の酸化還元酵素による電気化学的反応は、グルコースが十分量存在する場合に起こる。このため、本発明の装置31においては、キット1が挿入部32に挿入された際に、装置31内に予め仕込まれたグルコースが挿入部32に供給され、挿入部32からキット1の電極系21を介して検出部5に十分な量のグルコースが供給されるように実現されることが好ましい。
【0070】
また本発明の装置31における測定部33は、上述した挿入部32に設けられた各端子32a,32bの回路上に配置され、抗体6にトラップされたコンジュゲート11の酸化還元酵素による上述した電気化学的反応で得られた電流値または電気量を測定する手段である。当該測定部33は、具体的には、クーロメトリー、ポテンシオメトリーおよびアンペロメトリーなどを用いて好適に実現することができる。
【0071】
本発明の装置31はまた、測定部33により測定された電流値または電気量をコルチゾール濃度に換算する換算部34を備えることが好ましい。換算部34は、あらかじめ作成した検量線による算出によって、電流値または電気量をコルチゾール濃度に換算し得るようなプログラムを記録した媒体であれば特に制限されるものではなく、従来公知の適宜の手段を組み合わせて実現することができる。
【0072】
また本発明の装置31は、換算部34で算定された結果を表示部(図示せず)に表示するように実現されることが好ましい。この場合、表示部には、コルチゾール濃度の値をそのまま表示してもよいし、ストレス度と称した別のパラメーターにさらに換算して表示してもよい。また、数値に限らず、当該数値に対応したキャラクターを表示することもできる。
【0073】
以下、実験例を挙げて本発明をより詳細に説明するが、本発明はこれらに限定されるものではない。
【0074】
<実験例1:CORT−GODコンジュゲートの作成>
コルチゾール(CORT)との化学結合によるグルコースオキシダーゼ(GOD)の酵素活性の低下を抑えるために、アジポジヒドラジド(ADH)を介してGODとCORTを結合させ、リンカー分子が上記式(II)で表される構造を有し、酸化還元酵素がグルコースオキシダーゼであるCORT−GODコンジュゲートを作成した。
【0075】
まず、上記スキーム1に示したように、10mgのGOD、10μLの0.1M 過ヨウ素酸塩(Sodium meta-peropdate)および1mLの蒸留水を混合し、室温(約24℃)で30分間インキュベートし、GOD−アルデヒドを作成した。得られたGOD−アルデヒドを含む反応後の溶液を、10mM 炭酸アンモニウム(pH9.3)で平衡化したSephadex G−25カラムに通して不純物を除去し、GOD−アルデヒドを精製した。
【0076】
次に、精製されたGOD−アルデヒドに、上記スキーム2に示したように、100mgのアジポジヒドラジド(ADH)を混合し、4℃で一晩中インキュベートした後、1M 水酸化ナトリウムで調製した10μLの5M シアノ水素化ホウ素ナトリウムを混合し、4℃で3時間インキュベートし、GOD−ADHを作成した。得られたGOD−ADHを含む反応後の溶液を、10mM リン酸緩衝液で平衡化したSephadex G−25カラムに通して不純物を除去し、GOD−ADHを精製した。
【0077】
次に、コルチゾールとGOD−ADHとを反応させるために、5mgのコルチゾール−21−hemisuccinate、200μLのジメチルホルムアルデヒド、200μLのジオキサン、100μLの蒸留水を混合した後、10mgのN−ヒドロキシコハク酸イミド、20mgの1−エチル−3−カルボジイミド塩酸塩を混合し、4℃で一晩インキュベートしてコルチゾールを活性化する前処理を施した。その後、上記スキーム3に示したように、活性化させたコルチゾール500μLと、上述のようにして精製されたGOD−ADH1mLとを混合し、4℃で一晩インキュベートしてCORT−GODコンジュゲートを作成した。得られたCORT−GODコンジュゲートを含む反応後の溶液を、10mM リン酸緩衝液で平衡化したSephadex G−25カラムに通して不純物を除去し、CORT−GODコンジュゲートを精製した。(a)酵素免疫測定法、(b)電気泳動をそれぞれ以下のような手順で行い、上述のようにして作成されたのがCORT−GODコンジュゲートであることを確認した。
【0078】
(a)酵素免疫測定法を用いた確認
まず、予めプレートに抗コルチゾール抗体が固相化されているSalivary Cortisol Enzyme Immunoassay Kit(Salimetrics LLC製)に、上述のようにして作成した10mM リン酸緩衝液中のCORT−GODコンジュゲートを、1.06mg/mL、0.53mg/mL、0.21mg/mL、0.106mg/mL、0.053mg/mL、0.021mg/mL、0.0106mg/mLの濃度に調製して、それぞれ25mLずつ滴下し、37℃で1時間インキュベートした後、抗コルチゾール抗体と抗原抗体反応させた。反応後、プレートを洗浄した後に、GOD酵素活性溶液を300mL滴下し、490nmで吸光度の測定を行った。なお、コントロール条件としては、抗体未固相化プレートを用いた。
【0079】
図6は、実験例1で得られたCORT−GODコンジュゲートのGOD酵素活性の吸光度を示すグラフである。GOD酵素活性溶液滴下30分後の1.06mg/mLのCORT−GODコンジュゲートの吸光度は、抗体なしでは1.420、抗体ありでは2.338であり、抗体の有無により吸光度に顕著な差が見られた。また、全ての濃度のCORT−GODコンジュゲートにおいて、抗体なしと比較して、抗体ありの吸光度が高かったことから、特異的にCORT−GODコンジュゲートが抗コルチゾール抗体に結合したものと考えられる。
【0080】
(b)電気泳動を用いた確認
上述のようにして作成した10mM リン酸緩衝液中のCORT−GODコンジュゲート4.5mLに0.5mLの2−メルカプトエタノールと5mLのSample Bufferとを混ぜ、95℃の恒温槽で3分間ボイルしたものをSDS−PAGEのサンプルを調製した。コントロールとして市販のGOD(1mg/mL)を用い、当該GODをレーン1に、上述のように調製したSDS−PAGEのサンプルをレーン2にアプライし、泳動条件20mAでSDS−PAGE、Native−PAGEを行った。電気泳動後、ゲルを洗浄し、CBB染色液で染色を行った。
【0081】
図7は、実験例1に得られたCORT−GODコンジュゲートのSDS−PAGE電気泳動の結果を示す写真である。図7に示されるように、GODは75kDa、CORT−GODコンジュゲートは250kDaのバンドとして検出された。この結果から、上述のようにして得られたCORT−GODコンジュゲートは、グルコースオキシダーゼにコルチゾールが複数結合した酵素標識体であると考えられる。
【0082】
<実験例2:コルチゾール分析用キットの作成>
以下のようにして図1に示した例の本発明のコルチゾール分析用キット1を作成した。まず、ポリエチレン(PE)フィルム(厚み:500μm)を電極系基板20とし、その上に、電極系21として作用極22、対極23および参照極24を真空蒸着により形成した。具体的には、まず、レーザプリンタ(HP Laser Jet 4LJ Pro、ヒューレット・パッカード(株)製)を用いて、電極系基板20上の電極系21を形成する部分以外の部分にマスクを形成した。次に、電極系基板20と電極系21を形成する金属との密着性を向上するために、電極系基板20上にクロム(Cr)層を5nm真空蒸着させ、その上に、金属薄膜の導電率を向上するために、金(Au)層を40nm真空蒸着させた。さらにその上に、白金(Pt)層を40nm、銀(Ag)層を200nm真空蒸着させた。
【0083】
金属薄膜を蒸着させた部分以外のマスクを剥がし落とすために、上述した真空蒸着後の電極系基板20を100mLのアセトンに入れ、3〜5分程超音波洗浄を行ってマスクした部分の除去を行った。水で洗浄した後、エタノールを染み込ませた綿で軽く電極をこすって汚れを除去した。
【0084】
次に、電極系21を、ポテンショスタット/ガルバノスタット(1112型、(株)ビー・ビー・エス製)の参照極に銀/塩化銀、対極に白金(Pt)、そして作用極に銀(Ag)を溶かして白金にする2本の電極を繋いだ。次に、2%希硝酸70mLの中に電極系21の先端部分を2cm浸し、ポテンショスタット/ガルバノスタットを用いて+1mA、150秒で通電させ、最上層のAg層を溶解させPtを露出させた。反応後、電極系21を蒸留水で洗い流して洗浄した。AgClは、銀(Ag)を100mLのKCl溶液で酸化させ(銀塩化銀処理)、AgCl層を作成した。このようにして、図2に示したような形状を有する、白金(Pt)製の作用極22および対極23、ならびに、銀/塩化銀(AgCl)製の参照極24を有する電極系21を形成した。
【0085】
次に、作用極22上に、抗コルチゾール抗体6(Anti−Cortisol−21、コスモバイオ社製)および電子メディエータであるヘキサシアノ鉄イオン、ならびに、非酸化還元物質のグルコースを同時に固定した。なお、抗コルチゾール抗体6の固定は、以下の(1)〜(9)の手順で行った。
【0086】
(1)1.2mol/Lの水酸化ナトリウム水溶液に5分間親戚し、作用極22の表面を洗浄後、純水で洗浄する、
(2)1.2mol/Lの塩酸水溶液に5分間浸漬し、作用極22の表面を洗浄後、純水で洗浄する、
(3)濃塩酸を滴下し、1分後に純水で洗浄する、
(4)10mmol/L 11−メルカプトウンデカン酸のエタノール溶液で洗浄した後、純水で洗浄する、
(5)エタノール中で5分間超音波照射する、
(6)100mg/mL N−ヒドロキシスルホスクシンイミド水溶液100mL、100mg/mL 1−エチル−3−カルボジイミドヒドロクロライド水溶液100mLを滴下し、1時間反応させる、
(7)活性化した作用極22の表面を純水で洗浄し、0.1mol/L トリス−塩酸緩衝液(pH8.0)で洗浄する、
(8)0.1mol/L トリス−塩酸緩衝液(pH8.0)を作用極22に90mL滴下し、100秒後に0.1mol/L トリス−塩酸緩衝液(pH8.0)で希釈した抗体を10mL滴下する、
(9)30分間インキュベートした後に、緩衝液で洗浄する。
【0087】
次に、たとえば、アッセンブリーキット(Assembly Kit)(ミリポア社製)を用いて、以下のようにして本発明のキットを作成した。まず、アッセンブリーキットに付属のガラス繊維製パッドに実験例1で作成した10mM リン酸緩衝液中のCORT−GODコンジュゲートを数滴滴下し、コンジュゲートパッド4を形成した。これをアッセンブリーキットに付属の基板上に設置し、さらにその上に、付属のガラス繊維製パッドを設置して試料パッド3を形成した。また基板2に、上述のように電極系21を形成した電極系基板20を挿入し、検出部5を形成した。この検出部5に関し、試料パッド3とは反対側の基板2の端部には、キットに付属のガラス繊維製パッドを設置して吸収パッド15を形成した。このようにして、図1に示した本発明のキット1を作成した。
【0088】
今回開示された実施の形態および実験例は全ての点で例示であって、制限的なものではないと考えられるべきである。本発明の範囲は上記した説明ではなくて、特許請求の範囲によって示され、特許請求の範囲と均等の意味および範囲内で全ての変更が含まれることが意図される。
【図面の簡単な説明】
【0089】
【図1】本発明の好ましい一例のコルチゾール分析用キット1を模式的に示す図であり、図1(a)は上面図、図1(b)は斜視図である。
【図2】本発明のキット1に好適に用いられる電極系21の一例を模式的に示す上面図である。
【図3】図2に示す電極系21における電気化学的反応の検出原理を模式的に示す図である。
【図4】図3に示す電気化学的反応により検出され得る電流(検出電流)の一例を模式的に示すグラフである。
【図5】本発明のキット1と組み合わせて用いられ得る好ましい一例の本発明の分析装置31の模式的な概念図である。
【図6】実験例1で得られたCORT−GODコンジュゲートのGOD酵素活性の吸光度を示すグラフである。
【図7】実験例1に得られたCORT−GODコンジュゲートのSDS−PAGE電気泳動の結果を示す写真である。
【符号の説明】
【0090】
1 コルチゾール分析用キット、2 基板、3 試料パッド、4 コンジュゲートパッド、5 検出部、6 抗体、7 ハウジング、8 注入部、9 液体試料、10 コルチゾール、11 コンジュゲート、15 吸収パッド、20 電極系基板、21 電極系、22 作用極、23 対極、24 参照極、31 分析装置、32 挿入部、33 測定部、34 換算部。
【特許請求の範囲】
【請求項1】
コルチゾールと酸化還元酵素とが下記式(I)で表される構造を有するリンカーを介して連結された、コンジュゲート。
【化1】

(上記式(I)中、コルチゾール側に配置されるXはNH、NHNH、CONHNHであり、酸化還元酵素側に配置されるYはNH、NHN=、NHNH、CO、CONHN=、CONHNHであり、Rは酸素原子、硫黄原子または窒素原子で中断されていてもよい炭素数2〜20の炭化水素鎖である。)
【請求項2】
上記式(I)中におけるRが炭素数2〜20のアルキル基である、請求項1に記載のコンジュゲート。
【請求項3】
リンカーが下記式(II)で表される構造を有する、請求項1または2に記載のコンジュゲート。
【化2】

【請求項4】
酸化還元酵素が、グルコースオキシダーゼ、グルコースデヒドロゲナーゼ、アルコールオキシダーゼおよびガラクトースオキシダーゼから選ばれるいずれかである、請求項1〜3のいずれかに記載のコンジュゲート。
【請求項5】
酸化還元酵素がグルコースオキシダーゼである、請求項4に記載のコンジュゲート。
【請求項6】
液体試料中のコルチゾールと、請求項1〜5のいずれかに記載のコンジュゲートとの競合反応による酵素免疫測定法を利用して液体試料中のコルチゾールを分析する、コルチゾールの分析方法。
【請求項7】
液体試料が唾液から採取したものである、請求項6に記載の方法。
【請求項8】
毛細管現象によって液体が移動し得るように構成された基板上に、請求項1〜5のいずれかに記載のコンジュゲートが予め含浸されたコンジュゲートパッドと、コルチゾールの抗体が予め固定された検出部とが形成され、
コンジュゲートパッドから液体試料中のコルチゾールと前記コンジュゲートとをそれぞれ毛細管現象で検出部まで移動させ、検出部においてコルチゾールの抗体と競合反応させる、コルチゾール分析用キット。
【請求項9】
液体試料が唾液から採取したものである、請求項8に記載のキット。
【請求項10】
検出部に、電気絶縁性の電極系基板と、電極系基板上に互いに離間して配置された作用極と対極とを含む電極系が形成され、前記コルチゾールの抗体が作用極上に予め固定されている、請求項8または9に記載のキット。
【請求項11】
請求項10に記載のキットの検出部の作用極および対極をそれぞれ挿入するための挿入部と、
挿入部に電気的に接続され、挿入部に挿入された作用極および対極から前記コルチゾール分析用キットにて行われた競合反応の結果を電気化学的に測定する測定部とを備える、コルチゾール分析用装置。
【請求項1】
コルチゾールと酸化還元酵素とが下記式(I)で表される構造を有するリンカーを介して連結された、コンジュゲート。
【化1】

(上記式(I)中、コルチゾール側に配置されるXはNH、NHNH、CONHNHであり、酸化還元酵素側に配置されるYはNH、NHN=、NHNH、CO、CONHN=、CONHNHであり、Rは酸素原子、硫黄原子または窒素原子で中断されていてもよい炭素数2〜20の炭化水素鎖である。)
【請求項2】
上記式(I)中におけるRが炭素数2〜20のアルキル基である、請求項1に記載のコンジュゲート。
【請求項3】
リンカーが下記式(II)で表される構造を有する、請求項1または2に記載のコンジュゲート。
【化2】

【請求項4】
酸化還元酵素が、グルコースオキシダーゼ、グルコースデヒドロゲナーゼ、アルコールオキシダーゼおよびガラクトースオキシダーゼから選ばれるいずれかである、請求項1〜3のいずれかに記載のコンジュゲート。
【請求項5】
酸化還元酵素がグルコースオキシダーゼである、請求項4に記載のコンジュゲート。
【請求項6】
液体試料中のコルチゾールと、請求項1〜5のいずれかに記載のコンジュゲートとの競合反応による酵素免疫測定法を利用して液体試料中のコルチゾールを分析する、コルチゾールの分析方法。
【請求項7】
液体試料が唾液から採取したものである、請求項6に記載の方法。
【請求項8】
毛細管現象によって液体が移動し得るように構成された基板上に、請求項1〜5のいずれかに記載のコンジュゲートが予め含浸されたコンジュゲートパッドと、コルチゾールの抗体が予め固定された検出部とが形成され、
コンジュゲートパッドから液体試料中のコルチゾールと前記コンジュゲートとをそれぞれ毛細管現象で検出部まで移動させ、検出部においてコルチゾールの抗体と競合反応させる、コルチゾール分析用キット。
【請求項9】
液体試料が唾液から採取したものである、請求項8に記載のキット。
【請求項10】
検出部に、電気絶縁性の電極系基板と、電極系基板上に互いに離間して配置された作用極と対極とを含む電極系が形成され、前記コルチゾールの抗体が作用極上に予め固定されている、請求項8または9に記載のキット。
【請求項11】
請求項10に記載のキットの検出部の作用極および対極をそれぞれ挿入するための挿入部と、
挿入部に電気的に接続され、挿入部に挿入された作用極および対極から前記コルチゾール分析用キットにて行われた競合反応の結果を電気化学的に測定する測定部とを備える、コルチゾール分析用装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2009−210417(P2009−210417A)
【公開日】平成21年9月17日(2009.9.17)
【国際特許分類】
【出願番号】特願2008−53723(P2008−53723)
【出願日】平成20年3月4日(2008.3.4)
【出願人】(000135036)ニプロ株式会社 (583)
【出願人】(305060567)国立大学法人富山大学 (194)
【公開日】平成21年9月17日(2009.9.17)
【国際特許分類】
【出願日】平成20年3月4日(2008.3.4)
【出願人】(000135036)ニプロ株式会社 (583)
【出願人】(305060567)国立大学法人富山大学 (194)
[ Back to top ]

