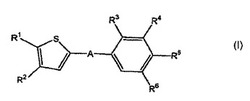
新規チオフェン誘導体
本発明は、Gタンパク質結合受容体S1P1/EDG1のアゴニストであり、かつ循環および浸潤するTおよびBリンパ球の数を減少させることによりこれらの成熟、記憶または増殖に影響を及ぼさずに達成される強力かつ持続性の免疫抑制効果を有する式(I)の新規化合物を提供する。S1P1/EDG1アゴニズムの結果としての循環T/Bリンパ球の減少により、おそらくS1P1/EDG1活性化と関連した内皮細胞層機能の改善が観察されることと合わせて、このような化合物が、抑制されていない炎症性疾患を治療するために、および血管機能性を改善するために有用となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、式(I)のS1P1/EDG1受容体アゴニストおよび医薬組成物の製造における活性成分としてのこれらの使用に関する。また、本発明は、化合物の製造のための方法、式(I)の化合物を含む医薬組成物、並びに血管機能を改善する化合物としての、および免疫調節薬としての、単独またはその他の活性化合物もしくは療法と組み合わせたこれらの使用を含む関連した側面に関する。
【背景技術】
【0002】
ヒト免疫系は、感染または疾患を生じさせる外来微生物および物質から体を守るようにデザインされている。複雑な調節機構が、免疫応答が侵入する物質または生物体を標的とし、宿主を標的としないことを保証する。場合によっては、これらの制御メカニズムが制御されず、自己免疫応答を発症し得る。炎症反応が制御されない結果として、重篤な器官、細胞、組織または関節の損傷が生じる。また、現在の治療では、通常、全免疫系が抑制されて、体が感染に応答する能力が大きく損なわれてしまう。この種の典型的な薬物には、アザチオプリン、クロランブシル、シクロホスファミド、シクロスポリンまたはメトトレキセートを含む。炎症を減少させて、免疫応答を抑制する副腎皮質ステロイドは、長期治療に使用されると、副作用の原因となることがある。非ステロイド性抗炎症薬(NSAID)は、疼痛および炎症を減少させることができるが、しかし、これらは、かなりの副作用を示す。代わりの治療には、サイトカインシグナリングを活性化し、または遮断する薬剤を含む。
【0003】
免疫調節特性をもち、免疫応答を損なうことなく、そして副作用が減少された、経口で有効な化合物は、制御されない炎症性疾患の現在の治療を大幅に向上させるであろう。
臓器移植の分野では、器官拒絶反応を防止するために宿主免疫応答を抑制しなければならない。臓器移植レシピエントは、彼らが免疫抑制剤を服用するときでも、いくらか拒絶反応を受けることがある。拒絶反応は、移植後の最初の数週に最も頻繁に生じるが、拒絶反応の発症は、移植の何月もまたは何年後でさえも生じ得る。副作用を最小にすると共に、拒絶反応から最大限保護するために、3つまたは4つまでの薬物療法の組み合わせが一般に使用されている。移植臓器の拒絶反応を治療するために使用される現在の標準薬は、T型またはB型白血球の活性化における別々の細胞内経路を妨げる。このような薬物の例には、サイトカイン放出またはシグナリングを妨げるシクロスポリン、ダクリズマブ、バシリキシマブ、エベロリムスもしくはFK506;ヌクレオチド合成を阻害するアザチオプリンもしくはレフルノミド;または白血球分化の阻害剤である15-デオキシスペルグアリンがある。
【0004】
広範な免疫抑制療法による有益な効果は、これらの効果に関連するが;しかし、これらの薬物により生じる全身的免疫抑制は、感染および悪性腫瘍に対する免疫系の防御を減弱させる。さらにまた、標準的な免疫抑制剤は、高投薬量で使用されることが多く、器官損傷を引き起こし、または促進し得る。
【発明の開示】
【0005】
本発明は、Gタンパク質結合受容体S1P1/EDG1のアゴニストであり、かつ循環および浸潤するTおよびBリンパ球の数を減少させることによりこれらの成熟、記憶または増殖に影響を及ぼさずに達成される強力かつ持続性の免疫抑制効果を有する式(I)の新規化合物を提供する。S1P1/EDG1アゴニズムの結果としての循環T/Bリンパ球の減少により、おそらくS1P1/EDG1活性化と関連した内皮細胞層機能の改善が観察されることと合わせて、このような化合物が、抑制されていない炎症性疾患を治療するために、および血管機能性を改善するために有用となる。
【0006】
本発明の化合物は、単独で、またはT細胞活性化を阻害する標準薬と組み合わせて、標準的な免疫抑制療法と比較したときに感染の性向が減少した新たな免疫抑制療法を提供するために利用することができる。さらにまた、本発明の化合物は、投薬量を減少した従来の免疫抑制性療法と組み合わせて、一方では有効な免疫抑制活性を、一方では高用量の標準的な免疫抑制剤に付随した末端器官損傷の減少を提供するために使用することができる。S1P1/EDG1活性化と関連した内皮細胞層機能の改善の観察は、血管機能を改善するための化合物のさらなる利点をもたらす。
【0007】
ヒトS1P1/EDG1受容体のためのヌクレオチド配列およびアミノ酸配列は、当技術分野において公知であり、たとえばHla, T., and Maciag, T. J. Biol Chem. 265(1990), 9308-9313;1991年10月17日に公開された国際公開公報第91/15583号;1999年9月16日に公開された国際公開公報第99/46277号に発表されている(非特許文献1、特許文献1および2)。式(I)の化合物の能力および有効性は、EC50値を決定するためのGTPγSアッセイ法を使用して、および経口投与後のラットにおける循環リンパ球を測定することによって、それぞれ評価される(実施例を参照されたい)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際公開公報第91/15583号
【特許文献2】国際公開公報第99/46277号
【非特許文献】
【0009】
【非特許文献1】Hla, T., and Maciag, T. J. Biol Chem. 265(1990) 上記及び下記において使用される一般的用語は、本開示の範囲内において、特に示さない限り、好ましくは以下の意味を有する。化合物、塩、医薬組成物、疾病等について複数形が使用される場合は、単数の化合物、塩等をも意味することが意図されている。
【0010】
式(I)の化合物に対する上記又は下記のいずれの言及も、適切かつ好都合なように、式(I)の化合物の塩、特に薬学的に許容される塩をも指すものと理解されるべきである。
【0011】
C1-5アルキルという用語は、単独で、またはその他の基と組み合わせて、1から5の炭素原子をもつ飽和した、分枝または好ましくは直鎖状基を意味する。C1-5アルキル基の好ましい例は、メチル、エチル、n-プロピル、n-ブチル、イソ-ブチルおよびn-ペンチルである。
【0012】
C1-4アルキルという用語は、単独で、またはその他の基と組み合わせて、1から4の炭素原子、好ましくは1から3の炭素原子、すなわちC1-3アルキル、をもつ飽和した、分枝または好ましくは直鎖状基を意味する。C1-4アルキル基の好ましい例は、メチル、エチルおよびn-プロピルである。
【0013】
同様に、C2-5アルキルという用語は、単独で、またはその他の基と組み合わせて、2から5の炭素原子をもつ飽和した、分枝または直鎖状基,を意味する。C2-5アルキル基の好ましい例は、エチル、n-プロピル、n-ブチル、イソ-ブチル、n-ペンチルおよびイソ-ペンチルである。
【0014】
C1-5アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC1-5アルキルであるR-O基を意味する。
【0015】
C1-4アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC1-4アルキルであるR-O基を意味する。C1-4アルコキシ基の好ましい例は、メトキシ、エトキシ、プロポキシ、イソ-プロポキシおよびイソ-ブトキシである。
【0016】
C2-5アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC2-5アルキルであるR-O基を意味する。
ハロゲンという用語は、フルオロ、クロロ、ブロモまたはヨード、好ましくはフルオロまたはクロロを意味する。
【0017】
塩は、好ましくは式(I)の化合物の薬学的に許容される塩である。
薬学的に許容される塩という用語は、無毒性の無機もしくは有機酸および/または塩基付加塩を意味する、文献: 例えば"Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217。
【0018】
式(I)の化合物は、1または2以上の不斉炭素原子などの、1または2以上のキラルまたは不斉中心を含んでいてもよい。二重結合または環の置換基は、特に明記しない限り、cis- (=Z-)またはtrans (=E-)形態で存在してもよい。従って、式(I)の化合物は、立体異性体の混合物として、または好ましくは純粋な立体異性体として存在してもよい。立体異性体の混合物は当業者に知られた方法で分離してもよい。
【0019】
i)本発明は、式(I)の新規なチオフェン誘導体およびこのような化合物の塩に関する:
【0020】
【化1】

【0021】
式中
Aは*-CO-CH2CH2-、 *-CO-CH=CH-、
【0022】
【化2】

【0023】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し;
R1はC2-5アルキルを表し;
R2は、水素、メチルまたはエチルを表し;
R3は、水素、C1-4アルキル、C1-4アルコキシまたはハロゲンを表し;
R4は、水素、C1-4アルキル、C1-4アルコキシ、ハロゲン、トリフルオロメチルまたはトリフルオロメトキシを表し;
R5は、水素、ヒドロキシ-C1-5アルキル、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)n-NHSO2R51、-(CH2)nCH(OH)-CH2-NHSO2R51、-CH2-(CH2)n-NHCOR52、-(CH2)nCH(OH)-CH2-NHCOR52、-CH2-(CH2)n-CONR53R54、-CONHR53、1-(3-カルボキシ-アゼチジニル)-2-アセチル、1-(2-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-アゼチジニル)-3-プロピオニル、1-(2-カルボキシ-ピロリジニル)-3-プロピオニル、1-(3-カルボキシ-ピロリジニル)-3-プロピオニル、ヒドロキシ、C1-5アルコキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHSO2R51、-OCH2-CH(OH)-CH2-NHSO2R51、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表し;
R51は、C1-3アルキル、メチルアミノ、エチルアミノまたはジメチルアミノを表し;
R52は、ヒドロキシメチル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチルまたは2,3-ジヒドロキシプロピルを表し;
R53は、水素、C1-3アルキル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチル、2,3-ジヒドロキシプロピル、カルボキシメチル、1-(C1-5アルキルカルボキシ)メチル、2-カルボキシエチルまたは2-(C1-5アルキルカルボキシ)エチルを表し;
R54は、水素またはメチルを表し;
mは、1または2の整数を表し;
nは、0、1または2を表し;そして
R6は、水素、C1-4アルキルまたはハロゲンを表す。
【0024】
ii)本発明の特定の態様は、Aが、
【0025】
【化3】

【0026】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0027】
iii)本発明のもう一つの特定の態様は、Aが、
【0028】
【化4】

【0029】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0030】
iv)本発明のもう一つの特定の態様は、Aが、
【0031】
【化5】

【0032】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0033】
v)本発明のもう一つの特定の態様は、Aが、
【0034】
【化6】

【0035】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0036】
vi)本発明のもう一つの特定の態様は、Aが、
【0037】
【化7】

【0038】
を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0039】
vii)本発明のもう一つの特定の態様は、R1がn-プロピルまたはイソ-ブチルを表す、態様i)からvi)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0040】
viii)本発明のもう一つの特定の態様は、R2が水素またはメチルを表す、態様i)からvii)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0041】
ix)本発明の好ましい態様は、R2が水素を表す、態様i)からvii)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0042】
x)本発明のもう一つの好ましい態様は、R3がメトキシを表し、R4およびR6が水素を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0043】
xi)本発明のもう一つの好ましい態様は、R3が水素を表し、R4がメチル、エチルまたはメトキシを表し、R6がメチル、エチルまたはハロゲンを表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0044】
xii)本発明のもう一つの好ましい態様は、R3が水素を表し、R4およびR6がメチル基を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0045】
xiii)本発明の特に好ましい態様は、R3が水素を表し、R4がメチル基を表し、R6がエチル基を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0046】
xiv)本発明のもう一つの好ましい態様は、R3が水素を表し、R4がメトキシ基を表し、R6が塩素原子を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0047】
xv)本発明のもう一つの好ましい態様は、R3が水素を表し、R4がメチル基を表し、R6が塩素原子を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0048】
xvi)本発明のもう一つの好ましい態様は、R5が2,3-ジヒドロキシプロピル、-CH2-(CH2)n-NHCOR52、-(CH2)nCH(OH)-CH2-NHCOR52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表す、態様i)からxv)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0049】
xvii)本発明のもう一つの好ましい態様は、R5がヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表す、態様i)からxv)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0050】
xviii)本発明のもう一つの好ましい態様は、R5が3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表す、態様i)からxv)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0051】
xix)本発明のもう一つの好ましい態様は、R5が2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し、R52がヒドロキシメチルを表す、態様i)からxv)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0052】
xx)本発明の特に好ましい態様は、Aが、
【0053】
【化8】

【0054】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し、R1がn-プロピルまたはイソ-ブチルを表し、R2が水素を表し、R3が水素またはメトキシを表し、R4が水素、メチル、エチルまたはメトキシを表し、R5が3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し、R6が水素、メチル、エチルまたは塩素を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0055】
xxi)本発明のもう一つの特に好ましい態様は、Aが*-CO-CH2CH2-、 *-CO-CH=CH-、
【0056】
【化9】

【0057】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し;
R1がC2-5アルキルを表し;
R2およびR3が共に水素を表し;
R4がC1-4アルキルを表し;
R5がヒドロキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し;
R52がヒドロキシメチルを表し;そして
R6がC1-4アルキルを表す、
態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0058】
xxii)特に好ましい式(I)のチオフェン化合物は:
(2R)-N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(2S)-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(2R)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
(2S)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
(2R)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2-エチル-6-メチル-フェノキシ}-プロピル)-アセタミドおよび
(2S)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2-エチル-6-メチル-フェノキシ}-プロピル)-アセタミド、
並びにこれらの化合物の塩である。
【0059】
xxiii) さらに特に好ましい式(I)のチオフェン化合物は:
2-ヒドロキシ-N-((2S)-2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-((2S)-3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、および
N-((2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド
並びにこれらの化合物の塩である。
【0060】
式(I)の化合物およびこれらの薬学的に許容される塩は、医薬として、たとえば経腸または非経口投与のための医薬組成物の形態で使用することができる。
医薬組成物の製造は、いずれの当業者によく知られた様式で(たとえばMark Gibson, Editor, Pharmaceutical Preformulation and Formulation, IHS Health Group, Englewood, CO, USA, 2001; Remington, The Science and Practice of Pharmacy, 20th Edition, Philadelphia College of Pharmacy and Scienceを参照されたい)、記述された式(I)の化合物またはこれらの薬学的に許容される塩を、任意に、ガレノスの投与形態中に、適切な無毒の不活性な薬学的に許容される固体または液体の担体材料および必要に応じて、通常の薬学的アジュバントと共に、その他の治療的に有益な物質と組み合わせることによって遂行することができる。
【0061】
式(I)の化合物を含む医薬組成物は、活性化された免疫系と関連する疾患もしくは障害の予防および/または治療のために有用である。
かかる疾患または障害は、移植された臓器、組織または細胞に対する拒絶反応;移植によってもたらされる移植片対宿主病;関節リウマチを含む自己免疫性症候群;全身性エリテマトーデス;抗リン脂質抗体症候群;橋本甲状腺炎;リンパ球性甲状腺炎;多発性硬化症;重症筋無力症;I型糖尿病;ブドウ膜炎;上強膜炎;強膜炎;川崎病、ブドウ膜網膜炎;後部ブドウ膜炎;ベーチェット病関連ブドウ膜炎;ブドウ膜髄膜炎症候群;アレルギー性脳脊髄炎;慢性アレルギー性血管症;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;炎症性および過増殖性皮膚疾患;乾癬;乾癬性関節炎;アトピー性皮膚炎;ミオパシー;筋炎;骨髄炎;接触皮膚炎;湿疹性皮膚炎;脂漏性皮膚炎;扁平苔癬;天疱瘡;水疱性類天疱瘡;表皮水疱症;蕁麻疹;血管性浮腫;脈管炎;紅斑;皮膚好酸球増加;アクネ(瘡);強皮症;円形脱毛症;角結膜炎;春季カタル性結膜炎;角膜炎;ヘルペス性角膜炎;角膜上皮性ジストロフィー;角膜白斑;眼部天疱瘡;モーレン潰瘍;潰瘍性角膜炎;強膜炎;グレーブス眼症;フォークト・小柳・原田症候群;類肉腫症;花粉アレルギー;可逆性閉塞性気道疾患;気管支喘息;アレルギー喘息;内因性喘息;外因性喘息;塵埃喘息;慢性または難治性喘息;遅発性喘息および気道過敏症;細気管支炎;気管支炎;子宮内膜症;睾丸炎;胃潰瘍;虚血性腸疾患;炎症性腸疾患;壊死性腸炎;熱傷関連腸病変;セリアック病;直腸炎;好酸球性胃腸炎;肥満細胞症;クローン病;潰瘍性大腸炎;虚血性疾患および血栓症により惹起された血管損傷;アテローム性動脈硬化症;脂肪心;心筋炎;心筋梗塞;大動脈症候群;ウイルス性疾患による悪液質;血管血栓症;偏頭痛;鼻炎;湿疹;間質性腎炎;IgA誘発腎障害;グッドパスチャー症候群;溶血性尿毒症症候群;糖尿病性腎障害;糸球体硬化;糸球体腎炎;尿細管間質性腎炎;間質性膀胱炎;多発筋炎;ギラン・バレ症候群;メニエール病;多発神経炎;多発性神経炎;脊髄炎;単神経炎;神経根障害;甲状腺機能亢進症;バセドウ病;甲状腺中毒症;真性赤血球系無形成症;再生不良性貧血;低形成貧血;特発性血小板減少性紫斑病;自己免疫性溶血性貧血;自己免疫性血小板減少症;顆粒球減少;悪性貧血;巨赤芽球性貧血;赤血球形成不全;骨粗しょう症;肺線維症;特発性間質性肺炎;皮膚筋炎;尋常性白斑;尋常性魚鱗癬;光線過敏症;皮膚T細胞リンパ腫;結節性多発性動脈炎;ハンチントン舞踏病;シデナム舞踏病;心筋症;心筋炎;強皮症;ウェーゲナー肉芽腫;シェーグレン症候群;脂肪過多;好酸球性筋膜炎;歯肉、歯周靱帯、歯槽骨、セメント質の損傷・病変;若はげまたは老年性脱毛;筋ジストロフィー;膿皮症;セザリー症候群;下垂体炎;慢性副腎機能不全;アジソン病;保存時に起る臓器の虚血・再灌流損傷;エンドトキシンショック;偽膜性結腸炎;薬物または放射線による結腸炎;虚血性急性腎不全;慢性腎不全;肺癌;リンパ起源の悪性腫瘍;急性または慢性リンパ球性白血病;リンパ腫;肺気腫;白内障;鉄沈着症;網膜色素変性;老年性黄斑変性;硝子体瘢痕化;角膜アルカリ熱傷;紅斑性皮膚炎;水疱性皮膚炎;セメント皮膚炎;歯肉炎;歯周炎;敗血症;膵炎;抹消動脈疾患;発癌;固形癌腫瘍;癌転移;高山病;自己免疫肝炎;原発性胆汁性肝硬変;硬化性胆道炎;部分肝切除;急性肝壊死;肝硬変;アルコール肝硬変;肝不全;劇症肝不全;遅発性肝不全;「慢性期急性」肝不全からなる群から選ばれるものである。
【0062】
式(I)の化合物により治療および/または予防されるべき、好ましい疾患または障害は、腎臓、肝臓、心臓、肺、膵臓、角膜および皮膚等の移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、クローン病および潰瘍性大腸炎等の炎症性腸疾患、乾癬、乾癬性関節炎、橋本甲状腺炎等の甲状腺炎、ブドウ膜網膜炎を含む自己免疫症候群;鼻炎、結膜炎、皮膚炎等のアトピー性疾患;喘息;I型糖尿病;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;固形癌および腫瘍転移からなる群から選ばれるものである。
式(I)の化合物により治療および/または予防されるべき、特に好ましい疾患または障害は、腎臓、肝臓、心臓および肺から選択される移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、乾癬、乾癬性関節炎、クローン病および橋本甲状腺炎から選択される自己免疫症候群;およびアトピー性皮膚炎からなる群から選ばれるものである。
【0063】
本発明はまた、式(I)の化合物の薬学的に活性な量を患者に投与することを含む、本明細書において言及した疾患もしくは障害の予防または治療のための方法にも関する。
さらにまた、式(I)の化合物は、1つまたはいくつかの免疫調節薬と組み合わせて、本明細書において言及した疾患および障害の予防および/または治療のために有用である。本発明の好ましい態様によれば、前記薬剤は、免疫抑制薬、副腎皮質ステロイド、NSAID、細胞毒、接着分子阻害剤、サイトカイン、サイトカイン阻害剤、サイトカイン受容体アンタゴニストおよび組換えサイトカイン受容体からなる群より選択される。
【0064】
また、本発明は、任意に1つまたはいくつかの免疫調節薬と組み合わせて使用するための、本明細書において言及した疾患および障害の予防または治療のための医薬組成物の製造のための、式(I)の化合物の使用に関する。
式(I)の化合物は、以下の方法によって、実施例に示された方法によって、または類似の方法によって製造することができる。最適反応条件は、使用する具体的反応物または溶媒によって変更してもよいが、このような条件は、当業者により、ルーチンの最適化手順によって決定することができる。
【0065】
本発明の式(I)の化合物は、下記に概説した反応の一般的順序に従って製造することができる。式(I)の化合物を生じる合成の可能性のうちの少数のみを記述してある。
【0066】
【化10】

【0067】
Aが-CO-CH=CH-を表す場合には、式(I)の化合物は、構造1の化合物を、塩基または酸の存在下で、構造2の化合物と反応させることにより調製してもよい。残基R3〜R6に存在する官能基は、一時的に保護を必要としてもよく、または縮合反応に続くさらなる工程においてさらに導入してもよい。Aが-CO-CH2CH2-を表す式(I)の化合物は、Aが-CO-CH=CH-を表す式(I)の化合物を、メタノール、エタノール、THFなど、またはそれらの混合物などの溶媒中で、Pd/C、Pt/C、PtO2などの触媒の存在下で、水素と反応させることによって調製してもよい。
【0068】
【化11】

【0069】
構造1の化合物は、構造3の化合物をメチルグリニャール試薬と反応させることにより、または構造4の化合物を、ジエチルエーテル、THF等の溶媒中で、−20と50℃の間の温度で、2当量のメチルリチウムで処理することにより調製してもよい。構造3のWeinrebアミド化合物は、EDC、DCCなどのカップリング試薬の存在下において、構造4の化合物を塩酸N,O-ジメチルヒドロキシルアミンで処理することによって製造される。(M. Mentzel, H. M. R. Hoffmann, N-Methoxy N-methyl amides (Weinreb amides) in modern organic synthesis, Journal fuer Praktische Chemie/Chemiker-Zeitung 339 (1997), 517-524; J. Singh, N. Satyamurthi, I. S. Aidhen, The growing synthetic utility of Weinreb's amide, Journal fuer Praktische Chemie(Weinheim, Germany) 342 (2000) 340-347; V. K. Khlestkin, D. G. Mazhukin, Recent advances in the application of N,O-dialkylhydroxylamines in organic chemistry, Current Organic Chemistry 7(2003), 967-993)。
【0070】
【化12】

【0071】
5-チエニル-[1,2,4]オキサジアゾール誘導体を表す式(I)の化合物は、キシレン、トルエン、ベンゼン、ピリジン、DMF、ジクロロメタン、酢酸、トリフルオロ酢酸などの溶媒中で、室温または高温にて、酸(たとえば、TFA、酢酸、HCl、その他)、塩基(たとえば、NaH、NaOAc、Na2CO3、K2CO3、トリエチルアミン、その他)、テトラアルキルアンモニウム塩または水除去剤(たとえば、塩化オキサリル、カルボン酸無水物、POCl3、PCl5、P4O10、モレキュラーシーブ、メトキシカルボニルスルファモイル トリエチルアンモニウム ヒドロキシド(Burgess試薬)、その他)等の添加剤の存在下または非存在下において、構造5の化合物を反応させることによって製造される(文献: たとえば、A. R. Gangloff, J. Litvak, E. J. Shelton, D. Sperandio, V. R. Wang, K. D. Rice, Tetrahedron Lett.42 (2001), 1441-1443; T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47 (1999), 120-122; R. F. Poulain, A. L. Tartar, B. P. Deprez, Tetrahedron Lett. 42 (2001), 1495-1498; R. M. Srivastava, F. J. S. Oliveira, D. S. Machado, R. M. Souto-Maior, Synthetic Commun. 29 (1999), 1437-1450; E. O. John, J. M. Shreeve, Inorganic Chemistry27 (1988), 3100-3104; B. Kaboudin,K. Navaee, Heterocycles60 (2003), 2287-2292)。
【0072】
構造5の化合物は、DMF、THF、DCMなどの溶媒中で、TBTU、DCC、EDC、HBTU、HOBt、CDIなどの1つまたは複数のカップリング試薬の存在下または非存在下において、およびトリエチルアミン、Huenig's塩基、NaH、K2CO3などの塩基の存在下または非存在下において、構造4の化合物を構造6の化合物と反応させることによって製造してもよい(文献: たとえば、A. Hamze, J.-F. Hernandez, P. Fulcrand, J. Martinez, J. Org. Chem. 68 (2003) 7316-7321;および前述の文献)。
【0073】
【化13】

【0074】
3-チエニル-[1,2,4]オキサジアゾール誘導体を表す式(I)の化合物は、構造7の化合物を構造8の化合物と反応させ、続いて対応するヒドロキシアミジンエステル中間体の環化を行うことにより、同様の方法にて製造される。(文献: たとえば、C. T. Brain, J. M. Paul, Y. Loong, P. J. Oakley, Tetrahedron Lett. 40 (1999) 3275-3278)。
【0075】
【化14】

【0076】
構造6および7の化合物は、メタノール、エタノール、ピリジンなどの溶媒中で、Na2CO3、K2CO3、tert.ブチルカリウム、トリエチルアミンなどの塩基の存在下または非存在下において、それぞれ構造9および10の化合物をヒドロキシルアミンまたはその塩の1つと反応させることによって製造してもよい(文献: たとえば、T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47 (1999), 120-122; J. Cui, D. Crich, D. Wink, M. Lam, A. L. Rheingold, D. A. Case, W. T. Fu, Y. Zhou, M. Rao, A. J. Olson, M. E. Johnson, Bioorg. Med. Chem. 11 (2003), 3379-3392; R. Miller, F. Lang, Z. J. Song, D. Zewge, WO 2004/035538 (Merck & Co., Inc., USA); B. Kaboudin, K. Navaee, Heterocycles60 (2003), 2287-2292)。
【0077】
【化15】

【0078】
構造2、5、6、8および9の残基R3〜R6に存在する官能基の性質に応じて、これらの官能基には、一時的な保護が必要であってもよい。適切な保護基は、当業者に公知であり、たとえばアルコールを保護するためのベンジルまたはトリアルキルシリル基、ジオールを保護するためのケタールなどを含む。これらの保護基は、標準的な方法論に従って採用してもよい(たとえば、T. W. Greene, P. G. M. Wuts, Protective Groups in Organic Synthesis, 3rdEdition, Wiley New York, 1991; P. J. Kocienski, Protecting Groups, Thieme Stuttgart, 1994)。あるいは、所望の残基R3〜R6、特にR5は、それぞれ構造2、6および8の化合物の適切な前駆体を用いることにより、構造1、4および7のチオフェン化合物の、構造2、6および8のフェニル誘導体とのカップリングに続く後半の工程で導入してもよい。構造2、6、8および9のフェニル化合物またはこれらの前駆体は、商業的に入手可能であるか、または当業者に公知の手順に従って製造される。
【0079】
【化16】

【0080】
2-チエニル-[1,3,4]オキサジアゾールまたは2-チエニル-[1,3,4]チアジアゾール誘導体を表す式(I)の化合物は、構造4の化合物を(TBTU、DCC、EDC、HBTU、PyBOP、HOBt、CDIなどのカップリング試薬を用いて)ヒドラジンと反応させ、構造11の化合物を生成させることにより、同様に製造される。構造11の化合物は、構造8の化合物とカップリングされ、構造12の化合物を与える。構造12の化合物は、逆の反応順序に従うことにより、すなわち、最初に構造8の化合物をヒドラジンとカップリングさせ、続いて対応するヒドラジド中間体を構造4の化合物と反応させることにより製造することもできる。所望の2-チエニル-[1,3,4]オキサジアゾール誘導体を生成させるための構造12の化合物の脱水反応は、トルエン、アセトニトリル、ジオキサン、THFまたはCHCl3等の溶媒中で、マイクロ波照射の存在下または非存在下、20と120℃の間の温度で、構造12の化合物を、トリフェニルホスフィン、P2O5、Burgess試薬等と組み合わせてPOCl3、CCl4またはCBr4等の試薬で処理することにより行われる。(文献: たとえば、 M. A. Garcia, S. Martin-Santamaria, M. Cacho, F. Moreno de la Llave, M. Julian, A. Martinez, B. De Pascual-Teresa, A. Ramos, J. Med. Chem. 48(2005) 4068-4075; C. T. Brain, J. M. Paul, Y. Loong, P. J. Oakley, Tetrahedron Lett. 40 (1999) 3275-3278)。 同様に、 2-チエニル-[1,3,4]チアジアゾール誘導体は、構造12の化合物を、ピリジン、トルエン、THFまたはアセトニトリル等の溶媒の存在下または非存在下、マイクロ波照射下または非照射下で、任意にP2S5と組み合わせて、Lawessonの試薬にて高温で環化することにより得られる(文献: たとえば、 A. A. Kiryanov, P. Sampson, A. J. Seed, J. Org. Chem. 66 (2001) 7925-7929)。
【0081】
【化17】

【0082】
5-チエニル-オキサゾールまたは5-チエニル-チアゾール誘導体を表す式(I)の化合物は、構造13の化合物を、トルエン、ベンゼン、ジオキサンまたはTHF等の溶媒中、20と120℃の間の温度で、トリフェニルホスフィンおよびトリエチルアミン、Burgess試薬、トリフルオロ酢酸無水物等と組み合わせてPOCl3、PCl5、I2で処理するか、または上述のようにピリジン、トルエン、THFまたはアセトニトリル等の溶媒の存在下または非存在下、マイクロ波照射下または非照射下で、任意にP2S5と組み合わせて、Lawessonの試薬にて高温で処理することにより製造される(文献: たとえば、 N. Sato, T. Shibata, M. Jitsuoka, T. Ohno, T. Takahashi, T. Hirohashi, T. Kanno, H. Iwaasa, A. Kanatani, T. Fukami, Takehiro, Bioorg. & Med. Chem. Lett. 14(2004) 1761-1764)。構造13の化合物は、構造14の化合物を構造9の化合物と反応させることにより製造される。構造14のアミノケトンは、構造1の化合物から、文献(たとえば. J. L. LaMattina, J. Heterocyclic Chem. 20(1983) 533-538; M. Pesson, M. Antoine, P. Girard, J. L. Benichon, S. Chabassier, P. De Lajudie, S. Patte, F. Roquet, G. Montay, Eur. J. Med. Chem. 15 (1980) 263-268)に記載された手順により製造することができる。2-チエニル-オキサゾールまたは2-チエニル-チアゾール誘導体を表す式(I)の化合物は、構造15の化合物および構造4の化合物から同様の方法で製造される。
【0083】
【化18】

【0084】
また、チオフェンまたはフェニル環と中央の5員芳香族複素環との間の結合は、パラジウムで触媒されたクロスカップリング反応を適用することによっても形成することができる。
【0085】
【化19】

【0086】
構造4の化合物は、構造16のチオフェン-2-カルボン酸を、文献(たとえば. D. W. Knight, A. P. Nott, J. Chem. Soc. Perkin Trans. 1 1983 791-794)の手順に従ってアルキル化することにより製造することができる。構造16のチオフェン-2-カルボン酸またはこれらのメチルまたはエチルエステルは、商業的に入手可能であるか、または文献(たとえば S. Gronowitz, T. Klingstedt, L. Svensson, U. Hansson, Lipids28 (1993) 889-897)の手順に従って製造することができる。
【0087】
【化20】

【0088】
構造4の化合物は、Rがメチル、エチル、tert.ブチル等を表す構造17の化合物を、Suzukiの条件下(文献:たとえば、 F. Kerins, D. F. O'Shea, J. Org. Chem. 67 (2002) 4968-4971)で、2,4,6-トリアルケニルシクロトリボロキサンと反応させて、Rがメチル、エチル、tert.ブチル等を表し、RaおよびRbがともに、独立して水素、メチル、エチル等を表す構造18の化合物を得、それを水素化および続いてエステル開裂に付すことにより構造4の所望の化合物を供給することによっても製造することができる。構造17の化合物は、商業的に入手可能であるか、または文献の手順に従って製造することができる。
【0089】
【化21】

【0090】
R2がメチルまたはエチルを表す構造4の化合物は、構造20の化合物を得るために、Rcがエチルまたはn-プロピルを表す構造19の化合物を、DMF中、Vilsmezerの条件下で、POCl3と反応させることによっても製造することができる(文献: たとえば、 G. Alvernhe, D. Greif, B. Langlois, A. Laurent, I. Le Drean, M. Pulst, A. Selmi, M. Weissenfels, Bull. Soc. Chim. Fr. 131 (1994) 167-172)。構造20の化合物を、NaH、NaOEt、NaOMe、K tert.-ブトキシド等の塩基の存在下において、THF、ジオキサン、DMF、エタノール、メタノール等、またはこれらの混合物中で、メルカプト酢酸エステルで処理するこより、構造21の中間体が生成する。好ましくは高温における、メタノール、エタノール、THF、DMF等の溶媒またはこれらの混合物中での、NaOMe、NaOEt、KOtBu、DBU等の無水塩基を用いた塩基条件下での環化、それに続く、水、エタノール、メタノール、THF等の溶媒またはこれらの混合物中での、NaOH水溶液、LiOH水溶液、KOH水溶液などの水性塩基またはHCl水溶液、TFA等の酸によるけん化により構造4の化合物が供給される。構造20の化合物を、チオ酢酸Sシアノメチルエステルからin situで生成されるメルカプトアセトニトリルで処理することにより、構造10の化合物を供給してもよい。
【0091】
構造4の化合物を構造10の化合物に変換する方法、またはその逆を行う方法は、当業者に知られている。
【実施例】
【0092】
以下の実施例は、本発明を例証するが、これらの範囲を全く限定しない。
すべての温度は、摂氏度で述べてある。化合物は、1H-NMR(300MHz)または13C-NMR(75MHz)によって(Varian Oxford;化学シフトは、使用する溶媒と関連して、ppmで示してある;多重度:s =一重項、d =二重項、t =三重項;p =四重項、hex= 五重項、hept= 六重項、m =多重項、br =広域、結合定数は、Hzで示してある);LC-MSによって(HP 1100 Binary PumpおよびDADを備えたFinnigan Navigator、カラム:4.6×50 mm、Zorbax SB-AQ、5μm、120Å、勾配:5〜95%のアセトニトリルの水溶液、1分、0.04%のトリフルオロ酢酸を含む、流速: 4.5 mL/分)、tRは、分で示してある;TLCによって(MerckからのTLC-プレート、Silica gel 60 F254);または融点によって特徴付けてある。化合物は、調製用HPLCによって(カラム:X-terra RP18、50×19 mm、5μm、勾配:0.5%のギ酸を含む10〜95%のアセトニトリルの水溶液)またはMPLCによって(Labomatic MD-80-100ポンプ、Linear UVIS-201検出器、カラム:350×18 mm、Labogel-RP-18-5s-100、勾配:10%のメタノール水溶液〜100%のメタノール)精製される。
【0093】
略語(本明細書で使用したもの)
aq. 水溶液
BSA ウシ血清アルブミン
Bu ブチル
CC カラムクロマトグラフィー
CDI カルボニルジイミダゾール
DBU 1,8-ジアザビシクロ[5.4.0]ウンデス-7-エン(1,8-
ジアザビシクロ[5.4.0]ウンデス-7-エン)
DCC ジシクロヘキシルカルボジイミド
DCM ジクロロメタン
DIPEA ジイソプロピルエチルアミン、Hunig's塩基、エチル-ジイソプロピルアミ
ン
DME 1,2-ジメトキシエタン
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
EA 酢酸エチル
EDC N-(3-ジメチルアミノプロピル)-N'-エチル-カルボジイミド
Et エチル
EtOH エタノール
h 時間
HBTU O-(ベンゾトリアゾール-1-イル)-N,N,N',N'-テトラメチルウロニウムヘキサ
フルオロホスフェート
HOBt 1-ヒドロキシベンゾトリアゾール
HPLC 高速液体クロマトグラフィー
KOtBu カリウムt-ブトキシド
LC-MS 液体クロマトグラフィー−質量分析
LDA リチウムジイソプロピルアミド
Lit. 文献
Me メチル
min 分
MPLC 中圧液体クロマトグラフィー
NaOAc 酢酸ナトリウム
NMO N-メチル-モルホリン-N-オキシド
org. 有機
Ph フェニル
prep. 調製用
PyBOP ベンゾトリアゾール-1-イル-オキシ-トリス-ピロリジノ-ホスホニウム-ヘキ
サフルオロ-ホスファート
rt 室温
sat. 飽和
S1P スフィンゴシン1-リン酸
TBME tert.-ブチルメチルエーテル
TBTU 2-(1H-ベンゾトリアゾール-1-イル)-1,2,3,3-テトラメチルウロニウムテト
ラフルオロホウ酸塩
TFA トリフルオロ酢酸
THF テトラヒドロフラン
TLC 薄層クロマトグラフィー
tR 保持時間
5-エチル-チオフェン-2-カルボン酸
【0094】
【化22】

【0095】
チオフェンカルボン酸(4.00g、30.9mmol)のTHF(24mL)溶液を、-78℃に冷却したLDAの(32.5mL、トルエン中2M)のTHF(40mL)溶液に、攪拌下、シリンジで滴下する。ヨウ化エタン(4.87g、30.9mmol)を添加するまで、反応液の温度は-78℃に10分間維持される。混合物を-78℃で1時間攪拌した後、一晩で室温に暖める。水の添加により、反応をクエンチする。混合物を酸性化し、ジエチルエーテルで3回抽出する。有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を逆相シリカゲル上でMPLCにより精製し、表題化合物(1.10g)を褐色がかった固体として得る;LC-MS:tR = 0.80 min, 1H NMR (CDCl3):δ 1.34 (t, J = 7.3 Hz, 3 H), 2.90 (q, J = 7.6 Hz, 2 H), 6.84 (d, J = 3.5 Hz, 1 H), 7.73 (d, J = 3.8 Hz, 1 H)。
【0096】
5-n-プロピル-チオフェン-2-カルボン酸
【0097】
【化23】

【0098】
2-チオフェンカルボン酸および1-ヨウ化プロパンから、5-エチル-チオフェン-2-カルボン酸と同様に表題化合物を製造する;LC-MS:tR = 0.87 min, 1H NMR (CDCl3):δ 0.99 (t, J = 7.0 Hz, 3 H), 1.74 (hex, J = 7.3 Hz, 2 H), 2.83 (t, J = 7.6 Hz, 2 H), 6.82 (d, J = 3.5 Hz, 1 H), 7.73 (d, J = 3.8 Hz, 1 H)。
【0099】
5-n-ブチル-チオフェン-2-カルボン酸
【0100】
【化24】

【0101】
2-チオフェンカルボン酸および1-ヨウ化ブタンから、5-エチル-チオフェン-2-カルボン酸と同様に表題化合物を製造する;LC-MS:tR = 0.92 min。
【0102】
5-イソブチル-チオフェン-2-カルボン酸
【0103】
【化25】

【0104】
2-チオフェン−カルボン酸(4.16g、32.1mmol)のTHF(200mL)溶液に、tert.ブチルリチウム(49mL、1.7M ペンタン溶液、83.6mmol)を-78℃にてゆっくりと添加する。混合物を-78℃で30分攪拌した後、臭化イソブチル(22.7g、160.7mmol)を注意深く添加する。混合物を-78℃で5時間、その後、室温で16時間攪拌する。水(400mL)の添加により、反応をクエンチする。混合物を酸性化し、EAで抽出する。有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を逆相シリカゲル上でMPLCにより精製し、表題化合物(1.67g)を褐色がかった油状物質として得る;LC-MS:tR = 0.91 min, 1H NMR (CDCl3):δ0.96 (d, J = 6.7 Hz, 6 H), 1.94 (hept, J = 6.7 Hz, 1H), 2.72 (d, J = 7.0 Hz, 2 H), 6.80 (d, J = 3.8 Hz, 1 H), 7.73 (d, J = 3.8 Hz, 1 H)。
【0105】
5-(2-メチル-プロペニル)-4-メチル-チオフェン-2-カルボン酸
【0106】
【化26】

【0107】
a) 5-ブロモ-4-メチル-チオフェン-2-カルボン酸メチルエステル (3.65g、15.53mmol)のDME (30mL)溶液に、2,4,6-トリス-(2-メチル-プロペニル)-シクロトリボロキサン ((5.04g、15.53mmol) F. Kerins, D. F. O'Shea, J. Org. Chem. 67 (2002), 4968-4971)を添加し、続いて2M K2CO3水溶液(12mL)を添加する。Pd(PPh3)4(366mg、0.317mmol)を添加する前に、溶液を脱気し、アルゴン下に置く。混合物を80℃で10時間攪拌した後、室温に冷却し、ジエチルエーテル(50mL)で希釈し、飽和NaHCO3水溶液(2x30mL)で洗浄する。有機抽出物をMgSO4で乾燥し、ろ過し、濃縮して、4-メチル-5-(2-メチル-プロペニル)-チオフェン-2-カルボン酸メチルエステル(4.08g)を黄色の油状物質として得る;LC-MS:tR= 1.04 min, [M+1]+ = 211.04.
b) 4-メチル-5-(2-メチル-プロペニル)-チオフェン-2-カルボン酸メチルエステル(4.08g、19.4mmol)のメタノール溶液(33mL)を2N LiOH水溶液(10mL)で処理する。混合物を室温で2時間、その後45℃で3時間攪拌する。反応混合物をジエチルエーテルで希釈する。有機相を分離して、水で抽出する。合わせた水相を1M HCl水溶液で酸性化し、ジエチルエーテルで2回抽出する。2回目の有機抽出物を合わせて、MgSO4で乾燥し、ろ過し、濃縮して、4-メチル-5-(2-メチル-プロペニル)-チオフェン-2-カルボン酸(3.05g)を薄灰色の固体として得る;LC-MS:tR = 0.92 min, [M+1]+ = 196.98。
【0108】
1-(5-イソブチル-チオフェン-2-イル)-エタノン
【0109】
【化27】

【0110】
5-イソブチル-チオフェン-2-カルボン酸(550mg、2.99mmol)のジエチルエーテル溶液(20mL)に、メチルリチウムの溶液(3.75mL、ジエチルエーテル中1.6 M)を室温でゆっくり添加する。反応混合物を室温で1時間攪拌した後、水で注意深く2回洗浄し、MgSO4で乾燥し、ろ過し、蒸発させて、表題化合物(336mg)を黄色がかった油状物質として得る;LC-MS:tR = 0.91 min, [M+1]+= 183.07。
【0111】
4,N-ジヒドロキシ-3,5-ジメチル-ベンズアミジン
【0112】
【化28】

【0113】
表題化合物を、商業的に入手可能な4-ヒドロキシ-3,5-ジメチル-ベンゾニトリルから、文献の手順に従って製造する(たとえば E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905);1H NMR (CD3OD):δ7.20 (s, 2H), 2.20 (s, 6H)。
【0114】
4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン
【0115】
【化29】

【0116】
商業的に入手可能な4-ヒドロキシ-3,5-ジメチル-ベンゾニトリルを、イソプロパノール中、NaOHの存在下、室温にて臭化アリルでアリル化することにより、表題化合物を製造する。ニトリルは、文献の手順に従ってヒドロキシアミジンに変換される(たとえば E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905);1H NMR (CD3OD):δ7.27 (s, 2 H), 6.10 (m, 1 H), 5.42 (m, 1 H), 5.26 (m, 1 H), 4.31 (dt, J = 5.6, 1.5 Hz, 2 H), 2.29 (s, 6 H)。
【0117】
3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジン
【0118】
【化30】

【0119】
表題化合物を、商業的に入手可能な2-エチル-6-メチル-フェノールから、文献の手順に従って製造する(G. Trapani, A. Latrofa, M. Franco, C. Altomare, E. Sanna, M. Usala, G. Biggio, G. Liso, J. Med. Chem. 41 (1998) 1846-1854; A. K. Chakraborti, G. Kaur, Tetrahedron55 (1999) 13265-13268; E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905);LC-MS:tR = 0.55 min;1H NMR (D6-DMSO):δ9.25 (s br, 1H), 7.21 (s, 2H), 5.56 (s, 2H), 2.55 (q, J = 7.6 Hz, 2H), 2.15 (s, 3H), 1.10 (t, J = 7.6 Hz, 3H)。
【0120】
4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジン
【0121】
【化31】

【0122】
2-エチル-6-メチル-フェノールから、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って製造される3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒドを、アリル化することにより、表題化合物を製造する。アルデヒドは、その後、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って、対応するヒドロキシアミジンに変換される;LC-MS:tR = 0.72 min, [M+1]+ = 235.09; 1H NMR(CD3OD):δ7.31 (s, 1 H), 7.29 (s, 1 H), 6.10 (m, 1 H), 5.43 (dd, J = 17.0, 1.5 Hz, 1 H), 5.27 (dd, J = 10.3, 1.2 Hz, 1 H), 4.81 (s br, 3H), 4.31 (d, J = 5.6 Hz, 2 H), 2.67 (q, J = 7.6 Hz, 2 H), 2.30 (s, 3 H), 1.23 (t, J = 7.6 Hz, 4 H)。
【0123】
3,5-ジエチル-4,N-ジヒドロキシ-ベンズアミジン
【0124】
【化32】

【0125】
表題化合物を、商業的に入手可能な2,6-ジエチルアニリンから、文献の手順に従って製造する(G. G. Ecke, J. P. Napolitano, A. H. Filbey, A. J. Kolka, J. Org. Chem.22 (1957) 639-642;および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された文献)。
【0126】
4-アリルオキシ-N-ヒドロキシ-2-メトキシ-ベンズアミジン
【0127】
【化33】

【0128】
表題化合物を、商業的に入手可能な4-ヒドロキシ-2-メトキシ-ベンズアルデヒドから、文献の手順に従って製造する(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された参照);LC-MS:tR = 0.64 min; [M+1]+ = 223.24; 1H NMR (D6-DMSO):δ9.33 (s br, 1H), 7.30 (d, J =8.2 Hz, 1H), 6.60 (d, J = 2.3 Hz, 1H), 6.50 (dd, J = 2.3, 8.2 Hz, 1H), 6.10-5.94 (m, 1H), 5.50 (s, 2H), 5.40 (d, J = 17.0 Hz, 1H), 5.24 (d, J = 10.6 Hz, 1H), 4.57 (d, J = 4.7 Hz, 2H), 3.76 (s, 3H)。
【0129】
4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジド
【0130】
【化34】

【0131】
a) 4-ブロモ-2,6-ジメチル-フェノール(20.1g、100mmol)および塩化アリル(32.7g、428mmol)の3N NaOH水溶液(100mL)およびイソプロパノール(250mL)中の混合物を60℃で15時間攪拌した後、1N NaOH水溶液(100mL)で希釈する。混合物をジエチルエーテル(300mL、150mL)で抽出し、合わせた有機抽出物を1N NaOH水溶液(2x100mL)、1M NaH2PO4水溶液(50mL)で洗浄し、Na2SO4で乾燥し、ろ過、濃縮して、2-アリルオキシ-5-ブロモ-1,3-ジメチル-ベンゼン(23.6g)を黄色の油状物質として得る;LC-MS:tR= 1.08 min, [M+1]+ = 241.20。
【0132】
b) 2-アリルオキシ-5-ブロモ-1,3-ジメチル-ベンゼン(23.6g、98.0mmol)のTHF(150mL)溶液に、-75℃で、n-BuLiの溶液(90mL、ジエチルエーテル中1.5M)を添加する。温度を-75℃に維持する。混合物を30分攪拌した後、ダブルチップカヌーラを用いて、冷却した(0℃)炭酸ジメチル(21.4g、238mmol)のTHF(90mL)溶液中に移す。混合物を0℃で2時間攪拌した後、15時間の間に室温まで暖める。混合物の溶媒を蒸発させた後、EtOH(200mL)から再度蒸発させ、大部分の酢酸ブチル副産物を除去する。混合物を2N LiOH水溶液(150mL)およびEtOH(200mL)に溶解し、室温で2時間攪拌した後、60℃で1時間攪拌する。EtOHを蒸発させ、残った混合物を0.5N NaOH水溶液で希釈し、ジエチルエーテル(200mL)で抽出する。有機抽出物を1M NaOH水溶液(5x50mL)で洗浄し、合わせた水性洗浄相をエーテル(100mL)で再抽出する。水相を25% HCl水溶液で酸性化し、DCM (5x50mL)で抽出する。合わせた有機抽出物をNa2SO4で乾燥し、ろ過し、蒸発させ、60℃で15時間、真空下で乾燥し、4-アリルオキシ-3,5-ジメチル-安息香酸 (8.0)を黄褐色の固体として得る;LC-MS:tR = 0.90 min.。
【0133】
c) 4-アリルオキシ-3,5-ジメチル-安息香酸(5.26g、25.5mmol)のCHCl3(75mL)溶液に、チオニルクロリド(7.5mL、103mmol)を室温にて添加する。混合物を2時間還流した後、溶媒を蒸発させ、粗製4-アリルオキシ-3,5-ジメチル-安息香酸クロリドを褐色がかった油状物質として得る。酸クロリドのDCM溶液(50mL)に、DCM (250mL)中のヒドラジン(THF中の1M 溶液75mL)を0℃にて添加する。混合物を室温で15時間攪拌した後、ジエチルエーテルで希釈し、1N HCl水溶液(75mL、その後5x50mL)で抽出する。合わせた水性抽出物を、33% KOH水溶液を添加することにより塩基性化し、DCM (5x50mL)で抽出する。合わせたDCM抽出物をNa2SO4で乾燥し、ろ過し、蒸発させて、4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジド(5.39g)を白色の固体として得る;LC-MS;tR= 0.71 min; [M+1]+ = 221.20; 1H NMR (D6-DMSO):δ2.22 (s, 6 H), 4.28-4.37 (m, 2 H), 4.39 (s, 2 H), 5.19-5.28 (m, 1 H), 5.36-5.47 (m, 1 H), 6.00-6.15 (m, 1 H), 7.49 (s, 2 H), 9.55 (s, 1 H)。
【0134】
4-ベンジルオキシ-3,5-ジメチル-安息香酸ヒドラジド
【0135】
【化35】

【0136】
4-ベンジルオキシ-3,5-ジメチル安息香酸から、4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジドと同様に、4-ベンジルオキシ-3,5-ジメチル-安息香酸ヒドラジドを製造する;LC-MS:tR= 0.81 min; [M+1]+ = 271.41。
【0137】
4-ベンジルオキシ-3-エチル-5-メチル-安息香酸ヒドラジド
【0138】
【化36】

【0139】
a) 3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒド(34.9g、0.213mol、2-エチル-6-メチル-phenolから、3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された文献に従って製造される。)のアセトニトリル溶液(350mL)に、K2CO3(58.7g、0.425mol)および臭化ベンジル(36.4g、0.213mol)を添加する。混合物を60℃で2時間攪拌した後、室温に冷却し、水で希釈し、EAで2回抽出する。有機抽出物を水で洗浄し、濃縮して、粗製4-ベンジルオキシ-3-エチル-5-メチル-ベンズアルデヒド(45g)を、オレンジ色の油状物質として得る;1H NMR (CDCl3):δ1.29 (t, J= 7.5 Hz, 3 H), 2.40 (s, 3 H), 2.77 (q, J= 7.8 Hz, 2 H), 4.90 (s, 2 H), 7.31-7.52 (m, 5 H), 7.62 (d, J = 1.5 Hz, 1 H), 7.66 (d, J = 1.8 Hz, 1 H), 9.94 (s, 1 H)。
【0140】
b) 4-ベンジルオキシ-3-エチル-5-メチル-ベンズアルデヒド(132g、0.519mol)および2-メチル-2-ブテン(364g、5.19mol)のtert.-ブタノール(1500mL)中の混合物に、NaH2PO4二水和物(249g、2.08mol)の水溶液(1500mL)を添加する。この混合物に、NaClO2(187.8g、2.08mol)を分けて添加する。混合物の温度を30℃未満に保ち、ガスの発生が観察される。添加が完了するやいなや、オレンジ色の二相混合物を3時間よく攪拌し、その後TBME(1500mL)で希釈する。有機相を分離し、20% NaHS水溶液(1500mL)および水(500mL)で洗浄する。その後、有機相を0.5N NaOH水溶液(1000mL)で3回洗浄し、水相を25% HCl水溶液(500mL)で酸性化し、TBME(1000mL)で2回抽出する。これらの有機抽出物を合わせ、乾燥するまで蒸発させ、4-ベンジルオキシ-3-エチル-5-メチル-安息香酸を得る;1H NMR (D6-DMSO):δ1.17 (t, J = 7.5 Hz, 3 H), 2.31 (s, 3 H), 2.67 (q, J = 7.5 Hz, 2 H), 4.86 (s, 2 H), 7.34-7.53 (m, 5 H), 7.68 (s, 2 H), 12.70 (s, 1 H)。
【0141】
c) 4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジドの製造のステップc)に従って、4-ベンジルオキシ-3-エチル-5-メチル-安息香酸を4-ベンジルオキシ-3-エチル-5-メチル-安息香酸ヒドラジドに変換する;LC-MS:tR= 0.82 min、[M+1]+ = 285.44。
メタンスルホン酸2,2-ジメチル-[1,3]ジオキサン-5-イルメチルエステル
【0142】
【化37】

【0143】
表題化合物をB. Xu, A. Stephens, G. Kirschenheuter, A. F. Greslin, X. Cheng, J. Sennelo, M. Cattaneo, M. L. Zighetti, A. Chen, S.-A. Kim, H. S. Kim, N. Bischofberger, G. Cook, K. A. Jacobson, J. Med. Chem. 45 (2002) 5694-5709に記載された手順に従って製造する。
【0144】
実施例1
【0145】
【化38】

【0146】
a) 5-エチル-チオフェン-2-カルボン酸(502mg、3.21mmol)およびDIPEA(1.04g、8.03mmol)のDCM溶液(16mL)に、TBTU(1.13g、3.53mmol)を0℃にて添加する。混合物を0℃で1時間攪拌した後、水(2mL)で反応をクエンチする。DCMを蒸発させ、残渣をEAで希釈し、飽和NaHCO3水溶液および水で洗浄し、MgSO4で乾燥し、ろ過し、蒸発させる。粗生成物をアセトニトリルからの結晶化により精製し、5-エチル-チオフェン-2-カルボン酸 (4,N-ジヒドロキシ-3,5-ジメチル-ベンズアミジン) エステル(600mg)を白色固体として得た;LC-MS:tR= 0.94 min, [M+1]+ = 319.02。
【0147】
b) 5-エチル-チオフェン-2-カルボン酸(4,N-ジヒドロキシ-3,5-ジメチル-ベンズアミジン)エステル(600mg、1.88mmol)のジオキサン溶液(40mL)を100℃で18時間攪拌する。溶媒を蒸発させ、残渣をヘプタン:EA、4:1で溶出するシリカゲル上のCCにより分離して、4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノール(525mg)を薄黄色の油状物質として得る;LC-MS:tR= 1.09 min, [M+1]+ = 301.11。
【0148】
実施例2
【0149】
【化39】

【0150】
実施例1と同様に2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノールを製造する;LC-MS:tR= 1.10 min, [M+1]+ = 315.35。
【0151】
実施例3
【0152】
【化40】

【0153】
実施例1と同様に4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノールを製造する;LC-M:tR= 1.15 min, [M+1]+ = 329.15。
【0154】
実施例4
【0155】
【化41】

【0156】
実施例1と同様に4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノールを製造する;LC-MS:tR= 1.15 min, [M+1]+ = 329.09。
【0157】
実施例5
【0158】
【化42】

【0159】
4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノール(79mg、0.263mmol)のイソプロパノール(3mL)および3N NaOH水溶液(0.6mL)の溶液に、(R)-3-クロロ-プロパン-1,2-ジオール(148mg、1.31mmol)を添加する。混合物を室温で2時間、さらに65℃で16時間攪拌した後、別量の(R)-3-クロロ-プロパン-1,2-ジオール(119mg、1.05mmol)を添加する。攪拌を65℃で24時間継続する。反応混合物を水で希釈し、ジエチルエーテルで抽出する。有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を調製用TLCプレート上のクロマトグラフィーにより、7N NH3 メタノール溶液を4%含むDCMで精製し、(2R)-3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを薄灰色の固体として得る;LC-MS:tR= 0.99 min;[M+1]+ = 375.13;1H NMR (CDCl3):δ7.83 (s, 2H), 7.80 (d, J = 3.8 Hz, 1H), 6.93 (d, J = 3.8 Hz, 1H), 4.20-4.11 (m, 1H), 3.97-3.93 (m, 1H), 3.91 (dd, J = 11.5, 4.3 Hz, 1H), 3.85 (dd, J = 11.5, 5.5 Hz, 1H), 2.97 (q, J = 7.5 Hz, 2 H), 2.39 (s, 6 H), 1.41 (t, J = 7.5 Hz, 3H)。
【0160】
実施例6〜12
【0161】
【化43】

【0162】
以下の実施例は、(R)-または(S)-3-クロロ-プロパン-1,2-ジオールを用いて、表示された実施例から、実施例5と同様に製造される:
【0163】
【表1】

【0164】
実施例12
1H NMR(CDCl3):δ0.98 (d, J = 6.4 Hz, 6 H), 1.96 (hept, J = 6.5 Hz, 1H), 2.35 (s, 6 H), 2.76 (d, J= 7.0 Hz, 2 H), 3.76-3.94 (m, 4 H), 4.09-4.18 (m, 1 H), 6.86 (d, J = 3.5 Hz, 1 H), 7.77 (d, J = 3.5 Hz, 1 H), 7.80 (s, 2 H)。
【0165】
実施例13
【0166】
【化44】

【0167】
a) 4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノール(367mg、1.22mmol)およびエピクロロヒドリン(565mg、6.10mmol)のイソプロパノール(20mL)および3N NaOH水溶液(6mL)中の混合物を40℃で15時間攪拌する。混合物をジエチルエーテルで希釈し、飽和NaHCO3水溶液および水で洗浄し、MgSO4で乾燥し、ろ過し、蒸発させた。粗生成物をヘプタン:EA、9:1で溶出するシリカゲル上のCCにより精製し、3-(3,5-ジメチル-4-オキシラニルメトキシ-フェニル)-5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール(123 mg)を薄黄色の油状物質として得る;LC-MS: tR = 1.15 min, [M+1]+= 357.11。
【0168】
b) 3-(3,5-ジメチル-4-オキシラニルメトキシ-フェニル)-5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール(123mg、0.345mmol)の7N NH3 メタノール溶液(10mL)を45℃で16時間攪拌する。溶媒を蒸発させ、残渣を調製用TLCプレート上のクロマトグラフィーにより、7N NH3 メタノール溶液を6%含むDCMで精製し、1-アミノ-3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(35mg)を白色の固体として得る;LC-MS:tR= 0.84 min, [M+1]+ = 374.14。
【0169】
c) 1-アミノ-3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(32mg、86μmol)の冷(0℃)DCM溶液(1mL)に、DIPEA(45mg、345μmol)、グリコール酸(13mg、172μmol)および最後にTBTU(33mg、101μmol)を添加する。混合物を室温で1時間攪拌した後、EAで希釈し、水で洗浄する。水相をEAで抽出する。合わせた有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物をアセトニトリルからの結晶化により精製し、N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド(7mg)を白色の固体として得る;LC-MS:tR= 0.95 min, [M+1]+ = 432.16。
【0170】
実施例14〜16
【0171】
【化45】

【0172】
以下の実施例は、表示された実施例から、実施例13と同様に製造される:
【0173】
【表2】

【0174】
実施例15
1H NMR(D6-DMSO):δ0.93 (t, J = 7.3 Hz, 3 H), 1.33-1.44 (m, 2 H), 1.63-1.72 (m, 2 H), 2.33 (s, 6 H), 2.93 (t, J = 7.5 Hz, 2 H), 3.20-3.30 (m, 1 H), 3.37-3.48 (m, 1 H), 3.69-3.80 (m, 2 H), 3.84 (d, J= 5.8 Hz, 2 H), 3.91-3.99 (m, 1 H), 5.30 (d, J = 5.3 Hz, 1 H), 5.56 (t, J = 5.8 Hz, 1 H), 7.12 (d, J = 3.8 Hz, 1 H), 7.69 (t, J = 6.0 Hz, 1 H), 7.72 (s, 2 H), 7.90 (d, J = 3.5 Hz, 1 H)。
【0175】
実施例16
1H NMR (D6-DMSO):δ0.92 (d, J = 6.4 Hz, 5 H), 1.83-2.00 (m, 1 H), 2.30 (s, 6 H), 2.78 (d, J = 7.0 Hz, 2 H), 3.14-3.27 (m, 2 H), 3.36-3.48 (m, 2 H), 3.65-3.78 (m, 2 H), 3.81 (d, J = 5.6 Hz, 2 H), 3.87-3.99 (m, 1 H), 5.26 (d, J = 5.0 Hz, 1 H), 5.52 (t, J = 5.6 Hz, 1 H), 7.07 (d, J = 3.5 Hz, 1 H), 7.66 (m, 3 H), 7.89 (d, J = 3.5 Hz, 1 H)。
【0176】
実施例17
【0177】
【化46】

【0178】
実施例2から、そして(R)-2-クロロメチル-オキシランをアルキル化試薬として用いて、(2R)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例13と同様に製造する;LC-MS:tR = 0.98 min, [M+1]+= 446.20。
【0179】
実施例18
【0180】
【化47】

【0181】
実施例2から、そして(S)-2-chloroメチル-オキシランをアルキル化試薬として用いて、(2S)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例13と同様に製造する;LC-MS:tR = 0.98 min, [M+1]+= 446.19, 1H NMR (CDCl3):δ1.04 (t, J = 7.3 Hz, 3 H), 1.72-1.84 (m, 2 H), 2.36 (s, 6 H), 2.89 (t, J = 7.5 Hz, 2 H), 3.19 (s br, 1H), 3.47-3.56 (m, 1 H), 3.60 (s br, 1 H), 3.73-3.92 (m, 3 H), 4.18 (s, 2 H), 6.90 (d, J = 3.8 Hz, 1 H), 7.12 (t, J = 5.8 Hz, 1 H), 7.78 (d, J = 3.8 Hz, 1 H), 7.80 (s, 2 H)。
【0182】
実施例19
【0183】
【化48】

【0184】
3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを用いて、2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノールを、実施例1と同様に製造する;LC-MS:tR = 1.16 min, [M+1]+= 343.02。
【0185】
実施例20
【0186】
【化49】

【0187】
実施例19から、N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例13と同様に製造する;LC-MS:tR = 1.01 min;1H NMR (CDCl3):δ0.99 (d, J = 6.7 Hz, 3 H), 1.29 (t, J = 7.6 Hz, 3 H), 1.90-2.05 (m, 1 H), 2.35 (s, 3 H), 2.57 (s br, 1H), 2.67-2.80 (m, 4 H), 3.23 (s br, 1H), 3.44-3.56 (m, 1 H), 3.72-3.92 (m, 3 H), 4.14-4.22 (m, 3H), 6.87 (d, J = 3.5 Hz, 1 H), 6.97 (t br, 1 H), 7.78 (d, J = 3.8 Hz, 1 H), 7.82 (s, 1H), 7.84 (s, 1H)。
【0188】
実施例21
【0189】
【化50】

【0190】
a) 5-イソブチル-チオフェン-2-カルボン酸(830mg、4.51mmol)およびDIPEA(680mg、5.27mmol)のDCM溶液(20mL)に、室温でTBTU(1.59g、4.96mmol)を添加する。混合物を室温で45分攪拌した後、4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジド(993mg、4.50mmol)を添加する。攪拌を2時間継続する。混合物をエーテル(200mL)で希釈し、1M HCl水溶液(3x50mL)、1M NaOH水溶液(3x50 mL)および食塩水(50mL)で洗浄する。有機抽出物をMgSO4で乾燥し、ろ過し、蒸発して、粗製4-アリルオキシ-3,5-ジメチル-安息香酸N'-(5-イソブチル-チオフェン-2-カルボニル)-ヒドラジド(1.40g)を、ゆっくりと固体化する黄色の油状物質として得る;LC-MS:tR = 1.02 min, [M+1]+= 387.10。
【0191】
b) 4-アリルオキシ-3,5-ジメチル-安息香酸 N'-(5-イソブチル-チオフェン-2-カルボニル)-ヒドラジド(1.40g、3.62mmol)およびBurgess試薬(1.12g、4.71mmol)のTHF溶液(15mL)を、110℃で3分、マイクロ波照射下で攪拌する。混合物をジエチルエーテルで希釈し、水で洗浄し、MgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を、ヘプタン:EA、9:1で溶出するシリカゲル上のCCにより精製し、2-(4-アリルオキシ-3,5-ジメチル-フェニル)-5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール(1.02g)を、無色の油状物質として得る;LC-MS:tR = 1.21 min, [M+1]+ = 369.15。
【0192】
c) 2-(4-アリルオキシ-3,5-ジメチル-フェニル)-5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール (1.02g、2.77mmol)のアセトン(24mL)および水(2.4mL)の溶液に、NMO(1.85g、13.7mmol)およびOsO4(128mg、13μmol、2.5%のブタノール溶液として)を、室温で添加する。混合物を室温で16時間攪拌した後、水(50mL)で希釈し、EA(2x100mL)で抽出する。合わせた有機抽出物をNa2SO4で乾燥し、ろ過し、蒸発させる。粗生成物をEAで溶出するシリカゲル上のCCにより精製し、3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール (680mg)を、無色の油状物質として得る;LC-MS:tR = 0.99 min, [M+1]+= 403.14。
【0193】
実施例22
【0194】
【化51】

【0195】
a) 3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール(627mg、1.56mmol)およびDIPEA(311mg、2.41mmol)のDCM溶液(10mL)に、メタンスルホン酸クロライド(207mg、1.81mmol)を添加する。混合物を室温で攪拌した後、別量のDIPEA(40mg、0.31mmol)およびメタンスルホン酸クロライド(36mg、0.31mmol)を添加する。攪拌を1時間継続した後、水の添加により反応をクエンチする。混合物をDCMで抽出する。有機抽出物を水で洗浄し、MgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を、ヘプタン:EA、7:3で溶出するシリカゲル上のCCにより精製し、メタンスルホン酸 2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル エステル(220mg)を、無色の油状物質として得る;LC-MS:tR = 1.08 min, [M+1]+= 481.09。
【0196】
b) メタンスルホン酸 2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル エステル(220mg、0.458mmol)のTHF(10mL)およびメタノール中7N NH3溶液(10mL)を65℃で15時間攪拌する。溶媒を蒸発させ、残渣を調製用TLCプレート上のクロマトグラフィーにより、7N NH3 メタノール溶液を6%含むDCMで精製し、1-アミノ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(110mg)を、黄色の油状物質として得る;LC-MS:tR = 0.83 min, [M+1]+= 402.48。
【0197】
c) 1-アミノ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(109mg、271μmol)のDCM溶液(10mL)に、0℃にて、DIPEA(140mg、1.086mmol)およびグリコール酸(41mg、543μmol)を添加した後、TBTU(102mg,、319μmol)を添加する。混合物を室温で1時間攪拌した後、EAで希釈し、水で洗浄する。水相を分離し、もう一度EAで抽出する。合わせた有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を調製用TLCプレート上のクロマトグラフィーにより、7N NH3 メタノール溶液を4%含むDCMで精製し、2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド(31mg)を、白色の固体として得る;LC-MS:tR = 0.94 min, [M+1]+= 460.51。
【0198】
実施例23
【0199】
【化52】

【0200】
1-(5-イソブチル-チオフェン-2-イル)-エタノン(336mg、1.84mmol)および3,5-ジメチル-4-ヒドロキシ-ベンズアルデヒド(277mg、1.84mmol)のEtOH溶液(6mL)に、5N HCl、イソプロパノール溶液(2.5mL)を添加する。暗色の溶液を室温で6時間攪拌した後、溶媒を真空下で除去する。残渣をEA(80mL)中に溶解し、飽和NaHCO3水溶液(25mL)および食塩水で洗浄する。洗浄物をEAで抽出する。合わせた有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させて、3-(4-ヒドロキシ-3,5-ジメチル-フェニル)-1-(5-イソブチル-チオフェン-2-イル)-プロペノン(682mg)を、黄色粉末として得る;LC-MS:tR = 1.10 min, [M+1]+ = 315.15。
【0201】
実施例24
【0202】
【化53】

【0203】
3-(4-ヒドロキシ-3,5-ジメチル-フェニル)-1-(5-イソブチル-チオフェン-2-イル)-プロペノン(660mg)のTHF(10mL)およびEtOH(5mL)溶液に、Pd/C(150mg、10%Pd)を添加し、懸濁液を、5barのH2下、室温で23時間攪拌する。別量のPd/C(150mg)を添加し、攪拌を、5barのH2下、室温で8時間継続する。触媒をろ過除去し、濾液を蒸発させ、3-(4-ヒドロキシ-3,5-ジメチル-フェニル)-1-(5-イソブチル-チオフェン-2-イル)-プロパン-1-オン(554mg)を、オレンジ色の油状物質として得る;LC-MS:tR = 1.10 min, [M+1]+= 317.04。
【0204】
実施例25
【0205】
【化54】

【0206】
実施例24から、実施例13と同様に、2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[3-(5-イソブチル-チオフェン-2-イル)-3-oxo-プロピル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを製造する;LC-MS:tR= 0.97 min, [M+1]+ = 448.21。
【0207】
実施例26
【0208】
【化55】

【0209】
5-プロピル-チオフェン-2-カルボン酸および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンから、実施例1と同様に、2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノールを製造する;LC-MS:tR = 1.12 min, [M+1]+ = 329.14。
【0210】
実施例27
【0211】
【化56】

【0212】
実施例26から、実施例13と同様に、(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR=0.95 min, [M+1]+ = 460.15。
【0213】
実施例28
【0214】
【化57】

【0215】
実施例26から、実施例13と同様に、(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.95 min, [M+1]+ = 460.13。
【0216】
実施例29
【0217】
【化58】

【0218】
5-イソブチル-チオフェン-2-カルボン酸を4-ベンジルオキシ-3,5-ジメチル-安息香酸 ヒドラジドとカップリングおよび環化することにより、実施例21のステップa)およびb)と同様に、2-(4-ベンジルオキシ-3,5-ジメチル-フェニル)-5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾールを製造する、LC-MS:tR = 1.06 min, [M+1]+= 437.17。この化合物(2.83g、6.75mmol)のEtOH(50mL)およびTHF(50mL)溶液に、Pd/C(10%Pd、400mg)を添加し、スラリーを、5barのH2の下、室温で48時間攪拌する。混合物をろ過し、濾液を濃縮して、粗生成物をヘプタン:EA、8:25で溶出するシリカゲル上のCCにより精製し、4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノール(943mg)を、白色粉末として得る;LC-MS:tR = 1.09 min, [M+1]+ = 329.36。
【0219】
実施例30
【0220】
【化59】

【0221】
4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノールから、2-ヒドロキシ-N-((2R)-2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを、実施例13と同様に製造する;LC-MS:tR= 0.95min, [M+1]+ = 460.18。
【0222】
実施例31
【0223】
【化60】

【0224】
4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノールから、実施例13と同様に、2-ヒドロキシ-N-((2S)-2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを製造する;LC-MS:tR= 0.95min, [M+1]+ = 460.18, 1H NMR δ0.99 (d, J= 6.5 Hz, 6 H), 1.90-2.01 (m, 1 H), 2.31 (s, 6 H), 2.75 (d, J = 7.0 Hz, 2 H), 3.46-3.54 (m, 1 H), 3.73-3.91 (m, 3 H), 4.15-4.23 (m, 3 H), 4.26 (s br, 1 H), 4.45 (s br, 1 H), 6.84 (d, J = 3.3 Hz, 1 H), 7.42 (t br, J = 5.5 Hz, 1 H), 7.64 (d, J = 3.5 Hz, 1 H), 7.68 (s, 2 H)。
【0225】
実施例32
【0226】
【化61】

【0227】
4-ベンジルオキシ-3-エチル-5-メチル-安息香酸 ヒドラジドおよび5-プロピル-チオフェン-2-カルボン酸から、実施例29と同様に、2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノールを製造する;LC-MS:tR= 0.99min, [M+1]+ = 329.13。
【0228】
実施例33
【0229】
【化62】

【0230】
実施例32から、実施例13と同様に、N-((2R)-3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.85min, [M+1]+ = 460.08。
【0231】
実施例34
【0232】
【化63】

【0233】
実施例32から、実施例13と同様に、N-((2S)-3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.85min, [M+1]+ = 460.08。
【0234】
実施例35
【0235】
【化64】

【0236】
5-イソブチル-チオフェン-2-カルボン酸および4-ベンジルオキシ-3-エチル-5-メチル-安息香酸 ヒドラジドから、実施例29と同様に、2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノールを製造する;LC-MS:tR= 1.03min, [M+1]+ = 343.22。
【0237】
実施例36
【0238】
【化65】

【0239】
実施例35から、実施例13と同様に、N-((2R)-3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.91min, [M+1]+ = 474.18。
【0240】
実施例37
【0241】
【化66】

【0242】
実施例35から、実施例13と同様に、N-((2S)-3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.91min, [M+1]+ = 474.17。
【0243】
実施例38
【0244】
【化67】

【0245】
4-メチル-5-(2-メチル-プロペニル)-チオフェン-2-カルボン酸および4-ベンジルオキシ-3-エチル-5-メチル-安息香酸 ヒドラジドから、実施例29と同様に、2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノールを製造する;LC-MS:tR = 1.13 min, [M+1]+= 357.49。
【0246】
実施例39
【0247】
【化68】

【0248】
実施例38から、実施例5と同様に、(2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、白色の固体として得る;LC-MS:tR= 1.05min;[M+1]+ = 431.13;1H NMR (CDCl3):δ1.01 (d, J = 6.8 Hz, 6 H), 1.31 (t, J = 7.5 Hz, 3 H), 1.91-2.02 (m, 1 H), 2.22 (s, 3 H), 2.39 (s, 3 H), 2.68 (d, J= 7.0 Hz, 2 H), 2.75 (q, J = 7.3 Hz, 2 H), 3.82-3.97 (m, 4 H), 4.14-4.22 (m, 1 H), 7.55 (s, 1 H), 7.78 (s, 1 H), 7.80 (s, 1 H)。
【0249】
実施例40
【0250】
【化69】

【0251】
実施例38から、実施例5と同様に、(2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、白色の固体として得る;LC-MS:tR= 1.05min, [M+1]+ = 431.14。
実施例41
【0252】
【化70】

【0253】
実施例38から、実施例13と同様に、N-((2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 1.00min, [M+1]+ = 488.19。
【0254】
実施例42
【0255】
【化71】

【0256】
実施例38から、実施例13と同様に、N-((2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 1.00min;[M+1]+ = 488.17; 1H NMR δ1.00 (d, J= 6.5 Hz, 6 H), 1.27 (t, J = 7.5 Hz, 3 H), 1.90-2.01 (m, 1 H), 2.21 (s, 3 H), 2.34 (s, 3 H), 2.67 (d, J = 7.3 Hz, 2 H), 2.71 (q, J = 7.5 Hz, 2H), 3.46-3.56 (m, 1 H), 3.75-3.91 (m, 3 H), 4.08 (s br, 2 H), 4.20 (s, 3 H), 7.33 (t br, J = 5.5 Hz, 1 H), 7.54 (s, 1 H), 7.72 (s, 1 H), 7.74 (s, 1 H)。
【0257】
実施例43:EC50値を決定するためのGTPγS結合アッセイ法
GTPγS結合アッセイ法は、96ウェルマイクロタイタープレート(Nunc, 442587)で、組換えヒトS1P1受容体を発現するCHO細胞の膜標品を用いて200μlの最終体積で行った。アッセイ条件は、20mM Hepes(Fluka, 54461)、100mM NaCl(Fluka, 71378)、5mM MgCl2(Fluka, 63064)、0.1%のBSA(Calbiochem, 126609)、1μM GDP(Sigma, G-7127)、2.5%のDMSO(Fluka, 41644)、50pMの35S-GTPγS(Amersham Biosciences, SJ1320)である。pHは、7.4である。試験化合物を溶解して、100%のDMSOに希釈し、35S-GTPγSの非存在下で150μlの上記アッセイ緩衝液中で室温にて30分間プレインキュベートする。50μlの、35S-GTPγSの添加後、アッセイを室温にて1時間インキュベートする。アッセイをPackard Biosciencesからのセル‐ハーベスターを使用して反応混合物をMultiscreenプレート(Millipore, MAHFC1H60)に移すことによって終結させて、プレートを氷冷10mM Na2HPO4/NaH2PO4(70%/30%)で洗浄して、乾燥させ、底面を封着して、25μlのMicroScint20(Packard Biosciences, order no. 6013621)を添加後に、上部を封着する。膜結合型の35S-GTPγSをPackard BiosciencesからのTopCountで測定する。
EC50は、最大の特異的35S-GTPγS結合の50%を誘導するアゴニストの濃度である。特異的結合は、非特異的結合を最大結合から減算することによって決定する。最大結合は、10μMのS1Pの存在下においてMultiscreenプレートに結合したcpmの量である。非特異的結合は、アッセイにおけるアゴニストの非存在下での結合の量である。
【0258】
表1は、本実施例のいくつかの化合物のEC50値を示す。EC50値は、上記方法に従って決定した。
表1:
【0259】
【表3】

【0260】
実施例44:インビボでの有効性の評価
式(I)の化合物の有効性は、正常圧の雄ウィスターラットに対する3〜30mg/kgの式(I)の化合物の経口投与後に、循環リンパ球を測定することによって評価する。動物は、12時間-光/暗闇サイクルで気候制御条件に収容して、通常のラット固形飼料および飲料水の自由な摂取をさせた。血液は、薬物投与前、並びに後の3、6および24時間に収集する。全血をAdvia Hematologyシステム(Bayer Diagnostics, Zurich, Switzerland)を使用する血液検査に供する。
【0261】
すべてのデータは、平均±SEMとして示してある。統計分析は、多重比較のためにStatistica(StatSoft)およびStudent-Newman-Keuls法を使用して分散分析(分散分析)によって行う。帰無仮説は、p<0.05のときに拒絶する。
一例として、表2には、媒体だけで処理した一群の動物と比較して、正常圧の雄ウィスターラットに対する本発明の化合物の10mg/kgの経口投与の6時間後におけるリンパ球カウントに対する効果を示す。
【0262】
表2:
【0263】
【表4】

【技術分野】
【0001】
本発明は、式(I)のS1P1/EDG1受容体アゴニストおよび医薬組成物の製造における活性成分としてのこれらの使用に関する。また、本発明は、化合物の製造のための方法、式(I)の化合物を含む医薬組成物、並びに血管機能を改善する化合物としての、および免疫調節薬としての、単独またはその他の活性化合物もしくは療法と組み合わせたこれらの使用を含む関連した側面に関する。
【背景技術】
【0002】
ヒト免疫系は、感染または疾患を生じさせる外来微生物および物質から体を守るようにデザインされている。複雑な調節機構が、免疫応答が侵入する物質または生物体を標的とし、宿主を標的としないことを保証する。場合によっては、これらの制御メカニズムが制御されず、自己免疫応答を発症し得る。炎症反応が制御されない結果として、重篤な器官、細胞、組織または関節の損傷が生じる。また、現在の治療では、通常、全免疫系が抑制されて、体が感染に応答する能力が大きく損なわれてしまう。この種の典型的な薬物には、アザチオプリン、クロランブシル、シクロホスファミド、シクロスポリンまたはメトトレキセートを含む。炎症を減少させて、免疫応答を抑制する副腎皮質ステロイドは、長期治療に使用されると、副作用の原因となることがある。非ステロイド性抗炎症薬(NSAID)は、疼痛および炎症を減少させることができるが、しかし、これらは、かなりの副作用を示す。代わりの治療には、サイトカインシグナリングを活性化し、または遮断する薬剤を含む。
【0003】
免疫調節特性をもち、免疫応答を損なうことなく、そして副作用が減少された、経口で有効な化合物は、制御されない炎症性疾患の現在の治療を大幅に向上させるであろう。
臓器移植の分野では、器官拒絶反応を防止するために宿主免疫応答を抑制しなければならない。臓器移植レシピエントは、彼らが免疫抑制剤を服用するときでも、いくらか拒絶反応を受けることがある。拒絶反応は、移植後の最初の数週に最も頻繁に生じるが、拒絶反応の発症は、移植の何月もまたは何年後でさえも生じ得る。副作用を最小にすると共に、拒絶反応から最大限保護するために、3つまたは4つまでの薬物療法の組み合わせが一般に使用されている。移植臓器の拒絶反応を治療するために使用される現在の標準薬は、T型またはB型白血球の活性化における別々の細胞内経路を妨げる。このような薬物の例には、サイトカイン放出またはシグナリングを妨げるシクロスポリン、ダクリズマブ、バシリキシマブ、エベロリムスもしくはFK506;ヌクレオチド合成を阻害するアザチオプリンもしくはレフルノミド;または白血球分化の阻害剤である15-デオキシスペルグアリンがある。
【0004】
広範な免疫抑制療法による有益な効果は、これらの効果に関連するが;しかし、これらの薬物により生じる全身的免疫抑制は、感染および悪性腫瘍に対する免疫系の防御を減弱させる。さらにまた、標準的な免疫抑制剤は、高投薬量で使用されることが多く、器官損傷を引き起こし、または促進し得る。
【発明の開示】
【0005】
本発明は、Gタンパク質結合受容体S1P1/EDG1のアゴニストであり、かつ循環および浸潤するTおよびBリンパ球の数を減少させることによりこれらの成熟、記憶または増殖に影響を及ぼさずに達成される強力かつ持続性の免疫抑制効果を有する式(I)の新規化合物を提供する。S1P1/EDG1アゴニズムの結果としての循環T/Bリンパ球の減少により、おそらくS1P1/EDG1活性化と関連した内皮細胞層機能の改善が観察されることと合わせて、このような化合物が、抑制されていない炎症性疾患を治療するために、および血管機能性を改善するために有用となる。
【0006】
本発明の化合物は、単独で、またはT細胞活性化を阻害する標準薬と組み合わせて、標準的な免疫抑制療法と比較したときに感染の性向が減少した新たな免疫抑制療法を提供するために利用することができる。さらにまた、本発明の化合物は、投薬量を減少した従来の免疫抑制性療法と組み合わせて、一方では有効な免疫抑制活性を、一方では高用量の標準的な免疫抑制剤に付随した末端器官損傷の減少を提供するために使用することができる。S1P1/EDG1活性化と関連した内皮細胞層機能の改善の観察は、血管機能を改善するための化合物のさらなる利点をもたらす。
【0007】
ヒトS1P1/EDG1受容体のためのヌクレオチド配列およびアミノ酸配列は、当技術分野において公知であり、たとえばHla, T., and Maciag, T. J. Biol Chem. 265(1990), 9308-9313;1991年10月17日に公開された国際公開公報第91/15583号;1999年9月16日に公開された国際公開公報第99/46277号に発表されている(非特許文献1、特許文献1および2)。式(I)の化合物の能力および有効性は、EC50値を決定するためのGTPγSアッセイ法を使用して、および経口投与後のラットにおける循環リンパ球を測定することによって、それぞれ評価される(実施例を参照されたい)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際公開公報第91/15583号
【特許文献2】国際公開公報第99/46277号
【非特許文献】
【0009】
【非特許文献1】Hla, T., and Maciag, T. J. Biol Chem. 265(1990) 上記及び下記において使用される一般的用語は、本開示の範囲内において、特に示さない限り、好ましくは以下の意味を有する。化合物、塩、医薬組成物、疾病等について複数形が使用される場合は、単数の化合物、塩等をも意味することが意図されている。
【0010】
式(I)の化合物に対する上記又は下記のいずれの言及も、適切かつ好都合なように、式(I)の化合物の塩、特に薬学的に許容される塩をも指すものと理解されるべきである。
【0011】
C1-5アルキルという用語は、単独で、またはその他の基と組み合わせて、1から5の炭素原子をもつ飽和した、分枝または好ましくは直鎖状基を意味する。C1-5アルキル基の好ましい例は、メチル、エチル、n-プロピル、n-ブチル、イソ-ブチルおよびn-ペンチルである。
【0012】
C1-4アルキルという用語は、単独で、またはその他の基と組み合わせて、1から4の炭素原子、好ましくは1から3の炭素原子、すなわちC1-3アルキル、をもつ飽和した、分枝または好ましくは直鎖状基を意味する。C1-4アルキル基の好ましい例は、メチル、エチルおよびn-プロピルである。
【0013】
同様に、C2-5アルキルという用語は、単独で、またはその他の基と組み合わせて、2から5の炭素原子をもつ飽和した、分枝または直鎖状基,を意味する。C2-5アルキル基の好ましい例は、エチル、n-プロピル、n-ブチル、イソ-ブチル、n-ペンチルおよびイソ-ペンチルである。
【0014】
C1-5アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC1-5アルキルであるR-O基を意味する。
【0015】
C1-4アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC1-4アルキルであるR-O基を意味する。C1-4アルコキシ基の好ましい例は、メトキシ、エトキシ、プロポキシ、イソ-プロポキシおよびイソ-ブトキシである。
【0016】
C2-5アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC2-5アルキルであるR-O基を意味する。
ハロゲンという用語は、フルオロ、クロロ、ブロモまたはヨード、好ましくはフルオロまたはクロロを意味する。
【0017】
塩は、好ましくは式(I)の化合物の薬学的に許容される塩である。
薬学的に許容される塩という用語は、無毒性の無機もしくは有機酸および/または塩基付加塩を意味する、文献: 例えば"Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217。
【0018】
式(I)の化合物は、1または2以上の不斉炭素原子などの、1または2以上のキラルまたは不斉中心を含んでいてもよい。二重結合または環の置換基は、特に明記しない限り、cis- (=Z-)またはtrans (=E-)形態で存在してもよい。従って、式(I)の化合物は、立体異性体の混合物として、または好ましくは純粋な立体異性体として存在してもよい。立体異性体の混合物は当業者に知られた方法で分離してもよい。
【0019】
i)本発明は、式(I)の新規なチオフェン誘導体およびこのような化合物の塩に関する:
【0020】
【化1】

【0021】
式中
Aは*-CO-CH2CH2-、 *-CO-CH=CH-、
【0022】
【化2】

【0023】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し;
R1はC2-5アルキルを表し;
R2は、水素、メチルまたはエチルを表し;
R3は、水素、C1-4アルキル、C1-4アルコキシまたはハロゲンを表し;
R4は、水素、C1-4アルキル、C1-4アルコキシ、ハロゲン、トリフルオロメチルまたはトリフルオロメトキシを表し;
R5は、水素、ヒドロキシ-C1-5アルキル、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)n-NHSO2R51、-(CH2)nCH(OH)-CH2-NHSO2R51、-CH2-(CH2)n-NHCOR52、-(CH2)nCH(OH)-CH2-NHCOR52、-CH2-(CH2)n-CONR53R54、-CONHR53、1-(3-カルボキシ-アゼチジニル)-2-アセチル、1-(2-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-アゼチジニル)-3-プロピオニル、1-(2-カルボキシ-ピロリジニル)-3-プロピオニル、1-(3-カルボキシ-ピロリジニル)-3-プロピオニル、ヒドロキシ、C1-5アルコキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHSO2R51、-OCH2-CH(OH)-CH2-NHSO2R51、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表し;
R51は、C1-3アルキル、メチルアミノ、エチルアミノまたはジメチルアミノを表し;
R52は、ヒドロキシメチル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチルまたは2,3-ジヒドロキシプロピルを表し;
R53は、水素、C1-3アルキル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチル、2,3-ジヒドロキシプロピル、カルボキシメチル、1-(C1-5アルキルカルボキシ)メチル、2-カルボキシエチルまたは2-(C1-5アルキルカルボキシ)エチルを表し;
R54は、水素またはメチルを表し;
mは、1または2の整数を表し;
nは、0、1または2を表し;そして
R6は、水素、C1-4アルキルまたはハロゲンを表す。
【0024】
ii)本発明の特定の態様は、Aが、
【0025】
【化3】

【0026】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0027】
iii)本発明のもう一つの特定の態様は、Aが、
【0028】
【化4】

【0029】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0030】
iv)本発明のもう一つの特定の態様は、Aが、
【0031】
【化5】

【0032】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0033】
v)本発明のもう一つの特定の態様は、Aが、
【0034】
【化6】

【0035】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0036】
vi)本発明のもう一つの特定の態様は、Aが、
【0037】
【化7】

【0038】
を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0039】
vii)本発明のもう一つの特定の態様は、R1がn-プロピルまたはイソ-ブチルを表す、態様i)からvi)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0040】
viii)本発明のもう一つの特定の態様は、R2が水素またはメチルを表す、態様i)からvii)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0041】
ix)本発明の好ましい態様は、R2が水素を表す、態様i)からvii)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0042】
x)本発明のもう一つの好ましい態様は、R3がメトキシを表し、R4およびR6が水素を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0043】
xi)本発明のもう一つの好ましい態様は、R3が水素を表し、R4がメチル、エチルまたはメトキシを表し、R6がメチル、エチルまたはハロゲンを表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0044】
xii)本発明のもう一つの好ましい態様は、R3が水素を表し、R4およびR6がメチル基を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0045】
xiii)本発明の特に好ましい態様は、R3が水素を表し、R4がメチル基を表し、R6がエチル基を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0046】
xiv)本発明のもう一つの好ましい態様は、R3が水素を表し、R4がメトキシ基を表し、R6が塩素原子を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0047】
xv)本発明のもう一つの好ましい態様は、R3が水素を表し、R4がメチル基を表し、R6が塩素原子を表す、態様i)からix)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0048】
xvi)本発明のもう一つの好ましい態様は、R5が2,3-ジヒドロキシプロピル、-CH2-(CH2)n-NHCOR52、-(CH2)nCH(OH)-CH2-NHCOR52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表す、態様i)からxv)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0049】
xvii)本発明のもう一つの好ましい態様は、R5がヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表す、態様i)からxv)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0050】
xviii)本発明のもう一つの好ましい態様は、R5が3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表す、態様i)からxv)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0051】
xix)本発明のもう一つの好ましい態様は、R5が2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し、R52がヒドロキシメチルを表す、態様i)からxv)のいずれかに記載のチオフェン誘導体およびそれらの塩に関する。
【0052】
xx)本発明の特に好ましい態様は、Aが、
【0053】
【化8】

【0054】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し、R1がn-プロピルまたはイソ-ブチルを表し、R2が水素を表し、R3が水素またはメトキシを表し、R4が水素、メチル、エチルまたはメトキシを表し、R5が3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し、R6が水素、メチル、エチルまたは塩素を表す、態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0055】
xxi)本発明のもう一つの特に好ましい態様は、Aが*-CO-CH2CH2-、 *-CO-CH=CH-、
【0056】
【化9】

【0057】
(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し;
R1がC2-5アルキルを表し;
R2およびR3が共に水素を表し;
R4がC1-4アルキルを表し;
R5がヒドロキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し;
R52がヒドロキシメチルを表し;そして
R6がC1-4アルキルを表す、
態様i)に記載のチオフェン誘導体およびそれらの塩に関する。
【0058】
xxii)特に好ましい式(I)のチオフェン化合物は:
(2R)-N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(2S)-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(2R)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
(2S)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
(2R)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2-エチル-6-メチル-フェノキシ}-プロピル)-アセタミドおよび
(2S)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2-エチル-6-メチル-フェノキシ}-プロピル)-アセタミド、
並びにこれらの化合物の塩である。
【0059】
xxiii) さらに特に好ましい式(I)のチオフェン化合物は:
2-ヒドロキシ-N-((2S)-2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-((2S)-3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、および
N-((2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド
並びにこれらの化合物の塩である。
【0060】
式(I)の化合物およびこれらの薬学的に許容される塩は、医薬として、たとえば経腸または非経口投与のための医薬組成物の形態で使用することができる。
医薬組成物の製造は、いずれの当業者によく知られた様式で(たとえばMark Gibson, Editor, Pharmaceutical Preformulation and Formulation, IHS Health Group, Englewood, CO, USA, 2001; Remington, The Science and Practice of Pharmacy, 20th Edition, Philadelphia College of Pharmacy and Scienceを参照されたい)、記述された式(I)の化合物またはこれらの薬学的に許容される塩を、任意に、ガレノスの投与形態中に、適切な無毒の不活性な薬学的に許容される固体または液体の担体材料および必要に応じて、通常の薬学的アジュバントと共に、その他の治療的に有益な物質と組み合わせることによって遂行することができる。
【0061】
式(I)の化合物を含む医薬組成物は、活性化された免疫系と関連する疾患もしくは障害の予防および/または治療のために有用である。
かかる疾患または障害は、移植された臓器、組織または細胞に対する拒絶反応;移植によってもたらされる移植片対宿主病;関節リウマチを含む自己免疫性症候群;全身性エリテマトーデス;抗リン脂質抗体症候群;橋本甲状腺炎;リンパ球性甲状腺炎;多発性硬化症;重症筋無力症;I型糖尿病;ブドウ膜炎;上強膜炎;強膜炎;川崎病、ブドウ膜網膜炎;後部ブドウ膜炎;ベーチェット病関連ブドウ膜炎;ブドウ膜髄膜炎症候群;アレルギー性脳脊髄炎;慢性アレルギー性血管症;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;炎症性および過増殖性皮膚疾患;乾癬;乾癬性関節炎;アトピー性皮膚炎;ミオパシー;筋炎;骨髄炎;接触皮膚炎;湿疹性皮膚炎;脂漏性皮膚炎;扁平苔癬;天疱瘡;水疱性類天疱瘡;表皮水疱症;蕁麻疹;血管性浮腫;脈管炎;紅斑;皮膚好酸球増加;アクネ(瘡);強皮症;円形脱毛症;角結膜炎;春季カタル性結膜炎;角膜炎;ヘルペス性角膜炎;角膜上皮性ジストロフィー;角膜白斑;眼部天疱瘡;モーレン潰瘍;潰瘍性角膜炎;強膜炎;グレーブス眼症;フォークト・小柳・原田症候群;類肉腫症;花粉アレルギー;可逆性閉塞性気道疾患;気管支喘息;アレルギー喘息;内因性喘息;外因性喘息;塵埃喘息;慢性または難治性喘息;遅発性喘息および気道過敏症;細気管支炎;気管支炎;子宮内膜症;睾丸炎;胃潰瘍;虚血性腸疾患;炎症性腸疾患;壊死性腸炎;熱傷関連腸病変;セリアック病;直腸炎;好酸球性胃腸炎;肥満細胞症;クローン病;潰瘍性大腸炎;虚血性疾患および血栓症により惹起された血管損傷;アテローム性動脈硬化症;脂肪心;心筋炎;心筋梗塞;大動脈症候群;ウイルス性疾患による悪液質;血管血栓症;偏頭痛;鼻炎;湿疹;間質性腎炎;IgA誘発腎障害;グッドパスチャー症候群;溶血性尿毒症症候群;糖尿病性腎障害;糸球体硬化;糸球体腎炎;尿細管間質性腎炎;間質性膀胱炎;多発筋炎;ギラン・バレ症候群;メニエール病;多発神経炎;多発性神経炎;脊髄炎;単神経炎;神経根障害;甲状腺機能亢進症;バセドウ病;甲状腺中毒症;真性赤血球系無形成症;再生不良性貧血;低形成貧血;特発性血小板減少性紫斑病;自己免疫性溶血性貧血;自己免疫性血小板減少症;顆粒球減少;悪性貧血;巨赤芽球性貧血;赤血球形成不全;骨粗しょう症;肺線維症;特発性間質性肺炎;皮膚筋炎;尋常性白斑;尋常性魚鱗癬;光線過敏症;皮膚T細胞リンパ腫;結節性多発性動脈炎;ハンチントン舞踏病;シデナム舞踏病;心筋症;心筋炎;強皮症;ウェーゲナー肉芽腫;シェーグレン症候群;脂肪過多;好酸球性筋膜炎;歯肉、歯周靱帯、歯槽骨、セメント質の損傷・病変;若はげまたは老年性脱毛;筋ジストロフィー;膿皮症;セザリー症候群;下垂体炎;慢性副腎機能不全;アジソン病;保存時に起る臓器の虚血・再灌流損傷;エンドトキシンショック;偽膜性結腸炎;薬物または放射線による結腸炎;虚血性急性腎不全;慢性腎不全;肺癌;リンパ起源の悪性腫瘍;急性または慢性リンパ球性白血病;リンパ腫;肺気腫;白内障;鉄沈着症;網膜色素変性;老年性黄斑変性;硝子体瘢痕化;角膜アルカリ熱傷;紅斑性皮膚炎;水疱性皮膚炎;セメント皮膚炎;歯肉炎;歯周炎;敗血症;膵炎;抹消動脈疾患;発癌;固形癌腫瘍;癌転移;高山病;自己免疫肝炎;原発性胆汁性肝硬変;硬化性胆道炎;部分肝切除;急性肝壊死;肝硬変;アルコール肝硬変;肝不全;劇症肝不全;遅発性肝不全;「慢性期急性」肝不全からなる群から選ばれるものである。
【0062】
式(I)の化合物により治療および/または予防されるべき、好ましい疾患または障害は、腎臓、肝臓、心臓、肺、膵臓、角膜および皮膚等の移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、クローン病および潰瘍性大腸炎等の炎症性腸疾患、乾癬、乾癬性関節炎、橋本甲状腺炎等の甲状腺炎、ブドウ膜網膜炎を含む自己免疫症候群;鼻炎、結膜炎、皮膚炎等のアトピー性疾患;喘息;I型糖尿病;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;固形癌および腫瘍転移からなる群から選ばれるものである。
式(I)の化合物により治療および/または予防されるべき、特に好ましい疾患または障害は、腎臓、肝臓、心臓および肺から選択される移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、乾癬、乾癬性関節炎、クローン病および橋本甲状腺炎から選択される自己免疫症候群;およびアトピー性皮膚炎からなる群から選ばれるものである。
【0063】
本発明はまた、式(I)の化合物の薬学的に活性な量を患者に投与することを含む、本明細書において言及した疾患もしくは障害の予防または治療のための方法にも関する。
さらにまた、式(I)の化合物は、1つまたはいくつかの免疫調節薬と組み合わせて、本明細書において言及した疾患および障害の予防および/または治療のために有用である。本発明の好ましい態様によれば、前記薬剤は、免疫抑制薬、副腎皮質ステロイド、NSAID、細胞毒、接着分子阻害剤、サイトカイン、サイトカイン阻害剤、サイトカイン受容体アンタゴニストおよび組換えサイトカイン受容体からなる群より選択される。
【0064】
また、本発明は、任意に1つまたはいくつかの免疫調節薬と組み合わせて使用するための、本明細書において言及した疾患および障害の予防または治療のための医薬組成物の製造のための、式(I)の化合物の使用に関する。
式(I)の化合物は、以下の方法によって、実施例に示された方法によって、または類似の方法によって製造することができる。最適反応条件は、使用する具体的反応物または溶媒によって変更してもよいが、このような条件は、当業者により、ルーチンの最適化手順によって決定することができる。
【0065】
本発明の式(I)の化合物は、下記に概説した反応の一般的順序に従って製造することができる。式(I)の化合物を生じる合成の可能性のうちの少数のみを記述してある。
【0066】
【化10】

【0067】
Aが-CO-CH=CH-を表す場合には、式(I)の化合物は、構造1の化合物を、塩基または酸の存在下で、構造2の化合物と反応させることにより調製してもよい。残基R3〜R6に存在する官能基は、一時的に保護を必要としてもよく、または縮合反応に続くさらなる工程においてさらに導入してもよい。Aが-CO-CH2CH2-を表す式(I)の化合物は、Aが-CO-CH=CH-を表す式(I)の化合物を、メタノール、エタノール、THFなど、またはそれらの混合物などの溶媒中で、Pd/C、Pt/C、PtO2などの触媒の存在下で、水素と反応させることによって調製してもよい。
【0068】
【化11】

【0069】
構造1の化合物は、構造3の化合物をメチルグリニャール試薬と反応させることにより、または構造4の化合物を、ジエチルエーテル、THF等の溶媒中で、−20と50℃の間の温度で、2当量のメチルリチウムで処理することにより調製してもよい。構造3のWeinrebアミド化合物は、EDC、DCCなどのカップリング試薬の存在下において、構造4の化合物を塩酸N,O-ジメチルヒドロキシルアミンで処理することによって製造される。(M. Mentzel, H. M. R. Hoffmann, N-Methoxy N-methyl amides (Weinreb amides) in modern organic synthesis, Journal fuer Praktische Chemie/Chemiker-Zeitung 339 (1997), 517-524; J. Singh, N. Satyamurthi, I. S. Aidhen, The growing synthetic utility of Weinreb's amide, Journal fuer Praktische Chemie(Weinheim, Germany) 342 (2000) 340-347; V. K. Khlestkin, D. G. Mazhukin, Recent advances in the application of N,O-dialkylhydroxylamines in organic chemistry, Current Organic Chemistry 7(2003), 967-993)。
【0070】
【化12】

【0071】
5-チエニル-[1,2,4]オキサジアゾール誘導体を表す式(I)の化合物は、キシレン、トルエン、ベンゼン、ピリジン、DMF、ジクロロメタン、酢酸、トリフルオロ酢酸などの溶媒中で、室温または高温にて、酸(たとえば、TFA、酢酸、HCl、その他)、塩基(たとえば、NaH、NaOAc、Na2CO3、K2CO3、トリエチルアミン、その他)、テトラアルキルアンモニウム塩または水除去剤(たとえば、塩化オキサリル、カルボン酸無水物、POCl3、PCl5、P4O10、モレキュラーシーブ、メトキシカルボニルスルファモイル トリエチルアンモニウム ヒドロキシド(Burgess試薬)、その他)等の添加剤の存在下または非存在下において、構造5の化合物を反応させることによって製造される(文献: たとえば、A. R. Gangloff, J. Litvak, E. J. Shelton, D. Sperandio, V. R. Wang, K. D. Rice, Tetrahedron Lett.42 (2001), 1441-1443; T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47 (1999), 120-122; R. F. Poulain, A. L. Tartar, B. P. Deprez, Tetrahedron Lett. 42 (2001), 1495-1498; R. M. Srivastava, F. J. S. Oliveira, D. S. Machado, R. M. Souto-Maior, Synthetic Commun. 29 (1999), 1437-1450; E. O. John, J. M. Shreeve, Inorganic Chemistry27 (1988), 3100-3104; B. Kaboudin,K. Navaee, Heterocycles60 (2003), 2287-2292)。
【0072】
構造5の化合物は、DMF、THF、DCMなどの溶媒中で、TBTU、DCC、EDC、HBTU、HOBt、CDIなどの1つまたは複数のカップリング試薬の存在下または非存在下において、およびトリエチルアミン、Huenig's塩基、NaH、K2CO3などの塩基の存在下または非存在下において、構造4の化合物を構造6の化合物と反応させることによって製造してもよい(文献: たとえば、A. Hamze, J.-F. Hernandez, P. Fulcrand, J. Martinez, J. Org. Chem. 68 (2003) 7316-7321;および前述の文献)。
【0073】
【化13】

【0074】
3-チエニル-[1,2,4]オキサジアゾール誘導体を表す式(I)の化合物は、構造7の化合物を構造8の化合物と反応させ、続いて対応するヒドロキシアミジンエステル中間体の環化を行うことにより、同様の方法にて製造される。(文献: たとえば、C. T. Brain, J. M. Paul, Y. Loong, P. J. Oakley, Tetrahedron Lett. 40 (1999) 3275-3278)。
【0075】
【化14】

【0076】
構造6および7の化合物は、メタノール、エタノール、ピリジンなどの溶媒中で、Na2CO3、K2CO3、tert.ブチルカリウム、トリエチルアミンなどの塩基の存在下または非存在下において、それぞれ構造9および10の化合物をヒドロキシルアミンまたはその塩の1つと反応させることによって製造してもよい(文献: たとえば、T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47 (1999), 120-122; J. Cui, D. Crich, D. Wink, M. Lam, A. L. Rheingold, D. A. Case, W. T. Fu, Y. Zhou, M. Rao, A. J. Olson, M. E. Johnson, Bioorg. Med. Chem. 11 (2003), 3379-3392; R. Miller, F. Lang, Z. J. Song, D. Zewge, WO 2004/035538 (Merck & Co., Inc., USA); B. Kaboudin, K. Navaee, Heterocycles60 (2003), 2287-2292)。
【0077】
【化15】

【0078】
構造2、5、6、8および9の残基R3〜R6に存在する官能基の性質に応じて、これらの官能基には、一時的な保護が必要であってもよい。適切な保護基は、当業者に公知であり、たとえばアルコールを保護するためのベンジルまたはトリアルキルシリル基、ジオールを保護するためのケタールなどを含む。これらの保護基は、標準的な方法論に従って採用してもよい(たとえば、T. W. Greene, P. G. M. Wuts, Protective Groups in Organic Synthesis, 3rdEdition, Wiley New York, 1991; P. J. Kocienski, Protecting Groups, Thieme Stuttgart, 1994)。あるいは、所望の残基R3〜R6、特にR5は、それぞれ構造2、6および8の化合物の適切な前駆体を用いることにより、構造1、4および7のチオフェン化合物の、構造2、6および8のフェニル誘導体とのカップリングに続く後半の工程で導入してもよい。構造2、6、8および9のフェニル化合物またはこれらの前駆体は、商業的に入手可能であるか、または当業者に公知の手順に従って製造される。
【0079】
【化16】

【0080】
2-チエニル-[1,3,4]オキサジアゾールまたは2-チエニル-[1,3,4]チアジアゾール誘導体を表す式(I)の化合物は、構造4の化合物を(TBTU、DCC、EDC、HBTU、PyBOP、HOBt、CDIなどのカップリング試薬を用いて)ヒドラジンと反応させ、構造11の化合物を生成させることにより、同様に製造される。構造11の化合物は、構造8の化合物とカップリングされ、構造12の化合物を与える。構造12の化合物は、逆の反応順序に従うことにより、すなわち、最初に構造8の化合物をヒドラジンとカップリングさせ、続いて対応するヒドラジド中間体を構造4の化合物と反応させることにより製造することもできる。所望の2-チエニル-[1,3,4]オキサジアゾール誘導体を生成させるための構造12の化合物の脱水反応は、トルエン、アセトニトリル、ジオキサン、THFまたはCHCl3等の溶媒中で、マイクロ波照射の存在下または非存在下、20と120℃の間の温度で、構造12の化合物を、トリフェニルホスフィン、P2O5、Burgess試薬等と組み合わせてPOCl3、CCl4またはCBr4等の試薬で処理することにより行われる。(文献: たとえば、 M. A. Garcia, S. Martin-Santamaria, M. Cacho, F. Moreno de la Llave, M. Julian, A. Martinez, B. De Pascual-Teresa, A. Ramos, J. Med. Chem. 48(2005) 4068-4075; C. T. Brain, J. M. Paul, Y. Loong, P. J. Oakley, Tetrahedron Lett. 40 (1999) 3275-3278)。 同様に、 2-チエニル-[1,3,4]チアジアゾール誘導体は、構造12の化合物を、ピリジン、トルエン、THFまたはアセトニトリル等の溶媒の存在下または非存在下、マイクロ波照射下または非照射下で、任意にP2S5と組み合わせて、Lawessonの試薬にて高温で環化することにより得られる(文献: たとえば、 A. A. Kiryanov, P. Sampson, A. J. Seed, J. Org. Chem. 66 (2001) 7925-7929)。
【0081】
【化17】

【0082】
5-チエニル-オキサゾールまたは5-チエニル-チアゾール誘導体を表す式(I)の化合物は、構造13の化合物を、トルエン、ベンゼン、ジオキサンまたはTHF等の溶媒中、20と120℃の間の温度で、トリフェニルホスフィンおよびトリエチルアミン、Burgess試薬、トリフルオロ酢酸無水物等と組み合わせてPOCl3、PCl5、I2で処理するか、または上述のようにピリジン、トルエン、THFまたはアセトニトリル等の溶媒の存在下または非存在下、マイクロ波照射下または非照射下で、任意にP2S5と組み合わせて、Lawessonの試薬にて高温で処理することにより製造される(文献: たとえば、 N. Sato, T. Shibata, M. Jitsuoka, T. Ohno, T. Takahashi, T. Hirohashi, T. Kanno, H. Iwaasa, A. Kanatani, T. Fukami, Takehiro, Bioorg. & Med. Chem. Lett. 14(2004) 1761-1764)。構造13の化合物は、構造14の化合物を構造9の化合物と反応させることにより製造される。構造14のアミノケトンは、構造1の化合物から、文献(たとえば. J. L. LaMattina, J. Heterocyclic Chem. 20(1983) 533-538; M. Pesson, M. Antoine, P. Girard, J. L. Benichon, S. Chabassier, P. De Lajudie, S. Patte, F. Roquet, G. Montay, Eur. J. Med. Chem. 15 (1980) 263-268)に記載された手順により製造することができる。2-チエニル-オキサゾールまたは2-チエニル-チアゾール誘導体を表す式(I)の化合物は、構造15の化合物および構造4の化合物から同様の方法で製造される。
【0083】
【化18】

【0084】
また、チオフェンまたはフェニル環と中央の5員芳香族複素環との間の結合は、パラジウムで触媒されたクロスカップリング反応を適用することによっても形成することができる。
【0085】
【化19】

【0086】
構造4の化合物は、構造16のチオフェン-2-カルボン酸を、文献(たとえば. D. W. Knight, A. P. Nott, J. Chem. Soc. Perkin Trans. 1 1983 791-794)の手順に従ってアルキル化することにより製造することができる。構造16のチオフェン-2-カルボン酸またはこれらのメチルまたはエチルエステルは、商業的に入手可能であるか、または文献(たとえば S. Gronowitz, T. Klingstedt, L. Svensson, U. Hansson, Lipids28 (1993) 889-897)の手順に従って製造することができる。
【0087】
【化20】

【0088】
構造4の化合物は、Rがメチル、エチル、tert.ブチル等を表す構造17の化合物を、Suzukiの条件下(文献:たとえば、 F. Kerins, D. F. O'Shea, J. Org. Chem. 67 (2002) 4968-4971)で、2,4,6-トリアルケニルシクロトリボロキサンと反応させて、Rがメチル、エチル、tert.ブチル等を表し、RaおよびRbがともに、独立して水素、メチル、エチル等を表す構造18の化合物を得、それを水素化および続いてエステル開裂に付すことにより構造4の所望の化合物を供給することによっても製造することができる。構造17の化合物は、商業的に入手可能であるか、または文献の手順に従って製造することができる。
【0089】
【化21】

【0090】
R2がメチルまたはエチルを表す構造4の化合物は、構造20の化合物を得るために、Rcがエチルまたはn-プロピルを表す構造19の化合物を、DMF中、Vilsmezerの条件下で、POCl3と反応させることによっても製造することができる(文献: たとえば、 G. Alvernhe, D. Greif, B. Langlois, A. Laurent, I. Le Drean, M. Pulst, A. Selmi, M. Weissenfels, Bull. Soc. Chim. Fr. 131 (1994) 167-172)。構造20の化合物を、NaH、NaOEt、NaOMe、K tert.-ブトキシド等の塩基の存在下において、THF、ジオキサン、DMF、エタノール、メタノール等、またはこれらの混合物中で、メルカプト酢酸エステルで処理するこより、構造21の中間体が生成する。好ましくは高温における、メタノール、エタノール、THF、DMF等の溶媒またはこれらの混合物中での、NaOMe、NaOEt、KOtBu、DBU等の無水塩基を用いた塩基条件下での環化、それに続く、水、エタノール、メタノール、THF等の溶媒またはこれらの混合物中での、NaOH水溶液、LiOH水溶液、KOH水溶液などの水性塩基またはHCl水溶液、TFA等の酸によるけん化により構造4の化合物が供給される。構造20の化合物を、チオ酢酸Sシアノメチルエステルからin situで生成されるメルカプトアセトニトリルで処理することにより、構造10の化合物を供給してもよい。
【0091】
構造4の化合物を構造10の化合物に変換する方法、またはその逆を行う方法は、当業者に知られている。
【実施例】
【0092】
以下の実施例は、本発明を例証するが、これらの範囲を全く限定しない。
すべての温度は、摂氏度で述べてある。化合物は、1H-NMR(300MHz)または13C-NMR(75MHz)によって(Varian Oxford;化学シフトは、使用する溶媒と関連して、ppmで示してある;多重度:s =一重項、d =二重項、t =三重項;p =四重項、hex= 五重項、hept= 六重項、m =多重項、br =広域、結合定数は、Hzで示してある);LC-MSによって(HP 1100 Binary PumpおよびDADを備えたFinnigan Navigator、カラム:4.6×50 mm、Zorbax SB-AQ、5μm、120Å、勾配:5〜95%のアセトニトリルの水溶液、1分、0.04%のトリフルオロ酢酸を含む、流速: 4.5 mL/分)、tRは、分で示してある;TLCによって(MerckからのTLC-プレート、Silica gel 60 F254);または融点によって特徴付けてある。化合物は、調製用HPLCによって(カラム:X-terra RP18、50×19 mm、5μm、勾配:0.5%のギ酸を含む10〜95%のアセトニトリルの水溶液)またはMPLCによって(Labomatic MD-80-100ポンプ、Linear UVIS-201検出器、カラム:350×18 mm、Labogel-RP-18-5s-100、勾配:10%のメタノール水溶液〜100%のメタノール)精製される。
【0093】
略語(本明細書で使用したもの)
aq. 水溶液
BSA ウシ血清アルブミン
Bu ブチル
CC カラムクロマトグラフィー
CDI カルボニルジイミダゾール
DBU 1,8-ジアザビシクロ[5.4.0]ウンデス-7-エン(1,8-
ジアザビシクロ[5.4.0]ウンデス-7-エン)
DCC ジシクロヘキシルカルボジイミド
DCM ジクロロメタン
DIPEA ジイソプロピルエチルアミン、Hunig's塩基、エチル-ジイソプロピルアミ
ン
DME 1,2-ジメトキシエタン
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
EA 酢酸エチル
EDC N-(3-ジメチルアミノプロピル)-N'-エチル-カルボジイミド
Et エチル
EtOH エタノール
h 時間
HBTU O-(ベンゾトリアゾール-1-イル)-N,N,N',N'-テトラメチルウロニウムヘキサ
フルオロホスフェート
HOBt 1-ヒドロキシベンゾトリアゾール
HPLC 高速液体クロマトグラフィー
KOtBu カリウムt-ブトキシド
LC-MS 液体クロマトグラフィー−質量分析
LDA リチウムジイソプロピルアミド
Lit. 文献
Me メチル
min 分
MPLC 中圧液体クロマトグラフィー
NaOAc 酢酸ナトリウム
NMO N-メチル-モルホリン-N-オキシド
org. 有機
Ph フェニル
prep. 調製用
PyBOP ベンゾトリアゾール-1-イル-オキシ-トリス-ピロリジノ-ホスホニウム-ヘキ
サフルオロ-ホスファート
rt 室温
sat. 飽和
S1P スフィンゴシン1-リン酸
TBME tert.-ブチルメチルエーテル
TBTU 2-(1H-ベンゾトリアゾール-1-イル)-1,2,3,3-テトラメチルウロニウムテト
ラフルオロホウ酸塩
TFA トリフルオロ酢酸
THF テトラヒドロフラン
TLC 薄層クロマトグラフィー
tR 保持時間
5-エチル-チオフェン-2-カルボン酸
【0094】
【化22】

【0095】
チオフェンカルボン酸(4.00g、30.9mmol)のTHF(24mL)溶液を、-78℃に冷却したLDAの(32.5mL、トルエン中2M)のTHF(40mL)溶液に、攪拌下、シリンジで滴下する。ヨウ化エタン(4.87g、30.9mmol)を添加するまで、反応液の温度は-78℃に10分間維持される。混合物を-78℃で1時間攪拌した後、一晩で室温に暖める。水の添加により、反応をクエンチする。混合物を酸性化し、ジエチルエーテルで3回抽出する。有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を逆相シリカゲル上でMPLCにより精製し、表題化合物(1.10g)を褐色がかった固体として得る;LC-MS:tR = 0.80 min, 1H NMR (CDCl3):δ 1.34 (t, J = 7.3 Hz, 3 H), 2.90 (q, J = 7.6 Hz, 2 H), 6.84 (d, J = 3.5 Hz, 1 H), 7.73 (d, J = 3.8 Hz, 1 H)。
【0096】
5-n-プロピル-チオフェン-2-カルボン酸
【0097】
【化23】

【0098】
2-チオフェンカルボン酸および1-ヨウ化プロパンから、5-エチル-チオフェン-2-カルボン酸と同様に表題化合物を製造する;LC-MS:tR = 0.87 min, 1H NMR (CDCl3):δ 0.99 (t, J = 7.0 Hz, 3 H), 1.74 (hex, J = 7.3 Hz, 2 H), 2.83 (t, J = 7.6 Hz, 2 H), 6.82 (d, J = 3.5 Hz, 1 H), 7.73 (d, J = 3.8 Hz, 1 H)。
【0099】
5-n-ブチル-チオフェン-2-カルボン酸
【0100】
【化24】

【0101】
2-チオフェンカルボン酸および1-ヨウ化ブタンから、5-エチル-チオフェン-2-カルボン酸と同様に表題化合物を製造する;LC-MS:tR = 0.92 min。
【0102】
5-イソブチル-チオフェン-2-カルボン酸
【0103】
【化25】

【0104】
2-チオフェン−カルボン酸(4.16g、32.1mmol)のTHF(200mL)溶液に、tert.ブチルリチウム(49mL、1.7M ペンタン溶液、83.6mmol)を-78℃にてゆっくりと添加する。混合物を-78℃で30分攪拌した後、臭化イソブチル(22.7g、160.7mmol)を注意深く添加する。混合物を-78℃で5時間、その後、室温で16時間攪拌する。水(400mL)の添加により、反応をクエンチする。混合物を酸性化し、EAで抽出する。有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を逆相シリカゲル上でMPLCにより精製し、表題化合物(1.67g)を褐色がかった油状物質として得る;LC-MS:tR = 0.91 min, 1H NMR (CDCl3):δ0.96 (d, J = 6.7 Hz, 6 H), 1.94 (hept, J = 6.7 Hz, 1H), 2.72 (d, J = 7.0 Hz, 2 H), 6.80 (d, J = 3.8 Hz, 1 H), 7.73 (d, J = 3.8 Hz, 1 H)。
【0105】
5-(2-メチル-プロペニル)-4-メチル-チオフェン-2-カルボン酸
【0106】
【化26】

【0107】
a) 5-ブロモ-4-メチル-チオフェン-2-カルボン酸メチルエステル (3.65g、15.53mmol)のDME (30mL)溶液に、2,4,6-トリス-(2-メチル-プロペニル)-シクロトリボロキサン ((5.04g、15.53mmol) F. Kerins, D. F. O'Shea, J. Org. Chem. 67 (2002), 4968-4971)を添加し、続いて2M K2CO3水溶液(12mL)を添加する。Pd(PPh3)4(366mg、0.317mmol)を添加する前に、溶液を脱気し、アルゴン下に置く。混合物を80℃で10時間攪拌した後、室温に冷却し、ジエチルエーテル(50mL)で希釈し、飽和NaHCO3水溶液(2x30mL)で洗浄する。有機抽出物をMgSO4で乾燥し、ろ過し、濃縮して、4-メチル-5-(2-メチル-プロペニル)-チオフェン-2-カルボン酸メチルエステル(4.08g)を黄色の油状物質として得る;LC-MS:tR= 1.04 min, [M+1]+ = 211.04.
b) 4-メチル-5-(2-メチル-プロペニル)-チオフェン-2-カルボン酸メチルエステル(4.08g、19.4mmol)のメタノール溶液(33mL)を2N LiOH水溶液(10mL)で処理する。混合物を室温で2時間、その後45℃で3時間攪拌する。反応混合物をジエチルエーテルで希釈する。有機相を分離して、水で抽出する。合わせた水相を1M HCl水溶液で酸性化し、ジエチルエーテルで2回抽出する。2回目の有機抽出物を合わせて、MgSO4で乾燥し、ろ過し、濃縮して、4-メチル-5-(2-メチル-プロペニル)-チオフェン-2-カルボン酸(3.05g)を薄灰色の固体として得る;LC-MS:tR = 0.92 min, [M+1]+ = 196.98。
【0108】
1-(5-イソブチル-チオフェン-2-イル)-エタノン
【0109】
【化27】

【0110】
5-イソブチル-チオフェン-2-カルボン酸(550mg、2.99mmol)のジエチルエーテル溶液(20mL)に、メチルリチウムの溶液(3.75mL、ジエチルエーテル中1.6 M)を室温でゆっくり添加する。反応混合物を室温で1時間攪拌した後、水で注意深く2回洗浄し、MgSO4で乾燥し、ろ過し、蒸発させて、表題化合物(336mg)を黄色がかった油状物質として得る;LC-MS:tR = 0.91 min, [M+1]+= 183.07。
【0111】
4,N-ジヒドロキシ-3,5-ジメチル-ベンズアミジン
【0112】
【化28】

【0113】
表題化合物を、商業的に入手可能な4-ヒドロキシ-3,5-ジメチル-ベンゾニトリルから、文献の手順に従って製造する(たとえば E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905);1H NMR (CD3OD):δ7.20 (s, 2H), 2.20 (s, 6H)。
【0114】
4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン
【0115】
【化29】

【0116】
商業的に入手可能な4-ヒドロキシ-3,5-ジメチル-ベンゾニトリルを、イソプロパノール中、NaOHの存在下、室温にて臭化アリルでアリル化することにより、表題化合物を製造する。ニトリルは、文献の手順に従ってヒドロキシアミジンに変換される(たとえば E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905);1H NMR (CD3OD):δ7.27 (s, 2 H), 6.10 (m, 1 H), 5.42 (m, 1 H), 5.26 (m, 1 H), 4.31 (dt, J = 5.6, 1.5 Hz, 2 H), 2.29 (s, 6 H)。
【0117】
3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジン
【0118】
【化30】

【0119】
表題化合物を、商業的に入手可能な2-エチル-6-メチル-フェノールから、文献の手順に従って製造する(G. Trapani, A. Latrofa, M. Franco, C. Altomare, E. Sanna, M. Usala, G. Biggio, G. Liso, J. Med. Chem. 41 (1998) 1846-1854; A. K. Chakraborti, G. Kaur, Tetrahedron55 (1999) 13265-13268; E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905);LC-MS:tR = 0.55 min;1H NMR (D6-DMSO):δ9.25 (s br, 1H), 7.21 (s, 2H), 5.56 (s, 2H), 2.55 (q, J = 7.6 Hz, 2H), 2.15 (s, 3H), 1.10 (t, J = 7.6 Hz, 3H)。
【0120】
4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジン
【0121】
【化31】

【0122】
2-エチル-6-メチル-フェノールから、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って製造される3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒドを、アリル化することにより、表題化合物を製造する。アルデヒドは、その後、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って、対応するヒドロキシアミジンに変換される;LC-MS:tR = 0.72 min, [M+1]+ = 235.09; 1H NMR(CD3OD):δ7.31 (s, 1 H), 7.29 (s, 1 H), 6.10 (m, 1 H), 5.43 (dd, J = 17.0, 1.5 Hz, 1 H), 5.27 (dd, J = 10.3, 1.2 Hz, 1 H), 4.81 (s br, 3H), 4.31 (d, J = 5.6 Hz, 2 H), 2.67 (q, J = 7.6 Hz, 2 H), 2.30 (s, 3 H), 1.23 (t, J = 7.6 Hz, 4 H)。
【0123】
3,5-ジエチル-4,N-ジヒドロキシ-ベンズアミジン
【0124】
【化32】

【0125】
表題化合物を、商業的に入手可能な2,6-ジエチルアニリンから、文献の手順に従って製造する(G. G. Ecke, J. P. Napolitano, A. H. Filbey, A. J. Kolka, J. Org. Chem.22 (1957) 639-642;および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された文献)。
【0126】
4-アリルオキシ-N-ヒドロキシ-2-メトキシ-ベンズアミジン
【0127】
【化33】

【0128】
表題化合物を、商業的に入手可能な4-ヒドロキシ-2-メトキシ-ベンズアルデヒドから、文献の手順に従って製造する(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された参照);LC-MS:tR = 0.64 min; [M+1]+ = 223.24; 1H NMR (D6-DMSO):δ9.33 (s br, 1H), 7.30 (d, J =8.2 Hz, 1H), 6.60 (d, J = 2.3 Hz, 1H), 6.50 (dd, J = 2.3, 8.2 Hz, 1H), 6.10-5.94 (m, 1H), 5.50 (s, 2H), 5.40 (d, J = 17.0 Hz, 1H), 5.24 (d, J = 10.6 Hz, 1H), 4.57 (d, J = 4.7 Hz, 2H), 3.76 (s, 3H)。
【0129】
4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジド
【0130】
【化34】

【0131】
a) 4-ブロモ-2,6-ジメチル-フェノール(20.1g、100mmol)および塩化アリル(32.7g、428mmol)の3N NaOH水溶液(100mL)およびイソプロパノール(250mL)中の混合物を60℃で15時間攪拌した後、1N NaOH水溶液(100mL)で希釈する。混合物をジエチルエーテル(300mL、150mL)で抽出し、合わせた有機抽出物を1N NaOH水溶液(2x100mL)、1M NaH2PO4水溶液(50mL)で洗浄し、Na2SO4で乾燥し、ろ過、濃縮して、2-アリルオキシ-5-ブロモ-1,3-ジメチル-ベンゼン(23.6g)を黄色の油状物質として得る;LC-MS:tR= 1.08 min, [M+1]+ = 241.20。
【0132】
b) 2-アリルオキシ-5-ブロモ-1,3-ジメチル-ベンゼン(23.6g、98.0mmol)のTHF(150mL)溶液に、-75℃で、n-BuLiの溶液(90mL、ジエチルエーテル中1.5M)を添加する。温度を-75℃に維持する。混合物を30分攪拌した後、ダブルチップカヌーラを用いて、冷却した(0℃)炭酸ジメチル(21.4g、238mmol)のTHF(90mL)溶液中に移す。混合物を0℃で2時間攪拌した後、15時間の間に室温まで暖める。混合物の溶媒を蒸発させた後、EtOH(200mL)から再度蒸発させ、大部分の酢酸ブチル副産物を除去する。混合物を2N LiOH水溶液(150mL)およびEtOH(200mL)に溶解し、室温で2時間攪拌した後、60℃で1時間攪拌する。EtOHを蒸発させ、残った混合物を0.5N NaOH水溶液で希釈し、ジエチルエーテル(200mL)で抽出する。有機抽出物を1M NaOH水溶液(5x50mL)で洗浄し、合わせた水性洗浄相をエーテル(100mL)で再抽出する。水相を25% HCl水溶液で酸性化し、DCM (5x50mL)で抽出する。合わせた有機抽出物をNa2SO4で乾燥し、ろ過し、蒸発させ、60℃で15時間、真空下で乾燥し、4-アリルオキシ-3,5-ジメチル-安息香酸 (8.0)を黄褐色の固体として得る;LC-MS:tR = 0.90 min.。
【0133】
c) 4-アリルオキシ-3,5-ジメチル-安息香酸(5.26g、25.5mmol)のCHCl3(75mL)溶液に、チオニルクロリド(7.5mL、103mmol)を室温にて添加する。混合物を2時間還流した後、溶媒を蒸発させ、粗製4-アリルオキシ-3,5-ジメチル-安息香酸クロリドを褐色がかった油状物質として得る。酸クロリドのDCM溶液(50mL)に、DCM (250mL)中のヒドラジン(THF中の1M 溶液75mL)を0℃にて添加する。混合物を室温で15時間攪拌した後、ジエチルエーテルで希釈し、1N HCl水溶液(75mL、その後5x50mL)で抽出する。合わせた水性抽出物を、33% KOH水溶液を添加することにより塩基性化し、DCM (5x50mL)で抽出する。合わせたDCM抽出物をNa2SO4で乾燥し、ろ過し、蒸発させて、4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジド(5.39g)を白色の固体として得る;LC-MS;tR= 0.71 min; [M+1]+ = 221.20; 1H NMR (D6-DMSO):δ2.22 (s, 6 H), 4.28-4.37 (m, 2 H), 4.39 (s, 2 H), 5.19-5.28 (m, 1 H), 5.36-5.47 (m, 1 H), 6.00-6.15 (m, 1 H), 7.49 (s, 2 H), 9.55 (s, 1 H)。
【0134】
4-ベンジルオキシ-3,5-ジメチル-安息香酸ヒドラジド
【0135】
【化35】

【0136】
4-ベンジルオキシ-3,5-ジメチル安息香酸から、4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジドと同様に、4-ベンジルオキシ-3,5-ジメチル-安息香酸ヒドラジドを製造する;LC-MS:tR= 0.81 min; [M+1]+ = 271.41。
【0137】
4-ベンジルオキシ-3-エチル-5-メチル-安息香酸ヒドラジド
【0138】
【化36】

【0139】
a) 3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒド(34.9g、0.213mol、2-エチル-6-メチル-phenolから、3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された文献に従って製造される。)のアセトニトリル溶液(350mL)に、K2CO3(58.7g、0.425mol)および臭化ベンジル(36.4g、0.213mol)を添加する。混合物を60℃で2時間攪拌した後、室温に冷却し、水で希釈し、EAで2回抽出する。有機抽出物を水で洗浄し、濃縮して、粗製4-ベンジルオキシ-3-エチル-5-メチル-ベンズアルデヒド(45g)を、オレンジ色の油状物質として得る;1H NMR (CDCl3):δ1.29 (t, J= 7.5 Hz, 3 H), 2.40 (s, 3 H), 2.77 (q, J= 7.8 Hz, 2 H), 4.90 (s, 2 H), 7.31-7.52 (m, 5 H), 7.62 (d, J = 1.5 Hz, 1 H), 7.66 (d, J = 1.8 Hz, 1 H), 9.94 (s, 1 H)。
【0140】
b) 4-ベンジルオキシ-3-エチル-5-メチル-ベンズアルデヒド(132g、0.519mol)および2-メチル-2-ブテン(364g、5.19mol)のtert.-ブタノール(1500mL)中の混合物に、NaH2PO4二水和物(249g、2.08mol)の水溶液(1500mL)を添加する。この混合物に、NaClO2(187.8g、2.08mol)を分けて添加する。混合物の温度を30℃未満に保ち、ガスの発生が観察される。添加が完了するやいなや、オレンジ色の二相混合物を3時間よく攪拌し、その後TBME(1500mL)で希釈する。有機相を分離し、20% NaHS水溶液(1500mL)および水(500mL)で洗浄する。その後、有機相を0.5N NaOH水溶液(1000mL)で3回洗浄し、水相を25% HCl水溶液(500mL)で酸性化し、TBME(1000mL)で2回抽出する。これらの有機抽出物を合わせ、乾燥するまで蒸発させ、4-ベンジルオキシ-3-エチル-5-メチル-安息香酸を得る;1H NMR (D6-DMSO):δ1.17 (t, J = 7.5 Hz, 3 H), 2.31 (s, 3 H), 2.67 (q, J = 7.5 Hz, 2 H), 4.86 (s, 2 H), 7.34-7.53 (m, 5 H), 7.68 (s, 2 H), 12.70 (s, 1 H)。
【0141】
c) 4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジドの製造のステップc)に従って、4-ベンジルオキシ-3-エチル-5-メチル-安息香酸を4-ベンジルオキシ-3-エチル-5-メチル-安息香酸ヒドラジドに変換する;LC-MS:tR= 0.82 min、[M+1]+ = 285.44。
メタンスルホン酸2,2-ジメチル-[1,3]ジオキサン-5-イルメチルエステル
【0142】
【化37】

【0143】
表題化合物をB. Xu, A. Stephens, G. Kirschenheuter, A. F. Greslin, X. Cheng, J. Sennelo, M. Cattaneo, M. L. Zighetti, A. Chen, S.-A. Kim, H. S. Kim, N. Bischofberger, G. Cook, K. A. Jacobson, J. Med. Chem. 45 (2002) 5694-5709に記載された手順に従って製造する。
【0144】
実施例1
【0145】
【化38】

【0146】
a) 5-エチル-チオフェン-2-カルボン酸(502mg、3.21mmol)およびDIPEA(1.04g、8.03mmol)のDCM溶液(16mL)に、TBTU(1.13g、3.53mmol)を0℃にて添加する。混合物を0℃で1時間攪拌した後、水(2mL)で反応をクエンチする。DCMを蒸発させ、残渣をEAで希釈し、飽和NaHCO3水溶液および水で洗浄し、MgSO4で乾燥し、ろ過し、蒸発させる。粗生成物をアセトニトリルからの結晶化により精製し、5-エチル-チオフェン-2-カルボン酸 (4,N-ジヒドロキシ-3,5-ジメチル-ベンズアミジン) エステル(600mg)を白色固体として得た;LC-MS:tR= 0.94 min, [M+1]+ = 319.02。
【0147】
b) 5-エチル-チオフェン-2-カルボン酸(4,N-ジヒドロキシ-3,5-ジメチル-ベンズアミジン)エステル(600mg、1.88mmol)のジオキサン溶液(40mL)を100℃で18時間攪拌する。溶媒を蒸発させ、残渣をヘプタン:EA、4:1で溶出するシリカゲル上のCCにより分離して、4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノール(525mg)を薄黄色の油状物質として得る;LC-MS:tR= 1.09 min, [M+1]+ = 301.11。
【0148】
実施例2
【0149】
【化39】

【0150】
実施例1と同様に2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノールを製造する;LC-MS:tR= 1.10 min, [M+1]+ = 315.35。
【0151】
実施例3
【0152】
【化40】

【0153】
実施例1と同様に4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノールを製造する;LC-M:tR= 1.15 min, [M+1]+ = 329.15。
【0154】
実施例4
【0155】
【化41】

【0156】
実施例1と同様に4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノールを製造する;LC-MS:tR= 1.15 min, [M+1]+ = 329.09。
【0157】
実施例5
【0158】
【化42】

【0159】
4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノール(79mg、0.263mmol)のイソプロパノール(3mL)および3N NaOH水溶液(0.6mL)の溶液に、(R)-3-クロロ-プロパン-1,2-ジオール(148mg、1.31mmol)を添加する。混合物を室温で2時間、さらに65℃で16時間攪拌した後、別量の(R)-3-クロロ-プロパン-1,2-ジオール(119mg、1.05mmol)を添加する。攪拌を65℃で24時間継続する。反応混合物を水で希釈し、ジエチルエーテルで抽出する。有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を調製用TLCプレート上のクロマトグラフィーにより、7N NH3 メタノール溶液を4%含むDCMで精製し、(2R)-3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを薄灰色の固体として得る;LC-MS:tR= 0.99 min;[M+1]+ = 375.13;1H NMR (CDCl3):δ7.83 (s, 2H), 7.80 (d, J = 3.8 Hz, 1H), 6.93 (d, J = 3.8 Hz, 1H), 4.20-4.11 (m, 1H), 3.97-3.93 (m, 1H), 3.91 (dd, J = 11.5, 4.3 Hz, 1H), 3.85 (dd, J = 11.5, 5.5 Hz, 1H), 2.97 (q, J = 7.5 Hz, 2 H), 2.39 (s, 6 H), 1.41 (t, J = 7.5 Hz, 3H)。
【0160】
実施例6〜12
【0161】
【化43】

【0162】
以下の実施例は、(R)-または(S)-3-クロロ-プロパン-1,2-ジオールを用いて、表示された実施例から、実施例5と同様に製造される:
【0163】
【表1】

【0164】
実施例12
1H NMR(CDCl3):δ0.98 (d, J = 6.4 Hz, 6 H), 1.96 (hept, J = 6.5 Hz, 1H), 2.35 (s, 6 H), 2.76 (d, J= 7.0 Hz, 2 H), 3.76-3.94 (m, 4 H), 4.09-4.18 (m, 1 H), 6.86 (d, J = 3.5 Hz, 1 H), 7.77 (d, J = 3.5 Hz, 1 H), 7.80 (s, 2 H)。
【0165】
実施例13
【0166】
【化44】

【0167】
a) 4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノール(367mg、1.22mmol)およびエピクロロヒドリン(565mg、6.10mmol)のイソプロパノール(20mL)および3N NaOH水溶液(6mL)中の混合物を40℃で15時間攪拌する。混合物をジエチルエーテルで希釈し、飽和NaHCO3水溶液および水で洗浄し、MgSO4で乾燥し、ろ過し、蒸発させた。粗生成物をヘプタン:EA、9:1で溶出するシリカゲル上のCCにより精製し、3-(3,5-ジメチル-4-オキシラニルメトキシ-フェニル)-5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール(123 mg)を薄黄色の油状物質として得る;LC-MS: tR = 1.15 min, [M+1]+= 357.11。
【0168】
b) 3-(3,5-ジメチル-4-オキシラニルメトキシ-フェニル)-5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール(123mg、0.345mmol)の7N NH3 メタノール溶液(10mL)を45℃で16時間攪拌する。溶媒を蒸発させ、残渣を調製用TLCプレート上のクロマトグラフィーにより、7N NH3 メタノール溶液を6%含むDCMで精製し、1-アミノ-3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(35mg)を白色の固体として得る;LC-MS:tR= 0.84 min, [M+1]+ = 374.14。
【0169】
c) 1-アミノ-3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(32mg、86μmol)の冷(0℃)DCM溶液(1mL)に、DIPEA(45mg、345μmol)、グリコール酸(13mg、172μmol)および最後にTBTU(33mg、101μmol)を添加する。混合物を室温で1時間攪拌した後、EAで希釈し、水で洗浄する。水相をEAで抽出する。合わせた有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物をアセトニトリルからの結晶化により精製し、N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド(7mg)を白色の固体として得る;LC-MS:tR= 0.95 min, [M+1]+ = 432.16。
【0170】
実施例14〜16
【0171】
【化45】

【0172】
以下の実施例は、表示された実施例から、実施例13と同様に製造される:
【0173】
【表2】

【0174】
実施例15
1H NMR(D6-DMSO):δ0.93 (t, J = 7.3 Hz, 3 H), 1.33-1.44 (m, 2 H), 1.63-1.72 (m, 2 H), 2.33 (s, 6 H), 2.93 (t, J = 7.5 Hz, 2 H), 3.20-3.30 (m, 1 H), 3.37-3.48 (m, 1 H), 3.69-3.80 (m, 2 H), 3.84 (d, J= 5.8 Hz, 2 H), 3.91-3.99 (m, 1 H), 5.30 (d, J = 5.3 Hz, 1 H), 5.56 (t, J = 5.8 Hz, 1 H), 7.12 (d, J = 3.8 Hz, 1 H), 7.69 (t, J = 6.0 Hz, 1 H), 7.72 (s, 2 H), 7.90 (d, J = 3.5 Hz, 1 H)。
【0175】
実施例16
1H NMR (D6-DMSO):δ0.92 (d, J = 6.4 Hz, 5 H), 1.83-2.00 (m, 1 H), 2.30 (s, 6 H), 2.78 (d, J = 7.0 Hz, 2 H), 3.14-3.27 (m, 2 H), 3.36-3.48 (m, 2 H), 3.65-3.78 (m, 2 H), 3.81 (d, J = 5.6 Hz, 2 H), 3.87-3.99 (m, 1 H), 5.26 (d, J = 5.0 Hz, 1 H), 5.52 (t, J = 5.6 Hz, 1 H), 7.07 (d, J = 3.5 Hz, 1 H), 7.66 (m, 3 H), 7.89 (d, J = 3.5 Hz, 1 H)。
【0176】
実施例17
【0177】
【化46】

【0178】
実施例2から、そして(R)-2-クロロメチル-オキシランをアルキル化試薬として用いて、(2R)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例13と同様に製造する;LC-MS:tR = 0.98 min, [M+1]+= 446.20。
【0179】
実施例18
【0180】
【化47】

【0181】
実施例2から、そして(S)-2-chloroメチル-オキシランをアルキル化試薬として用いて、(2S)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例13と同様に製造する;LC-MS:tR = 0.98 min, [M+1]+= 446.19, 1H NMR (CDCl3):δ1.04 (t, J = 7.3 Hz, 3 H), 1.72-1.84 (m, 2 H), 2.36 (s, 6 H), 2.89 (t, J = 7.5 Hz, 2 H), 3.19 (s br, 1H), 3.47-3.56 (m, 1 H), 3.60 (s br, 1 H), 3.73-3.92 (m, 3 H), 4.18 (s, 2 H), 6.90 (d, J = 3.8 Hz, 1 H), 7.12 (t, J = 5.8 Hz, 1 H), 7.78 (d, J = 3.8 Hz, 1 H), 7.80 (s, 2 H)。
【0182】
実施例19
【0183】
【化48】

【0184】
3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを用いて、2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノールを、実施例1と同様に製造する;LC-MS:tR = 1.16 min, [M+1]+= 343.02。
【0185】
実施例20
【0186】
【化49】

【0187】
実施例19から、N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例13と同様に製造する;LC-MS:tR = 1.01 min;1H NMR (CDCl3):δ0.99 (d, J = 6.7 Hz, 3 H), 1.29 (t, J = 7.6 Hz, 3 H), 1.90-2.05 (m, 1 H), 2.35 (s, 3 H), 2.57 (s br, 1H), 2.67-2.80 (m, 4 H), 3.23 (s br, 1H), 3.44-3.56 (m, 1 H), 3.72-3.92 (m, 3 H), 4.14-4.22 (m, 3H), 6.87 (d, J = 3.5 Hz, 1 H), 6.97 (t br, 1 H), 7.78 (d, J = 3.8 Hz, 1 H), 7.82 (s, 1H), 7.84 (s, 1H)。
【0188】
実施例21
【0189】
【化50】

【0190】
a) 5-イソブチル-チオフェン-2-カルボン酸(830mg、4.51mmol)およびDIPEA(680mg、5.27mmol)のDCM溶液(20mL)に、室温でTBTU(1.59g、4.96mmol)を添加する。混合物を室温で45分攪拌した後、4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジド(993mg、4.50mmol)を添加する。攪拌を2時間継続する。混合物をエーテル(200mL)で希釈し、1M HCl水溶液(3x50mL)、1M NaOH水溶液(3x50 mL)および食塩水(50mL)で洗浄する。有機抽出物をMgSO4で乾燥し、ろ過し、蒸発して、粗製4-アリルオキシ-3,5-ジメチル-安息香酸N'-(5-イソブチル-チオフェン-2-カルボニル)-ヒドラジド(1.40g)を、ゆっくりと固体化する黄色の油状物質として得る;LC-MS:tR = 1.02 min, [M+1]+= 387.10。
【0191】
b) 4-アリルオキシ-3,5-ジメチル-安息香酸 N'-(5-イソブチル-チオフェン-2-カルボニル)-ヒドラジド(1.40g、3.62mmol)およびBurgess試薬(1.12g、4.71mmol)のTHF溶液(15mL)を、110℃で3分、マイクロ波照射下で攪拌する。混合物をジエチルエーテルで希釈し、水で洗浄し、MgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を、ヘプタン:EA、9:1で溶出するシリカゲル上のCCにより精製し、2-(4-アリルオキシ-3,5-ジメチル-フェニル)-5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール(1.02g)を、無色の油状物質として得る;LC-MS:tR = 1.21 min, [M+1]+ = 369.15。
【0192】
c) 2-(4-アリルオキシ-3,5-ジメチル-フェニル)-5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール (1.02g、2.77mmol)のアセトン(24mL)および水(2.4mL)の溶液に、NMO(1.85g、13.7mmol)およびOsO4(128mg、13μmol、2.5%のブタノール溶液として)を、室温で添加する。混合物を室温で16時間攪拌した後、水(50mL)で希釈し、EA(2x100mL)で抽出する。合わせた有機抽出物をNa2SO4で乾燥し、ろ過し、蒸発させる。粗生成物をEAで溶出するシリカゲル上のCCにより精製し、3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール (680mg)を、無色の油状物質として得る;LC-MS:tR = 0.99 min, [M+1]+= 403.14。
【0193】
実施例22
【0194】
【化51】

【0195】
a) 3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール(627mg、1.56mmol)およびDIPEA(311mg、2.41mmol)のDCM溶液(10mL)に、メタンスルホン酸クロライド(207mg、1.81mmol)を添加する。混合物を室温で攪拌した後、別量のDIPEA(40mg、0.31mmol)およびメタンスルホン酸クロライド(36mg、0.31mmol)を添加する。攪拌を1時間継続した後、水の添加により反応をクエンチする。混合物をDCMで抽出する。有機抽出物を水で洗浄し、MgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を、ヘプタン:EA、7:3で溶出するシリカゲル上のCCにより精製し、メタンスルホン酸 2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル エステル(220mg)を、無色の油状物質として得る;LC-MS:tR = 1.08 min, [M+1]+= 481.09。
【0196】
b) メタンスルホン酸 2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル エステル(220mg、0.458mmol)のTHF(10mL)およびメタノール中7N NH3溶液(10mL)を65℃で15時間攪拌する。溶媒を蒸発させ、残渣を調製用TLCプレート上のクロマトグラフィーにより、7N NH3 メタノール溶液を6%含むDCMで精製し、1-アミノ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(110mg)を、黄色の油状物質として得る;LC-MS:tR = 0.83 min, [M+1]+= 402.48。
【0197】
c) 1-アミノ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(109mg、271μmol)のDCM溶液(10mL)に、0℃にて、DIPEA(140mg、1.086mmol)およびグリコール酸(41mg、543μmol)を添加した後、TBTU(102mg,、319μmol)を添加する。混合物を室温で1時間攪拌した後、EAで希釈し、水で洗浄する。水相を分離し、もう一度EAで抽出する。合わせた有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させる。粗生成物を調製用TLCプレート上のクロマトグラフィーにより、7N NH3 メタノール溶液を4%含むDCMで精製し、2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド(31mg)を、白色の固体として得る;LC-MS:tR = 0.94 min, [M+1]+= 460.51。
【0198】
実施例23
【0199】
【化52】

【0200】
1-(5-イソブチル-チオフェン-2-イル)-エタノン(336mg、1.84mmol)および3,5-ジメチル-4-ヒドロキシ-ベンズアルデヒド(277mg、1.84mmol)のEtOH溶液(6mL)に、5N HCl、イソプロパノール溶液(2.5mL)を添加する。暗色の溶液を室温で6時間攪拌した後、溶媒を真空下で除去する。残渣をEA(80mL)中に溶解し、飽和NaHCO3水溶液(25mL)および食塩水で洗浄する。洗浄物をEAで抽出する。合わせた有機抽出物をMgSO4で乾燥し、ろ過し、蒸発させて、3-(4-ヒドロキシ-3,5-ジメチル-フェニル)-1-(5-イソブチル-チオフェン-2-イル)-プロペノン(682mg)を、黄色粉末として得る;LC-MS:tR = 1.10 min, [M+1]+ = 315.15。
【0201】
実施例24
【0202】
【化53】

【0203】
3-(4-ヒドロキシ-3,5-ジメチル-フェニル)-1-(5-イソブチル-チオフェン-2-イル)-プロペノン(660mg)のTHF(10mL)およびEtOH(5mL)溶液に、Pd/C(150mg、10%Pd)を添加し、懸濁液を、5barのH2下、室温で23時間攪拌する。別量のPd/C(150mg)を添加し、攪拌を、5barのH2下、室温で8時間継続する。触媒をろ過除去し、濾液を蒸発させ、3-(4-ヒドロキシ-3,5-ジメチル-フェニル)-1-(5-イソブチル-チオフェン-2-イル)-プロパン-1-オン(554mg)を、オレンジ色の油状物質として得る;LC-MS:tR = 1.10 min, [M+1]+= 317.04。
【0204】
実施例25
【0205】
【化54】

【0206】
実施例24から、実施例13と同様に、2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[3-(5-イソブチル-チオフェン-2-イル)-3-oxo-プロピル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを製造する;LC-MS:tR= 0.97 min, [M+1]+ = 448.21。
【0207】
実施例26
【0208】
【化55】

【0209】
5-プロピル-チオフェン-2-カルボン酸および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンから、実施例1と同様に、2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノールを製造する;LC-MS:tR = 1.12 min, [M+1]+ = 329.14。
【0210】
実施例27
【0211】
【化56】

【0212】
実施例26から、実施例13と同様に、(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR=0.95 min, [M+1]+ = 460.15。
【0213】
実施例28
【0214】
【化57】

【0215】
実施例26から、実施例13と同様に、(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.95 min, [M+1]+ = 460.13。
【0216】
実施例29
【0217】
【化58】

【0218】
5-イソブチル-チオフェン-2-カルボン酸を4-ベンジルオキシ-3,5-ジメチル-安息香酸 ヒドラジドとカップリングおよび環化することにより、実施例21のステップa)およびb)と同様に、2-(4-ベンジルオキシ-3,5-ジメチル-フェニル)-5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾールを製造する、LC-MS:tR = 1.06 min, [M+1]+= 437.17。この化合物(2.83g、6.75mmol)のEtOH(50mL)およびTHF(50mL)溶液に、Pd/C(10%Pd、400mg)を添加し、スラリーを、5barのH2の下、室温で48時間攪拌する。混合物をろ過し、濾液を濃縮して、粗生成物をヘプタン:EA、8:25で溶出するシリカゲル上のCCにより精製し、4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノール(943mg)を、白色粉末として得る;LC-MS:tR = 1.09 min, [M+1]+ = 329.36。
【0219】
実施例30
【0220】
【化59】

【0221】
4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノールから、2-ヒドロキシ-N-((2R)-2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを、実施例13と同様に製造する;LC-MS:tR= 0.95min, [M+1]+ = 460.18。
【0222】
実施例31
【0223】
【化60】

【0224】
4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノールから、実施例13と同様に、2-ヒドロキシ-N-((2S)-2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを製造する;LC-MS:tR= 0.95min, [M+1]+ = 460.18, 1H NMR δ0.99 (d, J= 6.5 Hz, 6 H), 1.90-2.01 (m, 1 H), 2.31 (s, 6 H), 2.75 (d, J = 7.0 Hz, 2 H), 3.46-3.54 (m, 1 H), 3.73-3.91 (m, 3 H), 4.15-4.23 (m, 3 H), 4.26 (s br, 1 H), 4.45 (s br, 1 H), 6.84 (d, J = 3.3 Hz, 1 H), 7.42 (t br, J = 5.5 Hz, 1 H), 7.64 (d, J = 3.5 Hz, 1 H), 7.68 (s, 2 H)。
【0225】
実施例32
【0226】
【化61】

【0227】
4-ベンジルオキシ-3-エチル-5-メチル-安息香酸 ヒドラジドおよび5-プロピル-チオフェン-2-カルボン酸から、実施例29と同様に、2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノールを製造する;LC-MS:tR= 0.99min, [M+1]+ = 329.13。
【0228】
実施例33
【0229】
【化62】

【0230】
実施例32から、実施例13と同様に、N-((2R)-3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.85min, [M+1]+ = 460.08。
【0231】
実施例34
【0232】
【化63】

【0233】
実施例32から、実施例13と同様に、N-((2S)-3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.85min, [M+1]+ = 460.08。
【0234】
実施例35
【0235】
【化64】

【0236】
5-イソブチル-チオフェン-2-カルボン酸および4-ベンジルオキシ-3-エチル-5-メチル-安息香酸 ヒドラジドから、実施例29と同様に、2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノールを製造する;LC-MS:tR= 1.03min, [M+1]+ = 343.22。
【0237】
実施例36
【0238】
【化65】

【0239】
実施例35から、実施例13と同様に、N-((2R)-3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.91min, [M+1]+ = 474.18。
【0240】
実施例37
【0241】
【化66】

【0242】
実施例35から、実施例13と同様に、N-((2S)-3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 0.91min, [M+1]+ = 474.17。
【0243】
実施例38
【0244】
【化67】

【0245】
4-メチル-5-(2-メチル-プロペニル)-チオフェン-2-カルボン酸および4-ベンジルオキシ-3-エチル-5-メチル-安息香酸 ヒドラジドから、実施例29と同様に、2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノールを製造する;LC-MS:tR = 1.13 min, [M+1]+= 357.49。
【0246】
実施例39
【0247】
【化68】

【0248】
実施例38から、実施例5と同様に、(2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、白色の固体として得る;LC-MS:tR= 1.05min;[M+1]+ = 431.13;1H NMR (CDCl3):δ1.01 (d, J = 6.8 Hz, 6 H), 1.31 (t, J = 7.5 Hz, 3 H), 1.91-2.02 (m, 1 H), 2.22 (s, 3 H), 2.39 (s, 3 H), 2.68 (d, J= 7.0 Hz, 2 H), 2.75 (q, J = 7.3 Hz, 2 H), 3.82-3.97 (m, 4 H), 4.14-4.22 (m, 1 H), 7.55 (s, 1 H), 7.78 (s, 1 H), 7.80 (s, 1 H)。
【0249】
実施例40
【0250】
【化69】

【0251】
実施例38から、実施例5と同様に、(2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、白色の固体として得る;LC-MS:tR= 1.05min, [M+1]+ = 431.14。
実施例41
【0252】
【化70】

【0253】
実施例38から、実施例13と同様に、N-((2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 1.00min, [M+1]+ = 488.19。
【0254】
実施例42
【0255】
【化71】

【0256】
実施例38から、実施例13と同様に、N-((2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを製造する;LC-MS:tR= 1.00min;[M+1]+ = 488.17; 1H NMR δ1.00 (d, J= 6.5 Hz, 6 H), 1.27 (t, J = 7.5 Hz, 3 H), 1.90-2.01 (m, 1 H), 2.21 (s, 3 H), 2.34 (s, 3 H), 2.67 (d, J = 7.3 Hz, 2 H), 2.71 (q, J = 7.5 Hz, 2H), 3.46-3.56 (m, 1 H), 3.75-3.91 (m, 3 H), 4.08 (s br, 2 H), 4.20 (s, 3 H), 7.33 (t br, J = 5.5 Hz, 1 H), 7.54 (s, 1 H), 7.72 (s, 1 H), 7.74 (s, 1 H)。
【0257】
実施例43:EC50値を決定するためのGTPγS結合アッセイ法
GTPγS結合アッセイ法は、96ウェルマイクロタイタープレート(Nunc, 442587)で、組換えヒトS1P1受容体を発現するCHO細胞の膜標品を用いて200μlの最終体積で行った。アッセイ条件は、20mM Hepes(Fluka, 54461)、100mM NaCl(Fluka, 71378)、5mM MgCl2(Fluka, 63064)、0.1%のBSA(Calbiochem, 126609)、1μM GDP(Sigma, G-7127)、2.5%のDMSO(Fluka, 41644)、50pMの35S-GTPγS(Amersham Biosciences, SJ1320)である。pHは、7.4である。試験化合物を溶解して、100%のDMSOに希釈し、35S-GTPγSの非存在下で150μlの上記アッセイ緩衝液中で室温にて30分間プレインキュベートする。50μlの、35S-GTPγSの添加後、アッセイを室温にて1時間インキュベートする。アッセイをPackard Biosciencesからのセル‐ハーベスターを使用して反応混合物をMultiscreenプレート(Millipore, MAHFC1H60)に移すことによって終結させて、プレートを氷冷10mM Na2HPO4/NaH2PO4(70%/30%)で洗浄して、乾燥させ、底面を封着して、25μlのMicroScint20(Packard Biosciences, order no. 6013621)を添加後に、上部を封着する。膜結合型の35S-GTPγSをPackard BiosciencesからのTopCountで測定する。
EC50は、最大の特異的35S-GTPγS結合の50%を誘導するアゴニストの濃度である。特異的結合は、非特異的結合を最大結合から減算することによって決定する。最大結合は、10μMのS1Pの存在下においてMultiscreenプレートに結合したcpmの量である。非特異的結合は、アッセイにおけるアゴニストの非存在下での結合の量である。
【0258】
表1は、本実施例のいくつかの化合物のEC50値を示す。EC50値は、上記方法に従って決定した。
表1:
【0259】
【表3】

【0260】
実施例44:インビボでの有効性の評価
式(I)の化合物の有効性は、正常圧の雄ウィスターラットに対する3〜30mg/kgの式(I)の化合物の経口投与後に、循環リンパ球を測定することによって評価する。動物は、12時間-光/暗闇サイクルで気候制御条件に収容して、通常のラット固形飼料および飲料水の自由な摂取をさせた。血液は、薬物投与前、並びに後の3、6および24時間に収集する。全血をAdvia Hematologyシステム(Bayer Diagnostics, Zurich, Switzerland)を使用する血液検査に供する。
【0261】
すべてのデータは、平均±SEMとして示してある。統計分析は、多重比較のためにStatistica(StatSoft)およびStudent-Newman-Keuls法を使用して分散分析(分散分析)によって行う。帰無仮説は、p<0.05のときに拒絶する。
一例として、表2には、媒体だけで処理した一群の動物と比較して、正常圧の雄ウィスターラットに対する本発明の化合物の10mg/kgの経口投与の6時間後におけるリンパ球カウントに対する効果を示す。
【0262】
表2:
【0263】
【表4】

【特許請求の範囲】
【請求項1】
式(I)の化合物、およびこのような化合物の塩:
【化1】

式中
Aは*-CO-CH2CH2-、*-CO-CH=CH-、
【化2】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し;
R1はC2-5アルキルを表し;
R2は、水素、メチルまたはエチルを表し;
R3は、水素、C1-4アルキル、C1-4アルコキシまたはハロゲンを表し;
R4は、水素、C1-4アルキル、C1-4アルコキシ、ハロゲン、トリフルオロメチルまたはトリフルオロメトキシを表し;
R5は、水素、ヒドロキシ-C1-5アルキル、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ- C1-4アルキル)-C1-4 アルキル、-CH2-(CH2)n-NHSO2R51、-(CH2)nCH(OH)-CH2-NHSO2R51、-CH2-(CH2)n-NHCOR52、-(CH2)nCH(OH)-CH2-NHCOR52、-CH2-(CH2)n-CONR53R54、-CONHR53、1-(3-カルボキシ-アゼチジニル)-2-アセチル、1-(2-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-アゼチジニル)-3-プロピオニル、1-(2-カルボキシ-ピロリジニル)-3-プロピオニル、1-(3-カルボキシ-ピロリジニル)-3-プロピオニル、ヒドロキシ、C1-5アルコキシ、ヒドロキシ-C2-5 アルコキシ、ジ-(ヒドロキシ- C1-4 アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHSO2R51、-OCH2-CH(OH)-CH2-NHSO2R51、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表し;
R51は、C1-3アルキル、メチルアミノ、エチルアミノまたはジメチルアミノを表し;
R52は、ヒドロキシメチル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチルまたは2,3-ジヒドロキシプロピルを表し;
R53は、水素、C1-3アルキル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチル、2,3-ジヒドロキシプロピル、カルボキシメチル、1-(C1-5アルキルカルボキシ)メチル、2-カルボキシエチルまたは2-(C1-5アルキルカルボキシ)エチルを表し;
R54は、水素またはメチルを表し;
mは、1または2の整数を表し;
nは、0、1または2を表し;そして
R6は、水素、C1-4アルキルまたはハロゲンを表す。
【請求項2】
Aが、
【化3】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項3】
Aが、
【化4】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項4】
Aが、
【化5】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項5】
Aが、
【化6】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項6】
Aが、
【化7】

を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項7】
R1がn-プロピルまたはイソ-ブチルを表す、請求項1〜6のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項8】
R2が水素またはメチルを表す、請求項1〜7のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項9】
R2が水素を表す、請求項1〜7のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項10】
R3がメトキシを表し、R4およびR6が水素を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項11】
R3が水素を表し、R4がメチル、エチルまたはメトキシを表し、R6がメチル、エチルまたはハロゲンを表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項12】
R3が水素を表し、R4およびR6がメチル基を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項13】
R3が水素を表し、R4がメチル基を表し、R6がエチル基を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項14】
R3が水素を表し、R4がメトキシ基を表し、R6が塩素原子を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項15】
R3が水素を表し、R4がメチル基を表し、R6が塩素原子を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項16】
R5が2,3-ジヒドロキシプロピル、-CH2-(CH2)n-NHCOR52、-(CH2)nCH(OH)-CH2-NHCOR52、ヒドロキシ、ヒドロキシ-C2-5-アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表す、請求項1〜15のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項17】
R5がヒドロキシ、ヒドロキシ-C2-5-アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4-アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表す、請求項1〜15のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項18】
R5が3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表す、請求項1〜15のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項19】
R5が2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し、R52がヒドロキシメチルを表す、請求項1〜15のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項20】
Aが、
【化8】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し、R1がn-プロピルまたはイソ-ブチルを表し、R2が水素を表し、R3が水素またはメトキシを表し、R4が水素、メチル、エチルまたはメトキシを表し、R5が3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し、R6が水素、メチル、エチルまたは塩素を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項21】
以下からなる群より選択される請求項1に記載の化合物:
(2R)-N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(2S)-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(2R)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
(2S)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
(2R)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2-エチル-6-メチル-フェノキシ}-プロピル)-アセタミドおよび
(2S)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2-エチル-6-メチル-フェノキシ}-プロピル)-アセタミド、
並びにこれらの化合物の塩。
【請求項22】
以下からなる群より選択される請求項1に記載の化合物:
2-ヒドロキシ-N-((2S)-2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-((2S)-3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、および
N-((2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド
並びにこれらの化合物の塩。
【請求項23】
請求項1〜22のいずれか1項に記載の化合物またはこのような化合物の薬学的に許容される塩、および薬学的に許容される担体とを含む医薬組成物。
【請求項24】
医薬として使用するための、請求項1〜22のいずれか1項に記載の化合物、若しくはこのような化合物の薬学的に許容される塩、または請求項23に記載の医薬組成物。
【請求項25】
活性化された免疫系と関連する疾患もしくは障害の予防または治療のための医薬組成物の製造のための、請求項1〜22のいずれか1項に記載の化合物、またはこのような化合物の薬学的に許容される塩の使用。
【請求項26】
腎臓、肝臓、心臓、肺、膵臓、角膜および皮膚等の移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、クローン病および潰瘍性大腸炎等の炎症性腸疾患、乾癬、乾癬性関節炎、橋本甲状腺炎等の甲状腺炎、ブドウ膜網膜炎を含む自己免疫症候群;鼻炎、結膜炎、皮膚炎等のアトピー性疾患;喘息;I型糖尿病;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;固形癌および腫瘍転移からなる群より選択される疾患もしくは障害の予防または治療のための、請求項25に記載の使用。
【請求項27】
活性化された免疫系と関連する疾患もしくは障害の予防または治療のための、免疫抑制薬、副腎皮質ステロイド、NSAID、細胞障害性の薬剤、接着分子阻害剤、サイトカイン、サイトカイン阻害剤、サイトカイン受容体アンタゴニストおよび組換えサイトカイン受容体からなる群より選択される1つまたはいくつかの薬剤と組み合わせて使用するための医薬組成物の製造のための請求項1〜22のいずれか1項に記載の化合物、またはこのような化合物の薬学的に許容される塩の使用。
【請求項1】
式(I)の化合物、およびこのような化合物の塩:
【化1】

式中
Aは*-CO-CH2CH2-、*-CO-CH=CH-、
【化2】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し;
R1はC2-5アルキルを表し;
R2は、水素、メチルまたはエチルを表し;
R3は、水素、C1-4アルキル、C1-4アルコキシまたはハロゲンを表し;
R4は、水素、C1-4アルキル、C1-4アルコキシ、ハロゲン、トリフルオロメチルまたはトリフルオロメトキシを表し;
R5は、水素、ヒドロキシ-C1-5アルキル、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ- C1-4アルキル)-C1-4 アルキル、-CH2-(CH2)n-NHSO2R51、-(CH2)nCH(OH)-CH2-NHSO2R51、-CH2-(CH2)n-NHCOR52、-(CH2)nCH(OH)-CH2-NHCOR52、-CH2-(CH2)n-CONR53R54、-CONHR53、1-(3-カルボキシ-アゼチジニル)-2-アセチル、1-(2-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-アゼチジニル)-3-プロピオニル、1-(2-カルボキシ-ピロリジニル)-3-プロピオニル、1-(3-カルボキシ-ピロリジニル)-3-プロピオニル、ヒドロキシ、C1-5アルコキシ、ヒドロキシ-C2-5 アルコキシ、ジ-(ヒドロキシ- C1-4 アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHSO2R51、-OCH2-CH(OH)-CH2-NHSO2R51、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表し;
R51は、C1-3アルキル、メチルアミノ、エチルアミノまたはジメチルアミノを表し;
R52は、ヒドロキシメチル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチルまたは2,3-ジヒドロキシプロピルを表し;
R53は、水素、C1-3アルキル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチル、2,3-ジヒドロキシプロピル、カルボキシメチル、1-(C1-5アルキルカルボキシ)メチル、2-カルボキシエチルまたは2-(C1-5アルキルカルボキシ)エチルを表し;
R54は、水素またはメチルを表し;
mは、1または2の整数を表し;
nは、0、1または2を表し;そして
R6は、水素、C1-4アルキルまたはハロゲンを表す。
【請求項2】
Aが、
【化3】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項3】
Aが、
【化4】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項4】
Aが、
【化5】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項5】
Aが、
【化6】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項6】
Aが、
【化7】

を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項7】
R1がn-プロピルまたはイソ-ブチルを表す、請求項1〜6のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項8】
R2が水素またはメチルを表す、請求項1〜7のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項9】
R2が水素を表す、請求項1〜7のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項10】
R3がメトキシを表し、R4およびR6が水素を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項11】
R3が水素を表し、R4がメチル、エチルまたはメトキシを表し、R6がメチル、エチルまたはハロゲンを表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項12】
R3が水素を表し、R4およびR6がメチル基を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項13】
R3が水素を表し、R4がメチル基を表し、R6がエチル基を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項14】
R3が水素を表し、R4がメトキシ基を表し、R6が塩素原子を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項15】
R3が水素を表し、R4がメチル基を表し、R6が塩素原子を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項16】
R5が2,3-ジヒドロキシプロピル、-CH2-(CH2)n-NHCOR52、-(CH2)nCH(OH)-CH2-NHCOR52、ヒドロキシ、ヒドロキシ-C2-5-アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表す、請求項1〜15のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項17】
R5がヒドロキシ、ヒドロキシ-C2-5-アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4-アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NHCOR52または-OCH2-CH(OH)-CH2-NHCOR52を表す、請求項1〜15のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項18】
R5が3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表す、請求項1〜15のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項19】
R5が2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し、R52がヒドロキシメチルを表す、請求項1〜15のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項20】
Aが、
【化8】

(アスタリスクは式(I)のチオフェン基に結合される結合を表す。)を表し、R1がn-プロピルまたはイソ-ブチルを表し、R2が水素を表し、R3が水素またはメトキシを表し、R4が水素、メチル、エチルまたはメトキシを表し、R5が3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR52を表し、R6が水素、メチル、エチルまたは塩素を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項21】
以下からなる群より選択される請求項1に記載の化合物:
(2R)-N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{4-[5-(5-エチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-ブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2,6-ジメチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2S)-N-(3-{2-エチル-4-[5-(5-イソブチル-チオフェン-2-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(2S)-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(2R)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
(2S)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
(2R)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2-エチル-6-メチル-フェノキシ}-プロピル)-アセタミドおよび
(2S)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2-エチル-6-メチル-フェノキシ}-プロピル)-アセタミド、
並びにこれらの化合物の塩。
【請求項22】
以下からなる群より選択される請求項1に記載の化合物:
2-ヒドロキシ-N-((2S)-2-ヒドロキシ-3-{4-[5-(5-イソブチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-((2S)-3-{2-エチル-6-メチル-4-[5-(5-プロピル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((2R)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、および
N-((2S)-3-{2-エチル-4-[5-(5-イソブチル-4-メチル-チオフェン-2-イル)-[1,3,4]オキサジアゾール-2-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド
並びにこれらの化合物の塩。
【請求項23】
請求項1〜22のいずれか1項に記載の化合物またはこのような化合物の薬学的に許容される塩、および薬学的に許容される担体とを含む医薬組成物。
【請求項24】
医薬として使用するための、請求項1〜22のいずれか1項に記載の化合物、若しくはこのような化合物の薬学的に許容される塩、または請求項23に記載の医薬組成物。
【請求項25】
活性化された免疫系と関連する疾患もしくは障害の予防または治療のための医薬組成物の製造のための、請求項1〜22のいずれか1項に記載の化合物、またはこのような化合物の薬学的に許容される塩の使用。
【請求項26】
腎臓、肝臓、心臓、肺、膵臓、角膜および皮膚等の移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、クローン病および潰瘍性大腸炎等の炎症性腸疾患、乾癬、乾癬性関節炎、橋本甲状腺炎等の甲状腺炎、ブドウ膜網膜炎を含む自己免疫症候群;鼻炎、結膜炎、皮膚炎等のアトピー性疾患;喘息;I型糖尿病;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;固形癌および腫瘍転移からなる群より選択される疾患もしくは障害の予防または治療のための、請求項25に記載の使用。
【請求項27】
活性化された免疫系と関連する疾患もしくは障害の予防または治療のための、免疫抑制薬、副腎皮質ステロイド、NSAID、細胞障害性の薬剤、接着分子阻害剤、サイトカイン、サイトカイン阻害剤、サイトカイン受容体アンタゴニストおよび組換えサイトカイン受容体からなる群より選択される1つまたはいくつかの薬剤と組み合わせて使用するための医薬組成物の製造のための請求項1〜22のいずれか1項に記載の化合物、またはこのような化合物の薬学的に許容される塩の使用。
【公表番号】特表2010−502693(P2010−502693A)
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願番号】特願2009−527231(P2009−527231)
【出願日】平成19年7月10日(2007.7.10)
【国際出願番号】PCT/IB2007/052742
【国際公開番号】WO2008/029306
【国際公開日】平成20年3月13日(2008.3.13)
【出願人】(500226786)アクテリオン ファーマシューティカルズ リミテッド (151)
【氏名又は名称原語表記】Actelion Pharmaceuticals Ltd
【住所又は居所原語表記】Gewerbestrass 16,CH−4123 Allschwil,Switzerland
【Fターム(参考)】
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願日】平成19年7月10日(2007.7.10)
【国際出願番号】PCT/IB2007/052742
【国際公開番号】WO2008/029306
【国際公開日】平成20年3月13日(2008.3.13)
【出願人】(500226786)アクテリオン ファーマシューティカルズ リミテッド (151)
【氏名又は名称原語表記】Actelion Pharmaceuticals Ltd
【住所又は居所原語表記】Gewerbestrass 16,CH−4123 Allschwil,Switzerland
【Fターム(参考)】
[ Back to top ]

