新規ピシウム菌
【課題】ピシウム・ウルティマムのような病原性を有するピシウム属菌に対して拮抗性を有する新規なピシウム・ナンの提供。
【解決手段】rDNAの5.8Sを含むITS領域に特定の塩基配列を有する、ピシウム・ナン。ピシウム・ウルティマムのような病原性を有するピシウム属菌に対して拮抗性を有する、ピシウム・ナン。該菌をピシウム・ウルティマムなどの病原性菌が生息する土壌に散布して、立枯病などの植物病害を防除する。
【解決手段】rDNAの5.8Sを含むITS領域に特定の塩基配列を有する、ピシウム・ナン。ピシウム・ウルティマムのような病原性を有するピシウム属菌に対して拮抗性を有する、ピシウム・ナン。該菌をピシウム・ウルティマムなどの病原性菌が生息する土壌に散布して、立枯病などの植物病害を防除する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は新規ピシウム菌に関する。より具体的には苗立枯病を引き起こす植物病原菌(Pythium ultimum)に対して拮抗性を示す新規ピシウム菌に関する。
【背景技術】
【0002】
ピシウム属菌は世界各地の土壌や水域環境に広く分布し、これまで世界で150種以上、日本では約50種が報告されている。ピシウム属菌の多くの種は、野菜をはじめ多くの作物の苗立枯れや根腐れを引き起こす重要な植物病原菌として知られている。このような植物病原菌として、ピシウム・ウルティマム(Pythium ultimum)やピシウム・アファニデルマータム(Pythium aphanidermatum)が挙げられる。
【0003】
上記植物病原性のピシウム属菌に対して拮抗性を示す細菌又は放線菌を利用して植物病の発生を抑制しようとすることが試みられている。例えば、特許文献1には、ストレプトミセス・ヘイミ(Streptomyces heimi)やストレプトミセス・フラベオラス(Streptomyces flaveolus)がピシウム・アファニデルマータムに対して拮抗性を示し、芝草病原菌の防除に有効であることが示されている。また、特許文献2(特開平8−322556号公報)には、シュードモナス・フルオレッセンス(Psedomonas fluorescens)がピシウム・アファニデルマータムやリゾクトニア・ソラニ(Rhizoctonia solani)などに対し拮抗性を示し、これらの湿菌体を芝草に直接散布するか、あるいは菌体をバーミキュライトやゼオライトなどに吸着させた吸着剤や堆肥原料に混ぜて得られた堆肥などを芝草に施し、植物病害防除材として使用できる旨が記載されている。
【0004】
上記の病原性ピシウム属菌に対して拮抗性を有するピシウム属菌の存在も知られている。例えば、非特許文献1には、ピシウム・オリガンドラム(Pythium oligandrum)がトマト根茎の腐敗病菌に対して拮抗性を示すことが記載されている。また、特許文献3には、ピシウム・オリガンドラムの細胞壁由来のタンパク質が多くの作物の根圏に定着して、作物に耐病性を誘導する能力を発揮することが記載されている。また、非特許文献2には、ピシウム・ナン(Pythium nunn)がピシウム・ウルティマムによる病害を抑制することが、非特許文献3には、ピシウム・ナンがフィトフトラ属菌(Phytophthora spp.)による病害を、非特許文献4には同菌がリゾクトニア属菌(Rhizoctonia solani)による病害をそれぞれ抑制することが記載されている。
【0005】
ところで、ピシウム属菌をはじめとする真菌類は、細胞の形態で分類されることが多い。例えば、ピシウム属菌が属する卵菌類においては、蔵卵器、卵胞子、造精器、遊走子嚢等の有無やそれらの形態によって分類されていた。しかしながら、こうした形態による分類には豊富な知識と熟練した技術が必要で、菌種の分類・同定に必要な特徴的な形質が現れない場合には分類・同定ができないし、培養に日数がかかるために分類・同定に長期間要することなどの理由により、近年では遺伝子解析により分類・同定することが試みられている。例えば、非特許文献5にはDNA塩基配列の解析により病原性真菌の分類・同定ができることが記載されている。これによると、rDNA(リボソーマルDNA)のITS領域(Internal Transcribed Spacer領域)の塩基配列は、同一種内では99%以上の同一性があり、それ未満であれば別種であるとされるので、ピシウム属菌の種の分類・同定においてはITS領域及びrDNAのLSU(Large Subunit、26〜28S)にあるD1/D2領域の塩基配列の解析で十分であると結論づけられている。また、非特許文献6には、ピシウム属菌について、rDNAのITS領域とミトコンドリアのクロームオキシダーゼII遺伝子の多型性に基づく分類・同定と上記細胞の形態に基づく分類が比較され、分類・同定には形態学的特徴だけでなく、遺伝子レベルの多型性分析が必要であると結論づけられている。さらに、非特許文献7では、ピシウム属菌について、rDNA(リボソーマルDNA)のITS領域とD1/D2領域の塩基配列から分子系統解析を行い、形態学的分類との対比が試みられ結果、新たな系統群が見いだされている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平6−107512号公報
【特許文献2】特開平8−322556号公報
【特許文献3】特開2003−81998号
【非特許文献】
【0007】
【非特許文献1】Takenaka S et al., Phytopathology, 98(2008), p.187-195
【非特許文献2】Paulitz TC et al., Phytopathology, 77(1987), p.335-340
【非特許文献3】Fang JG et al., Phytopathology, 85(1995), p.29-36
【非特許文献4】Lifshitz et l., Phytopathology, 74(1984), p.1054-1061
【非特許文献5】杉田ら,Jpn. J. Med. Mycol., 45(2004), p55-58
【非特許文献6】Kajihara Y et al., Jpn. J. Phytopathol., 69(1), 2003, p.63
【非特許文献7】埋橋ら,日本菌学会大会公演要旨集,2008,133頁
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明者らは、国内土壌中から分離した非病原性ピシウム菌について研究を進める中で、当該ピシウム菌が病原性のピシウム菌に対して拮抗作用を示すと共に、当該ピシウム菌が形態学的にはピシウム・ナンと同定されるにもかかわらず、詳細な遺伝子解析の結果からピシウム・ナンの標準菌とは異なる変種であることを見出した。
【0009】
すなわち、本発明は病原性ピシウム菌に対して拮抗性を有する新規なピシウム菌を提供し、当該ピシウム菌を用いて苗立枯病に代表される各種植物病害を防除することを目的としている。
【課題を解決するための手段】
【0010】
本発明のピシウム菌はrDNAのITS領域の塩基配列が配列番号1に示す塩基配列と同一性が99%以上である新規なピシウム菌であり、本発明においては当該ピシウム菌を土壌に散布する等の方法により、苗立枯病の原因菌であるピシウム・ウルティマムなどで汚染された土壌中でこれらの病原性ピシウム菌による植物病害の防除を図る。
【発明の効果】
【0011】
本発明によると農薬などの化学物質による防除が困難な苗立枯病など植物病害の防除が図られる。
【図面の簡単な説明】
【0012】
【図1】図1は分離されたピシウム・ナンの形態学的特性を示す顕微鏡観察による画像である。a〜gはUZ041株を、h〜kはUZ415株を示す。aは発芽管を有する胞子嚢、bは遊走子を持つ小胞、cは遊走子を放出した後の空の胞子嚢、dは菌糸の中間にある球状の隆起、eは突起を有する造卵器と膨らんだ柄を持つ造精器、fは3個の造精器を有する頂生の造卵器、gは鈎状の柄を持つ造精器を有する造卵器、hは菌糸の中間にある球状の無性繁殖器官、iは菌糸の終端にある球状の無性繁殖器官、jは膨らんだ柄を持つ造精器を持った頂生の造卵器、kは一つの突起を有し、鈎状の柄を持つ雌雄同株性の造精器と造卵器である。
【図2】図2は分離されたピシウム・ナンUZ041株及UZ415株の生育速度と生育温度との関係を示す図である。
【図3】図3はピシウム・ナンにおけるITS領域の塩基配列に基づく系統樹である。
【図4】図4a、bはそれぞれ分離されたピシウム・ナン(UZ415株)とピシウム・ウルティマムの間における菌間寄生性を示す顕微鏡観察による画像である。PUはピシウム・ウルティマムを、PNはピシウム・ナンを示す。
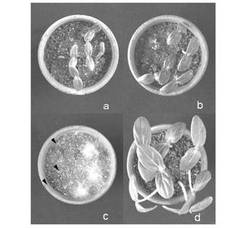
【図5】図5は分離されたピシウム・ナンUZ041株及びUZ415株によるキュウリ立枯病の防除効果を示す画像である。aはUZ041株を、bはUZ415株を、cはピシウム・ウルティマムのみを、dはピシウム・ウルティマムを感染させないコントロールを示す。
【図6】図6は土壌におけるピシウム・ナンUZ415株の菌密度変化を示す図であって、実線は緑肥を用いた場合を、破線は緑肥を用いない場合を示す。
【発明を実施するための形態】
【0013】
本発明のピシウム菌は新規のピシウム菌であって、rDNAのITS領域に配列番号1で示される塩基配列と同一性が99%以上である塩基配列を有する。ここにおいて、ITS領域とは、rRNA遺伝子の5.8Sサブユニットを含む領域であり、rRNA遺伝子の18Sサブユニットと5.8Sサブユニットの間に存在するイントロン領域(ITS1)と5.8Sサブユニットと26Sサブユニットの間に存在するイントロン領域(ITS2)及び5.8Sサブユニットを合わせた塩基配列(DNA)を意味する。なお、本願における同一性は、ClustalW(Thompson et al., Nucleic Acids Res 24(1997), p.4876-7882)によって行ったアラインメントの結果による。
【0014】
本発明のピシウム菌は下記の形態学的性質を有する。既に非特許文献2において報告されているピシウム・ナン(ピシウム・ナン標準菌)と形態学的特徴が一致し、その生育適温もほぼ一致する。また、本発明のピシウム菌は、遺伝子系統解析においても既報のピシウム・ナンとの近縁性が高い。その一方、これまでに報告のない遊走子形成が認められ、菌糸の生育最適温度が31℃と、既報のピシウム・ナンの34℃に比べて低いという特徴を有することから、当該ピシウム菌はピシウム・ナン標準菌の同種内異型ないし変種であると認められた。本発明のピシウム菌は、長野県の畑土壌、福岡県のツゲ繁殖地の土壌、大阪府の畑土壌など各地の土壌から分離されたものであり、このうち長野県の畑土壌から分離された株はPythium nunn UZ041株(受領番号:FERM AP−21976)として、また、福岡県のツゲ繁殖地の土壌から分離された株はPythium nunn UZ415株(受領番号:FERM AP−21977)として、独立行政法人産業技術総合研究所 特許生物寄託センター(IPOD)に寄託された。これら3つの株は、形態学的特徴からピシウム・ナンと同定され、ITS領域の塩基配列も同一であり、いずれも非病原性で病原性ピシウム菌に対する拮抗性も備えている。これらのことから、これら3つの菌株は同一の異型ないし変種であるといえる。
【0015】
〔形態学的性質〕
胞子嚢 球形又はほぼ球形に近い
胞子嚢の位置 頂生又は中間生
菌糸の隆起形状 球形又は卵形若しくはレモン形状
球状無性器官の位置 頂生又は中間生
卵胞子の位置 頂生又は中間生
造精器の充満性 充満性
造精器の柄の形状 鈎状又は膨状
造精器の雌雄同菌糸性 雌雄同菌糸又は雌雄別菌糸
造卵器への着生数 1〜4個
菌糸の生育温度 10〜40℃(最適温度 31℃)
【0016】
本発明のピシウム菌は非病原性である。この菌は病原性を有する他のピシウム属菌、例えば、ピシウム・ウルティマム(Pythium ultimum)に拮抗性を有する。この性質を利用して、本発明のピシウム菌を含む製剤を植物病害の防除剤として利用できる。この防除剤の対象となる植物病害は、前記ピシウム・ウルティマムやピシウム・アファニデルマータム(Pythium aphanidermatum)などの病原性ピシウム属菌に起因する植物病害の他、ピシウム属菌以外の病原性を有する菌、例えばフザリウム(Fusarium)属菌、ゴイマノマイセス(Gaeumannomyces)属菌、リゾクトニア(Rhizoctonia)属菌、バーティシリウム(Verticillium)属菌、フィトフトラ(Phytophthora)属菌、スクレロチウム(Sclerotium)属菌、コルティシウム(Corticium)属菌、プラスモディオフォラ(Plasmodiophora)属菌、リゾプス属(Rhizopus)菌、トリコデルマ(Trichoderma)属菌、ミクロドチウム(Microdochium)属菌、スクレロチニア(Sclerotinia)属菌に由来する植物病害が例示される。
【0017】
本発明の植物病害防除剤は、上記ピシウム属菌を含有した製剤であって、菌体そのものに限らず、各種の媒体(例えば培養用培地や製剤用の賦形剤)に菌体を加えた組成物を含む意味で用いられる。組成物の形態も液状組成物であるか固形状組成物であるか問わない。従って、培養後、集菌した菌体を利用する場合のみならず、集菌せずに培養した培地(液体培地、固体培地を問わない)をそのまま利用する場合でもよい。本発明の防除剤として、集菌の有無を問わず、培養した菌体をバーミキュライトやパーライト、培養土、ピートモスなどの固形状の媒体と混合した組成物、液肥や培地のような液状の媒体に菌体を混合した組成物が例示される。さらに、本発明のピシウム菌の拮抗性を減じない限りにおいて、本発明以外の植物病害防除性を有する微生物菌体を含有してもよく、苗立枯病などの各種植物病害に効果があるとされる薬剤、例えば、プロパモカルブ塩酸塩やヒドロキシイソキサゾールなどを、やはり本発明のピシウム菌の拮抗性を減じない限りにおいて、混合してもよい。
【0018】
本発明の植物病害防除剤の対象となる植物も特に限定されるものではなく、キュウリ・キャベツ・ホウレンソウ・ダイコン・ナスなどの食用植物、キク、アスターなどの観賞用植物、芝草などが例示される。
【0019】
植物病害防除剤として利用する場合、その菌体濃度は、防除剤の形態や目的とする植物病害に応じて適宜調整されるが、土壌1g当たりの散布菌数が1×102〜1×106cfu(コロニー形成単位)程度、好ましくは1×103〜1×105となるように調整される。
【0020】
本発明の土壌改良方法は本発明に係るピシウム菌を土壌に混入し、増殖させる方法である。これにより、土壌中に存在する病原性の糸状菌、特に病原性ピシウム属菌の増殖を抑制し、あるいは増殖した病原性糸状菌を減少させ、健全な土壌に回復して植物病害から植物を保護する。混入させる方法も特に限定されるものではなく、集菌した菌体や菌体を含む培地など前記防除剤を適宜土壌中に混入させればよい。また、植物が栽培されている土壌においてピシウム菌を増殖させ、対象作物の根圏に定着せしめることにより、植物病害を防除する。
【0021】
土壌中で本発明のピシウム菌を増殖させるために対象土壌に新鮮有機物を施肥するのが好ましい。本願において新鮮有機物とは、緑肥のように土壌にすき込むことによって土壌の肥料となる堆肥化していない有機物を意味し、緑肥の他には例えばおからや油かすなどが例示される。この中でも緑肥が好ましく施肥される。緑肥とは、エンバクやクローバ、レンゲソウ、ライ麦、エビスクサ、キュウリ、大豆のように対象となる土壌にて栽培され、栽培後収穫することなく土壌にすき込むことによって土壌の肥料となる堆肥化していない新鮮な植物体をいう。施肥する緑肥はこのような植物体であればいずれであってもよい。新鮮有機物を施肥する場合、本発明のピシウム菌を散布する時期は施肥の前後を問わない。また、緑肥を施肥する場合も、本発明のピシウム菌を散布する時期は、緑肥となる植物の栽培開始前、栽培途中を問わず、また、緑肥として土壌へすき込みするのと同時であってもよく、緑肥のすき込みをした後に本発明のピシウム菌を散布してもよい。
【0022】
本発明は、田畑の土壌などに本発明のピシウム菌を予め散布、増殖させた上で、ピシウム菌を含有した植物栽培用土壌としても提供される。本発明の植物苗は、当該植物栽培用土壌において、植物種子を発芽させ、または生育させたものである。また、本発明の植物苗は本発明のピシウム・ナンの菌体を含む植物病害防除剤を添加した土壌で発芽又は生育させることによっても提供される。これらの植物苗は発芽又は生育させた土壌に植え込んだまま提供されることもあり、前記植物栽培用土壌若しくは前記植物病害防除剤を添加した土壌を入れた栽培用ポットにおいて発芽又は生育させたいわゆるポット苗としても提供される。
【0023】
これら本発明の植物苗を発芽又は生育させる土壌中には、土壌1g当たりの菌数が1×102〜1×106cfu(コロニー形成単位)程度、好ましくは1×103〜1×105に調整されるように、本発明のピシウム菌を添加するか、本発明の植物病害防除剤を添加する。また、対象となる植物苗は特に限定されるものではなく、キュウリ・キャベツ・ホウレンソウ・ダイコン・ナスなどの食用植物、キク、アスターなどの観賞用植物、芝草などが例示される。
【0024】
本発明の植物種子は、本発明のピシウム・ナンの菌体を含むコーティング剤によってコーティングされたものである。当該コーティング剤はコーティング用基剤にピシウム・ナンを含ませたものであり、本発明のピシウム菌の拮抗性を減じない限りにおいて、公知である種々のコーティング基剤を用いることができる。当該コーティング用基剤として、PVA、CMC、MC、ゼラチン、デンプン、プルランなどの水溶性バインダー(結合剤)や、けいそう土、赤土、炭酸カルシウム、パーライト、タルク、クレー、カリオンなどの粉体材料(無機物)が例示される。コーティング方法は種子に菌体が付着できる方法であれば特に限定されるものでなく、前記バインダーや前記粉体材料と菌体並びに水などの媒体を混合し、当該混合物を種子の表面にスプレーや塗布した後乾燥させる方法、前記混合物中に種子を浸漬して種子表面に混合物を付着させる方法が例示される。このとき、種子の表面が皮膜(コーティング層)で完全に覆われる必要もなく、部分的に皮膜が付着した状態であっても差し使えない。菌体が付着した種子が播種されることにより、付着した菌体が播種された土壌にて増殖するからである。また、対象となる植物種子は特に限定されるものではなく、キュウリ・キャベツ・ホウレンソウ・ダイコン・ナスなどの食用植物の種子、キク、アスターなどの観賞用植物の種子、芝草の種子などが例示される。コーティング剤中には、コーティング剤1g当たりの菌数が1×100〜1×105cfu(コロニー形成単位)程度、好ましくは1×101〜1×103に調整される。
【実施例1】
【0025】
〔ピシウム菌の分離〕
日本国内3カ所の土壌からピシウム菌を分離した。使用した土壌は、長野県上田市の畑土壌、福岡県福岡市のツゲ繁殖地の土壌及び大阪府の畑土壌である。これらの土壌から、菌を捕捉するための基質(捕捉基質)としてピーマンの種子、キュウリの種子及びジャガイモ(芋)を用いた捕捉法(Watanabe 1981)によりそれぞれピシウム菌を分離した。各土壌中に捕捉基質を埋め込み、20〜30℃で24〜48時間培養した後、土壌から捕捉基質を取り出し流水で洗浄し、乾燥させた。この捕捉基質を水寒天培地上で培養し、増殖した菌糸を分離した。分離した菌は、コーンミール寒天培地(CMA培地:Tojoら 1998)で培養した。長野県の土壌から分離された株はピシウム・ナン(Pythium nunn)UZ041株(受領番号:FERM AP−21976)として、福岡県の土壌から分離された株はピシウム・ナン(Pythium nunn)UZ415株(受領番号:FERM AP−21977)として、それぞれ独立行政法人産業技術総合研究所 特許生物寄託センターに寄託された。また、分離した菌は、potato-carrot-agar培地(PCA培地:van der Plaats-Niterink AJ, Stud. Mycol. 21(1981), p.1-242)にて培養・保存し、これを下記試験の供試菌とした。
【0026】
〔ピシウム属菌の形態観察〕
分離したピシウム・ナンの形態観察を、van der Plaats-Niterink(van der Plaats-Niterink AJ, Stud. Mycol. 21(1981), p.1-242)に記載の項目について行った。芝葉片水培地(grass-leaf water culture:van der Plaats-Niterink AJ, Stud. Mycol. 21(1981), p.1-242)上で約25℃で1〜10日間培養後、胞子嚢、造卵器、造精器の大きさを測定した。その結果を表1に、その顕微鏡観察による画像を図1に示す。また、芝葉片水培地上で4〜40℃の3℃間隔で培養して成長速度を測定したところ、図2に示す結果が得られた。なお、大阪府の畑土壌から分離されたピシウム菌も同様な結果を示した。
【0027】
分離されたピシウム・ナンは、遊走子の形成が見られた点において、非特許文献4において報告されているピシウム・ナンと異なっていたが、形態学的にはその他に異なる点はなかった。また、分離された菌株の菌糸の生育至適温度は31℃であり、報告されているピシウム・ナン標準菌の至適温度に比べて3℃ほど低かった。
【0028】
【表1】

【0029】
〔ピシウム菌の遺伝子解析〕
長野県、福岡県、大阪府の土壌から分離された3つの菌株についてそれぞれ遺伝子解析を行った。遺伝子解析は5.8SrDNAを含むITS領域及びLSU(Large Subunit:25〜28s)rDNAのD1/D2領域について行った。ITS領域の増幅には、配列番号2で示される塩基配列を有するプライマーITS5及び配列番号3で示される塩基配列を有するプライマーITS4(いずれもWhite et al., Academic Press, 1990, p.315-322 参照)を、D1/D2領域の増幅には、配列番号4で示される塩基配列を有するプライマーNL1及び配列番号5で示される塩基配列を有するプライマーNL4(いずれもO'Donnell CAB International, 1993 p.225-233)を用いた。また、DNAの抽出及びPCRは、Uzuhashiらの方法(Uzuhashi et al., Mycoscience 49(2008), p.276-279)に従った。
【0030】
5.8SrDNA領域を含むITS領域の塩基配列(875bp)を配列番号1として示した。解析を行った3つの菌株のITS領域の塩基配列は全く同じであった。この5.8SrITS領域の塩基配列について、既に報告されているピシウム・ナン標準菌の塩基配列(GenBank 遺伝子登録番号AY598709)と比較すると98.6%の同一性があった。また、解析を行った3つの菌株のD1/D2領域の塩基配列は全く同じであり、ピシウム・ナン標準菌のそれとも全く同じであった。なお、同一性はClustalW(Thompson et al., Nucleic Acids Res 24(1997), p.4876-7882)によって行ったアラインメントの結果による。
【0031】
図3は分離されたピシウム・ナンを含む各種ピシウム属菌のITS領域のDNAに基づく系統樹である。この系統樹はRAxMLプログラム(Stamatakis, Bioinfomatucs 22(2006), p2688-2690)によって作成された、この系統樹からもわかるように、分離された3株のピシウム・ナンは、前記ITS領域の塩基配列に基づけば他のピシウム・ナンから分離して位置づけられ、他のピシウム・ナンとは異なるグループに属する。
【0032】
〔ピシウム属菌の病原性〕
分離されたピシウム・ナンUZ415株について植物病原性について調べた。供試植物としてキュウリ(品種:地這)、キャベツ(品種:キャベツ)およびバミューダグラス(品種:サンデビル)を用いた。各供試菌の培養菌叢(微生物叢)を市販の育苗用土(愛菜1号:片倉チッカリン株式会社製)に混和し、組織培養用プレートに入れて、プレートの各ウェルに供試植物種子を播種した。二重ポリエチレン製のバックに入れた後、28℃の植物育成器内に静置して5日後に苗立枯率を調べた。キュウリ及びキャベツについての結果を表2に示す。これによると、分離されたピシウム・ナンUZ415株は供試植物に対して苗立枯れや生育阻害を起こさなかった。しかし、これらの菌は供試植物の根に感染し、その表皮細胞中に卵胞子を形成した。また、バミューダグラスに対しても病原性を示さなかった。
【0033】
【表2】

【0034】
〔ピシウム・ウルティマムに対する菌種間寄生性〕
非病原菌としてピシウム・ナンUZ415株を、病原菌としてピシウム・ウルティマムのOPU774株(Kida et al., Plant Pathol, 56(2007),p1042)を用いた。菌糸の接触を観察しやすくするためCMA寒天培地の表面をセロファンで覆い、その上に非病原菌と病原菌を対峙させて接種した。25℃で3日間培養後、両菌の菌叢の接触部分を顕微鏡で観察した結果を図4a、bに示す。双方の画像に示されるように非病原菌P.nunnの菌糸がP. ultimumの菌糸内に侵入し、宿主菌糸の原形質を消失させる現象が観察された。
【0035】
〔病原性ピシウム属菌への拮抗作用〕
(キュウリ苗立枯病の抑制効果)
病原性ピシウム属菌への拮抗性としてキュウリ苗立枯病の抑制効果を調べた。非病原菌としてピシウム・ナンUZ041株とUZ415株を用いた。病原菌としてピシウム・ウルティマムのOPU774株を用いた。各菌株を市販の育苗用土(愛菜1号:片倉チッカリン株式会社製)に混和した混和土壌を作製し、素焼鉢に病原菌混和土壌、非病原菌混和土壌、病原菌混和土壌の順に土壌を入れた。キュウリ種子7粒を非病原菌混和土壌の層に播種し、二重ポリエチレン製のバッグに入れて25℃の植物育成器内で育成し、播種の4日後に健全な植物個体の数を調べた。その結果を表3及び図5に示す。ピシウム・ナン処理区の播種4日後では、健全個体数がピシウム・ウルティマムのみの接種区と比べて有意に(P<0.05)多かった。しかし、播種10日後にはピシウム・ウルティマムのみの接種区との間で有意な差が見られなくなった。
【0036】
【表3】

【0037】
(土壌中での密度変化)
ピシウム・ナンUZ415株を市販の育苗用土(愛菜1号:片倉チッカリン株式会社製)に混和した混和土壌を作製し、二重ポリエチレン製のバッグに入れて25℃の植物育成器内に静置した。混和1日後から11日目、21日目、31日目にピシウム属菌選択培地を用いた希釈平板法で菌密度を測定した。その結果、混和の1日後から21日にかけて菌密度の増加が見られ、その後減少する傾向が観察された。さらに、それぞれの混和土壌にキュウリ種子を播種し、同様の方法で土壌中の菌密度を測定した。その結果を図6に示す。植物体の存在しない土壌中よりも格段に菌密度が高くなった。このように、緑肥となりえる植物体と共に培養することにより、緑肥がない場合に比べて土壌中の菌密度が高まり、病原性菌類の増加を抑えることが期待される。
【産業上の利用可能性】
【0038】
本発明によると、ピシウム・ウルティマムのような植物病原性を有する糸状菌に対して拮抗性を有する新規なピシウム菌が提供される。この菌の利用により、苗立枯病などに対する植物病害防除剤が提供される。
【技術分野】
【0001】
本発明は新規ピシウム菌に関する。より具体的には苗立枯病を引き起こす植物病原菌(Pythium ultimum)に対して拮抗性を示す新規ピシウム菌に関する。
【背景技術】
【0002】
ピシウム属菌は世界各地の土壌や水域環境に広く分布し、これまで世界で150種以上、日本では約50種が報告されている。ピシウム属菌の多くの種は、野菜をはじめ多くの作物の苗立枯れや根腐れを引き起こす重要な植物病原菌として知られている。このような植物病原菌として、ピシウム・ウルティマム(Pythium ultimum)やピシウム・アファニデルマータム(Pythium aphanidermatum)が挙げられる。
【0003】
上記植物病原性のピシウム属菌に対して拮抗性を示す細菌又は放線菌を利用して植物病の発生を抑制しようとすることが試みられている。例えば、特許文献1には、ストレプトミセス・ヘイミ(Streptomyces heimi)やストレプトミセス・フラベオラス(Streptomyces flaveolus)がピシウム・アファニデルマータムに対して拮抗性を示し、芝草病原菌の防除に有効であることが示されている。また、特許文献2(特開平8−322556号公報)には、シュードモナス・フルオレッセンス(Psedomonas fluorescens)がピシウム・アファニデルマータムやリゾクトニア・ソラニ(Rhizoctonia solani)などに対し拮抗性を示し、これらの湿菌体を芝草に直接散布するか、あるいは菌体をバーミキュライトやゼオライトなどに吸着させた吸着剤や堆肥原料に混ぜて得られた堆肥などを芝草に施し、植物病害防除材として使用できる旨が記載されている。
【0004】
上記の病原性ピシウム属菌に対して拮抗性を有するピシウム属菌の存在も知られている。例えば、非特許文献1には、ピシウム・オリガンドラム(Pythium oligandrum)がトマト根茎の腐敗病菌に対して拮抗性を示すことが記載されている。また、特許文献3には、ピシウム・オリガンドラムの細胞壁由来のタンパク質が多くの作物の根圏に定着して、作物に耐病性を誘導する能力を発揮することが記載されている。また、非特許文献2には、ピシウム・ナン(Pythium nunn)がピシウム・ウルティマムによる病害を抑制することが、非特許文献3には、ピシウム・ナンがフィトフトラ属菌(Phytophthora spp.)による病害を、非特許文献4には同菌がリゾクトニア属菌(Rhizoctonia solani)による病害をそれぞれ抑制することが記載されている。
【0005】
ところで、ピシウム属菌をはじめとする真菌類は、細胞の形態で分類されることが多い。例えば、ピシウム属菌が属する卵菌類においては、蔵卵器、卵胞子、造精器、遊走子嚢等の有無やそれらの形態によって分類されていた。しかしながら、こうした形態による分類には豊富な知識と熟練した技術が必要で、菌種の分類・同定に必要な特徴的な形質が現れない場合には分類・同定ができないし、培養に日数がかかるために分類・同定に長期間要することなどの理由により、近年では遺伝子解析により分類・同定することが試みられている。例えば、非特許文献5にはDNA塩基配列の解析により病原性真菌の分類・同定ができることが記載されている。これによると、rDNA(リボソーマルDNA)のITS領域(Internal Transcribed Spacer領域)の塩基配列は、同一種内では99%以上の同一性があり、それ未満であれば別種であるとされるので、ピシウム属菌の種の分類・同定においてはITS領域及びrDNAのLSU(Large Subunit、26〜28S)にあるD1/D2領域の塩基配列の解析で十分であると結論づけられている。また、非特許文献6には、ピシウム属菌について、rDNAのITS領域とミトコンドリアのクロームオキシダーゼII遺伝子の多型性に基づく分類・同定と上記細胞の形態に基づく分類が比較され、分類・同定には形態学的特徴だけでなく、遺伝子レベルの多型性分析が必要であると結論づけられている。さらに、非特許文献7では、ピシウム属菌について、rDNA(リボソーマルDNA)のITS領域とD1/D2領域の塩基配列から分子系統解析を行い、形態学的分類との対比が試みられ結果、新たな系統群が見いだされている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平6−107512号公報
【特許文献2】特開平8−322556号公報
【特許文献3】特開2003−81998号
【非特許文献】
【0007】
【非特許文献1】Takenaka S et al., Phytopathology, 98(2008), p.187-195
【非特許文献2】Paulitz TC et al., Phytopathology, 77(1987), p.335-340
【非特許文献3】Fang JG et al., Phytopathology, 85(1995), p.29-36
【非特許文献4】Lifshitz et l., Phytopathology, 74(1984), p.1054-1061
【非特許文献5】杉田ら,Jpn. J. Med. Mycol., 45(2004), p55-58
【非特許文献6】Kajihara Y et al., Jpn. J. Phytopathol., 69(1), 2003, p.63
【非特許文献7】埋橋ら,日本菌学会大会公演要旨集,2008,133頁
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明者らは、国内土壌中から分離した非病原性ピシウム菌について研究を進める中で、当該ピシウム菌が病原性のピシウム菌に対して拮抗作用を示すと共に、当該ピシウム菌が形態学的にはピシウム・ナンと同定されるにもかかわらず、詳細な遺伝子解析の結果からピシウム・ナンの標準菌とは異なる変種であることを見出した。
【0009】
すなわち、本発明は病原性ピシウム菌に対して拮抗性を有する新規なピシウム菌を提供し、当該ピシウム菌を用いて苗立枯病に代表される各種植物病害を防除することを目的としている。
【課題を解決するための手段】
【0010】
本発明のピシウム菌はrDNAのITS領域の塩基配列が配列番号1に示す塩基配列と同一性が99%以上である新規なピシウム菌であり、本発明においては当該ピシウム菌を土壌に散布する等の方法により、苗立枯病の原因菌であるピシウム・ウルティマムなどで汚染された土壌中でこれらの病原性ピシウム菌による植物病害の防除を図る。
【発明の効果】
【0011】
本発明によると農薬などの化学物質による防除が困難な苗立枯病など植物病害の防除が図られる。
【図面の簡単な説明】
【0012】
【図1】図1は分離されたピシウム・ナンの形態学的特性を示す顕微鏡観察による画像である。a〜gはUZ041株を、h〜kはUZ415株を示す。aは発芽管を有する胞子嚢、bは遊走子を持つ小胞、cは遊走子を放出した後の空の胞子嚢、dは菌糸の中間にある球状の隆起、eは突起を有する造卵器と膨らんだ柄を持つ造精器、fは3個の造精器を有する頂生の造卵器、gは鈎状の柄を持つ造精器を有する造卵器、hは菌糸の中間にある球状の無性繁殖器官、iは菌糸の終端にある球状の無性繁殖器官、jは膨らんだ柄を持つ造精器を持った頂生の造卵器、kは一つの突起を有し、鈎状の柄を持つ雌雄同株性の造精器と造卵器である。
【図2】図2は分離されたピシウム・ナンUZ041株及UZ415株の生育速度と生育温度との関係を示す図である。
【図3】図3はピシウム・ナンにおけるITS領域の塩基配列に基づく系統樹である。
【図4】図4a、bはそれぞれ分離されたピシウム・ナン(UZ415株)とピシウム・ウルティマムの間における菌間寄生性を示す顕微鏡観察による画像である。PUはピシウム・ウルティマムを、PNはピシウム・ナンを示す。
【図5】図5は分離されたピシウム・ナンUZ041株及びUZ415株によるキュウリ立枯病の防除効果を示す画像である。aはUZ041株を、bはUZ415株を、cはピシウム・ウルティマムのみを、dはピシウム・ウルティマムを感染させないコントロールを示す。
【図6】図6は土壌におけるピシウム・ナンUZ415株の菌密度変化を示す図であって、実線は緑肥を用いた場合を、破線は緑肥を用いない場合を示す。
【発明を実施するための形態】
【0013】
本発明のピシウム菌は新規のピシウム菌であって、rDNAのITS領域に配列番号1で示される塩基配列と同一性が99%以上である塩基配列を有する。ここにおいて、ITS領域とは、rRNA遺伝子の5.8Sサブユニットを含む領域であり、rRNA遺伝子の18Sサブユニットと5.8Sサブユニットの間に存在するイントロン領域(ITS1)と5.8Sサブユニットと26Sサブユニットの間に存在するイントロン領域(ITS2)及び5.8Sサブユニットを合わせた塩基配列(DNA)を意味する。なお、本願における同一性は、ClustalW(Thompson et al., Nucleic Acids Res 24(1997), p.4876-7882)によって行ったアラインメントの結果による。
【0014】
本発明のピシウム菌は下記の形態学的性質を有する。既に非特許文献2において報告されているピシウム・ナン(ピシウム・ナン標準菌)と形態学的特徴が一致し、その生育適温もほぼ一致する。また、本発明のピシウム菌は、遺伝子系統解析においても既報のピシウム・ナンとの近縁性が高い。その一方、これまでに報告のない遊走子形成が認められ、菌糸の生育最適温度が31℃と、既報のピシウム・ナンの34℃に比べて低いという特徴を有することから、当該ピシウム菌はピシウム・ナン標準菌の同種内異型ないし変種であると認められた。本発明のピシウム菌は、長野県の畑土壌、福岡県のツゲ繁殖地の土壌、大阪府の畑土壌など各地の土壌から分離されたものであり、このうち長野県の畑土壌から分離された株はPythium nunn UZ041株(受領番号:FERM AP−21976)として、また、福岡県のツゲ繁殖地の土壌から分離された株はPythium nunn UZ415株(受領番号:FERM AP−21977)として、独立行政法人産業技術総合研究所 特許生物寄託センター(IPOD)に寄託された。これら3つの株は、形態学的特徴からピシウム・ナンと同定され、ITS領域の塩基配列も同一であり、いずれも非病原性で病原性ピシウム菌に対する拮抗性も備えている。これらのことから、これら3つの菌株は同一の異型ないし変種であるといえる。
【0015】
〔形態学的性質〕
胞子嚢 球形又はほぼ球形に近い
胞子嚢の位置 頂生又は中間生
菌糸の隆起形状 球形又は卵形若しくはレモン形状
球状無性器官の位置 頂生又は中間生
卵胞子の位置 頂生又は中間生
造精器の充満性 充満性
造精器の柄の形状 鈎状又は膨状
造精器の雌雄同菌糸性 雌雄同菌糸又は雌雄別菌糸
造卵器への着生数 1〜4個
菌糸の生育温度 10〜40℃(最適温度 31℃)
【0016】
本発明のピシウム菌は非病原性である。この菌は病原性を有する他のピシウム属菌、例えば、ピシウム・ウルティマム(Pythium ultimum)に拮抗性を有する。この性質を利用して、本発明のピシウム菌を含む製剤を植物病害の防除剤として利用できる。この防除剤の対象となる植物病害は、前記ピシウム・ウルティマムやピシウム・アファニデルマータム(Pythium aphanidermatum)などの病原性ピシウム属菌に起因する植物病害の他、ピシウム属菌以外の病原性を有する菌、例えばフザリウム(Fusarium)属菌、ゴイマノマイセス(Gaeumannomyces)属菌、リゾクトニア(Rhizoctonia)属菌、バーティシリウム(Verticillium)属菌、フィトフトラ(Phytophthora)属菌、スクレロチウム(Sclerotium)属菌、コルティシウム(Corticium)属菌、プラスモディオフォラ(Plasmodiophora)属菌、リゾプス属(Rhizopus)菌、トリコデルマ(Trichoderma)属菌、ミクロドチウム(Microdochium)属菌、スクレロチニア(Sclerotinia)属菌に由来する植物病害が例示される。
【0017】
本発明の植物病害防除剤は、上記ピシウム属菌を含有した製剤であって、菌体そのものに限らず、各種の媒体(例えば培養用培地や製剤用の賦形剤)に菌体を加えた組成物を含む意味で用いられる。組成物の形態も液状組成物であるか固形状組成物であるか問わない。従って、培養後、集菌した菌体を利用する場合のみならず、集菌せずに培養した培地(液体培地、固体培地を問わない)をそのまま利用する場合でもよい。本発明の防除剤として、集菌の有無を問わず、培養した菌体をバーミキュライトやパーライト、培養土、ピートモスなどの固形状の媒体と混合した組成物、液肥や培地のような液状の媒体に菌体を混合した組成物が例示される。さらに、本発明のピシウム菌の拮抗性を減じない限りにおいて、本発明以外の植物病害防除性を有する微生物菌体を含有してもよく、苗立枯病などの各種植物病害に効果があるとされる薬剤、例えば、プロパモカルブ塩酸塩やヒドロキシイソキサゾールなどを、やはり本発明のピシウム菌の拮抗性を減じない限りにおいて、混合してもよい。
【0018】
本発明の植物病害防除剤の対象となる植物も特に限定されるものではなく、キュウリ・キャベツ・ホウレンソウ・ダイコン・ナスなどの食用植物、キク、アスターなどの観賞用植物、芝草などが例示される。
【0019】
植物病害防除剤として利用する場合、その菌体濃度は、防除剤の形態や目的とする植物病害に応じて適宜調整されるが、土壌1g当たりの散布菌数が1×102〜1×106cfu(コロニー形成単位)程度、好ましくは1×103〜1×105となるように調整される。
【0020】
本発明の土壌改良方法は本発明に係るピシウム菌を土壌に混入し、増殖させる方法である。これにより、土壌中に存在する病原性の糸状菌、特に病原性ピシウム属菌の増殖を抑制し、あるいは増殖した病原性糸状菌を減少させ、健全な土壌に回復して植物病害から植物を保護する。混入させる方法も特に限定されるものではなく、集菌した菌体や菌体を含む培地など前記防除剤を適宜土壌中に混入させればよい。また、植物が栽培されている土壌においてピシウム菌を増殖させ、対象作物の根圏に定着せしめることにより、植物病害を防除する。
【0021】
土壌中で本発明のピシウム菌を増殖させるために対象土壌に新鮮有機物を施肥するのが好ましい。本願において新鮮有機物とは、緑肥のように土壌にすき込むことによって土壌の肥料となる堆肥化していない有機物を意味し、緑肥の他には例えばおからや油かすなどが例示される。この中でも緑肥が好ましく施肥される。緑肥とは、エンバクやクローバ、レンゲソウ、ライ麦、エビスクサ、キュウリ、大豆のように対象となる土壌にて栽培され、栽培後収穫することなく土壌にすき込むことによって土壌の肥料となる堆肥化していない新鮮な植物体をいう。施肥する緑肥はこのような植物体であればいずれであってもよい。新鮮有機物を施肥する場合、本発明のピシウム菌を散布する時期は施肥の前後を問わない。また、緑肥を施肥する場合も、本発明のピシウム菌を散布する時期は、緑肥となる植物の栽培開始前、栽培途中を問わず、また、緑肥として土壌へすき込みするのと同時であってもよく、緑肥のすき込みをした後に本発明のピシウム菌を散布してもよい。
【0022】
本発明は、田畑の土壌などに本発明のピシウム菌を予め散布、増殖させた上で、ピシウム菌を含有した植物栽培用土壌としても提供される。本発明の植物苗は、当該植物栽培用土壌において、植物種子を発芽させ、または生育させたものである。また、本発明の植物苗は本発明のピシウム・ナンの菌体を含む植物病害防除剤を添加した土壌で発芽又は生育させることによっても提供される。これらの植物苗は発芽又は生育させた土壌に植え込んだまま提供されることもあり、前記植物栽培用土壌若しくは前記植物病害防除剤を添加した土壌を入れた栽培用ポットにおいて発芽又は生育させたいわゆるポット苗としても提供される。
【0023】
これら本発明の植物苗を発芽又は生育させる土壌中には、土壌1g当たりの菌数が1×102〜1×106cfu(コロニー形成単位)程度、好ましくは1×103〜1×105に調整されるように、本発明のピシウム菌を添加するか、本発明の植物病害防除剤を添加する。また、対象となる植物苗は特に限定されるものではなく、キュウリ・キャベツ・ホウレンソウ・ダイコン・ナスなどの食用植物、キク、アスターなどの観賞用植物、芝草などが例示される。
【0024】
本発明の植物種子は、本発明のピシウム・ナンの菌体を含むコーティング剤によってコーティングされたものである。当該コーティング剤はコーティング用基剤にピシウム・ナンを含ませたものであり、本発明のピシウム菌の拮抗性を減じない限りにおいて、公知である種々のコーティング基剤を用いることができる。当該コーティング用基剤として、PVA、CMC、MC、ゼラチン、デンプン、プルランなどの水溶性バインダー(結合剤)や、けいそう土、赤土、炭酸カルシウム、パーライト、タルク、クレー、カリオンなどの粉体材料(無機物)が例示される。コーティング方法は種子に菌体が付着できる方法であれば特に限定されるものでなく、前記バインダーや前記粉体材料と菌体並びに水などの媒体を混合し、当該混合物を種子の表面にスプレーや塗布した後乾燥させる方法、前記混合物中に種子を浸漬して種子表面に混合物を付着させる方法が例示される。このとき、種子の表面が皮膜(コーティング層)で完全に覆われる必要もなく、部分的に皮膜が付着した状態であっても差し使えない。菌体が付着した種子が播種されることにより、付着した菌体が播種された土壌にて増殖するからである。また、対象となる植物種子は特に限定されるものではなく、キュウリ・キャベツ・ホウレンソウ・ダイコン・ナスなどの食用植物の種子、キク、アスターなどの観賞用植物の種子、芝草の種子などが例示される。コーティング剤中には、コーティング剤1g当たりの菌数が1×100〜1×105cfu(コロニー形成単位)程度、好ましくは1×101〜1×103に調整される。
【実施例1】
【0025】
〔ピシウム菌の分離〕
日本国内3カ所の土壌からピシウム菌を分離した。使用した土壌は、長野県上田市の畑土壌、福岡県福岡市のツゲ繁殖地の土壌及び大阪府の畑土壌である。これらの土壌から、菌を捕捉するための基質(捕捉基質)としてピーマンの種子、キュウリの種子及びジャガイモ(芋)を用いた捕捉法(Watanabe 1981)によりそれぞれピシウム菌を分離した。各土壌中に捕捉基質を埋め込み、20〜30℃で24〜48時間培養した後、土壌から捕捉基質を取り出し流水で洗浄し、乾燥させた。この捕捉基質を水寒天培地上で培養し、増殖した菌糸を分離した。分離した菌は、コーンミール寒天培地(CMA培地:Tojoら 1998)で培養した。長野県の土壌から分離された株はピシウム・ナン(Pythium nunn)UZ041株(受領番号:FERM AP−21976)として、福岡県の土壌から分離された株はピシウム・ナン(Pythium nunn)UZ415株(受領番号:FERM AP−21977)として、それぞれ独立行政法人産業技術総合研究所 特許生物寄託センターに寄託された。また、分離した菌は、potato-carrot-agar培地(PCA培地:van der Plaats-Niterink AJ, Stud. Mycol. 21(1981), p.1-242)にて培養・保存し、これを下記試験の供試菌とした。
【0026】
〔ピシウム属菌の形態観察〕
分離したピシウム・ナンの形態観察を、van der Plaats-Niterink(van der Plaats-Niterink AJ, Stud. Mycol. 21(1981), p.1-242)に記載の項目について行った。芝葉片水培地(grass-leaf water culture:van der Plaats-Niterink AJ, Stud. Mycol. 21(1981), p.1-242)上で約25℃で1〜10日間培養後、胞子嚢、造卵器、造精器の大きさを測定した。その結果を表1に、その顕微鏡観察による画像を図1に示す。また、芝葉片水培地上で4〜40℃の3℃間隔で培養して成長速度を測定したところ、図2に示す結果が得られた。なお、大阪府の畑土壌から分離されたピシウム菌も同様な結果を示した。
【0027】
分離されたピシウム・ナンは、遊走子の形成が見られた点において、非特許文献4において報告されているピシウム・ナンと異なっていたが、形態学的にはその他に異なる点はなかった。また、分離された菌株の菌糸の生育至適温度は31℃であり、報告されているピシウム・ナン標準菌の至適温度に比べて3℃ほど低かった。
【0028】
【表1】

【0029】
〔ピシウム菌の遺伝子解析〕
長野県、福岡県、大阪府の土壌から分離された3つの菌株についてそれぞれ遺伝子解析を行った。遺伝子解析は5.8SrDNAを含むITS領域及びLSU(Large Subunit:25〜28s)rDNAのD1/D2領域について行った。ITS領域の増幅には、配列番号2で示される塩基配列を有するプライマーITS5及び配列番号3で示される塩基配列を有するプライマーITS4(いずれもWhite et al., Academic Press, 1990, p.315-322 参照)を、D1/D2領域の増幅には、配列番号4で示される塩基配列を有するプライマーNL1及び配列番号5で示される塩基配列を有するプライマーNL4(いずれもO'Donnell CAB International, 1993 p.225-233)を用いた。また、DNAの抽出及びPCRは、Uzuhashiらの方法(Uzuhashi et al., Mycoscience 49(2008), p.276-279)に従った。
【0030】
5.8SrDNA領域を含むITS領域の塩基配列(875bp)を配列番号1として示した。解析を行った3つの菌株のITS領域の塩基配列は全く同じであった。この5.8SrITS領域の塩基配列について、既に報告されているピシウム・ナン標準菌の塩基配列(GenBank 遺伝子登録番号AY598709)と比較すると98.6%の同一性があった。また、解析を行った3つの菌株のD1/D2領域の塩基配列は全く同じであり、ピシウム・ナン標準菌のそれとも全く同じであった。なお、同一性はClustalW(Thompson et al., Nucleic Acids Res 24(1997), p.4876-7882)によって行ったアラインメントの結果による。
【0031】
図3は分離されたピシウム・ナンを含む各種ピシウム属菌のITS領域のDNAに基づく系統樹である。この系統樹はRAxMLプログラム(Stamatakis, Bioinfomatucs 22(2006), p2688-2690)によって作成された、この系統樹からもわかるように、分離された3株のピシウム・ナンは、前記ITS領域の塩基配列に基づけば他のピシウム・ナンから分離して位置づけられ、他のピシウム・ナンとは異なるグループに属する。
【0032】
〔ピシウム属菌の病原性〕
分離されたピシウム・ナンUZ415株について植物病原性について調べた。供試植物としてキュウリ(品種:地這)、キャベツ(品種:キャベツ)およびバミューダグラス(品種:サンデビル)を用いた。各供試菌の培養菌叢(微生物叢)を市販の育苗用土(愛菜1号:片倉チッカリン株式会社製)に混和し、組織培養用プレートに入れて、プレートの各ウェルに供試植物種子を播種した。二重ポリエチレン製のバックに入れた後、28℃の植物育成器内に静置して5日後に苗立枯率を調べた。キュウリ及びキャベツについての結果を表2に示す。これによると、分離されたピシウム・ナンUZ415株は供試植物に対して苗立枯れや生育阻害を起こさなかった。しかし、これらの菌は供試植物の根に感染し、その表皮細胞中に卵胞子を形成した。また、バミューダグラスに対しても病原性を示さなかった。
【0033】
【表2】

【0034】
〔ピシウム・ウルティマムに対する菌種間寄生性〕
非病原菌としてピシウム・ナンUZ415株を、病原菌としてピシウム・ウルティマムのOPU774株(Kida et al., Plant Pathol, 56(2007),p1042)を用いた。菌糸の接触を観察しやすくするためCMA寒天培地の表面をセロファンで覆い、その上に非病原菌と病原菌を対峙させて接種した。25℃で3日間培養後、両菌の菌叢の接触部分を顕微鏡で観察した結果を図4a、bに示す。双方の画像に示されるように非病原菌P.nunnの菌糸がP. ultimumの菌糸内に侵入し、宿主菌糸の原形質を消失させる現象が観察された。
【0035】
〔病原性ピシウム属菌への拮抗作用〕
(キュウリ苗立枯病の抑制効果)
病原性ピシウム属菌への拮抗性としてキュウリ苗立枯病の抑制効果を調べた。非病原菌としてピシウム・ナンUZ041株とUZ415株を用いた。病原菌としてピシウム・ウルティマムのOPU774株を用いた。各菌株を市販の育苗用土(愛菜1号:片倉チッカリン株式会社製)に混和した混和土壌を作製し、素焼鉢に病原菌混和土壌、非病原菌混和土壌、病原菌混和土壌の順に土壌を入れた。キュウリ種子7粒を非病原菌混和土壌の層に播種し、二重ポリエチレン製のバッグに入れて25℃の植物育成器内で育成し、播種の4日後に健全な植物個体の数を調べた。その結果を表3及び図5に示す。ピシウム・ナン処理区の播種4日後では、健全個体数がピシウム・ウルティマムのみの接種区と比べて有意に(P<0.05)多かった。しかし、播種10日後にはピシウム・ウルティマムのみの接種区との間で有意な差が見られなくなった。
【0036】
【表3】

【0037】
(土壌中での密度変化)
ピシウム・ナンUZ415株を市販の育苗用土(愛菜1号:片倉チッカリン株式会社製)に混和した混和土壌を作製し、二重ポリエチレン製のバッグに入れて25℃の植物育成器内に静置した。混和1日後から11日目、21日目、31日目にピシウム属菌選択培地を用いた希釈平板法で菌密度を測定した。その結果、混和の1日後から21日にかけて菌密度の増加が見られ、その後減少する傾向が観察された。さらに、それぞれの混和土壌にキュウリ種子を播種し、同様の方法で土壌中の菌密度を測定した。その結果を図6に示す。植物体の存在しない土壌中よりも格段に菌密度が高くなった。このように、緑肥となりえる植物体と共に培養することにより、緑肥がない場合に比べて土壌中の菌密度が高まり、病原性菌類の増加を抑えることが期待される。
【産業上の利用可能性】
【0038】
本発明によると、ピシウム・ウルティマムのような植物病原性を有する糸状菌に対して拮抗性を有する新規なピシウム菌が提供される。この菌の利用により、苗立枯病などに対する植物病害防除剤が提供される。
【特許請求の範囲】
【請求項1】
rDNAのITS領域に配列番号1に示された塩基配列と99%以上の同一性がある塩基配列を有するピシウム・ナン。
【請求項2】
ピシウム・ウルティマムに対して拮抗性を有する請求項1に記載のピシウム・ナン。
【請求項3】
財団法人産業技術創業研究所特許生物寄託センター受領番号FERM AP−21976又は受領番号FERM AP−21977で寄託されたピシウム・ナン。
【請求項4】
請求項1〜3の何れか1項に記載のピシウム・ナンの菌体を含有する植物病害防除剤。
【請求項5】
苗立枯病に対する請求項4に記載の植物病害防除剤。
【請求項6】
請求項1〜3の何れか1項に記載のピシウム・ナンを増殖させた栽培用土壌。
【請求項7】
請求項4又は請求項5に記載の植物病害防除剤を添加した栽培用土壌。
【請求項8】
請求項1〜3の何れか1項に記載のピシウム・ナンを土壌中で増殖させる土壌改良方法。
【請求項9】
併せて新鮮有機物を施肥する請求項8に記載の土壌改良方法。
【請求項10】
前記新鮮有機物は緑肥である請求項9に記載の土壌改良方法。
【請求項11】
請求項1〜3の何れか1項に記載のピシウム・ナンの菌体を含むコーティング剤でコーティングされた植物種子。
【請求項12】
請求項1〜3の何れか1項に記載のピシウム・ナンを含む土壌で発芽又は生育させた植物苗。
【請求項13】
請求項4又は5に記載の植物病害防除剤を含む土壌で発芽又は生育させた植物苗。
【請求項14】
請求項6又は7に記載の土壌と植物苗とで構成されるポット苗。
【請求項15】
前記植物苗がキュウリ苗、トマト苗、クローバ苗、エンバク苗の何れかである請求項12又は13に記載の植物苗若しくは請求項14に記載のポット苗。
【請求項1】
rDNAのITS領域に配列番号1に示された塩基配列と99%以上の同一性がある塩基配列を有するピシウム・ナン。
【請求項2】
ピシウム・ウルティマムに対して拮抗性を有する請求項1に記載のピシウム・ナン。
【請求項3】
財団法人産業技術創業研究所特許生物寄託センター受領番号FERM AP−21976又は受領番号FERM AP−21977で寄託されたピシウム・ナン。
【請求項4】
請求項1〜3の何れか1項に記載のピシウム・ナンの菌体を含有する植物病害防除剤。
【請求項5】
苗立枯病に対する請求項4に記載の植物病害防除剤。
【請求項6】
請求項1〜3の何れか1項に記載のピシウム・ナンを増殖させた栽培用土壌。
【請求項7】
請求項4又は請求項5に記載の植物病害防除剤を添加した栽培用土壌。
【請求項8】
請求項1〜3の何れか1項に記載のピシウム・ナンを土壌中で増殖させる土壌改良方法。
【請求項9】
併せて新鮮有機物を施肥する請求項8に記載の土壌改良方法。
【請求項10】
前記新鮮有機物は緑肥である請求項9に記載の土壌改良方法。
【請求項11】
請求項1〜3の何れか1項に記載のピシウム・ナンの菌体を含むコーティング剤でコーティングされた植物種子。
【請求項12】
請求項1〜3の何れか1項に記載のピシウム・ナンを含む土壌で発芽又は生育させた植物苗。
【請求項13】
請求項4又は5に記載の植物病害防除剤を含む土壌で発芽又は生育させた植物苗。
【請求項14】
請求項6又は7に記載の土壌と植物苗とで構成されるポット苗。
【請求項15】
前記植物苗がキュウリ苗、トマト苗、クローバ苗、エンバク苗の何れかである請求項12又は13に記載の植物苗若しくは請求項14に記載のポット苗。
【図2】


【図3】


【図6】


【図1】


【図4】


【図5】




【図3】


【図6】


【図1】


【図4】


【図5】


【公開番号】特開2012−5426(P2012−5426A)
【公開日】平成24年1月12日(2012.1.12)
【国際特許分類】
【出願番号】特願2010−144990(P2010−144990)
【出願日】平成22年6月25日(2010.6.25)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り A. (1)刊行物名 平成22年度 日本植物病理学会大会 プログラム・講演要旨予稿集 (2)発行日 平成22年3月30日 (3)発行者 日本植物病理学会 (4)該当ページ 第55ページ B. (1)ホームページのアドレス http://www.ncbi.nlm.nih.gov/nuccore/292680165 (2)掲載日 平成22年4月1日
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【Fターム(参考)】
【公開日】平成24年1月12日(2012.1.12)
【国際特許分類】
【出願日】平成22年6月25日(2010.6.25)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り A. (1)刊行物名 平成22年度 日本植物病理学会大会 プログラム・講演要旨予稿集 (2)発行日 平成22年3月30日 (3)発行者 日本植物病理学会 (4)該当ページ 第55ページ B. (1)ホームページのアドレス http://www.ncbi.nlm.nih.gov/nuccore/292680165 (2)掲載日 平成22年4月1日
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【Fターム(参考)】
[ Back to top ]

