新規ピノレジノールレダクターゼ遺伝子及び当該遺伝子を導入した形質転換植物
【課題】植物以外の生物由来のピノレジノールレダクターゼ遺伝子の提供。
【解決手段】特定のアミノ酸配列からなるタンパク質をコードするピノレジノールレダクターゼ遺伝子。スフィンゴモナス科(Sphingomonadaceae)細菌由来である、ピノレジノールレダクターゼ遺伝子。該ピノレジノールレダクターゼ遺伝子を機能しうる形で導入されてなる形質転換植物。該ピノレジノールレダクターゼ遺伝子の導入前の植物と比較して、リグニン及びリグナンの代謝が改変した、形質転換植物。
【解決手段】特定のアミノ酸配列からなるタンパク質をコードするピノレジノールレダクターゼ遺伝子。スフィンゴモナス科(Sphingomonadaceae)細菌由来である、ピノレジノールレダクターゼ遺伝子。該ピノレジノールレダクターゼ遺伝子を機能しうる形で導入されてなる形質転換植物。該ピノレジノールレダクターゼ遺伝子の導入前の植物と比較して、リグニン及びリグナンの代謝が改変した、形質転換植物。
【発明の詳細な説明】
【背景技術】
【0001】
リグニンは、植物細胞壁に含まれる芳香族ポリマーであり、植物の生育の様々な段階で重要な役割を果たしている。リグニンは、フェニルアラニンやチロシンから生合成されるコニフェリルアルコールなどのケイ皮アルコール類が重合することで細胞壁に沈着する。
【0002】
一方、リグナンは、植物の細胞に蓄積する低分子の芳香族化合物で、リグニンと同様にコニフェリルアルコール等を基本骨格として合成されるが、一般には配糖化などの修飾を受け、細胞質、液胞、細胞壁等に存在していると考えられている。同一の細胞内にリグニンとリグナンが同時に存在する場合、その作り分けがどのようになされているのかは、未だ明らかではない。
【0003】
産業利用上の観点から見た場合、リグニンの存在は木質(木材)からのパルプの生産性に対して負の効果を持ち、また飼料に含まれるリグニンが反芻動物の消化器官における飼料の消化性を阻害することも一般に知られている。これまでにリグニンの量や分子構造を変化させるために、種々の遺伝子を用いた遺伝子組換え植物に関する報告が多くなされている(特許文献1〜6)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許公開平9-173069号公報
【特許文献2】特許公表平11-514227号公報
【特許文献3】特許公開平11-276181号公報
【特許文献4】特許公表2001-500378号公報
【特許文献5】特許公表2004-520015号公報
【特許文献6】特許公表2008-513030号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
ところで、ピノレジノールレダクターゼは、リグニン二量体であるピノレジノールをラリシレジノール及び/又はセコイソラリシレジノールに変換する活性を有する還元酵素であり、シロイヌナズナ等の植物において見いだされてきた。しかしながら、植物以外の生物においてピノレジノールレダクターゼをコードする遺伝子は知られていなかった。酵素活性や基質特異性、その他の特徴が植物由来のピノレジノールレダクターゼとは異なる新たなピノレジノールレダクターゼをコードする遺伝子を見いだすことが期待されていた。
【0006】
そこで、本発明は、上述した実情に鑑み、植物以外の生物由来のピノレジノールレダクターゼ遺伝子及び当該遺伝子を導入した形質転換植物を提供することを目的としている。
【課題を解決するための手段】
【0007】
上述した目的を達成するため、本発明者らが鋭意検討した結果、Sphingobium属細菌からピノレジノールレダクターゼをコードする遺伝子を単離・同定することに成功した。本発明者らは、植物以外の生物から初めてピノレジノールレダクターゼ遺伝子を単離・同定したこととなる。本発明は、このような知見に基づいて案出されたものであり、以下を包含する。
【0008】
(1)以下の(a)〜(c)いずれかに記載のタンパク質をコードするピノレジノールレダクターゼ遺伝子
(a)配列番号2に示すアミノ酸配列からなるタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質
(c)配列番号2に示すアミノ酸配列に対する類似度(Similarity)が例えば70%以上のアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質
(2)上記タンパク質は、ピノレジノールを基質としてラリシレジノールへ変換する活性と、ラリシレジノールを基質としてセコイソラリシレジノールへ変換する活性とを有することを特徴とする(1)記載のピノレジノールレダクターゼ遺伝子。
(3)スフィンゴモナス科(Sphingomonadaceae)細菌由来であることを特徴とする(1)記載のピノレジノールレダクターゼ遺伝子。
(4)上記スフィンゴモナス科(Sphingomonadaceae)細菌はSphingobium属細菌であることを特徴とする(3)記載のピノレジノールレダクターゼ遺伝子。
(5)上記(1)乃至上記(4)いずれかに記載のピノレジノールレダクターゼ遺伝子を機能しうる形で導入されてなる形質転換植物。
(6)上記ピノレジノールレダクターゼ遺伝子の導入前の植物と比較して、リグニン及びリグナンの代謝が改変したことを特徴とする(5)記載の形質転換植物。
【発明の効果】
【0009】
本発明によれば、植物以外の生物由来として初めてのピノレジノールレダクターゼ遺伝子を提供することができる。本発明に係るピノレジノールレダクターゼ遺伝子を利用することにより、リグニンやリグナンの代謝調節能を改変した形質転換植物を作出することができる。
【図面の簡単な説明】
【0010】
【図1】ピノレジノールの変換活性が確認されたクローン150及び陰性対照であるクローン35の培養液上清をHPLC分析した結果を示す特性図である。
【図2】pinZ遺伝子で形質転換した大腸菌BL21(DE3)株及び発現ベクターpET-16bで形質転換した陰性対照の大腸菌BL21(DE3)株におけるピノレジノール変換能を分析した結果を示す特性図である。
【図3】pinZ遺伝子で形質転換した大腸菌BL21(DE3)株からアフィニティクロマトグラフィによりPinZを精製した後のSDS-PAGEの結果を示す電気泳動写真である。
【発明を実施するための形態】
【0011】
以下、本発明に係る新規ピノレジノールレダクターゼ遺伝子及びこれを用いて作製した形質転換植物について詳細に説明する。
【0012】
ピノレジノールレダクターゼ遺伝子
本発明は、植物以外の生物、具体的にはスフィンゴモナス科(Sphingomonadaceae)細菌由来のピノレジノールレダクターゼ遺伝子に関する。スフィンゴモナス科細菌としては、ブラストモナス属(Blastomonas)細菌、シトロミクロビウム属(Citromicrobium)細菌、カイストバクター属(Kaistobacter)属、ルチバクテリウム属(Lutibacterium)細菌、ノボスフィンゴビウム属(Novosphingobium)細菌、サンダラシノバクター属(Sandaracinobacter)細菌、サンダラキノハダス属(Sandarakinorhabdus)細菌、スフィンゴビウム属(Sphingobium)細菌、スフィンゴモナス属(Sphingomonas)細菌、スフィンゴピクシス属(Sphingopyxis)細菌、スフィンゴシニセラ属(Sphingosinicella)細菌及びジモモナス属(Zymomonas)細菌を挙げることができる。すなわち、本発明に係るピノレジノールレダクターゼ遺伝子は、これらいずれの属に属する細菌由来の遺伝子であってもよい。
【0013】
一例として、本発明に係るピノレジノールレダクターゼ遺伝子としては、Sphingobium属細菌由来の遺伝子を挙げることができるが、これに限定されるものではない。より具体的に、本発明に係るピノレジノールレダクターゼ遺伝子としては、Sphingobium属細菌であるSphingobium sp. SKY-6株にて同定され、単離された遺伝子(pinZ遺伝子と呼称される)を挙げることができる。pinZ遺伝子におけるピノレジノールレダクターゼをコードする領域の塩基配列を配列番号1に示し、pinZ遺伝子がコードするピノレジノールレダクターゼのアミノ酸配列を配列番号2に示す。
【0014】
本発明に係るピノレジノールレダクターゼ遺伝子は、配列番号1及び2に示すpinZ遺伝子に限定されず、例えば、配列番号2で特定されるアミノ酸配列において1又は複数個のアミノ酸配列が欠失、置換、付加又は挿入されたアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質をコードする遺伝子であっても良い。ここで、複数個のアミノ酸としては、例えば、1から40個、好ましくは1から30個、より好ましくは1から20個、さらに好ましくは1個から10個、特に好ましくは1個から5個を意味する。なお、アミノ酸の欠失、置換若しくは付加は、当該技術分野で公知の手法を適用してpinZ遺伝子を構成するポリヌクレオチドを改変することによって行うことができる。ポリヌクレオチドに変異を導入するには、Kunkel法またはGapped duplex法等の公知手法又はこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-KやMutant-G(何れも商品名、TAKARA Bio社製))等を用いて、あるいはLA PCR in vitro Mutagenesisシリーズキット(商品名、TAKARA Bio社製)を用いて変異が導入される。また、変異導入方法としては、EMS(エチルメタンスルホン酸)、5-ブロモウラシル、2-アミノプリン、ヒドロキシルアミン、N-メチル-N’-ニトロ-Nニトロソグアニジン、その他の発ガン性化合物に代表されるような化学的変異剤を使用する方法でも良いし、X線、アルファ線、ベータ線、ガンマ線、イオンビームに代表されるような放射線処理や紫外線処理による方法でも良い。
【0015】
また、本発明に係るピノレジノールレダクターゼ遺伝子は、Sphingobium属細菌由来のpinZ遺伝子の相同遺伝子であってもよい。ここで、相同遺伝子とは、一般的に、共通の祖先遺伝子から進化分岐した遺伝子を意味しており、2種類の種の相同遺伝子(オルソログ(ortholog))及び同一種内で重複分岐により生じた相同遺伝子(パラログ(paralog))を含む意味である。よって、本発明に係るピノレジノールレダクターゼ遺伝子は、pinZ遺伝子のオルソログやパラログといった相同遺伝子を含む意味である。但し、本発明に係るピノレジノールレダクターゼ遺伝子には、共通遺伝子から進化せず、単に類似した機能を有する遺伝子も含まれている。
【0016】
さらに、本発明に係るピノレジノールレダクターゼ遺伝子は、配列番号2に示すアミノ酸配列に対する類似度(Similarity)が例えば70%以上、好ましくは80%以上、より好ましくは90%以上、最も好ましくは95%以上であるアミノ酸配列を有し、且つ、ピノレジノールレダクターゼ活性を有するタンパク質をコードする遺伝子を挙げることができる。ここで、類似度の値は、EMBOSS pairwise alignment algorithms(http://www.ebi.ac.uk/Tools/emboss/align/)プログラムを実装したコンピュータプログラム及び遺伝子配列情報を格納したデータベースを用いてデフォルトの設定で求められる値を意味する。
【0017】
なお、pinZ遺伝子がコードするPinZタンパク質のアミノ酸配列(配列番号2)に基づいて、上記データベースを検索すると、スフィンゴモナス科(Sphingomonadaceae)細菌であるNovosphingobium aromaticivorans DSM 12444株で報告されている機能未知のNmrA様タンパク質を特定することができる。アミノ酸レベルで比較した場合、PinZタンパク質とNmrA様タンパク質の類似度及び同一性はそれぞれ85.8%及び76.3%であった。よって、このNmrA様タンパク質は、Novosphingobium aromaticivorans DSM 12444株におけるピノレジノールレダクターゼである蓋然性が高いと言える。
【0018】
さらにまた、本発明に係るピノレジノールレダクターゼ遺伝子としては、配列番号1の塩基配列からなるポリヌクレオチドの少なくとも一部に対して、ストリンジェントな条件下でハイブリダイズし、且つ、ピノレジノールレダクターゼ活性を有するタンパク質をコードする遺伝子であってもよい。すなわち、供試生物からゲノムを抽出するか或いは対象となる生物のcDNAライブラリーを構築し、配列番号1の塩基配列からなるポリヌクレオチドの少なくとも一部に対して、ストリンジェントな条件下でハイブリダイズするゲノム領域或いはcDNAを単離することで同定することができる。ここで、ストリンジェントな条件とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。例えば、45℃、6×SSC(塩化ナトリウム/クエン酸ナトリウム)でのハイブリダイゼーション、その後の50〜65℃、0.2〜1×SSC、0.1%SDSでの洗浄が挙げられ、或いはそのような条件として、65〜70℃、1×SSCでのハイブリダイゼーション、その後の65〜70℃、0.3×SSCでの洗浄を挙げることができる。ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。
【0019】
以上のように、本発明に係るピノレジノールレダクターゼ遺伝子は、具体的な塩基配列及びアミノ酸配列が決められたpinZ遺伝子に限定されず、ピノレジノールレダクターゼ活性を有するタンパク質をコードする限り、種々の塩基配列及びアミノ酸配列で特定される遺伝子を含んでいる。ここで、ピノレジノールレダクターゼ活性とは、下記化学式に示すように、ピノレジノールをラリシレジノールへと変換する活性及び/又はラリシレジノールをセコイソラリシレジノールへと変換する活性を意味する。特に、本発明に係るピノレジノールレダクターゼ遺伝子はこれら両方の活性を有するタンパク質をコードする遺伝子であることが好ましい。
【0020】
【化1】

【0021】
所定のタンパク質が上記ピノレジノールレダクターゼ活性を有するか否かは、例えば、供試タンパク質を、ピノレジノール及び/又はラリシレジノールを含む溶液に添加し、上述した変換反応の反応産物を検出することで評価できる。ラリシレジノールやセコイソラリシレジノールといった反応産物は、高速液体クロマトグラフィー等の手法で検出することができる。
【0022】
ところで、本発明に係るピノレジノールレダクターゼ遺伝子は、従来公知の植物由来のピノレジノールレダクターゼ遺伝子とはアミノ酸レベルでの類似度が著しく低い。具体的に、シロイヌナズナ(Arabidopsis thaliana)では2つのピノレジノールレダクターゼ遺伝子(AtPrR1遺伝子及びAtPrR2遺伝子)が知られているが、これらと配列番号2のアミノ酸配列との類似度は、それぞれ37%及び28%である。またAtPrR1遺伝子及びAtPrR2遺伝子と配列番号2のアミノ酸配列との同一性は、それぞれ21%及び16%である。さらに、ベイスギ (米杉、アメリカネズコ, レッドシダー、学名:Thuja plicata)では2つのピノレジノールレダクターゼ遺伝子(PLR_Tp1遺伝子及びPLR_Tp2遺伝子)が知られているが、これらと配列番号2のアミノ酸配列との類似度は、それぞれ29%及び35%である。またPLR_Tp1遺伝子及びPLR_Tp2遺伝子と配列番号2のアミノ酸配列との同一性は、それぞれ15%及び21%である。
【0023】
形質転換植物
上述した本発明に係るピノレジノールレダクターゼ遺伝子を機能する形で宿主となる植物に導入することで、本発明に係る形質転換植物を作製することができる。ピノレジノールレダクターゼ遺伝子を機能する形で導入するとは、当該ピノレジノールレダクターゼ遺伝子が発現してピノレジノールレダクターゼ活性を発揮することを意味する。ピノレジノールレダクターゼ遺伝子を宿主植物に導入する際には、例えば、当該遺伝子を組み込んだ発現ベクターを利用することができる。
【0024】
発現ベクターは、植物体内で発現を可能とするプロモーターと、上述したピノレジノールレダクターゼ遺伝子とを含むように構築する。発現ベクターの母体となるベクターとしては、従来公知の種々のベクターを用いることができる。例えば、プラスミド、ファージ、またはコスミド等を用いることができ、導入される植物細胞や導入方法に応じて適宜選択することができる。具体的には、例えば、pBR322、pBR325、pUC19、pUC119、pBluescript、pBluescriptSK、pBI系のベクター等を挙げることができる。特に、植物体へのベクターの導入法がアグロバクテリウムを用いる方法である場合には、pBI系のバイナリーベクターを用いることが好ましい。pBI系のバイナリーベクターとしては、具体的には、例えば、pBIG、pBIN19、pBI101、pBI121等を挙げることができる。
【0025】
プロモーターは、植物体内でピノレジノールレダクターゼ遺伝子を発現させることが可能なプロモーターであれば特に限定されるものではなく、公知のプロモーターを好適に用いることができる。かかるプロモーターとしては、例えば、カリフラワーモザイクウイルス35Sプロモーター(CaMV35S)、各種アクチン遺伝子プロモーター、各種ユビキチン遺伝子プロモーター、ノパリン合成酵素遺伝子のプロモーター、タバコのPR1a遺伝子プロモーター、ナピン遺伝子プロモーター、オレオシン遺伝子プロモーター等を挙げることができる。この中でも、カリフラワーモザイクウイルス35Sプロモーター、アクチン遺伝子プロモーター又はユビキチン遺伝子プロモーターをより好ましく用いることができる。上記各プロモーターを用いれば、植物細胞内に導入されたときに任意の遺伝子を強く発現させることが可能となる。
【0026】
また、プロモーターとしては、植物における部位特異的に発現させる機能を有するものを使用することもできる。このようなプロモーターとしては、従来公知の如何なるプロモーターを使用することができる。このようなプロモーターを使用して、上記ピノレジノールレダクターゼ遺伝子を部位特異的に発現させることができる。
【0027】
なお、発現ベクターは、プロモーター及び上記ピノレジノールレダクターゼ遺伝子に加えて、さらに他のDNAセグメントを含んでいてもよい。当該他のDNAセグメントは特に限定されるものではないが、ターミネーター、選別マーカー、エンハンサー、翻訳効率を高めるための塩基配列等を挙げることができる。また、発現ベクターは、さらにT-DNA領域を有していてもよい。T-DNA領域は特にアグロバクテリウムを用いて上記組換え発現ベクターを植物体に導入する場合に遺伝子導入の効率を高めることができる。
【0028】
転写ターミネーターは転写終結部位としての機能を有していれば特に限定されるものではなく、公知のものであってもよい。例えば、具体的には、ノパリン合成酵素遺伝子の転写終結領域(Nosターミネーター)、カリフラワーモザイクウイルス35Sの転写終結領域(CaMV35Sターミネーター)等を好ましく用いることができる。この中でもNosターミネーターをより好ましく用いることできる。上記発現ベクターにおいては、転写ターミネーターを適当な位置に配置することにより、植物細胞に導入された後に、不必要に長い転写物を合成されることを防止することができる。
【0029】
形質転換体選別マーカーとしては、例えば薬剤耐性遺伝子を用いることができる。かかる薬剤耐性遺伝子の具体的な一例としては、例えば、ハイグロマイシン、ブレオマイシン、カナマイシン、ゲンタマイシン、クロラムフェニコール等に対する薬剤耐性遺伝子を挙げることができる。これにより、上記抗生物質を含む培地中で生育する植物体を選択することによって、形質転換された植物体を容易に選別することができる。
【0030】
翻訳効率を高めるための塩基配列としては、例えばタバコモザイクウイルス由来のomega配列を挙げることができる。このomega配列をプロモーターの非翻訳領域(5’UTR)に配置させることによって、上記融合遺伝子の翻訳効率を高めることができる。このように、上記組換え発現ベクターには、その目的に応じて、さまざまなDNAセグメントを含ませることができる。
【0031】
発現ベクターの構築方法についても特に限定されるものではなく、適宜選択された母体となるベクターに、上記プロモーター、上記ピノレジノールレダクターゼ遺伝子、および転写抑制転換ポリヌクレオチド、並びに必要に応じて上記他のDNAセグメントを所定の順序となるように導入すればよい。例えば、上記ピノレジノールレダクターゼ遺伝子とプロモーターと(必要に応じて転写ターミネーター等)とを連結して発現カセットを構築し、これをベクターに導入すればよい。発現カセットの構築では、例えば、各DNAセグメントの切断部位を互いに相補的な突出末端としておき、ライゲーション酵素で反応させることで、当該DNAセグメントの順序を規定することが可能となる。なお、発現カセットにターミネーターが含まれる場合には、上流から、プロモーター、上記ピノレジノールレダクターゼ遺伝子、ターミネーターの順となっていればよい。また、発現ベクターを構築するための試薬類、すなわち制限酵素やライゲーション酵素等の種類についても特に限定されるものではなく、市販のものを適宜選択して用いればよい。
【0032】
また、上記発現ベクターの増殖方法(生産方法)も特に限定されるものではなく、従来公知の方法を用いることができる。一般的には大腸菌をホストとして当該大腸菌内で増殖させればよい。このとき、ベクターの種類に応じて、好ましい大腸菌の種類を選択してもよい。
【0033】
上述した発現ベクターは、一般的な形質転換方法によって対象の植物内に導入される。発現ベクターを植物細胞に導入する方法(形質転換方法)は特に限定されるものではなく、植物細胞に応じた適切な従来公知の方法を用いることができる。具体的には、例えば、アグロバクテリウムを用いる方法や直接植物細胞に導入する方法を用いることができる。アグロバクテリウムを用いる方法としては、例えば、Bechtold, E., Ellis, J. and Pelletier, G. (1993) In Planta Agrobacterium-mediated gene transfer by infiltration of adult Arabidopsis plants. C.R. Acad. Sci. Paris Sci. Vie, 316, 1194-1199. あるいは、Zyprian E, Kado Cl, Agrobacterium-mediated plant transformation by novel mini-T vectors in conjunction with a high-copy vir region helper plasmid. Plant Molecular Biology, 1990, 15(2), 245-256.に記載された方法を用いることができる。
【0034】
発現ベクターを直接植物細胞に導入する方法としては、例えば、マイクロインジェクション法、エレクトロポレーション法(電気穿孔法)、ポリエチレングリコール法、パーティクルガン法、プロトプラスト融合法、リン酸カルシウム法等を用いることができる。
【0035】
また、DNAを直接植物細胞に導入する方法を採るなら、対象とする遺伝子の発現に必要な転写ユニット、例えばプロモーターや転写ターミネーターと、対象とする遺伝子を含んだDNAであれば十分であり、ベクター機能は必須ではない。さらに、転写ユニットを有さない対象とする遺伝子のタンパク質コード領域のみを含むDNAであっても、宿主の転写ユニット内にインテグレートし、対象となる遺伝子を発現することができればよい。
【0036】
上記発現ベクターや、発現ベクターを含まず対象となる遺伝子を含んだ発現カセットが導入される植物細胞としては、例えば、花、葉、根等の植物器官における各組織の細胞、カルス、懸濁培養細胞等を挙げることができる。ここで、発現ベクターは、生産しようとする種類の植物体に合わせて適切なものを適宜構築してもよいが、汎用的な発現ベクターを予め構築しておき、それを植物細胞に導入してもよい。
【0037】
発現ベクターの導入対象となる植物、すなわち形質転換植物としては、特に限定されず如何なる植物でもよい。上述したピノレジノールレダクターゼ遺伝子を発現させることによって、あらゆる植物体についてリグニン及び/又はリグナンの代謝を改変することができる。対象となる植物としては、例えば、双子葉植物、単子葉植物、例えばアブラナ科、イネ科、ナス科、マメ科、ヤナギ科等に属する植物(下記参照)が挙げられるが、これらの植物に限定されるものではない。また、対象となる植物は、草本系植物及び木本系植物のいずれでも良い。対象となる植物の一例を以下に示すが、本発明はこれら具体的な植物に限定されるものではない。
【0038】
アブラナ科:シロイヌナズナ(Arabidopsis thaliana)、キャベツ(Brassica oleracea var. capitata)、ナタネ(Brassica rapa、Brassica napus)、ハクサイ(Brassica rapa var. pekinensis)、チンゲンサイ(Brassica rapa var. chinensis)、カブ(Brassica rapa var. rapa)、ノザワナ(Brassica rapa var. hakabura)、ミズナ(Brassica rapa var. lancinifolia)、コマツナ(Brassica rapa var. peruviridis)、パクチョイ(Brassica rapa var. chinensis)、ダイコン(Raphanus sativus)、ワサビ(Wasabia japonica)など。
ナス科:タバコ(Nicotiana tabacum)、ナス(Solanum melongena)、ジャガイモ(Solanum tuberosum)、トマト(Lycopersicon lycopersicum)、トウガラシ(Capsicum annuum)、ペチュニア(Petunia)など。
マメ科:ダイズ(Glycine max)、エンドウ(Pisum sativum)、ソラマメ(Vicia faba)、フジ(Wisteria floribunda)、ラッカセイ(Arachis. hypogaea)、ミヤコグサ(Lotus corniculatus var. japonicus)、インゲンマメ(Phaseolus vulgaris)、アズキ(Vigna angularis)、アカシア(Acacia)など。
キク科:キク(Chrysanthemum morifolium)、ヒマワリ(Helianthus annuus)など。
ヤシ科:アブラヤシ(Elaeis guineensis、Elaeis oleifera)、ココヤシ(Cocos nucifera)、ナツメヤシ(Phoenix dactylifera)、ロウヤシ(Copernicia)
ウルシ科:ハゼノキ(Rhus succedanea)、カシューナットノキ(Anacardium occidentale)、ウルシ(Toxicodendron vernicifluum)、マンゴー(Mangifera indica)、ピスタチオ(Pistacia vera)
ウリ科:カボチャ(Cucurbita maxima、Cucurbita moschata、Cucurbita pepo)、キュウリ(Cucumis sativus)、カラスウリ(Trichosanthes cucumeroides)、ヒョウタン(Lagenaria siceraria var. gourda)
バラ科:アーモンド(Amygdalus communis)、バラ(Rosa)、イチゴ(Fragaria)、サクラ(Prunus)、リンゴ(Malus pumila var. domestica)など。
ナデシコ科:カーネーション(Dianthus caryophyllus)など。
ヤナギ科:ポプラ(Populus trichocarpa、Populus nigra、Populus tremula)
イネ科:トウモロコシ(Zea mays)、イネ(Oryza sativa)、オオムギ(Hordeum vulgare)、コムギ(Triticum aestivum)、タケ(Phyllostachys)、サトウキビ(Saccharum officinarum)、ネピアグラス(Pennisetum pupureum)、エリアンサス(Erianthus ravenae)、ミスキャンタス(ススキ)(Miscanthus virgatum)、ソルガム(Sorghum)スイッチグラス(Panicum)など。
ユリ科:チューリップ(Tulipa)、ユリ(Lilium)など。
【0039】
上述したピノレジノールレダクターゼ遺伝子が機能する形で導入された形質転換植物では、導入前の植物と比較してリグニン及び/又はリグナンの代謝が改変されている。具体的には、導入されたピノレジノールレダクターゼ遺伝子が発現することで、植物体内におけるピノレジノールレダクターゼ活性が強まり、リグニン二量体であるピノレジノールの蓄積量が低減する。これより、形質転換植物は、導入前の植物と比較してリグニン・ポリマーの構造や含有量が改変することとなり、パルプ化やバイオエタノール生産の効率を向上させることができる。また、形質転換植物は、導入前の植物と比較してラリシレジノールやセコイソラリシレジノールの含有量が向上するため、これら化合物やその派生物といった有用物質の生産効率を向上させることができる。
【実施例】
【0040】
以下、実施例により本発明を更に詳細に説明するが、本発明の技術的範囲は以下の実施例に限定されるものではない。
【0041】
〔実施例1〕
1.遺伝子ライブラリーの構築
Sphingobium sp. SYK-6株(以下、SYK-6株とする。独立行政法人製品評価技術基盤機構よりNBRC 103272で入手可能)の全ゲノムを制限酵素SalIで部分消化した後にコスミドベクターpVK100とライゲーションさせ、in vitroパッケージング後、Escherichia coli HB101株に感染させて遺伝子ライブラリーを作製した。三親接合法によってHB101株が持つコスミドをPseudomonas putida PpY1100株に伝達させ、カナマイシンを含む寒天培地上に形質転換株を塗布することでコロニーを形成させた後、独立した200個の形質転換体を選んで各々に番号を付し、それぞれから釣菌して別の寒天培地上に画線培養した。このようにして、SYK-6株の遺伝子ライブラリーをPpY1100株中に構築した。
【0042】
2.ピノレジノール変換能を有するクローンの選抜
上記のライブラリーから170個のクローンを無作為に選び、各々をカナマイシン50μg/ml含む1mlのLB培地に接種して、30℃で一昼夜振とう培養をした。培養後、10クローンの培養液を混合して一つの試料とし、これを1バッチとした。これを遠心処理により培養液を除いた後、菌体のみを回収した。このようにして調製した菌体に、50mM Tris-HCl (pH7.4)を1ml、6 mMピノレジノールを5μl添加し、28℃で24時間振とう培養した。培養終了後、培養液全量を回収して15,000rpm、5分の遠心分離処理を施し、上清をHPLC分析することにより、各培養液に添加したピノレジノールの変化を調べた。
【0043】
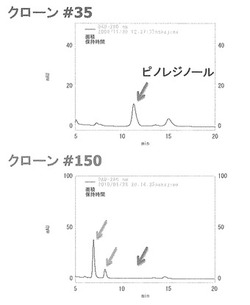
上記のようにして実験を行ったところ、解析した17個のバッチの試料の中の1つにピノレジノールの変換活性が確認された。そこで、当該バッチに含まれる10クローンの形質転換株を、上記と同様の方法で1クローンずつ別々に再度解析したところ、クローン番号150を付した形質転換クローンのみにピノレジノールの変換能が備わっていることが明らかとなった。図1に、クローン150と陰性対照であるクローン35を接種した試料のHPLC分析の結果を示す。クローン150を接種した試料でのみ、ピノレジノールのピークが消失して新しいピークが2つ出現している(図1中の矢印)。
【0044】
以上のことから、クローン150が持つコスミドベクターに搭載されているSYK-6株のゲノムDNA断片上に、ピノレジノールを変換する酵素の遺伝子がコードされていることが明らかとなった。
【0045】
3.遺伝子のクローニング
上記クローン150が持つコスミドベクターを回収して調べたところ、このベクター上にはSYK-6株に由来する約18kbpのゲノムDNAがクローン化されていた。更に、当該ゲノムDNAの塩基配列を解析したところ、この中には25個のオープンリーディングフレーム(以下、ORF)が存在していることが明らかになった。そこで、この25個のORFに含まれるピノレジノール変換能を与える遺伝子を特定するため、制限酵素を用いたゲノムDNAのサブクローニングやPCRを用いた単一ORFのクローニング等を実施し、これらを用いて組換え大腸菌によるピノレジノール変換実験を行った。その結果、ORFの1つがピノレジノールを変換する能力を担う酵素のアミノ酸配列をコードしていることが明らかとなり、この酵素をPinZ(遺伝子名:pinZ)と命名した。pinZのORFは951 bp(配列番号1)であり、316アミノ酸(配列番号2)、約34 kDaからなるポリペプチドをコードしていた。
【0046】
4.遺伝子の相同性検索
上記で得られたPinZのアミノ酸配列を公知のタンパク質のそれに対して相同性検索したところ、Novosphingobium aromaticivorans DSM 12444株に由来する機能が不明なNmrA-likeタンパク質(配列番号3)と76%の同一性(86%の類似度)を有していることが判明した。一方、シロイヌナズナ(Arabidopsis thaliana)から既にクローニングされているピノレジノールレダクターゼAtPrR1の遺伝子やウェスタンレッドシダーのピノレジノール/ラリシレジノールレダクターゼPLR-Tp1の遺伝子にコードされているポリペプチドとは、各々21%、15%程度の同一性を示すに過ぎなかった。
【0047】
5.遺伝子の過剰発現によるPinZタンパク質の生産とその解析
pinZのアミノ酸コード領域をPCRにより増幅後、このDNAを発現ベクターpET16-bへクローニングした。次に、このようにして得られたベクターpETPZを用いて大腸菌BL21(DE3)株を形質転換した。形質転換株をOD600が0.5になるまで37℃で振とう培養した後、終濃度が1mMになるようにIPTGを添加して、30℃で更に4時間培養した。培養終了後、緩衝液で菌体を2回洗浄し、OD600が10の休止菌体を調製した。これに終濃度0.1 mMのピノレジノールを添加した後、30℃で12時間反応させ、反応液をLC-MSで分析した。陰性対照として、発現ベクターpET-16bで形質転換した大腸菌BL21(DE3)株を用いて、同様の実験を行った。その結果を図2に示す。
【0048】
陰性対照の場合には12時間後も溶出時間3.1分にピノレジノールのピークが検出されたのに対し(図2A)、pETPZを用いて形質転換した大腸菌BL21(DE3)株を用いた場合には、溶出時間1.6分と1.8分に2つのピークが現れた(図2B)。別途有機合成した標品の溶出時間と分子イオンピークから、上述の2つのピークは、各々、セコイソラリシレジノールとラリシレジノールであることが明らかになった。これらのことから、PinZはピノレジノールを還元することでラリシレジノールを生成し、更にラリシレジノールを還元してセコイソラリシレジノールを生成するピノレジノール/ラリシレジノールレダクターゼであることが判明した。
【0049】
6.精製酵素の性質
上述のpETPZを用いて形質転換した大腸菌BL21(DE3)株からアフィニティクロマトグラフィによりPinZ(ヒスチジンタグが付加されたPinZ)を精製し、その性質を評価した。精製処理前後の酵素のSDS-PAGEを図3に示す。精製したPinZを100μg用い、100μMピノレジノール又はラリシレジノール、150μMのNADPHを含む1 mlの50mM Tris-HCl(pH7.0)で反応させて酵素活性を検出した。PinZはピノレジノール又はラリシレジノールの還元にNADPHを要求するため、その酵素活性は30℃で1分間に1 μmolのNADPHを消費する量を1ユニット(U)と規定した。上記反応条件で測定した場合、精製PinZのピノレジノールに対する比活性は468U/mgであり、ラリシレジノールに対するそれは0.033U/mgであった。中坪らによると、前述のシロイヌナズナのAtPrR1の精製組換え酵素が示す還元活性は、ピノレジノールとラリシレジノールに対して各々35.5 nU/mg、1.1 nU/mgであることから(Journal of Biological Chemistry, vol. 283, pp. 15550-15557, 2008)、本研究で得られたPinZは、AtPrR1と比較してピノレジノールとラリシレジノールに対して極めて高い還元活性を保持していることが判明した。
【背景技術】
【0001】
リグニンは、植物細胞壁に含まれる芳香族ポリマーであり、植物の生育の様々な段階で重要な役割を果たしている。リグニンは、フェニルアラニンやチロシンから生合成されるコニフェリルアルコールなどのケイ皮アルコール類が重合することで細胞壁に沈着する。
【0002】
一方、リグナンは、植物の細胞に蓄積する低分子の芳香族化合物で、リグニンと同様にコニフェリルアルコール等を基本骨格として合成されるが、一般には配糖化などの修飾を受け、細胞質、液胞、細胞壁等に存在していると考えられている。同一の細胞内にリグニンとリグナンが同時に存在する場合、その作り分けがどのようになされているのかは、未だ明らかではない。
【0003】
産業利用上の観点から見た場合、リグニンの存在は木質(木材)からのパルプの生産性に対して負の効果を持ち、また飼料に含まれるリグニンが反芻動物の消化器官における飼料の消化性を阻害することも一般に知られている。これまでにリグニンの量や分子構造を変化させるために、種々の遺伝子を用いた遺伝子組換え植物に関する報告が多くなされている(特許文献1〜6)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許公開平9-173069号公報
【特許文献2】特許公表平11-514227号公報
【特許文献3】特許公開平11-276181号公報
【特許文献4】特許公表2001-500378号公報
【特許文献5】特許公表2004-520015号公報
【特許文献6】特許公表2008-513030号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
ところで、ピノレジノールレダクターゼは、リグニン二量体であるピノレジノールをラリシレジノール及び/又はセコイソラリシレジノールに変換する活性を有する還元酵素であり、シロイヌナズナ等の植物において見いだされてきた。しかしながら、植物以外の生物においてピノレジノールレダクターゼをコードする遺伝子は知られていなかった。酵素活性や基質特異性、その他の特徴が植物由来のピノレジノールレダクターゼとは異なる新たなピノレジノールレダクターゼをコードする遺伝子を見いだすことが期待されていた。
【0006】
そこで、本発明は、上述した実情に鑑み、植物以外の生物由来のピノレジノールレダクターゼ遺伝子及び当該遺伝子を導入した形質転換植物を提供することを目的としている。
【課題を解決するための手段】
【0007】
上述した目的を達成するため、本発明者らが鋭意検討した結果、Sphingobium属細菌からピノレジノールレダクターゼをコードする遺伝子を単離・同定することに成功した。本発明者らは、植物以外の生物から初めてピノレジノールレダクターゼ遺伝子を単離・同定したこととなる。本発明は、このような知見に基づいて案出されたものであり、以下を包含する。
【0008】
(1)以下の(a)〜(c)いずれかに記載のタンパク質をコードするピノレジノールレダクターゼ遺伝子
(a)配列番号2に示すアミノ酸配列からなるタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質
(c)配列番号2に示すアミノ酸配列に対する類似度(Similarity)が例えば70%以上のアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質
(2)上記タンパク質は、ピノレジノールを基質としてラリシレジノールへ変換する活性と、ラリシレジノールを基質としてセコイソラリシレジノールへ変換する活性とを有することを特徴とする(1)記載のピノレジノールレダクターゼ遺伝子。
(3)スフィンゴモナス科(Sphingomonadaceae)細菌由来であることを特徴とする(1)記載のピノレジノールレダクターゼ遺伝子。
(4)上記スフィンゴモナス科(Sphingomonadaceae)細菌はSphingobium属細菌であることを特徴とする(3)記載のピノレジノールレダクターゼ遺伝子。
(5)上記(1)乃至上記(4)いずれかに記載のピノレジノールレダクターゼ遺伝子を機能しうる形で導入されてなる形質転換植物。
(6)上記ピノレジノールレダクターゼ遺伝子の導入前の植物と比較して、リグニン及びリグナンの代謝が改変したことを特徴とする(5)記載の形質転換植物。
【発明の効果】
【0009】
本発明によれば、植物以外の生物由来として初めてのピノレジノールレダクターゼ遺伝子を提供することができる。本発明に係るピノレジノールレダクターゼ遺伝子を利用することにより、リグニンやリグナンの代謝調節能を改変した形質転換植物を作出することができる。
【図面の簡単な説明】
【0010】
【図1】ピノレジノールの変換活性が確認されたクローン150及び陰性対照であるクローン35の培養液上清をHPLC分析した結果を示す特性図である。
【図2】pinZ遺伝子で形質転換した大腸菌BL21(DE3)株及び発現ベクターpET-16bで形質転換した陰性対照の大腸菌BL21(DE3)株におけるピノレジノール変換能を分析した結果を示す特性図である。
【図3】pinZ遺伝子で形質転換した大腸菌BL21(DE3)株からアフィニティクロマトグラフィによりPinZを精製した後のSDS-PAGEの結果を示す電気泳動写真である。
【発明を実施するための形態】
【0011】
以下、本発明に係る新規ピノレジノールレダクターゼ遺伝子及びこれを用いて作製した形質転換植物について詳細に説明する。
【0012】
ピノレジノールレダクターゼ遺伝子
本発明は、植物以外の生物、具体的にはスフィンゴモナス科(Sphingomonadaceae)細菌由来のピノレジノールレダクターゼ遺伝子に関する。スフィンゴモナス科細菌としては、ブラストモナス属(Blastomonas)細菌、シトロミクロビウム属(Citromicrobium)細菌、カイストバクター属(Kaistobacter)属、ルチバクテリウム属(Lutibacterium)細菌、ノボスフィンゴビウム属(Novosphingobium)細菌、サンダラシノバクター属(Sandaracinobacter)細菌、サンダラキノハダス属(Sandarakinorhabdus)細菌、スフィンゴビウム属(Sphingobium)細菌、スフィンゴモナス属(Sphingomonas)細菌、スフィンゴピクシス属(Sphingopyxis)細菌、スフィンゴシニセラ属(Sphingosinicella)細菌及びジモモナス属(Zymomonas)細菌を挙げることができる。すなわち、本発明に係るピノレジノールレダクターゼ遺伝子は、これらいずれの属に属する細菌由来の遺伝子であってもよい。
【0013】
一例として、本発明に係るピノレジノールレダクターゼ遺伝子としては、Sphingobium属細菌由来の遺伝子を挙げることができるが、これに限定されるものではない。より具体的に、本発明に係るピノレジノールレダクターゼ遺伝子としては、Sphingobium属細菌であるSphingobium sp. SKY-6株にて同定され、単離された遺伝子(pinZ遺伝子と呼称される)を挙げることができる。pinZ遺伝子におけるピノレジノールレダクターゼをコードする領域の塩基配列を配列番号1に示し、pinZ遺伝子がコードするピノレジノールレダクターゼのアミノ酸配列を配列番号2に示す。
【0014】
本発明に係るピノレジノールレダクターゼ遺伝子は、配列番号1及び2に示すpinZ遺伝子に限定されず、例えば、配列番号2で特定されるアミノ酸配列において1又は複数個のアミノ酸配列が欠失、置換、付加又は挿入されたアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質をコードする遺伝子であっても良い。ここで、複数個のアミノ酸としては、例えば、1から40個、好ましくは1から30個、より好ましくは1から20個、さらに好ましくは1個から10個、特に好ましくは1個から5個を意味する。なお、アミノ酸の欠失、置換若しくは付加は、当該技術分野で公知の手法を適用してpinZ遺伝子を構成するポリヌクレオチドを改変することによって行うことができる。ポリヌクレオチドに変異を導入するには、Kunkel法またはGapped duplex法等の公知手法又はこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-KやMutant-G(何れも商品名、TAKARA Bio社製))等を用いて、あるいはLA PCR in vitro Mutagenesisシリーズキット(商品名、TAKARA Bio社製)を用いて変異が導入される。また、変異導入方法としては、EMS(エチルメタンスルホン酸)、5-ブロモウラシル、2-アミノプリン、ヒドロキシルアミン、N-メチル-N’-ニトロ-Nニトロソグアニジン、その他の発ガン性化合物に代表されるような化学的変異剤を使用する方法でも良いし、X線、アルファ線、ベータ線、ガンマ線、イオンビームに代表されるような放射線処理や紫外線処理による方法でも良い。
【0015】
また、本発明に係るピノレジノールレダクターゼ遺伝子は、Sphingobium属細菌由来のpinZ遺伝子の相同遺伝子であってもよい。ここで、相同遺伝子とは、一般的に、共通の祖先遺伝子から進化分岐した遺伝子を意味しており、2種類の種の相同遺伝子(オルソログ(ortholog))及び同一種内で重複分岐により生じた相同遺伝子(パラログ(paralog))を含む意味である。よって、本発明に係るピノレジノールレダクターゼ遺伝子は、pinZ遺伝子のオルソログやパラログといった相同遺伝子を含む意味である。但し、本発明に係るピノレジノールレダクターゼ遺伝子には、共通遺伝子から進化せず、単に類似した機能を有する遺伝子も含まれている。
【0016】
さらに、本発明に係るピノレジノールレダクターゼ遺伝子は、配列番号2に示すアミノ酸配列に対する類似度(Similarity)が例えば70%以上、好ましくは80%以上、より好ましくは90%以上、最も好ましくは95%以上であるアミノ酸配列を有し、且つ、ピノレジノールレダクターゼ活性を有するタンパク質をコードする遺伝子を挙げることができる。ここで、類似度の値は、EMBOSS pairwise alignment algorithms(http://www.ebi.ac.uk/Tools/emboss/align/)プログラムを実装したコンピュータプログラム及び遺伝子配列情報を格納したデータベースを用いてデフォルトの設定で求められる値を意味する。
【0017】
なお、pinZ遺伝子がコードするPinZタンパク質のアミノ酸配列(配列番号2)に基づいて、上記データベースを検索すると、スフィンゴモナス科(Sphingomonadaceae)細菌であるNovosphingobium aromaticivorans DSM 12444株で報告されている機能未知のNmrA様タンパク質を特定することができる。アミノ酸レベルで比較した場合、PinZタンパク質とNmrA様タンパク質の類似度及び同一性はそれぞれ85.8%及び76.3%であった。よって、このNmrA様タンパク質は、Novosphingobium aromaticivorans DSM 12444株におけるピノレジノールレダクターゼである蓋然性が高いと言える。
【0018】
さらにまた、本発明に係るピノレジノールレダクターゼ遺伝子としては、配列番号1の塩基配列からなるポリヌクレオチドの少なくとも一部に対して、ストリンジェントな条件下でハイブリダイズし、且つ、ピノレジノールレダクターゼ活性を有するタンパク質をコードする遺伝子であってもよい。すなわち、供試生物からゲノムを抽出するか或いは対象となる生物のcDNAライブラリーを構築し、配列番号1の塩基配列からなるポリヌクレオチドの少なくとも一部に対して、ストリンジェントな条件下でハイブリダイズするゲノム領域或いはcDNAを単離することで同定することができる。ここで、ストリンジェントな条件とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。例えば、45℃、6×SSC(塩化ナトリウム/クエン酸ナトリウム)でのハイブリダイゼーション、その後の50〜65℃、0.2〜1×SSC、0.1%SDSでの洗浄が挙げられ、或いはそのような条件として、65〜70℃、1×SSCでのハイブリダイゼーション、その後の65〜70℃、0.3×SSCでの洗浄を挙げることができる。ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。
【0019】
以上のように、本発明に係るピノレジノールレダクターゼ遺伝子は、具体的な塩基配列及びアミノ酸配列が決められたpinZ遺伝子に限定されず、ピノレジノールレダクターゼ活性を有するタンパク質をコードする限り、種々の塩基配列及びアミノ酸配列で特定される遺伝子を含んでいる。ここで、ピノレジノールレダクターゼ活性とは、下記化学式に示すように、ピノレジノールをラリシレジノールへと変換する活性及び/又はラリシレジノールをセコイソラリシレジノールへと変換する活性を意味する。特に、本発明に係るピノレジノールレダクターゼ遺伝子はこれら両方の活性を有するタンパク質をコードする遺伝子であることが好ましい。
【0020】
【化1】

【0021】
所定のタンパク質が上記ピノレジノールレダクターゼ活性を有するか否かは、例えば、供試タンパク質を、ピノレジノール及び/又はラリシレジノールを含む溶液に添加し、上述した変換反応の反応産物を検出することで評価できる。ラリシレジノールやセコイソラリシレジノールといった反応産物は、高速液体クロマトグラフィー等の手法で検出することができる。
【0022】
ところで、本発明に係るピノレジノールレダクターゼ遺伝子は、従来公知の植物由来のピノレジノールレダクターゼ遺伝子とはアミノ酸レベルでの類似度が著しく低い。具体的に、シロイヌナズナ(Arabidopsis thaliana)では2つのピノレジノールレダクターゼ遺伝子(AtPrR1遺伝子及びAtPrR2遺伝子)が知られているが、これらと配列番号2のアミノ酸配列との類似度は、それぞれ37%及び28%である。またAtPrR1遺伝子及びAtPrR2遺伝子と配列番号2のアミノ酸配列との同一性は、それぞれ21%及び16%である。さらに、ベイスギ (米杉、アメリカネズコ, レッドシダー、学名:Thuja plicata)では2つのピノレジノールレダクターゼ遺伝子(PLR_Tp1遺伝子及びPLR_Tp2遺伝子)が知られているが、これらと配列番号2のアミノ酸配列との類似度は、それぞれ29%及び35%である。またPLR_Tp1遺伝子及びPLR_Tp2遺伝子と配列番号2のアミノ酸配列との同一性は、それぞれ15%及び21%である。
【0023】
形質転換植物
上述した本発明に係るピノレジノールレダクターゼ遺伝子を機能する形で宿主となる植物に導入することで、本発明に係る形質転換植物を作製することができる。ピノレジノールレダクターゼ遺伝子を機能する形で導入するとは、当該ピノレジノールレダクターゼ遺伝子が発現してピノレジノールレダクターゼ活性を発揮することを意味する。ピノレジノールレダクターゼ遺伝子を宿主植物に導入する際には、例えば、当該遺伝子を組み込んだ発現ベクターを利用することができる。
【0024】
発現ベクターは、植物体内で発現を可能とするプロモーターと、上述したピノレジノールレダクターゼ遺伝子とを含むように構築する。発現ベクターの母体となるベクターとしては、従来公知の種々のベクターを用いることができる。例えば、プラスミド、ファージ、またはコスミド等を用いることができ、導入される植物細胞や導入方法に応じて適宜選択することができる。具体的には、例えば、pBR322、pBR325、pUC19、pUC119、pBluescript、pBluescriptSK、pBI系のベクター等を挙げることができる。特に、植物体へのベクターの導入法がアグロバクテリウムを用いる方法である場合には、pBI系のバイナリーベクターを用いることが好ましい。pBI系のバイナリーベクターとしては、具体的には、例えば、pBIG、pBIN19、pBI101、pBI121等を挙げることができる。
【0025】
プロモーターは、植物体内でピノレジノールレダクターゼ遺伝子を発現させることが可能なプロモーターであれば特に限定されるものではなく、公知のプロモーターを好適に用いることができる。かかるプロモーターとしては、例えば、カリフラワーモザイクウイルス35Sプロモーター(CaMV35S)、各種アクチン遺伝子プロモーター、各種ユビキチン遺伝子プロモーター、ノパリン合成酵素遺伝子のプロモーター、タバコのPR1a遺伝子プロモーター、ナピン遺伝子プロモーター、オレオシン遺伝子プロモーター等を挙げることができる。この中でも、カリフラワーモザイクウイルス35Sプロモーター、アクチン遺伝子プロモーター又はユビキチン遺伝子プロモーターをより好ましく用いることができる。上記各プロモーターを用いれば、植物細胞内に導入されたときに任意の遺伝子を強く発現させることが可能となる。
【0026】
また、プロモーターとしては、植物における部位特異的に発現させる機能を有するものを使用することもできる。このようなプロモーターとしては、従来公知の如何なるプロモーターを使用することができる。このようなプロモーターを使用して、上記ピノレジノールレダクターゼ遺伝子を部位特異的に発現させることができる。
【0027】
なお、発現ベクターは、プロモーター及び上記ピノレジノールレダクターゼ遺伝子に加えて、さらに他のDNAセグメントを含んでいてもよい。当該他のDNAセグメントは特に限定されるものではないが、ターミネーター、選別マーカー、エンハンサー、翻訳効率を高めるための塩基配列等を挙げることができる。また、発現ベクターは、さらにT-DNA領域を有していてもよい。T-DNA領域は特にアグロバクテリウムを用いて上記組換え発現ベクターを植物体に導入する場合に遺伝子導入の効率を高めることができる。
【0028】
転写ターミネーターは転写終結部位としての機能を有していれば特に限定されるものではなく、公知のものであってもよい。例えば、具体的には、ノパリン合成酵素遺伝子の転写終結領域(Nosターミネーター)、カリフラワーモザイクウイルス35Sの転写終結領域(CaMV35Sターミネーター)等を好ましく用いることができる。この中でもNosターミネーターをより好ましく用いることできる。上記発現ベクターにおいては、転写ターミネーターを適当な位置に配置することにより、植物細胞に導入された後に、不必要に長い転写物を合成されることを防止することができる。
【0029】
形質転換体選別マーカーとしては、例えば薬剤耐性遺伝子を用いることができる。かかる薬剤耐性遺伝子の具体的な一例としては、例えば、ハイグロマイシン、ブレオマイシン、カナマイシン、ゲンタマイシン、クロラムフェニコール等に対する薬剤耐性遺伝子を挙げることができる。これにより、上記抗生物質を含む培地中で生育する植物体を選択することによって、形質転換された植物体を容易に選別することができる。
【0030】
翻訳効率を高めるための塩基配列としては、例えばタバコモザイクウイルス由来のomega配列を挙げることができる。このomega配列をプロモーターの非翻訳領域(5’UTR)に配置させることによって、上記融合遺伝子の翻訳効率を高めることができる。このように、上記組換え発現ベクターには、その目的に応じて、さまざまなDNAセグメントを含ませることができる。
【0031】
発現ベクターの構築方法についても特に限定されるものではなく、適宜選択された母体となるベクターに、上記プロモーター、上記ピノレジノールレダクターゼ遺伝子、および転写抑制転換ポリヌクレオチド、並びに必要に応じて上記他のDNAセグメントを所定の順序となるように導入すればよい。例えば、上記ピノレジノールレダクターゼ遺伝子とプロモーターと(必要に応じて転写ターミネーター等)とを連結して発現カセットを構築し、これをベクターに導入すればよい。発現カセットの構築では、例えば、各DNAセグメントの切断部位を互いに相補的な突出末端としておき、ライゲーション酵素で反応させることで、当該DNAセグメントの順序を規定することが可能となる。なお、発現カセットにターミネーターが含まれる場合には、上流から、プロモーター、上記ピノレジノールレダクターゼ遺伝子、ターミネーターの順となっていればよい。また、発現ベクターを構築するための試薬類、すなわち制限酵素やライゲーション酵素等の種類についても特に限定されるものではなく、市販のものを適宜選択して用いればよい。
【0032】
また、上記発現ベクターの増殖方法(生産方法)も特に限定されるものではなく、従来公知の方法を用いることができる。一般的には大腸菌をホストとして当該大腸菌内で増殖させればよい。このとき、ベクターの種類に応じて、好ましい大腸菌の種類を選択してもよい。
【0033】
上述した発現ベクターは、一般的な形質転換方法によって対象の植物内に導入される。発現ベクターを植物細胞に導入する方法(形質転換方法)は特に限定されるものではなく、植物細胞に応じた適切な従来公知の方法を用いることができる。具体的には、例えば、アグロバクテリウムを用いる方法や直接植物細胞に導入する方法を用いることができる。アグロバクテリウムを用いる方法としては、例えば、Bechtold, E., Ellis, J. and Pelletier, G. (1993) In Planta Agrobacterium-mediated gene transfer by infiltration of adult Arabidopsis plants. C.R. Acad. Sci. Paris Sci. Vie, 316, 1194-1199. あるいは、Zyprian E, Kado Cl, Agrobacterium-mediated plant transformation by novel mini-T vectors in conjunction with a high-copy vir region helper plasmid. Plant Molecular Biology, 1990, 15(2), 245-256.に記載された方法を用いることができる。
【0034】
発現ベクターを直接植物細胞に導入する方法としては、例えば、マイクロインジェクション法、エレクトロポレーション法(電気穿孔法)、ポリエチレングリコール法、パーティクルガン法、プロトプラスト融合法、リン酸カルシウム法等を用いることができる。
【0035】
また、DNAを直接植物細胞に導入する方法を採るなら、対象とする遺伝子の発現に必要な転写ユニット、例えばプロモーターや転写ターミネーターと、対象とする遺伝子を含んだDNAであれば十分であり、ベクター機能は必須ではない。さらに、転写ユニットを有さない対象とする遺伝子のタンパク質コード領域のみを含むDNAであっても、宿主の転写ユニット内にインテグレートし、対象となる遺伝子を発現することができればよい。
【0036】
上記発現ベクターや、発現ベクターを含まず対象となる遺伝子を含んだ発現カセットが導入される植物細胞としては、例えば、花、葉、根等の植物器官における各組織の細胞、カルス、懸濁培養細胞等を挙げることができる。ここで、発現ベクターは、生産しようとする種類の植物体に合わせて適切なものを適宜構築してもよいが、汎用的な発現ベクターを予め構築しておき、それを植物細胞に導入してもよい。
【0037】
発現ベクターの導入対象となる植物、すなわち形質転換植物としては、特に限定されず如何なる植物でもよい。上述したピノレジノールレダクターゼ遺伝子を発現させることによって、あらゆる植物体についてリグニン及び/又はリグナンの代謝を改変することができる。対象となる植物としては、例えば、双子葉植物、単子葉植物、例えばアブラナ科、イネ科、ナス科、マメ科、ヤナギ科等に属する植物(下記参照)が挙げられるが、これらの植物に限定されるものではない。また、対象となる植物は、草本系植物及び木本系植物のいずれでも良い。対象となる植物の一例を以下に示すが、本発明はこれら具体的な植物に限定されるものではない。
【0038】
アブラナ科:シロイヌナズナ(Arabidopsis thaliana)、キャベツ(Brassica oleracea var. capitata)、ナタネ(Brassica rapa、Brassica napus)、ハクサイ(Brassica rapa var. pekinensis)、チンゲンサイ(Brassica rapa var. chinensis)、カブ(Brassica rapa var. rapa)、ノザワナ(Brassica rapa var. hakabura)、ミズナ(Brassica rapa var. lancinifolia)、コマツナ(Brassica rapa var. peruviridis)、パクチョイ(Brassica rapa var. chinensis)、ダイコン(Raphanus sativus)、ワサビ(Wasabia japonica)など。
ナス科:タバコ(Nicotiana tabacum)、ナス(Solanum melongena)、ジャガイモ(Solanum tuberosum)、トマト(Lycopersicon lycopersicum)、トウガラシ(Capsicum annuum)、ペチュニア(Petunia)など。
マメ科:ダイズ(Glycine max)、エンドウ(Pisum sativum)、ソラマメ(Vicia faba)、フジ(Wisteria floribunda)、ラッカセイ(Arachis. hypogaea)、ミヤコグサ(Lotus corniculatus var. japonicus)、インゲンマメ(Phaseolus vulgaris)、アズキ(Vigna angularis)、アカシア(Acacia)など。
キク科:キク(Chrysanthemum morifolium)、ヒマワリ(Helianthus annuus)など。
ヤシ科:アブラヤシ(Elaeis guineensis、Elaeis oleifera)、ココヤシ(Cocos nucifera)、ナツメヤシ(Phoenix dactylifera)、ロウヤシ(Copernicia)
ウルシ科:ハゼノキ(Rhus succedanea)、カシューナットノキ(Anacardium occidentale)、ウルシ(Toxicodendron vernicifluum)、マンゴー(Mangifera indica)、ピスタチオ(Pistacia vera)
ウリ科:カボチャ(Cucurbita maxima、Cucurbita moschata、Cucurbita pepo)、キュウリ(Cucumis sativus)、カラスウリ(Trichosanthes cucumeroides)、ヒョウタン(Lagenaria siceraria var. gourda)
バラ科:アーモンド(Amygdalus communis)、バラ(Rosa)、イチゴ(Fragaria)、サクラ(Prunus)、リンゴ(Malus pumila var. domestica)など。
ナデシコ科:カーネーション(Dianthus caryophyllus)など。
ヤナギ科:ポプラ(Populus trichocarpa、Populus nigra、Populus tremula)
イネ科:トウモロコシ(Zea mays)、イネ(Oryza sativa)、オオムギ(Hordeum vulgare)、コムギ(Triticum aestivum)、タケ(Phyllostachys)、サトウキビ(Saccharum officinarum)、ネピアグラス(Pennisetum pupureum)、エリアンサス(Erianthus ravenae)、ミスキャンタス(ススキ)(Miscanthus virgatum)、ソルガム(Sorghum)スイッチグラス(Panicum)など。
ユリ科:チューリップ(Tulipa)、ユリ(Lilium)など。
【0039】
上述したピノレジノールレダクターゼ遺伝子が機能する形で導入された形質転換植物では、導入前の植物と比較してリグニン及び/又はリグナンの代謝が改変されている。具体的には、導入されたピノレジノールレダクターゼ遺伝子が発現することで、植物体内におけるピノレジノールレダクターゼ活性が強まり、リグニン二量体であるピノレジノールの蓄積量が低減する。これより、形質転換植物は、導入前の植物と比較してリグニン・ポリマーの構造や含有量が改変することとなり、パルプ化やバイオエタノール生産の効率を向上させることができる。また、形質転換植物は、導入前の植物と比較してラリシレジノールやセコイソラリシレジノールの含有量が向上するため、これら化合物やその派生物といった有用物質の生産効率を向上させることができる。
【実施例】
【0040】
以下、実施例により本発明を更に詳細に説明するが、本発明の技術的範囲は以下の実施例に限定されるものではない。
【0041】
〔実施例1〕
1.遺伝子ライブラリーの構築
Sphingobium sp. SYK-6株(以下、SYK-6株とする。独立行政法人製品評価技術基盤機構よりNBRC 103272で入手可能)の全ゲノムを制限酵素SalIで部分消化した後にコスミドベクターpVK100とライゲーションさせ、in vitroパッケージング後、Escherichia coli HB101株に感染させて遺伝子ライブラリーを作製した。三親接合法によってHB101株が持つコスミドをPseudomonas putida PpY1100株に伝達させ、カナマイシンを含む寒天培地上に形質転換株を塗布することでコロニーを形成させた後、独立した200個の形質転換体を選んで各々に番号を付し、それぞれから釣菌して別の寒天培地上に画線培養した。このようにして、SYK-6株の遺伝子ライブラリーをPpY1100株中に構築した。
【0042】
2.ピノレジノール変換能を有するクローンの選抜
上記のライブラリーから170個のクローンを無作為に選び、各々をカナマイシン50μg/ml含む1mlのLB培地に接種して、30℃で一昼夜振とう培養をした。培養後、10クローンの培養液を混合して一つの試料とし、これを1バッチとした。これを遠心処理により培養液を除いた後、菌体のみを回収した。このようにして調製した菌体に、50mM Tris-HCl (pH7.4)を1ml、6 mMピノレジノールを5μl添加し、28℃で24時間振とう培養した。培養終了後、培養液全量を回収して15,000rpm、5分の遠心分離処理を施し、上清をHPLC分析することにより、各培養液に添加したピノレジノールの変化を調べた。
【0043】
上記のようにして実験を行ったところ、解析した17個のバッチの試料の中の1つにピノレジノールの変換活性が確認された。そこで、当該バッチに含まれる10クローンの形質転換株を、上記と同様の方法で1クローンずつ別々に再度解析したところ、クローン番号150を付した形質転換クローンのみにピノレジノールの変換能が備わっていることが明らかとなった。図1に、クローン150と陰性対照であるクローン35を接種した試料のHPLC分析の結果を示す。クローン150を接種した試料でのみ、ピノレジノールのピークが消失して新しいピークが2つ出現している(図1中の矢印)。
【0044】
以上のことから、クローン150が持つコスミドベクターに搭載されているSYK-6株のゲノムDNA断片上に、ピノレジノールを変換する酵素の遺伝子がコードされていることが明らかとなった。
【0045】
3.遺伝子のクローニング
上記クローン150が持つコスミドベクターを回収して調べたところ、このベクター上にはSYK-6株に由来する約18kbpのゲノムDNAがクローン化されていた。更に、当該ゲノムDNAの塩基配列を解析したところ、この中には25個のオープンリーディングフレーム(以下、ORF)が存在していることが明らかになった。そこで、この25個のORFに含まれるピノレジノール変換能を与える遺伝子を特定するため、制限酵素を用いたゲノムDNAのサブクローニングやPCRを用いた単一ORFのクローニング等を実施し、これらを用いて組換え大腸菌によるピノレジノール変換実験を行った。その結果、ORFの1つがピノレジノールを変換する能力を担う酵素のアミノ酸配列をコードしていることが明らかとなり、この酵素をPinZ(遺伝子名:pinZ)と命名した。pinZのORFは951 bp(配列番号1)であり、316アミノ酸(配列番号2)、約34 kDaからなるポリペプチドをコードしていた。
【0046】
4.遺伝子の相同性検索
上記で得られたPinZのアミノ酸配列を公知のタンパク質のそれに対して相同性検索したところ、Novosphingobium aromaticivorans DSM 12444株に由来する機能が不明なNmrA-likeタンパク質(配列番号3)と76%の同一性(86%の類似度)を有していることが判明した。一方、シロイヌナズナ(Arabidopsis thaliana)から既にクローニングされているピノレジノールレダクターゼAtPrR1の遺伝子やウェスタンレッドシダーのピノレジノール/ラリシレジノールレダクターゼPLR-Tp1の遺伝子にコードされているポリペプチドとは、各々21%、15%程度の同一性を示すに過ぎなかった。
【0047】
5.遺伝子の過剰発現によるPinZタンパク質の生産とその解析
pinZのアミノ酸コード領域をPCRにより増幅後、このDNAを発現ベクターpET16-bへクローニングした。次に、このようにして得られたベクターpETPZを用いて大腸菌BL21(DE3)株を形質転換した。形質転換株をOD600が0.5になるまで37℃で振とう培養した後、終濃度が1mMになるようにIPTGを添加して、30℃で更に4時間培養した。培養終了後、緩衝液で菌体を2回洗浄し、OD600が10の休止菌体を調製した。これに終濃度0.1 mMのピノレジノールを添加した後、30℃で12時間反応させ、反応液をLC-MSで分析した。陰性対照として、発現ベクターpET-16bで形質転換した大腸菌BL21(DE3)株を用いて、同様の実験を行った。その結果を図2に示す。
【0048】
陰性対照の場合には12時間後も溶出時間3.1分にピノレジノールのピークが検出されたのに対し(図2A)、pETPZを用いて形質転換した大腸菌BL21(DE3)株を用いた場合には、溶出時間1.6分と1.8分に2つのピークが現れた(図2B)。別途有機合成した標品の溶出時間と分子イオンピークから、上述の2つのピークは、各々、セコイソラリシレジノールとラリシレジノールであることが明らかになった。これらのことから、PinZはピノレジノールを還元することでラリシレジノールを生成し、更にラリシレジノールを還元してセコイソラリシレジノールを生成するピノレジノール/ラリシレジノールレダクターゼであることが判明した。
【0049】
6.精製酵素の性質
上述のpETPZを用いて形質転換した大腸菌BL21(DE3)株からアフィニティクロマトグラフィによりPinZ(ヒスチジンタグが付加されたPinZ)を精製し、その性質を評価した。精製処理前後の酵素のSDS-PAGEを図3に示す。精製したPinZを100μg用い、100μMピノレジノール又はラリシレジノール、150μMのNADPHを含む1 mlの50mM Tris-HCl(pH7.0)で反応させて酵素活性を検出した。PinZはピノレジノール又はラリシレジノールの還元にNADPHを要求するため、その酵素活性は30℃で1分間に1 μmolのNADPHを消費する量を1ユニット(U)と規定した。上記反応条件で測定した場合、精製PinZのピノレジノールに対する比活性は468U/mgであり、ラリシレジノールに対するそれは0.033U/mgであった。中坪らによると、前述のシロイヌナズナのAtPrR1の精製組換え酵素が示す還元活性は、ピノレジノールとラリシレジノールに対して各々35.5 nU/mg、1.1 nU/mgであることから(Journal of Biological Chemistry, vol. 283, pp. 15550-15557, 2008)、本研究で得られたPinZは、AtPrR1と比較してピノレジノールとラリシレジノールに対して極めて高い還元活性を保持していることが判明した。
【特許請求の範囲】
【請求項1】
以下の(a)〜(c)いずれかに記載のタンパク質をコードするピノレジノールレダクターゼ遺伝子
(a)配列番号2に示すアミノ酸配列からなるタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質
(c)配列番号2に示すアミノ酸配列に対する類似度(Similarity)が例えば70%以上のアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質
【請求項2】
上記タンパク質は、ピノレジノールを基質としてラリシレジノールへ変換する活性と、ラリシレジノールを基質としてセコイソラリシレジノールへ変換する活性とを有することを特徴とする請求項1記載のピノレジノールレダクターゼ遺伝子。
【請求項3】
スフィンゴモナス科(Sphingomonadaceae)細菌由来であることを特徴とする請求項1記載のピノレジノールレダクターゼ遺伝子。
【請求項4】
上記スフィンゴモナス科(Sphingomonadaceae)細菌はSphingobium属細菌であることを特徴とする請求項3記載のピノレジノールレダクターゼ遺伝子。
【請求項5】
請求項1乃至4いずれか一項記載のピノレジノールレダクターゼ遺伝子を機能しうる形で導入されてなる形質転換植物。
【請求項6】
上記ピノレジノールレダクターゼ遺伝子の導入前の植物と比較して、リグニン及びリグナンの代謝が改変したことを特徴とする請求項5記載の形質転換植物。
【請求項1】
以下の(a)〜(c)いずれかに記載のタンパク質をコードするピノレジノールレダクターゼ遺伝子
(a)配列番号2に示すアミノ酸配列からなるタンパク質
(b)配列番号2に示すアミノ酸配列において1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質
(c)配列番号2に示すアミノ酸配列に対する類似度(Similarity)が例えば70%以上のアミノ酸配列を含み、且つ、ピノレジノールレダクターゼ活性を有するタンパク質
【請求項2】
上記タンパク質は、ピノレジノールを基質としてラリシレジノールへ変換する活性と、ラリシレジノールを基質としてセコイソラリシレジノールへ変換する活性とを有することを特徴とする請求項1記載のピノレジノールレダクターゼ遺伝子。
【請求項3】
スフィンゴモナス科(Sphingomonadaceae)細菌由来であることを特徴とする請求項1記載のピノレジノールレダクターゼ遺伝子。
【請求項4】
上記スフィンゴモナス科(Sphingomonadaceae)細菌はSphingobium属細菌であることを特徴とする請求項3記載のピノレジノールレダクターゼ遺伝子。
【請求項5】
請求項1乃至4いずれか一項記載のピノレジノールレダクターゼ遺伝子を機能しうる形で導入されてなる形質転換植物。
【請求項6】
上記ピノレジノールレダクターゼ遺伝子の導入前の植物と比較して、リグニン及びリグナンの代謝が改変したことを特徴とする請求項5記載の形質転換植物。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−130326(P2012−130326A)
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2010−287625(P2010−287625)
【出願日】平成22年12月24日(2010.12.24)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、独立行政法人新エネルギー・産業技術総合開発機構、「新エネルギー技術研究開発 バイオマスエネルギー等高効率転換技術開発(先導技術開発) 細菌のリグニン分解酵素遺伝子による植物細胞壁改変技術の開発」委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504132881)国立大学法人東京農工大学 (595)
【出願人】(304021288)国立大学法人長岡技術科学大学 (458)
【出願人】(501186173)独立行政法人森林総合研究所 (91)
【出願人】(599035627)学校法人加計学園 (43)
【Fターム(参考)】
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願日】平成22年12月24日(2010.12.24)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、独立行政法人新エネルギー・産業技術総合開発機構、「新エネルギー技術研究開発 バイオマスエネルギー等高効率転換技術開発(先導技術開発) 細菌のリグニン分解酵素遺伝子による植物細胞壁改変技術の開発」委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504132881)国立大学法人東京農工大学 (595)
【出願人】(304021288)国立大学法人長岡技術科学大学 (458)
【出願人】(501186173)独立行政法人森林総合研究所 (91)
【出願人】(599035627)学校法人加計学園 (43)
【Fターム(参考)】
[ Back to top ]

