新規ペプチド並びに分子シャペロン誘導剤及び抗がん剤
【課題】分子シャペロン誘導活性及び抗がん活性を有する新規ペプチド並びに新規な分子シャペロン誘導剤及び抗がん剤を提供することである。
【解決手段】納豆の抽出物のうち特定の画分のものが分子シャペロン誘導活性及び抗がん活性を有することを見出し、液体クロマトグラフィーを行って各ピークに含まれる物質を同定した結果、3種類の新規ペプチドを見出した。そして、これらのペプチドを有効成分として含有する分子シャペロン誘導剤及び抗がん剤を提供した。
【解決手段】納豆の抽出物のうち特定の画分のものが分子シャペロン誘導活性及び抗がん活性を有することを見出し、液体クロマトグラフィーを行って各ピークに含まれる物質を同定した結果、3種類の新規ペプチドを見出した。そして、これらのペプチドを有効成分として含有する分子シャペロン誘導剤及び抗がん剤を提供した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規なペプチド並びにそれを有効成分として含有する分子シャペロン誘導剤及び抗がん剤に関する。
【背景技術】
【0002】
分子シャペロンは、他の蛋白質分子が正しいフォールディングをして機能を獲得するのを助けるタンパク質の総称であり、熱ショック等の種々のストレスから生体を守る働きをしている。哺乳動物では、ヒートショック蛋白であるHSP90、HSP72、HSP60等、10数種類が報告されている。これらの分子シャペロンは、風邪などによる発熱時に強く誘導され、熱変性蛋白質の生理機能回復を介助する。
【0003】
細胞内における分子シャペロンの発現を増大させる物質が分子シャペロン誘導剤である。分子シャペロン誘導剤により細胞内における分子シャペロンの生産量が増大するので、分子シャペロン誘導剤も分子シャペロンと同様な生理活性を発揮する。分子シャペロン誘導剤の探索及びその医薬品への応用が進められているが、現在、上市されている医薬品で分子シャペロン誘導作用を有するものは、胃炎、胃潰瘍治療剤として用いられているテプレノン(商品名セルベックス)のみである。もっとも、テプレノンが分子シャペロン誘導を実現するには大量投与(成人でkgオーダー)が必要と考えられている。他の分子シャペロン誘導剤としては、各種アルカロイド類が報告されているが、アルカロイド類は一般に毒性が強く、医薬として用いられてはいない。
【0004】
一方、天然物由来の抗がん剤としては、大豆に含まれるイソフラボン及びその類縁体が知られており(特許文献1)、イソフラボン類と特定構造のカテキン類(特許文献2)又は大豆サポニン(特許文献3)との併用が抗がん活性を発揮することも報告されている。しかしながら、これらの抗がん活性は必ずしも満足できるものではない。また、癌抗原の部分ペプチドから成る、いわゆる癌ワクチンも種々開発されているが、これらのペプチドは、生体の細胞免疫機構を利用して癌細胞を攻撃するものであり、癌細胞に直接作用して癌細胞を死滅又は増殖抑制するものではない。
【0005】
さらに、特許文献4には、枯草菌のセリンプロテアーゼ由来のペプチドであって、ヒトMHCクラスIIに結合する可能性の高いペプチドが記載されている。しかしながら、特許文献4に記載されているペプチドは、アミノ酸配列が後述する本発明のペプチドとは異なっており、また、それらのペプチドの分子シャペロン誘導活性や抗がん活性については全く記載も示唆もされていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開昭61-246124号公報
【特許文献2】特開2001-114687
【特許文献3】特開2003-002838
【特許文献4】米国特許第7,430,476号
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、分子シャペロン誘導活性及び抗がん活性を有する新規ペプチドを提供することである。また、本発明の目的は、新規な分子シャペロン誘導剤及び抗がん剤を提供することである。
【課題を解決するための手段】
【0008】
本願発明者らは、下記実施例に具体的に記載するように、納豆の抽出物のうち特定の画分のものが分子シャペロン誘導活性及び抗がん活性を有することを見出し、液体クロマトグラフィーを行って各ピークに含まれる物質を同定した結果、3種類の新規ペプチドを見出し、本発明に至った。
【0009】
すなわち、本発明は、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを提供する。
【0010】
また、本発明は、下記(1)〜(3)の少なくともいずれかを有効成分として含有する分子シャペロン誘導剤を提供する。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含み分子シャペロン誘導作用を有するペプチド。
【0011】
さらに本発明は、下記(1)〜(3)の少なくともいずれかを有効成分として含有する抗がん剤を提供する。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって抗がん作用を有するペプチド。
【0012】
さらに本発明は、食品に、下記(1)〜(3)の少なくともいずれかのペプチドを添加した、ペプチド強化食品を提供する。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用又は抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって分子シャペロン誘導作用又は抗がん作用を有するペプチド。
【0013】
さらに本発明は、食品中に含まれる下記(1)〜(3)の少なくともいずれかのペプチドの含有量を測定することを特徴とする、食品の分子シャペロン誘導活性及び/又は抗ガン活性の評価方法を提供する。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用又は抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって分子シャペロン誘導作用又は抗がん作用を有するペプチド。
【0014】
さらに本発明は、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドに特異的に結合する活性を有する抗体を提供する。
【発明の効果】
【0015】
本発明により、分子シャペロン誘導活性及びがん細胞に直接作用する抗がん活性を有する新規なペプチドが提供された。下記実施例に具体的に記載されるように、本発明のペプチドは、HSP90等の分子シャペロンを誘導する高い活性を有する。従って、本発明のペプチドは、分子シャペロン誘導剤として有用であり、分子シャペロン誘導効果によりもたらされる様々な作用を発揮する。また、下記実施例に具体的に記載されるように、本発明のペプチドは、がん細胞に対して直接的に高い殺傷効果を発揮する。従って、本発明のペプチドは、優れた抗がん活性を発揮する抗がん剤として有用である。また、下記実施例に下記実施例に具体的に示されるように、本発明のペプチドは、正常細胞に対する増殖抑制作用が弱いので、副作用が少ない。
【図面の簡単な説明】
【0016】
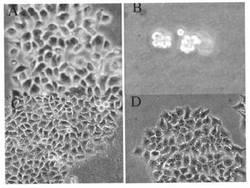
【図1】納豆の抽出画分をHeLa細胞に添加して培養した結果を示す顕微鏡写真である。Aは添加前のHeLa細胞、Bは、納豆の抽出画分を添加、培養後のHeLa細胞である。Cは対照として行った、煮豆の抽出画分をHeLa細胞に添加して培養した結果を示し、Dは納豆菌のみを添加、培養した結果を示す。
【図2】納豆の抽出物の硫安画分の電気泳動バンドを示す。
【図3】図2に示す電気泳動バンドのうち、抗がん活性を示した、矢印のバンドを切り出して高速液体クロマトグラフィーにかけた結果を示す図である。
【図4】図3に示す高速液体クロマトグラフィーで得られた各ピークを含むフラクションをHeLa細胞に添加、培養した結果を示す顕微鏡写真である。
【図5】本発明のペプチドを含む分画をHeLa細胞に添加、培養後、細胞内の各種熱ショックタンパクをイムノブロット法で検出した結果を示す図である。
【図6】本発明のペプチドを含む分画について、MTT法により正常細胞に対する効果を調べた結果をNeuro2A(マウス神経芽細胞腫)に対する結果と比較して示す図である。
【発明を実施するための形態】
【0017】
上記の通り、本発明のペプチドは、そのアミノ酸配列が配列番号1〜3のいずれかで示されるペプチドである。
【0018】
本発明のペプチドは、下記実施例に具体的に記載する方法により、納豆から精製することもできるし、そのサイズが13〜18と短いので、市販のペプチド合成機を用いて容易に化学合成することができる。
【0019】
下記実施例に具体的に記載するように、本発明のペプチドは、分子シャペロン誘導活性を有する。すなわち、本発明のペプチドを細胞に作用させると、細胞内でのHSP90、HSP72及びHSP60のような熱ショック蛋白等の分子シャペロンの生産が増大する。
【0020】
分子シャペロンは、細胞ひいては生体が熱ショックや化学薬品にさらされる等のストレスを受けた際に、正常なフォールディングができなくなった各種タンパク質の構造を元に戻して正常化する働きを持ち、生命の維持に重要な役割を果たしている。本発明のペプチドは、分子シャペロン誘導活性を有するので、この分子シャペロンの生産量を増大させ、ひいては細胞内における分子シャペロン活性を高める作用を有する。従って、本発明のペプチドは、分子シャペロンが発揮する様々な生理活性を高める働きをする。医薬品として用いる場合、具体的な薬効の例としては、体力消耗時の健康回復、流行性感冒等、ウィルス感染初期症状における生体防御等を挙げることができる。
【0021】
なお、一般に、生理活性を有するペプチドにおいて、少数のアミノ酸が置換し、欠失し又は挿入された場合であってもその生理活性が維持される場合があることは当業者にとって周知である。従って、上記した本発明のペプチドに加え、アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用を有するペプチドも分子シャペロン誘導剤として用いることができる。なお、天然のタンパク質を構成する20種類のアミノ酸は、低極性側鎖を有する中性アミノ酸(Gly, Ile, Val, Leu, Ala, Met, Pro)、親水性側鎖を有する中性アミノ酸(Asn, Gln, Thr, Ser, Tyr, Cys)、酸性アミノ酸(Asp, Glu)、塩基性アミノ酸(Arg, Lys, His)、芳香族アミノ酸(Phe, Tyr, Trp)のように類似の性質を有するものにグループ分けでき、これらの間での置換であればペプチドの性質が変化しないことが多いことが知られている。従って、配列番号1〜3のいずれかで示されるアミノ酸配列から成るペプチド中のアミノ酸残基を置換する場合には、これらの各グループの間で置換することにより、当該ペプチドの分子シャペロン誘導活性が維持される可能性が高くなる。
【0022】
また、生理活性を有する2種類のペプチドが連結された融合ペプチドが、各ペプチドの生理活性を維持する場合があることからも明らかなように、生理活性を有するペプチドをそっくり含み、その一端又は両端に他のアミノ酸配列が連結されたペプチドであってもその生理活性が維持される場合があることは当業者にとって周知である。従って、上記した分子シャペロン誘導活性を有するペプチドを含み、分子シャペロン誘導作用を有するペプチドを分子シャペロン誘導剤として用いることも可能である。この場合、上記した分子シャペロン誘導活性を有するペプチドの一端又は両端に付加されるアミノ酸の数は、最終的なペプチドが分子シャペロン誘導活性を有する限り特に限定されないが、合成の容易さ及び単位重量当たりの活性を高くする観点から、1個〜数個であることが好ましく、特に1個又は2個であることが好ましい。
【0023】
なお、一般に、ペプチド製剤においては、生体内でのプロテアーゼによる分解を受けにくくするためにペプチドの一端にポリエチレングリコール(PEG)鎖等を結合したものが広く用いられている。本発明の分子シャペロン誘導剤においても、同様に、上記したペプチドをそっくり含み、その一端にPEG鎖等の安定化構造を付加したものを有効成分として用いることができる。文脈からそうでないことが明らかな場合を除き、分子シャペロン誘導剤の有効成分として用いられる「ペプチド」という語には、PEG化ペプチドのような、安定化誘導体も包含される。なお、PEG化によりペプチドを安定化する場合には、PEGのサイズは分子量数千〜5万、好ましくは1万〜5万程度である。また、ペプチドの一端にPEGを結合する方法は周知である。
【0024】
上記種々のペプチドのうち、上記(1)を有効成分として含有するものが好ましく、特に、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て含むが好ましい。
【0025】
本発明の分子シャペロン誘導剤の投与経路は、経口でも非経口でもよく、非経口の場合、静脈内、筋肉内、皮下、皮内、経皮、直腸内、点眼等、通常の各種投与経路で投与可能である。投与量は、投与目的及び患者の状態等に応じて適宜設定されるが、通常、成人1日当たり、ペプチド量(PEG等の安定化構造を有する場合は、安定化構造を除外したペプチド量)で、0.1mg〜1mg、好ましくは0.4mg〜0.8mg程度であるがもちろんこの範囲に限定されるものではない。
【0026】
本発明の分子シャペロン誘導剤は、上記ペプチドのみから成っていてもよいし、また、各投与形態に適した、薬剤的に許容される担体及び/又は希釈剤を用いて製剤することもできる。製剤方法及びそのための各種担体は、医薬製剤の分野において周知である。薬剤的に許容される担体又は希釈剤は、例えば、生理緩衝液のような緩衝液や、賦形剤(砂糖、乳糖、コーンスターチ、リン酸カルシウム、ソルビトール、グリシン等)であってよく、結合剤(シロップ、ゼラチン、アラビアゴム、ソルビトール、ポリビニルクロリド、トラガント等)、滑沢剤(ステアリン酸マグネシウム、ポリエチレングリコール、タルク、シリカ等)等が適宜混合されていてもよい。投与形態としては、錠剤、カプセル剤、顆粒剤、散剤、シロップ剤などによる経口剤、吸入剤、注射剤、座剤、液剤などによる非経口剤などを挙げることができる。これらの製剤は一般的に知られている製法によって作ることができる。
【0027】
さらに、下記実施例に具体的に記載するように、上記本発明のペプチドは、がん細胞に対する殺傷効果を有し、一方、正常細胞に対する殺傷効果は低い。従って、上記ペプチドは、がん細胞に直接作用する抗がん剤として用いることができる。
【0028】
下記実施例では、種類が全く異なるヒト子宮頸部癌細胞、副腎髄質褐色細胞腫及び神経芽細胞腫に対する効果を調べた結果、いずれも優れた治療効果が確認されたので、本発明の抗がん剤は、これらの3種類のがんだけではなく、種々のがんに対して有効であると考えられる。従って、治療対象となるがんは、上記3種類の癌に加え、各種がん、特に子宮がん、乳がん、胃がん、大腸がん、肝臓がん、膵臓がん、肺がん等の各種固形がんの治療に有効である。
【0029】
上記の通り、生理活性を有するペプチドにおいて、少数のアミノ酸が置換し、欠失し又は挿入された場合であってもその生理活性が維持される場合があることは当業者にとって周知である。従って、上記した本発明のペプチドに加え、アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、抗がん作用を有するペプチドも抗がん剤として用いることができる。上記の通り、天然のタンパク質を構成する20種類のアミノ酸は、低極性側鎖を有する中性アミノ酸(Gly, Ile, Val, Leu, Ala, Met, Pro)、親水性側鎖を有する中性アミノ酸(Asn, Gln, Thr, Ser, Tyr, Cys)、酸性アミノ酸(Asp, Glu)、塩基性アミノ酸(Arg, Lys, His)、芳香族アミノ酸(Phe, Tyr, Trp)のように類似の性質を有するものにグループ分けでき、これらの間での置換であればペプチドの性質が変化しないことが多いことが知られている。従って、配列番号1〜3のいずれかで示されるアミノ酸配列から成るペプチド中のアミノ酸残基を置換する場合には、これらの各グループの間で置換することにより、当該ペプチドの抗がん活性が維持される可能性が高くなる。
【0030】
上記の通り、生理活性を有するペプチドをそっくり含み、その一端又は両端に他のアミノ酸配列が連結されたペプチドであってもその生理活性が維持される場合があることは当業者にとって周知である。従って、上記した抗がん活性を有するペプチドを含み、抗がん作用を有するペプチドを抗がん剤として用いることも可能である。この場合、上記した抗がん活性を有するペプチドの一端又は両端に付加されるアミノ酸の数は、最終的なペプチドが抗がん活性を有する限り特に限定されないが、合成の容易さ及び単位重量当たりの活性を高くする観点から、1個〜数個であることが好ましく、特に1個又は2個であることが好ましい。
【0031】
また、上記した通り、抗がん剤として用いる場合にも、上記したペプチドをそっくり含み、その一端にPEG鎖等の安定化構造を付加したものを有効成分として用いることができる。文脈からそうでないことが明らかな場合を除き、抗がん剤の有効成分として用いられる「ペプチド」という語には、PEG化ペプチドのような、安定化誘導体も包含される。なお、上記の通り、PEG化によりペプチドを安定化する場合には、PEGのサイズは分子量数千〜5万、好ましくは1万〜5万程度である。また、ペプチドの一端にPEGを結合する方法は周知である。
【0032】
上記種々のペプチドのうち、上記(1)を有効成分として含有するものが好ましく、特に、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て含むが好ましい。
【0033】
本発明の抗がん剤の投与経路は、経口でも非経口でもよく、非経口の場合、静脈内、筋肉内、皮下、皮内、経皮、直腸内、点眼等、通常の各種投与経路で投与可能である。特に、上記ペプチドは、がん細胞に対して直接的な殺傷効果を発揮することから、注射等により、がん組織に直接投与することにより特に強い抗がん活性を発揮する。投与量は、投与目的及び患者の状態等に応じて適宜設定されるが、通常、成人1日当たり、ペプチド量(PEG等の安定化構造を有する場合は、安定化構造を除外したペプチド量)で、1mg〜150mg、好ましくは50mg〜100mg程度であるがもちろんこの範囲に限定されるものではない。
【0034】
抗がん剤は、上記ペプチドのみから成っていてもよいし、常法により製剤化することも可能である。製剤化に関する説明は、分子シャペロン誘導剤についての上記説明をそのまま適用することができる。
【0035】
なお、上記の通り、本発明の分子シャペロン誘導剤又は抗がん剤の有効成分として用いられるペプチドは、市販のペプチド合成機で容易に化学合成可能であるので、分子シャペロン誘導剤又は抗がん剤は、好ましくは化学合成したペプチドを有効成分として含む医薬品の形態として用いることができる。化学合成ペプチドは、不純物をほとんど含まないので、組成のはっきりした医薬品を得るのに適している。一方、下記実施例に具体的に記載される通り、分子シャペロン誘導剤又は抗がん剤の有効成分として用いられるペプチドは、食品である納豆に含まれているので、分子シャペロン誘導剤又は抗がん剤は、納豆又はその抽出物を特定健康食品の形態とすることもできる。特定健康食品は、薬効を有する食品であり、薬効と、その薬効を発揮する成分を明示したものである。本発明により、上記の通り、分子シャペロン誘導活性と抗がん活性という薬効が明らかになり、その薬効を発揮するペプチドも同定されたので、本発明により分子シャペロン誘導作用又は抗がん作用を持つ特定健康食品が提供可能になった。
【0036】
また、本発明は、上記本発明の分子シャペロン誘導作用又は抗がん作用を持つペプチド(以下、「活性ペプチド」ということがある)を食品に添加又は増強した、該ペプチドを強化したペプチド強化食品をも提供する。このペプチド強化食品は、分子シャペロン誘導作用又は抗がん作用を持つペプチドを通常の食品よりも多く含むので、分子シャペロン誘導作用又は抗がん作用が増強された健康食品である。添加量は何ら限定されず、例えば上記した各投与量の範囲で適宜設定することができる。また、ペプチドを添加する食品としては、何ら限定されるものではないが、納豆、豆腐、揚げ、おから等の大豆製品を好ましい例として挙げることができる。ここで、食品に添加される活性ペプチドとしては、化学合成したペプチドを用いることができ、また、納豆などの発酵食品から得られる抽出物の画分のうち、活性ペプチドを多く含む画分を食品に添加してもよい。ここで、活性ペプチドを多く含む画分は、本発明の活性ペプチドの抗体を用いることにより、容易に判別することができる。
【0037】
尚、上記の食品に添加する活性ペプチド又は活性ペプチド多く含む画分は、それ単体で分子シャペロン誘導活性又は抗がん活性を有するサプリメントとすることもできる。
【0038】
さらに、食品が納豆の場合には、活性ペプチドを添加することなく、食品の発酵時間を長くし、又は、タンパク質の分解を促す酵素もしくは化学物質を添加することにより、本発明の活性ペプチドを増強した健康食品を製造することも可能である。
【0039】
上記種々のペプチドのうち、上記(1)を添加又は増強したものが好ましく、特に、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを添加又は増強したものが好ましい。
【0040】
本発明は、また、食品中に含まれる、本発明の活性ペプチドの含有量を測定することにより、食品の分子シャペロン誘導活性又は抗ガン活性を評価することを可能とする。この評価結果を食品のパッケージ等に表示することにより、食品の商品価値を高めることができるものである。
【0041】
ここで、食品としては、発酵食品が好ましく、特に納豆が好ましい。また、本発明の活性ペプチドの含有量を測定する方法としては、特に限定されず、例えば、本発明の活性ペプチドに特異的な抗体を作成し、該抗体を用いたELISA法などの抗原抗体反応により活性ペプチドの含有量を測定する方法や、高速液体クロマトグラフィーにより、活性ペプチドを検出・定量する方法を用いることができる。
【0042】
ここで用いる活性ペプチドに特異的な抗体は、これらに限定されるわけではないが、例えば、ラット、ウサギなどの動物に活性ペプチドを免疫し、該動物から分離された抗体産生細胞と骨髄腫細胞とを融合したハイブリドーマを作成し、活性ペプチドに特異的な抗体を産生する細胞をスクリーニングして、このハイブリドーマの培養上清から得られるモノクローナル抗体を用いることができる。また、ポリクローナル抗体や、ファージディスプレイでスクリーニングした上で動物細胞で産生した抗体を用いることもできる。抗体の作成方法は既に確立されており、免疫原として用いる活性ペプチドがあれば、常法により容易に作製することができる。
【0043】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【実施例】
【0044】
実施例1 ペプチドの同定と抗がん活性
1.方法
(1) 納豆分画試料作製方法
納豆 170gを秤量し、510ml(納豆に対し3倍量)の10mM Tris-HCl(pH7.4)を加え、ホモジナイザーで均質化した。均質化した納豆は15分間、 4℃、15,500rpmで遠心分離を行い、可溶性成分と不溶性成分に分離した。上清の可溶性成分を回収し、飽和濃度が30%になるように硫酸アンモニウムを添加して、30分冷蔵庫内で攪拌した。攪拌後の飽和溶液は15分、4℃、15,500rpmで遠心分離を行った。分離後に回収した上清に対し、飽和濃度が50%になるように硫酸アンモニウムを添加し、30分冷蔵庫内で攪拌した。同様に15分、4℃、15,000rpmで遠心分離を行い、沈殿を得た(30-50分画)。
【0045】
得られた沈殿は10mlの10mM Tris-HCl(pH7.4)で溶解した。溶解した分画溶液を10mM Tris-HCl(pH7.4)で24時間塩析を行った。塩析終了後の試料にmilli-Q水(商品名)を等量加え凍結させた後、凍結乾燥を行い、細胞添加用の試料とした。
【0046】
(2) 納豆分画成分添加実験(細胞形態)
6cmシャーレを使用し、5mlの培地(Dulbecco's Modified Eagle Medium(シグマ)、 10% Fetal bovine serum(MBL)、 0.1% Penicillin/Streptomycin(インビトロジェン))にHeLa細胞(ヒト子宮頸部癌細胞)を継代し、サブコンフルエント(シャーレの70〜80%)になるまで培養した。凍結乾燥した納豆分画成分を精密天秤で秤量し、濃度10mg/mlになるように1×PBS()で溶解し、0.22μmの滅菌フィルター(ザルトリウス社 ミニザルト)に通したものを細胞に添加した。添加濃度は1mg/mlとなるように、培地4.5mlに対し、10mg/mlの試料0.5mlを添加し、24時間培養した。
【0047】
(3) 細胞生存率測定実験(MTT法)
6cmシャーレにHeLa細胞をコンフルエント(約90%)になるまで通常培養した。細胞数を血球計算盤を用いてカウントし、1×104個/mlになるように培地で希釈し調整した。調整した細胞を96wellに100μLずつ添加し24時間培養した。24時間後、各wellから50μL培地を除去し、最終濃度の2倍濃度(2mg/ml)となる試料を50μL添加し、再び24時間培養した。培養後、5mg/mlのMTT溶液(Thiazolyl Blue Tetrazolium Bromide(シグマ)を1×PBS()で溶解)を各wellに10μL添加し、更に4時間培養した。培養終了後、全てのwellの培地を除去し、0.04N HCl-Isopropanolを各wellに100μL添加した。生成したホルマザン結晶を完全に溶解し、マイクロプレートリーダー(OD570)で吸光度を測定した。
【0048】
(4) ペプチドの同定
Tris-Tricine 電気泳動及び高速液体クロマトグラフィーを次のようにして行った。
【0049】
1)16%アクリルアミドゲルの上に、10%アクリルアミドゲルを1cm重層しさらにDW(重流水)を重層。ゲルが固まったのち、DWを捨て、その上にスッタッキングゲル(5%アクリルアミドゲル)を重層しコームをさす。
2) +極にAnode Buffer(0.1M Tris,0.2% HCl)、−極側にCathode Buffer (0.1M Tris,0.1M Tricine,0.1%(w/v) SDS) をみたし電気泳動を行う。
3) 泳動終了後、CBB(クーマシーブリリアントブルー)染色液(0.1%(w/v) CBB R250、10% 酢酸、25%イソプロパノール)で一晩染色を行う。
4) 脱色液(10% 酢酸、10%イソプロパノール)で脱色後、目的バンドを切り出し、溶出バッファー(0.05M Tris,0.2M Glycine,0.1%(w/v)SDS)で一晩平衡化を行う。
5) 切り出したゲルからプロテインエリューターを用いて蛋白質を抽出し、回収する。
6) 溶出したペプチドを、バッファー(0.05M Tris,0.2M Glycine)で平衡化した Affinity Pak TM Extracti-Gel Dカラム(Thermo)に添加、非吸着成分を回収し、SDSを除去する。
7) DW/0.1% TFAバッファーで平衡化したLP-HPLCカラム(高純度C18シリカゲルベース逆相HPLCカラム、TOSOH)に添加する。
8) Acetonitril/0.08%TFAバッファーを用い、0-60% まで直線濃度勾配をかけながら溶出し、サンプルをマイクロチューブにて回収する。
9) ピークが検出されたフラクションの凍結乾燥を行う。
10) 各フラクションをmilli-Q水(商品名)で再溶解し、HeLa細胞に添加後、細胞の生存率を解析する。
11) ペプチドシークェンサーで、アミノ酸配列を同定する。
【0050】
2.結果
納豆からタンパク質を抽出し、硫酸アンモニウムによる分画を行い、図1Aのコントロール細胞に対して、上記硫安30-50分画を培養ヒト子宮頸部癌細胞に添加した結果、翌日には全ての癌細胞が死滅した(図1B)。一方、煮豆からのタンパク質抽出成分から同様の方法で硫酸アンモニウムによる分画を行い、ヒト子宮頸部癌 (HeLa) 細胞に添加した結果、細胞の増殖には全く変化がなかった(図1C)。他の培養癌細胞(具体的にはHeLa(ヒト子宮頚部癌細胞), PC12(ラット副腎髄質褐色細胞腫 ), Neuro2A(マウス神経芽細胞腫)の3種類(形態))でも全く同一の結果を得た。
【0051】
煮豆成分では全く変化がなかったことから、大豆に含まれるイソフラボンは関与しないことが判明した。また、納豆菌のみを添加しても全く変化がなかった(図1D)。この結果から、納豆抽出成分には、癌細胞殺傷能力があることが判明した。
【0052】
上記と同様なMTT法により正常細胞に対する効果を調べた。各硫安分画を細胞に添加した。Neuro2A(マウス神経芽細胞腫)に対する結果と比較して図6に示す。図6から明らかなように、硫安30-50分画は、マウス神経芽細胞腫Neuro2Aの増殖を強く抑制したが、正常細胞であるNIH3T3(マウス胎児皮膚細胞)の増殖抑制はNeuro2A細胞に対する増殖抑制よりもずっと少なく、コントロールに対して統計学的有意差も認められない程度であった。正常細胞として、さらにHEK293(ヒト胎児腎臓細胞)及びLLC-PK1(ブタ腎臓近位尿細管細胞)の2種類(形態)を用いて確認したが、図6と同様な結果となり、正常細胞の増殖も若干抑えたが、その程度は、がん細胞の増殖抑制の程度に比べて明らかに少なかった。
【0053】
次に、抗がん成分を同定するために、上記の通り電気泳動と高速液体クロマトグラフィーを行った。電気泳動の結果を図2、高速液体クロマトグラフィーの結果を図3に示す。図2に示される電気泳動バンドのうち、矢印で示される分子量約5000の画分に抗がん活性が認められた。上記の通り、このバンドを切り出し、高速液体クロマトグラフィーにかけた結果、図3に示すように18個のピークが観察された。各ピークを含む18個のフラクションを上記の通りHeLa細胞に添加し、細胞の生存率を解析した。結果を図4に示す。図4中、Controlは、無添加のHeLa細胞を示す。図4に示されるようにフラクションNo.(6)〜(10)でがん細胞が死滅した。
【0054】
これらのフラクションに含まれる成分を解析したところ、下記の3種類のペプチドが同定された。なお、フラクションNo.(6)〜(10)の各フラクションがそれぞれ下記の3種類のペプチドを含んでいた。
ペプチド#1: AQSVPYGISQ IKAPALHS (配列番号1)
ペプチド#2: AVKVLDSTG SGQY (配列番号2)
ペプチド#3: SMATPHVAGA AALI (配列番号3)
【0055】
実施例2 分子シャペロン誘導効果
実施例1で同定されたペプチド#1、ペプチド#2及びペプチド#3を含む上記硫安30-50分画を実施例1と同様にしてHeLa細胞に添加、培養し、代表的な分子シャペロンであるHSP(heat shock protein)90、HSP72、HSP60のイムノブロット法で検出した。これは具体的に次のようにして行った。
【0056】
上記硫安30-50分画を添加、培養したHeLa細胞をホモジナイズし、4℃、15,000rpm、10分遠心分離を行い、上清を回収し、等量のSDS-Sample bufferを加え、100℃、3分加温し電気泳動(SDS-PAGE)を行った。ブロット槽を用いて、電気泳動バンドを100V10分間、PVDF膜に転写した。転写後のPVDF膜を(1)7%スキムミルク溶液で15分間ブロッキングし、(2)第一抗体である1000倍希釈抗分子シャペロン抗体(抗HSP90抗体、抗HSP72抗体又は抗HSP60抗体)と37℃2時間反応させ、(3)第一抗体洗浄後、第二抗体である1000倍希釈アルカリフォスファターゼ標識抗ウサギIgG抗体と37℃1時間反応させ、(4)アルカリフォスファターゼ発色液にて発色させた。なお、各分子シャペロン抗体は、常法により分子シャペロンをウサギに免疫して作製したポリクローナル抗体である。
【0057】
イムノブロットの結果を図5に示す。図5に示されるように、本発明のペプチドは分子シャペロン誘導活性を示した。
【技術分野】
【0001】
本発明は、新規なペプチド並びにそれを有効成分として含有する分子シャペロン誘導剤及び抗がん剤に関する。
【背景技術】
【0002】
分子シャペロンは、他の蛋白質分子が正しいフォールディングをして機能を獲得するのを助けるタンパク質の総称であり、熱ショック等の種々のストレスから生体を守る働きをしている。哺乳動物では、ヒートショック蛋白であるHSP90、HSP72、HSP60等、10数種類が報告されている。これらの分子シャペロンは、風邪などによる発熱時に強く誘導され、熱変性蛋白質の生理機能回復を介助する。
【0003】
細胞内における分子シャペロンの発現を増大させる物質が分子シャペロン誘導剤である。分子シャペロン誘導剤により細胞内における分子シャペロンの生産量が増大するので、分子シャペロン誘導剤も分子シャペロンと同様な生理活性を発揮する。分子シャペロン誘導剤の探索及びその医薬品への応用が進められているが、現在、上市されている医薬品で分子シャペロン誘導作用を有するものは、胃炎、胃潰瘍治療剤として用いられているテプレノン(商品名セルベックス)のみである。もっとも、テプレノンが分子シャペロン誘導を実現するには大量投与(成人でkgオーダー)が必要と考えられている。他の分子シャペロン誘導剤としては、各種アルカロイド類が報告されているが、アルカロイド類は一般に毒性が強く、医薬として用いられてはいない。
【0004】
一方、天然物由来の抗がん剤としては、大豆に含まれるイソフラボン及びその類縁体が知られており(特許文献1)、イソフラボン類と特定構造のカテキン類(特許文献2)又は大豆サポニン(特許文献3)との併用が抗がん活性を発揮することも報告されている。しかしながら、これらの抗がん活性は必ずしも満足できるものではない。また、癌抗原の部分ペプチドから成る、いわゆる癌ワクチンも種々開発されているが、これらのペプチドは、生体の細胞免疫機構を利用して癌細胞を攻撃するものであり、癌細胞に直接作用して癌細胞を死滅又は増殖抑制するものではない。
【0005】
さらに、特許文献4には、枯草菌のセリンプロテアーゼ由来のペプチドであって、ヒトMHCクラスIIに結合する可能性の高いペプチドが記載されている。しかしながら、特許文献4に記載されているペプチドは、アミノ酸配列が後述する本発明のペプチドとは異なっており、また、それらのペプチドの分子シャペロン誘導活性や抗がん活性については全く記載も示唆もされていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開昭61-246124号公報
【特許文献2】特開2001-114687
【特許文献3】特開2003-002838
【特許文献4】米国特許第7,430,476号
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、分子シャペロン誘導活性及び抗がん活性を有する新規ペプチドを提供することである。また、本発明の目的は、新規な分子シャペロン誘導剤及び抗がん剤を提供することである。
【課題を解決するための手段】
【0008】
本願発明者らは、下記実施例に具体的に記載するように、納豆の抽出物のうち特定の画分のものが分子シャペロン誘導活性及び抗がん活性を有することを見出し、液体クロマトグラフィーを行って各ピークに含まれる物質を同定した結果、3種類の新規ペプチドを見出し、本発明に至った。
【0009】
すなわち、本発明は、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを提供する。
【0010】
また、本発明は、下記(1)〜(3)の少なくともいずれかを有効成分として含有する分子シャペロン誘導剤を提供する。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含み分子シャペロン誘導作用を有するペプチド。
【0011】
さらに本発明は、下記(1)〜(3)の少なくともいずれかを有効成分として含有する抗がん剤を提供する。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって抗がん作用を有するペプチド。
【0012】
さらに本発明は、食品に、下記(1)〜(3)の少なくともいずれかのペプチドを添加した、ペプチド強化食品を提供する。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用又は抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって分子シャペロン誘導作用又は抗がん作用を有するペプチド。
【0013】
さらに本発明は、食品中に含まれる下記(1)〜(3)の少なくともいずれかのペプチドの含有量を測定することを特徴とする、食品の分子シャペロン誘導活性及び/又は抗ガン活性の評価方法を提供する。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用又は抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって分子シャペロン誘導作用又は抗がん作用を有するペプチド。
【0014】
さらに本発明は、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドに特異的に結合する活性を有する抗体を提供する。
【発明の効果】
【0015】
本発明により、分子シャペロン誘導活性及びがん細胞に直接作用する抗がん活性を有する新規なペプチドが提供された。下記実施例に具体的に記載されるように、本発明のペプチドは、HSP90等の分子シャペロンを誘導する高い活性を有する。従って、本発明のペプチドは、分子シャペロン誘導剤として有用であり、分子シャペロン誘導効果によりもたらされる様々な作用を発揮する。また、下記実施例に具体的に記載されるように、本発明のペプチドは、がん細胞に対して直接的に高い殺傷効果を発揮する。従って、本発明のペプチドは、優れた抗がん活性を発揮する抗がん剤として有用である。また、下記実施例に下記実施例に具体的に示されるように、本発明のペプチドは、正常細胞に対する増殖抑制作用が弱いので、副作用が少ない。
【図面の簡単な説明】
【0016】
【図1】納豆の抽出画分をHeLa細胞に添加して培養した結果を示す顕微鏡写真である。Aは添加前のHeLa細胞、Bは、納豆の抽出画分を添加、培養後のHeLa細胞である。Cは対照として行った、煮豆の抽出画分をHeLa細胞に添加して培養した結果を示し、Dは納豆菌のみを添加、培養した結果を示す。
【図2】納豆の抽出物の硫安画分の電気泳動バンドを示す。
【図3】図2に示す電気泳動バンドのうち、抗がん活性を示した、矢印のバンドを切り出して高速液体クロマトグラフィーにかけた結果を示す図である。
【図4】図3に示す高速液体クロマトグラフィーで得られた各ピークを含むフラクションをHeLa細胞に添加、培養した結果を示す顕微鏡写真である。
【図5】本発明のペプチドを含む分画をHeLa細胞に添加、培養後、細胞内の各種熱ショックタンパクをイムノブロット法で検出した結果を示す図である。
【図6】本発明のペプチドを含む分画について、MTT法により正常細胞に対する効果を調べた結果をNeuro2A(マウス神経芽細胞腫)に対する結果と比較して示す図である。
【発明を実施するための形態】
【0017】
上記の通り、本発明のペプチドは、そのアミノ酸配列が配列番号1〜3のいずれかで示されるペプチドである。
【0018】
本発明のペプチドは、下記実施例に具体的に記載する方法により、納豆から精製することもできるし、そのサイズが13〜18と短いので、市販のペプチド合成機を用いて容易に化学合成することができる。
【0019】
下記実施例に具体的に記載するように、本発明のペプチドは、分子シャペロン誘導活性を有する。すなわち、本発明のペプチドを細胞に作用させると、細胞内でのHSP90、HSP72及びHSP60のような熱ショック蛋白等の分子シャペロンの生産が増大する。
【0020】
分子シャペロンは、細胞ひいては生体が熱ショックや化学薬品にさらされる等のストレスを受けた際に、正常なフォールディングができなくなった各種タンパク質の構造を元に戻して正常化する働きを持ち、生命の維持に重要な役割を果たしている。本発明のペプチドは、分子シャペロン誘導活性を有するので、この分子シャペロンの生産量を増大させ、ひいては細胞内における分子シャペロン活性を高める作用を有する。従って、本発明のペプチドは、分子シャペロンが発揮する様々な生理活性を高める働きをする。医薬品として用いる場合、具体的な薬効の例としては、体力消耗時の健康回復、流行性感冒等、ウィルス感染初期症状における生体防御等を挙げることができる。
【0021】
なお、一般に、生理活性を有するペプチドにおいて、少数のアミノ酸が置換し、欠失し又は挿入された場合であってもその生理活性が維持される場合があることは当業者にとって周知である。従って、上記した本発明のペプチドに加え、アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用を有するペプチドも分子シャペロン誘導剤として用いることができる。なお、天然のタンパク質を構成する20種類のアミノ酸は、低極性側鎖を有する中性アミノ酸(Gly, Ile, Val, Leu, Ala, Met, Pro)、親水性側鎖を有する中性アミノ酸(Asn, Gln, Thr, Ser, Tyr, Cys)、酸性アミノ酸(Asp, Glu)、塩基性アミノ酸(Arg, Lys, His)、芳香族アミノ酸(Phe, Tyr, Trp)のように類似の性質を有するものにグループ分けでき、これらの間での置換であればペプチドの性質が変化しないことが多いことが知られている。従って、配列番号1〜3のいずれかで示されるアミノ酸配列から成るペプチド中のアミノ酸残基を置換する場合には、これらの各グループの間で置換することにより、当該ペプチドの分子シャペロン誘導活性が維持される可能性が高くなる。
【0022】
また、生理活性を有する2種類のペプチドが連結された融合ペプチドが、各ペプチドの生理活性を維持する場合があることからも明らかなように、生理活性を有するペプチドをそっくり含み、その一端又は両端に他のアミノ酸配列が連結されたペプチドであってもその生理活性が維持される場合があることは当業者にとって周知である。従って、上記した分子シャペロン誘導活性を有するペプチドを含み、分子シャペロン誘導作用を有するペプチドを分子シャペロン誘導剤として用いることも可能である。この場合、上記した分子シャペロン誘導活性を有するペプチドの一端又は両端に付加されるアミノ酸の数は、最終的なペプチドが分子シャペロン誘導活性を有する限り特に限定されないが、合成の容易さ及び単位重量当たりの活性を高くする観点から、1個〜数個であることが好ましく、特に1個又は2個であることが好ましい。
【0023】
なお、一般に、ペプチド製剤においては、生体内でのプロテアーゼによる分解を受けにくくするためにペプチドの一端にポリエチレングリコール(PEG)鎖等を結合したものが広く用いられている。本発明の分子シャペロン誘導剤においても、同様に、上記したペプチドをそっくり含み、その一端にPEG鎖等の安定化構造を付加したものを有効成分として用いることができる。文脈からそうでないことが明らかな場合を除き、分子シャペロン誘導剤の有効成分として用いられる「ペプチド」という語には、PEG化ペプチドのような、安定化誘導体も包含される。なお、PEG化によりペプチドを安定化する場合には、PEGのサイズは分子量数千〜5万、好ましくは1万〜5万程度である。また、ペプチドの一端にPEGを結合する方法は周知である。
【0024】
上記種々のペプチドのうち、上記(1)を有効成分として含有するものが好ましく、特に、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て含むが好ましい。
【0025】
本発明の分子シャペロン誘導剤の投与経路は、経口でも非経口でもよく、非経口の場合、静脈内、筋肉内、皮下、皮内、経皮、直腸内、点眼等、通常の各種投与経路で投与可能である。投与量は、投与目的及び患者の状態等に応じて適宜設定されるが、通常、成人1日当たり、ペプチド量(PEG等の安定化構造を有する場合は、安定化構造を除外したペプチド量)で、0.1mg〜1mg、好ましくは0.4mg〜0.8mg程度であるがもちろんこの範囲に限定されるものではない。
【0026】
本発明の分子シャペロン誘導剤は、上記ペプチドのみから成っていてもよいし、また、各投与形態に適した、薬剤的に許容される担体及び/又は希釈剤を用いて製剤することもできる。製剤方法及びそのための各種担体は、医薬製剤の分野において周知である。薬剤的に許容される担体又は希釈剤は、例えば、生理緩衝液のような緩衝液や、賦形剤(砂糖、乳糖、コーンスターチ、リン酸カルシウム、ソルビトール、グリシン等)であってよく、結合剤(シロップ、ゼラチン、アラビアゴム、ソルビトール、ポリビニルクロリド、トラガント等)、滑沢剤(ステアリン酸マグネシウム、ポリエチレングリコール、タルク、シリカ等)等が適宜混合されていてもよい。投与形態としては、錠剤、カプセル剤、顆粒剤、散剤、シロップ剤などによる経口剤、吸入剤、注射剤、座剤、液剤などによる非経口剤などを挙げることができる。これらの製剤は一般的に知られている製法によって作ることができる。
【0027】
さらに、下記実施例に具体的に記載するように、上記本発明のペプチドは、がん細胞に対する殺傷効果を有し、一方、正常細胞に対する殺傷効果は低い。従って、上記ペプチドは、がん細胞に直接作用する抗がん剤として用いることができる。
【0028】
下記実施例では、種類が全く異なるヒト子宮頸部癌細胞、副腎髄質褐色細胞腫及び神経芽細胞腫に対する効果を調べた結果、いずれも優れた治療効果が確認されたので、本発明の抗がん剤は、これらの3種類のがんだけではなく、種々のがんに対して有効であると考えられる。従って、治療対象となるがんは、上記3種類の癌に加え、各種がん、特に子宮がん、乳がん、胃がん、大腸がん、肝臓がん、膵臓がん、肺がん等の各種固形がんの治療に有効である。
【0029】
上記の通り、生理活性を有するペプチドにおいて、少数のアミノ酸が置換し、欠失し又は挿入された場合であってもその生理活性が維持される場合があることは当業者にとって周知である。従って、上記した本発明のペプチドに加え、アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、抗がん作用を有するペプチドも抗がん剤として用いることができる。上記の通り、天然のタンパク質を構成する20種類のアミノ酸は、低極性側鎖を有する中性アミノ酸(Gly, Ile, Val, Leu, Ala, Met, Pro)、親水性側鎖を有する中性アミノ酸(Asn, Gln, Thr, Ser, Tyr, Cys)、酸性アミノ酸(Asp, Glu)、塩基性アミノ酸(Arg, Lys, His)、芳香族アミノ酸(Phe, Tyr, Trp)のように類似の性質を有するものにグループ分けでき、これらの間での置換であればペプチドの性質が変化しないことが多いことが知られている。従って、配列番号1〜3のいずれかで示されるアミノ酸配列から成るペプチド中のアミノ酸残基を置換する場合には、これらの各グループの間で置換することにより、当該ペプチドの抗がん活性が維持される可能性が高くなる。
【0030】
上記の通り、生理活性を有するペプチドをそっくり含み、その一端又は両端に他のアミノ酸配列が連結されたペプチドであってもその生理活性が維持される場合があることは当業者にとって周知である。従って、上記した抗がん活性を有するペプチドを含み、抗がん作用を有するペプチドを抗がん剤として用いることも可能である。この場合、上記した抗がん活性を有するペプチドの一端又は両端に付加されるアミノ酸の数は、最終的なペプチドが抗がん活性を有する限り特に限定されないが、合成の容易さ及び単位重量当たりの活性を高くする観点から、1個〜数個であることが好ましく、特に1個又は2個であることが好ましい。
【0031】
また、上記した通り、抗がん剤として用いる場合にも、上記したペプチドをそっくり含み、その一端にPEG鎖等の安定化構造を付加したものを有効成分として用いることができる。文脈からそうでないことが明らかな場合を除き、抗がん剤の有効成分として用いられる「ペプチド」という語には、PEG化ペプチドのような、安定化誘導体も包含される。なお、上記の通り、PEG化によりペプチドを安定化する場合には、PEGのサイズは分子量数千〜5万、好ましくは1万〜5万程度である。また、ペプチドの一端にPEGを結合する方法は周知である。
【0032】
上記種々のペプチドのうち、上記(1)を有効成分として含有するものが好ましく、特に、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て含むが好ましい。
【0033】
本発明の抗がん剤の投与経路は、経口でも非経口でもよく、非経口の場合、静脈内、筋肉内、皮下、皮内、経皮、直腸内、点眼等、通常の各種投与経路で投与可能である。特に、上記ペプチドは、がん細胞に対して直接的な殺傷効果を発揮することから、注射等により、がん組織に直接投与することにより特に強い抗がん活性を発揮する。投与量は、投与目的及び患者の状態等に応じて適宜設定されるが、通常、成人1日当たり、ペプチド量(PEG等の安定化構造を有する場合は、安定化構造を除外したペプチド量)で、1mg〜150mg、好ましくは50mg〜100mg程度であるがもちろんこの範囲に限定されるものではない。
【0034】
抗がん剤は、上記ペプチドのみから成っていてもよいし、常法により製剤化することも可能である。製剤化に関する説明は、分子シャペロン誘導剤についての上記説明をそのまま適用することができる。
【0035】
なお、上記の通り、本発明の分子シャペロン誘導剤又は抗がん剤の有効成分として用いられるペプチドは、市販のペプチド合成機で容易に化学合成可能であるので、分子シャペロン誘導剤又は抗がん剤は、好ましくは化学合成したペプチドを有効成分として含む医薬品の形態として用いることができる。化学合成ペプチドは、不純物をほとんど含まないので、組成のはっきりした医薬品を得るのに適している。一方、下記実施例に具体的に記載される通り、分子シャペロン誘導剤又は抗がん剤の有効成分として用いられるペプチドは、食品である納豆に含まれているので、分子シャペロン誘導剤又は抗がん剤は、納豆又はその抽出物を特定健康食品の形態とすることもできる。特定健康食品は、薬効を有する食品であり、薬効と、その薬効を発揮する成分を明示したものである。本発明により、上記の通り、分子シャペロン誘導活性と抗がん活性という薬効が明らかになり、その薬効を発揮するペプチドも同定されたので、本発明により分子シャペロン誘導作用又は抗がん作用を持つ特定健康食品が提供可能になった。
【0036】
また、本発明は、上記本発明の分子シャペロン誘導作用又は抗がん作用を持つペプチド(以下、「活性ペプチド」ということがある)を食品に添加又は増強した、該ペプチドを強化したペプチド強化食品をも提供する。このペプチド強化食品は、分子シャペロン誘導作用又は抗がん作用を持つペプチドを通常の食品よりも多く含むので、分子シャペロン誘導作用又は抗がん作用が増強された健康食品である。添加量は何ら限定されず、例えば上記した各投与量の範囲で適宜設定することができる。また、ペプチドを添加する食品としては、何ら限定されるものではないが、納豆、豆腐、揚げ、おから等の大豆製品を好ましい例として挙げることができる。ここで、食品に添加される活性ペプチドとしては、化学合成したペプチドを用いることができ、また、納豆などの発酵食品から得られる抽出物の画分のうち、活性ペプチドを多く含む画分を食品に添加してもよい。ここで、活性ペプチドを多く含む画分は、本発明の活性ペプチドの抗体を用いることにより、容易に判別することができる。
【0037】
尚、上記の食品に添加する活性ペプチド又は活性ペプチド多く含む画分は、それ単体で分子シャペロン誘導活性又は抗がん活性を有するサプリメントとすることもできる。
【0038】
さらに、食品が納豆の場合には、活性ペプチドを添加することなく、食品の発酵時間を長くし、又は、タンパク質の分解を促す酵素もしくは化学物質を添加することにより、本発明の活性ペプチドを増強した健康食品を製造することも可能である。
【0039】
上記種々のペプチドのうち、上記(1)を添加又は増強したものが好ましく、特に、アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを添加又は増強したものが好ましい。
【0040】
本発明は、また、食品中に含まれる、本発明の活性ペプチドの含有量を測定することにより、食品の分子シャペロン誘導活性又は抗ガン活性を評価することを可能とする。この評価結果を食品のパッケージ等に表示することにより、食品の商品価値を高めることができるものである。
【0041】
ここで、食品としては、発酵食品が好ましく、特に納豆が好ましい。また、本発明の活性ペプチドの含有量を測定する方法としては、特に限定されず、例えば、本発明の活性ペプチドに特異的な抗体を作成し、該抗体を用いたELISA法などの抗原抗体反応により活性ペプチドの含有量を測定する方法や、高速液体クロマトグラフィーにより、活性ペプチドを検出・定量する方法を用いることができる。
【0042】
ここで用いる活性ペプチドに特異的な抗体は、これらに限定されるわけではないが、例えば、ラット、ウサギなどの動物に活性ペプチドを免疫し、該動物から分離された抗体産生細胞と骨髄腫細胞とを融合したハイブリドーマを作成し、活性ペプチドに特異的な抗体を産生する細胞をスクリーニングして、このハイブリドーマの培養上清から得られるモノクローナル抗体を用いることができる。また、ポリクローナル抗体や、ファージディスプレイでスクリーニングした上で動物細胞で産生した抗体を用いることもできる。抗体の作成方法は既に確立されており、免疫原として用いる活性ペプチドがあれば、常法により容易に作製することができる。
【0043】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【実施例】
【0044】
実施例1 ペプチドの同定と抗がん活性
1.方法
(1) 納豆分画試料作製方法
納豆 170gを秤量し、510ml(納豆に対し3倍量)の10mM Tris-HCl(pH7.4)を加え、ホモジナイザーで均質化した。均質化した納豆は15分間、 4℃、15,500rpmで遠心分離を行い、可溶性成分と不溶性成分に分離した。上清の可溶性成分を回収し、飽和濃度が30%になるように硫酸アンモニウムを添加して、30分冷蔵庫内で攪拌した。攪拌後の飽和溶液は15分、4℃、15,500rpmで遠心分離を行った。分離後に回収した上清に対し、飽和濃度が50%になるように硫酸アンモニウムを添加し、30分冷蔵庫内で攪拌した。同様に15分、4℃、15,000rpmで遠心分離を行い、沈殿を得た(30-50分画)。
【0045】
得られた沈殿は10mlの10mM Tris-HCl(pH7.4)で溶解した。溶解した分画溶液を10mM Tris-HCl(pH7.4)で24時間塩析を行った。塩析終了後の試料にmilli-Q水(商品名)を等量加え凍結させた後、凍結乾燥を行い、細胞添加用の試料とした。
【0046】
(2) 納豆分画成分添加実験(細胞形態)
6cmシャーレを使用し、5mlの培地(Dulbecco's Modified Eagle Medium(シグマ)、 10% Fetal bovine serum(MBL)、 0.1% Penicillin/Streptomycin(インビトロジェン))にHeLa細胞(ヒト子宮頸部癌細胞)を継代し、サブコンフルエント(シャーレの70〜80%)になるまで培養した。凍結乾燥した納豆分画成分を精密天秤で秤量し、濃度10mg/mlになるように1×PBS()で溶解し、0.22μmの滅菌フィルター(ザルトリウス社 ミニザルト)に通したものを細胞に添加した。添加濃度は1mg/mlとなるように、培地4.5mlに対し、10mg/mlの試料0.5mlを添加し、24時間培養した。
【0047】
(3) 細胞生存率測定実験(MTT法)
6cmシャーレにHeLa細胞をコンフルエント(約90%)になるまで通常培養した。細胞数を血球計算盤を用いてカウントし、1×104個/mlになるように培地で希釈し調整した。調整した細胞を96wellに100μLずつ添加し24時間培養した。24時間後、各wellから50μL培地を除去し、最終濃度の2倍濃度(2mg/ml)となる試料を50μL添加し、再び24時間培養した。培養後、5mg/mlのMTT溶液(Thiazolyl Blue Tetrazolium Bromide(シグマ)を1×PBS()で溶解)を各wellに10μL添加し、更に4時間培養した。培養終了後、全てのwellの培地を除去し、0.04N HCl-Isopropanolを各wellに100μL添加した。生成したホルマザン結晶を完全に溶解し、マイクロプレートリーダー(OD570)で吸光度を測定した。
【0048】
(4) ペプチドの同定
Tris-Tricine 電気泳動及び高速液体クロマトグラフィーを次のようにして行った。
【0049】
1)16%アクリルアミドゲルの上に、10%アクリルアミドゲルを1cm重層しさらにDW(重流水)を重層。ゲルが固まったのち、DWを捨て、その上にスッタッキングゲル(5%アクリルアミドゲル)を重層しコームをさす。
2) +極にAnode Buffer(0.1M Tris,0.2% HCl)、−極側にCathode Buffer (0.1M Tris,0.1M Tricine,0.1%(w/v) SDS) をみたし電気泳動を行う。
3) 泳動終了後、CBB(クーマシーブリリアントブルー)染色液(0.1%(w/v) CBB R250、10% 酢酸、25%イソプロパノール)で一晩染色を行う。
4) 脱色液(10% 酢酸、10%イソプロパノール)で脱色後、目的バンドを切り出し、溶出バッファー(0.05M Tris,0.2M Glycine,0.1%(w/v)SDS)で一晩平衡化を行う。
5) 切り出したゲルからプロテインエリューターを用いて蛋白質を抽出し、回収する。
6) 溶出したペプチドを、バッファー(0.05M Tris,0.2M Glycine)で平衡化した Affinity Pak TM Extracti-Gel Dカラム(Thermo)に添加、非吸着成分を回収し、SDSを除去する。
7) DW/0.1% TFAバッファーで平衡化したLP-HPLCカラム(高純度C18シリカゲルベース逆相HPLCカラム、TOSOH)に添加する。
8) Acetonitril/0.08%TFAバッファーを用い、0-60% まで直線濃度勾配をかけながら溶出し、サンプルをマイクロチューブにて回収する。
9) ピークが検出されたフラクションの凍結乾燥を行う。
10) 各フラクションをmilli-Q水(商品名)で再溶解し、HeLa細胞に添加後、細胞の生存率を解析する。
11) ペプチドシークェンサーで、アミノ酸配列を同定する。
【0050】
2.結果
納豆からタンパク質を抽出し、硫酸アンモニウムによる分画を行い、図1Aのコントロール細胞に対して、上記硫安30-50分画を培養ヒト子宮頸部癌細胞に添加した結果、翌日には全ての癌細胞が死滅した(図1B)。一方、煮豆からのタンパク質抽出成分から同様の方法で硫酸アンモニウムによる分画を行い、ヒト子宮頸部癌 (HeLa) 細胞に添加した結果、細胞の増殖には全く変化がなかった(図1C)。他の培養癌細胞(具体的にはHeLa(ヒト子宮頚部癌細胞), PC12(ラット副腎髄質褐色細胞腫 ), Neuro2A(マウス神経芽細胞腫)の3種類(形態))でも全く同一の結果を得た。
【0051】
煮豆成分では全く変化がなかったことから、大豆に含まれるイソフラボンは関与しないことが判明した。また、納豆菌のみを添加しても全く変化がなかった(図1D)。この結果から、納豆抽出成分には、癌細胞殺傷能力があることが判明した。
【0052】
上記と同様なMTT法により正常細胞に対する効果を調べた。各硫安分画を細胞に添加した。Neuro2A(マウス神経芽細胞腫)に対する結果と比較して図6に示す。図6から明らかなように、硫安30-50分画は、マウス神経芽細胞腫Neuro2Aの増殖を強く抑制したが、正常細胞であるNIH3T3(マウス胎児皮膚細胞)の増殖抑制はNeuro2A細胞に対する増殖抑制よりもずっと少なく、コントロールに対して統計学的有意差も認められない程度であった。正常細胞として、さらにHEK293(ヒト胎児腎臓細胞)及びLLC-PK1(ブタ腎臓近位尿細管細胞)の2種類(形態)を用いて確認したが、図6と同様な結果となり、正常細胞の増殖も若干抑えたが、その程度は、がん細胞の増殖抑制の程度に比べて明らかに少なかった。
【0053】
次に、抗がん成分を同定するために、上記の通り電気泳動と高速液体クロマトグラフィーを行った。電気泳動の結果を図2、高速液体クロマトグラフィーの結果を図3に示す。図2に示される電気泳動バンドのうち、矢印で示される分子量約5000の画分に抗がん活性が認められた。上記の通り、このバンドを切り出し、高速液体クロマトグラフィーにかけた結果、図3に示すように18個のピークが観察された。各ピークを含む18個のフラクションを上記の通りHeLa細胞に添加し、細胞の生存率を解析した。結果を図4に示す。図4中、Controlは、無添加のHeLa細胞を示す。図4に示されるようにフラクションNo.(6)〜(10)でがん細胞が死滅した。
【0054】
これらのフラクションに含まれる成分を解析したところ、下記の3種類のペプチドが同定された。なお、フラクションNo.(6)〜(10)の各フラクションがそれぞれ下記の3種類のペプチドを含んでいた。
ペプチド#1: AQSVPYGISQ IKAPALHS (配列番号1)
ペプチド#2: AVKVLDSTG SGQY (配列番号2)
ペプチド#3: SMATPHVAGA AALI (配列番号3)
【0055】
実施例2 分子シャペロン誘導効果
実施例1で同定されたペプチド#1、ペプチド#2及びペプチド#3を含む上記硫安30-50分画を実施例1と同様にしてHeLa細胞に添加、培養し、代表的な分子シャペロンであるHSP(heat shock protein)90、HSP72、HSP60のイムノブロット法で検出した。これは具体的に次のようにして行った。
【0056】
上記硫安30-50分画を添加、培養したHeLa細胞をホモジナイズし、4℃、15,000rpm、10分遠心分離を行い、上清を回収し、等量のSDS-Sample bufferを加え、100℃、3分加温し電気泳動(SDS-PAGE)を行った。ブロット槽を用いて、電気泳動バンドを100V10分間、PVDF膜に転写した。転写後のPVDF膜を(1)7%スキムミルク溶液で15分間ブロッキングし、(2)第一抗体である1000倍希釈抗分子シャペロン抗体(抗HSP90抗体、抗HSP72抗体又は抗HSP60抗体)と37℃2時間反応させ、(3)第一抗体洗浄後、第二抗体である1000倍希釈アルカリフォスファターゼ標識抗ウサギIgG抗体と37℃1時間反応させ、(4)アルカリフォスファターゼ発色液にて発色させた。なお、各分子シャペロン抗体は、常法により分子シャペロンをウサギに免疫して作製したポリクローナル抗体である。
【0057】
イムノブロットの結果を図5に示す。図5に示されるように、本発明のペプチドは分子シャペロン誘導活性を示した。
【特許請求の範囲】
【請求項1】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド。
【請求項2】
下記(1)〜(3)の少なくともいずれかを有効成分として含有する分子シャペロン誘導剤。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含み分子シャペロン誘導作用を有するペプチド。
【請求項3】
上記(1)を有効成分として含有する請求項2記載の分子シャペロン誘導剤。
【請求項4】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て含む請求項3記載の分子シャペロン誘導剤。
【請求項5】
下記(1)〜(3)の少なくともいずれかを有効成分として含有する抗がん剤。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって抗がん作用を有するペプチド。
【請求項6】
上記(1)を有効成分として含有する請求項5記載の抗がん剤。
【請求項7】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て含む請求項6記載の分子シャペロン誘導剤。
【請求項8】
食品に、下記(1)〜(3)の少なくともいずれかのペプチドを添加又は増強した、ペプチド強化食品。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用又は抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって分子シャペロン誘導作用又は抗がん作用を有するペプチド。
【請求項9】
上記(1)を添加又は増強した請求項8記載のペプチド強化食品。
【請求項10】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て添加又は増強した請求項9記載のペプチド強化食品。
【請求項11】
食品中に含まれる下記(1)〜(3)の少なくともいずれかのペプチドの含有量を測定することを特徴とする、食品の分子シャペロン誘導活性及び/又は抗ガン活性の評価方法。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用又は抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって分子シャペロン誘導作用又は抗がん作用を有するペプチド。
【請求項12】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドに特異的に結合する活性を有する抗体。
【請求項1】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド。
【請求項2】
下記(1)〜(3)の少なくともいずれかを有効成分として含有する分子シャペロン誘導剤。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含み分子シャペロン誘導作用を有するペプチド。
【請求項3】
上記(1)を有効成分として含有する請求項2記載の分子シャペロン誘導剤。
【請求項4】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て含む請求項3記載の分子シャペロン誘導剤。
【請求項5】
下記(1)〜(3)の少なくともいずれかを有効成分として含有する抗がん剤。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって抗がん作用を有するペプチド。
【請求項6】
上記(1)を有効成分として含有する請求項5記載の抗がん剤。
【請求項7】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て含む請求項6記載の分子シャペロン誘導剤。
【請求項8】
食品に、下記(1)〜(3)の少なくともいずれかのペプチドを添加又は増強した、ペプチド強化食品。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用又は抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって分子シャペロン誘導作用又は抗がん作用を有するペプチド。
【請求項9】
上記(1)を添加又は増強した請求項8記載のペプチド強化食品。
【請求項10】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドを全て添加又は増強した請求項9記載のペプチド強化食品。
【請求項11】
食品中に含まれる下記(1)〜(3)の少なくともいずれかのペプチドの含有量を測定することを特徴とする、食品の分子シャペロン誘導活性及び/又は抗ガン活性の評価方法。
(1) アミノ酸配列が配列番号1〜3のいずれかで表されるペプチド、
(2) アミノ酸配列が、配列番号1〜3のいずれかにおいて1個又は2個のアミノ酸が置換し、欠失し又は挿入されたアミノ酸配列で表されるペプチドであって、分子シャペロン誘導作用又は抗がん作用を有するペプチド、
(3) 上記(1)又は(2)のペプチドを含む物質であって分子シャペロン誘導作用又は抗がん作用を有するペプチド。
【請求項12】
アミノ酸配列が配列番号1〜3のいずれかで表されるペプチドに特異的に結合する活性を有する抗体。
【図6】


【図1】


【図2】


【図3】


【図4】


【図5】




【図1】


【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−41316(P2012−41316A)
【公開日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願番号】特願2010−185723(P2010−185723)
【出願日】平成22年8月23日(2010.8.23)
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
【公開日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願日】平成22年8月23日(2010.8.23)
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
[ Back to top ]

