新規ポリペプチドホルモンフォスファトニン
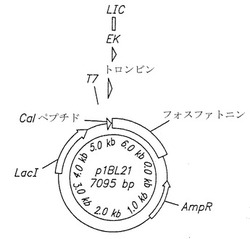
【課題】フォスファトニンと呼ばれる新規ヒトタンパク質、及びこのタンパク質をコードする単離ポリヌクレオチド、このヒトタンパク質を産生するためのベクター、宿主細胞、抗体、及び組み換え方法であり、さらに、この新規ヒトタンパク質に関連する障害を診断及び治療するために有用な診断及び治療方法の提供。
【解決手段】ヒトの腫瘍細胞からフォスファトニンを単離し、このフォスファトニンのアミノ酸配列、このフォスファトニンをコードする塩基配列の使用。
【解決手段】ヒトの腫瘍細胞からフォスファトニンを単離し、このフォスファトニンのアミノ酸配列、このフォスファトニンをコードする塩基配列の使用。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
フォスファトニン活性を示すことを特徴とする実質的に純粋な型の化合物。
【請求項2】
以下からなる群より選択される特徴を有するポリペプチドであることをさらに特徴とする、請求項1記載の化合物:
SDS-PAGEで測定すると、約60〜75 kDaの範囲の分子量を有する特徴;
pH7でビス-トリスSDS-PAGEで測定すると、約120 kDaの分子量を有する特徴;
Saos-2細胞(寄託番号ECACC 89050205号)の細胞培養物から精製したフォスファトニンのグリコシル化パターンを有する特徴;
フォスファトニンをコードするヌクレオチド配列を遺伝し導入した細胞株から生成されたフォスファトニンのグルコシル化パターンを有する特徴;
フォスファトニンを発現するように活性化されたその内因性DNAを有する細胞株から生成されたフォスファトニンのグルコシル化パターンを有する特徴;及び
グリコシル化を有しない特徴。
【請求項3】
リン酸代謝、ビタミンD代謝、骨格形成(skeletal formation)及び骨格ミネラル化(skeletal mineralization)からなる群より選択される機能を調節することをさらに特徴とする、請求項2記載の化合物。
【請求項4】
以下からなる群より選択されるポリヌクレオチドによって発現されるアミノ酸配列のグリコシル化パターンを有する、請求項1記載のポリペプチド:
(a) 配列番号:2(図8)又は配列番号:27に示すアミノ酸配列を含むポリペプチドの少なくとも成熟型をコードするポリヌクレオチド;
(b) 成熟型ポリペプチドを少なくともコードする配列番号:1(図8)又は配列番号:26に記載のコード配列を含むポリヌクレオチド;
(c) 配列番号:27の1〜96位、17〜96位、又は47〜96位のアミノ酸残基をコードするヌクレオチド配列を少なくとも含むポリヌクレオチド;
(d) (a)、(b)又は(c)のポリヌクレオチドにコードされるアミノ酸配列の一つ又はいくつかのアミノ酸の置換、欠失、及び/又は付加によって、(a)、(b)、又は(c)のポリヌクレオチドにコードされるポリペプチドから由来したポリペプチドをコードするポリヌクレオチド;
(e) (a)〜(d)のいずれかのポリヌクレオチドとハイブリダイズする相補鎖を含むポリヌクレオチド;
(f) (a)〜(e)のいずれか一つのポリヌクレオチドにコードされるポリペプチドのアミノ酸配列と60%又はそれ以上の同一性を有するポリペプチドをコードするポリヌクレオチド;
(g) (a)〜(f)のいずれか一つのポリヌクレオチドにコードされるポリペプチドの断片又は抗原決定基含有部分を含み、リン酸代謝を調節することができるポリペプチドをコードするポリヌクレオチド;
(h) 配列番号:2(図8)の約1〜40位、141〜180位、及び/もしくは401〜429位のアミノ酸残基、並びに/又は配列番号:27の約42〜51位及び/もしくは47〜96位のアミノ酸残基を含むフォスファトニンポリペプチドの抗原決定基含有部分をコードするポリヌクレオチド;
(i) (a)〜(h)のいずれか一つのポリヌクレオチドの少なくとも15ヌクレオチドを含み、リン酸代謝、ビタミンD代謝、骨格形成、及び骨格ミネラル化からなる群より選択される機能を調節することができるポリペプチドをコードするポリヌクレオチド;
(j) (a)〜(i)のいずれか一つのポリヌクレオチドにコードされるポリペプチドの細胞及び/又はグリコサミノグリカン接着モチーフ、及び/又は骨ミネラルモチーフを含み、リン酸代謝、ビタミンD代謝、骨格形成、及び骨格ミネラル化からなる群より選択される機能を調節することができるポリペプチドをコードするポリヌクレオチド;
(k) コードされたポリペプチドがホモダイマー及び/又はヘテロダイマーを形成することができる、(a)〜(j)のいずれか一つのポリヌクレオチド;並びに
(l) (a)〜(k)のいずれかのポリヌクレオチドのヌクレオチド配列に対する遺伝子コードの結果、ヌクレオチド配列が縮重しているポリヌクレオチド。
【請求項5】
請求項2記載のポリペプチドをコードする単離されたポリヌクレオチド。
【請求項6】
請求項5記載のポリヌクレオチドを含むベクター。
【請求項7】
請求項6記載のベクターによって遺伝子操作された宿主細胞。
【請求項8】
以下の段階を含む、フォスファトニンポリペプチドを単離する過程:
(a) 血清添加培地(DMEMイーグル/10%FCS/グルタミン/抗真菌剤(DMFCS))中で腫瘍馴化培地又は骨肉腫細胞をコンフルエンスになるまで培養する段階;
(b) 細胞を1日おきに無血清培地DMEMイーグル/グルタミン/抗真菌剤抗生物質(DM)中で最長5時間培養する段階;
(c) 細胞から無血清馴化培地を回収して、馴化培地をpH 7.2の0.06M リン酸ナトリウム及び0.5M NaCl(PBS)に平衡化する段階;
(d) (c)で得られた培地を、平衡化したコンカナバリンAセファロースに供する段階;
(e) カラムをPBSで十分に洗浄する段階;
(f) 0.5M α-メチル-D-グルコピラノシドを添加したPBSでコンカナバリンAカラムを溶出する段階;
(g) (f)で得られた溶出物質を陽イオン交換クロマトグラフィーに供する段階;及び
(h) 0.5 M NaClでフォスファトニンポリペプチド含有分画を溶出する段階。
【請求項9】
以下からなる群より選択される特徴をさらに特徴とする請求項2記載のポリペプチド:
(a) ナトリウム依存性リン酸共輸送をダウンレギュレートする特徴;
(b) 腎25-ヒドロキシビタミンD3-24-ヒドロキシラーゼをアップレギュレートする特徴;
(c) 腎25-ヒドロキシ-D-1α-ヒドロキシラーゼをダウンレギュレートする特徴;
(d) ナトリウム依存性リン酸共輸送をアップレギュレートする特徴;
(e) 腎25-ヒドロキシビタミンD3-24-ヒドロキシラーゼをダウンレギュレートする特徴;
(f) 腎25-ヒドロキシ-D-1-(-ヒドロキシラーゼ)をアップレギュレートする特徴;並びに
(g) 骨格形成及びミネラル化の特徴
【請求項10】
請求項2記載の単離ポリペプチドに対して特異的に結合する単離抗体。
【請求項11】
請求項5記載のポリヌクレオチドを含む核酸分子の発現を調節するプロモーターの単離された調節配列。
【請求項12】
哺乳類被験者に、請求項1記載の化合物、そのような化合物に特異的に結合する抗体、及び化合物をコードするヌクレオチド配列からなる群より選択される化合物の治療的有効量を投与する段階を含む、リン酸代謝障害、ビタミンD代謝障害、骨格形成障害及び骨格ミネラル化障害からなる群より選択される障害に関連した病態を治療する方法。
【請求項13】
以下を含む、リン酸代謝障害、ビタミンD代謝障害、骨格形成障害及び骨格ミネラル化障害からなる群より選択される障害に関連する被験者における病態又は病態に対する感受性を診断する方法:
(a) 請求項5記載のポリヌクレオチドにおける変異の有無を決定する段階;及び
(b) 該変異の有無に基づいて病態又は病態に対する感受性を診断する段階。
【請求項14】
リン酸代謝障害を治療する薬物の調製を目的とした、請求項2記載のポリペプチド又はそれに特異的に結合する抗体の使用。
【請求項15】
高リン酸血症を治療する薬物の調製を目的とした、請求項2記載のポリペプチド又はそれに特異的に結合する抗体の使用。
【請求項16】
腎性骨形成異常、腎透析/透析前における高リン酸血症、二次性副甲状腺機能亢進症、嚢胞性線維性骨炎、又は痛風を治療する薬物の調製を目的とした、請求項2記載のポリペプチド又はそれに特異的に結合する抗体の使用。
【請求項17】
疾患を治療する薬物の調製を目的とした、請求項5記載のヌクレオチド配列の使用。
【請求項18】
X染色体性(X-linked)低リン酸血症性くる病、高カルシウム尿症を伴う遺伝性低リン酸血症性くる病(HHRH)、低ミネラル化骨病変、幼少期成長停止、腫瘍形成性低リン酸血症性骨軟化症、腎性リン酸漏出、腎性骨形成異常、骨粗鬆症、ビタミンD抵抗性くる病、末端組織抵抗、腎ファンコーニ症候群、常染色体性くる病、パジェット病、腎不全、腎尿細管アシドーシス、嚢胞性線維症、又はスプルーを治療する薬物の調製を目的とした、請求項2記載のポリペプチド又はDNAの使用。
【請求項19】
リン酸代謝障害又は骨ミネラル減少障害を治療するため、同時に、個々に、又は連続して用いられる複合調製物の製造を目的とした、請求項5記載のポリペプチド及び亜鉛メタロエンドペプチダーゼの使用。
【請求項20】
フォスファトニン又はその断片を検出することによって、リン酸代謝障害、ビタミンD代謝障害、骨格形成障害、及び骨格ミネラル化障害からなる群より選択される障害に関連した被験者における病態、又はそのような病態に対する感受性を診断するための、請求項10記載の抗体の使用。
【請求項21】
薬学的に許容される担体と、ヒトフォスファトニン又は治療的に有効なその断片の治療的に許容される量とを含む、薬学的組成物。
【請求項1】
フォスファトニン活性を示すことを特徴とする実質的に純粋な型の化合物。
【請求項2】
以下からなる群より選択される特徴を有するポリペプチドであることをさらに特徴とする、請求項1記載の化合物:
SDS-PAGEで測定すると、約60〜75 kDaの範囲の分子量を有する特徴;
pH7でビス-トリスSDS-PAGEで測定すると、約120 kDaの分子量を有する特徴;
Saos-2細胞(寄託番号ECACC 89050205号)の細胞培養物から精製したフォスファトニンのグリコシル化パターンを有する特徴;
フォスファトニンをコードするヌクレオチド配列を遺伝し導入した細胞株から生成されたフォスファトニンのグルコシル化パターンを有する特徴;
フォスファトニンを発現するように活性化されたその内因性DNAを有する細胞株から生成されたフォスファトニンのグルコシル化パターンを有する特徴;及び
グリコシル化を有しない特徴。
【請求項3】
リン酸代謝、ビタミンD代謝、骨格形成(skeletal formation)及び骨格ミネラル化(skeletal mineralization)からなる群より選択される機能を調節することをさらに特徴とする、請求項2記載の化合物。
【請求項4】
以下からなる群より選択されるポリヌクレオチドによって発現されるアミノ酸配列のグリコシル化パターンを有する、請求項1記載のポリペプチド:
(a) 配列番号:2(図8)又は配列番号:27に示すアミノ酸配列を含むポリペプチドの少なくとも成熟型をコードするポリヌクレオチド;
(b) 成熟型ポリペプチドを少なくともコードする配列番号:1(図8)又は配列番号:26に記載のコード配列を含むポリヌクレオチド;
(c) 配列番号:27の1〜96位、17〜96位、又は47〜96位のアミノ酸残基をコードするヌクレオチド配列を少なくとも含むポリヌクレオチド;
(d) (a)、(b)又は(c)のポリヌクレオチドにコードされるアミノ酸配列の一つ又はいくつかのアミノ酸の置換、欠失、及び/又は付加によって、(a)、(b)、又は(c)のポリヌクレオチドにコードされるポリペプチドから由来したポリペプチドをコードするポリヌクレオチド;
(e) (a)〜(d)のいずれかのポリヌクレオチドとハイブリダイズする相補鎖を含むポリヌクレオチド;
(f) (a)〜(e)のいずれか一つのポリヌクレオチドにコードされるポリペプチドのアミノ酸配列と60%又はそれ以上の同一性を有するポリペプチドをコードするポリヌクレオチド;
(g) (a)〜(f)のいずれか一つのポリヌクレオチドにコードされるポリペプチドの断片又は抗原決定基含有部分を含み、リン酸代謝を調節することができるポリペプチドをコードするポリヌクレオチド;
(h) 配列番号:2(図8)の約1〜40位、141〜180位、及び/もしくは401〜429位のアミノ酸残基、並びに/又は配列番号:27の約42〜51位及び/もしくは47〜96位のアミノ酸残基を含むフォスファトニンポリペプチドの抗原決定基含有部分をコードするポリヌクレオチド;
(i) (a)〜(h)のいずれか一つのポリヌクレオチドの少なくとも15ヌクレオチドを含み、リン酸代謝、ビタミンD代謝、骨格形成、及び骨格ミネラル化からなる群より選択される機能を調節することができるポリペプチドをコードするポリヌクレオチド;
(j) (a)〜(i)のいずれか一つのポリヌクレオチドにコードされるポリペプチドの細胞及び/又はグリコサミノグリカン接着モチーフ、及び/又は骨ミネラルモチーフを含み、リン酸代謝、ビタミンD代謝、骨格形成、及び骨格ミネラル化からなる群より選択される機能を調節することができるポリペプチドをコードするポリヌクレオチド;
(k) コードされたポリペプチドがホモダイマー及び/又はヘテロダイマーを形成することができる、(a)〜(j)のいずれか一つのポリヌクレオチド;並びに
(l) (a)〜(k)のいずれかのポリヌクレオチドのヌクレオチド配列に対する遺伝子コードの結果、ヌクレオチド配列が縮重しているポリヌクレオチド。
【請求項5】
請求項2記載のポリペプチドをコードする単離されたポリヌクレオチド。
【請求項6】
請求項5記載のポリヌクレオチドを含むベクター。
【請求項7】
請求項6記載のベクターによって遺伝子操作された宿主細胞。
【請求項8】
以下の段階を含む、フォスファトニンポリペプチドを単離する過程:
(a) 血清添加培地(DMEMイーグル/10%FCS/グルタミン/抗真菌剤(DMFCS))中で腫瘍馴化培地又は骨肉腫細胞をコンフルエンスになるまで培養する段階;
(b) 細胞を1日おきに無血清培地DMEMイーグル/グルタミン/抗真菌剤抗生物質(DM)中で最長5時間培養する段階;
(c) 細胞から無血清馴化培地を回収して、馴化培地をpH 7.2の0.06M リン酸ナトリウム及び0.5M NaCl(PBS)に平衡化する段階;
(d) (c)で得られた培地を、平衡化したコンカナバリンAセファロースに供する段階;
(e) カラムをPBSで十分に洗浄する段階;
(f) 0.5M α-メチル-D-グルコピラノシドを添加したPBSでコンカナバリンAカラムを溶出する段階;
(g) (f)で得られた溶出物質を陽イオン交換クロマトグラフィーに供する段階;及び
(h) 0.5 M NaClでフォスファトニンポリペプチド含有分画を溶出する段階。
【請求項9】
以下からなる群より選択される特徴をさらに特徴とする請求項2記載のポリペプチド:
(a) ナトリウム依存性リン酸共輸送をダウンレギュレートする特徴;
(b) 腎25-ヒドロキシビタミンD3-24-ヒドロキシラーゼをアップレギュレートする特徴;
(c) 腎25-ヒドロキシ-D-1α-ヒドロキシラーゼをダウンレギュレートする特徴;
(d) ナトリウム依存性リン酸共輸送をアップレギュレートする特徴;
(e) 腎25-ヒドロキシビタミンD3-24-ヒドロキシラーゼをダウンレギュレートする特徴;
(f) 腎25-ヒドロキシ-D-1-(-ヒドロキシラーゼ)をアップレギュレートする特徴;並びに
(g) 骨格形成及びミネラル化の特徴
【請求項10】
請求項2記載の単離ポリペプチドに対して特異的に結合する単離抗体。
【請求項11】
請求項5記載のポリヌクレオチドを含む核酸分子の発現を調節するプロモーターの単離された調節配列。
【請求項12】
哺乳類被験者に、請求項1記載の化合物、そのような化合物に特異的に結合する抗体、及び化合物をコードするヌクレオチド配列からなる群より選択される化合物の治療的有効量を投与する段階を含む、リン酸代謝障害、ビタミンD代謝障害、骨格形成障害及び骨格ミネラル化障害からなる群より選択される障害に関連した病態を治療する方法。
【請求項13】
以下を含む、リン酸代謝障害、ビタミンD代謝障害、骨格形成障害及び骨格ミネラル化障害からなる群より選択される障害に関連する被験者における病態又は病態に対する感受性を診断する方法:
(a) 請求項5記載のポリヌクレオチドにおける変異の有無を決定する段階;及び
(b) 該変異の有無に基づいて病態又は病態に対する感受性を診断する段階。
【請求項14】
リン酸代謝障害を治療する薬物の調製を目的とした、請求項2記載のポリペプチド又はそれに特異的に結合する抗体の使用。
【請求項15】
高リン酸血症を治療する薬物の調製を目的とした、請求項2記載のポリペプチド又はそれに特異的に結合する抗体の使用。
【請求項16】
腎性骨形成異常、腎透析/透析前における高リン酸血症、二次性副甲状腺機能亢進症、嚢胞性線維性骨炎、又は痛風を治療する薬物の調製を目的とした、請求項2記載のポリペプチド又はそれに特異的に結合する抗体の使用。
【請求項17】
疾患を治療する薬物の調製を目的とした、請求項5記載のヌクレオチド配列の使用。
【請求項18】
X染色体性(X-linked)低リン酸血症性くる病、高カルシウム尿症を伴う遺伝性低リン酸血症性くる病(HHRH)、低ミネラル化骨病変、幼少期成長停止、腫瘍形成性低リン酸血症性骨軟化症、腎性リン酸漏出、腎性骨形成異常、骨粗鬆症、ビタミンD抵抗性くる病、末端組織抵抗、腎ファンコーニ症候群、常染色体性くる病、パジェット病、腎不全、腎尿細管アシドーシス、嚢胞性線維症、又はスプルーを治療する薬物の調製を目的とした、請求項2記載のポリペプチド又はDNAの使用。
【請求項19】
リン酸代謝障害又は骨ミネラル減少障害を治療するため、同時に、個々に、又は連続して用いられる複合調製物の製造を目的とした、請求項5記載のポリペプチド及び亜鉛メタロエンドペプチダーゼの使用。
【請求項20】
フォスファトニン又はその断片を検出することによって、リン酸代謝障害、ビタミンD代謝障害、骨格形成障害、及び骨格ミネラル化障害からなる群より選択される障害に関連した被験者における病態、又はそのような病態に対する感受性を診断するための、請求項10記載の抗体の使用。
【請求項21】
薬学的に許容される担体と、ヒトフォスファトニン又は治療的に有効なその断片の治療的に許容される量とを含む、薬学的組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8−1】


【図8−2】


【図9】


【図10】


【図11】


【図12A】


【図12B】


【図12C】


【図12D】


【図13】


【図14】


【図15−1】


【図15−2】


【図15−3】


【図15−4】


【図16】


【図17】


【図18】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8−1】


【図8−2】


【図9】


【図10】


【図11】


【図12A】


【図12B】


【図12C】


【図12D】


【図13】


【図14】


【図15−1】


【図15−2】


【図15−3】


【図15−4】


【図16】


【図17】


【図18】


【公開番号】特開2013−59334(P2013−59334A)
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2012−245913(P2012−245913)
【出願日】平成24年11月8日(2012.11.8)
【分割の表示】特願2009−47603(P2009−47603)の分割
【原出願日】平成12年10月31日(2000.10.31)
【出願人】(500533547)ユニバーシティー カレッジ ロンドン (3)
【Fターム(参考)】
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成24年11月8日(2012.11.8)
【分割の表示】特願2009−47603(P2009−47603)の分割
【原出願日】平成12年10月31日(2000.10.31)
【出願人】(500533547)ユニバーシティー カレッジ ロンドン (3)
【Fターム(参考)】
[ Back to top ]

