新規化合物及びその化合物を含む抗変異原性剤
【課題】本発明の主な目的は、癌の原因となる変異原性物質の活性を抑制できる新規な抗変異原性剤を提供することである。
【解決手段】ヤマブシダケ(Hericium erinaceum)の抽出物を有効成分とする、変異原性物質に対する優れた抑制作用を有する新規な抗変異原性剤、並びに該抗変異原性剤からなる食品添加剤、化粧品添加剤に関する。
【解決手段】ヤマブシダケ(Hericium erinaceum)の抽出物を有効成分とする、変異原性物質に対する優れた抑制作用を有する新規な抗変異原性剤、並びに該抗変異原性剤からなる食品添加剤、化粧品添加剤に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヤマブシダケ(Hericium erinaceum)から得られる抽出物を有効成分とする抗変異原性剤、並びに該抗変異原性剤を有効成分として含有する食品添加剤及び化粧品添加剤に関する。
【背景技術】
【0002】
近年、過加熱調理したアミノ酸、タンパク質を多く含む食品から、発ガン性を有する変異原性物質が検出されている。中でも、複素環芳香族アミン(Heterocyclic aromatic amines;以下HAAという)は、細胞内に入ると、DNA分子のグアニンを共有結合により修飾し、これが遺伝子の変異の原因であると考えられている。
【0003】
発ガン性を有するHAAとしては、トリプトファンの熱分解産物から単離された3−アミノ−1,4−ジメチル−5H−ピリド[4,3−b]インドール、3−アミノ−1−メチル−5H−ピリド[4,3−b]インドール、グルタミン酸の熱分解産物から単離された、2−アミノ−6−メチルジピリド[1,2−a:3’,2’−d]イミダゾール、2−アミノジピリド[1,2−a:3’,2’−d]イミダゾール、この他にも、2−アミノ−1−メチル−6−フェニル−イミダゾ[4,5−b]ピリジン、2−アミノ−α−カルボリン、2−アミノ−3−メチル−α−カルボリン等が報告されている。
【0004】
これらHAAによる発ガン性は、臓器を問わず報告されている。HAAは調理の過程、特に焦げ付くほどの過加熱状態の時に発生し、ビーフステーキやビーフハンバーグ、焼き肉に含まれることが報告されている。
【0005】
HAAが産生されることを防ぐ方法は、肉類を焦げつかないようにすることである。しかしながら、ハンバーグやステーキ等の肉料理の焦げ目は、料理の風味を良くすることが多く、全く焦げ目のない料理は、かえって食欲をそぐ結果となる。
【0006】
焦げ目の付いた料理を食しても、HAA等の変異原性物質の存在を気にせずにすむような食品や食品添加剤の開発が望まれていた。また、HAAは、煙草の煙の中にも存在していることが報告されており、食品添加物だけでなく、化粧品等の外用剤にも抗変異原性剤が含まれることが望まれている。
【0007】
さらには、土壌や湖沼、河川、海の水からHAAが検出されることもあり、こういった汚染環境を改善する抗変異原性剤が望まれている。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】財団法人日本公衆衛生協会 食品・薬品安全性ニュース第5号
【非特許文献2】Saleem,M et al, Eur.Org. Chem.2011,808−812
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の主な目的は、癌の原因となる変異原性物質の活性を抑制できる新規な化合物及びその合成方法を提供することである。
【課題を解決するための手段】
【0010】
本発明者は、上記の目的を達成すべく鋭意研究を重ねた結果、ヤマブシダケ(Hericium erinaceum)の抽出物が、変異原性物質によるDNAへの変異導入を強力に抑制する作用を有することを見いだし、ここに本発明を完成するに至った。
【0011】
即ち、本発明は、下記の抗変異原性剤、該抗変異原性剤を有効成分として含有する食品添加剤、食品添加剤を添加した食品、化粧品添加剤、化粧品添加剤を添加した化粧品及びヤマブシダケ抽出物を有効成分とする抗変異原性剤を提供することである。
【0012】
項1.一般式(I)で表される化合物:
【0013】
【化1】

【0014】
(式中、nは0または1、Rは、アルカノイル基又はアルケノイル基を示す)。
【0015】
項2.一般式(Ia)で表される項1に記載の化合物:
【0016】
【化2】

【0017】
(式中、Rは、前記に同じ)。
【0018】
項3.一般式(Ib)で表される項1に記載の化合物:
【0019】
【化3】

【0020】
(式中、Rは、前記に同じ)。
【0021】
項4.項1〜3のいずれか1項に記載の化合物を有効成分として含有する抗変異原性剤。
【0022】
項5.ヤマブシダケ(Hericium erinaceum)の抽出物を有効成分とする抗変異原性剤。
【0023】
項6.抽出溶媒がメタノール、エタノール、塩化メチレン及び酢酸エチルからなる群より選ばれる少なくとも1種である項5に記載の抗変異原性剤。
【0024】
項7.項4〜項6のいずれか1項に記載の抗変異原性剤を有効成分として含有する食品添加剤。
【0025】
項8.項7に記載の食品添加剤を添加した食品。
【0026】
項9.項4〜項6のいずれか1項に記載の抗変異原性剤を有効成分として含有する化粧品添加剤。
【0027】
項10.項9に記載の化粧品添加剤を添加した化粧品。
【発明の効果】
【0028】
本発明の抗変異原性剤は、食用キノコの一種であるヤマブシタケの抽出物を有効成分とするものであり、優れた変異原抑制作用を有する。また、今回抽出物中の有効成分を精製・同定することに成功し、新規化合物である一般式(I)で表される化合物が、抗変異原性活性を有することをつきとめた。中でも、一般式(I)で表され、nが1でありRが炭素数18のアルケノイル基を有する化合物が特に有効であることも示された。
【0029】
本発明の抗変異原性剤は、食品添加剤、化粧品添加剤等として利用される。
【図面の簡単な説明】
【0030】
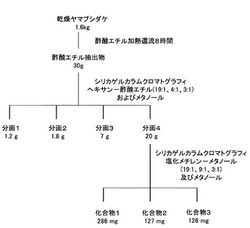
【図1】ヤマブシダケの抽出物分離工程を示す図である。
【図2】化合物1:エリスリトール−1−アセテートの構造式及びスペクトルデータを示す。
【図3】化合物2:D−アラビトール−1−アセテートの構造式及びスペクトルデータを示す。
【図4】化合物3:D−アラビトール−1−リノレートの構造式及びスペクトルデータを示す。
【図5】3−アミノ−1,4−ジメチル−5H−ピリド[4,3−b]インドールによって惹起されるDNA変異に対する、化合物1〜3の変異原抑制作用を示す。
【発明を実施するための形態】
【0031】
1.ヤマブシタケからの抽出物
本発明の抗変異原性剤は、ヤマブシタケ(Hericium erinaceum)の抽出物を有効成分とするものである。ここにおいてヤマブシタケとは、サンゴハリタケ科サンゴハリタケ属に属する食用キノコである。日本、中国、北アフリカ、北アメリカ等多くの国に自生し、食用に供されている。
【0032】
ヤマブシタケは、生のままでも抽出物に供することができるが、粉砕した後乾燥させたり、乾燥させたものを粉末状にして抽出することもできる。
【0033】
抽出溶媒としては、例えば、メタノール、エタノール、プロパノール、ブタノール等のアルコール類、1,3−ブチレングリコール、グリセリン、プロピレングリコール等のグリコール類、酢酸エチル、酢酸ブチル等のエステル類、エチルエーテル、プロピルエーテル、イソプロピルエーテル,テトラヒドロフラン、ジオキサン等のエーテル類、塩化メチレン、クロロホルム等のハロゲン化炭化水素等の極性有機溶媒、ヘキサン、シクロヘキサン、石油エーテル等の無極性有機溶媒等や水等を用いることができる。これらの抽出溶媒は、一種単独又は二種以上混合して用いることができる。
【0034】
好ましくは、アルコール、エステル系有機溶媒及びハロゲン系有機溶媒からなる群から選ばれた少なくとも1つの抽出溶媒により抗変異原活性を有する抽出物を得ることができる。さらに好ましい抽出溶媒はメタノール、エタノール、塩化メチレン、酢酸エチル単独又は、メタノール、エタノール、塩化メチレン、酢酸エチルのいずれか2以上の混合溶媒であり、より優れた抗変異原活性を有する抽出物を得ることができる。優れた抗変異原活性を有する抽出物を得るために、最も好ましいのは酢酸エチルである。
【0035】
抽出方法については、特に限定されるものではなく、ヤマブシタケに溶媒を加えた後、抽出物の抗変異原活性を失活させない程度に加温加熱する加熱抽出法や、加熱還流法、超臨界抽出法等を適宜適用できる。また、一定量の溶媒にヤマブシタケを浸漬してバッチ処理する浸漬抽出法や連続的に溶媒を送り続ける連続抽出法等、公知の種々の抽出法を適用できる。特に抗変異原性活性を有する抽出物を効率良く得ることができるのは、加熱還流法である。
【0036】
具体的な抽出方法の一例を挙げると、例えば、ヤマブシタケの乾燥重量に対して、1〜5重量倍程度、好ましくは、1.5〜3重量倍程度の抽出溶媒を加えて浸漬して加熱し、8〜12時間程度溶媒を還流させることにより、抗変異原活性を有する成分を抽出することができる。或いは、ヤマブシタケの乾燥重量に対して1〜5重量倍程度、好ましくは、1.5〜3重量倍程度の抽出溶媒を加えて浸漬し、室温で10〜14日間程度放置するか、或いは70〜75℃程度に加熱して還流しながら8〜12時間程度加熱することにより有効成分を抽出することも可能である。勿論、溶媒量や加熱温度、加熱時間等については、優れた抗変異原活性を有する成分を抽出できるように適宜調整すればよい。上記した方法によってヤマブシタケと抽出溶媒の混合液は、通常、濾過、遠心分離等の常法によって残渣と上清を分離することによって、抽出物を得ることができる。
【0037】
抽出分画を得るためには、抽出物をメタノール、エタノール、プロパノール、ブタノール、クロロホルム、酢酸エチル、トルエン等の有機溶媒を1種又は2種以上用いた溶媒分画操作を行うことができ、これらの抽出画分から、活性画分を分取したものを抗変異原性剤として用いることも可能である。
【0038】
更に、必要に応じて、アルミナカラムクロマトグラフィーやシリカゲルクロマトグラフィー、ゲルろ過クロマトグラフィー、イオン交換クロマトグラフィー、疎水クロマトグラフィー、高速液体クロマトグラフィー等の適当な分離精製手段を1種若しくは2種以上組み合わせて、変異原の活性抑制作用のある画分又は化合物を取り出して、抗変異原性剤とすることができる。これにより、少量の摂取で優れた活性を発揮させることができる。
【0039】
2.一般式(I)で表される化合物
図1を参照して、ヤマブシタケからの活性化合物の精製・同定の手順を具体的に示す。
【0040】
ヤマブシダケを、エステル系有機溶媒(例えば酢酸エチル)を用いて加熱還流を行い、エステル系有機溶媒抽出物を得る。この抽出物をシリカゲルカラムクロマトグラフィーにより分画し、得られた分画の一部をさらにシリカゲルカラムクロマトグラフィーにより分画する。この方法により抗変異原性物質として図2〜7で示される化合物1〜3が得られる。
【0041】
(2−1)一般式(I)で表される化合物
本発明者らが、さらに検討を重ねた結果、化合物1〜3を含む一般式(I)で表される化合物は、化合物1〜3と同様に抗変異原性活性有することを見出した。
【0042】
本発明は、化合物1〜3を含む一般式(I)で表される化合物、及び当該化合物を有効成分とする抗変異原性剤を提供する。
【0043】
一般式(I)で表される化合物は糖アルコールの誘導体である。抗変異原性活性を有する化合物は、nは、0または1である一般式(I)で表される化合物である。糖アルコール部分の立体配位はフィッシャーの投影式で、n=0の時はメソ体、n=1の時はD体(絶対配位)である。
【0044】
【化4】

【0045】
(式中、nは0又は1、Rは、アルカノイル基又はアルケノイル基を示す)。
【0046】
アルカノイル基は、例えば炭素数がC2〜30のアルカノイル基であり、好ましくは、C2〜20のアルカノイル基である(なお、炭素数は、カルボニル基の炭素を含む数である)。具体的には、例えばアセチル基、プロピオニル基、ブチリル基、ペンタノイル基、ヘキサノイル基、ヘプタノイル基、オクタノイル基、ノナノイル基、デカノイル基、ドデカノイル基、テトラデカノイル基、ペンタデカノイル基、ヘキサデカノイル基、ヘプタデカノイル基、オクタデカノイル基、ノナデカノイル基、イコサノイル基等があげられる。より好ましくは、アセチル基、プロピオニル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基、イコサノイル基等であり、さらに好ましくは、アセチル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基等であり、最も変異原抑制作用が高いのは、アセチル基、オクタデカノイル基等である。
【0047】
アルカノイル基は、直鎖型であっても分岐型であってもよいが、より好ましくは直鎖型である。
【0048】
アルケノイル基は、例えばC3〜30のアルケノイル基であり、好ましくは、C3〜25、さらに好ましくは、C3〜18のアルケノイル基である(なお、炭素数は、カルボニル基の炭素を含む数である)。
【0049】
アルケノイル基は、直鎖型であっても分岐型であってもよいが、好ましくは直鎖型である。
【0050】
アルケノイル基に含まれる二重結合の数に制限はないが、例えば1〜6個、好ましくは1〜3個、より好ましくは1または2個である。
【0051】
アルケノイル基の二重結合は、シス型、トランス型あるいはシス型とトランス型の共存いずれの幾何異性体であってもよいが、好ましくはシス型である。
【0052】
アルケノイル基の二重結合の位置に制限はない。
【0053】
アルケノイル基としては、二重結合を1〜6個有するものの具体例を以下に挙げる。
【0054】
二重結合を1個有する炭素数がC3〜C25であるアルケノイル基としては、例えば、クロトン酸、ミリストレイン酸、パルミトレイン酸 、オレイン酸、エライジン酸、バクセン酸、ガドレイン酸、エイコセン酸、エルカ酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。好ましくは、パルミトレイン酸 、オレイン酸、エライジン酸、ネルボン酸、より好ましくは、パルミトレイン酸 、オレイン酸からカルボキシル基の水酸基を除いた残基である。
【0055】
二重結合を2個有する炭素数がC5〜C25であるアルケノイル基としては、例えば、リノール酸、エイコサジエン酸、ドコサジエン酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。好ましいのは、リノール酸からカルボキシル基の水酸基を除いた残基である。
【0056】
二重結合を3個有する炭素数がC7〜C25であるアルケノイル基としては、例えば、リノレン酸、ピノレン酸、エレオステアリン酸、ミード酸、ジホモ-γ-リノレン酸、エイコサトリエン酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。好ましくは、リノレン酸、ピノレン酸、エレオステアリン酸、ジホモ-γ-リノレン酸からカルボキシル基の水酸基を除いた残基である。
【0057】
二重結合を4個有する炭素数がC9〜C25であるアルケノイル基としては、例えば、ステアリドン酸、アラキドン酸、エイコサテトラエン酸、アドレン酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。好ましくは、ステアリドン酸、アラキドン酸からカルボキシル基の水酸基を除いた残基である。
【0058】
二重結合を5個有する炭素数がC11〜C25であるアルケノイル基としては、例えば、ボセオペンタエン酸、エイコサペンタエン酸、オズボンド酸、イワシ酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。
【0059】
二重結合を6個有する炭素数がC13〜C25であるアルケノイル基としては、例えば、ドコサヘキサエン酸、ニシン酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。
【0060】
抗変異原抑制活性が強いのは、二重結合を2個有する炭素数がC5〜C25であるアルケノイル基であり、好ましくは、リノール酸、エイコサジエン酸、ドコサジエン酸等の酸からカルボキシル基の水酸基を除いた残基であり、最も抗変異原抑制活性が強いのは、リノール酸の酸からカルボキシル基の水酸基を除いた残基である。
【0061】
(2−2)一般式(Ia)で表される化合物
一般式(I)で表される化合物であって、nが0である化合物は、一般式(Ia)で表される。
【0062】
糖アルコール部分の立体配位はフィッシャーの投影式でメソ体である。
【0063】
【化5】

【0064】
(式中、Rは、前記に同じ)。
【0065】
Rがアルカノイル基の場合、好ましい態様はC2〜20のアルカノイル基であり、より好ましくは、C2〜18のアルカノイル基である(なお、炭素数は、カルボニル基の炭素を含む数である)。
【0066】
好ましくは、直鎖型である。
【0067】
アルカノイル基として好ましくは、例えば、アセチル基、プロピオニル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基、イコサノイル基等であり、より好ましくは、アセチル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基等であり、さらに好ましくは、アセチル基、オクタデカノイル基等である。
【0068】
Rがアルケノイル基である場合、好ましい態様は、C3〜21のアルケノイル基、より好ましくは、C3〜18のアルケノイル基である(炭素数は、カルボニル基の炭素を含む数である)。
【0069】
アルケノイル基は、直鎖型であっても分岐型であってもよいが、好ましくは、直鎖型である。
【0070】
アルケノイル基の二重結合は、シス型、トランス型あるいはシス型とトランス型の共存いずれの幾何異性体であってもよいが、好ましくはシス型である。アルケノイル基の二重結合の位置に制限はない。
【0071】
アルケノイル基としては、二重結合を2個有する炭素数がC5〜C25であるアルケノイル基が好ましく、例えば、リノール酸、エイコサジエン酸、ドコサジエン酸等の酸からカルボキシル基の水酸基を除いた残基等が挙げられる。抗変異原抑制活性が強いアルケノイル基は、リノール酸からカルボキシル基の水酸基を除いた残基である。
【0072】
(2−3)一般式(Ib)で表される化合物
一般式(I)で表される化合物であって、nが1の化合物は、一般式(Ib)で表される。
【0073】
糖アルコール部分の立体配位はフィッシャーの投影式でD体(絶対配置)である。
【0074】
【化6】

【0075】
(式中、Rは、前記と同じ)。
【0076】
Rがアルカノイル基の場合、好ましい態様はC2〜20のアルカノイル基であり、より好ましくは、C2〜18のアルカノイル基である(なお、炭素数は、カルボニル基の炭素を含む数である)。
【0077】
アルカノイル基は、直鎖型であっても分岐型であってもよいが、好ましくは、直鎖型である。
【0078】
アルカノイル基として好ましくは、例えば、アセチル基、プロピオニル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基、イコサノイル基等であり、より好ましくは、アセチル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基等であり、さらに好ましくは、アセチル基、オクタデカノイル基等である。最も活性が強いのは、アセチル基である。
【0079】
Rがアルケノイル基の場合、好ましい態様は、例えば、C3〜21のアルケノイル基、より好ましくは、C3〜18のアルケノイル基である(炭素数は、カルボニル基の炭素を含む数である)。
【0080】
アルケノイル基は、直鎖型であっても分岐型であってもよいが、好ましくは、直鎖型である。
【0081】
アルケノイル基の二重結合の数は、1以上、好ましくは、1〜6個である。
【0082】
アルケノイル基の二重結合は、シス型、トランス型あるいはシス型とトランス型の共存いずれの幾何異性体であってもよいが、好ましくはシス型である。
【0083】
アルケノイル基の二重結合の位置に制限はない。
【0084】
アルケノイル基としては、二重結合を2個有する炭素数がC5〜C25であるアルケノイル基が好ましく、例えば、リノール酸、エイコサジエン酸、ドコサジエン酸等の酸からカルボキシル基の水酸基を除いた残基等が挙げられる。
【0085】
抗変異原抑制活性が強いアルケノイル基は、リノール酸からカルボキシル基の水酸基を除いた残基である。
【0086】
3.一般式(I)で表される化合物の合成方法
なお、式(I)で表される化合物は、スキームI〜IIに示す工程により製造することができるが、製造方法は、これらの工程に限られるものではない。
【0087】
(3−1)一般式(Ia)で表される化合物の製造方法
【0088】
【化7】

【0089】
(Rは、前記と同じ、Xはハロゲンを示す)。
【0090】
工程:化合物(a)から化合物(Ia)を製造する工程
メソ−エリスリトール(化合物(a))を、スキームIに従って、塩基性水溶液中で、酸無水物(R2O:Rは前記と同じ)又はR−X(Rは前記と同じ、Xはハロゲンを示す)で示される化合物と反応させ、一般式(Ia)で表される化合物(以下、化合物(Ia)と表記する)を製造することができる。
【0091】
Rが短い(具体的には、カルボニル基の炭素を含めて、炭素数がC5以下)の時には、例えば酸無水物を用いることができ、Rの炭素数がC5以上の場合には、R−Xを用いることができる。
【0092】
Xで示されるハロゲンとしては、例えば塩素、臭素、ヨウ素等が挙げられ、好ましくは、塩素である。
【0093】
塩基としては、例えば、炭酸水素アルカリ金属塩、炭酸アルカリ金属塩であり、炭酸水素ナトリウム、炭酸水素カリウム、炭酸ナトリウム、炭酸カリウムを用いることができる。さらに好ましくは、炭酸水素ナトリウム、炭酸水素カリウム、であり、最も好ましいのは、炭酸水素ナトリウムである。
【0094】
塩基の使用量は、通常化合物(a)1モルに対して、1〜10モル、好ましくは1〜5モルである。
【0095】
酸無水物又はR−Xで示される化合物の使用量は、通常化合物(a)1モルに対して、1〜10モル、好ましくは1〜7モルである。
【0096】
本反応は、通常15〜30℃、撹拌条件で行うことができる。
【0097】
反応時間は、通常1〜5時間であり、好ましくは2時間であるが、Rの長さに応じて適宜設定することができる。
【0098】
その後、水を減圧等の常法により除去し、反応によって生成した塩基飽和溶液にて中和する。
【0099】
再度、減圧等の常法により水を除去した後、アセトン等の両親媒性有機溶媒を用いて反応物を抽出することができる。
【0100】
アセトンで抽出された反応物をシリカゲルカラムクロマトグラフィー等の常法で精製し、化合物(Ia)を得ることができる。
【0101】
(3−2)一般式(Ib)で表される化合物の製造方法
一般式(Ib)で表される化合物(以下、化合物(Ib)と表記する)は、スキームIIに示す工程1〜工程4により製造することができる。
【0102】
【化8】

【0103】
(Rは、前記と同じ、Xはハロゲンを示す)。
【0104】
工程−1:化合物(b)から、化合物(c)を製造する工程
D−アラビノース(以下、化合物(b)と表記する)の第5位の水酸基に保護基を導入し、5−O−トリチル−D−アラビノース(以下、化合物(c)と表記する)を製造する。保護基の導入は、有機溶媒、反応促進のための添加剤、塩基の存在下で行われる。
【0105】
保護基は、以降の各工程に悪影響を与えないものであればよく、好ましくはトリチル基である。
【0106】
保護基を提供する化合物は、好ましくはハロゲン化トリチルが挙げられる。さらに好ましいのは、トリチルクロライドである。ハロゲン化トリチルの使用量は、通常化合物(b)1モルに対して、1〜5モル、好ましくは1〜2.5モルである。
【0107】
有機溶媒は、トリチル化反応に影響を与えないものであればよく、例えば塩化メチレン、クロロホルム等のハロゲン系炭化水素溶媒;ジエチルエーテル、ジイソプロピルエーテル、THF、ジオキサン等のエーテル系溶媒;アセトン、メチルエチルケトン等のケトン系溶媒等;N,N−ジメチルホルムアミド(DMF)等の非プロトン性極性溶媒等;あるいはこれらの混合溶媒が挙げられる。好ましくは非プロトン性極性溶媒等、エーテル系溶媒であり、最も好ましいのはDMF又はTHFである。
【0108】
添加剤としては、アミン化合物を用いることができる。好ましくは、トリエチルアミン、ジイソプロピルエチルアミン、さらに好ましくはトリエチルアミンである。
【0109】
添加剤の使用量は、通常化合物(b)1モルに対して、1〜5モル、好ましくは1〜3モルである。
【0110】
塩基としては、ピリジン誘導体が用いられる。好ましくはジメチルアミノピリジンである。
【0111】
塩基の使用量は、通常化合物(b)1モルに対して、0.01〜0.1モル、好ましくは0.02〜0.07モルである。
【0112】
反応は、通常15〜30℃で、撹拌条件で行うことができる。反応時間は通常12〜24時間、好ましくは16〜18時間である。
【0113】
得られた化合物(c)は、酢酸エチル等のエステル系有機溶媒で抽出することができる。
【0114】
有機層を5%塩酸、5%炭酸水素ナトリウム及び水にて洗浄した後、減圧等の常法により、有機溶媒を除去し、化合物(c)を得ることができる。
【0115】
工程−2:化合物(c)から化合物(d)を製造する方法
化合物(c)を、アルコールに溶解し、還元剤の存在下で還元して5−O−トリチル−D−アラビトール(以下、化合物(d)と表記する)を製造する。
【0116】
アルコールは、例えばメタノール、エタノール、2−プロパノール等の低級アルコールが挙げられ、好ましくはメタノール、エタノールである。これらのアルコールは、単独で用いてもよいが、混合溶媒として用いてもよい。混合溶媒として好ましいのは、メタノールとエタノールの混合溶媒である。
【0117】
還元剤は、例えば水素化アルミニウムリチウム、水素化ホウ素ナトリウムであり、さらに好ましくは、水素化ホウ素ナトリウムである。
【0118】
還元剤の使用量は、通常化合物(c)1モルに対して、0.5〜3モル、好ましくは、0.08〜1.5モルであり、撹拌しながら、化合物(c)を含むアルコール溶液に徐々に添加することができる。
【0119】
反応は、通常10℃以下で行うことができ、好ましくは−5〜5℃、さらに好ましくは−2〜2℃、もっとも好ましいのは−1〜1℃である。
【0120】
反応は、通常撹拌条件下で行われ、反応時間は通常15分〜1時間、好ましくは20分〜40分である。
【0121】
反応物は、アルコールを除去した後、シリカゲルカラムクロマトグラフィー等で精製し、化合物(d)を得ることができる。
【0122】
工程−3:化合物(d)から化合物(e)を製造する工程
化合物(d)を、溶媒に溶解し、塩基の存在下で酸無水物(R2O:Rは前記と同じ)又はR−X(R及びXは前記と同じ)で示される化合物と反応させ、化合物(e)を製造する。
【0123】
Rが短い(具体的には、カルボニル基の炭素を含めて、炭素数がC5以下)の時には、例えば酸無水物を用いることができ、Rの炭素数がC5以上の場合には、R−Xを用いることができる。
【0124】
Xで示されるハロゲンとしては、例えば塩素、臭素、ヨウ素等が挙げられ、好ましくは、塩素である。
【0125】
有機溶媒は、反応に影響を与えないものであればよく、例えば塩化メチレン、クロロホルム等のハロゲン系炭化水素溶媒;ジエチルエーテル、ジイソプロピルエーテル、THF、ジオキサン等のエーテル系溶媒;アセトン、メチルエチルケトン等のケトン系溶媒等;N,N−ジメチルホルムアミド(DMF)等の非プロトン性極性溶媒等;あるいはこれらの混合溶媒が挙げられる。好ましくはハロゲン系炭化水素溶媒であり、最も好ましいのは塩化メチレンである。
酸無水物又はR−Xで示される化合物の使用量は、通常化合物(d)1モルに対して、0.5〜5モル、好ましくは0.8〜2モルである。
【0126】
塩基としては、ピリジン誘導体が用いられる。好ましくはジメチルアミノピリジンである。
【0127】
塩基の使用量は、通常化合物(d)1モルに対して、0.01〜1モル、好ましくは0.05〜0.5モルである。
【0128】
本反応は、通常15〜30℃、撹拌条件で行うことができる。
【0129】
反応時間は、通常15〜1時間、好ましくは20〜40分である。
【0130】
常法に従って、有機溶媒を除去した後、シリカゲルカラムクロマトグラフィー等で反応物を精製し、化合物(e)を得ることができる。
【0131】
工程−4:化合物(e)から化合物(Ib)を製造する工程
化合物(e)から、保護基を除去することにより、化合物(Ib)を製造する。
【0132】
有機溶媒と、酸の混合液を用いて、保護基を除去する。
【0133】
使用される有機溶媒は、例えばハロゲン系炭化水素溶媒、エステル系有機溶媒が挙げられる。好ましくは塩化メチレン、酢酸エチルである。
【0134】
酸は、保護基の種類に合わせて、適宜決めうる。例えば塩酸、硫酸、p−トルエンスルホン酸や蟻酸等が挙げられる。好ましくは、p−トルエンスルホン酸や蟻酸であり、Rの性質に応じて、適宜選択し得る。
【0135】
酸の使用量は、通常化合物(e)1モルに対して、0.01〜0.3モル、好ましくは、0.05〜0.2モルである。
【0136】
反応温度は、通常15〜30℃で行うことができる。
【0137】
反応は、通常撹拌条件下で行われ、反応時間は通常15分〜18時間であり、使用する酸の種類に応じて、適宜決定し得る。
【0138】
得られた反応物は、常法により有機溶媒を除去し後、両極性溶媒にて洗浄する。両親媒性有機溶媒としては、好ましくはアセトンである。
【0139】
洗浄後の反応物をヘキサンとアセトンの混合溶媒で再結晶化させ、化合物(Ib)を得ることができる。
【0140】
4.用途
一般式(I)で表される化合物は、優れた抗変異原活性を有している。そのため、人及び動物に対する抗変異原性剤として使用することができる。特に、DNAの異常修飾を起こし、癌を引き起こす変異原性物質の阻害に有効である。
【0141】
また、一般式(I)で表される化合物が有する抗変異原性活性は、人や動物に対して用いられるだけでなく、生化学の分野において、細菌の突然変異を抑制する必要がある場合、例えば、培養、生化学分析にも使用することができる。
【0142】
本発明の抗変異原性剤の使用形態については、特に限定はなく、経口、非経口の何れも可能であるが、例えば、経口的に摂取する場合には、食品添加剤として食品に添加して摂取することができる。また、化粧品等に添加して皮膚等に塗布することによって、皮膚癌等の予防にも有効に使用できる。
【0143】
食品添加剤として用いる場合には、その添加量については、特に限定的ではなく、食品の種類に応じ適宜決めればよい。例えば、清涼飲料、炭酸飲料等の液体食品や菓子類やその他の各種食品等の固形食品に添加して用いることができるが、これらの場合の添加量については、食品の種類に応じて適宜決めればよく、一例としては、上記した抽出物の乾燥重量として、含有量が0.005重量%〜5重量%程度の範囲内となるように添加すればよい。
【0144】
また、化粧品に添加する場合には、化粧品の本来の機能を阻害しない範囲において、添加量を適宜決めればよい。
【0145】
また、その他に、本発明の抗変異原性剤を人体に投与する場合の投与方法及び投与量の一例を示すと次の通りである。
【0146】
投与は、種々の方法で行うことができ、例えば、錠剤、カプセル剤、顆粒剤、シロップ剤等による経口投与とすることができる。投与量については、経口投与の場合には、通常、成人において、有効成分量として0.01〜1000mg/kg(体重)程度が適当であり、これを1日1回〜数回に分けて投与すればよい。経口投与剤は、通常の製造方法に従って製造することができる。例えば、デンプン、乳糖、マンニット等の賦形剤、カルボキシメチルセルロースナトリウム、ヒドロキシプロピルセルロース等の結合剤、結晶セルロース、カルボキシメチルセルロースカルシウム等の崩壊剤、タルク、ステアリン酸マグネシウム等の滑沢剤、軽質無水ケイ酸等の流動性向上剤等を適宜組み合わせて処方することにより、錠剤、カプセル剤、顆粒剤等として製造することができる。
【0147】
また、近年ペットとして飼育される動物(イヌ、ネコ、家畜等)の悪性腫瘍が増加の傾向にあるが、これらの動物の餌に本願の抗変異原性剤を添加することにより、或いは動物に該抗変異原性剤を薬剤として投与することにより悪性腫瘍の予防が可能となる。
【0148】
さらに、本発明の抗変異原性剤は、変異原性物質で汚染された土壌等に、抗変異原性剤を直接、または有機溶剤または水に溶解するなどして、溶液にして散布することができる。また汚染された湖沼、河川、海水にも使用することができる。この場合、対象となる水に直接混ぜても良いし、溶液にして混合しても良い。本発明の抗変異原性剤は、糖とカルボン酸がエステル結合で結合した化合物であるので、環境においても無害である。
【実施例】
【0149】
以下、実施例を示して本発明をさらに詳細に説明する。
【0150】
実施例1
ヤマブシダケからの新規糖アルコールエステルの抽出
図1に手順に従って、乾燥ヤマブシダケから抽出物から各分画を得た。
【0151】
すなわち、乾燥ヤマブシタケ1.6kgを酢酸エチルを用いて加熱還流にて抽出操作を8時間行い、ヤマブシタケの酢酸エチル抽出物を30g得た。
【0152】
得られた酢酸エチル抽出物をシリカゲルカラムクロマトグラフィーにより分画操作を行い、新規糖アルコールエステルである化合物1〜3をそれぞれの収量で得た。(図1)
得られた化合物1〜3の構造決定
化合物1〜3の構造を決定する目的で、IR、1H−NMR及び13C−NMR、比旋光度を測定した。各種解析結果を、図2〜図4に示す。
【0153】
各種スペクトル測定を行った結果、得られた化合物は、全て新規化合物であり、糖アルコールであるエリスリトールがエステルとなったエリスリトール−1−アセテート(化合物1)、糖アルコールであるD−アラビトールがエステルとなったD−アラビトール−1−アセテート(化合物2)であることを決定した。また化合物3に関しても化合物2と同様にD−アラビトールがリノール酸とエステル結合したD−アラビトール−1−リノレートであることを決定した。
【0154】
化合物1〜3を構成する糖アルコールの種類及び立体については、それぞれの化合物を加水分解し、得られた糖アルコールを1H−NMR測定及び比旋光度測定することにより、化合物1では、エリスリトール、化合物2及び3では、D−アラビトールであることを確認した。IR(赤外線吸収)スペクトルの測定には、日本分光株式会社製のJASCO FT/IR−470 plus Fourier transform infrared spectrometerを使用した。
【0155】
NMRスペクトルの測定には、JEOL FX−500(500MHz,1H;125MHz,13C)、JEOR FX−700(700MHz,1H;175MHz,13C)spectrometerを使用した。DMSO−d6及びD2O−d6中にて測定し、DMSOにおいてはテトラメチルシラン(TMS)をD2O−d6においては3−(トリメチルシリル)−1−プロパンスルホン酸ナトリウム(DSS)を標準物質として使用した。多重度は、DEPT pulse sequenceにより決定した。
【0156】
比旋光度は、日本分光株式会社製 JASCO DIP−1000を使用した。
【0157】
実施例2
(1)化合物1(化合物(Ia))
メソ−エリスリトール(1.2g、10mmol)及び炭酸水素ナトリウム(2.7g、32mmol)を水20mlに溶解させ、その後、無水酢酸(6.7ml、72mmol)加え、常温にて2時間攪拌する。その後、水を減圧下にて概ね除去し、反応によって生成した酢酸を炭酸水素ナトリウム飽和溶液にて中和する。再度、水を除去し、アセトンを用いて反応器内の生成物を抽出する。アセトンに抽出された抽出物をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=6:1)にて精製し、収率31.7%で無色のオイル状のエリスリトール−1−アセテート(511mg)を得た。
【0158】
(2)化合物2(化合物(Ib−1))
D−アラビノース(2.0g,13.3mmol)、トリチルクロライド(4.0g、14.6mmol、トリエチルアミン(3.22ml,23.85mmol)、ジメチルアミノピリジン(80.5mg、0.66mmol)をDMF(4.0ml)に溶解させ18時間室温にて攪拌する。反応溶液を水に注ぎ、酢酸エチルにて抽出し、得られた有機層を5%塩酸、5%炭酸水素ナトリウム、及び水にて洗浄し、溶媒を減圧下にて除去し、5−O−トリチル−D−アラビノース(1.55g、収率29.6%)を得た。
【0159】
得られた5−O−トリチル−D−アラビノース(1.55g、3.95mmol)をエタノール(25ml)に溶解させ、0℃の条件下で、NaBH4(127mg、3.36mmol)を少量ずつ加え30分攪拌する。その後、溶媒を除去し黄色の固体を得た。得られた黄色の固体をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=9:1)にて精製し5−O−トリチル−D−アラビトール(1.4g、90.0%).を得た。
【0160】
得られた5−O−トリチル−D−アラビトール(1.4g、3.55mmol)、無水酢酸(335mL、3、55mmol)、を塩化メチレン(50ml)に溶解させ、ジメチルアミノピリジン(36mg、0.36mmol)を加え室温にて18時間攪拌した。その後、溶媒を除去し薄黄色の1−アセチル−5−O−トリチル−D−アラビトールの固体を得た。得られた結晶をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=9:1)にて精製し1−アセチル−5−O−トリチルl−D−アラビトール(486mg、31.4%)を得た。
【0161】
更に1−アセチル−5−O−トリチルl−D−アラビトール(486mg、1mmol)5mlの塩化メチレンに溶解させ、p−トルエンスルホン酸一水和物(3.3mg、0.017mmol)を加え、室温にて30分攪拌した。その後、溶媒を除去し薄黄色の固体を得た。得られた薄黄色の固体をアセトンにて洗浄し、濾過した。得られ白色の残査をヘキサン及びアセトンの混合溶媒にて結晶化させ、白色のD−アラビトール−1−アセート固体(132.7mg)を得た。
【0162】
(3)化合物3(化合物(Ib−2))
D−アラビノース(2.0g、13.3mmol)、トリチルクロライド(4.1g、14.7mmol)、トリエチルアミン(3.32ml、24.0mmol)、ジメチルアミノピリジン(81.0mg、0.67mmol)をTHF(20.0ml)に溶解させ、室温にて1時間攪拌させた。反応液を水に注ぎ、酢酸エチルにて抽出した。得られた有機層を水にて洗浄し、溶媒を除去し、5−O−トリチル−D−アラビノース(2.00g、収率38.0%)を得た。
【0163】
5−O−トリチル−D−アラビノース(2.00g、5.1mmol)をメタノール(25ml)及びエタノール(7ml)の混合溶媒に溶解させ、0℃の条件下で、NaBH4(94mg、2.6mmol)を少量ずつ加え30分攪拌した。その後、溶媒を除去し黄色の固体を得た。得られた黄色の5−O−トリチル−D−アラビトール固体をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=9:1)にて精製し5−O−トリチル−D−アラビトール(1.29g、64.0%)を得た。
【0164】
得られた5−O−トリチル−D−アラビトール(500mg、1.27mmol)、リノレオイルクロリド(490mL、1.52mmol)をジクロロメタン(15ml)に溶解し、ジメチルアミノピリジン(8mg、0.065mmol)を加え、室温にて18時間攪拌した。その後、溶媒を除去し薄黄色の固体を得た。得られた固体をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=9:1)にて精製し1−リノレオイル−5−O−トリチル−D−アラビトール(396mg、47%)を得た。
【0165】
さらに1−リノレオイル−5−O−トリチル−D−アラビトール(486mg、1mmol)を酢酸エチル(4ml)と蟻酸(2ml)の混合溶媒に加え室温にて30分攪拌した。反応液を水(10ml)で希釈し、飽和炭酸水素ナトリウム水溶液にて中和し、酢酸エチルにて抽出を行い、溶媒除去後、残査をシリカゲルカラムクロマトグラフィー(酢酸エチル:アセトン=4:1)にて精製しD−アラビトール1−リノレート(200mg、収率58%)を白色の固体として得た。さらにヘキサンとアセトンの混合溶媒にて結晶化させた。
【0166】
実施例3
抗変異原特性試験
さらに上記3種類の化合物について抗変異原特性試験を実施した。
変異原物質としては、3−アミノ−1,4−ジメチル−5H−ピリド[4,3−b]インドール(Trp−p−1)を用い、菌株としては、Salamonella typhimurium TA 1535/psk 1002を用いた。試験方法の概略を以下に説明する。
【0167】
LB培地(トリプトン1%、酵母エキス0.5%、食塩0.5%)にて37℃で一夜培養した試験菌液を、TGA培地(Bacto トリプトン1%、食塩0.5%、グルコース0.2%に20mg/Lのアンピシリンを加えたものに1/50量植菌し、37℃で振とう培養した。その後、菌濃度が対数増殖期(A600が0.25〜0.30)に達したとき、菌液とS−9mixをそれぞれ850μL、150μLずつ試験管にとり、これに変異原物質と図5のグラフに示された各濃度となる量の抽出物を加えて、37℃で2時間培養した。尚、変異原物質の添加量は、3.3μg/mL DMSO溶液を10μLとした。
【0168】
β−ガラクトシダーゼ活性の測定は、Z緩衝液(Na2HPO4 21.50g、NaH2PO4・H2O 6.21g、KCl 0.75g、MgSO4・7H2O 0.246gを500mlの蒸留水に溶解させ、pH7.0に調製した。)0.9mLに上記試験菌液0.1mLを加えた後、0.1%のドデシル硫酸ナトリウム水溶液50μL及びクロロホルムμLを加え強く攪拌した。その液に基質(o−ニトロフェニル−β−D−ガラクトピラノシド4mg/mL)0.1mLを加え、28℃で反応させた。そして20分後に1M Na2CO3を0.5mL加えて反応を止め、分光光度計で420、550、600nmで測定した。それぞれの吸光度をA420、A550及びA600で表す。
【0169】
ここで、β−ガラクトシダーゼ活性値は、次式により算出した。
【0170】
β−ガラクトシダーゼ活性値(unit)
=1000(A420−1.75×A550)/1.5×A600
また、SOS反応抑制率は、次式により算出した。
SOS反応抑制率(%)
=[1−(A−C/(B−C))×100
但し、上式中Aは変異原物質に各抽出物を加えた場合のβ−ガラクトシダーゼ活性値を、Bは変異原物質のみにより誘導されたβ−ガラクトシダーゼ活性値を、Cはコントロールのβ−ガラクトシダーゼ活性値をそれぞれ示す。尚、コントロールには同量のDMSOを使用した。また、各試験は試行を1組として行い、その平均をとった。
【0171】
結果を図5に示す。
【0172】
化合物1、2については、濃度依存的に抑制効果が確認された。特に、化合物3については、100μMで86%抑制し、50%阻害濃度としては、30.3μMであった。このことよりヤマブシタケに含有する新規糖アルコール化合物は、変異原抑制作用を有しており、抗変異原性剤として有用であることが示された。
【技術分野】
【0001】
本発明は、ヤマブシダケ(Hericium erinaceum)から得られる抽出物を有効成分とする抗変異原性剤、並びに該抗変異原性剤を有効成分として含有する食品添加剤及び化粧品添加剤に関する。
【背景技術】
【0002】
近年、過加熱調理したアミノ酸、タンパク質を多く含む食品から、発ガン性を有する変異原性物質が検出されている。中でも、複素環芳香族アミン(Heterocyclic aromatic amines;以下HAAという)は、細胞内に入ると、DNA分子のグアニンを共有結合により修飾し、これが遺伝子の変異の原因であると考えられている。
【0003】
発ガン性を有するHAAとしては、トリプトファンの熱分解産物から単離された3−アミノ−1,4−ジメチル−5H−ピリド[4,3−b]インドール、3−アミノ−1−メチル−5H−ピリド[4,3−b]インドール、グルタミン酸の熱分解産物から単離された、2−アミノ−6−メチルジピリド[1,2−a:3’,2’−d]イミダゾール、2−アミノジピリド[1,2−a:3’,2’−d]イミダゾール、この他にも、2−アミノ−1−メチル−6−フェニル−イミダゾ[4,5−b]ピリジン、2−アミノ−α−カルボリン、2−アミノ−3−メチル−α−カルボリン等が報告されている。
【0004】
これらHAAによる発ガン性は、臓器を問わず報告されている。HAAは調理の過程、特に焦げ付くほどの過加熱状態の時に発生し、ビーフステーキやビーフハンバーグ、焼き肉に含まれることが報告されている。
【0005】
HAAが産生されることを防ぐ方法は、肉類を焦げつかないようにすることである。しかしながら、ハンバーグやステーキ等の肉料理の焦げ目は、料理の風味を良くすることが多く、全く焦げ目のない料理は、かえって食欲をそぐ結果となる。
【0006】
焦げ目の付いた料理を食しても、HAA等の変異原性物質の存在を気にせずにすむような食品や食品添加剤の開発が望まれていた。また、HAAは、煙草の煙の中にも存在していることが報告されており、食品添加物だけでなく、化粧品等の外用剤にも抗変異原性剤が含まれることが望まれている。
【0007】
さらには、土壌や湖沼、河川、海の水からHAAが検出されることもあり、こういった汚染環境を改善する抗変異原性剤が望まれている。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】財団法人日本公衆衛生協会 食品・薬品安全性ニュース第5号
【非特許文献2】Saleem,M et al, Eur.Org. Chem.2011,808−812
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の主な目的は、癌の原因となる変異原性物質の活性を抑制できる新規な化合物及びその合成方法を提供することである。
【課題を解決するための手段】
【0010】
本発明者は、上記の目的を達成すべく鋭意研究を重ねた結果、ヤマブシダケ(Hericium erinaceum)の抽出物が、変異原性物質によるDNAへの変異導入を強力に抑制する作用を有することを見いだし、ここに本発明を完成するに至った。
【0011】
即ち、本発明は、下記の抗変異原性剤、該抗変異原性剤を有効成分として含有する食品添加剤、食品添加剤を添加した食品、化粧品添加剤、化粧品添加剤を添加した化粧品及びヤマブシダケ抽出物を有効成分とする抗変異原性剤を提供することである。
【0012】
項1.一般式(I)で表される化合物:
【0013】
【化1】

【0014】
(式中、nは0または1、Rは、アルカノイル基又はアルケノイル基を示す)。
【0015】
項2.一般式(Ia)で表される項1に記載の化合物:
【0016】
【化2】

【0017】
(式中、Rは、前記に同じ)。
【0018】
項3.一般式(Ib)で表される項1に記載の化合物:
【0019】
【化3】

【0020】
(式中、Rは、前記に同じ)。
【0021】
項4.項1〜3のいずれか1項に記載の化合物を有効成分として含有する抗変異原性剤。
【0022】
項5.ヤマブシダケ(Hericium erinaceum)の抽出物を有効成分とする抗変異原性剤。
【0023】
項6.抽出溶媒がメタノール、エタノール、塩化メチレン及び酢酸エチルからなる群より選ばれる少なくとも1種である項5に記載の抗変異原性剤。
【0024】
項7.項4〜項6のいずれか1項に記載の抗変異原性剤を有効成分として含有する食品添加剤。
【0025】
項8.項7に記載の食品添加剤を添加した食品。
【0026】
項9.項4〜項6のいずれか1項に記載の抗変異原性剤を有効成分として含有する化粧品添加剤。
【0027】
項10.項9に記載の化粧品添加剤を添加した化粧品。
【発明の効果】
【0028】
本発明の抗変異原性剤は、食用キノコの一種であるヤマブシタケの抽出物を有効成分とするものであり、優れた変異原抑制作用を有する。また、今回抽出物中の有効成分を精製・同定することに成功し、新規化合物である一般式(I)で表される化合物が、抗変異原性活性を有することをつきとめた。中でも、一般式(I)で表され、nが1でありRが炭素数18のアルケノイル基を有する化合物が特に有効であることも示された。
【0029】
本発明の抗変異原性剤は、食品添加剤、化粧品添加剤等として利用される。
【図面の簡単な説明】
【0030】
【図1】ヤマブシダケの抽出物分離工程を示す図である。
【図2】化合物1:エリスリトール−1−アセテートの構造式及びスペクトルデータを示す。
【図3】化合物2:D−アラビトール−1−アセテートの構造式及びスペクトルデータを示す。
【図4】化合物3:D−アラビトール−1−リノレートの構造式及びスペクトルデータを示す。
【図5】3−アミノ−1,4−ジメチル−5H−ピリド[4,3−b]インドールによって惹起されるDNA変異に対する、化合物1〜3の変異原抑制作用を示す。
【発明を実施するための形態】
【0031】
1.ヤマブシタケからの抽出物
本発明の抗変異原性剤は、ヤマブシタケ(Hericium erinaceum)の抽出物を有効成分とするものである。ここにおいてヤマブシタケとは、サンゴハリタケ科サンゴハリタケ属に属する食用キノコである。日本、中国、北アフリカ、北アメリカ等多くの国に自生し、食用に供されている。
【0032】
ヤマブシタケは、生のままでも抽出物に供することができるが、粉砕した後乾燥させたり、乾燥させたものを粉末状にして抽出することもできる。
【0033】
抽出溶媒としては、例えば、メタノール、エタノール、プロパノール、ブタノール等のアルコール類、1,3−ブチレングリコール、グリセリン、プロピレングリコール等のグリコール類、酢酸エチル、酢酸ブチル等のエステル類、エチルエーテル、プロピルエーテル、イソプロピルエーテル,テトラヒドロフラン、ジオキサン等のエーテル類、塩化メチレン、クロロホルム等のハロゲン化炭化水素等の極性有機溶媒、ヘキサン、シクロヘキサン、石油エーテル等の無極性有機溶媒等や水等を用いることができる。これらの抽出溶媒は、一種単独又は二種以上混合して用いることができる。
【0034】
好ましくは、アルコール、エステル系有機溶媒及びハロゲン系有機溶媒からなる群から選ばれた少なくとも1つの抽出溶媒により抗変異原活性を有する抽出物を得ることができる。さらに好ましい抽出溶媒はメタノール、エタノール、塩化メチレン、酢酸エチル単独又は、メタノール、エタノール、塩化メチレン、酢酸エチルのいずれか2以上の混合溶媒であり、より優れた抗変異原活性を有する抽出物を得ることができる。優れた抗変異原活性を有する抽出物を得るために、最も好ましいのは酢酸エチルである。
【0035】
抽出方法については、特に限定されるものではなく、ヤマブシタケに溶媒を加えた後、抽出物の抗変異原活性を失活させない程度に加温加熱する加熱抽出法や、加熱還流法、超臨界抽出法等を適宜適用できる。また、一定量の溶媒にヤマブシタケを浸漬してバッチ処理する浸漬抽出法や連続的に溶媒を送り続ける連続抽出法等、公知の種々の抽出法を適用できる。特に抗変異原性活性を有する抽出物を効率良く得ることができるのは、加熱還流法である。
【0036】
具体的な抽出方法の一例を挙げると、例えば、ヤマブシタケの乾燥重量に対して、1〜5重量倍程度、好ましくは、1.5〜3重量倍程度の抽出溶媒を加えて浸漬して加熱し、8〜12時間程度溶媒を還流させることにより、抗変異原活性を有する成分を抽出することができる。或いは、ヤマブシタケの乾燥重量に対して1〜5重量倍程度、好ましくは、1.5〜3重量倍程度の抽出溶媒を加えて浸漬し、室温で10〜14日間程度放置するか、或いは70〜75℃程度に加熱して還流しながら8〜12時間程度加熱することにより有効成分を抽出することも可能である。勿論、溶媒量や加熱温度、加熱時間等については、優れた抗変異原活性を有する成分を抽出できるように適宜調整すればよい。上記した方法によってヤマブシタケと抽出溶媒の混合液は、通常、濾過、遠心分離等の常法によって残渣と上清を分離することによって、抽出物を得ることができる。
【0037】
抽出分画を得るためには、抽出物をメタノール、エタノール、プロパノール、ブタノール、クロロホルム、酢酸エチル、トルエン等の有機溶媒を1種又は2種以上用いた溶媒分画操作を行うことができ、これらの抽出画分から、活性画分を分取したものを抗変異原性剤として用いることも可能である。
【0038】
更に、必要に応じて、アルミナカラムクロマトグラフィーやシリカゲルクロマトグラフィー、ゲルろ過クロマトグラフィー、イオン交換クロマトグラフィー、疎水クロマトグラフィー、高速液体クロマトグラフィー等の適当な分離精製手段を1種若しくは2種以上組み合わせて、変異原の活性抑制作用のある画分又は化合物を取り出して、抗変異原性剤とすることができる。これにより、少量の摂取で優れた活性を発揮させることができる。
【0039】
2.一般式(I)で表される化合物
図1を参照して、ヤマブシタケからの活性化合物の精製・同定の手順を具体的に示す。
【0040】
ヤマブシダケを、エステル系有機溶媒(例えば酢酸エチル)を用いて加熱還流を行い、エステル系有機溶媒抽出物を得る。この抽出物をシリカゲルカラムクロマトグラフィーにより分画し、得られた分画の一部をさらにシリカゲルカラムクロマトグラフィーにより分画する。この方法により抗変異原性物質として図2〜7で示される化合物1〜3が得られる。
【0041】
(2−1)一般式(I)で表される化合物
本発明者らが、さらに検討を重ねた結果、化合物1〜3を含む一般式(I)で表される化合物は、化合物1〜3と同様に抗変異原性活性有することを見出した。
【0042】
本発明は、化合物1〜3を含む一般式(I)で表される化合物、及び当該化合物を有効成分とする抗変異原性剤を提供する。
【0043】
一般式(I)で表される化合物は糖アルコールの誘導体である。抗変異原性活性を有する化合物は、nは、0または1である一般式(I)で表される化合物である。糖アルコール部分の立体配位はフィッシャーの投影式で、n=0の時はメソ体、n=1の時はD体(絶対配位)である。
【0044】
【化4】

【0045】
(式中、nは0又は1、Rは、アルカノイル基又はアルケノイル基を示す)。
【0046】
アルカノイル基は、例えば炭素数がC2〜30のアルカノイル基であり、好ましくは、C2〜20のアルカノイル基である(なお、炭素数は、カルボニル基の炭素を含む数である)。具体的には、例えばアセチル基、プロピオニル基、ブチリル基、ペンタノイル基、ヘキサノイル基、ヘプタノイル基、オクタノイル基、ノナノイル基、デカノイル基、ドデカノイル基、テトラデカノイル基、ペンタデカノイル基、ヘキサデカノイル基、ヘプタデカノイル基、オクタデカノイル基、ノナデカノイル基、イコサノイル基等があげられる。より好ましくは、アセチル基、プロピオニル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基、イコサノイル基等であり、さらに好ましくは、アセチル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基等であり、最も変異原抑制作用が高いのは、アセチル基、オクタデカノイル基等である。
【0047】
アルカノイル基は、直鎖型であっても分岐型であってもよいが、より好ましくは直鎖型である。
【0048】
アルケノイル基は、例えばC3〜30のアルケノイル基であり、好ましくは、C3〜25、さらに好ましくは、C3〜18のアルケノイル基である(なお、炭素数は、カルボニル基の炭素を含む数である)。
【0049】
アルケノイル基は、直鎖型であっても分岐型であってもよいが、好ましくは直鎖型である。
【0050】
アルケノイル基に含まれる二重結合の数に制限はないが、例えば1〜6個、好ましくは1〜3個、より好ましくは1または2個である。
【0051】
アルケノイル基の二重結合は、シス型、トランス型あるいはシス型とトランス型の共存いずれの幾何異性体であってもよいが、好ましくはシス型である。
【0052】
アルケノイル基の二重結合の位置に制限はない。
【0053】
アルケノイル基としては、二重結合を1〜6個有するものの具体例を以下に挙げる。
【0054】
二重結合を1個有する炭素数がC3〜C25であるアルケノイル基としては、例えば、クロトン酸、ミリストレイン酸、パルミトレイン酸 、オレイン酸、エライジン酸、バクセン酸、ガドレイン酸、エイコセン酸、エルカ酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。好ましくは、パルミトレイン酸 、オレイン酸、エライジン酸、ネルボン酸、より好ましくは、パルミトレイン酸 、オレイン酸からカルボキシル基の水酸基を除いた残基である。
【0055】
二重結合を2個有する炭素数がC5〜C25であるアルケノイル基としては、例えば、リノール酸、エイコサジエン酸、ドコサジエン酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。好ましいのは、リノール酸からカルボキシル基の水酸基を除いた残基である。
【0056】
二重結合を3個有する炭素数がC7〜C25であるアルケノイル基としては、例えば、リノレン酸、ピノレン酸、エレオステアリン酸、ミード酸、ジホモ-γ-リノレン酸、エイコサトリエン酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。好ましくは、リノレン酸、ピノレン酸、エレオステアリン酸、ジホモ-γ-リノレン酸からカルボキシル基の水酸基を除いた残基である。
【0057】
二重結合を4個有する炭素数がC9〜C25であるアルケノイル基としては、例えば、ステアリドン酸、アラキドン酸、エイコサテトラエン酸、アドレン酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。好ましくは、ステアリドン酸、アラキドン酸からカルボキシル基の水酸基を除いた残基である。
【0058】
二重結合を5個有する炭素数がC11〜C25であるアルケノイル基としては、例えば、ボセオペンタエン酸、エイコサペンタエン酸、オズボンド酸、イワシ酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。
【0059】
二重結合を6個有する炭素数がC13〜C25であるアルケノイル基としては、例えば、ドコサヘキサエン酸、ニシン酸等の酸からカルボキシル基の水酸基を除いた残基が挙げられる。
【0060】
抗変異原抑制活性が強いのは、二重結合を2個有する炭素数がC5〜C25であるアルケノイル基であり、好ましくは、リノール酸、エイコサジエン酸、ドコサジエン酸等の酸からカルボキシル基の水酸基を除いた残基であり、最も抗変異原抑制活性が強いのは、リノール酸の酸からカルボキシル基の水酸基を除いた残基である。
【0061】
(2−2)一般式(Ia)で表される化合物
一般式(I)で表される化合物であって、nが0である化合物は、一般式(Ia)で表される。
【0062】
糖アルコール部分の立体配位はフィッシャーの投影式でメソ体である。
【0063】
【化5】

【0064】
(式中、Rは、前記に同じ)。
【0065】
Rがアルカノイル基の場合、好ましい態様はC2〜20のアルカノイル基であり、より好ましくは、C2〜18のアルカノイル基である(なお、炭素数は、カルボニル基の炭素を含む数である)。
【0066】
好ましくは、直鎖型である。
【0067】
アルカノイル基として好ましくは、例えば、アセチル基、プロピオニル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基、イコサノイル基等であり、より好ましくは、アセチル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基等であり、さらに好ましくは、アセチル基、オクタデカノイル基等である。
【0068】
Rがアルケノイル基である場合、好ましい態様は、C3〜21のアルケノイル基、より好ましくは、C3〜18のアルケノイル基である(炭素数は、カルボニル基の炭素を含む数である)。
【0069】
アルケノイル基は、直鎖型であっても分岐型であってもよいが、好ましくは、直鎖型である。
【0070】
アルケノイル基の二重結合は、シス型、トランス型あるいはシス型とトランス型の共存いずれの幾何異性体であってもよいが、好ましくはシス型である。アルケノイル基の二重結合の位置に制限はない。
【0071】
アルケノイル基としては、二重結合を2個有する炭素数がC5〜C25であるアルケノイル基が好ましく、例えば、リノール酸、エイコサジエン酸、ドコサジエン酸等の酸からカルボキシル基の水酸基を除いた残基等が挙げられる。抗変異原抑制活性が強いアルケノイル基は、リノール酸からカルボキシル基の水酸基を除いた残基である。
【0072】
(2−3)一般式(Ib)で表される化合物
一般式(I)で表される化合物であって、nが1の化合物は、一般式(Ib)で表される。
【0073】
糖アルコール部分の立体配位はフィッシャーの投影式でD体(絶対配置)である。
【0074】
【化6】

【0075】
(式中、Rは、前記と同じ)。
【0076】
Rがアルカノイル基の場合、好ましい態様はC2〜20のアルカノイル基であり、より好ましくは、C2〜18のアルカノイル基である(なお、炭素数は、カルボニル基の炭素を含む数である)。
【0077】
アルカノイル基は、直鎖型であっても分岐型であってもよいが、好ましくは、直鎖型である。
【0078】
アルカノイル基として好ましくは、例えば、アセチル基、プロピオニル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基、イコサノイル基等であり、より好ましくは、アセチル基、テトラデカノイル基、ヘキサデカノイル基、オクタデカノイル基等であり、さらに好ましくは、アセチル基、オクタデカノイル基等である。最も活性が強いのは、アセチル基である。
【0079】
Rがアルケノイル基の場合、好ましい態様は、例えば、C3〜21のアルケノイル基、より好ましくは、C3〜18のアルケノイル基である(炭素数は、カルボニル基の炭素を含む数である)。
【0080】
アルケノイル基は、直鎖型であっても分岐型であってもよいが、好ましくは、直鎖型である。
【0081】
アルケノイル基の二重結合の数は、1以上、好ましくは、1〜6個である。
【0082】
アルケノイル基の二重結合は、シス型、トランス型あるいはシス型とトランス型の共存いずれの幾何異性体であってもよいが、好ましくはシス型である。
【0083】
アルケノイル基の二重結合の位置に制限はない。
【0084】
アルケノイル基としては、二重結合を2個有する炭素数がC5〜C25であるアルケノイル基が好ましく、例えば、リノール酸、エイコサジエン酸、ドコサジエン酸等の酸からカルボキシル基の水酸基を除いた残基等が挙げられる。
【0085】
抗変異原抑制活性が強いアルケノイル基は、リノール酸からカルボキシル基の水酸基を除いた残基である。
【0086】
3.一般式(I)で表される化合物の合成方法
なお、式(I)で表される化合物は、スキームI〜IIに示す工程により製造することができるが、製造方法は、これらの工程に限られるものではない。
【0087】
(3−1)一般式(Ia)で表される化合物の製造方法
【0088】
【化7】

【0089】
(Rは、前記と同じ、Xはハロゲンを示す)。
【0090】
工程:化合物(a)から化合物(Ia)を製造する工程
メソ−エリスリトール(化合物(a))を、スキームIに従って、塩基性水溶液中で、酸無水物(R2O:Rは前記と同じ)又はR−X(Rは前記と同じ、Xはハロゲンを示す)で示される化合物と反応させ、一般式(Ia)で表される化合物(以下、化合物(Ia)と表記する)を製造することができる。
【0091】
Rが短い(具体的には、カルボニル基の炭素を含めて、炭素数がC5以下)の時には、例えば酸無水物を用いることができ、Rの炭素数がC5以上の場合には、R−Xを用いることができる。
【0092】
Xで示されるハロゲンとしては、例えば塩素、臭素、ヨウ素等が挙げられ、好ましくは、塩素である。
【0093】
塩基としては、例えば、炭酸水素アルカリ金属塩、炭酸アルカリ金属塩であり、炭酸水素ナトリウム、炭酸水素カリウム、炭酸ナトリウム、炭酸カリウムを用いることができる。さらに好ましくは、炭酸水素ナトリウム、炭酸水素カリウム、であり、最も好ましいのは、炭酸水素ナトリウムである。
【0094】
塩基の使用量は、通常化合物(a)1モルに対して、1〜10モル、好ましくは1〜5モルである。
【0095】
酸無水物又はR−Xで示される化合物の使用量は、通常化合物(a)1モルに対して、1〜10モル、好ましくは1〜7モルである。
【0096】
本反応は、通常15〜30℃、撹拌条件で行うことができる。
【0097】
反応時間は、通常1〜5時間であり、好ましくは2時間であるが、Rの長さに応じて適宜設定することができる。
【0098】
その後、水を減圧等の常法により除去し、反応によって生成した塩基飽和溶液にて中和する。
【0099】
再度、減圧等の常法により水を除去した後、アセトン等の両親媒性有機溶媒を用いて反応物を抽出することができる。
【0100】
アセトンで抽出された反応物をシリカゲルカラムクロマトグラフィー等の常法で精製し、化合物(Ia)を得ることができる。
【0101】
(3−2)一般式(Ib)で表される化合物の製造方法
一般式(Ib)で表される化合物(以下、化合物(Ib)と表記する)は、スキームIIに示す工程1〜工程4により製造することができる。
【0102】
【化8】

【0103】
(Rは、前記と同じ、Xはハロゲンを示す)。
【0104】
工程−1:化合物(b)から、化合物(c)を製造する工程
D−アラビノース(以下、化合物(b)と表記する)の第5位の水酸基に保護基を導入し、5−O−トリチル−D−アラビノース(以下、化合物(c)と表記する)を製造する。保護基の導入は、有機溶媒、反応促進のための添加剤、塩基の存在下で行われる。
【0105】
保護基は、以降の各工程に悪影響を与えないものであればよく、好ましくはトリチル基である。
【0106】
保護基を提供する化合物は、好ましくはハロゲン化トリチルが挙げられる。さらに好ましいのは、トリチルクロライドである。ハロゲン化トリチルの使用量は、通常化合物(b)1モルに対して、1〜5モル、好ましくは1〜2.5モルである。
【0107】
有機溶媒は、トリチル化反応に影響を与えないものであればよく、例えば塩化メチレン、クロロホルム等のハロゲン系炭化水素溶媒;ジエチルエーテル、ジイソプロピルエーテル、THF、ジオキサン等のエーテル系溶媒;アセトン、メチルエチルケトン等のケトン系溶媒等;N,N−ジメチルホルムアミド(DMF)等の非プロトン性極性溶媒等;あるいはこれらの混合溶媒が挙げられる。好ましくは非プロトン性極性溶媒等、エーテル系溶媒であり、最も好ましいのはDMF又はTHFである。
【0108】
添加剤としては、アミン化合物を用いることができる。好ましくは、トリエチルアミン、ジイソプロピルエチルアミン、さらに好ましくはトリエチルアミンである。
【0109】
添加剤の使用量は、通常化合物(b)1モルに対して、1〜5モル、好ましくは1〜3モルである。
【0110】
塩基としては、ピリジン誘導体が用いられる。好ましくはジメチルアミノピリジンである。
【0111】
塩基の使用量は、通常化合物(b)1モルに対して、0.01〜0.1モル、好ましくは0.02〜0.07モルである。
【0112】
反応は、通常15〜30℃で、撹拌条件で行うことができる。反応時間は通常12〜24時間、好ましくは16〜18時間である。
【0113】
得られた化合物(c)は、酢酸エチル等のエステル系有機溶媒で抽出することができる。
【0114】
有機層を5%塩酸、5%炭酸水素ナトリウム及び水にて洗浄した後、減圧等の常法により、有機溶媒を除去し、化合物(c)を得ることができる。
【0115】
工程−2:化合物(c)から化合物(d)を製造する方法
化合物(c)を、アルコールに溶解し、還元剤の存在下で還元して5−O−トリチル−D−アラビトール(以下、化合物(d)と表記する)を製造する。
【0116】
アルコールは、例えばメタノール、エタノール、2−プロパノール等の低級アルコールが挙げられ、好ましくはメタノール、エタノールである。これらのアルコールは、単独で用いてもよいが、混合溶媒として用いてもよい。混合溶媒として好ましいのは、メタノールとエタノールの混合溶媒である。
【0117】
還元剤は、例えば水素化アルミニウムリチウム、水素化ホウ素ナトリウムであり、さらに好ましくは、水素化ホウ素ナトリウムである。
【0118】
還元剤の使用量は、通常化合物(c)1モルに対して、0.5〜3モル、好ましくは、0.08〜1.5モルであり、撹拌しながら、化合物(c)を含むアルコール溶液に徐々に添加することができる。
【0119】
反応は、通常10℃以下で行うことができ、好ましくは−5〜5℃、さらに好ましくは−2〜2℃、もっとも好ましいのは−1〜1℃である。
【0120】
反応は、通常撹拌条件下で行われ、反応時間は通常15分〜1時間、好ましくは20分〜40分である。
【0121】
反応物は、アルコールを除去した後、シリカゲルカラムクロマトグラフィー等で精製し、化合物(d)を得ることができる。
【0122】
工程−3:化合物(d)から化合物(e)を製造する工程
化合物(d)を、溶媒に溶解し、塩基の存在下で酸無水物(R2O:Rは前記と同じ)又はR−X(R及びXは前記と同じ)で示される化合物と反応させ、化合物(e)を製造する。
【0123】
Rが短い(具体的には、カルボニル基の炭素を含めて、炭素数がC5以下)の時には、例えば酸無水物を用いることができ、Rの炭素数がC5以上の場合には、R−Xを用いることができる。
【0124】
Xで示されるハロゲンとしては、例えば塩素、臭素、ヨウ素等が挙げられ、好ましくは、塩素である。
【0125】
有機溶媒は、反応に影響を与えないものであればよく、例えば塩化メチレン、クロロホルム等のハロゲン系炭化水素溶媒;ジエチルエーテル、ジイソプロピルエーテル、THF、ジオキサン等のエーテル系溶媒;アセトン、メチルエチルケトン等のケトン系溶媒等;N,N−ジメチルホルムアミド(DMF)等の非プロトン性極性溶媒等;あるいはこれらの混合溶媒が挙げられる。好ましくはハロゲン系炭化水素溶媒であり、最も好ましいのは塩化メチレンである。
酸無水物又はR−Xで示される化合物の使用量は、通常化合物(d)1モルに対して、0.5〜5モル、好ましくは0.8〜2モルである。
【0126】
塩基としては、ピリジン誘導体が用いられる。好ましくはジメチルアミノピリジンである。
【0127】
塩基の使用量は、通常化合物(d)1モルに対して、0.01〜1モル、好ましくは0.05〜0.5モルである。
【0128】
本反応は、通常15〜30℃、撹拌条件で行うことができる。
【0129】
反応時間は、通常15〜1時間、好ましくは20〜40分である。
【0130】
常法に従って、有機溶媒を除去した後、シリカゲルカラムクロマトグラフィー等で反応物を精製し、化合物(e)を得ることができる。
【0131】
工程−4:化合物(e)から化合物(Ib)を製造する工程
化合物(e)から、保護基を除去することにより、化合物(Ib)を製造する。
【0132】
有機溶媒と、酸の混合液を用いて、保護基を除去する。
【0133】
使用される有機溶媒は、例えばハロゲン系炭化水素溶媒、エステル系有機溶媒が挙げられる。好ましくは塩化メチレン、酢酸エチルである。
【0134】
酸は、保護基の種類に合わせて、適宜決めうる。例えば塩酸、硫酸、p−トルエンスルホン酸や蟻酸等が挙げられる。好ましくは、p−トルエンスルホン酸や蟻酸であり、Rの性質に応じて、適宜選択し得る。
【0135】
酸の使用量は、通常化合物(e)1モルに対して、0.01〜0.3モル、好ましくは、0.05〜0.2モルである。
【0136】
反応温度は、通常15〜30℃で行うことができる。
【0137】
反応は、通常撹拌条件下で行われ、反応時間は通常15分〜18時間であり、使用する酸の種類に応じて、適宜決定し得る。
【0138】
得られた反応物は、常法により有機溶媒を除去し後、両極性溶媒にて洗浄する。両親媒性有機溶媒としては、好ましくはアセトンである。
【0139】
洗浄後の反応物をヘキサンとアセトンの混合溶媒で再結晶化させ、化合物(Ib)を得ることができる。
【0140】
4.用途
一般式(I)で表される化合物は、優れた抗変異原活性を有している。そのため、人及び動物に対する抗変異原性剤として使用することができる。特に、DNAの異常修飾を起こし、癌を引き起こす変異原性物質の阻害に有効である。
【0141】
また、一般式(I)で表される化合物が有する抗変異原性活性は、人や動物に対して用いられるだけでなく、生化学の分野において、細菌の突然変異を抑制する必要がある場合、例えば、培養、生化学分析にも使用することができる。
【0142】
本発明の抗変異原性剤の使用形態については、特に限定はなく、経口、非経口の何れも可能であるが、例えば、経口的に摂取する場合には、食品添加剤として食品に添加して摂取することができる。また、化粧品等に添加して皮膚等に塗布することによって、皮膚癌等の予防にも有効に使用できる。
【0143】
食品添加剤として用いる場合には、その添加量については、特に限定的ではなく、食品の種類に応じ適宜決めればよい。例えば、清涼飲料、炭酸飲料等の液体食品や菓子類やその他の各種食品等の固形食品に添加して用いることができるが、これらの場合の添加量については、食品の種類に応じて適宜決めればよく、一例としては、上記した抽出物の乾燥重量として、含有量が0.005重量%〜5重量%程度の範囲内となるように添加すればよい。
【0144】
また、化粧品に添加する場合には、化粧品の本来の機能を阻害しない範囲において、添加量を適宜決めればよい。
【0145】
また、その他に、本発明の抗変異原性剤を人体に投与する場合の投与方法及び投与量の一例を示すと次の通りである。
【0146】
投与は、種々の方法で行うことができ、例えば、錠剤、カプセル剤、顆粒剤、シロップ剤等による経口投与とすることができる。投与量については、経口投与の場合には、通常、成人において、有効成分量として0.01〜1000mg/kg(体重)程度が適当であり、これを1日1回〜数回に分けて投与すればよい。経口投与剤は、通常の製造方法に従って製造することができる。例えば、デンプン、乳糖、マンニット等の賦形剤、カルボキシメチルセルロースナトリウム、ヒドロキシプロピルセルロース等の結合剤、結晶セルロース、カルボキシメチルセルロースカルシウム等の崩壊剤、タルク、ステアリン酸マグネシウム等の滑沢剤、軽質無水ケイ酸等の流動性向上剤等を適宜組み合わせて処方することにより、錠剤、カプセル剤、顆粒剤等として製造することができる。
【0147】
また、近年ペットとして飼育される動物(イヌ、ネコ、家畜等)の悪性腫瘍が増加の傾向にあるが、これらの動物の餌に本願の抗変異原性剤を添加することにより、或いは動物に該抗変異原性剤を薬剤として投与することにより悪性腫瘍の予防が可能となる。
【0148】
さらに、本発明の抗変異原性剤は、変異原性物質で汚染された土壌等に、抗変異原性剤を直接、または有機溶剤または水に溶解するなどして、溶液にして散布することができる。また汚染された湖沼、河川、海水にも使用することができる。この場合、対象となる水に直接混ぜても良いし、溶液にして混合しても良い。本発明の抗変異原性剤は、糖とカルボン酸がエステル結合で結合した化合物であるので、環境においても無害である。
【実施例】
【0149】
以下、実施例を示して本発明をさらに詳細に説明する。
【0150】
実施例1
ヤマブシダケからの新規糖アルコールエステルの抽出
図1に手順に従って、乾燥ヤマブシダケから抽出物から各分画を得た。
【0151】
すなわち、乾燥ヤマブシタケ1.6kgを酢酸エチルを用いて加熱還流にて抽出操作を8時間行い、ヤマブシタケの酢酸エチル抽出物を30g得た。
【0152】
得られた酢酸エチル抽出物をシリカゲルカラムクロマトグラフィーにより分画操作を行い、新規糖アルコールエステルである化合物1〜3をそれぞれの収量で得た。(図1)
得られた化合物1〜3の構造決定
化合物1〜3の構造を決定する目的で、IR、1H−NMR及び13C−NMR、比旋光度を測定した。各種解析結果を、図2〜図4に示す。
【0153】
各種スペクトル測定を行った結果、得られた化合物は、全て新規化合物であり、糖アルコールであるエリスリトールがエステルとなったエリスリトール−1−アセテート(化合物1)、糖アルコールであるD−アラビトールがエステルとなったD−アラビトール−1−アセテート(化合物2)であることを決定した。また化合物3に関しても化合物2と同様にD−アラビトールがリノール酸とエステル結合したD−アラビトール−1−リノレートであることを決定した。
【0154】
化合物1〜3を構成する糖アルコールの種類及び立体については、それぞれの化合物を加水分解し、得られた糖アルコールを1H−NMR測定及び比旋光度測定することにより、化合物1では、エリスリトール、化合物2及び3では、D−アラビトールであることを確認した。IR(赤外線吸収)スペクトルの測定には、日本分光株式会社製のJASCO FT/IR−470 plus Fourier transform infrared spectrometerを使用した。
【0155】
NMRスペクトルの測定には、JEOL FX−500(500MHz,1H;125MHz,13C)、JEOR FX−700(700MHz,1H;175MHz,13C)spectrometerを使用した。DMSO−d6及びD2O−d6中にて測定し、DMSOにおいてはテトラメチルシラン(TMS)をD2O−d6においては3−(トリメチルシリル)−1−プロパンスルホン酸ナトリウム(DSS)を標準物質として使用した。多重度は、DEPT pulse sequenceにより決定した。
【0156】
比旋光度は、日本分光株式会社製 JASCO DIP−1000を使用した。
【0157】
実施例2
(1)化合物1(化合物(Ia))
メソ−エリスリトール(1.2g、10mmol)及び炭酸水素ナトリウム(2.7g、32mmol)を水20mlに溶解させ、その後、無水酢酸(6.7ml、72mmol)加え、常温にて2時間攪拌する。その後、水を減圧下にて概ね除去し、反応によって生成した酢酸を炭酸水素ナトリウム飽和溶液にて中和する。再度、水を除去し、アセトンを用いて反応器内の生成物を抽出する。アセトンに抽出された抽出物をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=6:1)にて精製し、収率31.7%で無色のオイル状のエリスリトール−1−アセテート(511mg)を得た。
【0158】
(2)化合物2(化合物(Ib−1))
D−アラビノース(2.0g,13.3mmol)、トリチルクロライド(4.0g、14.6mmol、トリエチルアミン(3.22ml,23.85mmol)、ジメチルアミノピリジン(80.5mg、0.66mmol)をDMF(4.0ml)に溶解させ18時間室温にて攪拌する。反応溶液を水に注ぎ、酢酸エチルにて抽出し、得られた有機層を5%塩酸、5%炭酸水素ナトリウム、及び水にて洗浄し、溶媒を減圧下にて除去し、5−O−トリチル−D−アラビノース(1.55g、収率29.6%)を得た。
【0159】
得られた5−O−トリチル−D−アラビノース(1.55g、3.95mmol)をエタノール(25ml)に溶解させ、0℃の条件下で、NaBH4(127mg、3.36mmol)を少量ずつ加え30分攪拌する。その後、溶媒を除去し黄色の固体を得た。得られた黄色の固体をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=9:1)にて精製し5−O−トリチル−D−アラビトール(1.4g、90.0%).を得た。
【0160】
得られた5−O−トリチル−D−アラビトール(1.4g、3.55mmol)、無水酢酸(335mL、3、55mmol)、を塩化メチレン(50ml)に溶解させ、ジメチルアミノピリジン(36mg、0.36mmol)を加え室温にて18時間攪拌した。その後、溶媒を除去し薄黄色の1−アセチル−5−O−トリチル−D−アラビトールの固体を得た。得られた結晶をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=9:1)にて精製し1−アセチル−5−O−トリチルl−D−アラビトール(486mg、31.4%)を得た。
【0161】
更に1−アセチル−5−O−トリチルl−D−アラビトール(486mg、1mmol)5mlの塩化メチレンに溶解させ、p−トルエンスルホン酸一水和物(3.3mg、0.017mmol)を加え、室温にて30分攪拌した。その後、溶媒を除去し薄黄色の固体を得た。得られた薄黄色の固体をアセトンにて洗浄し、濾過した。得られ白色の残査をヘキサン及びアセトンの混合溶媒にて結晶化させ、白色のD−アラビトール−1−アセート固体(132.7mg)を得た。
【0162】
(3)化合物3(化合物(Ib−2))
D−アラビノース(2.0g、13.3mmol)、トリチルクロライド(4.1g、14.7mmol)、トリエチルアミン(3.32ml、24.0mmol)、ジメチルアミノピリジン(81.0mg、0.67mmol)をTHF(20.0ml)に溶解させ、室温にて1時間攪拌させた。反応液を水に注ぎ、酢酸エチルにて抽出した。得られた有機層を水にて洗浄し、溶媒を除去し、5−O−トリチル−D−アラビノース(2.00g、収率38.0%)を得た。
【0163】
5−O−トリチル−D−アラビノース(2.00g、5.1mmol)をメタノール(25ml)及びエタノール(7ml)の混合溶媒に溶解させ、0℃の条件下で、NaBH4(94mg、2.6mmol)を少量ずつ加え30分攪拌した。その後、溶媒を除去し黄色の固体を得た。得られた黄色の5−O−トリチル−D−アラビトール固体をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=9:1)にて精製し5−O−トリチル−D−アラビトール(1.29g、64.0%)を得た。
【0164】
得られた5−O−トリチル−D−アラビトール(500mg、1.27mmol)、リノレオイルクロリド(490mL、1.52mmol)をジクロロメタン(15ml)に溶解し、ジメチルアミノピリジン(8mg、0.065mmol)を加え、室温にて18時間攪拌した。その後、溶媒を除去し薄黄色の固体を得た。得られた固体をシリカゲルカラムクロマトグラフィー(塩化メチレン:メタノール=9:1)にて精製し1−リノレオイル−5−O−トリチル−D−アラビトール(396mg、47%)を得た。
【0165】
さらに1−リノレオイル−5−O−トリチル−D−アラビトール(486mg、1mmol)を酢酸エチル(4ml)と蟻酸(2ml)の混合溶媒に加え室温にて30分攪拌した。反応液を水(10ml)で希釈し、飽和炭酸水素ナトリウム水溶液にて中和し、酢酸エチルにて抽出を行い、溶媒除去後、残査をシリカゲルカラムクロマトグラフィー(酢酸エチル:アセトン=4:1)にて精製しD−アラビトール1−リノレート(200mg、収率58%)を白色の固体として得た。さらにヘキサンとアセトンの混合溶媒にて結晶化させた。
【0166】
実施例3
抗変異原特性試験
さらに上記3種類の化合物について抗変異原特性試験を実施した。
変異原物質としては、3−アミノ−1,4−ジメチル−5H−ピリド[4,3−b]インドール(Trp−p−1)を用い、菌株としては、Salamonella typhimurium TA 1535/psk 1002を用いた。試験方法の概略を以下に説明する。
【0167】
LB培地(トリプトン1%、酵母エキス0.5%、食塩0.5%)にて37℃で一夜培養した試験菌液を、TGA培地(Bacto トリプトン1%、食塩0.5%、グルコース0.2%に20mg/Lのアンピシリンを加えたものに1/50量植菌し、37℃で振とう培養した。その後、菌濃度が対数増殖期(A600が0.25〜0.30)に達したとき、菌液とS−9mixをそれぞれ850μL、150μLずつ試験管にとり、これに変異原物質と図5のグラフに示された各濃度となる量の抽出物を加えて、37℃で2時間培養した。尚、変異原物質の添加量は、3.3μg/mL DMSO溶液を10μLとした。
【0168】
β−ガラクトシダーゼ活性の測定は、Z緩衝液(Na2HPO4 21.50g、NaH2PO4・H2O 6.21g、KCl 0.75g、MgSO4・7H2O 0.246gを500mlの蒸留水に溶解させ、pH7.0に調製した。)0.9mLに上記試験菌液0.1mLを加えた後、0.1%のドデシル硫酸ナトリウム水溶液50μL及びクロロホルムμLを加え強く攪拌した。その液に基質(o−ニトロフェニル−β−D−ガラクトピラノシド4mg/mL)0.1mLを加え、28℃で反応させた。そして20分後に1M Na2CO3を0.5mL加えて反応を止め、分光光度計で420、550、600nmで測定した。それぞれの吸光度をA420、A550及びA600で表す。
【0169】
ここで、β−ガラクトシダーゼ活性値は、次式により算出した。
【0170】
β−ガラクトシダーゼ活性値(unit)
=1000(A420−1.75×A550)/1.5×A600
また、SOS反応抑制率は、次式により算出した。
SOS反応抑制率(%)
=[1−(A−C/(B−C))×100
但し、上式中Aは変異原物質に各抽出物を加えた場合のβ−ガラクトシダーゼ活性値を、Bは変異原物質のみにより誘導されたβ−ガラクトシダーゼ活性値を、Cはコントロールのβ−ガラクトシダーゼ活性値をそれぞれ示す。尚、コントロールには同量のDMSOを使用した。また、各試験は試行を1組として行い、その平均をとった。
【0171】
結果を図5に示す。
【0172】
化合物1、2については、濃度依存的に抑制効果が確認された。特に、化合物3については、100μMで86%抑制し、50%阻害濃度としては、30.3μMであった。このことよりヤマブシタケに含有する新規糖アルコール化合物は、変異原抑制作用を有しており、抗変異原性剤として有用であることが示された。
【特許請求の範囲】
【請求項1】
一般式(I)で表される化合物:
【化1】

(式中、nは0または1、Rは、アルカノイル基又はアルケノイル基を示す)。
【請求項2】
一般式(Ia)で表される請求項1に記載の化合物:
【化2】

(式中、Rは、前記に同じ)。
【請求項3】
一般式(Ib)で表される請求項1に記載の化合物:
【化3】

(式中、Rは、前記に同じ)。
【請求項4】
請求項1〜3のいずれか1項に記載の化合物を有効成分として含有する抗変異原性剤。
【請求項5】
ヤマブシダケ(Hericium erinaceum)の抽出物を有効成分とする抗変異原性剤。
【請求項6】
抽出溶媒がメタノール、エタノール、塩化メチレン及び酢酸エチルからなる群より選ばれる少なくとも1種である請求項5に記載の抗変異原性剤。
【請求項7】
請求項4〜6のいずれか1項に記載の抗変異原性剤を有効成分として含有する食品添加剤。
【請求項8】
請求項7に記載の食品添加剤を添加した食品。
【請求項9】
請求項4〜6のいずれか1項に記載の抗変異原性剤を有効成分として含有する化粧品添加剤。
【請求項10】
請求項9に記載の化粧品添加剤を添加した化粧品。
【請求項1】
一般式(I)で表される化合物:
【化1】

(式中、nは0または1、Rは、アルカノイル基又はアルケノイル基を示す)。
【請求項2】
一般式(Ia)で表される請求項1に記載の化合物:
【化2】

(式中、Rは、前記に同じ)。
【請求項3】
一般式(Ib)で表される請求項1に記載の化合物:
【化3】

(式中、Rは、前記に同じ)。
【請求項4】
請求項1〜3のいずれか1項に記載の化合物を有効成分として含有する抗変異原性剤。
【請求項5】
ヤマブシダケ(Hericium erinaceum)の抽出物を有効成分とする抗変異原性剤。
【請求項6】
抽出溶媒がメタノール、エタノール、塩化メチレン及び酢酸エチルからなる群より選ばれる少なくとも1種である請求項5に記載の抗変異原性剤。
【請求項7】
請求項4〜6のいずれか1項に記載の抗変異原性剤を有効成分として含有する食品添加剤。
【請求項8】
請求項7に記載の食品添加剤を添加した食品。
【請求項9】
請求項4〜6のいずれか1項に記載の抗変異原性剤を有効成分として含有する化粧品添加剤。
【請求項10】
請求項9に記載の化粧品添加剤を添加した化粧品。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−91633(P2013−91633A)
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願番号】特願2011−236346(P2011−236346)
【出願日】平成23年10月27日(2011.10.27)
【出願人】(000125347)学校法人近畿大学 (389)
【出願人】(505249193)株式会社太陽統合医療開発 (3)
【Fターム(参考)】
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願日】平成23年10月27日(2011.10.27)
【出願人】(000125347)学校法人近畿大学 (389)
【出願人】(505249193)株式会社太陽統合医療開発 (3)
【Fターム(参考)】
[ Back to top ]

