新規微生物および新規微生物を用いた化合物の製造方法
【課題】鉄イオンと高い結合能を有し、鉄イオンが水溶液中で安定して存在することを補助する新規化合物を生産する新規微生物および当該微生物の製造方法を提供する。
【解決手段】下記式の化合物(I)および(II)を生産する能力を有する微生物YM5-799株(NITE AP-480)、並びに、式(I)および(II)の化合物の製造法。

【解決手段】下記式の化合物(I)および(II)を生産する能力を有する微生物YM5-799株(NITE AP-480)、並びに、式(I)および(II)の化合物の製造法。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、シデロフォアと総称される三価鉄イオンと高い結合能を有する化合物の1つである、新規な化合物を生産する能力を有する新規な微生物、および、その微生物を用いた前記新規な化合物を製造する方法に関する。
【背景技術】
【0002】
鉄はほとんどの生物にとって必須の元素である。鉄は、地球において最も豊富に存在する元素ではあるものの、酸素の存在下で容易に2価イオンから3価イオンに酸化され、この3価の鉄イオンは、中性あるいはアルカリ性において、生物が利用することができない難溶性の塩を生じる。このような鉄イオンの性質が、生物が鉄イオンを摂取することを困難にしている。
【0003】
そこで、多くの微生物は、環境中にわずかに存在する鉄イオンを取り込むために、シデロフォアと呼ばれる3価の鉄イオンと高い親和力を有する比較的低分子の有機化合物を分泌し、分泌されたシデロフォアは、環境中に微量に存在する3価の鉄イオンと結合し、鉄−シデロフォア複合体を形成する。この複合体は、そのシデロフォアに特異的な外膜レセプターを介して細胞内にとりこまれ、取り込まれた複合体から、シデロフォアの加水分解あるいは鉄を2価に還元するような酵素によって、鉄が複合体からはずれ、微生物に利用される。このようにある種の微生物はシデロフォアを分泌することによって水中の微量な鉄イオンを効果的に取り込むことを可能にしている。
【0004】
また、微生物、特に病原菌のシデロフォアの産生は宿主への感染と病原性の発現に深く関与していることから、病原菌のシデロフォア産生はよく研究され多くのシデロフォアが単離・構造決定されている(非特許文献1参照)。ある種の微生物にとっては、特定のシデロフォアしか利用することができず、他のシデロフォアによって生育が抑制されることも考えられ、シデロフォアを抗菌剤として用いようとする考え方がある(非特許文献2参照)。また、シデロフォアのなかでも、ストレプトマイセス属をはじめとする数種の放線菌の菌株が産生するデフェロキサミンBのように鉄排出薬として実用化されているものもある(非特許文献3参照)。
【0005】
さらに、海洋環境、特に光合成に必要な太陽光線が届く表層域においては、溶存酸素によって鉄イオンは速やかに3価に酸化され、鉄イオンが水酸化鉄として沈降してしまうためその濃度が極めて低くなり、そのために、海洋における炭酸ガス吸収の主体たる植物プランクトン等の海洋生物の生育が抑制されていることが知られており(非特許文献4参照)、海洋の表層域における鉄イオン濃度を高めることができれば、海洋環境における植物プランクトンの光合成能力を高めることができ、その結果として、海洋の炭酸ガス固定能を増強でき、地球温暖化対策の一助となる。
【0006】
【非特許文献1】山本重雄:ファルマシア、第31巻6号、588頁(1995年)
【非特許文献2】Ward, C. Gillon, The Journal of Trauma: Injury, Infection, and Cinical Care, Vol. 41, No.2, pp 356-361 (1996)
【非特許文献3】Bullen, J. J., European Journal of Clinical Microbial Infection Dis., 10, 613 (1991)
【非特許文献4】Price, N. L., Morel, F. M. M., Biological cycling of iron in the ocean. In Metal Ions in Biological Systems, Shigel, A., Shigel, H., Eds.; Marcel Dekker Inc.: New York, 1998; Vol. 35, pp 1-36.
【非特許文献5】Schwyn, B. and Neilands, J.B., Analytical Biochemistry, 160(1), 47 (1987)
【発明の開示】
【発明が解決しようとする課題】
【0007】
しかしながら、海洋環境中の鉄イオン濃度を高めることができる化合物は今まで殆ど知られておらず、更には、そのような化合物を生産することができる微生物についても今まで知られていなかった。本発明は、鉄と高い結合能を有して海洋環境中の鉄イオン濃度を高めることが可能な化合物を生産する新規な微生物、および、その微生物を利用して海洋環境中の鉄イオン濃度を高めることが可能な化合物を製造する方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者は、海中の藻類およびアマモから得られた多数の微生物から、CAS(Chrome azurol S)アッセイを実施して、シデロフォア生産能を有する微生物を1株得ることができた。検討の結果、当該微生物はストレプトマイセス属に属する新規な微生物であることが判り、且つ、当該微生物菌株の培養液から得られた化合物が、鉄イオンと高い結合性を有し、三価鉄イオンが水溶液中に安定して存在することを補助する特性を有する新規な化合物であることを見出し、本発明を為すに至った。
【0009】
尚、CASアッセイとは、シデロフォアの存在を判定する方法であり、例えば、非特許文献5に記載されている。CASは、鉄イオンと結合すると特徴的な呈色をする色素化合物であり、CASを含んだ溶液にシデロフォアのような鉄結合能の高い化合物を添加するとシデロフォアはCAS-鉄複合体から鉄イオンを奪い取り、その結果、CAS-鉄複合体に特徴的な呈色が解消することから、判定することができる。つまり、この評価方法は海水中でのシデロフォアと三価鉄イオンとの結合能を反映していると考えられる。
【0010】
本発明の要旨は、以下の通りである。
(1)下記の式(I):
【化1】

および下記の式(II):
【化2】

で表される化合物並びに/またはそれらの塩を生産する能力を有する微生物ストレプトマイセス・スピーシーズYM5-799株(NITE AP-480)に関する発明である。
【0011】
(2)また、本発明は、当該微生物を培地に培養し、培養物中に上記の化合物を生成蓄積させた後、該培養物から上記の化合物を採取することを特徴とする式(I)および式(II)の化合物並びに/またはそれらの塩の製造法に関する。
【0012】
(3)さらに、本発明は、このようにして製造された式(I)および式(II)の化合物並びに/またはそれらの塩を、カラムクロマトグラフィーおよび/または高速液体クロマトグラフィーを用いて分離し、式(I)の化合物および/またはその塩を得ることを特徴とする式(I)の化合物および/またはその塩の製造方法に関する。
【0013】
(4)更にまた、本発明は、上記のようにして製造された式(I)および式(II)の化合物並びに/またはそれらの塩を、カラムクロマトグラフィーおよび/または高速液体クロマトグラフィーを用いて分離し、式(II)の化合物および/またはそれらの塩を得ることを特徴とする式(II)の化合物および/またはそれらの塩の製造方法に関する。
【発明の効果】
【0014】
本発明により、鉄イオンと高い結合能を有する新規な化合物を生産する新規な微生物を提供できる。また、当該新規な微生物を用いて、鉄イオンと高い結合能を有する新規な化合物を製造することができる。更にまた、製造した新規な化合物は、海洋環境中の鉄イオン濃度を向上させる藻類の成長促進剤等の海洋環境改質剤や、抗菌剤や、鉄排出剤として有用である。
【0015】
また、微生物そのものを微生物製剤として利用可能である。
【発明を実施するための最良の形態】
【0016】
以下に本発明を詳細に説明する。
(1)本発明の微生物
本発明の微生物は、ストレプトマイセス属に属するストレプトマイセス・スピーシーズYM5-799株であり、独立行政法人製品評価技術基盤機構特許微生物寄託センター(千葉県木更津市かずさ鎌足2−5−8)に、平成20年1月24日付で受託番号NITE AP-480として寄託されている。
【0017】
当該菌株は、北海道沿岸域より採取した藻類およびアマモを、滅菌海水中で破砕し、マリンブロス寒天培地に塗布し、7日間培養して得た約300株の細菌の中から、非特許文献5に記載のCAS(Chrome azurol S)アッセイによってシデロフォアの生産能力を評価し、式(I)および式(II)の化合物の生産能力があることを確認して得られた菌株である。
【0018】
本発明のストレプトマイセス・スピーシーズYM5-799株の菌学的性質は以下のとおりである。
【0019】
a.形態的及び培養的性質
1)胞子の有無 :有り
2)気菌糸の形状 分岐あり。幅 0.8-1.0mm。
3)運動性の有無 :無し
4)ISP培地 No.2 平板培養 :コロニーサイズ 直径1-2 mm。コロニー表面の形状 紋縞状。色調 表面(気菌糸)褐色、裏面(基生菌糸)褐色。褐色水溶性色素産生。
5)ISP培地 No.3 平板培養 :生育する。表面:灰色、裏面:灰色。
6)ISP培地 No.4 平板培養 :生育する。表面:灰色、裏面:灰色。
7)ISP培地 No.5 平板培養 :生育する。表面:灰色、裏面:灰色。
【0020】
b.生理・生化学的性質(+:陽性、−:陰性)
1)ゼラチンの液化:−
2)デンプンの加水分解:+
3)硝酸還元反応:+
4)脱脂粉乳のペプトン化・凝固:−
5)生育温度の範囲:20〜30℃ 生育する。37℃ 生育しない。
6)耐塩性:1〜4% 生育する。5% 生育しない。
7)炭素源の利用性
ISP培地No.9(陰性コントロール) :−
グルコース(陽性コントロール) :+
L-ラムノース :−
D-マンニトール :+
D-フラクトース :+
L-アラビノース :−
ラフィノース :−
シュクロース :−
D-キシロース :−
イノシトール :−
8)メラニン様色素の生成
ISP培地No.6 :+
ISP培地No.7 :−
9)16S rDNA配列 配列表(配列番号1)に示す。
【0021】
この配列をもとにDDBJ(日本DNAデータバンク)の塩基配列データベースに対しての相同性検索(BLAST検索)を行ったところストレプトマイセス・スピーシーズ(Streptomyces sp.)AR17 (EF672649.1)が最も高い相同性(99%)を示したが、完全に一致する配列は確認されなかったことから、これまでに報告のない新規の微生物であった。なお、最も高い相同性を示したストレプトマイセス・スピーシーズAR17株がシデロフォアを生産するとする報告はない。
【0022】
(2)微生物の培養
本発明に係る微生物の培養は、通常の微生物の培養方法が用いられる。培地としては、資化可能な炭素源、窒素源、無機物および必要な生育・生産促進物質を適宜含有する培地であれば、合成培地又は天然培地のいずれでも使用可能である。炭素源としては、グルコース、澱粉、デキストリン、マンノース、フラクトース、シュクロース、ラクトース、キシロース、アラビノース、マンニトール、糖蜜などを単独又は組み合わせて用いることができる。さらに、必要に応じて炭化水素、アルコール類、有機酸、アミノ酸(トリプトファン等)なども用いることができる。窒素源としては塩化アンモニウム、硫酸アンモニウム、硝酸アンモニウム、硝酸ナトリウム、尿素、ペプトン、肉エキス、酵母エキス、乾燥酵母、コーン・スチープ・リカー、大豆粉、綿実かす、カザミノ酸などを単独又は組み合わせて用いることができる。そのほか、必要に応じて食塩、塩化カリウム、硫酸マグネシウム、炭酸カルシウム、リン酸二水素カリウム、リン酸水素ニカリウム、硫酸第一鉄、塩化カルシウム、硫酸マンガン、硫酸亜鉛などの無機塩類を加えることができる。さらに使用する微生物の生育や本発明の化合物の生産を促進する微量成分を適当に添加することができ、当業者であればそのような成分として適当なものを選択することができる。
【0023】
培養法としては、液体培養が適しているが、これに限定されるものではない。培養温度は、25〜37℃が適当であり、培養中の培地のpHは7〜9に維持することが望ましく、振盪速度が30〜120rpmで回転又は往復振盪培養することが望ましい。液体培養で通常5〜14日間培養を行うと、目的化合物が培養液中に生成蓄積される。通常は、培養物中の生成量が最大に達した時に培養を停止する。
【0024】
(3)化合物の製造方法
培養物からの本発明の化合物の製造方法(単離・精製)は、微生物代謝生産物を培養物から単離・精製するために常用される方法に従って行われ得る。ここで、「培養物」とは、培養上清、培養菌体、又は菌体の破砕物のいずれをも意味するものである。例えば培養物を濾過や遠心分離により培養濾液と菌体に分け、菌体を適当な溶媒で抽出する。また培養濾液は酢酸エチル、クロロホルムなどで抽出することができる。また、合成吸着剤等を用いて化合物を抽出することもできる。ついで、菌体抽出液、培養濾液若しくは培養濾液の抽出物をそれぞれ単独で又はそれらの2種以上を合わせて濃縮し、カラムクロマトグラフィー、分取薄層クロマトグラフィー、高速液体クロマトグラフィーなどにより精製を行い、本発明の化合物を得ることができる。得られた化合物は、NMR解析等の通常の化学的手法により、上記「式(I)の化合物、および式(II)の化合物の性質」に記載した性質を示すか否かを調べることにより、本発明の化合物であることを確認することができる。
【0025】
また、式(I)の化合物と式(II)の化合物は、分子量や極性が異なるため常法に従って逆相カラムを用いた高速液体クロマトグラフィー(HPLC)にて分離することができる。
【0026】
例えば、式(I)の化合物と式(II)の化合物を含む上記抽出物をHPLCにて精製し、分画してシデロフォアを含む画分を集め、CASアッセイを行ってシデロフォアの活性を測定し、(I)のシデロフォアにピークを有する画分や、(II)のシデロフォアにピークを有する画分を回収すればよい。より純度の高い化合物を得るためには、一度回収した画分を更にHPLCにて精製し、分画後、画分を回収することを繰り返せば良い。
【0027】
(4)医薬品としての利用
本発明の化合物もしくはその塩は、非特許文献2に記載されたような抗菌剤や非特許文献3に記載されたような鉄排出薬として利用することができる。
【0028】
本発明の化合物は、用途に応じて塩の形態とすることができる。塩の形態としては、例えば、塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、酢酸塩、メタンスルホン酸塩、トルエンスルホン酸塩、クエン酸塩等が挙げられ、塩の形態を変更することによって水溶性や脂溶性といった溶媒に対する溶解性を改善することができる。
【0029】
(5)微生物製剤としての使用
前述のごとく、培養法によってシデロフォアを生産する微生物を大量培養し、その培養物からシデロフォア活性を有する化合物を精製することができるが、医学品以外の用途で当該化合物を使用する場合にあっては、高度な精製をすることなく、微生物そのものもしくは微生物を混合した担体を施用し、適用場において製造させることができる。
【0030】
例えば、シデロフォアを生産する微生物を、前記した培養方法で培養した培養物を得、土壌や腐植土などの担体と混合して微生物製剤を調製することができる。前記培養物と前記担体を混合し、数時間から数日間にわたって、混練もしくは静置して、シデロフォアを生産する微生物を馴致、培養する。培養温度は、増殖を活性化するために25〜37℃が適当であり、乾燥せぬように湿潤状態を保持する。
【0031】
以上のように調製したシデロフォア生産菌を含有した微生物製剤を農地に施用することによってそこに生育する植物の鉄分取り込みを促進することができ、また、当該微生物製剤を沿岸域の水底に埋設もしくは敷設することによって、周辺海域の生物利用性の鉄分の供給が促進し、海藻類の成長が加速させることができる。
【0032】
(6)海洋環境改質剤としての利用
本発明の化合物もしくはその塩、あるいは、本発明の化合物を含有した粗精製物と、鉄分を含有した担体との混合物を海洋環境改質剤として利用することができる。
【0033】
本発明の化合物を含有した粗精製物は、本発明の化合物を生産する微生物菌株を適切な培養培地で培養して得た、培養上清、培養ろ液、培養菌体、又は菌体の破砕物などの培養物、または、該培養液から適切な方法でシデロフォアを含む画分を抽出した抽出物をそれぞれ単独で又は2種以上合わせて用いることができる。本発明の化合物もしくはその塩、あるいは本発明の化合物を含有した粗精製物は乾燥粉末として利用することができるが、後述の担体と混合した方がより均質に混ぜることができるため、溶液として利用したほうが好ましい。
【0034】
鉄分を含有した担体は、鉄粉、鉄片、鉄鋼スラグ、腐葉土、腐植土をそれぞれ単独で又は2種類以上合わせて用いることができる。
【0035】
本発明の化合物もしくはその塩、あるいは、本発明の化合物を含有した粗精製物と、鉄分を含有した担体との混合物は、適切な容器に充填して、海洋環境を改善したい海域に沈設もしくは埋設することによって、該混合物から海水中に鉄分とシデロフォアが放出され、周辺の海域のおける鉄濃度、特に生物利用性の鉄濃度が高まるため、海藻類の成長を加速することができる。なお、該混合物を充填する容器は、該混合物を保持でき、かつ、該混合物から溶出する鉄分や本発明の化合物が海水中に放出される機能があれば特に限定されるものではないが、例えば、布製や網製の袋、鋼製の籠、壁面に小孔を有する鋼製やコンクリート製の箱などが挙げられる。
【実施例】
【0036】
以下に本発明を実施例により具体的に説明する。ただし、本発明はこれら実施例によりその技術的範囲が限定されるものではない。
【0037】
(実施例1)
北海道沿岸域より採取した藻類およびアマモを滅菌海水中で破砕し、その破砕物をマリンブロス寒天培地に塗布し、7日間培養して約300株の細菌を得た。これらの細菌株について、前記したCASアッセイを実施して、シデロフォア生産能を有する細菌株を1株得た。
【0038】
当該菌株のDNAを抽出して、16S rDNA塩基配列を解析した。すなわち、インスタジーンDNA精製マトリックスを用いて当該菌株のゲノムDNAを抽出し、16S rDNA断片をPCRにて増幅した。PCRプライマーとして、16S rDNA増幅用のユニバーサルプライマー、27F (5'- GGC TAC CTT GTT ACG ACT T -3’)(配列番号2)および1492R (5'-AGA GTT TGA TCC TGG CTC AG -3’)(配列番号3)を用いた。サンプルあたりの反応液の容量は25 μl、PCR用の酵素は、LA Taq polymerase (TaKaRa Biochem)を用いた。反応液の組成は、DNA 1 μl, 10 x LA buffer 2.5 μl, 25 mM MgCl2 2.5μl, dNTP Mixture 2.0 μl, 25 μM プライマー 0.25 μl, 酵素 0.1 μlで、PCR増幅は、95℃、1分、58℃、1分、72℃、1分30秒のサイクルを30回繰り返して行った。PCR反応には96サンプル用サーマルサイクラー(Techne社製、Genius)を用いた。増幅産物をMontage PCR96 (ミリポア社)を用いて精製し、塩基配列を決定した。16S rDNA断片の部分配列は、16 S rDNA用のユニバーサルプライマー、341F (5'- CTC CTA CGG GAG GCA GCA G -3’)を用いてPCR反応を行い、キャピラリーシーケンサーPE3730を用いて塩基配列を決定した。得られた塩基配列データは塩基配列編集用ソフトSeqED上で、目視によって確認した。得られた配列は、DDBJデータベースにてBLAST検索を行った。その結果、当該菌株は全く新規のものであり、ストレプトマイセス・スピーシーズYM5-799株と命名した。
【0039】
(実施例2)
ストレプトマイセス・スピーシーズYM5-799株の培養を以下の様に行った。本菌株を200 mLのマリンブロス培地を入れた1 Lバッフル付き三角フラスコ中で、30 ℃にて5日間回転震盪(100 rpm)培養して種菌とした。2 Lのバッフル付三角フラスコ1本あたり、生産培地(ASG培地:カザミノ酸 5 g/L、グリセリン 3 mL/L、グリセロリン酸 0.1 g/L、塩化ナトリウム 15.5 g/L、塩化カリウム 0.8 g/L、硫酸マグネシウム・七水和物 12.4 g/L、塩化カルシウム・二水和物 2.9 g/L、塩化アンモニウム 1.0 g/L、HEPESナトリウム塩 2.6 g/L、炭酸水素ナトリウム 0.17 g/L、塩化鉄0.01 μM (滅菌前pH 6.8))1 Lを入れ、オートクレーブにて滅菌したフラスコ各々(計10本、10 L)に、あらかじめ培養した種菌を10 mL接種し、30 ℃にて10日間、振盪培養(100 rpm)を行った。培養中、pHは特に制御しなかった。
【0040】
培養物からのシデロフォアの精製は以下の様に行った。精製はシデロフォアと三価鉄イオンとの結合能評価に用いられるCAS (Chrome azurol S)アッセイ[Schwyn, B. and Neilands, J. B. : Analytical Biochemistry, Vol. 160, 47-56 (1987)]を指標に行った。培養物を遠心分離(6000 xg, 4 ℃, 20 min)により菌体と上清を分離した。分離した上清のpHを塩酸にてpH 3に調整し、芳香族系合成吸着樹脂HP20樹脂(三菱化学社製)を2 L加え、4 ℃に24時間放置した。ガラスフィルター(3G)を用いて樹脂を濾過し、瀘別した樹脂は、塩酸にてpH 3に調整した超純水10 Lで洗浄した。洗浄したHP20樹脂をビーカーに移し、5 Lのメタノールに24時間浸漬した。次に、グラスフィルターを用いて、メタノールと樹脂を濾別し、得られたメタノール溶液をエバポレーターを用いて減圧濃縮し、12 gの褐色固形物を得た。
【0041】
次に、LH-20樹脂を用いたカラムクロマトグラフィーを行った。内径3 cm、長さ80 cmのガラスカラムに、あらかじめ50%メタノール−超純水で膨潤したLH-20樹脂(アマシャム・ファルマシア社製)150 gをつめ、平衡化後、先の褐色固形物12 gを5 mlの50 %メタノール−超純水に溶解したものをロードし、50 %メタノール−超純水にて溶出を行った。20 mLずつ分画をおこない、CASアッセイにて鉄キレーターの存在する画分を検出した。鉄キレーターを含む画分を集め、エバポレーターにて減圧濃縮後、凍結乾燥を行い、淡褐色固形物680 mgを得た。
【0042】
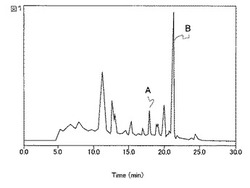
次に、逆相カラムを用いた高速液体クロマトグラフィー(HPLC)にて精製を行った。カラムにコスモシール5C18-AR-II(内径20 mm、長さ250 mm)を用い、移動相としては、45%メタノール−超純水を用い、10 mL/minの流速で分画を行った。2分(20 mL)ごとに分画をおこない、CASアッセイを行い、シデロフォアを含む画分を集め、エバポレーターにて減圧濃縮後、凍結乾燥を行い、淡黄色固形物130 mgを得た。次に、カラムに、TSK GEL ODS 80Ts(内径7.8 mm、長さ300 mm)を用い、2種類の溶媒(溶媒A:0.1 %トリフルオロ酢酸−超純水、溶媒B:0.1 % トリフルオロ酢酸−アセトニトリル)を用いたグラジエント溶出(初発の溶媒Bの濃度を10 %とし、30分後に40 %にあげる。流速2 mL/min)を行った。波長220nmの紫外吸収のチャートを図1に例示した。それぞれのピークに対応する分画を分離回収し、前述の非特許文献5に記載のCASアッセイによってシデロフォアの活性を測定したところ、図中ピークAおよびピークBについて当該活性があることが確認できた。分離同条件で繰り返し精製を行い、ピークAおよびピークBの画分を回収し、それぞれ乾燥重量にて式(I)の化合物を10 mgおよび式(II)の化合物を、20 mg得た。
【0043】
それぞれの化合物について高分解能FAB-MSにより組成式を決定し、さらに1H NMR、13C NMR、HSQC、HMBC等のNMRデータの詳細な解析により構造を決定した結果、ピークAから式(I)の化合物を、ピークBから式(II)の化合物をそれぞれ得た。
【0044】
(実施例3)
海産緑藻クロロコッカム・リトラーレ(Chlorococcum littorale)NBRC102761を用いて、式(I)の化合物および式(II)の化合物が当該単細胞藻類に対して増殖促進効果を有するかどうかを調べた。
【0045】
一般に海産の植物プランクトンは海水中の低い鉄濃度のレベル(数nM)では十分な増殖が困難であり、細胞への鉄供給が促進されると増殖も促進されることが知られている。まず基本生育培地(A5培地:硝酸ナトリウム1.5g/L、硫酸マグネシウム・七水和物0.1g/L、リン酸一カリウム35mg/L、リン酸二カリウム45 mg/L、鉄−EDTA 12mg/L、塩化カルシウム・ニ水和物9mg/L、ホウ酸70μg/L、硫酸マンガン・七水和物150 μg/L、硫酸亜鉛・七水和物 300μg/L、硫酸銅・五水和物300μg/L、モリブデン酸ナトリウム 3μg/L、塩化コバルト70μg/L、海水1L)で前培養した後、基本生育培地から鉄−EDTAを欠如させた培地(ただし培地調製に用いた海水由来の微量な鉄は存在する;以下、鉄欠乏培地という)で3日おきに2回継代培養して鉄欠乏状態の細胞(以下、鉄欠乏細胞という)を作成した。次に、鉄欠乏培地、鉄欠乏培地にデフェロキサミンBを0.1mM添加した培地、鉄欠乏培地に式(I)の化合物を0.1mM添加した培地、鉄欠乏培地に式(II)の化合物を0.1mM添加した培地をそれぞれ調製し、前記の鉄欠乏細胞を接種して、温度25℃、光強度50μmoL m-2 s-1のインキュベータ内で静置培養して増殖を調べた。
【0046】
結果を図2に示す。縦軸は培養開始時と培養44時間後のクロロフィル蛍光強度の差の平均値(n=12)を示しており、当該期間における微細藻の増殖量を意味する。バーは標準誤差(n=12)を示す。クロロフィル蛍光は蛍光分光光度計を用いて励起波長485nmとした時の蛍光波長645nmの強度を測定した。
【0047】
図2において、Aは鉄欠乏培地を用いた場合、Bは鉄欠乏培地にデフェロキサミンBを添加した培地を用いた場合、Cは鉄欠乏培地に式(I)の化合物を添加した培地を用いた場合、Dは鉄欠乏培地に式(II)の化合物を添加した培地を用いた場合におけるクロロコッカム・リトラーレのクロロフィル蛍光量の増加量をそれぞれ表す。デフェロキサミンBを添加した培地では鉄欠乏培地で認められた蛍光増加量よりも低かった。つまりデフェロキサミンBを添加すると当該の微細藻は増殖が抑制された。
【0048】
この結果は、デフェロキサミンBが培地中の微量な鉄と結合すると、微細藻はそれを摂取することができず、増殖が抑制されたと考えられる。これに対して、式(I)の化合物もしくは式(II)の化合物を添加すると鉄欠乏培地の場合よりも増殖が促進された。すなわち、式(I)の化合物及び式(II)の化合物はクロロコッカム・リトラーレによる海水からの極微量の鉄の取り込みを促進したと考えられる。つまり、本発明に係る化合物は藻類の増殖を促進する効果があることを確認した。
【0049】
(実施例4)
シデロフォアを生産する微生物を混和した担体を海岸線に沿って埋設し、海域の藻場造成に対する効果を確認した。
【0050】
ストレプトマイセス・スピーシーズYM5-799株の培養を以下の様に行った。本菌株を200 mLのマリンブロス培地を入れた1 Lバッフル付き三角フラスコ中で、30 ℃にて5日間回転震盪(100 rpm)培養して種菌とした。2 Lのバッフル付三角フラスコ1本あたり、生産培地(ASG培地:カザミノ酸 5 g/L、グリセリン 3 mL/L、グリセロリン酸 0.1 g/L、塩化ナトリウム 15.5 g/L、塩化カリウム 0.8 g/L、硫酸マグネシウム・七水和物 12.4 g/L、塩化カルシウム・二水和物 2.9 g/L、塩化アンモニウム 1.0 g/L、HEPESナトリウム塩 2.6 g/L、炭酸水素ナトリウム 0.17 g/L、塩化鉄0.01 μM (滅菌前pH 6.8))1 Lを入れ、オートクレーブにて滅菌したフラスコ各々(計10本、10 L)に、あらかじめ培養した種菌を10 mL接種し、30 ℃にて10日間、振盪培養(100 rpm)を行った。
【0051】
市販の腐植土100kg当たり前記培養液10Lを添加し、3日間通気攪拌した後に布袋に詰め、試験海域の汀線に埋設した。実施例では約1tの腐植土を用いた。比較例として、市販の腐植土100kg当たりマリンブロス培地10L添加し、3日間通気攪拌した後に布袋に詰め、試験海域の汀線で、実施例の埋設地点から100m離れた地点に埋設した。比較例では約1tの腐植土を用いた。
【0052】
実施例および比較例の資材を埋設した後、1年後および2年後に、それぞれの埋設地点近傍の海藻類の繁茂の状況と海水中の鉄濃度を調査した。海藻類の繁茂の状況は、検査地点の海底における1m四方の区画に繁茂した海草を採取し、その質重量を測定した。海水中の鉄濃度は、JIS K0102に準拠してICP発光分析法で分析した。調査結果を表2に示す。海藻繁茂状況の記号は、100g/m2未満を“―”、100g/m2以上1kg/m2未満を“+”、1kg/m2以上を“++”と表記した。
【0053】
施用前は実施例、比較例ともに海水中の鉄濃度が低く、海藻もほとんど生育していない海域であったが、施用1年後は実施例において海藻の生育が確認され、施用2年後には著しく繁茂した。海水中の鉄濃度は施用前は1.9μg/L程度であったが、施用後は10μg/L以上に増加し、施用2年後においてもその鉄濃度レベルは維持されていた。一方、比較例においては、施用1年後では海藻の生育は確認できなかったが、施用2年後には若干程度の海藻の生育が観察された。これは、海藻が繁茂した海域が、実施例の施用地点を中心にその効果域が拡大してゆき、施用2年後の時点では、実施例の効果域が比較例の施用地点にまで拡大したためである。比較例における海水中の鉄濃度は、施用前は実施例のそれと同程度の1.8μg/Lであり、施用1年後においても施用前とほとんど変わらず2.1μg/L程度であった。施用2年後は若干高まったが、これは前述のように実施例の効果域の拡大と考えられる。
【0054】
以上のように海水中の鉄濃度と海藻の繁茂の状況とは明らかに相関が観察された。鉄イオンは酸性の液中ではイオンとして溶解するが、中性もしくはアルカリ性の液中では水酸化物を形成し、沈殿を生じ、水中に溶解できない性質がある。比較例に比べて実施例においては海水中の鉄濃度が高く保持され、海藻の繁茂が顕著であった。これは、実施例のように鉄分を含んだ腐植土とシデロフォアを生産する微生物を含んだ担体を海域に施用することによって当該担体から鉄分および/または海水中の鉄イオンが、担体から供給されたシデロフォアにキレートされたために海水中に溶存態として存在する、生物利用性の高い鉄分濃度が高まり、その結果として海藻の生育が促進されたと考えられる。
【0055】
【表1】

【0056】
また、施用2年後の観察を行った後に実施例および比較例の埋設担体を採取し、滅菌海水中で分散させ、その上清をマリンブロス寒天培地に塗布し、7日間培養して得たコロニー約100個について、非特許文献5に記載のCAS(Chrome azurol S)アッセイによってシデロフォアの生産能力の有無を確認したところ、23個の分離株についてシデロフォア活性が観察された。シデロフォア活性が確認された23株についてDNAを抽出し、16S rDNAの塩基配列を調べたところ、すべてがYM5-799株と同一であった。
【図面の簡単な説明】
【0057】
【図1】本発明のシデロフォア精製過程におけるHPLCチャートの例図である。
【図2】海産緑藻の増殖に及ぼすシデロフォアの効果を調べた結果例である。
【技術分野】
【0001】
本発明は、シデロフォアと総称される三価鉄イオンと高い結合能を有する化合物の1つである、新規な化合物を生産する能力を有する新規な微生物、および、その微生物を用いた前記新規な化合物を製造する方法に関する。
【背景技術】
【0002】
鉄はほとんどの生物にとって必須の元素である。鉄は、地球において最も豊富に存在する元素ではあるものの、酸素の存在下で容易に2価イオンから3価イオンに酸化され、この3価の鉄イオンは、中性あるいはアルカリ性において、生物が利用することができない難溶性の塩を生じる。このような鉄イオンの性質が、生物が鉄イオンを摂取することを困難にしている。
【0003】
そこで、多くの微生物は、環境中にわずかに存在する鉄イオンを取り込むために、シデロフォアと呼ばれる3価の鉄イオンと高い親和力を有する比較的低分子の有機化合物を分泌し、分泌されたシデロフォアは、環境中に微量に存在する3価の鉄イオンと結合し、鉄−シデロフォア複合体を形成する。この複合体は、そのシデロフォアに特異的な外膜レセプターを介して細胞内にとりこまれ、取り込まれた複合体から、シデロフォアの加水分解あるいは鉄を2価に還元するような酵素によって、鉄が複合体からはずれ、微生物に利用される。このようにある種の微生物はシデロフォアを分泌することによって水中の微量な鉄イオンを効果的に取り込むことを可能にしている。
【0004】
また、微生物、特に病原菌のシデロフォアの産生は宿主への感染と病原性の発現に深く関与していることから、病原菌のシデロフォア産生はよく研究され多くのシデロフォアが単離・構造決定されている(非特許文献1参照)。ある種の微生物にとっては、特定のシデロフォアしか利用することができず、他のシデロフォアによって生育が抑制されることも考えられ、シデロフォアを抗菌剤として用いようとする考え方がある(非特許文献2参照)。また、シデロフォアのなかでも、ストレプトマイセス属をはじめとする数種の放線菌の菌株が産生するデフェロキサミンBのように鉄排出薬として実用化されているものもある(非特許文献3参照)。
【0005】
さらに、海洋環境、特に光合成に必要な太陽光線が届く表層域においては、溶存酸素によって鉄イオンは速やかに3価に酸化され、鉄イオンが水酸化鉄として沈降してしまうためその濃度が極めて低くなり、そのために、海洋における炭酸ガス吸収の主体たる植物プランクトン等の海洋生物の生育が抑制されていることが知られており(非特許文献4参照)、海洋の表層域における鉄イオン濃度を高めることができれば、海洋環境における植物プランクトンの光合成能力を高めることができ、その結果として、海洋の炭酸ガス固定能を増強でき、地球温暖化対策の一助となる。
【0006】
【非特許文献1】山本重雄:ファルマシア、第31巻6号、588頁(1995年)
【非特許文献2】Ward, C. Gillon, The Journal of Trauma: Injury, Infection, and Cinical Care, Vol. 41, No.2, pp 356-361 (1996)
【非特許文献3】Bullen, J. J., European Journal of Clinical Microbial Infection Dis., 10, 613 (1991)
【非特許文献4】Price, N. L., Morel, F. M. M., Biological cycling of iron in the ocean. In Metal Ions in Biological Systems, Shigel, A., Shigel, H., Eds.; Marcel Dekker Inc.: New York, 1998; Vol. 35, pp 1-36.
【非特許文献5】Schwyn, B. and Neilands, J.B., Analytical Biochemistry, 160(1), 47 (1987)
【発明の開示】
【発明が解決しようとする課題】
【0007】
しかしながら、海洋環境中の鉄イオン濃度を高めることができる化合物は今まで殆ど知られておらず、更には、そのような化合物を生産することができる微生物についても今まで知られていなかった。本発明は、鉄と高い結合能を有して海洋環境中の鉄イオン濃度を高めることが可能な化合物を生産する新規な微生物、および、その微生物を利用して海洋環境中の鉄イオン濃度を高めることが可能な化合物を製造する方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者は、海中の藻類およびアマモから得られた多数の微生物から、CAS(Chrome azurol S)アッセイを実施して、シデロフォア生産能を有する微生物を1株得ることができた。検討の結果、当該微生物はストレプトマイセス属に属する新規な微生物であることが判り、且つ、当該微生物菌株の培養液から得られた化合物が、鉄イオンと高い結合性を有し、三価鉄イオンが水溶液中に安定して存在することを補助する特性を有する新規な化合物であることを見出し、本発明を為すに至った。
【0009】
尚、CASアッセイとは、シデロフォアの存在を判定する方法であり、例えば、非特許文献5に記載されている。CASは、鉄イオンと結合すると特徴的な呈色をする色素化合物であり、CASを含んだ溶液にシデロフォアのような鉄結合能の高い化合物を添加するとシデロフォアはCAS-鉄複合体から鉄イオンを奪い取り、その結果、CAS-鉄複合体に特徴的な呈色が解消することから、判定することができる。つまり、この評価方法は海水中でのシデロフォアと三価鉄イオンとの結合能を反映していると考えられる。
【0010】
本発明の要旨は、以下の通りである。
(1)下記の式(I):
【化1】

および下記の式(II):
【化2】

で表される化合物並びに/またはそれらの塩を生産する能力を有する微生物ストレプトマイセス・スピーシーズYM5-799株(NITE AP-480)に関する発明である。
【0011】
(2)また、本発明は、当該微生物を培地に培養し、培養物中に上記の化合物を生成蓄積させた後、該培養物から上記の化合物を採取することを特徴とする式(I)および式(II)の化合物並びに/またはそれらの塩の製造法に関する。
【0012】
(3)さらに、本発明は、このようにして製造された式(I)および式(II)の化合物並びに/またはそれらの塩を、カラムクロマトグラフィーおよび/または高速液体クロマトグラフィーを用いて分離し、式(I)の化合物および/またはその塩を得ることを特徴とする式(I)の化合物および/またはその塩の製造方法に関する。
【0013】
(4)更にまた、本発明は、上記のようにして製造された式(I)および式(II)の化合物並びに/またはそれらの塩を、カラムクロマトグラフィーおよび/または高速液体クロマトグラフィーを用いて分離し、式(II)の化合物および/またはそれらの塩を得ることを特徴とする式(II)の化合物および/またはそれらの塩の製造方法に関する。
【発明の効果】
【0014】
本発明により、鉄イオンと高い結合能を有する新規な化合物を生産する新規な微生物を提供できる。また、当該新規な微生物を用いて、鉄イオンと高い結合能を有する新規な化合物を製造することができる。更にまた、製造した新規な化合物は、海洋環境中の鉄イオン濃度を向上させる藻類の成長促進剤等の海洋環境改質剤や、抗菌剤や、鉄排出剤として有用である。
【0015】
また、微生物そのものを微生物製剤として利用可能である。
【発明を実施するための最良の形態】
【0016】
以下に本発明を詳細に説明する。
(1)本発明の微生物
本発明の微生物は、ストレプトマイセス属に属するストレプトマイセス・スピーシーズYM5-799株であり、独立行政法人製品評価技術基盤機構特許微生物寄託センター(千葉県木更津市かずさ鎌足2−5−8)に、平成20年1月24日付で受託番号NITE AP-480として寄託されている。
【0017】
当該菌株は、北海道沿岸域より採取した藻類およびアマモを、滅菌海水中で破砕し、マリンブロス寒天培地に塗布し、7日間培養して得た約300株の細菌の中から、非特許文献5に記載のCAS(Chrome azurol S)アッセイによってシデロフォアの生産能力を評価し、式(I)および式(II)の化合物の生産能力があることを確認して得られた菌株である。
【0018】
本発明のストレプトマイセス・スピーシーズYM5-799株の菌学的性質は以下のとおりである。
【0019】
a.形態的及び培養的性質
1)胞子の有無 :有り
2)気菌糸の形状 分岐あり。幅 0.8-1.0mm。
3)運動性の有無 :無し
4)ISP培地 No.2 平板培養 :コロニーサイズ 直径1-2 mm。コロニー表面の形状 紋縞状。色調 表面(気菌糸)褐色、裏面(基生菌糸)褐色。褐色水溶性色素産生。
5)ISP培地 No.3 平板培養 :生育する。表面:灰色、裏面:灰色。
6)ISP培地 No.4 平板培養 :生育する。表面:灰色、裏面:灰色。
7)ISP培地 No.5 平板培養 :生育する。表面:灰色、裏面:灰色。
【0020】
b.生理・生化学的性質(+:陽性、−:陰性)
1)ゼラチンの液化:−
2)デンプンの加水分解:+
3)硝酸還元反応:+
4)脱脂粉乳のペプトン化・凝固:−
5)生育温度の範囲:20〜30℃ 生育する。37℃ 生育しない。
6)耐塩性:1〜4% 生育する。5% 生育しない。
7)炭素源の利用性
ISP培地No.9(陰性コントロール) :−
グルコース(陽性コントロール) :+
L-ラムノース :−
D-マンニトール :+
D-フラクトース :+
L-アラビノース :−
ラフィノース :−
シュクロース :−
D-キシロース :−
イノシトール :−
8)メラニン様色素の生成
ISP培地No.6 :+
ISP培地No.7 :−
9)16S rDNA配列 配列表(配列番号1)に示す。
【0021】
この配列をもとにDDBJ(日本DNAデータバンク)の塩基配列データベースに対しての相同性検索(BLAST検索)を行ったところストレプトマイセス・スピーシーズ(Streptomyces sp.)AR17 (EF672649.1)が最も高い相同性(99%)を示したが、完全に一致する配列は確認されなかったことから、これまでに報告のない新規の微生物であった。なお、最も高い相同性を示したストレプトマイセス・スピーシーズAR17株がシデロフォアを生産するとする報告はない。
【0022】
(2)微生物の培養
本発明に係る微生物の培養は、通常の微生物の培養方法が用いられる。培地としては、資化可能な炭素源、窒素源、無機物および必要な生育・生産促進物質を適宜含有する培地であれば、合成培地又は天然培地のいずれでも使用可能である。炭素源としては、グルコース、澱粉、デキストリン、マンノース、フラクトース、シュクロース、ラクトース、キシロース、アラビノース、マンニトール、糖蜜などを単独又は組み合わせて用いることができる。さらに、必要に応じて炭化水素、アルコール類、有機酸、アミノ酸(トリプトファン等)なども用いることができる。窒素源としては塩化アンモニウム、硫酸アンモニウム、硝酸アンモニウム、硝酸ナトリウム、尿素、ペプトン、肉エキス、酵母エキス、乾燥酵母、コーン・スチープ・リカー、大豆粉、綿実かす、カザミノ酸などを単独又は組み合わせて用いることができる。そのほか、必要に応じて食塩、塩化カリウム、硫酸マグネシウム、炭酸カルシウム、リン酸二水素カリウム、リン酸水素ニカリウム、硫酸第一鉄、塩化カルシウム、硫酸マンガン、硫酸亜鉛などの無機塩類を加えることができる。さらに使用する微生物の生育や本発明の化合物の生産を促進する微量成分を適当に添加することができ、当業者であればそのような成分として適当なものを選択することができる。
【0023】
培養法としては、液体培養が適しているが、これに限定されるものではない。培養温度は、25〜37℃が適当であり、培養中の培地のpHは7〜9に維持することが望ましく、振盪速度が30〜120rpmで回転又は往復振盪培養することが望ましい。液体培養で通常5〜14日間培養を行うと、目的化合物が培養液中に生成蓄積される。通常は、培養物中の生成量が最大に達した時に培養を停止する。
【0024】
(3)化合物の製造方法
培養物からの本発明の化合物の製造方法(単離・精製)は、微生物代謝生産物を培養物から単離・精製するために常用される方法に従って行われ得る。ここで、「培養物」とは、培養上清、培養菌体、又は菌体の破砕物のいずれをも意味するものである。例えば培養物を濾過や遠心分離により培養濾液と菌体に分け、菌体を適当な溶媒で抽出する。また培養濾液は酢酸エチル、クロロホルムなどで抽出することができる。また、合成吸着剤等を用いて化合物を抽出することもできる。ついで、菌体抽出液、培養濾液若しくは培養濾液の抽出物をそれぞれ単独で又はそれらの2種以上を合わせて濃縮し、カラムクロマトグラフィー、分取薄層クロマトグラフィー、高速液体クロマトグラフィーなどにより精製を行い、本発明の化合物を得ることができる。得られた化合物は、NMR解析等の通常の化学的手法により、上記「式(I)の化合物、および式(II)の化合物の性質」に記載した性質を示すか否かを調べることにより、本発明の化合物であることを確認することができる。
【0025】
また、式(I)の化合物と式(II)の化合物は、分子量や極性が異なるため常法に従って逆相カラムを用いた高速液体クロマトグラフィー(HPLC)にて分離することができる。
【0026】
例えば、式(I)の化合物と式(II)の化合物を含む上記抽出物をHPLCにて精製し、分画してシデロフォアを含む画分を集め、CASアッセイを行ってシデロフォアの活性を測定し、(I)のシデロフォアにピークを有する画分や、(II)のシデロフォアにピークを有する画分を回収すればよい。より純度の高い化合物を得るためには、一度回収した画分を更にHPLCにて精製し、分画後、画分を回収することを繰り返せば良い。
【0027】
(4)医薬品としての利用
本発明の化合物もしくはその塩は、非特許文献2に記載されたような抗菌剤や非特許文献3に記載されたような鉄排出薬として利用することができる。
【0028】
本発明の化合物は、用途に応じて塩の形態とすることができる。塩の形態としては、例えば、塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、酢酸塩、メタンスルホン酸塩、トルエンスルホン酸塩、クエン酸塩等が挙げられ、塩の形態を変更することによって水溶性や脂溶性といった溶媒に対する溶解性を改善することができる。
【0029】
(5)微生物製剤としての使用
前述のごとく、培養法によってシデロフォアを生産する微生物を大量培養し、その培養物からシデロフォア活性を有する化合物を精製することができるが、医学品以外の用途で当該化合物を使用する場合にあっては、高度な精製をすることなく、微生物そのものもしくは微生物を混合した担体を施用し、適用場において製造させることができる。
【0030】
例えば、シデロフォアを生産する微生物を、前記した培養方法で培養した培養物を得、土壌や腐植土などの担体と混合して微生物製剤を調製することができる。前記培養物と前記担体を混合し、数時間から数日間にわたって、混練もしくは静置して、シデロフォアを生産する微生物を馴致、培養する。培養温度は、増殖を活性化するために25〜37℃が適当であり、乾燥せぬように湿潤状態を保持する。
【0031】
以上のように調製したシデロフォア生産菌を含有した微生物製剤を農地に施用することによってそこに生育する植物の鉄分取り込みを促進することができ、また、当該微生物製剤を沿岸域の水底に埋設もしくは敷設することによって、周辺海域の生物利用性の鉄分の供給が促進し、海藻類の成長が加速させることができる。
【0032】
(6)海洋環境改質剤としての利用
本発明の化合物もしくはその塩、あるいは、本発明の化合物を含有した粗精製物と、鉄分を含有した担体との混合物を海洋環境改質剤として利用することができる。
【0033】
本発明の化合物を含有した粗精製物は、本発明の化合物を生産する微生物菌株を適切な培養培地で培養して得た、培養上清、培養ろ液、培養菌体、又は菌体の破砕物などの培養物、または、該培養液から適切な方法でシデロフォアを含む画分を抽出した抽出物をそれぞれ単独で又は2種以上合わせて用いることができる。本発明の化合物もしくはその塩、あるいは本発明の化合物を含有した粗精製物は乾燥粉末として利用することができるが、後述の担体と混合した方がより均質に混ぜることができるため、溶液として利用したほうが好ましい。
【0034】
鉄分を含有した担体は、鉄粉、鉄片、鉄鋼スラグ、腐葉土、腐植土をそれぞれ単独で又は2種類以上合わせて用いることができる。
【0035】
本発明の化合物もしくはその塩、あるいは、本発明の化合物を含有した粗精製物と、鉄分を含有した担体との混合物は、適切な容器に充填して、海洋環境を改善したい海域に沈設もしくは埋設することによって、該混合物から海水中に鉄分とシデロフォアが放出され、周辺の海域のおける鉄濃度、特に生物利用性の鉄濃度が高まるため、海藻類の成長を加速することができる。なお、該混合物を充填する容器は、該混合物を保持でき、かつ、該混合物から溶出する鉄分や本発明の化合物が海水中に放出される機能があれば特に限定されるものではないが、例えば、布製や網製の袋、鋼製の籠、壁面に小孔を有する鋼製やコンクリート製の箱などが挙げられる。
【実施例】
【0036】
以下に本発明を実施例により具体的に説明する。ただし、本発明はこれら実施例によりその技術的範囲が限定されるものではない。
【0037】
(実施例1)
北海道沿岸域より採取した藻類およびアマモを滅菌海水中で破砕し、その破砕物をマリンブロス寒天培地に塗布し、7日間培養して約300株の細菌を得た。これらの細菌株について、前記したCASアッセイを実施して、シデロフォア生産能を有する細菌株を1株得た。
【0038】
当該菌株のDNAを抽出して、16S rDNA塩基配列を解析した。すなわち、インスタジーンDNA精製マトリックスを用いて当該菌株のゲノムDNAを抽出し、16S rDNA断片をPCRにて増幅した。PCRプライマーとして、16S rDNA増幅用のユニバーサルプライマー、27F (5'- GGC TAC CTT GTT ACG ACT T -3’)(配列番号2)および1492R (5'-AGA GTT TGA TCC TGG CTC AG -3’)(配列番号3)を用いた。サンプルあたりの反応液の容量は25 μl、PCR用の酵素は、LA Taq polymerase (TaKaRa Biochem)を用いた。反応液の組成は、DNA 1 μl, 10 x LA buffer 2.5 μl, 25 mM MgCl2 2.5μl, dNTP Mixture 2.0 μl, 25 μM プライマー 0.25 μl, 酵素 0.1 μlで、PCR増幅は、95℃、1分、58℃、1分、72℃、1分30秒のサイクルを30回繰り返して行った。PCR反応には96サンプル用サーマルサイクラー(Techne社製、Genius)を用いた。増幅産物をMontage PCR96 (ミリポア社)を用いて精製し、塩基配列を決定した。16S rDNA断片の部分配列は、16 S rDNA用のユニバーサルプライマー、341F (5'- CTC CTA CGG GAG GCA GCA G -3’)を用いてPCR反応を行い、キャピラリーシーケンサーPE3730を用いて塩基配列を決定した。得られた塩基配列データは塩基配列編集用ソフトSeqED上で、目視によって確認した。得られた配列は、DDBJデータベースにてBLAST検索を行った。その結果、当該菌株は全く新規のものであり、ストレプトマイセス・スピーシーズYM5-799株と命名した。
【0039】
(実施例2)
ストレプトマイセス・スピーシーズYM5-799株の培養を以下の様に行った。本菌株を200 mLのマリンブロス培地を入れた1 Lバッフル付き三角フラスコ中で、30 ℃にて5日間回転震盪(100 rpm)培養して種菌とした。2 Lのバッフル付三角フラスコ1本あたり、生産培地(ASG培地:カザミノ酸 5 g/L、グリセリン 3 mL/L、グリセロリン酸 0.1 g/L、塩化ナトリウム 15.5 g/L、塩化カリウム 0.8 g/L、硫酸マグネシウム・七水和物 12.4 g/L、塩化カルシウム・二水和物 2.9 g/L、塩化アンモニウム 1.0 g/L、HEPESナトリウム塩 2.6 g/L、炭酸水素ナトリウム 0.17 g/L、塩化鉄0.01 μM (滅菌前pH 6.8))1 Lを入れ、オートクレーブにて滅菌したフラスコ各々(計10本、10 L)に、あらかじめ培養した種菌を10 mL接種し、30 ℃にて10日間、振盪培養(100 rpm)を行った。培養中、pHは特に制御しなかった。
【0040】
培養物からのシデロフォアの精製は以下の様に行った。精製はシデロフォアと三価鉄イオンとの結合能評価に用いられるCAS (Chrome azurol S)アッセイ[Schwyn, B. and Neilands, J. B. : Analytical Biochemistry, Vol. 160, 47-56 (1987)]を指標に行った。培養物を遠心分離(6000 xg, 4 ℃, 20 min)により菌体と上清を分離した。分離した上清のpHを塩酸にてpH 3に調整し、芳香族系合成吸着樹脂HP20樹脂(三菱化学社製)を2 L加え、4 ℃に24時間放置した。ガラスフィルター(3G)を用いて樹脂を濾過し、瀘別した樹脂は、塩酸にてpH 3に調整した超純水10 Lで洗浄した。洗浄したHP20樹脂をビーカーに移し、5 Lのメタノールに24時間浸漬した。次に、グラスフィルターを用いて、メタノールと樹脂を濾別し、得られたメタノール溶液をエバポレーターを用いて減圧濃縮し、12 gの褐色固形物を得た。
【0041】
次に、LH-20樹脂を用いたカラムクロマトグラフィーを行った。内径3 cm、長さ80 cmのガラスカラムに、あらかじめ50%メタノール−超純水で膨潤したLH-20樹脂(アマシャム・ファルマシア社製)150 gをつめ、平衡化後、先の褐色固形物12 gを5 mlの50 %メタノール−超純水に溶解したものをロードし、50 %メタノール−超純水にて溶出を行った。20 mLずつ分画をおこない、CASアッセイにて鉄キレーターの存在する画分を検出した。鉄キレーターを含む画分を集め、エバポレーターにて減圧濃縮後、凍結乾燥を行い、淡褐色固形物680 mgを得た。
【0042】
次に、逆相カラムを用いた高速液体クロマトグラフィー(HPLC)にて精製を行った。カラムにコスモシール5C18-AR-II(内径20 mm、長さ250 mm)を用い、移動相としては、45%メタノール−超純水を用い、10 mL/minの流速で分画を行った。2分(20 mL)ごとに分画をおこない、CASアッセイを行い、シデロフォアを含む画分を集め、エバポレーターにて減圧濃縮後、凍結乾燥を行い、淡黄色固形物130 mgを得た。次に、カラムに、TSK GEL ODS 80Ts(内径7.8 mm、長さ300 mm)を用い、2種類の溶媒(溶媒A:0.1 %トリフルオロ酢酸−超純水、溶媒B:0.1 % トリフルオロ酢酸−アセトニトリル)を用いたグラジエント溶出(初発の溶媒Bの濃度を10 %とし、30分後に40 %にあげる。流速2 mL/min)を行った。波長220nmの紫外吸収のチャートを図1に例示した。それぞれのピークに対応する分画を分離回収し、前述の非特許文献5に記載のCASアッセイによってシデロフォアの活性を測定したところ、図中ピークAおよびピークBについて当該活性があることが確認できた。分離同条件で繰り返し精製を行い、ピークAおよびピークBの画分を回収し、それぞれ乾燥重量にて式(I)の化合物を10 mgおよび式(II)の化合物を、20 mg得た。
【0043】
それぞれの化合物について高分解能FAB-MSにより組成式を決定し、さらに1H NMR、13C NMR、HSQC、HMBC等のNMRデータの詳細な解析により構造を決定した結果、ピークAから式(I)の化合物を、ピークBから式(II)の化合物をそれぞれ得た。
【0044】
(実施例3)
海産緑藻クロロコッカム・リトラーレ(Chlorococcum littorale)NBRC102761を用いて、式(I)の化合物および式(II)の化合物が当該単細胞藻類に対して増殖促進効果を有するかどうかを調べた。
【0045】
一般に海産の植物プランクトンは海水中の低い鉄濃度のレベル(数nM)では十分な増殖が困難であり、細胞への鉄供給が促進されると増殖も促進されることが知られている。まず基本生育培地(A5培地:硝酸ナトリウム1.5g/L、硫酸マグネシウム・七水和物0.1g/L、リン酸一カリウム35mg/L、リン酸二カリウム45 mg/L、鉄−EDTA 12mg/L、塩化カルシウム・ニ水和物9mg/L、ホウ酸70μg/L、硫酸マンガン・七水和物150 μg/L、硫酸亜鉛・七水和物 300μg/L、硫酸銅・五水和物300μg/L、モリブデン酸ナトリウム 3μg/L、塩化コバルト70μg/L、海水1L)で前培養した後、基本生育培地から鉄−EDTAを欠如させた培地(ただし培地調製に用いた海水由来の微量な鉄は存在する;以下、鉄欠乏培地という)で3日おきに2回継代培養して鉄欠乏状態の細胞(以下、鉄欠乏細胞という)を作成した。次に、鉄欠乏培地、鉄欠乏培地にデフェロキサミンBを0.1mM添加した培地、鉄欠乏培地に式(I)の化合物を0.1mM添加した培地、鉄欠乏培地に式(II)の化合物を0.1mM添加した培地をそれぞれ調製し、前記の鉄欠乏細胞を接種して、温度25℃、光強度50μmoL m-2 s-1のインキュベータ内で静置培養して増殖を調べた。
【0046】
結果を図2に示す。縦軸は培養開始時と培養44時間後のクロロフィル蛍光強度の差の平均値(n=12)を示しており、当該期間における微細藻の増殖量を意味する。バーは標準誤差(n=12)を示す。クロロフィル蛍光は蛍光分光光度計を用いて励起波長485nmとした時の蛍光波長645nmの強度を測定した。
【0047】
図2において、Aは鉄欠乏培地を用いた場合、Bは鉄欠乏培地にデフェロキサミンBを添加した培地を用いた場合、Cは鉄欠乏培地に式(I)の化合物を添加した培地を用いた場合、Dは鉄欠乏培地に式(II)の化合物を添加した培地を用いた場合におけるクロロコッカム・リトラーレのクロロフィル蛍光量の増加量をそれぞれ表す。デフェロキサミンBを添加した培地では鉄欠乏培地で認められた蛍光増加量よりも低かった。つまりデフェロキサミンBを添加すると当該の微細藻は増殖が抑制された。
【0048】
この結果は、デフェロキサミンBが培地中の微量な鉄と結合すると、微細藻はそれを摂取することができず、増殖が抑制されたと考えられる。これに対して、式(I)の化合物もしくは式(II)の化合物を添加すると鉄欠乏培地の場合よりも増殖が促進された。すなわち、式(I)の化合物及び式(II)の化合物はクロロコッカム・リトラーレによる海水からの極微量の鉄の取り込みを促進したと考えられる。つまり、本発明に係る化合物は藻類の増殖を促進する効果があることを確認した。
【0049】
(実施例4)
シデロフォアを生産する微生物を混和した担体を海岸線に沿って埋設し、海域の藻場造成に対する効果を確認した。
【0050】
ストレプトマイセス・スピーシーズYM5-799株の培養を以下の様に行った。本菌株を200 mLのマリンブロス培地を入れた1 Lバッフル付き三角フラスコ中で、30 ℃にて5日間回転震盪(100 rpm)培養して種菌とした。2 Lのバッフル付三角フラスコ1本あたり、生産培地(ASG培地:カザミノ酸 5 g/L、グリセリン 3 mL/L、グリセロリン酸 0.1 g/L、塩化ナトリウム 15.5 g/L、塩化カリウム 0.8 g/L、硫酸マグネシウム・七水和物 12.4 g/L、塩化カルシウム・二水和物 2.9 g/L、塩化アンモニウム 1.0 g/L、HEPESナトリウム塩 2.6 g/L、炭酸水素ナトリウム 0.17 g/L、塩化鉄0.01 μM (滅菌前pH 6.8))1 Lを入れ、オートクレーブにて滅菌したフラスコ各々(計10本、10 L)に、あらかじめ培養した種菌を10 mL接種し、30 ℃にて10日間、振盪培養(100 rpm)を行った。
【0051】
市販の腐植土100kg当たり前記培養液10Lを添加し、3日間通気攪拌した後に布袋に詰め、試験海域の汀線に埋設した。実施例では約1tの腐植土を用いた。比較例として、市販の腐植土100kg当たりマリンブロス培地10L添加し、3日間通気攪拌した後に布袋に詰め、試験海域の汀線で、実施例の埋設地点から100m離れた地点に埋設した。比較例では約1tの腐植土を用いた。
【0052】
実施例および比較例の資材を埋設した後、1年後および2年後に、それぞれの埋設地点近傍の海藻類の繁茂の状況と海水中の鉄濃度を調査した。海藻類の繁茂の状況は、検査地点の海底における1m四方の区画に繁茂した海草を採取し、その質重量を測定した。海水中の鉄濃度は、JIS K0102に準拠してICP発光分析法で分析した。調査結果を表2に示す。海藻繁茂状況の記号は、100g/m2未満を“―”、100g/m2以上1kg/m2未満を“+”、1kg/m2以上を“++”と表記した。
【0053】
施用前は実施例、比較例ともに海水中の鉄濃度が低く、海藻もほとんど生育していない海域であったが、施用1年後は実施例において海藻の生育が確認され、施用2年後には著しく繁茂した。海水中の鉄濃度は施用前は1.9μg/L程度であったが、施用後は10μg/L以上に増加し、施用2年後においてもその鉄濃度レベルは維持されていた。一方、比較例においては、施用1年後では海藻の生育は確認できなかったが、施用2年後には若干程度の海藻の生育が観察された。これは、海藻が繁茂した海域が、実施例の施用地点を中心にその効果域が拡大してゆき、施用2年後の時点では、実施例の効果域が比較例の施用地点にまで拡大したためである。比較例における海水中の鉄濃度は、施用前は実施例のそれと同程度の1.8μg/Lであり、施用1年後においても施用前とほとんど変わらず2.1μg/L程度であった。施用2年後は若干高まったが、これは前述のように実施例の効果域の拡大と考えられる。
【0054】
以上のように海水中の鉄濃度と海藻の繁茂の状況とは明らかに相関が観察された。鉄イオンは酸性の液中ではイオンとして溶解するが、中性もしくはアルカリ性の液中では水酸化物を形成し、沈殿を生じ、水中に溶解できない性質がある。比較例に比べて実施例においては海水中の鉄濃度が高く保持され、海藻の繁茂が顕著であった。これは、実施例のように鉄分を含んだ腐植土とシデロフォアを生産する微生物を含んだ担体を海域に施用することによって当該担体から鉄分および/または海水中の鉄イオンが、担体から供給されたシデロフォアにキレートされたために海水中に溶存態として存在する、生物利用性の高い鉄分濃度が高まり、その結果として海藻の生育が促進されたと考えられる。
【0055】
【表1】

【0056】
また、施用2年後の観察を行った後に実施例および比較例の埋設担体を採取し、滅菌海水中で分散させ、その上清をマリンブロス寒天培地に塗布し、7日間培養して得たコロニー約100個について、非特許文献5に記載のCAS(Chrome azurol S)アッセイによってシデロフォアの生産能力の有無を確認したところ、23個の分離株についてシデロフォア活性が観察された。シデロフォア活性が確認された23株についてDNAを抽出し、16S rDNAの塩基配列を調べたところ、すべてがYM5-799株と同一であった。
【図面の簡単な説明】
【0057】
【図1】本発明のシデロフォア精製過程におけるHPLCチャートの例図である。
【図2】海産緑藻の増殖に及ぼすシデロフォアの効果を調べた結果例である。
【特許請求の範囲】
【請求項1】
下記の化合物(I)および化合物(II)並びに/またはそれらの塩を生産する能力を有する微生物ストレプトマイセス・スピーシーズ(Streptomyces sp.)YM5-799株(NITE AP-480)
化合物(I)
【化1】

化合物(II)
【化2】

【請求項2】
請求項1記載の微生物を培地に培養し、前記培養物中に請求項1に規定する式(I)および(II)の化合物並びに/またはそれらの塩を生成蓄積させた後、前記培養物から式(I)および(II)の化合物並びに/またはそれらの塩を採取することを特徴とする、式(I)および(II)並びに/またはそれらの塩の化合物の製造方法。
【請求項3】
請求項2記載の製造方法によって製造された式(I)及び式(II)の化合物並びに/またはそれらの塩を、カラムクロマトグラフィーおよび/または高速液体クロマトグラフィーを用いて分離し、式(I)の化合物および/またはその塩を得ることを特徴とする式(I)の化合物の製造方法。
【請求項4】
請求項2記載の製造方法によって製造された式(I)および式(II)の化合物並びに/またはそれらの塩を、カラムクロマトグラフィーおよび/または高速液体クロマトグラフィーを用いて分離し、式(II)の化合物および/またはその塩を得ることを特徴とする式(II)の化合物の製造方法。
【請求項1】
下記の化合物(I)および化合物(II)並びに/またはそれらの塩を生産する能力を有する微生物ストレプトマイセス・スピーシーズ(Streptomyces sp.)YM5-799株(NITE AP-480)
化合物(I)
【化1】

化合物(II)
【化2】

【請求項2】
請求項1記載の微生物を培地に培養し、前記培養物中に請求項1に規定する式(I)および(II)の化合物並びに/またはそれらの塩を生成蓄積させた後、前記培養物から式(I)および(II)の化合物並びに/またはそれらの塩を採取することを特徴とする、式(I)および(II)並びに/またはそれらの塩の化合物の製造方法。
【請求項3】
請求項2記載の製造方法によって製造された式(I)及び式(II)の化合物並びに/またはそれらの塩を、カラムクロマトグラフィーおよび/または高速液体クロマトグラフィーを用いて分離し、式(I)の化合物および/またはその塩を得ることを特徴とする式(I)の化合物の製造方法。
【請求項4】
請求項2記載の製造方法によって製造された式(I)および式(II)の化合物並びに/またはそれらの塩を、カラムクロマトグラフィーおよび/または高速液体クロマトグラフィーを用いて分離し、式(II)の化合物および/またはその塩を得ることを特徴とする式(II)の化合物の製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2009−178086(P2009−178086A)
【公開日】平成21年8月13日(2009.8.13)
【国際特許分類】
【出願番号】特願2008−19498(P2008−19498)
【出願日】平成20年1月30日(2008.1.30)
【出願人】(000006655)新日本製鐵株式会社 (6,474)
【Fターム(参考)】
【公開日】平成21年8月13日(2009.8.13)
【国際特許分類】
【出願日】平成20年1月30日(2008.1.30)
【出願人】(000006655)新日本製鐵株式会社 (6,474)
【Fターム(参考)】
[ Back to top ]

