新規水溶性イリジウム錯体化合物およびそれを用いた酸素濃度測定試薬
【課題】酸素濃度検出用イリジウム錯体試薬を提供する。
【解決手段】イリジウム錯体は、ビス[1−(2’−ベンゾチエニル)−キノリナート−N,C3’]イリジウム、ビス[9−(2’−ベンゾチエニル)−フェナンスリナート−N,C3’]イリジウム、ビス[2−(2’−ベンゾチエニル)−キノリナート−N,C3’]イリジウム及びビス[2−(2’−ベンゾチエニル)−ピリジナート−N,C3’]イリジウム等から選ばれる配位体とペプチド残基が結合したアセチルアセトン補助配位子を含む化合物からなる。
【解決手段】イリジウム錯体は、ビス[1−(2’−ベンゾチエニル)−キノリナート−N,C3’]イリジウム、ビス[9−(2’−ベンゾチエニル)−フェナンスリナート−N,C3’]イリジウム、ビス[2−(2’−ベンゾチエニル)−キノリナート−N,C3’]イリジウム及びビス[2−(2’−ベンゾチエニル)−ピリジナート−N,C3’]イリジウム等から選ばれる配位体とペプチド残基が結合したアセチルアセトン補助配位子を含む化合物からなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は新規水溶性イリジウム錯体化合物、およびそれを用いて酸素濃度をリアルタイムで可視化し定量することのできる試薬に関する。
【背景技術】
【0002】
イリジウム(III)錯体(非特許文献1〜4)はりん光を発することが知られており、有機ELディスプレイなどへの応用が期待されている。
一方、本発明者らは、イリジウム錯体((btp)2Ir(acac))が酸素濃度に依存してりん光を発することを発見し、イリジウム錯体((btp)2Ir(acac))の室温りん光(強度、寿命)を用いた生体組織中における酸素濃度計測方法を開発した(特許文献1)。また、(btp)2Ir(acac)のりん光強度、寿命の測定から、リポソーム膜中の酸素濃度の定量、癌細胞中の酸素濃度の可視化、担癌マウス中の腫瘍の可視化に成功した(特許文献1)。
【化1】

さらに、酸素濃度に依存して近赤外光領域にりん光を発する化合物も開発した((btq)2Ir(acac)、(btiq)2Ir(acac)、(btph)2Ir(acac))(特許文献2)。
【0003】
しかしながら、これらの化合物は水に溶解しないため、生体に投与する場合、ジメチルスルホキシド(DMSO)などの有機溶媒に一度溶解させ、生理食塩水で希釈する必要があり、有機溶媒が生体に何らかの影響を及ぼす可能性も否定できない。これまで水溶性りん光化合物として、ルテニウム錯体、金属ポルフィリン錯体がある。これらの化合物はイリジウム錯体と比較してりん光量子収率(0.1以下)が低く、また、ルテニウム錯体では、細胞毒性があることが指摘されており、これらの化合物を用いて細胞や組織中の酸素濃度を定量することは困難である。
【0004】
一般に、水に溶解性の低い有機化合物を水溶性化する方法として、ポリエチレングリコール(PEG)を結合させることが知られている。しかしながら、PEGは生体に対して毒性が低いとされているが、分子量(一般に5000以上)が大きくなりすぎることが問題視されている。
【特許文献1】飛田成史,吉原利忠,竹内利行,穂坂正博,「酸素濃度測定試薬および酸素濃度測定方法」,特願2007-126518
【特許文献2】飛田成史,吉原利忠,竹内利行,穂坂正博,特願2008-185151
【非特許文献1】S. Lamansky, P. Djurovich, D. Murphy, F. Abdel-Razzaq, H. Lee, C. Adachi, P. E. Burrows, S. R. Forrest, and M. E. Thompson, J. Am. Chem. Soc., 123, 4303 (2001).
【非特許文献2】H. Konno,Chem. Times, 199, 13 (2006).
【非特許文献3】M. Nonoyama, Bull. Chem. Soc. Jpn., 47, 767 (1974).
【非特許文献4】S. Sprouse, K. A. King, P. J. Spellane, and R. J. Watts, J. Am. Chem. Soc., 106, 6647 (1984).
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、水溶液中でも使用可能な、酸素濃度に依存してりん光を発する新規イリジウム錯体を提供すること、及びそれを用いた酸素濃度測定試薬を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者は上記課題を解決すべく鋭意検討を行った。その結果、イリジウム錯体の配位子であるアセチルアセトンをアミノ酸残基またはペプチド残基を含む水溶性配位子に変えることにより、りん光特性を維持した水溶性イリジウム錯体を合成することに成功し、さらに、そのりん光が酸素濃度に依存することを見出し、本発明を完成するに至った。
【0007】
すなわち、本発明は以下の通りである。
(1)下記一般式(I)〜(IV)のいずれかで表される化合物(nは1〜5の自然数を表し、Rはアミノ酸残基またはペプチド残基を表す)。
(2)前記アミノ酸残基またはペプチド残基が、側鎖に水酸基、カルボキシル基もしくはアミノ基を有するアミノ酸の残基または該アミノ酸からなるペプチドの残基である、(1)の化合物。
(3)前記アミノ酸残基またはペプチド残基が、チロシン、アスパラギン酸、グルタミン酸、リシンおよびアルギニンから選ばれるアミノ酸の残基または該アミノ酸からなるペプチドの残基である、(1)の化合物。
(4)前記アミノ酸残基またはペプチド残基が、アスパラギン酸残基またはアスパラギン酸からなるペプチドの残基である、(1)の化合物。
(5)下記式(V)または(VI)で表される化合物。
(6)(1)〜(5)のいずれかの化合物を含む酸素濃度測定試薬。
【発明の効果】
【0008】
本発明のイリジウム錯体は、酸素濃度に依存してりん光を発するため、水溶液中の酸素濃度をモニターすることができ、さらにりん光寿命の値から酸素濃度を定量することができる。これにより、分析化学、生命科学、バイオイメージング分野、医療診断、細胞生物学などの分野に用いることができる。具体的には、酸素濃度定量試薬、低酸素細胞画像化試薬、低酸素腫瘍診断試薬などとして用いることができる。
本発明のIr錯体は、(btp)2Ir(acac)のりん光特性を維持した水溶性イリジウム錯体であり、生体投与において有機溶媒の割合を軽減させることができる。また、水中で利用できる酸素センサーとしても有用である。
【発明を実施するための最良の形態】
【0009】
以下に本発明を詳しく説明する。
【0010】
本発明の化合物は下記一般式(I)〜(IV)のいずれかで表される化合物である。
【化2】

【0011】
ここで、nは1〜5の自然数を表し、1〜3が好ましく、2が特に好ましい。
Rはアミノ酸残基またはペプチド残基を表し、側鎖に水酸基、カルボキシル基またはアミノ基を有するアミノ酸の残基または該アミノ酸からなるペプチドの残基であることが好ましい。
なお、「アミノ酸残基およびペプチド残基」とは、アミノ酸またはペプチドがそのアミノ基を介してアミド結合したときの残基をいう。
側鎖に水酸基を有するアミノ酸としては、チロシン、セリン、スレオニンが挙げられ、チロシンがより好ましい。
側鎖にカルボキシル基を有するアミノ酸としては、アスパラギン酸、グルタミン酸が挙げられ、側鎖にアミノ基を有するアミノ酸としてはリシンおよびアルギニンが挙げられる。なお、アミノ酸はL体でもD体でもよく、非天然のアミノ酸でもよい。
ペプチド残基としては、上記アミノ酸の1種又は複数種からなるペプチド残基が挙げられ、その長さは好ましくは2〜10、より好ましくは2〜5である。
【0012】
より具体的には、Rがアスパラギン酸残基またはアスパラギン酸ジペプチドの残基である、下記式(V)または(VI)で表される化合物が挙げられる。ただし、本発明の化合物は水溶性を示し、酸素濃度に依存したりん光を発するものである限り、下記化合物に限定されるものではない。
【化3】

【0013】
本発明のイリジウム錯体は、後述の実施例に記載の方法に従って合成することができる。なお、実施例ではRがアスパラギン酸またはアスパラギン酸ジペプチドの残基である上記式(V)または(VI)の化合物の合成例を示したが、アミド結合させるアミノ酸又はペプチドの種類を変えることにより他のアミノ酸またはペプチドが結合した化合物を得ることができる。
【0014】
上記のようなイリジウム錯体は、水性媒体に溶解し、水溶液中の酸素濃度が低いときにより強いりん光を発する。したがって、りん光の強度に基づいて酸素濃度を測定することができる。すなわち、りん光が強いときに酸素濃度が低いというような判定ができる。また、あらかじめ酸素濃度とりん光強度の関係を求めておくことにより、酸素濃度を定量的に測定することも可能である。
【0015】
また、マウスやラットなどの実験動物あるいはヒトにイリジウム錯体を投与し、酸素濃度が低下している部位の検出などを行うこともできる。癌組織では酸素供給が不足しているので、酸素濃度が低下している部位の検出を行うことにより、癌組織を特異的に染色し、癌の診断薬として使用することもできる。
生体内の酸素濃度を検出する場合は、イリジウム錯体を生体に添加してインキュベートした後、イリジウム錯体を励起してりん光を観察できるような蛍光顕微鏡、蛍光測定装置、蛍光イメージング装置などを用いてりん光を観察することができる。
【実施例】
【0016】
以下に実施例を示し、本発明をさらに具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0017】
(btp)2Ir(sa)の合成
2-ベンゾチエニルピリジン(1175.4mg、3.0mmol)、塩化イリジウム三水和物(純度:90%、1373.6mg、6.5mmol)に2-エトキシエタノール(90ml)、水(30ml)を加え、16時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体(859mg、0.66mmol)、トリフルオロメタンスルホン酸銀(377.2mg、1.47mol)に脱水アセトン(120ml)を加え3時間還流し、溶液をろ過した。得られたろ液にスクシニルアセトン(308.8mg、1.95mol)、トリエチルアミン(1ml)を加え室温にて20時間撹拌した。溶液を減圧乾固し、得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム:メタノール(9:1、v/v))を用いて生成した(収量:993.5mg、収率:97.5%)。
1H HNR (300 MHz, d-DMSO, TMS, RT):δ 8.60-8.51(2H, m), 8.01-7.98(2H, d), 7.78-7.74(2H, q), 7.70-7.62(2H, q), 7.23-7.21(2H, q), 7.10-7.08(2H, q), 6.83-6.77(2H, t), 6.30-6.24(2H, t), 5.43(1H, s), 2.37-2.22(4H, m), 1.76(3H, s)
【化4】

【0018】
(btp)2Ir(sa-NH2)の合成
(btp)2Ir(sa)(100.5mg、0.130mol)、Fmocエチレンジアミン(46.2mg、0.145mol)、ジイソプロピルエチルアミン(49μl、0.288mol)にDMF(5ml)を加え縮合剤としてHATU(56.2mg、0.148mol)を用いて、氷浴下3時間撹拌した。溶液に水を注ぎ、固体を析出させろ過した。得られた生成物をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:42.1mg、収率:31%)。得られた固体(42mg、0.041mol)に2%DBU/DMF(8ml)溶液を加え3時間室温で撹拌した。溶液に水を加え、クロロホルムを用いて抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られたオイルに少量のクロロホルムを加えた後、多量のヘキサンを加え、固体を析出させろ過した(収量:16.7mg、収率:51%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.45-8.32(2H, m), 7.82-7.75(2H, d), 7.68-7.62(4H, m), 7.10-7.02(4H, m), 6.83-6.77(2H, m), 6.22-6.20(2H, d), 6.15(1H, s), 5.29(1H, s), 2.65-2.45(4H, m) 2.32-2.25(2H, m), 2.15-2.08(2H, m), 1.80(3H, s)
【化5】

【0019】
(btp)2Ir(sa-Asp)の合成
(btp)2Ir(sa)(171mg、0.22mol)、Z基でカルボキシ基を保護したL-アスパラギン酸(97.8mg、0.20mol)、ジイソプロピルエチルアミン(85μl、0.50mol)にDMF(5ml)を加え縮合剤としてHATU(84mg、0.22mol)を用いて、氷浴下3時間撹拌した。溶液に水を注ぎ、固体を析出させろ過した。得られた生成物をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:74mg、収率:35%)。Z基で保護した(btp)2Ir(sa-Asp) (70mg、0.066mol)をテトラヒドロフランに溶解させ、5%PdCを適量加え、容器内を水素で満たし室温にて撹拌した。反応をTLCで追跡し原料が消失したところで、溶液をろ過
し、ろ液を減圧乾固した(収量:28mg、収率:49%)。
1H HNR (300 MHz, d-DMSO, TMS, RT):δ 12.5(2H, br), 8.45-8.37(2H, d), 8.12(1H, s), 8.01-7.98(2H, d), 7.79-7.71(4H, q), 7.23-7.21(2H, t), 7.10-7.08(2H, t), 6.83-6.77(2H, t), 6.10-6.02(2H, d), 5.38(1H, s), 4.50-4.45(2H, m), 2.37-2.22(4H, m), 1.76(3H, s)
【化6】

【0020】
(btp)2Ir(sa-Asp-Asp)の合成
(btp)2Ir(sa)(148.3mg、0.193mol)、Z基でカルボキシ基を保護したL-Asp-L-Asp(100.2mg、0.193mol)、ジイソプロピルエチルアミン(73μl、0.429mol)にDMF(5ml)を加え縮合剤としてHATU(82mg、0.216mol)を用いて、氷浴下3時間撹拌した。溶液に水を注ぎ、固体を析出させろ過した。得られた生成物をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:192.2mg、収率:78.2%)。Z基で保護した(btp)2Ir(sa-Asp-Asp) (192mg、0.151mol)をテトラヒドロフランに溶解させ、5%PdCを適量加え、容器内を水素で満たし室温にて撹拌した。反応をTLCで追跡し原料が消失したところで、溶液をろ過し、ろ液を減圧乾固した(収量:70.2mg、収率:46%)。
1H HNR (300 MHz, d-DMSO, TMS, RT):δ 12.5(3H, br), 8.43-8.37(2H, d), 8.20(1H, s), 8.01-7.98(2H, d), 7.81-7.73(4H, q), 7.23-7.21(2H, d), 7.10-7.08(2H, t), 6.83-6.77(2H, t), 6.10-6.02(2H, t), 5.38(1H, s), 4.50-4.45(2H, m), 4.12(1H, s), 2.20-2.10(4H, m), 1.75(3H, s)
【化7】

【0021】
表1に、(btp)2Ir(sa)、(btp)2Ir(sa-NH2)、(btp)2Ir(sa-Asp)、および(btp)2Ir(sa-Asp-Asp)のTris-HCl緩衝液(pH=7.0):DMSO(95:5)およびTris-HCl緩衝液(pH=7.0)への溶解度を示す。(btp)2Ir(acac)では、Tris-HCl緩衝液(pH=7.0):DMSO(95:5)にほとんど溶解しないが、(btp)2Ir(sa)、(btp)2Ir(sa-NH2)において23mgL-1程度溶解することがわかる。一方、(btp)2Ir(sa-Asp)、(btp)2Ir(sa-Asp-Asp)では、Tris-HCl緩衝液(pH=7.0)に溶解する。特に(btp)2Ir(sa-Asp-Asp)では、モル濃度に換算すると340μMであり、ほぼ実用レベルに到達している。この結果より、水溶性のアミノ酸を導入することで水溶性を著しく向上させることができる。
【0022】
【表1】

【0023】
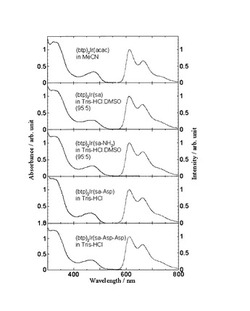
図1に、各イリジウム錯体の吸収、りん光スペクトルを示す。その結果、(btp)2Ir(sa-Asp)および(btp)2Ir(sa-Asp-Asp) はTris-HCl緩衝液(pH=7.0)中で、アセトニトリル中の(btp)2Ir(acac)とほぼ同じ吸収、りん光スペクトルを示し、acac部位のアミノ酸またはペプチドによる修飾はりん光特性に影響を及ぼさないことがわかった。表2に各化合物の窒素置換中におけるりん光量子収率を示す。(btp)2Ir(sa-Asp)および(btp)2Ir(sa-Asp-Asp) は水中においてりん光量子収率が減少するが、従来の水溶性りん光性化合物と比較して大きな値である。
【0024】
【表2】

【0025】
図2に、Tris-HCl緩衝液(pH=7.0)中での、(btp)2Ir(sa-Asp-Asp)のりん光強度の酸素依存性の検討を行った。その結果、りん光強度は空気飽和下と比較してAr(アルゴン)置換下において5.3倍増加しており、水中においても酸素濃度に依存してりん光強度が変化しており、酸素センサーへの展開が期待できる。
【0026】
参考例1
ビス[2-(2'-ベンゾチエニル)-キノリナート- N,C3']イリジウム(アセチルアセトン)((btq)2Ir(acac))の合成
【0027】
2-ベンゾチエニルキノリンの合成
ベンゾ[b]チオフェン-2-イルボロン酸(990mg,5.6mmol)、2-クロロキノリン(937mg,5.7mmol)をトルエン(20ml)、エタノール(10ml)に溶解させ、パラジウム触媒(200mg,0.17mmol)、2M炭酸ナトリウム水溶液(20ml)を加え、N2置換下、5時間還流した。反応溶液を水に注ぎ、クロロホルムで抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られた固体をトルエンで洗浄した(収量:888mg、収率:61%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.20-8.17(1H, d), 8.15-8.12(1H, d), 7.98(1H, S), 7.96-7.93(1H, d), 7.91-7.88(1H, q), 7.86-7.83(1H, q), 7.82-7.79(1H, d), 7.75-7.70(1H, t), 7.55-7.50(1H, t), 7.39-7.36(2H, q)
【化8】

【0028】
ビス[2-(2'-ベンゾチエニル)-キノリナート- N,C3']イリジウム(アセチルアセトン)の合成
2-ベンゾチエニルキノリン(581mg、2.2mmol)、塩化イリジウム三水和物(純度:90%、392mg、1.0mmol)に2-エトキシエタノール(30ml)、水(10ml)を加え、16時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体(304mg、0.20mmol)に2-メトキシエタノール(25ml)、アセチルアセトン(1ml)、炭酸ナトリウム(170mg)を加え還流を加え2時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:262mg、収率:79%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.17-8.14(2H, d), 8.01-7.98(2H, d), 7.85-7.83(2H, d), 7.75-7.73(2H, d), 7.71-7.68(2H, d), 7.37-7.32(2H, t), 7.73-7.23(2H, t), 7.02-6.97(2H, t), 6.57-6.52(2H, t), 6.32-6.30(2H, d), 4.63(1H, s), 1.55(6H, s)
【化9】

【0029】
参考例2
ビス[1-(2'-ベンゾチエニル)-キノリナート- N,C3']イリジウム(アセチルアセトン)((btiq)2Ir(acac))の合成
【0030】
1-ベンゾチエニルイソキノリンの合成
ベンゾ[b]チオフェン-2-イルボロン酸(997mg、5.6mmol)、1-クロロイソキノリン(946mg、5.8mmol)をトルエン(20ml)、エタノール(10ml)に溶解させ、パラジウム触媒(220mg、0.19mmol)、2M炭酸ナトリウム水溶液(20ml)を加え、N2置換下、5時間還流した。反応溶液を水に注ぎ、クロロホルムで抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:1.16g、収率:79%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.62-8.60(2H, d), 7.96-7.87(3H, m), 7.84(1H, s), 7.78-7.73(1H, d), 7.71-7.67(1H, d), 7.65-7.63(1H, d), 7.42-7.39(2H, m)
【化10】

【0031】
ビス[1-(2'-ベンゾチエニル)-キノリナート- N,C3']イリジウム(アセチルアセトン)の合成
1-ベンゾチエニルイソキノリン(574mg、2.2mmol)、塩化イリジウム三水和物(純度:90%、398mg、1.0mmol)に2-エトキシエタノール(30ml)、水(10ml)を加え、16時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体(250mg、0.17mmol)に2-メトキシエタノール(30ml)、アセチルアセトン(1ml)、炭酸ナトリウム(150mg)を加え還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:50mg、収率:18%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.92-8.88(2H, d), 8.22-8.19(2H, d), 7.88-7.84(2H, m), 7.68-7.64(4H, m), 7.56-7.54(2H, d), 7.32-7.27(2H, m), 6.94-6.91(2H, d), 6.56-6.53(2H, m), 6.18-6.14(2H, d), 5.12(1H, s), 1.63(6H, s)
【化11】

【0032】
参考例3
ビス[9-(2'-ベンゾチエニル)-フェナンスリナート- N,C3']イリジウム(アセチルアセトン)((btph)2Ir(acac))の合成
【0033】
9-クロロフェナンスリジンの合成
フェナンスリジノン(2.0g)にオキシ塩化リン(15ml)、ジメチルアニリン(0.63ml)を加え、3時間還流した。溶液を水に注ぎクロロホルムで抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:2.1g,収率:96%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.63-8.60(1H, d), 8.55-8.52(1H, d), 8.50-8.48(1H, d), 8.11-8.09(1H, d), 7.94-7.92(1H, t), 7.79-7.66(3H, m)
【化12】

【0034】
9-ベンゾチエニルフェナンスリジリンの合成
ベンゾ[b]チオフェン-2-イルボロン酸(884mg、5.0mmol)、9-クロロフェナンスリジリン(1.0g、4.8mmol)をテトラヒドロフラン(30ml)、パラジウム触媒(160mg、0.14mmol)、2M炭酸ナトリウム水溶液(20ml)を加え、N2置換下、5時間還流した。反応溶液を水に注ぎ、クロロホルムで抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:1.15g、収率:78%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.74-8.71(1H, d), 8.67-8.65(1H, d), 8.62-8.59(1H), 8.26-8.23(1H, d), 7.97-7.88(3H, m), 7.86(1H, s), 7.80-7.67(3H, m), 7.44-7.41(2H)
【化13】

【0035】
ビス[9-(2'-ベンゾチエニル)-フェナンスリナート- N,C3']イリジウム(アセチルアセトン)の合成
9-ベンゾチエニルフェナンスリジリン(706mg、2.3mmol)、塩化イリジウム三水和物(純度:90%、398mg、1.0mmol)に2-エトキシエタノール(30ml)、水(10ml)を加え、16時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体(343mg、0.20mmol)に2-メトキシエタノール(20ml)、アセチルアセトン(1ml)、炭酸ナトリウム(180mg)を加え2時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:293mg、収率:80%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 9.35-9.33(2H, d), 8.72-8.70(2H, d), 8.46-8.44(2H, d), 7.98-7.87(4H, m), 7.85-7.82(2H, d), 7.73-7.70(2H, d), 7.43-7.38(2H, t), 7.20-7.15(2H, t), 7.04-6.99(2H, m), 6.52-6.51(4H, d), 4.50(1H, s), 1.39(6H, s)
【化14】

【0036】
表3に、(btq)2Ir(acac)、(btiq)2Ir(acac)、(btph)2Ir(acac)の1,2-ジクロロエタン中におけるりん光スペクトルを示す。また、これらの化合物のりん光は酸素濃度依存性を示した(データは示さず)。
【0037】
【表3】

【0038】
参考例1〜3のそれぞれにおいて、アセチルアセトン(acac)のかわりにスクシニルアセトン(sa)を反応させることにより、(btq)2Ir(sa)、(btiq)2Ir(sa)、(btph)2Ir(sa)を得ることができる。そして、(btq)2Ir(sa)、(btiq)2Ir(sa)、(btph)2Ir(sa)にアミノ酸やペプチドを反応させることにより、水溶性のイリジウム錯体((btq)2Ir(sa-asp)、(btiq)2Ir(sa-asp)、(btph)2Ir(sa-asp)、(btq)2Ir(sa-asp-asp)、(btiq)2Ir(sa-asp-asp)、(btph)2Ir(sa-asp-asp)など)を得ることができる。
表3より、(btq)2Ir(acac)、(btiq)2Ir(acac)、(btph)2Ir(acac)がりん光を発するため、(btq)2Ir(sa-asp)、(btiq)2Ir(sa-asp)、(btph)2Ir(sa-asp)、(btq)2Ir(sa-asp-asp)、(btiq)2Ir(sa-asp-asp)、(btph)2Ir(sa-asp-asp)などのイリジウム錯体も水溶性のりん光化合物であることが理解できる。
【化15】

【産業上の利用可能性】
【0039】
本発明の酸素濃度検出試薬によれば、水溶液中の酸素濃度を高感度かつリアルタイムで定量することができ、細胞内酸素濃度定量試薬、低酸素細胞画像化薬などとして有用である。
【図面の簡単な説明】
【0040】
【図1】(btp)2Ir(sa)、(btp)2Ir(sa-NH2)、(btp)2Ir(sa-Asp)、(btp)2Ir(sa-Asp-Asp)と、対照の(btp)2Ir(acac)の吸収、りん光スペクトルを示す図。
【図2】Ar置換溶液、空気飽和溶液の(btp)2Ir(sa-Asp-Asp)のりん光スペクトルを示す図。
【技術分野】
【0001】
本発明は新規水溶性イリジウム錯体化合物、およびそれを用いて酸素濃度をリアルタイムで可視化し定量することのできる試薬に関する。
【背景技術】
【0002】
イリジウム(III)錯体(非特許文献1〜4)はりん光を発することが知られており、有機ELディスプレイなどへの応用が期待されている。
一方、本発明者らは、イリジウム錯体((btp)2Ir(acac))が酸素濃度に依存してりん光を発することを発見し、イリジウム錯体((btp)2Ir(acac))の室温りん光(強度、寿命)を用いた生体組織中における酸素濃度計測方法を開発した(特許文献1)。また、(btp)2Ir(acac)のりん光強度、寿命の測定から、リポソーム膜中の酸素濃度の定量、癌細胞中の酸素濃度の可視化、担癌マウス中の腫瘍の可視化に成功した(特許文献1)。
【化1】

さらに、酸素濃度に依存して近赤外光領域にりん光を発する化合物も開発した((btq)2Ir(acac)、(btiq)2Ir(acac)、(btph)2Ir(acac))(特許文献2)。
【0003】
しかしながら、これらの化合物は水に溶解しないため、生体に投与する場合、ジメチルスルホキシド(DMSO)などの有機溶媒に一度溶解させ、生理食塩水で希釈する必要があり、有機溶媒が生体に何らかの影響を及ぼす可能性も否定できない。これまで水溶性りん光化合物として、ルテニウム錯体、金属ポルフィリン錯体がある。これらの化合物はイリジウム錯体と比較してりん光量子収率(0.1以下)が低く、また、ルテニウム錯体では、細胞毒性があることが指摘されており、これらの化合物を用いて細胞や組織中の酸素濃度を定量することは困難である。
【0004】
一般に、水に溶解性の低い有機化合物を水溶性化する方法として、ポリエチレングリコール(PEG)を結合させることが知られている。しかしながら、PEGは生体に対して毒性が低いとされているが、分子量(一般に5000以上)が大きくなりすぎることが問題視されている。
【特許文献1】飛田成史,吉原利忠,竹内利行,穂坂正博,「酸素濃度測定試薬および酸素濃度測定方法」,特願2007-126518
【特許文献2】飛田成史,吉原利忠,竹内利行,穂坂正博,特願2008-185151
【非特許文献1】S. Lamansky, P. Djurovich, D. Murphy, F. Abdel-Razzaq, H. Lee, C. Adachi, P. E. Burrows, S. R. Forrest, and M. E. Thompson, J. Am. Chem. Soc., 123, 4303 (2001).
【非特許文献2】H. Konno,Chem. Times, 199, 13 (2006).
【非特許文献3】M. Nonoyama, Bull. Chem. Soc. Jpn., 47, 767 (1974).
【非特許文献4】S. Sprouse, K. A. King, P. J. Spellane, and R. J. Watts, J. Am. Chem. Soc., 106, 6647 (1984).
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、水溶液中でも使用可能な、酸素濃度に依存してりん光を発する新規イリジウム錯体を提供すること、及びそれを用いた酸素濃度測定試薬を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者は上記課題を解決すべく鋭意検討を行った。その結果、イリジウム錯体の配位子であるアセチルアセトンをアミノ酸残基またはペプチド残基を含む水溶性配位子に変えることにより、りん光特性を維持した水溶性イリジウム錯体を合成することに成功し、さらに、そのりん光が酸素濃度に依存することを見出し、本発明を完成するに至った。
【0007】
すなわち、本発明は以下の通りである。
(1)下記一般式(I)〜(IV)のいずれかで表される化合物(nは1〜5の自然数を表し、Rはアミノ酸残基またはペプチド残基を表す)。
(2)前記アミノ酸残基またはペプチド残基が、側鎖に水酸基、カルボキシル基もしくはアミノ基を有するアミノ酸の残基または該アミノ酸からなるペプチドの残基である、(1)の化合物。
(3)前記アミノ酸残基またはペプチド残基が、チロシン、アスパラギン酸、グルタミン酸、リシンおよびアルギニンから選ばれるアミノ酸の残基または該アミノ酸からなるペプチドの残基である、(1)の化合物。
(4)前記アミノ酸残基またはペプチド残基が、アスパラギン酸残基またはアスパラギン酸からなるペプチドの残基である、(1)の化合物。
(5)下記式(V)または(VI)で表される化合物。
(6)(1)〜(5)のいずれかの化合物を含む酸素濃度測定試薬。
【発明の効果】
【0008】
本発明のイリジウム錯体は、酸素濃度に依存してりん光を発するため、水溶液中の酸素濃度をモニターすることができ、さらにりん光寿命の値から酸素濃度を定量することができる。これにより、分析化学、生命科学、バイオイメージング分野、医療診断、細胞生物学などの分野に用いることができる。具体的には、酸素濃度定量試薬、低酸素細胞画像化試薬、低酸素腫瘍診断試薬などとして用いることができる。
本発明のIr錯体は、(btp)2Ir(acac)のりん光特性を維持した水溶性イリジウム錯体であり、生体投与において有機溶媒の割合を軽減させることができる。また、水中で利用できる酸素センサーとしても有用である。
【発明を実施するための最良の形態】
【0009】
以下に本発明を詳しく説明する。
【0010】
本発明の化合物は下記一般式(I)〜(IV)のいずれかで表される化合物である。
【化2】

【0011】
ここで、nは1〜5の自然数を表し、1〜3が好ましく、2が特に好ましい。
Rはアミノ酸残基またはペプチド残基を表し、側鎖に水酸基、カルボキシル基またはアミノ基を有するアミノ酸の残基または該アミノ酸からなるペプチドの残基であることが好ましい。
なお、「アミノ酸残基およびペプチド残基」とは、アミノ酸またはペプチドがそのアミノ基を介してアミド結合したときの残基をいう。
側鎖に水酸基を有するアミノ酸としては、チロシン、セリン、スレオニンが挙げられ、チロシンがより好ましい。
側鎖にカルボキシル基を有するアミノ酸としては、アスパラギン酸、グルタミン酸が挙げられ、側鎖にアミノ基を有するアミノ酸としてはリシンおよびアルギニンが挙げられる。なお、アミノ酸はL体でもD体でもよく、非天然のアミノ酸でもよい。
ペプチド残基としては、上記アミノ酸の1種又は複数種からなるペプチド残基が挙げられ、その長さは好ましくは2〜10、より好ましくは2〜5である。
【0012】
より具体的には、Rがアスパラギン酸残基またはアスパラギン酸ジペプチドの残基である、下記式(V)または(VI)で表される化合物が挙げられる。ただし、本発明の化合物は水溶性を示し、酸素濃度に依存したりん光を発するものである限り、下記化合物に限定されるものではない。
【化3】

【0013】
本発明のイリジウム錯体は、後述の実施例に記載の方法に従って合成することができる。なお、実施例ではRがアスパラギン酸またはアスパラギン酸ジペプチドの残基である上記式(V)または(VI)の化合物の合成例を示したが、アミド結合させるアミノ酸又はペプチドの種類を変えることにより他のアミノ酸またはペプチドが結合した化合物を得ることができる。
【0014】
上記のようなイリジウム錯体は、水性媒体に溶解し、水溶液中の酸素濃度が低いときにより強いりん光を発する。したがって、りん光の強度に基づいて酸素濃度を測定することができる。すなわち、りん光が強いときに酸素濃度が低いというような判定ができる。また、あらかじめ酸素濃度とりん光強度の関係を求めておくことにより、酸素濃度を定量的に測定することも可能である。
【0015】
また、マウスやラットなどの実験動物あるいはヒトにイリジウム錯体を投与し、酸素濃度が低下している部位の検出などを行うこともできる。癌組織では酸素供給が不足しているので、酸素濃度が低下している部位の検出を行うことにより、癌組織を特異的に染色し、癌の診断薬として使用することもできる。
生体内の酸素濃度を検出する場合は、イリジウム錯体を生体に添加してインキュベートした後、イリジウム錯体を励起してりん光を観察できるような蛍光顕微鏡、蛍光測定装置、蛍光イメージング装置などを用いてりん光を観察することができる。
【実施例】
【0016】
以下に実施例を示し、本発明をさらに具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0017】
(btp)2Ir(sa)の合成
2-ベンゾチエニルピリジン(1175.4mg、3.0mmol)、塩化イリジウム三水和物(純度:90%、1373.6mg、6.5mmol)に2-エトキシエタノール(90ml)、水(30ml)を加え、16時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体(859mg、0.66mmol)、トリフルオロメタンスルホン酸銀(377.2mg、1.47mol)に脱水アセトン(120ml)を加え3時間還流し、溶液をろ過した。得られたろ液にスクシニルアセトン(308.8mg、1.95mol)、トリエチルアミン(1ml)を加え室温にて20時間撹拌した。溶液を減圧乾固し、得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム:メタノール(9:1、v/v))を用いて生成した(収量:993.5mg、収率:97.5%)。
1H HNR (300 MHz, d-DMSO, TMS, RT):δ 8.60-8.51(2H, m), 8.01-7.98(2H, d), 7.78-7.74(2H, q), 7.70-7.62(2H, q), 7.23-7.21(2H, q), 7.10-7.08(2H, q), 6.83-6.77(2H, t), 6.30-6.24(2H, t), 5.43(1H, s), 2.37-2.22(4H, m), 1.76(3H, s)
【化4】

【0018】
(btp)2Ir(sa-NH2)の合成
(btp)2Ir(sa)(100.5mg、0.130mol)、Fmocエチレンジアミン(46.2mg、0.145mol)、ジイソプロピルエチルアミン(49μl、0.288mol)にDMF(5ml)を加え縮合剤としてHATU(56.2mg、0.148mol)を用いて、氷浴下3時間撹拌した。溶液に水を注ぎ、固体を析出させろ過した。得られた生成物をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:42.1mg、収率:31%)。得られた固体(42mg、0.041mol)に2%DBU/DMF(8ml)溶液を加え3時間室温で撹拌した。溶液に水を加え、クロロホルムを用いて抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られたオイルに少量のクロロホルムを加えた後、多量のヘキサンを加え、固体を析出させろ過した(収量:16.7mg、収率:51%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.45-8.32(2H, m), 7.82-7.75(2H, d), 7.68-7.62(4H, m), 7.10-7.02(4H, m), 6.83-6.77(2H, m), 6.22-6.20(2H, d), 6.15(1H, s), 5.29(1H, s), 2.65-2.45(4H, m) 2.32-2.25(2H, m), 2.15-2.08(2H, m), 1.80(3H, s)
【化5】

【0019】
(btp)2Ir(sa-Asp)の合成
(btp)2Ir(sa)(171mg、0.22mol)、Z基でカルボキシ基を保護したL-アスパラギン酸(97.8mg、0.20mol)、ジイソプロピルエチルアミン(85μl、0.50mol)にDMF(5ml)を加え縮合剤としてHATU(84mg、0.22mol)を用いて、氷浴下3時間撹拌した。溶液に水を注ぎ、固体を析出させろ過した。得られた生成物をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:74mg、収率:35%)。Z基で保護した(btp)2Ir(sa-Asp) (70mg、0.066mol)をテトラヒドロフランに溶解させ、5%PdCを適量加え、容器内を水素で満たし室温にて撹拌した。反応をTLCで追跡し原料が消失したところで、溶液をろ過
し、ろ液を減圧乾固した(収量:28mg、収率:49%)。
1H HNR (300 MHz, d-DMSO, TMS, RT):δ 12.5(2H, br), 8.45-8.37(2H, d), 8.12(1H, s), 8.01-7.98(2H, d), 7.79-7.71(4H, q), 7.23-7.21(2H, t), 7.10-7.08(2H, t), 6.83-6.77(2H, t), 6.10-6.02(2H, d), 5.38(1H, s), 4.50-4.45(2H, m), 2.37-2.22(4H, m), 1.76(3H, s)
【化6】

【0020】
(btp)2Ir(sa-Asp-Asp)の合成
(btp)2Ir(sa)(148.3mg、0.193mol)、Z基でカルボキシ基を保護したL-Asp-L-Asp(100.2mg、0.193mol)、ジイソプロピルエチルアミン(73μl、0.429mol)にDMF(5ml)を加え縮合剤としてHATU(82mg、0.216mol)を用いて、氷浴下3時間撹拌した。溶液に水を注ぎ、固体を析出させろ過した。得られた生成物をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:192.2mg、収率:78.2%)。Z基で保護した(btp)2Ir(sa-Asp-Asp) (192mg、0.151mol)をテトラヒドロフランに溶解させ、5%PdCを適量加え、容器内を水素で満たし室温にて撹拌した。反応をTLCで追跡し原料が消失したところで、溶液をろ過し、ろ液を減圧乾固した(収量:70.2mg、収率:46%)。
1H HNR (300 MHz, d-DMSO, TMS, RT):δ 12.5(3H, br), 8.43-8.37(2H, d), 8.20(1H, s), 8.01-7.98(2H, d), 7.81-7.73(4H, q), 7.23-7.21(2H, d), 7.10-7.08(2H, t), 6.83-6.77(2H, t), 6.10-6.02(2H, t), 5.38(1H, s), 4.50-4.45(2H, m), 4.12(1H, s), 2.20-2.10(4H, m), 1.75(3H, s)
【化7】

【0021】
表1に、(btp)2Ir(sa)、(btp)2Ir(sa-NH2)、(btp)2Ir(sa-Asp)、および(btp)2Ir(sa-Asp-Asp)のTris-HCl緩衝液(pH=7.0):DMSO(95:5)およびTris-HCl緩衝液(pH=7.0)への溶解度を示す。(btp)2Ir(acac)では、Tris-HCl緩衝液(pH=7.0):DMSO(95:5)にほとんど溶解しないが、(btp)2Ir(sa)、(btp)2Ir(sa-NH2)において23mgL-1程度溶解することがわかる。一方、(btp)2Ir(sa-Asp)、(btp)2Ir(sa-Asp-Asp)では、Tris-HCl緩衝液(pH=7.0)に溶解する。特に(btp)2Ir(sa-Asp-Asp)では、モル濃度に換算すると340μMであり、ほぼ実用レベルに到達している。この結果より、水溶性のアミノ酸を導入することで水溶性を著しく向上させることができる。
【0022】
【表1】

【0023】
図1に、各イリジウム錯体の吸収、りん光スペクトルを示す。その結果、(btp)2Ir(sa-Asp)および(btp)2Ir(sa-Asp-Asp) はTris-HCl緩衝液(pH=7.0)中で、アセトニトリル中の(btp)2Ir(acac)とほぼ同じ吸収、りん光スペクトルを示し、acac部位のアミノ酸またはペプチドによる修飾はりん光特性に影響を及ぼさないことがわかった。表2に各化合物の窒素置換中におけるりん光量子収率を示す。(btp)2Ir(sa-Asp)および(btp)2Ir(sa-Asp-Asp) は水中においてりん光量子収率が減少するが、従来の水溶性りん光性化合物と比較して大きな値である。
【0024】
【表2】

【0025】
図2に、Tris-HCl緩衝液(pH=7.0)中での、(btp)2Ir(sa-Asp-Asp)のりん光強度の酸素依存性の検討を行った。その結果、りん光強度は空気飽和下と比較してAr(アルゴン)置換下において5.3倍増加しており、水中においても酸素濃度に依存してりん光強度が変化しており、酸素センサーへの展開が期待できる。
【0026】
参考例1
ビス[2-(2'-ベンゾチエニル)-キノリナート- N,C3']イリジウム(アセチルアセトン)((btq)2Ir(acac))の合成
【0027】
2-ベンゾチエニルキノリンの合成
ベンゾ[b]チオフェン-2-イルボロン酸(990mg,5.6mmol)、2-クロロキノリン(937mg,5.7mmol)をトルエン(20ml)、エタノール(10ml)に溶解させ、パラジウム触媒(200mg,0.17mmol)、2M炭酸ナトリウム水溶液(20ml)を加え、N2置換下、5時間還流した。反応溶液を水に注ぎ、クロロホルムで抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られた固体をトルエンで洗浄した(収量:888mg、収率:61%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.20-8.17(1H, d), 8.15-8.12(1H, d), 7.98(1H, S), 7.96-7.93(1H, d), 7.91-7.88(1H, q), 7.86-7.83(1H, q), 7.82-7.79(1H, d), 7.75-7.70(1H, t), 7.55-7.50(1H, t), 7.39-7.36(2H, q)
【化8】

【0028】
ビス[2-(2'-ベンゾチエニル)-キノリナート- N,C3']イリジウム(アセチルアセトン)の合成
2-ベンゾチエニルキノリン(581mg、2.2mmol)、塩化イリジウム三水和物(純度:90%、392mg、1.0mmol)に2-エトキシエタノール(30ml)、水(10ml)を加え、16時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体(304mg、0.20mmol)に2-メトキシエタノール(25ml)、アセチルアセトン(1ml)、炭酸ナトリウム(170mg)を加え還流を加え2時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:262mg、収率:79%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.17-8.14(2H, d), 8.01-7.98(2H, d), 7.85-7.83(2H, d), 7.75-7.73(2H, d), 7.71-7.68(2H, d), 7.37-7.32(2H, t), 7.73-7.23(2H, t), 7.02-6.97(2H, t), 6.57-6.52(2H, t), 6.32-6.30(2H, d), 4.63(1H, s), 1.55(6H, s)
【化9】

【0029】
参考例2
ビス[1-(2'-ベンゾチエニル)-キノリナート- N,C3']イリジウム(アセチルアセトン)((btiq)2Ir(acac))の合成
【0030】
1-ベンゾチエニルイソキノリンの合成
ベンゾ[b]チオフェン-2-イルボロン酸(997mg、5.6mmol)、1-クロロイソキノリン(946mg、5.8mmol)をトルエン(20ml)、エタノール(10ml)に溶解させ、パラジウム触媒(220mg、0.19mmol)、2M炭酸ナトリウム水溶液(20ml)を加え、N2置換下、5時間還流した。反応溶液を水に注ぎ、クロロホルムで抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:1.16g、収率:79%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.62-8.60(2H, d), 7.96-7.87(3H, m), 7.84(1H, s), 7.78-7.73(1H, d), 7.71-7.67(1H, d), 7.65-7.63(1H, d), 7.42-7.39(2H, m)
【化10】

【0031】
ビス[1-(2'-ベンゾチエニル)-キノリナート- N,C3']イリジウム(アセチルアセトン)の合成
1-ベンゾチエニルイソキノリン(574mg、2.2mmol)、塩化イリジウム三水和物(純度:90%、398mg、1.0mmol)に2-エトキシエタノール(30ml)、水(10ml)を加え、16時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体(250mg、0.17mmol)に2-メトキシエタノール(30ml)、アセチルアセトン(1ml)、炭酸ナトリウム(150mg)を加え還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:50mg、収率:18%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.92-8.88(2H, d), 8.22-8.19(2H, d), 7.88-7.84(2H, m), 7.68-7.64(4H, m), 7.56-7.54(2H, d), 7.32-7.27(2H, m), 6.94-6.91(2H, d), 6.56-6.53(2H, m), 6.18-6.14(2H, d), 5.12(1H, s), 1.63(6H, s)
【化11】

【0032】
参考例3
ビス[9-(2'-ベンゾチエニル)-フェナンスリナート- N,C3']イリジウム(アセチルアセトン)((btph)2Ir(acac))の合成
【0033】
9-クロロフェナンスリジンの合成
フェナンスリジノン(2.0g)にオキシ塩化リン(15ml)、ジメチルアニリン(0.63ml)を加え、3時間還流した。溶液を水に注ぎクロロホルムで抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:2.1g,収率:96%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.63-8.60(1H, d), 8.55-8.52(1H, d), 8.50-8.48(1H, d), 8.11-8.09(1H, d), 7.94-7.92(1H, t), 7.79-7.66(3H, m)
【化12】

【0034】
9-ベンゾチエニルフェナンスリジリンの合成
ベンゾ[b]チオフェン-2-イルボロン酸(884mg、5.0mmol)、9-クロロフェナンスリジリン(1.0g、4.8mmol)をテトラヒドロフラン(30ml)、パラジウム触媒(160mg、0.14mmol)、2M炭酸ナトリウム水溶液(20ml)を加え、N2置換下、5時間還流した。反応溶液を水に注ぎ、クロロホルムで抽出を行い、クロロホルム溶液を硫酸ナトリウムで乾燥し、ろ過後、ろ液を減圧乾固した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:1.15g、収率:78%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 8.74-8.71(1H, d), 8.67-8.65(1H, d), 8.62-8.59(1H), 8.26-8.23(1H, d), 7.97-7.88(3H, m), 7.86(1H, s), 7.80-7.67(3H, m), 7.44-7.41(2H)
【化13】

【0035】
ビス[9-(2'-ベンゾチエニル)-フェナンスリナート- N,C3']イリジウム(アセチルアセトン)の合成
9-ベンゾチエニルフェナンスリジリン(706mg、2.3mmol)、塩化イリジウム三水和物(純度:90%、398mg、1.0mmol)に2-エトキシエタノール(30ml)、水(10ml)を加え、16時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体(343mg、0.20mmol)に2-メトキシエタノール(20ml)、アセチルアセトン(1ml)、炭酸ナトリウム(180mg)を加え2時間還流した。溶液を室温まで冷却し生成した固体をろ過した。得られた固体をカラムクロマトグラフィー(展開溶媒:クロロホルム)を用いて生成した(収量:293mg、収率:80%)。
1H HNR (300 MHz, CDCl3, TMS, RT):δ 9.35-9.33(2H, d), 8.72-8.70(2H, d), 8.46-8.44(2H, d), 7.98-7.87(4H, m), 7.85-7.82(2H, d), 7.73-7.70(2H, d), 7.43-7.38(2H, t), 7.20-7.15(2H, t), 7.04-6.99(2H, m), 6.52-6.51(4H, d), 4.50(1H, s), 1.39(6H, s)
【化14】

【0036】
表3に、(btq)2Ir(acac)、(btiq)2Ir(acac)、(btph)2Ir(acac)の1,2-ジクロロエタン中におけるりん光スペクトルを示す。また、これらの化合物のりん光は酸素濃度依存性を示した(データは示さず)。
【0037】
【表3】

【0038】
参考例1〜3のそれぞれにおいて、アセチルアセトン(acac)のかわりにスクシニルアセトン(sa)を反応させることにより、(btq)2Ir(sa)、(btiq)2Ir(sa)、(btph)2Ir(sa)を得ることができる。そして、(btq)2Ir(sa)、(btiq)2Ir(sa)、(btph)2Ir(sa)にアミノ酸やペプチドを反応させることにより、水溶性のイリジウム錯体((btq)2Ir(sa-asp)、(btiq)2Ir(sa-asp)、(btph)2Ir(sa-asp)、(btq)2Ir(sa-asp-asp)、(btiq)2Ir(sa-asp-asp)、(btph)2Ir(sa-asp-asp)など)を得ることができる。
表3より、(btq)2Ir(acac)、(btiq)2Ir(acac)、(btph)2Ir(acac)がりん光を発するため、(btq)2Ir(sa-asp)、(btiq)2Ir(sa-asp)、(btph)2Ir(sa-asp)、(btq)2Ir(sa-asp-asp)、(btiq)2Ir(sa-asp-asp)、(btph)2Ir(sa-asp-asp)などのイリジウム錯体も水溶性のりん光化合物であることが理解できる。
【化15】

【産業上の利用可能性】
【0039】
本発明の酸素濃度検出試薬によれば、水溶液中の酸素濃度を高感度かつリアルタイムで定量することができ、細胞内酸素濃度定量試薬、低酸素細胞画像化薬などとして有用である。
【図面の簡単な説明】
【0040】
【図1】(btp)2Ir(sa)、(btp)2Ir(sa-NH2)、(btp)2Ir(sa-Asp)、(btp)2Ir(sa-Asp-Asp)と、対照の(btp)2Ir(acac)の吸収、りん光スペクトルを示す図。
【図2】Ar置換溶液、空気飽和溶液の(btp)2Ir(sa-Asp-Asp)のりん光スペクトルを示す図。
【特許請求の範囲】
【請求項1】
下記一般式(I)〜(IV)のいずれかで表される化合物(nは1〜5の自然数を表し、Rはアミノ酸残基またはペプチド残基を表す)。
【化1】

【請求項2】
前記アミノ酸残基またはペプチド残基が、側鎖に水酸基、カルボキシル基もしくはアミノ基を有するアミノ酸の残基または該アミノ酸からなるペプチドの残基である、請求項1に記載の化合物。
【請求項3】
前記アミノ酸残基またはペプチド残基が、チロシン、アスパラギン酸、グルタミン酸、リシンおよびアルギニンから選ばれるアミノ酸の残基または該アミノ酸からなるペプチドの残基である、請求項1に記載の化合物。
【請求項4】
前記アミノ酸残基またはペプチド残基が、アスパラギン酸残基またはアスパラギン酸からなるペプチドの残基である、請求項1に記載の化合物。
【請求項5】
下記式(V)または(VI)で表される化合物。
【化2】

【請求項6】
請求項1〜5のいずれか一項に記載の化合物を含む酸素濃度測定試薬。
【請求項1】
下記一般式(I)〜(IV)のいずれかで表される化合物(nは1〜5の自然数を表し、Rはアミノ酸残基またはペプチド残基を表す)。
【化1】

【請求項2】
前記アミノ酸残基またはペプチド残基が、側鎖に水酸基、カルボキシル基もしくはアミノ基を有するアミノ酸の残基または該アミノ酸からなるペプチドの残基である、請求項1に記載の化合物。
【請求項3】
前記アミノ酸残基またはペプチド残基が、チロシン、アスパラギン酸、グルタミン酸、リシンおよびアルギニンから選ばれるアミノ酸の残基または該アミノ酸からなるペプチドの残基である、請求項1に記載の化合物。
【請求項4】
前記アミノ酸残基またはペプチド残基が、アスパラギン酸残基またはアスパラギン酸からなるペプチドの残基である、請求項1に記載の化合物。
【請求項5】
下記式(V)または(VI)で表される化合物。
【化2】

【請求項6】
請求項1〜5のいずれか一項に記載の化合物を含む酸素濃度測定試薬。
【図1】


【図2】




【図2】


【公開番号】特開2010−70494(P2010−70494A)
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願番号】特願2008−239660(P2008−239660)
【出願日】平成20年9月18日(2008.9.18)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度、独立行政法人科学技術振興機構委託研究「産学協同イノベーション化事業 顕在化ステージ イリジウム錯体を用いた癌などの低酸素組織イメージング技術の開発」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願日】平成20年9月18日(2008.9.18)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度、独立行政法人科学技術振興機構委託研究「産学協同イノベーション化事業 顕在化ステージ イリジウム錯体を用いた癌などの低酸素組織イメージング技術の開発」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
[ Back to top ]

