新規溶菌酵素、その製造方法およびその用途
【課題】高い溶菌活性および広い溶菌スペクトルを有する新規な溶菌酵素を提供する。
【解決手段】溶原ファージφgaYを保有する乳酸棹菌の1種であるLactobacillus gasseri JCM1131Tから得た933個のヌクレオチド配列からなるDNAからなる遺伝子およびそのコードするアミノ酸配列からなるタンパク質;該DNAを含む組換えプラスミド;該組換えプラスミドで形質転換された宿主細胞;該宿主細胞を培養してタンパク質を回収することを含む該タンパク質の製造方法;並びに該タンパク質を有効成分として含有する組成物、特には研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤または医療用抗生物質。
【解決手段】溶原ファージφgaYを保有する乳酸棹菌の1種であるLactobacillus gasseri JCM1131Tから得た933個のヌクレオチド配列からなるDNAからなる遺伝子およびそのコードするアミノ酸配列からなるタンパク質;該DNAを含む組換えプラスミド;該組換えプラスミドで形質転換された宿主細胞;該宿主細胞を培養してタンパク質を回収することを含む該タンパク質の製造方法;並びに該タンパク質を有効成分として含有する組成物、特には研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤または医療用抗生物質。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は新規な溶菌酵素、その製造方法およびその用途に関する。より具体的には、溶原ファージφgaYを保有する乳酸棹菌の1種であるLactobacillus gasseri JCM1131Tから得た遺伝子によりコードされる新規な溶菌酵素に関する。
【背景技術】
【0002】
真正細菌はグラム陽性菌とグラム陰性菌とに大別でき、構造的に異なる細胞壁をそれぞれ有している。この細胞壁の主成分は糖鎖とペプチドとの化合物:ペプチドグリカンであるが、さらに分子構造の差異によりムレインとシュードムレインに大別することができる。そして細胞壁を分解する加水分解酵素、所謂溶菌酵素は、近年著しく発展しつつある生命工学分野および医療分野において大きな重要性を有する。例えば、遺伝子の調製、遺伝子組換タンパク質の生産等では細菌の細胞壁を破壊する必要が有るため、溶菌酵素は必須な手段として用いられている。また、溶菌酵素をコードする遺伝子を使用し、発酵スターター細菌の人為的な溶菌制御等、発酵産業への応用も試みられている。
【0003】
さらに、ペプチドグリカンは細菌の細胞壁に特異的な構造であるため、病原細菌の細胞壁を加水分解することにより、溶菌酵素を病原細菌の撲滅に使用できる。病原細菌の撲滅では、溶菌酵素は従来の抗生物質と攻撃機序が異なるため、抗生物質等に耐性を有する薬剤耐性菌にも有効であり、また攻撃対象がペプチドグリカンであるため、細菌にのみ選択的に作用して他の細胞への副作用はないという利点を有する。さらに溶菌酵素がタンパク質であることから、環境汚染に関する問題も回避できる。
【0004】
現在市販されている溶菌酵素剤としては、例えば、ムタノリシン(シグマ社、和光純薬工業株式会社)、リゾスタフィン(シグマ社、和光純薬工業株式会社)、ラビアーゼ(生化学工業株式会社)等が挙げられる。これらのうち、ムタノリシンは2種のタンパク質M1およびM2の混合物であり、タンパク質M1はムラミダーゼ族に属することが知られているが、タンパク質M2については不明である。またラビアーゼは、N−アセチルグルコサミニダーゼ、ムラミダーゼ等を主体とする複合酵素剤である。
【0005】
ところで乳酸菌は、N−アセチルグルコサミニダーゼ、N−アセチルムラミダーゼ、N−アセチルムラミル−L−アラニンアミダーゼ、エンドペプチダーゼ、トランスグリコシラーゼ、カルボキシペプチダーゼを含む多数の細胞壁分解酵素を有することが報告されている(例えば非特許文献1参照)。これは細菌のペプチドグリカン(ムレイン)の分解を触媒し、そしてそれらの細胞成長および細胞分裂における機能が細胞壁合成、娘細胞分離等において確かめられている(例えば非特許文献2参照)。
【0006】
一般に、乳酸菌が有するムラミン加水分解酵素はオートリシンとエンドリシンの2つの群に分けることができる。該オートリシンは、細菌のリボソームによりコードされたムレインの分解およびそれによる溶菌を可能とする酵素である(例えば非特許文献3参照)。しかしながら、Lactobacillus lactis MG1363によりコードされる酵素をを除き、構造および機能は分子および遺伝子レベルまで明らかにされている乳酸菌のオートリシンはない(例えば非特許文献3参照)。
【0007】
他方、前記エンドリシンはファージが保有する溶菌酵素である。該エンドリシンは、宿主細胞自身が持つオートリシンより強い活性を有すると想定されており、そしてラクトコッカスファージφLC3(例えば非特許文献4参照)、Tuc2009(例えば非特許文献5参照)、φvML3(例えば非特許文献6参照)およびr1t(例えば非特許文献7参照)、並びにラ
クトバチルスファージφadh(例えば非特許文献8参照)、LL-H(例えば非特許文献9参照)、mv1(例えば非特許文献10参照)、mv4(例えば非特許文献11参照)およびφg1e(例えば非特許文献12参照)に由来するものを含み、約30種のエンドリシンをコードする溶菌遺伝子が報告されている。
【0008】
しかしながら現在に至るまで、生化学的特性が分子レベルおよび遺伝子レベルまで解析されている溶菌酵素は少なく、特にブドウ球菌、肺炎球菌等の病原細菌が属するグラム陽性菌に有効な溶菌酵素に関する知見は乏しい。また溶菌酵素として商品化されているもの価格は非常に高価であり、また溶菌活性および溶菌スペクトルについても問題が残るものであった。
【非特許文献1】Delcour, J., Ferain, T., Deghorain, M., Palumbo, E., Pascal Hols, P., 1999. The biosynthesis and functionality of the cell-wall of lactic acid bacteria. Antonie van Leeuwenhoek 76, 159-184.
【非特許文献2】Cleveland, R.F., Holtje, J.-V., Wicken, A.J., Tomasz, A., Daneo-Moore, L., Shockman, G.D., 1975. Inhibition of bacterial wall lysins by lipoteichoic acids and related compounds. Biochem. Biophys. Res. Commun. 67, 1128-1135.
【非特許文献3】Buist, G., Karsens, H., Nauta, A., van Sinderen, D., Venema, G., Kok, J. 1997. Autolysis of Lactococcus lactis caused by induced overproduction of its major autolysin, AcmA. Appl. Environ. Microbiol. 63, 2722-2728.
【非特許文献4】Birkeland, N.-K., 1994. Cloning, molecular characterization, and expression of the genes encoding the lytic functions of lactococcal bacteriophage φLC3: a dual lysis system of molecular design. Can. J. Microbiol. 40, 658-665.
【非特許文献5】Arendt, E. K., Daly, C., Fitzgerald, G. F., van de Guchte,M., 1994. Molecular characterization of lactococcal bacteriophage Tuc2009 and identification and analysis of genes encoding lysin, a putative holin, and two structural proteins. Appl. Environ. Microbiol. 60, 1875-1883.
【非特許文献6】Shearman, C.A., Jury, K.L., Gasson, M.J., 1994. Controlled expression and structural organization of a Lactococcus lactis bacteriophage lysin encoded by two overlapping genes. Appl. Environ. Microbiol. 60, 3063-73.
【非特許文献7】van Sinderen, D., Karsens, H., Kok, J., Terpstra, P., Ruiters, M. H. J., Venema, G., Nauta, A., 1996. Sequence analysis and molecular characterization of the temperate lactococcal bacteriophage r1t. Mol. Microbiol. 19,1343-1355.
【非特許文献8】Henrich, B., Binishofer, B., Blasi, U., 1995. Primary structure and functional analysis of the lysis genes of Lactobacillus gasseri bacteriophage φadh. J. Bacteriol. 177, 723-732.
【非特許文献9】Vasala, A., Valkkila, M., Caldentey, J., Alatossava, T., 1995. Genetic and biochemical characterization of the Lactobacillus delbrueckii subsp. lactis bacteriophage LL-H lysin. Appl. Environ. Microbiol. 61, 4004-4011.
【非特許文献10】Boizet, B., Lahbib-Mansais, Y., Dupont, L., Ritzenthaler, P., Mala, M., 1990. Cloning, expression and sequence analysis of an endolysin-encoding gene of Lactobacillus bulgaricus bacteriophage mv1. Gene 94, 61-67.
【非特許文献11】Dupont, L., Vasala, A., Mikkonen, M., Boizet-Bonhoure, B., Alatossava, T., Ritzenthaler, P., 1993. GenBank accession no. Z26590.
【非特許文献12】Oki, M., Kakikawa, M., Yamada, K., Taketo, A., Kodaira, K. -I., 1996. Cloning, sequence analysis, and expression of the gene encoding lytic functions of bacteriophage φg1e. Gene 176, 215-223.
【発明の開示】
【発明が解決しようとする課題】
【0009】
従って、本発明の目的は、高い溶菌活性および広い溶菌スペクトルを有する新規な溶菌酵素を提供することにある。
【課題を解決するための手段】
【0010】
本発明者等は上記課題に鑑み鋭意研究を重ねた結果、乳酸棹菌の1種であるLactobacillus gasseri JCM1131Tから新規な溶菌酵素の遺伝子を分離した。そして該遺伝子が産生するタンパク質の大量産生系を構築し、得られたタンパク質の生化学的特性を検討したところ、既知の同種の酵素群と比較して、高い溶菌活性を示し、また広い溶菌スペクトルを有することを確認して本発明を完成させた。
【0011】
即ち、本発明は以下の1ないし14の観点に関する;
[1]
以下のa)ないしd)のいずれか1つのDNAからなる遺伝子;
a)下記する配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列からなるDNA、
b)下記する配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列を含むDNA、
c)前記a)記載のDNAのヌクレオチド配列と相補的なヌクレオチド配列からなる一本鎖DNAとストリンジェントな条件下でハイブリダイズし、溶菌活性を有するタンパク質をコードする領域を含むDNA、
d)前記a)記載のDNAと95%のヌクレオチド配列相同性を示し、溶菌活性を有するタンパク質をコードする領域を含むDNA。
[2]
以下のa)ないしc)のいずれか1つのタンパク質をコードする遺伝子;
a)下記する配列番号2に表されるアミノ酸配列からなるタンパク質、
b)下記する配列番号2に表されるアミノ酸配列を含むタンパク質、
c)下記する配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、溶菌活性を有するタンパク質。
[3]
前記c)記載のタンパク質において、アミノ酸の欠失、置換および/または付加は、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行われることを特徴とする、上記[3]に記載の遺伝子。
[4]
以下のa)ないしd)のいずれか1つのタンパク質;
a)下記する配列番号2に表されるアミノ酸配列からなるタンパク質、
b)下記する配列番号2に表されるアミノ酸配列を含むタンパク質、
c)下記する配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、溶菌活性を有するタンパク質、
d)請求項1記載のDNAによりコードされ、溶菌活性を有するタンパク質。
[5]
前記c)記載のタンパク質において、アミノ酸の欠失、置換および/または付加は、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行
われることを特徴とする、上記[4]に記載のタンパク質。
[6]
上記[1]ないし[3]のうちの何れか1つに記載の遺伝子を含む組換えプラスミド。[7]
発現ベクターであることを特徴とする、上記[6]に記載の組換えプラスミド。
[8]
上記[6]または[7]に記載の組換えプラスミドで形質転換された宿主細胞。
[9]
グラム陽性細菌であることを特徴とする、上記[8]に記載の宿主細胞。
[10]
大腸菌、乳酸菌、枯草菌またはブドウ球菌であることを特徴とする、上記[9]に記載の宿主細胞。
[11]
以下の工程1)および2)を含む、上記[4]または[5]に記載のタンパク質の製造方法;
1)上記[8]ないし[10]のうちの何れか1つに記載の宿主細胞を、溶菌活性を有するタンパク質の産生が可能な条件下で培養する工程、
2)前記工程1)における培養により得た培養物から、溶菌活性を有するタンパク質を回収する工程。
[12]
上記[11]に記載の製造方法により得られるタンパク質。
[13]
上記[2]または[3]に記載のタンパク質を有効成分として含有する組成物。
[14]
研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤または医療用抗生物質であることを特徴とする、上記[13]に記載の組成物。
【発明の効果】
【0012】
本発明によれば、高い溶菌活性および広い溶菌スペクトルを有する新規な溶菌酵素が提供される。そして該溶菌酵素は生命工学分野および医療分野の用途への適用、特に研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤、医療用抗生物質等の有効成分として好ましく使用することができる。
【発明を実施するための最良の形態】
【0013】
本発明の遺伝子は、ヒトの健康維持における善玉菌として知られているプロバイオティクバクテリアに属する乳酸棹菌の1種であるLactobacillus gasseri JCM1131Tより得ることができる。該Lactobacillus gasseri JCM1131Tは、対数増殖後培養液から菌体を集め緩衝液中に懸濁すると顕著な自己溶菌を示し、また、この菌の培養液上清をザイモグラム法で解析すると54kDaおよび35kDaの溶菌活性を有するタンパク質が見出された。この知見に鑑み、本発明者は、Lactobacillus gasseri JCM1131Tの自己溶菌機構おおび溶菌酵素遺伝子に関する知見を得るために分子レベルでの解析を行った。
【0014】
始めに、Lactobacillus gasseri JCM1131Tのゲノムライブラリを大腸菌プラスミドを用いて構築し、溶菌活性を指標にスクリーニングした。その結果、それぞれ約3.2kbpおよび約3.9kbpの溶菌活性を有する2クローンを得た。これらのクローンは、3’末端の一部の配列を除いて殆ど同一の塩基配列を有し、そして双方のクローン共に、Lactobacillus jonsonii由来の溶菌酵素と相同性を示す310個のアミノ酸からなるタンパク質をコードしていた。
【0015】
次いで、大腸菌内で前記タンパク質の誘導発現を試みると、約33kDaのタンパク質
の発現を認められ、さらにザイモグラム法により、このタンパク質がムラミダーゼ族に属し、Lactobacillus属、Staphylococcus属等のグラム陽性菌に対し幅広い溶菌スペクトルを示すことが判明した。この結果より、Lactobacillus gasseri JCM1131Tは溶原ファージを保有すると推定し、紫外線照射によりファージ誘発を行ったところ、菌の培養液の濁度減少が観察され、そして培養液上清より、正多面体のヘッドと非収縮性のテールを有するファージ:φgaYを検出した。該タンパク質の至適pHは6.5〜7.5、至適温度は37℃であって、2価陽イオン依存は認められなかった。
【0016】
従って本発明の遺伝子の1つの例は、Lactobacillus gasseri JCM1131Tのゲノムライブラリから得た前記2つのクローンに共通し310個のアミノ酸からなるタンパク質をコードする領域に相当する以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列からなるDNAである。以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列を含むDNAからなる遺伝子も、溶菌活性を示す限り本発明に包含される。
【0017】
また、本発明の遺伝子の他の例は、下記する配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列と相補的なヌクレオチド配列からなる一本鎖DNAとストリンジェントな条件下でハイブリダイズし、溶菌活性を有するタンパク質をコードする領域を含むDNAからなるもの、および下記する配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列と95%以上のヌクレオチド配列相同性を示し、溶菌活性を有するタンパク質をコードする領域を含むDNAからなるものが挙げられる。このようなDNAとしては、自然界で発見される変異型DNA、人為的に改変した変異型DNA、異種生物由来の相同DNA等が含まれる。
【0018】
本発明の遺伝子のさらなる例は、前記310個のアミノ酸に相当する以下の配列番号2に表されるアミノ酸配列からなるタンパク質をコードする遺伝子が挙げられる。下記する配列番号2に表されるアミノ酸配列を含むタンパク質をコードする遺伝子も本発明に包含される。ここで、各アミノ酸に対応するコドンは任意に選択でき、また例えば利用する宿主のコドン使用頻度を考慮して常法に従い決定できる。
【0019】
他方、本発明のタンパク質の例としては、以下の配列番号2に表されるアミノ酸配列からなるタンパク質を挙げることができる。以下の配列番号2に表されるアミノ酸配列を含むタンパク質も本発明に包含される。
【0020】
また、以下の配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなるタンパク質であっても、溶菌活性を有する限り本発明に包含される。ここで数個とは、10個を超えない数であり、好ましくは5個以下である。
【0021】
ここで、あるDNAが以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列と相補的なヌクレオチド配列からなる一本鎖DNAとハイブリダイズするか否かは、例えば以下の手順により決定できる:先ず、目的とするDNAをランダムプライマー法、ニックトランスレーション法等に従いプローブを用いて標識する。次いで、ハイブリダイゼーションに用いるDNAを公知の方法、例えばニトロセルロース膜やナイロン膜等に吸着させ、加熱あるいは紫外線照射により固相化する。その膜をその後、例えば6×SSC、5%デンハート溶液および0.1%ドデシル硫酸ナトリウム(SDS)を含むプレハイブリダイゼーション溶液に浸漬し、55℃で4時間以上保温する。ここで先に作成した標識プローブを同様のプレハイブリダイゼーション溶液に最終比活性1×106cpm/mLとなるように添加し、60℃で一晩保温する。膜を57℃で5分間洗浄する操作を5回繰り返し、さらに57℃で20分間洗浄後、オートラジオグラフィーを行うこ
とにより、ハイブリダイズしたか否かを判定することができる。
【0022】
ハイブリダイゼーションの条件は前記条件に限定されず、ストリンジェントな条件下であればよい。本発明において、ストリンジェントな条件下でのハイブリダイゼーションとは、5×SSC(0.75M 塩化ナトリウム、0.075M クエン酸ナトリウム)またはこれと同等の塩濃度のハイブリダイゼーション溶液中、37〜42℃の温度条件下、約12時間行い、5×SSCまたはこれと同等の塩濃度の溶液等で必要に応じて予備洗浄を行った後、1×SSCまたはこれと同等の塩濃度の溶液中で洗浄を行うことからなるハイブリダイゼーションを指す。さらに0.1×SSCまたはこれと同等の塩濃度の溶液中で洗浄を行うこともできる。
【0023】
また、本発明のタンパク質が溶菌活性を有するか否かは、通常の方法により評価できる。より詳しくは、以下の実施例の何れかに詳述されるのと同じかまたはそれに準じた溶菌活性試験を、アミノ酸の欠失、置換および/または付加により生成した改変タンパク質に対して行うことにより、該改変タンパク質の溶菌活性の有無を決定できる。
【0024】
ところで、本発明のタンパク質と他の溶菌酵素との相同性比較および三次元構造予測を行った結果、本発明のタンパク質の活性ドメインであるN末端領域は、β/α−バレル構造を有することが示唆された。そして以下の配列番号2における、アミノ酸番号12のアスパラギン酸、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸またはアミノ酸番号198のアスパラギン酸の何れかがプロトンまたは電子対の供与体として働いていることが推測された。他方、C末端領域は細胞壁認識ドメインを形成すると推測された。
【0025】
この知見に従い、上記4つのアミノ酸に加えて、アミノ酸番号33のグルタミン酸およびアミノ酸番号36のアスパラギン酸について、各々をアラニンに置換した変異体を構築し、その溶菌活性を調査した。すると、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸またはアミノ酸番号98のグルタミン酸を置換した変異体は略完全に溶菌活性を失い、またアミノ酸番号96のアスパラギン酸またはアミノ酸番号198のアスパラギン酸を置換した変異体の溶菌活性は低下した。他方、アミノ酸番号36のアスパラギン酸を置換した変異体の溶菌活性は、未置換の野生株と略同等であった。またさらに無作為変異の導入により、アミノ酸番号10のグリシンをセリンに置換した変異体、およびアミノ酸番号60のヒスチジンをアルギニンに置換した変異体もまた溶菌活性を失うことを見出した。またβ/α−バレル構造のみを発現させた場合にも、溶菌活性を示さないことも見出した。
【0026】
従って本発明の遺伝子およびタンパク質では、前記アミノ酸の欠失、置換および/または付加が、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行われることが好ましい。
【0027】
また本発明のDNAがベクターに挿入された組換えプラスミドも本発明に包含される。該ベクターとしては、一般に知られている様々なベクターを使用でき、原核細胞用ベクター、真核細胞用ベクター、哺乳動物由来の細胞用ベクター等があるが、これに限定されない。このような組換えプラスミドにより、原核生物または真核生物の宿主細胞を形質転換できる。さらに、適当なプロモーター配列および/または形質発現に関わる配列を有するベクターを用いるか、もしくはそのような配列を導入することにより、発現ベクターとすることができ好ましい。
【0028】
本発明の組換えプラスミドを各種細胞に導入することにより得られる宿主細胞も本発明に包含される。該宿主細胞として好ましいのは、グラム陽性細菌、特に大腸菌、乳酸菌、枯草菌、ブドウ球菌等である。
【0029】
本発明のタンパク質は、前記組換えプラスミドにより形質転換した前記宿主細胞を、溶菌活性を有するタンパク質の産生が可能な条件下で培養し、該培養により得た培養物から溶菌活性を有するタンパク質を回収することにより製造できる。宿主細胞の培養方法およびタンパク質の回収方法としては従来一般に知られている方法が使用可能であり、例えば以下の実施例の何れかに詳述されるのと同じかまたはそれに準じた方法により行うことができる。
【0030】
本発明はまた、本発明のタンパク質を有効成分として含有してなる組成物に関する。該組成物は、細菌の細胞壁を分解することが必要となるか、または細胞壁の分解により細菌を死滅させることが必要となる様々な用途に適用できる。該用途としては、具体的には、研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤、医療用抗生物質等が挙げられる。
【0031】
特に、ペプチドグリカンは細菌の細胞壁に特異的な構造であるため、本発明のタンパク質は病原細菌の撲滅に使用できる。本発明のタンパク質は従来用いられている抗生物質と異なる作用機序により病原細菌を死滅させるので、従来の抗生物質によって死滅させることが困難な病原細菌、所謂抗生物質耐性菌に対しても有効であり得る。メチシリン耐性黄色ブドウ球菌(MRSA)等の抗生物質耐性菌は近年特に院内感染等において大きな問題となっており、よって本発明のタンパク質は“酵素抗生物質”として好ましく適用できる。また本発明のタンパク質は、ペプチドグリカンからなる細胞壁を有する細菌にのみ作用するので、投与対象の他の細胞には作用せず、副作用を招く惧れがない。さらに本発明のタンパク質は、化学的に安定な物質である従来の抗生物質と比較して、環境中の放出されたときの負荷も小さい。
【0032】
以下、本発明を具体的な例を示してさらに詳細に説明するが、本発明はこれらの具体例に限定することを意図しない。
【実施例1】
【0033】
Lactobacillus gasseri JCM1131Tからの溶菌活性遺伝子の分離
Lactobacillus gasseri JCM1131T(寄託番号:ATCC33323)の全DNAを以下のサンブルック等の方法(Sambrook et al., Molecular Cloning. A Laboratory Manual,
2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. (1989))に従って調製した。
Lactobacillus gasseri JCM 1131Tを、MRS培地(ディフコ社製)を用い、37℃で一晩静置培養(12時間)した。該培養菌を新たなMRS培地(10mL)に植え継ぎ、菌数が5×108/mLに達したとき、遠心分離法(冷却遠心機、日立製作所製:10000rpm、4℃、10分)で菌体を回収し、滅菌水およびTris−HCl緩衝液(10mM、pH7.5)で遠心洗浄後、溶菌酵素反応緩衝液(10mMのTris−HCl(pH7.5)、12%PEG6000)に懸濁した。ムタノリシン(和光純薬工業社製、2μg/μL)を2μl添加し、60℃で2.5時間、次いで、プロテイナーゼK(タカラ社製、0.4mg/μl)を20μl添加し、37℃で1時間処理した。SDS(3%)を500μl添加し、室温で30分間保温し、次いで遠心分離法で菌体DNAを含む粗抽出液(上清分画)を得た。菌体DNAを、フェノール/クロロホルム処理で部分精製し、組換えプラスミドの作成に用いた。
こうして抽出したDNAを、ショットガンクローニングのために制限酵素Sau3AIで切断して、3171bpおよび3768bpの2種のDNAフラグメントを得た。
【0034】
次いで、該2種のDNAフラグメントをプラスミドpUC118(3162bpの大腸菌ベクター、Ampr、plac、lacZ’)のBamHIサイト中にクローニングして、2つの組換えプラスミド:p118gaY1およびp118gaY2を得た。
組換えプラスミドの作成は以下のサンブルック等の方法(Sambrook et al., Molecular
Cloning. A Laboratory Manual, 2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.(1989))で行った。
上記の菌体DNA(50μg)を制限酵素Sau3AI(0.2単位)で、37℃、1時間部分切断した。プラスミドpUC118のDNAをBamHIで完全分解し、線状DNA分子を得た。該部分切断菌体DNA(3μg)と線状pUC118DNA(0.5μg)を混合し、DNA結合酵素(400単位)を加えた。16℃で16時間の結合反応により組換えプラスミドを作成した。
また同様にして、該組換えプラスミドを使用して以下の3つの組換えプラスミドを得た(図1参照):
・p119gaY3
p118gaY1のMfeI/EcoRIフラグメント(1138bp)をプラスミドpUC119のEcoRIサイトにクローニングして入手。
・p119gaY4
p119gaY3のSmaI/XbaIフラグメント(513bp)をプラスミドpUC119のHincII/XbaIサイトにクローニングして入手。
・p119gaY5
HindIII/XbaIフラグメント(980bp)をプラスミドpUC119のHindIII/XbaIサイトにクローニングして入手。
【0035】
こうして得た5つの組換えプラスミドをエレクトロポレーションにより大腸菌(E. coli)XL1−Blue(supE44、hsdR17、recA1、endA1、gyrA46、thi、relA1、lac-、F’[proAB+、lacIq、lacZΔM15、Tn10(Tetr)])中に導入して形質転換体を得た。
詳細には、先ず大腸菌XL1−BlueをLB(Luria-Bertain)培地を用い、37℃で培養した。一晩(12時間)経過後、培養菌2mLを新鮮なLB培地100mLに植え継ぎ、37℃で培養した。菌数が5×108/mlに達したとき、上記と同様の遠心分離法で集菌した。菌体を滅菌水で3度洗浄し、100μLの蒸留水に懸濁した。該懸濁液に1μLの組換えプラスミドDNA(0.5μg/μl)とPEG6000(10%)を添加した。大腸菌体内への該組換えプラスミドの導入は、ジーンパルサー(登録商標、バイオラッド社製)を用い、電圧1.75kV/cm、静電容量25μF、抵抗600Ωの電気パルス条件を用いたエレクトロポレーション法で行った。電気パルス処理後、LB培地を4倍量加え、37℃で30分間保温し、形質転換体を得た。
【0036】
該形質転換体を、1×109/mLのオートクレーブにより失活させたLactobacillus gasseri JCM1131T細胞、0.1%のトリトンX−100n、100μg/mLのアンピシリンおよび1mMのIPTGを補足したLB(Luria-Bertani)培地中、37℃で24時間培養し、その後4℃で24時間定温放置した。より詳しい条件は以下の通りである:
Lactobacillus gasseri JCM 1131TをLB培地で一晩培養した。集菌後、蒸留水で二回洗浄した後、オートクレーブ(加熱蒸気圧滅菌:三洋電気社製)を用い、110℃、1.5気圧で15分間加熱処理した。1×109/mLに相当する該加熱処理菌体と、0.1%のトリトンX−100n、100μg/mLのアンピシリンを含む固形LB寒天培地(プレート)を径9cmのシャーレに作成した。1mMのIPTGと共に該形質転換体を該寒天プレートに塗布し、37℃で24時間培養した。生成した菌体コロニーを4℃で24時間放置し、溶菌斑を生じる形質転換体を選別分離した。
【0037】
次いで、前記培養プレートを、オートクレーブにより失活させたLactobacillus gasseri JCM1131T細胞に対する、トリトンX−100誘導溶菌表現型についてスクリーニングした。
その結果、組換えプラスミドp118gaY1およびp118gaY2により形質転換した大腸菌は、IPTGでの誘導により約33kDaの同じ分子量を持つタンパク質を産生し、該タンパク質は失活させたLactobacillus gasseri JCM1131T細胞に対し溶菌活性を示した。その結果、これらの形質転換体のコロニーの周囲には明らかなハロ領域が形成した(図2参照)。
組換えプラスミドp118gaY1により形質転換した大腸菌を37℃で時間を変えて培養し、培養により産生したタンパク質をSDSゲル上での電気泳動により分析した結果を図3(A)に示す。図3(A)は、培養時間が最も短いもの(最も左側のレーン)から最も長いもの(最も右側のレーン)に増加するにつれて、約33kDaのタンパク質(矢印部分)の産生が増加したことを明らかに示している。
また、組換えプラスミドp118gaY1により形質転換した大腸菌による約33kDaのタンパク質の産生を、他のプラスミドで形質転換した大腸菌と比較した結果を図3(B)に示す。レーン1はマーカーであり、レーン2ないしレーン5はpUC118で形質転換した大腸菌をそれぞれ0、1、2および3時間培養した結果であり、レーン6ないし9はp118gaY1で形質転換した大腸菌をそれぞれ0、1、2および3時間培養した結果である。これにより、プラスミドpUC118で形質転換した大腸菌は約33kDaのタンパク質(矢印部分)の産生を誘導しないのに対し、組換えプラスミドp118gaY1により形質転換した大腸菌は、時間と共に該タンパク質を産生することが解る。
【実施例2】
【0038】
p118gaY1およびp118gaY2の配列決定
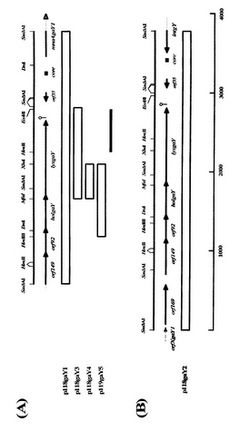
Lactobacillus gasseriの全遺伝子ショットガン配列(GenBank受入番号NZ_AAA002000006)に基き、p118gaY1およびp118gaY2の挿入DNAフラグメントの配列を決定した(。決定したDNA配列の物理マップを図1に示す。
図1に示すように、p118gaY1に挿入したDNAフラグメントは、orf149、orf92、holgaY、lysgaY、orf35およびmnaAgaY1をコードし、またp118gaY2に挿入したDNAフラグメントは、orfXgaY1、orf169、orf149、orf92、holgaY、lysgaY、orf35intgaYをコードしていた。
これらのうちholgaYとorf35との間に位置するlysgaYは、その分子量が33.7kDaであると推計される310アミノ酸からなるタンパク質であり、そして該タンパク質の分子量は、p118gaY1およびp118gaY2により形質転換した大腸菌がIPTG誘導により産生し溶菌活性の要因と推測されるタンパク質の分子量と同一であった。これらの理由により、lysgaYをLactobacillus gasseri JCM1131Tが産生する溶菌性タンパク質であると決定した。lysgaYをコードするヌクレオチド配列を以下の配列番号1に、また該ヌクレオチド配列によりコードされるlysgaYのアミノ酸配列を以下の配列番号2に示す。またlysgaYをコードする遺伝子の境界領域を図4に図示する。図4は境界領域のみを示し、N末端とC末端の間の中間部分は省略されている。また図4において、lysgaYの下流に存在する転写終結因子として機能し得る38塩基のステム−ループ2次構造を矢印で示す。
【0039】
p118gaY1およびp118gaY2により形質転換した大腸菌が産生した33kDaのタンパク質がlysgaYであることを確認するために、lysgaYのみを含むMfel/EcoRI断片をプラスミドpUC118に挿入して組換えプラスミドp119gaY3を入手し、上記と同様にしてp119gaY3により大腸菌を形質転換し、そしてlysgaYの誘導発現を試みた。その結果、p119gaY3は予測通り33kDaのタンパク質(lysgaY)を産生した。
【実施例3】
【0040】
lysgaYの溶菌活性評価
lysgaYの溶菌活性を、オートクレーブにより失活させた3種のグラム陽性菌:Lactobacillus gasseri JCM1134T、Staphylococcus warneri MおよびMicrococcus luteusについて評価し、その溶菌活性を市販の溶菌酵素剤であるムタノリシンおよび卵白リゾチーム(共にシグマ社製)のものと比較した。
オートクレーブ処理した3種類の菌体をTris−HCl(pH7.5)3mLに懸濁し、660nmでの吸光度が0.5となるように調整した。次いで、lysgaY0.06μg/μLを添加し37℃で保温した。スペクトロニック20(ミルトン・ロイ社製)を用い、660nmでの吸光度の経時変化を15分ごとに測定して、活性評価試験を行った。
上記した660nmでの吸光度の経時変化を、各タンパク質について、吸光度を縦軸(OD660)に、また時間(分)を横軸にとったグラフとして図5に示す。
また得られた各タンパク質の酵素活性(U/μg)を、3種の基質毎に表1に示す。
【表1】

【0041】
試験結果から明らかなように、本発明のタンパク質であるlysgaYは3種全ての基質に対して溶菌活性を示した。特にLactobacillus gasseri JCM1134Tに対する溶菌活性は高く、ムタノリシンの溶菌活性に匹敵していた。
他方、卵白リゾチームはLactobacillus gasseri JCM1134Tに対する溶菌活性を殆ど示さなかった。
【実施例4】
【0042】
lysgaYの溶菌スペクトル評価
lysgaYの溶菌スペクトルを、オートクレーブで失活させた様々なグラム陽性菌を基質として、以下の手順に従い評価した:
LysgaYの溶菌スペクトルをザイモグラフィー法を用い以下の手順で評価した。
各グラム陽性菌をオートクレーブ処理して基質とした。該基質(湿潤、2%wt/vol)を含有するSDSポリアクリルアミドゲル(10%)を作成し、LysgaYを電気泳動した。次いで泳動終了ゲルを、0.1%のトリトンX−100nを含む50mMのTris−HCl中、37℃で24時間保温した。その後、0.1%のメチレンブルーで染色し、溶菌活性を検出した。
結果を表2に示す。表2では+++が強い溶菌活性を、++が中程度の溶菌活性を、+が弱い溶菌活性を示し、そして−は溶菌活性が検出されなかったことを示す。また比較の目的で同様に評価したLactobacillus plantarum G1e phage φg1eがコードするエンドリシン:Lysgleの溶菌スペクトルを共に示す。
【表2】

【0043】
表2に示す結果から明らかなように、、本発明のタンパク質であるlysgaYは、試験した18種のグラム陽性菌のうち、Staphylococcus haemolyticusを除く全てについて少なくとも弱い溶菌活性を示し、その殆どでは中程度以上の溶菌活性を示した。これらの結果より、lysgaYが広い溶菌スペクトルを有することを確認できた。
他方、Lysgleは僅かに2種のグラム陽性菌でのみしか溶菌活性を示さず、また示した溶菌活性もlysgaYのものと比較すると弱かった。
【0044】
・配列番号1:lysgaYをコードする遺伝子のヌクレオチド配列
atg gtt gaa gta gct aaa aga agt tac ggt gta gat gta tca agt cat aac aac ggc aat tat tcc gga tcg aaa ttt gcc gtt gtt aaa gtg tca gag ggc tta gat tat cgt aat cct aaa gca caa tct caa gta tct act gca aga gct aat agt atg ttg cca atg gct tat cac tat gcg agg ttt agt ggc aat agt aac gta gca att caa gaa ggt aac tat gca gtt act tct gca aaa gct gtt ggt ctt gag gca ggt act tac tta gct tgt gac tat gaa caa gga agt gga aac gaa act aga gga gat cgt gaa act aat acg act gct atc tta tct ttc tta gat act att gtg ggt gct ggt tat aag cct tta cta tac tca ggc gct tat ctt atg aga gac aaa att aat act tct aga att tta gcc aag tat cct aat tgt ttg tgg gta gca gca tat cca tca ggt aat ggt act gcg gta agt gaa cca aac ttt ggc tac ttt cca tca atg aac gga gta gca att tgg caa ttt acc gat aac tgg cgt ggg tta aat gtt gac gga aac atc agc ttg att gat cta aaa aat gat agc aaa cca gta gct cag cca tct gtt gca caa tca gca tca gaa aaa aca tgg act gat gta caa ggt atg act tgg cat gaa gaa cat ggt act ttc atc act ggt gga gcg att aat ctt cgc tgg ggc gct aat acg caa agc aca ctg att acc acc tta cca gca ggt tca gaa gtt aaa tac aat gct tgg gct aga gat agt gct ggg cgt gta tgg tta cag caa ccg aga gaa aat ggt aag aat ggc tat tta gtt ggt cgt gtc ggc agt gag ccg tgg gga act ttc aaa taa
【0045】
・配列番号2:lysgaYのアミノ酸配列
Met Val Glu Val Ala Lys Arg Ser Tyr Gly Val Asp Val Ser Ser His Asn Asn Gly Asn Tyr Ser Gly Ser Lys Phe Ala Val Val Lys Val Ser Glu Gly Leu Asp Tyr Arg Asn Pro Lys Ala Gln Ser Gln Val Ser Thr Ala Arg Ala Asn Ser Met Leu Pro Met Ala Tyr His Tyr Ala Arg Phe Ser Gly Asn Ser Asn Val Ala Ile Gln Glu Gly Asn Tyr Ala Val Thr Ser Ala Lys Ala Val Gly Leu Glu Ala Gly Thr Tyr Leu Ala Cys Asp Tyr Glu Gln Gly Ser Gly Asn Glu Thr Arg Gly Asp Arg Glu Thr Asn Thr Thr Ala Ile Leu Ser Phe Leu Asp Thr Ile Val Gly Ala Gly Tyr Lys Pro Leu Leu Tyr Ser Gly Ala Tyr Leu Met Arg Asp Lys Ile Asn Thr Ser Arg Ile Leu Ala Lys Tyr Pro Asn Cys Leu Trp Val Ala Ala Tyr Pro Ser Gly Asn Gly Thr Ala Val Ser Glu Pro Asn Phe Gly Tyr Phe Pro Ser Met Asn Gly Val Ala Ile Trp Gln Phe Thr Asp Asn Trp Arg Gly Leu Asn Val Asp Gly Asn Ile Ser Leu Ile Asp Leu Lys Asn Asp Ser Lys Pro Val Ala Gln Pro Ser Val Ala Gln Ser Ala Ser Glu Lys Thr Trp Thr Asp Val Gln Gly Met Thr Trp His Glu Glu His Gly Thr Phe Ile Thr Gly Gly Ala Ile Asn Leu Arg Trp Gly Ala Asn Thr Gln Ser Thr Leu Ile Thr Thr Leu Pro Ala Gly Ser Glu Val Lys Tyr Asn Ala Trp Ala Arg Asp Ser Ala Gly Arg Val Trp Leu Gln Gln Pro Arg Glu Asn Gly Lys Asn Gly Tyr Leu Val Gly Arg Val Gly Ser Glu Pro Trp Gly Thr Phe Lys
【図面の簡単な説明】
【0046】
【図1】図1は、実施例1の組換えプラスミドが含むDNAフラグメントを図示する物理マップであり、(A)はp118gaY1、p118gaY3、p118gaY4およびp119gaY5を示し、(B)はp118gaY2を示す。
【図2】図2は、実施例1における形質転換大腸菌の培養結果の写真を表す図である。
【図3】図3は、実施例1において形質転換大腸菌が産生したタンパク質の電気泳動結果の写真を表す図であり、(A)は時間を変えたときの結果を表し、そして(B)はp118gaY1により形質転換した大腸菌によるタンパク質の産生を他のプラスミドで形質転換したもの比較した結果を表す。
【図4】図4は、lysgaYをコードする遺伝子の境界領域を図示する。
【図5】図5は、実施例4における溶菌活性評価の結果を図示するグラフである。
【技術分野】
【0001】
本発明は新規な溶菌酵素、その製造方法およびその用途に関する。より具体的には、溶原ファージφgaYを保有する乳酸棹菌の1種であるLactobacillus gasseri JCM1131Tから得た遺伝子によりコードされる新規な溶菌酵素に関する。
【背景技術】
【0002】
真正細菌はグラム陽性菌とグラム陰性菌とに大別でき、構造的に異なる細胞壁をそれぞれ有している。この細胞壁の主成分は糖鎖とペプチドとの化合物:ペプチドグリカンであるが、さらに分子構造の差異によりムレインとシュードムレインに大別することができる。そして細胞壁を分解する加水分解酵素、所謂溶菌酵素は、近年著しく発展しつつある生命工学分野および医療分野において大きな重要性を有する。例えば、遺伝子の調製、遺伝子組換タンパク質の生産等では細菌の細胞壁を破壊する必要が有るため、溶菌酵素は必須な手段として用いられている。また、溶菌酵素をコードする遺伝子を使用し、発酵スターター細菌の人為的な溶菌制御等、発酵産業への応用も試みられている。
【0003】
さらに、ペプチドグリカンは細菌の細胞壁に特異的な構造であるため、病原細菌の細胞壁を加水分解することにより、溶菌酵素を病原細菌の撲滅に使用できる。病原細菌の撲滅では、溶菌酵素は従来の抗生物質と攻撃機序が異なるため、抗生物質等に耐性を有する薬剤耐性菌にも有効であり、また攻撃対象がペプチドグリカンであるため、細菌にのみ選択的に作用して他の細胞への副作用はないという利点を有する。さらに溶菌酵素がタンパク質であることから、環境汚染に関する問題も回避できる。
【0004】
現在市販されている溶菌酵素剤としては、例えば、ムタノリシン(シグマ社、和光純薬工業株式会社)、リゾスタフィン(シグマ社、和光純薬工業株式会社)、ラビアーゼ(生化学工業株式会社)等が挙げられる。これらのうち、ムタノリシンは2種のタンパク質M1およびM2の混合物であり、タンパク質M1はムラミダーゼ族に属することが知られているが、タンパク質M2については不明である。またラビアーゼは、N−アセチルグルコサミニダーゼ、ムラミダーゼ等を主体とする複合酵素剤である。
【0005】
ところで乳酸菌は、N−アセチルグルコサミニダーゼ、N−アセチルムラミダーゼ、N−アセチルムラミル−L−アラニンアミダーゼ、エンドペプチダーゼ、トランスグリコシラーゼ、カルボキシペプチダーゼを含む多数の細胞壁分解酵素を有することが報告されている(例えば非特許文献1参照)。これは細菌のペプチドグリカン(ムレイン)の分解を触媒し、そしてそれらの細胞成長および細胞分裂における機能が細胞壁合成、娘細胞分離等において確かめられている(例えば非特許文献2参照)。
【0006】
一般に、乳酸菌が有するムラミン加水分解酵素はオートリシンとエンドリシンの2つの群に分けることができる。該オートリシンは、細菌のリボソームによりコードされたムレインの分解およびそれによる溶菌を可能とする酵素である(例えば非特許文献3参照)。しかしながら、Lactobacillus lactis MG1363によりコードされる酵素をを除き、構造および機能は分子および遺伝子レベルまで明らかにされている乳酸菌のオートリシンはない(例えば非特許文献3参照)。
【0007】
他方、前記エンドリシンはファージが保有する溶菌酵素である。該エンドリシンは、宿主細胞自身が持つオートリシンより強い活性を有すると想定されており、そしてラクトコッカスファージφLC3(例えば非特許文献4参照)、Tuc2009(例えば非特許文献5参照)、φvML3(例えば非特許文献6参照)およびr1t(例えば非特許文献7参照)、並びにラ
クトバチルスファージφadh(例えば非特許文献8参照)、LL-H(例えば非特許文献9参照)、mv1(例えば非特許文献10参照)、mv4(例えば非特許文献11参照)およびφg1e(例えば非特許文献12参照)に由来するものを含み、約30種のエンドリシンをコードする溶菌遺伝子が報告されている。
【0008】
しかしながら現在に至るまで、生化学的特性が分子レベルおよび遺伝子レベルまで解析されている溶菌酵素は少なく、特にブドウ球菌、肺炎球菌等の病原細菌が属するグラム陽性菌に有効な溶菌酵素に関する知見は乏しい。また溶菌酵素として商品化されているもの価格は非常に高価であり、また溶菌活性および溶菌スペクトルについても問題が残るものであった。
【非特許文献1】Delcour, J., Ferain, T., Deghorain, M., Palumbo, E., Pascal Hols, P., 1999. The biosynthesis and functionality of the cell-wall of lactic acid bacteria. Antonie van Leeuwenhoek 76, 159-184.
【非特許文献2】Cleveland, R.F., Holtje, J.-V., Wicken, A.J., Tomasz, A., Daneo-Moore, L., Shockman, G.D., 1975. Inhibition of bacterial wall lysins by lipoteichoic acids and related compounds. Biochem. Biophys. Res. Commun. 67, 1128-1135.
【非特許文献3】Buist, G., Karsens, H., Nauta, A., van Sinderen, D., Venema, G., Kok, J. 1997. Autolysis of Lactococcus lactis caused by induced overproduction of its major autolysin, AcmA. Appl. Environ. Microbiol. 63, 2722-2728.
【非特許文献4】Birkeland, N.-K., 1994. Cloning, molecular characterization, and expression of the genes encoding the lytic functions of lactococcal bacteriophage φLC3: a dual lysis system of molecular design. Can. J. Microbiol. 40, 658-665.
【非特許文献5】Arendt, E. K., Daly, C., Fitzgerald, G. F., van de Guchte,M., 1994. Molecular characterization of lactococcal bacteriophage Tuc2009 and identification and analysis of genes encoding lysin, a putative holin, and two structural proteins. Appl. Environ. Microbiol. 60, 1875-1883.
【非特許文献6】Shearman, C.A., Jury, K.L., Gasson, M.J., 1994. Controlled expression and structural organization of a Lactococcus lactis bacteriophage lysin encoded by two overlapping genes. Appl. Environ. Microbiol. 60, 3063-73.
【非特許文献7】van Sinderen, D., Karsens, H., Kok, J., Terpstra, P., Ruiters, M. H. J., Venema, G., Nauta, A., 1996. Sequence analysis and molecular characterization of the temperate lactococcal bacteriophage r1t. Mol. Microbiol. 19,1343-1355.
【非特許文献8】Henrich, B., Binishofer, B., Blasi, U., 1995. Primary structure and functional analysis of the lysis genes of Lactobacillus gasseri bacteriophage φadh. J. Bacteriol. 177, 723-732.
【非特許文献9】Vasala, A., Valkkila, M., Caldentey, J., Alatossava, T., 1995. Genetic and biochemical characterization of the Lactobacillus delbrueckii subsp. lactis bacteriophage LL-H lysin. Appl. Environ. Microbiol. 61, 4004-4011.
【非特許文献10】Boizet, B., Lahbib-Mansais, Y., Dupont, L., Ritzenthaler, P., Mala, M., 1990. Cloning, expression and sequence analysis of an endolysin-encoding gene of Lactobacillus bulgaricus bacteriophage mv1. Gene 94, 61-67.
【非特許文献11】Dupont, L., Vasala, A., Mikkonen, M., Boizet-Bonhoure, B., Alatossava, T., Ritzenthaler, P., 1993. GenBank accession no. Z26590.
【非特許文献12】Oki, M., Kakikawa, M., Yamada, K., Taketo, A., Kodaira, K. -I., 1996. Cloning, sequence analysis, and expression of the gene encoding lytic functions of bacteriophage φg1e. Gene 176, 215-223.
【発明の開示】
【発明が解決しようとする課題】
【0009】
従って、本発明の目的は、高い溶菌活性および広い溶菌スペクトルを有する新規な溶菌酵素を提供することにある。
【課題を解決するための手段】
【0010】
本発明者等は上記課題に鑑み鋭意研究を重ねた結果、乳酸棹菌の1種であるLactobacillus gasseri JCM1131Tから新規な溶菌酵素の遺伝子を分離した。そして該遺伝子が産生するタンパク質の大量産生系を構築し、得られたタンパク質の生化学的特性を検討したところ、既知の同種の酵素群と比較して、高い溶菌活性を示し、また広い溶菌スペクトルを有することを確認して本発明を完成させた。
【0011】
即ち、本発明は以下の1ないし14の観点に関する;
[1]
以下のa)ないしd)のいずれか1つのDNAからなる遺伝子;
a)下記する配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列からなるDNA、
b)下記する配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列を含むDNA、
c)前記a)記載のDNAのヌクレオチド配列と相補的なヌクレオチド配列からなる一本鎖DNAとストリンジェントな条件下でハイブリダイズし、溶菌活性を有するタンパク質をコードする領域を含むDNA、
d)前記a)記載のDNAと95%のヌクレオチド配列相同性を示し、溶菌活性を有するタンパク質をコードする領域を含むDNA。
[2]
以下のa)ないしc)のいずれか1つのタンパク質をコードする遺伝子;
a)下記する配列番号2に表されるアミノ酸配列からなるタンパク質、
b)下記する配列番号2に表されるアミノ酸配列を含むタンパク質、
c)下記する配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、溶菌活性を有するタンパク質。
[3]
前記c)記載のタンパク質において、アミノ酸の欠失、置換および/または付加は、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行われることを特徴とする、上記[3]に記載の遺伝子。
[4]
以下のa)ないしd)のいずれか1つのタンパク質;
a)下記する配列番号2に表されるアミノ酸配列からなるタンパク質、
b)下記する配列番号2に表されるアミノ酸配列を含むタンパク質、
c)下記する配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、溶菌活性を有するタンパク質、
d)請求項1記載のDNAによりコードされ、溶菌活性を有するタンパク質。
[5]
前記c)記載のタンパク質において、アミノ酸の欠失、置換および/または付加は、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行
われることを特徴とする、上記[4]に記載のタンパク質。
[6]
上記[1]ないし[3]のうちの何れか1つに記載の遺伝子を含む組換えプラスミド。[7]
発現ベクターであることを特徴とする、上記[6]に記載の組換えプラスミド。
[8]
上記[6]または[7]に記載の組換えプラスミドで形質転換された宿主細胞。
[9]
グラム陽性細菌であることを特徴とする、上記[8]に記載の宿主細胞。
[10]
大腸菌、乳酸菌、枯草菌またはブドウ球菌であることを特徴とする、上記[9]に記載の宿主細胞。
[11]
以下の工程1)および2)を含む、上記[4]または[5]に記載のタンパク質の製造方法;
1)上記[8]ないし[10]のうちの何れか1つに記載の宿主細胞を、溶菌活性を有するタンパク質の産生が可能な条件下で培養する工程、
2)前記工程1)における培養により得た培養物から、溶菌活性を有するタンパク質を回収する工程。
[12]
上記[11]に記載の製造方法により得られるタンパク質。
[13]
上記[2]または[3]に記載のタンパク質を有効成分として含有する組成物。
[14]
研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤または医療用抗生物質であることを特徴とする、上記[13]に記載の組成物。
【発明の効果】
【0012】
本発明によれば、高い溶菌活性および広い溶菌スペクトルを有する新規な溶菌酵素が提供される。そして該溶菌酵素は生命工学分野および医療分野の用途への適用、特に研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤、医療用抗生物質等の有効成分として好ましく使用することができる。
【発明を実施するための最良の形態】
【0013】
本発明の遺伝子は、ヒトの健康維持における善玉菌として知られているプロバイオティクバクテリアに属する乳酸棹菌の1種であるLactobacillus gasseri JCM1131Tより得ることができる。該Lactobacillus gasseri JCM1131Tは、対数増殖後培養液から菌体を集め緩衝液中に懸濁すると顕著な自己溶菌を示し、また、この菌の培養液上清をザイモグラム法で解析すると54kDaおよび35kDaの溶菌活性を有するタンパク質が見出された。この知見に鑑み、本発明者は、Lactobacillus gasseri JCM1131Tの自己溶菌機構おおび溶菌酵素遺伝子に関する知見を得るために分子レベルでの解析を行った。
【0014】
始めに、Lactobacillus gasseri JCM1131Tのゲノムライブラリを大腸菌プラスミドを用いて構築し、溶菌活性を指標にスクリーニングした。その結果、それぞれ約3.2kbpおよび約3.9kbpの溶菌活性を有する2クローンを得た。これらのクローンは、3’末端の一部の配列を除いて殆ど同一の塩基配列を有し、そして双方のクローン共に、Lactobacillus jonsonii由来の溶菌酵素と相同性を示す310個のアミノ酸からなるタンパク質をコードしていた。
【0015】
次いで、大腸菌内で前記タンパク質の誘導発現を試みると、約33kDaのタンパク質
の発現を認められ、さらにザイモグラム法により、このタンパク質がムラミダーゼ族に属し、Lactobacillus属、Staphylococcus属等のグラム陽性菌に対し幅広い溶菌スペクトルを示すことが判明した。この結果より、Lactobacillus gasseri JCM1131Tは溶原ファージを保有すると推定し、紫外線照射によりファージ誘発を行ったところ、菌の培養液の濁度減少が観察され、そして培養液上清より、正多面体のヘッドと非収縮性のテールを有するファージ:φgaYを検出した。該タンパク質の至適pHは6.5〜7.5、至適温度は37℃であって、2価陽イオン依存は認められなかった。
【0016】
従って本発明の遺伝子の1つの例は、Lactobacillus gasseri JCM1131Tのゲノムライブラリから得た前記2つのクローンに共通し310個のアミノ酸からなるタンパク質をコードする領域に相当する以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列からなるDNAである。以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列を含むDNAからなる遺伝子も、溶菌活性を示す限り本発明に包含される。
【0017】
また、本発明の遺伝子の他の例は、下記する配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列と相補的なヌクレオチド配列からなる一本鎖DNAとストリンジェントな条件下でハイブリダイズし、溶菌活性を有するタンパク質をコードする領域を含むDNAからなるもの、および下記する配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列と95%以上のヌクレオチド配列相同性を示し、溶菌活性を有するタンパク質をコードする領域を含むDNAからなるものが挙げられる。このようなDNAとしては、自然界で発見される変異型DNA、人為的に改変した変異型DNA、異種生物由来の相同DNA等が含まれる。
【0018】
本発明の遺伝子のさらなる例は、前記310個のアミノ酸に相当する以下の配列番号2に表されるアミノ酸配列からなるタンパク質をコードする遺伝子が挙げられる。下記する配列番号2に表されるアミノ酸配列を含むタンパク質をコードする遺伝子も本発明に包含される。ここで、各アミノ酸に対応するコドンは任意に選択でき、また例えば利用する宿主のコドン使用頻度を考慮して常法に従い決定できる。
【0019】
他方、本発明のタンパク質の例としては、以下の配列番号2に表されるアミノ酸配列からなるタンパク質を挙げることができる。以下の配列番号2に表されるアミノ酸配列を含むタンパク質も本発明に包含される。
【0020】
また、以下の配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなるタンパク質であっても、溶菌活性を有する限り本発明に包含される。ここで数個とは、10個を超えない数であり、好ましくは5個以下である。
【0021】
ここで、あるDNAが以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列と相補的なヌクレオチド配列からなる一本鎖DNAとハイブリダイズするか否かは、例えば以下の手順により決定できる:先ず、目的とするDNAをランダムプライマー法、ニックトランスレーション法等に従いプローブを用いて標識する。次いで、ハイブリダイゼーションに用いるDNAを公知の方法、例えばニトロセルロース膜やナイロン膜等に吸着させ、加熱あるいは紫外線照射により固相化する。その膜をその後、例えば6×SSC、5%デンハート溶液および0.1%ドデシル硫酸ナトリウム(SDS)を含むプレハイブリダイゼーション溶液に浸漬し、55℃で4時間以上保温する。ここで先に作成した標識プローブを同様のプレハイブリダイゼーション溶液に最終比活性1×106cpm/mLとなるように添加し、60℃で一晩保温する。膜を57℃で5分間洗浄する操作を5回繰り返し、さらに57℃で20分間洗浄後、オートラジオグラフィーを行うこ
とにより、ハイブリダイズしたか否かを判定することができる。
【0022】
ハイブリダイゼーションの条件は前記条件に限定されず、ストリンジェントな条件下であればよい。本発明において、ストリンジェントな条件下でのハイブリダイゼーションとは、5×SSC(0.75M 塩化ナトリウム、0.075M クエン酸ナトリウム)またはこれと同等の塩濃度のハイブリダイゼーション溶液中、37〜42℃の温度条件下、約12時間行い、5×SSCまたはこれと同等の塩濃度の溶液等で必要に応じて予備洗浄を行った後、1×SSCまたはこれと同等の塩濃度の溶液中で洗浄を行うことからなるハイブリダイゼーションを指す。さらに0.1×SSCまたはこれと同等の塩濃度の溶液中で洗浄を行うこともできる。
【0023】
また、本発明のタンパク質が溶菌活性を有するか否かは、通常の方法により評価できる。より詳しくは、以下の実施例の何れかに詳述されるのと同じかまたはそれに準じた溶菌活性試験を、アミノ酸の欠失、置換および/または付加により生成した改変タンパク質に対して行うことにより、該改変タンパク質の溶菌活性の有無を決定できる。
【0024】
ところで、本発明のタンパク質と他の溶菌酵素との相同性比較および三次元構造予測を行った結果、本発明のタンパク質の活性ドメインであるN末端領域は、β/α−バレル構造を有することが示唆された。そして以下の配列番号2における、アミノ酸番号12のアスパラギン酸、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸またはアミノ酸番号198のアスパラギン酸の何れかがプロトンまたは電子対の供与体として働いていることが推測された。他方、C末端領域は細胞壁認識ドメインを形成すると推測された。
【0025】
この知見に従い、上記4つのアミノ酸に加えて、アミノ酸番号33のグルタミン酸およびアミノ酸番号36のアスパラギン酸について、各々をアラニンに置換した変異体を構築し、その溶菌活性を調査した。すると、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸またはアミノ酸番号98のグルタミン酸を置換した変異体は略完全に溶菌活性を失い、またアミノ酸番号96のアスパラギン酸またはアミノ酸番号198のアスパラギン酸を置換した変異体の溶菌活性は低下した。他方、アミノ酸番号36のアスパラギン酸を置換した変異体の溶菌活性は、未置換の野生株と略同等であった。またさらに無作為変異の導入により、アミノ酸番号10のグリシンをセリンに置換した変異体、およびアミノ酸番号60のヒスチジンをアルギニンに置換した変異体もまた溶菌活性を失うことを見出した。またβ/α−バレル構造のみを発現させた場合にも、溶菌活性を示さないことも見出した。
【0026】
従って本発明の遺伝子およびタンパク質では、前記アミノ酸の欠失、置換および/または付加が、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行われることが好ましい。
【0027】
また本発明のDNAがベクターに挿入された組換えプラスミドも本発明に包含される。該ベクターとしては、一般に知られている様々なベクターを使用でき、原核細胞用ベクター、真核細胞用ベクター、哺乳動物由来の細胞用ベクター等があるが、これに限定されない。このような組換えプラスミドにより、原核生物または真核生物の宿主細胞を形質転換できる。さらに、適当なプロモーター配列および/または形質発現に関わる配列を有するベクターを用いるか、もしくはそのような配列を導入することにより、発現ベクターとすることができ好ましい。
【0028】
本発明の組換えプラスミドを各種細胞に導入することにより得られる宿主細胞も本発明に包含される。該宿主細胞として好ましいのは、グラム陽性細菌、特に大腸菌、乳酸菌、枯草菌、ブドウ球菌等である。
【0029】
本発明のタンパク質は、前記組換えプラスミドにより形質転換した前記宿主細胞を、溶菌活性を有するタンパク質の産生が可能な条件下で培養し、該培養により得た培養物から溶菌活性を有するタンパク質を回収することにより製造できる。宿主細胞の培養方法およびタンパク質の回収方法としては従来一般に知られている方法が使用可能であり、例えば以下の実施例の何れかに詳述されるのと同じかまたはそれに準じた方法により行うことができる。
【0030】
本発明はまた、本発明のタンパク質を有効成分として含有してなる組成物に関する。該組成物は、細菌の細胞壁を分解することが必要となるか、または細胞壁の分解により細菌を死滅させることが必要となる様々な用途に適用できる。該用途としては、具体的には、研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤、医療用抗生物質等が挙げられる。
【0031】
特に、ペプチドグリカンは細菌の細胞壁に特異的な構造であるため、本発明のタンパク質は病原細菌の撲滅に使用できる。本発明のタンパク質は従来用いられている抗生物質と異なる作用機序により病原細菌を死滅させるので、従来の抗生物質によって死滅させることが困難な病原細菌、所謂抗生物質耐性菌に対しても有効であり得る。メチシリン耐性黄色ブドウ球菌(MRSA)等の抗生物質耐性菌は近年特に院内感染等において大きな問題となっており、よって本発明のタンパク質は“酵素抗生物質”として好ましく適用できる。また本発明のタンパク質は、ペプチドグリカンからなる細胞壁を有する細菌にのみ作用するので、投与対象の他の細胞には作用せず、副作用を招く惧れがない。さらに本発明のタンパク質は、化学的に安定な物質である従来の抗生物質と比較して、環境中の放出されたときの負荷も小さい。
【0032】
以下、本発明を具体的な例を示してさらに詳細に説明するが、本発明はこれらの具体例に限定することを意図しない。
【実施例1】
【0033】
Lactobacillus gasseri JCM1131Tからの溶菌活性遺伝子の分離
Lactobacillus gasseri JCM1131T(寄託番号:ATCC33323)の全DNAを以下のサンブルック等の方法(Sambrook et al., Molecular Cloning. A Laboratory Manual,
2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. (1989))に従って調製した。
Lactobacillus gasseri JCM 1131Tを、MRS培地(ディフコ社製)を用い、37℃で一晩静置培養(12時間)した。該培養菌を新たなMRS培地(10mL)に植え継ぎ、菌数が5×108/mLに達したとき、遠心分離法(冷却遠心機、日立製作所製:10000rpm、4℃、10分)で菌体を回収し、滅菌水およびTris−HCl緩衝液(10mM、pH7.5)で遠心洗浄後、溶菌酵素反応緩衝液(10mMのTris−HCl(pH7.5)、12%PEG6000)に懸濁した。ムタノリシン(和光純薬工業社製、2μg/μL)を2μl添加し、60℃で2.5時間、次いで、プロテイナーゼK(タカラ社製、0.4mg/μl)を20μl添加し、37℃で1時間処理した。SDS(3%)を500μl添加し、室温で30分間保温し、次いで遠心分離法で菌体DNAを含む粗抽出液(上清分画)を得た。菌体DNAを、フェノール/クロロホルム処理で部分精製し、組換えプラスミドの作成に用いた。
こうして抽出したDNAを、ショットガンクローニングのために制限酵素Sau3AIで切断して、3171bpおよび3768bpの2種のDNAフラグメントを得た。
【0034】
次いで、該2種のDNAフラグメントをプラスミドpUC118(3162bpの大腸菌ベクター、Ampr、plac、lacZ’)のBamHIサイト中にクローニングして、2つの組換えプラスミド:p118gaY1およびp118gaY2を得た。
組換えプラスミドの作成は以下のサンブルック等の方法(Sambrook et al., Molecular
Cloning. A Laboratory Manual, 2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.(1989))で行った。
上記の菌体DNA(50μg)を制限酵素Sau3AI(0.2単位)で、37℃、1時間部分切断した。プラスミドpUC118のDNAをBamHIで完全分解し、線状DNA分子を得た。該部分切断菌体DNA(3μg)と線状pUC118DNA(0.5μg)を混合し、DNA結合酵素(400単位)を加えた。16℃で16時間の結合反応により組換えプラスミドを作成した。
また同様にして、該組換えプラスミドを使用して以下の3つの組換えプラスミドを得た(図1参照):
・p119gaY3
p118gaY1のMfeI/EcoRIフラグメント(1138bp)をプラスミドpUC119のEcoRIサイトにクローニングして入手。
・p119gaY4
p119gaY3のSmaI/XbaIフラグメント(513bp)をプラスミドpUC119のHincII/XbaIサイトにクローニングして入手。
・p119gaY5
HindIII/XbaIフラグメント(980bp)をプラスミドpUC119のHindIII/XbaIサイトにクローニングして入手。
【0035】
こうして得た5つの組換えプラスミドをエレクトロポレーションにより大腸菌(E. coli)XL1−Blue(supE44、hsdR17、recA1、endA1、gyrA46、thi、relA1、lac-、F’[proAB+、lacIq、lacZΔM15、Tn10(Tetr)])中に導入して形質転換体を得た。
詳細には、先ず大腸菌XL1−BlueをLB(Luria-Bertain)培地を用い、37℃で培養した。一晩(12時間)経過後、培養菌2mLを新鮮なLB培地100mLに植え継ぎ、37℃で培養した。菌数が5×108/mlに達したとき、上記と同様の遠心分離法で集菌した。菌体を滅菌水で3度洗浄し、100μLの蒸留水に懸濁した。該懸濁液に1μLの組換えプラスミドDNA(0.5μg/μl)とPEG6000(10%)を添加した。大腸菌体内への該組換えプラスミドの導入は、ジーンパルサー(登録商標、バイオラッド社製)を用い、電圧1.75kV/cm、静電容量25μF、抵抗600Ωの電気パルス条件を用いたエレクトロポレーション法で行った。電気パルス処理後、LB培地を4倍量加え、37℃で30分間保温し、形質転換体を得た。
【0036】
該形質転換体を、1×109/mLのオートクレーブにより失活させたLactobacillus gasseri JCM1131T細胞、0.1%のトリトンX−100n、100μg/mLのアンピシリンおよび1mMのIPTGを補足したLB(Luria-Bertani)培地中、37℃で24時間培養し、その後4℃で24時間定温放置した。より詳しい条件は以下の通りである:
Lactobacillus gasseri JCM 1131TをLB培地で一晩培養した。集菌後、蒸留水で二回洗浄した後、オートクレーブ(加熱蒸気圧滅菌:三洋電気社製)を用い、110℃、1.5気圧で15分間加熱処理した。1×109/mLに相当する該加熱処理菌体と、0.1%のトリトンX−100n、100μg/mLのアンピシリンを含む固形LB寒天培地(プレート)を径9cmのシャーレに作成した。1mMのIPTGと共に該形質転換体を該寒天プレートに塗布し、37℃で24時間培養した。生成した菌体コロニーを4℃で24時間放置し、溶菌斑を生じる形質転換体を選別分離した。
【0037】
次いで、前記培養プレートを、オートクレーブにより失活させたLactobacillus gasseri JCM1131T細胞に対する、トリトンX−100誘導溶菌表現型についてスクリーニングした。
その結果、組換えプラスミドp118gaY1およびp118gaY2により形質転換した大腸菌は、IPTGでの誘導により約33kDaの同じ分子量を持つタンパク質を産生し、該タンパク質は失活させたLactobacillus gasseri JCM1131T細胞に対し溶菌活性を示した。その結果、これらの形質転換体のコロニーの周囲には明らかなハロ領域が形成した(図2参照)。
組換えプラスミドp118gaY1により形質転換した大腸菌を37℃で時間を変えて培養し、培養により産生したタンパク質をSDSゲル上での電気泳動により分析した結果を図3(A)に示す。図3(A)は、培養時間が最も短いもの(最も左側のレーン)から最も長いもの(最も右側のレーン)に増加するにつれて、約33kDaのタンパク質(矢印部分)の産生が増加したことを明らかに示している。
また、組換えプラスミドp118gaY1により形質転換した大腸菌による約33kDaのタンパク質の産生を、他のプラスミドで形質転換した大腸菌と比較した結果を図3(B)に示す。レーン1はマーカーであり、レーン2ないしレーン5はpUC118で形質転換した大腸菌をそれぞれ0、1、2および3時間培養した結果であり、レーン6ないし9はp118gaY1で形質転換した大腸菌をそれぞれ0、1、2および3時間培養した結果である。これにより、プラスミドpUC118で形質転換した大腸菌は約33kDaのタンパク質(矢印部分)の産生を誘導しないのに対し、組換えプラスミドp118gaY1により形質転換した大腸菌は、時間と共に該タンパク質を産生することが解る。
【実施例2】
【0038】
p118gaY1およびp118gaY2の配列決定
Lactobacillus gasseriの全遺伝子ショットガン配列(GenBank受入番号NZ_AAA002000006)に基き、p118gaY1およびp118gaY2の挿入DNAフラグメントの配列を決定した(。決定したDNA配列の物理マップを図1に示す。
図1に示すように、p118gaY1に挿入したDNAフラグメントは、orf149、orf92、holgaY、lysgaY、orf35およびmnaAgaY1をコードし、またp118gaY2に挿入したDNAフラグメントは、orfXgaY1、orf169、orf149、orf92、holgaY、lysgaY、orf35intgaYをコードしていた。
これらのうちholgaYとorf35との間に位置するlysgaYは、その分子量が33.7kDaであると推計される310アミノ酸からなるタンパク質であり、そして該タンパク質の分子量は、p118gaY1およびp118gaY2により形質転換した大腸菌がIPTG誘導により産生し溶菌活性の要因と推測されるタンパク質の分子量と同一であった。これらの理由により、lysgaYをLactobacillus gasseri JCM1131Tが産生する溶菌性タンパク質であると決定した。lysgaYをコードするヌクレオチド配列を以下の配列番号1に、また該ヌクレオチド配列によりコードされるlysgaYのアミノ酸配列を以下の配列番号2に示す。またlysgaYをコードする遺伝子の境界領域を図4に図示する。図4は境界領域のみを示し、N末端とC末端の間の中間部分は省略されている。また図4において、lysgaYの下流に存在する転写終結因子として機能し得る38塩基のステム−ループ2次構造を矢印で示す。
【0039】
p118gaY1およびp118gaY2により形質転換した大腸菌が産生した33kDaのタンパク質がlysgaYであることを確認するために、lysgaYのみを含むMfel/EcoRI断片をプラスミドpUC118に挿入して組換えプラスミドp119gaY3を入手し、上記と同様にしてp119gaY3により大腸菌を形質転換し、そしてlysgaYの誘導発現を試みた。その結果、p119gaY3は予測通り33kDaのタンパク質(lysgaY)を産生した。
【実施例3】
【0040】
lysgaYの溶菌活性評価
lysgaYの溶菌活性を、オートクレーブにより失活させた3種のグラム陽性菌:Lactobacillus gasseri JCM1134T、Staphylococcus warneri MおよびMicrococcus luteusについて評価し、その溶菌活性を市販の溶菌酵素剤であるムタノリシンおよび卵白リゾチーム(共にシグマ社製)のものと比較した。
オートクレーブ処理した3種類の菌体をTris−HCl(pH7.5)3mLに懸濁し、660nmでの吸光度が0.5となるように調整した。次いで、lysgaY0.06μg/μLを添加し37℃で保温した。スペクトロニック20(ミルトン・ロイ社製)を用い、660nmでの吸光度の経時変化を15分ごとに測定して、活性評価試験を行った。
上記した660nmでの吸光度の経時変化を、各タンパク質について、吸光度を縦軸(OD660)に、また時間(分)を横軸にとったグラフとして図5に示す。
また得られた各タンパク質の酵素活性(U/μg)を、3種の基質毎に表1に示す。
【表1】

【0041】
試験結果から明らかなように、本発明のタンパク質であるlysgaYは3種全ての基質に対して溶菌活性を示した。特にLactobacillus gasseri JCM1134Tに対する溶菌活性は高く、ムタノリシンの溶菌活性に匹敵していた。
他方、卵白リゾチームはLactobacillus gasseri JCM1134Tに対する溶菌活性を殆ど示さなかった。
【実施例4】
【0042】
lysgaYの溶菌スペクトル評価
lysgaYの溶菌スペクトルを、オートクレーブで失活させた様々なグラム陽性菌を基質として、以下の手順に従い評価した:
LysgaYの溶菌スペクトルをザイモグラフィー法を用い以下の手順で評価した。
各グラム陽性菌をオートクレーブ処理して基質とした。該基質(湿潤、2%wt/vol)を含有するSDSポリアクリルアミドゲル(10%)を作成し、LysgaYを電気泳動した。次いで泳動終了ゲルを、0.1%のトリトンX−100nを含む50mMのTris−HCl中、37℃で24時間保温した。その後、0.1%のメチレンブルーで染色し、溶菌活性を検出した。
結果を表2に示す。表2では+++が強い溶菌活性を、++が中程度の溶菌活性を、+が弱い溶菌活性を示し、そして−は溶菌活性が検出されなかったことを示す。また比較の目的で同様に評価したLactobacillus plantarum G1e phage φg1eがコードするエンドリシン:Lysgleの溶菌スペクトルを共に示す。
【表2】

【0043】
表2に示す結果から明らかなように、、本発明のタンパク質であるlysgaYは、試験した18種のグラム陽性菌のうち、Staphylococcus haemolyticusを除く全てについて少なくとも弱い溶菌活性を示し、その殆どでは中程度以上の溶菌活性を示した。これらの結果より、lysgaYが広い溶菌スペクトルを有することを確認できた。
他方、Lysgleは僅かに2種のグラム陽性菌でのみしか溶菌活性を示さず、また示した溶菌活性もlysgaYのものと比較すると弱かった。
【0044】
・配列番号1:lysgaYをコードする遺伝子のヌクレオチド配列
atg gtt gaa gta gct aaa aga agt tac ggt gta gat gta tca agt cat aac aac ggc aat tat tcc gga tcg aaa ttt gcc gtt gtt aaa gtg tca gag ggc tta gat tat cgt aat cct aaa gca caa tct caa gta tct act gca aga gct aat agt atg ttg cca atg gct tat cac tat gcg agg ttt agt ggc aat agt aac gta gca att caa gaa ggt aac tat gca gtt act tct gca aaa gct gtt ggt ctt gag gca ggt act tac tta gct tgt gac tat gaa caa gga agt gga aac gaa act aga gga gat cgt gaa act aat acg act gct atc tta tct ttc tta gat act att gtg ggt gct ggt tat aag cct tta cta tac tca ggc gct tat ctt atg aga gac aaa att aat act tct aga att tta gcc aag tat cct aat tgt ttg tgg gta gca gca tat cca tca ggt aat ggt act gcg gta agt gaa cca aac ttt ggc tac ttt cca tca atg aac gga gta gca att tgg caa ttt acc gat aac tgg cgt ggg tta aat gtt gac gga aac atc agc ttg att gat cta aaa aat gat agc aaa cca gta gct cag cca tct gtt gca caa tca gca tca gaa aaa aca tgg act gat gta caa ggt atg act tgg cat gaa gaa cat ggt act ttc atc act ggt gga gcg att aat ctt cgc tgg ggc gct aat acg caa agc aca ctg att acc acc tta cca gca ggt tca gaa gtt aaa tac aat gct tgg gct aga gat agt gct ggg cgt gta tgg tta cag caa ccg aga gaa aat ggt aag aat ggc tat tta gtt ggt cgt gtc ggc agt gag ccg tgg gga act ttc aaa taa
【0045】
・配列番号2:lysgaYのアミノ酸配列
Met Val Glu Val Ala Lys Arg Ser Tyr Gly Val Asp Val Ser Ser His Asn Asn Gly Asn Tyr Ser Gly Ser Lys Phe Ala Val Val Lys Val Ser Glu Gly Leu Asp Tyr Arg Asn Pro Lys Ala Gln Ser Gln Val Ser Thr Ala Arg Ala Asn Ser Met Leu Pro Met Ala Tyr His Tyr Ala Arg Phe Ser Gly Asn Ser Asn Val Ala Ile Gln Glu Gly Asn Tyr Ala Val Thr Ser Ala Lys Ala Val Gly Leu Glu Ala Gly Thr Tyr Leu Ala Cys Asp Tyr Glu Gln Gly Ser Gly Asn Glu Thr Arg Gly Asp Arg Glu Thr Asn Thr Thr Ala Ile Leu Ser Phe Leu Asp Thr Ile Val Gly Ala Gly Tyr Lys Pro Leu Leu Tyr Ser Gly Ala Tyr Leu Met Arg Asp Lys Ile Asn Thr Ser Arg Ile Leu Ala Lys Tyr Pro Asn Cys Leu Trp Val Ala Ala Tyr Pro Ser Gly Asn Gly Thr Ala Val Ser Glu Pro Asn Phe Gly Tyr Phe Pro Ser Met Asn Gly Val Ala Ile Trp Gln Phe Thr Asp Asn Trp Arg Gly Leu Asn Val Asp Gly Asn Ile Ser Leu Ile Asp Leu Lys Asn Asp Ser Lys Pro Val Ala Gln Pro Ser Val Ala Gln Ser Ala Ser Glu Lys Thr Trp Thr Asp Val Gln Gly Met Thr Trp His Glu Glu His Gly Thr Phe Ile Thr Gly Gly Ala Ile Asn Leu Arg Trp Gly Ala Asn Thr Gln Ser Thr Leu Ile Thr Thr Leu Pro Ala Gly Ser Glu Val Lys Tyr Asn Ala Trp Ala Arg Asp Ser Ala Gly Arg Val Trp Leu Gln Gln Pro Arg Glu Asn Gly Lys Asn Gly Tyr Leu Val Gly Arg Val Gly Ser Glu Pro Trp Gly Thr Phe Lys
【図面の簡単な説明】
【0046】
【図1】図1は、実施例1の組換えプラスミドが含むDNAフラグメントを図示する物理マップであり、(A)はp118gaY1、p118gaY3、p118gaY4およびp119gaY5を示し、(B)はp118gaY2を示す。
【図2】図2は、実施例1における形質転換大腸菌の培養結果の写真を表す図である。
【図3】図3は、実施例1において形質転換大腸菌が産生したタンパク質の電気泳動結果の写真を表す図であり、(A)は時間を変えたときの結果を表し、そして(B)はp118gaY1により形質転換した大腸菌によるタンパク質の産生を他のプラスミドで形質転換したもの比較した結果を表す。
【図4】図4は、lysgaYをコードする遺伝子の境界領域を図示する。
【図5】図5は、実施例4における溶菌活性評価の結果を図示するグラフである。
【特許請求の範囲】
【請求項1】
以下のa)ないしd)のいずれか1つのDNAからなる遺伝子;
a)以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列からなるDNA、
b)以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列を含むDNA。
c)前記a)記載のDNAのヌクレオチド配列と相補的なヌクレオチド配列からなる一本鎖DNAとストリンジェントな条件下でハイブリダイズし、溶菌活性を有するタンパク質をコードする領域を含むDNA、
d)前記a)記載のDNAと95%のヌクレオチド配列相同性を示し、溶菌活性を有するタンパク質をコードする領域を含むDNA。
atg gtt gaa gta gct aaa aga agt tac ggt gta gat gta tca agt cat aac aac ggc aat tat tcc gga tcg aaa ttt gcc gtt gtt aaa gtg tca gag ggc tta gat tat cgt aat cct aaa gca caa tct caa gta tct act gca aga gct aat agt atg ttg cca atg gct tat cac tat gcg agg ttt agt ggc aat agt aac gta gca att caa gaa ggt aac tat gca gtt act tct gca aaa gct gtt ggt ctt gag gca ggt act tac tta gct tgt gac tat gaa caa gga agt gga aac gaa act aga gga gat cgt gaa act aat acg act gct atc tta tct ttc tta gat act att gtg ggt gct ggt tat aag cct tta cta tac tca ggc gct tat ctt atg aga gac aaa att aat act tct aga att tta gcc aag tat cct aat tgt ttg tgg gta gca gca tat cca tca ggt aat ggt act gcg gta agt gaa cca aac ttt ggc tac ttt cca tca atg aac gga gta gca att tgg caa ttt acc gat aac tgg cgt ggg tta aat gtt gac gga aac atc agc ttg att gat cta aaa aat gat agc aaa cca gta gct cag cca tct gtt gca caa tca gca tca gaa aaa aca tgg act gat gta caa ggt atg act tgg cat gaa gaa cat ggt act ttc atc act ggt gga gcg att aat ctt cgc tgg ggc gct aat acg caa agc aca ctg att acc acc tta cca gca ggt tca gaa gtt aaa tac aat gct tgg gct aga gat agt gct ggg cgt gta tgg tta cag caa ccg aga gaa aat ggt aag aat ggc tat tta gtt ggt cgt gtc ggc agt gag ccg tgg gga act ttc aaa taa
【請求項2】
以下のa)ないしc)のいずれか1つのタンパク質をコードする遺伝子;
a)以下の配列番号2に表されるアミノ酸配列からなるタンパク質、
b)以下の配列番号2に表されるアミノ酸配列を含むタンパク質、
c)以下の配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、溶菌活性を有するタンパク質。
Met Val Glu Val Ala Lys Arg Ser Tyr Gly Val Asp Val Ser Ser His Asn Asn Gly Asn Tyr Ser Gly Ser Lys Phe Ala Val Val Lys Val Ser Glu Gly Leu Asp Tyr Arg Asn Pro Lys Ala Gln Ser Gln Val Ser Thr Ala Arg Ala Asn Ser Met Leu Pro Met Ala Tyr His Tyr Ala Arg Phe Ser Gly Asn Ser Asn Val Ala Ile Gln Glu Gly Asn Tyr Ala Val Thr Ser Ala Lys Ala Val Gly Leu Glu Ala Gly Thr Tyr Leu Ala Cys Asp Tyr Glu Gln Gly Ser Gly Asn Glu Thr Arg Gly Asp Arg Glu Thr Asn Thr Thr Ala Ile Leu Ser Phe Leu Asp Thr Ile Val Gly Ala Gly Tyr Lys Pro Leu Leu Tyr Ser Gly Ala Tyr Leu Met Arg Asp Lys Ile Asn Thr Ser Arg Ile Leu Ala Lys Tyr Pro Asn Cys Leu Trp Val Ala Ala Tyr Pro Ser Gly Asn Gly Thr Ala Val Ser Glu Pro Asn Phe Gly Tyr Phe Pro Ser Met Asn Gly Val Ala Ile Trp Gln Phe Thr Asp Asn Trp Arg Gly Leu Asn Val Asp Gly Asn Ile Ser Leu Ile Asp Leu Lys Asn Asp Ser Lys Pro Val Ala Gln Pro Ser Val Ala Gln Ser Ala Ser Glu Lys Thr Trp Thr Asp Val Gln Gly Met Thr Trp His Glu Glu His Gly Thr Phe Ile Thr Gly Gly Ala Ile Asn Leu Arg Trp Gly Ala Asn Thr Gln Ser Thr Leu Ile Thr Thr Leu Pro Ala Gly Ser Glu Val Lys Tyr Asn Ala Trp Ala Arg Asp Ser Ala Gly Arg Val Trp Leu Gln Gln Pro Arg Glu Asn Gly Lys Asn Gly Tyr Leu Val Gly Arg
Val Gly Ser Glu Pro Trp Gly Thr Phe Lys
【請求項3】
前記c)記載のタンパク質において、アミノ酸の欠失、置換および/または付加は、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行われることを特徴とする、請求項2記載の遺伝子。
【請求項4】
以下のa)ないしd)のいずれか1つのタンパク質;
a)以下の配列番号2に表されるアミノ酸配列からなるタンパク質、
b)以下の配列番号2に表されるアミノ酸配列を含むタンパク質、
c)以下の配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、溶菌活性を有するタンパク質、
d)請求項1記載のDNAによりコードされ、溶菌活性を有するタンパク質。
Met Val Glu Val Ala Lys Arg Ser Tyr Gly Val Asp Val Ser Ser His Asn Asn Gly Asn Tyr Ser Gly Ser Lys Phe Ala Val Val Lys Val Ser Glu Gly Leu Asp Tyr Arg Asn Pro Lys Ala Gln Ser Gln Val Ser Thr Ala Arg Ala Asn Ser Met Leu Pro Met Ala Tyr His Tyr Ala Arg Phe Ser Gly Asn Ser Asn Val Ala Ile Gln Glu Gly Asn Tyr Ala Val Thr Ser Ala Lys Ala Val Gly Leu Glu Ala Gly Thr Tyr Leu Ala Cys Asp Tyr Glu Gln Gly Ser Gly Asn Glu Thr Arg Gly Asp Arg Glu Thr Asn Thr Thr Ala Ile Leu Ser Phe Leu Asp Thr Ile Val Gly Ala Gly Tyr Lys Pro Leu Leu Tyr Ser Gly Ala Tyr Leu Met Arg Asp Lys Ile Asn Thr Ser Arg Ile Leu Ala Lys Tyr Pro Asn Cys Leu Trp Val Ala Ala Tyr Pro Ser Gly Asn Gly Thr Ala Val Ser Glu Pro Asn Phe Gly Tyr Phe Pro Ser Met Asn Gly Val Ala Ile Trp Gln Phe Thr Asp Asn Trp Arg Gly Leu Asn Val Asp Gly Asn Ile Ser Leu Ile Asp Leu Lys Asn Asp Ser Lys Pro Val Ala Gln Pro Ser Val Ala Gln Ser Ala Ser Glu Lys Thr Trp Thr Asp Val Gln Gly Met Thr Trp His Glu Glu His Gly Thr Phe Ile Thr Gly Gly Ala Ile Asn Leu Arg Trp Gly Ala Asn Thr Gln Ser Thr Leu Ile Thr Thr Leu Pro Ala Gly Ser Glu Val Lys Tyr Asn Ala Trp Ala Arg Asp Ser Ala Gly Arg Val Trp Leu Gln Gln Pro Arg Glu Asn Gly Lys Asn Gly Tyr Leu Val Gly Arg Val Gly Ser Glu Pro Trp Gly Thr Phe Lys
【請求項5】
前記c)記載のタンパク質において、アミノ酸の欠失、置換および/または付加は、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行われることを特徴とする、請求項4記載のタンパク質。
【請求項6】
請求項1ないし3のうちの何れか1項に記載の遺伝子を含む組換えプラスミド。
【請求項7】
発現ベクターであることを特徴とする、請求項6記載の組換えプラスミド。
【請求項8】
請求項6または7に記載の組換えプラスミドで形質転換された宿主細胞。
【請求項9】
グラム陽性細菌であることを特徴とする、請求項8記載の宿主細胞。
【請求項10】
大腸菌、乳酸菌、枯草菌またはブドウ球菌であることを特徴とする、請求項9記載の宿主細胞。
【請求項11】
以下の工程1)および2)を含む、請求項4または5に記載のタンパク質の製造方法;
1)請求項8ないし10のうちの何れか1項に記載の宿主細胞を、溶菌活性を有するタンパク質の産生が可能な条件下で培養する工程、
2)前記工程1)における培養により得た培養物から、溶菌活性を有するタンパク質を回収する工程。
【請求項12】
請求項11記載の製造方法により得られるタンパク質。
【請求項13】
請求項2または3に記載のタンパク質を有効成分として含有する組成物。
【請求項14】
研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤または医療用抗生物質であることを特徴とする、請求項13記載の組成物。
【請求項1】
以下のa)ないしd)のいずれか1つのDNAからなる遺伝子;
a)以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列からなるDNA、
b)以下の配列番号1のヌクレオチド番号1から933に表されるヌクレオチド配列を含むDNA。
c)前記a)記載のDNAのヌクレオチド配列と相補的なヌクレオチド配列からなる一本鎖DNAとストリンジェントな条件下でハイブリダイズし、溶菌活性を有するタンパク質をコードする領域を含むDNA、
d)前記a)記載のDNAと95%のヌクレオチド配列相同性を示し、溶菌活性を有するタンパク質をコードする領域を含むDNA。
atg gtt gaa gta gct aaa aga agt tac ggt gta gat gta tca agt cat aac aac ggc aat tat tcc gga tcg aaa ttt gcc gtt gtt aaa gtg tca gag ggc tta gat tat cgt aat cct aaa gca caa tct caa gta tct act gca aga gct aat agt atg ttg cca atg gct tat cac tat gcg agg ttt agt ggc aat agt aac gta gca att caa gaa ggt aac tat gca gtt act tct gca aaa gct gtt ggt ctt gag gca ggt act tac tta gct tgt gac tat gaa caa gga agt gga aac gaa act aga gga gat cgt gaa act aat acg act gct atc tta tct ttc tta gat act att gtg ggt gct ggt tat aag cct tta cta tac tca ggc gct tat ctt atg aga gac aaa att aat act tct aga att tta gcc aag tat cct aat tgt ttg tgg gta gca gca tat cca tca ggt aat ggt act gcg gta agt gaa cca aac ttt ggc tac ttt cca tca atg aac gga gta gca att tgg caa ttt acc gat aac tgg cgt ggg tta aat gtt gac gga aac atc agc ttg att gat cta aaa aat gat agc aaa cca gta gct cag cca tct gtt gca caa tca gca tca gaa aaa aca tgg act gat gta caa ggt atg act tgg cat gaa gaa cat ggt act ttc atc act ggt gga gcg att aat ctt cgc tgg ggc gct aat acg caa agc aca ctg att acc acc tta cca gca ggt tca gaa gtt aaa tac aat gct tgg gct aga gat agt gct ggg cgt gta tgg tta cag caa ccg aga gaa aat ggt aag aat ggc tat tta gtt ggt cgt gtc ggc agt gag ccg tgg gga act ttc aaa taa
【請求項2】
以下のa)ないしc)のいずれか1つのタンパク質をコードする遺伝子;
a)以下の配列番号2に表されるアミノ酸配列からなるタンパク質、
b)以下の配列番号2に表されるアミノ酸配列を含むタンパク質、
c)以下の配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、溶菌活性を有するタンパク質。
Met Val Glu Val Ala Lys Arg Ser Tyr Gly Val Asp Val Ser Ser His Asn Asn Gly Asn Tyr Ser Gly Ser Lys Phe Ala Val Val Lys Val Ser Glu Gly Leu Asp Tyr Arg Asn Pro Lys Ala Gln Ser Gln Val Ser Thr Ala Arg Ala Asn Ser Met Leu Pro Met Ala Tyr His Tyr Ala Arg Phe Ser Gly Asn Ser Asn Val Ala Ile Gln Glu Gly Asn Tyr Ala Val Thr Ser Ala Lys Ala Val Gly Leu Glu Ala Gly Thr Tyr Leu Ala Cys Asp Tyr Glu Gln Gly Ser Gly Asn Glu Thr Arg Gly Asp Arg Glu Thr Asn Thr Thr Ala Ile Leu Ser Phe Leu Asp Thr Ile Val Gly Ala Gly Tyr Lys Pro Leu Leu Tyr Ser Gly Ala Tyr Leu Met Arg Asp Lys Ile Asn Thr Ser Arg Ile Leu Ala Lys Tyr Pro Asn Cys Leu Trp Val Ala Ala Tyr Pro Ser Gly Asn Gly Thr Ala Val Ser Glu Pro Asn Phe Gly Tyr Phe Pro Ser Met Asn Gly Val Ala Ile Trp Gln Phe Thr Asp Asn Trp Arg Gly Leu Asn Val Asp Gly Asn Ile Ser Leu Ile Asp Leu Lys Asn Asp Ser Lys Pro Val Ala Gln Pro Ser Val Ala Gln Ser Ala Ser Glu Lys Thr Trp Thr Asp Val Gln Gly Met Thr Trp His Glu Glu His Gly Thr Phe Ile Thr Gly Gly Ala Ile Asn Leu Arg Trp Gly Ala Asn Thr Gln Ser Thr Leu Ile Thr Thr Leu Pro Ala Gly Ser Glu Val Lys Tyr Asn Ala Trp Ala Arg Asp Ser Ala Gly Arg Val Trp Leu Gln Gln Pro Arg Glu Asn Gly Lys Asn Gly Tyr Leu Val Gly Arg
Val Gly Ser Glu Pro Trp Gly Thr Phe Lys
【請求項3】
前記c)記載のタンパク質において、アミノ酸の欠失、置換および/または付加は、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行われることを特徴とする、請求項2記載の遺伝子。
【請求項4】
以下のa)ないしd)のいずれか1つのタンパク質;
a)以下の配列番号2に表されるアミノ酸配列からなるタンパク質、
b)以下の配列番号2に表されるアミノ酸配列を含むタンパク質、
c)以下の配列番号2に表されるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換および/または付加されたアミノ酸配列からなり、溶菌活性を有するタンパク質、
d)請求項1記載のDNAによりコードされ、溶菌活性を有するタンパク質。
Met Val Glu Val Ala Lys Arg Ser Tyr Gly Val Asp Val Ser Ser His Asn Asn Gly Asn Tyr Ser Gly Ser Lys Phe Ala Val Val Lys Val Ser Glu Gly Leu Asp Tyr Arg Asn Pro Lys Ala Gln Ser Gln Val Ser Thr Ala Arg Ala Asn Ser Met Leu Pro Met Ala Tyr His Tyr Ala Arg Phe Ser Gly Asn Ser Asn Val Ala Ile Gln Glu Gly Asn Tyr Ala Val Thr Ser Ala Lys Ala Val Gly Leu Glu Ala Gly Thr Tyr Leu Ala Cys Asp Tyr Glu Gln Gly Ser Gly Asn Glu Thr Arg Gly Asp Arg Glu Thr Asn Thr Thr Ala Ile Leu Ser Phe Leu Asp Thr Ile Val Gly Ala Gly Tyr Lys Pro Leu Leu Tyr Ser Gly Ala Tyr Leu Met Arg Asp Lys Ile Asn Thr Ser Arg Ile Leu Ala Lys Tyr Pro Asn Cys Leu Trp Val Ala Ala Tyr Pro Ser Gly Asn Gly Thr Ala Val Ser Glu Pro Asn Phe Gly Tyr Phe Pro Ser Met Asn Gly Val Ala Ile Trp Gln Phe Thr Asp Asn Trp Arg Gly Leu Asn Val Asp Gly Asn Ile Ser Leu Ile Asp Leu Lys Asn Asp Ser Lys Pro Val Ala Gln Pro Ser Val Ala Gln Ser Ala Ser Glu Lys Thr Trp Thr Asp Val Gln Gly Met Thr Trp His Glu Glu His Gly Thr Phe Ile Thr Gly Gly Ala Ile Asn Leu Arg Trp Gly Ala Asn Thr Gln Ser Thr Leu Ile Thr Thr Leu Pro Ala Gly Ser Glu Val Lys Tyr Asn Ala Trp Ala Arg Asp Ser Ala Gly Arg Val Trp Leu Gln Gln Pro Arg Glu Asn Gly Lys Asn Gly Tyr Leu Val Gly Arg Val Gly Ser Glu Pro Trp Gly Thr Phe Lys
【請求項5】
前記c)記載のタンパク質において、アミノ酸の欠失、置換および/または付加は、アミノ酸番号10のグリシン、アミノ酸番号12のアスパラギン酸、アミノ酸番号33のグルタミン酸、アミノ酸番号60のヒスチジン、アミノ酸番号96のアスパラギン酸、アミノ酸番号98のグルタミン酸およびアミノ酸番号198のアスパラギン酸以外の部位で行われることを特徴とする、請求項4記載のタンパク質。
【請求項6】
請求項1ないし3のうちの何れか1項に記載の遺伝子を含む組換えプラスミド。
【請求項7】
発現ベクターであることを特徴とする、請求項6記載の組換えプラスミド。
【請求項8】
請求項6または7に記載の組換えプラスミドで形質転換された宿主細胞。
【請求項9】
グラム陽性細菌であることを特徴とする、請求項8記載の宿主細胞。
【請求項10】
大腸菌、乳酸菌、枯草菌またはブドウ球菌であることを特徴とする、請求項9記載の宿主細胞。
【請求項11】
以下の工程1)および2)を含む、請求項4または5に記載のタンパク質の製造方法;
1)請求項8ないし10のうちの何れか1項に記載の宿主細胞を、溶菌活性を有するタンパク質の産生が可能な条件下で培養する工程、
2)前記工程1)における培養により得た培養物から、溶菌活性を有するタンパク質を回収する工程。
【請求項12】
請求項11記載の製造方法により得られるタンパク質。
【請求項13】
請求項2または3に記載のタンパク質を有効成分として含有する組成物。
【請求項14】
研究用試薬、食品添加物、防腐剤、工業用殺菌剤、農業用殺菌剤または医療用抗生物質であることを特徴とする、請求項13記載の組成物。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2006−121993(P2006−121993A)
【公開日】平成18年5月18日(2006.5.18)
【国際特許分類】
【出願番号】特願2004−315862(P2004−315862)
【出願日】平成16年10月29日(2004.10.29)
【出願人】(000003986)日産化学工業株式会社 (510)
【Fターム(参考)】
【公開日】平成18年5月18日(2006.5.18)
【国際特許分類】
【出願日】平成16年10月29日(2004.10.29)
【出願人】(000003986)日産化学工業株式会社 (510)
【Fターム(参考)】
[ Back to top ]

