新規骨吸収抑制剤のスクリーニング方法
【課題】本発明は、骨吸収抑制剤について、現存の薬剤とは異なる作用機序を有する薬剤を開発するための、新規メカニズムによるスクリーニング方法を提供することを課題とする。
【解決手段】スフィンゴシン1リン酸(S1P)とスフィンゴシン1リン酸受容体2型(S1P2)との相互作用を阻害しうる物質を検出することを特徴とする、新規骨吸収抑制物質のスクリーニング方法による。具体的には、少なくとも以下のA)及びB)の工程を含むスクリーニング方法による。A)候補物質のS1PとS1P2 との相互作用に及ぼす影響を確認し、S1PとS1P2 との相互作用を阻害しうる候補物質を選別する工程;B)候補物質による細胞の遊走能に及ぼす影響を確認し、遊走能の増強が確認された物質をさらに選別する工程。
【解決手段】スフィンゴシン1リン酸(S1P)とスフィンゴシン1リン酸受容体2型(S1P2)との相互作用を阻害しうる物質を検出することを特徴とする、新規骨吸収抑制物質のスクリーニング方法による。具体的には、少なくとも以下のA)及びB)の工程を含むスクリーニング方法による。A)候補物質のS1PとS1P2 との相互作用に及ぼす影響を確認し、S1PとS1P2 との相互作用を阻害しうる候補物質を選別する工程;B)候補物質による細胞の遊走能に及ぼす影響を確認し、遊走能の増強が確認された物質をさらに選別する工程。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規メカニズムを有する骨吸収抑制剤のスクリーニング方法に関する。
【背景技術】
【0002】
破骨細胞は骨を融解・吸収する生体内での唯一の細胞であり、骨を作る骨芽細胞と協調して骨の新陳代謝を担っている。
【0003】
骨組織は「骨芽細胞による骨新生」と「破骨細胞による骨吸収」のバランスによって恒常性が維持されている。破骨細胞の膜表面には分化や機能調節をつかさどる膜表面分子が存在している。破骨細胞は、血球系の単球・マクロファージ由来の細胞であり、破骨細胞前駆細胞が血中から骨表面に定着し、その場所で骨芽細胞からRANKL(receptor activator of NF kappa B ligand)という分化因子による刺激を受けることにより破骨能を持った成熟破骨細胞に分化し、骨吸収が行われる(Nat Rev Genet. 2003 Aug;4(8):638-49. Review)。正の制御に関与するものとして、RANK(RANKLレセプター)とIL-1レセプター、及びインテグリンαvβ3などが挙げられる。関節リウマチや閉経後骨粗鬆症などの骨吸収性疾患では、この破骨細胞の活性が増強している。
【0004】
骨粗鬆症の治療薬としては、骨量の減少を防止しうる薬剤として、ビタミンD3、ビタミンK2、イプリフラボンなどが使用されており、骨減少を防止し、骨量増加が期待される薬剤として、女性ホルモンの1種であるエストロゲンやエストロゲン受容体に作用する薬剤(選択的エストロゲン受容体モデュレーター、通称SERM)などが使用されている。また、近年、最も効果が期待されている薬剤として破骨細胞を細胞死させて機能を抑えるビスホスホネート製剤が、これらの骨吸収性疾患の予防・治療薬として汎用されている。ビスホスホネート製剤は骨表面に接着し、これを破骨細胞が取り込むことによりアポトーシスが誘導されると考えられている。
【0005】
骨関節疾患の予防及び改善薬として、スフィンゴシン骨格を有する化合物を有効成分とする薬剤が開示されている(特許文献1)。また、スフィンゴシン骨格を有する化合物を有効成分とする骨形成促進剤についても開示されている(特許文献2)。これらの文献では、スフィンゴシン骨格を有する化合物が骨芽細胞を活性化し、骨形成促進剤としての機能を有することが開示されている。
【0006】
スフィンゴシン1リン酸(以下、「S1P」という。)は、生体膜を構成するスフィンゴ脂質の代表産物であり、血中に存在する脂質メディエーターの1種である。S1Pは、酵素などにより膜から切り出されて遊離した後に、細胞膜に発現しているGタンパク質共役受容体に結合することによって、細胞遊走などを引き起こす生理活性物質でもある。S1Pの受容体としてスフィンゴシン1リン酸受容体1型(S1P1)〜5型(S1P5)の5種類のGタンパク質共役受容体が知られている。特にS1P1とS1P3はRacの活性を促進化し、S1Pに対する正の走化性(chemo taxis)を誘導するといわれており、S1P2は走化性を抑制するといわれている。以降、走化性を遊走能という場合もある。
【0007】
またS1Pは、免疫システムでのリンパ球などの移動に重要であることも示されている。例えば、Tリンパ球がリンパ節内で抗原提示を受けて全身循環に戻っていくときに、S1P1の発現が増強されることで、血中に戻っていくことができるようになる機構が知られている(Nat Rev Immunol. 2005 Jul;5(7):560-70. Review)。
【0008】
破骨細胞前駆細胞に、S1P受容体のひとつであるS1P1が発現していることを初めて見出したことに基づき、S1P1の血中S1Pへの走化性により当該前駆細胞が血中へ再還流しうることを示唆する報告がある(特許文献3)。S1Pが破骨細胞前駆細胞の遊走能を刺激し、S1P1とS1Pとの相互作用により当該前駆細胞が破骨細胞に成熟する前に骨表面から当該前駆細胞を引き離して破骨細胞に成熟するのを阻止するというメカニズムによる。
【0009】
具体的には、破骨細胞前駆細胞に、RANKLを含む条件(RANKL(+))又は含まない条件(RANKL(-))で培養したところ、RANKL(-)でS1P1及びS1P2のmRNAが発現し、RANKL(+)ではS1P1の発現が著明に減弱しており、S1P2の発現が不変〜軽度亢進していることが確認されている(特許文献3、図2A参照)。また、細胞の遊走能は、RANKL(-)の場合に増強することが確認されている(特許文献3、図2B参照)。さらに、S1P1アゴニストであるSEW2871を加えて細胞の遊走能を調べたところ、SEW2871の添加により遊走能が増強することが確認されている(特許文献3、図3参照)。しかしながら、SEW2871による骨代謝に及ぼす影響までは確認していない。つまり、S1P1を発現した破骨細胞前駆細胞が、血中S1Pへの走化性により血中へ再還流しうるというメカニズムについては示唆はあるものの、それにより、骨量に対して実際に影響を及ぼすことについては確認されていない。
【0010】
S1P1アゴニストとして公知のフィンゴリモド(Fingolimod:FTY720)を骨粗鬆症モデル動物に投与すると、骨量が増加したことについて報告がある(非特許文献1)。しかしながら、S1Pとの相互作用において、S1P1以外のS1P受容体の作用についてはなんら言及されていない。
【0011】
従来公知のビスホスホネート製剤など破骨細胞の機能を抑制する薬剤は、有効ではあるが、骨量の減少を完全に抑制するには至ってはいない。現存の薬剤とは異なる作用機序を有する薬剤の開発が望まれている。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特開2001-158736号公開公報
【特許文献2】特開2004-231616号公開公報
【特許文献3】特開2007-267665号公開公報
【非特許文献】
【0013】
【特許文献1】Nature, Vol.458, 26 March 2009, 524-528
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明は、骨吸収抑制剤について、現存の薬剤とは異なる作用機序を有する薬剤を開発するための、新規メカニズムによるスクリーニング方法を提供することを課題とする。
【課題を解決するための手段】
【0015】
本発明者らは上記課題を解決するために、S1PやCXCL12 (C-X-C motif ligand 12)、CX3CL1 (C-X3-C motif ligand 1)等のケモカインが破骨細胞前駆細胞の遊走能を刺激することに着目し、鋭意検討を重ねた結果、S1P受容体のひとつであるS1P2を調節することで、破骨細胞前駆細胞の遊走能に影響を及ぼし、当該前駆細胞が破骨細胞に成熟する前に骨表面から当該前駆細胞を引き離して破骨細胞に成熟するのを阻止し、骨量を変化させうることを初めて見出し、本発明を完成した。
【0016】
すなわち、本発明は以下よりなる。
1.S1PとS1P2との相互作用を阻害しうる物質を検出することを特徴とする、新規骨吸収抑制物質のスクリーニング方法。
2.少なくとも以下のA)及びB)の工程を含むことを特徴とする前項1に記載のスクリーニング方法:
A)候補物質のS1PとS1P2 との相互作用に及ぼす影響を確認し、S1PとS1P2 との相互作用を阻害しうる候補物質を選別する工程;
B)候補物質による細胞の遊走能に及ぼす影響を確認し、遊走能の増強が確認された物質をさらに選別する工程。
3.以下の工程を含む前項1又は2に記載のスクリーニング方法:
1)試験系に候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
2)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる候補物質を選別する工程:
3)前記工程により選別された候補物質を、S1Pを含む系で培養した細胞培養系に添加する工程;
4)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された物質をさらに選別する工程。
4.以下の工程を含む前項1又は2に記載のスクリーニング方法:
1)候補物質をS1Pを含む系で培養した細胞培養系に添加する工程;
2)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された候補物質を選別する工程;
3)試験系に前記工程により選別された候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
4)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる物質をさらに選別する工程。
5.S1PとS1P2との相互作用に及ぼす影響を確認する工程が、S1P2活性又はS1P2発現量を確認する工程による、前項2〜4のいずれか1に記載のスクリーニング方法。
6.スクリーニング方法に用いる細胞が、S1P2及びS1P1を発現している細胞である、前項2〜5のいずれか1に記載のスクリーニング方法。
7.スクリーニング方法に用いる細胞が、破骨細胞前駆細胞である、前項2〜6のいずれか1に記載のスクリーニング方法。
8.S1PとS1P2との相互作用を阻害しうる物質を有効成分とする、新規骨吸収抑制剤。
9.S1PとS1P2との相互作用を阻害しうる物質が、破骨細胞前駆細胞の遊走能を増強しうる物質である、前項8に記載の新規骨吸収抑制剤。
10.S1PとS1P2との相互作用を阻害しうる物質が、S1P2アンタゴニスト、抗S1P2抗体又はS1P2発現抑制剤である、前項8又は9に記載の新規骨吸収抑制剤。
【発明の効果】
【0017】
本発明のスクリーニング方法により、現存の骨吸収抑制剤とは異なる作用機序を有する薬剤を開発するための、新規メカニズムによるスクリーニングを行うことができる。具体的には、S1PとS1P2との相互作用並び破骨細胞前駆細胞の遊走能に及ぼす効果に基づく新規骨吸収抑制物質を選別しうるスクリーニングを行うことができる。従来公知のビスホスホネート製剤は骨表面で成熟破骨細胞をアポトーシスさせる作用によるものであり、成熟破骨細胞の機能を抑制する薬剤である。一方、本発明のスクリーニング方法により選別される薬剤は、成熟した破骨細胞の前段階である破骨細胞前駆細胞の遊走・位置決めを標的としている点において、極めて優れている。
【図面の簡単な説明】
【0018】
【図1】破骨細胞による骨吸収メカニズム及び破骨細胞前駆細胞の血中への再還流メカニズムを示す図である。
【図2】破骨細胞前駆細胞の培養系にRANKLを含む条件(RANKL(+))又は含まない条件(RANKL(-))で、各濃度のS1Pを加えて培養したときの、各種S1P受容体の発現を確認した写真図である。(参考例1)
【図3】破骨細胞前駆細胞の培養系にRANKL(+)又はRANKL(-)で、各濃度のS1Pを加えて培養したときの、S1Pに対する細胞の遊走能を示す図である。(参考例1)
【図4】RAW264.7細胞の培養系に、RANKL(-)で、百日咳毒素 (PTX: Perutussistoxin)を含む条件(PTX(+))又は含まない条件(PTX(-))で各濃度のS1Pを加えて培養したときの、S1Pに対する破骨細胞前駆細胞の遊走能を示す図である。(参考例1)
【図5】破骨細胞前駆細胞内でのRacの活性化について確認した写真図である。(参考例1)
【図6】骨粗鬆症モデルマウスにS1P1アゴニスト(FTY720)を作用させたときの、骨量の変化を示す写真図である。(参考例2)
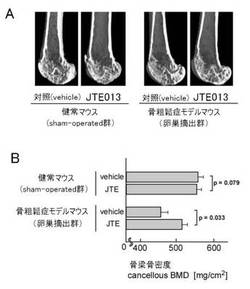
【図7】骨粗鬆症モデルマウスにS1P2アンタゴニスト(JTE013)を作用させたときの、骨量の変化を示す図である。(実施例1)
【発明を実施するための形態】
【0019】
本発明を説明するにあたり、本発明を完成するに至った経緯をまず詳述する。
【0020】
S1PやCXCL12 (C-X-C motif ligand 12)、CX3CL1(C-X3-C motif ligand 1)等のケモカインは破骨細胞前駆細胞の遊走を刺激し、当該前駆細胞に発現したS1P1と血中S1Pとが相互作用することにより、破骨細胞前駆細胞の一部は破骨細胞へ成熟することなく血中へ再還流される(図1参照)。
【0021】
破骨細胞前駆細胞に発現したS1P1と血中S1Pとが相互作用することによる細胞の遊走能を確認するために、破骨細胞前駆細胞由来細胞(RAW264.7)及び骨髄由来破骨細胞前駆細胞(BM-MDM :bone marrow-derived M-CSF dependent monocytes)細胞をRANKLを含む条件(RANKL(+))又は含まない条件(RANKL(-))で培養し、各培養系に各濃度のS1Pを加えて、ボイデンチェンバー法により細胞の遊走能を調べた。その結果、RANKL(-)ではS1P濃度により遊走能に顕著な違いが認められた。また、RANKL(+)では遊走能はRANKL(-)に比べて低いものの、添加したS1P濃度により遊走能に違いが認められた(図3参照)。
【0022】
さらに、RAW264.7細胞をGタンパク質共役受容体に対して阻害活性を有する百日咳毒素 (PTX: Perutussistoxin)を含む条件(PTX(+))又は含まない条件(PTX(-))で培養し、各濃度のS1Pを加えて、ボイデンチェンバー法により細胞の遊走能を調べた。その結果、PTX(-)ではS1P濃度により遊走能に顕著な違いが認められた。一方、PTX(+)ではPTX(-)に比べて細胞の遊走能は低く、添加したS1P濃度が低い方がやや細胞の遊走能が高い傾向が認められた(図4参照)。背景技術の欄でも説明したように、S1Pは細胞膜に発現しているGタンパク質共役受容体(S1P受容体)に結合することによって、細胞遊走などを引き起こす生理活性物質でもある。Gタンパク質共役受容体に対して阻害活性を有するPTXを添加した場合、S1Pを加えた系でも遊走能が抑制されていることから、破骨細胞前駆細胞はS1PとGタンパク質共役受容体との相互作用において、遊走能を有することが確認された。
【0023】
上記により、破骨細胞前駆細胞に発現したS1P1と血中S1Pとが相互作用することによる細胞の遊走能が確認された。また、特許文献3により、S1P1アゴニストが細胞の遊走能をさらに増強させうることが確認されたことに基づき、S1P1アゴニストの一種であるFTY720について、実際に骨代謝に及ぼす影響を確認した。卵巣摘出により作製した骨粗鬆症モデルマウスに、FTY720を3mg/kg/dayで4週間腹腔内投与を行なった結果、FTY720を投与しない系に比べて明らかに骨代謝が改善することが確認された(図6参照)。このことより、破骨細胞前駆細胞の遊走能が増強されると、骨代謝も改善されることが示唆された。
【0024】
ここで、S1P1アゴニストとして、例えばSEW2871(5-(4-Phenyl-5-trifluoromethylthiophen-2-yl)-3-(3-trifluoromethylphenyl)-1,2,4-oxadiazole)、KRP-203(2-amino-2-{2-[4-(3-benzyloxyphenylthio)-2-chlorophenyl]ethyl}-1,3-propanediol hydrochloride)、FTY720(2-amino-2-[2-(4-octylphenyl)ethyl]propane-1,3-diol hydrochloride)及びこれらの誘導体等が例示される。FTY720は、冬虫夏草の一種であるlasaria sinclairii菌が産生するミリオシン(myriocin)をリード化合物として、化学修飾により創製された化合物である。細胞傷害を引き起こすT細胞に直接作用することが特徴で、既存の薬剤もしくは既存の免疫抑制剤と併用することで、臓器移植の拒絶反応抑制や自己免疫疾患などの治療薬になると期待されている。KRP-203は、FTY720と同様に、拒絶反応を抑える免疫抑制剤として使用可能であることが報告されている(Shimizu et al., Circulation 2005、Takahashi et al., Transplant Proc 2005)。
【0025】
ここで、上述の細胞培養系に各濃度のS1Pを添加した場合における、S1P添加濃度と細胞の遊走能との関係をさらに検討した。図3の結果より、S1P添加濃度が高い場合に、却って遊走能が低下している傾向が認められた。また、S1P1はS1P2に比べて、S1Pに対する結合能が高く、このため低濃度のS1P存在下では、S1P1のみが作用して正の走化性を示すのに対し、高濃度のS1P存在下では、S1P2にも作用することにより、走化性が阻害されると考えられる。
【0026】
そこで、本発明において、破骨細胞前駆細胞のモデル細胞であるRAW264.7にS1P1 siRNA又はS1P2 siRNAを作用させた場合の細胞の遊走能に及ぼす影響について初めて確認した。その結果、S1P2 siRNAを作用させた場合は、S1P1 siRNAを作用させた場合に比べて遊走能が増強していることが観察された。このことより、S1P2を抑制することで、細胞の遊走能を増強しうることが示唆された。
【0027】
上記の知見に基づき、本発明の新規骨吸収抑制物質のスクリーニング方法を完成した。以下、本発明の内容を詳細に説明する。
【0028】
本発明は、S1PとS1P2 との相互作用を阻害しうる物質を検出することを特徴とする、新規骨吸収抑制物質のスクリーニング方法に関する。本発明のスクリーニング方法では、新規骨吸収抑制物質の候補物質について、S1PとS1P2 との相互作用に及ぼす影響を確認することを要する。ここで、S1PとS1P2 との相互作用に及ぼす影響とは、S1PとS1P2 との相互作用を阻害することをいう。このような影響を確認するために、具体的にはS1P2活性又はS1P2発現を確認することが必要である。さらに、S1PとS1P2 との相互作用を阻害しうる物質が、破骨細胞前駆細胞の遊走能を増強しうることを確認することも必要である。
【0029】
従って、本発明のスクリーニング方法では、少なくとも以下のA)及びB)の工程を含むことが必要である。
A)候補物質のS1PとS1P2 との相互作用に及ぼす影響を確認し、S1PとS1P2 との相互作用を阻害しうる候補物質を選別する工程。
B)候補物質による細胞の遊走能に及ぼす影響を確認し、遊走能の増強が確認された物質をさらに選別する工程。
【0030】
上記において、これら2種の工程の順序は特に限定されず、いずれが先であっても良いが、好ましくはA)の工程で選別された物質について、さらにB)の工程で選別するのが好適である。より具体的には、以下の1.又は2.の方法により、スクリーニングすることができる。
【0031】
1.A)の工程の後B)の工程を行なうスクリーニング方法:
1)試験系に候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
2)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる候補物質を選別する工程:
3)前記工程により選別された候補物質を、S1Pを含む系で培養した細胞培養系に添加する工程;
4)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された物質をさらに選別する工程。
【0032】
2.B)の工程の後A)の工程を行なうスクリーニング方法:
1)候補物質をS1Pを含む系で培養した細胞培養系に添加する工程;
2)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された候補物質を選別する工程;
3)試験系に前記工程により選別された候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
4)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる物質をさらに選別する工程。
【0033】
本発明のスクリーニング方法において、A)S1PとS1P2との相互作用を阻害しうる候補物質を選別するためのS1PとS1P2との相互作用に及ぼす影響の確認は、S1P2活性又はS1P2発現量を確認する試験系によることができる。
【0034】
本発明のスクリーニング方法において、S1P2活性を確認する方法としては、自体公知の方法又は今後開発される方法を採用することができ、特に限定されない。例えばS1P2(受容体=膜たんぱく質)を組み込んだ担体と標識されたS1Pとの結合を測定する試験系において、候補物質を添加して、S1P2担体と標識化S1Pの結合の阻害を観察する方法や、表面プラズモン共鳴(SPR)を利用した、タンパク質間相互作用、脂質−タンパク質間相互作用測定装置を用いてS1Pを結合させた基盤に対し、S1P2ミセルを添加して結合を見る測定系による方法などを適用することができる。具体的には、S1P2を組み込んだ擬似的な脂質ミセルを作製し、これに32P(ラジオアイソトープ)で標識したS1Pとの結合能を測定する系において、S1P2ミセルとS1P(32P)の結合が阻害されるかを観察する方法が挙げられる。また、表面プラズモン共鳴(SPR)を利用したタンパク質間相互作用、脂質−タンパク質間相互作用測定装置を用いる方法では、市販されている自体公知の装置、例えば商品名BIAcore装置を用いることができる。また候補物質が、S1P2抗原を阻害しうる物質、例えば抗S1P2抗体の場合には、単にS1P2と候補物質の抗原抗体反応を確認する方法であっても良い。具体的には、免疫クロマトグラフィー、ELISA法によることができる。
【0035】
本発明のスクリーニング方法において、S1P2発現量を確認する方法としては自体公知の方法によることができる。例えば、mRNAの発現量を確認する方法としては、リアルタイムPCRによることができ、発現したタンパク質を確認する方法としては、例えばウェスタンブロット(Western blot)法やフローサイトメトリー法によることができる。フローサイトメトリー法による解析は、自体公知のフローサイトメーター、例えば商品名FACSCanto装置により解析することができる。ハイスループットスクリーニングとして適しているのは、表面プラズモン共鳴(SPR)を利用した測定方法や、フローサイトメトリー法による測定方法が挙げられる。
【0036】
本発明のスクリーニング方法において、B)遊走能の増強が確認された物質をさらに選別するための候補物質による遊走能に及ぼす影響の確認は、細胞及び候補物質とS1Pを含む系で細胞を培養し、候補物質による細胞の遊走能に及ぼす影響を確認することにより達成することができる。この場合に添加するS1P濃度は、試験系において使用する細胞数及び候補物質との関係で適宜決定することができるが、具体的には10-9M以上の濃度が好ましく、好適には10-8M以上、特に好ましくは10-7M以上である。また、添加するS1P濃度の上限は特に限定されないが、培養液に溶解しうる濃度が好ましく、例えば10-6M以下であることが好ましい。
【0037】
本発明のスクリーニング方法で使用可能な細胞は、少なくともS1P1が発現している細胞、あるいはS1P1を強制発現させた細胞であることが必要である。発現しているS1P1とS1Pとの相互作用による細胞の遊走能を確認することが必要だからである。また、特にS1P2に基づく遊走能を確認する場合は、S1P2とS1P1が発現している細胞、あるいはS1P2とS1P1を強制発現させた細胞を用いることが必要である。このような細胞としては、好ましくは破骨細胞前駆細胞であり、スクリーニング系に使用するために株化され、入手可能な細胞であることが好ましい。具体的にはRAW264.7細胞、MOCP-5細胞、BM2細胞、HL-60細胞などが挙げられ、好ましくはRAW264.7細胞、MOCP-5細胞であり、最も好ましくはRAW264.7細胞である。
【0038】
本発明のスクリーニング方法で使用する遊走能の測定は、自体公知の方法により行うことができる。具体的には、細胞遊走能測定技術として公知のボイデンチェンバー法、ジグモンドチェンバー法やその変法を採用することができる。さらに、今後開発される新たな細胞遊走能測定技術を採用することもできる。具体的には、多数の孔を有するメンブレンにより遮断された上室に細胞を加え、下段に走化性因子を加え、一定時間反応させると、走化性因子に対して遊走活性を示す細胞は、メンブレンの孔を通過して下室に落ちるか、又はメンブレンの裏側に接着する。その落下した細胞を直接計測するか、又はメンブレンに接着した細胞を固定・染色後に一定面積内の細胞を計測することにより、遊走能を判定することができる。チェンバーをマルチウェルとすることにより、多くの試料を処理することができる。例えば、Neuro Probe社製のケモタキシスチェンバーが市販されており、利用することができる。
【0039】
より具体的には、次の方法によりスクリーニングすることができる。
上述の破骨細胞前駆細胞を、細胞増殖に必要な培地を用いて2〜7日間培養容器内で培養する。得られた細胞を、常法に従って培養容器から単離し、細胞の維持に必要な培地に懸濁し、細胞浮遊液を調製する。細胞浮遊液中の細胞の濃度は、遊走能の測定方法に従い適宜決定することができる。
【0040】
例えば、Neuro Probe社製のケモタキシスチェンバーを用いる場合について説明するが、これらに制限されるものではない。ケモタキシスチェンバーの下段には適当な濃度の候補物質を含む溶液を満たし、メンブレンをセットし、さらに上段に上記得られた細胞浮遊液を加えて、適当な時間培養する。培養時間は、細胞の種類、細胞数、候補物質の濃度等により適宜決定することができる。培養後、メンブレンをチェンバーから取り外し、その後メンブレンに付着している細胞を固定し、染色する。その後、上室に接していた面の細胞をふき取り風乾したのち、マイクロプレートリーダーを用いて吸光度を測定することにより、候補物質による細胞の遊走能を測定し、評価することができる。
【0041】
また、本発明のスクリーニング方法により選抜された候補物質の機能的効果は、S1P1発現細胞、好ましくはS1P1及びS1P2を発現している細胞に候補物質とS1Pを加えて培養し、細胞のS1Pに対する遊走能を測定することにより確認することができる。さらには、S1P1発現細胞、好ましくはS1P1及びS1P2を発現している細胞に、候補物質とS1Pを加えて培養し、細胞内でのRacの活性化を測定することでも確認可能である。RacはS1P1の刺激により活性化し、この作用によりS1Pに対して細胞が遊走能を示すからである。効果の確認に用いる細胞は、スクリーニングに使用可能な細胞を使用することができる。
【0042】
本発明は、S1PとS1P2との相互作用を阻害しうる物質を有効成分とする、新規骨吸収抑制剤にも及ぶ。ここにおいて、S1PとS1P2との相互作用を阻害しうる物質は、破骨細胞前駆細胞の遊走能を増強しうる物質である。そのような物質としては、S1P2アンタゴニスト、抗S1P2抗体又はS1P2発現抑制剤が挙げられる。S1P2アンタゴニストとして公知の化合物はJTE013であるが、本発明のスクリーニング方法により選別される新規S1P2アンタゴニストであってもよい。また、抗S1P2抗体は、自体公知の方法、例えばハイブリドーマから得たモノクローナル抗体、若しくは遺伝子組換により作製するモノクローナル抗体であっても良い。S1P2発現抑制剤としては、スクリーニング方法により選別される新規S1P2発現抑制剤であっても良いし、siRNAやアンチセンスオリゴヌクレオチドなどであっても良い。
【実施例】
【0043】
以下に、本発明を完成させるために行なった実験結果を参考例として示し、実施例において本発明をさらに具体的に説明するが、本発明はこれらに限定されるものではなく、本発明の技術的思想を逸脱しない範囲内で種々の応用が可能である。
【0044】
(参考例1)破骨細胞前駆細胞とS1Pとの作用について
1)S1Pの受容体発現の確認
破骨細胞前駆細胞由来細胞(RAW264.7)又は骨髄由来破骨細胞前駆細胞(BM-MDM)について、S1P1〜S1P5及びインテグリンαvのmRNA発現を確認した。mRNAの発現確認のため、対照としてGAPDHについても調べた。
【0045】
RAW264.7細胞又はBM-MDM細胞を、培地としてαMEM(Minimal Essential Medium)に10%熱非働化ウシ胎児血清(以下、「FCS」)とペニシリン/ストレプトマイシンを加えたものを用いて、RANKLを含まない系(RANKL(-))及び終濃度50ng/mlのRANKLを添加した系(RANKL(+))で37℃、3日間培養した。この細胞をセルスクレーパーを用いて単離して集め、該細胞からフェノール・クロロホルム抽出によりRNAを抽出し、これを基にして逆転写酵素によりcDNAを作製した。これを鋳型として各種遺伝子(S1P1〜S1P5、インテグリンαv、GAPDH)に特異的なプライマーを用いてPCR反応を行った。PCRに用いたプライマー及びPCRの条件は、特許文献3の記載に従った。
【0046】
得られたPCR産物を電気泳動用ローディングバッファー(10×loading buffer(タカラバイオ製))と混合し、2%アガロースゲルにて100V・20分の電気泳動を行い、目的とする遺伝子の発現を確認した。
【0047】
その結果を図2に示した。破骨細胞前駆細胞においては、RANKL(-)では、S1P1及びS1P2のmRNAが発現していることが確認された。一方、RANKL(+)の系では、S1P1の発現が著明に減弱しており、S1P2の発現が不変〜軽度亢進していることが確認された。また、S1P3〜S1P5の発現は見られなかった。
【0048】
なお、破骨細胞前駆細胞及び破骨細胞に発現し、RANKLにてその発現が亢進することが知られているインテグリンαvについては、RANKL(+)の系で発現増強が見られた。これより、本試験系において破骨細胞前駆細胞はRANKLにより分化誘導シグナルを受けていることが確認された。また、GAPDHの結果より、RANKL(+)(-)の系で全mRNAレベルに変化がない(またはその抽出過程での変化もない)ことを確認した。図2において、RTは逆転写反応を意味し、RT(+)は逆転写反応を行ったもの、RT(-)は反応を行わなかったもの意味する。RT(-)はmRNAを抽出する際に、ゲノムのDNAがコンタミネーションしていないことを確認するためのネガティブ・コントロールである。
【0049】
2)破骨細胞前駆細胞のS1Pに対する遊走能の確認
上記1)と同様に、RANKL(+)又は(-)の系で37℃、3日間培養したRAW264.7細胞又はBM-MDM細胞をセルスクレーパー及び0.025%トリプシン-EDTAを用いて単離した。96ウェル・ケモタキシスチェンバー(Neuro Probe社製)にフィブロネクチンでコートしたポリカーボン製メンブレンフィルターをセットし、下段にはS1Pの終濃度が0, 10-10〜10-7Mとなるように調製したS1P含有培地を加えた。上段には単離したRAW264.7細胞又はBM-MDM細胞を、1ウェルあたり3×105個加え、CO2インキュベーターにて37℃、5時間培養した。その後、メンブレンフィルターを取り出してヘマトキシリン・エオジン染色を行い、プレートリーダーを用いて吸光度を測定し、遊走によりメンブレンフィルターへ移動した細胞の数を定量した。
【0050】
その結果in vitroの試験系で、RANKL(-)、即ちRANKLにより分化誘導されていない破骨細胞前駆細胞がS1Pに対する遊走能を示すことが確認された(図3ab)。また、RAW264.7細胞ではS1Pの終濃度が10-9〜10-8Mの場合に遊走能が最も高く、10-7Mの場合はやや低下した(図3a)。BM-MDM細胞ではS1Pの濃度依存的に遊走能も増強した(図3b)。
【0051】
3)破骨細胞前駆細胞のS1Pに対する遊走能の確認
RANKL(-)の条件で、PTX(+)又は(-)の系で37℃、3日間培養したRAW264.7細胞を上記2)と同手法にてメンブレンフィルターをセットし、下段にはS1Pの終濃度が0, 10-12〜10-5Mとなるように調製したS1P含有培地を加えた。上記2)と同手法にて上段には単離したRAW264.7細胞を加え、培養後、メンブレンフィルターを取り出してヘマトキシリン・エオジン染色を行い、プレートリーダーを用いて吸光度を測定し、遊走によりメンブレンフィルターへ移動した細胞の数を定量した。
【0052】
その結果を図4に示した。in vitroの試験系で、PTX(+)の系で、破骨細胞前駆細胞のS1Pに対する遊走能の阻害が確認された。
【0053】
4)破骨細胞前駆細胞内でのRacの活性化の確認
上記2)及び3)と同様に、RANKL(-)の条件で、37℃、3日間培養したRAW264.7を、S1Pの終濃度が0, 10-8〜10-6Mとなるように調製したS1P含有培地を用いてさらに3時間培養した。該RAW264.7細胞をセルスクレーパーを用いて単離し、遠心分離により細胞を沈殿させた。沈殿した細胞をタンパク質抽出用緩衝液(150 mM NaCl, 5 mM KCl, 25 mM Hepes-NaOH (pH 7.4), 1 mM PMSF, プロテアーゼ阻害剤カクテル)を用いて再懸濁し、これを超音波破砕器で処理し、高速微量遠心分離により不溶解物を除去したものをRac活性測定用の試料とした。
【0054】
上記により得た試料の1/100量を分離し、試料1(Rac(1/100))とした。残りの試料に、グルタチオン・セファロース(ビーズ)に固着させた「活性型(GTP結合型)Rac結合ドメイン蛋白質(大腸菌で発現・精製)」を添加し、プルダウン・アッセイ法(標準的プロトコールに従う)によりこれに結合する蛋白質を単離し、試料2(GTP-Rac)とした。
【0055】
試料1及び試料2について、15%アクリルアミドゲルにてSDS-PAGEを行った。電気泳動終了後、PVDF膜へトランスファーした後に、抗Rac抗体(Upstate Biotechnology社製)を用いてウェスタン・ブロッティングを行い、膜上でのRacタンパク質の同定を行った。この方法により、破骨細胞前駆細胞での総Rac量(Rac(1/100))、及び活性型(GTP結合型)Rac量(GTP-Rac)のそれぞれを調べた。
【0056】
その結果を図5に示した。S1Pの添加により、細胞内での総Rac量(Rac(1/100))には変化がないのに対し、遊走能に重要な活性型Rac量(GTP-Rac)が増加していることが認められた。この結果は、S1Pによる刺激により破骨細胞前駆細胞内でRacの活性化が見られることを意味している。
【0057】
5)結果
破骨細胞前駆細胞にS1Pの受容体(S1P1及びS1P2)が発現していることが確認された。また、RANKLの刺激により破骨細胞前駆細胞が成熟破骨細胞に分化すると、S1P1の発現が低下することが確認された(図2)。in vitroの試験系で、破骨細胞前駆細胞が実際にS1Pに対する遊走能を示すことが確認された(図3,4)。さらに、細胞の遊走に重要なRacの活性化が破骨細胞前駆細胞内で起こっていることが確認された(図5)。
【0058】
(参考例2)骨粗鬆症モデルマウスにFTY720(S1P1アゴニスト)を投与した場合の骨代謝に及ぼす影響
1)実験方法
8〜12週齢のC57BL/6マウス(雌性)の卵巣を麻酔下で摘出した骨粗鬆症モデルマウスを用いて、FTY720(S1P1アゴニスト)を投与した場合の骨代謝に及ぼす影響を確認した。健常マウス(sham-operated)群及び骨粗鬆症モデルマウス群を準備し、各マウス群について、FTY720投与群及び対照(vehicle)群に分類した。FTY720投与群では、卵巣摘出翌日若しくは偽手術翌日より、FTY720を3mg/kgを毎日1度ずつ4週間連続して腹腔内投与した。各群5匹のマウスを用いた。4週間後に屠殺し、大腿骨の断面を観察した。
【0059】
2)結果
上記の結果、骨粗鬆症モデルマウス群では、対照群に比べてFTY720投与群の方が、明らかに骨密度が増加し、骨代謝が行なわれていることが観察された。一方、健常マウス群においては、骨密度に違いは殆ど認められなかった。このことより、S1P1アゴニストであるFTY720の投与により、骨粗鬆症モデルの場合は、骨密度が改善したのに対し、健常マウスでは健常な骨密度を維持し、骨密度を異常に上昇させることはなかった(図6参照)。
【0060】
(実施例1)骨粗鬆症モデルマウスにJTE013(S1P2アンタゴニスト)を投与した場合の骨代謝に及ぼす影響
1)実験方法
参考例2と同手法により作製した骨粗鬆症モデルマウスを用いて、JTE013(S1P2アンタゴニスト)を投与した場合の骨代謝に及ぼす影響を確認した。実験は、健常マウス(sham-operated)群及び骨粗鬆症モデルマウス群を準備し、各マウス群について、JTE013投与群及び対照(vehicle)群に分類した。JTE013投与群では、卵巣摘出翌日若しくは偽手術翌日より、JTE013を1mg/kgを毎日1度ずつ4週間連続して腹腔内投与した。各群5匹のマウスを用いた。4週間後に屠殺し、大腿骨の断面を観察し、骨重量を測定した。
【0061】
2)結果
上記の結果、骨粗鬆症モデルマウス群では、対照群に比べてJTE013投与群の方が、明らかに骨密度が増加し、骨代謝が行なわれていることが観察された。一方、健常マウス群においては、骨密度に違いは殆ど認められなかった。このことより、S1P2アンタゴニストであるJTE013の投与により、骨粗鬆症モデルの場合は骨密度が改善したのに対し、健常マウスでは健常な骨密度を維持し、必要以上に骨密度を上昇させることはなかった(図7A,B参照)。
【産業上の利用可能性】
【0062】
以上詳述したように、本発明のスクリーニング方法により、現存の骨吸収抑制剤とは異なるメカニズムによるスクリーニングを行うことができる。具体的には、S1PとS1P2との相互作用、並び破骨細胞前駆細胞の遊走能に及ぼす効果に基づく新規骨吸収抑制物質を選別しうるスクリーニングを行うことができる。本発明のスクリーニング方法により選別された骨吸収抑制剤は、現存する骨吸収抑制剤の作用機序とは異なり、成熟した破骨細胞の前段階である破骨細胞前駆細胞の遊走・位置決めを標的としている点において、極めて優れている。
【0063】
従来公知のビスホスホネート製剤は骨表面で成熟破骨細胞をアポトーシスさせる作用によるものであるが、本発明の方法により選別される薬剤は破骨細胞前駆細胞の骨細胞への流出入のバランスを制御するものであり、より安全性が高い薬剤ということができる。異なる作用機序による骨吸収抑制剤は、従来の薬剤と併用して使用することもできる。併用することで、従来の薬剤の使用量を軽減させ、かつ相乗効果も期待できる。さらに、破骨細胞前駆細胞が破骨細胞に成熟するのを防止する作用があることから、予防的に使用することで、骨粗鬆症の発症を抑制することも期待できる。
【0064】
人口の4人に1人が65歳以上の高齢者という超高齢者時代を迎えた日本では、加齢による骨粗鬆症の患者数は1000万人を突破しつつある。また、社会の高齢化及び骨吸収性疾患の増加は、日本に限ったものではなく先進諸国に共通した問題である。現在、骨粗鬆症の罹患患者数は日米欧の先進諸国において約7500万人と推定されており、ビスホスホネート製剤をはじめとする骨吸収抑制剤の世界市場は総額8000億円に及ぶ巨大なマーケットである。また、この市場は今後確実に増加することが予想される。このため、本発明を基にした新規の有効な骨吸収抑制剤の開発の意義は、日本国内に留まらず、世界規模での創薬ビジネスへと発展することが期待される。
【技術分野】
【0001】
本発明は、新規メカニズムを有する骨吸収抑制剤のスクリーニング方法に関する。
【背景技術】
【0002】
破骨細胞は骨を融解・吸収する生体内での唯一の細胞であり、骨を作る骨芽細胞と協調して骨の新陳代謝を担っている。
【0003】
骨組織は「骨芽細胞による骨新生」と「破骨細胞による骨吸収」のバランスによって恒常性が維持されている。破骨細胞の膜表面には分化や機能調節をつかさどる膜表面分子が存在している。破骨細胞は、血球系の単球・マクロファージ由来の細胞であり、破骨細胞前駆細胞が血中から骨表面に定着し、その場所で骨芽細胞からRANKL(receptor activator of NF kappa B ligand)という分化因子による刺激を受けることにより破骨能を持った成熟破骨細胞に分化し、骨吸収が行われる(Nat Rev Genet. 2003 Aug;4(8):638-49. Review)。正の制御に関与するものとして、RANK(RANKLレセプター)とIL-1レセプター、及びインテグリンαvβ3などが挙げられる。関節リウマチや閉経後骨粗鬆症などの骨吸収性疾患では、この破骨細胞の活性が増強している。
【0004】
骨粗鬆症の治療薬としては、骨量の減少を防止しうる薬剤として、ビタミンD3、ビタミンK2、イプリフラボンなどが使用されており、骨減少を防止し、骨量増加が期待される薬剤として、女性ホルモンの1種であるエストロゲンやエストロゲン受容体に作用する薬剤(選択的エストロゲン受容体モデュレーター、通称SERM)などが使用されている。また、近年、最も効果が期待されている薬剤として破骨細胞を細胞死させて機能を抑えるビスホスホネート製剤が、これらの骨吸収性疾患の予防・治療薬として汎用されている。ビスホスホネート製剤は骨表面に接着し、これを破骨細胞が取り込むことによりアポトーシスが誘導されると考えられている。
【0005】
骨関節疾患の予防及び改善薬として、スフィンゴシン骨格を有する化合物を有効成分とする薬剤が開示されている(特許文献1)。また、スフィンゴシン骨格を有する化合物を有効成分とする骨形成促進剤についても開示されている(特許文献2)。これらの文献では、スフィンゴシン骨格を有する化合物が骨芽細胞を活性化し、骨形成促進剤としての機能を有することが開示されている。
【0006】
スフィンゴシン1リン酸(以下、「S1P」という。)は、生体膜を構成するスフィンゴ脂質の代表産物であり、血中に存在する脂質メディエーターの1種である。S1Pは、酵素などにより膜から切り出されて遊離した後に、細胞膜に発現しているGタンパク質共役受容体に結合することによって、細胞遊走などを引き起こす生理活性物質でもある。S1Pの受容体としてスフィンゴシン1リン酸受容体1型(S1P1)〜5型(S1P5)の5種類のGタンパク質共役受容体が知られている。特にS1P1とS1P3はRacの活性を促進化し、S1Pに対する正の走化性(chemo taxis)を誘導するといわれており、S1P2は走化性を抑制するといわれている。以降、走化性を遊走能という場合もある。
【0007】
またS1Pは、免疫システムでのリンパ球などの移動に重要であることも示されている。例えば、Tリンパ球がリンパ節内で抗原提示を受けて全身循環に戻っていくときに、S1P1の発現が増強されることで、血中に戻っていくことができるようになる機構が知られている(Nat Rev Immunol. 2005 Jul;5(7):560-70. Review)。
【0008】
破骨細胞前駆細胞に、S1P受容体のひとつであるS1P1が発現していることを初めて見出したことに基づき、S1P1の血中S1Pへの走化性により当該前駆細胞が血中へ再還流しうることを示唆する報告がある(特許文献3)。S1Pが破骨細胞前駆細胞の遊走能を刺激し、S1P1とS1Pとの相互作用により当該前駆細胞が破骨細胞に成熟する前に骨表面から当該前駆細胞を引き離して破骨細胞に成熟するのを阻止するというメカニズムによる。
【0009】
具体的には、破骨細胞前駆細胞に、RANKLを含む条件(RANKL(+))又は含まない条件(RANKL(-))で培養したところ、RANKL(-)でS1P1及びS1P2のmRNAが発現し、RANKL(+)ではS1P1の発現が著明に減弱しており、S1P2の発現が不変〜軽度亢進していることが確認されている(特許文献3、図2A参照)。また、細胞の遊走能は、RANKL(-)の場合に増強することが確認されている(特許文献3、図2B参照)。さらに、S1P1アゴニストであるSEW2871を加えて細胞の遊走能を調べたところ、SEW2871の添加により遊走能が増強することが確認されている(特許文献3、図3参照)。しかしながら、SEW2871による骨代謝に及ぼす影響までは確認していない。つまり、S1P1を発現した破骨細胞前駆細胞が、血中S1Pへの走化性により血中へ再還流しうるというメカニズムについては示唆はあるものの、それにより、骨量に対して実際に影響を及ぼすことについては確認されていない。
【0010】
S1P1アゴニストとして公知のフィンゴリモド(Fingolimod:FTY720)を骨粗鬆症モデル動物に投与すると、骨量が増加したことについて報告がある(非特許文献1)。しかしながら、S1Pとの相互作用において、S1P1以外のS1P受容体の作用についてはなんら言及されていない。
【0011】
従来公知のビスホスホネート製剤など破骨細胞の機能を抑制する薬剤は、有効ではあるが、骨量の減少を完全に抑制するには至ってはいない。現存の薬剤とは異なる作用機序を有する薬剤の開発が望まれている。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特開2001-158736号公開公報
【特許文献2】特開2004-231616号公開公報
【特許文献3】特開2007-267665号公開公報
【非特許文献】
【0013】
【特許文献1】Nature, Vol.458, 26 March 2009, 524-528
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明は、骨吸収抑制剤について、現存の薬剤とは異なる作用機序を有する薬剤を開発するための、新規メカニズムによるスクリーニング方法を提供することを課題とする。
【課題を解決するための手段】
【0015】
本発明者らは上記課題を解決するために、S1PやCXCL12 (C-X-C motif ligand 12)、CX3CL1 (C-X3-C motif ligand 1)等のケモカインが破骨細胞前駆細胞の遊走能を刺激することに着目し、鋭意検討を重ねた結果、S1P受容体のひとつであるS1P2を調節することで、破骨細胞前駆細胞の遊走能に影響を及ぼし、当該前駆細胞が破骨細胞に成熟する前に骨表面から当該前駆細胞を引き離して破骨細胞に成熟するのを阻止し、骨量を変化させうることを初めて見出し、本発明を完成した。
【0016】
すなわち、本発明は以下よりなる。
1.S1PとS1P2との相互作用を阻害しうる物質を検出することを特徴とする、新規骨吸収抑制物質のスクリーニング方法。
2.少なくとも以下のA)及びB)の工程を含むことを特徴とする前項1に記載のスクリーニング方法:
A)候補物質のS1PとS1P2 との相互作用に及ぼす影響を確認し、S1PとS1P2 との相互作用を阻害しうる候補物質を選別する工程;
B)候補物質による細胞の遊走能に及ぼす影響を確認し、遊走能の増強が確認された物質をさらに選別する工程。
3.以下の工程を含む前項1又は2に記載のスクリーニング方法:
1)試験系に候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
2)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる候補物質を選別する工程:
3)前記工程により選別された候補物質を、S1Pを含む系で培養した細胞培養系に添加する工程;
4)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された物質をさらに選別する工程。
4.以下の工程を含む前項1又は2に記載のスクリーニング方法:
1)候補物質をS1Pを含む系で培養した細胞培養系に添加する工程;
2)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された候補物質を選別する工程;
3)試験系に前記工程により選別された候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
4)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる物質をさらに選別する工程。
5.S1PとS1P2との相互作用に及ぼす影響を確認する工程が、S1P2活性又はS1P2発現量を確認する工程による、前項2〜4のいずれか1に記載のスクリーニング方法。
6.スクリーニング方法に用いる細胞が、S1P2及びS1P1を発現している細胞である、前項2〜5のいずれか1に記載のスクリーニング方法。
7.スクリーニング方法に用いる細胞が、破骨細胞前駆細胞である、前項2〜6のいずれか1に記載のスクリーニング方法。
8.S1PとS1P2との相互作用を阻害しうる物質を有効成分とする、新規骨吸収抑制剤。
9.S1PとS1P2との相互作用を阻害しうる物質が、破骨細胞前駆細胞の遊走能を増強しうる物質である、前項8に記載の新規骨吸収抑制剤。
10.S1PとS1P2との相互作用を阻害しうる物質が、S1P2アンタゴニスト、抗S1P2抗体又はS1P2発現抑制剤である、前項8又は9に記載の新規骨吸収抑制剤。
【発明の効果】
【0017】
本発明のスクリーニング方法により、現存の骨吸収抑制剤とは異なる作用機序を有する薬剤を開発するための、新規メカニズムによるスクリーニングを行うことができる。具体的には、S1PとS1P2との相互作用並び破骨細胞前駆細胞の遊走能に及ぼす効果に基づく新規骨吸収抑制物質を選別しうるスクリーニングを行うことができる。従来公知のビスホスホネート製剤は骨表面で成熟破骨細胞をアポトーシスさせる作用によるものであり、成熟破骨細胞の機能を抑制する薬剤である。一方、本発明のスクリーニング方法により選別される薬剤は、成熟した破骨細胞の前段階である破骨細胞前駆細胞の遊走・位置決めを標的としている点において、極めて優れている。
【図面の簡単な説明】
【0018】
【図1】破骨細胞による骨吸収メカニズム及び破骨細胞前駆細胞の血中への再還流メカニズムを示す図である。
【図2】破骨細胞前駆細胞の培養系にRANKLを含む条件(RANKL(+))又は含まない条件(RANKL(-))で、各濃度のS1Pを加えて培養したときの、各種S1P受容体の発現を確認した写真図である。(参考例1)
【図3】破骨細胞前駆細胞の培養系にRANKL(+)又はRANKL(-)で、各濃度のS1Pを加えて培養したときの、S1Pに対する細胞の遊走能を示す図である。(参考例1)
【図4】RAW264.7細胞の培養系に、RANKL(-)で、百日咳毒素 (PTX: Perutussistoxin)を含む条件(PTX(+))又は含まない条件(PTX(-))で各濃度のS1Pを加えて培養したときの、S1Pに対する破骨細胞前駆細胞の遊走能を示す図である。(参考例1)
【図5】破骨細胞前駆細胞内でのRacの活性化について確認した写真図である。(参考例1)
【図6】骨粗鬆症モデルマウスにS1P1アゴニスト(FTY720)を作用させたときの、骨量の変化を示す写真図である。(参考例2)
【図7】骨粗鬆症モデルマウスにS1P2アンタゴニスト(JTE013)を作用させたときの、骨量の変化を示す図である。(実施例1)
【発明を実施するための形態】
【0019】
本発明を説明するにあたり、本発明を完成するに至った経緯をまず詳述する。
【0020】
S1PやCXCL12 (C-X-C motif ligand 12)、CX3CL1(C-X3-C motif ligand 1)等のケモカインは破骨細胞前駆細胞の遊走を刺激し、当該前駆細胞に発現したS1P1と血中S1Pとが相互作用することにより、破骨細胞前駆細胞の一部は破骨細胞へ成熟することなく血中へ再還流される(図1参照)。
【0021】
破骨細胞前駆細胞に発現したS1P1と血中S1Pとが相互作用することによる細胞の遊走能を確認するために、破骨細胞前駆細胞由来細胞(RAW264.7)及び骨髄由来破骨細胞前駆細胞(BM-MDM :bone marrow-derived M-CSF dependent monocytes)細胞をRANKLを含む条件(RANKL(+))又は含まない条件(RANKL(-))で培養し、各培養系に各濃度のS1Pを加えて、ボイデンチェンバー法により細胞の遊走能を調べた。その結果、RANKL(-)ではS1P濃度により遊走能に顕著な違いが認められた。また、RANKL(+)では遊走能はRANKL(-)に比べて低いものの、添加したS1P濃度により遊走能に違いが認められた(図3参照)。
【0022】
さらに、RAW264.7細胞をGタンパク質共役受容体に対して阻害活性を有する百日咳毒素 (PTX: Perutussistoxin)を含む条件(PTX(+))又は含まない条件(PTX(-))で培養し、各濃度のS1Pを加えて、ボイデンチェンバー法により細胞の遊走能を調べた。その結果、PTX(-)ではS1P濃度により遊走能に顕著な違いが認められた。一方、PTX(+)ではPTX(-)に比べて細胞の遊走能は低く、添加したS1P濃度が低い方がやや細胞の遊走能が高い傾向が認められた(図4参照)。背景技術の欄でも説明したように、S1Pは細胞膜に発現しているGタンパク質共役受容体(S1P受容体)に結合することによって、細胞遊走などを引き起こす生理活性物質でもある。Gタンパク質共役受容体に対して阻害活性を有するPTXを添加した場合、S1Pを加えた系でも遊走能が抑制されていることから、破骨細胞前駆細胞はS1PとGタンパク質共役受容体との相互作用において、遊走能を有することが確認された。
【0023】
上記により、破骨細胞前駆細胞に発現したS1P1と血中S1Pとが相互作用することによる細胞の遊走能が確認された。また、特許文献3により、S1P1アゴニストが細胞の遊走能をさらに増強させうることが確認されたことに基づき、S1P1アゴニストの一種であるFTY720について、実際に骨代謝に及ぼす影響を確認した。卵巣摘出により作製した骨粗鬆症モデルマウスに、FTY720を3mg/kg/dayで4週間腹腔内投与を行なった結果、FTY720を投与しない系に比べて明らかに骨代謝が改善することが確認された(図6参照)。このことより、破骨細胞前駆細胞の遊走能が増強されると、骨代謝も改善されることが示唆された。
【0024】
ここで、S1P1アゴニストとして、例えばSEW2871(5-(4-Phenyl-5-trifluoromethylthiophen-2-yl)-3-(3-trifluoromethylphenyl)-1,2,4-oxadiazole)、KRP-203(2-amino-2-{2-[4-(3-benzyloxyphenylthio)-2-chlorophenyl]ethyl}-1,3-propanediol hydrochloride)、FTY720(2-amino-2-[2-(4-octylphenyl)ethyl]propane-1,3-diol hydrochloride)及びこれらの誘導体等が例示される。FTY720は、冬虫夏草の一種であるlasaria sinclairii菌が産生するミリオシン(myriocin)をリード化合物として、化学修飾により創製された化合物である。細胞傷害を引き起こすT細胞に直接作用することが特徴で、既存の薬剤もしくは既存の免疫抑制剤と併用することで、臓器移植の拒絶反応抑制や自己免疫疾患などの治療薬になると期待されている。KRP-203は、FTY720と同様に、拒絶反応を抑える免疫抑制剤として使用可能であることが報告されている(Shimizu et al., Circulation 2005、Takahashi et al., Transplant Proc 2005)。
【0025】
ここで、上述の細胞培養系に各濃度のS1Pを添加した場合における、S1P添加濃度と細胞の遊走能との関係をさらに検討した。図3の結果より、S1P添加濃度が高い場合に、却って遊走能が低下している傾向が認められた。また、S1P1はS1P2に比べて、S1Pに対する結合能が高く、このため低濃度のS1P存在下では、S1P1のみが作用して正の走化性を示すのに対し、高濃度のS1P存在下では、S1P2にも作用することにより、走化性が阻害されると考えられる。
【0026】
そこで、本発明において、破骨細胞前駆細胞のモデル細胞であるRAW264.7にS1P1 siRNA又はS1P2 siRNAを作用させた場合の細胞の遊走能に及ぼす影響について初めて確認した。その結果、S1P2 siRNAを作用させた場合は、S1P1 siRNAを作用させた場合に比べて遊走能が増強していることが観察された。このことより、S1P2を抑制することで、細胞の遊走能を増強しうることが示唆された。
【0027】
上記の知見に基づき、本発明の新規骨吸収抑制物質のスクリーニング方法を完成した。以下、本発明の内容を詳細に説明する。
【0028】
本発明は、S1PとS1P2 との相互作用を阻害しうる物質を検出することを特徴とする、新規骨吸収抑制物質のスクリーニング方法に関する。本発明のスクリーニング方法では、新規骨吸収抑制物質の候補物質について、S1PとS1P2 との相互作用に及ぼす影響を確認することを要する。ここで、S1PとS1P2 との相互作用に及ぼす影響とは、S1PとS1P2 との相互作用を阻害することをいう。このような影響を確認するために、具体的にはS1P2活性又はS1P2発現を確認することが必要である。さらに、S1PとS1P2 との相互作用を阻害しうる物質が、破骨細胞前駆細胞の遊走能を増強しうることを確認することも必要である。
【0029】
従って、本発明のスクリーニング方法では、少なくとも以下のA)及びB)の工程を含むことが必要である。
A)候補物質のS1PとS1P2 との相互作用に及ぼす影響を確認し、S1PとS1P2 との相互作用を阻害しうる候補物質を選別する工程。
B)候補物質による細胞の遊走能に及ぼす影響を確認し、遊走能の増強が確認された物質をさらに選別する工程。
【0030】
上記において、これら2種の工程の順序は特に限定されず、いずれが先であっても良いが、好ましくはA)の工程で選別された物質について、さらにB)の工程で選別するのが好適である。より具体的には、以下の1.又は2.の方法により、スクリーニングすることができる。
【0031】
1.A)の工程の後B)の工程を行なうスクリーニング方法:
1)試験系に候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
2)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる候補物質を選別する工程:
3)前記工程により選別された候補物質を、S1Pを含む系で培養した細胞培養系に添加する工程;
4)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された物質をさらに選別する工程。
【0032】
2.B)の工程の後A)の工程を行なうスクリーニング方法:
1)候補物質をS1Pを含む系で培養した細胞培養系に添加する工程;
2)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された候補物質を選別する工程;
3)試験系に前記工程により選別された候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
4)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる物質をさらに選別する工程。
【0033】
本発明のスクリーニング方法において、A)S1PとS1P2との相互作用を阻害しうる候補物質を選別するためのS1PとS1P2との相互作用に及ぼす影響の確認は、S1P2活性又はS1P2発現量を確認する試験系によることができる。
【0034】
本発明のスクリーニング方法において、S1P2活性を確認する方法としては、自体公知の方法又は今後開発される方法を採用することができ、特に限定されない。例えばS1P2(受容体=膜たんぱく質)を組み込んだ担体と標識されたS1Pとの結合を測定する試験系において、候補物質を添加して、S1P2担体と標識化S1Pの結合の阻害を観察する方法や、表面プラズモン共鳴(SPR)を利用した、タンパク質間相互作用、脂質−タンパク質間相互作用測定装置を用いてS1Pを結合させた基盤に対し、S1P2ミセルを添加して結合を見る測定系による方法などを適用することができる。具体的には、S1P2を組み込んだ擬似的な脂質ミセルを作製し、これに32P(ラジオアイソトープ)で標識したS1Pとの結合能を測定する系において、S1P2ミセルとS1P(32P)の結合が阻害されるかを観察する方法が挙げられる。また、表面プラズモン共鳴(SPR)を利用したタンパク質間相互作用、脂質−タンパク質間相互作用測定装置を用いる方法では、市販されている自体公知の装置、例えば商品名BIAcore装置を用いることができる。また候補物質が、S1P2抗原を阻害しうる物質、例えば抗S1P2抗体の場合には、単にS1P2と候補物質の抗原抗体反応を確認する方法であっても良い。具体的には、免疫クロマトグラフィー、ELISA法によることができる。
【0035】
本発明のスクリーニング方法において、S1P2発現量を確認する方法としては自体公知の方法によることができる。例えば、mRNAの発現量を確認する方法としては、リアルタイムPCRによることができ、発現したタンパク質を確認する方法としては、例えばウェスタンブロット(Western blot)法やフローサイトメトリー法によることができる。フローサイトメトリー法による解析は、自体公知のフローサイトメーター、例えば商品名FACSCanto装置により解析することができる。ハイスループットスクリーニングとして適しているのは、表面プラズモン共鳴(SPR)を利用した測定方法や、フローサイトメトリー法による測定方法が挙げられる。
【0036】
本発明のスクリーニング方法において、B)遊走能の増強が確認された物質をさらに選別するための候補物質による遊走能に及ぼす影響の確認は、細胞及び候補物質とS1Pを含む系で細胞を培養し、候補物質による細胞の遊走能に及ぼす影響を確認することにより達成することができる。この場合に添加するS1P濃度は、試験系において使用する細胞数及び候補物質との関係で適宜決定することができるが、具体的には10-9M以上の濃度が好ましく、好適には10-8M以上、特に好ましくは10-7M以上である。また、添加するS1P濃度の上限は特に限定されないが、培養液に溶解しうる濃度が好ましく、例えば10-6M以下であることが好ましい。
【0037】
本発明のスクリーニング方法で使用可能な細胞は、少なくともS1P1が発現している細胞、あるいはS1P1を強制発現させた細胞であることが必要である。発現しているS1P1とS1Pとの相互作用による細胞の遊走能を確認することが必要だからである。また、特にS1P2に基づく遊走能を確認する場合は、S1P2とS1P1が発現している細胞、あるいはS1P2とS1P1を強制発現させた細胞を用いることが必要である。このような細胞としては、好ましくは破骨細胞前駆細胞であり、スクリーニング系に使用するために株化され、入手可能な細胞であることが好ましい。具体的にはRAW264.7細胞、MOCP-5細胞、BM2細胞、HL-60細胞などが挙げられ、好ましくはRAW264.7細胞、MOCP-5細胞であり、最も好ましくはRAW264.7細胞である。
【0038】
本発明のスクリーニング方法で使用する遊走能の測定は、自体公知の方法により行うことができる。具体的には、細胞遊走能測定技術として公知のボイデンチェンバー法、ジグモンドチェンバー法やその変法を採用することができる。さらに、今後開発される新たな細胞遊走能測定技術を採用することもできる。具体的には、多数の孔を有するメンブレンにより遮断された上室に細胞を加え、下段に走化性因子を加え、一定時間反応させると、走化性因子に対して遊走活性を示す細胞は、メンブレンの孔を通過して下室に落ちるか、又はメンブレンの裏側に接着する。その落下した細胞を直接計測するか、又はメンブレンに接着した細胞を固定・染色後に一定面積内の細胞を計測することにより、遊走能を判定することができる。チェンバーをマルチウェルとすることにより、多くの試料を処理することができる。例えば、Neuro Probe社製のケモタキシスチェンバーが市販されており、利用することができる。
【0039】
より具体的には、次の方法によりスクリーニングすることができる。
上述の破骨細胞前駆細胞を、細胞増殖に必要な培地を用いて2〜7日間培養容器内で培養する。得られた細胞を、常法に従って培養容器から単離し、細胞の維持に必要な培地に懸濁し、細胞浮遊液を調製する。細胞浮遊液中の細胞の濃度は、遊走能の測定方法に従い適宜決定することができる。
【0040】
例えば、Neuro Probe社製のケモタキシスチェンバーを用いる場合について説明するが、これらに制限されるものではない。ケモタキシスチェンバーの下段には適当な濃度の候補物質を含む溶液を満たし、メンブレンをセットし、さらに上段に上記得られた細胞浮遊液を加えて、適当な時間培養する。培養時間は、細胞の種類、細胞数、候補物質の濃度等により適宜決定することができる。培養後、メンブレンをチェンバーから取り外し、その後メンブレンに付着している細胞を固定し、染色する。その後、上室に接していた面の細胞をふき取り風乾したのち、マイクロプレートリーダーを用いて吸光度を測定することにより、候補物質による細胞の遊走能を測定し、評価することができる。
【0041】
また、本発明のスクリーニング方法により選抜された候補物質の機能的効果は、S1P1発現細胞、好ましくはS1P1及びS1P2を発現している細胞に候補物質とS1Pを加えて培養し、細胞のS1Pに対する遊走能を測定することにより確認することができる。さらには、S1P1発現細胞、好ましくはS1P1及びS1P2を発現している細胞に、候補物質とS1Pを加えて培養し、細胞内でのRacの活性化を測定することでも確認可能である。RacはS1P1の刺激により活性化し、この作用によりS1Pに対して細胞が遊走能を示すからである。効果の確認に用いる細胞は、スクリーニングに使用可能な細胞を使用することができる。
【0042】
本発明は、S1PとS1P2との相互作用を阻害しうる物質を有効成分とする、新規骨吸収抑制剤にも及ぶ。ここにおいて、S1PとS1P2との相互作用を阻害しうる物質は、破骨細胞前駆細胞の遊走能を増強しうる物質である。そのような物質としては、S1P2アンタゴニスト、抗S1P2抗体又はS1P2発現抑制剤が挙げられる。S1P2アンタゴニストとして公知の化合物はJTE013であるが、本発明のスクリーニング方法により選別される新規S1P2アンタゴニストであってもよい。また、抗S1P2抗体は、自体公知の方法、例えばハイブリドーマから得たモノクローナル抗体、若しくは遺伝子組換により作製するモノクローナル抗体であっても良い。S1P2発現抑制剤としては、スクリーニング方法により選別される新規S1P2発現抑制剤であっても良いし、siRNAやアンチセンスオリゴヌクレオチドなどであっても良い。
【実施例】
【0043】
以下に、本発明を完成させるために行なった実験結果を参考例として示し、実施例において本発明をさらに具体的に説明するが、本発明はこれらに限定されるものではなく、本発明の技術的思想を逸脱しない範囲内で種々の応用が可能である。
【0044】
(参考例1)破骨細胞前駆細胞とS1Pとの作用について
1)S1Pの受容体発現の確認
破骨細胞前駆細胞由来細胞(RAW264.7)又は骨髄由来破骨細胞前駆細胞(BM-MDM)について、S1P1〜S1P5及びインテグリンαvのmRNA発現を確認した。mRNAの発現確認のため、対照としてGAPDHについても調べた。
【0045】
RAW264.7細胞又はBM-MDM細胞を、培地としてαMEM(Minimal Essential Medium)に10%熱非働化ウシ胎児血清(以下、「FCS」)とペニシリン/ストレプトマイシンを加えたものを用いて、RANKLを含まない系(RANKL(-))及び終濃度50ng/mlのRANKLを添加した系(RANKL(+))で37℃、3日間培養した。この細胞をセルスクレーパーを用いて単離して集め、該細胞からフェノール・クロロホルム抽出によりRNAを抽出し、これを基にして逆転写酵素によりcDNAを作製した。これを鋳型として各種遺伝子(S1P1〜S1P5、インテグリンαv、GAPDH)に特異的なプライマーを用いてPCR反応を行った。PCRに用いたプライマー及びPCRの条件は、特許文献3の記載に従った。
【0046】
得られたPCR産物を電気泳動用ローディングバッファー(10×loading buffer(タカラバイオ製))と混合し、2%アガロースゲルにて100V・20分の電気泳動を行い、目的とする遺伝子の発現を確認した。
【0047】
その結果を図2に示した。破骨細胞前駆細胞においては、RANKL(-)では、S1P1及びS1P2のmRNAが発現していることが確認された。一方、RANKL(+)の系では、S1P1の発現が著明に減弱しており、S1P2の発現が不変〜軽度亢進していることが確認された。また、S1P3〜S1P5の発現は見られなかった。
【0048】
なお、破骨細胞前駆細胞及び破骨細胞に発現し、RANKLにてその発現が亢進することが知られているインテグリンαvについては、RANKL(+)の系で発現増強が見られた。これより、本試験系において破骨細胞前駆細胞はRANKLにより分化誘導シグナルを受けていることが確認された。また、GAPDHの結果より、RANKL(+)(-)の系で全mRNAレベルに変化がない(またはその抽出過程での変化もない)ことを確認した。図2において、RTは逆転写反応を意味し、RT(+)は逆転写反応を行ったもの、RT(-)は反応を行わなかったもの意味する。RT(-)はmRNAを抽出する際に、ゲノムのDNAがコンタミネーションしていないことを確認するためのネガティブ・コントロールである。
【0049】
2)破骨細胞前駆細胞のS1Pに対する遊走能の確認
上記1)と同様に、RANKL(+)又は(-)の系で37℃、3日間培養したRAW264.7細胞又はBM-MDM細胞をセルスクレーパー及び0.025%トリプシン-EDTAを用いて単離した。96ウェル・ケモタキシスチェンバー(Neuro Probe社製)にフィブロネクチンでコートしたポリカーボン製メンブレンフィルターをセットし、下段にはS1Pの終濃度が0, 10-10〜10-7Mとなるように調製したS1P含有培地を加えた。上段には単離したRAW264.7細胞又はBM-MDM細胞を、1ウェルあたり3×105個加え、CO2インキュベーターにて37℃、5時間培養した。その後、メンブレンフィルターを取り出してヘマトキシリン・エオジン染色を行い、プレートリーダーを用いて吸光度を測定し、遊走によりメンブレンフィルターへ移動した細胞の数を定量した。
【0050】
その結果in vitroの試験系で、RANKL(-)、即ちRANKLにより分化誘導されていない破骨細胞前駆細胞がS1Pに対する遊走能を示すことが確認された(図3ab)。また、RAW264.7細胞ではS1Pの終濃度が10-9〜10-8Mの場合に遊走能が最も高く、10-7Mの場合はやや低下した(図3a)。BM-MDM細胞ではS1Pの濃度依存的に遊走能も増強した(図3b)。
【0051】
3)破骨細胞前駆細胞のS1Pに対する遊走能の確認
RANKL(-)の条件で、PTX(+)又は(-)の系で37℃、3日間培養したRAW264.7細胞を上記2)と同手法にてメンブレンフィルターをセットし、下段にはS1Pの終濃度が0, 10-12〜10-5Mとなるように調製したS1P含有培地を加えた。上記2)と同手法にて上段には単離したRAW264.7細胞を加え、培養後、メンブレンフィルターを取り出してヘマトキシリン・エオジン染色を行い、プレートリーダーを用いて吸光度を測定し、遊走によりメンブレンフィルターへ移動した細胞の数を定量した。
【0052】
その結果を図4に示した。in vitroの試験系で、PTX(+)の系で、破骨細胞前駆細胞のS1Pに対する遊走能の阻害が確認された。
【0053】
4)破骨細胞前駆細胞内でのRacの活性化の確認
上記2)及び3)と同様に、RANKL(-)の条件で、37℃、3日間培養したRAW264.7を、S1Pの終濃度が0, 10-8〜10-6Mとなるように調製したS1P含有培地を用いてさらに3時間培養した。該RAW264.7細胞をセルスクレーパーを用いて単離し、遠心分離により細胞を沈殿させた。沈殿した細胞をタンパク質抽出用緩衝液(150 mM NaCl, 5 mM KCl, 25 mM Hepes-NaOH (pH 7.4), 1 mM PMSF, プロテアーゼ阻害剤カクテル)を用いて再懸濁し、これを超音波破砕器で処理し、高速微量遠心分離により不溶解物を除去したものをRac活性測定用の試料とした。
【0054】
上記により得た試料の1/100量を分離し、試料1(Rac(1/100))とした。残りの試料に、グルタチオン・セファロース(ビーズ)に固着させた「活性型(GTP結合型)Rac結合ドメイン蛋白質(大腸菌で発現・精製)」を添加し、プルダウン・アッセイ法(標準的プロトコールに従う)によりこれに結合する蛋白質を単離し、試料2(GTP-Rac)とした。
【0055】
試料1及び試料2について、15%アクリルアミドゲルにてSDS-PAGEを行った。電気泳動終了後、PVDF膜へトランスファーした後に、抗Rac抗体(Upstate Biotechnology社製)を用いてウェスタン・ブロッティングを行い、膜上でのRacタンパク質の同定を行った。この方法により、破骨細胞前駆細胞での総Rac量(Rac(1/100))、及び活性型(GTP結合型)Rac量(GTP-Rac)のそれぞれを調べた。
【0056】
その結果を図5に示した。S1Pの添加により、細胞内での総Rac量(Rac(1/100))には変化がないのに対し、遊走能に重要な活性型Rac量(GTP-Rac)が増加していることが認められた。この結果は、S1Pによる刺激により破骨細胞前駆細胞内でRacの活性化が見られることを意味している。
【0057】
5)結果
破骨細胞前駆細胞にS1Pの受容体(S1P1及びS1P2)が発現していることが確認された。また、RANKLの刺激により破骨細胞前駆細胞が成熟破骨細胞に分化すると、S1P1の発現が低下することが確認された(図2)。in vitroの試験系で、破骨細胞前駆細胞が実際にS1Pに対する遊走能を示すことが確認された(図3,4)。さらに、細胞の遊走に重要なRacの活性化が破骨細胞前駆細胞内で起こっていることが確認された(図5)。
【0058】
(参考例2)骨粗鬆症モデルマウスにFTY720(S1P1アゴニスト)を投与した場合の骨代謝に及ぼす影響
1)実験方法
8〜12週齢のC57BL/6マウス(雌性)の卵巣を麻酔下で摘出した骨粗鬆症モデルマウスを用いて、FTY720(S1P1アゴニスト)を投与した場合の骨代謝に及ぼす影響を確認した。健常マウス(sham-operated)群及び骨粗鬆症モデルマウス群を準備し、各マウス群について、FTY720投与群及び対照(vehicle)群に分類した。FTY720投与群では、卵巣摘出翌日若しくは偽手術翌日より、FTY720を3mg/kgを毎日1度ずつ4週間連続して腹腔内投与した。各群5匹のマウスを用いた。4週間後に屠殺し、大腿骨の断面を観察した。
【0059】
2)結果
上記の結果、骨粗鬆症モデルマウス群では、対照群に比べてFTY720投与群の方が、明らかに骨密度が増加し、骨代謝が行なわれていることが観察された。一方、健常マウス群においては、骨密度に違いは殆ど認められなかった。このことより、S1P1アゴニストであるFTY720の投与により、骨粗鬆症モデルの場合は、骨密度が改善したのに対し、健常マウスでは健常な骨密度を維持し、骨密度を異常に上昇させることはなかった(図6参照)。
【0060】
(実施例1)骨粗鬆症モデルマウスにJTE013(S1P2アンタゴニスト)を投与した場合の骨代謝に及ぼす影響
1)実験方法
参考例2と同手法により作製した骨粗鬆症モデルマウスを用いて、JTE013(S1P2アンタゴニスト)を投与した場合の骨代謝に及ぼす影響を確認した。実験は、健常マウス(sham-operated)群及び骨粗鬆症モデルマウス群を準備し、各マウス群について、JTE013投与群及び対照(vehicle)群に分類した。JTE013投与群では、卵巣摘出翌日若しくは偽手術翌日より、JTE013を1mg/kgを毎日1度ずつ4週間連続して腹腔内投与した。各群5匹のマウスを用いた。4週間後に屠殺し、大腿骨の断面を観察し、骨重量を測定した。
【0061】
2)結果
上記の結果、骨粗鬆症モデルマウス群では、対照群に比べてJTE013投与群の方が、明らかに骨密度が増加し、骨代謝が行なわれていることが観察された。一方、健常マウス群においては、骨密度に違いは殆ど認められなかった。このことより、S1P2アンタゴニストであるJTE013の投与により、骨粗鬆症モデルの場合は骨密度が改善したのに対し、健常マウスでは健常な骨密度を維持し、必要以上に骨密度を上昇させることはなかった(図7A,B参照)。
【産業上の利用可能性】
【0062】
以上詳述したように、本発明のスクリーニング方法により、現存の骨吸収抑制剤とは異なるメカニズムによるスクリーニングを行うことができる。具体的には、S1PとS1P2との相互作用、並び破骨細胞前駆細胞の遊走能に及ぼす効果に基づく新規骨吸収抑制物質を選別しうるスクリーニングを行うことができる。本発明のスクリーニング方法により選別された骨吸収抑制剤は、現存する骨吸収抑制剤の作用機序とは異なり、成熟した破骨細胞の前段階である破骨細胞前駆細胞の遊走・位置決めを標的としている点において、極めて優れている。
【0063】
従来公知のビスホスホネート製剤は骨表面で成熟破骨細胞をアポトーシスさせる作用によるものであるが、本発明の方法により選別される薬剤は破骨細胞前駆細胞の骨細胞への流出入のバランスを制御するものであり、より安全性が高い薬剤ということができる。異なる作用機序による骨吸収抑制剤は、従来の薬剤と併用して使用することもできる。併用することで、従来の薬剤の使用量を軽減させ、かつ相乗効果も期待できる。さらに、破骨細胞前駆細胞が破骨細胞に成熟するのを防止する作用があることから、予防的に使用することで、骨粗鬆症の発症を抑制することも期待できる。
【0064】
人口の4人に1人が65歳以上の高齢者という超高齢者時代を迎えた日本では、加齢による骨粗鬆症の患者数は1000万人を突破しつつある。また、社会の高齢化及び骨吸収性疾患の増加は、日本に限ったものではなく先進諸国に共通した問題である。現在、骨粗鬆症の罹患患者数は日米欧の先進諸国において約7500万人と推定されており、ビスホスホネート製剤をはじめとする骨吸収抑制剤の世界市場は総額8000億円に及ぶ巨大なマーケットである。また、この市場は今後確実に増加することが予想される。このため、本発明を基にした新規の有効な骨吸収抑制剤の開発の意義は、日本国内に留まらず、世界規模での創薬ビジネスへと発展することが期待される。
【特許請求の範囲】
【請求項1】
スフィンゴシン1リン酸(S1P)とスフィンゴシン1リン酸受容体2型(S1P2)との相互作用を阻害しうる物質を検出することを特徴とする、新規骨吸収抑制物質のスクリーニング方法。
【請求項2】
少なくとも以下のA)及びB)の工程を含むことを特徴とする請求項1に記載のスクリーニング方法:
A)候補物質のS1PとS1P2 との相互作用に及ぼす影響を確認し、S1PとS1P2 との相互作用を阻害しうる候補物質を選別する工程;
B)候補物質による細胞の遊走能に及ぼす影響を確認し、遊走能の増強が確認された物質をさらに選別する工程。
【請求項3】
以下の工程を含む請求項1又は2に記載のスクリーニング方法:
1)試験系に候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
2)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる候補物質を選別する工程:
3)前記工程により選別された候補物質を、S1Pを含む系で培養した細胞培養系に添加する工程;
4)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された物質をさらに選別する工程。
【請求項4】
以下の工程を含む請求項1又は2に記載のスクリーニング方法:
1)候補物質をS1Pを含む系で培養した細胞培養系に添加する工程;
2)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された候補物質を選別する工程;
3)試験系に前記工程により選別された候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
4)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる物質をさらに選別する工程。
【請求項5】
S1PとS1P2との相互作用に及ぼす影響を確認する工程が、S1P2活性又はS1P2発現量を確認する工程による、請求項2〜4のいずれか1に記載のスクリーニング方法。
【請求項6】
スクリーニング方法に用いる細胞が、S1P2及びS1P1を発現している細胞である、請求項2〜5のいずれか1に記載のスクリーニング方法。
【請求項7】
スクリーニング方法に用いる細胞が、破骨細胞前駆細胞である、請求項2〜6のいずれか1に記載のスクリーニング方法。
【請求項8】
S1PとS1P2との相互作用を阻害しうる物質を有効成分とする、新規骨吸収抑制剤。
【請求項9】
S1PとS1P2との相互作用を阻害しうる物質が、破骨細胞前駆細胞の遊走能を増強しうる物質である、請求項8に記載の新規骨吸収抑制剤。
【請求項10】
S1PとS1P2との相互作用を阻害しうる物質が、S1P2アンタゴニスト、抗S1P2抗体又はS1P2発現抑制剤である、請求項8又は9に記載の新規骨吸収抑制剤。
【請求項1】
スフィンゴシン1リン酸(S1P)とスフィンゴシン1リン酸受容体2型(S1P2)との相互作用を阻害しうる物質を検出することを特徴とする、新規骨吸収抑制物質のスクリーニング方法。
【請求項2】
少なくとも以下のA)及びB)の工程を含むことを特徴とする請求項1に記載のスクリーニング方法:
A)候補物質のS1PとS1P2 との相互作用に及ぼす影響を確認し、S1PとS1P2 との相互作用を阻害しうる候補物質を選別する工程;
B)候補物質による細胞の遊走能に及ぼす影響を確認し、遊走能の増強が確認された物質をさらに選別する工程。
【請求項3】
以下の工程を含む請求項1又は2に記載のスクリーニング方法:
1)試験系に候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
2)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる候補物質を選別する工程:
3)前記工程により選別された候補物質を、S1Pを含む系で培養した細胞培養系に添加する工程;
4)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された物質をさらに選別する工程。
【請求項4】
以下の工程を含む請求項1又は2に記載のスクリーニング方法:
1)候補物質をS1Pを含む系で培養した細胞培養系に添加する工程;
2)前記工程の後、細胞の遊走能を測定し、遊走能の増強が確認された候補物質を選別する工程;
3)試験系に前記工程により選別された候補物質を添加し、S1PとS1P2との相互作用に及ぼす影響を確認する工程;
4)前記相互作用に及ぼす影響を確認した結果に基づき、S1PとS1P2との相互作用を阻害しうる物質をさらに選別する工程。
【請求項5】
S1PとS1P2との相互作用に及ぼす影響を確認する工程が、S1P2活性又はS1P2発現量を確認する工程による、請求項2〜4のいずれか1に記載のスクリーニング方法。
【請求項6】
スクリーニング方法に用いる細胞が、S1P2及びS1P1を発現している細胞である、請求項2〜5のいずれか1に記載のスクリーニング方法。
【請求項7】
スクリーニング方法に用いる細胞が、破骨細胞前駆細胞である、請求項2〜6のいずれか1に記載のスクリーニング方法。
【請求項8】
S1PとS1P2との相互作用を阻害しうる物質を有効成分とする、新規骨吸収抑制剤。
【請求項9】
S1PとS1P2との相互作用を阻害しうる物質が、破骨細胞前駆細胞の遊走能を増強しうる物質である、請求項8に記載の新規骨吸収抑制剤。
【請求項10】
S1PとS1P2との相互作用を阻害しうる物質が、S1P2アンタゴニスト、抗S1P2抗体又はS1P2発現抑制剤である、請求項8又は9に記載の新規骨吸収抑制剤。
【図3】


【図4】


【図1】


【図2】


【図5】


【図6】


【図7】




【図4】


【図1】


【図2】


【図5】


【図6】


【図7】


【公開番号】特開2013−27314(P2013−27314A)
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願番号】特願2009−260655(P2009−260655)
【出願日】平成21年11月16日(2009.11.16)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願日】平成21年11月16日(2009.11.16)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
[ Back to top ]

