日に1回の取り替えによるフェンタニルの経皮投与
【課題】 効果的に鎮痛をもたらすオピオイドの経皮投与用の医療用パッチの提供。
【構成】 鎮痛効果の目的でオピオイド、特に、フェンタニル、を経皮投与するための方法および毎日取り替えるパッチ。
【構成】 鎮痛効果の目的でオピオイド、特に、フェンタニル、を経皮投与するための方法および毎日取り替えるパッチ。
【発明の詳細な説明】
【技術分野】
【0001】
本開示は、薬を経皮投与するための方法および送達デバイスに関する。例えば、オピオイド薬を送達するための経皮パッチおよびオピオイド薬を経皮投与する方法を記述する。
【背景技術】
【0002】
オピオイド薬は公知でありかつ様々の薬製品の中に含まれている。例えば、フェンタニルおよびこれの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどは強力な合成オピオイドであり、これらはヒトおよび獣医両方用の薬剤として使用可能であることが示されている。アルフェンタニル、フェンタニル、レミフェンタニルおよびスフェンタニルは全身麻酔薬として規制当局によってヒト用薬剤に用いる許可が与えられている。フェンタニルおよびこれの類似物を急性および慢性両方の痛みを治療する目的で経皮投与することは特許および公開出願の中で示唆されている(例えば特許文献1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20および21を参照)。その上、また、フェンタニル含有製品(フェンタニル含有経皮パッチを包含)も慢性痛を治療する時の鎮痛薬として市販されている。
【0003】
経皮パッチ形態の例にはモノリスおよび多層デバイスが含まれる。モノリスデバイスは比較的簡単であり、接着性モノリスが薬含有貯蔵層を含有していてそれが裏地の上に位置することを特徴とし得る。そのようなデバイスに入っている薬含有貯蔵層は典型的に製薬学的に許容される感圧接着剤から作られたものである。ある場合には、その薬含有貯蔵層が非接着性材料から作られることもあり得、それの皮膚接触表面に適切な接着剤の薄層が与えられている。そのようなパッチから当該薬が患者に投与される速度は、薬の皮膚透過性が通常の人から人および皮膚部位から皮膚部位で異なることが理由で多様であり得る。多層もしくは多積層デバイスには1つ以上の膜と結合しているマトリクス薬貯蔵層もしくは液体貯蔵層が含まれている可能性がある。例えば、多積層パッチの場合には薬放出速度を制御する膜を薬貯蔵層と皮膚接触接着剤の間に位置させることができる。放出速度制御膜は、薬がパッチから放出される速度を制御することによって、皮膚透過性が多様である影響を低くする働きをする。
【0004】
モノリスおよび多層デザインに加えて、経皮パッチの薬含有貯蔵層は、薬を貯蔵層中に完全に溶かす能力を有する貯蔵層(飽和状態ではないパッチ、例えば特許文献22、23、24、25、26、27、28、29、30、31、32、33および34を参照)または飽和濃度以上の溶解していない薬が過剰量で入っている可能性のある貯蔵層(持続性薬パッチ)のいずれかである。経皮パッチは皮膚を貫く拡散によって薬を送達することから、その薬がパッチから送達される速度は一般にフィックの法則に左右され、典型的には、当該貯蔵層に入っている薬の飽和度合に比例する。
【0005】
鎮痛用経皮パッチとして幅広く入手可能なフェンタニル製品はDURAGESIC(商標)パッチである。例えば、前記パッチおよびそれの使用が記述されているラベルを参照(例えば非特許文献1)。フェンタニルが感圧接着剤に溶解している別のフェンタニルパッチであるDUROGESIC(商標)DTRANS(商標)[またはDUROGESIC(商標)SMAT]マトリクスパッチを鎮痛用経皮パッチとして特定の国で入手することができる(非特許文献2を参照)。前記DUROGESIC(商標)DTRANS(商標)経皮パッチは、フェンタニルを3日間投与する製品であり、術後もしくは他の急性痛とは対照的に慢性痛の治療で処方される。このDUROGESIC(商標)DTRANS(商標)マトリクスフェンタニルパッチは、慢性痛から解放されるように3日間が終了す
る毎に逐次的に剥がして代わりに新しいパッチを新しい皮膚部位に貼り付けることを意図したものであり、かつ投与量を経時的に多くしてもよくそして抑えきれない痛みに対処する目的で他の鎮痛薬を同時に使用してもよいことを意図したものである。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第4,466,953号
【特許文献2】米国特許第4,470,962号
【特許文献3】米国特許第4,588,580号
【特許文献4】米国特許第4,626,539号
【特許文献5】米国特許第5,006,342号
【特許文献6】米国特許第5,186,939号
【特許文献7】米国特許第5,310,559号
【特許文献8】米国特許第5,474,783号
【特許文献9】米国特許第5,656,286号
【特許文献10】米国特許第5,762,952号
【特許文献11】米国特許第5,948,433号
【特許文献12】米国特許第5,985,317号
【特許文献13】米国特許第5,958,446号
【特許文献14】米国特許第5,993,849号
【特許文献15】米国特許第6,024,976号
【特許文献16】米国特許第6,063,399号
【特許文献17】米国特許第6,139,866号
【特許文献18】米国出願番号2003002682
【特許文献19】米国出願番号20050208117
【特許文献20】米国出願番号2002119187
【特許文献21】米国出願番号20040234584
【特許文献22】米国特許第4,704,282号
【特許文献23】米国特許第4,725,439号
【特許文献24】米国特許第4,867,982号
【特許文献25】米国特許第4,908,027号
【特許文献26】米国特許第5,004,610号
【特許文献27】米国特許第5,152,997号
【特許文献28】米国特許第5,164,190号
【特許文献29】米国特許第5,342,623号
【特許文献30】米国特許第5,344,656号
【特許文献31】米国特許第5,364,630号
【特許文献32】米国特許第5,462,745号
【特許文献33】米国特許第5,633,008号
【特許文献34】米国特許第6,165,497号
【非特許文献】
【0007】
【非特許文献1】Physicians Desk Reference、58版、2004、1751−1755頁
【非特許文献2】インターネットを通してhttp://emc.medicines.org.uk.で公にアクセス可能なSummary of Product Characteristics of “DUROGESIC(R) DTRANS(R) transdermal patch” and DUROGESIC(R) DTRANS(R) transdermal patch “Patient Information Leaflet”
【発明の概要】
【0008】
本開示は、オピオイド薬を経皮投与するためのデバイスおよび方法を提供するものである。例えば、特定の態様において、本開示は、オピオイド薬を鎮痛を誘発してほぼ1日持続する治療期間に渡って維持するに充分な量および目標の速度で経皮送達するための日に1回のパッチ(1日パッチ)を提供するものである。そのような態様において、本パッチに入れて送達するオピオイドはフェンタニルまたはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上であってもよい。各態様において、本明細書に記述する如き経皮パッチはヒト患者に投与する目的で調製可能である。
【0009】
本開示は、経皮パッチに加えて、オピオイド薬を投与する方法も提供する。特定の態様において、本明細書に記述する方法は、フェンタニルまたはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上から選択したオピオイドを投与することを包含する。そのような態様の一例として、本方法は、フェンタニルまたはこれの類似物の中の1つ以上が送達されるように考案した少なくとも1枚のパッチを患者に貼り付けた後に前記少なくとも1枚のパッチの中の少なくとも1枚を3日毎より多い頻度、例えば2日毎より多い頻度または毎日剥がして取り替えることを包含する。
【図面の簡単な説明】
【0010】
本開示を添付図の図中に限定するものではない態様の例として例示し、図中の同様な参照記号は同様な要素を示す。内容の中で特に示さない限り、本図は原寸で示すものでない。グラフ中のデータ点と連結している垂直線は標準偏差を示す線である
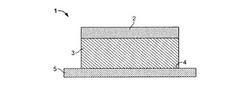
【図1】図1に、1つの態様の経皮治療システムを貫く図式断面図を示す。
【図2】図2に、別の態様の経皮治療システムを貫く図式断面図を示す。
【図3】図3に、1日経皮フェンタニルパッチを日に1回貼り付ける模擬の血中薬濃度を3日経皮フェンタニルパッチを3日毎に1回貼り付けた時の定常状態のそれと対比させた比較を示す。
【図4】図4に、1日経皮フェンタニルパッチを日に1回貼り付ける模擬の血中薬濃度を3日経皮フェンタニルパッチを3日間貼り付けた時の実際の実験データと対比させた比較を示す。
【図5】図5に、1日経皮フェンタニルパッチを日に1回貼り付ける模擬の血中薬濃度を3日経皮フェンタニルパッチを3日間貼り付けた時の実際の実験データと対比させた別の比較を示す。
【図6】図6に、いろいろな投薬濃度の3日パッチを用いて経時的に集めた実際の血清中フェンタニル濃度を示す。
【図7】図7に、3日フェンタニル経皮パッチを毎日新しいパッチに取り替えて投与した時の血清中フェンタニル濃度実験結果を示す。
【図8】図8に、マトリクス薬層の厚みを変えた時に被験体の血中フェンタニル濃度に関する平均データ(被験体全体に渡る)の要約を示す。
【図9】図9に、1日パッチを繰り返し貼り付けることによるフェンタニル濃度の模擬データを3日パッチを336時間に及んで貼り付けた時のそれと対比させて示す。
【図10】図10に、1日パッチの場合の216時間目から288時間目までの被験体の血清中フェンタニル濃度の平均データ(被験体全体に渡る)を3日パッチの場合のそれと比較した要約を示す。
【図11】図11に、図10の定常状態3日パッチデータを図9のデータから見積もった模擬定常状態3日パッチデータと対比させた比較を示す。
【図12】図12に、図10の定常状態1日パッチデータを図9のデータから見積もった模擬定常状態1日パッチデータと対比させた比較を示す。
【図13】図13に、いろいろな投薬濃度の1日フェンタニルパッチを1日貼り付けた時の血清中フェンタニル濃度のデータを示す。
【図14】図14に、1つの態様の1日パッチを貼り付けた時の定常状態の被験体の血中フェンタニル濃度の平均データ(被験体全体に渡る)を3日パッチのそれと対比させた要約を示す。
【図15】図15に、別の態様の1日パッチを貼り付けた時の定常状態の被験体の血中フェンタニル濃度の平均データ(被験体全体に渡る)を3日パッチのそれと対比させた要約を示す。
【図16】図16は、1日パッチを用いてフェンタニルを投与したある被験体におけるフェンタニルおよびこれの代謝産物であるノルフェンタニルの血清中濃度を示すグラフである。
【0011】
詳細な記述
本明細書では、オピオイド薬を送達するための経皮パッチを記述する。また、オピオイド薬を送達する方法も提供し、特定の態様において、本発明の方法は、本明細書に記述する如き経皮パッチを患者に1枚以上貼り付けることを包含する。いくつかの態様において、本開示は、鎮痛の目的で1日(時には便利さの目的で「QD」と呼ぶ)フェンタニルパッチを毎日取り替えることを提供する。特定の態様において、本明細書に記述するように患者の皮膚に1枚のパッチを毎日取り替えて貼り付けると治療的に有効な範囲内の定常状態血漿中濃度が達成され得る。このように、皮膚に貼り付けるパッチが1枚のみの場合、そのパッチを毎日取り替えることで治療的に有効な範囲内の定常状態血漿中プロファイルが達成されるであろう。本明細書に記述するパッチで送達すべき典型的なオピオイドには、フェンタニルおよびフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上が含まれる。本明細書に記述する如きパッチに入れて送達可能なフェンタニルの典型的な形態はフェンタニルの塩基形態である。
【0012】
フェンタニルを送達するための多日経皮パッチ、例えばDUROGESIC(商標)DTRANS(商標)マトリクスパッチなどを3日毎ではなく日に1回取り替えて貼り付けると血漿中フェンタニル濃度が最初の3回の投与に渡って急速に高くなり、その結果として、血漿中薬濃度が同じパッチを3日毎に取り替えた時に達成される定常状態濃度よりも高くなることを確認した。所定理論で制限するものでも範囲を限定するものでもないが、取り替える時に使用済みパッチを剥がすことでその古いパッチと新しいパッチを同時に皮膚上に存在させなくてもその古いパッチに由来する薬がある量で使用者の組織の中に保持されることでそれがその使用者から排泄されるまでに有意な時間要する結果として持続性薬の影響が生じることから達成させる性能がそのようであると考えている。例えば、経皮送達されたフェンタニルの半減期はそのような持続性薬の影響が理由で静脈内投与されたフェンタニルのそれに比べて極めて長いことを確認した。
【0013】
パッチを取り替えるのが3日毎または4日毎のみである場合、血漿中フェンタニル濃度蓄積に対してそのような持続性薬が示す影響は比較的目立たない可能性がある。しかしながら、3日パッチを患者に毎日取り替えて貼り付けた時に達成される血漿中薬濃度はその3日パッチを3日毎または4日毎に貼り付けた時のそれよりも高いことを確認した。このように、毎日取り替えて患者に貼り付ける本発明に従う経皮パッチは多日パッチ、例えば3日パッチなどに比べて相対的に小型であってもよくそして/または充填する薬の量も比較的少なくてもよいが、それでも、治療的に有効な血漿中薬濃度を達成して維持し得ることを見いだした。特に、多日経皮パッチを用いてオピオイド薬、例えばフェンタニルなどの目標血漿中濃度を達成して維持する目的で現在入手可能な多日パッチ、例えば現在入手可能な3日経皮フェンタニルパッチなどより小型のパッチシステムを用いることができることを見いだした。いくつかの態様において、本発明に従う1日パッチに含有させる薬の
充填量は従来の3日パッチの半分以下であるが、それでも、それを用いて毎日取り替えて貼り付けると治療的に有効な目標の血漿中オピオイド薬濃度が達成されそして/または維持され得る。更にその上、我々は、本明細書に記述する如き経皮パッチを1枚毎日取り替えて貼り付けることで治療的に有効な目標の血漿中オピオイド薬濃度を達して維持することができることも見いだした。勿論、毎日取り替えて貼り付けるパッチが1枚のみであったとしても結果として吸収される薬の量に有意な差がないならば患者に貼り付けられているままであるパッチが2枚以上である重り合い時間がある程度存在してもよく、例えば取り替える間に経過する時間が数秒間または数分間でさえあっても構わないことを意図する。
【0014】
本開示は、使用者が治療濃度のオピオイド薬を目標のCmaxを超えることなく送達して維持することを可能にする経皮パッチおよび方法を提供するものである。その上、本明細書に記述する経皮パッチおよび方法は、送達すべきオピオイドのCmaxとCminの間の変動を狭くしながらオピオイド薬の好ましい定常状態送達をもたらすものである。本明細書に記述するパッチおよび方法を用いて送達すべき薬のCmaxとCminの変動を制御することは当該薬の治療効果の維持および起こり得る副作用の制御に役立つ。本明細書に記述する経皮パッチの態様におけるパッチは、オピオイド薬を1日パッチが示すCmaxとCminの間の差が同じオピオイドを送達する目的で考案された多日パッチが達成するそれよりも小さくなるように送達する1日パッチである。
【0015】
特定の態様において、本明細書に記述するパッチが示す1日当たりの薬使用重量%は多日パッチのそれに比べて高い。例えば、1つのそのような態様では、本明細書に記述するパッチをオピオイド薬を送達するに適していて1日当たりの薬使用重量%が同じ薬、例えばフェンタニル塩基などが用いられている多日パッチ、例えばDUROGESIC(商標)DTRANS(商標)マトリクスパッチなどのそれに比べて高くなるように構築および配置する。いくつかの態様では、本明細書に記述するパッチに含有させるオピオイド薬の含有量を現在入手可能な製品もしくは多日オピオイドパッチのそれに比べて低くすることができる。いくつかの態様において、本開示は、1日後のオピオイド薬使用パーセントが多日パッチを数日使用することでもたらされるオピオイド薬使用パーセントに近い1日パッチを提供するものである。1つのそのような態様では、1日使用後のフェンタニル使用パーセントが3日フェンタニルマトリクスパッチを3日間使用した後にもたらされるフェンタニル使用パーセントに近い1日フェンタニルパッチを記述する。本明細書に記述する態様のパッチを用いると薬充填率を比較的低くすることができかつ薬使用重量%を高くすることができることで、使用後のパッチに残存する残存薬の量が少なくなる可能性があり、そのような特性によって、そのような態様に従うパッチが乱用または不法な使用を受け得る危険性が低下し得る。
【0016】
また、本明細書に記述する1日パッチは使用者の便利さの向上をもたらす可能性もあり、それによって患者の服薬順守度が高くなる可能性がある。ある場合には、経皮パッチを毎日少なくとも短時間剥がす方が好ましい可能性がある。例えば、多日オピオイドパッチを用いる場合には、入浴中に前記パッチを剥がす方が好ましい可能性がある、と言うのは、多量の水に浸かるか或はさらされると薬が当該パッチからある量で出て行く可能性があるからである。その上、人は習慣の奴隷であることから、毎日取り替える決まった行動は3日毎または4日毎に取り替えるよりも服薬順守により役立つ可能性もある。
【0017】
本記述に従う経皮パッチは裏地層および前記裏地層の上に位置する薬貯蔵層を含有し得る。特定の態様において、前記貯蔵層の皮膚接触表面は接着性であってもよく、前記貯蔵層は、オピオイドが鎮痛を患者に誘発して約1日維持するに充分な量で入っている重合体組成物を含有する。そのような態様における薬貯蔵層は溶解していないオピオイド薬を含有するか或は含有していなくてもよい。従って、いくつかの態様における薬貯蔵層は、溶
解していないオピオイドを含有せずかつ場合により溶解していない材料を薬貯蔵層接着剤中にも含有していなくてもよい。別法として、他の態様では、本明細書に記述する如き経皮パッチの薬貯蔵層は溶解していないオピオイドを含有していてもよい。
【0018】
本明細書に記述する如きパッチを用いて送達可能な典型的なオピオイドには、フェンタニルおよびフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上が含まれる。各態様において、本明細書に記述するパッチの構成および構築はヒト患者に投与するに適するように実施可能である。
【0019】
1つの態様において、本開示は、パッチを毎日取り替えることで鎮痛を誘発して維持するに充分な投与速度でオピオイドを経皮送達するための速度非制御モノリスパッチ(速度制御膜を伴わない)を提供するものである。1つのそのような態様における薬は、フェンタニル、例えば塩基形態のフェンタニルなどであってもよい(イオン化していない形態のフェンタニルを貯蔵層内に存在させる)。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上であってもよい。1つのそのような態様におけるパッチは、裏地層および前記裏地層の上に位置する薬貯蔵層を含有する。前記薬貯蔵層の皮膚接触表面は接着性であってもよく、そして前記貯蔵層は、オピオイド、例えばフェンタニル塩基などが鎮痛をヒトに誘発して1日維持するに充分な量で入っている重合体組成物(溶解していていない成分が入っているか或は入っていない)を含有し得る。そのような態様は、そのようなパッチを1枚貼り付けて毎日取り替えることで治療的に有効な範囲の定常状態血漿中濃度を達成しようとする方法で利用可能である。
【0020】
本開示では、オピオイド薬の投与を必要としている被験体にそれを投与する方法を提供する。1つの態様において、本明細書に記述する方法は、1枚の経皮パッチを被験体の皮膚に治療範囲内の定常状態血漿中プロファイルが達成されるように貼り付けた後に毎日取り替えることを包含する。1つのそのような態様で用いるパッチは、裏地層およびオピオイド薬を含有する重合体組成物を有する薬貯蔵層を含有する。1つのそのような態様のパッチで送達する薬はフェンタニルであり、それを前記貯蔵層内に(イオン化していない)塩基形態で存在させてもよくかつそれをポリアクリレート系接着剤に溶解させてもよい。特定の態様では、溶解していないフェンタニルを存在させてもよい。他のそのような態様において、本パッチで送達する薬はフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上であってもよい。その上、そのような態様の各々において、オピオイドの投与を必要として被験体はヒト被験体であってもよい。
【0021】
別の態様において、本開示では、治療範囲内の血漿中オピオイド薬プロファイルが1日の間達成されるように最初に2枚以上のパッチを1日目に貼り付けた後に2日目から開始して前日のパッチの代わりに新しいパッチを毎日貼り付けることでオピオイド薬の投与を必要としている被験体にそれを投与する方法を提供する。そのような態様では、2枚以上のパッチの中のいくつかを1日目の後の日に剥がしてもよくそして鎮痛の目的で所定時に被験体の定常状態で皮膚に貼り付けられたままであるパッチが1枚のみであるようにそれを取り替えなくてもよい。1つのそのような態様で用いるパッチはオピオイド薬を含有する重合体組成物を有する薬貯蔵層および裏地層を含有する。1つのそのような態様において、本パッチで送達する薬はフェンタニルであり、それを(イオン化していない)塩基形態で貯蔵層内に存在させてもよく、かつそれをポリアクリレート系接着剤に溶解させてもよい。特定の態様では、溶解していないフェンタニルを存在させなくてもよい。他のそのような態様において、本パッチで送達する薬はフェンタニルの類似物、例えばアルフェン
タニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上であってもよい。その上、そのような態様の各々において、オピオイドの投与を必要として被験体はヒト被験体であってもよい。
【0022】
さらなる態様では、本発明の方法に、患者が麻薬性オピオイドに耐性のあるヒトであるか或は麻薬性オピオイドの投薬を受けていないかを決定する追加的段階を含めてもよい。そのような情報は、例えば当該患者の医療記録などを基にして入手可能であり、その後にそれをそのヒトに推奨することができる投薬量もしくは投与療法の決定で用いることができる。例えば、ある患者がオピオイドに耐性がある場合、有効な痛み管理をもたらす目的で、血中オピオイド薬濃度を目標の定常状態濃度にまで比較的迅速に高める必要があり得る。そのような場合には、最初にそのヒトの皮膚にパッチを2枚以上貼り付けた後に皮膚に貼り付けるパッチの数を少なくすることでオピオイド薬の濃度を治療的定常状態濃度に迅速にもって行くことができる。別法として、ある患者がオピオイドの投薬を受けていないと決定される場合、そのような患者は、血中オピオイド濃度が相対的に低くなるようにした方が利益を受ける可能性がある。従って、オピオイドの投薬を受けていない患者は、最初に貼り付けるパッチを1枚のみにした後に毎日取り替えることで利益を得る可能性がある。オピオイドの投薬を受けていない患者の特定の症例では、2−3日で定常状態の目標血漿中濃度を達成するのが好ましいことを決定してもよい。最初に1日目に貼り付けるパッチを1枚のみにすることで開始する療法では、当該患者がオピオイドの投薬を受けていない性質を有することが理由で、受け入れられる鎮痛が起こりかつ更に達成されるように徐々に多くして行く。本明細書で用いる如き「オピオイドの投薬を受けていない」患者は、当該薬に対して顕著な耐性がいくらか生じるほどには前記薬にさらされていない患者である。本明細書で用いる如き「オピオイドに耐性のある」患者は、当該薬に対して顕著な耐性がいくらか生じるような度合で前記薬にさらされた患者である。
【0023】
さらなる態様において、本開示では、経皮オピオイドパッチを使用説明書印刷物と一緒に含有するキットを提供する。その使用説明書印刷物は挿入物であってもよいか或は容器または包装材の上に与えられていてもよく、それによって、使用者に使用に関する説明を与える。例えば、そのような使用説明書印刷物に、各パッチを貼り付ける方法、各パッチを患者に貼り付けておく時間および各パッチを剥がして新しいパッチに取り替える頻度を記述しておいてもよい。
【0024】
定義
本技術の記述では、下記の用語を用いかつ以下に示すように定義する。本明細書および添付請求項で用いる如き単数形「a」、「an」および「the」は、本文の内容で他であると明確に示さない限り、複数言及を包含する。
【0025】
本明細書で用いる如き用語「経皮」は、薬を局所投与してそれが全身循環に入り込むようにする薬投与入り口として皮膚、粘膜および/または他の体表面を用いることを指す。
【0026】
本明細書で用いる如き用語「薬」は、ある種の生物学的、有益、治療的または他の意図した効果、例えば健康障害の症状の軽減などをもたらすことを意図した材料のいずれかを指すが、主要な効果が別の生物学的に有効な作用剤、例えば治療薬などを経皮送達しようとする時の補助である作用剤(例えば透過促進剤)などは指さない。
【0027】
本明細書で用いる如き用語「治療的に有効」は、所望の治療結果をもたらすに必要な薬量または薬投与率を指す。
【0028】
本明細書で用いる如き用語「透過促進剤」は、ある薬が透過促進剤の存在下で皮膚を透過する度合の方が前記薬が透過促進剤の存在無しに皮膚を透過する度合に比べて高いこと
を意図する。透過促進剤の「透過促進量」は、その透過促進剤の量が当該薬が体表面で示す透過性を向上させて前記薬が治療的に有効な速度で送達されるようにするに充分な量である。
【0029】
本明細書で用いる如き「アクリレート」、「ポリアクリレート」または「アクリル重合体」を接着剤または接着剤前駆体用の重合体を指す時に用いる場合、それはアクリル酸、これのエステル1種または2種以上、アクリルアミドまたはアクリロニトリルの重合体もしくは共重合体を指す。特に明記しない限り、それはホモ重合体、共重合体またはホモ重合体および/または共重合体の混合物であってもよい。
【0030】
本明細書で用いる如き用語「フェンタニルの類似物(本明細書では以降「類似物」と呼ぶ」は、アルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの如き効力のある有効な鎮痛薬を指す。典型的な形態はフェンタニルもしくは類似物の塩基形態である。
【0031】
本明細書で用いる如き用語「飽和状態ではないパッチ」は、当該薬の濃度が溶解度限界未満であるパッチを指す。「飽和状態のパッチ」は、分散している薬(例えばフェンタニル塩基)の固体または液体を貯蔵層中に飽和濃度より高い濃度で含有する製剤を指す。
【0032】
本明細書で用いる如き用語「単相重合体組成物」は、当該薬および他のあらゆる成分が重合体の中に溶解していることで当該組成物中に存在する溶解していない成分が投与期間の実質的部分に渡って存在せずかつ前記成分の全部が前記重合体と一緒に単相を形成するように貯蔵層中に飽和濃度以下、例えば未満の濃度で存在する組成物を指す。
【0033】
本明細書で用いる如き用語「成分」は、薬貯蔵層内の要素を指し、それには、これらに限定するものでないが、この上で定義した如き薬、添加剤、透過促進剤、安定剤、染料、希釈剤、可塑剤、粘着付与剤、顔料、担体、不活性充填剤、抗酸化剤、賦形剤、ゲル化剤、抗刺激剤、血管収縮剤などが含まれる。
【0034】
本明細書で用いる如き「速度制御膜」は、薬の放出速度を制御する膜を指し、それを薬含有貯蔵層と体表面の間に位置させるが、それは当該薬が貯蔵層から体表面に伝達される速度を制御する機能を果たす。「速度非制御」フェンタニルパッチは、速度制御膜を伴わないパッチを意味する。
【0035】
「DURAGESIC(商標)フェンタニルパッチ」は、この上で考察した如きフェンタニルパッチ(またPhysicians Desk Reference、58版、2004、1751−1755頁も参照)を指す。「DUROGESIC(商標)SMATマトリクスパッチ」および「DUROGESIC(商標)DTRANS(商標)経皮パッチ」は、フェンタニルがポリアクリレートマトリクスに入っている経皮送達パッチを指し、これはドイツおよび英国のそれぞれにおいてJanssen−Cilagから入手可能である(公に入手可能なSummary of Product Characteristics of “DURAGESIC(R) DTRANS(R) transdermal patch” and DUROGESIC(R) DTRANS(R) transdermal patch “Patient Information Leaflet”を参照)。
【0036】
用語「AUC」は、被験体における有益剤の血清中濃度を投薬開始時から投薬開始後の時間「t」まで測定した時間と対比させてプロットすることによってその被験体に関して得た曲線下の面積を意味する。AUCinfは、時間を無限にまで延長した曲線下の面積である。定常状態の場合のAUCssは、投薬を時間的に無限に実施した場合のある投薬
期間の間の曲線下の面積である。患者から得た血清サンプルを検定することでAUCを得ることができる。また、実験で得たデータを基にした模擬によって構築した血清中フェンタニル濃度プロファイルに関するAUCも得ることができる。薬物動態が線形である時にはAUCssとAUCinfが同じであると予測する。経皮フェンタニル製品の場合、AUCssとAUCinfは生物学的に等しいことが示されている[Sathyan他、「Evaluation of the bioequivalence of two transdermal fentanyl systems following single and repeat applications」、Current Medical Research and Opinion 21(12)、1961−1968、2005]。
【0037】
本明細書で用いる如き用語「Cmax」は、薬、例えばフェンタニルもしくはこれの類似物などのピーク血中もしくは血漿中濃度を指す。
【0038】
本明細書で用いる如き用語「Cmin」は、薬、例えばフェンタニルもしくはこれの類似物などの谷血中もしくは血漿中濃度を指す。
【0039】
本明細書で用いる如き用語「正規化Cmax(ng/ml/(mg/時)」は、Cmax(ng/ml)を名目上の薬投与速度(mg/時)で割った値を指す。同様に、正規化Cminも同様な様式のCminに相当する。前記名目上の薬投与速度は、当該製品を使用期間中に送達するように考案した平均薬投与速度である(典型的には製品のラベルに記述されている速度)。
【0040】
本明細書で用いる如き用語「生物学的利用能」は、有効成分もしくは有効部分が薬製品から吸収されて作用部位で有効になる速度および度合を指す。その速度および度合を薬物動態パラメーター、例えば薬のピーク血中もしくは血漿中濃度(Cmax)および血中もしくは血漿中薬濃度−時間曲線下の面積(AUC)などを用いて確立する。
【0041】
本明細書の以下により詳細に記述する如き数種のインビボおよびインビトロ方法で実証するように、異なる2種類の製品を同様な実験条件下で検査した時にそれらが実質的に同じ治療効果をもたらすならば、それらは「薬理学的に同等である」と見なす。治療効果は、本明細書の以下により詳細に記述するように、様々な要因、例えば当該薬剤の効力、当該薬剤が薬貯蔵層中に入っている濃度、当該薬剤が皮膚中で示す溶解度および拡散度、皮膚の厚み、当該薬剤が貼り付け部位内で示す濃度などに依存する。一般的には、曲線下の面積(AUC)などの如き測定値を用いて薬理学的同等性を立証する。
【0042】
AUC、CmaxおよびCminは、パッチの特徴に関連したパラメーターである。薬投与速度に関して正規化したピーク血中もしくは血漿中薬濃度(即ち以下に定義する如き正規化Cmax)は、パッチの特徴に関連したパラメーターである。
【0043】
同じ薬に関して異なる2種類の製品を比較しようとする時、規制当局(例えばFDA)の生物学的同等性指針に従い、AUCおよびCmax値が同様であることで生物学的同等性を確立することができる。
【0044】
経皮パッチ
典型的な経皮薬送達システムを図1および2に示す態様で例示する。図1および2に示すように、経皮モノリスパッチ1の態様は、裏地層2、前記裏地層2の上に位置する薬貯蔵層3および引き剥がし可能な保護層5を有する。貯蔵層3は層であってもよく、少なくともそれの皮膚接触表面4は接着性である。前記貯蔵層は、経皮送達用の製薬学的作用剤(または薬)を担持するに適したマトリクス(担体)である。内容の中で他であると明確
に示さない限り、「マトリクス」は、他の材料、例えば薬などを伴うか或は伴わない担体材料を指すことを意味し得る。1つの態様では、薬および他の任意の材料を伴うマトリクス全体が所望の接着特性を有する材料である。貯蔵層3は単相の重合体組成物または多相の重合体組成物のいずれかであり得る。単相重合体組成物の場合、その中に薬および他の成分の全部がそれらが貯蔵層3中で示す飽和濃度以下、好適には未満の濃度で存在する。それによって、あらゆる成分が溶解している組成物がもたらされる(即ち貯蔵層に入っている接着性重合体に溶解している)。他の態様における貯蔵層に入っている薬は固体または液体であり得かつ溶解濃度より高いと理解されるべきである。体表面に貼り付けるに適した許容される接着性を示し得る製薬学的に許容される重合体材料を用いて貯蔵層3を生じさせる。多相重合体組成物の場合、その中に少なくとも1種の成分、例えば治療薬などを飽和濃度より多い量で存在させる。いくつかの態様では、2種以上の成分、例えば薬と透過促進剤または重合体材料などを飽和濃度より多い量で存在させる。図1に示す態様では、接着剤が貯蔵層として働きそしてそれに薬が入っている。
【0045】
図2に示す態様では、薄い接着性被膜6を用いて貯蔵層4の皮膚接触面を構築することができる。貯蔵層3は、この上に記述した如き単相重合体組成物または多相重合体組成物であり得る。その接着性被膜に当該薬および透過促進剤ばかりでなく他の材料も含有させてもよい。
【0046】
裏地層2は、経皮送達パッチの製造に適した材料のいずれからも成形可能であり、例えば通気性もしくは閉塞性材料などから成形可能であり、それにはポリ酢酸ビニル、ポリ塩化ビニリデン、ポリエチレン、ポリウレタン、ポリエステル、エチレン酢酸ビニル(EVA)、ポリエチレンテレフタレート、ポリブチレンテレフタレート、被覆紙製品、アルミニウムシートなどまたはこれらの組み合わせで出来ている布またはシートが含まれる。いくつかの態様では、その裏地層に低密度ポリエチレン(LDPE)材料、中密度ポリエチレン(MDPE)材料または高密度ポリエチレン(HDPE)材料、例えばSARANEX[Dow Chemical(Midland、Mich.)]などを含める。その裏地層はモノリスまたは多積層層であってもよい。いくつかの態様における裏地層は、非線状LDPE層/線状LDPE層/非線状LDPE層を包含する多積層層である。その裏地層に持たせる厚みは約0.012mm(0.5ミル)から0.125mm(5ミル)、例えば約0.018mm(0.75ミル)から0.1mm(4ミル)、または約0.025mm(1ミル)から0.0875mm(3.5ミル)であってもよい。
【0047】
接着性貯蔵層3または接着性被膜6は、当該技術分野で公知の標準的感圧接着剤から成形可能である。感圧接着剤の例には、これらに限定するものでないが、ポリアクリレート、ポリシロキサン、ポリイソブチレン(PIB)、ポリイソプレン、ポリブタジエン、スチレン系ブロック重合体などが含まれる。スチレン系ブロック共重合体が基になった接着剤の例には、これらに限定するものでないが、スチレン−イソプレン−スチレンブロック共重合体(SIS)、スチレン−ブタジエン−スチレン共重合体(SBS)、スチレン−エチレンブテン−スチレン共重合体(SEBS)およびそれらのジブロック類似物が含まれる。
【0048】
ポリイソブチレン系接着剤は、高分子量(HMW)のPIBと低分子量(LMW)のPIBの混合物である。そのような混合物は当該技術分野、例えば米国特許第5508038号などに記述されている。前記HMWのPIBが示す分子量は一般に約700,000から2,000,000Daの範囲内である一方、前記LMWのPIBが示す分子量は典型的に35,000から60,000の範囲であろう。本明細書に示す分子量は重量平均分子量である。そのような接着剤中のHMW PIBとLMW PIBの重量比は一般に1:1から1:10の範囲であろう。そのPIB系接着剤には通常また粘着付与剤、例えばポリブテン油および高Tgで低分子量の脂肪樹脂、例えばExxon Chemica
lから入手可能なESCOREZ(商標)樹脂なども入っている。ポリイソブチレン重合体はExxon Chemicalから商標名VISTANEX(商標)の下で商業的に入手可能である。好適な接着剤はPIB系接着剤組成物である、と言うのは、フェンタニルがPIB中で示す溶解度が低いことが理由でフェンタニル含有量を低くしても目標の送達を起こさせることができ、従って転用および乱用の傾向を低くするに役立つからである。フェンタニル、これの誘導体および類似物および他の薬を保持するためのマトリクスとして用いるに有用な他の接着剤材料には、シリコーン誘導体、例えば高分子量のポリジメチルシロキサンまたはポリジメチルジフェニルシロキサンなどが含まれる。経皮パッチで用いるに有用なシリコーン系接着剤の配合が米国特許第5,232,702号、4,906,169号および4,951,622号に記述されている。
【0049】
上述したように、薬貯蔵層3を裏地層2の上に位置させ、そして少なくとも貯蔵層3の皮膚接触表面は接着性である。述べたように、その皮膚接触表面に接着層の構造を持たせてもよい。しかしながら、貯蔵層3全体を局所的変化も層化も伴わない実質的に同じ組成にしてもよく、それを引き剥がし可能保護層5に接着させる。貯蔵層3は、当該技術分野で公知の如き薬(または生物学的に有効な作用剤)貯蔵層材料から成形可能である。例えば、当該薬が所望範囲内で送達されるに妥当な溶解度を前記薬が示す重合体材料、例えばポリウレタン、エチレン/酢酸ビニル共重合体(EVA)、アクリレート、スチレン系ブロック重合体などから薬貯蔵層を生じさせることができる。いくつかの態様では、以下により詳細に記述する如き製薬学的に許容される接着剤、例えばPIBまたはアクリレート共重合体が基になった接着剤から貯蔵層3を生じさせる。その薬貯蔵層は、当該薬および場合によりそれの中に組み込まれている他の材料と一緒になって、経皮パッチを皮膚上に送達期間の間保持するに必要な接着特性を示す。その薬貯蔵層またはマトリクス層に持たせる厚みは約0.2ミル(0.005mm)から4ミル(0.1mm)未満、例えば約0.5−1.5ミル(0.0125−0.0375mm)または約0.5−1.25ミル(0.0125−0.03mm)または約0.8−1.2ミル(0.02−0.03mm)または更に約0.9−1.1ミル(0.023−0.028mm)にしてもよい。一般的には、その厚みを市販されている鎮痛用パッチの厚み(これは約2ミルである)より薄くする。
【0050】
前記貯蔵層の厚みを日に1回(約24時間毎)の取り替え計画のパッチを用いて所望の流量[送達すべき薬(μg/cm2・時)]が達成されるように選択する。その流量は拡散に依存するが、拡散は皮膚と貯蔵層の間の濃度差の関数である。また、各パッチ毎に送達すべき薬の速度(μg/時)も貯蔵層と皮膚の間の接触面積に依存する。このように、前記貯蔵層の寸法(面積および厚みを包含)を所望の流量および薬送達速度がもたらされるように選択する。
【0051】
貯蔵層の寸法を選択する時に考慮に入れてもよい別の要因は、乱用の減少または阻止である。可能性のある乱用者が単一のパッチから入手することができる薬の量が比較的少量のみであることを確認すると、その可能性のある乱用者がそのパッチを乱用する可能性が低くなり得る。従って、貯蔵層の体積および薬充填率が比較的低いパッチは乱用の減少または阻止に役立ち得る。1つの態様では、PIB材料を用いて生じさせた貯蔵層を含めたパッチを提供する。PIB材料を用いて生じさせた貯蔵層は好ましい可能性がある、と言うのは、それらはフェンタニルがPIB中で示す溶解度が低いことが理由でフェンタニル含有量を低くしても匹敵する皮膚流量をもたらし得るからである。
【0052】
美的理由で、パッチの表面積、従って貯蔵層の表面積を小さくする方が好ましい可能性がある。いくつかの態様では、パッチの表面積(および貯蔵層の表面積)を多日使用の目的で考案されたパッチのそれよりも有意に小さくする。例えば、1つのそのような態様では、本明細書に示すパッチの表面積を同じオピオイド薬を送達する目的で考案された3日
パッチの表面積より有意に小さくする。パッチの表面積、即ち貯蔵層の表面積を以下に記述する。
【0053】
乱用の減少または阻止に関連して薬充填率(例えばパッチの中に充填する薬の量の濃度および/または総量)もまた考慮に入れてもよい。特定の態様では、オピオイド薬(例えばフェンタニル、例えばフェンタニル塩基またはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上)を投与するための経皮パッチに含める薬貯蔵層を薬貯蔵層に充填する薬の総量が100μg/時の投薬濃度の場合に約12mg未満、例えば100μg/時の投薬濃度の場合に約8mg未満または100μg/時の投薬濃度の場合に約7.5mg以下などになり得るような貯蔵層にする。材料は同じであるが大きさが異なる他の投薬濃度(100μg/時以外)のデバイスの場合、当該パッチに入れる薬の含有量を大きさ(面積)に比例して調整してもよい、即ちただ1つの差が面積(典型的には大きさと呼ぶ)の場合、その拡大縮小は面積(即ち大きさ)に比例する。例えば50μg/時の投薬濃度の場合には薬含有量をそれの面積が半分であることから上述した100μg/時の投薬濃度の薬含有量の半分にすることができるであろう。
【0054】
乱用の減少または阻止に関連して考慮に入れてもよい更に別の要因は、使用済みパッチに入っている残存薬(使用後のパッチに残存する薬)の量である。例えば、当該パッチが示す薬使用重量%(パッチを使用期間後に剥がした時のそれ)を高くする場合には、パッチ使用後に乱用の可能性で使用可能な薬の量が少なくなることでそのようなデバイスが乱用される可能性が低くなり得る。特定の態様では、本明細書に記述する如きパッチに含める薬貯蔵層の寸法を残存オピオイド(例えばフェンタニル、例えばフェンタニル塩基またはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上)の量が100μg/時の投薬濃度の場合に約6mg以下もしくは未満になるように選択する。1つのそのような態様では、残存オピオイドの量が約5mg以下になるようにする。
【0055】
この上に示したパラメーターは相互に関係していて、例えばパッチが示す薬使用重量%を向上させかつオピオイド薬を当該患者に治療的効果を達成する様式で所望期間に渡って送達する能力を有するパッチを提供すると同時にオピオイド薬充填量の減少、オピオイド薬濃度の低下および貯蔵層の大きさの低下を取り扱うことは簡単なことではないと理解されるべきである。本明細書に詳述するように、本開示は、多日システムに比べてオピオイド薬含有量が低くかつ中に含まれているオピオイド薬が使用前および/または使用後に乱用で利用される可能性を低くすることが可能な態様のパッチを提供するものである。
【0056】
本明細書に記述する如きパッチに含める接着性貯蔵層3または接着性被膜6は、当該技術分野で公知の標準的感圧接着剤を用いて成形可能である。本明細書に記述するパッチの態様で用いるに適した感圧接着剤の例には、これらに限定するものでないが、ポリアクリレート、ポリシロキサン、ポリイソブチレン(PIB)、ポリイソプレン、ポリブタジエン、スチレン系ブロック重合体などが含まれる。本明細書に記述する如きパッチの態様で用いるに適したスチレン系ブロック共重合体が基になった接着剤の例には、これらに限定するものでないが、スチレン−イソプレン−スチレンブロック共重合体(SIS)、スチレン−ブタジエン−スチレン共重合体(SBS)、スチレン−エチレンブテン−スチレン共重合体(SEBS)およびそれらのジブロック類似物が含まれる。
【0057】
典型的な接着剤には、ポリアクリレートおよびPIB、特にポリアクリレートが含まれる。ポリアクリレート(アクリル系重合体)は、アクリル酸、アクリル酸アルキル、メタアクリレート、共重合性二次単量体または官能基を有する単量体を包含する群から選択される少なくとも2種以上の典型的な成分を含有して成る共重合体もしくは三元重合体で構
成されている可能性がある。単量体の例には、これらに限定するものでないが、酢酸ビニル、アクリル酸、メタアクリル酸、アクリル酸メトキシエチル、アクリル酸メチル、アクリル酸エチル、アクリル酸ブチル、メタアクリル酸ブチル、アクリル酸ヘキシル、メタアクリル酸ヘキシル、アクリル酸2−エチルブチル、メタアクリル酸2−エチルブチル、アクリル酸イソオクチル、メタアクリル酸イソオクチル、アクリル酸2−エチルヘキシル、メタアクリル酸2−エチルヘキシル、アクリル酸デシル、メタアクリル酸デシル、アクリル酸ドデシル、メタアクリル酸ドデシル、アクリル酸トリデシル、メタアクリル酸トリデシル、アクリル酸ヒドロキシエチル、アクリル酸ヒドロキシプロピル、アクリルアミド、ジメチルアクリルアミド、アクリロニトリル、アクリル酸ジメチルアミノエチル、メタアクリル酸ジメチルアミノエチル、アクリル酸t−ブチルアミノエチル、メタアクリル酸t−ブチルアミノエチル、アクリル酸メトキシエチル、メタアクリル酸グリシダルなどが含まれる。適切なアクリル系接着剤の追加的例がSatas、「Acrylic Adhesives」、Handbook of pressure−Sensitive Adhesive Technology、第2版、396−456頁(D.Satas編集)、Van Nostrand Reinhold、New York(1989)に記述されている。アクリル系接着剤は商業的に入手可能である(National Starch and Chemical Corporation、Bridgewater、NJ;Solutia、MA)。ポリアクリレートが基になった接着剤のさらなる例は下記のようにNational Starchが製造している接着剤[Product Bulletin、2000、DURO−TAK(商標)はNational Starch接着剤の商標である]であり、それらを下記の製品番号で識別する:87−4098,87−2287,87−4287,87−5216,87−2051,87−2052,87−2054,87−2196,87−9259,87−9261,87−2979,87−2510,87−2353,87−2100,87−2852,87−2074,87−2258,87−9085,87−9301および87−5298。DURO−TAK(商標)87−2287および87−4287は両方ともアクリル酸2−ヒドロキシエチルが5.2重量%で酢酸ビニルが約20−40重量%でアクリル酸2−エチルヘキシルが約55−75重量%の同様な単量体組成物から作られた重合体である接着剤であり、この2種類の重合体である接着剤は酢酸エチルに固体含有量が約40−50重量%になるように溶解した状態で提供される。DURO−TAK(商標)87−2287接着剤は、酢酸ビニルが28%でアクリル酸2−エチルヘキシルが67%でアクリル酸ヒドロキシエチルが4.9%でメタアクリル酸グリシジルが0.1%の単量体組成物から作られた接着剤である(米国特許第5,693,335号を参照)。
【0058】
本明細書に記述するパッチの態様で用いるに適したアクリル系重合体は、架橋もしくは非架橋重合体または両方を含有し得る。公知方法を用いてそのような重合体を架橋させることで所望重合体を生じさせる。いくつかの態様における接着剤は、ガラス転移温度(Tg)が−10℃未満、より好適にはTgが約−20℃から約−30℃のポリアクリレート系接着剤である。そのようなポリアクリレート系接着剤が示す分子量は、重量平均(MW)で表して、いずれかの架橋反応を起こす前に一般に25,000から10,000,000、例えば50,000から約3,000,000または100,000から1,000,000などの範囲である。重合体化学技術分野に関係する技術者に公知のように、架橋させるとMWが無限に近づく。
【0059】
特定の態様では、PIB系接着剤をPIB系接着剤組成物として提供する。そのような態様では、PIB組成物を低分子量および高分子量のPIB成分、粘着付与樹脂および可塑化用油で構成させてもよい。加うるに、本明細書に記述するように、また、シリコーン系接着剤を用いることも可能である。
【0060】
この上で考察したように、本明細書に記述する如きパッチの貯蔵層(例えば図1または
図2に示す貯蔵層3)は、溶解していない成分が入っているか或は入っていなくてもよい重合体組成物を用いて成形可能である。特定の態様では、本明細書で意図する如き貯蔵層に、オピオイド薬を鎮痛をヒトに誘発してほぼ1日の間維持するに充分な量で含有させる。1つのそのような態様における薬はフェンタニルである。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上である。いくつかの態様では、薬貯蔵層に含有させる薬の量を約0.05から約1.75mg/cm2、例えば薬含有量を約0.07から約1.50mg/cm2または薬含有量を約0.08から約1.25mg/cm2または約0.14から0.3mg/cm2にする。特定態様における薬は塩基形態のフェンタニルであり、フェンタニルが塩基形態であると溶解または分散する。他の態様では、そのような薬を完全に溶解させる。
【0061】
特定の態様では、本記述に従うパッチの貯蔵層を形成する材料が薬を溶かす能力が総重合体組成物の約0.5重量%から約25重量%、例えば総重合体組成物4の約1重量%から約15重量%または約2重量%から約12重量%であるようにする。本明細書に記述する如きパッチで用いる貯蔵層が示す厚みは、接着性被膜6を伴うか或は伴わないかに拘わらず、約0.2−10ミル(0.005−0.25mm)、例えば約0.5−1.5ミル(0.0125−0.0375mm)または約0.5−1.25ミル(0.0125−0.03mm)または約0.8−1.2ミル(0.02−0.03mm)、例えば約0.9−1.1ミル(0.023−0.028mm)などであり得る。そのようないくつかの態様における薬は塩基形態のフェンタニルであり、貯蔵層3を形成する材料がフェンタニルを溶かす度合は総重合体組成物の約0.5重量%から約25重量%、例えば総重合体組成物の約1重量%から約15重量%または約2重量%から約12重量%または約4重量%から約10重量%である。当該薬が接着剤中で示す溶解度を測定する1つの方法は、薬濃度がいろいろなマトリクス薬貯蔵層を裏地材料の上に流し込み成形しそしてその流し込み成形した材料を室温である期間貯蔵した後に薬の結晶が現れるか否かを測定することによる方法である。特定の濃度の時に結晶が1カ月の貯蔵後に現れたとすると、その濃度が当該薬がマトリクス接着剤中で示す溶解度限界であると見なすことができる。結晶または溶解していない材料の存在は顕微鏡またはX線回折分析で測定可能である。
【0062】
本明細書に記述する如きパッチに含める貯蔵層3に場合により追加的成分、例えば添加剤、透過促進剤、安定剤、染料、希釈剤、可塑剤、粘着付与剤、顔料、担体、不活性充填剤、抗酸化剤、ゲル化剤、抗刺激剤、血管収縮剤および経皮技術分野で一般に公知の如き他の材料などを含有させてもよいが、そのような材料を前記貯蔵層に飽和濃度未満の濃度で存在させることを条件とする。
【0063】
必要ならば、薬1種または2種以上が送達を治療的に有効な速度で達成するように皮膚透過率を向上させようとする時には透過促進剤が有用であり得る。そのような透過促進剤を前処理でか或は薬と一緒に例えば貯蔵層の中に混合することなどでそれが皮膚に付着するようにしてもよい。透過促進剤は1種以上の薬または他の生物学的に有効な作用剤が示す皮膚透過性を向上させる能力を有するべきである。有用な透過促進剤は所望薬もしくは生物学的に有効な作用剤が示す透過率をそれが妥当な大きさのパッチ(例えば約2から25cm2であるが、より大きくてもよい)から治療的血漿中濃度が達成されるに充分な速度で送達されるように向上させるであろう。いくつかの有用な透過促進剤には非イオン性界面活性剤が含まれるが、1種以上をモノオレイン酸グリセリル、モノラウリン酸グリセリル、ソルビタンモノオレエート、トリオレイン酸グリセリルおよびミリスチン酸イソプロピルを包含する群から選択してもよい。そのような非イオン性界面活性剤を貯蔵層の総組成に対して約0.1から30重量%(固体)の量で用いてもよい。透過促進剤の例には、これらに限定するものでないが、アルコール(グリセリンを包含)の脂肪酸エステル、例えばカプリン酸、カプリル酸、ドデシル、オレイン酸などのエステル、イソロルビド、
スクロース、ポリエチレングリコールの脂肪酸エステル、カプロイル乳酸、ラウレス−2、ラウレス−2アセテート、ラウレス−2ベンゾエート、ラウレス−3カルボン酸、ラウレス−4、ラウレス−5カルボン酸、オレス−2、ピログルタミン酸オレイン酸グリセリル、オレイン酸グリセリル、N−ラウロイルサルコシン、N−ミリストイルサルコシン、N−オクチル−2−ピロリドン、ラウロアミノプロピオン酸、ポリプロピレングリコール−4−ラウレス−2、ポリプロピレングリコール−4−ラウレス−5ジメチル−1ラウロアミド、ラウロアミドジエタノールアミン(DEA)が含まれる。好適な促進剤には、これらに限定するものでないが、ピログルタミン酸ラウリル(LP)、モノラウリン酸グリセリル(GML)、モノカプリル酸グリセリル、モノカプリン酸グリセリル、モノオレイン酸グリセリル(GMO)、オレイン酸、N−ラウリルサルコシン、パルミチン酸エチル、ラウレス−2、ラウレス−4およびソルビタンモノラウレートが含まれる。適切な透過促進剤の追加的例が例えば米国特許第5,785,991号、5,843,468号、5,882,676号および6,004,578号に記述されている。しかしながら、特定の態様では透過促進剤を用いない。
【0064】
特定の態様では、貯蔵層に、急速な粘着を低下させ、粘度を高くしそして/またはマトリクスの構造を強化する能力を有する希釈剤材料、例えばポリメタアクリル酸ブチル(ICI Acrylicsが製造しているELVACITE、例えばELVACITE 1010、ELVACITE 1020、ELVACITE 20)、高分子量アクリレート、即ち平均分子量が少なくとも500,000のアクリレートなどを含有させる。そのような分子量が大きいアクリレート材料、例えばELVACITEなどを用いる場合、それらを重合させて接着性重合体を生じさせるのではなく、それを混合する。このように、接着剤重合用の単量体には、そのようなELVACITE型の高分子量アクリレート(または巨大単量体であるアクリレート)などは含まれない。
【0065】
特定の態様では、可塑剤または粘着付与剤を接着剤組成物に混合することで接着特性を向上させる。適切な粘着付与剤の例には、これらに限定するものでないが、脂肪族炭化水素、芳香族炭化水素、水添エステル、ポリテルペン、水添木樹脂、粘着付与樹脂、例えばESCOREZ、石油化学原料のカチオン重合または石油化学原料の熱重合に続く水添で作られた脂肪族炭化水素樹脂、ロジンエステル系粘着付与剤など、鉱油およびそれらの組み合わせが含まれる。
【0066】
そのような粘着付与剤を用いる場合、その用いる粘着付与剤は当該重合体もしくは重合体混合物に相溶すべきである。例えば、スチレン系ブロック共重合体をゴムに相溶し得る粘着付与樹脂、相溶性末端ブロック樹脂、例えばポリメチルスチレンなどまたは可塑剤、例えば鉱油などと一緒に配合してもよい。特定の態様では、本明細書に記述する如きパッチに、重合体材料、粘着付与材料および鉱油系可塑剤を用いて生じさせた貯蔵層を含めてもよく、その場合には、前記重合体が総接着剤組成物の約5−50%で粘着付与材料が総接着剤組成物の約30−85%で鉱油が総接着剤組成物の約2−40%になるようにする。
【0067】
本明細書に記述する如きパッチに更に引きはがし可能な保護層5を含めることも可能である。その保護層5を例えば重合体材料などで構成させてもよく、それを場合により金属で被覆してもよい。そのような重合体材料の例には、ポリウレタン、ポリ酢酸ビニル、ポリ塩化ビニリデン、ポリプロピレン、ポリカーボネート、ポリスチレン、ポリエチレン、ポリエチレンテレフタレート、ポリブチレンテレフタレート、紙などおよびそれらの組み合わせが含まれる。いくつかの態様の保護層はシリコーン処理ポリエステルシートを含んで成る。
【0068】
この上に記述した経皮送達パッチのいろいろな層を組み立てようとする時に幅広く多様
な材料を用いることができる。従って、本開示では、本明細書に具体的に開示する材料以外の材料の使用も意図し、そのような材料には、必要な機能を果たす能力を有することが当該技術分野で後に知られるようになるであろうそれらも含まれる。
【0069】
1つの態様では、本明細書に記述する如きパッチに図1に示す構造を持たせ、図1中のパッチに持たせた層は3層のみ、即ち裏地層、麻薬性鎮痛薬が全体的に溶解している単相貯蔵層マトリクス層および剥離ライナーである。そのような態様では、PIB系接着剤配合物またはポリアクリレート系接着剤と1種類のみのオピオイド薬、例えばフェンタニル塩基などを用いて前記貯蔵層マトリクスを生じさせてもよい。1つのそのような態様では、透過促進剤、粘着付与剤、充填剤などの量をあまり多くしない。他のそのような態様において、前記材料を存在させる場合、それらの存在量を僅かな量にすることで薬送達に実質的な影響が生じないようにする。そのような態様で用いるポリアクリレート系接着剤を単一の共重合体化学物質、例えば単量体である酢酸ビニル、アクリル酸2−エチルヘキシルおよびアクリル酸ヒドロキシエチルなどの共重合体、例えば三元重合体であるDURO−TAK(商標)87−4287接着剤または共重合体であるDURO−TAK(商標)87−2287接着剤などで構成させてもよい。
【0070】
マトリクスを薬保持用貯蔵層として用いる以外に、本明細書に記述するパッチの態様で使用可能な貯蔵層の代替形態は、オピオイド薬組成物を入れたパウチ[例えばフォームフィルドシール(form−filled seal)]であり、その貯蔵層を米国特許第4,588,580号に記述されている様式と同様な様式で生じさせる。不透過性裏地層および薬の送達速度を制御する速度制御膜を用いて生じさせたパウチの中に薬組成物を封じ込めることでそのような貯蔵層を生じさせることができる。そのようなデバイスに、また、このデバイスが皮膚に付着するように接触接着層(これはアミン耐性であってもよい)および皮膚に付着させる前の接着剤を保護する引き剥がし可能な保護層を持たせることも可能である。
【0071】
様々な薬貯蔵層組成物をパウチで用いることができ、それらには水性および非水性系の両方が含まれる。典型的な水性ゲル系の一般的配合を以下の表1に示し、ゲル化剤はヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロースまたは他の公知のゲル化剤である。
【0072】
【表1】

【0073】
この上に記述した水−エタノール系を速度制御膜、例えば低密度ポリエチレン(LDP
E)、エチレン−酢酸ビニル(EVA)共重合体(VAが0−40%、好適には5−18%)、熱密封性ポリエステルおよびゴム弾性ポリエステルブロック共重合体、例えばDuPontから入手可能で米国特許第4,127,127号に記述されているHYTREL(商標)重合体などと組み合わせて用いると、それは特定のユニークな特性を示す。速度制御膜は、エタノール放出速度に有意な影響を与えることなくフェンタニル放出速度に対して実質的な制御を及ぼす。それによって、そのようなシステムを用いる時に貯蔵層に入っているエタノールの相対濃度が水および薬の相対濃度に対して変化する動的状況がもたらされる。フェンタニルおよびこれの誘導体の場合、それらはエタノール中の方が水中よりも高い溶解度を示すことから、貯蔵層に入っている前記薬が当該システムから送達される時に前記薬が示す熱力学的活量は通常予想されるほどには低くならない。当該薬が速度制御膜を通って移行するのを促す推進力は、絶対濃度ではなく前記薬が溶媒中で示す熱力学的活量である。このように、エタノールが枯渇する速度がより速いと水性貯蔵層に入っている薬の飽和濃度が低くなる。当該システムから送達されるエタノールおよび薬の速度を適切に調節することによって、当該薬が示す活性を当該システムの寿命に渡って一定に維持することができるか或は高くして行くことさえ可能である。
【0074】
速度制御膜を含める場合、それの厚みを例えば約0.5−5ミル(0.0127−0.1270mm)、例えば厚みを約1−3ミル(0.025−0.076mm)にしてもよい。その上、パッチにパウチ型貯蔵層を含める場合、その貯蔵層のゲル充填率を約10−50mg/cm2にすることで乾燥状態の充填率を約0.01−5mg/cm2にしてもよい。マトリクス貯蔵層と同様に、パウチとして生じさせた貯蔵層にもまた上述した如き透過促進剤、賦形剤、例えば粘着付与剤、充填剤などおよび他の薬を含有させることも可能である。
【0075】
薬の投与
経皮パッチ1を皮膚に貼り付けると、それの薬貯蔵層3に入っている薬が皮膚の中に拡散し、吸収されて血流の中に入り込むことで、全身鎮痛効果がもたらされる。鎮痛の開始は様々な要因、例えば当該薬の効力、当該薬が皮膚中で示す溶解度および拡散度、皮膚の厚み、当該薬が皮膚貼り付け部位内で示す濃度、薬貯蔵層内に入っている当該薬の濃度などに依存する。
【0076】
1つの態様では、連続的鎮痛を維持する目的で、1日貼り付けた後に皮膚の上に1日存在したままであった古い(即ち使用済み)パッチを剥がして、新しいパッチを皮膚に好適には新しい場所に貼り付ける。例えば、血中薬濃度が治療濃度に到達した後、その投与期間が終了した時点で前記パッチを逐次的に剥がして新しいパッチに置き換えることで慢性通を軽減することができるであろう。好適には、その古い(即ち使用済み)パッチと新しいパッチが同時に皮膚に付着した状態にしないか、或は貼り付けの便利さの目的で重なり合う時間が僅かに短く(例えば数分内)なるようにすることで鎮痛結果をより予測できるようにする。定常状態の時、その新しいパッチから薬が新しい貼り付け領域の中に吸収されて全身に循環しそして以前にパッチを貼り付けておいた場所の中に残存していた薬の吸収がオピオイド薬の血中濃度が許容される範囲内に維持される速度で起こる。
【0077】
治療的血中濃度をより迅速に達成しようとする時、健康管理者または患者は、最初に1枚のパッチまたは複数のパッチを貼り付けそして1日(即ち約24時間)経過した後に皮膚に貼り付けたままにするパッチの数を少なくする、例えば毎日(即ちほぼ24時間毎に)取り替えることで皮膚に貼り付けられたままであるパッチの数を1枚のみにするように選択してもよい。
【0078】
フェンタニルが送達すべき薬である場合には典型的にフェンタニルの血漿中濃度が約0.02から約10ng/mlになるようにすると治療効果がもたらされることを見いだし
た。その範囲内の約0.3から約3ng/mlの範囲の血漿中濃度を目標にしてもよい。そのような範囲内において、通常は大部分の薬の場合と同様に、経時的変動の度合が小さい方が変動の度合が大きい場合よりも好ましい、と言うのは、血中薬濃度の変動が小さいことに関連して鎮痛効果が経時的により一定になるからである。
【0079】
本発明に従う日に1回のフェンタニルパッチを用いて毎日取り替えるプログラムを用いると、多日パッチ療法、例えば3日パッチ投与療法などに比べてずっと小さい血漿中薬濃度変動を達成することができる。このように、1つの態様において、本明細書に記述する如きパッチおよび投与方法を用いると、同じ薬を送達する目的で多日パッチを投与する療法を用いた時に達成されるそれに比べて、1回投与のCmaxが低くなり、定常状態のCminが高くなりかつ定常状態におけるCmaxとCminの間の差が小さくなる。特定の態様において、本開示は、3日パッチを3日間貼り付けるか或は週に2回貼り付ける療法を用いた時に達成されるそれに比べて1回投与のCmaxが低く、定常状態のCminが高くかつ定常状態におけるCmaxとCminの間の差が小さいことを達成するパッチおよび毎日取り替え方法を提供する。
【0080】
特定の態様において、本明細書に記述する如きパッチは、100μg/時の名目上送達速度で1日貼り付けた後のCmaxの範囲が約0.45から約5.5ng/ml、例えば約0.9から約2.7ng/mlまたは約1.2から約2.5ng/mlなどである1回投与オピオイド薬プロファイル(即ち1枚のパッチを貼り付けた後に取り替えることなく24時間が終了した時点で剥がす)をもたらす1日パッチである。100μg/時の名目上送達速度と投薬濃度の差に関しては、相当して、面積の差を用いてCmaxの範囲を見積もる。1つのそのような態様における薬はフェンタニルである。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上である。そのような特定の態様における薬は塩基形態のフェンタニルであり、この場合のフェンタニルは塩基形態であることから溶解または分散する。他の態様における薬は完全に溶解している。
【0081】
特定の態様において、本明細書に記述する如きパッチは投薬濃度が100μg/時の経皮フェンタニルパッチであり、これが示す定常状態のCmaxは約0.7から約12ng/ml、例えば約1.5から約6ng/mlまたは約2から約5.5ng/ml、更に約3から約5ng/mlなどの範囲である。そのようなフェンタニルパッチは追加的に約0.5から約10ng/mlまたは約1から約5.5ng/mlまたは約1から約4ng/mlまたは約1から約3ng/mlの範囲の定常状態Cminも示し得る。投薬濃度がより高いか或はより低いパッチの場合の定常状態Cmaxの範囲を相当して見積もり、例えば面積の差を基にして見積もる。そのような態様に存在させるフェンタニルは塩基形態のフェンタニルであってもよく、この場合のフェンタニルは塩基形態であることから溶解または分散する。他のそのような態様における薬は完全に溶解している。
【0082】
また、本明細書に開示する如きパッチは所定投薬濃度にとって目標のCmaxとCminの間の差をもたらす可能性もある。例えば、100μg/時の投薬濃度をもたらす本明細書に記述する如きパッチの1つの態様において、CmaxとCminの間の毎日の揺れは約0.025から約13.0ng/ml、例えば約0.25から約2ng/mlまたは約0.3から約1.6ng/mlまたは約0.4から約0.8ng/mlなどの範囲である。1つのそのような態様における薬はフェンタニルである。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上である。そのような特定の態様における薬は塩基形態のフェンタニルであり、この場合のフェンタニルは塩基形態であることから溶解または分散する。他の態様における薬は完全に溶
解している。
【0083】
加うるに、また、投薬濃度が100μg/時の場合に定常状態をもたらすように考案した本明細書に開示する如きパッチが示す薬変動[(Cmax−Cmin)/Cavgとして定義]も100%未満、例えば90%未満または80%未満または更に70%未満または約30%から65%であり得る。1つのそのような態様における薬はフェンタニルである。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上である。そのような特定の態様における薬は塩基形態のフェンタニルであり、この場合のフェンタニルは塩基形態であることから溶解または分散する。他の態様における薬は完全に溶解している。
【0084】
投薬濃度が100μg/時ではないデバイスの場合、相当して、CmaxとCminの間の毎日の揺れの範囲を見積もることができる。正規化CmaxとCminの間の毎日の揺れは約2から約100ng/ml(mg/時)、例えば約4から約50ng/ml(mg/時)または約5から約20ng/ml(mg/時)または約5から約15ng/ml(mg/時)などの範囲である。投薬濃度が100μg/時ではない(例えば投薬濃度が25μg/時、50μg/時、75μg/時および12.5μg/時などの場合の)デバイスが示す正規化Cmaxと正規化Cminの間の毎日の揺れの範囲も相当して見積もり可能である。新規な経皮システムがDURAGESIC(商標)DTRANS(商標)フェンタニル経皮システムと生物学的に同等であるようにするには、DURAGESIC(商標)DTRANS(商標)システムのそれに対する新規な経皮システムの定常状態Cmax比の90%信頼区間が80%から125%の範囲内になるようにすべきである。また、同じ投薬濃度のDURAGESIC(商標)DTRANS(商標)システムのそれに対する新規な経皮システムのAUCss比の90%信頼区間も80%から125%の範囲内になるようにすべきである。このように、生物学的同等性を試験しようとする場合、フェンタニル送達用の新規な経皮システムに試験をDURAGESIC(商標)DTRANS(商標)システムと対比させて受けさせることで、DURAGESIC(商標)DTRANS(商標)システムのそれに対する新規なシステムが示す上述した薬物動態パラメーター比の90%信頼区間が80%から125%の範囲内であることを示す。
【0085】
名目上の送達速度が100μg/時の場合、本明細書に記述する如き日に1回のフェンタニルパッチを1回分貼り付けた時のAUCinf(即ち1回投与後の無限時間に至るAUC)は、名目上の送達速度が100μg/時の経皮フェンタニルパッチを毎日貼り付けた後、約15から約200ng・時/ml、例えば約30から約140ng・時/mlなどの範囲であり得る。経皮フェンタニル製品が示すAUCssおよびAUCinfは生物学的に同等であることが示されている[Sathyan他、「Evaluation of the bioequivalence of two transdermal fentanyl systems following single and repeat applications」、Current Medical Research and Opinion 21(12)、1961−1968、2005を参照]。投薬濃度がより低いか或はより高いパッチの場合の定常状態AUCinfの範囲をパッチの面積(または大きさ)に比例して見積もる。そのようないくつかの態様における薬はフェンタニルである。そのような特定の態様における薬はフェンタニルの塩基形態であり、フェンタニルが塩基形態であると溶解または分散する。他の態様では、その薬を完全に溶解させる。
【0086】
いくつかの態様において、本明細書に開示する如きパッチは、送達された薬に関して約7から約120ng/ml(mg/時)、例えば約15から約60ng/ml(mg/時)または約20から約55ng/ml(mg/時)または約30から約50ng/ml(
mg/時)などの範囲の正規化定常状態Cmaxを示す経皮フェンタニルパッチである。本明細書に記述する如きパッチを皮膚に貼り付けると約0.1から約20μg/(cm2・時)、例えば約0.75から約10μg/(cm2・時)または約1から約8μg/(cm2・時)または約1.5から約5μg/(cm2・時)または約2から約3μg/(cm2・時)などの定常状態薬流量がもたらされ得る。本開示に従って得ることができる定常状態投与速度は、約0.1から約500μg/時、例えば約1から約300μg/時または約2から約250μg/時または約5から約200μg/時などの範囲である。名目上の定常状態投与は例えば12.5μg/時、25μg/時、50μg/時、75μg/時、100μg/時および125μg/時などの範囲の投薬濃度であり得る。そのようないくつかの態様における薬はフェンタニルであり得る。そのような特定の態様における薬はフェンタニルの塩基形態であり、フェンタニルが塩基形態であると溶解または分散する。他の態様では、その薬を完全に溶解させる。
【0087】
追加的態様において、本明細書に開示するパッチは、約5から約100ng/ml(mg/時)、例えば約10から約55ng/ml(mg/時)または約10から約40ng/ml(mg/時)または約10から約30ng/ml(mg/時)などの範囲の正規化定常状態Cminを示す経皮フェンタニルパッチである。この経皮パッチは約1から約100cm2、例えば約1から約40cm2または約5から約38cm2または約10から約35cm2または約10から約35cm2などである。この経皮フェンタニルパッチを皮膚に貼り付けると、そのパッチに存在するフェンタニルの量および流量に関して、一般に、約0.1から20μg/(cm2・時)、例えば約1から約10μg/(cm2・時)、約1.5から約8μg/(cm2・時)、約2.8から約5μg/(cm2・時)または約3から約3.6μg/(cm2・時)などの定常状態薬流量を示し得る。そのようないくつかの態様における薬はフェンタニルである。そのような特定の態様における薬はフェンタニルの塩基形態であり、フェンタニルが塩基形態であると溶解または分散する。他の態様では、その薬を完全に溶解させる。
【0088】
更に追加的態様において、本明細書に開示するパッチは、フェンタニルを3日DURAGESIC(商標)DTRANS(商標)システムに近い様式、例えばそれに生物学的に等しい様式で送達する1日フェンタニルパッチである。1つのそのような態様では、前記1日パッチの表面積および厚みの両方を前記3日パッチよりも小さくする。例えば、1つのそのような態様では、前記1日パッチの皮膚接触面積を前記3日パッチの面積の約0.5から0.85、例えば約0.6から0.8または0.7から0.77または約0.71から0.76にしてもよい。加うるに、1つのそのような態様では、前記1日フェンタニル貯蔵層の厚みを前記3日パッチに含まれている貯蔵層のそれの約0.25から0.75、例えば約0.4から0.6または約0.5にしてもよい。そのような態様の各々のパッチにポリアクリレート系フェンタニルマトリクスを含めてもよい。
【0089】
1日パッチが送達するフェンタニルの量を3日パッチが送達するそれの約1/3にすべきであるが、我々は、その1日パッチの皮膚接触面積を同じ投薬濃度の3日パッチのそれの1/3以上にしてもよく、従って3日パッチのそれの1/3から0.9にしてもよいことを見いだした。その2種類のパッチの表面積を比較する時、パッチの薬貯蔵層の面積を投薬濃度で割りかつ当該薬の送達でパッチを用いる日数で割った値であると定義する如きパッチの正規化面積を考慮する(即ち3日パッチの場合の正規化面積は、42cm2を100μg/時で割った値を3で割った値=1日当たりのμg/時当たり0.14cm2=名目上の送達量1mg当たり5.8cm2であるとして得られる)。比較として、1日パッチの正規化面積は、3日パッチのそれである1日当たりのμg/時当たり0.14cm2より大きい(即ち名目上の送達量1mg当たり5.8cm2より大きい)。このことは、1日パッチの薬貯蔵層(例えば薬含有マトリクス)の厚みが3日マトリクスパッチのそれよりも薄い時でも当てはまる。
【0090】
名目上の投薬濃度を基にした正規化面積、即ち体接触表面積を名目上の投薬濃度で割った値(例えば表面積が42cm2で送達速度が100μg/時の投薬濃度のパッチの正規化表面はμg/時当たり0.42cm2である)に関して、フェンタニルの1日の量を送達した場合を名目上の投薬濃度に従って計算すると、本明細書に開示する如き1日パッチの態様が示す正規化面積は1日当たりのμg/時当たり約0.2から0.4cm2(即ち1mg当たり8.5から16.5cm2)、例えば1日当たりのμg/時当たり約0.25から0.36cm2(即ち1mg当たり10.5から15cm2)または1日当たりのμg/時当たり約0.28から0.32cm2(即ち1mg当たり11.5から13.5cm2)であり得る。
【0091】
1つの態様において、本記述に従う1日フェンタニルパッチの表面積当たりのフェンタニル充填率は3日フェンタニルマトリクスパッチのそれよりも小さい、即ち約0.4mg/cm2未満であるが、DURAGESIC(商標)DTRANS(商標)フェンタニル経皮システムのそれは約0.4mg/cm2である。しかしながら、我々は、DURAGESIC(商標)DTRANS(商標)フェンタニル経皮システムと生物学的に同等にしようとする場合には1日パッチの充填率を3日パッチのちょうど1/3より大きくする、即ち0.13mg/cm2以上にすることを見いだした。従って、1つのそのような態様の1日フェンタニルパッチの場合、表面積当たりのフェンタニル充填率を約0.14から0.3mg/cm2、例えば約0.16から0.25mg/cm2または約0.18から0.22mg/cm2にする。
【0092】
パッチに充填する薬の量を少なくしかつ使用済みパッチに残存する薬の量が少なくなるようにすると、薬乱用を減少または阻止する点で利点が得られる可能性がある。本記述に従う1日フェンタニルパッチの1つの態様では、1パッチ当たりのフェンタニル含有量を名目上投薬濃度が100μg/時のパッチの場合には約4から8mg、例えば5から7mgまたは5.5から6.5mgなどにしてもよい。投薬濃度が異なる、例えば25μg/時、50μg/時、125μg/時などの場合のそれを見積もる目的で計算した正規化値に関して、正規化フェンタニル含有量(これはフェンタニル含有量を投薬濃度で割った値である)は約0.04から0.08mg・時/μg、例えば0.05から0.07mg・時/μgまたは0.055から0.065mg・時/μgなどである。そのような充填率を示す1日パッチが示す治療的鎮痛は3日DUROGESIC DTRANS(商標)のそれと同様であることを見いだした。比較として、その3日DUROGESIC DTRANS(商標)100μg/時パッチはフェンタニルを約17mg含有し、それは約0.17mg・時/μgである。
【0093】
本明細書に記述する如きパッチは、所望の薬使用率(使用%)をもたらすようにデザイン可能である。例えば、特定の態様において、本明細書に記述するパッチは、約30%以上、例えば少なくとも35%または少なくとも40%または40%から50%などの薬使用率をもたらす1日パッチであり得る。1つのそのような態様におけるパッチは、約30%以上、例えば少なくとも35%または少なくとも40%または40%から50%などのフェンタニル使用率をもたらすフェンタニルパッチである。そのような特定の態様における薬は塩基形態のフェンタニルであり、その場合のフェンタニルは塩基形態であることで溶解または分散する。他の態様における薬は完全に溶解する。別法として、そのような態様に従ってデザインしたパッチは、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどを送達するようにデザインしたパッチである。
【0094】
1枚のパッチによる投与を典型的には3日間以内、例えば2日間または1日に渡って維持する。本開示を基にして、パッチを患者にいずれかの時間(例えば8、24、36、4
8、72時間)貼り付けた後に取り替えると理解されるべきである。しかしながら、1つの態様において本明細書に開示する如き投薬方法では毎日取り替える必要がある(1日使用)。再び、所定理論で範囲を限定するものでも制限するものでもないが、持続性薬効果を鑑み、最初の日に貼り付けるパッチを1枚にしそして毎日取り替える場合には血漿中薬濃度が徐々に高くなって治療に有効な定常状態になるには2日以上要する可能性があると考えている。別の面において、本開示は、最初にパッチを1日目に2枚以上貼り付けた後に2日目から開始して血漿中薬濃度が短時間、例えばほぼ1日で治療範囲になるように前日のパッチの代わりに新しいパッチを毎日貼り付けることでオピオイド(フェンタニルまたはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどを包含)を投与する方法を提供する。最初の日の後の日では、定常状態の時に鎮痛用として皮膚に貼り付けたままであるパッチが1枚のみになるように前記2枚以上のパッチの中の数枚を剥がしてもよい。
【0095】
このように、1つの態様において、フェンタニルを患者に鎮痛の目的で送達すべき場合、その患者は比較的高い血漿中フェンタニル濃度を必要とする可能性もあり、例えばオピオイドに耐性のある患者が治療効果を達成するには、最初の日に治療的に有効な血漿中フェンタニル濃度の達成を確保する目的で、その患者に最初の日に多い量のフェンタニルを投与する必要があり、例えばパッチを2枚、3枚以上貼り付ける必要がある。2日目に前記パッチの中の1枚以上を取り替えそして3日目に前記パッチの全部を剥がして再び貼り付けられた新しいパッチが1枚のみであるようにしてもよい。この上に示した手順の変法を用いることも可能であり、例えば1日目の後に取り替えるパッチを1枚のみにしそして/または使用済みパッチを異なる数で剥がすことなどを行ってもよい。当該薬の投薬を受けてはいないが既にあるレベルの耐性を示す患者の場合には、最初に複数のパッチを用いるのが特に適切である。最初に2枚以上のパッチを用いそして皮膚に貼り付けるパッチの数を徐々に少なくして行くことによって血中薬濃度を迅速に定常状態の濃度にもって行くことができる。ある患者が当該薬の投薬を受けているか否かを決定する目的で、その過程で医療記録を参考にしてもよい。
【0096】
別の面では、ある患者がオピオイド薬、例えばフェンタニルなどの投薬を受けていないことを決定してもよく(例えば医療記録を基にして)、そしてそのような患者では1日目の間の血中薬濃度の方が定常状態の血中濃度より低くする方が有益である。このような決定を基にして、貼り付ける経皮オピオイドパッチの枚数を1枚のみにしそして薬送達の目的で一度に用いるパッチの枚数が1枚のみになるように毎日(24時間毎に)取り替えを実施する。ある場合には、2−3日かけて定常状態の目標血漿中薬濃度を達成する方が好ましいことを決定してもよく、例えばフェンタニルの投薬を受けていない患者の場合などに決定してもよい。1日目に貼り付けるパッチの数を1枚のみにして最初に開始する療法を用いると、そのように徐々に高くして行くことができそしてそれでも当該患者が薬の投薬を受けていないことが理由で許容される鎮痛を達成することができるであろう。
【0097】
この開示する経皮デバイスをキットの中に含有させることも可能であり、そのキットに本デバイスを含有させかつ使用説明書印刷物、例えば挿入片または印刷物などを容器などの上に含めて、各パッチを患者に貼り付ける時間の長さおよびパッチを剥がして新しいパッチに取り替える頻度がどれくらいの頻度であるかに関する説明を与える。そのような使用説明書に、上述した如きパッチを貼り付ける計画を含めてもよく、それには、最初に1枚のパッチを貼り付けた後に毎日取り替えること、または最初に2枚のパッチを貼り付けた後に両方を剥がすが1日目の後に取り替える枚数を1枚のみにすること、または他の代替計画などの説明が含まれる。そのような使用説明書に、また、当該薬の簡単な説明、裏地、貯蔵層、接着剤、薬理学的情報、対照物質(例えばフェンタニル)を位置させることに関する情報および注意書きなどを含めることも可能である。
【0098】
製造方法
本経皮デバイスの製造を公知方法、例えば米国特許公開番号2003002682に記述されている方法などに従って実施する。簡単に述べると、経皮薬送達デバイスの製造は、マトリクス薬含有接着性貯蔵層を裏地材料の上に生じさせ、保護フィルムを前記マトリクス貯蔵層の上に置きそして切断して所望の大きさのデバイスを生じさせることで実施可能である。薬/接着剤溶液を裏地層の上に流し込み成形した後に溶媒を蒸発させて前記薬/接着剤から出て行かせることで所望の厚みと薬濃度を有する薬含有マトリクスを生じさせることで、薬含有マトリクスを裏地の上に生じさせることができる。
【0099】
模擬
以下は日に1回のフェンタニルパッチの具体的態様の例である。
【0100】
模擬1:定常状態、3日パッチと対比させた1日パッチ
図3に、定常状態における血清中フェンタニル濃度の模擬グラフを示し、この図では、1日経皮フェンタニル塩基パッチの使用を3日経皮基準パッチ[英国の中でJanssen−Cilagから入手可能なDUROGESIC(商標)DTRANS(商標)マトリクスパッチ]の使用と対比させて比較する。3日パッチを皮膚に取り替えることなく3日間貼り付けた後に剥がした時の実際のデータを定常状態投与の連続効果の基準として用いた。その3日パッチが示した実際のデータは図4および図5に示すそれらと同じである。
【0101】
1枚の経皮DTRANS(商標)フェンタニル100μg/時マトリクスシステムを3日間貼り付けた後の実際の個々の血清中フェンタニル濃度データを模擬の目的で用いた。経皮フェンタニルシステムを1回投与した場合のシステム着用中の時間点tにおける血清中フェンタニル濃度C(t)は集めたデータを基にしたものである。各個人が示す消失速度定数k(この定数は当該システムを24時間使用後に剥がした時と同じであると仮定する)を用いた一次減衰関数を用いて、経皮フェンタニルシステムを剥がした後の血清中フェンタニル濃度を見積もる。2番目のシステムを貼り付けると同時に1番目のシステムを剥がした後の時間tの時の血清中フェンタニル濃度C(t)2ndを重ね合わせの原理を基にした下記の式:
C(t)2nd=C(t)+C(τ)e−kt
[式中、τは投与間隔、例えば24時間が終了した時点で1番目のシステムを剥がして2番目のシステムを貼り付ける時には24時間であり、C(t)は1枚のシステムを貼り付けてからt時間後に実測した血清中濃度であり、C(τ)は1枚のシステムを貼り付けてからτ時間後の血清中濃度であり、そしてkはτ時間経過した時点でシステムを剥がした後の血清中フェンタニル濃度を記述する見かけ一次減衰速度定数である]
に従って模擬する。N番目のシステムを貼り付けた後の血清中フェンタニル濃度を下記の式:
【0102】
【数1】

【0103】
に従って模擬する。C(τ)e−ktはτ時の時に貼り付けた古いパッチによる減衰濃度であり、τは投与間隔、即ち24または72時間などである一方、tは最後のパッチを貼り付けてから経過した時間に関係している。
【0104】
定常状態の時(Nが無限に近づく時)の血漿中フェンタニル濃度を下記の式:
【0105】
【数2】

【0106】
に従って模擬する。
【0107】
3日アクリレートマトリクスフェンタニルパッチを37人の健康な被験体に1回貼り付けた後の血清中フェンタニル濃度データを3日システムおよび1日システムの模擬の基準として用いた。DUROGESIC(商標)DTRANS(商標)マトリクスパッチ100μg/時の大きさの約半分(52%)でありかつ同じ組成を有するパッチを模擬の目的で1日パッチとして用いた。このように、3日パッチを用いて得たデータを基にして模擬することで同じ材料構成(表面積を除いて)の1日システムが示すパラメーターを得るための倍率は0.52である。3日アクリレートマトリクスフェンタニルパッチ[DUROGESIC(商標)DTRANS(商標)マトリクスパッチ]を単に1日貼り付けた時のCavg(平均濃度)を3日アクリレートマトリクスフェンタニルパッチを3日間貼り付けた時のCavgで割ることで52%の値に到達した。3日パッチは3日間の時にうまく働くことから、それが最初の日に送達する量は、それを3倍にした値が3日パッチで3日間送達した時の値に相当するであろう量であると仮定する。DUROGESIC(商標)DTRANS(商標)マトリクスパッチ(投薬濃度が100μg/時)を3日パッチとして用いた。従って、1日パッチのマトリクス厚および薬濃度はDUROGESIC(商標)DTRANS(商標)マトリクスパッチのそれらと同じであるが、各々を42cm2ではなく21cm2にした。この模擬では、前記3日パッチを所定時間の時に皮膚にパッチを1枚貼り付けることで3日(72時間)毎に1回取り替えるように貼り付けた。前記1日パッチの模擬を所定時間の時に1枚のパッチを皮膚に貼り付けて毎日(24時間)1回取り替えるように貼り付けることで実貼り付けた。
【0108】
数学的に模擬した定常状態(時間が無限に近くなる)の72時間部分の抜粋をグラフに示す。便利さの目的で、図3のグラフの中に時間をゼロ時から出発して定常状態における72時間の間の時間を示す(即ち曲線は連続的であり、ゼロ時間の前および72時間の後にも繰り返す)。図3中の白丸データ点を伴う破線(−−)曲線は3日パッチの場合の模擬血清中フェンタニル濃度値を示し、菱形データ点を伴う実線曲線は1日パッチの場合の模擬値を示す。この模擬では、図3のグラフに示した抜粋の中に含めなかったが、1日パッチが本質的に定常状態の条件になるには約3日要した。濃度が上昇する最初の2日間(定常状態に到達する前)の間、24時間後の濃度は定常状態Cmaxのほぼ半分のみでありそして48時間後の濃度は定常状態Cmaxの約70%のみであったが、このことは、1日パッチの貼り付けに関して図5に示したそれらと同様であった。3日100μg/時パッチを3日毎に1回取り替えた。この100μg/時パッチの場合の平均Cmaxは約4.7ng/mlでありかつ平均Cminは約2.1ng/mlであったことを特記する。前記1日パッチの場合の平均Cmaxは約3.5ng/mlでありかつ平均Cminは約2.9ng/mlであった。このように、前記1日パッチが示したCmaxの方が前記3日パッチが示したCmaxよりも低かった。しかしながら、前記1日パッチが示したCminの方が前記3日パッチが示したCminより高く、その結果として、前記1日パッチが示したCmaxとCminの間の揺れの方が小さかった。
【0109】
模擬2:1日パッチを3日間貼り付け、最初に2回分
図4に、経皮フェンタニル製品使用開始時の血中フェンタニル濃度の模擬グラフを示し、このグラフでは、1日経皮フェンタニル塩基パッチの使用を3日経皮基準パッチ[DUROGESIC(商標)DTRANS(商標)マトリクスパッチ]を取り替えることなく
1回用いた実際のデータと対比させて比較する。模擬1と同じ皮膚およびパッチパラメーターを用いた。
【0110】
大きさがDUROGESIC(商標)DTRANS(商標)マトリクスパッチの半分でありかつ組成物が同じであるパッチを模擬の目的で1日パッチとして用いた。前記DUROGESIC(商標)DTRANS(商標)マトリクスパッチは各々が42cm2の100μg/時パッチであった。従って、1日パッチのマトリクス厚および薬濃度はDUROGESIC(商標)DTRANS(商標)マトリクスパッチのそれらと同じであったが、各々約21cm2であった。3日パッチの場合、実際の実験で、最初にゼロ時の時にDUROGESIC(商標)DTRANS(商標)マトリクスパッチを1枚のみ貼り付けそして72時間後に剥がすまで貼り付けたままにした。1日パッチの場合には24時間毎に取り替えた。模擬では、ゼロ時の時に1日パッチを2枚貼り付けた。24時間が経過した時点で前記2枚の初期パッチを剥がして貼り付ける新しい1日パッチの数を1枚のみにした。次に、その1日パッチを新鮮なパッチに毎日取り替えた。最終的使用済みパッチを両方の場合とも72時間経過した時点で剥がした。この模擬で生じさせるデータ点の開始を前記3日パッチの物理的に24時間目のデータ点の所にした、と言うのは、両方の場合とも最初の24時間の間に用いたパッチ材料および量が同じであったからである。図4に示したグラフ中の白丸データ点を伴う破線(−−)曲線は前記3日パッチが示したデータを示し、三角データ点を伴う実線曲線は前記1日パッチが示した曲線である。
【0111】
実際の実験データは、3日パッチの場合には血中フェンタニル濃度が全体として徐々に降下することを伴って毎日揺れることを示している。この模擬データは、大きさがDUROGESIC(商標)DTRANS(商標)マトリクスパッチの半分のパッチを用いて血中フェンタニル濃度を24時間目から開始して妥当な安定な治療濃度に維持することができることを示している。実際、毎日の変動は前記3日パッチが示したそれよりもずっと小さい。
【0112】
模擬3:1日パッチを3日間貼り付け、最初に1回分
図5に、経皮フェンタニル製品使用開始時の血清中フェンタニル濃度の模擬グラフを示し、このグラフでは、1日経皮フェンタニル塩基パッチの使用を3日経皮基準パッチ[DUROGESIC(商標)DTRANS(商標)マトリクスパッチ]を使用した実際のデータと対比させて比較する。3日パッチに関するデータは図4に示したそれと同じ実際のデータを用いた。模擬1と同じ薬物動態パラメーターを用いた。
【0113】
大きさがDUROGESIC(商標)DTRANS(商標)マトリクスパッチの半分でありかつ組成物が同じであるパッチを模擬の目的で1日パッチとして用いた。前記DUROGESIC(商標)DTRANS(商標)マトリクスパッチは各々が42cm2の100μg/時パッチであった。従って、1日パッチのマトリクス厚および薬濃度はDUROGESIC(商標)DTRANS(商標)マトリクスパッチのそれらと同じであったが、各々約21cm2であった。3日パッチの場合には、模擬2で用いたそれと同じ実際の物理的実験データを用いた。模擬では、ゼロ時の時に貼り付ける1日パッチを1枚のみにした。24時間経過した時点(即ち24時間後)に前記初期パッチを剥がして1枚の新しい1日パッチと取り替えた。その後、その1日パッチを新鮮なパッチに毎日取り替えた。最終的使用済みパッチを両方の場合とも72時間経過した時点で剥がした。この模擬で生じさせるデータ点の開始をゼロ時にした。図5に示したグラフ中の白丸データ点を伴う破線(−−)曲線は前記3日パッチが示したデータを示し、菱形データ点を伴う実線曲線は前記1日パッチが示した模擬データ示す。この模擬のデータは、大きさがDUROGESIC(商標)DTRANS(商標)マトリクスパッチの半分のパッチを1回に1枚のみ用いて血中フェンタニル濃度を徐々に高くして行くと3日後の治療濃度である濃度に到達することを示している。この1日パッチが1日パッチを用いた模擬1の定常状態の条件と本質
的に同様なピーク条件になるには約3日間要した。濃度が上昇する最初の2日間の間、24時間後の濃度はピークCmaxのほぼ半分のみでありそして48時間後の濃度はピークCmaxの約75%のみであった。取り替える時点で血中フェンタニル濃度が降下する度合は極めて僅かのみであった、と言うのは、血中フェンタニル濃度は絶えず上方に揺れて定常状態の濃度に到達したからである。
【0114】
実験
具体的態様の例を以下に含める。本実施例は単に例示の目的で示すものであり、決して本開示の範囲を限定することを意図するものでない。薬で飽和状態にした貯蔵層を用いることも可能であるが、以下の実施例には、フェンタニルが飽和濃度以下の量で入っていて溶解していない成分を含有しない単相重合体組成物を含有して成る接着性貯蔵層パッチを開示する。以下の実施例では、特に明記しない限り、あらゆるパーセントを重量で表す。以下の実施例では実験の目的で3日パッチを製造する代わりにまたDUROGESIC(商標)DTRANS(商標)またはDUROGESIC(商標)SMAT[これは構造的にDUROGESIC(商標)DTRANSと同様である]パッチを製造供給元から入手することも可能であり、それを実験に必要な如き正確な表面積になるように切断することを特記する。
【0115】
実施例1:3日パッチ、3日に1回貼り付け
フェンタニル塩基含有量が約8重量%の市販DUROGESIC(商標)DTRANS(商標)パッチと同じ構造を持たせた図1に従うモノリス経皮パッチを作成して使用した。マトリクス接着剤はNational Starch DURO−TAK(商標)87−4287ポリアクリレート系接着剤であった。その結果として得たマトリクスの厚みは約2ミル(0.05mm)であった。12.5μg/時、25μg/時、50μg/時、75μg/時および100μg/時の名目上のフェンタニル投薬濃度送達速度に相当する大きさが約5.5cm2、11cm2、21cm2、32cm2および42cm2のパッチを作成した。これらのパッチを作成する過程で、ポリアクリレート系接着剤の溶液を調製した(約39重量%固体のNational Starch 87−4287を98.35kg用いて、これを18.3kgの酢酸エチルで希釈した)。次に、3.35kgのフェンタニル塩基を前記ポリアクリレート系接着剤の溶液にフェンタニルが接着剤溶液に2.8重量%入っている混合物が生じるに充分な量で加えた後、撹拌を行って前記薬を溶解させた。その溶液を流し込み成形した後、溶媒を蒸発させると、結果として厚みが2ミル(0.05mm)の貯蔵層がもたらされた。ポリエチレン/ポリウレタン/ポリエステル層の多積層物で構成されている厚みが1.7ミル(0.04mm)の裏地層を標準的手順で前記接着性薬貯蔵層の上に積層させた。この積層物からそれぞれがフェンタニルを各々4.4、8.5、13および17mg含有する大きさが11cm2、21cm2、32cm2および42cm2の個々のパッチをダイスで切り取ることでフェンタニル塩基を約0.4mg/cm2含有するモノリス経皮パッチを生じさせた。
【0116】
被験体を無作為に処置手順に割り当てて、無作為リストに従って、試験システムを上方外側腕、上方胸または上方背中に着用してもらった。処置期間を4期間にした。選択した被験体はオピオイド依存性でなかった。各処置中、被験体が無作為に決めた貼り付け領域(上方外側腕、上方胸または上方背)の新しい皮膚貼り付け部位に前記試験システムを72時間着用してもらった。各被験体毎に試験期間全体に渡って体の同じ領域を使用してもらった。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。
【0117】
図6に、被験体の血中フェンタニル濃度の平均データの要約を正規化した形態で示す[即ち、データを名目上の投薬濃度送達速度の比係数を用いてフェンタニル濃度を名目上の
投薬濃度送達速度である25μg/時で割ることで25μg/時の投薬速度(即ち投薬濃度)に対して正規化した]。このように、投薬速度が100μg/時の場合のデータを4で割ることで得られる曲線は元々の25μg/時の時の曲線に匹敵していた。図6中の菱形データ点を伴う実線は投薬速度が25μg/時の場合のデータを表している。白丸データ点を伴う破線曲線は投薬速度が50μg/時の場合のデータを表している。星形データ点を伴う破線曲線は投薬速度が75μg/時の場合のデータを表している。星印データ点を伴う破線/点(・−・−)曲線は投薬速度が100μg/時の場合のデータを表している。図6は、投薬速度が異なってもフェンタニル濃度が時間に伴ってほぼ同じ比率で変化することを示している。無次元の正規化形態で表すと、各投薬速度の曲線はほぼ同じであった(実験誤差の範囲内であり、有意な統計学的差を伴わない)。このように、フェンタニル血中濃度をCavg[ここで、Cavgは平均血漿中フェンタニル濃度である]で割った別の正規化形態で表しても、いろいろな投薬濃度が示す曲線(ここのグラフには示していない)はほとんど同じであろう。例えば、最初の48時間以内のCmax/CavgおよびCmin/Cavgは各投薬速度毎にほぼ同じであろう。
【0118】
実施例2:3日パッチ、3日間毎日取り替え
図7に、3日パッチ[構成はフェンタニル塩基含有量が約8重量%の市販DURAGESIC(商標)貯蔵層パッチと同じであった]を用いてそれらを24時間毎に1回取り替えることで経時的に集めた実際の血清中フェンタニル濃度を示す。DUROGESIC(商標)DTRANSマトリクスパッチはDURAGESIC(商標)貯蔵層パッチと生物学的に等しくなるように製造されたものであることから、これらのパッチのいずれの種類を用いても結果として同様な血清中フェンタニル濃度がもたらされるであろう。投薬濃度が75μg/時のパッチを用いた。この試験(結腸直腸手術を受けた11人の患者に試験を受けさせた)では、ゼロ時(麻酔を誘発する約2時間前)の開始時に最初の75μg/時パッチを貼り付けた。チオペンタルを2−4mg/kgおよびフェンタニルボーラスを最大投薬量が400μgになるように3−5μg/kg用いて全身麻酔を誘発した。その後、パッチを24時間毎に取り替えた。72時間が経過した時(後)にパッチ(即ち3回目のパッチ)を剥がした。
【0119】
そのデータは、新しいパッチを貼り付ける毎に血清中濃度が段階的に高くなることを示している。このような結果は予想外であった、と言うのは、多日パッチはフェンタニルの一定静脈内注入と一致した速度で薬を送達するであろうと仮定されていたからである。所定時に皮膚に貼り付けたパッチは1枚のみであることから、予測(一定注入モデルの場合と同様)は、血清中フェンタニル濃度は1枚の3日パッチを皮膚に3日間貼り付けた場合のそれと同様でありかつその場合の血清中フェンタニル濃度は24時間後に得られるほぼ定常状態の濃度にまで上昇して維持されるであろうと言った予測であった。しかしながら、麻酔性オピオイド、例えばフェンタニルなどを送達する時に毎日取り替えると蓄積が起こる影響の結果として血清中薬濃度が数日の間に徐々に(または段階的に)高くなることを確認した。
【0120】
実施例3:1日パッチ(87−2287接着剤を伴う)、3日間以上毎日取り替え
大きさが5、11、21、31および42cm2でフェンタニル塩基含有量が約7重量%である図1に従うモノリス経皮パッチを調製したが、それらは25μg/時、50μg/時、100μg/時、150μg/時および200μg/時に相当する(0.52の倍率を基にして)。
【0121】
マトリクス接着剤はNational Starch DURO−TAK(商標)87−4287ポリアクリレート系接着剤であった。このDURO−TAK(商標)87−4287接着性重合体は、酢酸ビニルを28%とアクリル酸2−エチルヘキシルを67%とアクリル酸ヒドロキシエチルを4.9%とメタアクリル酸グリシジルを0.1%用いて重
合させた接着剤である(米国特許第5,693,335号を参照)。ポリアクリレート系接着剤が約43重量%入っている溶液(National Starch 87−4287が酢酸エチルに入っている)を調製した。このポリアクリレート系接着剤溶液にフェンタニル塩基をフェンタニルが接着剤溶液に約3.4重量%入っている混合物が生じるに充分な量で加えた後、撹拌を行うことで前記薬を溶解させた。その溶液を貯蔵層の中に流し込んだ後、溶媒を蒸発させると、結果として厚みが1ミル(0.025mm)のマトリクス層がもたらされた。溶媒蒸発後に非線状LDPE層/線状LDPE層/非線状LDPE層の多積層物で構成されている厚みが3ミルの裏地層を標準的手順で前記接着性薬貯蔵層の上に積層させる。この積層物から各々がフェンタニルを約7重量%有する大きさが5、11、21、31および42cm2の個々のパッチをダイスで切り取ることでフェンタニル塩基を約0.2mg/cm2含有するモノリス経皮パッチを生じさせる。
【0122】
そのようなパッチをオピオイドの投薬を受けていない患者に最初に1枚のみ貼り付けて24時間毎に取り替えることで投与を実施する。その結果は1日パッチを用いた時に本質的に定常状態の条件になるには約3日間要すると予測する。24時間後の濃度は定常状態Cmaxのそれの約50%から60%のみでありかつ48時間後の濃度は定常状態Cmaxのそれの約70%から80%のみである。この最初の3日間の結果は模擬を基にして約3日後のほぼ定常状態の時に図5に示した結果と同様でありかつ図3に示した結果と同様であると予測する。大きさの差を基にした投薬濃度に従って値を見積もることができ、そしてそのような投薬濃度に従って正規化した曲線は実質的に重なり合うであろう。
【0123】
別の試験として、前記パッチを前記薬が血中に実質的に存在しないヒトに最初にゼロ時の時にパッチを2枚貼り付けることで投与を実施する。24時間が終了した時点で最初のパッチを両方とも剥がして単に1枚の1日パッチに取り替え、そしてその後、24時間毎に取り替える。その結果は1日パッチを用いた時に本質的に定常状態の条件の濃度になるには約1日要すると予測する。最初の24時間の間のフェンタニル濃度Cmaxは約3ng/mlである。その後の2日目および3日目の結果は図4に示した結果(ほぼ定常状態)と同様でありかつ図3に示した結果と同様であると予測する。約3日後にフェンタニル濃度が定常状態になるであろう。大きさの差を基にした投薬濃度に従って値を見積もることができ、そしてそのような投薬濃度に従って正規化した曲線は実質的に重なり合うであろう。
【0124】
実施例4:1日パッチ(87−2287接着剤を伴う)、3日間以上毎日取り替え
大きさが5、11、21、31および42cm2で各々のフェンタニル塩基含有量が約8重量%である図1に従うモノリス経皮パッチを実施例1の方法を用いて調製したが、それらは投薬濃度が25μg/時、50μg/時、100μg/時、150μg/時および200μg/時であることに相当する。
【0125】
ポリアクリレート系接着剤[National Starch DURO−TAK(商標)87−4287、100g]を溶媒(酢酸エチル、160ml)に溶解させる。このポリアクリレート系接着剤溶液にフェンタニル塩基をフェンタニルが接着剤溶液に約2.8重量%入っている混合物が生じるに充分な量で加えた後、撹拌を行うことで前記薬を溶解させた。その溶液を貯蔵層の中に流し込んだ後、溶媒を蒸発させると、結果として厚みが約1ミル(0.025mm)のマトリクス層がもたらされる。溶媒蒸発後にポリエチレン/ポリウレタンポリエステル層の多積層物で構成されている厚みが1.7ミルの裏地層を標準的手順で前記接着性薬貯蔵層の上に積層させる。この積層物から各々がフェンタニルを約8重量%含有する大きさが5、11、21、31および42cm2の個々のパッチをダイスで切り取ることでフェンタニル塩基を約0.2mg/cm2含有するモノリス経皮パッチを1日パッチとして生じさせる。
【0126】
そのような低投薬量のパッチをオピオイドの投薬を受けていない患者に最初に1枚のみ貼り付けて24時間毎に取り替えることで投与を実施する。このように、例えば患者に投薬濃度が100μg/時のデバイスを貼り付ける場合には、その患者に投与する薬を低い投薬濃度、例えば25μg/時などの投薬濃度で開始して上方に漸増させる。その結果は1日パッチを用いた時に本質的に定常状態の条件になるには約3日間要すると予測する。24時間後のCmaxは定常状態Cmaxの約50%から60%のみでありかつ48時間後のCmaxは定常状態Cmaxの約70%から80%のみである。この最初の3日間の結果は、投薬濃度の数値が100μg/時より低い以外は約3日後のほぼ定常状態の時に図5に示した形状と同様でありかつ図3に示した形状と同様であると予測する。大きさの差を基にした投薬濃度に従って値を見積もることができ、そしてそのような投薬濃度に従って正規化した曲線は実質的に重なり合うであろう。
【0127】
別の試験として、前記パッチをオピオイドの投薬を受けていない(前記薬が血中に実質的に存在しない)ヒトに最初にゼロ時の時にパッチを2枚貼り付けることで投与を実施する。24時間が終了した時点で最初のパッチを両方とも剥がして単に1枚の1日パッチに取り替え、そしてその後、24時間毎に取り替える。その結果は1日パッチを用いた時に本質的に定常状態の条件の血中濃度になるには約1日要すると予測する。その後の2日目および3日目の結果は図4に示したそれの形状(ほぼ定常状態)と同様でありかつ図3に示したそれの形状と同様であると予測する。大きさの差を基にした投薬濃度に従って値を見積もることができ、そしてそのような投薬濃度に従って正規化した曲線は実質的に重なり合うであろう。
【0128】
実施例5:3日間貼り付け:3日パッチと対比させた1日パッチ(50μg/時)
投薬濃度が50μg/時になるように実施例1の工程と同様にしてNational Starch DURO−TAK(商標)87−4287を用いてフェンタニル塩基含有量が約8重量%の図1に従うモノリス経皮パッチを調製した。3日パッチの面積は21cm2でありそしてフェンタニルマトリクス層の厚みは約2ミル(0.05mm=50μm)であった。また、比較の目的で、より薄くてより小型の16cm2パッチも1日使用パッチとして作成した。そのような薄いパッチの場合には、前記フェンタニル溶液を流し込み成形してマトリクスの厚み(溶媒蒸発後)が0.038mm(38μm)および0.025mm(25μm)になるようにすることで16cm2のパッチを生じさせた。前記2ミルの3日モノリス経皮パッチのフェンタニル塩基含有量は0.4mg/cm2であった。前記1ミルの1日モノリス経皮パッチのフェンタニル塩基含有量は0.2mg/cm2であった。
【0129】
そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。各被験体に1日パッチおよび3日パッチの両方を貼り付けてもらったが、一緒には貼り付けなかった。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに18人の被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着用してもらった。各被験体毎に試験全体に渡って同じ解剖学的領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。前記3日パッチ(50μm)を72時間着用してもらった後に剥がしてもらった。前記25μmパッチを24時間着用してもらった後に24時間目および48時間目に新しいパッチに変えてもらった。前記38μmパッチを24時間着用してもらった後に24時間目および48時間目に新しいパッチに変えてもらった。1つの期間では、25μmのパッチを24時間着用してもらい、剥がしてもらった後、血中フェンタニル濃度を72時間目が終了するまで監視した。
【0130】
図8に、マトリクスの厚みを変えた時の被験体の血中フェンタニル濃度の平均データ(
あらゆる被験体N=18の全体)の要約を示す。菱形データ点は3日パッチを3日間貼り付けた時のデータを表している。丸のデータ点は38μmの1日パッチを毎日取り替えながら3日間貼り付けた時のデータを表している。四角のデータ点(丸のデータ点の下方)は25μmの1日パッチを毎日取り替えながら3日間貼り付けた時のデータを表している。三角のデータ点は、25μm1日パッチを取り替えることなく1日使用した後に前記パッチを剥がした時のデータを示している。これらの結果は、前記38μmのパッチは3日後に前記3日パッチが示し得る定常状態の血中フェンタニル含有量より高い血中フェンタニル含有量をもたらし得ることを示している。3日後、前記25μmのパッチは前記3日パッチを用いた時になるであろう定常状態血中含有量にほぼ相当する定常状態の血中フェンタニル含有量をもたらした。前記16cm2の25μmパッチがもたらしたフェンタニル含有量は前記3日パッチのそれの38%のみであり、前記模擬1で予測した52%より低かった。前記25μmパッチは約0.4mg/cm2を示した。このパッチのフェンタニル含有量は模擬1の時のそれより低いが、模擬1で予測したフェンタニル送達速度に合致またはそれ以上になり得た。
【0131】
以下に示すようにして、時間0(t=0)の時に当該システムが示す初期平均フェンタニル含有量から平均残存フェンタニル含有量を差し引くことで、送達される平均フェンタニル量を各処置毎に計算した:
送達される平均量(mg)=初期含有量(mg)−平均残存含有量(mg)。
【0132】
このデータは、前記1日システムが送達するフェンタニルの平均量は38μmのQDシステムの場合には1.59mgで25μmのQDシステムの場合には1.39から1.54mgであることを示している。3日50μg/時システムが送達する平均量は3.85mgであった。計算して、初期平均フェンタニル量(t=0の時の当該システムの実際のフェンタニル含有量)は、38μmのQD、25μmのQDおよび3日(50μm)50μg/時のシステムのそれぞれに関して5.47mg、3.42mg、8.01mgであった。システムを貼り付けている間に送達される平均量は、38μmのQD、25μmのQDおよび3日(50μm)50μg/時のシステムのそれぞれに入っているフェンタニルの約29%、43%および48%に相当していた。このように、薄い方の1日QDパッチ(25μm)が示したフェンタニル使用%は3日(50μm)システムが示したそれに近く、厚い方の1日(38μm)QDシステムが示したそれよりも良好であり得た。
【0133】
50μmの3日パッチが示したデータおよび25μmの1日パッチが示したデータを用い、模擬1の模擬方法を用いることで、3日パッチを用いて3日毎に取り替えた場合の定常状態プロファイルおよび1日パッチを用いて毎日取り替えた場合の定常状態のプロファイルの薬物動態学的プロファイルを模擬した。図9に、336時間に及ぶ模擬データを示す。3日パッチの最後の交換を216時間目に行った(実線)。1日パッチの最後の交換を264時間目に行った(破線)。この模擬データは、50μmで21cm2の3日パッチが示した定常状態プロファイルと25μmで18cm2の1日パッチが示したそれが同様であることを示している。50μg/時以外の投薬濃度の場合、データの情報を推定で見積もることができる。例えば、50μg/時のデータのフェンタニル濃度を2倍することで100μg/時の模擬データを得ることができる。
【0134】
実施例6A:12日間貼り付け:3日パッチと対比させた1日パッチ(100μg/時)
投薬濃度が100μg/時になるように実施例1の工程と同様にしてNational
Starch DURO−TAK(商標)87−4287接着剤を用いてフェンタニル塩基含有量が約8重量%の図1に従うモノリス経皮パッチを調製した。3日パッチの面積は42cm2でありそしてフェンタニルマトリクス層の厚みは約2ミル(0.05mm=50μm)であった。また、比較の目的で、より薄いマトリクスの厚みが25μmで36cm2のパッチも1日使用パッチとして作成した。従って、前記1日パッチのフェンタニ
ル量は前記3日パッチのそれの43%であった。前記25μmの1日パッチは約0.2mg/cm2を示した。
【0135】
そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに17人の被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着用してもらった。各被験体毎に試験全体に渡って同じ体領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。前記50μmの3日パッチを72時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で4パッチ)。前記25μmの1日パッチを24時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で12パッチ)。驚くべきことに、両方の大きさとも被験体平均(N=17)フェンタニル濃度は144時間目の後でも高くなり続けた(216時間目前のデータはこのグラフに示していない)。216時間目またはそれ以前に定常状態に到達した。図10に、216時間目から288時間目までの被験体の血中フェンタニル濃度に関する平均データ(N=17に渡る)の要約を示す。菱形データ点を伴う曲線は3日パッチを表している。白丸データ点を伴う曲線は1パッチを表している。これらのデータは、定常状態の血中フェンタニル濃度は1日パッチの場合の方が3日パッチのそれに比べて高いことを示している(1.25倍以上高い)。
【0136】
図11に、図10に示した定常状態3日パッチデータを図9に示したデータから名目上投薬濃度が100μg/時になるように見積もった模擬定常状態3日パッチデータと対比させた比較を示す。その模擬曲線は菱形データ点無しの曲線である。この2つの曲線は非常に良好に合致している。図12に、図10に示した定常状態1日パッチデータ(菱形データ点を伴う上方の曲線)を図9に示したデータから名目上投薬濃度が100μg/時になるように見積もった模擬定常状態1日パッチデータ(下方の曲線)と対比させた比較を示す。実際の定常状態データ(上方の曲線)が示したAUCavgの方が模擬定常状態データのそれよりも約29%高かった。このように、3日パッチの結果は模擬で良好に予測されはしたが、このケースでは、1日パッチの結果と全く同様には予測されなかった。
【0137】
実施例6B:12日間貼り付け:1日パッチ
モノリス経皮1日パッチを実施例6Aに従って作成した。3種類の投与濃度を用いた(1.25、50および100μg/時)。
【0138】
この試験では、1日(簡単にQDと呼ぶ)フェンタニルマトリクス(接着剤の厚みが25μm)システムの投薬範囲の全体を網羅する目的で、この製品と仮定した名目上の送達速度である約12.5μg/時、50μg/時および100μg/時の投薬量関係をシステムの面積の大きさ(それぞれ4.5cm2、18cm2および36cm2)を変えて評価した。被験体に下記の3処置を無作為割り当て順に従って重複様式で受けさせた:処置A:(図13に菱形で示すデータ点、被験体n=16)フェンタニルマトリクスQD 12.5μg/時で4.5cm2のシステム面積、1回貼り付け。処置B:(図13に白丸で示すデータ点、被験体n=16)フェンタニルマトリクスQD 50μg/時で18cm2のシステム面積、1回貼り付け。処置C:(図13に白三角で示すデータ点、被験体n=17)フェンタニルマトリクスQD 100μg/時で36cm2のシステム面積、1回貼り付け。13人の被験体が試験を完了した。このように、1日パッチのフェンタニル量は3日パッチのそれの約38%であった。そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに前記被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着
用してもらった。各被験体毎に試験全体に渡って同じ体領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。各処置の平均血清中フェンタニル濃度を図13に示す。図13のデータは、血中フェンタニル濃度が投薬濃度の関数であることを示している。測定血清中フェンタニル濃度で表す血中フェンタニル濃度を個々の投薬濃度で割ることで正規化すると形状および値が互いに非常に近い曲線がもたらされることが分かる。
【0139】
初期平均フェンタニル量(t=0の時に12.5μg/時、50μg/時および100μg/時のシステムを測定した時のフェンタニル含有量)はそれぞれ0.97mg、3.5mgおよび7.1mgであった。3投薬濃度(12.5μg/時、50μg/時および100μg/時)の全部を同じ積層物から作成したことから、それらはmg/cm2を基に同じフェンタニル含有量を示すはずである(3ロットの放出値の平均として0.20mg/cm2)。次に、その12.5μg/時、50μg/時および100μg/時のシステムに関して計算したそれぞれの初期フェンタニル含有量である0.91mg、3.64mgおよび7.29mgを用いてフェンタニル送達量を計算した。このデータは、投薬濃度が名目上12.5μg/時、50μg/時および100μg/時のシステムが送達する平均フェンタニル量はそれぞれ0.38mg、1.24mgおよび2.92mgであることを示していた。システムを貼り付けている間に送達される平均フェンタニル量(使用%)は12.5μg/時、50μg/時および100μg/時のシステムのそれぞれに入っているフェンタニル量の約42%、34%および40%に相当していた。比較として、DUROGESIC(商標)DTRANS(商標)が示す使用%はそれらとあまり違わなかった。DUROGESIC(商標)DTRANS(商標)フェンタニルパッチの試験では、12人の被験体を用い、100μg/時および12.5μg/時のDUROGESIC(商標)DTRANS(商標)フェンタニル(8システムに及ぶ)を貼り付けた後のシステムを残存フェンタニル含有量に関して分析した。100μg/時のフェンタニルパッチを貼り付けた後の平均残存フェンタニル含有量は9.34mgであった。12.5μg/時のフェンタニルパッチを8枚貼り付けた後の平均残存フェンタニル含有量は1.05mgであった。
【0140】
100μg/時および12.5μg/時のDUROGESIC(商標)DTRANS(商標)フェンタニルシステムがロットクリアランス(lot clearance)の時に示した平均フェンタニル含有量はそれぞれ16.3および2.0mgであった。このように、残存フェンタニル含有量を基にして吸収される平均フェンタニル量は100μg/時および12.5μg/時のDTRANS(商標)フェンタニルシステムのそれぞれに関して6.96および0.95mgであると推定する。投薬濃度が100μg/時および12.5μg/時のパッチの場合の使用率はそれぞれ43%および48%である。勿論、DUROGESIC(商標)DTRANS(商標)フェンタニルシステムの場合の使用%値は3日間使用後の値である。DUROGESIC(商標)DTRANS(商標)フェンタニルシステムの1日使用当たりの平均使用%は3日間の値の1/3のみであり、投薬濃度が100μg/時および12.5μg/時のパッチの場合のそれはそれぞれ約12.5%および16%であろう。
【0141】
実施例7:12日間貼り付け:3日パッチと対比させた32cm2の1日パッチ(100μg/時)
投薬濃度が100μg/時になるように実施例1の工程と同様にしてNational
Starch DURO−TAK(商標)87−4287接着剤を用いてフェンタニル塩基含有量が約8重量%の図1に従うモノリス経皮パッチを調製した。3日パッチの面積は42cm2でありそしてフェンタニルマトリクス層の厚みは約2ミル(0.05mm=50μm)であった。また、比較の目的で、より薄い25μmで32cm2のパッチも1
日使用パッチとして作成した。従って、前記1日パッチのフェンタニル量は前記3日パッチのそれの約38%であった。
【0142】
そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに17人の被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着用してもらった。各被験体毎に試験全体に渡って同じ体領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。前記50μmの3日パッチを72時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で4パッチ)。前記25μmの1日パッチを24時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で12パッチ)。360時間目までデータを集めた。両方の大きさとも被験体平均(N=17)フェンタニル濃度は144時間目の後でも高くなり続けた。216時間目またはそれ以前に定常状態に到達した。図14に、216時間目から288時間目までの被験体の血中フェンタニル濃度に関する平均データ(N=17に渡る)の要約を示す。白丸データ点を伴う曲線は1日パッチを表している。菱形データ点を伴う曲線は3パッチを表している。これらのデータは、定常状態の血中AUCフェンタニル濃度は1日パッチの場合の方が3日パッチのそれに比べて若干高いことを示している。
【0143】
表2に、前記3日パッチが示した薬物動態パラメーターを前記1日パッチが示したそれと対比させた比較を示す。定常状態の条件の場合のデータは216時間目から288時間目までの72時間のデータであると見なした。AUCssデータを幾何平均および平均(CV%)として示す。CVは、平均値で割った標準偏差である。CmaxおよびCminを平均(CV%)として示す。
【0144】
1日パッチ(Trt C)が示したAUCssは3日パッチ(Trt A)のそれの約1.07倍であった。1日パッチが示したCmaxは3日パッチが示したそれの約0.94倍であった。1日パッチが示したCminは3日パッチが示したそれの約1.2倍であった。このように、1日パッチと3日パッチは生物学的に同等であった。表2中の驚くべき差は(Cmax−Cmin)/Cavgとして定義する変動であり、この場合のCavg=AUCss/72である。このような変動は定常状態の間の血中フェンタニル濃度が変動する度合がどれほど大きいかを示している(これを無次元数で表す)。前記3日パッチの場合、CmaxとCminの間の揺れの大きさは平均濃度Cavgとほぼ同じであった。前記1日パッチの場合の変動は前記3日パッチの場合のそれの約64%のみであり、実質的に小さかった。このように、前記1日パッチはより一定した血中濃度をもたらした。
【0145】
【表2】

【0146】
表3に、3日パッチ(Trt A)が示したデータの統計学的値を1日パッチ(Trt
C)のそれと対比させて示す。
【0147】
【表3】

【0148】
このように、前記統計学は、DUROGESIC(商標)DTRANS(商標)に対する1日パッチが示したCmaxおよびAUCss比の90%信頼区間は80%以内および125%以内であることを示している。従って、前記1日パッチは100μg/時の3日パッチであるDUROGESIC(商標)DTRANS(商標)と生物学的に同等である。前記32cm2の1日パッチのフェンタニル含有量は6.7mgでありかつ100μg/時のDUROGESIC(商標)DTRANS(商標)パッチのフェンタニル含有量は16.8mgである。従って、フェンタニル含有量が16.8mgの3日パッチを用いた時と生物学的に同等な量のフェンタニルを送達するには1日パッチを3枚(全体で20.1mgのフェンタニル)用いる必要がある(約18.5%の差)。予測使用%により、それは43%から35%までの降下である。しかしながら、そのような1日パッチが示した使用%性能は、そのパッチに入っているフェンタニルを使用するに要した時間は3日パッチに比較して3日パッチの1/3のみであることを考慮すると妥当に良好である。予測した1日当たりの使用%により、前記1日パッチの使用%の方が前記3日パッチのそれよりもずっと高かった。個々のパッチを考慮すると、前記1日パッチに入っているパッチ当たりの残存フェンタニルの量の方が前記3日パッチのそれよりも有意に少ない。
【0149】
実施例8:12日間貼り付け:3日パッチと対比させた28cm2の1日パッチ(100μg/時)
投薬濃度が100μg/時になるように実施例1の工程と同様にしてNational
Starch DURO−TAK(商標)87−4287接着剤を用いてフェンタニル塩基含有量が約8重量%の図1に従うモノリス経皮パッチを調製した。3日パッチの面積は42cm2でありそしてフェンタニルマトリクス層の厚みは約2ミル(0.05mm=50μm)であった。また、比較の目的で、より薄い25μmで28cm2のパッチも1日使用パッチとして作成した。従って、前記1日パッチのフェンタニル量は前記3日パッチのそれの約33%であった。
【0150】
そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに19から20人の被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着用してもらった。各被験体毎に試験全体に渡って同じ体領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。前記50μmの3日パッチを72時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で4パッチ)。前記25μmの1日パッチを24時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で12パッチ)。260時間目までデータを集めた。両方の大きさとも被験体平均フェンタニル濃度は144時間目の後でも高くなり続けた。216時間目またはそれ以前に定常状態に到達した。図15に、216時間目から288時間目までの被験体の血中フェンタニル濃度に関する平均データの要約を示す。このデータは、定常状態の血中AUCssフェンタニル濃度を1日パッチ(n=20)の場合と3日パッチ(n=19)の場合を比較した時に近いことを示している。前記20人の被験体の中の一人には3日パッチを用いた試験を受けさせなかった。菱形は3日パッチが示したデータ点を表している。白丸は1日パッチが示したデータ点を表している。図15中、2種類のパッチが示したAUCssは近かったが、個々の被験体の間の差が大きいデータ点が4個(例えば242、243、245、252時間点)存在し、このようにデータの統計学的有意さに影響を与えた。
【0151】
表4Aおよび表4Bに、前記3日パッチが示した薬物動態パラメーターを前記1日パッチが示したそれと対比させた比較を示す。定常状態の条件の場合のデータは216時間目から288時間目までの72時間のデータであると見なした。AUCssデータを幾何平均および平均(CV%)として示す。CVは、平均値で割った標準偏差である。CmaxおよびCminを平均(CV%)として示す。
【0152】
表4Aに、1日パッチと3日パッチの両方を個別に貼り付けた19人の被験体(N=19)に関するデータを示す。このように、1日パッチのみを貼り付けた(3日パッチを個別には貼り付けなかった)被験体を排除した。
【0153】
【表4A】

【0154】
19人の被験体の中の5人が異常データ点を示した(即ち隣接するデータ点とは有意に異なるデータ点)。216時間目から288時間目の間に集めたサンプル中のフェンタニル代謝産物であるノルフェンタニルを分析した結果、異常データを示した5人の被験体全部が安定な代謝産物濃度を示すことが分かり、このことは、その5人の被験体が示した異常なデータは経皮フェンタニル輸送が原因ではないことを示している。分析を受けさせた5人の被験体の特定サンプルが大きな変動を示したのは汚染によるものである可能性が高かった。例えば、図16に、異常データを示した典型的な被験体の血清中フェンタニル濃度およびノルフェンタニル濃度を示す。菱形データ点を伴う曲線Fは1日パッチのフェンタニルデータを表す一方で、白丸データ点を伴う曲線NORは同じパッチ送達のノルフェンタニルデータを表している。240時間後のデータ点の中のいくつかはフェンタニル濃度の点で幅広い変動を示したが、代謝産物であるノルフェンタニルの濃度は同じ期間の間安定であった。血清中フェンタニル濃度が経皮送達によってそのように幅広くかつ急速に変動するのは物理的不可能である。このように、その期間の時のノルフェンタニル濃度は、送達されるフェンタニル量が変動したことを示すより良好な指標であった。表4Bに、異常値を示した被験体のデータを除いた後の表4Aのデータを示す。表4Bに示す被験体の数は14(N=14)である。
【0155】
【表4B】

【0156】
表4Bは、前記1日パッチが示したAUCss(216時間目から288時間目までのAUC(216−288)で示す)は幾何平均データを基にして前記3日パッチのそれの約0.9倍であることを示している。前記1日パッチが示したCmaxの幾何平均は3日
パッチのそれの約0.9倍であった。前記1日パッチが示したCminの幾何平均は3日パッチのそれの約1.0倍であった。変動度合(%)は1日パッチの場合が約70であるのに対して3日パッチの場合は約75であった。表4Bのみを考慮すると、表4B中のAUCss、CmaxおよびCminは1日パッチと3日パッチの間の差は僅かであることから前記1日パッチは前記3日パッチと生物学的に同等であると見なすことができる。表4Bのデータから、28cm2の1日パッチが体にもたらしたフェンタニルの量は100μg/時のDUROGESIC(商標)DTRANS(商標)のそれと生物学的に同等な量であった。28cm2のパッチの各々に入っているフェンタニルの量は約5.9mgであった。従って、100μg/時のDUROGESIC(商標)DTRANS(商標)パッチに入っている16.8mgのフェンタニルと同じ量のフェンタニルを送達するには1日パッチに入っているフェンタニル量を全体で17.7mg(3x5.9)にする。28cm2の1日パッチを使用した後の使用率は39%であると推定したが、これは100μg/時のDUROGESIC(商標)DTRANS(商標)パッチの場合のそれの43%より若干低いのみであった。しかしながら、1日当たり使用率は1日パッチの場合の方が有意に高かった。
【0157】
本発明の実施では、特に明記しない限り、製薬学的製品開発者が当該技術分野の技術の範囲内で用いる通常の方法を用いる。そのような技術は文献に詳細に説明されている。
【0158】
上述した典型的な態様はあらゆる面で限定ではなく本発明の例示であることを意図する。従って、本発明は詳細な実施の点で本明細書に含めた説明から当業者が引き出す可能性のあるいろいろな変形を受け得る。そのような変形および修飾形の全部が本発明の範囲内であると見なす。
【0159】
また、本発明の主たる特徴または態様は次のとおりである。
【0160】
態様1:経皮パッチを用いて薬を投与するためのキットであって、
(a)裏地層、
前記裏地層の上に位置している貯蔵層であって、少なくとも該貯蔵層の皮膚接触表面が接着性であり、かつ鎮痛を1日の間ヒトに誘発しかつ維持するに充分な量でフェンタニルを含有する重合体組成物を含有して成る、上記貯蔵層、
を含有して成る、フェンタニルを皮膚に通して投与するための経皮パッチであって、皮膚にパッチを毎日1枚ずつ取り替えて貼り付けることで鎮痛に有効な定常状態の血漿中濃度を達成する、上記経皮パッチ、および
(b)前記経皮パッチを毎日取り替えることに関する使用説明書を包含する使用説明書印刷物、
を含有して成るキット。
【0161】
態様2:前記重合体組成物がポリアクリレートを含有しかつ1日使用後の前記パッチ中の薬の使用率が少なくとも30重量%である態様1記載のキット。
【0162】
態様3:前記薬がフェンタニル塩基でありかつ前記貯蔵層がポリアクリレートから本質的に成る接着性重合体から作られた層でありそして1日使用後の前記パッチ中の薬の使用率が少なくとも35重量%である態様2記載のキット。
【0163】
態様4:前記パッチが定常状態の時に15から60ng/ml(mg/時)の正規化Cmaxおよび10から55ng/ml(mg/時)の正規化Cminを示す態様3記載のキット。
【0164】
態様5:前記パッチが0.1から20μg/cm2・時の定常状態薬流量を示す態様4記
載のキット。
【0165】
態様6:前記パッチが定常状態の時に15ng・時/mlから200ng・時/mlのAUCinfを示す態様3記載のキット。
【0166】
態様7:前記パッチが0.1から20μg/(cm2・時)の定常状態薬流量を示す態様6記載のキット。
【0167】
態様8:前記貯蔵層が0.14から0.3mg/cm2の濃度の量で溶解しているフェンタニル塩基を含有して成る態様2記載のキット。
【0168】
態様9:前記パッチが名目上1日送達でフェンタニル1mg当たりに有する投薬濃度に対して正規化された面積が8.5から16.5cm2である態様1記載のキット。
【0169】
態様10:前記貯蔵層がフェンタニル塩基溶解度が1重量%から25重量%の重合体を含有して成りかつ1日使用時に前記貯蔵層に残存するフェンタニル塩基の量が70重量%未満である態様8記載のキット。
【0170】
態様11:前記貯蔵層がフェンタニル塩基を貯蔵層面積当たり0.14から0.3mg/cm2含有して成りかつ前記パッチが名目上1日送達でフェンタニル1mg当たりに有する投薬濃度に対して正規化された面積が10.5から15cm2である態様8記載のキット。
【0171】
態様12:前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)である態様8記載のキット。
【0172】
態様13:前記貯蔵層が更に促進剤も含有して成る態様12記載のキット。
【0173】
態様14:経皮パッチ中に存在する接着剤もしくはマトリクス層が1種類のみでありかつ前記貯蔵層が促進剤を含有しない態様3記載のキット。
【0174】
態様15:前記裏地層が下記:ポリウレタン、ポリ酢酸ビニル、ポリ塩化ビニリデン、ポリエチレン、ポリエチレンテレフタレート(PET)、PET−ポリオレフィン積層物およびポリブチレンテレフタレートの中の少なくとも1種から選択される重合体を含有して成る態様3記載のキット。
【0175】
態様16:前記裏地層の厚みが0.012mm(0.5ミル)から0.125mm(5ミル)である態様3記載のキット。
【0176】
態様17:最初の日にパッチを2枚貼り付けそして次にその後の日毎にパッチを1枚ずつ貼り付けることによって1日の内に15から60ng/ml(mg/時)の定常状態正規化Cmaxおよび10ng/ml(mg/時)から55ng/ml(mg/時)の正規化Cminをもたらす態様3記載のキット。
【0177】
態様18:最初の日にパッチを1枚貼り付けそして次にその後の日毎にパッチを1枚ずつ貼り付けることによって3日間の内に15から60ng/ml(mg/時)の正規化Cmaxおよび10ng/ml(mg/時)から55ng/ml(mg/時)の正規化Cminをもたらす態様3記載のキット。
【0178】
態様19:前記パッチが示す定常状態(正規化Cmax−正規化Cmin)差が0.5n
g/ml(mg/時)から2ng/ml(mg/時)である態様18記載のキット。
【0179】
態様20:前記パッチが前記パッチを1回貼り付けた後に示す正規化Cmaxが0.01から0.2ng/ml・cm2である態様19記載のキット。
【0180】
態様21:前記パッチが示す定常状態薬流量が1から10μg/cm2・時である態様19記載のキット。
【0181】
態様22:フェンタニルが前記貯蔵層中で示す溶解度が7重量%から12重量%である態様17記載のキット。
【0182】
態様23:前記貯蔵層がポリアクリレートマトリクスを有するマトリクス貯蔵層でありかつ前記ポリアクリレートがアクリル酸2−ヒドロキシエチル単量体を5−10重量%、酢酸ビニルを20−40重量%およびアクリル酸2−エチルヘキシルを55−75重量%有する態様3記載のキット。
【0183】
態様24:前記貯蔵層がNational Starch DURO−TAK(商標)87−4287接着剤であるポリアクリレートマトリクスを有するマトリクス貯蔵層である態様3記載のキット。
【0184】
態様25:重合体組成物を含有しかつフェンタニルを鎮痛を1日の間ヒトに誘発しかつ維持するに有効な量で含有する接着性フェンタニル貯蔵層を裏地層の上に含有して成るフェンタニル投与用経皮パッチであって、皮膚に毎日取り替えて貼り付けることで15から60ng/ml(mg/時)の定常状態正規化Cmaxおよび2から60ng/ml(mg/時)の正規化Cminを達成しかつ前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)でありそして1日使用後に前記パッチが示すフェンタニル使用率が少なくとも35重量%である、上記経皮パッチ。
【0185】
態様26:フェンタニル塩基の投与を必要としているヒトにそれを投与する方法であって、定常状態の送達が鎮痛維持に有効なようにモノリス経皮パッチを皮膚に毎日1枚ずつ取り替えて貼り付けることを含んで成り、該パッチが、裏地並びにポリアクリレートおよびフェンタニル塩基を含有する重合体組成物を含有して成る貯蔵層、を含有する上記方法。
【0186】
態様27:毎日取り替える時に前記パッチが1日使用後に示すフェンタニル塩基使用率が少なくとも35重量%である態様26記載の方法。
【0187】
態様28:更に前記ヒトがオピオイドの投薬を受けていないことを決定しかつ最初の日そしてパッチを毎日1枚ずつ取り替える時に貼り付けるパッチが1枚のみであることも含んで成る態様26記載の方法。
【0188】
態様29:更に前記ヒトがオピオイドの投薬を受けていないことを決定しかつ最初の日そして血漿中のフェンタニル濃度が2日間の間定常状態の範囲であるように前日のパッチの代わりに新しいパッチを毎日貼り付ける時にパッチを1枚貼り付けることも含んで成る態様26記載の方法。
【0189】
態様30:更にパッチを貼り付ける1日目に前記ヒトがオピオイドに耐性があることを決定しかつ最初の日にパッチを2枚貼り付けそして2日目から開始して血漿中のフェンタニル濃度が1日の間鎮痛に有効であるように前日のパッチの代わりに新しいパッチを毎日貼り付けることも含んで成る態様26記載の方法。
【0190】
態様31:更にパッチを貼り付ける最初の日に前記ヒトの医療記録に従って前記ヒトがオピオイドに耐性があることを決定しかつ最初の日にパッチを2枚貼り付けそして2日目から開始して血漿中のフェンタニル濃度が1日の間鎮痛に有効であるように前日のパッチの代わりに新しいパッチを毎日貼り付けることも含んで成る態様26記載の方法。
【0191】
態様32:前記パッチが定常状態の時に15から60ng/ml(mg/時)の正規化Cmaxおよび10から55ng/ml(mg/時)の正規化Cminを示す態様26記載の方法。
【0192】
態様33:前記パッチが0.1から20μg/(cm2・時)の定常状態薬流量を示す態様26記載の方法。
【0193】
態様34:前記パッチが示す定常状態(正規化Cmax−正規化Cmin)差が0.5ng/ml(mg/時)から2ng/ml(mg/時)である態様26記載の方法。
【0194】
態様35:前記パッチが示す定常状態薬流量が0.1から20μg/(cm2・時)でありかつ前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)である態様26記載の方法。
【0195】
態様36:前記貯蔵層が20mg/gmから200mg/gmの濃度の量で溶解しているフェンタニルを含有して成る態様26記載の方法。
【0196】
態様37:前記貯蔵層がフェンタニル塩基溶解度が1重量%から25重量%の重合体を含有して成る態様26記載の方法。
【0197】
態様38:前記貯蔵層がフェンタニル塩基を貯蔵層の面積当たり0.14から0.3mg/cm2含有して成りかつ前記パッチが名目上1日送達でフェンタニル1mg当たりに有する投薬濃度に対して正規化された面積が10.5から15cm2である態様26記載の方法。
【0198】
態様39:前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)である態様26記載の方法。
【0199】
態様40:前記貯蔵層が1日使用後に有する残存フェンタニル塩基が30重量%未満である態様26記載の方法。
【0200】
態様41:鎮痛のためにフェンタニルの投与を必要としているヒトにそれを投与するための経皮パッチの製造におけるフェンタニル塩基の使用であって、前記経皮パッチが、フェンタニル貯蔵層を裏地層の上に含有して成り、前記貯蔵層が、ポリアクリレート並びに1日の使用毎に1枚のパッチで鎮痛を1日の間ヒトに誘発しかつ維持するためのフェンタニル塩基を含有する重合体組成物を含有して成り、かつ皮膚に毎日取り替えて貼り付けることで15から60ng/ml(mg/時)の定常状態正規化Cmaxおよび10から55ng/ml(mg/時)の正規化Cminが達成され、かつ前記フェンタニル塩基が前記貯蔵層中で示す溶解度が少なくとも4重量%であり、前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)でありかつ1日使用後の前記パッチ中のフェンタニル塩基使用率が少なくとも35重量%である使用。
【産業上の利用可能性】
【0201】
本発明は、副作用を低減し、乱用を防止できる、フェンタニルによる鎮痛を効果的にもたらす、経皮パッチ等を提供できる。したがって、例えば、医薬製造業で利用できる。
【技術分野】
【0001】
本開示は、薬を経皮投与するための方法および送達デバイスに関する。例えば、オピオイド薬を送達するための経皮パッチおよびオピオイド薬を経皮投与する方法を記述する。
【背景技術】
【0002】
オピオイド薬は公知でありかつ様々の薬製品の中に含まれている。例えば、フェンタニルおよびこれの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどは強力な合成オピオイドであり、これらはヒトおよび獣医両方用の薬剤として使用可能であることが示されている。アルフェンタニル、フェンタニル、レミフェンタニルおよびスフェンタニルは全身麻酔薬として規制当局によってヒト用薬剤に用いる許可が与えられている。フェンタニルおよびこれの類似物を急性および慢性両方の痛みを治療する目的で経皮投与することは特許および公開出願の中で示唆されている(例えば特許文献1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20および21を参照)。その上、また、フェンタニル含有製品(フェンタニル含有経皮パッチを包含)も慢性痛を治療する時の鎮痛薬として市販されている。
【0003】
経皮パッチ形態の例にはモノリスおよび多層デバイスが含まれる。モノリスデバイスは比較的簡単であり、接着性モノリスが薬含有貯蔵層を含有していてそれが裏地の上に位置することを特徴とし得る。そのようなデバイスに入っている薬含有貯蔵層は典型的に製薬学的に許容される感圧接着剤から作られたものである。ある場合には、その薬含有貯蔵層が非接着性材料から作られることもあり得、それの皮膚接触表面に適切な接着剤の薄層が与えられている。そのようなパッチから当該薬が患者に投与される速度は、薬の皮膚透過性が通常の人から人および皮膚部位から皮膚部位で異なることが理由で多様であり得る。多層もしくは多積層デバイスには1つ以上の膜と結合しているマトリクス薬貯蔵層もしくは液体貯蔵層が含まれている可能性がある。例えば、多積層パッチの場合には薬放出速度を制御する膜を薬貯蔵層と皮膚接触接着剤の間に位置させることができる。放出速度制御膜は、薬がパッチから放出される速度を制御することによって、皮膚透過性が多様である影響を低くする働きをする。
【0004】
モノリスおよび多層デザインに加えて、経皮パッチの薬含有貯蔵層は、薬を貯蔵層中に完全に溶かす能力を有する貯蔵層(飽和状態ではないパッチ、例えば特許文献22、23、24、25、26、27、28、29、30、31、32、33および34を参照)または飽和濃度以上の溶解していない薬が過剰量で入っている可能性のある貯蔵層(持続性薬パッチ)のいずれかである。経皮パッチは皮膚を貫く拡散によって薬を送達することから、その薬がパッチから送達される速度は一般にフィックの法則に左右され、典型的には、当該貯蔵層に入っている薬の飽和度合に比例する。
【0005】
鎮痛用経皮パッチとして幅広く入手可能なフェンタニル製品はDURAGESIC(商標)パッチである。例えば、前記パッチおよびそれの使用が記述されているラベルを参照(例えば非特許文献1)。フェンタニルが感圧接着剤に溶解している別のフェンタニルパッチであるDUROGESIC(商標)DTRANS(商標)[またはDUROGESIC(商標)SMAT]マトリクスパッチを鎮痛用経皮パッチとして特定の国で入手することができる(非特許文献2を参照)。前記DUROGESIC(商標)DTRANS(商標)経皮パッチは、フェンタニルを3日間投与する製品であり、術後もしくは他の急性痛とは対照的に慢性痛の治療で処方される。このDUROGESIC(商標)DTRANS(商標)マトリクスフェンタニルパッチは、慢性痛から解放されるように3日間が終了す
る毎に逐次的に剥がして代わりに新しいパッチを新しい皮膚部位に貼り付けることを意図したものであり、かつ投与量を経時的に多くしてもよくそして抑えきれない痛みに対処する目的で他の鎮痛薬を同時に使用してもよいことを意図したものである。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第4,466,953号
【特許文献2】米国特許第4,470,962号
【特許文献3】米国特許第4,588,580号
【特許文献4】米国特許第4,626,539号
【特許文献5】米国特許第5,006,342号
【特許文献6】米国特許第5,186,939号
【特許文献7】米国特許第5,310,559号
【特許文献8】米国特許第5,474,783号
【特許文献9】米国特許第5,656,286号
【特許文献10】米国特許第5,762,952号
【特許文献11】米国特許第5,948,433号
【特許文献12】米国特許第5,985,317号
【特許文献13】米国特許第5,958,446号
【特許文献14】米国特許第5,993,849号
【特許文献15】米国特許第6,024,976号
【特許文献16】米国特許第6,063,399号
【特許文献17】米国特許第6,139,866号
【特許文献18】米国出願番号2003002682
【特許文献19】米国出願番号20050208117
【特許文献20】米国出願番号2002119187
【特許文献21】米国出願番号20040234584
【特許文献22】米国特許第4,704,282号
【特許文献23】米国特許第4,725,439号
【特許文献24】米国特許第4,867,982号
【特許文献25】米国特許第4,908,027号
【特許文献26】米国特許第5,004,610号
【特許文献27】米国特許第5,152,997号
【特許文献28】米国特許第5,164,190号
【特許文献29】米国特許第5,342,623号
【特許文献30】米国特許第5,344,656号
【特許文献31】米国特許第5,364,630号
【特許文献32】米国特許第5,462,745号
【特許文献33】米国特許第5,633,008号
【特許文献34】米国特許第6,165,497号
【非特許文献】
【0007】
【非特許文献1】Physicians Desk Reference、58版、2004、1751−1755頁
【非特許文献2】インターネットを通してhttp://emc.medicines.org.uk.で公にアクセス可能なSummary of Product Characteristics of “DUROGESIC(R) DTRANS(R) transdermal patch” and DUROGESIC(R) DTRANS(R) transdermal patch “Patient Information Leaflet”
【発明の概要】
【0008】
本開示は、オピオイド薬を経皮投与するためのデバイスおよび方法を提供するものである。例えば、特定の態様において、本開示は、オピオイド薬を鎮痛を誘発してほぼ1日持続する治療期間に渡って維持するに充分な量および目標の速度で経皮送達するための日に1回のパッチ(1日パッチ)を提供するものである。そのような態様において、本パッチに入れて送達するオピオイドはフェンタニルまたはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上であってもよい。各態様において、本明細書に記述する如き経皮パッチはヒト患者に投与する目的で調製可能である。
【0009】
本開示は、経皮パッチに加えて、オピオイド薬を投与する方法も提供する。特定の態様において、本明細書に記述する方法は、フェンタニルまたはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上から選択したオピオイドを投与することを包含する。そのような態様の一例として、本方法は、フェンタニルまたはこれの類似物の中の1つ以上が送達されるように考案した少なくとも1枚のパッチを患者に貼り付けた後に前記少なくとも1枚のパッチの中の少なくとも1枚を3日毎より多い頻度、例えば2日毎より多い頻度または毎日剥がして取り替えることを包含する。
【図面の簡単な説明】
【0010】
本開示を添付図の図中に限定するものではない態様の例として例示し、図中の同様な参照記号は同様な要素を示す。内容の中で特に示さない限り、本図は原寸で示すものでない。グラフ中のデータ点と連結している垂直線は標準偏差を示す線である
【図1】図1に、1つの態様の経皮治療システムを貫く図式断面図を示す。
【図2】図2に、別の態様の経皮治療システムを貫く図式断面図を示す。
【図3】図3に、1日経皮フェンタニルパッチを日に1回貼り付ける模擬の血中薬濃度を3日経皮フェンタニルパッチを3日毎に1回貼り付けた時の定常状態のそれと対比させた比較を示す。
【図4】図4に、1日経皮フェンタニルパッチを日に1回貼り付ける模擬の血中薬濃度を3日経皮フェンタニルパッチを3日間貼り付けた時の実際の実験データと対比させた比較を示す。
【図5】図5に、1日経皮フェンタニルパッチを日に1回貼り付ける模擬の血中薬濃度を3日経皮フェンタニルパッチを3日間貼り付けた時の実際の実験データと対比させた別の比較を示す。
【図6】図6に、いろいろな投薬濃度の3日パッチを用いて経時的に集めた実際の血清中フェンタニル濃度を示す。
【図7】図7に、3日フェンタニル経皮パッチを毎日新しいパッチに取り替えて投与した時の血清中フェンタニル濃度実験結果を示す。
【図8】図8に、マトリクス薬層の厚みを変えた時に被験体の血中フェンタニル濃度に関する平均データ(被験体全体に渡る)の要約を示す。
【図9】図9に、1日パッチを繰り返し貼り付けることによるフェンタニル濃度の模擬データを3日パッチを336時間に及んで貼り付けた時のそれと対比させて示す。
【図10】図10に、1日パッチの場合の216時間目から288時間目までの被験体の血清中フェンタニル濃度の平均データ(被験体全体に渡る)を3日パッチの場合のそれと比較した要約を示す。
【図11】図11に、図10の定常状態3日パッチデータを図9のデータから見積もった模擬定常状態3日パッチデータと対比させた比較を示す。
【図12】図12に、図10の定常状態1日パッチデータを図9のデータから見積もった模擬定常状態1日パッチデータと対比させた比較を示す。
【図13】図13に、いろいろな投薬濃度の1日フェンタニルパッチを1日貼り付けた時の血清中フェンタニル濃度のデータを示す。
【図14】図14に、1つの態様の1日パッチを貼り付けた時の定常状態の被験体の血中フェンタニル濃度の平均データ(被験体全体に渡る)を3日パッチのそれと対比させた要約を示す。
【図15】図15に、別の態様の1日パッチを貼り付けた時の定常状態の被験体の血中フェンタニル濃度の平均データ(被験体全体に渡る)を3日パッチのそれと対比させた要約を示す。
【図16】図16は、1日パッチを用いてフェンタニルを投与したある被験体におけるフェンタニルおよびこれの代謝産物であるノルフェンタニルの血清中濃度を示すグラフである。
【0011】
詳細な記述
本明細書では、オピオイド薬を送達するための経皮パッチを記述する。また、オピオイド薬を送達する方法も提供し、特定の態様において、本発明の方法は、本明細書に記述する如き経皮パッチを患者に1枚以上貼り付けることを包含する。いくつかの態様において、本開示は、鎮痛の目的で1日(時には便利さの目的で「QD」と呼ぶ)フェンタニルパッチを毎日取り替えることを提供する。特定の態様において、本明細書に記述するように患者の皮膚に1枚のパッチを毎日取り替えて貼り付けると治療的に有効な範囲内の定常状態血漿中濃度が達成され得る。このように、皮膚に貼り付けるパッチが1枚のみの場合、そのパッチを毎日取り替えることで治療的に有効な範囲内の定常状態血漿中プロファイルが達成されるであろう。本明細書に記述するパッチで送達すべき典型的なオピオイドには、フェンタニルおよびフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上が含まれる。本明細書に記述する如きパッチに入れて送達可能なフェンタニルの典型的な形態はフェンタニルの塩基形態である。
【0012】
フェンタニルを送達するための多日経皮パッチ、例えばDUROGESIC(商標)DTRANS(商標)マトリクスパッチなどを3日毎ではなく日に1回取り替えて貼り付けると血漿中フェンタニル濃度が最初の3回の投与に渡って急速に高くなり、その結果として、血漿中薬濃度が同じパッチを3日毎に取り替えた時に達成される定常状態濃度よりも高くなることを確認した。所定理論で制限するものでも範囲を限定するものでもないが、取り替える時に使用済みパッチを剥がすことでその古いパッチと新しいパッチを同時に皮膚上に存在させなくてもその古いパッチに由来する薬がある量で使用者の組織の中に保持されることでそれがその使用者から排泄されるまでに有意な時間要する結果として持続性薬の影響が生じることから達成させる性能がそのようであると考えている。例えば、経皮送達されたフェンタニルの半減期はそのような持続性薬の影響が理由で静脈内投与されたフェンタニルのそれに比べて極めて長いことを確認した。
【0013】
パッチを取り替えるのが3日毎または4日毎のみである場合、血漿中フェンタニル濃度蓄積に対してそのような持続性薬が示す影響は比較的目立たない可能性がある。しかしながら、3日パッチを患者に毎日取り替えて貼り付けた時に達成される血漿中薬濃度はその3日パッチを3日毎または4日毎に貼り付けた時のそれよりも高いことを確認した。このように、毎日取り替えて患者に貼り付ける本発明に従う経皮パッチは多日パッチ、例えば3日パッチなどに比べて相対的に小型であってもよくそして/または充填する薬の量も比較的少なくてもよいが、それでも、治療的に有効な血漿中薬濃度を達成して維持し得ることを見いだした。特に、多日経皮パッチを用いてオピオイド薬、例えばフェンタニルなどの目標血漿中濃度を達成して維持する目的で現在入手可能な多日パッチ、例えば現在入手可能な3日経皮フェンタニルパッチなどより小型のパッチシステムを用いることができることを見いだした。いくつかの態様において、本発明に従う1日パッチに含有させる薬の
充填量は従来の3日パッチの半分以下であるが、それでも、それを用いて毎日取り替えて貼り付けると治療的に有効な目標の血漿中オピオイド薬濃度が達成されそして/または維持され得る。更にその上、我々は、本明細書に記述する如き経皮パッチを1枚毎日取り替えて貼り付けることで治療的に有効な目標の血漿中オピオイド薬濃度を達して維持することができることも見いだした。勿論、毎日取り替えて貼り付けるパッチが1枚のみであったとしても結果として吸収される薬の量に有意な差がないならば患者に貼り付けられているままであるパッチが2枚以上である重り合い時間がある程度存在してもよく、例えば取り替える間に経過する時間が数秒間または数分間でさえあっても構わないことを意図する。
【0014】
本開示は、使用者が治療濃度のオピオイド薬を目標のCmaxを超えることなく送達して維持することを可能にする経皮パッチおよび方法を提供するものである。その上、本明細書に記述する経皮パッチおよび方法は、送達すべきオピオイドのCmaxとCminの間の変動を狭くしながらオピオイド薬の好ましい定常状態送達をもたらすものである。本明細書に記述するパッチおよび方法を用いて送達すべき薬のCmaxとCminの変動を制御することは当該薬の治療効果の維持および起こり得る副作用の制御に役立つ。本明細書に記述する経皮パッチの態様におけるパッチは、オピオイド薬を1日パッチが示すCmaxとCminの間の差が同じオピオイドを送達する目的で考案された多日パッチが達成するそれよりも小さくなるように送達する1日パッチである。
【0015】
特定の態様において、本明細書に記述するパッチが示す1日当たりの薬使用重量%は多日パッチのそれに比べて高い。例えば、1つのそのような態様では、本明細書に記述するパッチをオピオイド薬を送達するに適していて1日当たりの薬使用重量%が同じ薬、例えばフェンタニル塩基などが用いられている多日パッチ、例えばDUROGESIC(商標)DTRANS(商標)マトリクスパッチなどのそれに比べて高くなるように構築および配置する。いくつかの態様では、本明細書に記述するパッチに含有させるオピオイド薬の含有量を現在入手可能な製品もしくは多日オピオイドパッチのそれに比べて低くすることができる。いくつかの態様において、本開示は、1日後のオピオイド薬使用パーセントが多日パッチを数日使用することでもたらされるオピオイド薬使用パーセントに近い1日パッチを提供するものである。1つのそのような態様では、1日使用後のフェンタニル使用パーセントが3日フェンタニルマトリクスパッチを3日間使用した後にもたらされるフェンタニル使用パーセントに近い1日フェンタニルパッチを記述する。本明細書に記述する態様のパッチを用いると薬充填率を比較的低くすることができかつ薬使用重量%を高くすることができることで、使用後のパッチに残存する残存薬の量が少なくなる可能性があり、そのような特性によって、そのような態様に従うパッチが乱用または不法な使用を受け得る危険性が低下し得る。
【0016】
また、本明細書に記述する1日パッチは使用者の便利さの向上をもたらす可能性もあり、それによって患者の服薬順守度が高くなる可能性がある。ある場合には、経皮パッチを毎日少なくとも短時間剥がす方が好ましい可能性がある。例えば、多日オピオイドパッチを用いる場合には、入浴中に前記パッチを剥がす方が好ましい可能性がある、と言うのは、多量の水に浸かるか或はさらされると薬が当該パッチからある量で出て行く可能性があるからである。その上、人は習慣の奴隷であることから、毎日取り替える決まった行動は3日毎または4日毎に取り替えるよりも服薬順守により役立つ可能性もある。
【0017】
本記述に従う経皮パッチは裏地層および前記裏地層の上に位置する薬貯蔵層を含有し得る。特定の態様において、前記貯蔵層の皮膚接触表面は接着性であってもよく、前記貯蔵層は、オピオイドが鎮痛を患者に誘発して約1日維持するに充分な量で入っている重合体組成物を含有する。そのような態様における薬貯蔵層は溶解していないオピオイド薬を含有するか或は含有していなくてもよい。従って、いくつかの態様における薬貯蔵層は、溶
解していないオピオイドを含有せずかつ場合により溶解していない材料を薬貯蔵層接着剤中にも含有していなくてもよい。別法として、他の態様では、本明細書に記述する如き経皮パッチの薬貯蔵層は溶解していないオピオイドを含有していてもよい。
【0018】
本明細書に記述する如きパッチを用いて送達可能な典型的なオピオイドには、フェンタニルおよびフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上が含まれる。各態様において、本明細書に記述するパッチの構成および構築はヒト患者に投与するに適するように実施可能である。
【0019】
1つの態様において、本開示は、パッチを毎日取り替えることで鎮痛を誘発して維持するに充分な投与速度でオピオイドを経皮送達するための速度非制御モノリスパッチ(速度制御膜を伴わない)を提供するものである。1つのそのような態様における薬は、フェンタニル、例えば塩基形態のフェンタニルなどであってもよい(イオン化していない形態のフェンタニルを貯蔵層内に存在させる)。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上であってもよい。1つのそのような態様におけるパッチは、裏地層および前記裏地層の上に位置する薬貯蔵層を含有する。前記薬貯蔵層の皮膚接触表面は接着性であってもよく、そして前記貯蔵層は、オピオイド、例えばフェンタニル塩基などが鎮痛をヒトに誘発して1日維持するに充分な量で入っている重合体組成物(溶解していていない成分が入っているか或は入っていない)を含有し得る。そのような態様は、そのようなパッチを1枚貼り付けて毎日取り替えることで治療的に有効な範囲の定常状態血漿中濃度を達成しようとする方法で利用可能である。
【0020】
本開示では、オピオイド薬の投与を必要としている被験体にそれを投与する方法を提供する。1つの態様において、本明細書に記述する方法は、1枚の経皮パッチを被験体の皮膚に治療範囲内の定常状態血漿中プロファイルが達成されるように貼り付けた後に毎日取り替えることを包含する。1つのそのような態様で用いるパッチは、裏地層およびオピオイド薬を含有する重合体組成物を有する薬貯蔵層を含有する。1つのそのような態様のパッチで送達する薬はフェンタニルであり、それを前記貯蔵層内に(イオン化していない)塩基形態で存在させてもよくかつそれをポリアクリレート系接着剤に溶解させてもよい。特定の態様では、溶解していないフェンタニルを存在させてもよい。他のそのような態様において、本パッチで送達する薬はフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上であってもよい。その上、そのような態様の各々において、オピオイドの投与を必要として被験体はヒト被験体であってもよい。
【0021】
別の態様において、本開示では、治療範囲内の血漿中オピオイド薬プロファイルが1日の間達成されるように最初に2枚以上のパッチを1日目に貼り付けた後に2日目から開始して前日のパッチの代わりに新しいパッチを毎日貼り付けることでオピオイド薬の投与を必要としている被験体にそれを投与する方法を提供する。そのような態様では、2枚以上のパッチの中のいくつかを1日目の後の日に剥がしてもよくそして鎮痛の目的で所定時に被験体の定常状態で皮膚に貼り付けられたままであるパッチが1枚のみであるようにそれを取り替えなくてもよい。1つのそのような態様で用いるパッチはオピオイド薬を含有する重合体組成物を有する薬貯蔵層および裏地層を含有する。1つのそのような態様において、本パッチで送達する薬はフェンタニルであり、それを(イオン化していない)塩基形態で貯蔵層内に存在させてもよく、かつそれをポリアクリレート系接着剤に溶解させてもよい。特定の態様では、溶解していないフェンタニルを存在させなくてもよい。他のそのような態様において、本パッチで送達する薬はフェンタニルの類似物、例えばアルフェン
タニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上であってもよい。その上、そのような態様の各々において、オピオイドの投与を必要として被験体はヒト被験体であってもよい。
【0022】
さらなる態様では、本発明の方法に、患者が麻薬性オピオイドに耐性のあるヒトであるか或は麻薬性オピオイドの投薬を受けていないかを決定する追加的段階を含めてもよい。そのような情報は、例えば当該患者の医療記録などを基にして入手可能であり、その後にそれをそのヒトに推奨することができる投薬量もしくは投与療法の決定で用いることができる。例えば、ある患者がオピオイドに耐性がある場合、有効な痛み管理をもたらす目的で、血中オピオイド薬濃度を目標の定常状態濃度にまで比較的迅速に高める必要があり得る。そのような場合には、最初にそのヒトの皮膚にパッチを2枚以上貼り付けた後に皮膚に貼り付けるパッチの数を少なくすることでオピオイド薬の濃度を治療的定常状態濃度に迅速にもって行くことができる。別法として、ある患者がオピオイドの投薬を受けていないと決定される場合、そのような患者は、血中オピオイド濃度が相対的に低くなるようにした方が利益を受ける可能性がある。従って、オピオイドの投薬を受けていない患者は、最初に貼り付けるパッチを1枚のみにした後に毎日取り替えることで利益を得る可能性がある。オピオイドの投薬を受けていない患者の特定の症例では、2−3日で定常状態の目標血漿中濃度を達成するのが好ましいことを決定してもよい。最初に1日目に貼り付けるパッチを1枚のみにすることで開始する療法では、当該患者がオピオイドの投薬を受けていない性質を有することが理由で、受け入れられる鎮痛が起こりかつ更に達成されるように徐々に多くして行く。本明細書で用いる如き「オピオイドの投薬を受けていない」患者は、当該薬に対して顕著な耐性がいくらか生じるほどには前記薬にさらされていない患者である。本明細書で用いる如き「オピオイドに耐性のある」患者は、当該薬に対して顕著な耐性がいくらか生じるような度合で前記薬にさらされた患者である。
【0023】
さらなる態様において、本開示では、経皮オピオイドパッチを使用説明書印刷物と一緒に含有するキットを提供する。その使用説明書印刷物は挿入物であってもよいか或は容器または包装材の上に与えられていてもよく、それによって、使用者に使用に関する説明を与える。例えば、そのような使用説明書印刷物に、各パッチを貼り付ける方法、各パッチを患者に貼り付けておく時間および各パッチを剥がして新しいパッチに取り替える頻度を記述しておいてもよい。
【0024】
定義
本技術の記述では、下記の用語を用いかつ以下に示すように定義する。本明細書および添付請求項で用いる如き単数形「a」、「an」および「the」は、本文の内容で他であると明確に示さない限り、複数言及を包含する。
【0025】
本明細書で用いる如き用語「経皮」は、薬を局所投与してそれが全身循環に入り込むようにする薬投与入り口として皮膚、粘膜および/または他の体表面を用いることを指す。
【0026】
本明細書で用いる如き用語「薬」は、ある種の生物学的、有益、治療的または他の意図した効果、例えば健康障害の症状の軽減などをもたらすことを意図した材料のいずれかを指すが、主要な効果が別の生物学的に有効な作用剤、例えば治療薬などを経皮送達しようとする時の補助である作用剤(例えば透過促進剤)などは指さない。
【0027】
本明細書で用いる如き用語「治療的に有効」は、所望の治療結果をもたらすに必要な薬量または薬投与率を指す。
【0028】
本明細書で用いる如き用語「透過促進剤」は、ある薬が透過促進剤の存在下で皮膚を透過する度合の方が前記薬が透過促進剤の存在無しに皮膚を透過する度合に比べて高いこと
を意図する。透過促進剤の「透過促進量」は、その透過促進剤の量が当該薬が体表面で示す透過性を向上させて前記薬が治療的に有効な速度で送達されるようにするに充分な量である。
【0029】
本明細書で用いる如き「アクリレート」、「ポリアクリレート」または「アクリル重合体」を接着剤または接着剤前駆体用の重合体を指す時に用いる場合、それはアクリル酸、これのエステル1種または2種以上、アクリルアミドまたはアクリロニトリルの重合体もしくは共重合体を指す。特に明記しない限り、それはホモ重合体、共重合体またはホモ重合体および/または共重合体の混合物であってもよい。
【0030】
本明細書で用いる如き用語「フェンタニルの類似物(本明細書では以降「類似物」と呼ぶ」は、アルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの如き効力のある有効な鎮痛薬を指す。典型的な形態はフェンタニルもしくは類似物の塩基形態である。
【0031】
本明細書で用いる如き用語「飽和状態ではないパッチ」は、当該薬の濃度が溶解度限界未満であるパッチを指す。「飽和状態のパッチ」は、分散している薬(例えばフェンタニル塩基)の固体または液体を貯蔵層中に飽和濃度より高い濃度で含有する製剤を指す。
【0032】
本明細書で用いる如き用語「単相重合体組成物」は、当該薬および他のあらゆる成分が重合体の中に溶解していることで当該組成物中に存在する溶解していない成分が投与期間の実質的部分に渡って存在せずかつ前記成分の全部が前記重合体と一緒に単相を形成するように貯蔵層中に飽和濃度以下、例えば未満の濃度で存在する組成物を指す。
【0033】
本明細書で用いる如き用語「成分」は、薬貯蔵層内の要素を指し、それには、これらに限定するものでないが、この上で定義した如き薬、添加剤、透過促進剤、安定剤、染料、希釈剤、可塑剤、粘着付与剤、顔料、担体、不活性充填剤、抗酸化剤、賦形剤、ゲル化剤、抗刺激剤、血管収縮剤などが含まれる。
【0034】
本明細書で用いる如き「速度制御膜」は、薬の放出速度を制御する膜を指し、それを薬含有貯蔵層と体表面の間に位置させるが、それは当該薬が貯蔵層から体表面に伝達される速度を制御する機能を果たす。「速度非制御」フェンタニルパッチは、速度制御膜を伴わないパッチを意味する。
【0035】
「DURAGESIC(商標)フェンタニルパッチ」は、この上で考察した如きフェンタニルパッチ(またPhysicians Desk Reference、58版、2004、1751−1755頁も参照)を指す。「DUROGESIC(商標)SMATマトリクスパッチ」および「DUROGESIC(商標)DTRANS(商標)経皮パッチ」は、フェンタニルがポリアクリレートマトリクスに入っている経皮送達パッチを指し、これはドイツおよび英国のそれぞれにおいてJanssen−Cilagから入手可能である(公に入手可能なSummary of Product Characteristics of “DURAGESIC(R) DTRANS(R) transdermal patch” and DUROGESIC(R) DTRANS(R) transdermal patch “Patient Information Leaflet”を参照)。
【0036】
用語「AUC」は、被験体における有益剤の血清中濃度を投薬開始時から投薬開始後の時間「t」まで測定した時間と対比させてプロットすることによってその被験体に関して得た曲線下の面積を意味する。AUCinfは、時間を無限にまで延長した曲線下の面積である。定常状態の場合のAUCssは、投薬を時間的に無限に実施した場合のある投薬
期間の間の曲線下の面積である。患者から得た血清サンプルを検定することでAUCを得ることができる。また、実験で得たデータを基にした模擬によって構築した血清中フェンタニル濃度プロファイルに関するAUCも得ることができる。薬物動態が線形である時にはAUCssとAUCinfが同じであると予測する。経皮フェンタニル製品の場合、AUCssとAUCinfは生物学的に等しいことが示されている[Sathyan他、「Evaluation of the bioequivalence of two transdermal fentanyl systems following single and repeat applications」、Current Medical Research and Opinion 21(12)、1961−1968、2005]。
【0037】
本明細書で用いる如き用語「Cmax」は、薬、例えばフェンタニルもしくはこれの類似物などのピーク血中もしくは血漿中濃度を指す。
【0038】
本明細書で用いる如き用語「Cmin」は、薬、例えばフェンタニルもしくはこれの類似物などの谷血中もしくは血漿中濃度を指す。
【0039】
本明細書で用いる如き用語「正規化Cmax(ng/ml/(mg/時)」は、Cmax(ng/ml)を名目上の薬投与速度(mg/時)で割った値を指す。同様に、正規化Cminも同様な様式のCminに相当する。前記名目上の薬投与速度は、当該製品を使用期間中に送達するように考案した平均薬投与速度である(典型的には製品のラベルに記述されている速度)。
【0040】
本明細書で用いる如き用語「生物学的利用能」は、有効成分もしくは有効部分が薬製品から吸収されて作用部位で有効になる速度および度合を指す。その速度および度合を薬物動態パラメーター、例えば薬のピーク血中もしくは血漿中濃度(Cmax)および血中もしくは血漿中薬濃度−時間曲線下の面積(AUC)などを用いて確立する。
【0041】
本明細書の以下により詳細に記述する如き数種のインビボおよびインビトロ方法で実証するように、異なる2種類の製品を同様な実験条件下で検査した時にそれらが実質的に同じ治療効果をもたらすならば、それらは「薬理学的に同等である」と見なす。治療効果は、本明細書の以下により詳細に記述するように、様々な要因、例えば当該薬剤の効力、当該薬剤が薬貯蔵層中に入っている濃度、当該薬剤が皮膚中で示す溶解度および拡散度、皮膚の厚み、当該薬剤が貼り付け部位内で示す濃度などに依存する。一般的には、曲線下の面積(AUC)などの如き測定値を用いて薬理学的同等性を立証する。
【0042】
AUC、CmaxおよびCminは、パッチの特徴に関連したパラメーターである。薬投与速度に関して正規化したピーク血中もしくは血漿中薬濃度(即ち以下に定義する如き正規化Cmax)は、パッチの特徴に関連したパラメーターである。
【0043】
同じ薬に関して異なる2種類の製品を比較しようとする時、規制当局(例えばFDA)の生物学的同等性指針に従い、AUCおよびCmax値が同様であることで生物学的同等性を確立することができる。
【0044】
経皮パッチ
典型的な経皮薬送達システムを図1および2に示す態様で例示する。図1および2に示すように、経皮モノリスパッチ1の態様は、裏地層2、前記裏地層2の上に位置する薬貯蔵層3および引き剥がし可能な保護層5を有する。貯蔵層3は層であってもよく、少なくともそれの皮膚接触表面4は接着性である。前記貯蔵層は、経皮送達用の製薬学的作用剤(または薬)を担持するに適したマトリクス(担体)である。内容の中で他であると明確
に示さない限り、「マトリクス」は、他の材料、例えば薬などを伴うか或は伴わない担体材料を指すことを意味し得る。1つの態様では、薬および他の任意の材料を伴うマトリクス全体が所望の接着特性を有する材料である。貯蔵層3は単相の重合体組成物または多相の重合体組成物のいずれかであり得る。単相重合体組成物の場合、その中に薬および他の成分の全部がそれらが貯蔵層3中で示す飽和濃度以下、好適には未満の濃度で存在する。それによって、あらゆる成分が溶解している組成物がもたらされる(即ち貯蔵層に入っている接着性重合体に溶解している)。他の態様における貯蔵層に入っている薬は固体または液体であり得かつ溶解濃度より高いと理解されるべきである。体表面に貼り付けるに適した許容される接着性を示し得る製薬学的に許容される重合体材料を用いて貯蔵層3を生じさせる。多相重合体組成物の場合、その中に少なくとも1種の成分、例えば治療薬などを飽和濃度より多い量で存在させる。いくつかの態様では、2種以上の成分、例えば薬と透過促進剤または重合体材料などを飽和濃度より多い量で存在させる。図1に示す態様では、接着剤が貯蔵層として働きそしてそれに薬が入っている。
【0045】
図2に示す態様では、薄い接着性被膜6を用いて貯蔵層4の皮膚接触面を構築することができる。貯蔵層3は、この上に記述した如き単相重合体組成物または多相重合体組成物であり得る。その接着性被膜に当該薬および透過促進剤ばかりでなく他の材料も含有させてもよい。
【0046】
裏地層2は、経皮送達パッチの製造に適した材料のいずれからも成形可能であり、例えば通気性もしくは閉塞性材料などから成形可能であり、それにはポリ酢酸ビニル、ポリ塩化ビニリデン、ポリエチレン、ポリウレタン、ポリエステル、エチレン酢酸ビニル(EVA)、ポリエチレンテレフタレート、ポリブチレンテレフタレート、被覆紙製品、アルミニウムシートなどまたはこれらの組み合わせで出来ている布またはシートが含まれる。いくつかの態様では、その裏地層に低密度ポリエチレン(LDPE)材料、中密度ポリエチレン(MDPE)材料または高密度ポリエチレン(HDPE)材料、例えばSARANEX[Dow Chemical(Midland、Mich.)]などを含める。その裏地層はモノリスまたは多積層層であってもよい。いくつかの態様における裏地層は、非線状LDPE層/線状LDPE層/非線状LDPE層を包含する多積層層である。その裏地層に持たせる厚みは約0.012mm(0.5ミル)から0.125mm(5ミル)、例えば約0.018mm(0.75ミル)から0.1mm(4ミル)、または約0.025mm(1ミル)から0.0875mm(3.5ミル)であってもよい。
【0047】
接着性貯蔵層3または接着性被膜6は、当該技術分野で公知の標準的感圧接着剤から成形可能である。感圧接着剤の例には、これらに限定するものでないが、ポリアクリレート、ポリシロキサン、ポリイソブチレン(PIB)、ポリイソプレン、ポリブタジエン、スチレン系ブロック重合体などが含まれる。スチレン系ブロック共重合体が基になった接着剤の例には、これらに限定するものでないが、スチレン−イソプレン−スチレンブロック共重合体(SIS)、スチレン−ブタジエン−スチレン共重合体(SBS)、スチレン−エチレンブテン−スチレン共重合体(SEBS)およびそれらのジブロック類似物が含まれる。
【0048】
ポリイソブチレン系接着剤は、高分子量(HMW)のPIBと低分子量(LMW)のPIBの混合物である。そのような混合物は当該技術分野、例えば米国特許第5508038号などに記述されている。前記HMWのPIBが示す分子量は一般に約700,000から2,000,000Daの範囲内である一方、前記LMWのPIBが示す分子量は典型的に35,000から60,000の範囲であろう。本明細書に示す分子量は重量平均分子量である。そのような接着剤中のHMW PIBとLMW PIBの重量比は一般に1:1から1:10の範囲であろう。そのPIB系接着剤には通常また粘着付与剤、例えばポリブテン油および高Tgで低分子量の脂肪樹脂、例えばExxon Chemica
lから入手可能なESCOREZ(商標)樹脂なども入っている。ポリイソブチレン重合体はExxon Chemicalから商標名VISTANEX(商標)の下で商業的に入手可能である。好適な接着剤はPIB系接着剤組成物である、と言うのは、フェンタニルがPIB中で示す溶解度が低いことが理由でフェンタニル含有量を低くしても目標の送達を起こさせることができ、従って転用および乱用の傾向を低くするに役立つからである。フェンタニル、これの誘導体および類似物および他の薬を保持するためのマトリクスとして用いるに有用な他の接着剤材料には、シリコーン誘導体、例えば高分子量のポリジメチルシロキサンまたはポリジメチルジフェニルシロキサンなどが含まれる。経皮パッチで用いるに有用なシリコーン系接着剤の配合が米国特許第5,232,702号、4,906,169号および4,951,622号に記述されている。
【0049】
上述したように、薬貯蔵層3を裏地層2の上に位置させ、そして少なくとも貯蔵層3の皮膚接触表面は接着性である。述べたように、その皮膚接触表面に接着層の構造を持たせてもよい。しかしながら、貯蔵層3全体を局所的変化も層化も伴わない実質的に同じ組成にしてもよく、それを引き剥がし可能保護層5に接着させる。貯蔵層3は、当該技術分野で公知の如き薬(または生物学的に有効な作用剤)貯蔵層材料から成形可能である。例えば、当該薬が所望範囲内で送達されるに妥当な溶解度を前記薬が示す重合体材料、例えばポリウレタン、エチレン/酢酸ビニル共重合体(EVA)、アクリレート、スチレン系ブロック重合体などから薬貯蔵層を生じさせることができる。いくつかの態様では、以下により詳細に記述する如き製薬学的に許容される接着剤、例えばPIBまたはアクリレート共重合体が基になった接着剤から貯蔵層3を生じさせる。その薬貯蔵層は、当該薬および場合によりそれの中に組み込まれている他の材料と一緒になって、経皮パッチを皮膚上に送達期間の間保持するに必要な接着特性を示す。その薬貯蔵層またはマトリクス層に持たせる厚みは約0.2ミル(0.005mm)から4ミル(0.1mm)未満、例えば約0.5−1.5ミル(0.0125−0.0375mm)または約0.5−1.25ミル(0.0125−0.03mm)または約0.8−1.2ミル(0.02−0.03mm)または更に約0.9−1.1ミル(0.023−0.028mm)にしてもよい。一般的には、その厚みを市販されている鎮痛用パッチの厚み(これは約2ミルである)より薄くする。
【0050】
前記貯蔵層の厚みを日に1回(約24時間毎)の取り替え計画のパッチを用いて所望の流量[送達すべき薬(μg/cm2・時)]が達成されるように選択する。その流量は拡散に依存するが、拡散は皮膚と貯蔵層の間の濃度差の関数である。また、各パッチ毎に送達すべき薬の速度(μg/時)も貯蔵層と皮膚の間の接触面積に依存する。このように、前記貯蔵層の寸法(面積および厚みを包含)を所望の流量および薬送達速度がもたらされるように選択する。
【0051】
貯蔵層の寸法を選択する時に考慮に入れてもよい別の要因は、乱用の減少または阻止である。可能性のある乱用者が単一のパッチから入手することができる薬の量が比較的少量のみであることを確認すると、その可能性のある乱用者がそのパッチを乱用する可能性が低くなり得る。従って、貯蔵層の体積および薬充填率が比較的低いパッチは乱用の減少または阻止に役立ち得る。1つの態様では、PIB材料を用いて生じさせた貯蔵層を含めたパッチを提供する。PIB材料を用いて生じさせた貯蔵層は好ましい可能性がある、と言うのは、それらはフェンタニルがPIB中で示す溶解度が低いことが理由でフェンタニル含有量を低くしても匹敵する皮膚流量をもたらし得るからである。
【0052】
美的理由で、パッチの表面積、従って貯蔵層の表面積を小さくする方が好ましい可能性がある。いくつかの態様では、パッチの表面積(および貯蔵層の表面積)を多日使用の目的で考案されたパッチのそれよりも有意に小さくする。例えば、1つのそのような態様では、本明細書に示すパッチの表面積を同じオピオイド薬を送達する目的で考案された3日
パッチの表面積より有意に小さくする。パッチの表面積、即ち貯蔵層の表面積を以下に記述する。
【0053】
乱用の減少または阻止に関連して薬充填率(例えばパッチの中に充填する薬の量の濃度および/または総量)もまた考慮に入れてもよい。特定の態様では、オピオイド薬(例えばフェンタニル、例えばフェンタニル塩基またはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上)を投与するための経皮パッチに含める薬貯蔵層を薬貯蔵層に充填する薬の総量が100μg/時の投薬濃度の場合に約12mg未満、例えば100μg/時の投薬濃度の場合に約8mg未満または100μg/時の投薬濃度の場合に約7.5mg以下などになり得るような貯蔵層にする。材料は同じであるが大きさが異なる他の投薬濃度(100μg/時以外)のデバイスの場合、当該パッチに入れる薬の含有量を大きさ(面積)に比例して調整してもよい、即ちただ1つの差が面積(典型的には大きさと呼ぶ)の場合、その拡大縮小は面積(即ち大きさ)に比例する。例えば50μg/時の投薬濃度の場合には薬含有量をそれの面積が半分であることから上述した100μg/時の投薬濃度の薬含有量の半分にすることができるであろう。
【0054】
乱用の減少または阻止に関連して考慮に入れてもよい更に別の要因は、使用済みパッチに入っている残存薬(使用後のパッチに残存する薬)の量である。例えば、当該パッチが示す薬使用重量%(パッチを使用期間後に剥がした時のそれ)を高くする場合には、パッチ使用後に乱用の可能性で使用可能な薬の量が少なくなることでそのようなデバイスが乱用される可能性が低くなり得る。特定の態様では、本明細書に記述する如きパッチに含める薬貯蔵層の寸法を残存オピオイド(例えばフェンタニル、例えばフェンタニル塩基またはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上)の量が100μg/時の投薬濃度の場合に約6mg以下もしくは未満になるように選択する。1つのそのような態様では、残存オピオイドの量が約5mg以下になるようにする。
【0055】
この上に示したパラメーターは相互に関係していて、例えばパッチが示す薬使用重量%を向上させかつオピオイド薬を当該患者に治療的効果を達成する様式で所望期間に渡って送達する能力を有するパッチを提供すると同時にオピオイド薬充填量の減少、オピオイド薬濃度の低下および貯蔵層の大きさの低下を取り扱うことは簡単なことではないと理解されるべきである。本明細書に詳述するように、本開示は、多日システムに比べてオピオイド薬含有量が低くかつ中に含まれているオピオイド薬が使用前および/または使用後に乱用で利用される可能性を低くすることが可能な態様のパッチを提供するものである。
【0056】
本明細書に記述する如きパッチに含める接着性貯蔵層3または接着性被膜6は、当該技術分野で公知の標準的感圧接着剤を用いて成形可能である。本明細書に記述するパッチの態様で用いるに適した感圧接着剤の例には、これらに限定するものでないが、ポリアクリレート、ポリシロキサン、ポリイソブチレン(PIB)、ポリイソプレン、ポリブタジエン、スチレン系ブロック重合体などが含まれる。本明細書に記述する如きパッチの態様で用いるに適したスチレン系ブロック共重合体が基になった接着剤の例には、これらに限定するものでないが、スチレン−イソプレン−スチレンブロック共重合体(SIS)、スチレン−ブタジエン−スチレン共重合体(SBS)、スチレン−エチレンブテン−スチレン共重合体(SEBS)およびそれらのジブロック類似物が含まれる。
【0057】
典型的な接着剤には、ポリアクリレートおよびPIB、特にポリアクリレートが含まれる。ポリアクリレート(アクリル系重合体)は、アクリル酸、アクリル酸アルキル、メタアクリレート、共重合性二次単量体または官能基を有する単量体を包含する群から選択される少なくとも2種以上の典型的な成分を含有して成る共重合体もしくは三元重合体で構
成されている可能性がある。単量体の例には、これらに限定するものでないが、酢酸ビニル、アクリル酸、メタアクリル酸、アクリル酸メトキシエチル、アクリル酸メチル、アクリル酸エチル、アクリル酸ブチル、メタアクリル酸ブチル、アクリル酸ヘキシル、メタアクリル酸ヘキシル、アクリル酸2−エチルブチル、メタアクリル酸2−エチルブチル、アクリル酸イソオクチル、メタアクリル酸イソオクチル、アクリル酸2−エチルヘキシル、メタアクリル酸2−エチルヘキシル、アクリル酸デシル、メタアクリル酸デシル、アクリル酸ドデシル、メタアクリル酸ドデシル、アクリル酸トリデシル、メタアクリル酸トリデシル、アクリル酸ヒドロキシエチル、アクリル酸ヒドロキシプロピル、アクリルアミド、ジメチルアクリルアミド、アクリロニトリル、アクリル酸ジメチルアミノエチル、メタアクリル酸ジメチルアミノエチル、アクリル酸t−ブチルアミノエチル、メタアクリル酸t−ブチルアミノエチル、アクリル酸メトキシエチル、メタアクリル酸グリシダルなどが含まれる。適切なアクリル系接着剤の追加的例がSatas、「Acrylic Adhesives」、Handbook of pressure−Sensitive Adhesive Technology、第2版、396−456頁(D.Satas編集)、Van Nostrand Reinhold、New York(1989)に記述されている。アクリル系接着剤は商業的に入手可能である(National Starch and Chemical Corporation、Bridgewater、NJ;Solutia、MA)。ポリアクリレートが基になった接着剤のさらなる例は下記のようにNational Starchが製造している接着剤[Product Bulletin、2000、DURO−TAK(商標)はNational Starch接着剤の商標である]であり、それらを下記の製品番号で識別する:87−4098,87−2287,87−4287,87−5216,87−2051,87−2052,87−2054,87−2196,87−9259,87−9261,87−2979,87−2510,87−2353,87−2100,87−2852,87−2074,87−2258,87−9085,87−9301および87−5298。DURO−TAK(商標)87−2287および87−4287は両方ともアクリル酸2−ヒドロキシエチルが5.2重量%で酢酸ビニルが約20−40重量%でアクリル酸2−エチルヘキシルが約55−75重量%の同様な単量体組成物から作られた重合体である接着剤であり、この2種類の重合体である接着剤は酢酸エチルに固体含有量が約40−50重量%になるように溶解した状態で提供される。DURO−TAK(商標)87−2287接着剤は、酢酸ビニルが28%でアクリル酸2−エチルヘキシルが67%でアクリル酸ヒドロキシエチルが4.9%でメタアクリル酸グリシジルが0.1%の単量体組成物から作られた接着剤である(米国特許第5,693,335号を参照)。
【0058】
本明細書に記述するパッチの態様で用いるに適したアクリル系重合体は、架橋もしくは非架橋重合体または両方を含有し得る。公知方法を用いてそのような重合体を架橋させることで所望重合体を生じさせる。いくつかの態様における接着剤は、ガラス転移温度(Tg)が−10℃未満、より好適にはTgが約−20℃から約−30℃のポリアクリレート系接着剤である。そのようなポリアクリレート系接着剤が示す分子量は、重量平均(MW)で表して、いずれかの架橋反応を起こす前に一般に25,000から10,000,000、例えば50,000から約3,000,000または100,000から1,000,000などの範囲である。重合体化学技術分野に関係する技術者に公知のように、架橋させるとMWが無限に近づく。
【0059】
特定の態様では、PIB系接着剤をPIB系接着剤組成物として提供する。そのような態様では、PIB組成物を低分子量および高分子量のPIB成分、粘着付与樹脂および可塑化用油で構成させてもよい。加うるに、本明細書に記述するように、また、シリコーン系接着剤を用いることも可能である。
【0060】
この上で考察したように、本明細書に記述する如きパッチの貯蔵層(例えば図1または
図2に示す貯蔵層3)は、溶解していない成分が入っているか或は入っていなくてもよい重合体組成物を用いて成形可能である。特定の態様では、本明細書で意図する如き貯蔵層に、オピオイド薬を鎮痛をヒトに誘発してほぼ1日の間維持するに充分な量で含有させる。1つのそのような態様における薬はフェンタニルである。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上である。いくつかの態様では、薬貯蔵層に含有させる薬の量を約0.05から約1.75mg/cm2、例えば薬含有量を約0.07から約1.50mg/cm2または薬含有量を約0.08から約1.25mg/cm2または約0.14から0.3mg/cm2にする。特定態様における薬は塩基形態のフェンタニルであり、フェンタニルが塩基形態であると溶解または分散する。他の態様では、そのような薬を完全に溶解させる。
【0061】
特定の態様では、本記述に従うパッチの貯蔵層を形成する材料が薬を溶かす能力が総重合体組成物の約0.5重量%から約25重量%、例えば総重合体組成物4の約1重量%から約15重量%または約2重量%から約12重量%であるようにする。本明細書に記述する如きパッチで用いる貯蔵層が示す厚みは、接着性被膜6を伴うか或は伴わないかに拘わらず、約0.2−10ミル(0.005−0.25mm)、例えば約0.5−1.5ミル(0.0125−0.0375mm)または約0.5−1.25ミル(0.0125−0.03mm)または約0.8−1.2ミル(0.02−0.03mm)、例えば約0.9−1.1ミル(0.023−0.028mm)などであり得る。そのようないくつかの態様における薬は塩基形態のフェンタニルであり、貯蔵層3を形成する材料がフェンタニルを溶かす度合は総重合体組成物の約0.5重量%から約25重量%、例えば総重合体組成物の約1重量%から約15重量%または約2重量%から約12重量%または約4重量%から約10重量%である。当該薬が接着剤中で示す溶解度を測定する1つの方法は、薬濃度がいろいろなマトリクス薬貯蔵層を裏地材料の上に流し込み成形しそしてその流し込み成形した材料を室温である期間貯蔵した後に薬の結晶が現れるか否かを測定することによる方法である。特定の濃度の時に結晶が1カ月の貯蔵後に現れたとすると、その濃度が当該薬がマトリクス接着剤中で示す溶解度限界であると見なすことができる。結晶または溶解していない材料の存在は顕微鏡またはX線回折分析で測定可能である。
【0062】
本明細書に記述する如きパッチに含める貯蔵層3に場合により追加的成分、例えば添加剤、透過促進剤、安定剤、染料、希釈剤、可塑剤、粘着付与剤、顔料、担体、不活性充填剤、抗酸化剤、ゲル化剤、抗刺激剤、血管収縮剤および経皮技術分野で一般に公知の如き他の材料などを含有させてもよいが、そのような材料を前記貯蔵層に飽和濃度未満の濃度で存在させることを条件とする。
【0063】
必要ならば、薬1種または2種以上が送達を治療的に有効な速度で達成するように皮膚透過率を向上させようとする時には透過促進剤が有用であり得る。そのような透過促進剤を前処理でか或は薬と一緒に例えば貯蔵層の中に混合することなどでそれが皮膚に付着するようにしてもよい。透過促進剤は1種以上の薬または他の生物学的に有効な作用剤が示す皮膚透過性を向上させる能力を有するべきである。有用な透過促進剤は所望薬もしくは生物学的に有効な作用剤が示す透過率をそれが妥当な大きさのパッチ(例えば約2から25cm2であるが、より大きくてもよい)から治療的血漿中濃度が達成されるに充分な速度で送達されるように向上させるであろう。いくつかの有用な透過促進剤には非イオン性界面活性剤が含まれるが、1種以上をモノオレイン酸グリセリル、モノラウリン酸グリセリル、ソルビタンモノオレエート、トリオレイン酸グリセリルおよびミリスチン酸イソプロピルを包含する群から選択してもよい。そのような非イオン性界面活性剤を貯蔵層の総組成に対して約0.1から30重量%(固体)の量で用いてもよい。透過促進剤の例には、これらに限定するものでないが、アルコール(グリセリンを包含)の脂肪酸エステル、例えばカプリン酸、カプリル酸、ドデシル、オレイン酸などのエステル、イソロルビド、
スクロース、ポリエチレングリコールの脂肪酸エステル、カプロイル乳酸、ラウレス−2、ラウレス−2アセテート、ラウレス−2ベンゾエート、ラウレス−3カルボン酸、ラウレス−4、ラウレス−5カルボン酸、オレス−2、ピログルタミン酸オレイン酸グリセリル、オレイン酸グリセリル、N−ラウロイルサルコシン、N−ミリストイルサルコシン、N−オクチル−2−ピロリドン、ラウロアミノプロピオン酸、ポリプロピレングリコール−4−ラウレス−2、ポリプロピレングリコール−4−ラウレス−5ジメチル−1ラウロアミド、ラウロアミドジエタノールアミン(DEA)が含まれる。好適な促進剤には、これらに限定するものでないが、ピログルタミン酸ラウリル(LP)、モノラウリン酸グリセリル(GML)、モノカプリル酸グリセリル、モノカプリン酸グリセリル、モノオレイン酸グリセリル(GMO)、オレイン酸、N−ラウリルサルコシン、パルミチン酸エチル、ラウレス−2、ラウレス−4およびソルビタンモノラウレートが含まれる。適切な透過促進剤の追加的例が例えば米国特許第5,785,991号、5,843,468号、5,882,676号および6,004,578号に記述されている。しかしながら、特定の態様では透過促進剤を用いない。
【0064】
特定の態様では、貯蔵層に、急速な粘着を低下させ、粘度を高くしそして/またはマトリクスの構造を強化する能力を有する希釈剤材料、例えばポリメタアクリル酸ブチル(ICI Acrylicsが製造しているELVACITE、例えばELVACITE 1010、ELVACITE 1020、ELVACITE 20)、高分子量アクリレート、即ち平均分子量が少なくとも500,000のアクリレートなどを含有させる。そのような分子量が大きいアクリレート材料、例えばELVACITEなどを用いる場合、それらを重合させて接着性重合体を生じさせるのではなく、それを混合する。このように、接着剤重合用の単量体には、そのようなELVACITE型の高分子量アクリレート(または巨大単量体であるアクリレート)などは含まれない。
【0065】
特定の態様では、可塑剤または粘着付与剤を接着剤組成物に混合することで接着特性を向上させる。適切な粘着付与剤の例には、これらに限定するものでないが、脂肪族炭化水素、芳香族炭化水素、水添エステル、ポリテルペン、水添木樹脂、粘着付与樹脂、例えばESCOREZ、石油化学原料のカチオン重合または石油化学原料の熱重合に続く水添で作られた脂肪族炭化水素樹脂、ロジンエステル系粘着付与剤など、鉱油およびそれらの組み合わせが含まれる。
【0066】
そのような粘着付与剤を用いる場合、その用いる粘着付与剤は当該重合体もしくは重合体混合物に相溶すべきである。例えば、スチレン系ブロック共重合体をゴムに相溶し得る粘着付与樹脂、相溶性末端ブロック樹脂、例えばポリメチルスチレンなどまたは可塑剤、例えば鉱油などと一緒に配合してもよい。特定の態様では、本明細書に記述する如きパッチに、重合体材料、粘着付与材料および鉱油系可塑剤を用いて生じさせた貯蔵層を含めてもよく、その場合には、前記重合体が総接着剤組成物の約5−50%で粘着付与材料が総接着剤組成物の約30−85%で鉱油が総接着剤組成物の約2−40%になるようにする。
【0067】
本明細書に記述する如きパッチに更に引きはがし可能な保護層5を含めることも可能である。その保護層5を例えば重合体材料などで構成させてもよく、それを場合により金属で被覆してもよい。そのような重合体材料の例には、ポリウレタン、ポリ酢酸ビニル、ポリ塩化ビニリデン、ポリプロピレン、ポリカーボネート、ポリスチレン、ポリエチレン、ポリエチレンテレフタレート、ポリブチレンテレフタレート、紙などおよびそれらの組み合わせが含まれる。いくつかの態様の保護層はシリコーン処理ポリエステルシートを含んで成る。
【0068】
この上に記述した経皮送達パッチのいろいろな層を組み立てようとする時に幅広く多様
な材料を用いることができる。従って、本開示では、本明細書に具体的に開示する材料以外の材料の使用も意図し、そのような材料には、必要な機能を果たす能力を有することが当該技術分野で後に知られるようになるであろうそれらも含まれる。
【0069】
1つの態様では、本明細書に記述する如きパッチに図1に示す構造を持たせ、図1中のパッチに持たせた層は3層のみ、即ち裏地層、麻薬性鎮痛薬が全体的に溶解している単相貯蔵層マトリクス層および剥離ライナーである。そのような態様では、PIB系接着剤配合物またはポリアクリレート系接着剤と1種類のみのオピオイド薬、例えばフェンタニル塩基などを用いて前記貯蔵層マトリクスを生じさせてもよい。1つのそのような態様では、透過促進剤、粘着付与剤、充填剤などの量をあまり多くしない。他のそのような態様において、前記材料を存在させる場合、それらの存在量を僅かな量にすることで薬送達に実質的な影響が生じないようにする。そのような態様で用いるポリアクリレート系接着剤を単一の共重合体化学物質、例えば単量体である酢酸ビニル、アクリル酸2−エチルヘキシルおよびアクリル酸ヒドロキシエチルなどの共重合体、例えば三元重合体であるDURO−TAK(商標)87−4287接着剤または共重合体であるDURO−TAK(商標)87−2287接着剤などで構成させてもよい。
【0070】
マトリクスを薬保持用貯蔵層として用いる以外に、本明細書に記述するパッチの態様で使用可能な貯蔵層の代替形態は、オピオイド薬組成物を入れたパウチ[例えばフォームフィルドシール(form−filled seal)]であり、その貯蔵層を米国特許第4,588,580号に記述されている様式と同様な様式で生じさせる。不透過性裏地層および薬の送達速度を制御する速度制御膜を用いて生じさせたパウチの中に薬組成物を封じ込めることでそのような貯蔵層を生じさせることができる。そのようなデバイスに、また、このデバイスが皮膚に付着するように接触接着層(これはアミン耐性であってもよい)および皮膚に付着させる前の接着剤を保護する引き剥がし可能な保護層を持たせることも可能である。
【0071】
様々な薬貯蔵層組成物をパウチで用いることができ、それらには水性および非水性系の両方が含まれる。典型的な水性ゲル系の一般的配合を以下の表1に示し、ゲル化剤はヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロースまたは他の公知のゲル化剤である。
【0072】
【表1】

【0073】
この上に記述した水−エタノール系を速度制御膜、例えば低密度ポリエチレン(LDP
E)、エチレン−酢酸ビニル(EVA)共重合体(VAが0−40%、好適には5−18%)、熱密封性ポリエステルおよびゴム弾性ポリエステルブロック共重合体、例えばDuPontから入手可能で米国特許第4,127,127号に記述されているHYTREL(商標)重合体などと組み合わせて用いると、それは特定のユニークな特性を示す。速度制御膜は、エタノール放出速度に有意な影響を与えることなくフェンタニル放出速度に対して実質的な制御を及ぼす。それによって、そのようなシステムを用いる時に貯蔵層に入っているエタノールの相対濃度が水および薬の相対濃度に対して変化する動的状況がもたらされる。フェンタニルおよびこれの誘導体の場合、それらはエタノール中の方が水中よりも高い溶解度を示すことから、貯蔵層に入っている前記薬が当該システムから送達される時に前記薬が示す熱力学的活量は通常予想されるほどには低くならない。当該薬が速度制御膜を通って移行するのを促す推進力は、絶対濃度ではなく前記薬が溶媒中で示す熱力学的活量である。このように、エタノールが枯渇する速度がより速いと水性貯蔵層に入っている薬の飽和濃度が低くなる。当該システムから送達されるエタノールおよび薬の速度を適切に調節することによって、当該薬が示す活性を当該システムの寿命に渡って一定に維持することができるか或は高くして行くことさえ可能である。
【0074】
速度制御膜を含める場合、それの厚みを例えば約0.5−5ミル(0.0127−0.1270mm)、例えば厚みを約1−3ミル(0.025−0.076mm)にしてもよい。その上、パッチにパウチ型貯蔵層を含める場合、その貯蔵層のゲル充填率を約10−50mg/cm2にすることで乾燥状態の充填率を約0.01−5mg/cm2にしてもよい。マトリクス貯蔵層と同様に、パウチとして生じさせた貯蔵層にもまた上述した如き透過促進剤、賦形剤、例えば粘着付与剤、充填剤などおよび他の薬を含有させることも可能である。
【0075】
薬の投与
経皮パッチ1を皮膚に貼り付けると、それの薬貯蔵層3に入っている薬が皮膚の中に拡散し、吸収されて血流の中に入り込むことで、全身鎮痛効果がもたらされる。鎮痛の開始は様々な要因、例えば当該薬の効力、当該薬が皮膚中で示す溶解度および拡散度、皮膚の厚み、当該薬が皮膚貼り付け部位内で示す濃度、薬貯蔵層内に入っている当該薬の濃度などに依存する。
【0076】
1つの態様では、連続的鎮痛を維持する目的で、1日貼り付けた後に皮膚の上に1日存在したままであった古い(即ち使用済み)パッチを剥がして、新しいパッチを皮膚に好適には新しい場所に貼り付ける。例えば、血中薬濃度が治療濃度に到達した後、その投与期間が終了した時点で前記パッチを逐次的に剥がして新しいパッチに置き換えることで慢性通を軽減することができるであろう。好適には、その古い(即ち使用済み)パッチと新しいパッチが同時に皮膚に付着した状態にしないか、或は貼り付けの便利さの目的で重なり合う時間が僅かに短く(例えば数分内)なるようにすることで鎮痛結果をより予測できるようにする。定常状態の時、その新しいパッチから薬が新しい貼り付け領域の中に吸収されて全身に循環しそして以前にパッチを貼り付けておいた場所の中に残存していた薬の吸収がオピオイド薬の血中濃度が許容される範囲内に維持される速度で起こる。
【0077】
治療的血中濃度をより迅速に達成しようとする時、健康管理者または患者は、最初に1枚のパッチまたは複数のパッチを貼り付けそして1日(即ち約24時間)経過した後に皮膚に貼り付けたままにするパッチの数を少なくする、例えば毎日(即ちほぼ24時間毎に)取り替えることで皮膚に貼り付けられたままであるパッチの数を1枚のみにするように選択してもよい。
【0078】
フェンタニルが送達すべき薬である場合には典型的にフェンタニルの血漿中濃度が約0.02から約10ng/mlになるようにすると治療効果がもたらされることを見いだし
た。その範囲内の約0.3から約3ng/mlの範囲の血漿中濃度を目標にしてもよい。そのような範囲内において、通常は大部分の薬の場合と同様に、経時的変動の度合が小さい方が変動の度合が大きい場合よりも好ましい、と言うのは、血中薬濃度の変動が小さいことに関連して鎮痛効果が経時的により一定になるからである。
【0079】
本発明に従う日に1回のフェンタニルパッチを用いて毎日取り替えるプログラムを用いると、多日パッチ療法、例えば3日パッチ投与療法などに比べてずっと小さい血漿中薬濃度変動を達成することができる。このように、1つの態様において、本明細書に記述する如きパッチおよび投与方法を用いると、同じ薬を送達する目的で多日パッチを投与する療法を用いた時に達成されるそれに比べて、1回投与のCmaxが低くなり、定常状態のCminが高くなりかつ定常状態におけるCmaxとCminの間の差が小さくなる。特定の態様において、本開示は、3日パッチを3日間貼り付けるか或は週に2回貼り付ける療法を用いた時に達成されるそれに比べて1回投与のCmaxが低く、定常状態のCminが高くかつ定常状態におけるCmaxとCminの間の差が小さいことを達成するパッチおよび毎日取り替え方法を提供する。
【0080】
特定の態様において、本明細書に記述する如きパッチは、100μg/時の名目上送達速度で1日貼り付けた後のCmaxの範囲が約0.45から約5.5ng/ml、例えば約0.9から約2.7ng/mlまたは約1.2から約2.5ng/mlなどである1回投与オピオイド薬プロファイル(即ち1枚のパッチを貼り付けた後に取り替えることなく24時間が終了した時点で剥がす)をもたらす1日パッチである。100μg/時の名目上送達速度と投薬濃度の差に関しては、相当して、面積の差を用いてCmaxの範囲を見積もる。1つのそのような態様における薬はフェンタニルである。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上である。そのような特定の態様における薬は塩基形態のフェンタニルであり、この場合のフェンタニルは塩基形態であることから溶解または分散する。他の態様における薬は完全に溶解している。
【0081】
特定の態様において、本明細書に記述する如きパッチは投薬濃度が100μg/時の経皮フェンタニルパッチであり、これが示す定常状態のCmaxは約0.7から約12ng/ml、例えば約1.5から約6ng/mlまたは約2から約5.5ng/ml、更に約3から約5ng/mlなどの範囲である。そのようなフェンタニルパッチは追加的に約0.5から約10ng/mlまたは約1から約5.5ng/mlまたは約1から約4ng/mlまたは約1から約3ng/mlの範囲の定常状態Cminも示し得る。投薬濃度がより高いか或はより低いパッチの場合の定常状態Cmaxの範囲を相当して見積もり、例えば面積の差を基にして見積もる。そのような態様に存在させるフェンタニルは塩基形態のフェンタニルであってもよく、この場合のフェンタニルは塩基形態であることから溶解または分散する。他のそのような態様における薬は完全に溶解している。
【0082】
また、本明細書に開示する如きパッチは所定投薬濃度にとって目標のCmaxとCminの間の差をもたらす可能性もある。例えば、100μg/時の投薬濃度をもたらす本明細書に記述する如きパッチの1つの態様において、CmaxとCminの間の毎日の揺れは約0.025から約13.0ng/ml、例えば約0.25から約2ng/mlまたは約0.3から約1.6ng/mlまたは約0.4から約0.8ng/mlなどの範囲である。1つのそのような態様における薬はフェンタニルである。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上である。そのような特定の態様における薬は塩基形態のフェンタニルであり、この場合のフェンタニルは塩基形態であることから溶解または分散する。他の態様における薬は完全に溶
解している。
【0083】
加うるに、また、投薬濃度が100μg/時の場合に定常状態をもたらすように考案した本明細書に開示する如きパッチが示す薬変動[(Cmax−Cmin)/Cavgとして定義]も100%未満、例えば90%未満または80%未満または更に70%未満または約30%から65%であり得る。1つのそのような態様における薬はフェンタニルである。他のそのような態様における薬は、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどの中の1つ以上である。そのような特定の態様における薬は塩基形態のフェンタニルであり、この場合のフェンタニルは塩基形態であることから溶解または分散する。他の態様における薬は完全に溶解している。
【0084】
投薬濃度が100μg/時ではないデバイスの場合、相当して、CmaxとCminの間の毎日の揺れの範囲を見積もることができる。正規化CmaxとCminの間の毎日の揺れは約2から約100ng/ml(mg/時)、例えば約4から約50ng/ml(mg/時)または約5から約20ng/ml(mg/時)または約5から約15ng/ml(mg/時)などの範囲である。投薬濃度が100μg/時ではない(例えば投薬濃度が25μg/時、50μg/時、75μg/時および12.5μg/時などの場合の)デバイスが示す正規化Cmaxと正規化Cminの間の毎日の揺れの範囲も相当して見積もり可能である。新規な経皮システムがDURAGESIC(商標)DTRANS(商標)フェンタニル経皮システムと生物学的に同等であるようにするには、DURAGESIC(商標)DTRANS(商標)システムのそれに対する新規な経皮システムの定常状態Cmax比の90%信頼区間が80%から125%の範囲内になるようにすべきである。また、同じ投薬濃度のDURAGESIC(商標)DTRANS(商標)システムのそれに対する新規な経皮システムのAUCss比の90%信頼区間も80%から125%の範囲内になるようにすべきである。このように、生物学的同等性を試験しようとする場合、フェンタニル送達用の新規な経皮システムに試験をDURAGESIC(商標)DTRANS(商標)システムと対比させて受けさせることで、DURAGESIC(商標)DTRANS(商標)システムのそれに対する新規なシステムが示す上述した薬物動態パラメーター比の90%信頼区間が80%から125%の範囲内であることを示す。
【0085】
名目上の送達速度が100μg/時の場合、本明細書に記述する如き日に1回のフェンタニルパッチを1回分貼り付けた時のAUCinf(即ち1回投与後の無限時間に至るAUC)は、名目上の送達速度が100μg/時の経皮フェンタニルパッチを毎日貼り付けた後、約15から約200ng・時/ml、例えば約30から約140ng・時/mlなどの範囲であり得る。経皮フェンタニル製品が示すAUCssおよびAUCinfは生物学的に同等であることが示されている[Sathyan他、「Evaluation of the bioequivalence of two transdermal fentanyl systems following single and repeat applications」、Current Medical Research and Opinion 21(12)、1961−1968、2005を参照]。投薬濃度がより低いか或はより高いパッチの場合の定常状態AUCinfの範囲をパッチの面積(または大きさ)に比例して見積もる。そのようないくつかの態様における薬はフェンタニルである。そのような特定の態様における薬はフェンタニルの塩基形態であり、フェンタニルが塩基形態であると溶解または分散する。他の態様では、その薬を完全に溶解させる。
【0086】
いくつかの態様において、本明細書に開示する如きパッチは、送達された薬に関して約7から約120ng/ml(mg/時)、例えば約15から約60ng/ml(mg/時)または約20から約55ng/ml(mg/時)または約30から約50ng/ml(
mg/時)などの範囲の正規化定常状態Cmaxを示す経皮フェンタニルパッチである。本明細書に記述する如きパッチを皮膚に貼り付けると約0.1から約20μg/(cm2・時)、例えば約0.75から約10μg/(cm2・時)または約1から約8μg/(cm2・時)または約1.5から約5μg/(cm2・時)または約2から約3μg/(cm2・時)などの定常状態薬流量がもたらされ得る。本開示に従って得ることができる定常状態投与速度は、約0.1から約500μg/時、例えば約1から約300μg/時または約2から約250μg/時または約5から約200μg/時などの範囲である。名目上の定常状態投与は例えば12.5μg/時、25μg/時、50μg/時、75μg/時、100μg/時および125μg/時などの範囲の投薬濃度であり得る。そのようないくつかの態様における薬はフェンタニルであり得る。そのような特定の態様における薬はフェンタニルの塩基形態であり、フェンタニルが塩基形態であると溶解または分散する。他の態様では、その薬を完全に溶解させる。
【0087】
追加的態様において、本明細書に開示するパッチは、約5から約100ng/ml(mg/時)、例えば約10から約55ng/ml(mg/時)または約10から約40ng/ml(mg/時)または約10から約30ng/ml(mg/時)などの範囲の正規化定常状態Cminを示す経皮フェンタニルパッチである。この経皮パッチは約1から約100cm2、例えば約1から約40cm2または約5から約38cm2または約10から約35cm2または約10から約35cm2などである。この経皮フェンタニルパッチを皮膚に貼り付けると、そのパッチに存在するフェンタニルの量および流量に関して、一般に、約0.1から20μg/(cm2・時)、例えば約1から約10μg/(cm2・時)、約1.5から約8μg/(cm2・時)、約2.8から約5μg/(cm2・時)または約3から約3.6μg/(cm2・時)などの定常状態薬流量を示し得る。そのようないくつかの態様における薬はフェンタニルである。そのような特定の態様における薬はフェンタニルの塩基形態であり、フェンタニルが塩基形態であると溶解または分散する。他の態様では、その薬を完全に溶解させる。
【0088】
更に追加的態様において、本明細書に開示するパッチは、フェンタニルを3日DURAGESIC(商標)DTRANS(商標)システムに近い様式、例えばそれに生物学的に等しい様式で送達する1日フェンタニルパッチである。1つのそのような態様では、前記1日パッチの表面積および厚みの両方を前記3日パッチよりも小さくする。例えば、1つのそのような態様では、前記1日パッチの皮膚接触面積を前記3日パッチの面積の約0.5から0.85、例えば約0.6から0.8または0.7から0.77または約0.71から0.76にしてもよい。加うるに、1つのそのような態様では、前記1日フェンタニル貯蔵層の厚みを前記3日パッチに含まれている貯蔵層のそれの約0.25から0.75、例えば約0.4から0.6または約0.5にしてもよい。そのような態様の各々のパッチにポリアクリレート系フェンタニルマトリクスを含めてもよい。
【0089】
1日パッチが送達するフェンタニルの量を3日パッチが送達するそれの約1/3にすべきであるが、我々は、その1日パッチの皮膚接触面積を同じ投薬濃度の3日パッチのそれの1/3以上にしてもよく、従って3日パッチのそれの1/3から0.9にしてもよいことを見いだした。その2種類のパッチの表面積を比較する時、パッチの薬貯蔵層の面積を投薬濃度で割りかつ当該薬の送達でパッチを用いる日数で割った値であると定義する如きパッチの正規化面積を考慮する(即ち3日パッチの場合の正規化面積は、42cm2を100μg/時で割った値を3で割った値=1日当たりのμg/時当たり0.14cm2=名目上の送達量1mg当たり5.8cm2であるとして得られる)。比較として、1日パッチの正規化面積は、3日パッチのそれである1日当たりのμg/時当たり0.14cm2より大きい(即ち名目上の送達量1mg当たり5.8cm2より大きい)。このことは、1日パッチの薬貯蔵層(例えば薬含有マトリクス)の厚みが3日マトリクスパッチのそれよりも薄い時でも当てはまる。
【0090】
名目上の投薬濃度を基にした正規化面積、即ち体接触表面積を名目上の投薬濃度で割った値(例えば表面積が42cm2で送達速度が100μg/時の投薬濃度のパッチの正規化表面はμg/時当たり0.42cm2である)に関して、フェンタニルの1日の量を送達した場合を名目上の投薬濃度に従って計算すると、本明細書に開示する如き1日パッチの態様が示す正規化面積は1日当たりのμg/時当たり約0.2から0.4cm2(即ち1mg当たり8.5から16.5cm2)、例えば1日当たりのμg/時当たり約0.25から0.36cm2(即ち1mg当たり10.5から15cm2)または1日当たりのμg/時当たり約0.28から0.32cm2(即ち1mg当たり11.5から13.5cm2)であり得る。
【0091】
1つの態様において、本記述に従う1日フェンタニルパッチの表面積当たりのフェンタニル充填率は3日フェンタニルマトリクスパッチのそれよりも小さい、即ち約0.4mg/cm2未満であるが、DURAGESIC(商標)DTRANS(商標)フェンタニル経皮システムのそれは約0.4mg/cm2である。しかしながら、我々は、DURAGESIC(商標)DTRANS(商標)フェンタニル経皮システムと生物学的に同等にしようとする場合には1日パッチの充填率を3日パッチのちょうど1/3より大きくする、即ち0.13mg/cm2以上にすることを見いだした。従って、1つのそのような態様の1日フェンタニルパッチの場合、表面積当たりのフェンタニル充填率を約0.14から0.3mg/cm2、例えば約0.16から0.25mg/cm2または約0.18から0.22mg/cm2にする。
【0092】
パッチに充填する薬の量を少なくしかつ使用済みパッチに残存する薬の量が少なくなるようにすると、薬乱用を減少または阻止する点で利点が得られる可能性がある。本記述に従う1日フェンタニルパッチの1つの態様では、1パッチ当たりのフェンタニル含有量を名目上投薬濃度が100μg/時のパッチの場合には約4から8mg、例えば5から7mgまたは5.5から6.5mgなどにしてもよい。投薬濃度が異なる、例えば25μg/時、50μg/時、125μg/時などの場合のそれを見積もる目的で計算した正規化値に関して、正規化フェンタニル含有量(これはフェンタニル含有量を投薬濃度で割った値である)は約0.04から0.08mg・時/μg、例えば0.05から0.07mg・時/μgまたは0.055から0.065mg・時/μgなどである。そのような充填率を示す1日パッチが示す治療的鎮痛は3日DUROGESIC DTRANS(商標)のそれと同様であることを見いだした。比較として、その3日DUROGESIC DTRANS(商標)100μg/時パッチはフェンタニルを約17mg含有し、それは約0.17mg・時/μgである。
【0093】
本明細書に記述する如きパッチは、所望の薬使用率(使用%)をもたらすようにデザイン可能である。例えば、特定の態様において、本明細書に記述するパッチは、約30%以上、例えば少なくとも35%または少なくとも40%または40%から50%などの薬使用率をもたらす1日パッチであり得る。1つのそのような態様におけるパッチは、約30%以上、例えば少なくとも35%または少なくとも40%または40%から50%などのフェンタニル使用率をもたらすフェンタニルパッチである。そのような特定の態様における薬は塩基形態のフェンタニルであり、その場合のフェンタニルは塩基形態であることで溶解または分散する。他の態様における薬は完全に溶解する。別法として、そのような態様に従ってデザインしたパッチは、フェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどを送達するようにデザインしたパッチである。
【0094】
1枚のパッチによる投与を典型的には3日間以内、例えば2日間または1日に渡って維持する。本開示を基にして、パッチを患者にいずれかの時間(例えば8、24、36、4
8、72時間)貼り付けた後に取り替えると理解されるべきである。しかしながら、1つの態様において本明細書に開示する如き投薬方法では毎日取り替える必要がある(1日使用)。再び、所定理論で範囲を限定するものでも制限するものでもないが、持続性薬効果を鑑み、最初の日に貼り付けるパッチを1枚にしそして毎日取り替える場合には血漿中薬濃度が徐々に高くなって治療に有効な定常状態になるには2日以上要する可能性があると考えている。別の面において、本開示は、最初にパッチを1日目に2枚以上貼り付けた後に2日目から開始して血漿中薬濃度が短時間、例えばほぼ1日で治療範囲になるように前日のパッチの代わりに新しいパッチを毎日貼り付けることでオピオイド(フェンタニルまたはフェンタニルの類似物、例えばアルフェンタニル、カルフェンタニル、ロフェンタニル、レミフェンタニル、スフェンタニル、トレフェンタニルなどを包含)を投与する方法を提供する。最初の日の後の日では、定常状態の時に鎮痛用として皮膚に貼り付けたままであるパッチが1枚のみになるように前記2枚以上のパッチの中の数枚を剥がしてもよい。
【0095】
このように、1つの態様において、フェンタニルを患者に鎮痛の目的で送達すべき場合、その患者は比較的高い血漿中フェンタニル濃度を必要とする可能性もあり、例えばオピオイドに耐性のある患者が治療効果を達成するには、最初の日に治療的に有効な血漿中フェンタニル濃度の達成を確保する目的で、その患者に最初の日に多い量のフェンタニルを投与する必要があり、例えばパッチを2枚、3枚以上貼り付ける必要がある。2日目に前記パッチの中の1枚以上を取り替えそして3日目に前記パッチの全部を剥がして再び貼り付けられた新しいパッチが1枚のみであるようにしてもよい。この上に示した手順の変法を用いることも可能であり、例えば1日目の後に取り替えるパッチを1枚のみにしそして/または使用済みパッチを異なる数で剥がすことなどを行ってもよい。当該薬の投薬を受けてはいないが既にあるレベルの耐性を示す患者の場合には、最初に複数のパッチを用いるのが特に適切である。最初に2枚以上のパッチを用いそして皮膚に貼り付けるパッチの数を徐々に少なくして行くことによって血中薬濃度を迅速に定常状態の濃度にもって行くことができる。ある患者が当該薬の投薬を受けているか否かを決定する目的で、その過程で医療記録を参考にしてもよい。
【0096】
別の面では、ある患者がオピオイド薬、例えばフェンタニルなどの投薬を受けていないことを決定してもよく(例えば医療記録を基にして)、そしてそのような患者では1日目の間の血中薬濃度の方が定常状態の血中濃度より低くする方が有益である。このような決定を基にして、貼り付ける経皮オピオイドパッチの枚数を1枚のみにしそして薬送達の目的で一度に用いるパッチの枚数が1枚のみになるように毎日(24時間毎に)取り替えを実施する。ある場合には、2−3日かけて定常状態の目標血漿中薬濃度を達成する方が好ましいことを決定してもよく、例えばフェンタニルの投薬を受けていない患者の場合などに決定してもよい。1日目に貼り付けるパッチの数を1枚のみにして最初に開始する療法を用いると、そのように徐々に高くして行くことができそしてそれでも当該患者が薬の投薬を受けていないことが理由で許容される鎮痛を達成することができるであろう。
【0097】
この開示する経皮デバイスをキットの中に含有させることも可能であり、そのキットに本デバイスを含有させかつ使用説明書印刷物、例えば挿入片または印刷物などを容器などの上に含めて、各パッチを患者に貼り付ける時間の長さおよびパッチを剥がして新しいパッチに取り替える頻度がどれくらいの頻度であるかに関する説明を与える。そのような使用説明書に、上述した如きパッチを貼り付ける計画を含めてもよく、それには、最初に1枚のパッチを貼り付けた後に毎日取り替えること、または最初に2枚のパッチを貼り付けた後に両方を剥がすが1日目の後に取り替える枚数を1枚のみにすること、または他の代替計画などの説明が含まれる。そのような使用説明書に、また、当該薬の簡単な説明、裏地、貯蔵層、接着剤、薬理学的情報、対照物質(例えばフェンタニル)を位置させることに関する情報および注意書きなどを含めることも可能である。
【0098】
製造方法
本経皮デバイスの製造を公知方法、例えば米国特許公開番号2003002682に記述されている方法などに従って実施する。簡単に述べると、経皮薬送達デバイスの製造は、マトリクス薬含有接着性貯蔵層を裏地材料の上に生じさせ、保護フィルムを前記マトリクス貯蔵層の上に置きそして切断して所望の大きさのデバイスを生じさせることで実施可能である。薬/接着剤溶液を裏地層の上に流し込み成形した後に溶媒を蒸発させて前記薬/接着剤から出て行かせることで所望の厚みと薬濃度を有する薬含有マトリクスを生じさせることで、薬含有マトリクスを裏地の上に生じさせることができる。
【0099】
模擬
以下は日に1回のフェンタニルパッチの具体的態様の例である。
【0100】
模擬1:定常状態、3日パッチと対比させた1日パッチ
図3に、定常状態における血清中フェンタニル濃度の模擬グラフを示し、この図では、1日経皮フェンタニル塩基パッチの使用を3日経皮基準パッチ[英国の中でJanssen−Cilagから入手可能なDUROGESIC(商標)DTRANS(商標)マトリクスパッチ]の使用と対比させて比較する。3日パッチを皮膚に取り替えることなく3日間貼り付けた後に剥がした時の実際のデータを定常状態投与の連続効果の基準として用いた。その3日パッチが示した実際のデータは図4および図5に示すそれらと同じである。
【0101】
1枚の経皮DTRANS(商標)フェンタニル100μg/時マトリクスシステムを3日間貼り付けた後の実際の個々の血清中フェンタニル濃度データを模擬の目的で用いた。経皮フェンタニルシステムを1回投与した場合のシステム着用中の時間点tにおける血清中フェンタニル濃度C(t)は集めたデータを基にしたものである。各個人が示す消失速度定数k(この定数は当該システムを24時間使用後に剥がした時と同じであると仮定する)を用いた一次減衰関数を用いて、経皮フェンタニルシステムを剥がした後の血清中フェンタニル濃度を見積もる。2番目のシステムを貼り付けると同時に1番目のシステムを剥がした後の時間tの時の血清中フェンタニル濃度C(t)2ndを重ね合わせの原理を基にした下記の式:
C(t)2nd=C(t)+C(τ)e−kt
[式中、τは投与間隔、例えば24時間が終了した時点で1番目のシステムを剥がして2番目のシステムを貼り付ける時には24時間であり、C(t)は1枚のシステムを貼り付けてからt時間後に実測した血清中濃度であり、C(τ)は1枚のシステムを貼り付けてからτ時間後の血清中濃度であり、そしてkはτ時間経過した時点でシステムを剥がした後の血清中フェンタニル濃度を記述する見かけ一次減衰速度定数である]
に従って模擬する。N番目のシステムを貼り付けた後の血清中フェンタニル濃度を下記の式:
【0102】
【数1】

【0103】
に従って模擬する。C(τ)e−ktはτ時の時に貼り付けた古いパッチによる減衰濃度であり、τは投与間隔、即ち24または72時間などである一方、tは最後のパッチを貼り付けてから経過した時間に関係している。
【0104】
定常状態の時(Nが無限に近づく時)の血漿中フェンタニル濃度を下記の式:
【0105】
【数2】

【0106】
に従って模擬する。
【0107】
3日アクリレートマトリクスフェンタニルパッチを37人の健康な被験体に1回貼り付けた後の血清中フェンタニル濃度データを3日システムおよび1日システムの模擬の基準として用いた。DUROGESIC(商標)DTRANS(商標)マトリクスパッチ100μg/時の大きさの約半分(52%)でありかつ同じ組成を有するパッチを模擬の目的で1日パッチとして用いた。このように、3日パッチを用いて得たデータを基にして模擬することで同じ材料構成(表面積を除いて)の1日システムが示すパラメーターを得るための倍率は0.52である。3日アクリレートマトリクスフェンタニルパッチ[DUROGESIC(商標)DTRANS(商標)マトリクスパッチ]を単に1日貼り付けた時のCavg(平均濃度)を3日アクリレートマトリクスフェンタニルパッチを3日間貼り付けた時のCavgで割ることで52%の値に到達した。3日パッチは3日間の時にうまく働くことから、それが最初の日に送達する量は、それを3倍にした値が3日パッチで3日間送達した時の値に相当するであろう量であると仮定する。DUROGESIC(商標)DTRANS(商標)マトリクスパッチ(投薬濃度が100μg/時)を3日パッチとして用いた。従って、1日パッチのマトリクス厚および薬濃度はDUROGESIC(商標)DTRANS(商標)マトリクスパッチのそれらと同じであるが、各々を42cm2ではなく21cm2にした。この模擬では、前記3日パッチを所定時間の時に皮膚にパッチを1枚貼り付けることで3日(72時間)毎に1回取り替えるように貼り付けた。前記1日パッチの模擬を所定時間の時に1枚のパッチを皮膚に貼り付けて毎日(24時間)1回取り替えるように貼り付けることで実貼り付けた。
【0108】
数学的に模擬した定常状態(時間が無限に近くなる)の72時間部分の抜粋をグラフに示す。便利さの目的で、図3のグラフの中に時間をゼロ時から出発して定常状態における72時間の間の時間を示す(即ち曲線は連続的であり、ゼロ時間の前および72時間の後にも繰り返す)。図3中の白丸データ点を伴う破線(−−)曲線は3日パッチの場合の模擬血清中フェンタニル濃度値を示し、菱形データ点を伴う実線曲線は1日パッチの場合の模擬値を示す。この模擬では、図3のグラフに示した抜粋の中に含めなかったが、1日パッチが本質的に定常状態の条件になるには約3日要した。濃度が上昇する最初の2日間(定常状態に到達する前)の間、24時間後の濃度は定常状態Cmaxのほぼ半分のみでありそして48時間後の濃度は定常状態Cmaxの約70%のみであったが、このことは、1日パッチの貼り付けに関して図5に示したそれらと同様であった。3日100μg/時パッチを3日毎に1回取り替えた。この100μg/時パッチの場合の平均Cmaxは約4.7ng/mlでありかつ平均Cminは約2.1ng/mlであったことを特記する。前記1日パッチの場合の平均Cmaxは約3.5ng/mlでありかつ平均Cminは約2.9ng/mlであった。このように、前記1日パッチが示したCmaxの方が前記3日パッチが示したCmaxよりも低かった。しかしながら、前記1日パッチが示したCminの方が前記3日パッチが示したCminより高く、その結果として、前記1日パッチが示したCmaxとCminの間の揺れの方が小さかった。
【0109】
模擬2:1日パッチを3日間貼り付け、最初に2回分
図4に、経皮フェンタニル製品使用開始時の血中フェンタニル濃度の模擬グラフを示し、このグラフでは、1日経皮フェンタニル塩基パッチの使用を3日経皮基準パッチ[DUROGESIC(商標)DTRANS(商標)マトリクスパッチ]を取り替えることなく
1回用いた実際のデータと対比させて比較する。模擬1と同じ皮膚およびパッチパラメーターを用いた。
【0110】
大きさがDUROGESIC(商標)DTRANS(商標)マトリクスパッチの半分でありかつ組成物が同じであるパッチを模擬の目的で1日パッチとして用いた。前記DUROGESIC(商標)DTRANS(商標)マトリクスパッチは各々が42cm2の100μg/時パッチであった。従って、1日パッチのマトリクス厚および薬濃度はDUROGESIC(商標)DTRANS(商標)マトリクスパッチのそれらと同じであったが、各々約21cm2であった。3日パッチの場合、実際の実験で、最初にゼロ時の時にDUROGESIC(商標)DTRANS(商標)マトリクスパッチを1枚のみ貼り付けそして72時間後に剥がすまで貼り付けたままにした。1日パッチの場合には24時間毎に取り替えた。模擬では、ゼロ時の時に1日パッチを2枚貼り付けた。24時間が経過した時点で前記2枚の初期パッチを剥がして貼り付ける新しい1日パッチの数を1枚のみにした。次に、その1日パッチを新鮮なパッチに毎日取り替えた。最終的使用済みパッチを両方の場合とも72時間経過した時点で剥がした。この模擬で生じさせるデータ点の開始を前記3日パッチの物理的に24時間目のデータ点の所にした、と言うのは、両方の場合とも最初の24時間の間に用いたパッチ材料および量が同じであったからである。図4に示したグラフ中の白丸データ点を伴う破線(−−)曲線は前記3日パッチが示したデータを示し、三角データ点を伴う実線曲線は前記1日パッチが示した曲線である。
【0111】
実際の実験データは、3日パッチの場合には血中フェンタニル濃度が全体として徐々に降下することを伴って毎日揺れることを示している。この模擬データは、大きさがDUROGESIC(商標)DTRANS(商標)マトリクスパッチの半分のパッチを用いて血中フェンタニル濃度を24時間目から開始して妥当な安定な治療濃度に維持することができることを示している。実際、毎日の変動は前記3日パッチが示したそれよりもずっと小さい。
【0112】
模擬3:1日パッチを3日間貼り付け、最初に1回分
図5に、経皮フェンタニル製品使用開始時の血清中フェンタニル濃度の模擬グラフを示し、このグラフでは、1日経皮フェンタニル塩基パッチの使用を3日経皮基準パッチ[DUROGESIC(商標)DTRANS(商標)マトリクスパッチ]を使用した実際のデータと対比させて比較する。3日パッチに関するデータは図4に示したそれと同じ実際のデータを用いた。模擬1と同じ薬物動態パラメーターを用いた。
【0113】
大きさがDUROGESIC(商標)DTRANS(商標)マトリクスパッチの半分でありかつ組成物が同じであるパッチを模擬の目的で1日パッチとして用いた。前記DUROGESIC(商標)DTRANS(商標)マトリクスパッチは各々が42cm2の100μg/時パッチであった。従って、1日パッチのマトリクス厚および薬濃度はDUROGESIC(商標)DTRANS(商標)マトリクスパッチのそれらと同じであったが、各々約21cm2であった。3日パッチの場合には、模擬2で用いたそれと同じ実際の物理的実験データを用いた。模擬では、ゼロ時の時に貼り付ける1日パッチを1枚のみにした。24時間経過した時点(即ち24時間後)に前記初期パッチを剥がして1枚の新しい1日パッチと取り替えた。その後、その1日パッチを新鮮なパッチに毎日取り替えた。最終的使用済みパッチを両方の場合とも72時間経過した時点で剥がした。この模擬で生じさせるデータ点の開始をゼロ時にした。図5に示したグラフ中の白丸データ点を伴う破線(−−)曲線は前記3日パッチが示したデータを示し、菱形データ点を伴う実線曲線は前記1日パッチが示した模擬データ示す。この模擬のデータは、大きさがDUROGESIC(商標)DTRANS(商標)マトリクスパッチの半分のパッチを1回に1枚のみ用いて血中フェンタニル濃度を徐々に高くして行くと3日後の治療濃度である濃度に到達することを示している。この1日パッチが1日パッチを用いた模擬1の定常状態の条件と本質
的に同様なピーク条件になるには約3日間要した。濃度が上昇する最初の2日間の間、24時間後の濃度はピークCmaxのほぼ半分のみでありそして48時間後の濃度はピークCmaxの約75%のみであった。取り替える時点で血中フェンタニル濃度が降下する度合は極めて僅かのみであった、と言うのは、血中フェンタニル濃度は絶えず上方に揺れて定常状態の濃度に到達したからである。
【0114】
実験
具体的態様の例を以下に含める。本実施例は単に例示の目的で示すものであり、決して本開示の範囲を限定することを意図するものでない。薬で飽和状態にした貯蔵層を用いることも可能であるが、以下の実施例には、フェンタニルが飽和濃度以下の量で入っていて溶解していない成分を含有しない単相重合体組成物を含有して成る接着性貯蔵層パッチを開示する。以下の実施例では、特に明記しない限り、あらゆるパーセントを重量で表す。以下の実施例では実験の目的で3日パッチを製造する代わりにまたDUROGESIC(商標)DTRANS(商標)またはDUROGESIC(商標)SMAT[これは構造的にDUROGESIC(商標)DTRANSと同様である]パッチを製造供給元から入手することも可能であり、それを実験に必要な如き正確な表面積になるように切断することを特記する。
【0115】
実施例1:3日パッチ、3日に1回貼り付け
フェンタニル塩基含有量が約8重量%の市販DUROGESIC(商標)DTRANS(商標)パッチと同じ構造を持たせた図1に従うモノリス経皮パッチを作成して使用した。マトリクス接着剤はNational Starch DURO−TAK(商標)87−4287ポリアクリレート系接着剤であった。その結果として得たマトリクスの厚みは約2ミル(0.05mm)であった。12.5μg/時、25μg/時、50μg/時、75μg/時および100μg/時の名目上のフェンタニル投薬濃度送達速度に相当する大きさが約5.5cm2、11cm2、21cm2、32cm2および42cm2のパッチを作成した。これらのパッチを作成する過程で、ポリアクリレート系接着剤の溶液を調製した(約39重量%固体のNational Starch 87−4287を98.35kg用いて、これを18.3kgの酢酸エチルで希釈した)。次に、3.35kgのフェンタニル塩基を前記ポリアクリレート系接着剤の溶液にフェンタニルが接着剤溶液に2.8重量%入っている混合物が生じるに充分な量で加えた後、撹拌を行って前記薬を溶解させた。その溶液を流し込み成形した後、溶媒を蒸発させると、結果として厚みが2ミル(0.05mm)の貯蔵層がもたらされた。ポリエチレン/ポリウレタン/ポリエステル層の多積層物で構成されている厚みが1.7ミル(0.04mm)の裏地層を標準的手順で前記接着性薬貯蔵層の上に積層させた。この積層物からそれぞれがフェンタニルを各々4.4、8.5、13および17mg含有する大きさが11cm2、21cm2、32cm2および42cm2の個々のパッチをダイスで切り取ることでフェンタニル塩基を約0.4mg/cm2含有するモノリス経皮パッチを生じさせた。
【0116】
被験体を無作為に処置手順に割り当てて、無作為リストに従って、試験システムを上方外側腕、上方胸または上方背中に着用してもらった。処置期間を4期間にした。選択した被験体はオピオイド依存性でなかった。各処置中、被験体が無作為に決めた貼り付け領域(上方外側腕、上方胸または上方背)の新しい皮膚貼り付け部位に前記試験システムを72時間着用してもらった。各被験体毎に試験期間全体に渡って体の同じ領域を使用してもらった。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。
【0117】
図6に、被験体の血中フェンタニル濃度の平均データの要約を正規化した形態で示す[即ち、データを名目上の投薬濃度送達速度の比係数を用いてフェンタニル濃度を名目上の
投薬濃度送達速度である25μg/時で割ることで25μg/時の投薬速度(即ち投薬濃度)に対して正規化した]。このように、投薬速度が100μg/時の場合のデータを4で割ることで得られる曲線は元々の25μg/時の時の曲線に匹敵していた。図6中の菱形データ点を伴う実線は投薬速度が25μg/時の場合のデータを表している。白丸データ点を伴う破線曲線は投薬速度が50μg/時の場合のデータを表している。星形データ点を伴う破線曲線は投薬速度が75μg/時の場合のデータを表している。星印データ点を伴う破線/点(・−・−)曲線は投薬速度が100μg/時の場合のデータを表している。図6は、投薬速度が異なってもフェンタニル濃度が時間に伴ってほぼ同じ比率で変化することを示している。無次元の正規化形態で表すと、各投薬速度の曲線はほぼ同じであった(実験誤差の範囲内であり、有意な統計学的差を伴わない)。このように、フェンタニル血中濃度をCavg[ここで、Cavgは平均血漿中フェンタニル濃度である]で割った別の正規化形態で表しても、いろいろな投薬濃度が示す曲線(ここのグラフには示していない)はほとんど同じであろう。例えば、最初の48時間以内のCmax/CavgおよびCmin/Cavgは各投薬速度毎にほぼ同じであろう。
【0118】
実施例2:3日パッチ、3日間毎日取り替え
図7に、3日パッチ[構成はフェンタニル塩基含有量が約8重量%の市販DURAGESIC(商標)貯蔵層パッチと同じであった]を用いてそれらを24時間毎に1回取り替えることで経時的に集めた実際の血清中フェンタニル濃度を示す。DUROGESIC(商標)DTRANSマトリクスパッチはDURAGESIC(商標)貯蔵層パッチと生物学的に等しくなるように製造されたものであることから、これらのパッチのいずれの種類を用いても結果として同様な血清中フェンタニル濃度がもたらされるであろう。投薬濃度が75μg/時のパッチを用いた。この試験(結腸直腸手術を受けた11人の患者に試験を受けさせた)では、ゼロ時(麻酔を誘発する約2時間前)の開始時に最初の75μg/時パッチを貼り付けた。チオペンタルを2−4mg/kgおよびフェンタニルボーラスを最大投薬量が400μgになるように3−5μg/kg用いて全身麻酔を誘発した。その後、パッチを24時間毎に取り替えた。72時間が経過した時(後)にパッチ(即ち3回目のパッチ)を剥がした。
【0119】
そのデータは、新しいパッチを貼り付ける毎に血清中濃度が段階的に高くなることを示している。このような結果は予想外であった、と言うのは、多日パッチはフェンタニルの一定静脈内注入と一致した速度で薬を送達するであろうと仮定されていたからである。所定時に皮膚に貼り付けたパッチは1枚のみであることから、予測(一定注入モデルの場合と同様)は、血清中フェンタニル濃度は1枚の3日パッチを皮膚に3日間貼り付けた場合のそれと同様でありかつその場合の血清中フェンタニル濃度は24時間後に得られるほぼ定常状態の濃度にまで上昇して維持されるであろうと言った予測であった。しかしながら、麻酔性オピオイド、例えばフェンタニルなどを送達する時に毎日取り替えると蓄積が起こる影響の結果として血清中薬濃度が数日の間に徐々に(または段階的に)高くなることを確認した。
【0120】
実施例3:1日パッチ(87−2287接着剤を伴う)、3日間以上毎日取り替え
大きさが5、11、21、31および42cm2でフェンタニル塩基含有量が約7重量%である図1に従うモノリス経皮パッチを調製したが、それらは25μg/時、50μg/時、100μg/時、150μg/時および200μg/時に相当する(0.52の倍率を基にして)。
【0121】
マトリクス接着剤はNational Starch DURO−TAK(商標)87−4287ポリアクリレート系接着剤であった。このDURO−TAK(商標)87−4287接着性重合体は、酢酸ビニルを28%とアクリル酸2−エチルヘキシルを67%とアクリル酸ヒドロキシエチルを4.9%とメタアクリル酸グリシジルを0.1%用いて重
合させた接着剤である(米国特許第5,693,335号を参照)。ポリアクリレート系接着剤が約43重量%入っている溶液(National Starch 87−4287が酢酸エチルに入っている)を調製した。このポリアクリレート系接着剤溶液にフェンタニル塩基をフェンタニルが接着剤溶液に約3.4重量%入っている混合物が生じるに充分な量で加えた後、撹拌を行うことで前記薬を溶解させた。その溶液を貯蔵層の中に流し込んだ後、溶媒を蒸発させると、結果として厚みが1ミル(0.025mm)のマトリクス層がもたらされた。溶媒蒸発後に非線状LDPE層/線状LDPE層/非線状LDPE層の多積層物で構成されている厚みが3ミルの裏地層を標準的手順で前記接着性薬貯蔵層の上に積層させる。この積層物から各々がフェンタニルを約7重量%有する大きさが5、11、21、31および42cm2の個々のパッチをダイスで切り取ることでフェンタニル塩基を約0.2mg/cm2含有するモノリス経皮パッチを生じさせる。
【0122】
そのようなパッチをオピオイドの投薬を受けていない患者に最初に1枚のみ貼り付けて24時間毎に取り替えることで投与を実施する。その結果は1日パッチを用いた時に本質的に定常状態の条件になるには約3日間要すると予測する。24時間後の濃度は定常状態Cmaxのそれの約50%から60%のみでありかつ48時間後の濃度は定常状態Cmaxのそれの約70%から80%のみである。この最初の3日間の結果は模擬を基にして約3日後のほぼ定常状態の時に図5に示した結果と同様でありかつ図3に示した結果と同様であると予測する。大きさの差を基にした投薬濃度に従って値を見積もることができ、そしてそのような投薬濃度に従って正規化した曲線は実質的に重なり合うであろう。
【0123】
別の試験として、前記パッチを前記薬が血中に実質的に存在しないヒトに最初にゼロ時の時にパッチを2枚貼り付けることで投与を実施する。24時間が終了した時点で最初のパッチを両方とも剥がして単に1枚の1日パッチに取り替え、そしてその後、24時間毎に取り替える。その結果は1日パッチを用いた時に本質的に定常状態の条件の濃度になるには約1日要すると予測する。最初の24時間の間のフェンタニル濃度Cmaxは約3ng/mlである。その後の2日目および3日目の結果は図4に示した結果(ほぼ定常状態)と同様でありかつ図3に示した結果と同様であると予測する。約3日後にフェンタニル濃度が定常状態になるであろう。大きさの差を基にした投薬濃度に従って値を見積もることができ、そしてそのような投薬濃度に従って正規化した曲線は実質的に重なり合うであろう。
【0124】
実施例4:1日パッチ(87−2287接着剤を伴う)、3日間以上毎日取り替え
大きさが5、11、21、31および42cm2で各々のフェンタニル塩基含有量が約8重量%である図1に従うモノリス経皮パッチを実施例1の方法を用いて調製したが、それらは投薬濃度が25μg/時、50μg/時、100μg/時、150μg/時および200μg/時であることに相当する。
【0125】
ポリアクリレート系接着剤[National Starch DURO−TAK(商標)87−4287、100g]を溶媒(酢酸エチル、160ml)に溶解させる。このポリアクリレート系接着剤溶液にフェンタニル塩基をフェンタニルが接着剤溶液に約2.8重量%入っている混合物が生じるに充分な量で加えた後、撹拌を行うことで前記薬を溶解させた。その溶液を貯蔵層の中に流し込んだ後、溶媒を蒸発させると、結果として厚みが約1ミル(0.025mm)のマトリクス層がもたらされる。溶媒蒸発後にポリエチレン/ポリウレタンポリエステル層の多積層物で構成されている厚みが1.7ミルの裏地層を標準的手順で前記接着性薬貯蔵層の上に積層させる。この積層物から各々がフェンタニルを約8重量%含有する大きさが5、11、21、31および42cm2の個々のパッチをダイスで切り取ることでフェンタニル塩基を約0.2mg/cm2含有するモノリス経皮パッチを1日パッチとして生じさせる。
【0126】
そのような低投薬量のパッチをオピオイドの投薬を受けていない患者に最初に1枚のみ貼り付けて24時間毎に取り替えることで投与を実施する。このように、例えば患者に投薬濃度が100μg/時のデバイスを貼り付ける場合には、その患者に投与する薬を低い投薬濃度、例えば25μg/時などの投薬濃度で開始して上方に漸増させる。その結果は1日パッチを用いた時に本質的に定常状態の条件になるには約3日間要すると予測する。24時間後のCmaxは定常状態Cmaxの約50%から60%のみでありかつ48時間後のCmaxは定常状態Cmaxの約70%から80%のみである。この最初の3日間の結果は、投薬濃度の数値が100μg/時より低い以外は約3日後のほぼ定常状態の時に図5に示した形状と同様でありかつ図3に示した形状と同様であると予測する。大きさの差を基にした投薬濃度に従って値を見積もることができ、そしてそのような投薬濃度に従って正規化した曲線は実質的に重なり合うであろう。
【0127】
別の試験として、前記パッチをオピオイドの投薬を受けていない(前記薬が血中に実質的に存在しない)ヒトに最初にゼロ時の時にパッチを2枚貼り付けることで投与を実施する。24時間が終了した時点で最初のパッチを両方とも剥がして単に1枚の1日パッチに取り替え、そしてその後、24時間毎に取り替える。その結果は1日パッチを用いた時に本質的に定常状態の条件の血中濃度になるには約1日要すると予測する。その後の2日目および3日目の結果は図4に示したそれの形状(ほぼ定常状態)と同様でありかつ図3に示したそれの形状と同様であると予測する。大きさの差を基にした投薬濃度に従って値を見積もることができ、そしてそのような投薬濃度に従って正規化した曲線は実質的に重なり合うであろう。
【0128】
実施例5:3日間貼り付け:3日パッチと対比させた1日パッチ(50μg/時)
投薬濃度が50μg/時になるように実施例1の工程と同様にしてNational Starch DURO−TAK(商標)87−4287を用いてフェンタニル塩基含有量が約8重量%の図1に従うモノリス経皮パッチを調製した。3日パッチの面積は21cm2でありそしてフェンタニルマトリクス層の厚みは約2ミル(0.05mm=50μm)であった。また、比較の目的で、より薄くてより小型の16cm2パッチも1日使用パッチとして作成した。そのような薄いパッチの場合には、前記フェンタニル溶液を流し込み成形してマトリクスの厚み(溶媒蒸発後)が0.038mm(38μm)および0.025mm(25μm)になるようにすることで16cm2のパッチを生じさせた。前記2ミルの3日モノリス経皮パッチのフェンタニル塩基含有量は0.4mg/cm2であった。前記1ミルの1日モノリス経皮パッチのフェンタニル塩基含有量は0.2mg/cm2であった。
【0129】
そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。各被験体に1日パッチおよび3日パッチの両方を貼り付けてもらったが、一緒には貼り付けなかった。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに18人の被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着用してもらった。各被験体毎に試験全体に渡って同じ解剖学的領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。前記3日パッチ(50μm)を72時間着用してもらった後に剥がしてもらった。前記25μmパッチを24時間着用してもらった後に24時間目および48時間目に新しいパッチに変えてもらった。前記38μmパッチを24時間着用してもらった後に24時間目および48時間目に新しいパッチに変えてもらった。1つの期間では、25μmのパッチを24時間着用してもらい、剥がしてもらった後、血中フェンタニル濃度を72時間目が終了するまで監視した。
【0130】
図8に、マトリクスの厚みを変えた時の被験体の血中フェンタニル濃度の平均データ(
あらゆる被験体N=18の全体)の要約を示す。菱形データ点は3日パッチを3日間貼り付けた時のデータを表している。丸のデータ点は38μmの1日パッチを毎日取り替えながら3日間貼り付けた時のデータを表している。四角のデータ点(丸のデータ点の下方)は25μmの1日パッチを毎日取り替えながら3日間貼り付けた時のデータを表している。三角のデータ点は、25μm1日パッチを取り替えることなく1日使用した後に前記パッチを剥がした時のデータを示している。これらの結果は、前記38μmのパッチは3日後に前記3日パッチが示し得る定常状態の血中フェンタニル含有量より高い血中フェンタニル含有量をもたらし得ることを示している。3日後、前記25μmのパッチは前記3日パッチを用いた時になるであろう定常状態血中含有量にほぼ相当する定常状態の血中フェンタニル含有量をもたらした。前記16cm2の25μmパッチがもたらしたフェンタニル含有量は前記3日パッチのそれの38%のみであり、前記模擬1で予測した52%より低かった。前記25μmパッチは約0.4mg/cm2を示した。このパッチのフェンタニル含有量は模擬1の時のそれより低いが、模擬1で予測したフェンタニル送達速度に合致またはそれ以上になり得た。
【0131】
以下に示すようにして、時間0(t=0)の時に当該システムが示す初期平均フェンタニル含有量から平均残存フェンタニル含有量を差し引くことで、送達される平均フェンタニル量を各処置毎に計算した:
送達される平均量(mg)=初期含有量(mg)−平均残存含有量(mg)。
【0132】
このデータは、前記1日システムが送達するフェンタニルの平均量は38μmのQDシステムの場合には1.59mgで25μmのQDシステムの場合には1.39から1.54mgであることを示している。3日50μg/時システムが送達する平均量は3.85mgであった。計算して、初期平均フェンタニル量(t=0の時の当該システムの実際のフェンタニル含有量)は、38μmのQD、25μmのQDおよび3日(50μm)50μg/時のシステムのそれぞれに関して5.47mg、3.42mg、8.01mgであった。システムを貼り付けている間に送達される平均量は、38μmのQD、25μmのQDおよび3日(50μm)50μg/時のシステムのそれぞれに入っているフェンタニルの約29%、43%および48%に相当していた。このように、薄い方の1日QDパッチ(25μm)が示したフェンタニル使用%は3日(50μm)システムが示したそれに近く、厚い方の1日(38μm)QDシステムが示したそれよりも良好であり得た。
【0133】
50μmの3日パッチが示したデータおよび25μmの1日パッチが示したデータを用い、模擬1の模擬方法を用いることで、3日パッチを用いて3日毎に取り替えた場合の定常状態プロファイルおよび1日パッチを用いて毎日取り替えた場合の定常状態のプロファイルの薬物動態学的プロファイルを模擬した。図9に、336時間に及ぶ模擬データを示す。3日パッチの最後の交換を216時間目に行った(実線)。1日パッチの最後の交換を264時間目に行った(破線)。この模擬データは、50μmで21cm2の3日パッチが示した定常状態プロファイルと25μmで18cm2の1日パッチが示したそれが同様であることを示している。50μg/時以外の投薬濃度の場合、データの情報を推定で見積もることができる。例えば、50μg/時のデータのフェンタニル濃度を2倍することで100μg/時の模擬データを得ることができる。
【0134】
実施例6A:12日間貼り付け:3日パッチと対比させた1日パッチ(100μg/時)
投薬濃度が100μg/時になるように実施例1の工程と同様にしてNational
Starch DURO−TAK(商標)87−4287接着剤を用いてフェンタニル塩基含有量が約8重量%の図1に従うモノリス経皮パッチを調製した。3日パッチの面積は42cm2でありそしてフェンタニルマトリクス層の厚みは約2ミル(0.05mm=50μm)であった。また、比較の目的で、より薄いマトリクスの厚みが25μmで36cm2のパッチも1日使用パッチとして作成した。従って、前記1日パッチのフェンタニ
ル量は前記3日パッチのそれの43%であった。前記25μmの1日パッチは約0.2mg/cm2を示した。
【0135】
そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに17人の被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着用してもらった。各被験体毎に試験全体に渡って同じ体領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。前記50μmの3日パッチを72時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で4パッチ)。前記25μmの1日パッチを24時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で12パッチ)。驚くべきことに、両方の大きさとも被験体平均(N=17)フェンタニル濃度は144時間目の後でも高くなり続けた(216時間目前のデータはこのグラフに示していない)。216時間目またはそれ以前に定常状態に到達した。図10に、216時間目から288時間目までの被験体の血中フェンタニル濃度に関する平均データ(N=17に渡る)の要約を示す。菱形データ点を伴う曲線は3日パッチを表している。白丸データ点を伴う曲線は1パッチを表している。これらのデータは、定常状態の血中フェンタニル濃度は1日パッチの場合の方が3日パッチのそれに比べて高いことを示している(1.25倍以上高い)。
【0136】
図11に、図10に示した定常状態3日パッチデータを図9に示したデータから名目上投薬濃度が100μg/時になるように見積もった模擬定常状態3日パッチデータと対比させた比較を示す。その模擬曲線は菱形データ点無しの曲線である。この2つの曲線は非常に良好に合致している。図12に、図10に示した定常状態1日パッチデータ(菱形データ点を伴う上方の曲線)を図9に示したデータから名目上投薬濃度が100μg/時になるように見積もった模擬定常状態1日パッチデータ(下方の曲線)と対比させた比較を示す。実際の定常状態データ(上方の曲線)が示したAUCavgの方が模擬定常状態データのそれよりも約29%高かった。このように、3日パッチの結果は模擬で良好に予測されはしたが、このケースでは、1日パッチの結果と全く同様には予測されなかった。
【0137】
実施例6B:12日間貼り付け:1日パッチ
モノリス経皮1日パッチを実施例6Aに従って作成した。3種類の投与濃度を用いた(1.25、50および100μg/時)。
【0138】
この試験では、1日(簡単にQDと呼ぶ)フェンタニルマトリクス(接着剤の厚みが25μm)システムの投薬範囲の全体を網羅する目的で、この製品と仮定した名目上の送達速度である約12.5μg/時、50μg/時および100μg/時の投薬量関係をシステムの面積の大きさ(それぞれ4.5cm2、18cm2および36cm2)を変えて評価した。被験体に下記の3処置を無作為割り当て順に従って重複様式で受けさせた:処置A:(図13に菱形で示すデータ点、被験体n=16)フェンタニルマトリクスQD 12.5μg/時で4.5cm2のシステム面積、1回貼り付け。処置B:(図13に白丸で示すデータ点、被験体n=16)フェンタニルマトリクスQD 50μg/時で18cm2のシステム面積、1回貼り付け。処置C:(図13に白三角で示すデータ点、被験体n=17)フェンタニルマトリクスQD 100μg/時で36cm2のシステム面積、1回貼り付け。13人の被験体が試験を完了した。このように、1日パッチのフェンタニル量は3日パッチのそれの約38%であった。そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに前記被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着
用してもらった。各被験体毎に試験全体に渡って同じ体領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。各処置の平均血清中フェンタニル濃度を図13に示す。図13のデータは、血中フェンタニル濃度が投薬濃度の関数であることを示している。測定血清中フェンタニル濃度で表す血中フェンタニル濃度を個々の投薬濃度で割ることで正規化すると形状および値が互いに非常に近い曲線がもたらされることが分かる。
【0139】
初期平均フェンタニル量(t=0の時に12.5μg/時、50μg/時および100μg/時のシステムを測定した時のフェンタニル含有量)はそれぞれ0.97mg、3.5mgおよび7.1mgであった。3投薬濃度(12.5μg/時、50μg/時および100μg/時)の全部を同じ積層物から作成したことから、それらはmg/cm2を基に同じフェンタニル含有量を示すはずである(3ロットの放出値の平均として0.20mg/cm2)。次に、その12.5μg/時、50μg/時および100μg/時のシステムに関して計算したそれぞれの初期フェンタニル含有量である0.91mg、3.64mgおよび7.29mgを用いてフェンタニル送達量を計算した。このデータは、投薬濃度が名目上12.5μg/時、50μg/時および100μg/時のシステムが送達する平均フェンタニル量はそれぞれ0.38mg、1.24mgおよび2.92mgであることを示していた。システムを貼り付けている間に送達される平均フェンタニル量(使用%)は12.5μg/時、50μg/時および100μg/時のシステムのそれぞれに入っているフェンタニル量の約42%、34%および40%に相当していた。比較として、DUROGESIC(商標)DTRANS(商標)が示す使用%はそれらとあまり違わなかった。DUROGESIC(商標)DTRANS(商標)フェンタニルパッチの試験では、12人の被験体を用い、100μg/時および12.5μg/時のDUROGESIC(商標)DTRANS(商標)フェンタニル(8システムに及ぶ)を貼り付けた後のシステムを残存フェンタニル含有量に関して分析した。100μg/時のフェンタニルパッチを貼り付けた後の平均残存フェンタニル含有量は9.34mgであった。12.5μg/時のフェンタニルパッチを8枚貼り付けた後の平均残存フェンタニル含有量は1.05mgであった。
【0140】
100μg/時および12.5μg/時のDUROGESIC(商標)DTRANS(商標)フェンタニルシステムがロットクリアランス(lot clearance)の時に示した平均フェンタニル含有量はそれぞれ16.3および2.0mgであった。このように、残存フェンタニル含有量を基にして吸収される平均フェンタニル量は100μg/時および12.5μg/時のDTRANS(商標)フェンタニルシステムのそれぞれに関して6.96および0.95mgであると推定する。投薬濃度が100μg/時および12.5μg/時のパッチの場合の使用率はそれぞれ43%および48%である。勿論、DUROGESIC(商標)DTRANS(商標)フェンタニルシステムの場合の使用%値は3日間使用後の値である。DUROGESIC(商標)DTRANS(商標)フェンタニルシステムの1日使用当たりの平均使用%は3日間の値の1/3のみであり、投薬濃度が100μg/時および12.5μg/時のパッチの場合のそれはそれぞれ約12.5%および16%であろう。
【0141】
実施例7:12日間貼り付け:3日パッチと対比させた32cm2の1日パッチ(100μg/時)
投薬濃度が100μg/時になるように実施例1の工程と同様にしてNational
Starch DURO−TAK(商標)87−4287接着剤を用いてフェンタニル塩基含有量が約8重量%の図1に従うモノリス経皮パッチを調製した。3日パッチの面積は42cm2でありそしてフェンタニルマトリクス層の厚みは約2ミル(0.05mm=50μm)であった。また、比較の目的で、より薄い25μmで32cm2のパッチも1
日使用パッチとして作成した。従って、前記1日パッチのフェンタニル量は前記3日パッチのそれの約38%であった。
【0142】
そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに17人の被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着用してもらった。各被験体毎に試験全体に渡って同じ体領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。前記50μmの3日パッチを72時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で4パッチ)。前記25μmの1日パッチを24時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で12パッチ)。360時間目までデータを集めた。両方の大きさとも被験体平均(N=17)フェンタニル濃度は144時間目の後でも高くなり続けた。216時間目またはそれ以前に定常状態に到達した。図14に、216時間目から288時間目までの被験体の血中フェンタニル濃度に関する平均データ(N=17に渡る)の要約を示す。白丸データ点を伴う曲線は1日パッチを表している。菱形データ点を伴う曲線は3パッチを表している。これらのデータは、定常状態の血中AUCフェンタニル濃度は1日パッチの場合の方が3日パッチのそれに比べて若干高いことを示している。
【0143】
表2に、前記3日パッチが示した薬物動態パラメーターを前記1日パッチが示したそれと対比させた比較を示す。定常状態の条件の場合のデータは216時間目から288時間目までの72時間のデータであると見なした。AUCssデータを幾何平均および平均(CV%)として示す。CVは、平均値で割った標準偏差である。CmaxおよびCminを平均(CV%)として示す。
【0144】
1日パッチ(Trt C)が示したAUCssは3日パッチ(Trt A)のそれの約1.07倍であった。1日パッチが示したCmaxは3日パッチが示したそれの約0.94倍であった。1日パッチが示したCminは3日パッチが示したそれの約1.2倍であった。このように、1日パッチと3日パッチは生物学的に同等であった。表2中の驚くべき差は(Cmax−Cmin)/Cavgとして定義する変動であり、この場合のCavg=AUCss/72である。このような変動は定常状態の間の血中フェンタニル濃度が変動する度合がどれほど大きいかを示している(これを無次元数で表す)。前記3日パッチの場合、CmaxとCminの間の揺れの大きさは平均濃度Cavgとほぼ同じであった。前記1日パッチの場合の変動は前記3日パッチの場合のそれの約64%のみであり、実質的に小さかった。このように、前記1日パッチはより一定した血中濃度をもたらした。
【0145】
【表2】

【0146】
表3に、3日パッチ(Trt A)が示したデータの統計学的値を1日パッチ(Trt
C)のそれと対比させて示す。
【0147】
【表3】

【0148】
このように、前記統計学は、DUROGESIC(商標)DTRANS(商標)に対する1日パッチが示したCmaxおよびAUCss比の90%信頼区間は80%以内および125%以内であることを示している。従って、前記1日パッチは100μg/時の3日パッチであるDUROGESIC(商標)DTRANS(商標)と生物学的に同等である。前記32cm2の1日パッチのフェンタニル含有量は6.7mgでありかつ100μg/時のDUROGESIC(商標)DTRANS(商標)パッチのフェンタニル含有量は16.8mgである。従って、フェンタニル含有量が16.8mgの3日パッチを用いた時と生物学的に同等な量のフェンタニルを送達するには1日パッチを3枚(全体で20.1mgのフェンタニル)用いる必要がある(約18.5%の差)。予測使用%により、それは43%から35%までの降下である。しかしながら、そのような1日パッチが示した使用%性能は、そのパッチに入っているフェンタニルを使用するに要した時間は3日パッチに比較して3日パッチの1/3のみであることを考慮すると妥当に良好である。予測した1日当たりの使用%により、前記1日パッチの使用%の方が前記3日パッチのそれよりもずっと高かった。個々のパッチを考慮すると、前記1日パッチに入っているパッチ当たりの残存フェンタニルの量の方が前記3日パッチのそれよりも有意に少ない。
【0149】
実施例8:12日間貼り付け:3日パッチと対比させた28cm2の1日パッチ(100μg/時)
投薬濃度が100μg/時になるように実施例1の工程と同様にしてNational
Starch DURO−TAK(商標)87−4287接着剤を用いてフェンタニル塩基含有量が約8重量%の図1に従うモノリス経皮パッチを調製した。3日パッチの面積は42cm2でありそしてフェンタニルマトリクス層の厚みは約2ミル(0.05mm=50μm)であった。また、比較の目的で、より薄い25μmで28cm2のパッチも1日使用パッチとして作成した。従って、前記1日パッチのフェンタニル量は前記3日パッチのそれの約33%であった。
【0150】
そのようなパッチをオピオイドの投薬を受けていない患者に貼り付けた。選択した被験体はオピオイド依存性ではなかった。厚みが異なるパッチをいろいろな期間用いることで前記パッチに19から20人の被験体による試験を受けさせた。各処置中、試験システムを貼り付け領域の新しい貼り付け皮膚部位に決めた時間着用してもらった。各被験体毎に試験全体に渡って同じ体領域を用いた。最低限で少なくとも6日間のウォッシュアウト期間を設けそして処置と処置の間が14日以上にならないようにした。前記試験システムを剥がした時点でウォッシュアウト期間を開始させた。前記50μmの3日パッチを72時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で4パッチ)。前記25μmの1日パッチを24時間着用してもらった後に剥がして新しいパッチに取り替えてもらった(全体で12パッチ)。260時間目までデータを集めた。両方の大きさとも被験体平均フェンタニル濃度は144時間目の後でも高くなり続けた。216時間目またはそれ以前に定常状態に到達した。図15に、216時間目から288時間目までの被験体の血中フェンタニル濃度に関する平均データの要約を示す。このデータは、定常状態の血中AUCssフェンタニル濃度を1日パッチ(n=20)の場合と3日パッチ(n=19)の場合を比較した時に近いことを示している。前記20人の被験体の中の一人には3日パッチを用いた試験を受けさせなかった。菱形は3日パッチが示したデータ点を表している。白丸は1日パッチが示したデータ点を表している。図15中、2種類のパッチが示したAUCssは近かったが、個々の被験体の間の差が大きいデータ点が4個(例えば242、243、245、252時間点)存在し、このようにデータの統計学的有意さに影響を与えた。
【0151】
表4Aおよび表4Bに、前記3日パッチが示した薬物動態パラメーターを前記1日パッチが示したそれと対比させた比較を示す。定常状態の条件の場合のデータは216時間目から288時間目までの72時間のデータであると見なした。AUCssデータを幾何平均および平均(CV%)として示す。CVは、平均値で割った標準偏差である。CmaxおよびCminを平均(CV%)として示す。
【0152】
表4Aに、1日パッチと3日パッチの両方を個別に貼り付けた19人の被験体(N=19)に関するデータを示す。このように、1日パッチのみを貼り付けた(3日パッチを個別には貼り付けなかった)被験体を排除した。
【0153】
【表4A】

【0154】
19人の被験体の中の5人が異常データ点を示した(即ち隣接するデータ点とは有意に異なるデータ点)。216時間目から288時間目の間に集めたサンプル中のフェンタニル代謝産物であるノルフェンタニルを分析した結果、異常データを示した5人の被験体全部が安定な代謝産物濃度を示すことが分かり、このことは、その5人の被験体が示した異常なデータは経皮フェンタニル輸送が原因ではないことを示している。分析を受けさせた5人の被験体の特定サンプルが大きな変動を示したのは汚染によるものである可能性が高かった。例えば、図16に、異常データを示した典型的な被験体の血清中フェンタニル濃度およびノルフェンタニル濃度を示す。菱形データ点を伴う曲線Fは1日パッチのフェンタニルデータを表す一方で、白丸データ点を伴う曲線NORは同じパッチ送達のノルフェンタニルデータを表している。240時間後のデータ点の中のいくつかはフェンタニル濃度の点で幅広い変動を示したが、代謝産物であるノルフェンタニルの濃度は同じ期間の間安定であった。血清中フェンタニル濃度が経皮送達によってそのように幅広くかつ急速に変動するのは物理的不可能である。このように、その期間の時のノルフェンタニル濃度は、送達されるフェンタニル量が変動したことを示すより良好な指標であった。表4Bに、異常値を示した被験体のデータを除いた後の表4Aのデータを示す。表4Bに示す被験体の数は14(N=14)である。
【0155】
【表4B】

【0156】
表4Bは、前記1日パッチが示したAUCss(216時間目から288時間目までのAUC(216−288)で示す)は幾何平均データを基にして前記3日パッチのそれの約0.9倍であることを示している。前記1日パッチが示したCmaxの幾何平均は3日
パッチのそれの約0.9倍であった。前記1日パッチが示したCminの幾何平均は3日パッチのそれの約1.0倍であった。変動度合(%)は1日パッチの場合が約70であるのに対して3日パッチの場合は約75であった。表4Bのみを考慮すると、表4B中のAUCss、CmaxおよびCminは1日パッチと3日パッチの間の差は僅かであることから前記1日パッチは前記3日パッチと生物学的に同等であると見なすことができる。表4Bのデータから、28cm2の1日パッチが体にもたらしたフェンタニルの量は100μg/時のDUROGESIC(商標)DTRANS(商標)のそれと生物学的に同等な量であった。28cm2のパッチの各々に入っているフェンタニルの量は約5.9mgであった。従って、100μg/時のDUROGESIC(商標)DTRANS(商標)パッチに入っている16.8mgのフェンタニルと同じ量のフェンタニルを送達するには1日パッチに入っているフェンタニル量を全体で17.7mg(3x5.9)にする。28cm2の1日パッチを使用した後の使用率は39%であると推定したが、これは100μg/時のDUROGESIC(商標)DTRANS(商標)パッチの場合のそれの43%より若干低いのみであった。しかしながら、1日当たり使用率は1日パッチの場合の方が有意に高かった。
【0157】
本発明の実施では、特に明記しない限り、製薬学的製品開発者が当該技術分野の技術の範囲内で用いる通常の方法を用いる。そのような技術は文献に詳細に説明されている。
【0158】
上述した典型的な態様はあらゆる面で限定ではなく本発明の例示であることを意図する。従って、本発明は詳細な実施の点で本明細書に含めた説明から当業者が引き出す可能性のあるいろいろな変形を受け得る。そのような変形および修飾形の全部が本発明の範囲内であると見なす。
【0159】
また、本発明の主たる特徴または態様は次のとおりである。
【0160】
態様1:経皮パッチを用いて薬を投与するためのキットであって、
(a)裏地層、
前記裏地層の上に位置している貯蔵層であって、少なくとも該貯蔵層の皮膚接触表面が接着性であり、かつ鎮痛を1日の間ヒトに誘発しかつ維持するに充分な量でフェンタニルを含有する重合体組成物を含有して成る、上記貯蔵層、
を含有して成る、フェンタニルを皮膚に通して投与するための経皮パッチであって、皮膚にパッチを毎日1枚ずつ取り替えて貼り付けることで鎮痛に有効な定常状態の血漿中濃度を達成する、上記経皮パッチ、および
(b)前記経皮パッチを毎日取り替えることに関する使用説明書を包含する使用説明書印刷物、
を含有して成るキット。
【0161】
態様2:前記重合体組成物がポリアクリレートを含有しかつ1日使用後の前記パッチ中の薬の使用率が少なくとも30重量%である態様1記載のキット。
【0162】
態様3:前記薬がフェンタニル塩基でありかつ前記貯蔵層がポリアクリレートから本質的に成る接着性重合体から作られた層でありそして1日使用後の前記パッチ中の薬の使用率が少なくとも35重量%である態様2記載のキット。
【0163】
態様4:前記パッチが定常状態の時に15から60ng/ml(mg/時)の正規化Cmaxおよび10から55ng/ml(mg/時)の正規化Cminを示す態様3記載のキット。
【0164】
態様5:前記パッチが0.1から20μg/cm2・時の定常状態薬流量を示す態様4記
載のキット。
【0165】
態様6:前記パッチが定常状態の時に15ng・時/mlから200ng・時/mlのAUCinfを示す態様3記載のキット。
【0166】
態様7:前記パッチが0.1から20μg/(cm2・時)の定常状態薬流量を示す態様6記載のキット。
【0167】
態様8:前記貯蔵層が0.14から0.3mg/cm2の濃度の量で溶解しているフェンタニル塩基を含有して成る態様2記載のキット。
【0168】
態様9:前記パッチが名目上1日送達でフェンタニル1mg当たりに有する投薬濃度に対して正規化された面積が8.5から16.5cm2である態様1記載のキット。
【0169】
態様10:前記貯蔵層がフェンタニル塩基溶解度が1重量%から25重量%の重合体を含有して成りかつ1日使用時に前記貯蔵層に残存するフェンタニル塩基の量が70重量%未満である態様8記載のキット。
【0170】
態様11:前記貯蔵層がフェンタニル塩基を貯蔵層面積当たり0.14から0.3mg/cm2含有して成りかつ前記パッチが名目上1日送達でフェンタニル1mg当たりに有する投薬濃度に対して正規化された面積が10.5から15cm2である態様8記載のキット。
【0171】
態様12:前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)である態様8記載のキット。
【0172】
態様13:前記貯蔵層が更に促進剤も含有して成る態様12記載のキット。
【0173】
態様14:経皮パッチ中に存在する接着剤もしくはマトリクス層が1種類のみでありかつ前記貯蔵層が促進剤を含有しない態様3記載のキット。
【0174】
態様15:前記裏地層が下記:ポリウレタン、ポリ酢酸ビニル、ポリ塩化ビニリデン、ポリエチレン、ポリエチレンテレフタレート(PET)、PET−ポリオレフィン積層物およびポリブチレンテレフタレートの中の少なくとも1種から選択される重合体を含有して成る態様3記載のキット。
【0175】
態様16:前記裏地層の厚みが0.012mm(0.5ミル)から0.125mm(5ミル)である態様3記載のキット。
【0176】
態様17:最初の日にパッチを2枚貼り付けそして次にその後の日毎にパッチを1枚ずつ貼り付けることによって1日の内に15から60ng/ml(mg/時)の定常状態正規化Cmaxおよび10ng/ml(mg/時)から55ng/ml(mg/時)の正規化Cminをもたらす態様3記載のキット。
【0177】
態様18:最初の日にパッチを1枚貼り付けそして次にその後の日毎にパッチを1枚ずつ貼り付けることによって3日間の内に15から60ng/ml(mg/時)の正規化Cmaxおよび10ng/ml(mg/時)から55ng/ml(mg/時)の正規化Cminをもたらす態様3記載のキット。
【0178】
態様19:前記パッチが示す定常状態(正規化Cmax−正規化Cmin)差が0.5n
g/ml(mg/時)から2ng/ml(mg/時)である態様18記載のキット。
【0179】
態様20:前記パッチが前記パッチを1回貼り付けた後に示す正規化Cmaxが0.01から0.2ng/ml・cm2である態様19記載のキット。
【0180】
態様21:前記パッチが示す定常状態薬流量が1から10μg/cm2・時である態様19記載のキット。
【0181】
態様22:フェンタニルが前記貯蔵層中で示す溶解度が7重量%から12重量%である態様17記載のキット。
【0182】
態様23:前記貯蔵層がポリアクリレートマトリクスを有するマトリクス貯蔵層でありかつ前記ポリアクリレートがアクリル酸2−ヒドロキシエチル単量体を5−10重量%、酢酸ビニルを20−40重量%およびアクリル酸2−エチルヘキシルを55−75重量%有する態様3記載のキット。
【0183】
態様24:前記貯蔵層がNational Starch DURO−TAK(商標)87−4287接着剤であるポリアクリレートマトリクスを有するマトリクス貯蔵層である態様3記載のキット。
【0184】
態様25:重合体組成物を含有しかつフェンタニルを鎮痛を1日の間ヒトに誘発しかつ維持するに有効な量で含有する接着性フェンタニル貯蔵層を裏地層の上に含有して成るフェンタニル投与用経皮パッチであって、皮膚に毎日取り替えて貼り付けることで15から60ng/ml(mg/時)の定常状態正規化Cmaxおよび2から60ng/ml(mg/時)の正規化Cminを達成しかつ前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)でありそして1日使用後に前記パッチが示すフェンタニル使用率が少なくとも35重量%である、上記経皮パッチ。
【0185】
態様26:フェンタニル塩基の投与を必要としているヒトにそれを投与する方法であって、定常状態の送達が鎮痛維持に有効なようにモノリス経皮パッチを皮膚に毎日1枚ずつ取り替えて貼り付けることを含んで成り、該パッチが、裏地並びにポリアクリレートおよびフェンタニル塩基を含有する重合体組成物を含有して成る貯蔵層、を含有する上記方法。
【0186】
態様27:毎日取り替える時に前記パッチが1日使用後に示すフェンタニル塩基使用率が少なくとも35重量%である態様26記載の方法。
【0187】
態様28:更に前記ヒトがオピオイドの投薬を受けていないことを決定しかつ最初の日そしてパッチを毎日1枚ずつ取り替える時に貼り付けるパッチが1枚のみであることも含んで成る態様26記載の方法。
【0188】
態様29:更に前記ヒトがオピオイドの投薬を受けていないことを決定しかつ最初の日そして血漿中のフェンタニル濃度が2日間の間定常状態の範囲であるように前日のパッチの代わりに新しいパッチを毎日貼り付ける時にパッチを1枚貼り付けることも含んで成る態様26記載の方法。
【0189】
態様30:更にパッチを貼り付ける1日目に前記ヒトがオピオイドに耐性があることを決定しかつ最初の日にパッチを2枚貼り付けそして2日目から開始して血漿中のフェンタニル濃度が1日の間鎮痛に有効であるように前日のパッチの代わりに新しいパッチを毎日貼り付けることも含んで成る態様26記載の方法。
【0190】
態様31:更にパッチを貼り付ける最初の日に前記ヒトの医療記録に従って前記ヒトがオピオイドに耐性があることを決定しかつ最初の日にパッチを2枚貼り付けそして2日目から開始して血漿中のフェンタニル濃度が1日の間鎮痛に有効であるように前日のパッチの代わりに新しいパッチを毎日貼り付けることも含んで成る態様26記載の方法。
【0191】
態様32:前記パッチが定常状態の時に15から60ng/ml(mg/時)の正規化Cmaxおよび10から55ng/ml(mg/時)の正規化Cminを示す態様26記載の方法。
【0192】
態様33:前記パッチが0.1から20μg/(cm2・時)の定常状態薬流量を示す態様26記載の方法。
【0193】
態様34:前記パッチが示す定常状態(正規化Cmax−正規化Cmin)差が0.5ng/ml(mg/時)から2ng/ml(mg/時)である態様26記載の方法。
【0194】
態様35:前記パッチが示す定常状態薬流量が0.1から20μg/(cm2・時)でありかつ前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)である態様26記載の方法。
【0195】
態様36:前記貯蔵層が20mg/gmから200mg/gmの濃度の量で溶解しているフェンタニルを含有して成る態様26記載の方法。
【0196】
態様37:前記貯蔵層がフェンタニル塩基溶解度が1重量%から25重量%の重合体を含有して成る態様26記載の方法。
【0197】
態様38:前記貯蔵層がフェンタニル塩基を貯蔵層の面積当たり0.14から0.3mg/cm2含有して成りかつ前記パッチが名目上1日送達でフェンタニル1mg当たりに有する投薬濃度に対して正規化された面積が10.5から15cm2である態様26記載の方法。
【0198】
態様39:前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)である態様26記載の方法。
【0199】
態様40:前記貯蔵層が1日使用後に有する残存フェンタニル塩基が30重量%未満である態様26記載の方法。
【0200】
態様41:鎮痛のためにフェンタニルの投与を必要としているヒトにそれを投与するための経皮パッチの製造におけるフェンタニル塩基の使用であって、前記経皮パッチが、フェンタニル貯蔵層を裏地層の上に含有して成り、前記貯蔵層が、ポリアクリレート並びに1日の使用毎に1枚のパッチで鎮痛を1日の間ヒトに誘発しかつ維持するためのフェンタニル塩基を含有する重合体組成物を含有して成り、かつ皮膚に毎日取り替えて貼り付けることで15から60ng/ml(mg/時)の定常状態正規化Cmaxおよび10から55ng/ml(mg/時)の正規化Cminが達成され、かつ前記フェンタニル塩基が前記貯蔵層中で示す溶解度が少なくとも4重量%であり、前記貯蔵層の厚みが0.0125mm(0.5ミル)から0.0375mm(1.5ミル)でありかつ1日使用後の前記パッチ中のフェンタニル塩基使用率が少なくとも35重量%である使用。
【産業上の利用可能性】
【0201】
本発明は、副作用を低減し、乱用を防止できる、フェンタニルによる鎮痛を効果的にもたらす、経皮パッチ等を提供できる。したがって、例えば、医薬製造業で利用できる。
【特許請求の範囲】
【請求項1】
経皮パッチを用いて薬を投与するためのキットであって、
(a)裏地層、
前記裏地層の上に位置している貯蔵層であって、少なくとも該貯蔵層の皮膚接触表面が接着性であり、かつ鎮痛を1日の間ヒトに誘発しかつ維持するに充分な量でフェンタニルを含有する重合体組成物を含有して成る、上記貯蔵層、
を含有して成る、フェンタニルを皮膚に通して投与するための経皮パッチであって、皮膚にパッチを毎日1枚ずつ取り替えて貼り付けることで鎮痛に有効な定常状態の血漿中濃度を達成する、上記経皮パッチ、および
(b)前記経皮パッチを毎日取り替えることに関する使用説明書を包含する使用説明書印刷物、
を含んで成るキット。
【請求項1】
経皮パッチを用いて薬を投与するためのキットであって、
(a)裏地層、
前記裏地層の上に位置している貯蔵層であって、少なくとも該貯蔵層の皮膚接触表面が接着性であり、かつ鎮痛を1日の間ヒトに誘発しかつ維持するに充分な量でフェンタニルを含有する重合体組成物を含有して成る、上記貯蔵層、
を含有して成る、フェンタニルを皮膚に通して投与するための経皮パッチであって、皮膚にパッチを毎日1枚ずつ取り替えて貼り付けることで鎮痛に有効な定常状態の血漿中濃度を達成する、上記経皮パッチ、および
(b)前記経皮パッチを毎日取り替えることに関する使用説明書を包含する使用説明書印刷物、
を含んで成るキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2013−60470(P2013−60470A)
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2013−112(P2013−112)
【出願日】平成25年1月4日(2013.1.4)
【分割の表示】特願2010−529152(P2010−529152)の分割
【原出願日】平成20年10月15日(2008.10.15)
【出願人】(503073787)アルザ・コーポレーシヨン (113)
【Fターム(参考)】
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成25年1月4日(2013.1.4)
【分割の表示】特願2010−529152(P2010−529152)の分割
【原出願日】平成20年10月15日(2008.10.15)
【出願人】(503073787)アルザ・コーポレーシヨン (113)
【Fターム(参考)】
[ Back to top ]

