早期膵がんの検出方法
【課題】腫瘍サイズが2cm以下の早期膵がんを短時間かつ容易に検出する方法およびそれに使用する試薬を提供する。
【解決手段】この発明の早期膵がんの検出方法は、放射性核種で標識されたc(RGDfK)ペプチドを、哺乳動物に投与する工程、及び、投与後の哺乳動物の膵臓における前記放射性核種を検出する工程を含む。
【解決手段】この発明の早期膵がんの検出方法は、放射性核種で標識されたc(RGDfK)ペプチドを、哺乳動物に投与する工程、及び、投与後の哺乳動物の膵臓における前記放射性核種を検出する工程を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、膵がんの検出方法に関し、より詳細には、微小サイズの早期膵がんを簡便かつ短時間に非侵襲的に検出する方法及びその方法に好適な試薬又はキットに関する。
【背景技術】
【0002】
膵がんは、特徴的な自覚症状に乏しく、75%以上はステージIV(腫瘍の大きさが2cm以上、膵がんは膵臓の外へ少し出ており、第2群のリンパ節転移があるか、またはがんが膵臓周囲の血管におよんでいるがリンパ節転移はないか第1群までに限られている)で発見される。発見が遅れる結果、5年生存率が5%以下という極めて予後不良な悪性がんとなっている。さらに、ステージI(腫瘍の大きさが2cm以下、リンパ節転移なし、膵臓の内部に限局)の切除例でも、5年生存率が32%という難治がんである。
【0003】
膵がんによる死亡率を顕著に下げるためには、膵臓における1cm以下の微小病変の早期発見とそれに基づいた早期治療が不可欠である。膵がん診断法の1つに、放射性造影剤を用いたPET診断がある。特に、造影剤としてFDG(フルオロデオキシグルコース)を用いたPET診断(FDG−PET)は、保険適用もあって普及している。しかし、FDG−PETを含む従来の膵がんのPET診断では、異型過形成や1cm以下の微小膵がん、及び、ステージI(腫瘍の大きさが2cm以下)の検出が困難である。さらに、FDGは、炎症部位(膵炎)に対して擬陽性を呈することがある。したがって、現状では、膵がんの微小病変を高い確度で検出する方法やそれに用いるイメージング剤は確立されていない。
【0004】
インテグリンは、細胞接着(細胞−細胞間、細胞−細胞外基質間)に関与する膜貫通型の糖タンパクの一種である。インテグリンは、α鎖とβ鎖からなるヘテロ2量体で構成され、サブタイプがいくつか知られている。αvβ3インテグリンは、一部の腫瘍細胞や血管新生中の内皮細胞に高発現し、通常の正常細胞や内皮細胞にはほとんど発現しない。そこで、αvβ3インテグリンが、腫瘍イメージングにおける標的分子として注目されている。
【0005】
αvβ3インテグリンは、特にアルギニン(R)−グリシン(G)−アスパラギン酸(D)の配列からなるペプチド(RGD)を認識する。この特性を利用して、種々のRGD類似化合物やRGD含有ペプチドからなるαvβ3インテグリンリガンド等が開発されている。
【0006】
例えば、125I−c(RGDyV)及び125I−c(RGDfY)が、MelanomaM21、Osterosarcoma、Mammary cacrinomaを移植した担がんモデルマウスで評価されている(非特許文献1)。125I−c(RGDyV)は、αvβ3インテグリン特異的な腫瘍集積と速やかな血液クリアランスを示すが、肝臓への高い集積を示すことが問題であった。肝臓への非特異的集積を改善するために、c(RGDyK)やc(RGDfK)が開発された(非特許文献2〜3)。
【0007】
また、ペプチドに糖修飾することにより親水性を高めたGalacto−c(RGDfK)が開発されている。糖の導入は、アミノメチル基への18F標識([18F]Galacto−c(RGDfK))を可能にし、薬物動態の改善とPETトレーサーへの応用を可能にする。Haubnerらは、悪性黒色腫、肉種、骨転移がん及び絨毛結節性骨膜炎の患者9名に185Mbqの[18F]Galacto−c(RGDfK)を投与した(非特許文献5)。[18F]Galacto−c(RGDfK)は腎臓に最も高い集積を示し、動物実験から得られた知見とよく一致した。
【0008】
本発明者もまた、111In−DOTA−c(RGDfk)及び90Y−DOTA−c(RGDfk)を用いたαvβ3インテグリンイメージング及び内用放射線療法を報告している(非特許文献6)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】R.Haubner,et al.:Radiolabeled αvβ3integrin antagonists:a new class of tracers for tumor targeting,J.Nucl.Med.,40,1061−1071(1999)
【非特許文献2】X.Chen,et al.:MicroPET and autoradiographic imaging of breast cancer αv−integrin expression using 18F− and 64Cu−labeled RGD peptide,Bioconjug.Chem.,15,41−49(2004)
【非特許文献3】X.Chen,et al.:Pharmacokinetics and tumor retention of 125I−labeled RGD peptide are improved by PEGylation,Nucl.Med.Biol.,31,11−19(2004)
【非特許文献4】M.Janssen,et al.:Comparison of a monomeric and dimeric radiolabeled RGD−peptide for tumor targeting,Cancer Biother.Radiopharm.,17,641−646(2002)
【非特許文献5】R.Haubner,et al.:Noninvasive visualization of the activated αvβ3integrin in cancer patients by positron emission tomography and [18F]Galacto−RGD,PLoS Med.,2,e70(2005)
【非特許文献6】Yoshimoto M,et al.:αvβ3Integrin−targeting radionuclide therapy and imaging with monomeric RGD peptide:Int J Cancer.Aug 1,123(3),709−15(2008)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、膵がんの微小病変の発見に基づく早期膵がんの検出方法、及びその方法に好適な試薬及びキットを提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者は、αvβ3インテグリンを標的とした膵がんイメージングを鋭意検討した結果、以下の方法によれば早期膵がんを検出可能であることを発見した。すなわち、本発明は、放射性核種で標識されたc(RGDfK)ペプチドを、哺乳動物に投与する工程、及び、投与後の哺乳動物の膵臓における前記放射性核種を検出する工程を含む、早期膵がんの検出方法、ならびに放射性核種で標識されたc(RGDfK)ペプチドを有効成分とする、哺乳動物の早期膵がん検出用試薬又はそのキットを提供する。
【0012】
c(RGDfK)ペプチドは、血管内皮細胞を標的にした血管新生や腫瘍のイメージングに使用されることが示唆されており、そのため、腫瘍の浸潤・転移能といった悪性度の評価に利用されていた。しかし、膵がんの早期発見は非常に困難であるという従来の認識から、微小病変の発見を目的とした膵がんの早期検出には利用されていなかった。したがって、本発明の方法及び試薬により膵がんの微小病変をin vivo又はex vivoイメージング可能であることは全く予想できなかった。
【0013】
本発明の方法及び試薬に使用する放射性核種は、放射性インジウム、放射性ガリウム、放射性テクネチウム、及び放射性銅及び放射性フッ素の少なくとも一種であることが好ましい。
【0014】
前記放射性核種で標識されたc(RGDfK)ペプチドは、特に111In−DOTA−c(RGDfk)であることが好ましい。
【発明の効果】
【0015】
FGD(フルオロデオキシグルコース)のような従来の放射性標識剤を使用したPETでは、早期膵がんの検出が困難であった。一方、本発明の方法及び試薬によれば、これらの早期膵がんを簡便かつ短時間に検出することができる。FDGは膵炎にも取り込まれるため、膵炎を膵がんと判断することがある。それに対して、本発明の方法で使用する111In−DOTA−c(RGDfK)などは炎症部位に取り込まれ難いため、本発明の検出方法は、膵がんの陽性率の数値の確度が高まる。しかも、本発明に使用するc(RGDfK)は正常組織への集積が低く、したがって患者への被曝線量が低くできる点でも、本発明の方法及び試薬は、有利である。また、本発明の方法及び試薬は、治療、予後の観察等への利用が期待される。また、膵がんの抗ガン剤を開発する際の評価手段としても期待される。
【図面の簡単な説明】
【0016】
【図1】化学発がん物質BOPを投与したハムスターの膵管がんの発達過程とαvβ3インテグリンの発現:(A1)正常な腺管のHE染色図、(A2)正常な腺管のαvβ3インテグリンの染色図、(B1)腺管内の過形成部(Hyperplasia)のHE染色図、(B2)腺管内の過形成部(Hyperplasia)のαvβ3インテグリンの染色図、(C1)腺管内の異型過形成部(Atypical hyperplasia)のHE染色図、(C2)腺管内の異型過形成部(Atypical hyperplasia)のαvβ3インテグリンの染色図、(D1)膵管がんのHE染色図、(D2)膵管がんのαvβ3インテグリンの染色図を示す。
【図2】本発明の早期膵がんの検出方法のプロトコールを示す。条件は、以下のとおりである。投与量:18.5〜37MBq、CTの撮像スケジュール:SPECT撮像を行う前に臨床用ヨード造影剤(イオパミロン等)を投与し、その後、撮像を行う、SPECTの撮像スケジュール:111In−DOTA−c(RGDfk)投与1時間後及び4時間後、合計撮像時間:1時間(ex vivo SPECTの場合は、0.5時間)
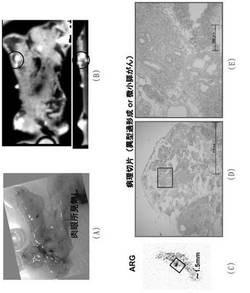
【図3】BOP投与後18週目ハムスターの微小膵がんの、(A)解剖図(肉眼所見無し)、(B)ex vivo SPECT(○内は、微小病変部位への111In−DOTA−c(RGDfk)の集積を示す)、(C)ARG(□内は、〜1.5mmの微小病変部位への111In−DOTA−c(RGDfk)の集積を示す)、(D)病理切片のHE染色図、(E)Dの拡大図を示す。
【図4】BOP投与後22週目ハムスターの膵がんのSPECT:(A)解剖図(○内は、膵頭部に見られた膵がんを示す)、(B)SPECT冠状断面画像(○内は、図Aの膵頭部にできた膵がんへの111In−DOTA−c(RGDfk)の集積を示す)、(C)SPECT横断面画像(○内は、膵がん部位への111In−DOTA−c(RGDfk)の集積を示す)、(D)摘出したハムスターのすい臓(○内は、図Aは膵頭部に見られた膵がん(4mm)、○内は脾葉部位にできた膵がん(3mm)を示す)、(E)SPECT冠状断面画像(○内は図Dの脾葉部位にできた膵がんへの111In−DOTA−c(RGDfK)の集積を示す)、(F)SPECT横断面画像(○内は、図Dの脾葉部位にできた膵がんへの111In−DOTA−c(RGDfk)の集積を示す)を示す。
【図5】図4のハムスターの膵臓の、(A)解剖図(○内は、膵頭にできた膵がん、右下○内は、脾葉にできた膵がんを示す)、(B)〜(E)ex vivoSPECT(○内は、膵頭及び脾葉にできた膵がんを示す)を示す。
【図6】図4のハムスターの、(A)膵頭部の解剖写真とARG、(B)病理組織のHE染色図、(C)図Bの□内の拡大図、(D)脾葉の解剖写真とARG、(E)病理組織のHE染色図、(F)図Eの□内の拡大図を示す。
【図7】BOP投与後23週目ハムスターの膵臓の、(A)解剖図(○内は、膵頭部にできた膵がんを示す)、(B)Aの拡大図、(C)SPECT冠状断面画像(○内は、膵頭部にできた膵がんを示す)、(D)SPECT横断面画像(○内は、膵頭部にできた膵がんを示す)、(E)SPECT矢状断面画像(○内は、膵頭部にできた膵がんを示す)を示す。
【図8】図7のハムスターの膵頭部のARGとHE染色図(□内は、膵頭部にできた膵がんを示す)を示す。
【発明を実施するための形態】
【0017】
以下に、本発明の早期膵がんの検出方法及び試薬をより詳細に説明する。本発明の膵がんの検出する方法は、放射性核種で標識されたc(RGDfK)ペプチドを、哺乳動物に投与する工程、及び、投与後の哺乳動物の膵臓における前記放射性核種を検出する工程を必須とする。
【0018】
前記c(RGDfK)は、アルギニン−グリシン−アスパラギン酸−Dフェニルアラニン−リジンの順で環状に結合した環状ペンタペプチドである。様々なRGD様化合物が開発されている中で、c(RGDfK)は、脂溶性のチロシンを含むc(RGDyK)に比べ肝臓への集積が低い、また、c(RGDfK)が2個結合したダイマーや4個結合したテトラマーに比べて正常組織(特に肝臓、腎臓)への集積が低く、その結果、被曝線量低減につながるという点で、その他のRGD様化合物よりも優れる。
【0019】
前記放射性核種の例として、放射性インジウム、放射性ガリウム、放射性テクネチウム、放射性銅のような放射性金属核種、18Fのような放射性ハロゲン核種が挙げられる。本発明には、111In、67Ga、68Ga、99mTc、62Cu、及び64Cuの少なくも一種を用いることが、核医学用画像診断機器(PET、SPECT)で体外から正確に検出できる点で好ましい。なお、核医学用画像診断機器の選択に応じて、適宜の放射性核種が選ばれる。
【0020】
111In、67Ga、68Ga、99mTc、62Cu、64Cuなどの放射性金属核種は、DOTA(1,4,7,10−テトラアザシクロデカン−1,4,7,10−テトラ酢酸)、DTPA(ジエチレントリアミノペンタ酢酸)、NOTA(1,4,7−triazacyclononane−1,4,7−triacetic acid)、HYNIC(6−hydrazinopyridine−3−carboxylic acid)のようなキレート剤を介してc(RGDfK)と結合することができる。また、18Fのような放射性ハロゲンは、ガラクトースなどを介してc(RGDfK)と結合することができる。
【0021】
前記放射性核種で標識されたc(RGDfK)ペプチドの好適な例は、下記化学式:
【化1】

で示される111In−DOTA−c(RGDfK)、111In−DTPA−c(RGDfK)、62Cu−DOTA−c(RGDfK)、64Cu−DOTA−c(RGDfK)、62Cu−NOTA−c(RGDfK)、64Cu−NOTA−c(RGDfK)、67Ga−DOTA−c(RGDfK)、68Ga−DOTA−c(RGDfK)、99mTc−HYNIC−c(RGDfK)、18F−Galacto−c(RGDfK)などである。
【0022】
本発明の試薬又はそのキットは、上記放射性核種で標識されたc(RGDfK)を必須の有効成分とし、適宜、pH緩衝液、安定化剤、等張化剤、保存剤等の医薬的に許容される添加剤を含む。
【0023】
本発明では、前記放射性核種で標識されたc(RGDfK)を、哺乳動物に投与する。哺乳動物の例には、ヒトの他に、ハムスター、ラット、マウスのような実験動物が挙げられる。特に、ハムスターは、N−nitrosobis(2−oxopropyl)amine(以下、BOPという)のような化学発がん物質で膵管がんや膵がん前がん病変を約10週間で発症させることができる。
【0024】
放射性核種で標識されたc(RGDfK)を、静脈内注射の投与経路で哺乳動物へ投与する。その投与量は、動物種、放射性核種、放射性核種検知手段などの種類にもよるが、通常、7.4〜370MBqになる量である。ハムスターの場合、好ましくは18.5〜37MBqになる量である。ヒトの場合、好ましくは185〜370MBqになる量である。
【0025】
放射性核種で標識されたc(RGDfK)を投与した哺乳動物の膵臓を、適宜の放射性核種検知手段でin vivo又はex vivoイメージング又は計測する。αvβ3インテグリンは腫瘍化した膵臓に高発現するので、放射性核種で標識されたc(RGDfK)による膵臓での描出部位は、膵がんの発症を大いに示唆する。
【0026】
放射性核種検知手段として、SPECT(Single photon emission computed tomography)、PET(positron emission tomography)、ARG(Autoradiography、オートジオグラフィ)、が挙げられる。これらの検知手段によれば、肉眼や病理診断では観察が困難な微小膵がんのin vivo又はex vivoイメージングが可能である。特にSPECT/CTやPET/CTは、SPECTとCTやPETとCTの融合画像の取得により、核医学の生体情報と解剖学的情報とを関連づけられる点で有利である。
【0027】
放射性核種検知手段による測定時期は、測定する動物種や使用する核種により適宜決められるが、通常、標識化c(RGDfK)を投与してから、0.5〜24時間後、好ましくは1〜4時間後である。24時間よりも遅すぎると、放射能の減衰また標識化c(RGDfK)の腫瘍組織からの洗い流しにより、膵がんを見逃す恐れがある。
【0028】
前記放射性核種を検出する工程では、膵臓内部に限局した大きさが2cm以下、好ましくは1cm以下の腫瘍を検出する。この腫瘍の大きさは、膵がんのステージIの早期がんの症状を意味する。本発明によれば、従来検出が困難であった早期膵がんを非侵襲的に短時間かつ容易に検出することが可能である。
【実施例】
【0029】
以下に、実施例を用いて本発明をより詳細に説明する。しかし、本発明は、以下の実施例に限定されるものではない。
〔実施例1〕
1.分子プローブの合成
非特許文献6に記載される方法に従って、c(RGDfK)にキレート剤としてのDOTAを結合させた後、さらに放射性核種111Inで結合することにより、111In−DOTA−c(RGDfK)を合成した。具体的には、以下の手順で合成した。Fmocアミノ酸を用いた固相合成法によりc(RGDfK)を合成した。N,N−ジイソプロピルアミンの存在下、DOTA−NHS esterと反応させ、DOTA−c(RGDfK)を合成した。3M酢酸緩衝液(pH 6.0)を必要量の111InCl3に添加した。該混合溶液を室温で5分間放置し、DOTA−c(RGDfK)を添加した。この混合物を100℃で15分間加熱した。
【0030】
111In−DOTA−c(RGDfK)の精製を、Cosmosil 5C18−AR 300 column(4.6×150mm,Nacalai Tesque)を用いたHPLCにより行った。溶出溶媒として、90%水(0.1%トリフルオロ酢酸を含む)と10%のアセトニトリル(0.1%トリフルオロ酢酸を含む)を用いた。111In−DOTA−c(RGDfK)の放射化学純度は、99%以上であった。
【0031】
2.発がんとαvβ3インテグリンの発現
化学発がんモデルを用いた111In−DOTA−c(RGDfK)による早期膵がんイメージングを検討するために、ヒト膵がんとほぼ同様な発がん過程及び病理組織像を示すハムスターのBOP化学発がんモデルを用いた。具体的には、6週齢の雌性シリアンゴールデンハムスター(日本エスエルシー(株)より入手)に発がん剤であるBOPを10mg/kg体重の量で処置した。
【0032】
図1のA1、B1、C1及びD1に示す膵がんの発達過程で、ハムスターの膵臓から切片を取得し、HE染色及びαvβ3インテグリンの染色を行った。HE染色結果を図1のA1、B1、C1及びD1に示す。αvβ3インテグリンのHE染色の結果、前がん病変部(図1のB2やC2)ですでにαvβ3インテグリンの発現が認められ、膵臓腺管がん部(図1のD2)に強い発現が認められた。
【0033】
3.膵がん検出試薬の投与と検出
BOP投与後、16、18、22及び23週目のハムスター計6匹に、それぞれ18.5〜37MBqの111In−DOTA−c(RGDfK)を静脈内投与した。
【0034】
上記ハムスターに対して、図2のプロトコールに従って生体分析を行った。具体的には、試薬投与1及び4時間後に、小動物用SPECT/CT装置(Bioscan社製)を用いてCT/SPECTを撮影した。そして、投与2時間後又は5時間後、ハムスターを屠殺し、膵臓組織を採取した。摘出した膵臓のCTとSPECT(ex vivo)を撮影した。
【0035】
また、オートジオグラフィー(ARG)を用いて腫瘍への111In−DOTA−c(RGDfK)の集積分布及び強度の解析を行った。採取した膵臓組織から凍結切片を作成し、スライドガラスに貼り付けた。得られた切片をイメージングプレート(富士フィルム社製)に密着させた。画像解析装置(富士フィルム社製)にて画像化し、腫瘍部位と正常膵臓部位に関心領域を設定し、腫瘍/非腫瘍比(T/N比)を、下記式により求めた。
【数1】

【0036】
さらに、111In−DOTA−c(RGDfK)の集積部位が実際の腫瘍部位と一致するか否かを調べるため、摘出した組織をHE染色することにより、病理学的診断を行った。
【0037】
〔18週目〕
図3に、24週齢(BOP投与後18週)のハムスターから摘出した膵臓部位の解剖写真、SPECT(ex vivo)、ARG及びHE染色図(組織病理像)を示す。SPECT(ex vivo)では、2mm以下の微小病変部位への111In−DOTA−c(RGDfK)の集積を確認することができた。また、この集積部位はARG解析における高集積部位(T/N>4.9、図3のC)と一致した。さらに、病理切片のHE染色図(図3のD及びE)から、111In−DOTA−c(RGDfK)の集積部位が前がん病変部(異型過形成)であることを確認した。このように、111In−DOTA−c(RGDfK)が正常膵臓に対して微小病変に高集積を示しことがから、ヒトの臨床試験においても微小病変からなる早期膵がんの検出が可能であると考えられる。
【0038】
〔22週目〕
28週齢(BOP投与後22週目)のハムスターについて、図4に解剖写真と膵臓腫瘍のSPECT、図5にSPECT(ex vivo)、そして、図6に膵頭部及び脾葉部のARGとHE染色図(病理組織像)を示す。
【0039】
図4に示すとおり、SPECT(in vivo)において、大きさが3mmと4mmの腫瘍部位に111In−DOTA−c(RGDfK)の高集積が認められた。また、図5に示すとおり、SPECT(ex vivo)において、摘出膵臓において確認された腫瘍部位に111In−DOTA−c(RGDfK)の高集積が認められた。図6のARGの解析では腫瘍正常膵臓組織比(T/N)が平均4.0と高い値を示した。
【0040】
〔23週目〕
5mm以上の膵がんにおいても、SPECT(in vivo)イメージングで111In−DOTA−c(RGDfK)の明らかな高集積が見られた。
【0041】
111In−DOTA−c(RGDfK)の集積部位が実際の腫瘍部位と一致するか否かを調べるため、HE染色による病理学的診断を行った。結果を図8に示す。図8から、病理切片との対比によって111In−DOTA−c(RGDfK)の高集積部位と実際の腫瘍部位が一致することを確認した。
【0042】
〔実施例2〕
FDGは、がん細胞に取り込まれるため、PET撮影のイメージング剤として使用されている。しかし、FDGは炎症細胞にも取り込まれるため、がん診断の際に擬陽性を呈することがある。そこで、111In−DOTA−c(RGDfK)の炎症部位への取り込みを以下の手順で測定した。対照の18F−FDGについても、同様の測定を行った。
【0043】
ddYマウス(♂、6週齢)に1匹あたり50μLのテレピン油を下肢大腿部に筋注した。処置後3日経過した動物を炎症モデルとして実験に使用した。925KBqの111In−DOTA−c(RGDfK)又は18F−FDGを尾静脈より投与した。投与1時間後に炎症部位を取り出し、凍結切片を作成した。オートラジオグラフィーにより解析を行い、炎症部位と正常筋肉組織への集積比(炎症筋肉比;I/M比)を算出した。
【0044】
18F−FDGのI/M比は8.37と高値を示した。一方、111In−DOTA−c(RGDfK)のI/M比は1.98と低値であった。このことから、111In−DOTA−c(RGDfK)は18F−FDGに比べて炎症部位への集積が非常に低いことから、膵がんと膵炎との鑑別も容易であることが示された。
【技術分野】
【0001】
本発明は、膵がんの検出方法に関し、より詳細には、微小サイズの早期膵がんを簡便かつ短時間に非侵襲的に検出する方法及びその方法に好適な試薬又はキットに関する。
【背景技術】
【0002】
膵がんは、特徴的な自覚症状に乏しく、75%以上はステージIV(腫瘍の大きさが2cm以上、膵がんは膵臓の外へ少し出ており、第2群のリンパ節転移があるか、またはがんが膵臓周囲の血管におよんでいるがリンパ節転移はないか第1群までに限られている)で発見される。発見が遅れる結果、5年生存率が5%以下という極めて予後不良な悪性がんとなっている。さらに、ステージI(腫瘍の大きさが2cm以下、リンパ節転移なし、膵臓の内部に限局)の切除例でも、5年生存率が32%という難治がんである。
【0003】
膵がんによる死亡率を顕著に下げるためには、膵臓における1cm以下の微小病変の早期発見とそれに基づいた早期治療が不可欠である。膵がん診断法の1つに、放射性造影剤を用いたPET診断がある。特に、造影剤としてFDG(フルオロデオキシグルコース)を用いたPET診断(FDG−PET)は、保険適用もあって普及している。しかし、FDG−PETを含む従来の膵がんのPET診断では、異型過形成や1cm以下の微小膵がん、及び、ステージI(腫瘍の大きさが2cm以下)の検出が困難である。さらに、FDGは、炎症部位(膵炎)に対して擬陽性を呈することがある。したがって、現状では、膵がんの微小病変を高い確度で検出する方法やそれに用いるイメージング剤は確立されていない。
【0004】
インテグリンは、細胞接着(細胞−細胞間、細胞−細胞外基質間)に関与する膜貫通型の糖タンパクの一種である。インテグリンは、α鎖とβ鎖からなるヘテロ2量体で構成され、サブタイプがいくつか知られている。αvβ3インテグリンは、一部の腫瘍細胞や血管新生中の内皮細胞に高発現し、通常の正常細胞や内皮細胞にはほとんど発現しない。そこで、αvβ3インテグリンが、腫瘍イメージングにおける標的分子として注目されている。
【0005】
αvβ3インテグリンは、特にアルギニン(R)−グリシン(G)−アスパラギン酸(D)の配列からなるペプチド(RGD)を認識する。この特性を利用して、種々のRGD類似化合物やRGD含有ペプチドからなるαvβ3インテグリンリガンド等が開発されている。
【0006】
例えば、125I−c(RGDyV)及び125I−c(RGDfY)が、MelanomaM21、Osterosarcoma、Mammary cacrinomaを移植した担がんモデルマウスで評価されている(非特許文献1)。125I−c(RGDyV)は、αvβ3インテグリン特異的な腫瘍集積と速やかな血液クリアランスを示すが、肝臓への高い集積を示すことが問題であった。肝臓への非特異的集積を改善するために、c(RGDyK)やc(RGDfK)が開発された(非特許文献2〜3)。
【0007】
また、ペプチドに糖修飾することにより親水性を高めたGalacto−c(RGDfK)が開発されている。糖の導入は、アミノメチル基への18F標識([18F]Galacto−c(RGDfK))を可能にし、薬物動態の改善とPETトレーサーへの応用を可能にする。Haubnerらは、悪性黒色腫、肉種、骨転移がん及び絨毛結節性骨膜炎の患者9名に185Mbqの[18F]Galacto−c(RGDfK)を投与した(非特許文献5)。[18F]Galacto−c(RGDfK)は腎臓に最も高い集積を示し、動物実験から得られた知見とよく一致した。
【0008】
本発明者もまた、111In−DOTA−c(RGDfk)及び90Y−DOTA−c(RGDfk)を用いたαvβ3インテグリンイメージング及び内用放射線療法を報告している(非特許文献6)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】R.Haubner,et al.:Radiolabeled αvβ3integrin antagonists:a new class of tracers for tumor targeting,J.Nucl.Med.,40,1061−1071(1999)
【非特許文献2】X.Chen,et al.:MicroPET and autoradiographic imaging of breast cancer αv−integrin expression using 18F− and 64Cu−labeled RGD peptide,Bioconjug.Chem.,15,41−49(2004)
【非特許文献3】X.Chen,et al.:Pharmacokinetics and tumor retention of 125I−labeled RGD peptide are improved by PEGylation,Nucl.Med.Biol.,31,11−19(2004)
【非特許文献4】M.Janssen,et al.:Comparison of a monomeric and dimeric radiolabeled RGD−peptide for tumor targeting,Cancer Biother.Radiopharm.,17,641−646(2002)
【非特許文献5】R.Haubner,et al.:Noninvasive visualization of the activated αvβ3integrin in cancer patients by positron emission tomography and [18F]Galacto−RGD,PLoS Med.,2,e70(2005)
【非特許文献6】Yoshimoto M,et al.:αvβ3Integrin−targeting radionuclide therapy and imaging with monomeric RGD peptide:Int J Cancer.Aug 1,123(3),709−15(2008)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、膵がんの微小病変の発見に基づく早期膵がんの検出方法、及びその方法に好適な試薬及びキットを提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者は、αvβ3インテグリンを標的とした膵がんイメージングを鋭意検討した結果、以下の方法によれば早期膵がんを検出可能であることを発見した。すなわち、本発明は、放射性核種で標識されたc(RGDfK)ペプチドを、哺乳動物に投与する工程、及び、投与後の哺乳動物の膵臓における前記放射性核種を検出する工程を含む、早期膵がんの検出方法、ならびに放射性核種で標識されたc(RGDfK)ペプチドを有効成分とする、哺乳動物の早期膵がん検出用試薬又はそのキットを提供する。
【0012】
c(RGDfK)ペプチドは、血管内皮細胞を標的にした血管新生や腫瘍のイメージングに使用されることが示唆されており、そのため、腫瘍の浸潤・転移能といった悪性度の評価に利用されていた。しかし、膵がんの早期発見は非常に困難であるという従来の認識から、微小病変の発見を目的とした膵がんの早期検出には利用されていなかった。したがって、本発明の方法及び試薬により膵がんの微小病変をin vivo又はex vivoイメージング可能であることは全く予想できなかった。
【0013】
本発明の方法及び試薬に使用する放射性核種は、放射性インジウム、放射性ガリウム、放射性テクネチウム、及び放射性銅及び放射性フッ素の少なくとも一種であることが好ましい。
【0014】
前記放射性核種で標識されたc(RGDfK)ペプチドは、特に111In−DOTA−c(RGDfk)であることが好ましい。
【発明の効果】
【0015】
FGD(フルオロデオキシグルコース)のような従来の放射性標識剤を使用したPETでは、早期膵がんの検出が困難であった。一方、本発明の方法及び試薬によれば、これらの早期膵がんを簡便かつ短時間に検出することができる。FDGは膵炎にも取り込まれるため、膵炎を膵がんと判断することがある。それに対して、本発明の方法で使用する111In−DOTA−c(RGDfK)などは炎症部位に取り込まれ難いため、本発明の検出方法は、膵がんの陽性率の数値の確度が高まる。しかも、本発明に使用するc(RGDfK)は正常組織への集積が低く、したがって患者への被曝線量が低くできる点でも、本発明の方法及び試薬は、有利である。また、本発明の方法及び試薬は、治療、予後の観察等への利用が期待される。また、膵がんの抗ガン剤を開発する際の評価手段としても期待される。
【図面の簡単な説明】
【0016】
【図1】化学発がん物質BOPを投与したハムスターの膵管がんの発達過程とαvβ3インテグリンの発現:(A1)正常な腺管のHE染色図、(A2)正常な腺管のαvβ3インテグリンの染色図、(B1)腺管内の過形成部(Hyperplasia)のHE染色図、(B2)腺管内の過形成部(Hyperplasia)のαvβ3インテグリンの染色図、(C1)腺管内の異型過形成部(Atypical hyperplasia)のHE染色図、(C2)腺管内の異型過形成部(Atypical hyperplasia)のαvβ3インテグリンの染色図、(D1)膵管がんのHE染色図、(D2)膵管がんのαvβ3インテグリンの染色図を示す。
【図2】本発明の早期膵がんの検出方法のプロトコールを示す。条件は、以下のとおりである。投与量:18.5〜37MBq、CTの撮像スケジュール:SPECT撮像を行う前に臨床用ヨード造影剤(イオパミロン等)を投与し、その後、撮像を行う、SPECTの撮像スケジュール:111In−DOTA−c(RGDfk)投与1時間後及び4時間後、合計撮像時間:1時間(ex vivo SPECTの場合は、0.5時間)
【図3】BOP投与後18週目ハムスターの微小膵がんの、(A)解剖図(肉眼所見無し)、(B)ex vivo SPECT(○内は、微小病変部位への111In−DOTA−c(RGDfk)の集積を示す)、(C)ARG(□内は、〜1.5mmの微小病変部位への111In−DOTA−c(RGDfk)の集積を示す)、(D)病理切片のHE染色図、(E)Dの拡大図を示す。
【図4】BOP投与後22週目ハムスターの膵がんのSPECT:(A)解剖図(○内は、膵頭部に見られた膵がんを示す)、(B)SPECT冠状断面画像(○内は、図Aの膵頭部にできた膵がんへの111In−DOTA−c(RGDfk)の集積を示す)、(C)SPECT横断面画像(○内は、膵がん部位への111In−DOTA−c(RGDfk)の集積を示す)、(D)摘出したハムスターのすい臓(○内は、図Aは膵頭部に見られた膵がん(4mm)、○内は脾葉部位にできた膵がん(3mm)を示す)、(E)SPECT冠状断面画像(○内は図Dの脾葉部位にできた膵がんへの111In−DOTA−c(RGDfK)の集積を示す)、(F)SPECT横断面画像(○内は、図Dの脾葉部位にできた膵がんへの111In−DOTA−c(RGDfk)の集積を示す)を示す。
【図5】図4のハムスターの膵臓の、(A)解剖図(○内は、膵頭にできた膵がん、右下○内は、脾葉にできた膵がんを示す)、(B)〜(E)ex vivoSPECT(○内は、膵頭及び脾葉にできた膵がんを示す)を示す。
【図6】図4のハムスターの、(A)膵頭部の解剖写真とARG、(B)病理組織のHE染色図、(C)図Bの□内の拡大図、(D)脾葉の解剖写真とARG、(E)病理組織のHE染色図、(F)図Eの□内の拡大図を示す。
【図7】BOP投与後23週目ハムスターの膵臓の、(A)解剖図(○内は、膵頭部にできた膵がんを示す)、(B)Aの拡大図、(C)SPECT冠状断面画像(○内は、膵頭部にできた膵がんを示す)、(D)SPECT横断面画像(○内は、膵頭部にできた膵がんを示す)、(E)SPECT矢状断面画像(○内は、膵頭部にできた膵がんを示す)を示す。
【図8】図7のハムスターの膵頭部のARGとHE染色図(□内は、膵頭部にできた膵がんを示す)を示す。
【発明を実施するための形態】
【0017】
以下に、本発明の早期膵がんの検出方法及び試薬をより詳細に説明する。本発明の膵がんの検出する方法は、放射性核種で標識されたc(RGDfK)ペプチドを、哺乳動物に投与する工程、及び、投与後の哺乳動物の膵臓における前記放射性核種を検出する工程を必須とする。
【0018】
前記c(RGDfK)は、アルギニン−グリシン−アスパラギン酸−Dフェニルアラニン−リジンの順で環状に結合した環状ペンタペプチドである。様々なRGD様化合物が開発されている中で、c(RGDfK)は、脂溶性のチロシンを含むc(RGDyK)に比べ肝臓への集積が低い、また、c(RGDfK)が2個結合したダイマーや4個結合したテトラマーに比べて正常組織(特に肝臓、腎臓)への集積が低く、その結果、被曝線量低減につながるという点で、その他のRGD様化合物よりも優れる。
【0019】
前記放射性核種の例として、放射性インジウム、放射性ガリウム、放射性テクネチウム、放射性銅のような放射性金属核種、18Fのような放射性ハロゲン核種が挙げられる。本発明には、111In、67Ga、68Ga、99mTc、62Cu、及び64Cuの少なくも一種を用いることが、核医学用画像診断機器(PET、SPECT)で体外から正確に検出できる点で好ましい。なお、核医学用画像診断機器の選択に応じて、適宜の放射性核種が選ばれる。
【0020】
111In、67Ga、68Ga、99mTc、62Cu、64Cuなどの放射性金属核種は、DOTA(1,4,7,10−テトラアザシクロデカン−1,4,7,10−テトラ酢酸)、DTPA(ジエチレントリアミノペンタ酢酸)、NOTA(1,4,7−triazacyclononane−1,4,7−triacetic acid)、HYNIC(6−hydrazinopyridine−3−carboxylic acid)のようなキレート剤を介してc(RGDfK)と結合することができる。また、18Fのような放射性ハロゲンは、ガラクトースなどを介してc(RGDfK)と結合することができる。
【0021】
前記放射性核種で標識されたc(RGDfK)ペプチドの好適な例は、下記化学式:
【化1】

で示される111In−DOTA−c(RGDfK)、111In−DTPA−c(RGDfK)、62Cu−DOTA−c(RGDfK)、64Cu−DOTA−c(RGDfK)、62Cu−NOTA−c(RGDfK)、64Cu−NOTA−c(RGDfK)、67Ga−DOTA−c(RGDfK)、68Ga−DOTA−c(RGDfK)、99mTc−HYNIC−c(RGDfK)、18F−Galacto−c(RGDfK)などである。
【0022】
本発明の試薬又はそのキットは、上記放射性核種で標識されたc(RGDfK)を必須の有効成分とし、適宜、pH緩衝液、安定化剤、等張化剤、保存剤等の医薬的に許容される添加剤を含む。
【0023】
本発明では、前記放射性核種で標識されたc(RGDfK)を、哺乳動物に投与する。哺乳動物の例には、ヒトの他に、ハムスター、ラット、マウスのような実験動物が挙げられる。特に、ハムスターは、N−nitrosobis(2−oxopropyl)amine(以下、BOPという)のような化学発がん物質で膵管がんや膵がん前がん病変を約10週間で発症させることができる。
【0024】
放射性核種で標識されたc(RGDfK)を、静脈内注射の投与経路で哺乳動物へ投与する。その投与量は、動物種、放射性核種、放射性核種検知手段などの種類にもよるが、通常、7.4〜370MBqになる量である。ハムスターの場合、好ましくは18.5〜37MBqになる量である。ヒトの場合、好ましくは185〜370MBqになる量である。
【0025】
放射性核種で標識されたc(RGDfK)を投与した哺乳動物の膵臓を、適宜の放射性核種検知手段でin vivo又はex vivoイメージング又は計測する。αvβ3インテグリンは腫瘍化した膵臓に高発現するので、放射性核種で標識されたc(RGDfK)による膵臓での描出部位は、膵がんの発症を大いに示唆する。
【0026】
放射性核種検知手段として、SPECT(Single photon emission computed tomography)、PET(positron emission tomography)、ARG(Autoradiography、オートジオグラフィ)、が挙げられる。これらの検知手段によれば、肉眼や病理診断では観察が困難な微小膵がんのin vivo又はex vivoイメージングが可能である。特にSPECT/CTやPET/CTは、SPECTとCTやPETとCTの融合画像の取得により、核医学の生体情報と解剖学的情報とを関連づけられる点で有利である。
【0027】
放射性核種検知手段による測定時期は、測定する動物種や使用する核種により適宜決められるが、通常、標識化c(RGDfK)を投与してから、0.5〜24時間後、好ましくは1〜4時間後である。24時間よりも遅すぎると、放射能の減衰また標識化c(RGDfK)の腫瘍組織からの洗い流しにより、膵がんを見逃す恐れがある。
【0028】
前記放射性核種を検出する工程では、膵臓内部に限局した大きさが2cm以下、好ましくは1cm以下の腫瘍を検出する。この腫瘍の大きさは、膵がんのステージIの早期がんの症状を意味する。本発明によれば、従来検出が困難であった早期膵がんを非侵襲的に短時間かつ容易に検出することが可能である。
【実施例】
【0029】
以下に、実施例を用いて本発明をより詳細に説明する。しかし、本発明は、以下の実施例に限定されるものではない。
〔実施例1〕
1.分子プローブの合成
非特許文献6に記載される方法に従って、c(RGDfK)にキレート剤としてのDOTAを結合させた後、さらに放射性核種111Inで結合することにより、111In−DOTA−c(RGDfK)を合成した。具体的には、以下の手順で合成した。Fmocアミノ酸を用いた固相合成法によりc(RGDfK)を合成した。N,N−ジイソプロピルアミンの存在下、DOTA−NHS esterと反応させ、DOTA−c(RGDfK)を合成した。3M酢酸緩衝液(pH 6.0)を必要量の111InCl3に添加した。該混合溶液を室温で5分間放置し、DOTA−c(RGDfK)を添加した。この混合物を100℃で15分間加熱した。
【0030】
111In−DOTA−c(RGDfK)の精製を、Cosmosil 5C18−AR 300 column(4.6×150mm,Nacalai Tesque)を用いたHPLCにより行った。溶出溶媒として、90%水(0.1%トリフルオロ酢酸を含む)と10%のアセトニトリル(0.1%トリフルオロ酢酸を含む)を用いた。111In−DOTA−c(RGDfK)の放射化学純度は、99%以上であった。
【0031】
2.発がんとαvβ3インテグリンの発現
化学発がんモデルを用いた111In−DOTA−c(RGDfK)による早期膵がんイメージングを検討するために、ヒト膵がんとほぼ同様な発がん過程及び病理組織像を示すハムスターのBOP化学発がんモデルを用いた。具体的には、6週齢の雌性シリアンゴールデンハムスター(日本エスエルシー(株)より入手)に発がん剤であるBOPを10mg/kg体重の量で処置した。
【0032】
図1のA1、B1、C1及びD1に示す膵がんの発達過程で、ハムスターの膵臓から切片を取得し、HE染色及びαvβ3インテグリンの染色を行った。HE染色結果を図1のA1、B1、C1及びD1に示す。αvβ3インテグリンのHE染色の結果、前がん病変部(図1のB2やC2)ですでにαvβ3インテグリンの発現が認められ、膵臓腺管がん部(図1のD2)に強い発現が認められた。
【0033】
3.膵がん検出試薬の投与と検出
BOP投与後、16、18、22及び23週目のハムスター計6匹に、それぞれ18.5〜37MBqの111In−DOTA−c(RGDfK)を静脈内投与した。
【0034】
上記ハムスターに対して、図2のプロトコールに従って生体分析を行った。具体的には、試薬投与1及び4時間後に、小動物用SPECT/CT装置(Bioscan社製)を用いてCT/SPECTを撮影した。そして、投与2時間後又は5時間後、ハムスターを屠殺し、膵臓組織を採取した。摘出した膵臓のCTとSPECT(ex vivo)を撮影した。
【0035】
また、オートジオグラフィー(ARG)を用いて腫瘍への111In−DOTA−c(RGDfK)の集積分布及び強度の解析を行った。採取した膵臓組織から凍結切片を作成し、スライドガラスに貼り付けた。得られた切片をイメージングプレート(富士フィルム社製)に密着させた。画像解析装置(富士フィルム社製)にて画像化し、腫瘍部位と正常膵臓部位に関心領域を設定し、腫瘍/非腫瘍比(T/N比)を、下記式により求めた。
【数1】

【0036】
さらに、111In−DOTA−c(RGDfK)の集積部位が実際の腫瘍部位と一致するか否かを調べるため、摘出した組織をHE染色することにより、病理学的診断を行った。
【0037】
〔18週目〕
図3に、24週齢(BOP投与後18週)のハムスターから摘出した膵臓部位の解剖写真、SPECT(ex vivo)、ARG及びHE染色図(組織病理像)を示す。SPECT(ex vivo)では、2mm以下の微小病変部位への111In−DOTA−c(RGDfK)の集積を確認することができた。また、この集積部位はARG解析における高集積部位(T/N>4.9、図3のC)と一致した。さらに、病理切片のHE染色図(図3のD及びE)から、111In−DOTA−c(RGDfK)の集積部位が前がん病変部(異型過形成)であることを確認した。このように、111In−DOTA−c(RGDfK)が正常膵臓に対して微小病変に高集積を示しことがから、ヒトの臨床試験においても微小病変からなる早期膵がんの検出が可能であると考えられる。
【0038】
〔22週目〕
28週齢(BOP投与後22週目)のハムスターについて、図4に解剖写真と膵臓腫瘍のSPECT、図5にSPECT(ex vivo)、そして、図6に膵頭部及び脾葉部のARGとHE染色図(病理組織像)を示す。
【0039】
図4に示すとおり、SPECT(in vivo)において、大きさが3mmと4mmの腫瘍部位に111In−DOTA−c(RGDfK)の高集積が認められた。また、図5に示すとおり、SPECT(ex vivo)において、摘出膵臓において確認された腫瘍部位に111In−DOTA−c(RGDfK)の高集積が認められた。図6のARGの解析では腫瘍正常膵臓組織比(T/N)が平均4.0と高い値を示した。
【0040】
〔23週目〕
5mm以上の膵がんにおいても、SPECT(in vivo)イメージングで111In−DOTA−c(RGDfK)の明らかな高集積が見られた。
【0041】
111In−DOTA−c(RGDfK)の集積部位が実際の腫瘍部位と一致するか否かを調べるため、HE染色による病理学的診断を行った。結果を図8に示す。図8から、病理切片との対比によって111In−DOTA−c(RGDfK)の高集積部位と実際の腫瘍部位が一致することを確認した。
【0042】
〔実施例2〕
FDGは、がん細胞に取り込まれるため、PET撮影のイメージング剤として使用されている。しかし、FDGは炎症細胞にも取り込まれるため、がん診断の際に擬陽性を呈することがある。そこで、111In−DOTA−c(RGDfK)の炎症部位への取り込みを以下の手順で測定した。対照の18F−FDGについても、同様の測定を行った。
【0043】
ddYマウス(♂、6週齢)に1匹あたり50μLのテレピン油を下肢大腿部に筋注した。処置後3日経過した動物を炎症モデルとして実験に使用した。925KBqの111In−DOTA−c(RGDfK)又は18F−FDGを尾静脈より投与した。投与1時間後に炎症部位を取り出し、凍結切片を作成した。オートラジオグラフィーにより解析を行い、炎症部位と正常筋肉組織への集積比(炎症筋肉比;I/M比)を算出した。
【0044】
18F−FDGのI/M比は8.37と高値を示した。一方、111In−DOTA−c(RGDfK)のI/M比は1.98と低値であった。このことから、111In−DOTA−c(RGDfK)は18F−FDGに比べて炎症部位への集積が非常に低いことから、膵がんと膵炎との鑑別も容易であることが示された。
【特許請求の範囲】
【請求項1】
放射性核種で標識されたc(RGDfK)ペプチドを哺乳動物に投与する工程、及び、
投与後の哺乳動物の膵臓における前記放射性核種を検出する工程、
を含む、早期膵がんの検出方法。
【請求項2】
前記前記放射性核種を検出する工程は、膵臓内部に限局した大きさ2cm以下の腫瘍を検出することを特徴とする、請求項1に記載の早期膵がんの検出方法。
【請求項3】
前記放射性核種が、放射性インジウム、放射性ガリウム、放射性テクネチウム、放射性銅、及び放射性フッ素の少なくとも一種から選択される、請求項1又は2に記載の早期膵がんの検出方法。
【請求項4】
前記放射性核種で標識されたc(RGDfK)ペプチドが、111In−DOTA−c(RGDfk)であることを特徴とする、請求項1〜3のいずれかに記載の早期膵がんの検出方法。
【請求項5】
放射性核種で標識されたc(RGDfK)ペプチドを有効成分とする、哺乳動物の早期膵がん検出用試薬又はそのキット。
【請求項6】
前記放射性核種が、放射性インジウム、放射性ガリウム、放射性テクネチウム、放射性銅、及び放射性フッ素の少なくとも一種であるである、請求項5に記載の哺乳動物の早期膵がん検出用試薬又はそのキット。
【請求項7】
前記放射性核種で標識されたc(RGDfK)ペプチドが、111In−DOTA−c(RGDfk)であることを特徴とする、請求項4〜6のいずれかに記載の哺乳動物の早期膵がん検出用試薬又はそのキット。
【請求項1】
放射性核種で標識されたc(RGDfK)ペプチドを哺乳動物に投与する工程、及び、
投与後の哺乳動物の膵臓における前記放射性核種を検出する工程、
を含む、早期膵がんの検出方法。
【請求項2】
前記前記放射性核種を検出する工程は、膵臓内部に限局した大きさ2cm以下の腫瘍を検出することを特徴とする、請求項1に記載の早期膵がんの検出方法。
【請求項3】
前記放射性核種が、放射性インジウム、放射性ガリウム、放射性テクネチウム、放射性銅、及び放射性フッ素の少なくとも一種から選択される、請求項1又は2に記載の早期膵がんの検出方法。
【請求項4】
前記放射性核種で標識されたc(RGDfK)ペプチドが、111In−DOTA−c(RGDfk)であることを特徴とする、請求項1〜3のいずれかに記載の早期膵がんの検出方法。
【請求項5】
放射性核種で標識されたc(RGDfK)ペプチドを有効成分とする、哺乳動物の早期膵がん検出用試薬又はそのキット。
【請求項6】
前記放射性核種が、放射性インジウム、放射性ガリウム、放射性テクネチウム、放射性銅、及び放射性フッ素の少なくとも一種であるである、請求項5に記載の哺乳動物の早期膵がん検出用試薬又はそのキット。
【請求項7】
前記放射性核種で標識されたc(RGDfK)ペプチドが、111In−DOTA−c(RGDfk)であることを特徴とする、請求項4〜6のいずれかに記載の哺乳動物の早期膵がん検出用試薬又はそのキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−42215(P2012−42215A)
【公開日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願番号】特願2010−180778(P2010−180778)
【出願日】平成22年8月12日(2010.8.12)
【出願人】(803000056)財団法人ヒューマンサイエンス振興財団 (341)
【Fターム(参考)】
【公開日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願日】平成22年8月12日(2010.8.12)
【出願人】(803000056)財団法人ヒューマンサイエンス振興財団 (341)
【Fターム(参考)】
[ Back to top ]

