有効微生物コーティング種子において、植物応答を指標とした標的微生物の活性評価方法
【課題】本発明は、有効微生物コーティング種子の品質管理・品質保証に関する新規な方法を提供することを目的とする。
【解決手段】有効微生物コーティング種子における有効微生物の活性を評価する方法であって、有効微生物コーティング種子から幼植物を得る第一工程、前記幼植物における遺伝子の発現量を測定する第二工程、および前記発現量を指標として、有効微生物コーティング種子における有効微生物の活性を評価する第三工程、を含む方法。
【解決手段】有効微生物コーティング種子における有効微生物の活性を評価する方法であって、有効微生物コーティング種子から幼植物を得る第一工程、前記幼植物における遺伝子の発現量を測定する第二工程、および前記発現量を指標として、有効微生物コーティング種子における有効微生物の活性を評価する第三工程、を含む方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は有効微生物コーティング種子の品質管理技術に関する。
【背景技術】
【0002】
微生物コーティング種子の製造方法は多くの特許、論文が報告されている。しかしながら、従来から微生物コーティング種子を製造した後の品質管理、品質の保証に関しては、種子に導入した微生物の生菌数を調査する程度で、それ以上の品質管理は行われてこなかった。ところが、微生物は、培養条件の違いによって活性が変化すること、活性を維持した状態で保存することが難しいことが知られている(特許文献1および2)。そのため、変異処理や遺伝子操作により、高活性な変異株や宿主植物への定着・共生能力を増強するための試みが進められている(特許文献3、4および5)。すなわち、微生物は、変化しやすいものであり、変異株の出現、活性の低下、失活などが起こる場合があり、種子処理の目的である病害軽減効果や生育促進効果、あるいは窒素固定能力などが充分に得られないという場合がある。従って微生物を導入し、一定レベル以上の菌濃度がいるということだけでは充分に品質を保証したということはできなかった。
【0003】
従来から知られている有効微生物の活性の測定方法は、有効微生物が植物側に与える有益な影響を指標にして調べられてきた。例えば、拮抗微生物を用いる場合には、目的とする病害の軽減程度を発病度、発病株率、防除価などで数値化して表現することができる。
【0004】
イネのばか苗病やモミ枯細菌病、ナス科植物(トマトやナスなど)の青枯病、アブラナ科植物(キャベツ・白菜・ブロッコリーなど)の根こぶ病などの病害に対する病害軽減効果などについて、発病度、発病株率、防除価などが指標として使用される。植物生育促進微生物を用いる場合には、育苗時の苗の生育促進量を草丈、茎の太さ、葉長、葉幅、重量などを計測して数値化できる。根粒菌を用いる場合には、根における根粒菌の着生程度(量)、根粒の窒素固定活性、植物体に吸収された窒素量の増加、あるいは植物体の重量の増加などで調べることができる。菌根菌を用いる場合には、菌根菌の着生程度(量)、植物体の吸収したリン酸量の増加、あるいは植物体の重量の増加などで調べることができる。
【0005】
しかしながら、これらのバイオアッセイ法は、植物の栽培環境の影響を受けたりして振れが大きいことが問題であった。この他に、植物を用いないで有効微生物の活性を調べる方法もある。例えば、微生物の増殖速度、呼吸活性(酸素吸収量、二酸化炭素放出量)、活性染色法(例えばFDA染色法など)、ATP含量、酵素活性測定などを利用することができるが、間接的な方法であり植物へ与える影響とどの程度相関があるのかははっきりしていない。
【0006】
特許文献6は環境ストレスをスクリーニングするために植物遺伝子発現を利用する方法を開示しており、その中には病原微生物によるストレスも含まれている。しかしながら、この方法は環境ストレスの有無を判断する定性的な試験に過ぎず、定量化は行われていなかった。なぜならば、定量化するためには、微生物活性と植物側の遺伝子発現の間にきちんと相関があることが示されなければならないからである。つまり、植物の遺伝子発現を調べることは既に行われているが、これを有効微生物の活性を調べるために使用する試みは世界でも例がない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平7−163334号公報
【特許文献2】特開2000−175678号公報
【特許文献3】特開2007−306852号公報
【特許文献4】特開2004−261078号公報
【特許文献5】特開2003−33174号公報
【特許文献6】特開2007−68495号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、有効微生物コーティング種子の品質管理・品質保証に関する新規な方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
上記のような従来から行われていた有効微生物の活性測定方法を用いて測定した有効微生物の活性と植物遺伝子の発現量との間に相関が認められれば、植物体の遺伝子発現量を有効微生物の活性の指標として使用することができる。さらに、植物体の遺伝子発現量を指標とすることにより、従来の有効微生物の活性測定方法における問題点を解決することができる。
【0010】
本発明者らは、植物体の遺伝子発現量に着目し、有効微生物コーティング種子の品質を管理・保証する方法について検討した。その結果、本発明者らは、様々な有効微生物コーティング種子を用いて育苗した植物において、幾つかの植物側の遺伝子発現レベルが、変化することを見出した。そして、この変化が有効微生物の活性の変化と関連していることが示唆される実験結果を得た。この結果から、本発明者らは、有効微生物コーティング種子において、その品質として最も重要な有効微生物の活性を植物応答の指標として調べる新しい方法を開発した。
【0011】
上記の本発明者らによって確認された現象は、例えば以下のように説明できる。有効微生物コーティング種子を発芽、育苗することにより、有効微生物が植物の根にうまく定着あるいは共生関係を構築できた場合に、植物は、有効微生物からの刺激に対して様々な応答反応を起こし、幾つかの遺伝子発現のレベルを変化させる。しかし、有効微生物コーティング種子中の有効微生物がうまく植物の根に定着できなかった場合、あるいは有効微生物の活性が低下、失活、変異などの変化が生じた場合には、植物側のこの応答反応に変化が生じることになる。
【0012】
今回、本発明者らは、この植物の応答を指標とすることにより、有効微生物コーティング種子における導入した有効微生物の活性を計測することに成功した。
【0013】
即ち本発明は、より具体的には、下記の発明を包含する。
(1)有効微生物コーティング種子における有効微生物の活性を評価する方法であって、
有効微生物コーティング種子から幼植物を得る第一工程、
前記幼植物における遺伝子の発現量を測定する第二工程、および
前記発現量を指標として、有効微生物コーティング種子における有効微生物の活性を評価する第三工程、
を含む方法。
(2)前記遺伝子がマイクロアレイ解析により特異的に発現量が上昇または減少する遺伝子である、(1)の方法。
(3)前記遺伝子が全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生および抵抗性に関連する遺伝子、ならびに根粒菌のNodファクターおよびVA菌根菌のMYcファクターに応答する植物側遺伝子から選択される少なくとも1種の遺伝子である、(1)または(2)の方法。
(4)前記有効微生物が、拮抗微生物、植物生育促進微生物、根粒菌または菌根菌である、(1)〜(3)のいずれかの方法。
(5)前記種子がイネまたはトマトの種子である、(1)〜(4)のいずれかの方法。
(6)前記微生物が拮抗微生物または植物生育促進微生物であり、
前記種子がイネの種子であり、
前記遺伝子がPR-1a、PR1b、Glutathione S-transferase、CytochromeP450およびPR-10遺伝子から選択される少なくとも1種の遺伝子である、(1)の方法。
(7)前記微生物が拮抗微生物または植物生育促進微生物であり、
前記種子がトマトの種子であり、
前記遺伝子がPR3、PR4、ACS2およびPDF1,4遺伝子から選択される少なくとも1種の遺伝子である、(1)の方法。
【発明の効果】
【0014】
本発明は、有効微生物コーティング種子を製造した後の品質を確認するため、導入した微生物の活性を評価する新しい方法を提供する。
【図面の簡単な説明】
【0015】
【図1】図1は温度処理したSKT-1株分生子のイネばか苗病に対する防除効果を示す。
【図2】図2は温度処理したSKT-1株分生子のFDA蛍光強度を示す。
【図3】図3は温度処理したSKT-1株分生子をライブコートしたイネの防御関連遺伝子の発現を示す。
【図4】図4は半定量RT-PCRによるPR10遺伝子の発現量の熱処理による影響を示す。
【図5】図5は微生物コーティング(ライブコート)種子由来トマト幼植物におけるPR4遺伝子の発現上昇を示す。
【図6】図6はライブコート種子由来サポートおよび麗夏の幼植物におけるPR3、PR4、PDF1.4およびACS2各遺伝子の発現動向を示す。
【図7】図7は微生物コーティング種子由来サポートおよびマイロックの幼植物におけるPR3、PR4、PDF1.4およびACS2各遺伝子の経時的な発現動向を示す。
【図8】図8はライブコート処理・接木苗における防御関連遺伝子の発現レベルを示す。
【発明を実施するための形態】
【0016】
以下、本発明について詳細に説明する。
本発明において、「有効微生物コーティング種子」とは、拮抗微生物、植物生育促進微生物、根粒菌、菌根菌など植物に対してなんらかの有益な影響を与える有効微生物を種子にコーティングしたものを言う。すなわち、有効微生物が種子にコーティングされている限り、裸種子のままであっても良いし、フィルムコート種子、ペレット種子、ゲル被覆種子、シーダーテープ、シードグラフ、プライミング処理種子など様々な加工処理が施された種子であっても良い。なお、有効微生物コーティング種子とは、種子全体が有効微生物でコーティングされているものだけではなく、種子の一部分のみがコーティングされているものも含む。また、有効微生物が種子表面にのみ存在しているものだけではなく、有効微生物が種子内部に導入されているものも含む。コーティングされた微生物の菌数は特に限定されないが、101〜1010 cells/粒の範囲内で含まれていれば良い。好ましくは、102〜109 cells/粒の範囲であり、より好ましくは、103〜108 cells/粒の範囲である。
【0017】
本発明に用いる拮抗微生物としては、植物病原菌に対して拮抗性を示すものであれば特に限定されないが、例えば、バチルス(Bacillus)属細菌、ストレプトマイセス(Streptomyces)属放線菌、蛍光性シュードモナス(Pseudomonas)属細菌(P. fluorescens, P. putida)、非病原性エルビニア(Erwinia)属細菌、バリオボラックス(Variovorax)属細菌、非病原性フザリウム(Fusarium)属糸状菌、トリコデルマ(Trichoderma)属糸状菌、グリオクラディウム(Gliocladium)属糸状菌、ペニシリウム(penicillium)属糸状菌、タラロマイセス(Talaromyces)属糸状菌、などが挙げられる。
【0018】
植物生育促進微生物とは、植物に対して生育促進効果を示すものであれば特に限定されないが、例えば、蛍光性シュードモナス(Pseudomonas)属細菌(P. fluorescens, P. putida)、の他に、バチルス(Bacillus)属細菌(B.subtilis、B. polymyxa)、エンテロバクター(Enterobacter)属細菌(E.clocae)、セラチア(Serratia)属細菌(S. fonticola, S. liquefacience, S. marcescens )などの細菌類や、ユーペニシリウム(Eupenisillium)属糸状菌(E. javanicum)、ペニシリウム(Penicillium)属糸状菌(P. janthinellum, P. citreonigrum, P. citrium)、トリコデルマ(Trichoderma)属糸状菌、非病原性リゾクトニア(Rhizoctonia)属糸状菌、フォーマ(Phoma)属糸状菌、および胞子を形成しないステライル(sterile)菌と称されるグループ、などが上げられる。
【0019】
根粒菌とは、大豆をはじめとしたマメ科植物に共生し、大気中の窒素を固定してアンモニア態窒素に変換し宿主植物へ提供する微生物であれば特に限定されないが、例えば、リゾビウム(Rhizobium)属細菌、ブラディリゾビウム(Bradyrhizobium)属細菌、シノリゾビウム(Sinorhizobium)属細菌、メソリゾビウム(Mesorhizobium)属細菌などが挙げられる。
【0020】
菌根菌とは、陸上植物の根の組織に侵入したり、あるいは根組織表面にしっかりと付着して、植物と菌の間で養分の授受などの相利的な関係の成立しいる菌根を形成する共生菌のことである。菌根は、菌糸が根皮層組織へ侵入する内生菌根、菌糸が根組織表面に付着し厚い菌糸層を形成する外生菌根、その中間的なタイプに分けられる。
【0021】
本発明で用いる種子は特に制限されない。例えば、タマネギ、ネギなどのユリ科の種子、ホウレンソウ、テンサイなどのアカザ科の種子、キャベツ、ハクサイ、カリフラワー、ブロッコリー、ダイコンなどのアブラナ科の種子、ソラマメ、エンドウなどのマメ科の種子、ニンジン、セルリー、ミツバなどのセリ科の種子、レタス、シュンギク、ゴボウなどのキク科の種子、トマト、ナス、ピーマンなどのナス科の種子、メロン、キュウリ、スイカ、カボチャなどのウリ科の種子、イネ、トウモロコシ、コムギ、オオムギなどのイネ科の種子などの作物種子; パンジー、ビオラ、ペチュニア、トルコギキョウ、ストック、アスター、シクラメン、プリムラ、キンギョソウ、ジニア、マリーゴールド、アサガオ、ヒマワリ、コスモス、ラナンキュラス、ラベンダー、ルピナス、ミムラス、ポピー、ベゴニア、ネメシア、ビンカ、トレニア、デルフィニューム、ダイアンサス、ゼラニューム、センニチコウ、スイートピー、サルビア、ガーベラ、ガザニア、カレンジュラ、グロキシニア、ケイトウ、インパチェンス、アネモネ、アゲラタムなどの花卉種子; その他には飼料作物種子、牧草、芝などの種子が挙げられる。
【0022】
有効微生物コーティング種子を作成する方法としては特に制限されず、公知の様々な方法を使用することができる。例えば、特開平2007−77118号公報に記載されたように、有効微生物を種子に減圧接種する方法などを使用することができる。
【0023】
有効微生物コーティング種子から幼植物を得るためには、有効微生物コーティング種子を発芽させ、育苗すればよい。種子を発芽させ、育苗する方法は、一般に行われる発芽・育苗方法であれば特に制限はないが、清潔で雑菌の少ない環境で育苗することが望ましい。
【0024】
本発明における幼植物には有効微生物コーティング種子を発芽させ、育苗した幼植物を接木処理したものも含まれる。つまり、本発明の方法は有効微生物コーティング種子を発芽させ、育苗した幼植物を接木処理したものにも使用することができる。例えば、果菜類において、土壌病害に抵抗性のある台木に穂木を接木したものについて有効微生物の活性を評価することができる。台木および穂木がいずれも有効微生物コーティング種子から得られたものの場合には、台木および穂木のぞれぞれについて有効微生物の活性を評価することもできる。接木処理に使用する植物は特に制限されないが、親和性の良い植物を用いることが好ましい。
【0025】
本発明において、種子を発芽、育苗して得られる幼植物は、発芽直後から3ヶ月以内の植物を使用することが好ましい。接木処理をする場合には、接木後、加湿・養生期間などは植物の生育が停滞し著しく遅れが生じるため、育苗期間が1ヶ月程度延長される場合もある。
【0026】
遺伝子の発現量は幼植物からRNAを抽出することによって測定することができる。幼植物からRNAを抽出する場合には、幼植物体全体を用いても良いし、地上部、根部、茎、双葉、本葉、あるいは表皮細胞、髄、導管、柔組織、維管束などに分画して抽出することもできる。種子の状態であっても、遺伝子の発現量に変化が生じる場合には種子からRNAを抽出しても良い。RNAの採取時期は、発芽直後から3ヶ月以内が好ましく、より好ましくは発芽直後から1ヶ月以内である。接木苗の場合には、接木直後から90日以内が好ましく、接木直後から7〜50日以内がより好ましく、接木直後から10〜30日以内が特に好ましい。
【0027】
RNAの抽出は、使用する植物体あるいは組織を冷却あるいは凍結してホモジナイズし、RNA抽出キットを用いるなどの一般的な方法で行えばよい。次にRNAからm-RNAの精製は、oligo-dTを用いたm-RNA精製試薬・キットを用いるなどの一般に行われる方法を用いて行うことができる。m-RNAからc-DNAへの逆転写は、逆転写酵素を含むキットなどを用いた定法を用いて行うことができる。発現量を確認したい遺伝子を決めてその遺伝情報からハイブリダイゼーションプローブを作製する。また、c-DNAへの逆転写を行わず、Northern hybridization法で直接RNAから目的遺伝子の発現を検出することもできる。RT-PCR法あるいはreverse PCR法を用いて発現遺伝子を定量的に増幅させて検出することは、検出感度を高める上で非常に有効な場合がある。PCRで増幅した遺伝子が目的の遺伝子であるかどうかを確認するために、クローニングし、その塩基配列を決定することを行うことが必要な場合もある。遺伝子の発現量は定量PCR法、半定量PCR法、マイクロアレイなどにより測定することができ、発現量の増減に基づいて有効微生物の活性を評価することができる。
【0028】
本発明において、マイクロアレイの作製は、一般に行われる方法でよく、トマト、イネ、シロイヌナズナなどの場合には、既に全遺伝情報が明らかとなっているため、この遺伝情報を基に作製することができる。さらにこの遺伝情報に基づいてホモロジー検索を容易に行うことができる。それ以外の植物では、部分的に判っている遺伝情報や他の動植物・微生物などの遺伝情報を元に作製することができる。
【0029】
本発明において、マイクロアレイ解析により、特異的に発現が上昇した遺伝子または特異的に発現が減少した遺伝子をマーカー遺伝子として選択することができる。特異的に発現が上昇した遺伝子とは、無処理の植物の遺伝子発現量と比較して、1.5倍以上に発現が増加している場合を言う。好ましくは、3倍以上、より好ましくは10倍以上、さらに好ましくは30倍以上である。特異的に発現が減少した遺伝子とは、無処理の植物の遺伝子発現量と比較して、3/4以下に発現が減少している場合を言う。好ましくは1/2以下、より好ましくは、1/4以下である。
【0030】
本発明において、全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生および抵抗性に関連する遺伝子とは、例えば、LB-LPRタンパク質ファミリー、シロイヌナズナのPRM1、PRS2、PRS5、トマトのecLRP遺伝子Cf-2、イネのNB-LPR遺伝子Pi-ta、(片桐文章(2004):抵抗性遺伝子と病原体認識機構、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p88-95、秀潤社)、大麦のMLA1、MLA6、MLA12、ジャガイモのRx、タバコのN、シロイヌナズナのRPS4、RPP1A、RPP2、RPP4、RPP5、RPP7、RPP8、RPW8、RAR1、SGT1、HSP90(heat shock protein 90)、(高橋章、市村和也、白須賢(2004):耐病性機構に関わるタンパク質の機能解析、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p96-102、秀潤社)、rboh遺伝子、(吉岡博文、川北一人、道家紀志(2004):植物の生体防御機構、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p103-110、秀潤社)、低分子Gタンパク質Rac/Ropファミリー、ヘテロ3量体Gタンパク質、(川崎努、島本功(2004):Gタンパク質を介した抵抗性のシグナル伝達、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p111-117、秀潤社)、PCD(programmed cell death)、HR(hypersensitive response)などに関与する遺伝子、(中屋敷均、眞山滋志(2004):細胞死現象の新展開、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p118-125、秀潤社)、PRプロテイン、nahG、PR1、PR2、PR5、NPR1、などのサリチル酸(SA)のシグナル伝達関連遺伝子、WSR(wound-induced systemic resistance)、ISR(induced―systemic resistance)、(光原一朗、瀬尾茂美、大橋祐子(2004):病害抵抗性の全身誘導機構とそのシグナル伝達、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p126-135、秀潤社)、ジャスモン酸シグナル伝達系、エチレンシグナル伝達系に関与する遺伝子などが挙げられるが、現在も次々と新しい遺伝子が明らかになっているため、この例だけに留まらない。今後新たに見出される関連遺伝子を使用することも可能である。
【0031】
本発明において、根粒菌のNodファクターおよびVA菌根菌のMYcファクターに応答する植物側遺伝子とは、根粒形成初期と菌根菌との共生系を支える宿主遺伝子(LjSym1、LjSym5、LjSym35/70、PsSym10、MtDmi1、LjSymRK、LjSym3、LjSym4/22/71、LjSym15/72、LjSym23、LjSym30/82、LjNin1、LjSym74、LjSym79)(中川知己、河内宏、川口正代司(2004):根粒共生系を制御する宿主因子 ―Nodファクターシグナリングを中心に―、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p32-41、秀潤社)などが挙げられる。
【0032】
当業者であれば有効微生物の種類や種子の種類、並びにマイクロアレイ解析などから、過度の実験を必要とすることなく、有効微生物の活性を評価するための指標として使用することができる遺伝子を決定することができる。
【0033】
例えば、拮抗微生物を用いる場合には、全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生、抵抗性に関連する遺伝子の中から選択した遺伝子を指標として利用することができる。
【0034】
植物生育促進微生物を用いる場合には、全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生、抵抗性に関連する遺伝子の中から選択した遺伝子を指標として利用することができる。
【0035】
根粒菌を用いる場合には、根粒菌のNodファクターに応答する植物側遺伝子の中から選択した遺伝子を指標として利用することができる。
【0036】
菌根菌を用いる場合には、VA菌根菌のMYcファクターに応答する植物側遺伝子の中から選択した遺伝子を指標として利用することができる。
【0037】
拮抗微生物、特にトリコデルマ(Trichoderma)属糸状菌をイネの種子にコーティングした場合には、PR-1a、PR1b、Glutathione S-transferase、CytochromeP450、PR-10遺伝子を指標として使用することができる。
【0038】
植物生育促進微生物、特にトリコデルマ(Trichoderma)属糸状菌をイネの種子にコーティングした場合には、PR-1a、PR1b、Glutathione S-transferase、CytochromeP450、PR-10遺伝子を指標として使用することができる。
【0039】
拮抗微生物、特に蛍光性シュードモナス(Pseudomonas)属細菌をトマトの種子にコーティングした場合には、PR3、PR4、ACS2、PDF1,4遺伝子を指標として使用することができる。
【0040】
植物生育促進微生物、特に蛍光性シュードモナス(Pseudomonas)属細菌をトマトの種子にコーティングした場合には、PR3、PR4、ACS2、PDF1,4遺伝子を指標として使用することができる。
【実施例】
【0041】
以下に本発明の実施例を掲げて、さらに具体的に説明するが、本発明はこれらの実施例に制限されるものではない。
【0042】
実施例1.温度処理による活性低下微生物の作製方法、FDA染色による活性低下の確認方法
使用した微生物は、生物農薬製剤(エコホープ・クミアイ化学製)の成分微生物であるトリコデルマ アスペレラム(Trichoderma asperellum)SKT-1株を用いた。
【0043】
PDA上で25℃、7日間培養したSKT-1株より分生子を回収し、1.0×108cfu/mlに調整した後、遠心処理を2回行い、リン酸緩衝液(60mM NaH2PO4・2H2Oと60mM Na2HPO4・12H2O、pH 7.6)に再懸濁して得られた分生子懸濁液を用いた。この分生子懸濁液を25℃、40℃、60℃、100℃で30分間処理した。各種温度処理したSKT-1株の分生子懸濁液100μlに対してFDA(2mg/ml in acetone)を0.5μl加え5分間室温で静置して分生子を染色した。染色したSKT-1株分生子懸濁液の蛍光強度を時間分解蛍光光度計(DELFIA, パーキンエルマーライフサイエンス社製)で測定した。
【0044】
Fluorescein diacetate(FDA)染色法は、生きている細胞を蛍光染色する方法である。その原理は、無蛍光物質であるFDAが、生きている細胞内に取り込まれた後、プロテアーゼ、 リパーゼ、エステラーゼ等の酵素によって加水分解され、蛍光物質であるフルオレセインを生成することを利用する。この方法は周知である。
【0045】
実施例2.有効微生物コーティング種子(イネ)の作成方法
植物はイネ(品種:コシヒカリ、Oryza sativa L. cv. Koshihikari)を供試した。
SKT-1株の分生子懸濁液(5.0×107cfu/ml)10mlにイネ種子3gを浸漬し、デシケータ内で10分間減圧処理した。この減圧接種は、特開2007−77118号公報で開示された方法による接種に準じている。
【0046】
実施例3.温度処理による活性低下SKT-1株のイネばか苗病に対する防除効果検定
温度処理したSKT-1株分生子を実施例2の方法でばか苗病汚染イネ種子に微生物コーティングした。作成した各種ライブコート種子を25℃の制御温室内で3週間栽培し、徒長・枯死苗率を調査し、そこから防除価を算出した。25℃(室温)保存のSKT-1分生子を微生物コーティング処理した場合、高い防除価を示した(図1)。これを各種温度処理したSKT-1株分生子をイネ種子にライブコートし、ばか苗病に対する防除効果を調査した場合には、60℃、100℃といった高温処理したSKT-1株については、防除効果がほとんど失われていた(図1)。
【0047】
実施例4.FDA染色によるSKT-1株の活性評価結果
SKT-1株分生子のFDA染色による防除活性の評価法を検討した。図2A上図には、FDA染色したSKT-1株胞子懸濁液の明視野での顕微鏡写真を、図2A下図には、FDA染色した胞子懸濁液の蛍光視野における顕微鏡写真の例を示した。このように生きている細胞が蛍光染色されていることがわかる。
【0048】
SKT-1株の活性を低下させるために分生子を温度処理した。処理温度が高くなるにつれ胞子発芽率が低下した。温度処理したSKT-1株分生子をFDAで染色し、その蛍光強度を測定したところ、処理温度が高くなるにつれ蛍光強度が低下した(図2B)。
【0049】
以上のように、処理温度が高くなるにつれ、SKT-1株の分生子発芽率、ばか苗病に対する防除活性、FDA蛍光強度が低下した。これらの間に正の相関がみられたことから、温度処理はSKT-1株の防除活性を低下させる手法として有効であることが示唆された。また、SKT-1株の防除活性はFDA染色によって簡易かつ迅速に検出可能であった。なお、FDA蛍光の検出限界は1.0×107(cfu/ml)であった。
【0050】
実施例5.有効微生物コーティング種子(イネ)の発芽・育苗方法
滅菌蒸留水で湿らせた濾紙上にイネ種子を置床し、30℃の暗所で24時間催芽した。イネ育苗用培土(クリーン2号)に播種し、30℃で3日間出芽処理を行った後、25℃の制御温室内で栽培した。
【0051】
実施例6.イネ育苗苗からのRNA抽出方法・発現遺伝子レベルの確認方法
微生物コーティング種子を25℃で1週間生育させ、地上部よりGTC法でtotalRNAを抽出した。抽出したtotal RNA 1μgをReverTra Ace(TOYOBO, Osaka, Japan)で逆転写しcDNAを合成した。合成したcDNAを防御関連遺伝子のRT-PCR解析に用いた。PCR増幅産物を1.5%アガロースで電気泳動し、そのバンド強度で防御関連遺伝子の発現量を比較した。なお、対照には無処理ならびにサンプリングの3日前に50μMベンゾチアジアゾール(BTH)を10ml土壌潅注した。
【0052】
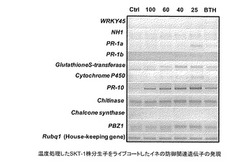
各種温度処理したSKT-1株分生子を微生物コーティングしたイネの防御関連遺伝子の発現を調査したところ、PR1a、PR1b、CytochromeP450、PR10では処理温度が高くなると発現量が低下した。BTH処理によって発現が誘導されると報告のあるWRKY45やNH1(OsNPR1)は微生物コーティング処理では発現量が顕著に増加しなかった。(図3)
【0053】
実施例7.半定量RT-PCRによる発現量の確認
発現遺伝子量を半定量PCRにより、発現量をゲルバンドの濃度で比較した(図4)。その結果、PR10 遺伝子の発現量は、ライブコート処理により約4倍に上昇した。その後、100℃、60℃、40℃で温度処理すると、25℃の温度条件(室温)に保存しているものと比較してPR10遺伝子の発現量は失活、低下することが明らかとなった(図4)。
【0054】
以上、遺伝子発現レベルとFDA蛍光やばか苗病に対する防除活性との相関をより正確に検証するために、処理温度によって発現量に変化がみられた防御関連遺伝子ついて発現量の半定量解析を行った。その結果、温度処理により防御関連遺伝子の内のPR10遺伝子の発現量が低下する事を確認した。同様の温度処理により微生物活性が低下する事、そのことはFDA染色により確認できること、同様の温度処理によりバカ苗病に対する防除活性が低下することは、先の実施例において示している。従って、半定量RT−PCR法の結果より、PR10遺伝子の発現量は、温度処理による微生物活性の低下と相関があることが示された。
【0055】
実施例8.共生菌(Pseudomonas fluorescens)感染シロイヌナズナを用いたマイクロアレイ解析方法と結果
有用微生物が共生した植物における遺伝子発現動向を網羅的に調査するためにモデル植物であるシロイヌナズナを用いたマイクロアレイ解析を行った。セル苗元気の有効微生物成分であるPseudomonas fluorescens FPT9601由来の菌系(T5)の培養液(109 cfu/ml)に播種後一週間のシロイヌナズナ幼植物の根を侵漬して感染させた。接種後3週間の計27個体のシロイヌナズナから抽出したトータルRNAをマイクロアレイ解析に供した。
【0056】
マイクロアレイ解析は、Affymetrix社のATH1アレイを用いて、同社のMAS version 5.0ソフトウエアを用いて解析した。また、マイクロアレイ解析のためのcDNA合成は、T7RNAポリメラーゼのプロモーター配列を持つオリゴdTプライマーによりインビトロジェン社のsuperscript choiceシステムにより行った。解析の結果、コントロールに比べて2倍以上の発現上昇が見られた遺伝子が95個、また発現量が半分以下になっていた遺伝子が105個、同定された。
【0057】
実施例9.シロイヌナズナのマイクロアレイ解析結果からトマトのゲノムデータベースを用いたホモロジー検索方法と結果
シロイヌナズナのマイクロアレイ解析結果から、発現上昇の度合いが大きかった遺伝子を上位から約30個選抜し、トマトゲノムデーターベースとのホモロジーサーチをBLASTプログラムにより行った。E-Valueが10-3以下であったものを該当シロイヌナズナ遺伝子のトマトホモログと想定した。複数の遺伝子に相同性が見られた場合には、E-Valueが最も低い物を選択した。これらのトマトホモログの塩基配列の3’領域にPrimer3プログラムを用いて特異的なプライマーを構築した。
【0058】
実施例10.有効微生物コーティング種子(トマト)の作成方法
Pseudomonas fluorescens FPH株、およびFPT株の培養液(多木化学提供)から、遠心分離により濃縮菌体を得た。菌体を1%ペプトン、1%グルタミン酸ソーダを含む溶液に懸濁した。トマト種子(品種:麗夏およびサポート)をビーカーに入れ、その2.5倍量(重量比)の上記菌体懸濁液を添加し、減圧乾燥を行った。種子に付着した菌濃度を希釈平板法で調査した。その結果、FPH株、FPT株は、共に104cfu/種子以上であった。
【0059】
実施例11.有効微生物コーティング種子(トマト)の発芽・育苗方法
播種用土:赤玉細粒土とスーパーセルトップVを容量比で1:4に混合。200穴トレーに充填。深さ5mmの播き穴を作り、一粒ずつ播種トマト穂木(品種:秀麗)および台木(品種:サポート)を播種した。人工気象器、昼(6時〜20時、温度28℃、湿度60%、約1万ルクス蛍光灯照明)、夜(20時〜6時、温度25℃、湿度85%)で育苗した。
【0060】
実施例12.接木苗の作成方法
実施例11に記載の方法で播種・育苗した播種後13日目の苗(穂木および台木)をそれぞれ斜め45°以上の角度に切断し、接木クリップを用いて接いだ。湿度100%の高湿度ハウス内で7日間養生し、その後2日間室内に出して馴化させた。その後、ガラス室に移し、9cmポットに移植し、2週間〜4週間育苗した。
【0061】
実施例13.トマト幼植物体からのRNA抽出方法
微生物コーティング・トマト種子を播種し、5日〜3週間の幼植物からのトータルRNAの抽出を行った。RNA抽出はQiagen社のRNeasy Plant Mini Kitキットの付属試薬を用いて、プロトコールに従い行った。得られたトータルRNAは、MOPSバッファーを用いたホルムアミド変性アガロースゲル電気泳動により、rRNAバンドを検出することで品質を確認した。
【0062】
トータルRNAは、RNaseフリーDNase(インビトロジェン社)処理後、cDNA合成のテンプレートとして用いた。cDNA合成は、PrimeScript RT reagent Kit(タカラバイオ)の付属試薬を用いて、オリゴdTをプライマーとしてプロトコールに従い行った。
【0063】
実施例14.発現遺伝子レベルの確認方法と結果
選抜された約30個の遺伝子発現レベルは、半定量的RT-PCR法により一次スクリーニングを行い、その結果、最も有望であったPathogenesis-Related 4 (PR) 遺伝子について、リアルタイムPCRを用いた定量PCR解析に供した。リアルタイムPCRは、Takara TP800(タカラバイオ)を用いて、SYBR Premix Ex Taq II (タカラバイオ)もしくはTHUNDERBIRD SYBR qPCR Mix (TOYOBO)によるSYBR green法によって行った。使用したプライマー配列は(PR4-L:配列番号1; PR4-R:配列番号2)である。その結果、Pseudomonas剤が微生物コーティングされたトマト種子(品種サポート)を播種後一週間の幼植物において、平均4.3倍のPR4の発現上昇が認められた(図5)。
【0064】
実施例15.防御関連遺伝子の発現レベル調査
PR4は、シロイヌナズナやタバコ等の植物において、エチレン・ジャスモン酸系のシグナルにより発現が誘導されることが知られている。そこで他の植物で同シグナル系に属することが知られている遺伝子群の動向を微生物コーティング・トマト植物において調査した所、PR3, PDF1.4, 1-aminocyclopropane-1-carboxylate synthase2 (ACS2)などにおいて、品種や播種後の時間により差異はあるものの有意な発現上昇が認められた(図6)。尚、これらの遺伝子に対するプライマー配列はそれぞれ以下の通りである。PR3 (PR3-L:配列番号3; PR3-R:配列番号4), PDF1.4 (PDF1.4-L: 配列番号5; PDF1.4-R: 配列番号6), ACS2 (ACS2-L: 配列番号7; ACS2-R: 配列番号8)。
【0065】
図6において、台木品種サポートにおいては、PR3、PR4、ACS2遺伝子の発現レベルの上昇が確認された。一方の穂木品種・麗夏においては、PDF1,4 遺伝子の発現上昇が確認されたが、PR3、PR4、ACS2遺伝子の発現レベルは上昇していなかった。この様に、台木品種と穂木品種ではその遺伝子発現の時期・量の変化が異なることが示された。このことが、青枯病などの病気に対する抵抗性・感受性の違いとなっていることが考えられた。
【0066】
実施例16.発現遺伝子レベルの経時的変化
図7に発現遺伝子レベルの経時的変化を示した(図の太い横線は、無処理の遺伝子発現レベルを示す)。
【0067】
その結果、台木品種・サポートでは、PR3遺伝子とACS2遺伝子は、7日目に、PR4遺伝子の発現は、7日目と2週間目に、PDF1,4遺伝子発現は、3週目に発現上昇が認められた。穂木品種・マイロックでは、PR3遺伝子発現は、2週間目に、PR4遺伝子発現は、10日目をピークに2週間目、3週間目まで発現上昇が認められた。PDF1,4遺伝子は、7日目、10日目、3週間目に発現上昇が起こった。ACS2遺伝子発現レベルは、10日目に発現上昇が認められた。
【0068】
図6と図7で共通する播種後7日目のデータを比較すると、青枯病に耐病性を持つ台木(サポート)では、PR3、PR4、ACS2遺伝子の発現レベルが上昇した。青枯病に対して感受性の穂木品種(麗夏またはマイロック)の場合には、PDF1,4の遺伝子の発現レベルが上昇していた。
【0069】
この様に、台木品種と穂木品種ではその遺伝子発現の時期・量の変化が異なることが示された。このことが、青枯病などの病気に対する抵抗性・感受性の違いとなっていることが考えられた。
【0070】
これらの実験結果を総合すると、播種7日目において、台木品種の場合には、PR3、PR4、ACS2遺伝子を、穂木品種の場合には、PDF1,4の遺伝子をマーカーとして用いることで、幼植物において有効微生物が機能していることを早期に判定できると考えられた。
【0071】
実施例17.接木苗における遺伝子発現
穂木品種は、秀麗を、台木品種にはサポートを用いた。実施例10に準じる方法で有効微生物コーティング種子を作成し、実施例11の方法で播種・育苗し、実施例12の方法で接木苗を作成した。9cmポット移植後2週間目〜3週間目の接木苗を用いて遺伝子発現を調べた(播種から13+7+2+(14〜28)=36〜50日目)。台木部・穂木部のどちらにおいても、台木種子に微生物コーティング処理した場合に、幾つかの遺伝子が有意に上昇している傾向があった(図8)。
【0072】
具体的には、微生物を台木種子に処理した接木苗の場合には、穂木部のPR3とACS2遺伝子発現上昇が起こり、台木部のPR4、PDF1,4、ACS2遺伝子の発現上昇が起こっていることが示された。
【0073】
微生物を穂木種子に処理した場合には、穂木部では確認が難しいものの、台木部においてPDF1,4、ACS2遺伝子の発現上昇が起こっていることが示された。
【0074】
以上、温度処理により微生物活性を低下させた。活性の低下はFDA染色により確認することができた。イネ・バカ苗病汚染モミに対する微生物コーティング処理の効果は、微生物活性の低下と防除効果の間で正の相関があった。イネ・微生物コーティング種子において複数の防御関連遺伝子の発現レベルが上昇することが明らかとなった(PR-1a、PR1b、GlutathioneS-transferase、CytochromeP450、PR-10 など)。温度処理するとこれらの遺伝子発現レベルは低下することが明らかとなった。この中でもPR10遺伝子発現は、半定量RT-PCR法により、熱処理による失活と高い相関のあることが確認された。
【0075】
シロイヌナズナを用い、微生物処理によって発現遺伝子が上昇する遺伝子をマイクロアレイ解析で調査し、発現上昇の明確な遺伝子を選抜した。トマトの全遺伝情報とホモロジー検索を行いその結果に基づいて有望な30個の遺伝子についてプライマーを作成し、トマトの発現遺伝子レベルを一次スクリーニングした。その結果、最も有望な遺伝子としてPR4遺伝子が選抜できた。さらに複数の防御関連遺伝子の発現レベルを調査した。その結果は以下のように整理できた。
【0076】
(1)台木品種: PR3、PR4、ACS2遺伝子。
(2)穂木品種: PDF1,4の遺伝子。
(3)接木苗・台木種子処理:(播種後30〜50日の苗)台木部のPR4、PDF1,4、ACS2遺伝子または穂木部のPR3とACS2遺伝子。
(4)接木苗・穂木種子処理:(播種後30〜60日の苗)台木部のPDF1,4、ACS2遺伝子。
【0077】
この中でも特に注目すべきは、接木苗(播種後30〜60日の苗)・台木部における遺伝子発現レベルが30〜50倍もの著しい上昇を示した事例が得られたことにある。通常、これほど著しい発現上昇が起こることは非常に珍しい。そして、30〜50倍もの発現上昇であれば、厳密な定量PCRなどの特別高価な装置を用いなくとも、素人がみても容易に判別することが可能であり、品質管理においても簡単な方法で確認できる技術となる。
【0078】
これらの結果から、微生物コーティング種子において、植物応答を指標とした新しい微生物の活性評価方法が確立できた。
【配列表フリーテキスト】
【0079】
配列番号1:プライマー
配列番号2:プライマー
配列番号3:プライマー
配列番号4:プライマー
配列番号5:プライマー
配列番号6:プライマー
配列番号7:プライマー
配列番号8:プライマー
【技術分野】
【0001】
本発明は有効微生物コーティング種子の品質管理技術に関する。
【背景技術】
【0002】
微生物コーティング種子の製造方法は多くの特許、論文が報告されている。しかしながら、従来から微生物コーティング種子を製造した後の品質管理、品質の保証に関しては、種子に導入した微生物の生菌数を調査する程度で、それ以上の品質管理は行われてこなかった。ところが、微生物は、培養条件の違いによって活性が変化すること、活性を維持した状態で保存することが難しいことが知られている(特許文献1および2)。そのため、変異処理や遺伝子操作により、高活性な変異株や宿主植物への定着・共生能力を増強するための試みが進められている(特許文献3、4および5)。すなわち、微生物は、変化しやすいものであり、変異株の出現、活性の低下、失活などが起こる場合があり、種子処理の目的である病害軽減効果や生育促進効果、あるいは窒素固定能力などが充分に得られないという場合がある。従って微生物を導入し、一定レベル以上の菌濃度がいるということだけでは充分に品質を保証したということはできなかった。
【0003】
従来から知られている有効微生物の活性の測定方法は、有効微生物が植物側に与える有益な影響を指標にして調べられてきた。例えば、拮抗微生物を用いる場合には、目的とする病害の軽減程度を発病度、発病株率、防除価などで数値化して表現することができる。
【0004】
イネのばか苗病やモミ枯細菌病、ナス科植物(トマトやナスなど)の青枯病、アブラナ科植物(キャベツ・白菜・ブロッコリーなど)の根こぶ病などの病害に対する病害軽減効果などについて、発病度、発病株率、防除価などが指標として使用される。植物生育促進微生物を用いる場合には、育苗時の苗の生育促進量を草丈、茎の太さ、葉長、葉幅、重量などを計測して数値化できる。根粒菌を用いる場合には、根における根粒菌の着生程度(量)、根粒の窒素固定活性、植物体に吸収された窒素量の増加、あるいは植物体の重量の増加などで調べることができる。菌根菌を用いる場合には、菌根菌の着生程度(量)、植物体の吸収したリン酸量の増加、あるいは植物体の重量の増加などで調べることができる。
【0005】
しかしながら、これらのバイオアッセイ法は、植物の栽培環境の影響を受けたりして振れが大きいことが問題であった。この他に、植物を用いないで有効微生物の活性を調べる方法もある。例えば、微生物の増殖速度、呼吸活性(酸素吸収量、二酸化炭素放出量)、活性染色法(例えばFDA染色法など)、ATP含量、酵素活性測定などを利用することができるが、間接的な方法であり植物へ与える影響とどの程度相関があるのかははっきりしていない。
【0006】
特許文献6は環境ストレスをスクリーニングするために植物遺伝子発現を利用する方法を開示しており、その中には病原微生物によるストレスも含まれている。しかしながら、この方法は環境ストレスの有無を判断する定性的な試験に過ぎず、定量化は行われていなかった。なぜならば、定量化するためには、微生物活性と植物側の遺伝子発現の間にきちんと相関があることが示されなければならないからである。つまり、植物の遺伝子発現を調べることは既に行われているが、これを有効微生物の活性を調べるために使用する試みは世界でも例がない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平7−163334号公報
【特許文献2】特開2000−175678号公報
【特許文献3】特開2007−306852号公報
【特許文献4】特開2004−261078号公報
【特許文献5】特開2003−33174号公報
【特許文献6】特開2007−68495号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、有効微生物コーティング種子の品質管理・品質保証に関する新規な方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
上記のような従来から行われていた有効微生物の活性測定方法を用いて測定した有効微生物の活性と植物遺伝子の発現量との間に相関が認められれば、植物体の遺伝子発現量を有効微生物の活性の指標として使用することができる。さらに、植物体の遺伝子発現量を指標とすることにより、従来の有効微生物の活性測定方法における問題点を解決することができる。
【0010】
本発明者らは、植物体の遺伝子発現量に着目し、有効微生物コーティング種子の品質を管理・保証する方法について検討した。その結果、本発明者らは、様々な有効微生物コーティング種子を用いて育苗した植物において、幾つかの植物側の遺伝子発現レベルが、変化することを見出した。そして、この変化が有効微生物の活性の変化と関連していることが示唆される実験結果を得た。この結果から、本発明者らは、有効微生物コーティング種子において、その品質として最も重要な有効微生物の活性を植物応答の指標として調べる新しい方法を開発した。
【0011】
上記の本発明者らによって確認された現象は、例えば以下のように説明できる。有効微生物コーティング種子を発芽、育苗することにより、有効微生物が植物の根にうまく定着あるいは共生関係を構築できた場合に、植物は、有効微生物からの刺激に対して様々な応答反応を起こし、幾つかの遺伝子発現のレベルを変化させる。しかし、有効微生物コーティング種子中の有効微生物がうまく植物の根に定着できなかった場合、あるいは有効微生物の活性が低下、失活、変異などの変化が生じた場合には、植物側のこの応答反応に変化が生じることになる。
【0012】
今回、本発明者らは、この植物の応答を指標とすることにより、有効微生物コーティング種子における導入した有効微生物の活性を計測することに成功した。
【0013】
即ち本発明は、より具体的には、下記の発明を包含する。
(1)有効微生物コーティング種子における有効微生物の活性を評価する方法であって、
有効微生物コーティング種子から幼植物を得る第一工程、
前記幼植物における遺伝子の発現量を測定する第二工程、および
前記発現量を指標として、有効微生物コーティング種子における有効微生物の活性を評価する第三工程、
を含む方法。
(2)前記遺伝子がマイクロアレイ解析により特異的に発現量が上昇または減少する遺伝子である、(1)の方法。
(3)前記遺伝子が全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生および抵抗性に関連する遺伝子、ならびに根粒菌のNodファクターおよびVA菌根菌のMYcファクターに応答する植物側遺伝子から選択される少なくとも1種の遺伝子である、(1)または(2)の方法。
(4)前記有効微生物が、拮抗微生物、植物生育促進微生物、根粒菌または菌根菌である、(1)〜(3)のいずれかの方法。
(5)前記種子がイネまたはトマトの種子である、(1)〜(4)のいずれかの方法。
(6)前記微生物が拮抗微生物または植物生育促進微生物であり、
前記種子がイネの種子であり、
前記遺伝子がPR-1a、PR1b、Glutathione S-transferase、CytochromeP450およびPR-10遺伝子から選択される少なくとも1種の遺伝子である、(1)の方法。
(7)前記微生物が拮抗微生物または植物生育促進微生物であり、
前記種子がトマトの種子であり、
前記遺伝子がPR3、PR4、ACS2およびPDF1,4遺伝子から選択される少なくとも1種の遺伝子である、(1)の方法。
【発明の効果】
【0014】
本発明は、有効微生物コーティング種子を製造した後の品質を確認するため、導入した微生物の活性を評価する新しい方法を提供する。
【図面の簡単な説明】
【0015】
【図1】図1は温度処理したSKT-1株分生子のイネばか苗病に対する防除効果を示す。
【図2】図2は温度処理したSKT-1株分生子のFDA蛍光強度を示す。
【図3】図3は温度処理したSKT-1株分生子をライブコートしたイネの防御関連遺伝子の発現を示す。
【図4】図4は半定量RT-PCRによるPR10遺伝子の発現量の熱処理による影響を示す。
【図5】図5は微生物コーティング(ライブコート)種子由来トマト幼植物におけるPR4遺伝子の発現上昇を示す。
【図6】図6はライブコート種子由来サポートおよび麗夏の幼植物におけるPR3、PR4、PDF1.4およびACS2各遺伝子の発現動向を示す。
【図7】図7は微生物コーティング種子由来サポートおよびマイロックの幼植物におけるPR3、PR4、PDF1.4およびACS2各遺伝子の経時的な発現動向を示す。
【図8】図8はライブコート処理・接木苗における防御関連遺伝子の発現レベルを示す。
【発明を実施するための形態】
【0016】
以下、本発明について詳細に説明する。
本発明において、「有効微生物コーティング種子」とは、拮抗微生物、植物生育促進微生物、根粒菌、菌根菌など植物に対してなんらかの有益な影響を与える有効微生物を種子にコーティングしたものを言う。すなわち、有効微生物が種子にコーティングされている限り、裸種子のままであっても良いし、フィルムコート種子、ペレット種子、ゲル被覆種子、シーダーテープ、シードグラフ、プライミング処理種子など様々な加工処理が施された種子であっても良い。なお、有効微生物コーティング種子とは、種子全体が有効微生物でコーティングされているものだけではなく、種子の一部分のみがコーティングされているものも含む。また、有効微生物が種子表面にのみ存在しているものだけではなく、有効微生物が種子内部に導入されているものも含む。コーティングされた微生物の菌数は特に限定されないが、101〜1010 cells/粒の範囲内で含まれていれば良い。好ましくは、102〜109 cells/粒の範囲であり、より好ましくは、103〜108 cells/粒の範囲である。
【0017】
本発明に用いる拮抗微生物としては、植物病原菌に対して拮抗性を示すものであれば特に限定されないが、例えば、バチルス(Bacillus)属細菌、ストレプトマイセス(Streptomyces)属放線菌、蛍光性シュードモナス(Pseudomonas)属細菌(P. fluorescens, P. putida)、非病原性エルビニア(Erwinia)属細菌、バリオボラックス(Variovorax)属細菌、非病原性フザリウム(Fusarium)属糸状菌、トリコデルマ(Trichoderma)属糸状菌、グリオクラディウム(Gliocladium)属糸状菌、ペニシリウム(penicillium)属糸状菌、タラロマイセス(Talaromyces)属糸状菌、などが挙げられる。
【0018】
植物生育促進微生物とは、植物に対して生育促進効果を示すものであれば特に限定されないが、例えば、蛍光性シュードモナス(Pseudomonas)属細菌(P. fluorescens, P. putida)、の他に、バチルス(Bacillus)属細菌(B.subtilis、B. polymyxa)、エンテロバクター(Enterobacter)属細菌(E.clocae)、セラチア(Serratia)属細菌(S. fonticola, S. liquefacience, S. marcescens )などの細菌類や、ユーペニシリウム(Eupenisillium)属糸状菌(E. javanicum)、ペニシリウム(Penicillium)属糸状菌(P. janthinellum, P. citreonigrum, P. citrium)、トリコデルマ(Trichoderma)属糸状菌、非病原性リゾクトニア(Rhizoctonia)属糸状菌、フォーマ(Phoma)属糸状菌、および胞子を形成しないステライル(sterile)菌と称されるグループ、などが上げられる。
【0019】
根粒菌とは、大豆をはじめとしたマメ科植物に共生し、大気中の窒素を固定してアンモニア態窒素に変換し宿主植物へ提供する微生物であれば特に限定されないが、例えば、リゾビウム(Rhizobium)属細菌、ブラディリゾビウム(Bradyrhizobium)属細菌、シノリゾビウム(Sinorhizobium)属細菌、メソリゾビウム(Mesorhizobium)属細菌などが挙げられる。
【0020】
菌根菌とは、陸上植物の根の組織に侵入したり、あるいは根組織表面にしっかりと付着して、植物と菌の間で養分の授受などの相利的な関係の成立しいる菌根を形成する共生菌のことである。菌根は、菌糸が根皮層組織へ侵入する内生菌根、菌糸が根組織表面に付着し厚い菌糸層を形成する外生菌根、その中間的なタイプに分けられる。
【0021】
本発明で用いる種子は特に制限されない。例えば、タマネギ、ネギなどのユリ科の種子、ホウレンソウ、テンサイなどのアカザ科の種子、キャベツ、ハクサイ、カリフラワー、ブロッコリー、ダイコンなどのアブラナ科の種子、ソラマメ、エンドウなどのマメ科の種子、ニンジン、セルリー、ミツバなどのセリ科の種子、レタス、シュンギク、ゴボウなどのキク科の種子、トマト、ナス、ピーマンなどのナス科の種子、メロン、キュウリ、スイカ、カボチャなどのウリ科の種子、イネ、トウモロコシ、コムギ、オオムギなどのイネ科の種子などの作物種子; パンジー、ビオラ、ペチュニア、トルコギキョウ、ストック、アスター、シクラメン、プリムラ、キンギョソウ、ジニア、マリーゴールド、アサガオ、ヒマワリ、コスモス、ラナンキュラス、ラベンダー、ルピナス、ミムラス、ポピー、ベゴニア、ネメシア、ビンカ、トレニア、デルフィニューム、ダイアンサス、ゼラニューム、センニチコウ、スイートピー、サルビア、ガーベラ、ガザニア、カレンジュラ、グロキシニア、ケイトウ、インパチェンス、アネモネ、アゲラタムなどの花卉種子; その他には飼料作物種子、牧草、芝などの種子が挙げられる。
【0022】
有効微生物コーティング種子を作成する方法としては特に制限されず、公知の様々な方法を使用することができる。例えば、特開平2007−77118号公報に記載されたように、有効微生物を種子に減圧接種する方法などを使用することができる。
【0023】
有効微生物コーティング種子から幼植物を得るためには、有効微生物コーティング種子を発芽させ、育苗すればよい。種子を発芽させ、育苗する方法は、一般に行われる発芽・育苗方法であれば特に制限はないが、清潔で雑菌の少ない環境で育苗することが望ましい。
【0024】
本発明における幼植物には有効微生物コーティング種子を発芽させ、育苗した幼植物を接木処理したものも含まれる。つまり、本発明の方法は有効微生物コーティング種子を発芽させ、育苗した幼植物を接木処理したものにも使用することができる。例えば、果菜類において、土壌病害に抵抗性のある台木に穂木を接木したものについて有効微生物の活性を評価することができる。台木および穂木がいずれも有効微生物コーティング種子から得られたものの場合には、台木および穂木のぞれぞれについて有効微生物の活性を評価することもできる。接木処理に使用する植物は特に制限されないが、親和性の良い植物を用いることが好ましい。
【0025】
本発明において、種子を発芽、育苗して得られる幼植物は、発芽直後から3ヶ月以内の植物を使用することが好ましい。接木処理をする場合には、接木後、加湿・養生期間などは植物の生育が停滞し著しく遅れが生じるため、育苗期間が1ヶ月程度延長される場合もある。
【0026】
遺伝子の発現量は幼植物からRNAを抽出することによって測定することができる。幼植物からRNAを抽出する場合には、幼植物体全体を用いても良いし、地上部、根部、茎、双葉、本葉、あるいは表皮細胞、髄、導管、柔組織、維管束などに分画して抽出することもできる。種子の状態であっても、遺伝子の発現量に変化が生じる場合には種子からRNAを抽出しても良い。RNAの採取時期は、発芽直後から3ヶ月以内が好ましく、より好ましくは発芽直後から1ヶ月以内である。接木苗の場合には、接木直後から90日以内が好ましく、接木直後から7〜50日以内がより好ましく、接木直後から10〜30日以内が特に好ましい。
【0027】
RNAの抽出は、使用する植物体あるいは組織を冷却あるいは凍結してホモジナイズし、RNA抽出キットを用いるなどの一般的な方法で行えばよい。次にRNAからm-RNAの精製は、oligo-dTを用いたm-RNA精製試薬・キットを用いるなどの一般に行われる方法を用いて行うことができる。m-RNAからc-DNAへの逆転写は、逆転写酵素を含むキットなどを用いた定法を用いて行うことができる。発現量を確認したい遺伝子を決めてその遺伝情報からハイブリダイゼーションプローブを作製する。また、c-DNAへの逆転写を行わず、Northern hybridization法で直接RNAから目的遺伝子の発現を検出することもできる。RT-PCR法あるいはreverse PCR法を用いて発現遺伝子を定量的に増幅させて検出することは、検出感度を高める上で非常に有効な場合がある。PCRで増幅した遺伝子が目的の遺伝子であるかどうかを確認するために、クローニングし、その塩基配列を決定することを行うことが必要な場合もある。遺伝子の発現量は定量PCR法、半定量PCR法、マイクロアレイなどにより測定することができ、発現量の増減に基づいて有効微生物の活性を評価することができる。
【0028】
本発明において、マイクロアレイの作製は、一般に行われる方法でよく、トマト、イネ、シロイヌナズナなどの場合には、既に全遺伝情報が明らかとなっているため、この遺伝情報を基に作製することができる。さらにこの遺伝情報に基づいてホモロジー検索を容易に行うことができる。それ以外の植物では、部分的に判っている遺伝情報や他の動植物・微生物などの遺伝情報を元に作製することができる。
【0029】
本発明において、マイクロアレイ解析により、特異的に発現が上昇した遺伝子または特異的に発現が減少した遺伝子をマーカー遺伝子として選択することができる。特異的に発現が上昇した遺伝子とは、無処理の植物の遺伝子発現量と比較して、1.5倍以上に発現が増加している場合を言う。好ましくは、3倍以上、より好ましくは10倍以上、さらに好ましくは30倍以上である。特異的に発現が減少した遺伝子とは、無処理の植物の遺伝子発現量と比較して、3/4以下に発現が減少している場合を言う。好ましくは1/2以下、より好ましくは、1/4以下である。
【0030】
本発明において、全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生および抵抗性に関連する遺伝子とは、例えば、LB-LPRタンパク質ファミリー、シロイヌナズナのPRM1、PRS2、PRS5、トマトのecLRP遺伝子Cf-2、イネのNB-LPR遺伝子Pi-ta、(片桐文章(2004):抵抗性遺伝子と病原体認識機構、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p88-95、秀潤社)、大麦のMLA1、MLA6、MLA12、ジャガイモのRx、タバコのN、シロイヌナズナのRPS4、RPP1A、RPP2、RPP4、RPP5、RPP7、RPP8、RPW8、RAR1、SGT1、HSP90(heat shock protein 90)、(高橋章、市村和也、白須賢(2004):耐病性機構に関わるタンパク質の機能解析、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p96-102、秀潤社)、rboh遺伝子、(吉岡博文、川北一人、道家紀志(2004):植物の生体防御機構、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p103-110、秀潤社)、低分子Gタンパク質Rac/Ropファミリー、ヘテロ3量体Gタンパク質、(川崎努、島本功(2004):Gタンパク質を介した抵抗性のシグナル伝達、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p111-117、秀潤社)、PCD(programmed cell death)、HR(hypersensitive response)などに関与する遺伝子、(中屋敷均、眞山滋志(2004):細胞死現象の新展開、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p118-125、秀潤社)、PRプロテイン、nahG、PR1、PR2、PR5、NPR1、などのサリチル酸(SA)のシグナル伝達関連遺伝子、WSR(wound-induced systemic resistance)、ISR(induced―systemic resistance)、(光原一朗、瀬尾茂美、大橋祐子(2004):病害抵抗性の全身誘導機構とそのシグナル伝達、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p126-135、秀潤社)、ジャスモン酸シグナル伝達系、エチレンシグナル伝達系に関与する遺伝子などが挙げられるが、現在も次々と新しい遺伝子が明らかになっているため、この例だけに留まらない。今後新たに見出される関連遺伝子を使用することも可能である。
【0031】
本発明において、根粒菌のNodファクターおよびVA菌根菌のMYcファクターに応答する植物側遺伝子とは、根粒形成初期と菌根菌との共生系を支える宿主遺伝子(LjSym1、LjSym5、LjSym35/70、PsSym10、MtDmi1、LjSymRK、LjSym3、LjSym4/22/71、LjSym15/72、LjSym23、LjSym30/82、LjNin1、LjSym74、LjSym79)(中川知己、河内宏、川口正代司(2004):根粒共生系を制御する宿主因子 ―Nodファクターシグナリングを中心に―、分子レベルから見た植物の耐病性 ―ポストゲノム時代の植物免疫研究― 細胞工学別冊 植物細胞工学シリーズ 第19巻、p32-41、秀潤社)などが挙げられる。
【0032】
当業者であれば有効微生物の種類や種子の種類、並びにマイクロアレイ解析などから、過度の実験を必要とすることなく、有効微生物の活性を評価するための指標として使用することができる遺伝子を決定することができる。
【0033】
例えば、拮抗微生物を用いる場合には、全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生、抵抗性に関連する遺伝子の中から選択した遺伝子を指標として利用することができる。
【0034】
植物生育促進微生物を用いる場合には、全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生、抵抗性に関連する遺伝子の中から選択した遺伝子を指標として利用することができる。
【0035】
根粒菌を用いる場合には、根粒菌のNodファクターに応答する植物側遺伝子の中から選択した遺伝子を指標として利用することができる。
【0036】
菌根菌を用いる場合には、VA菌根菌のMYcファクターに応答する植物側遺伝子の中から選択した遺伝子を指標として利用することができる。
【0037】
拮抗微生物、特にトリコデルマ(Trichoderma)属糸状菌をイネの種子にコーティングした場合には、PR-1a、PR1b、Glutathione S-transferase、CytochromeP450、PR-10遺伝子を指標として使用することができる。
【0038】
植物生育促進微生物、特にトリコデルマ(Trichoderma)属糸状菌をイネの種子にコーティングした場合には、PR-1a、PR1b、Glutathione S-transferase、CytochromeP450、PR-10遺伝子を指標として使用することができる。
【0039】
拮抗微生物、特に蛍光性シュードモナス(Pseudomonas)属細菌をトマトの種子にコーティングした場合には、PR3、PR4、ACS2、PDF1,4遺伝子を指標として使用することができる。
【0040】
植物生育促進微生物、特に蛍光性シュードモナス(Pseudomonas)属細菌をトマトの種子にコーティングした場合には、PR3、PR4、ACS2、PDF1,4遺伝子を指標として使用することができる。
【実施例】
【0041】
以下に本発明の実施例を掲げて、さらに具体的に説明するが、本発明はこれらの実施例に制限されるものではない。
【0042】
実施例1.温度処理による活性低下微生物の作製方法、FDA染色による活性低下の確認方法
使用した微生物は、生物農薬製剤(エコホープ・クミアイ化学製)の成分微生物であるトリコデルマ アスペレラム(Trichoderma asperellum)SKT-1株を用いた。
【0043】
PDA上で25℃、7日間培養したSKT-1株より分生子を回収し、1.0×108cfu/mlに調整した後、遠心処理を2回行い、リン酸緩衝液(60mM NaH2PO4・2H2Oと60mM Na2HPO4・12H2O、pH 7.6)に再懸濁して得られた分生子懸濁液を用いた。この分生子懸濁液を25℃、40℃、60℃、100℃で30分間処理した。各種温度処理したSKT-1株の分生子懸濁液100μlに対してFDA(2mg/ml in acetone)を0.5μl加え5分間室温で静置して分生子を染色した。染色したSKT-1株分生子懸濁液の蛍光強度を時間分解蛍光光度計(DELFIA, パーキンエルマーライフサイエンス社製)で測定した。
【0044】
Fluorescein diacetate(FDA)染色法は、生きている細胞を蛍光染色する方法である。その原理は、無蛍光物質であるFDAが、生きている細胞内に取り込まれた後、プロテアーゼ、 リパーゼ、エステラーゼ等の酵素によって加水分解され、蛍光物質であるフルオレセインを生成することを利用する。この方法は周知である。
【0045】
実施例2.有効微生物コーティング種子(イネ)の作成方法
植物はイネ(品種:コシヒカリ、Oryza sativa L. cv. Koshihikari)を供試した。
SKT-1株の分生子懸濁液(5.0×107cfu/ml)10mlにイネ種子3gを浸漬し、デシケータ内で10分間減圧処理した。この減圧接種は、特開2007−77118号公報で開示された方法による接種に準じている。
【0046】
実施例3.温度処理による活性低下SKT-1株のイネばか苗病に対する防除効果検定
温度処理したSKT-1株分生子を実施例2の方法でばか苗病汚染イネ種子に微生物コーティングした。作成した各種ライブコート種子を25℃の制御温室内で3週間栽培し、徒長・枯死苗率を調査し、そこから防除価を算出した。25℃(室温)保存のSKT-1分生子を微生物コーティング処理した場合、高い防除価を示した(図1)。これを各種温度処理したSKT-1株分生子をイネ種子にライブコートし、ばか苗病に対する防除効果を調査した場合には、60℃、100℃といった高温処理したSKT-1株については、防除効果がほとんど失われていた(図1)。
【0047】
実施例4.FDA染色によるSKT-1株の活性評価結果
SKT-1株分生子のFDA染色による防除活性の評価法を検討した。図2A上図には、FDA染色したSKT-1株胞子懸濁液の明視野での顕微鏡写真を、図2A下図には、FDA染色した胞子懸濁液の蛍光視野における顕微鏡写真の例を示した。このように生きている細胞が蛍光染色されていることがわかる。
【0048】
SKT-1株の活性を低下させるために分生子を温度処理した。処理温度が高くなるにつれ胞子発芽率が低下した。温度処理したSKT-1株分生子をFDAで染色し、その蛍光強度を測定したところ、処理温度が高くなるにつれ蛍光強度が低下した(図2B)。
【0049】
以上のように、処理温度が高くなるにつれ、SKT-1株の分生子発芽率、ばか苗病に対する防除活性、FDA蛍光強度が低下した。これらの間に正の相関がみられたことから、温度処理はSKT-1株の防除活性を低下させる手法として有効であることが示唆された。また、SKT-1株の防除活性はFDA染色によって簡易かつ迅速に検出可能であった。なお、FDA蛍光の検出限界は1.0×107(cfu/ml)であった。
【0050】
実施例5.有効微生物コーティング種子(イネ)の発芽・育苗方法
滅菌蒸留水で湿らせた濾紙上にイネ種子を置床し、30℃の暗所で24時間催芽した。イネ育苗用培土(クリーン2号)に播種し、30℃で3日間出芽処理を行った後、25℃の制御温室内で栽培した。
【0051】
実施例6.イネ育苗苗からのRNA抽出方法・発現遺伝子レベルの確認方法
微生物コーティング種子を25℃で1週間生育させ、地上部よりGTC法でtotalRNAを抽出した。抽出したtotal RNA 1μgをReverTra Ace(TOYOBO, Osaka, Japan)で逆転写しcDNAを合成した。合成したcDNAを防御関連遺伝子のRT-PCR解析に用いた。PCR増幅産物を1.5%アガロースで電気泳動し、そのバンド強度で防御関連遺伝子の発現量を比較した。なお、対照には無処理ならびにサンプリングの3日前に50μMベンゾチアジアゾール(BTH)を10ml土壌潅注した。
【0052】
各種温度処理したSKT-1株分生子を微生物コーティングしたイネの防御関連遺伝子の発現を調査したところ、PR1a、PR1b、CytochromeP450、PR10では処理温度が高くなると発現量が低下した。BTH処理によって発現が誘導されると報告のあるWRKY45やNH1(OsNPR1)は微生物コーティング処理では発現量が顕著に増加しなかった。(図3)
【0053】
実施例7.半定量RT-PCRによる発現量の確認
発現遺伝子量を半定量PCRにより、発現量をゲルバンドの濃度で比較した(図4)。その結果、PR10 遺伝子の発現量は、ライブコート処理により約4倍に上昇した。その後、100℃、60℃、40℃で温度処理すると、25℃の温度条件(室温)に保存しているものと比較してPR10遺伝子の発現量は失活、低下することが明らかとなった(図4)。
【0054】
以上、遺伝子発現レベルとFDA蛍光やばか苗病に対する防除活性との相関をより正確に検証するために、処理温度によって発現量に変化がみられた防御関連遺伝子ついて発現量の半定量解析を行った。その結果、温度処理により防御関連遺伝子の内のPR10遺伝子の発現量が低下する事を確認した。同様の温度処理により微生物活性が低下する事、そのことはFDA染色により確認できること、同様の温度処理によりバカ苗病に対する防除活性が低下することは、先の実施例において示している。従って、半定量RT−PCR法の結果より、PR10遺伝子の発現量は、温度処理による微生物活性の低下と相関があることが示された。
【0055】
実施例8.共生菌(Pseudomonas fluorescens)感染シロイヌナズナを用いたマイクロアレイ解析方法と結果
有用微生物が共生した植物における遺伝子発現動向を網羅的に調査するためにモデル植物であるシロイヌナズナを用いたマイクロアレイ解析を行った。セル苗元気の有効微生物成分であるPseudomonas fluorescens FPT9601由来の菌系(T5)の培養液(109 cfu/ml)に播種後一週間のシロイヌナズナ幼植物の根を侵漬して感染させた。接種後3週間の計27個体のシロイヌナズナから抽出したトータルRNAをマイクロアレイ解析に供した。
【0056】
マイクロアレイ解析は、Affymetrix社のATH1アレイを用いて、同社のMAS version 5.0ソフトウエアを用いて解析した。また、マイクロアレイ解析のためのcDNA合成は、T7RNAポリメラーゼのプロモーター配列を持つオリゴdTプライマーによりインビトロジェン社のsuperscript choiceシステムにより行った。解析の結果、コントロールに比べて2倍以上の発現上昇が見られた遺伝子が95個、また発現量が半分以下になっていた遺伝子が105個、同定された。
【0057】
実施例9.シロイヌナズナのマイクロアレイ解析結果からトマトのゲノムデータベースを用いたホモロジー検索方法と結果
シロイヌナズナのマイクロアレイ解析結果から、発現上昇の度合いが大きかった遺伝子を上位から約30個選抜し、トマトゲノムデーターベースとのホモロジーサーチをBLASTプログラムにより行った。E-Valueが10-3以下であったものを該当シロイヌナズナ遺伝子のトマトホモログと想定した。複数の遺伝子に相同性が見られた場合には、E-Valueが最も低い物を選択した。これらのトマトホモログの塩基配列の3’領域にPrimer3プログラムを用いて特異的なプライマーを構築した。
【0058】
実施例10.有効微生物コーティング種子(トマト)の作成方法
Pseudomonas fluorescens FPH株、およびFPT株の培養液(多木化学提供)から、遠心分離により濃縮菌体を得た。菌体を1%ペプトン、1%グルタミン酸ソーダを含む溶液に懸濁した。トマト種子(品種:麗夏およびサポート)をビーカーに入れ、その2.5倍量(重量比)の上記菌体懸濁液を添加し、減圧乾燥を行った。種子に付着した菌濃度を希釈平板法で調査した。その結果、FPH株、FPT株は、共に104cfu/種子以上であった。
【0059】
実施例11.有効微生物コーティング種子(トマト)の発芽・育苗方法
播種用土:赤玉細粒土とスーパーセルトップVを容量比で1:4に混合。200穴トレーに充填。深さ5mmの播き穴を作り、一粒ずつ播種トマト穂木(品種:秀麗)および台木(品種:サポート)を播種した。人工気象器、昼(6時〜20時、温度28℃、湿度60%、約1万ルクス蛍光灯照明)、夜(20時〜6時、温度25℃、湿度85%)で育苗した。
【0060】
実施例12.接木苗の作成方法
実施例11に記載の方法で播種・育苗した播種後13日目の苗(穂木および台木)をそれぞれ斜め45°以上の角度に切断し、接木クリップを用いて接いだ。湿度100%の高湿度ハウス内で7日間養生し、その後2日間室内に出して馴化させた。その後、ガラス室に移し、9cmポットに移植し、2週間〜4週間育苗した。
【0061】
実施例13.トマト幼植物体からのRNA抽出方法
微生物コーティング・トマト種子を播種し、5日〜3週間の幼植物からのトータルRNAの抽出を行った。RNA抽出はQiagen社のRNeasy Plant Mini Kitキットの付属試薬を用いて、プロトコールに従い行った。得られたトータルRNAは、MOPSバッファーを用いたホルムアミド変性アガロースゲル電気泳動により、rRNAバンドを検出することで品質を確認した。
【0062】
トータルRNAは、RNaseフリーDNase(インビトロジェン社)処理後、cDNA合成のテンプレートとして用いた。cDNA合成は、PrimeScript RT reagent Kit(タカラバイオ)の付属試薬を用いて、オリゴdTをプライマーとしてプロトコールに従い行った。
【0063】
実施例14.発現遺伝子レベルの確認方法と結果
選抜された約30個の遺伝子発現レベルは、半定量的RT-PCR法により一次スクリーニングを行い、その結果、最も有望であったPathogenesis-Related 4 (PR) 遺伝子について、リアルタイムPCRを用いた定量PCR解析に供した。リアルタイムPCRは、Takara TP800(タカラバイオ)を用いて、SYBR Premix Ex Taq II (タカラバイオ)もしくはTHUNDERBIRD SYBR qPCR Mix (TOYOBO)によるSYBR green法によって行った。使用したプライマー配列は(PR4-L:配列番号1; PR4-R:配列番号2)である。その結果、Pseudomonas剤が微生物コーティングされたトマト種子(品種サポート)を播種後一週間の幼植物において、平均4.3倍のPR4の発現上昇が認められた(図5)。
【0064】
実施例15.防御関連遺伝子の発現レベル調査
PR4は、シロイヌナズナやタバコ等の植物において、エチレン・ジャスモン酸系のシグナルにより発現が誘導されることが知られている。そこで他の植物で同シグナル系に属することが知られている遺伝子群の動向を微生物コーティング・トマト植物において調査した所、PR3, PDF1.4, 1-aminocyclopropane-1-carboxylate synthase2 (ACS2)などにおいて、品種や播種後の時間により差異はあるものの有意な発現上昇が認められた(図6)。尚、これらの遺伝子に対するプライマー配列はそれぞれ以下の通りである。PR3 (PR3-L:配列番号3; PR3-R:配列番号4), PDF1.4 (PDF1.4-L: 配列番号5; PDF1.4-R: 配列番号6), ACS2 (ACS2-L: 配列番号7; ACS2-R: 配列番号8)。
【0065】
図6において、台木品種サポートにおいては、PR3、PR4、ACS2遺伝子の発現レベルの上昇が確認された。一方の穂木品種・麗夏においては、PDF1,4 遺伝子の発現上昇が確認されたが、PR3、PR4、ACS2遺伝子の発現レベルは上昇していなかった。この様に、台木品種と穂木品種ではその遺伝子発現の時期・量の変化が異なることが示された。このことが、青枯病などの病気に対する抵抗性・感受性の違いとなっていることが考えられた。
【0066】
実施例16.発現遺伝子レベルの経時的変化
図7に発現遺伝子レベルの経時的変化を示した(図の太い横線は、無処理の遺伝子発現レベルを示す)。
【0067】
その結果、台木品種・サポートでは、PR3遺伝子とACS2遺伝子は、7日目に、PR4遺伝子の発現は、7日目と2週間目に、PDF1,4遺伝子発現は、3週目に発現上昇が認められた。穂木品種・マイロックでは、PR3遺伝子発現は、2週間目に、PR4遺伝子発現は、10日目をピークに2週間目、3週間目まで発現上昇が認められた。PDF1,4遺伝子は、7日目、10日目、3週間目に発現上昇が起こった。ACS2遺伝子発現レベルは、10日目に発現上昇が認められた。
【0068】
図6と図7で共通する播種後7日目のデータを比較すると、青枯病に耐病性を持つ台木(サポート)では、PR3、PR4、ACS2遺伝子の発現レベルが上昇した。青枯病に対して感受性の穂木品種(麗夏またはマイロック)の場合には、PDF1,4の遺伝子の発現レベルが上昇していた。
【0069】
この様に、台木品種と穂木品種ではその遺伝子発現の時期・量の変化が異なることが示された。このことが、青枯病などの病気に対する抵抗性・感受性の違いとなっていることが考えられた。
【0070】
これらの実験結果を総合すると、播種7日目において、台木品種の場合には、PR3、PR4、ACS2遺伝子を、穂木品種の場合には、PDF1,4の遺伝子をマーカーとして用いることで、幼植物において有効微生物が機能していることを早期に判定できると考えられた。
【0071】
実施例17.接木苗における遺伝子発現
穂木品種は、秀麗を、台木品種にはサポートを用いた。実施例10に準じる方法で有効微生物コーティング種子を作成し、実施例11の方法で播種・育苗し、実施例12の方法で接木苗を作成した。9cmポット移植後2週間目〜3週間目の接木苗を用いて遺伝子発現を調べた(播種から13+7+2+(14〜28)=36〜50日目)。台木部・穂木部のどちらにおいても、台木種子に微生物コーティング処理した場合に、幾つかの遺伝子が有意に上昇している傾向があった(図8)。
【0072】
具体的には、微生物を台木種子に処理した接木苗の場合には、穂木部のPR3とACS2遺伝子発現上昇が起こり、台木部のPR4、PDF1,4、ACS2遺伝子の発現上昇が起こっていることが示された。
【0073】
微生物を穂木種子に処理した場合には、穂木部では確認が難しいものの、台木部においてPDF1,4、ACS2遺伝子の発現上昇が起こっていることが示された。
【0074】
以上、温度処理により微生物活性を低下させた。活性の低下はFDA染色により確認することができた。イネ・バカ苗病汚染モミに対する微生物コーティング処理の効果は、微生物活性の低下と防除効果の間で正の相関があった。イネ・微生物コーティング種子において複数の防御関連遺伝子の発現レベルが上昇することが明らかとなった(PR-1a、PR1b、GlutathioneS-transferase、CytochromeP450、PR-10 など)。温度処理するとこれらの遺伝子発現レベルは低下することが明らかとなった。この中でもPR10遺伝子発現は、半定量RT-PCR法により、熱処理による失活と高い相関のあることが確認された。
【0075】
シロイヌナズナを用い、微生物処理によって発現遺伝子が上昇する遺伝子をマイクロアレイ解析で調査し、発現上昇の明確な遺伝子を選抜した。トマトの全遺伝情報とホモロジー検索を行いその結果に基づいて有望な30個の遺伝子についてプライマーを作成し、トマトの発現遺伝子レベルを一次スクリーニングした。その結果、最も有望な遺伝子としてPR4遺伝子が選抜できた。さらに複数の防御関連遺伝子の発現レベルを調査した。その結果は以下のように整理できた。
【0076】
(1)台木品種: PR3、PR4、ACS2遺伝子。
(2)穂木品種: PDF1,4の遺伝子。
(3)接木苗・台木種子処理:(播種後30〜50日の苗)台木部のPR4、PDF1,4、ACS2遺伝子または穂木部のPR3とACS2遺伝子。
(4)接木苗・穂木種子処理:(播種後30〜60日の苗)台木部のPDF1,4、ACS2遺伝子。
【0077】
この中でも特に注目すべきは、接木苗(播種後30〜60日の苗)・台木部における遺伝子発現レベルが30〜50倍もの著しい上昇を示した事例が得られたことにある。通常、これほど著しい発現上昇が起こることは非常に珍しい。そして、30〜50倍もの発現上昇であれば、厳密な定量PCRなどの特別高価な装置を用いなくとも、素人がみても容易に判別することが可能であり、品質管理においても簡単な方法で確認できる技術となる。
【0078】
これらの結果から、微生物コーティング種子において、植物応答を指標とした新しい微生物の活性評価方法が確立できた。
【配列表フリーテキスト】
【0079】
配列番号1:プライマー
配列番号2:プライマー
配列番号3:プライマー
配列番号4:プライマー
配列番号5:プライマー
配列番号6:プライマー
配列番号7:プライマー
配列番号8:プライマー
【特許請求の範囲】
【請求項1】
有効微生物コーティング種子における有効微生物の活性を評価する方法であって、
有効微生物コーティング種子から幼植物を得る第一工程、
前記幼植物における遺伝子の発現量を測定する第二工程、および
前記発現量を指標として、有効微生物コーティング種子における有効微生物の活性を評価する第三工程、
を含む方法。
【請求項2】
前記遺伝子がマイクロアレイ解析により特異的に発現量が上昇または減少する遺伝子である、請求項1の方法。
【請求項3】
前記遺伝子が全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生および抵抗性に関連する遺伝子、ならびに根粒菌のNodファクターおよびVA菌根菌のMYcファクターに応答する植物側遺伝子から選択される少なくとも1種の遺伝子である、請求項1または2の方法。
【請求項4】
前記有効微生物が、拮抗微生物、植物生育促進微生物、根粒菌または菌根菌である、請求項1〜3のいずれかの方法。
【請求項5】
前記種子がイネまたはトマトの種子である、請求項1〜4のいずれかの方法。
【請求項6】
前記微生物が拮抗微生物または植物生育促進微生物であり、
前記種子がイネの種子であり、
前記遺伝子がPR-1a、PR1b、Glutathione S-transferase、CytochromeP450およびPR-10遺伝子から選択される少なくとも1種の遺伝子である、
請求項1の方法。
【請求項7】
前記微生物が拮抗微生物または植物生育促進微生物であり、
前記種子がトマトの種子であり、
前記遺伝子がPR3、PR4、ACS2およびPDF1,4遺伝子から選択される少なくとも1種の遺伝子である、
請求項1の方法。
【請求項1】
有効微生物コーティング種子における有効微生物の活性を評価する方法であって、
有効微生物コーティング種子から幼植物を得る第一工程、
前記幼植物における遺伝子の発現量を測定する第二工程、および
前記発現量を指標として、有効微生物コーティング種子における有効微生物の活性を評価する第三工程、
を含む方法。
【請求項2】
前記遺伝子がマイクロアレイ解析により特異的に発現量が上昇または減少する遺伝子である、請求項1の方法。
【請求項3】
前記遺伝子が全身獲得抵抗性誘導、過敏感反応、防御機構、ファイトアレキシン、活性酸素分子産生および抵抗性に関連する遺伝子、ならびに根粒菌のNodファクターおよびVA菌根菌のMYcファクターに応答する植物側遺伝子から選択される少なくとも1種の遺伝子である、請求項1または2の方法。
【請求項4】
前記有効微生物が、拮抗微生物、植物生育促進微生物、根粒菌または菌根菌である、請求項1〜3のいずれかの方法。
【請求項5】
前記種子がイネまたはトマトの種子である、請求項1〜4のいずれかの方法。
【請求項6】
前記微生物が拮抗微生物または植物生育促進微生物であり、
前記種子がイネの種子であり、
前記遺伝子がPR-1a、PR1b、Glutathione S-transferase、CytochromeP450およびPR-10遺伝子から選択される少なくとも1種の遺伝子である、
請求項1の方法。
【請求項7】
前記微生物が拮抗微生物または植物生育促進微生物であり、
前記種子がトマトの種子であり、
前記遺伝子がPR3、PR4、ACS2およびPDF1,4遺伝子から選択される少なくとも1種の遺伝子である、
請求項1の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2011−200149(P2011−200149A)
【公開日】平成23年10月13日(2011.10.13)
【国際特許分類】
【出願番号】特願2010−69461(P2010−69461)
【出願日】平成22年3月25日(2010.3.25)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 刊行物名 :平成21年度 日本植物病理学会関西部会講演要旨予稿集 発行日 :平成21年9月30日 発行者 :日本植物病理学会 会長 白石 友紀 講演番号 :210
【出願人】(591042403)株式会社サカタのタネ (10)
【出願人】(304019399)国立大学法人岐阜大学 (289)
【出願人】(592216384)兵庫県 (258)
【Fターム(参考)】
【公開日】平成23年10月13日(2011.10.13)
【国際特許分類】
【出願日】平成22年3月25日(2010.3.25)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 刊行物名 :平成21年度 日本植物病理学会関西部会講演要旨予稿集 発行日 :平成21年9月30日 発行者 :日本植物病理学会 会長 白石 友紀 講演番号 :210
【出願人】(591042403)株式会社サカタのタネ (10)
【出願人】(304019399)国立大学法人岐阜大学 (289)
【出願人】(592216384)兵庫県 (258)
【Fターム(参考)】
[ Back to top ]

