有効成分候補物質のスクリーニング方法
【課題】関節リウマチに対する処置剤の有効成分の候補となる物質を、簡便、迅速、効率的かつ高精度にスクリーニングする方法を提供すること。
【解決手段】次のステップを少なくとも含むことを特徴とする、関節リウマチに対する処置剤の有効成分の候補となる物質のスクリーニング方法;「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」の活性を阻害する作用を有する物質を選択するステップ。このステップの前に、さらに次のステップを含むことが好ましい;「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」を選択するステップ。またこのステップは、遺伝子サブトラクション法によって行われることが好ましい。
【解決手段】次のステップを少なくとも含むことを特徴とする、関節リウマチに対する処置剤の有効成分の候補となる物質のスクリーニング方法;「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」の活性を阻害する作用を有する物質を選択するステップ。このステップの前に、さらに次のステップを含むことが好ましい;「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」を選択するステップ。またこのステップは、遺伝子サブトラクション法によって行われることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、関節リウマチに対する処置剤の有効成分の候補となる物質の新規なスクリーニング方法に関する。
【背景技術】
【0002】
まず、本出願書類において用いた略号について説明する。
CIA:コラーゲン誘発関節炎(collagen-induced arthritis)
G3PDH:グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(glyceraldehyde 3-phosphate dehydrogenase)
HCK:造血細胞キナーゼ(Hemopoietic cell kinase)
MET:肝細胞増殖因子受容体(hepatocyte growth factor receptor、HGF receptor、c-MET)
OA:変形性関節症(osteoarthritis)
PCR:ポリメラーゼ連鎖反応(Polymerase Chain Reaction)
PHA−665752:(3Z)−5−[(2,6−ジクロロベンジル)スルフォニル]−3−[(3,5−ジメチル−4−{[(2R)−2−(ピロリジン−1−イルメチル)ピロリジン−1−イル]カルボニル}−1H−ピロル−2−イル)メチレン]−1,3−ジヒドロ−2H−インドール−2−オン((3Z)-5-[(2,6-dichlorobenzyl)sulfonyl]-3-[(3,5-dimethyl-4-{[(2R)-2-(pyrrolidin-1-ylmethyl)pyrrolidin-1-yl]carbonyl}-1H-pyrrol-2-yl)methylene]-1,3-dihydro-2H-indol-2-one)
PK:タンパク質キナーゼ(protein kinase)
RA:関節リウマチ(rheumatoid arthritis)
RON:マクロファージ刺激タンパク質受容体(macrophage stimulating protein receptor、Msp receptor)
SDS:ドデシル硫酸ナトリウム(sodium dodecyl sulfate)
また本出願書類においてヌクレオチド配列(塩基配列)を示す場合には、以下の略号を用いる。
A(又はa):アデニン
G(又はg):グアニン
C(又はc):シトシン
T(又はt):チミン
U(又はu):ウラシル
R(又はr):グアニン又はアデニン
Y(又はy):チミン又はシトシン
M(又はm):アデニン又はシトシン
S(又はs):グアニン又はシトシン
W(又はw):アデニン又はチミン
N(又はn):アデニン又はグアニン又はシトシン又はチミン
RAは結合組織に炎症をきたす全身的な疾患であり、主に関節の滑膜に非特異的炎症を起こし、全身の多発性関節炎の病像を呈する疾患である。RAに対する治療剤等やそのスクリーニング方法に関する先行技術も存在するが(特許文献1及び特許文献2参照)、RAは複雑な疾患であり、かつその処置も抗炎症剤等による対症療法的なものに止まっているのが実情である。
【0003】
【特許文献1】特開2002−187856号公報
【特許文献2】特開2003−183177号公報 そこで、RAに対する処置剤の有効成分の候補物質を種々の観点からなるべく多く見い出し、それをRAの処置剤に応用していく必要がある。
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、RAに対する処置剤の有効成分の候補となる物質を、簡便、迅速、効率的かつ高精度にスクリーニングする方法を提供することを課題とする。
【課題を解決するための手段】
【0005】
本発明者らは上記課題を解決するため鋭意検討した結果、「RAに罹患している動物の細胞において発現が変化しているPK」の活性を調節する作用を有する物質を選択しすることによって、RAの処置剤の有効成分物質を、簡便、迅速、効率的かつ高精度にスクリーニングできることを見い出し、本発明を完成した。
すなわち本発明は、以下のステップを少なくとも含むことを特徴とする、RAに対する処置剤の有効成分の候補となる物質のスクリーニング方法(以下、「本発明方法」という。)を提供する;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質を選択するステップ。
【0006】
本発明方法は、前記のステップの前に、さらに以下のステップを含むことが好ましい;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」を選択するステップ。このステップは、遺伝子サブトラクション法によって行われることが好ましい。またこの「遺伝子サブトラクション法」は、「『遺伝子サブトラクションのターゲットとするPK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」が結合している遺伝子サブトラクション用の担体を用いて行われることが好ましい。
また、前記のPKは、チロシンキナーゼ及びセリン/スレオニンキナーゼからなる群から選ばれる1又は2以上のPKであることが好ましい。
また、前記における「変化」の態様が「増加」であり、かつ、「調節」の態様が「阻害」であることが好ましい。この場合、「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が増加しているPK」は、HCK、MET及びRONからなる群から選ばれる1又は2以上のPKであることが好ましい。
【発明の効果】
【0007】
本発明によれば、RAに対する処置剤の有効成分の候補となる物質を、簡便、迅速、効率的かつ高精度にスクリーニングする方法が提供されることから、極めて有用である。
【発明を実施するための最良の形態】
【0008】
以下、本発明を発明の実施の形態により詳説する。
【0009】
本発明方法は、以下のステップを少なくとも含むことを特徴とする、RAに対する処置剤の有効成分の候補となる物質のスクリーニング方法である;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質を選択するステップ。
【0010】
本出願書類における「RAに対する処置剤」の用語は、RAに対する何らかの処置のために用いられる剤である限りにおいて特に限定されない。例えば、RAの予防、維持(悪化防止)、軽減(症状改善)、治療等の処置のために用いられる剤は、いずれも本出願書類における「RAに対する処置剤」の用語に包含される。
【0011】
また「RAに対する処置剤の有効成分の候補となる物質」とは、RAに対する処置剤の有効成分として利用できる可能性がある物質を意味する。したがって、この物質がRAに対する処置剤の有効成分として実際に利用できるものであるか否かは問わない。例えばこの物質について、仮にその後に行われる動物試験や臨床試験等によってRAに対する効果が否定されたとしても、本発明方法を実施した時点においてRA処置剤の有効成分として利用できる「可能性」があった限りにおいて、「RAに対する処置剤の有効成分の候補となる物質」に包含される。
【0012】
本発明方法は、以下のステップを少なくとも含むことを特徴としている;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質を選択するステップ。
【0013】
ここにいう「RA」は、医学上の厳密な定義におけるRAのみならず、RAと同様又は類似の疾患症状を呈するものをも含む趣旨である。
【0014】
またここにいう「RAに罹患」とは、自然発症的にRAに罹患した場合のみならず、人為的にRAに罹患させた場合をも含む。例えば、人為的に作製されたRAのモデル動物は、「RAに罹患している動物」に含まれる。
【0015】
また、ここにいう「動物」は、RAに罹患する可能性がある動物である限りにおいて特に限定されない。このような動物としては哺乳動物が例示され、そのなかでもヒト、サル、イヌ、ネコ、ウマ、マウス、ラット等が例示される。どの動物を選択するかは、スクリーニングの目的や、RA処置剤の適用対象とする動物等に応じて適宜設定することができる。なかでもヒトが好ましい。
【0016】
また、ここにいう「細胞」は、RAによって何らかの影響を受けうる組織の細胞である限りにおいて特に限定されない。RAでは、関節の滑膜に炎症が起き、痛みと変形が引き起こされることから、この「細胞」としては、例えば、関節の滑膜の細胞を例示することができる。
また、ここにいう「RAに罹患していない動物の細胞」は、「RAに罹患している動物の細胞」が由来する動物と同種の動物に由来する、同じ組織の細胞であることが好ましい。すなわち、例えば「RAに罹患している動物の細胞」がRAモデルマウスの関節滑膜細胞である場合には、「RAに罹患していない動物の細胞」としては、RAに罹患していないマウスの関節滑膜細胞を選択することが好ましい。同様に、例えば「RAに罹患している動物の細胞」がヒトRA患者の関節滑膜細胞である場合には、「RAに罹患していない動物の細胞」としては、RAに罹患していないヒトの関節滑膜細胞を選択することが好ましい。
また、「RAに罹患していない」とは、RAに罹患していない限りにおいて特に限定されず、健常なもの(何らの疾患にも罹患していないもの)はもちろん、RA以外の疾患には罹患しているがRAには罹患していないものをも含む趣旨である。したがって、例えば、OAにのみ罹患している動物は、「RAに罹患していない動物」であるといえる。
【0017】
また、ここにいう「発現」とは、核酸(mRNA等)の発現であっても、タンパク質レベルの発現であってもよく、目的等に応じて適宜選択することができる。例えば、後述する遺伝子サブトラクション法によってPKの発現を明らかにする場合には、核酸(mRNA等)の発現に注目すればよい。
【0018】
また「発現が変化」とは、RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比してPKの発現レベルが増加又は減少していることを意味する。例えば、前者の細胞において、後者の細胞に比してPKの発現の量が増加又は減少しているような場合である。前者の細胞におけるPKの発現レベルが後者の細胞に比して増加している(高い)又は減少している(低い)限りにおいて、両者間の発現レベルの差の程度は問わない。両者間の発現レベルの差が小さいものであれば、それだけ多くの候補物質が選択されうる反面、RAに対する処置剤の有効成分として効果を発揮しないものも多く選択されうる。逆に、両者間の発現レベルの差が大きいものであれば、選択される候補物質が少なくなる反面、RAに対する処置剤の有効成分として効果を発揮するものが選択される可能性が高くなる。したがって、どのような程度の発現レベルの差をもって「発現が変化している」と判断するかは、スクリーニングの目的等に応じて当業者が適宜設定すればよい。
また、PKは、チロシンキナーゼ及びセリン/スレオニンキナーゼからなる群から選ばれる1又は2以上のPKであることが好ましい。
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質の選択は、当該「変化」が「増加」である場合には当該PKの酵素活性に対して阻害作用を発揮する物質を、当該「変化」が「減少」である場合には生体に投与することによって当該PKの活性を補いうる物質(例えば、当該PK分子自体、当該PK分子をコードするcDNAなど)を選択することにより行うことができる。この選択は、前者の場合には、当該PKとある物質とを接触させ、この物質が当該PKの酵素活性を消失又は低下させるか否かを判定し、当該PKの酵素活性を消失又は低下させた物質を選択することにより行うことができる。また後者の場合には、当該PK分子自体や当該PK分子をコードするcDNAなどをそのまま選択すれば良い。
ここで、前者の場合において、PKの酵素活性をどの程度低下させた場合に「PKの活性を阻害する作用を有する」と判定するかは、スクリーニングの目的等に応じて当業者が適宜設定すればよい。PKの酵素活性をわずかに低下させたものをも「PKの活性を阻害する作用を有する」として判定する場合には、それだけ多くの候補物質が選択されうる反面、RAに対する処置剤の有効成分として効果を発揮しないものも多く選択されうる。逆に、PKの酵素活性を相当程度低下(又は消失)させたもののみを「PKの活性を阻害する作用を有する」として判定する場合には、選択される候補物質が少なくなる反面、RAに対する処置剤の有効成分として効果を発揮するものが選択される可能性が高くなる。
この「PKの活性を阻害する作用を有する物質」の選択の手法も特に限定されず、例えばハイスループット・スクリーニングのような手法を用いることもできる。
後述の実施例にも示す通り、本発明者らは、「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が増加しているPK」として、HCK、MET及びRONを同定することに成功した。したがって本発明方法は、HCK、MET及びRONからなる群から選ばれる1又は2以上のPKの活性を阻害する作用を有する物質を選択するステップを少なくとも含むものが好ましい。
【0019】
なお本発明方法は、「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質を選択するステップを少なくとも含む限りにおいて、他のステップをさらに含んでいてもよい。例えば、このステップと並行して他のスクリーニング方法を実施するステップをさらに含んでいてもよい。またこのステップの後に、選択された物質を他のスクリーニング方法に付するステップをさらに含んでいてもよい。またこのステップの前に、以下のステップをさらに含んでいてもよい;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」を選択するステップ。
【0020】
「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が変化しているPK」は、種々の方法によって選択することができる。例えば、両者の細胞からタンパク質を抽出し、「RAに罹患している動物の細胞」において「RAに罹患していない動物の細胞」よりもタンパク質量が多い又は少ないPKを同定することにより選択してもよい。また、PK遺伝子ファミリーについて、両者の細胞を用いた遺伝子サブトラクション法を行うことにより、RAに罹患している動物の細胞において発現が変化している「PKをコードする核酸(mRNA等)」を同定することにより選択してもよい。
【0021】
このステップは、なかでも遺伝子サブトラクション法によって行われることが好ましい。
【0022】
遺伝子サブトラクション法(差し引きハイブリッド法)は、異なる2種類の細胞や組織間において発現レベルの差がある目的遺伝子を、ハイブリダイゼーションによって差し引きすることにより単離する方法である。例えば、ある目的遺伝子のmRNAが細胞Aに較べ細胞Bにおいてより高レベルに発現している場合、細胞A及びBに由来するmRNA/cDNA/cRNA等の間でハイブリッドを形成させ、そのハイブリッド形成したもの以外のものを除去することで、細胞Bにおいて高レベルに発現している遺伝子を単離することができる。本出願書類では、この場合におけるハイブリッドを形成させる細胞A由来の核酸(対照試料)を「ドライバー」と、細胞B由来の核酸(目的試料)を「テスター」という。
【0023】
「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が増加しているPK」を、遺伝子サブトラクション法によって選択する場合には、RAに罹患していない動物細胞由来の核酸(PKに関するもの)を「ドライバー」とし、RAに罹患している動物細胞由来の核酸(PKに関するもの)を「テスター」として用いればよい。また、「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が減少しているPK」を、遺伝子サブトラクション法によって選択する場合には、RAに罹患していない動物細胞由来の核酸(PKに関するもの)を「テスター」とし、RAに罹患している動物細胞由来の核酸(PKに関するもの)を「ドライバー」として用いればよい。遺伝子サブトラクションの方法は、通常の方法を採用することができる。
例えば、「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が増加しているPK」を遺伝子サブトラクション法によって選択する場合には、「ドライバー」としては、「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」であってRAに罹患していない動物の細胞において発現しているものを、「テスター」としては、「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」であってRAに罹患している動物の細胞において発現しているものをそれぞれ採用することが好ましい。
以下、遺伝子サブトラクション法に関する具体的説明をする場合には、「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が増加しているPK」を選択する場合について説明することとする。「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が減少しているPK」を選択する場合には、テスターとドライバーとを入れ替えて用いればよいことは前記の通りである。
【0024】
なお、ここで、「PK遺伝子ファミリー」は、チロシンキナーゼファミリー及びセリン/スレオニンキナーゼファミリーであることが好ましい。また、この「チロシンキナーゼファミリー及びセリン/スレオニンキナーゼファミリー」は、HCK、MET及びRONからなる群であることが好ましい。
また、PK遺伝子ファミリーに「共通なヌクレオチド配列」とは、当該ファミリーに共通して存在するヌクレオチド配列である限りにおいて特に限定されない。ここで「共通して存在する」とは、必ずしも当該遺伝子ファミリーに属する全ての遺伝子において存在している必要はなく、当該遺伝子ファミリーに属する多くの遺伝子において存在するものであれば良い。また、「共通なヌクレオチド配列」自体も、必ずしもその遺伝子間において完全に一致している必要はなく、若干のヌクレオチドの差異があってもよい。
PK遺伝子ファミリーにおいて、具体的にどのようなヌクレオチド配列を「共通なヌクレオチド配列」とするかについては、サブトラクションの目的・精度等に応じて当業者が適宜決定することができる。例えば、PK遺伝子ファミリーに関してある程度幅広く遺伝子サブトラクションを行いたいのであれば、「PK遺伝子ファミリーに共通なヌクレオチド配列」として、当該遺伝子ファミリーに属する全ての遺伝子において存在するヌクレオチド配列ではなく、当該遺伝子ファミリーに属する多くの遺伝子において存在するヌクレオチド配列を用いればよい。逆に、PK遺伝子ファミリーに関して、当該遺伝子ファミリーに属する全ての遺伝子において存在する特定のヌクレオチド配列に厳密に着目して遺伝子サブトラクションを行いたいのであれば、「PK遺伝子ファミリーに共通なヌクレオチド配列」として、当該遺伝子ファミリーに属する全ての遺伝子において存在する当該特定のヌクレオチド配列を用いればよい。
PK遺伝子ファミリーに共通なヌクレオチド配列としては、配列番号1及び/又は配列番号2で示されるヌクレオチド配列を採用することが好ましい。
GTGCACMGNGAYYT (配列番号1)
GAYGTSTGGTCCTWTGG (配列番号2)
(配列番号中におけるTはUであってもよい。また、Y、W及びNにおけるTも、Uであってもよい。)
そのなかでも、PK遺伝子ファミリーに共通なヌクレオチド配列として、配列番号1と配列番号2の両方のヌクレオチド配列を採用することが好ましい。
また、「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列」とは、以上に説明した「PK遺伝子ファミリーに共通なヌクレオチド配列」に対して、アニーリングする性質を有するヌクレオチド配列である限りにおいて特に限定されない。ここで「アニーリング」の条件は、相補的にハイブリッドを形成すべき核酸鎖間の水素結合が切断されている温度条件から温度を下げていったときに、当該核酸鎖間で水素結合が再構成され、両者が再結合するような条件である限りにおいて特に限定されない。具体的には、PCRにおける冷却のステップにおいて、前記核酸鎖間で再結合が形成されるような条件が挙げられる。より具体的には、ExTaq ポリメラーゼ(TaKaRa社:RR001A)に付属のバッファーを用いて、48℃(〜70℃)、1分間で前記核酸鎖間の再結合が形成されるものであることが好ましい。
「PK遺伝子ファミリーに共通なヌクレオチド配列」にアニーリングするヌクレオチド配列としては、配列番号1及び/又は配列番号3で示されるヌクレオチド配列を採用することが好ましい。
GTGCACMGNGAYYT (配列番号1)
CCAWAGGACCASACRTC (配列番号3)
(配列番号中におけるTはUであってもよい。また、Y、W及びNにおけるTも、Uであってもよい。)
そのなかでも、配列番号1と配列番号3の両方のヌクレオチド配列を採用することが好ましい。
また「PK遺伝子ファミリーに共通なヌクレオチド配列」にアニーリングするヌクレオチド配列としては、配列番号1及び/又は配列番号4で示されるヌクレオチド配列を採用することも好ましい。
GTGCACMGNGAYYT (配列番号1)
GCGAATTCCAWAGGACCASACRTC (配列番号4)
(配列番号中におけるTはUであってもよい。また、Y、W及びNにおけるTも、Uであってもよい。)
そのなかでも、配列番号1と配列番号4の両方のヌクレオチド配列を採用することが好ましい。
【0025】
このような、「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列」からなる核酸をもとに、当該配列を保持する核酸を製造することができる。なお本出願書類において、あるヌクレオチド配列を「保持する」核酸とは、当該ヌクレオチド配列からなる核酸のみならず、当該ヌクレオチド配列を一部分に含んでいる核酸をも含む趣旨である。
ドライバーとすべきこのような核酸は、前記の「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列」からなる核酸をプライマーとし、RAに罹患していない動物の細胞に存在する核酸(mRNA等)を鋳型としたPCRによって製造し、増幅することができる。例えば、配列番号1及び/又は配列番号3で示される核酸をプライマーとし、OA患者の関節滑膜から抽出された核酸を鋳型としたPCRによって、ドライバーとすべき核酸を製造・増幅することができる。配列番号3に代えて、配列番号4で示される核酸を用いてもよい。
GTGCACMGNGAYYT (配列番号1)
CCAWAGGACCASACRTC (配列番号3)
GCGAATTCCAWAGGACCASACRTC (配列番号4)
(配列番号中におけるTはUであってもよい。また、Y、W及びNにおけるTも、Uであってもよい。)
このような「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」は、動物種や、用いる細胞や組織等に応じて異なることとなるが、これらに応じて当業者が適宜設定・製造等することができる。
【0026】
また、この遺伝子サブトラクション法は、このような「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」が結合している遺伝子サブトラクション用の担体を用いて行われることが好ましい。
【0027】
この「担体」は、核酸を結合させることができ、かつ、水や反応液等に不溶である限りにおいて特に限定されない。その形状も特に限定されず、ビーズ、プレート(例えばマイクロプレートのウェル等)、チューブ、メンブレン、ゲル等を例示することができる。なかでもビーズの形状が好ましい。
また担体の材質も特に限定されず、磁性体、ポリスチレン、ポリプロピレン、ポリ塩化ビニル、ニトロセルロース、ナイロン、ポリアクリルアミド、ポリアロマー、ポリエチレン、ガラス、アガロース等の材質が例示される。
【0028】
これらのなかでも、磁性体のビーズであることが、ハイブリダイゼーション後のドライバーの除去を簡便、迅速かつ確実に行いうることから好ましい。すなわち、担体として磁性体ビーズを用いれば、ハイブリダイゼーション後に、磁石によって当該ビーズ(これに結合している核酸及びこれにハイブリダイズした核酸)を簡便、迅速かつ確実に除去することができる。
【0029】
また、前記の核酸と担体との間の結合様式も、水や反応液等の中において両者が解離しない強度以上の強度を有するものである限りにおいて特に限定されない。また、核酸と担体とが直接結合しているものはもちろん、両者が別の物質を介して結合していてもよい。
両者間の結合としては、例えば、2個の原子がいくつかの電子を共有してつくる共有結合や、2個の分子間における親和性により形成されるアフィニティー結合等を例示することができる。アフィニティー結合としては、ビオチン−アビジン結合(ビオチンとアビジンとの間の結合)等を例示することができる。なお、本出願書類における「アビジン」の用語には、ストレプトアビジンも当然に包含される。
【0030】
両者間の結合様式としてビオチン−アビジン結合を採用する場合には、例えば、担体に結合させるべき核酸に公知の方法でビオチンを結合させ、担体(例えば、磁性体ビーズ)にはアビジンを結合させて、両者を接触させてアフィニティー結合させることにより、核酸と担体とがビオチン−アビジン結合によって結合した担体とすることができる。また、アビジン等が結合している担体(例えば、磁性体ビーズ)等も市販されており、これらを用いることもできる。
【0031】
なお、核酸と担体との結合は、遺伝子サブトラクションの過程で形成させてもよい。例えば、ドライバーとテスターとをハイブリダイズさせた後に、当該ドライバーを担体に結合させる態様であってもよい。例えば、予めドライバーにビオチンを結合させておき、これとテスターとをハイブリダイズさせた後に、ドライバーに結合しているビオチンを担体に結合しているアビジンに結合させてもよい。
【0032】
なお、以上に示したヌクレオチド配列や核酸は、DNAであっても、RNAであってもよく、遺伝子サブトラクションの目的や方法等によって当業者が適宜選択することができる。例えば、ヌクレオチド配列や核酸としてRNAを採用する場合にはチミン(T)をウラシル(U)に変更すればよく、またmRNAを用いる場合には、DNAからの転写を考慮してそのヌクレオチド配列をデザインすればよい。
【0033】
遺伝子サブトラクションの方法は、通常の方法を採用することができる。具体的には、「RAに罹患していない動物細胞由来の前記核酸(ドライバー)」と「RAに罹患している動物細胞由来の前記核酸を含有する核酸画分(テスター)」とを接触させてハイブリダイゼーション反応させ、その後、両者がハイブリダイズした核酸を除去するステップを含むことが好ましい。
【0034】
ハイブリダイゼーション反応の条件は、非特異的なハイブリダイゼーションが生じない程度のストリンジェントな条件で行われることが好ましい。このような条件としては、終濃度として0.5〜10xSSC(好ましくは1〜5xSSC、より好ましくは3xSSC)、0.5〜5xDenhardt溶液(好ましくは1〜4xDenhardt溶液、より好ましくは2.5xDenhardt溶液)及び0.01〜0.1% SDS(好ましくは0.02〜0.08% SDS、より好ましくは0.05% SDS)を含有する溶液中で、55℃〜75℃(好ましくは60℃〜70℃、より好ましくは68℃)でインキュベートする条件が例示される。インキュベートの時間としては、例えば6時間〜24時間(好ましくは10時間〜20時間、より好ましくは15時間)程度を例示することができる。
例えば「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」が結合している遺伝子サブトラクション用の担体を用い、OA患者の関節滑膜に比してRA患者の関節滑膜において発現レベルが高いPK遺伝子ファミリーについて遺伝子サブトラクションを行う場合には、OA患者の関節滑膜から抽出し増幅させたPK遺伝子に関する核酸群(ドライバー)が担体に結合したものを用い、当該担体に結合している核酸(ドライバー)と、RA患者の関節滑膜から抽出し増幅させたPK遺伝子に関する核酸画分(テスター)とを接触させてハイブリダイゼーション反応させ、その後、前記担体(これに結合している核酸及びこれにハイブリダイズした核酸)を除去すればよい。
特に、「担体」として磁性体ビーズを用いた場合には、担体の除去は、磁石を用いて簡便、迅速かつ確実に行うことができる。
より具体的には、例えば、以下ステップからなる方法を例示することができる。
(1)ヒトRA患者及びヒトOA患者の関節滑膜からRNAを抽出する。
(2)抽出したRNAを鋳型としてcDNAを合成する。
(3)RA患者由来のcDNAを鋳型とし、PK遺伝子ファミリーに特異的なプライマーを用いてPCRを行い、PK遺伝子ファミリーの断片を特異的に増幅する。これにより得られたDNAを「テスターDNA」という。
(4)OA患者由来のcDNAを鋳型とし、PK遺伝子ファミリーに特異的な配列の5'端にビオチンを付加したプライマーを用いてPCRを行い、両端にビオチンが修飾されたPK遺伝子ファミリーの断片を特異的に増幅する。これより得られたDNAを「ドライバーDNA」という。
(5)テスターDNAとドライバーDNAを混合し、水溶液中で加熱(好ましくは80℃〜100℃、より好ましくは90℃〜100℃、特に好ましくは100℃程度)することによって変性させる。次いで、終濃度として0.5〜10xSSC(好ましくは1〜5xSSC、より好ましくは3xSSC)、0.5〜5xDenhardt溶液(好ましくは1〜4xDenhardt溶液、より好ましくは2.5xDenhardt溶液)及び0.01〜0.1% SDS(好ましくは0.02〜0.08% SDS、より好ましくは0.05% SDS)を含有する溶液中、55℃〜75℃(好ましくは60℃〜70℃、より好ましくは68℃)で6時間〜24時間(好ましくは10時間〜20時間、より好ましくは15時間)インキュベートすることによりテスターDNAとドライバーDNAの間に二本鎖を形成させる。
(6)この反応液に磁気ビーズを添加し、ドライバーDNA中のビオチンと磁気ビーズに結合しているストレプトアビジンとを結合させる。
(7)ドライバーDNAと磁気ビーズとの複合体を磁石を用いて除去する。これによってドライバーDNAのみならず、テスターDNAとドライバーDNAに共通して存在する遺伝子断片も除去される。その結果、OA患者に比してRA患者において発現が増加しているDNAが溶液中に残ることになる。このDNAをPCRによって増幅し、PKの同定その他の諸解析に用いる。また遺伝子サブトラクションの感度及び精度をより高めるために、磁気ビーズ(担体)を除去した後の溶液について、上記ステップをさらに繰り返して実施してもよい。これにより、簡便、迅速かつ高精度な遺伝子サブトラクション法を行うことができる。
本発明方法によって選択された物質は、RAに対する処置剤の有効成分の候補として、更なる動物試験や臨床試験等に付することができる。
【実施例】
【0035】
以下、実施例により本発明をより具体的に説明する。
<実施例1> 「ヒトRA患者の細胞において、ヒトOA患者の細胞に比して発現が増加しているPK」の選択(遺伝子サブトラクション法)
(1)ヒトRA患者(6例)及びヒトOA患者(3例)の手術時に膝関節滑膜を摘出し、この滑膜からISOGEN(NIPPON GENE社)法によってRNAを抽出した。
(2)抽出したRNAを鋳型にして、SuperSript III First-Strand Synthesis System(Invitrogen社)を用いてcDNAを合成した。操作方法は同製品のマニュアルに従って行った。
(3)RA患者由来のcDNAを鋳型として、PK遺伝子ファミリーに特異的なプライマー(TAGAACTAGTGGATCCGTGCACMGNGAYYT(配列番号5)及びGGTCGACGGTATCGATCCAWAGGACCASACRTC(配列番号6))を用いてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(1分)-48℃(1分)-72℃(1分)]x 30回 - 72℃(5分))を行い、PK遺伝子ファミリーの断片を特異的に増幅した。以下、この増幅により得られたDNAを「テスターDNA」という。
(4)OA患者由来のcDNAを鋳型として、PK遺伝子ファミリーに特異的な配列の5'端にビオチンを付加したプライマー(GTGCACMGNGAYYT(配列番号1)及びGCGAATTCCAWAGGACCASACRTC(配列番号4))を用いてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(1分)-48℃(1分)-72℃(1分)]x 30回 - 72℃(5分))を行い、両端にビオチンが修飾されたPK遺伝子ファミリーの断片を特異的に増幅した。以下、この増幅により得られたDNAを「ドライバーDNA」という。
(5)6患者分のテスターDNA 2μgと、3患者分のドライバーDNA 4μgを混合し、100℃で5分間処理して変性させた。この溶液に等量のハイブリダイゼーションバッファー(6xSSC、5xDenhardt溶液、0.1%SDS)を添加し、68℃で一晩保温することによってテスターDNAとドライバーDNAの間に二本鎖を形成させた。
(6)この反応液に500μgの磁気ビーズ(Dynal Biotech社; M-270 Streptavidin)を添加し、1時間攪拌することによって、ドライバーDNA中のビオチンと磁気ビーズに結合しているストレプトアビジンとを結合させた。
(7)ドライバーDNAと磁気ビーズとの複合体を、ビーズ分離用磁石(Dynal Biotech社; MPC-S)を用いて除去した。これによってドライバーDNAのみならず、テスターDNAとドライバーDNAに共通して存在する遺伝子断片も除去される。その結果、OA患者に比してRA患者において発現が増加している遺伝子が溶液中に残ることになる。
(8)前記(7)の操作後の溶液に、新たにドライバーDNAを添加し、前記(5)から(7)の操作を2回繰り返した。
(9)前記(8)の操作後の溶液に含まれるDNAを増幅するために、テスターDNA増幅用プライマー(TAGAACTAGTGGATCC(配列番号7)及びTCGACGGTATCGAT(配列番号8))を用いてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(1分)-62℃(1分)-72℃(1分)]x 10〜16回 - 72℃(5分))を行った。
(10)上記PCRの産物から、PK遺伝子ファミリーの断片サイズである約240bpの断片を切り出し、TOPO-TA Cloning Kit for Sequence(Invitrogen社)を用いて、断片をプラスミドベクターにサブクローニングした。
(11)サブクローニングしたプラスミドDNAの挿入配列を解析し、GeneBank等のデータベースで検索した。その結果、HCK遺伝子、MET遺伝子、RON遺伝子等のPK遺伝子が同定された。従って、これらの遺伝子はOA患者に比してRA患者において発現が増加していることが示された。
<実施例2> RA患者及びOA患者滑膜における発現解析
(1)前記のサブトラクション法によって同定されたPK遺伝子が、OA患者と比較してRA患者において発現が増加していることを確認するために、6例のRA患者及び3例のOA患者由来のcDNAを鋳型としてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(30秒)-60℃(30秒)-72℃(1分)]x 27回 - 72℃(5分))を行った。各PK遺伝子の増幅には、HCK遺伝子(GCAGGCTCTGAGGACATCATC(配列番号9)及びTTGGTACTGGCTCTCTGTGGC(配列番号10))、MET遺伝子(CATGCCGACAAGTGCAGTA(配列番号11)及びTCTTGCCATCATTGTCCAAC(配列番号12))又はRON遺伝子(GTCAAGGATGTGCTGATTCCC(配列番号13)及びTCTGTGGAGTGAGGTACCTAATG(配列番号14))をプライマーとして用いた。
(2)RA及びOA患者由来のcDNAを鋳型として、サーマルサイクラー(TaKaRa社; TP3000)を用いてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(30秒)-60℃(30秒)-72℃(1分)]x 27回 - 72℃(5分))を行った後、PCR産物をアガロースゲル電気泳動し、対応するバンドの濃さをイメージアナライザ(Bio-Rad社; MOLECULAR IMAGER FX)を用いて定量した。
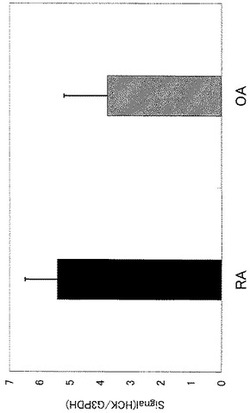
(3)各遺伝子のバンドの定量値は、内在性コントロールであるG3PDHの定量値に対する比として算出し、RA、OAそれぞれの平均値+標準偏差を求めた。HCK遺伝子の定量値(発現量)を図1に、MET遺伝子の定量値(発現量)を図2に、RON遺伝子の定量値(発現量)を図3にそれぞれ示す。
【0036】
その結果、HCK、MET及びRON遺伝子の発現量は、OA患者と比較してRA患者において高かった。このことから、前記サブトラクション法によって同定されたPK遺伝子は、OA患者に比してRA患者において発現が増加していることが確認された。
<実施例3> マウスCIAモデルの滑膜組織における遺伝子発現解析
(1)ヒトRA患者において発現が増加していることが確認されたPK遺伝子が、マウスCIAモデルにおいても発現が増加しているか調べるため、以下の試験を行った。マウスCIAモデルは、ヒトのRAに類似した関節炎を発症することが知られており、RA評価のモデルとして最も一般的に用いられている。
(2)マウスCIAモデルは、6〜7週齢の雄性DBA/1Jマウス(日本チャールズリバー社)の尾根部皮内に、ウシ由来のII型コラーゲン(3mg/ml、0.01M酢酸で溶解したもの)と完全フロインドアジュバントとを等量混和したエマルジョンを150μg/0.1ml注入することによって感作し、さらに初回感作から21日目に追加感作することによって作成した。追加感作の方法は、初回感作と同様である。マウスCIAモデルでは、追加感作後4〜5日目に四肢における炎症が惹起され、追加感作後10〜20日目に炎症がピークになることが知られている。
(3)初回感作の直前(0日)並びに初回感作後20日、23日、27日及び30日目にマウスの足根関節滑膜及び滑膜周辺組織を採取し(各時点においてn=5)、両足分から採取されたサンプルを合わせた後、前記のISOGEN(NIPPON GENE社)法によってRNAを抽出した。
(4)抽出したRNAを鋳型として、SuperSript III First-Strand Synthesis System(Invitrogen社)を用いてcDNAを合成した。
(5)各PK遺伝子の増幅には、HCK遺伝子(GCTGCCAACATCTTAGTCTCTG(配列番号15)及びAGCTGTCCACTTGATGGGGAAC(配列番号16))又はMET遺伝子(CATGCAGACAAGTGCAATATC(配列番号17)及びTTCTTTCCGTCATTGTCCAGC(配列番号18))をプライマーとして用いた。
(6)マウス滑膜及び滑膜周辺組織由来のcDNAを鋳型として、Smart Cycler(TaKaRa社)を用いて、SYBR Green法で定量PCRを行った。酵素としてはSYBR Premix Ex Taq(Perfect Real Time)(TaKaRa社; RR041A)を用い、PCRの反応条件は95℃(30秒)、次いで[95℃(5秒)−60℃(10秒)−72℃(15秒)]からなるサイクルを40回とした。
(7)初回感作の直前(0日)並びに初回感作後20日、23日、27日及び30日目の各時点における各遺伝子の定量値は、内在性コントロールであるG3PDHの定量値に対する比として算出し、平均値±標準偏差を求め、グラフにプロットした。HCK遺伝子の定量値(発現量)を図4に、MET遺伝子の定量値(発現量)を図5にそれぞれ示す。図4及び図5中における直線は、各時点における平均値を結んだものである。
その結果、HCK遺伝子は初回感作後27日目以降、MET遺伝子は初回感作後30日目以降で顕著に発現量が増加していた。
(8)以上の結果から、RA患者からサブトラクションにより同定されたHCK及びMETの各遺伝子は、マウスCIAモデルにおいても発現量が増加していることが確認された。また、これら各PK遺伝子の発現時期は、マウスCIAモデルにおける炎症が惹起される時期と相関していたことから、これら各PK遺伝子はRAの病態にも深く関与していると考えられる。
<実施例4> ラットアジュバントモデルの滑膜組織における遺伝子発現解析
(1)RA患者で発現が増加していることが確認されたPK遺伝子が、ラットアジュバントモデルにおいても発現が増加しているか調べるため、以下の試験を行った。ラットアジュバントモデルは、ヒトのRAに類似した関節炎を発症することが知られており、アジュバント投与後2〜7日目にアジュバントを投与した足で一次炎症が惹起され、投与後14日目以降に両足で二次炎症が惹起されることが知られている。
(2)ラットアジュバントモデルは、6週齢の雄性Lewis系ラット(日本チャールズリバー社)の右後肢足蹠皮下に、完全フロインドアジュバント(6mg/mlの結核(Mycobacterium Butyricum)死菌(DIFCO社)の流動パラフィン懸濁物)0.05mlを注射することによって作成した。
(3)アジュバント投与の直前(0日)並びに注射後2日、7日、10日、15日、28日及び44日目に膝関節滑膜組織を採取し(各時点においてn=3)、前記のISOGEN(NIPPON GENE社)法によってRNAを抽出した。
(4)抽出したRNAを鋳型として、SuperSript III First-Strand Synthesis System(Invitrogen社)を用いてcDNAを合成した。
(5)各PK遺伝子の増幅には、HCK遺伝子(CGTGAAGACCTCAGCTTCCAG(配列番号19)及びGGTCTCGGTGGATGTAGTTCC(配列番号20))、MET遺伝子(CCTGCAGACAAGTGCAGTAT(配列番号21)及びGTTGGACAGTGACGGAAAGA(配列番号22))及びRON遺伝子(GGTCAAGGATGTACTGATTCCC(配列番号23)及びCCAAAGTCAGCCACCTTGACTG(配列番号24))をプライマーとして用いた。
(6)ラット滑膜由来のcDNAを鋳型として、サーマルサイクラー(TaKaRa社; TP3000)を用いて、PCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(1分)-60℃(1分)-72℃(1分)]x 28回 - 72℃(5分))を行った後、PCR産物のバンドの濃さをイメージアナライザ(Bio-Rad社; MOLECULAR IMAGER FX)を用いて定量した。
(7)アジュバント投与の直前(0日)並びに注射後2日、7日、10日、15日、28日及び44日目の各時点における各遺伝子の定量値は、内在性コントロールであるG3PDHの定量値に対する比として算出し、平均値±標準偏差を求め、グラフにプロットした。HCK遺伝子の定量値(発現量)を図6に、MET遺伝子の定量値(発現量)を図7に、RON遺伝子の定量値(発現量)を図8にそれぞれ示す。図6〜図8中における直線は、各時点における平均値を結んだものである。
その結果、HCKは、アジュバント投与足においては注射後7日目と15日目に、アジュバント非投与足においては注射後15日目に顕著に発現量が増加していた。またMET遺伝子及びRON遺伝子は、アジュバント非投与足において注射後15日目で顕著に発現量が増加していた。
(8)以上の結果から、RA患者からサブトラクションにより同定されたHCK、MET及びRONの各遺伝子は、ラットアジュバントモデルにおいても発現量が増加していることが確認された。また、これら各PK遺伝子の発現時期は、ラットアジュバントモデルにおいて急性及び慢性の炎症が惹起される時期と相関していたことから、これら各PK遺伝子はRAの病態にも深く関与していると考えられる。
<実施例5> ラットアジュバントモデルの滑膜組織におけるPK遺伝子の局在性解析
(1)RA患者及びRAモデル動物で発現が増加していたPK遺伝子のうち、HCK遺伝子及びMET遺伝子について、RAモデル動物の滑膜組織における発現局在性を確認するために、In situ Hybridizationを行った。
(2)RAモデルとして、前記の方法で作成したラットアジュバントモデルを用いた(アジュバント群)。また対照群として、同じ週齢の正常ラットを用いた(正常群)。
(3)アジュバントの投与後14日目(慢性炎症初期)のラット膝及び足根関節滑膜組織を採取し、ホルマリン溶液で固定した。
(4)固定した組織をトリミングし、常法により骨組織の脱灰処理した後に、パラフィン包埋ブロックを作成した。
(5)アジュバント群及び正常群における、膝及び足根関節滑膜組織の各パラフィンブロックを4μmの厚さで薄切し、スライドグラス上に固定した。
(6)各PK遺伝子のプローブとして以下のものを用い、in vitro transcription法によってRNAを合成した後に、これをDIG RNA Labeling Mix(Roche社)を用いてジゴキシゲニン標識した。
HCK遺伝子:AGCACAGCCAGAAGCCCCATCAGGGCCTTGACATGCTCGACCTGCTGGGCCCACTCTCAGACGCCCCCTCCCCCACATTCCAGCTGTCGAGTGGAGGGAGAGGACTTCACAATCTCTTTTTGACTCTAGTCATCTGCAATCTGCCATTCTCAGGGCCTCCAAGTTAGTGTTTC(配列番号25)
MET遺伝子:TATCCTCCAAGCCGCGTATGTCAGTAAACCAGGGGCCAATCTTGCTAAGCAAATAGGGGCCAGCCCGTATGATGACATTCTCTACGGGGTGTTTGCACAAAGCAAGCCAGATTCTGCTGAGCCCATGAACCGATCAGCGGTCTGTGCATTCCCCATCAAATATGTCAATGACTTCTTCAACAAGATTGTCAACAAAAACAACGTACGGTGTCTCCAGCATTTTTATGGACCCAACCACGAGCACTGTTTCAATAGGACCCTGCTGAGAAATTCATCGGGCTGCGAAGTGCGCAGTGACGAGTACCGGACGGAGTTTACCACAGCGCTGCAGGCTGTGGATTTATTCATGGGCCGGCTCAACCATGTACTCTTGACGTCTATCTCTACCTTCATCAAAGGTGACCTCACCATTGCTAATCTAGGGACATCAGAAGGTCGCTTCATGCAGGTGGTGCTCTCTCGCACAGCACATTTCACCCCCCA(配列番号26)
(7)前記(5)で作製した各組織切片と、前記(6)で作製したジゴキシゲニン標識RNAプローブを用いてIn situ Hybridizationを行った。このプローブの検出は、アルカリホスファターゼ標識した抗ジゴキシゲニン抗体と、酵素基質としてニトロブルーテトラゾリウム(nitro blue tetrazolium;NBT)及びブロモクロロインドイルフォスフェート(bromochloroindoyl phosphate)を用いて行った。
また、ジゴキシゲニン染色後、ケルネヒトロート液(武藤化学薬品株式会社)を用いて核染色した。
(8)その結果、HCK遺伝子及びMET遺伝子のいずれもが、アジュバント群の膝及び足根関節滑膜組織における滑膜細胞、繊維芽細胞のみならず、マクロファージ、リンパ球、顆粒球といった炎症性細胞で発現していることが示された。
(9)滑膜細胞や炎症性細胞は、RAの発症や病態進行に深く関与していることが知られている。RAモデルにおけるこれらの細胞でHCK遺伝子及びMET遺伝子が発現していることからみても、これらのPK遺伝子はRAに深く関与していると考えられる。
<実施例6> 「RAにおいて発現が増加しているPK」の活性を阻害する作用を有する物質の選択1
前記の通り、OA患者に比してRA患者において発現が増加しているPKとして、HCK、MET、RONが同定された。この中でHCKに着目し、その活性を阻害する作用を有する物質としてPP2(4-amino-5-(4-chlorophenyl)-7-(t-butyl)pyrazolo[3,4,d] pyrimidine)を選択し、以下の試験を行った。
(1)RAモデル動物において遺伝子発現が増加しているHCKを阻害することで、モデル動物の病態が改善されるか調べるため、このモデルにPP2(HCK阻害剤)を投与する試験を行った。PP2は、CALBIOCHEM社のもの(HCK IC50=5 nM)を用いた。このPP2はジメチルスルホキシド(DMSO)に溶解されているため、生理食塩水で希釈して投与に用いた(PP2の終濃度:10μg/ml、DMSO終濃度1%)。
(2)RAモデルとして、前記の方法で作成されたラットアジュバントモデルを用いた。アジュバントを投与後、PP2を40μg/4ml/匹(約200μg/kg体重)で腹腔内に連日投与した(PP2群;n=5)。
陽性対照は、アジュバントを投与後、酢酸メチルプレドニソロン(Pfizer社;デポメドロール(登録商標))を2mg/4ml/匹(約10mg/kg体重)で腹腔内に連日投与したものとした(Pred群、n=3)。
また陰性対照は、アジュバントを投与後、1%DMSOを4ml/匹で腹腔内に連日投与したものとした(DMSO群、n=5)。
また対照群は、前記のラットアジュバントモデルと同じ週齢の正常ラットを用い、1%DMSOを4ml/匹で腹腔内に連日投与したものとした(正常群、n=3)。
(3)ラットアジュバントモデルでは炎症に伴って足蹠に浮腫が観察されるため、ラット後肢の足蹠浮腫容積を週3回測定して、病態の改善度の指標とした。各群ともに、各時点における足蹠容積の平均値±標準偏差を、アジュバント非投与足(左足)、アジュバント投与足(右足)別にグラフ化した。アジュバント非投与足(左足)の結果を図9に、アジュバント投与足(右足)の結果を図10にそれぞれ示す。
【0037】
その結果、PP2群では、DMSO群(陰性対照)に比して足蹠浮腫容積が減少していることが示された。
(4)またアジュバント投与後30日目に、ラット後肢(両足)のレントゲン写真を撮影して、足根骨、距踵骨、中足骨及び頸骨における足根骨側の4箇所の骨変性の程度を観察した。骨の変性の程度に応じて、0(無変化)、1(軽度の変性)、2(中度の変性)、3(重度の変性)としたスコア(1匹あたりのスコアの最高は24点となる。)をつけ、両後肢の骨変性の程度を評価し、各群における平均値+標準偏差をグラフ化した。結果を図11に示す。
【0038】
その結果、PP2群では、DMSO群(陰性対照)に比して骨変性スコアが改善していることが示された。
この結果から、RAモデル等において発現量が増加しているPKに対する阻害剤を投与することによって、RAの病態が改善されることが示された。
<実施例7> 「RAにおいて発現が増加しているPK」の活性を阻害する作用を有する物質の選択2
前記の通り、OA患者に比してRA患者において発現が増加しているPKとして、HCK、MET、RON等が同定された。この中でHCK及びMETに着目し、前者の活性を阻害する作用を有する物質としてPP2を、後者の活性を阻害する作用を有する物質としてMETを中和する活性を有する抗体をそれぞれ選択し、以下の試験を行った。
(1)RAモデル動物において遺伝子発現が増加しているPKを阻害することで、モデル動物の病態が改善されるか調べるため、このモデルにPP2(HCK阻害剤)又は抗MET中和抗体(MET阻害剤)を投与する試験を行った。PP2は前記と同じものを用いた。また、抗MET中和抗体は、マウスMETを中和する活性を有する抗体(R&D systems社; AF527)を用いた。この抗MET中和抗体は、生理食塩水で終濃度2mg/mlとしたものを用いた。
(2)RAモデルとして、前記の方法で作成されたマウスCIAモデルを用いた。
初回感作後24日目から39日目の間に、PP2を40μg/0.4ml/匹(約2mg/kg体重)で腹腔内に連日投与した(PP2群;n=10)。またPP2の陰性対照は、初回感作後24日目から39日目の間に3%DMSOを0.4ml/匹で腹腔内に連日投与したものとした(DMSO群、n=10)。
また、初回感作後24日目、27日目、30日目及び33日目に(計4回)、抗MET中和抗体を200μg/0.1ml/匹(約10mg/kg体重)で腹腔内に投与した(抗MET群;n=10)。また抗MET中和抗体の陰性対照は、初回感作後24日目、27日目、30日目及び33日目に(計4回)、抗MET中和抗体のアイソタイプコントロールである正常ヤギIgG(Cappel社; 55926)を200μg/0.1ml/匹(約10mg/kg体重)で腹腔内に投与したものとした(Isotype群、n=10)。
陽性対照は、初回感作後21日目から40日目の間に、酢酸メチルプレドニソロン(Pfizer社;デポメドロール(登録商標))を100μg/0.1ml/匹(約5mg/kg体重)で腹腔内に連日投与したものとした(Pred群、n=5)。
また対照群は、前記のマウスCIAモデルと同じ週齢の正常マウスを用い、試験開始後24日目、27日目、30日目及び33日目に(計4回)、生理食塩水を0.1ml/匹で腹腔内に投与したものとした(正常群、n=3)。
(3)関節炎の病態改善は、四肢における炎症スコア(両足の親指を除く指、甲及び踵並びに両手の親指を除く指及び甲(計22箇所)を観察し、浮腫、発赤の見られた個所に1点をつける。従って、スコアの最高は22点/匹となる。)によって評価した(追加感作の後、週3回評価した。)。
各群及び各時点における炎症スコアの平均値±標準偏差を、HCK評価群(PP2群、DMSO群及びPred群)と、MET評価群(抗MET群、Isotype群及びPred群)に分けてグラフ化した。HCK評価群の結果を図12に、MET評価群の結果を図13にそれぞれ示す。
【0039】
その結果、HCK評価群におけるPP2群では、DMSO群(陰性対照)に比して炎症スコアが改善していることが示された(図12)。またMET評価群における抗MET群でも、Isotype群(陰性対照)に比して炎症スコアが改善していることが示された(図13)。
(4)また初回感作後41日目に、マウス後肢(両足)のレントゲン写真を撮影して、足根骨、距踵骨、中足骨及び頸骨における足根骨側の4箇所の骨変性の程度を観察した。骨の変性の程度に応じて、0(無変化)、1(軽度の変性)、2(中度の変性)、3(重度の変性)としたスコア(1匹あたりのスコアの最高は24点となる。)をつけ、両後肢の骨変性の程度を評価し、各群における平均値+標準偏差をグラフ化した。結果を図14に示す。
【0040】
その結果、HCK評価群におけるPP2群、及び、MET評価群における抗MET群のいずれにおいても、陰性対照(DMSO群又はIsotype群)に比して骨変性スコアが改善していることが示された。
この結果からも、RAモデル等において発現量が増加しているPKに対する阻害剤を投与することによって、RAの病態が改善されることが示された。
<実施例8> 「RAにおいて発現が増加しているPK」の活性を阻害する作用を有する物質の選択3
OA患者に比してRA患者において発現が増加しているPKとして同定されたMETに着目し、抗MET中和抗体以外にMETの活性を阻害する作用を有する物質として、PHA-665752(低分子阻害剤)を選択し、以下の試験を行った。
(1)PHA-665752は、in vitro及びin vivoにおいて、METを特異的かつ強力に阻害することが知られている(Cancer Res., 63(21), 7345-7355(2003)、国際公開第WO02/096361号パンフレット、米国特許第6599902号明細書)。PHA-665752を、これらの文献に記載の方法に従って合成した後、DMSOとポリエチレングリコール(PEG)−400に溶解し、さらにリン酸緩衝生理食塩液(PBS)を添加して、終濃度1mg/mlの溶液として用いた。
(2)RAモデルとして、前記の方法で作成されたマウスCIAモデルを用いた。
初回感作後21日目から42日目の間に、PHA-665752を30 mg/kg(体重)で腹腔内に連日投与した(PHA-665752群;n=10)。陰性対照は、初回感作後21日目から42日目の間に1.5% DMSO/1.5% PEG-400/PBSを30 ml/kg(体重)で腹腔内に連日投与したものとした(Control群;n=10)。
陽性対照は、初回感作後21日目から42日目の間に、酢酸メチルプレドニソロン(Pfizer社;デポメドロール(登録商標))を5 mg/kg(体重)で腹腔内に連日投与したものとした(Pred群;n=5)。
正常群として、前記のマウスCIAモデルと同じ週齢の正常マウスを用い、初回感作後21日目から42日目の間に1.5% DMSO/1.5% PEG-400/PBSを30 ml/kg(体重)で腹腔内に連日投与したものとした(正常群; n=5)。
(3)関節炎及び骨変性の改善は、初回感作後42日目に、前記<実施例7>に記載の方法で評価し、各群におけるスコアの平均値と標準偏差をグラフ化した。関節炎に関する結果(平均値±標準偏差)を図15に、骨変性に関する結果(平均値+標準偏差)を図16にそれぞれ示す。
その結果、PHA-665752群では、四肢における関節炎のスコアがControl群に比して改善していることが示された(図15)。また骨変性についても、PHA-665752群はControl群に比して改善していることが示された(図16)。
この結果からも、RAモデル等において発現量が増加しているPKに対する阻害剤を投与することによって、RAの病態が改善されることが示された。またこの結果は、中和抗体、低分子阻害剤といった異なる機序でMETを阻害する複数の物質が、いずれもRAの病態改善に対して効果を発揮することを示すものでもある。このことから、METをはじめとする「OA患者に比してRA患者において発現が増加しているPK」の阻害剤は、その種類を問わず、RAの病態改善に有効であることが示された。
以上の結果から、「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が増加しているPK」の活性を阻害する作用を有する物質を選択することにより、当該物質をRAに対する処置剤の有効成分の候補とすることができることが示された。
【図面の簡単な説明】
【0041】
【図1】HCK遺伝子の発現量(RA、OA患者滑膜)を示す図である。
【図2】MET遺伝子の発現量(RA、OA患者滑膜)を示す図である。
【図3】RON遺伝子の発現量(RA、OA患者滑膜)を示す図である。
【図4】HCK遺伝子の発現の変化(マウスCIAモデル)を示す図である。
【図5】MET遺伝子の発現の変化(マウスCIAモデル)を示す図である。
【図6】HCK遺伝子の発現の変化(ラットアジュバントモデル)を示す図である。
【図7】MET遺伝子の発現の変化(ラットアジュバントモデル)を示す図である。
【図8】RON遺伝子の発現の変化(ラットアジュバントモデル)を示す図である。
【図9】HCK阻害剤(PP2)投与による足蹠容積(ラットアジュバントモデル;アジュバント非投与足(左足))を示す図である。
【図10】HCK阻害剤(PP2)投与による足蹠容積(ラットアジュバントモデル;アジュバント投与足(右足))を示す図である。
【図11】HCK阻害剤(PP2)投与による骨変性スコア(ラットアジュバントモデル)を示す図である。
【図12】HCK阻害剤(PP2)投与による炎症スコア(マウスCIAモデル)を示す図である。
【図13】抗MET中和抗体投与による炎症スコア(マウスCIAモデル)を示す図である。
【図14】HCK阻害剤(PP2)又は抗MET中和抗体投与による骨変性スコア(マウスCIAモデル)を示す図である。
【図15】MET阻害剤(PHA-665752)投与による炎症スコア(マウスCIAモデル)を示す図である。
【図16】MET阻害剤(PHA-665752)投与による骨変性スコア(マウスCIAモデル)を示す図である。
【技術分野】
【0001】
本発明は、関節リウマチに対する処置剤の有効成分の候補となる物質の新規なスクリーニング方法に関する。
【背景技術】
【0002】
まず、本出願書類において用いた略号について説明する。
CIA:コラーゲン誘発関節炎(collagen-induced arthritis)
G3PDH:グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(glyceraldehyde 3-phosphate dehydrogenase)
HCK:造血細胞キナーゼ(Hemopoietic cell kinase)
MET:肝細胞増殖因子受容体(hepatocyte growth factor receptor、HGF receptor、c-MET)
OA:変形性関節症(osteoarthritis)
PCR:ポリメラーゼ連鎖反応(Polymerase Chain Reaction)
PHA−665752:(3Z)−5−[(2,6−ジクロロベンジル)スルフォニル]−3−[(3,5−ジメチル−4−{[(2R)−2−(ピロリジン−1−イルメチル)ピロリジン−1−イル]カルボニル}−1H−ピロル−2−イル)メチレン]−1,3−ジヒドロ−2H−インドール−2−オン((3Z)-5-[(2,6-dichlorobenzyl)sulfonyl]-3-[(3,5-dimethyl-4-{[(2R)-2-(pyrrolidin-1-ylmethyl)pyrrolidin-1-yl]carbonyl}-1H-pyrrol-2-yl)methylene]-1,3-dihydro-2H-indol-2-one)
PK:タンパク質キナーゼ(protein kinase)
RA:関節リウマチ(rheumatoid arthritis)
RON:マクロファージ刺激タンパク質受容体(macrophage stimulating protein receptor、Msp receptor)
SDS:ドデシル硫酸ナトリウム(sodium dodecyl sulfate)
また本出願書類においてヌクレオチド配列(塩基配列)を示す場合には、以下の略号を用いる。
A(又はa):アデニン
G(又はg):グアニン
C(又はc):シトシン
T(又はt):チミン
U(又はu):ウラシル
R(又はr):グアニン又はアデニン
Y(又はy):チミン又はシトシン
M(又はm):アデニン又はシトシン
S(又はs):グアニン又はシトシン
W(又はw):アデニン又はチミン
N(又はn):アデニン又はグアニン又はシトシン又はチミン
RAは結合組織に炎症をきたす全身的な疾患であり、主に関節の滑膜に非特異的炎症を起こし、全身の多発性関節炎の病像を呈する疾患である。RAに対する治療剤等やそのスクリーニング方法に関する先行技術も存在するが(特許文献1及び特許文献2参照)、RAは複雑な疾患であり、かつその処置も抗炎症剤等による対症療法的なものに止まっているのが実情である。
【0003】
【特許文献1】特開2002−187856号公報
【特許文献2】特開2003−183177号公報 そこで、RAに対する処置剤の有効成分の候補物質を種々の観点からなるべく多く見い出し、それをRAの処置剤に応用していく必要がある。
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、RAに対する処置剤の有効成分の候補となる物質を、簡便、迅速、効率的かつ高精度にスクリーニングする方法を提供することを課題とする。
【課題を解決するための手段】
【0005】
本発明者らは上記課題を解決するため鋭意検討した結果、「RAに罹患している動物の細胞において発現が変化しているPK」の活性を調節する作用を有する物質を選択しすることによって、RAの処置剤の有効成分物質を、簡便、迅速、効率的かつ高精度にスクリーニングできることを見い出し、本発明を完成した。
すなわち本発明は、以下のステップを少なくとも含むことを特徴とする、RAに対する処置剤の有効成分の候補となる物質のスクリーニング方法(以下、「本発明方法」という。)を提供する;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質を選択するステップ。
【0006】
本発明方法は、前記のステップの前に、さらに以下のステップを含むことが好ましい;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」を選択するステップ。このステップは、遺伝子サブトラクション法によって行われることが好ましい。またこの「遺伝子サブトラクション法」は、「『遺伝子サブトラクションのターゲットとするPK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」が結合している遺伝子サブトラクション用の担体を用いて行われることが好ましい。
また、前記のPKは、チロシンキナーゼ及びセリン/スレオニンキナーゼからなる群から選ばれる1又は2以上のPKであることが好ましい。
また、前記における「変化」の態様が「増加」であり、かつ、「調節」の態様が「阻害」であることが好ましい。この場合、「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が増加しているPK」は、HCK、MET及びRONからなる群から選ばれる1又は2以上のPKであることが好ましい。
【発明の効果】
【0007】
本発明によれば、RAに対する処置剤の有効成分の候補となる物質を、簡便、迅速、効率的かつ高精度にスクリーニングする方法が提供されることから、極めて有用である。
【発明を実施するための最良の形態】
【0008】
以下、本発明を発明の実施の形態により詳説する。
【0009】
本発明方法は、以下のステップを少なくとも含むことを特徴とする、RAに対する処置剤の有効成分の候補となる物質のスクリーニング方法である;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質を選択するステップ。
【0010】
本出願書類における「RAに対する処置剤」の用語は、RAに対する何らかの処置のために用いられる剤である限りにおいて特に限定されない。例えば、RAの予防、維持(悪化防止)、軽減(症状改善)、治療等の処置のために用いられる剤は、いずれも本出願書類における「RAに対する処置剤」の用語に包含される。
【0011】
また「RAに対する処置剤の有効成分の候補となる物質」とは、RAに対する処置剤の有効成分として利用できる可能性がある物質を意味する。したがって、この物質がRAに対する処置剤の有効成分として実際に利用できるものであるか否かは問わない。例えばこの物質について、仮にその後に行われる動物試験や臨床試験等によってRAに対する効果が否定されたとしても、本発明方法を実施した時点においてRA処置剤の有効成分として利用できる「可能性」があった限りにおいて、「RAに対する処置剤の有効成分の候補となる物質」に包含される。
【0012】
本発明方法は、以下のステップを少なくとも含むことを特徴としている;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質を選択するステップ。
【0013】
ここにいう「RA」は、医学上の厳密な定義におけるRAのみならず、RAと同様又は類似の疾患症状を呈するものをも含む趣旨である。
【0014】
またここにいう「RAに罹患」とは、自然発症的にRAに罹患した場合のみならず、人為的にRAに罹患させた場合をも含む。例えば、人為的に作製されたRAのモデル動物は、「RAに罹患している動物」に含まれる。
【0015】
また、ここにいう「動物」は、RAに罹患する可能性がある動物である限りにおいて特に限定されない。このような動物としては哺乳動物が例示され、そのなかでもヒト、サル、イヌ、ネコ、ウマ、マウス、ラット等が例示される。どの動物を選択するかは、スクリーニングの目的や、RA処置剤の適用対象とする動物等に応じて適宜設定することができる。なかでもヒトが好ましい。
【0016】
また、ここにいう「細胞」は、RAによって何らかの影響を受けうる組織の細胞である限りにおいて特に限定されない。RAでは、関節の滑膜に炎症が起き、痛みと変形が引き起こされることから、この「細胞」としては、例えば、関節の滑膜の細胞を例示することができる。
また、ここにいう「RAに罹患していない動物の細胞」は、「RAに罹患している動物の細胞」が由来する動物と同種の動物に由来する、同じ組織の細胞であることが好ましい。すなわち、例えば「RAに罹患している動物の細胞」がRAモデルマウスの関節滑膜細胞である場合には、「RAに罹患していない動物の細胞」としては、RAに罹患していないマウスの関節滑膜細胞を選択することが好ましい。同様に、例えば「RAに罹患している動物の細胞」がヒトRA患者の関節滑膜細胞である場合には、「RAに罹患していない動物の細胞」としては、RAに罹患していないヒトの関節滑膜細胞を選択することが好ましい。
また、「RAに罹患していない」とは、RAに罹患していない限りにおいて特に限定されず、健常なもの(何らの疾患にも罹患していないもの)はもちろん、RA以外の疾患には罹患しているがRAには罹患していないものをも含む趣旨である。したがって、例えば、OAにのみ罹患している動物は、「RAに罹患していない動物」であるといえる。
【0017】
また、ここにいう「発現」とは、核酸(mRNA等)の発現であっても、タンパク質レベルの発現であってもよく、目的等に応じて適宜選択することができる。例えば、後述する遺伝子サブトラクション法によってPKの発現を明らかにする場合には、核酸(mRNA等)の発現に注目すればよい。
【0018】
また「発現が変化」とは、RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比してPKの発現レベルが増加又は減少していることを意味する。例えば、前者の細胞において、後者の細胞に比してPKの発現の量が増加又は減少しているような場合である。前者の細胞におけるPKの発現レベルが後者の細胞に比して増加している(高い)又は減少している(低い)限りにおいて、両者間の発現レベルの差の程度は問わない。両者間の発現レベルの差が小さいものであれば、それだけ多くの候補物質が選択されうる反面、RAに対する処置剤の有効成分として効果を発揮しないものも多く選択されうる。逆に、両者間の発現レベルの差が大きいものであれば、選択される候補物質が少なくなる反面、RAに対する処置剤の有効成分として効果を発揮するものが選択される可能性が高くなる。したがって、どのような程度の発現レベルの差をもって「発現が変化している」と判断するかは、スクリーニングの目的等に応じて当業者が適宜設定すればよい。
また、PKは、チロシンキナーゼ及びセリン/スレオニンキナーゼからなる群から選ばれる1又は2以上のPKであることが好ましい。
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質の選択は、当該「変化」が「増加」である場合には当該PKの酵素活性に対して阻害作用を発揮する物質を、当該「変化」が「減少」である場合には生体に投与することによって当該PKの活性を補いうる物質(例えば、当該PK分子自体、当該PK分子をコードするcDNAなど)を選択することにより行うことができる。この選択は、前者の場合には、当該PKとある物質とを接触させ、この物質が当該PKの酵素活性を消失又は低下させるか否かを判定し、当該PKの酵素活性を消失又は低下させた物質を選択することにより行うことができる。また後者の場合には、当該PK分子自体や当該PK分子をコードするcDNAなどをそのまま選択すれば良い。
ここで、前者の場合において、PKの酵素活性をどの程度低下させた場合に「PKの活性を阻害する作用を有する」と判定するかは、スクリーニングの目的等に応じて当業者が適宜設定すればよい。PKの酵素活性をわずかに低下させたものをも「PKの活性を阻害する作用を有する」として判定する場合には、それだけ多くの候補物質が選択されうる反面、RAに対する処置剤の有効成分として効果を発揮しないものも多く選択されうる。逆に、PKの酵素活性を相当程度低下(又は消失)させたもののみを「PKの活性を阻害する作用を有する」として判定する場合には、選択される候補物質が少なくなる反面、RAに対する処置剤の有効成分として効果を発揮するものが選択される可能性が高くなる。
この「PKの活性を阻害する作用を有する物質」の選択の手法も特に限定されず、例えばハイスループット・スクリーニングのような手法を用いることもできる。
後述の実施例にも示す通り、本発明者らは、「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が増加しているPK」として、HCK、MET及びRONを同定することに成功した。したがって本発明方法は、HCK、MET及びRONからなる群から選ばれる1又は2以上のPKの活性を阻害する作用を有する物質を選択するステップを少なくとも含むものが好ましい。
【0019】
なお本発明方法は、「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が変化しているPK」の活性を調節する作用を有する物質を選択するステップを少なくとも含む限りにおいて、他のステップをさらに含んでいてもよい。例えば、このステップと並行して他のスクリーニング方法を実施するステップをさらに含んでいてもよい。またこのステップの後に、選択された物質を他のスクリーニング方法に付するステップをさらに含んでいてもよい。またこのステップの前に、以下のステップをさらに含んでいてもよい;
「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているPK」を選択するステップ。
【0020】
「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が変化しているPK」は、種々の方法によって選択することができる。例えば、両者の細胞からタンパク質を抽出し、「RAに罹患している動物の細胞」において「RAに罹患していない動物の細胞」よりもタンパク質量が多い又は少ないPKを同定することにより選択してもよい。また、PK遺伝子ファミリーについて、両者の細胞を用いた遺伝子サブトラクション法を行うことにより、RAに罹患している動物の細胞において発現が変化している「PKをコードする核酸(mRNA等)」を同定することにより選択してもよい。
【0021】
このステップは、なかでも遺伝子サブトラクション法によって行われることが好ましい。
【0022】
遺伝子サブトラクション法(差し引きハイブリッド法)は、異なる2種類の細胞や組織間において発現レベルの差がある目的遺伝子を、ハイブリダイゼーションによって差し引きすることにより単離する方法である。例えば、ある目的遺伝子のmRNAが細胞Aに較べ細胞Bにおいてより高レベルに発現している場合、細胞A及びBに由来するmRNA/cDNA/cRNA等の間でハイブリッドを形成させ、そのハイブリッド形成したもの以外のものを除去することで、細胞Bにおいて高レベルに発現している遺伝子を単離することができる。本出願書類では、この場合におけるハイブリッドを形成させる細胞A由来の核酸(対照試料)を「ドライバー」と、細胞B由来の核酸(目的試料)を「テスター」という。
【0023】
「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が増加しているPK」を、遺伝子サブトラクション法によって選択する場合には、RAに罹患していない動物細胞由来の核酸(PKに関するもの)を「ドライバー」とし、RAに罹患している動物細胞由来の核酸(PKに関するもの)を「テスター」として用いればよい。また、「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が減少しているPK」を、遺伝子サブトラクション法によって選択する場合には、RAに罹患していない動物細胞由来の核酸(PKに関するもの)を「テスター」とし、RAに罹患している動物細胞由来の核酸(PKに関するもの)を「ドライバー」として用いればよい。遺伝子サブトラクションの方法は、通常の方法を採用することができる。
例えば、「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が増加しているPK」を遺伝子サブトラクション法によって選択する場合には、「ドライバー」としては、「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」であってRAに罹患していない動物の細胞において発現しているものを、「テスター」としては、「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」であってRAに罹患している動物の細胞において発現しているものをそれぞれ採用することが好ましい。
以下、遺伝子サブトラクション法に関する具体的説明をする場合には、「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が増加しているPK」を選択する場合について説明することとする。「RAに罹患している動物の細胞において、RAに罹患していない動物の細胞に比して発現が減少しているPK」を選択する場合には、テスターとドライバーとを入れ替えて用いればよいことは前記の通りである。
【0024】
なお、ここで、「PK遺伝子ファミリー」は、チロシンキナーゼファミリー及びセリン/スレオニンキナーゼファミリーであることが好ましい。また、この「チロシンキナーゼファミリー及びセリン/スレオニンキナーゼファミリー」は、HCK、MET及びRONからなる群であることが好ましい。
また、PK遺伝子ファミリーに「共通なヌクレオチド配列」とは、当該ファミリーに共通して存在するヌクレオチド配列である限りにおいて特に限定されない。ここで「共通して存在する」とは、必ずしも当該遺伝子ファミリーに属する全ての遺伝子において存在している必要はなく、当該遺伝子ファミリーに属する多くの遺伝子において存在するものであれば良い。また、「共通なヌクレオチド配列」自体も、必ずしもその遺伝子間において完全に一致している必要はなく、若干のヌクレオチドの差異があってもよい。
PK遺伝子ファミリーにおいて、具体的にどのようなヌクレオチド配列を「共通なヌクレオチド配列」とするかについては、サブトラクションの目的・精度等に応じて当業者が適宜決定することができる。例えば、PK遺伝子ファミリーに関してある程度幅広く遺伝子サブトラクションを行いたいのであれば、「PK遺伝子ファミリーに共通なヌクレオチド配列」として、当該遺伝子ファミリーに属する全ての遺伝子において存在するヌクレオチド配列ではなく、当該遺伝子ファミリーに属する多くの遺伝子において存在するヌクレオチド配列を用いればよい。逆に、PK遺伝子ファミリーに関して、当該遺伝子ファミリーに属する全ての遺伝子において存在する特定のヌクレオチド配列に厳密に着目して遺伝子サブトラクションを行いたいのであれば、「PK遺伝子ファミリーに共通なヌクレオチド配列」として、当該遺伝子ファミリーに属する全ての遺伝子において存在する当該特定のヌクレオチド配列を用いればよい。
PK遺伝子ファミリーに共通なヌクレオチド配列としては、配列番号1及び/又は配列番号2で示されるヌクレオチド配列を採用することが好ましい。
GTGCACMGNGAYYT (配列番号1)
GAYGTSTGGTCCTWTGG (配列番号2)
(配列番号中におけるTはUであってもよい。また、Y、W及びNにおけるTも、Uであってもよい。)
そのなかでも、PK遺伝子ファミリーに共通なヌクレオチド配列として、配列番号1と配列番号2の両方のヌクレオチド配列を採用することが好ましい。
また、「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列」とは、以上に説明した「PK遺伝子ファミリーに共通なヌクレオチド配列」に対して、アニーリングする性質を有するヌクレオチド配列である限りにおいて特に限定されない。ここで「アニーリング」の条件は、相補的にハイブリッドを形成すべき核酸鎖間の水素結合が切断されている温度条件から温度を下げていったときに、当該核酸鎖間で水素結合が再構成され、両者が再結合するような条件である限りにおいて特に限定されない。具体的には、PCRにおける冷却のステップにおいて、前記核酸鎖間で再結合が形成されるような条件が挙げられる。より具体的には、ExTaq ポリメラーゼ(TaKaRa社:RR001A)に付属のバッファーを用いて、48℃(〜70℃)、1分間で前記核酸鎖間の再結合が形成されるものであることが好ましい。
「PK遺伝子ファミリーに共通なヌクレオチド配列」にアニーリングするヌクレオチド配列としては、配列番号1及び/又は配列番号3で示されるヌクレオチド配列を採用することが好ましい。
GTGCACMGNGAYYT (配列番号1)
CCAWAGGACCASACRTC (配列番号3)
(配列番号中におけるTはUであってもよい。また、Y、W及びNにおけるTも、Uであってもよい。)
そのなかでも、配列番号1と配列番号3の両方のヌクレオチド配列を採用することが好ましい。
また「PK遺伝子ファミリーに共通なヌクレオチド配列」にアニーリングするヌクレオチド配列としては、配列番号1及び/又は配列番号4で示されるヌクレオチド配列を採用することも好ましい。
GTGCACMGNGAYYT (配列番号1)
GCGAATTCCAWAGGACCASACRTC (配列番号4)
(配列番号中におけるTはUであってもよい。また、Y、W及びNにおけるTも、Uであってもよい。)
そのなかでも、配列番号1と配列番号4の両方のヌクレオチド配列を採用することが好ましい。
【0025】
このような、「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列」からなる核酸をもとに、当該配列を保持する核酸を製造することができる。なお本出願書類において、あるヌクレオチド配列を「保持する」核酸とは、当該ヌクレオチド配列からなる核酸のみならず、当該ヌクレオチド配列を一部分に含んでいる核酸をも含む趣旨である。
ドライバーとすべきこのような核酸は、前記の「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列」からなる核酸をプライマーとし、RAに罹患していない動物の細胞に存在する核酸(mRNA等)を鋳型としたPCRによって製造し、増幅することができる。例えば、配列番号1及び/又は配列番号3で示される核酸をプライマーとし、OA患者の関節滑膜から抽出された核酸を鋳型としたPCRによって、ドライバーとすべき核酸を製造・増幅することができる。配列番号3に代えて、配列番号4で示される核酸を用いてもよい。
GTGCACMGNGAYYT (配列番号1)
CCAWAGGACCASACRTC (配列番号3)
GCGAATTCCAWAGGACCASACRTC (配列番号4)
(配列番号中におけるTはUであってもよい。また、Y、W及びNにおけるTも、Uであってもよい。)
このような「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」は、動物種や、用いる細胞や組織等に応じて異なることとなるが、これらに応じて当業者が適宜設定・製造等することができる。
【0026】
また、この遺伝子サブトラクション法は、このような「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」が結合している遺伝子サブトラクション用の担体を用いて行われることが好ましい。
【0027】
この「担体」は、核酸を結合させることができ、かつ、水や反応液等に不溶である限りにおいて特に限定されない。その形状も特に限定されず、ビーズ、プレート(例えばマイクロプレートのウェル等)、チューブ、メンブレン、ゲル等を例示することができる。なかでもビーズの形状が好ましい。
また担体の材質も特に限定されず、磁性体、ポリスチレン、ポリプロピレン、ポリ塩化ビニル、ニトロセルロース、ナイロン、ポリアクリルアミド、ポリアロマー、ポリエチレン、ガラス、アガロース等の材質が例示される。
【0028】
これらのなかでも、磁性体のビーズであることが、ハイブリダイゼーション後のドライバーの除去を簡便、迅速かつ確実に行いうることから好ましい。すなわち、担体として磁性体ビーズを用いれば、ハイブリダイゼーション後に、磁石によって当該ビーズ(これに結合している核酸及びこれにハイブリダイズした核酸)を簡便、迅速かつ確実に除去することができる。
【0029】
また、前記の核酸と担体との間の結合様式も、水や反応液等の中において両者が解離しない強度以上の強度を有するものである限りにおいて特に限定されない。また、核酸と担体とが直接結合しているものはもちろん、両者が別の物質を介して結合していてもよい。
両者間の結合としては、例えば、2個の原子がいくつかの電子を共有してつくる共有結合や、2個の分子間における親和性により形成されるアフィニティー結合等を例示することができる。アフィニティー結合としては、ビオチン−アビジン結合(ビオチンとアビジンとの間の結合)等を例示することができる。なお、本出願書類における「アビジン」の用語には、ストレプトアビジンも当然に包含される。
【0030】
両者間の結合様式としてビオチン−アビジン結合を採用する場合には、例えば、担体に結合させるべき核酸に公知の方法でビオチンを結合させ、担体(例えば、磁性体ビーズ)にはアビジンを結合させて、両者を接触させてアフィニティー結合させることにより、核酸と担体とがビオチン−アビジン結合によって結合した担体とすることができる。また、アビジン等が結合している担体(例えば、磁性体ビーズ)等も市販されており、これらを用いることもできる。
【0031】
なお、核酸と担体との結合は、遺伝子サブトラクションの過程で形成させてもよい。例えば、ドライバーとテスターとをハイブリダイズさせた後に、当該ドライバーを担体に結合させる態様であってもよい。例えば、予めドライバーにビオチンを結合させておき、これとテスターとをハイブリダイズさせた後に、ドライバーに結合しているビオチンを担体に結合しているアビジンに結合させてもよい。
【0032】
なお、以上に示したヌクレオチド配列や核酸は、DNAであっても、RNAであってもよく、遺伝子サブトラクションの目的や方法等によって当業者が適宜選択することができる。例えば、ヌクレオチド配列や核酸としてRNAを採用する場合にはチミン(T)をウラシル(U)に変更すればよく、またmRNAを用いる場合には、DNAからの転写を考慮してそのヌクレオチド配列をデザインすればよい。
【0033】
遺伝子サブトラクションの方法は、通常の方法を採用することができる。具体的には、「RAに罹患していない動物細胞由来の前記核酸(ドライバー)」と「RAに罹患している動物細胞由来の前記核酸を含有する核酸画分(テスター)」とを接触させてハイブリダイゼーション反応させ、その後、両者がハイブリダイズした核酸を除去するステップを含むことが好ましい。
【0034】
ハイブリダイゼーション反応の条件は、非特異的なハイブリダイゼーションが生じない程度のストリンジェントな条件で行われることが好ましい。このような条件としては、終濃度として0.5〜10xSSC(好ましくは1〜5xSSC、より好ましくは3xSSC)、0.5〜5xDenhardt溶液(好ましくは1〜4xDenhardt溶液、より好ましくは2.5xDenhardt溶液)及び0.01〜0.1% SDS(好ましくは0.02〜0.08% SDS、より好ましくは0.05% SDS)を含有する溶液中で、55℃〜75℃(好ましくは60℃〜70℃、より好ましくは68℃)でインキュベートする条件が例示される。インキュベートの時間としては、例えば6時間〜24時間(好ましくは10時間〜20時間、より好ましくは15時間)程度を例示することができる。
例えば「『PK遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」が結合している遺伝子サブトラクション用の担体を用い、OA患者の関節滑膜に比してRA患者の関節滑膜において発現レベルが高いPK遺伝子ファミリーについて遺伝子サブトラクションを行う場合には、OA患者の関節滑膜から抽出し増幅させたPK遺伝子に関する核酸群(ドライバー)が担体に結合したものを用い、当該担体に結合している核酸(ドライバー)と、RA患者の関節滑膜から抽出し増幅させたPK遺伝子に関する核酸画分(テスター)とを接触させてハイブリダイゼーション反応させ、その後、前記担体(これに結合している核酸及びこれにハイブリダイズした核酸)を除去すればよい。
特に、「担体」として磁性体ビーズを用いた場合には、担体の除去は、磁石を用いて簡便、迅速かつ確実に行うことができる。
より具体的には、例えば、以下ステップからなる方法を例示することができる。
(1)ヒトRA患者及びヒトOA患者の関節滑膜からRNAを抽出する。
(2)抽出したRNAを鋳型としてcDNAを合成する。
(3)RA患者由来のcDNAを鋳型とし、PK遺伝子ファミリーに特異的なプライマーを用いてPCRを行い、PK遺伝子ファミリーの断片を特異的に増幅する。これにより得られたDNAを「テスターDNA」という。
(4)OA患者由来のcDNAを鋳型とし、PK遺伝子ファミリーに特異的な配列の5'端にビオチンを付加したプライマーを用いてPCRを行い、両端にビオチンが修飾されたPK遺伝子ファミリーの断片を特異的に増幅する。これより得られたDNAを「ドライバーDNA」という。
(5)テスターDNAとドライバーDNAを混合し、水溶液中で加熱(好ましくは80℃〜100℃、より好ましくは90℃〜100℃、特に好ましくは100℃程度)することによって変性させる。次いで、終濃度として0.5〜10xSSC(好ましくは1〜5xSSC、より好ましくは3xSSC)、0.5〜5xDenhardt溶液(好ましくは1〜4xDenhardt溶液、より好ましくは2.5xDenhardt溶液)及び0.01〜0.1% SDS(好ましくは0.02〜0.08% SDS、より好ましくは0.05% SDS)を含有する溶液中、55℃〜75℃(好ましくは60℃〜70℃、より好ましくは68℃)で6時間〜24時間(好ましくは10時間〜20時間、より好ましくは15時間)インキュベートすることによりテスターDNAとドライバーDNAの間に二本鎖を形成させる。
(6)この反応液に磁気ビーズを添加し、ドライバーDNA中のビオチンと磁気ビーズに結合しているストレプトアビジンとを結合させる。
(7)ドライバーDNAと磁気ビーズとの複合体を磁石を用いて除去する。これによってドライバーDNAのみならず、テスターDNAとドライバーDNAに共通して存在する遺伝子断片も除去される。その結果、OA患者に比してRA患者において発現が増加しているDNAが溶液中に残ることになる。このDNAをPCRによって増幅し、PKの同定その他の諸解析に用いる。また遺伝子サブトラクションの感度及び精度をより高めるために、磁気ビーズ(担体)を除去した後の溶液について、上記ステップをさらに繰り返して実施してもよい。これにより、簡便、迅速かつ高精度な遺伝子サブトラクション法を行うことができる。
本発明方法によって選択された物質は、RAに対する処置剤の有効成分の候補として、更なる動物試験や臨床試験等に付することができる。
【実施例】
【0035】
以下、実施例により本発明をより具体的に説明する。
<実施例1> 「ヒトRA患者の細胞において、ヒトOA患者の細胞に比して発現が増加しているPK」の選択(遺伝子サブトラクション法)
(1)ヒトRA患者(6例)及びヒトOA患者(3例)の手術時に膝関節滑膜を摘出し、この滑膜からISOGEN(NIPPON GENE社)法によってRNAを抽出した。
(2)抽出したRNAを鋳型にして、SuperSript III First-Strand Synthesis System(Invitrogen社)を用いてcDNAを合成した。操作方法は同製品のマニュアルに従って行った。
(3)RA患者由来のcDNAを鋳型として、PK遺伝子ファミリーに特異的なプライマー(TAGAACTAGTGGATCCGTGCACMGNGAYYT(配列番号5)及びGGTCGACGGTATCGATCCAWAGGACCASACRTC(配列番号6))を用いてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(1分)-48℃(1分)-72℃(1分)]x 30回 - 72℃(5分))を行い、PK遺伝子ファミリーの断片を特異的に増幅した。以下、この増幅により得られたDNAを「テスターDNA」という。
(4)OA患者由来のcDNAを鋳型として、PK遺伝子ファミリーに特異的な配列の5'端にビオチンを付加したプライマー(GTGCACMGNGAYYT(配列番号1)及びGCGAATTCCAWAGGACCASACRTC(配列番号4))を用いてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(1分)-48℃(1分)-72℃(1分)]x 30回 - 72℃(5分))を行い、両端にビオチンが修飾されたPK遺伝子ファミリーの断片を特異的に増幅した。以下、この増幅により得られたDNAを「ドライバーDNA」という。
(5)6患者分のテスターDNA 2μgと、3患者分のドライバーDNA 4μgを混合し、100℃で5分間処理して変性させた。この溶液に等量のハイブリダイゼーションバッファー(6xSSC、5xDenhardt溶液、0.1%SDS)を添加し、68℃で一晩保温することによってテスターDNAとドライバーDNAの間に二本鎖を形成させた。
(6)この反応液に500μgの磁気ビーズ(Dynal Biotech社; M-270 Streptavidin)を添加し、1時間攪拌することによって、ドライバーDNA中のビオチンと磁気ビーズに結合しているストレプトアビジンとを結合させた。
(7)ドライバーDNAと磁気ビーズとの複合体を、ビーズ分離用磁石(Dynal Biotech社; MPC-S)を用いて除去した。これによってドライバーDNAのみならず、テスターDNAとドライバーDNAに共通して存在する遺伝子断片も除去される。その結果、OA患者に比してRA患者において発現が増加している遺伝子が溶液中に残ることになる。
(8)前記(7)の操作後の溶液に、新たにドライバーDNAを添加し、前記(5)から(7)の操作を2回繰り返した。
(9)前記(8)の操作後の溶液に含まれるDNAを増幅するために、テスターDNA増幅用プライマー(TAGAACTAGTGGATCC(配列番号7)及びTCGACGGTATCGAT(配列番号8))を用いてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(1分)-62℃(1分)-72℃(1分)]x 10〜16回 - 72℃(5分))を行った。
(10)上記PCRの産物から、PK遺伝子ファミリーの断片サイズである約240bpの断片を切り出し、TOPO-TA Cloning Kit for Sequence(Invitrogen社)を用いて、断片をプラスミドベクターにサブクローニングした。
(11)サブクローニングしたプラスミドDNAの挿入配列を解析し、GeneBank等のデータベースで検索した。その結果、HCK遺伝子、MET遺伝子、RON遺伝子等のPK遺伝子が同定された。従って、これらの遺伝子はOA患者に比してRA患者において発現が増加していることが示された。
<実施例2> RA患者及びOA患者滑膜における発現解析
(1)前記のサブトラクション法によって同定されたPK遺伝子が、OA患者と比較してRA患者において発現が増加していることを確認するために、6例のRA患者及び3例のOA患者由来のcDNAを鋳型としてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(30秒)-60℃(30秒)-72℃(1分)]x 27回 - 72℃(5分))を行った。各PK遺伝子の増幅には、HCK遺伝子(GCAGGCTCTGAGGACATCATC(配列番号9)及びTTGGTACTGGCTCTCTGTGGC(配列番号10))、MET遺伝子(CATGCCGACAAGTGCAGTA(配列番号11)及びTCTTGCCATCATTGTCCAAC(配列番号12))又はRON遺伝子(GTCAAGGATGTGCTGATTCCC(配列番号13)及びTCTGTGGAGTGAGGTACCTAATG(配列番号14))をプライマーとして用いた。
(2)RA及びOA患者由来のcDNAを鋳型として、サーマルサイクラー(TaKaRa社; TP3000)を用いてPCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(30秒)-60℃(30秒)-72℃(1分)]x 27回 - 72℃(5分))を行った後、PCR産物をアガロースゲル電気泳動し、対応するバンドの濃さをイメージアナライザ(Bio-Rad社; MOLECULAR IMAGER FX)を用いて定量した。
(3)各遺伝子のバンドの定量値は、内在性コントロールであるG3PDHの定量値に対する比として算出し、RA、OAそれぞれの平均値+標準偏差を求めた。HCK遺伝子の定量値(発現量)を図1に、MET遺伝子の定量値(発現量)を図2に、RON遺伝子の定量値(発現量)を図3にそれぞれ示す。
【0036】
その結果、HCK、MET及びRON遺伝子の発現量は、OA患者と比較してRA患者において高かった。このことから、前記サブトラクション法によって同定されたPK遺伝子は、OA患者に比してRA患者において発現が増加していることが確認された。
<実施例3> マウスCIAモデルの滑膜組織における遺伝子発現解析
(1)ヒトRA患者において発現が増加していることが確認されたPK遺伝子が、マウスCIAモデルにおいても発現が増加しているか調べるため、以下の試験を行った。マウスCIAモデルは、ヒトのRAに類似した関節炎を発症することが知られており、RA評価のモデルとして最も一般的に用いられている。
(2)マウスCIAモデルは、6〜7週齢の雄性DBA/1Jマウス(日本チャールズリバー社)の尾根部皮内に、ウシ由来のII型コラーゲン(3mg/ml、0.01M酢酸で溶解したもの)と完全フロインドアジュバントとを等量混和したエマルジョンを150μg/0.1ml注入することによって感作し、さらに初回感作から21日目に追加感作することによって作成した。追加感作の方法は、初回感作と同様である。マウスCIAモデルでは、追加感作後4〜5日目に四肢における炎症が惹起され、追加感作後10〜20日目に炎症がピークになることが知られている。
(3)初回感作の直前(0日)並びに初回感作後20日、23日、27日及び30日目にマウスの足根関節滑膜及び滑膜周辺組織を採取し(各時点においてn=5)、両足分から採取されたサンプルを合わせた後、前記のISOGEN(NIPPON GENE社)法によってRNAを抽出した。
(4)抽出したRNAを鋳型として、SuperSript III First-Strand Synthesis System(Invitrogen社)を用いてcDNAを合成した。
(5)各PK遺伝子の増幅には、HCK遺伝子(GCTGCCAACATCTTAGTCTCTG(配列番号15)及びAGCTGTCCACTTGATGGGGAAC(配列番号16))又はMET遺伝子(CATGCAGACAAGTGCAATATC(配列番号17)及びTTCTTTCCGTCATTGTCCAGC(配列番号18))をプライマーとして用いた。
(6)マウス滑膜及び滑膜周辺組織由来のcDNAを鋳型として、Smart Cycler(TaKaRa社)を用いて、SYBR Green法で定量PCRを行った。酵素としてはSYBR Premix Ex Taq(Perfect Real Time)(TaKaRa社; RR041A)を用い、PCRの反応条件は95℃(30秒)、次いで[95℃(5秒)−60℃(10秒)−72℃(15秒)]からなるサイクルを40回とした。
(7)初回感作の直前(0日)並びに初回感作後20日、23日、27日及び30日目の各時点における各遺伝子の定量値は、内在性コントロールであるG3PDHの定量値に対する比として算出し、平均値±標準偏差を求め、グラフにプロットした。HCK遺伝子の定量値(発現量)を図4に、MET遺伝子の定量値(発現量)を図5にそれぞれ示す。図4及び図5中における直線は、各時点における平均値を結んだものである。
その結果、HCK遺伝子は初回感作後27日目以降、MET遺伝子は初回感作後30日目以降で顕著に発現量が増加していた。
(8)以上の結果から、RA患者からサブトラクションにより同定されたHCK及びMETの各遺伝子は、マウスCIAモデルにおいても発現量が増加していることが確認された。また、これら各PK遺伝子の発現時期は、マウスCIAモデルにおける炎症が惹起される時期と相関していたことから、これら各PK遺伝子はRAの病態にも深く関与していると考えられる。
<実施例4> ラットアジュバントモデルの滑膜組織における遺伝子発現解析
(1)RA患者で発現が増加していることが確認されたPK遺伝子が、ラットアジュバントモデルにおいても発現が増加しているか調べるため、以下の試験を行った。ラットアジュバントモデルは、ヒトのRAに類似した関節炎を発症することが知られており、アジュバント投与後2〜7日目にアジュバントを投与した足で一次炎症が惹起され、投与後14日目以降に両足で二次炎症が惹起されることが知られている。
(2)ラットアジュバントモデルは、6週齢の雄性Lewis系ラット(日本チャールズリバー社)の右後肢足蹠皮下に、完全フロインドアジュバント(6mg/mlの結核(Mycobacterium Butyricum)死菌(DIFCO社)の流動パラフィン懸濁物)0.05mlを注射することによって作成した。
(3)アジュバント投与の直前(0日)並びに注射後2日、7日、10日、15日、28日及び44日目に膝関節滑膜組織を採取し(各時点においてn=3)、前記のISOGEN(NIPPON GENE社)法によってRNAを抽出した。
(4)抽出したRNAを鋳型として、SuperSript III First-Strand Synthesis System(Invitrogen社)を用いてcDNAを合成した。
(5)各PK遺伝子の増幅には、HCK遺伝子(CGTGAAGACCTCAGCTTCCAG(配列番号19)及びGGTCTCGGTGGATGTAGTTCC(配列番号20))、MET遺伝子(CCTGCAGACAAGTGCAGTAT(配列番号21)及びGTTGGACAGTGACGGAAAGA(配列番号22))及びRON遺伝子(GGTCAAGGATGTACTGATTCCC(配列番号23)及びCCAAAGTCAGCCACCTTGACTG(配列番号24))をプライマーとして用いた。
(6)ラット滑膜由来のcDNAを鋳型として、サーマルサイクラー(TaKaRa社; TP3000)を用いて、PCR(反応条件:ExTaq ポリメラーゼ(TaKaRa社:RR001A)とそれに付属のバッファーを用いて、94℃(3分)-[94℃(1分)-60℃(1分)-72℃(1分)]x 28回 - 72℃(5分))を行った後、PCR産物のバンドの濃さをイメージアナライザ(Bio-Rad社; MOLECULAR IMAGER FX)を用いて定量した。
(7)アジュバント投与の直前(0日)並びに注射後2日、7日、10日、15日、28日及び44日目の各時点における各遺伝子の定量値は、内在性コントロールであるG3PDHの定量値に対する比として算出し、平均値±標準偏差を求め、グラフにプロットした。HCK遺伝子の定量値(発現量)を図6に、MET遺伝子の定量値(発現量)を図7に、RON遺伝子の定量値(発現量)を図8にそれぞれ示す。図6〜図8中における直線は、各時点における平均値を結んだものである。
その結果、HCKは、アジュバント投与足においては注射後7日目と15日目に、アジュバント非投与足においては注射後15日目に顕著に発現量が増加していた。またMET遺伝子及びRON遺伝子は、アジュバント非投与足において注射後15日目で顕著に発現量が増加していた。
(8)以上の結果から、RA患者からサブトラクションにより同定されたHCK、MET及びRONの各遺伝子は、ラットアジュバントモデルにおいても発現量が増加していることが確認された。また、これら各PK遺伝子の発現時期は、ラットアジュバントモデルにおいて急性及び慢性の炎症が惹起される時期と相関していたことから、これら各PK遺伝子はRAの病態にも深く関与していると考えられる。
<実施例5> ラットアジュバントモデルの滑膜組織におけるPK遺伝子の局在性解析
(1)RA患者及びRAモデル動物で発現が増加していたPK遺伝子のうち、HCK遺伝子及びMET遺伝子について、RAモデル動物の滑膜組織における発現局在性を確認するために、In situ Hybridizationを行った。
(2)RAモデルとして、前記の方法で作成したラットアジュバントモデルを用いた(アジュバント群)。また対照群として、同じ週齢の正常ラットを用いた(正常群)。
(3)アジュバントの投与後14日目(慢性炎症初期)のラット膝及び足根関節滑膜組織を採取し、ホルマリン溶液で固定した。
(4)固定した組織をトリミングし、常法により骨組織の脱灰処理した後に、パラフィン包埋ブロックを作成した。
(5)アジュバント群及び正常群における、膝及び足根関節滑膜組織の各パラフィンブロックを4μmの厚さで薄切し、スライドグラス上に固定した。
(6)各PK遺伝子のプローブとして以下のものを用い、in vitro transcription法によってRNAを合成した後に、これをDIG RNA Labeling Mix(Roche社)を用いてジゴキシゲニン標識した。
HCK遺伝子:AGCACAGCCAGAAGCCCCATCAGGGCCTTGACATGCTCGACCTGCTGGGCCCACTCTCAGACGCCCCCTCCCCCACATTCCAGCTGTCGAGTGGAGGGAGAGGACTTCACAATCTCTTTTTGACTCTAGTCATCTGCAATCTGCCATTCTCAGGGCCTCCAAGTTAGTGTTTC(配列番号25)
MET遺伝子:TATCCTCCAAGCCGCGTATGTCAGTAAACCAGGGGCCAATCTTGCTAAGCAAATAGGGGCCAGCCCGTATGATGACATTCTCTACGGGGTGTTTGCACAAAGCAAGCCAGATTCTGCTGAGCCCATGAACCGATCAGCGGTCTGTGCATTCCCCATCAAATATGTCAATGACTTCTTCAACAAGATTGTCAACAAAAACAACGTACGGTGTCTCCAGCATTTTTATGGACCCAACCACGAGCACTGTTTCAATAGGACCCTGCTGAGAAATTCATCGGGCTGCGAAGTGCGCAGTGACGAGTACCGGACGGAGTTTACCACAGCGCTGCAGGCTGTGGATTTATTCATGGGCCGGCTCAACCATGTACTCTTGACGTCTATCTCTACCTTCATCAAAGGTGACCTCACCATTGCTAATCTAGGGACATCAGAAGGTCGCTTCATGCAGGTGGTGCTCTCTCGCACAGCACATTTCACCCCCCA(配列番号26)
(7)前記(5)で作製した各組織切片と、前記(6)で作製したジゴキシゲニン標識RNAプローブを用いてIn situ Hybridizationを行った。このプローブの検出は、アルカリホスファターゼ標識した抗ジゴキシゲニン抗体と、酵素基質としてニトロブルーテトラゾリウム(nitro blue tetrazolium;NBT)及びブロモクロロインドイルフォスフェート(bromochloroindoyl phosphate)を用いて行った。
また、ジゴキシゲニン染色後、ケルネヒトロート液(武藤化学薬品株式会社)を用いて核染色した。
(8)その結果、HCK遺伝子及びMET遺伝子のいずれもが、アジュバント群の膝及び足根関節滑膜組織における滑膜細胞、繊維芽細胞のみならず、マクロファージ、リンパ球、顆粒球といった炎症性細胞で発現していることが示された。
(9)滑膜細胞や炎症性細胞は、RAの発症や病態進行に深く関与していることが知られている。RAモデルにおけるこれらの細胞でHCK遺伝子及びMET遺伝子が発現していることからみても、これらのPK遺伝子はRAに深く関与していると考えられる。
<実施例6> 「RAにおいて発現が増加しているPK」の活性を阻害する作用を有する物質の選択1
前記の通り、OA患者に比してRA患者において発現が増加しているPKとして、HCK、MET、RONが同定された。この中でHCKに着目し、その活性を阻害する作用を有する物質としてPP2(4-amino-5-(4-chlorophenyl)-7-(t-butyl)pyrazolo[3,4,d] pyrimidine)を選択し、以下の試験を行った。
(1)RAモデル動物において遺伝子発現が増加しているHCKを阻害することで、モデル動物の病態が改善されるか調べるため、このモデルにPP2(HCK阻害剤)を投与する試験を行った。PP2は、CALBIOCHEM社のもの(HCK IC50=5 nM)を用いた。このPP2はジメチルスルホキシド(DMSO)に溶解されているため、生理食塩水で希釈して投与に用いた(PP2の終濃度:10μg/ml、DMSO終濃度1%)。
(2)RAモデルとして、前記の方法で作成されたラットアジュバントモデルを用いた。アジュバントを投与後、PP2を40μg/4ml/匹(約200μg/kg体重)で腹腔内に連日投与した(PP2群;n=5)。
陽性対照は、アジュバントを投与後、酢酸メチルプレドニソロン(Pfizer社;デポメドロール(登録商標))を2mg/4ml/匹(約10mg/kg体重)で腹腔内に連日投与したものとした(Pred群、n=3)。
また陰性対照は、アジュバントを投与後、1%DMSOを4ml/匹で腹腔内に連日投与したものとした(DMSO群、n=5)。
また対照群は、前記のラットアジュバントモデルと同じ週齢の正常ラットを用い、1%DMSOを4ml/匹で腹腔内に連日投与したものとした(正常群、n=3)。
(3)ラットアジュバントモデルでは炎症に伴って足蹠に浮腫が観察されるため、ラット後肢の足蹠浮腫容積を週3回測定して、病態の改善度の指標とした。各群ともに、各時点における足蹠容積の平均値±標準偏差を、アジュバント非投与足(左足)、アジュバント投与足(右足)別にグラフ化した。アジュバント非投与足(左足)の結果を図9に、アジュバント投与足(右足)の結果を図10にそれぞれ示す。
【0037】
その結果、PP2群では、DMSO群(陰性対照)に比して足蹠浮腫容積が減少していることが示された。
(4)またアジュバント投与後30日目に、ラット後肢(両足)のレントゲン写真を撮影して、足根骨、距踵骨、中足骨及び頸骨における足根骨側の4箇所の骨変性の程度を観察した。骨の変性の程度に応じて、0(無変化)、1(軽度の変性)、2(中度の変性)、3(重度の変性)としたスコア(1匹あたりのスコアの最高は24点となる。)をつけ、両後肢の骨変性の程度を評価し、各群における平均値+標準偏差をグラフ化した。結果を図11に示す。
【0038】
その結果、PP2群では、DMSO群(陰性対照)に比して骨変性スコアが改善していることが示された。
この結果から、RAモデル等において発現量が増加しているPKに対する阻害剤を投与することによって、RAの病態が改善されることが示された。
<実施例7> 「RAにおいて発現が増加しているPK」の活性を阻害する作用を有する物質の選択2
前記の通り、OA患者に比してRA患者において発現が増加しているPKとして、HCK、MET、RON等が同定された。この中でHCK及びMETに着目し、前者の活性を阻害する作用を有する物質としてPP2を、後者の活性を阻害する作用を有する物質としてMETを中和する活性を有する抗体をそれぞれ選択し、以下の試験を行った。
(1)RAモデル動物において遺伝子発現が増加しているPKを阻害することで、モデル動物の病態が改善されるか調べるため、このモデルにPP2(HCK阻害剤)又は抗MET中和抗体(MET阻害剤)を投与する試験を行った。PP2は前記と同じものを用いた。また、抗MET中和抗体は、マウスMETを中和する活性を有する抗体(R&D systems社; AF527)を用いた。この抗MET中和抗体は、生理食塩水で終濃度2mg/mlとしたものを用いた。
(2)RAモデルとして、前記の方法で作成されたマウスCIAモデルを用いた。
初回感作後24日目から39日目の間に、PP2を40μg/0.4ml/匹(約2mg/kg体重)で腹腔内に連日投与した(PP2群;n=10)。またPP2の陰性対照は、初回感作後24日目から39日目の間に3%DMSOを0.4ml/匹で腹腔内に連日投与したものとした(DMSO群、n=10)。
また、初回感作後24日目、27日目、30日目及び33日目に(計4回)、抗MET中和抗体を200μg/0.1ml/匹(約10mg/kg体重)で腹腔内に投与した(抗MET群;n=10)。また抗MET中和抗体の陰性対照は、初回感作後24日目、27日目、30日目及び33日目に(計4回)、抗MET中和抗体のアイソタイプコントロールである正常ヤギIgG(Cappel社; 55926)を200μg/0.1ml/匹(約10mg/kg体重)で腹腔内に投与したものとした(Isotype群、n=10)。
陽性対照は、初回感作後21日目から40日目の間に、酢酸メチルプレドニソロン(Pfizer社;デポメドロール(登録商標))を100μg/0.1ml/匹(約5mg/kg体重)で腹腔内に連日投与したものとした(Pred群、n=5)。
また対照群は、前記のマウスCIAモデルと同じ週齢の正常マウスを用い、試験開始後24日目、27日目、30日目及び33日目に(計4回)、生理食塩水を0.1ml/匹で腹腔内に投与したものとした(正常群、n=3)。
(3)関節炎の病態改善は、四肢における炎症スコア(両足の親指を除く指、甲及び踵並びに両手の親指を除く指及び甲(計22箇所)を観察し、浮腫、発赤の見られた個所に1点をつける。従って、スコアの最高は22点/匹となる。)によって評価した(追加感作の後、週3回評価した。)。
各群及び各時点における炎症スコアの平均値±標準偏差を、HCK評価群(PP2群、DMSO群及びPred群)と、MET評価群(抗MET群、Isotype群及びPred群)に分けてグラフ化した。HCK評価群の結果を図12に、MET評価群の結果を図13にそれぞれ示す。
【0039】
その結果、HCK評価群におけるPP2群では、DMSO群(陰性対照)に比して炎症スコアが改善していることが示された(図12)。またMET評価群における抗MET群でも、Isotype群(陰性対照)に比して炎症スコアが改善していることが示された(図13)。
(4)また初回感作後41日目に、マウス後肢(両足)のレントゲン写真を撮影して、足根骨、距踵骨、中足骨及び頸骨における足根骨側の4箇所の骨変性の程度を観察した。骨の変性の程度に応じて、0(無変化)、1(軽度の変性)、2(中度の変性)、3(重度の変性)としたスコア(1匹あたりのスコアの最高は24点となる。)をつけ、両後肢の骨変性の程度を評価し、各群における平均値+標準偏差をグラフ化した。結果を図14に示す。
【0040】
その結果、HCK評価群におけるPP2群、及び、MET評価群における抗MET群のいずれにおいても、陰性対照(DMSO群又はIsotype群)に比して骨変性スコアが改善していることが示された。
この結果からも、RAモデル等において発現量が増加しているPKに対する阻害剤を投与することによって、RAの病態が改善されることが示された。
<実施例8> 「RAにおいて発現が増加しているPK」の活性を阻害する作用を有する物質の選択3
OA患者に比してRA患者において発現が増加しているPKとして同定されたMETに着目し、抗MET中和抗体以外にMETの活性を阻害する作用を有する物質として、PHA-665752(低分子阻害剤)を選択し、以下の試験を行った。
(1)PHA-665752は、in vitro及びin vivoにおいて、METを特異的かつ強力に阻害することが知られている(Cancer Res., 63(21), 7345-7355(2003)、国際公開第WO02/096361号パンフレット、米国特許第6599902号明細書)。PHA-665752を、これらの文献に記載の方法に従って合成した後、DMSOとポリエチレングリコール(PEG)−400に溶解し、さらにリン酸緩衝生理食塩液(PBS)を添加して、終濃度1mg/mlの溶液として用いた。
(2)RAモデルとして、前記の方法で作成されたマウスCIAモデルを用いた。
初回感作後21日目から42日目の間に、PHA-665752を30 mg/kg(体重)で腹腔内に連日投与した(PHA-665752群;n=10)。陰性対照は、初回感作後21日目から42日目の間に1.5% DMSO/1.5% PEG-400/PBSを30 ml/kg(体重)で腹腔内に連日投与したものとした(Control群;n=10)。
陽性対照は、初回感作後21日目から42日目の間に、酢酸メチルプレドニソロン(Pfizer社;デポメドロール(登録商標))を5 mg/kg(体重)で腹腔内に連日投与したものとした(Pred群;n=5)。
正常群として、前記のマウスCIAモデルと同じ週齢の正常マウスを用い、初回感作後21日目から42日目の間に1.5% DMSO/1.5% PEG-400/PBSを30 ml/kg(体重)で腹腔内に連日投与したものとした(正常群; n=5)。
(3)関節炎及び骨変性の改善は、初回感作後42日目に、前記<実施例7>に記載の方法で評価し、各群におけるスコアの平均値と標準偏差をグラフ化した。関節炎に関する結果(平均値±標準偏差)を図15に、骨変性に関する結果(平均値+標準偏差)を図16にそれぞれ示す。
その結果、PHA-665752群では、四肢における関節炎のスコアがControl群に比して改善していることが示された(図15)。また骨変性についても、PHA-665752群はControl群に比して改善していることが示された(図16)。
この結果からも、RAモデル等において発現量が増加しているPKに対する阻害剤を投与することによって、RAの病態が改善されることが示された。またこの結果は、中和抗体、低分子阻害剤といった異なる機序でMETを阻害する複数の物質が、いずれもRAの病態改善に対して効果を発揮することを示すものでもある。このことから、METをはじめとする「OA患者に比してRA患者において発現が増加しているPK」の阻害剤は、その種類を問わず、RAの病態改善に有効であることが示された。
以上の結果から、「RAに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が増加しているPK」の活性を阻害する作用を有する物質を選択することにより、当該物質をRAに対する処置剤の有効成分の候補とすることができることが示された。
【図面の簡単な説明】
【0041】
【図1】HCK遺伝子の発現量(RA、OA患者滑膜)を示す図である。
【図2】MET遺伝子の発現量(RA、OA患者滑膜)を示す図である。
【図3】RON遺伝子の発現量(RA、OA患者滑膜)を示す図である。
【図4】HCK遺伝子の発現の変化(マウスCIAモデル)を示す図である。
【図5】MET遺伝子の発現の変化(マウスCIAモデル)を示す図である。
【図6】HCK遺伝子の発現の変化(ラットアジュバントモデル)を示す図である。
【図7】MET遺伝子の発現の変化(ラットアジュバントモデル)を示す図である。
【図8】RON遺伝子の発現の変化(ラットアジュバントモデル)を示す図である。
【図9】HCK阻害剤(PP2)投与による足蹠容積(ラットアジュバントモデル;アジュバント非投与足(左足))を示す図である。
【図10】HCK阻害剤(PP2)投与による足蹠容積(ラットアジュバントモデル;アジュバント投与足(右足))を示す図である。
【図11】HCK阻害剤(PP2)投与による骨変性スコア(ラットアジュバントモデル)を示す図である。
【図12】HCK阻害剤(PP2)投与による炎症スコア(マウスCIAモデル)を示す図である。
【図13】抗MET中和抗体投与による炎症スコア(マウスCIAモデル)を示す図である。
【図14】HCK阻害剤(PP2)又は抗MET中和抗体投与による骨変性スコア(マウスCIAモデル)を示す図である。
【図15】MET阻害剤(PHA-665752)投与による炎症スコア(マウスCIAモデル)を示す図である。
【図16】MET阻害剤(PHA-665752)投与による骨変性スコア(マウスCIAモデル)を示す図である。
【特許請求の範囲】
【請求項1】
以下のステップを少なくとも含むことを特徴とする、関節リウマチに対する処置剤の有効成分の候補となる物質のスクリーニング方法;
「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」の活性を調節する作用を有する物質を選択するステップ。
【請求項2】
前記のステップの前に、さらに以下のステップを含むことを特徴とする、請求項1に記載のスクリーニング方法;
「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」を選択するステップ。
【請求項3】
「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」を選択するステップが、遺伝子サブトラクション法によって行われることを特徴とする、請求項2に記載のスクリーニング方法。
【請求項4】
遺伝子サブトラクション法が、「『遺伝子サブトラクションのターゲットとするタンパク質キナーゼ遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」が結合している遺伝子サブトラクション用の担体を用いて行われることを特徴とする、請求項3に記載のスクリーニング方法。
【請求項5】
タンパク質キナーゼが、チロシンキナーゼ及びセリン/スレオニンキナーゼからなる群から選ばれる1又は2以上のタンパク質キナーゼであることを特徴とする、請求項1〜4のいずれか1項に記載のスクリーニング方法。
【請求項6】
「変化」が「増加」であり、かつ、「調節」が「阻害」である、請求項1〜5のいずれか1項に記載のスクリーニング方法。
【請求項7】
「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が増加しているタンパク質キナーゼ」が、HCK、MET及びRONからなる群から選ばれる1又は2以上のタンパク質キナーゼであることを特徴とする、請求項6に記載のスクリーニング方法。
【請求項1】
以下のステップを少なくとも含むことを特徴とする、関節リウマチに対する処置剤の有効成分の候補となる物質のスクリーニング方法;
「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」の活性を調節する作用を有する物質を選択するステップ。
【請求項2】
前記のステップの前に、さらに以下のステップを含むことを特徴とする、請求項1に記載のスクリーニング方法;
「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」を選択するステップ。
【請求項3】
「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が変化しているタンパク質キナーゼ」を選択するステップが、遺伝子サブトラクション法によって行われることを特徴とする、請求項2に記載のスクリーニング方法。
【請求項4】
遺伝子サブトラクション法が、「『遺伝子サブトラクションのターゲットとするタンパク質キナーゼ遺伝子ファミリーに共通なヌクレオチド配列』にアニーリングするヌクレオチド配列を保持する核酸」が結合している遺伝子サブトラクション用の担体を用いて行われることを特徴とする、請求項3に記載のスクリーニング方法。
【請求項5】
タンパク質キナーゼが、チロシンキナーゼ及びセリン/スレオニンキナーゼからなる群から選ばれる1又は2以上のタンパク質キナーゼであることを特徴とする、請求項1〜4のいずれか1項に記載のスクリーニング方法。
【請求項6】
「変化」が「増加」であり、かつ、「調節」が「阻害」である、請求項1〜5のいずれか1項に記載のスクリーニング方法。
【請求項7】
「関節リウマチに罹患している動物の細胞において、これに罹患していない動物の細胞に比して発現が増加しているタンパク質キナーゼ」が、HCK、MET及びRONからなる群から選ばれる1又は2以上のタンパク質キナーゼであることを特徴とする、請求項6に記載のスクリーニング方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2009−89697(P2009−89697A)
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願番号】特願2007−266133(P2007−266133)
【出願日】平成19年10月12日(2007.10.12)
【出願人】(000195524)生化学工業株式会社 (143)
【Fターム(参考)】
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願日】平成19年10月12日(2007.10.12)
【出願人】(000195524)生化学工業株式会社 (143)
【Fターム(参考)】
[ Back to top ]

