有効物質を徐放する3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール含有医薬
【課題】3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールをマトリックスの形で含有する、有効物質を徐放する薬学的調合物の提供。
【解決手段】マトリックスは薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%を含有し、試験内で次の分解速度を示す:0.5時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール3−35重量%(100重量%有効物質に対して)を放出し、1時間後、5−50重量%を放出し、2時間後、10−75重量%を放出し、3時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール15−82重量%を放出し、6時間後、30−97重量%を放出し、12時間後、50重量%より多くを放出し、
18時間後、70重量%より多くを放出し、24時間後、80重量%より多くを放出する。
【解決手段】マトリックスは薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%を含有し、試験内で次の分解速度を示す:0.5時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール3−35重量%(100重量%有効物質に対して)を放出し、1時間後、5−50重量%を放出し、2時間後、10−75重量%を放出し、3時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール15−82重量%を放出し、6時間後、30−97重量%を放出し、12時間後、50重量%より多くを放出し、
18時間後、70重量%より多くを放出し、24時間後、80重量%より多くを放出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩のうちの1つをマトリックスの形で含有する、有効物質を徐放する薬学的調合物に関する。
【背景技術】
【0002】
3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは特許文献1:欧州特許第0693475号明細書から鎮痛に有効な医薬として公知であり、そして経口投与することができる。3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの経口投与に通常の調合物は胃腸経路で有効物質の急速な放出を生じ、その結果として鎮痛作用がすぐに開始される。それと同時に作用の急速な減少が観察される。したがって3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールを用いる強い慢性痛の治療は、患者の血清中で十分な有効物質濃度を保証するために、従来比較的短い間隔で、たとえば1日に4〜6回薬を投与しなければならない。しかし頻繁な投薬の必要性は投薬に際して間違いが起こりやすくなり、望まれない血清濃度の変動を生じる。これは患者の薬剤服用順守及び治療効果に、特に慢性痛状態の治療で有害である。したがって有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの経口投与のための遅延された遊離を有する医薬投与形(徐放性調合物)が望まれる。
【0003】
公知技術において、一般に多数の種々の有効物質に対する徐放性調合物は公知である。通常の徐放性調合物は特にコーティング徐放剤及びコーティング徐放剤である。
【0004】
たとえば特許文献2:ドイツ特許公開第3625458号公報に記載されているようなコーティング徐放剤の場合、薬学的調合物の有効物質を含有する核は、1種以上の親水性又は疎水性ポリマーから有効物質の遊離を遅延させるコーティングを有する。
【0005】
マトリックス徐放剤の場合、有効物質の遊離を調節する、1種以上の担体材料から形成されたマトリックスの形で有効物質を含有する。たとえば特許文献3:ドイツ特許公開第3309516号公報には担体材料として及び部分的に有効物質の徐放担体材料としてヒドロキシプロピルメチルセルロース(HPMC)を用いるマトリックス調合物の製造方法が開示され、この際、この担体材料は調合物の重量の3倍より多くならず、そしてこれは16−24重量%のメトキシ含量、4−32重量%のヒドロキシプロピル含量及び少なくとも50.000の数値上の平均分子量を有する、ヒドロキシプロピルメチルセルロース少なくとも1個からなる。ドイツ特許公開第3309516号公報に開示された調合物に含有される、15〜30.000cPs(15〜30.000mPa・s)の粘度(20℃で2重量%水溶液中で)のHPMCsを含有する。溶解媒体のpH値に依存しない遊離挙動は特許文献3:ドイツ特許公開第3309516号公報に開示されていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】欧州特許第0693475号明細書
【特許文献2】ドイツ特許公開第3625458号公報
【特許文献3】ドイツ特許公開第3309516号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
したがって、本発明の課題は3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールを含有する、有効物質を徐放する薬学的調合物を調製することである。
【課題を解決するための手段】
【0008】
この課題は、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を有効物質を徐放するマトリックスの形で含有する、徐放性薬学的調合物において、マトリックスが薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%、好ましくは5〜80重量%を含有し、次の放出速度を有する(この速度は試験内で欧州薬局方パドル法(Ph.Eur.Paddle Method)の使用下でpH−値6.8及び37℃で緩衝液(欧州薬局方による)中で75U/分で及びUV−スペクオトロメトリー検出下で測定される):
0.5時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール3−35重量%(100重量%有効物質に対して)を放出し、
1時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール5−50重量%を放出し、
2時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール10−75重量%を放出し、
3時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール15−82重量%を放出し、
6時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール30−97重量%を放出し、
12時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール50重量%より多くを放出し、
18時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール70重量%より多くを放出し、
24時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール80重量%より多くを放出する、
ことを特徴とする、上記薬学的調合物によって解決される。
【0009】
驚くべきことに、本発明の有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは経口投与で徐放され、したがって少なくとも12時間間隔での投与に適当である。したがって、本発明の調合物は痛みの治療を可能にする。その治療経過で鎮痛薬3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールが僅かに1日1回、たとえば24時間間隔で、又は1日2回、好ましくは12時間間隔で有効物質の十分な血漿濃度を保証するために投与しなければならない。対応する作用時間及び十分な血中濃度の持続は刺激の研究及び実験に基づく検査によって裏付けられる。
【0010】
その場合、特に驚くべきことには、本発明の調合物は徐放に基づき長時間持続する治療の有効性を比較的長い時間(少なくとも12時間)にわたって保証するばかりでなく、同時に医薬の最初の服用で血漿中に有効物質の速やかな上昇(Anfluten)を可能にする。これは患者の急速な痛みの緩和を生じる(“急速な開始”)。したがって痛みを患う患者に本発明の調合物を投与した場合その痛みを急速に緩和することができ、その時鎮痛作用が同様に急速に再び低下しない。したがって、本発明の調合物は即座に有効物質を放出する調合物の特性(医薬の投与直後に十分に高い有効物質濃度によって痛みが急速に緩和される)と徐放性調合物の特性(より長い時間にわたって十分に高い有効物質濃度に基づく長時間持続する鎮痛作用)を一体化する。したがって痛みを患う患者は、本発明の調合物形での鎮痛剤の服用によってその痛みを有効に急性に克服することができ、そして同時に別の処置をすることなくかつ12(又は24)時間間隔で規則正しく服用するだけでより長い時間にわたって効果的に治療することができる。
【0011】
本発明の調合物の有効物質は徐放性マトリックスの形で含有される。しかし有効物質を通常の放出挙動を有するマトリックスの形で含有し、徐放をコーティング徐放によって達成させることも考えられる。
【0012】
別の可能性の場合、徐放挙動は浸透作用する放出システムによって達成される。
本発明の調合物が徐放性マトリックスを含有する場合、マトリックスは薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%を有し、たとえばゴム、セルロースエーテル、セルロースエステル、アクリル樹脂、蛋白質由来の材料、脂肪、ロウ、脂肪アルコール又は脂肪エステルを有する。マトリックス形成剤としての疎水性ポリマーを使用する場合、マトリックスはマトリックス形成剤5〜8重量%を有するのが好ましい。
【0013】
本発明の別の対象は、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を、有効物質を徐放するマトリックスの形で含有する、徐放性薬学的調合物であって、その際マトリックスが薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%、特に5〜80重量%を含有し、そしてこれは薬学的に許容し得るマトリックス形成剤としてセルロースエーテル及び(又は)セルロースエステルを有し、これは2重量%水溶液の形で20℃で粘度3.000〜150.000mPa・sを有することを特徴とする(この場合粘度測定は欧州薬局方にしたがってキャピラル−ビスコメーターを用いて行う)。この調合物は上記の本発明の放出プロフィールを有する。
【0014】
薬学的に許容し得るマトリックス形成剤として2重量%水溶液の形で20℃で粘度50.000〜150.000mPasを有するセルロースエーテル及び(又は)セルロースエステルを使用するのが好ましい。
【0015】
特に適する薬学的に許容し得るマトリックス形成剤は、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース(HPC)、メチルセルロース、エチルセルロース及びカルボキシメチルセルロースよりなる群から選ばれ、特にHPMCs、ヒドロキシエチルセルロース及びHPCsよりなる群から選ばれる。最も好ましくは2重量%水溶液の形で20℃で測定された粘度約100.000mPa・sのHPMCsである。
有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールはそのまま、すなわち遊離塩基として、しかもまた薬学的に許容し得る塩の形で、たとえば塩酸塩として存在することができる。遊離塩基の製造は欧州特許公開第0693475号公報から公知である。欧州特許公開第0693475号公報に薬学的に許容し得る塩(たとえば塩酸塩)の製造が開示されていない場合にかぎり、これらは公知技術で通常の周知の方法を用いて遊離塩基から出発して得られる。
【0016】
3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは、2個の不斉中心を有するので、この化合物は4つの異なる立体異性体の形で存在することができる。本発明の調合物において、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールを任意の混合割合での4つのジアステレオマーすべての混合物として、しかしまた4つの立体異性体のうちの2又は3つの混合物として又は立体異性体純粋な形で存在することができる。この際、好ましい立体異性体は(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール及び(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールであって、これらは本発明の調合物において、混合物として、特に1:1−混合物(ラセミ化合物)として、又は特に好ましくは異性体純粋な形で存在することができる。したがって“有効物質”とは本発明の目的に関して、種々のその立体異性体の混合物として又はその純粋な立体異性体の1つとして、それぞれ遊離塩基として又は薬学的に許容し得る塩の形での3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールを意味する。
【0017】
本発明の医薬において、徐放性有効物質含量が好ましくは0.5〜85重量%及び薬学的に許容し得るマトリックス形成剤の含量は8〜40重量%である。徐放性有効物質含量が3〜70重量%、特に8〜66重量%及び薬学的に許容し得るマトリックス形成剤の含量が10〜35重量%、特に10〜30重量%であるのが特に好ましい。有効物質として対掌体純粋な(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール((+)- 又は(−)−対掌体と大過剰の(+)- 対掌体の混合物)を使用した場合、有効物質含量は下限、すなわち0.5〜25重量%(全重量に対して)であるのが特に好ましい。有効物質として対掌体純粋な(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール((+)- 又は(−)−対掌体と大過剰の(−)- 対掌体の混合物)を使用した場合、有効物質含量は16〜66重量%であるのが特に好ましい。
【0018】
本発明の調合物のマトリックスのその他の成分は場合により消化のよい長鎖の(すなわち炭素原子8〜50個、好ましくは12〜40個の)置換されていないか又は置換された炭化水素、たとえば脂肪アルコール、脂肪酸グリセリルエステル、鉱油及び植物油、並びにロウであることができ、この際融点25−90℃の炭化水素が好ましい。脂肪アルコールが特に好ましく、さらに特にラウリルアルコール、ミリスチルアルコール、ステアリルアルコール、セチルアルコール及びセチルステアリルアルコールである。マトリックス中のその含量は0〜60重量%である。あるいは又は付加的にポリエチレングリコールをマトリックス中に0〜60重量%の含量で含有することもできる。
【0019】
更に本発明の薬学的調合物において、その他の成分として薬学的に慣用の助剤、たとえば充填剤、たとえばラクトース、微晶質セルロース(MMC)又はリン酸水素カルシウム、減摩剤(Gleitmittel)、滑沢剤及び流動調節剤、たとえばタルク、ステアリン酸マグネシウム、ステアリン酸及び(又は)高分散性二酸化ケイ素を含有することができ、その錠剤中の全含量は0〜80重量%、好ましくは5〜65重量%である。
【0020】
しばしば有効物質の投与形からの放出速度は放出媒体のpH値に依存する。これは医薬の胃腸通過の間1以下で1に近い値から約8(von unter 1 bis etwa 8) のpH値範囲内を変動する。この変動はそれぞれの服用するヒトによって異なってよい。また服用ごとに同一のヒトの場合、種々のpH値−時間−プロフィールを胃腸通過の間に生じることができる。医薬からの有効物質の放出速度はpH値に依存するので、これは生体内で種々の放出速度を生じ、それによって種々のバイオアベラビリティーを生じる。しかし本発明の薬学的調合物からの有効物質の放出プロフィール(塩基の形で又はその薬学的に許容し得る塩の1つ)は驚くことにpH値に依存しない。たとえばこれは生理学的に胃腸通過の間に発生する。1.2、4.0及び6.8の環境−pH値での放出プロフィールは、相互に同一か又はpH1.2からpH2.3以上で2.3に近い値(von pH 1.2 ueber pH 2.3) 及びpH6.8〜pH7.2までのpH値−時間−プロフィールの間の放出に比べて同一である。
【0021】
好ましくは錠剤形で存在する本発明の調合物からの有効物質の徐放を達成するために、有効物質、マトリックス形成剤及び任意の成分に対してその他に錠剤の大きさ及び組成を変えない場合、充填剤として水溶性充填剤、たとえばラクトース、不溶性の、水性媒体中で膨潤しない充填剤、たとえばリン酸水素カルシウム、又は不溶性の、水性媒体中で膨潤する充填剤、たとえば微結晶セルロースを使用するかどうかは重要でないことが分かった。このような医薬すべては、相互に対応する放出挙動を示す。
【0022】
更に、驚くべきことは、所定の有効物質量での本発明の調合物において、マトリックス形成剤の量及び任意の成分の量はそれぞれ比較的大きい範囲にわたって、少なくとも12時間の又は1日2回投与での治療効果を疑うことなく(有効物質、マトリックス形成剤及びその他の任意の成分に対する上記量制限が維持されているかぎり)変動することができることである。少なくとも12時間にわたる有効性は、たとえば(調合物全体の重量に対して)約32.25重量%の有効物質含量の場合、マトリックス形成剤としての100.000mPa・sの粘度のHPMC12.9重量%及び充填剤として約52.6重量%のたとえばMCC含量からなる調合物中で及び同一のHPMC約25.8重量%及びMCC(又はラクトース一水和物)約39.7重量%からなる調合物中で更に加えて同量の減摩剤、滑沢剤及び流動調節剤と共に保証される。上記制限内でより高い又はより少ない有効物質含量の本発明の調合物に対しても同等のことがいえる。
【発明の効果】
【0023】
本発明の有効物質を徐放する調合物の投与の際にヒト検体で有効物質に対する高い初回通過効果にかかわらず予期に反して即座に有効物質を放出する調合物に比べて変わらないバイオアベラビリティーが達成されることも観察され、非常に驚くべきことである。
【0024】
さらに、調合物の経口投与後に生体内で血漿濃度−時間−図表中のそのtmax 値が2〜10時間、特に3.5〜6時間、特に好ましくは4〜5.5時間である、すなわちそのピーク−血漿−レベルが上記時間枠内で生じるような本発明の調合物が好ましい。
【0025】
本発明の調合物は有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールをそのまま及び(又は)その薬学的に許容し得る塩として投薬単位あたり通常2.5mgな800mg、特に5〜400mg、まさに特に好ましくは10〜250mg(塩酸塩としての有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの重量)を含有する。この際本発明の調合物の放出挙動は、上記含量制限が維持されているかぎり有効物質の正確な量によって左右されない。2つの特に好ましい対掌体(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール及び(−)−(1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの異なる作用強度に基づき、より作用の強い(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは2.5mgな80mg、特に5〜40mg、まさに特に好ましくは10〜25mgの有効物質(その塩酸塩に対して)の量で本発明の調合物中に存在し、一方(−)−(1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは好ましくは25mgな800mg、特に50〜400mg、まさに特に好ましくは100〜250mgの有効物質(その塩酸塩に対して)の量で本発明の調合物中に存在し、但し上記含量制限が維持されているという条件つきである。
【0026】
有効物質の薬学的に許容し得る(又は容認された)塩は本発明の範囲において、医療適用で生理学的に(特に哺乳類及び(又は)ヒトに適用した場合)許容し得る有効物質の塩である。このような薬学的に許容し得る塩はたとえば無機又は有機酸と共に形成することができる。
【0027】
本発明の薬学的調合物は簡単な錠剤として及びコーティング錠剤として、たとえばフィルム錠剤又はドラジェとして存在することができる。驚くべきことに錠剤は丸く、そして両凸である:錠剤の分割を可能にする長方形の錠剤形もありうる。更に、顆粒、回転楕円体、ペレット又はマイクロカプセルも可能であって、これらは小袋又はカプセル中に詰められるか又は圧縮して崩壊する錠剤とすることができる。
【0028】
コーティング錠剤のために、1個以上のコーティング層を使用することができる。コーティング材料として、約1〜100mPa・sの低粘度及び<10.000の低分子量の公知のヒドロキシプロピルメチルセルロース(たとえば20℃で2重量%水溶液の形で粘度6mPa・sのPharmacoat606)が適当であり、これは本発明の医薬の放出プロフィールにほんの僅かに影響を与える。当業者に周知の拡散被覆処理、たとえば膨潤する、しかし水不溶性ポリ(メタ)アクリレートを主体とする拡散被覆処理は本発明の薬学的調合物からの有効物質放出の遅延の調節を生じる。好ましくは0.5〜85重量%、特に好ましくは3〜70重量%、まさに特に好ましくは8〜66重量%の有効物質含量を有し、有効物質を徐放的に放出する有効物質含有錠剤核を付加的な有効物質(これは徐放されず、最初の薬用量として放出される)と共に種々の、当業者に周知の方法、たとえば溶液又は懸濁液からの糖衣化、噴霧によって又は粉末塗布処理によって包むことができる。所望の徐放に関して、有効物質の同時の急速な上昇で本発明の薬学的調合物の最初の投与で速やかに痛みを緩和するために必ずしも必要でない。その他の実施形態は多層錠剤及びコーティング錠剤である。この場合好ましくは0.5〜85重量%、特に好ましくは3〜70重量%、まさに特に好ましくは8〜66重量%の有効物質含量の多層錠剤の1個以上の層中に又は好ましくは0.5〜85重量%、特に好ましくは3〜70重量%、まさに特に好ましくは8〜66重量%の有効物質含量の核中に含まれる3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩の1つを薬学的に許容し得るマトリックス形成剤によって徐放し、そして多層錠剤の1個以上の層中の又はコーティング錠剤の外側のコーティング層中の有効物質の放出を徐放的に行わない。多層錠剤及びコーティング錠剤は1種以上の有効物質不含コーティングを含有することができる。
【0029】
徐放性薬学的調合物中の徐放性マトリックスの代わりに、普通に放出するマトリックスを使用することは有効物質の放出を徐放するコーティングによって可能となる。その際たとえば有効物質を微結晶セルロース及び場合によりその他の医薬助剤、たとえば結合剤、充填剤、減摩剤、滑沢剤及び流動調節剤からなる通常のマトリックス中に含有させることができる。これらの助剤は有効物質の徐放を水性媒体中で調節する材料でコーティングされているか又は層をなしている。適する結合剤はたとえば水不溶性ロウ及びポリマー、たとえばポリメタアクリレート[Eudragit(ユードラギット) 等々]又は水不溶性セルロース、特にエチルセルロースである。場合によりコーティング材料中に水溶性ポリマー、たとえばポリビニルピロリドン、水溶性セルロース、たとえばヒドロキシプロピルメチルセルロース又はヒドロキシプロピルセルロース、その他の水溶性剤、たとえばポリソルベート80又は親水性細孔形成剤、たとえばポリエチレングリコール、ラクトース又はマンニトールを含有することもできる。
【0030】
徐放性薬学的調合物中に徐放性マトリックス又は有効物質の放出を徐放するコーティングを有する通常に放出するマトリックスと共に又はこれに加えて、浸透作用する放出システムを徐放を達成するために使用することもできる。このような、好ましくは経口の、放出システムにおいて、放出システムの少なくとも1個の表面、好ましくは表面全体(好ましくはこれは放出媒体と接触するか又は接触することができる)は半透過性表面であり、好ましくは半透過性コーティングが付与されているので、放出媒体に対する表面は透過性であるが、有効物質に対しては実質上好ましくは完全に非透過性である。この場合表面及び(又は)場合によりコーティングは、少なくとも1個の孔を有効物質の放出のために有する。有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩、好ましくは(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩及び(又は)(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩あるいはその混合物はその際(必ずではないが)マトリックスの形で存在することができる。これは好ましくは放出孔、浸透性医薬核、半透過性膜及びポリマー部分を有する錠剤形の系(圧縮される)を意味する。その際このような系の良好な、好ましい例は、ALZA corporation(USA)のOROS(R) −system、そのインターネットシーン又はOROS(R) −systemに関するその他の製品情報の個々のものを含む。とくにこれらはまたOROS(R) Push−PullTM−system,OROS(R) Delayed Push−PullTM−system,OROS(R) Multi−Layer Push−PullTM−system,OROS(R) Push−Stick Systemであり、あるいはまた特定の問題がある場合はL−OROSTMである。浸透作用の放出システムの具体的製造の実施態様及び例は米国特許第4,765,989号明細書、第4,783,337号明細書及び第4,612,008号明細書から引用され、全体が本発明を説明するための構成要素である。
【図面の簡単な説明】
【0031】
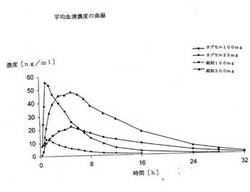
【図1】図1は臨床実験で測定された平均血清濃度の経過を示す。
【発明を実施するための形態】
【0032】
本発明の調合物はたとえば次の一般法にしたがって製造することができる:
調合物の成分(有効物質、マトリックス形成剤及び任意の成分)を順番に計量し、ついで慣用の篩い機で篩分する。ここでたとえば篩い機Quadro Comil U 10 を使用することができる。この際使用する篩いサイズは約0.813mmである。ついで篩いをコンテナー混合機中で、たとえばBohle コンテナーミキサー(Containermischer)中で混合する。典型的な作業条件で行う:回転数20±1U/分で持続時間約15分±45秒。その後、得られた粉末混合物を錠剤圧縮機で圧縮して錠剤とする。これに対して直径10mmのドラジェアーチ形のドーム(rundstempel)を備えた錠剤圧縮機 Korsch EKO を使用する。あるいは粉末混合の圧縮、ついで圧縮物の篩分(Comil 3mm 摩擦薄刃篩、ついで1.2mm円形細孔篩)を行うこともできる。この場合生じる顆粒を引き続き上記のように滑沢剤(たとえばステアリン酸マグネシウム)の添加下にたとえば10mmドームを備えたEK0錠剤圧縮機で圧縮する。顆粒化を水性溶剤又は有機溶剤をベースとする湿式顆粒化によっても行うことができる。その際適当な結合剤含有又は不含の水性溶剤が好ましい。製造処理を容易にその都度の要求及び所望の投与形態に従来技術で周知の方法にしたがって適合させることができる。
【0033】
本発明の薬学的調合物の製造は得られた調合物(これは3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を含有する)の放出特性の高い再生産性の点で優れている。ICH Q1AR−安定性−テスト−ガイドラインによる通常の保存条件下で少なくとも1年の保存期間の間、本発明の医薬の放出プロフィールは安定を示す。
【0034】
患者が本発明の薬学的調合物を1日1〜2回服用した場合、良好な治療有効性は持続する強い痛みに対して確実に得られる。
【実施例】
【0035】
以下に例によって本発明及び好ましい実施態様を説明するが、本発明の保護範囲はこれによって限定されない。
【0036】
例1
錠剤あたり次の組成のマトリックス形成剤を錠剤1000個の仕込みサイズで下記方法で製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 123mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
すべての成分を計量し、篩い機Quadro Comil U 10 で篩いサイズは約0.813mm下で篩分し、コンテナー混合機(Bohle LM40)中で回転数20±1U/分で15分±15秒混合し、Korsch EKO圧縮機で圧縮して、直径10mm、アーチ半径8mm及び平均錠剤重量310mg のドラジェアーチ形錠剤とする。
【0037】
試験管内放出を欧州薬局方パドル法の使用下で37℃で欧州薬局方による緩衝液pH6.8 900ml中で75U/分で、そしてUV−分光光度検出器を用いて測定し、その結果を次の表に示す。
時間(分) 有効物質の放出された全量(%)
0 0
30 18
60 27
120 41
180 50
240 59
360 71
480 80
600 87
720 93
例2
錠剤あたり次の組成のマトリックス錠剤3000個を例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 200mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 23mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 19
60 30
120 46
180 58
240 68
360 84
480 93
720 99
例3
錠剤あたり次の組成のマトリックス錠剤を錠剤3000個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 40mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 163mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1のように測定する;その他は同一条件下で別の放出を50U/分及び100U/分の攪拌速度で測定する。
時間(分)50U/分で有効物質 70U/分で有効物質 100U/分で有効物質
の放出された全量(%) の放出された全量(%) の放出された全量(%)
0 0 0 0
30 20 20 21
60 35 33 35
120 54 51 53
180 67 63 66
240 76 73 76
360 89 87 89
480 97 95 97
600 100 100 100
例4
錠剤あたり次の組成のマトリックス錠剤を錠剤200個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mgラクトース一水和物 (Fa. Meggle) 123mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 16
60 26
120 39
180 49
240 57
360 71
480 81
600 87
720 92
例5
錠剤あたり次の組成のマトリックス錠剤を錠剤100個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 40mgCellactose(Fa. Meggle) 163mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 18
60 31
120 48
180 61
240 71
360 84
480 91
600 95
720 97
例6
錠剤あたり次の組成のマトリックス錠剤を錠剤200個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 50mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 40mg
Ludipress (Fa. BASF) 123mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 17
60 27
120 40
180 51
240 59
360 72
480 82
600 89
720 93
例7
錠剤あたり次の組成のマトリックス錠剤を錠剤200個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 50mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 40mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 163mg
ラクトース 200 (Fa. Meggle) 50mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 18
60 31
120 49
180 61
240 70
360 82
480 90
600 94
720 96
例8
錠剤あたり次の組成のマトリックス錠剤を錠剤200個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
Cellactose(Fa. Meggle) 72.5mg
ヒドロキシエチルセルロース
(Natrosol 250 HX (Fa. Herkules) 12.5mg
CutinaHR(Fa. Henkel) 130mg
タルク 3mg
ステアリン酸マグネシウム 2mg
全量 320mg
有効物質、セルラクトース、Natrosol及びCutinaを混合し、ついで乾燥棚で80℃に加熱し、Kenwood Chef−Kuecken混合機で顆粒化する。冷却された顆粒を1mmの篩によって篩分する。ステアリン酸マグネシウム及びタルクとの混合した後、顆粒をEK0 Exzeterpresse (Korsch)で圧縮して6×15mmのサイズの、折れ目線(Bruckkerbe) のある長方形錠剤となす。
【0038】
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 28
60 39
120 56
180 68
240 80
360 97
390 99
例9
錠剤あたり次の組成のマトリックス錠剤を錠剤100個の仕込みサイズで例1に記載した方法にしたがって製造する:
(+)- (1S、2S)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 10mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 213mg
ラクトース 200 (Fa. Meggle) 50mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 15
60 24
120 36
180 44
240 51
360 61
480 69
600 75
720 79
例10
錠剤あたり次の組成のマトリックス錠剤を錠剤100個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 63mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 250mg
試験管内放出を次の条件下で測定する。
(A)欧州薬局方パドル法の使用下で37℃でUSP 22による緩衝液pH7.2 900ml中で75U/分で、そしてUV−分光光度検出器を用いて測定する。
(B)75U/分で欧州薬局方パドル法の使用下、この際0−30分、pH1.2;30−120分、pH2.3;120−180分、pH6.5及び残りの試験時間pH7.2を調整する。錠剤は2つの試験条件に対して結果を示す:
時間(分) 条件(A)下で有効物質 条件(B)下で有効物質
の放出された全量(%) の放出された全量(%)
0 0 0
30 19 20
60 29 30
120 43 44
180 54 55
240 63 65
360 78 80
480 87 90
600 94 97
720 98 100
試験から、本発明の調合物の放出挙動が放出媒体のpH値に依存しないことが分かった。
【0039】
例11
次の組成のペレットを以下のようにして製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
低度に置換されたヒドロキシプロピルメチルセルロース
(L-HPC LH 31 (Fa. Shinetsu)) 75mg
Aquacoat (水性エチルセルロース−分散液 (Fa. FMC)
( 乾燥物質として計算) 20mg
微結晶セルロース(Avicel PH102 (Fa.FAFMC)) 75mg
ジブチルセバケート(DBS) 4mg
トゥイーン 80 0.4mg
全量 274.4mg
有効物質、Avicel及びL−HPCをプラネットミキサー(Kenwood K-Mischer)で10分混合し、ついで水を用いて顆粒化する。湿性顆粒を0.8×0.8mm鋳型のあるNica押出機で押し出し、ついで10分Nica−球形機で500U/分で丸める(負荷1kg)。ペレットを一晩50℃で乾燥棚中で乾燥させ、ついで篩フラクションを分類する。
【0040】
大きさ0.6−1.0mmのペレット(収率約95%)をWSG(Wurstereinsatzを備えたGlatt GPCG1 ) で供給温度60℃(生成物温度40℃)でAquacoat及びDBS(Aquacoat固体顆粒に対して計算して20%)からなる水性分散液を用いてコーティングし、それによって9.8%の重量増加(出発重量に対して)を示す。分散液の製造は製造業者(FA.FMC)の指示にしたがって行う。この場合DBSをトゥイーン80と一緒に水のアリコート中で均質化し、ついで希釈されたAquacoat分散液に加える。完成した分散液は20重量%の固体含量を有し、少なくとも3時間攪拌する。コーティングペレットをWSGで乾燥させ、乾燥棚中で暖める(60℃で2時間)。放出の試験を例1と同様に行うが100U/分で小カゴ(Koerbchen)法によってしたがって行う。
時間(分) 有効物質の放出された全量(%)
0 0
30 5
60 15
120 28
180 43
240 56
360 73
480 82
600 87
720 90
臨床試験
単中心の開放された無作為化された単一薬用量−4−法−クロスオーバー−研究で、薬物動態学データの測定のために(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール−塩酸塩(有効物質)の種々の投与形を18〜45歳の16人の男性白人に投与する。データの実験にようる測定はHPLC−分析を用いて行う。
“カプセル100mg”:有効物質を即座に放出し、有効物質含量100mgのカプセル、
“カプセル25mg”:有効物質を即座に放出し、有効物質含量25mgのカプセル、
“錠剤100mg”:例1による錠剤(有効物質含量100mg)、
“錠剤200mg”:例2による錠剤(有効物質含量200mg)、
を投与する。
【0041】
(カプセルは充填量360mgのサイズ0 ELの白色不透明な硬ゼラチンカプセルであり、これは次のような組成である:
“カプセル100mg”:(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール−塩酸塩100mg、微結晶セルロース152mg、Aerosil 8mg、ステアリン酸マグネシウム20mg及びPrimojel (ナトリウム−カルボキシメチルデンプン Typ A (Fa.Avebe))80mg;
“カプセル25mg”:(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール−塩酸塩25mg、微結晶セルロース227mg、Aerosil 8mg、ステアリン酸マグネシウム20mg及びPrimojel (ナトリウム−カルボキシメチルデンプン Typ A (Fa.Avebe))80mg)
主要な薬物動態学的データを次表に、実験で測定された平均血清濃度の経過を図1に示す。
パラメータ "カプセル25mg" " カプセル100mg" "錠剤100mg" "錠剤200mg"AUC[ng・h/ml] 69±14 318±66 300 ±51 667 ±141 C max [ng/ml] 14 ±4 64±19 23±5 51±13t max [h] 1.2 ±0.4 1.5 ±0.9 4.6±1.3 4.8±1.1
MRT * [h] 5.8 ±0.7 5.9 ±0.9 10.7 ±1.5 10.3±1.1
HVD ** 3.5 ±1.2 3.6 ±1.1 12.4 ±2.8 11.9±2.3
* MRT=“Mean Residence Time ”=“平均体内滞留時間”
**HVD =“Half Value Duration ”=“半値持続時間”
一方で、“カプセル100mg”と“錠剤100mg”の比較でまさに、本発明の調合物が有効物質を徐放する3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール含有薬学的調合物を提供する課題を満たすことに優れていることが分かる。他方で、“錠剤100mg”と“錠剤200mg”の比較で放出挙動の点で極めて有益な薬用量比率性も分かる。
【産業上の利用可能性】
【0042】
しかも更にこれから下記のことが分かる:
2つの本発明の調合物“錠剤100mg”及び“錠剤200mg”は開始時に有効物質を検出できる量で、しかも即座に放出する2つの調合物に比べて徐々に放出する;
しかし血清濃度は2つの徐放性調合物で1時間後すでに10ng/mlより多く、そして16時間後でもまだ十分に高く、鎮痛作用を保証する。更に“錠剤100mg”に対する刺激検査は、12時間間隔で医薬の繰り返し投与で、20ng/ml以下に低下しない血清濃度が達成されるので、1日2回服用によってすでに良好な鎮痛効果を保証することが分かる。これは特に慢性痛状態の処置に大きな進歩であり、そして患者の薬剤服用順守の著しい改善を可能にする。
【技術分野】
【0001】
本発明は、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩のうちの1つをマトリックスの形で含有する、有効物質を徐放する薬学的調合物に関する。
【背景技術】
【0002】
3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは特許文献1:欧州特許第0693475号明細書から鎮痛に有効な医薬として公知であり、そして経口投与することができる。3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの経口投与に通常の調合物は胃腸経路で有効物質の急速な放出を生じ、その結果として鎮痛作用がすぐに開始される。それと同時に作用の急速な減少が観察される。したがって3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールを用いる強い慢性痛の治療は、患者の血清中で十分な有効物質濃度を保証するために、従来比較的短い間隔で、たとえば1日に4〜6回薬を投与しなければならない。しかし頻繁な投薬の必要性は投薬に際して間違いが起こりやすくなり、望まれない血清濃度の変動を生じる。これは患者の薬剤服用順守及び治療効果に、特に慢性痛状態の治療で有害である。したがって有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの経口投与のための遅延された遊離を有する医薬投与形(徐放性調合物)が望まれる。
【0003】
公知技術において、一般に多数の種々の有効物質に対する徐放性調合物は公知である。通常の徐放性調合物は特にコーティング徐放剤及びコーティング徐放剤である。
【0004】
たとえば特許文献2:ドイツ特許公開第3625458号公報に記載されているようなコーティング徐放剤の場合、薬学的調合物の有効物質を含有する核は、1種以上の親水性又は疎水性ポリマーから有効物質の遊離を遅延させるコーティングを有する。
【0005】
マトリックス徐放剤の場合、有効物質の遊離を調節する、1種以上の担体材料から形成されたマトリックスの形で有効物質を含有する。たとえば特許文献3:ドイツ特許公開第3309516号公報には担体材料として及び部分的に有効物質の徐放担体材料としてヒドロキシプロピルメチルセルロース(HPMC)を用いるマトリックス調合物の製造方法が開示され、この際、この担体材料は調合物の重量の3倍より多くならず、そしてこれは16−24重量%のメトキシ含量、4−32重量%のヒドロキシプロピル含量及び少なくとも50.000の数値上の平均分子量を有する、ヒドロキシプロピルメチルセルロース少なくとも1個からなる。ドイツ特許公開第3309516号公報に開示された調合物に含有される、15〜30.000cPs(15〜30.000mPa・s)の粘度(20℃で2重量%水溶液中で)のHPMCsを含有する。溶解媒体のpH値に依存しない遊離挙動は特許文献3:ドイツ特許公開第3309516号公報に開示されていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】欧州特許第0693475号明細書
【特許文献2】ドイツ特許公開第3625458号公報
【特許文献3】ドイツ特許公開第3309516号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
したがって、本発明の課題は3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールを含有する、有効物質を徐放する薬学的調合物を調製することである。
【課題を解決するための手段】
【0008】
この課題は、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を有効物質を徐放するマトリックスの形で含有する、徐放性薬学的調合物において、マトリックスが薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%、好ましくは5〜80重量%を含有し、次の放出速度を有する(この速度は試験内で欧州薬局方パドル法(Ph.Eur.Paddle Method)の使用下でpH−値6.8及び37℃で緩衝液(欧州薬局方による)中で75U/分で及びUV−スペクオトロメトリー検出下で測定される):
0.5時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール3−35重量%(100重量%有効物質に対して)を放出し、
1時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール5−50重量%を放出し、
2時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール10−75重量%を放出し、
3時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール15−82重量%を放出し、
6時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール30−97重量%を放出し、
12時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール50重量%より多くを放出し、
18時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール70重量%より多くを放出し、
24時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール80重量%より多くを放出する、
ことを特徴とする、上記薬学的調合物によって解決される。
【0009】
驚くべきことに、本発明の有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは経口投与で徐放され、したがって少なくとも12時間間隔での投与に適当である。したがって、本発明の調合物は痛みの治療を可能にする。その治療経過で鎮痛薬3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールが僅かに1日1回、たとえば24時間間隔で、又は1日2回、好ましくは12時間間隔で有効物質の十分な血漿濃度を保証するために投与しなければならない。対応する作用時間及び十分な血中濃度の持続は刺激の研究及び実験に基づく検査によって裏付けられる。
【0010】
その場合、特に驚くべきことには、本発明の調合物は徐放に基づき長時間持続する治療の有効性を比較的長い時間(少なくとも12時間)にわたって保証するばかりでなく、同時に医薬の最初の服用で血漿中に有効物質の速やかな上昇(Anfluten)を可能にする。これは患者の急速な痛みの緩和を生じる(“急速な開始”)。したがって痛みを患う患者に本発明の調合物を投与した場合その痛みを急速に緩和することができ、その時鎮痛作用が同様に急速に再び低下しない。したがって、本発明の調合物は即座に有効物質を放出する調合物の特性(医薬の投与直後に十分に高い有効物質濃度によって痛みが急速に緩和される)と徐放性調合物の特性(より長い時間にわたって十分に高い有効物質濃度に基づく長時間持続する鎮痛作用)を一体化する。したがって痛みを患う患者は、本発明の調合物形での鎮痛剤の服用によってその痛みを有効に急性に克服することができ、そして同時に別の処置をすることなくかつ12(又は24)時間間隔で規則正しく服用するだけでより長い時間にわたって効果的に治療することができる。
【0011】
本発明の調合物の有効物質は徐放性マトリックスの形で含有される。しかし有効物質を通常の放出挙動を有するマトリックスの形で含有し、徐放をコーティング徐放によって達成させることも考えられる。
【0012】
別の可能性の場合、徐放挙動は浸透作用する放出システムによって達成される。
本発明の調合物が徐放性マトリックスを含有する場合、マトリックスは薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%を有し、たとえばゴム、セルロースエーテル、セルロースエステル、アクリル樹脂、蛋白質由来の材料、脂肪、ロウ、脂肪アルコール又は脂肪エステルを有する。マトリックス形成剤としての疎水性ポリマーを使用する場合、マトリックスはマトリックス形成剤5〜8重量%を有するのが好ましい。
【0013】
本発明の別の対象は、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を、有効物質を徐放するマトリックスの形で含有する、徐放性薬学的調合物であって、その際マトリックスが薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%、特に5〜80重量%を含有し、そしてこれは薬学的に許容し得るマトリックス形成剤としてセルロースエーテル及び(又は)セルロースエステルを有し、これは2重量%水溶液の形で20℃で粘度3.000〜150.000mPa・sを有することを特徴とする(この場合粘度測定は欧州薬局方にしたがってキャピラル−ビスコメーターを用いて行う)。この調合物は上記の本発明の放出プロフィールを有する。
【0014】
薬学的に許容し得るマトリックス形成剤として2重量%水溶液の形で20℃で粘度50.000〜150.000mPasを有するセルロースエーテル及び(又は)セルロースエステルを使用するのが好ましい。
【0015】
特に適する薬学的に許容し得るマトリックス形成剤は、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース(HPC)、メチルセルロース、エチルセルロース及びカルボキシメチルセルロースよりなる群から選ばれ、特にHPMCs、ヒドロキシエチルセルロース及びHPCsよりなる群から選ばれる。最も好ましくは2重量%水溶液の形で20℃で測定された粘度約100.000mPa・sのHPMCsである。
有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールはそのまま、すなわち遊離塩基として、しかもまた薬学的に許容し得る塩の形で、たとえば塩酸塩として存在することができる。遊離塩基の製造は欧州特許公開第0693475号公報から公知である。欧州特許公開第0693475号公報に薬学的に許容し得る塩(たとえば塩酸塩)の製造が開示されていない場合にかぎり、これらは公知技術で通常の周知の方法を用いて遊離塩基から出発して得られる。
【0016】
3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは、2個の不斉中心を有するので、この化合物は4つの異なる立体異性体の形で存在することができる。本発明の調合物において、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールを任意の混合割合での4つのジアステレオマーすべての混合物として、しかしまた4つの立体異性体のうちの2又は3つの混合物として又は立体異性体純粋な形で存在することができる。この際、好ましい立体異性体は(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール及び(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールであって、これらは本発明の調合物において、混合物として、特に1:1−混合物(ラセミ化合物)として、又は特に好ましくは異性体純粋な形で存在することができる。したがって“有効物質”とは本発明の目的に関して、種々のその立体異性体の混合物として又はその純粋な立体異性体の1つとして、それぞれ遊離塩基として又は薬学的に許容し得る塩の形での3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールを意味する。
【0017】
本発明の医薬において、徐放性有効物質含量が好ましくは0.5〜85重量%及び薬学的に許容し得るマトリックス形成剤の含量は8〜40重量%である。徐放性有効物質含量が3〜70重量%、特に8〜66重量%及び薬学的に許容し得るマトリックス形成剤の含量が10〜35重量%、特に10〜30重量%であるのが特に好ましい。有効物質として対掌体純粋な(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール((+)- 又は(−)−対掌体と大過剰の(+)- 対掌体の混合物)を使用した場合、有効物質含量は下限、すなわち0.5〜25重量%(全重量に対して)であるのが特に好ましい。有効物質として対掌体純粋な(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール((+)- 又は(−)−対掌体と大過剰の(−)- 対掌体の混合物)を使用した場合、有効物質含量は16〜66重量%であるのが特に好ましい。
【0018】
本発明の調合物のマトリックスのその他の成分は場合により消化のよい長鎖の(すなわち炭素原子8〜50個、好ましくは12〜40個の)置換されていないか又は置換された炭化水素、たとえば脂肪アルコール、脂肪酸グリセリルエステル、鉱油及び植物油、並びにロウであることができ、この際融点25−90℃の炭化水素が好ましい。脂肪アルコールが特に好ましく、さらに特にラウリルアルコール、ミリスチルアルコール、ステアリルアルコール、セチルアルコール及びセチルステアリルアルコールである。マトリックス中のその含量は0〜60重量%である。あるいは又は付加的にポリエチレングリコールをマトリックス中に0〜60重量%の含量で含有することもできる。
【0019】
更に本発明の薬学的調合物において、その他の成分として薬学的に慣用の助剤、たとえば充填剤、たとえばラクトース、微晶質セルロース(MMC)又はリン酸水素カルシウム、減摩剤(Gleitmittel)、滑沢剤及び流動調節剤、たとえばタルク、ステアリン酸マグネシウム、ステアリン酸及び(又は)高分散性二酸化ケイ素を含有することができ、その錠剤中の全含量は0〜80重量%、好ましくは5〜65重量%である。
【0020】
しばしば有効物質の投与形からの放出速度は放出媒体のpH値に依存する。これは医薬の胃腸通過の間1以下で1に近い値から約8(von unter 1 bis etwa 8) のpH値範囲内を変動する。この変動はそれぞれの服用するヒトによって異なってよい。また服用ごとに同一のヒトの場合、種々のpH値−時間−プロフィールを胃腸通過の間に生じることができる。医薬からの有効物質の放出速度はpH値に依存するので、これは生体内で種々の放出速度を生じ、それによって種々のバイオアベラビリティーを生じる。しかし本発明の薬学的調合物からの有効物質の放出プロフィール(塩基の形で又はその薬学的に許容し得る塩の1つ)は驚くことにpH値に依存しない。たとえばこれは生理学的に胃腸通過の間に発生する。1.2、4.0及び6.8の環境−pH値での放出プロフィールは、相互に同一か又はpH1.2からpH2.3以上で2.3に近い値(von pH 1.2 ueber pH 2.3) 及びpH6.8〜pH7.2までのpH値−時間−プロフィールの間の放出に比べて同一である。
【0021】
好ましくは錠剤形で存在する本発明の調合物からの有効物質の徐放を達成するために、有効物質、マトリックス形成剤及び任意の成分に対してその他に錠剤の大きさ及び組成を変えない場合、充填剤として水溶性充填剤、たとえばラクトース、不溶性の、水性媒体中で膨潤しない充填剤、たとえばリン酸水素カルシウム、又は不溶性の、水性媒体中で膨潤する充填剤、たとえば微結晶セルロースを使用するかどうかは重要でないことが分かった。このような医薬すべては、相互に対応する放出挙動を示す。
【0022】
更に、驚くべきことは、所定の有効物質量での本発明の調合物において、マトリックス形成剤の量及び任意の成分の量はそれぞれ比較的大きい範囲にわたって、少なくとも12時間の又は1日2回投与での治療効果を疑うことなく(有効物質、マトリックス形成剤及びその他の任意の成分に対する上記量制限が維持されているかぎり)変動することができることである。少なくとも12時間にわたる有効性は、たとえば(調合物全体の重量に対して)約32.25重量%の有効物質含量の場合、マトリックス形成剤としての100.000mPa・sの粘度のHPMC12.9重量%及び充填剤として約52.6重量%のたとえばMCC含量からなる調合物中で及び同一のHPMC約25.8重量%及びMCC(又はラクトース一水和物)約39.7重量%からなる調合物中で更に加えて同量の減摩剤、滑沢剤及び流動調節剤と共に保証される。上記制限内でより高い又はより少ない有効物質含量の本発明の調合物に対しても同等のことがいえる。
【発明の効果】
【0023】
本発明の有効物質を徐放する調合物の投与の際にヒト検体で有効物質に対する高い初回通過効果にかかわらず予期に反して即座に有効物質を放出する調合物に比べて変わらないバイオアベラビリティーが達成されることも観察され、非常に驚くべきことである。
【0024】
さらに、調合物の経口投与後に生体内で血漿濃度−時間−図表中のそのtmax 値が2〜10時間、特に3.5〜6時間、特に好ましくは4〜5.5時間である、すなわちそのピーク−血漿−レベルが上記時間枠内で生じるような本発明の調合物が好ましい。
【0025】
本発明の調合物は有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールをそのまま及び(又は)その薬学的に許容し得る塩として投薬単位あたり通常2.5mgな800mg、特に5〜400mg、まさに特に好ましくは10〜250mg(塩酸塩としての有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの重量)を含有する。この際本発明の調合物の放出挙動は、上記含量制限が維持されているかぎり有効物質の正確な量によって左右されない。2つの特に好ましい対掌体(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール及び(−)−(1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの異なる作用強度に基づき、より作用の強い(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは2.5mgな80mg、特に5〜40mg、まさに特に好ましくは10〜25mgの有効物質(その塩酸塩に対して)の量で本発明の調合物中に存在し、一方(−)−(1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールは好ましくは25mgな800mg、特に50〜400mg、まさに特に好ましくは100〜250mgの有効物質(その塩酸塩に対して)の量で本発明の調合物中に存在し、但し上記含量制限が維持されているという条件つきである。
【0026】
有効物質の薬学的に許容し得る(又は容認された)塩は本発明の範囲において、医療適用で生理学的に(特に哺乳類及び(又は)ヒトに適用した場合)許容し得る有効物質の塩である。このような薬学的に許容し得る塩はたとえば無機又は有機酸と共に形成することができる。
【0027】
本発明の薬学的調合物は簡単な錠剤として及びコーティング錠剤として、たとえばフィルム錠剤又はドラジェとして存在することができる。驚くべきことに錠剤は丸く、そして両凸である:錠剤の分割を可能にする長方形の錠剤形もありうる。更に、顆粒、回転楕円体、ペレット又はマイクロカプセルも可能であって、これらは小袋又はカプセル中に詰められるか又は圧縮して崩壊する錠剤とすることができる。
【0028】
コーティング錠剤のために、1個以上のコーティング層を使用することができる。コーティング材料として、約1〜100mPa・sの低粘度及び<10.000の低分子量の公知のヒドロキシプロピルメチルセルロース(たとえば20℃で2重量%水溶液の形で粘度6mPa・sのPharmacoat606)が適当であり、これは本発明の医薬の放出プロフィールにほんの僅かに影響を与える。当業者に周知の拡散被覆処理、たとえば膨潤する、しかし水不溶性ポリ(メタ)アクリレートを主体とする拡散被覆処理は本発明の薬学的調合物からの有効物質放出の遅延の調節を生じる。好ましくは0.5〜85重量%、特に好ましくは3〜70重量%、まさに特に好ましくは8〜66重量%の有効物質含量を有し、有効物質を徐放的に放出する有効物質含有錠剤核を付加的な有効物質(これは徐放されず、最初の薬用量として放出される)と共に種々の、当業者に周知の方法、たとえば溶液又は懸濁液からの糖衣化、噴霧によって又は粉末塗布処理によって包むことができる。所望の徐放に関して、有効物質の同時の急速な上昇で本発明の薬学的調合物の最初の投与で速やかに痛みを緩和するために必ずしも必要でない。その他の実施形態は多層錠剤及びコーティング錠剤である。この場合好ましくは0.5〜85重量%、特に好ましくは3〜70重量%、まさに特に好ましくは8〜66重量%の有効物質含量の多層錠剤の1個以上の層中に又は好ましくは0.5〜85重量%、特に好ましくは3〜70重量%、まさに特に好ましくは8〜66重量%の有効物質含量の核中に含まれる3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩の1つを薬学的に許容し得るマトリックス形成剤によって徐放し、そして多層錠剤の1個以上の層中の又はコーティング錠剤の外側のコーティング層中の有効物質の放出を徐放的に行わない。多層錠剤及びコーティング錠剤は1種以上の有効物質不含コーティングを含有することができる。
【0029】
徐放性薬学的調合物中の徐放性マトリックスの代わりに、普通に放出するマトリックスを使用することは有効物質の放出を徐放するコーティングによって可能となる。その際たとえば有効物質を微結晶セルロース及び場合によりその他の医薬助剤、たとえば結合剤、充填剤、減摩剤、滑沢剤及び流動調節剤からなる通常のマトリックス中に含有させることができる。これらの助剤は有効物質の徐放を水性媒体中で調節する材料でコーティングされているか又は層をなしている。適する結合剤はたとえば水不溶性ロウ及びポリマー、たとえばポリメタアクリレート[Eudragit(ユードラギット) 等々]又は水不溶性セルロース、特にエチルセルロースである。場合によりコーティング材料中に水溶性ポリマー、たとえばポリビニルピロリドン、水溶性セルロース、たとえばヒドロキシプロピルメチルセルロース又はヒドロキシプロピルセルロース、その他の水溶性剤、たとえばポリソルベート80又は親水性細孔形成剤、たとえばポリエチレングリコール、ラクトース又はマンニトールを含有することもできる。
【0030】
徐放性薬学的調合物中に徐放性マトリックス又は有効物質の放出を徐放するコーティングを有する通常に放出するマトリックスと共に又はこれに加えて、浸透作用する放出システムを徐放を達成するために使用することもできる。このような、好ましくは経口の、放出システムにおいて、放出システムの少なくとも1個の表面、好ましくは表面全体(好ましくはこれは放出媒体と接触するか又は接触することができる)は半透過性表面であり、好ましくは半透過性コーティングが付与されているので、放出媒体に対する表面は透過性であるが、有効物質に対しては実質上好ましくは完全に非透過性である。この場合表面及び(又は)場合によりコーティングは、少なくとも1個の孔を有効物質の放出のために有する。有効物質:3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩、好ましくは(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩及び(又は)(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩あるいはその混合物はその際(必ずではないが)マトリックスの形で存在することができる。これは好ましくは放出孔、浸透性医薬核、半透過性膜及びポリマー部分を有する錠剤形の系(圧縮される)を意味する。その際このような系の良好な、好ましい例は、ALZA corporation(USA)のOROS(R) −system、そのインターネットシーン又はOROS(R) −systemに関するその他の製品情報の個々のものを含む。とくにこれらはまたOROS(R) Push−PullTM−system,OROS(R) Delayed Push−PullTM−system,OROS(R) Multi−Layer Push−PullTM−system,OROS(R) Push−Stick Systemであり、あるいはまた特定の問題がある場合はL−OROSTMである。浸透作用の放出システムの具体的製造の実施態様及び例は米国特許第4,765,989号明細書、第4,783,337号明細書及び第4,612,008号明細書から引用され、全体が本発明を説明するための構成要素である。
【図面の簡単な説明】
【0031】
【図1】図1は臨床実験で測定された平均血清濃度の経過を示す。
【発明を実施するための形態】
【0032】
本発明の調合物はたとえば次の一般法にしたがって製造することができる:
調合物の成分(有効物質、マトリックス形成剤及び任意の成分)を順番に計量し、ついで慣用の篩い機で篩分する。ここでたとえば篩い機Quadro Comil U 10 を使用することができる。この際使用する篩いサイズは約0.813mmである。ついで篩いをコンテナー混合機中で、たとえばBohle コンテナーミキサー(Containermischer)中で混合する。典型的な作業条件で行う:回転数20±1U/分で持続時間約15分±45秒。その後、得られた粉末混合物を錠剤圧縮機で圧縮して錠剤とする。これに対して直径10mmのドラジェアーチ形のドーム(rundstempel)を備えた錠剤圧縮機 Korsch EKO を使用する。あるいは粉末混合の圧縮、ついで圧縮物の篩分(Comil 3mm 摩擦薄刃篩、ついで1.2mm円形細孔篩)を行うこともできる。この場合生じる顆粒を引き続き上記のように滑沢剤(たとえばステアリン酸マグネシウム)の添加下にたとえば10mmドームを備えたEK0錠剤圧縮機で圧縮する。顆粒化を水性溶剤又は有機溶剤をベースとする湿式顆粒化によっても行うことができる。その際適当な結合剤含有又は不含の水性溶剤が好ましい。製造処理を容易にその都度の要求及び所望の投与形態に従来技術で周知の方法にしたがって適合させることができる。
【0033】
本発明の薬学的調合物の製造は得られた調合物(これは3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を含有する)の放出特性の高い再生産性の点で優れている。ICH Q1AR−安定性−テスト−ガイドラインによる通常の保存条件下で少なくとも1年の保存期間の間、本発明の医薬の放出プロフィールは安定を示す。
【0034】
患者が本発明の薬学的調合物を1日1〜2回服用した場合、良好な治療有効性は持続する強い痛みに対して確実に得られる。
【実施例】
【0035】
以下に例によって本発明及び好ましい実施態様を説明するが、本発明の保護範囲はこれによって限定されない。
【0036】
例1
錠剤あたり次の組成のマトリックス形成剤を錠剤1000個の仕込みサイズで下記方法で製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 123mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
すべての成分を計量し、篩い機Quadro Comil U 10 で篩いサイズは約0.813mm下で篩分し、コンテナー混合機(Bohle LM40)中で回転数20±1U/分で15分±15秒混合し、Korsch EKO圧縮機で圧縮して、直径10mm、アーチ半径8mm及び平均錠剤重量310mg のドラジェアーチ形錠剤とする。
【0037】
試験管内放出を欧州薬局方パドル法の使用下で37℃で欧州薬局方による緩衝液pH6.8 900ml中で75U/分で、そしてUV−分光光度検出器を用いて測定し、その結果を次の表に示す。
時間(分) 有効物質の放出された全量(%)
0 0
30 18
60 27
120 41
180 50
240 59
360 71
480 80
600 87
720 93
例2
錠剤あたり次の組成のマトリックス錠剤3000個を例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 200mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 23mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 19
60 30
120 46
180 58
240 68
360 84
480 93
720 99
例3
錠剤あたり次の組成のマトリックス錠剤を錠剤3000個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 40mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 163mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1のように測定する;その他は同一条件下で別の放出を50U/分及び100U/分の攪拌速度で測定する。
時間(分)50U/分で有効物質 70U/分で有効物質 100U/分で有効物質
の放出された全量(%) の放出された全量(%) の放出された全量(%)
0 0 0 0
30 20 20 21
60 35 33 35
120 54 51 53
180 67 63 66
240 76 73 76
360 89 87 89
480 97 95 97
600 100 100 100
例4
錠剤あたり次の組成のマトリックス錠剤を錠剤200個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mgラクトース一水和物 (Fa. Meggle) 123mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 16
60 26
120 39
180 49
240 57
360 71
480 81
600 87
720 92
例5
錠剤あたり次の組成のマトリックス錠剤を錠剤100個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 40mgCellactose(Fa. Meggle) 163mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 18
60 31
120 48
180 61
240 71
360 84
480 91
600 95
720 97
例6
錠剤あたり次の組成のマトリックス錠剤を錠剤200個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 50mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 40mg
Ludipress (Fa. BASF) 123mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 17
60 27
120 40
180 51
240 59
360 72
480 82
600 89
720 93
例7
錠剤あたり次の組成のマトリックス錠剤を錠剤200個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 50mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 40mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 163mg
ラクトース 200 (Fa. Meggle) 50mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 18
60 31
120 49
180 61
240 70
360 82
480 90
600 94
720 96
例8
錠剤あたり次の組成のマトリックス錠剤を錠剤200個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
Cellactose(Fa. Meggle) 72.5mg
ヒドロキシエチルセルロース
(Natrosol 250 HX (Fa. Herkules) 12.5mg
CutinaHR(Fa. Henkel) 130mg
タルク 3mg
ステアリン酸マグネシウム 2mg
全量 320mg
有効物質、セルラクトース、Natrosol及びCutinaを混合し、ついで乾燥棚で80℃に加熱し、Kenwood Chef−Kuecken混合機で顆粒化する。冷却された顆粒を1mmの篩によって篩分する。ステアリン酸マグネシウム及びタルクとの混合した後、顆粒をEK0 Exzeterpresse (Korsch)で圧縮して6×15mmのサイズの、折れ目線(Bruckkerbe) のある長方形錠剤となす。
【0038】
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 28
60 39
120 56
180 68
240 80
360 97
390 99
例9
錠剤あたり次の組成のマトリックス錠剤を錠剤100個の仕込みサイズで例1に記載した方法にしたがって製造する:
(+)- (1S、2S)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 10mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 213mg
ラクトース 200 (Fa. Meggle) 50mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 310mg
試験管内放出を例1におけると同様に測定する。
時間(分) 有効物質の放出された全量(%)
0 0
30 15
60 24
120 36
180 44
240 51
360 61
480 69
600 75
720 79
例10
錠剤あたり次の組成のマトリックス錠剤を錠剤100個の仕込みサイズで例1に記載した方法にしたがって製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
ヒドロキシプロピルメチルセルロース
(メトロース90 SH 100.000 (Fa. Fa. Shinetsu)) 100.000 mPa ・s 80mg微結晶セルロース(Avicel PH102 (Fa.FA FMC)) 63mg
高分散性二酸化珪素 4mg
ステアリン酸マグネシウム 3mg
全量 250mg
試験管内放出を次の条件下で測定する。
(A)欧州薬局方パドル法の使用下で37℃でUSP 22による緩衝液pH7.2 900ml中で75U/分で、そしてUV−分光光度検出器を用いて測定する。
(B)75U/分で欧州薬局方パドル法の使用下、この際0−30分、pH1.2;30−120分、pH2.3;120−180分、pH6.5及び残りの試験時間pH7.2を調整する。錠剤は2つの試験条件に対して結果を示す:
時間(分) 条件(A)下で有効物質 条件(B)下で有効物質
の放出された全量(%) の放出された全量(%)
0 0 0
30 19 20
60 29 30
120 43 44
180 54 55
240 63 65
360 78 80
480 87 90
600 94 97
720 98 100
試験から、本発明の調合物の放出挙動が放出媒体のpH値に依存しないことが分かった。
【0039】
例11
次の組成のペレットを以下のようにして製造する:
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−
エチル−2−メチル−プロピル)フェノール−塩酸塩 100mg
低度に置換されたヒドロキシプロピルメチルセルロース
(L-HPC LH 31 (Fa. Shinetsu)) 75mg
Aquacoat (水性エチルセルロース−分散液 (Fa. FMC)
( 乾燥物質として計算) 20mg
微結晶セルロース(Avicel PH102 (Fa.FAFMC)) 75mg
ジブチルセバケート(DBS) 4mg
トゥイーン 80 0.4mg
全量 274.4mg
有効物質、Avicel及びL−HPCをプラネットミキサー(Kenwood K-Mischer)で10分混合し、ついで水を用いて顆粒化する。湿性顆粒を0.8×0.8mm鋳型のあるNica押出機で押し出し、ついで10分Nica−球形機で500U/分で丸める(負荷1kg)。ペレットを一晩50℃で乾燥棚中で乾燥させ、ついで篩フラクションを分類する。
【0040】
大きさ0.6−1.0mmのペレット(収率約95%)をWSG(Wurstereinsatzを備えたGlatt GPCG1 ) で供給温度60℃(生成物温度40℃)でAquacoat及びDBS(Aquacoat固体顆粒に対して計算して20%)からなる水性分散液を用いてコーティングし、それによって9.8%の重量増加(出発重量に対して)を示す。分散液の製造は製造業者(FA.FMC)の指示にしたがって行う。この場合DBSをトゥイーン80と一緒に水のアリコート中で均質化し、ついで希釈されたAquacoat分散液に加える。完成した分散液は20重量%の固体含量を有し、少なくとも3時間攪拌する。コーティングペレットをWSGで乾燥させ、乾燥棚中で暖める(60℃で2時間)。放出の試験を例1と同様に行うが100U/分で小カゴ(Koerbchen)法によってしたがって行う。
時間(分) 有効物質の放出された全量(%)
0 0
30 5
60 15
120 28
180 43
240 56
360 73
480 82
600 87
720 90
臨床試験
単中心の開放された無作為化された単一薬用量−4−法−クロスオーバー−研究で、薬物動態学データの測定のために(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール−塩酸塩(有効物質)の種々の投与形を18〜45歳の16人の男性白人に投与する。データの実験にようる測定はHPLC−分析を用いて行う。
“カプセル100mg”:有効物質を即座に放出し、有効物質含量100mgのカプセル、
“カプセル25mg”:有効物質を即座に放出し、有効物質含量25mgのカプセル、
“錠剤100mg”:例1による錠剤(有効物質含量100mg)、
“錠剤200mg”:例2による錠剤(有効物質含量200mg)、
を投与する。
【0041】
(カプセルは充填量360mgのサイズ0 ELの白色不透明な硬ゼラチンカプセルであり、これは次のような組成である:
“カプセル100mg”:(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール−塩酸塩100mg、微結晶セルロース152mg、Aerosil 8mg、ステアリン酸マグネシウム20mg及びPrimojel (ナトリウム−カルボキシメチルデンプン Typ A (Fa.Avebe))80mg;
“カプセル25mg”:(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール−塩酸塩25mg、微結晶セルロース227mg、Aerosil 8mg、ステアリン酸マグネシウム20mg及びPrimojel (ナトリウム−カルボキシメチルデンプン Typ A (Fa.Avebe))80mg)
主要な薬物動態学的データを次表に、実験で測定された平均血清濃度の経過を図1に示す。
パラメータ "カプセル25mg" " カプセル100mg" "錠剤100mg" "錠剤200mg"AUC[ng・h/ml] 69±14 318±66 300 ±51 667 ±141 C max [ng/ml] 14 ±4 64±19 23±5 51±13t max [h] 1.2 ±0.4 1.5 ±0.9 4.6±1.3 4.8±1.1
MRT * [h] 5.8 ±0.7 5.9 ±0.9 10.7 ±1.5 10.3±1.1
HVD ** 3.5 ±1.2 3.6 ±1.1 12.4 ±2.8 11.9±2.3
* MRT=“Mean Residence Time ”=“平均体内滞留時間”
**HVD =“Half Value Duration ”=“半値持続時間”
一方で、“カプセル100mg”と“錠剤100mg”の比較でまさに、本発明の調合物が有効物質を徐放する3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール含有薬学的調合物を提供する課題を満たすことに優れていることが分かる。他方で、“錠剤100mg”と“錠剤200mg”の比較で放出挙動の点で極めて有益な薬用量比率性も分かる。
【産業上の利用可能性】
【0042】
しかも更にこれから下記のことが分かる:
2つの本発明の調合物“錠剤100mg”及び“錠剤200mg”は開始時に有効物質を検出できる量で、しかも即座に放出する2つの調合物に比べて徐々に放出する;
しかし血清濃度は2つの徐放性調合物で1時間後すでに10ng/mlより多く、そして16時間後でもまだ十分に高く、鎮痛作用を保証する。更に“錠剤100mg”に対する刺激検査は、12時間間隔で医薬の繰り返し投与で、20ng/ml以下に低下しない血清濃度が達成されるので、1日2回服用によってすでに良好な鎮痛効果を保証することが分かる。これは特に慢性痛状態の処置に大きな進歩であり、そして患者の薬剤服用順守の著しい改善を可能にする。
【特許請求の範囲】
【請求項1】
3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を有効物質を徐放するマトリックスの形で含有する、徐放性薬学的調合物において、マトリックスが薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%を含有し、次の放出速度を有する(この速度は試験内で欧州薬局方パドル法(Ph.Eur.Paddle Method)の使用下でpH−値6.8及び37℃で緩衝液(欧州薬局方による)中で75U/分で及びUV−スペクオトロメトリー検出下で測定される):
0.5時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール3−35重量%(100重量%有効物質に対して)を放出し、
1時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール5−50重量%を放出し、
2時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール10−75重量%を放出し、
3時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール15−82重量%を放出し、
6時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール30−97重量%を放出し、
12時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール50重量%より多くを放出し、
18時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール70重量%より多くを放出し、
24時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール80重量%より多くを放出する、
ことを特徴とする、上記薬学的調合物。
【請求項2】
3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を有効物質を徐放するマトリックスの形で含有する徐放性薬学的調合物において、マトリックスが薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%を含有し、薬学的に許容し得るマトリックス形成剤としてセルロースエーテル及び(又は)セルロースエステルを有し、これは2重量%水溶液の形で20℃で粘度3.000〜150.000mPasを有することを特徴とする、上記薬学的調合物。
【請求項3】
薬学的に許容し得るマトリックス形成剤としてセルロースエーテル及び(又は)セルロースエステルを有し、これは2重量%水溶液の形で20℃で粘度10.000〜150.000mPasを有する、請求項1又は2記載の薬学的調合物。
【請求項4】
薬学的に許容し得るマトリックス形成剤としてセルロースエーテル及び(又は)セルロースエステルを有し、これは2重量%水溶液の形で20℃で粘度50.000〜150.000mPasを有する、請求項1〜3のいずれか1つに記載の薬学的調合物。
【請求項5】
薬学的に許容し得るマトリックス形成剤としてヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース(HPC)、メチルセルロース、エチルセルロース及びカルボキシメチルセルロースを含む群から選ばれる物質少なくとも1個を含有する、請求項1〜4のいずれか1つに記載の薬学的調合物。
【請求項6】
薬学的に許容し得るマトリックス形成剤としてヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロース及びヒドロキシプロピルセルロースを含む群から選ばれる物質少なくとも1個を含有する、請求項1〜5のいずれか1つに記載の薬学的調合物。
【請求項7】
徐放性有効物質の含量が0.5〜85重量%であり、そして薬学的に許容し得るマトリックス形成剤の含量が8〜40重量%である、請求項1〜6のいずれか1つに記載の薬学的調合物。
【請求項8】
徐放性有効物質の含量が3〜70重量%、特に8〜66重量%であり、そして薬学的に許容し得るマトリックス形成剤の含量が10〜35重量%、特に10〜30重量%である、請求項1〜7のいずれか1つに記載の薬学的調合物。
【請求項9】
有効物質のピーク−血清−レベルが生体内で2〜10時間後、特に3.5〜6時間後に達成される、請求項1〜8のいずれか1つに記載の薬学的調合物。
【請求項10】
(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を含有する、請求項1〜9のいずれか1つに記載の薬学的調合物。
【請求項11】
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を含有する、請求項1〜9のいずれか1つに記載の薬学的調合物。
【請求項12】
請求項1〜11のいずれか1つに記載の薬学的調合物を含有する、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの1日2回経口投与用錠剤。
【請求項1】
3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を有効物質を徐放するマトリックスの形で含有する、徐放性薬学的調合物において、マトリックスが薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%を含有し、次の放出速度を有する(この速度は試験内で欧州薬局方パドル法(Ph.Eur.Paddle Method)の使用下でpH−値6.8及び37℃で緩衝液(欧州薬局方による)中で75U/分で及びUV−スペクオトロメトリー検出下で測定される):
0.5時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール3−35重量%(100重量%有効物質に対して)を放出し、
1時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール5−50重量%を放出し、
2時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール10−75重量%を放出し、
3時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール15−82重量%を放出し、
6時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール30−97重量%を放出し、
12時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール50重量%より多くを放出し、
18時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール70重量%より多くを放出し、
24時間後、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール80重量%より多くを放出する、
ことを特徴とする、上記薬学的調合物。
【請求項2】
3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を有効物質を徐放するマトリックスの形で含有する徐放性薬学的調合物において、マトリックスが薬学的に許容し得るマトリックス形成剤として1種以上の親水性又は疎水性ポリマー1〜80重量%を含有し、薬学的に許容し得るマトリックス形成剤としてセルロースエーテル及び(又は)セルロースエステルを有し、これは2重量%水溶液の形で20℃で粘度3.000〜150.000mPasを有することを特徴とする、上記薬学的調合物。
【請求項3】
薬学的に許容し得るマトリックス形成剤としてセルロースエーテル及び(又は)セルロースエステルを有し、これは2重量%水溶液の形で20℃で粘度10.000〜150.000mPasを有する、請求項1又は2記載の薬学的調合物。
【請求項4】
薬学的に許容し得るマトリックス形成剤としてセルロースエーテル及び(又は)セルロースエステルを有し、これは2重量%水溶液の形で20℃で粘度50.000〜150.000mPasを有する、請求項1〜3のいずれか1つに記載の薬学的調合物。
【請求項5】
薬学的に許容し得るマトリックス形成剤としてヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース(HPC)、メチルセルロース、エチルセルロース及びカルボキシメチルセルロースを含む群から選ばれる物質少なくとも1個を含有する、請求項1〜4のいずれか1つに記載の薬学的調合物。
【請求項6】
薬学的に許容し得るマトリックス形成剤としてヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロース及びヒドロキシプロピルセルロースを含む群から選ばれる物質少なくとも1個を含有する、請求項1〜5のいずれか1つに記載の薬学的調合物。
【請求項7】
徐放性有効物質の含量が0.5〜85重量%であり、そして薬学的に許容し得るマトリックス形成剤の含量が8〜40重量%である、請求項1〜6のいずれか1つに記載の薬学的調合物。
【請求項8】
徐放性有効物質の含量が3〜70重量%、特に8〜66重量%であり、そして薬学的に許容し得るマトリックス形成剤の含量が10〜35重量%、特に10〜30重量%である、請求項1〜7のいずれか1つに記載の薬学的調合物。
【請求項9】
有効物質のピーク−血清−レベルが生体内で2〜10時間後、特に3.5〜6時間後に達成される、請求項1〜8のいずれか1つに記載の薬学的調合物。
【請求項10】
(+)- (1S、2S)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を含有する、請求項1〜9のいずれか1つに記載の薬学的調合物。
【請求項11】
(−)- (1R、2R)−3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール又はその薬学的に許容し得る塩を含有する、請求項1〜9のいずれか1つに記載の薬学的調合物。
【請求項12】
請求項1〜11のいずれか1つに記載の薬学的調合物を含有する、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノールの1日2回経口投与用錠剤。
【図1】




【公開番号】特開2010−280697(P2010−280697A)
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願番号】特願2010−176084(P2010−176084)
【出願日】平成22年8月5日(2010.8.5)
【分割の表示】特願2003−537620(P2003−537620)の分割
【原出願日】平成14年10月22日(2002.10.22)
【出願人】(390035404)グリュネンタール・ゲゼルシャフト・ミト・ベシュレンクテル・ハフツング (127)
【Fターム(参考)】
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願日】平成22年8月5日(2010.8.5)
【分割の表示】特願2003−537620(P2003−537620)の分割
【原出願日】平成14年10月22日(2002.10.22)
【出願人】(390035404)グリュネンタール・ゲゼルシャフト・ミト・ベシュレンクテル・ハフツング (127)
【Fターム(参考)】
[ Back to top ]

