有機エレクトロルミネセンス材料およびそれを用いた有機エレクトロルミネセンス素子
【課題】高効率・高寿命で不純物の少ない有機エレクトロルミネセンス素子の提供。
【解決手段】式1又は2で表される有機基を部分構造として有する有機エレクトロルミネセンス材料を素子の発光層、正孔輸送層、正孔注入層のいずれかに用いる。

(式中、R1,R2は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R1とR2は結合して環を形成してもよい。)
【解決手段】式1又は2で表される有機基を部分構造として有する有機エレクトロルミネセンス材料を素子の発光層、正孔輸送層、正孔注入層のいずれかに用いる。

(式中、R1,R2は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R1とR2は結合して環を形成してもよい。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、不純物濃度を低減した有機エレクトロルミネセンス材料およびそれを用いた有機エレクトロルミネセンス素子に関するものである。
【0002】
なお、以下、エレクトロルミネセンスをELと略す。
【背景技術】
【0003】
有機EL素子は、高速応答性・高視野角・高効率の発光素子として精力的に研究がなされており、近年、実用化も始まっている。しかし、今なお、寿命・効率の面で満足できるレベルにはなく、さらなる長寿命・高効率を目指した開発が続けられている。
【0004】
特に問題となっている有機EL素子の劣化は、さらなる改善が必要となっている。最近、有機EL素子の初期輝度低下および経時的な劣化要因として、材料中の不純物が大きく影響していることが報告されている(例えば、特許文献1〜6参照)。
【0005】
中でも、特許文献6には、有機EL材料の不純物として、これら材料を製造する際の原料物質に由来する不純物や、その製造工程で生成する中間体或いは前駆体、さらには、ハロゲン化合物を用いる際の中間体としての未反応物が記載されている。そして、不純物の定量法としては、高速液体クロマトグラフィーがよいと記載されている。
【0006】
また、特許文献3には、クロスカップリング反応により生じうる不純物、例えば、同じ反応種の間で結合したホモカップリング体、原料のハロゲン原子や金属原子が水素で置き換わったもの等を記載している。そして、その定量法は、やはり同じく高速液体クロマトグラフィーである。
【0007】
【特許文献1】特開2002−235077公報(特許請求の範囲)
【特許文献2】特開2002−373785公報(特許請求の範囲)
【特許文献3】特開2002−373786公報(特許請求の範囲)
【特許文献4】特開2003−68467公報(特許請求の範囲)
【特許文献5】特開2005−225916公報(特許請求の範囲)
【特許文献6】WO2000/41443号公報(特許請求の範囲)
【発明の開示】
【発明が解決しようとする課題】
【0008】
高い効率を示す上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料において、従来の高速液体クロマトグラフィーによる不純物の分析では、定量できない不純物があることが分かってきた。例えば、高速液体クロマトグラフィー分析で、同じ純度を示しているにも拘らず、EL素子での評価では、色純度、寿命がかなり異なり、ロット間でEL性能にバラツキが見られる場合があり、この不純物の挙動を解析しない限り、高効率・高寿命の素子を安定よく製造できないことが分かってきた。
【0009】
本発明の目的は、不純物の少ない上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料およびそれを用いた有機EL素子を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは鋭意検討した結果、一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料において、薄膜での蛍光スペクトルの最大蛍光波長(λmax)における蛍光強度に対する(λmax+60nm)における蛍光強度の比が0.2未満であることを特徴とする有機EL材料が、効率および素子の劣化抑制の面で非常に優れていることを見出し、本発明を完成するに至った。
【0011】
即ち、本発明は、下記一般式(1)または(2)で表される有機基を部分構造として有し、薄膜での蛍光スペクトルの最大蛍光波長(λmax)における蛍光強度に対する(λmax+60nm)における蛍光強度の比が0.2未満であることを特徴とする有機EL材料およびその用途に関するものである。
【0012】
【化1】

(式中、R1,R2は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R1とR2は結合して環を形成してもよい。)
上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料は、下記一般式(3)または(4)で表されるハロゲン化合物と、銅,パラジウムおよびニッケルのような遷移金属触媒存在下、有機金属化合物とのクロスカップリング反応、パラジウム触媒を用いたアミン化合物とのBuchwald−Hartwig反応(例えば、Journal of chemistry,65,1158−1174(2000)参照)、銅触媒を用いたアミン化合物とのUllmann反応等から合成することができる。
【0013】
【化2】

(式中、X1,X2は各々独立して水素原子、臭素原子、塩素原子またはヨウ素原子であり、少なくともいずれかはハロゲン原子である。また、R1,R2は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R1とR2は結合して環を形成してもよい。)
ここで言うクロスカップリング反応とは、炭素−炭素結合を生成する反応であり、有機ホウ素化合物を用いた鈴木−宮浦反応(例えば、Tetrahedron,58,9633−9695(2002)参照)、有機スズ化合物を用いたStill反応、有機亜鉛化合物を用いたNegishi反応等(例えば、Palladium Reagents and Catalysts(2004) John Wiley & Sons,Ltd.参照)が挙げられる。
【0014】
これら反応時の条件は、特に制限はない。しかし、これら反応で使用する遷移金属触媒に由来する金属残渣は、極力少ない方がよく、遷移金属触媒量は、上記一般式(3)または(4)で表されるハロゲン化合物1molに対して0.5mol%以下、より好ましくは0.2mol%以下である。
【0015】
さらに、このような公知の方法により得られる上記一般式(1)または(2)で表される有機EL材料は、シリカゲル、アルミナおよび活性白土等のクロマトグラフィー、再結晶、昇華精製等の精製操作を組み合わせて用いることにより精製される。
【0016】
以下に合成される有機EL材料を例示するが、特にこれらの化合物に限定されるものではない。
【0017】
【化3】

【0018】
【化4】

【0019】
【化5】

【0020】
【化6】

上記化合物は、下記一般式(5)〜(8)または(9)〜(11)で表されるフェニルナフタレン誘導体の環化反応を経由して合成できる。
【0021】
【化7】

【0022】
【化8】

(式中、X1,X2は各々独立して水素原子、臭素原子、塩素原子またはヨウ素原子であり、少なくともいずれかはハロゲン原子である。また、R3〜R6は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R3とR4またはR5とR6は結合して環を形成してもよい。)
上記一般式(5)〜(8)の環化反応は、酸触媒、有機溶媒中で実施される。酸触媒としては、ブレンステッド酸またはルイス酸であり、好ましくはルイス酸である。ルイス酸の具体例としては、塩化鉄(III)、臭化鉄(III)等の鉄化合物、塩化亜鉛、臭化亜鉛等の亜鉛化合物、塩化ジルコニウム等のジルコニウム化合物、塩化チタン、臭化チタン、チタニウムエトキシド等のチタン化合物、塩化アルミニウム、臭化アルミニウム等のアルミニウム化合物、三フッ化ホウ素、三フッ化ホウ素・エーテル錯体、三フッ化ホウ素・酢酸錯体、三臭化ホウ素等のホウ素化合物、塩化スカンジウム、塩化ランタン等のランタノイド金属塩等が挙げられる。中でもホウ素化合物が好ましい。
【0023】
酸触媒の使用量は、上記一般式(5)〜(8)のいずれかで表されるフェニルナフタレン誘導体1molに対して、通常、0.1〜20倍molである。また、使用される有機溶媒は、反応を阻害しないものであれば特に制限はないが、通常、ジクロロメタン、クロロホルム、四塩化炭素等のハロゲン系溶媒が好ましい。
【0024】
また、上記一般式(9)〜(12)で表されるフェニルナフタレン誘導体の環化反応は、強塩基存在下、有機溶媒中で実施される(例えば、Journal of Organic Chemistry,56,1683−1685(1991)参照)。強塩基としては、前記文献に記載されているようなtert−ブチルリチウム、リチウムジイソプロピルアミド等が挙げられる。有機溶媒としては、反応を阻害しないものであれば特に制限はないが、通常、テトラハイドロフラン、ジオキサン等のエーテル系溶媒が好ましい。
【0025】
なお、上記一般式(9)〜(12)のいずれかで表されるフェニルナフタレン誘導体の環化反応により、対応するベンゾフルオレノン誘導体が生成するが、例えば、上記一般式(3)または(4)で表されるハロゲン化合物への変換(例えば、R3,R4=フェニル)は、公知のグリニヤール反応およびフリーデル・クラフト反応を経て合成される(下式(13)参照)。
【0026】
【化9】

前述の環化反応により、95%以上の純度で目的とする上記一般式(3)または(4)で表されるハロゲン化合物が得られる。しかし、このまま次工程のクロスカップリング反応および/またはアミノ化反応を経て、再結晶、クロマトグラフィーまたは昇華による精製を行っても、高純度の上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料が得られないばかりか、素子特性でも良好な結果が得られない。
【0027】
特にアミノ化反応により合成される有機EL材料(例えば、上記例示化合物(A1)〜(A6)、(B1)〜(B8)、(C1)〜(C6))は、見かけの純度が高くても、素子特性、特に素子寿命の低下速度が大きい。
【0028】
前述の環化反応生成物は非常に複雑であり、必ずしも全て同定はできていないが、質量分析により、上記一般式(3)または(4)で表されるハロゲン化合物以外に、例えば、末端にオレフィン基または三級アルキル基を有する化合物、二量化した化合物、或いは重合した粘性化合物等の存在が示唆されている。これら不純物を再結晶、クロマトグラフィー等の公知の方法で精製し、高速液体クロマトグラフィー分析での不純物濃度を0.5面積%以下に低減させたハロゲン化合物を用いて、クロスカップリング反応および/またはアミノ化反応を行って得られた有機EL材料と、そうでない有機EL材料とを比較した場合、高速液体クロマトグラフィー分析で同じ純度を示しても、蛍光スペクトルにおいて、明らかに長波長成分のスペクトルが異なることが判明した。長波長成分のスペクトルが異なるとは、薄膜での蛍光スペクトルの最大蛍光波長(λmax)における蛍光強度に対する(λmax+60nm)における蛍光強度の比、即ち、蛍光強度λmax+60/蛍光強度λmaxが0.2未満であるかないかを指す。蛍光強度λmax+60/蛍光強度λmaxが0.2未満であることを満たす有機EL材料を用いると、EL素子の効率・寿命は向上することが分かった。
【0029】
なお、ここで言う薄膜での蛍光スペクトルは、粉末での蛍光スペクトルを指す。
【0030】
このように上記(1)または(2)で表される有機基を部分構造として有する有機EL材料の薄膜での蛍光強度λmax+60/蛍光強度λmaxが0.2未満であることにより、非常に高効率・高寿命の有機EL素子が可能となる。
【0031】
本発明の上記一般式(1)または(2)で表される有機基を部分構造とする有機EL材料は、正孔注入層、正孔輸送層、発光層、電子輸送層の少なくともいずれかの層に使用されるが、好ましくは正孔注入層、正孔輸送層、発光層である。
【発明の効果】
【0032】
本発明による上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料は、さらなる低電圧駆動と高い電力効率を達成し、加えてそれからなる有機EL素子の耐久性向上が期待できる。
【実施例】
【0033】
以下、本発明を実施例に基づき、さらに詳細に説明する。
【0034】
高速液体クロマトグラフィー(HPLC)分析は、東ソー製 LC−8020シリーズ(CCPM−II型ポンプ、UV−8020型UV検出器、CO−8020型カラムオーブン)を使用し、移動層としてアセトニトリル:テトラハイドロフラン=9:1(体積比)、分析カラムとしてInertsil ODS−3V(4.5mm i.d.×250mm)を用いた。なお、流速は1ml/分、測定波長は254nm、カラム温度は45℃、注入量は5μlとした。
【0035】
蛍光スペクトルは、めのう乳鉢で粉砕した試料を粉末セルに充填し、日立製 F−2500を用いて、室温(大気中)、励起波長340nmの条件下で測定した。
【0036】
1H−NMR測定、13C−NMR測定およびFDMS測定は、各々バリアン社製 Gemini200、日立製作所製 M−80Bを使用して実施した。
【0037】
合成例1
2−ブロモ−6−(2−ヒドロキシイソプロピル)フェニル−ナフタレン 26.7g(78mmol)、クロロホルム570mlを窒素置換した1l 3つ口フラスコに入れ、この溶液に窒素気流下で三フッ化ホウ素・ジエチルエーテル錯体 14.5g(102mmol)を10分間かけて滴下した。滴下終了後、50℃まで昇温し、2時間攪拌した。室温まで冷却後、純水にて分液・洗浄し、得られた有機層を無水硫酸マグネシウムで乾燥した。濃縮後に得られた残渣をシリカゲルクロマトグラフィー(ヘキサン/トルエン=1/1(体積比))で精製後、ヘキサンで洗浄することにより、黄色粉末として13.5g(収率49%)を得た。得られた粉末のHPLC純度は99.4%であった。本サンプルをAとする。
【0038】
さらに、トルエン/ヘキサン=1/1(体積比)溶液から再結晶を2回行い、無色のハロゲン化合物を純度99.7%で得た。本サンプルをBとする。
【0039】
合成例2(化合物[B7]の合成)
100mlナス型フラスコに、合成例1で得たハロゲン化合物(サンプルAまたはB)3.0g(9.3mmol)、N,N’−ジフェニルベンジジン 1.54g(4.6mmol)、ナトリウム−tert−ブトキシド 1.1g(11.5mmol)およびキシレン80mlを導入して懸濁させ、窒素で系内を置換した。さらに、窒素雰囲気下、酢酸パラジウム4.2mg(0.019mmol,0.2mol%)およびトリ−tert−ブチルホスフィン 12mgを添加し、125℃に加熱した。所定温度で5時間熟成した後、反応液を室温まで冷却した。水40mlを添加後、ジクロロメタンで抽出を行い、有機相を水洗後、濃縮した。
【0040】
比較例1
合成例1のサンプルA(HPLC純度99.4%)を用い、合成例2に準じて目的物を合成した。得られた濃縮液をシリカゲルカラムクロマトグラフィー(トルエン)にて精製し、濃縮した。その後、10mlのトルエンに溶解後、あらかじめ用意したメタノール溶液に滴下して、生成した沈殿を濾過した。真空乾燥することにより、3.4gの化合物[B7]を得た(純度97.8%,収率89%)。
【0041】
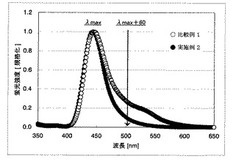
さらに、0.8gを340℃×10−3Paで5時間昇華精製を行い、0.67gのサンプルCを得た。HPLC分析での純度は99.3%であった。得られた化合物[B7]の蛍光スペクトルを図1に示す。蛍光強度λmax+60/蛍光強度λmax(以下、PL強度比と略す)は0.26であった。
【0042】
<素子作製>
厚さ130nmのITO透明電極を有するガラス基板をアセトン、イソプロピルアルコールで順次超音波洗浄し、次いで、イソプロピルアルコールで煮沸洗浄した後、乾燥した。さらに、UV/オゾン処理したものを透明導電性支持基板として使用した。ITO透明電極上に、銅フタロシアニンを真空蒸着法により25nmの膜厚で成膜した。次に、比較例1で得られた化合物[B7]を真空蒸着法により45nmの膜厚で成膜し、正孔輸送層を形成した。次に、アルミニウムトリスキノリノール錯体を真空蒸着法により60nmの膜厚で成膜し、電子輸送層を形成した。なお、上記有機化合物の蒸着条件は、真空度1.0×10−4Pa、成膜速度0.3nm/秒の同一条件で成膜した。
【0043】
次に、陰極としてLiFを0.5nm、Alを100nm蒸着し、金属電極を形成した。
【0044】
さらに、窒素雰囲気下、保護用ガラス基板を重ね、UV硬化樹脂で封止した。このようにして得られたEL素子に、ITO電極を正極、LiF−Al電極を負極にして、電流密度20mA/cm2でのEL素子評価を行った。その際の電圧、電流効率はそれぞれ5.6V、4.5cd/Aであった。また、輝度半減寿命は1000時間であった。結果を表1に示す。
【0045】
比較例2
比較例1でシリカゲルクロマトグラフィーにより精製して得られた濃縮液を再度シリカゲルクロマトグラフィーで2回精製した。その後、比較例1と同様な再沈操作を行い、3.2gの化合物[B7]を得た(純度98.1%,収率86%)。
【0046】
その後、1.0gを340℃×10−3Paで昇華精製を2回行い、0.59gの化合物[B7]を得た。HPLC分析での純度は99.8%であった。比較例1と同様な素子を作製し、EL素子を評価した。結果を表1に示す。
【0047】
実施例1
合成例1のサンプルB(HPLC純度99.7%)を用い、合成例2に準じて目的物を合成した。比較例1と同様な操作を行い、99.8%の化合物[B7]を得た。
【0048】
比較例1と同様な素子を作製し、EL素子を評価した。結果を表1に示す。
【0049】
実施例2
実施例1で得られたものを再度同一条件下で昇華精製を行い、HPLC純度99.9%のサンプルを得た。得られた化合物[B7]の蛍光スペクトルを図1に示す。PL強度比は0.09であった。比較例1と同様な素子を作製し、EL素子を評価した。結果を表1に示す。
【0050】
【表1】

【図面の簡単な説明】
【0051】
【図1】比較例1と実施例2で得られた化合物[B7]の蛍光スペクトルを示す。
【技術分野】
【0001】
本発明は、不純物濃度を低減した有機エレクトロルミネセンス材料およびそれを用いた有機エレクトロルミネセンス素子に関するものである。
【0002】
なお、以下、エレクトロルミネセンスをELと略す。
【背景技術】
【0003】
有機EL素子は、高速応答性・高視野角・高効率の発光素子として精力的に研究がなされており、近年、実用化も始まっている。しかし、今なお、寿命・効率の面で満足できるレベルにはなく、さらなる長寿命・高効率を目指した開発が続けられている。
【0004】
特に問題となっている有機EL素子の劣化は、さらなる改善が必要となっている。最近、有機EL素子の初期輝度低下および経時的な劣化要因として、材料中の不純物が大きく影響していることが報告されている(例えば、特許文献1〜6参照)。
【0005】
中でも、特許文献6には、有機EL材料の不純物として、これら材料を製造する際の原料物質に由来する不純物や、その製造工程で生成する中間体或いは前駆体、さらには、ハロゲン化合物を用いる際の中間体としての未反応物が記載されている。そして、不純物の定量法としては、高速液体クロマトグラフィーがよいと記載されている。
【0006】
また、特許文献3には、クロスカップリング反応により生じうる不純物、例えば、同じ反応種の間で結合したホモカップリング体、原料のハロゲン原子や金属原子が水素で置き換わったもの等を記載している。そして、その定量法は、やはり同じく高速液体クロマトグラフィーである。
【0007】
【特許文献1】特開2002−235077公報(特許請求の範囲)
【特許文献2】特開2002−373785公報(特許請求の範囲)
【特許文献3】特開2002−373786公報(特許請求の範囲)
【特許文献4】特開2003−68467公報(特許請求の範囲)
【特許文献5】特開2005−225916公報(特許請求の範囲)
【特許文献6】WO2000/41443号公報(特許請求の範囲)
【発明の開示】
【発明が解決しようとする課題】
【0008】
高い効率を示す上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料において、従来の高速液体クロマトグラフィーによる不純物の分析では、定量できない不純物があることが分かってきた。例えば、高速液体クロマトグラフィー分析で、同じ純度を示しているにも拘らず、EL素子での評価では、色純度、寿命がかなり異なり、ロット間でEL性能にバラツキが見られる場合があり、この不純物の挙動を解析しない限り、高効率・高寿命の素子を安定よく製造できないことが分かってきた。
【0009】
本発明の目的は、不純物の少ない上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料およびそれを用いた有機EL素子を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは鋭意検討した結果、一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料において、薄膜での蛍光スペクトルの最大蛍光波長(λmax)における蛍光強度に対する(λmax+60nm)における蛍光強度の比が0.2未満であることを特徴とする有機EL材料が、効率および素子の劣化抑制の面で非常に優れていることを見出し、本発明を完成するに至った。
【0011】
即ち、本発明は、下記一般式(1)または(2)で表される有機基を部分構造として有し、薄膜での蛍光スペクトルの最大蛍光波長(λmax)における蛍光強度に対する(λmax+60nm)における蛍光強度の比が0.2未満であることを特徴とする有機EL材料およびその用途に関するものである。
【0012】
【化1】

(式中、R1,R2は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R1とR2は結合して環を形成してもよい。)
上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料は、下記一般式(3)または(4)で表されるハロゲン化合物と、銅,パラジウムおよびニッケルのような遷移金属触媒存在下、有機金属化合物とのクロスカップリング反応、パラジウム触媒を用いたアミン化合物とのBuchwald−Hartwig反応(例えば、Journal of chemistry,65,1158−1174(2000)参照)、銅触媒を用いたアミン化合物とのUllmann反応等から合成することができる。
【0013】
【化2】

(式中、X1,X2は各々独立して水素原子、臭素原子、塩素原子またはヨウ素原子であり、少なくともいずれかはハロゲン原子である。また、R1,R2は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R1とR2は結合して環を形成してもよい。)
ここで言うクロスカップリング反応とは、炭素−炭素結合を生成する反応であり、有機ホウ素化合物を用いた鈴木−宮浦反応(例えば、Tetrahedron,58,9633−9695(2002)参照)、有機スズ化合物を用いたStill反応、有機亜鉛化合物を用いたNegishi反応等(例えば、Palladium Reagents and Catalysts(2004) John Wiley & Sons,Ltd.参照)が挙げられる。
【0014】
これら反応時の条件は、特に制限はない。しかし、これら反応で使用する遷移金属触媒に由来する金属残渣は、極力少ない方がよく、遷移金属触媒量は、上記一般式(3)または(4)で表されるハロゲン化合物1molに対して0.5mol%以下、より好ましくは0.2mol%以下である。
【0015】
さらに、このような公知の方法により得られる上記一般式(1)または(2)で表される有機EL材料は、シリカゲル、アルミナおよび活性白土等のクロマトグラフィー、再結晶、昇華精製等の精製操作を組み合わせて用いることにより精製される。
【0016】
以下に合成される有機EL材料を例示するが、特にこれらの化合物に限定されるものではない。
【0017】
【化3】

【0018】
【化4】

【0019】
【化5】

【0020】
【化6】

上記化合物は、下記一般式(5)〜(8)または(9)〜(11)で表されるフェニルナフタレン誘導体の環化反応を経由して合成できる。
【0021】
【化7】

【0022】
【化8】

(式中、X1,X2は各々独立して水素原子、臭素原子、塩素原子またはヨウ素原子であり、少なくともいずれかはハロゲン原子である。また、R3〜R6は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R3とR4またはR5とR6は結合して環を形成してもよい。)
上記一般式(5)〜(8)の環化反応は、酸触媒、有機溶媒中で実施される。酸触媒としては、ブレンステッド酸またはルイス酸であり、好ましくはルイス酸である。ルイス酸の具体例としては、塩化鉄(III)、臭化鉄(III)等の鉄化合物、塩化亜鉛、臭化亜鉛等の亜鉛化合物、塩化ジルコニウム等のジルコニウム化合物、塩化チタン、臭化チタン、チタニウムエトキシド等のチタン化合物、塩化アルミニウム、臭化アルミニウム等のアルミニウム化合物、三フッ化ホウ素、三フッ化ホウ素・エーテル錯体、三フッ化ホウ素・酢酸錯体、三臭化ホウ素等のホウ素化合物、塩化スカンジウム、塩化ランタン等のランタノイド金属塩等が挙げられる。中でもホウ素化合物が好ましい。
【0023】
酸触媒の使用量は、上記一般式(5)〜(8)のいずれかで表されるフェニルナフタレン誘導体1molに対して、通常、0.1〜20倍molである。また、使用される有機溶媒は、反応を阻害しないものであれば特に制限はないが、通常、ジクロロメタン、クロロホルム、四塩化炭素等のハロゲン系溶媒が好ましい。
【0024】
また、上記一般式(9)〜(12)で表されるフェニルナフタレン誘導体の環化反応は、強塩基存在下、有機溶媒中で実施される(例えば、Journal of Organic Chemistry,56,1683−1685(1991)参照)。強塩基としては、前記文献に記載されているようなtert−ブチルリチウム、リチウムジイソプロピルアミド等が挙げられる。有機溶媒としては、反応を阻害しないものであれば特に制限はないが、通常、テトラハイドロフラン、ジオキサン等のエーテル系溶媒が好ましい。
【0025】
なお、上記一般式(9)〜(12)のいずれかで表されるフェニルナフタレン誘導体の環化反応により、対応するベンゾフルオレノン誘導体が生成するが、例えば、上記一般式(3)または(4)で表されるハロゲン化合物への変換(例えば、R3,R4=フェニル)は、公知のグリニヤール反応およびフリーデル・クラフト反応を経て合成される(下式(13)参照)。
【0026】
【化9】

前述の環化反応により、95%以上の純度で目的とする上記一般式(3)または(4)で表されるハロゲン化合物が得られる。しかし、このまま次工程のクロスカップリング反応および/またはアミノ化反応を経て、再結晶、クロマトグラフィーまたは昇華による精製を行っても、高純度の上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料が得られないばかりか、素子特性でも良好な結果が得られない。
【0027】
特にアミノ化反応により合成される有機EL材料(例えば、上記例示化合物(A1)〜(A6)、(B1)〜(B8)、(C1)〜(C6))は、見かけの純度が高くても、素子特性、特に素子寿命の低下速度が大きい。
【0028】
前述の環化反応生成物は非常に複雑であり、必ずしも全て同定はできていないが、質量分析により、上記一般式(3)または(4)で表されるハロゲン化合物以外に、例えば、末端にオレフィン基または三級アルキル基を有する化合物、二量化した化合物、或いは重合した粘性化合物等の存在が示唆されている。これら不純物を再結晶、クロマトグラフィー等の公知の方法で精製し、高速液体クロマトグラフィー分析での不純物濃度を0.5面積%以下に低減させたハロゲン化合物を用いて、クロスカップリング反応および/またはアミノ化反応を行って得られた有機EL材料と、そうでない有機EL材料とを比較した場合、高速液体クロマトグラフィー分析で同じ純度を示しても、蛍光スペクトルにおいて、明らかに長波長成分のスペクトルが異なることが判明した。長波長成分のスペクトルが異なるとは、薄膜での蛍光スペクトルの最大蛍光波長(λmax)における蛍光強度に対する(λmax+60nm)における蛍光強度の比、即ち、蛍光強度λmax+60/蛍光強度λmaxが0.2未満であるかないかを指す。蛍光強度λmax+60/蛍光強度λmaxが0.2未満であることを満たす有機EL材料を用いると、EL素子の効率・寿命は向上することが分かった。
【0029】
なお、ここで言う薄膜での蛍光スペクトルは、粉末での蛍光スペクトルを指す。
【0030】
このように上記(1)または(2)で表される有機基を部分構造として有する有機EL材料の薄膜での蛍光強度λmax+60/蛍光強度λmaxが0.2未満であることにより、非常に高効率・高寿命の有機EL素子が可能となる。
【0031】
本発明の上記一般式(1)または(2)で表される有機基を部分構造とする有機EL材料は、正孔注入層、正孔輸送層、発光層、電子輸送層の少なくともいずれかの層に使用されるが、好ましくは正孔注入層、正孔輸送層、発光層である。
【発明の効果】
【0032】
本発明による上記一般式(1)または(2)で表される有機基を部分構造として有する有機EL材料は、さらなる低電圧駆動と高い電力効率を達成し、加えてそれからなる有機EL素子の耐久性向上が期待できる。
【実施例】
【0033】
以下、本発明を実施例に基づき、さらに詳細に説明する。
【0034】
高速液体クロマトグラフィー(HPLC)分析は、東ソー製 LC−8020シリーズ(CCPM−II型ポンプ、UV−8020型UV検出器、CO−8020型カラムオーブン)を使用し、移動層としてアセトニトリル:テトラハイドロフラン=9:1(体積比)、分析カラムとしてInertsil ODS−3V(4.5mm i.d.×250mm)を用いた。なお、流速は1ml/分、測定波長は254nm、カラム温度は45℃、注入量は5μlとした。
【0035】
蛍光スペクトルは、めのう乳鉢で粉砕した試料を粉末セルに充填し、日立製 F−2500を用いて、室温(大気中)、励起波長340nmの条件下で測定した。
【0036】
1H−NMR測定、13C−NMR測定およびFDMS測定は、各々バリアン社製 Gemini200、日立製作所製 M−80Bを使用して実施した。
【0037】
合成例1
2−ブロモ−6−(2−ヒドロキシイソプロピル)フェニル−ナフタレン 26.7g(78mmol)、クロロホルム570mlを窒素置換した1l 3つ口フラスコに入れ、この溶液に窒素気流下で三フッ化ホウ素・ジエチルエーテル錯体 14.5g(102mmol)を10分間かけて滴下した。滴下終了後、50℃まで昇温し、2時間攪拌した。室温まで冷却後、純水にて分液・洗浄し、得られた有機層を無水硫酸マグネシウムで乾燥した。濃縮後に得られた残渣をシリカゲルクロマトグラフィー(ヘキサン/トルエン=1/1(体積比))で精製後、ヘキサンで洗浄することにより、黄色粉末として13.5g(収率49%)を得た。得られた粉末のHPLC純度は99.4%であった。本サンプルをAとする。
【0038】
さらに、トルエン/ヘキサン=1/1(体積比)溶液から再結晶を2回行い、無色のハロゲン化合物を純度99.7%で得た。本サンプルをBとする。
【0039】
合成例2(化合物[B7]の合成)
100mlナス型フラスコに、合成例1で得たハロゲン化合物(サンプルAまたはB)3.0g(9.3mmol)、N,N’−ジフェニルベンジジン 1.54g(4.6mmol)、ナトリウム−tert−ブトキシド 1.1g(11.5mmol)およびキシレン80mlを導入して懸濁させ、窒素で系内を置換した。さらに、窒素雰囲気下、酢酸パラジウム4.2mg(0.019mmol,0.2mol%)およびトリ−tert−ブチルホスフィン 12mgを添加し、125℃に加熱した。所定温度で5時間熟成した後、反応液を室温まで冷却した。水40mlを添加後、ジクロロメタンで抽出を行い、有機相を水洗後、濃縮した。
【0040】
比較例1
合成例1のサンプルA(HPLC純度99.4%)を用い、合成例2に準じて目的物を合成した。得られた濃縮液をシリカゲルカラムクロマトグラフィー(トルエン)にて精製し、濃縮した。その後、10mlのトルエンに溶解後、あらかじめ用意したメタノール溶液に滴下して、生成した沈殿を濾過した。真空乾燥することにより、3.4gの化合物[B7]を得た(純度97.8%,収率89%)。
【0041】
さらに、0.8gを340℃×10−3Paで5時間昇華精製を行い、0.67gのサンプルCを得た。HPLC分析での純度は99.3%であった。得られた化合物[B7]の蛍光スペクトルを図1に示す。蛍光強度λmax+60/蛍光強度λmax(以下、PL強度比と略す)は0.26であった。
【0042】
<素子作製>
厚さ130nmのITO透明電極を有するガラス基板をアセトン、イソプロピルアルコールで順次超音波洗浄し、次いで、イソプロピルアルコールで煮沸洗浄した後、乾燥した。さらに、UV/オゾン処理したものを透明導電性支持基板として使用した。ITO透明電極上に、銅フタロシアニンを真空蒸着法により25nmの膜厚で成膜した。次に、比較例1で得られた化合物[B7]を真空蒸着法により45nmの膜厚で成膜し、正孔輸送層を形成した。次に、アルミニウムトリスキノリノール錯体を真空蒸着法により60nmの膜厚で成膜し、電子輸送層を形成した。なお、上記有機化合物の蒸着条件は、真空度1.0×10−4Pa、成膜速度0.3nm/秒の同一条件で成膜した。
【0043】
次に、陰極としてLiFを0.5nm、Alを100nm蒸着し、金属電極を形成した。
【0044】
さらに、窒素雰囲気下、保護用ガラス基板を重ね、UV硬化樹脂で封止した。このようにして得られたEL素子に、ITO電極を正極、LiF−Al電極を負極にして、電流密度20mA/cm2でのEL素子評価を行った。その際の電圧、電流効率はそれぞれ5.6V、4.5cd/Aであった。また、輝度半減寿命は1000時間であった。結果を表1に示す。
【0045】
比較例2
比較例1でシリカゲルクロマトグラフィーにより精製して得られた濃縮液を再度シリカゲルクロマトグラフィーで2回精製した。その後、比較例1と同様な再沈操作を行い、3.2gの化合物[B7]を得た(純度98.1%,収率86%)。
【0046】
その後、1.0gを340℃×10−3Paで昇華精製を2回行い、0.59gの化合物[B7]を得た。HPLC分析での純度は99.8%であった。比較例1と同様な素子を作製し、EL素子を評価した。結果を表1に示す。
【0047】
実施例1
合成例1のサンプルB(HPLC純度99.7%)を用い、合成例2に準じて目的物を合成した。比較例1と同様な操作を行い、99.8%の化合物[B7]を得た。
【0048】
比較例1と同様な素子を作製し、EL素子を評価した。結果を表1に示す。
【0049】
実施例2
実施例1で得られたものを再度同一条件下で昇華精製を行い、HPLC純度99.9%のサンプルを得た。得られた化合物[B7]の蛍光スペクトルを図1に示す。PL強度比は0.09であった。比較例1と同様な素子を作製し、EL素子を評価した。結果を表1に示す。
【0050】
【表1】

【図面の簡単な説明】
【0051】
【図1】比較例1と実施例2で得られた化合物[B7]の蛍光スペクトルを示す。
【特許請求の範囲】
【請求項1】
下記一般式(1)または(2)で表される有機基を部分構造として有し、薄膜での蛍光スペクトルの最大蛍光波長(以下、λmaxと略す)における蛍光強度に対する(λmax+60nm)における蛍光強度の比が0.2未満であることを特徴とする有機エレクトロルミネセンス材料。
【化1】

(式中、R1,R2は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R1とR2は結合して環を形成してもよい。)
【請求項2】
請求項1に記載の有機エレクトロルミネセンス材料において、有機基の部分構造が上記一般式(2)で表されることを特徴とする有機エレクトロルミネセンス材料。
【請求項3】
λmaxに対する(λmax+60nm)の蛍光強度比が0.15以下であることを特徴とする請求項1〜2に記載の有機エレクトロルミネセンス材料。
【請求項4】
上記一般式(1)または(2)の縮合環上の炭素原子にアミノ基が結合していることを特徴とする請求項1〜3に記載の有機エレクトロルミネセンス材料。
【請求項5】
請求項1〜4に記載の有機エレクトロルミネセンス材料において、R1およびR2が各々独立して炭素数1〜8のアルキル基であることを特徴とする有機エレクトロルミネセンス材料。
【請求項6】
一対の電極間に、請求項1〜5に記載の有機エレクトロルミネセンス材料を有機化合物層として少なくとも一層含むことを特徴とする有機エレクトロルミネセンス素子。
【請求項7】
請求項1〜5に記載の有機エレクトロルミネセンス材料を含む有機化合物層が、発光層、正孔輸送層、正孔注入層のいずれかであることを特徴とする請求項6に記載の有機エレクトロルミネセンス素子。
【請求項1】
下記一般式(1)または(2)で表される有機基を部分構造として有し、薄膜での蛍光スペクトルの最大蛍光波長(以下、λmaxと略す)における蛍光強度に対する(λmax+60nm)における蛍光強度の比が0.2未満であることを特徴とする有機エレクトロルミネセンス材料。
【化1】

(式中、R1,R2は各々独立して炭素数1〜8のアルキル基、または炭素数6〜12のアリール基を表す。なお、R1とR2は結合して環を形成してもよい。)
【請求項2】
請求項1に記載の有機エレクトロルミネセンス材料において、有機基の部分構造が上記一般式(2)で表されることを特徴とする有機エレクトロルミネセンス材料。
【請求項3】
λmaxに対する(λmax+60nm)の蛍光強度比が0.15以下であることを特徴とする請求項1〜2に記載の有機エレクトロルミネセンス材料。
【請求項4】
上記一般式(1)または(2)の縮合環上の炭素原子にアミノ基が結合していることを特徴とする請求項1〜3に記載の有機エレクトロルミネセンス材料。
【請求項5】
請求項1〜4に記載の有機エレクトロルミネセンス材料において、R1およびR2が各々独立して炭素数1〜8のアルキル基であることを特徴とする有機エレクトロルミネセンス材料。
【請求項6】
一対の電極間に、請求項1〜5に記載の有機エレクトロルミネセンス材料を有機化合物層として少なくとも一層含むことを特徴とする有機エレクトロルミネセンス素子。
【請求項7】
請求項1〜5に記載の有機エレクトロルミネセンス材料を含む有機化合物層が、発光層、正孔輸送層、正孔注入層のいずれかであることを特徴とする請求項6に記載の有機エレクトロルミネセンス素子。
【図1】




【公開番号】特開2008−285561(P2008−285561A)
【公開日】平成20年11月27日(2008.11.27)
【国際特許分類】
【出願番号】特願2007−130779(P2007−130779)
【出願日】平成19年5月16日(2007.5.16)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成20年11月27日(2008.11.27)
【国際特許分類】
【出願日】平成19年5月16日(2007.5.16)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

