有機エレクトロルミネッセンス化合物およびエレクトロルミネッセンス物質としてそれを使用したディスプレイデバイス
【課題】本発明の目的は、欠点を克服し、従来の有機主材料またはアルミニウム錯体と比較して発光特性および物理的性質が非常に優れているエレクトロルミネッセンス材料として混合型の配位子−金属錯体を提供することである。
【解決手段】本発明は、〔化学式1〕L1L2Mで表される有機エレクトロルミネッセンス化合物、およびそれをエレクトロルミネッセンス材料として含有するエレクトロルミネッセンスデバイスに関する。本発明によるエレクトロルミネッセンス化合物は、OLEDデバイスの主材料として使用した場合に駆動電圧を大きく低下させ、電力効率を大幅に向上するため有利である。
【解決手段】本発明は、〔化学式1〕L1L2Mで表される有機エレクトロルミネッセンス化合物、およびそれをエレクトロルミネッセンス材料として含有するエレクトロルミネッセンスデバイスに関する。本発明によるエレクトロルミネッセンス化合物は、OLEDデバイスの主材料として使用した場合に駆動電圧を大きく低下させ、電力効率を大幅に向上するため有利である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、金属錯体で構成され、優れた導電性、および高い効率を有するエレクトロルミネッセンス特性を示すエレクトロルミネッセンス化合物、ならびにそれを主材料として含むエレクトロルミネッセンスデバイスに関する。
【背景技術】
【0002】
OLEDの発光効率を決定する最も重要な要因は、エレクトロルミネッセンス材料のエレクトロルミネッセンス特性である。現在まで、蛍光材料がエレクトロルミネッセンス材料として広く使用されてきたが、リン光材料の開発が、エレクトロルミネッセンス機構を考えると理論的に最大4倍に発光効率を向上するための最良の解決法の1つである。
【0003】
現在まで、イリジウム(III)錯体がリン光ドーパントとして広く知られており、たとえば(acac)Ir(btp)2、Ir(ppy)3、およびFirpicがそれぞれ赤色、緑色、および青色のドーパントとして知られている。特に、さらに向上したリン光材料の開発が期待されているので、数多くのリン光材料が日本および欧州および米国で研究されている。
【0004】
【化1】

【0005】
リン光発光材料のための主材料としては、CBPが現在までで最も広く知られており、正孔ブロック層、たとえばBCPおよびBAlqなどの高効率OLEDが知られている。パイオニア(Pioneer)(日本)は、BAlq誘導体を主として使用する高効率OLEDを報告している。
【0006】
【化2】

【0007】
従来技術の材料は発光特性を考えれば好都合であるが、これらは低いガラス転移温度および非常に低い熱安定性を有するため、これらの材料は高温真空蒸着プロセス中に変化しやすい。さらに、これらはOLEDデバイスの寿命に関しては不十分であるため、より良好な材料安定性およびより優れたEL性能を有する主材料の開発が必要である。
【0008】
本発明によると、従来材料と比較して優れた材料安定性、優れた導電性、および高効率の発光特性を示す金属錯体材料を開発した。非結合電子対を有する側鎖置換基ヘテロ原子またはヘテロ原子含有芳香環は、金属に容易に配位する性質を有する。このような配位は、電気化学的な側面で非常に安定な性質を示し、そのことは広く知られている。本発明は、種々の配位子を開発し、上記性質を有する金属錯体を調製し、それらを主材料として利用した。
【0009】
多数のこのような種類の従来の錯体は、1990年代半ばから研究されている。しかし、これらの材料は、単にエレクトロルミネッセンス材料として利用されており、主材料としての利用はほとんどなかった。
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明の目的は、前述の不都合を克服し、従来の有機主材料またはアルミニウム錯体と比較して発光特性および物理的性質が非常に優れているエレクトロルミネッセンス材料として混合型の配位子−金属錯体を提供することである。本発明の別の目的は、このように調製したエレクトロルミネッセンス化合物を主材料として含有するエレクトロルミネッセンスデバイスとして提供することである。
【課題を解決するための手段】
【0011】
本発明は、化学式1によって表されるものを含むエレクトロルミネッセンス化合物、およびそれを主材料として含有するエレクトロルミネッセンスデバイスに関する。
L1L2M 〔化学式1〕
【0012】
上式中、L1およびL2は互いに異なり、以下の構造式の中の1つによって表されるものから選択される。
【0013】
【化3】

【0014】
上式中、Mは二価金属であり;Xは、O、S、またはSeであり;A環は、オキサゾール、チアゾール、イミダゾール、オキサジアゾール、チアジアゾール、ベンゾオキサゾール、ベンゾチアゾール、ベンズイミダゾール、ピリジン、またはキノリンであり、上記ピリジンまたはキノリンは、化学結合によってR1と縮合環を形成してもよく、該A環は、例えばC1〜C5アルキル、あるいは置換基を有するまたは有さないフェニルまたはナフチルなどの追加の置換基を有していてもよく;B環はピリジンまたはキノリンであり、該B環は、例えばC1〜C5アルキル、あるいは置換基を有するまたは有さないフェニルまたはナフチルなどの追加の置換基を有していてもよく;並びに、R1は独立に、水素またはC1〜C5アルキルを表す。
【0015】
上記の化学式1中、配位子L1およびL2が互いに異なり、以下の構造式の中の1つによって表されるものから選択され得る。
【0016】
【化4】

【0017】
上式中、Mは二価金属であり;Xは、O、S、またはSeであり;Yは、O、S、またはN−R4であり、Zは、CHまたはNであり;R2およびR3は独立に、水素、または置換基を有するまたは有さないフェニルまたはナフチルを表し;並びにR4は、C1〜C5アルキル、あるいは置換基を有するまたは有さないフェニルまたはナフチルである。
【0018】
化学式1中、Mは、好ましくはBe、Zn、Mg、Cu、およびNiから選択され、配位子L1およびL2は、好ましくは以下の構造式の中の1つによって表されるものから選択される。
【0019】
【化5】

【0020】
上式中、Xは、O、S、またはSeである。
【0021】
本発明によるエレクトロルミネッセンス化合物の配位子L1およびL2の例は以下の通りである。
【0022】
【化6】

【0023】
上式中、XはOまたはSである。
【0024】
具体的には、本発明による化学式1のエレクトロルミネッセンス化合物は、化学式1−1から1−18の1つによって表される化合物として例示することができる。
【0025】
【化7】

【0026】
【化8】

【0027】
本発明のその他およびさらなる目的、特徴、および利点は、以下の説明から、より十分に明らかとなるであろう。
【発明を実施するための最良の形態】
【0028】
本発明による代表的化合物を参照しながら、本発明によるエレクトロルミネッセンス化合物、それらの調製方法、およびそれらを使用したデバイスのエレクトロルミネッセンス特性に関して本発明をさらに説明するが、これらは単に説明のために提供しており、決して限定を意図したものではない。
【実施例】
【0029】
〔調製実施例1〕化学式1−1の化合物
50mLのメタノール中に、2−ピリジン−2−イル−フェノール(1.0g、5.84mmol)を溶解させ、それに10mLの1M水酸化ナトリウム水溶液を加えた。この溶液を混合したものに、10mLのメタノール水溶液(メタノール7mL:水3mL)中の硫酸ベリリウム四水和物(1.05g、5.93mmol)の溶液を滴下し、得られた混合物を周囲温度で2時間撹拌した。撹拌終了後、50mLのメタノール中に溶解させた2−ヒドロキシ−フェニルベンゾオキサゾール(1.54g、7.30mmol)をゆっくりと加えた。その反応溶液を次に周囲温度で2時間撹拌した。溶液の温度を50℃まで上昇させ、その溶液を10時間撹拌した。
【0030】
撹拌終了後、生成した沈殿物を濾過し、水(50mL)およびアセトン(50mL)で洗浄し、乾燥させて表題化合物の化合物(1−1)(0.80g、2.04mmol、収率:34%)を得た。
MS/FAB:391(測定値)、391.43(計算値)
EA:C 73.55%、H 4.59%、N 7.05%、O 12.41%
【0031】
〔調製実施例2〕化学式1−2の化合物
50mLのメタノール中に、2−ピリジン−2−イル−フェノール(1.0g、5.84mmol)を溶解させ、それに10mLの1M水酸化ナトリウム水溶液を加えた。この溶液を混合したものに、メタノール(10mL)中に溶解させた酢酸亜鉛(0.95g、5.18mmol)を滴下し、得られた混合物を周囲温度で2時間撹拌した。撹拌終了後、50mLのメタノール中に溶解させた2−ヒドロキシ−フェニルベンゾオキサゾール(1.50g、7.10mmol)をゆっくりと加えた。その反応混合物を次に周囲温度で10時間撹拌した。
【0032】
撹拌終了後、生成した沈殿物を濾過し、水(50mL)およびアセトン(50mL)で洗浄し、乾燥させて表題化合物の化合物(1−2)(0.72g、1.61mmol、収率:27%)を得た。
MS/FAB: 447(測定値)、447.79(計算値)
EA:C 64.22%、H 4.01%、N 6.05%、O 10.95%
【0033】
〔調製実施例3〕化学式1−3の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、10−ヒドロキシベンゾ[h]キノリン(1.48g、7.58mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して、表題化合物の化合物(1−3)(0.35g、0.84mmol、収率:14%)を得た。
MS/FAB:415(測定値)、415.46(計算値)
EA:C 75.02%、H 4.27%、N 6.64%、O 11.65%
【0034】
〔調製実施例4〕化学式1−4の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、10−ヒドロキシベンゾ[h]キノリン(1.48g、7.58mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して、表題化合物の化合物(1−4)(0.52g、1.10mmol、収率:19%)を得た。
MS/FAB: 471(測定値)、471.81(計算値)
EA:C 66.08%、H 3.79%、N 5.84%、O 10.30%
【0035】
〔調製実施例5〕化学式1−5の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、2−ヒドロキシ−フェニルベンゾチアゾール(1.72g、7.57mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−5)(0.96g、2.15mmol、収率:37%)を得た。
MS/FAB:447(測定値)、447.52(計算値)
EA:C 69.68%、H 4.01%、N 6.16%、O 10.85% S 7.05%
【0036】
〔調製実施例6〕化学式1−6の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、2−ヒドロキシ−フェニルベンゾチアゾール(1.72g、7.57mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−6)(1.36g、2.70mmol、収率:46%)を得た。
MS/FAB:503(測定値)、503.88(計算値)
EA:C 61.88%、H 3.54%、N 5.46%、O 9.73%、S 6.26%
【0037】
〔調製実施例7〕化学式1−7の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−ピリジン−2−イル−フェノール(1.30g、7.59mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−7)(0.59g、1.45mmol、収率:25%)を得た。
MS/FAB:407(測定値)、407.50(計算値)
EA:C 70.64%、H 4.35%、N 6.76%、O 7.96%、S 7.75%
【0038】
〔調製実施例8〕化学式1−8の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−ピリジン−2−イル−フェノール(1.30g、7.59mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−8)(0.83g、1.79mmol、収率:31%)を得た。
MS/FAB:463(測定値)、463.86(計算値)
EA:C 62.04%、H 3.82%、N 5.98%、O 7.02%、S 6.83%
【0039】
〔調製実施例9〕化学式1−9の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−ヒドロキシ−フェニルベンゾオキサゾールの代わりの10−ヒドロキシベンゾ[h]キノリン(1.48g、7.58mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−9)(0.98g、2.27mmol、収率:39%)を得た。
MS/FAB:431(測定値)、431.52(計算値)
EA:C 72.22%、H 4.10%、N 6.40%、O 7.62%、S 7.33%
【0040】
〔調製実施例10〕化学式1−10の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、10−ヒドロキシベンゾ[h]キノリン(1.48g、7.58mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例4と同じ手順を実施して表題化合物の化合物(1−10)(1.22g、2.50mmol、収率:43%)を得た。
MS/FAB:487(測定値)、487.88(計算値)
EA:C 63.93%、H 3.65%、N 5.64%、O 6.70%、S 6.44%
【0041】
〔調製実施例11〕化学式1−11の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)−フェノール(2.17g、7.58mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−11)(0.56g、1.11mmol、収率:19%)を得た。
MS/FAB:506(測定値)、506.57(計算値)
EA:C 75.67%、H 4.50%、N 8.20%、O 9.68%
【0042】
〔調製実施例12〕化学式1−12の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)−フェノール(2.17g、7.58mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−12)(0.72g、1.28mmol、収率:22%)を得た。
MS/FAB:562(測定値)、562.93(計算値)
EA:C 68.16%、H 4.05%、N 7.36%、O 8.68%
【0043】
〔調製実施例13〕化学式1−13の化合物
2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)フェノール(1.67g、5.83mmol)、2−ピリジン−2−イル−フェノール(1.30g、7.59mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−13)(0.84g、1.80mmol、収率:31%)を得た。
MS/FAB:466(測定値)、466.55(計算値)
EA:C 77.08%、H 4.87%、N 8.90%、O 6.98%
【0044】
〔調製実施例14〕化学式1−14の化合物
2−(1−フェニル−1H−ベンズイミダゾール−2−イル)−フェノール(1.67g、5.83mmol)、2−ピリジン−2−イル−フェノール(1.30g、7.59mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−14)(0.88g、1.68mmol、収率:29%)を得た。
MS/FAB:522(測定値)、522.91(計算値)
EA:C 68.81 %、H 4.33%、N 7.92%、O 6.32%
【0045】
〔調製実施例15〕化学式1−15の化合物
2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)−フェノール(1.67g、5.83mmol)、10−ヒドロキシベンゾ[h]キノリン(1.50g、7.68mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−15)(0.26g、0.53mmol、収率:9%)を得た。
MS/FAB:490(測定値)、490.57(計算値)
EA:C 78.20%、H 4.68%、N 8.42%、O 6.70%
【0046】
〔調製実施例16〕化学式1−16の化合物
2−(1−フェニル−1H−ベンズイミダゾール−2−イル)−フェノール(1.67g、5.83mmol)、10−ヒドロキシベンゾ[h]キノリン(1.50g、7.68mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−16)(0.42g、0.77mmol、収率:13%)を得た。
MS/FAB:546(測定値)、546.93(計算値)
EA:C 70.13%、H 4.16%、N 7.58%、O 5.98%
【0047】
〔調製実施例17〕化学式1−17の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)−フェノール(2.17g、7.58mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−17)(0.64g、1.22mmol、収率:21%)を得た。
MS/FAB:522(測定値)、522.64(計算値)
EA:C 73.42%、H 4.34%、N 7.97%、O 6.25%、S 6.04%
【0048】
〔調製実施例18〕化学式1−18の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−(1−フェニル−1H−ベンズイミダゾール−2−イル)−フェノール(2.17g、7.58mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−18)(0.94g、1.62mmol、収率:28%)を得た。
MS/FAB:578(測定値)、578.99(計算値)
EA:C 66.22%、H 3.94%、N 7.16%、O 5.70%、S 5.49%
【0049】
〔実施例1−18〕
発明による化合物を使用することによるOLEDデバイスの製造
本発明による主材料を使用した構造を有するOLEDデバイスを製造した。
【0050】
最初に、OLED用ガラスから得た透明電極ITO薄膜(15Ω/□)を、トリクロロエチレン、アセトン、エタノール、および蒸留水を使用した超音波洗浄にかけ、逐次、使用するまでイソプロナノール(isopronanol)中に保管した。
【0051】
次に、ITO基体を真空蒸着装置の基体フォルダに取り付け、以下の構造式で表される4,4’,4”−トリス(N,N−(2−ナフチル)−フェニルアミノ)トリフェニルアミン(2−TNATA)を、真空蒸着装置のセル中に入れ、次に、チャンバー中を最高10−6torrの真空まで通気した。電流をセルに印加して2−TNATAを蒸発させて、ITO基体上に厚さ40nmの正孔注入層を蒸着した。
【0052】
【化9】

【0053】
次に、真空蒸着装置の別のセルにN,N’−ビス(α−ナフチル)−N,N’−ジフェニル−4,4’−ジアミン(NPB)を投入し、電流をセルに印加してNPBを蒸発させて、上記正孔注入層上に厚さ20nmの正孔輸送層を蒸着した。
【0054】
【化10】

【0055】
正孔注入層および正孔輸送層を形成した後、それらの上にエレクトロルミネッセンス層を以下の方法で蒸着した。真空蒸着装置の一方のセルに、10−6torr未満の真空中で昇華させることによって精製した化合物1−1〜1−18から選択される化合物を主材料として投入し、他方のセルには(NPy)2Ir(acac)を投入した。これら2つの材料を、4〜10mol%のドーピングが得られるように異なる速度で蒸発させて、正孔輸送層上に厚さ30nmを有する発光層を蒸着した。
【0056】
【化11】

【0057】
次に、以下の構造式で表されるトリス(8−ヒドロキシキノリン)アルミニウム(III)(Alq)を、電子輸送層として厚さ20nmで蒸着し、以下の構造式で表されるリチウムキノレート(Liq)を、電子注入層として厚さ1〜2nmで蒸着した。その後、別の蒸着装置を使用してAlカソードを厚さ150nmで蒸着してOLEDを製造した。
【0058】
【化12】

【0059】
〔比較例1〕
ビス(2−メチル−8−キノリナト)(p−フェニルフェノラト)アルミニウム(III)(BAlq)を真空蒸着装置中の別のセルに発光主材料として投入し、(NPy)2Ir(acac)を発光材料としてさらに別のセルに投入し、これら2つの材料を、4〜10mol%のドーピングが得られるように異なる速度で蒸発させて、上記正孔輸送層上に厚さ30nmを有する発光層を蒸着したことを除けば、実施例1に記載の手順と同じ手順によりOLEDを作製した。
【0060】
【化13】

【0061】
〔実施例19〕
OLED特性の確認
実施例1〜18の中の1つから調製した本発明によるエレクトロルミネッセンス化合物および比較例1で調製した従来のエレクトロルミネッセンス化合物を含有する各OLEDデバイスの発光効率および電力効率を1,000cd/m2において測定し、それらの結果を表1に示している。
【0062】
本発明によって開発された錯体の発光特性を示す表から、本発明によって開発された錯体が従来材料と比較して性能に関して優れた特性を示すことが分かる。
【0063】
【表1】

【0064】
この表から分かるように、本発明によるエレクトロルミネッセンス材料を主として使用する場合、概してEL性能が大きく改善されている。
【0065】
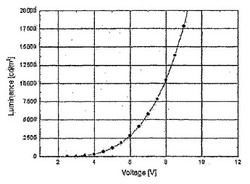
(NPy)2Ir(acac)化合物(橙赤色光を発する)をエレクトロルミネッセンス材料として使用し、かつBAlqを主材料として使用した比較例1のELスペクトルである図1は、最大ELピークを約624nmで示している。比較例1の輝度−印加電圧特性を示す図2から、比較例1のデバイスの駆動電圧が約5Vであり、1,000cd/m2(表1の基準)における駆動電圧が7.49Vであったことが確認される。比較例1の発光効率−輝度特性を示す図3および表1から、比較例1のデバイスは、輝度約1,000cd/m2および色座標(0.677,0.321)で、約6.16cd/Aの発光効率を示したことが確認される。
【0066】
実施例14により作製したOLEDデバイスの輝度−印加電圧特性を示す図4から分かるように、本発明によるエレクトロルミネッセンス化合物を使用した実施例14のデバイスは、約3Vの駆動電圧、約4.86Vにおいて約1,000cd/m2の輝度を示し、この結果から、比較例1のデバイスと比較して駆動電圧が少なくとも2.6Vが低下したことが分かる。
【0067】
さらに、実施例14によるデバイスの発光効率−輝度特性を示す図5から分かるように、これは1,000cd/m2の輝度において約6.67cd/Aの発光効率を示し、同じ輝度における比較例1のデバイスと比較して発光効率が約0.5cd/Aだけ高いことを示している。
【0068】
実際のパネルにおいて重要であると考えられる電力効率に関して、「電圧」の項が以下の式1の分母に含まれるため、より低い駆動電圧を有するデバイスが電力消費に関してはさらに好都合となる:
電力効率(lm/W)=(π×輝度)/(電流密度×電圧) (1)
【0069】
前記の表1から分かるように、本発明によるエレクトロルミネッセンス化合物を主材料として使用したデバイスは、駆動電圧が低下することで、0.5〜2.0lm/Wだけ電力効率が増加し、それによって電力消費が改善される。
【0070】
本発明によるエレクトロルミネッセンス化合物をOLEDデバイス中に主材料として使用すると、駆動電圧が顕著に低下し、電力効率が顕著に増加する。したがって、本発明の化合物は、次世代OLED材料に好適であり、OLEDを採用した大型ディスプレイの開発に大きく貢献することが期待される。
【図面の簡単な説明】
【0071】
【図1】比較例1により作製したOLEDデバイスのELスペクトルである。
【図2】比較例1により作製したOLEDデバイスの輝度−印加電圧特性である。
【図3】比較例1により作製したOLEDデバイスの発光効率−輝度特性である。
【図4】実施例1により作製したOLEDデバイスの輝度−印加電圧特性である。
【図5】実施例1により作製したOLEDデバイスの発光効率−輝度特性である。
【技術分野】
【0001】
本発明は、金属錯体で構成され、優れた導電性、および高い効率を有するエレクトロルミネッセンス特性を示すエレクトロルミネッセンス化合物、ならびにそれを主材料として含むエレクトロルミネッセンスデバイスに関する。
【背景技術】
【0002】
OLEDの発光効率を決定する最も重要な要因は、エレクトロルミネッセンス材料のエレクトロルミネッセンス特性である。現在まで、蛍光材料がエレクトロルミネッセンス材料として広く使用されてきたが、リン光材料の開発が、エレクトロルミネッセンス機構を考えると理論的に最大4倍に発光効率を向上するための最良の解決法の1つである。
【0003】
現在まで、イリジウム(III)錯体がリン光ドーパントとして広く知られており、たとえば(acac)Ir(btp)2、Ir(ppy)3、およびFirpicがそれぞれ赤色、緑色、および青色のドーパントとして知られている。特に、さらに向上したリン光材料の開発が期待されているので、数多くのリン光材料が日本および欧州および米国で研究されている。
【0004】
【化1】

【0005】
リン光発光材料のための主材料としては、CBPが現在までで最も広く知られており、正孔ブロック層、たとえばBCPおよびBAlqなどの高効率OLEDが知られている。パイオニア(Pioneer)(日本)は、BAlq誘導体を主として使用する高効率OLEDを報告している。
【0006】
【化2】

【0007】
従来技術の材料は発光特性を考えれば好都合であるが、これらは低いガラス転移温度および非常に低い熱安定性を有するため、これらの材料は高温真空蒸着プロセス中に変化しやすい。さらに、これらはOLEDデバイスの寿命に関しては不十分であるため、より良好な材料安定性およびより優れたEL性能を有する主材料の開発が必要である。
【0008】
本発明によると、従来材料と比較して優れた材料安定性、優れた導電性、および高効率の発光特性を示す金属錯体材料を開発した。非結合電子対を有する側鎖置換基ヘテロ原子またはヘテロ原子含有芳香環は、金属に容易に配位する性質を有する。このような配位は、電気化学的な側面で非常に安定な性質を示し、そのことは広く知られている。本発明は、種々の配位子を開発し、上記性質を有する金属錯体を調製し、それらを主材料として利用した。
【0009】
多数のこのような種類の従来の錯体は、1990年代半ばから研究されている。しかし、これらの材料は、単にエレクトロルミネッセンス材料として利用されており、主材料としての利用はほとんどなかった。
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明の目的は、前述の不都合を克服し、従来の有機主材料またはアルミニウム錯体と比較して発光特性および物理的性質が非常に優れているエレクトロルミネッセンス材料として混合型の配位子−金属錯体を提供することである。本発明の別の目的は、このように調製したエレクトロルミネッセンス化合物を主材料として含有するエレクトロルミネッセンスデバイスとして提供することである。
【課題を解決するための手段】
【0011】
本発明は、化学式1によって表されるものを含むエレクトロルミネッセンス化合物、およびそれを主材料として含有するエレクトロルミネッセンスデバイスに関する。
L1L2M 〔化学式1〕
【0012】
上式中、L1およびL2は互いに異なり、以下の構造式の中の1つによって表されるものから選択される。
【0013】
【化3】

【0014】
上式中、Mは二価金属であり;Xは、O、S、またはSeであり;A環は、オキサゾール、チアゾール、イミダゾール、オキサジアゾール、チアジアゾール、ベンゾオキサゾール、ベンゾチアゾール、ベンズイミダゾール、ピリジン、またはキノリンであり、上記ピリジンまたはキノリンは、化学結合によってR1と縮合環を形成してもよく、該A環は、例えばC1〜C5アルキル、あるいは置換基を有するまたは有さないフェニルまたはナフチルなどの追加の置換基を有していてもよく;B環はピリジンまたはキノリンであり、該B環は、例えばC1〜C5アルキル、あるいは置換基を有するまたは有さないフェニルまたはナフチルなどの追加の置換基を有していてもよく;並びに、R1は独立に、水素またはC1〜C5アルキルを表す。
【0015】
上記の化学式1中、配位子L1およびL2が互いに異なり、以下の構造式の中の1つによって表されるものから選択され得る。
【0016】
【化4】

【0017】
上式中、Mは二価金属であり;Xは、O、S、またはSeであり;Yは、O、S、またはN−R4であり、Zは、CHまたはNであり;R2およびR3は独立に、水素、または置換基を有するまたは有さないフェニルまたはナフチルを表し;並びにR4は、C1〜C5アルキル、あるいは置換基を有するまたは有さないフェニルまたはナフチルである。
【0018】
化学式1中、Mは、好ましくはBe、Zn、Mg、Cu、およびNiから選択され、配位子L1およびL2は、好ましくは以下の構造式の中の1つによって表されるものから選択される。
【0019】
【化5】

【0020】
上式中、Xは、O、S、またはSeである。
【0021】
本発明によるエレクトロルミネッセンス化合物の配位子L1およびL2の例は以下の通りである。
【0022】
【化6】

【0023】
上式中、XはOまたはSである。
【0024】
具体的には、本発明による化学式1のエレクトロルミネッセンス化合物は、化学式1−1から1−18の1つによって表される化合物として例示することができる。
【0025】
【化7】

【0026】
【化8】

【0027】
本発明のその他およびさらなる目的、特徴、および利点は、以下の説明から、より十分に明らかとなるであろう。
【発明を実施するための最良の形態】
【0028】
本発明による代表的化合物を参照しながら、本発明によるエレクトロルミネッセンス化合物、それらの調製方法、およびそれらを使用したデバイスのエレクトロルミネッセンス特性に関して本発明をさらに説明するが、これらは単に説明のために提供しており、決して限定を意図したものではない。
【実施例】
【0029】
〔調製実施例1〕化学式1−1の化合物
50mLのメタノール中に、2−ピリジン−2−イル−フェノール(1.0g、5.84mmol)を溶解させ、それに10mLの1M水酸化ナトリウム水溶液を加えた。この溶液を混合したものに、10mLのメタノール水溶液(メタノール7mL:水3mL)中の硫酸ベリリウム四水和物(1.05g、5.93mmol)の溶液を滴下し、得られた混合物を周囲温度で2時間撹拌した。撹拌終了後、50mLのメタノール中に溶解させた2−ヒドロキシ−フェニルベンゾオキサゾール(1.54g、7.30mmol)をゆっくりと加えた。その反応溶液を次に周囲温度で2時間撹拌した。溶液の温度を50℃まで上昇させ、その溶液を10時間撹拌した。
【0030】
撹拌終了後、生成した沈殿物を濾過し、水(50mL)およびアセトン(50mL)で洗浄し、乾燥させて表題化合物の化合物(1−1)(0.80g、2.04mmol、収率:34%)を得た。
MS/FAB:391(測定値)、391.43(計算値)
EA:C 73.55%、H 4.59%、N 7.05%、O 12.41%
【0031】
〔調製実施例2〕化学式1−2の化合物
50mLのメタノール中に、2−ピリジン−2−イル−フェノール(1.0g、5.84mmol)を溶解させ、それに10mLの1M水酸化ナトリウム水溶液を加えた。この溶液を混合したものに、メタノール(10mL)中に溶解させた酢酸亜鉛(0.95g、5.18mmol)を滴下し、得られた混合物を周囲温度で2時間撹拌した。撹拌終了後、50mLのメタノール中に溶解させた2−ヒドロキシ−フェニルベンゾオキサゾール(1.50g、7.10mmol)をゆっくりと加えた。その反応混合物を次に周囲温度で10時間撹拌した。
【0032】
撹拌終了後、生成した沈殿物を濾過し、水(50mL)およびアセトン(50mL)で洗浄し、乾燥させて表題化合物の化合物(1−2)(0.72g、1.61mmol、収率:27%)を得た。
MS/FAB: 447(測定値)、447.79(計算値)
EA:C 64.22%、H 4.01%、N 6.05%、O 10.95%
【0033】
〔調製実施例3〕化学式1−3の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、10−ヒドロキシベンゾ[h]キノリン(1.48g、7.58mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して、表題化合物の化合物(1−3)(0.35g、0.84mmol、収率:14%)を得た。
MS/FAB:415(測定値)、415.46(計算値)
EA:C 75.02%、H 4.27%、N 6.64%、O 11.65%
【0034】
〔調製実施例4〕化学式1−4の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、10−ヒドロキシベンゾ[h]キノリン(1.48g、7.58mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して、表題化合物の化合物(1−4)(0.52g、1.10mmol、収率:19%)を得た。
MS/FAB: 471(測定値)、471.81(計算値)
EA:C 66.08%、H 3.79%、N 5.84%、O 10.30%
【0035】
〔調製実施例5〕化学式1−5の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、2−ヒドロキシ−フェニルベンゾチアゾール(1.72g、7.57mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−5)(0.96g、2.15mmol、収率:37%)を得た。
MS/FAB:447(測定値)、447.52(計算値)
EA:C 69.68%、H 4.01%、N 6.16%、O 10.85% S 7.05%
【0036】
〔調製実施例6〕化学式1−6の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、2−ヒドロキシ−フェニルベンゾチアゾール(1.72g、7.57mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−6)(1.36g、2.70mmol、収率:46%)を得た。
MS/FAB:503(測定値)、503.88(計算値)
EA:C 61.88%、H 3.54%、N 5.46%、O 9.73%、S 6.26%
【0037】
〔調製実施例7〕化学式1−7の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−ピリジン−2−イル−フェノール(1.30g、7.59mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−7)(0.59g、1.45mmol、収率:25%)を得た。
MS/FAB:407(測定値)、407.50(計算値)
EA:C 70.64%、H 4.35%、N 6.76%、O 7.96%、S 7.75%
【0038】
〔調製実施例8〕化学式1−8の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−ピリジン−2−イル−フェノール(1.30g、7.59mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−8)(0.83g、1.79mmol、収率:31%)を得た。
MS/FAB:463(測定値)、463.86(計算値)
EA:C 62.04%、H 3.82%、N 5.98%、O 7.02%、S 6.83%
【0039】
〔調製実施例9〕化学式1−9の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−ヒドロキシ−フェニルベンゾオキサゾールの代わりの10−ヒドロキシベンゾ[h]キノリン(1.48g、7.58mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−9)(0.98g、2.27mmol、収率:39%)を得た。
MS/FAB:431(測定値)、431.52(計算値)
EA:C 72.22%、H 4.10%、N 6.40%、O 7.62%、S 7.33%
【0040】
〔調製実施例10〕化学式1−10の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、10−ヒドロキシベンゾ[h]キノリン(1.48g、7.58mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例4と同じ手順を実施して表題化合物の化合物(1−10)(1.22g、2.50mmol、収率:43%)を得た。
MS/FAB:487(測定値)、487.88(計算値)
EA:C 63.93%、H 3.65%、N 5.64%、O 6.70%、S 6.44%
【0041】
〔調製実施例11〕化学式1−11の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)−フェノール(2.17g、7.58mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−11)(0.56g、1.11mmol、収率:19%)を得た。
MS/FAB:506(測定値)、506.57(計算値)
EA:C 75.67%、H 4.50%、N 8.20%、O 9.68%
【0042】
〔調製実施例12〕化学式1−12の化合物
2−ヒドロキシ−フェニルベンゾオキサゾール(1.23g、5.82mmol)、2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)−フェノール(2.17g、7.58mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−12)(0.72g、1.28mmol、収率:22%)を得た。
MS/FAB:562(測定値)、562.93(計算値)
EA:C 68.16%、H 4.05%、N 7.36%、O 8.68%
【0043】
〔調製実施例13〕化学式1−13の化合物
2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)フェノール(1.67g、5.83mmol)、2−ピリジン−2−イル−フェノール(1.30g、7.59mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−13)(0.84g、1.80mmol、収率:31%)を得た。
MS/FAB:466(測定値)、466.55(計算値)
EA:C 77.08%、H 4.87%、N 8.90%、O 6.98%
【0044】
〔調製実施例14〕化学式1−14の化合物
2−(1−フェニル−1H−ベンズイミダゾール−2−イル)−フェノール(1.67g、5.83mmol)、2−ピリジン−2−イル−フェノール(1.30g、7.59mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−14)(0.88g、1.68mmol、収率:29%)を得た。
MS/FAB:522(測定値)、522.91(計算値)
EA:C 68.81 %、H 4.33%、N 7.92%、O 6.32%
【0045】
〔調製実施例15〕化学式1−15の化合物
2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)−フェノール(1.67g、5.83mmol)、10−ヒドロキシベンゾ[h]キノリン(1.50g、7.68mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−15)(0.26g、0.53mmol、収率:9%)を得た。
MS/FAB:490(測定値)、490.57(計算値)
EA:C 78.20%、H 4.68%、N 8.42%、O 6.70%
【0046】
〔調製実施例16〕化学式1−16の化合物
2−(1−フェニル−1H−ベンズイミダゾール−2−イル)−フェノール(1.67g、5.83mmol)、10−ヒドロキシベンゾ[h]キノリン(1.50g、7.68mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−16)(0.42g、0.77mmol、収率:13%)を得た。
MS/FAB:546(測定値)、546.93(計算値)
EA:C 70.13%、H 4.16%、N 7.58%、O 5.98%
【0047】
〔調製実施例17〕化学式1−17の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−(1−フェニル−1H−ベンゾイミダゾール−2−イル)−フェノール(2.17g、7.58mmol)、および硫酸ベリリウム四水和物(1.05g、5.93mmol)を使用することによって調製実施例1と同じ手順を実施して表題化合物の化合物(1−17)(0.64g、1.22mmol、収率:21%)を得た。
MS/FAB:522(測定値)、522.64(計算値)
EA:C 73.42%、H 4.34%、N 7.97%、O 6.25%、S 6.04%
【0048】
〔調製実施例18〕化学式1−18の化合物
2−ヒドロキシ−フェニルベンゾチアゾール(1.32g、5.80mmol)、2−(1−フェニル−1H−ベンズイミダゾール−2−イル)−フェノール(2.17g、7.58mmol)、および酢酸亜鉛(0.95g、5.18mmol)を使用することによって調製実施例2と同じ手順を実施して表題化合物の化合物(1−18)(0.94g、1.62mmol、収率:28%)を得た。
MS/FAB:578(測定値)、578.99(計算値)
EA:C 66.22%、H 3.94%、N 7.16%、O 5.70%、S 5.49%
【0049】
〔実施例1−18〕
発明による化合物を使用することによるOLEDデバイスの製造
本発明による主材料を使用した構造を有するOLEDデバイスを製造した。
【0050】
最初に、OLED用ガラスから得た透明電極ITO薄膜(15Ω/□)を、トリクロロエチレン、アセトン、エタノール、および蒸留水を使用した超音波洗浄にかけ、逐次、使用するまでイソプロナノール(isopronanol)中に保管した。
【0051】
次に、ITO基体を真空蒸着装置の基体フォルダに取り付け、以下の構造式で表される4,4’,4”−トリス(N,N−(2−ナフチル)−フェニルアミノ)トリフェニルアミン(2−TNATA)を、真空蒸着装置のセル中に入れ、次に、チャンバー中を最高10−6torrの真空まで通気した。電流をセルに印加して2−TNATAを蒸発させて、ITO基体上に厚さ40nmの正孔注入層を蒸着した。
【0052】
【化9】

【0053】
次に、真空蒸着装置の別のセルにN,N’−ビス(α−ナフチル)−N,N’−ジフェニル−4,4’−ジアミン(NPB)を投入し、電流をセルに印加してNPBを蒸発させて、上記正孔注入層上に厚さ20nmの正孔輸送層を蒸着した。
【0054】
【化10】

【0055】
正孔注入層および正孔輸送層を形成した後、それらの上にエレクトロルミネッセンス層を以下の方法で蒸着した。真空蒸着装置の一方のセルに、10−6torr未満の真空中で昇華させることによって精製した化合物1−1〜1−18から選択される化合物を主材料として投入し、他方のセルには(NPy)2Ir(acac)を投入した。これら2つの材料を、4〜10mol%のドーピングが得られるように異なる速度で蒸発させて、正孔輸送層上に厚さ30nmを有する発光層を蒸着した。
【0056】
【化11】

【0057】
次に、以下の構造式で表されるトリス(8−ヒドロキシキノリン)アルミニウム(III)(Alq)を、電子輸送層として厚さ20nmで蒸着し、以下の構造式で表されるリチウムキノレート(Liq)を、電子注入層として厚さ1〜2nmで蒸着した。その後、別の蒸着装置を使用してAlカソードを厚さ150nmで蒸着してOLEDを製造した。
【0058】
【化12】

【0059】
〔比較例1〕
ビス(2−メチル−8−キノリナト)(p−フェニルフェノラト)アルミニウム(III)(BAlq)を真空蒸着装置中の別のセルに発光主材料として投入し、(NPy)2Ir(acac)を発光材料としてさらに別のセルに投入し、これら2つの材料を、4〜10mol%のドーピングが得られるように異なる速度で蒸発させて、上記正孔輸送層上に厚さ30nmを有する発光層を蒸着したことを除けば、実施例1に記載の手順と同じ手順によりOLEDを作製した。
【0060】
【化13】

【0061】
〔実施例19〕
OLED特性の確認
実施例1〜18の中の1つから調製した本発明によるエレクトロルミネッセンス化合物および比較例1で調製した従来のエレクトロルミネッセンス化合物を含有する各OLEDデバイスの発光効率および電力効率を1,000cd/m2において測定し、それらの結果を表1に示している。
【0062】
本発明によって開発された錯体の発光特性を示す表から、本発明によって開発された錯体が従来材料と比較して性能に関して優れた特性を示すことが分かる。
【0063】
【表1】

【0064】
この表から分かるように、本発明によるエレクトロルミネッセンス材料を主として使用する場合、概してEL性能が大きく改善されている。
【0065】
(NPy)2Ir(acac)化合物(橙赤色光を発する)をエレクトロルミネッセンス材料として使用し、かつBAlqを主材料として使用した比較例1のELスペクトルである図1は、最大ELピークを約624nmで示している。比較例1の輝度−印加電圧特性を示す図2から、比較例1のデバイスの駆動電圧が約5Vであり、1,000cd/m2(表1の基準)における駆動電圧が7.49Vであったことが確認される。比較例1の発光効率−輝度特性を示す図3および表1から、比較例1のデバイスは、輝度約1,000cd/m2および色座標(0.677,0.321)で、約6.16cd/Aの発光効率を示したことが確認される。
【0066】
実施例14により作製したOLEDデバイスの輝度−印加電圧特性を示す図4から分かるように、本発明によるエレクトロルミネッセンス化合物を使用した実施例14のデバイスは、約3Vの駆動電圧、約4.86Vにおいて約1,000cd/m2の輝度を示し、この結果から、比較例1のデバイスと比較して駆動電圧が少なくとも2.6Vが低下したことが分かる。
【0067】
さらに、実施例14によるデバイスの発光効率−輝度特性を示す図5から分かるように、これは1,000cd/m2の輝度において約6.67cd/Aの発光効率を示し、同じ輝度における比較例1のデバイスと比較して発光効率が約0.5cd/Aだけ高いことを示している。
【0068】
実際のパネルにおいて重要であると考えられる電力効率に関して、「電圧」の項が以下の式1の分母に含まれるため、より低い駆動電圧を有するデバイスが電力消費に関してはさらに好都合となる:
電力効率(lm/W)=(π×輝度)/(電流密度×電圧) (1)
【0069】
前記の表1から分かるように、本発明によるエレクトロルミネッセンス化合物を主材料として使用したデバイスは、駆動電圧が低下することで、0.5〜2.0lm/Wだけ電力効率が増加し、それによって電力消費が改善される。
【0070】
本発明によるエレクトロルミネッセンス化合物をOLEDデバイス中に主材料として使用すると、駆動電圧が顕著に低下し、電力効率が顕著に増加する。したがって、本発明の化合物は、次世代OLED材料に好適であり、OLEDを採用した大型ディスプレイの開発に大きく貢献することが期待される。
【図面の簡単な説明】
【0071】
【図1】比較例1により作製したOLEDデバイスのELスペクトルである。
【図2】比較例1により作製したOLEDデバイスの輝度−印加電圧特性である。
【図3】比較例1により作製したOLEDデバイスの発光効率−輝度特性である。
【図4】実施例1により作製したOLEDデバイスの輝度−印加電圧特性である。
【図5】実施例1により作製したOLEDデバイスの発光効率−輝度特性である。
【特許請求の範囲】
【請求項1】
化学式1によって表されるエレクトロルミネッセンス化合物。
〔化学式1〕
L1L2M
(式中、L1およびL2は互いに異なり、および以下の構造式の中の1つによって表されるものから選択される:
【化1】

式中、Mは二価金属であり;Xは、O、SまたはSeであり;A環は、オキサゾール、チアゾール、イミダゾール、オキサジアゾール、チアジアゾール、ベンゾオキサゾール、ベンゾチアゾール、ベンズイミダゾール、ピリジンまたはキノリンであり、および前記ピリジンまたはキノリンは、化学結合によってR1と縮合環を形成してもよく、前記A環は、C1〜C5アルキル、または置換基を有するまたは有さないフェニルまたはナフチルなどの追加の置換基を有していてもよく;B環はピリジンまたはキノリンであり、該B環は、C1〜C5アルキル、または置換基を有するまたは有さないフェニルまたはナフチルなどの追加の置換基を有していてもよく;並びに、R1は独立に、水素またはC1〜C5アルキルを表す。)
【請求項2】
配位子L1およびL2が互いに異なり、および以下の構造式の中の1つによって表されるものから選択される、請求項1記載のエレクトロルミネッセンス化合物。
【化2】

(式中、Mは二価金属であり;Xは、O、SまたはSeであり;Yは、O、SまたはN−R4であり、Zは、CHまたはNであり;R2およびR3は独立に、水素、または置換基を有するまたは有さないフェニルまたはナフチルを表し;R4は、C1〜C5アルキル、または置換基を有するまたは有さないフェニルまたはナフチルである。)
【請求項3】
Mが、Be、Zn、Mg、Cu、およびNiから選択される、請求項1記載のエレクトロルミネッセンス化合物。
【請求項4】
配位子L1およびL2が互いに異なり、および以下の構造式の中の1つによって表されるものから選択される、請求項1記載のエレクトロルミネッセンス化合物。
【化3】

(式中、Xは、O、SまたはSeである。)
【請求項5】
配位子L1およびL2が互いに異なり、および以下の構造式の中の1つによって表されるものから選択される、請求項4記載のエレクトロルミネッセンス化合物。
【化4】

(式中、XはOまたはSである。)
【請求項6】
化学式1−1〜1−18の1つによって表される化合物から選択される、請求項5記載のエレクトロルミネッセンス化合物。
【化5】

【請求項7】
請求項1から6のいずれか1項記載のエレクトロルミネッセンス化合物を含むエレクトロルミネッセンスデバイス。
【請求項8】
前記エレクトロルミネッセンス化合物が発光層中の主材料として使用される、請求項7記載のエレクトロルミネッセンスデバイス。
【請求項1】
化学式1によって表されるエレクトロルミネッセンス化合物。
〔化学式1〕
L1L2M
(式中、L1およびL2は互いに異なり、および以下の構造式の中の1つによって表されるものから選択される:
【化1】

式中、Mは二価金属であり;Xは、O、SまたはSeであり;A環は、オキサゾール、チアゾール、イミダゾール、オキサジアゾール、チアジアゾール、ベンゾオキサゾール、ベンゾチアゾール、ベンズイミダゾール、ピリジンまたはキノリンであり、および前記ピリジンまたはキノリンは、化学結合によってR1と縮合環を形成してもよく、前記A環は、C1〜C5アルキル、または置換基を有するまたは有さないフェニルまたはナフチルなどの追加の置換基を有していてもよく;B環はピリジンまたはキノリンであり、該B環は、C1〜C5アルキル、または置換基を有するまたは有さないフェニルまたはナフチルなどの追加の置換基を有していてもよく;並びに、R1は独立に、水素またはC1〜C5アルキルを表す。)
【請求項2】
配位子L1およびL2が互いに異なり、および以下の構造式の中の1つによって表されるものから選択される、請求項1記載のエレクトロルミネッセンス化合物。
【化2】

(式中、Mは二価金属であり;Xは、O、SまたはSeであり;Yは、O、SまたはN−R4であり、Zは、CHまたはNであり;R2およびR3は独立に、水素、または置換基を有するまたは有さないフェニルまたはナフチルを表し;R4は、C1〜C5アルキル、または置換基を有するまたは有さないフェニルまたはナフチルである。)
【請求項3】
Mが、Be、Zn、Mg、Cu、およびNiから選択される、請求項1記載のエレクトロルミネッセンス化合物。
【請求項4】
配位子L1およびL2が互いに異なり、および以下の構造式の中の1つによって表されるものから選択される、請求項1記載のエレクトロルミネッセンス化合物。
【化3】

(式中、Xは、O、SまたはSeである。)
【請求項5】
配位子L1およびL2が互いに異なり、および以下の構造式の中の1つによって表されるものから選択される、請求項4記載のエレクトロルミネッセンス化合物。
【化4】

(式中、XはOまたはSである。)
【請求項6】
化学式1−1〜1−18の1つによって表される化合物から選択される、請求項5記載のエレクトロルミネッセンス化合物。
【化5】

【請求項7】
請求項1から6のいずれか1項記載のエレクトロルミネッセンス化合物を含むエレクトロルミネッセンスデバイス。
【請求項8】
前記エレクトロルミネッセンス化合物が発光層中の主材料として使用される、請求項7記載のエレクトロルミネッセンスデバイス。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公表番号】特表2009−524650(P2009−524650A)
【公表日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願番号】特願2008−552233(P2008−552233)
【出願日】平成19年1月24日(2007.1.24)
【国際出願番号】PCT/KR2007/000423
【国際公開番号】WO2007/086682
【国際公開日】平成19年8月2日(2007.8.2)
【出願人】(508223435)グラセル・ディスプレイ・インコーポレーテッド (53)
【出願人】(508224672)
【Fターム(参考)】
【公表日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願日】平成19年1月24日(2007.1.24)
【国際出願番号】PCT/KR2007/000423
【国際公開番号】WO2007/086682
【国際公開日】平成19年8月2日(2007.8.2)
【出願人】(508223435)グラセル・ディスプレイ・インコーポレーテッド (53)
【出願人】(508224672)

【Fターム(参考)】
[ Back to top ]

