有機光電素子用化合物およびこれを含む有機光電素子
本発明は、有機光電素子用化合物およびこれを含む有機光電素子に関し、前記有機光電素子用化合物は化学式1または2で表されるものを提供する。
前記化学式1および2の定義は、明細書に記載されたとおりである。前記有機光電素子用化合物を利用すると、低い駆動電圧を有し、熱的/電気化学的安定性および寿命、効率に優れた有機光電素子を提供することができる。
前記化学式1および2の定義は、明細書に記載されたとおりである。前記有機光電素子用化合物を利用すると、低い駆動電圧を有し、熱的/電気化学的安定性および寿命、効率に優れた有機光電素子を提供することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、寿命、効率、電気化学的安定性および熱的安定性に優れた有機光電素子を提供することができる有機光電素子用化合物およびこれを含む有機光電素子に関する。
【背景技術】
【0002】
有機光電素子(organic photoelectric device)は、正孔または電子を利用した電極と有機材料との間での電荷交換を必要とする素子である。
【0003】
有機光電素子は動作原理に応じて次のように分類することができる。第一の有機光電素子は、外部の光源からの光子により有機材料層で励起子(exciton)が生成し、この励起子が電子と正孔に分離され、そしてこの電子と正孔が互いに異なる電極に電流源(電圧源)として移動することによって駆動される電子素子である。
【0004】
第二の有機光電素子は、少なくとも2つの電極に電圧または電流を加えて前記電極の界面に位置する有機材料半導体に正孔または電子を注入し、そして注入された電子および正孔により素子が駆動される電子素子である。
【0005】
有機光電素子の例としては、有機発光ダイオード(OLED)、有機太陽電池、有機感光体ドラム(organic photo conductor drum)、有機トランジスタ、有機メモリ素子などがあり、これらは正孔注入材料もしくは正孔輸送材料、電子注入材料もしくは電子輸送材料、または発光材料を必要とする。
【0006】
有機発光ダイオード(organic light emitting diode、OLED)は、近年、平板ディスプレイ(flat panel display)の需要が増加することに伴い注目されている。一般に有機発光とは、有機物質を利用して電気エネルギーを光エネルギーに変換させることをいう。
【0007】
このような有機発光ダイオードは、有機発光材料に電流を加えて電気エネルギーを光に変換させる素子であって、陽極(anode)と陰極(cathode)との間に機能性有機材料層が挿入された構造を有する。前記有機材料層は、有機発光ダイオードの効率および安全性を高めるために、それぞれ異なる材料を含む多層、例えば、正孔注入層(HIL)、正孔輸送層(HTL)、発光層、電子輸送層(ETL)、電子注入層(EIL)などを含む。
【0008】
このような有機発光ダイオードにおいて、陽極と陰極との間に電圧をかけると、陽極からは正孔(hole)が、陰極からは電子(electron)が有機材料層に注入され、注入された正孔と電子が会って再結合(recombination)によりエネルギーの高い励起子を生成する。生成した励起子が基底状態(ground state)に移動しながら特定の波長を有する光を生成する。
【0009】
1987年にイーストマンコダック(Eastman Kodak)社では、発光層形成用材料として低分子の芳香族ジアミンとアルミニウム錯体とを含む有機発光ダイオードを最初に開発した(Applied Physics Letters,51,913,1987)。1987年にC.W.Tangらが最初に有機発光ダイオードとして実用的な素子を報告した(Applied Physics Letters,51 12,913〜915,1987)。
【0010】
前記文献によれば有機層はジアミン誘導体の薄膜(正孔輸送層(HTL))とトリス(8−ヒドロキシ−キノレート)アルミニウム(tris(8−hydroxy−quinolate)aluminum、Alq3)の薄膜とが積層された構造を有する。
【0011】
最近は、蛍光発光材料のみならず、燐光発光材料も有機発光ダイオードの発光材料として使用され得ることが知られるようになった(D.F.O’Brienら、Applied Physics Letters,74 3,442〜444,1999;M.A.Baldoら、Applied Physics letters,75 1,4〜6,1999)。このような燐光材料は基底状態(ground state)から励起状態(excited state)に電子が遷移した後、項間交差(intersystem crossing)を通じて一重項励起子が三重項励起子に無輻射遷移した後、三重項励起子が基底状態に遷移して発光するメカニズムによって発光する。
【0012】
前記のように有機発光ダイオードにおいて有機材料層は、発光材料および電荷輸送材料、例えば正孔注入材料、正孔輸送材料、電子輸送材料、電子注入材料などを含む。
【0013】
また、発光材料は、発光色に応じて青色、緑色、および赤色発光材料とさらに改善された天然色に近い色を発光させるための黄色および橙色発光材料とに分類される。
【0014】
一方、発光材料として一つの材料のみを使用する場合、分子間相互作用により最大発光波長が長波長側に移動したり、色純度が落ちる、または発光クエンチング効果により素子の効率が低下する。したがって、色純度を改善し、エネルギー移動を通じて発光効率および安定性を増加させるために、発光材料としてホスト/ドーパント系を使用しても良い。
【0015】
有機発光ダイオードが前述した優れた特徴を十分に発揮するためには、有機材料層を構成する材料、例えば正孔注入材料、正孔輸送材料、発光材料、電子輸送材料、電子注入材料、ホストおよび/またはドーパントなどの発光材料が安定であり且つ良好な効率を有する必要がある。しかしながら、現在まで有機発光ダイオード用の有機材料層を形成する材料の開発がまだ十分ではなく、したがって新たな材料が要求されている。このような材料開発は前述した他の有機光電素子でも同様に要求されている。
【0016】
また、低分子有機光電素子は、真空蒸着法により薄膜形態で素子を製造するため、効率および寿命性能が良く、高分子有機発光ダイオードは、インクジェット(Inkjet)またはスピンコーティング(spin coating)法を用いるため、初期投資費用が少なく、大面積化に有利な長所がある。
【0017】
低分子有機光電素子および高分子有機光電素子は共に自発光、高速応答、広視野角、超薄型、高画質、耐久性、広い駆動温度範囲などの長所を持っていて次世代ディスプレイとして注目を浴びつつある。特に既存のLCD(liquid crystal displayay)と比較して自発光型であることから、暗いところや外部の光が入っても視認性が良く、バックライトが必要ないため、LCDの1/3水準に厚さおよび重量を減少させることができる。
【0018】
また、応答速度がLCDに比べて1000倍以上速いマイクロ秒単位であるため、残像がない完璧な動画を実現することができる。したがって、最近、本格的なマルチメディア時代に合わせて最適のディスプレイとして脚光を浴びることが期待され、このような長所を基に初めに1980年代後半に開発されて以降、効率80倍、寿命100倍以上となる急激な技術発展をなしてきており、最近は40インチ有機発光ダイオードパネルが発表されるなど大型化が急速に進行されている。
【0019】
大型化のためには、発光効率の増大および素子の寿命向上が伴わなければならない。この時、素子の発光効率は発光層内の正孔と電子の結合が円滑に行われなければならない。しかし、一般に有機材料の電子移動度は正孔移動度に比べて遅いため、発光層内の正孔と電子の結合が効率的に行われるためには、効率的な電子輸送層(ETL)を用いて陰極からの電子注入および移動度を高めると同時に、正孔の移動を遮断可能でなければならない。
【0020】
また、寿命向上のためには、素子の駆動時に発生するジュール熱(Joule heat)により材料が結晶化されることを防止しなければならない。したがって、電子の注入および移動性に優れ、電気化学的安定性の高い有機化合物に対する開発が必要である。
【発明の概要】
【発明が解決しようとする課題】
【0021】
本発明の例示的な実施形態は、発光、または電子注入および/または輸送の役割を果たすことができ、適切なドーパントと共に発光ホストとしての役割を果たすことができる有機光電素子用化合物を提供する。
【0022】
また、本発明の他の実施形態は、寿命、効率、駆動電圧、電気化学的安定性および熱的安定性に優れた有機光電素子を提供し、特に電子輸送層(ETL)として有機光電素子に使用される場合、素子が低い駆動電圧と共に優れた性能の効率特性を有することができる有機光電素子を提供する。
【課題を解決するための手段】
【0023】
本発明の一実施形態よれば、下記化学式1で表される有機光電素子用化合物を提供する。
【0024】
【化1】

【0025】
前記化学式1中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【0026】
本発明の一実施形態例によれば、前記有機光電素子用化合物は、下記化学式2で表されてもよい。
【0027】
【化2】

【0028】
前記化学式2中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【0029】
本発明の一実施形態例によれば、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のピリダジニル基、置換または非置換のキノリニル基および置換または非置換のイソキノリニル基からなる群より選択されてもよい。
【0030】
本発明の一実施形態例によれば、前記B1は、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のピレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のキノリニル基、置換または非置換のベンゾキノリニル基および置換または非置換のフェナントロリニル基からなる群より選択されてもよい。
【0031】
本発明の他の一実施形態によれば、下記化学式3〜186のうちのいずれか一つで表される有機光電素子用化合物を提供する。
【0032】
【化3】

【0033】
【化4】

【0034】
【化5】

【0035】
【化6】

【0036】
【化7】

【0037】
【化8】

【0038】
【化9】

【0039】
【化10】

【0040】
【化11】

【0041】
【化12】

【0042】
【化13】

【0043】
【化14】

【0044】
【化15】

【0045】
【化16】

【0046】
【化17】

【0047】
【化18】

【0048】
【化19】

【0049】
【化20】

【0050】
【化21−1】

【0051】
【化21−2】

【0052】
【化21−3】

【0053】
【化21−4】

【0054】
【化21−5】

【0055】
本発明のさらに他の実施形態によれば、陽極、陰極および前記陽極と陰極との間に配置される少なくとも一層以上の有機薄膜層を含む有機光電素子において、前記有機薄膜層のうちの少なくとも一層は、前述した有機光電素子用化合物を含む有機光電素子を提供する。
【0056】
前記有機薄膜層は、発光層、正孔輸送層(HTL)、正孔注入層(HIL)、電子輸送層(ETL)、電子注入層(EIL)、正孔阻止層およびこれらの組み合わせからなる群より選択されてもよい。
【0057】
前記有機光電素子用化合物は、電子輸送層(ETL)または電子注入層(EIL)内に含まれてもよい。
【0058】
前記有機光電素子用化合物は、発光層内に含まれてもよい。
【0059】
前記有機光電素子用化合物は、発光層内に燐光または蛍光ホスト材料として使用されてもよい。
【0060】
前記有機光電素子用化合物は、発光層内に蛍光青色ドーパント材料として使用されてもよい。
【0061】
前記有機光電素子は、有機発光ダイオード、有機太陽電池、有機トランジスタ、有機感光体ドラムおよび有機メモリ素子からなる群より選択されてもよい。
【0062】
本発明のさらに他の実施形態によれば、前述した有機光電素子を含む表示装置を提供する。
【発明の効果】
【0063】
本発明によれば、優れた電気化学的および熱的安定性により寿命特性に優れ、低い駆動電圧でも高い発光効率を有する有機光電素子を提供することができる。
【図面の簡単な説明】
【0064】
【図1】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図2】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図3】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図4】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図5】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図6】本発明の実施例および比較例の電圧変化による電流密度の変化測定データである。
【図7】本発明の実施例および比較例の電圧変化による発光輝度の変化測定データである。
【図8】本発明の実施例および比較例の発光効率測定データである。
【図9】本発明の実施例および比較例の電力効率測定データである。
【発明を実施するための形態】
【0065】
以下、本発明の例示的な実施形態を詳しく説明する。但し、これらの実施形態は単なる例示であり、これらによって本発明が制限されず、後述する特許請求の範囲の範疇のみによって定義される。
【0066】
本明細書で「置換」の用語は、別途の定義がない限り、C1〜C30アルキル基、C1〜C10アルキルシリル基、C3〜C30シクロアルキル基、C6〜C30アリール基、C1〜C10アルコキシ基、フルオロ基、トリフルオロメチル基などのC1〜C10トリフルオロアルキル基、またはシアノ基で置換されたものを意味する。
【0067】
本明細書で「ヘテロ」の用語は、別途の定義がない限り、一つの環内にN、O、SおよびPからなる群より選択されるヘテロ原子を1〜3個含有し、残りは炭素であることを意味する。
【0068】
本明細書で「これらの組み合わせ」の用語は、別途の定義がない限り、二つ以上の置換基が連結基で結合されていたり、二つ以上の置換基が縮合して結合されているものを意味する。
【0069】
本明細書で「アルキル(alkyl)」の用語は、別途の定義がない限り、脂肪族炭化水素基を意味する。アルキル部位は、いかなるアルケンやアルキン部位を含んでいないものを意味する「飽和アルキル(saturated alkyl)」基であってもよい。アルキル部位は、少なくとも一つのアルケンまたはアルキン部位を含んでいるものを意味する「不飽和アルキル(unsaturated alkyl)」基であってもよい。「アルケン(alkene)」基は、少なくとも二つの炭素原子が結合して少なくとも一つの炭素−炭素二重結合を形成する基を意味し、「アルキン(alkyne)」基は、少なくとも二つの炭素原子が結合して少なくとも一つの炭素−炭素三重結合を形成する基を意味する。飽和や不飽和に関係なくアルキル基は分枝型、直鎖型または環状であってもよい。
【0070】
アルキル基は、1〜20個の炭素原子を有することができる。アルキル基は、1〜10個の炭素原子を有する中間サイズのアルキルであってもよい。アルキル基は、1〜6個の炭素原子を有する低級アルキルであってもよい。
【0071】
例えば、C1〜C4アルキルは、アルキル鎖に1〜4個の炭素原子、つまり、アルキル鎖はメチル、エチル、プロピル、イソ−プロピル、n−ブチル、イソ−ブチル、sec−ブチルおよびt−ブチルからなる群より選択されるものを意味する。
【0072】
アルキ基の例は、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、t−ブチル、ペンチル、ヘキシル、エテニル、プロペニル、ブテニル、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルなどから選択され、個別的且つ独立的に選択された一つまたはそれ以上の置換基で置換され得る。
【0073】
用語「アリール(aryl)」は、共役π電子系を有している少なくとも一つの環を持つ炭素環式アリール(例えば、フェニル)を含むアリール基を意味する。この用語は、単環または融合した多環(つまり、炭素原子の隣接した対を分けて有する環)グループを含む。また、この用語は一つの炭素を接点で有しているスピロ(spiro)化合物を含む。
【0074】
用語「ヘテロアリール(heteroaryl)」は、共役π電子系を有している少なくとも一つの環を有している複素環アリール(例えば、ピリジン)を含むアリールグループを意味する。この用語は、単環または融合した多環(つまり、炭素原子の隣接した対を分けて有する環)グループを含む。また、この用語は、一つの炭素を接点で有しているスピロ(spiro)化合物を含む。
【0075】
本発明の一実施形態による有機光電素子用化合物は、ベンゼンコア構造にアリール基またはヘテロアリール基が3個結合された構造であってもよい。前記3個の置換基結合位置はコアベンゼンの1、3および5位であってもよい。
【0076】
また、前記有機光電素子用化合物は、コア部分と前記二つの置換基に多様な置換基を導入することによって、多様なエネルギーバンドギャップを有する化合物を合成することができるため、電子注入層(EIL)および輸送層のみならず、発光層で要求される条件を満たすことができる化合物になり得る。
【0077】
前記化合物の置換基により適切なエネルギー準位を有する化合物を有機光電素子に使用することによって、電子伝達能力が強化されて効率および駆動電圧の面で優れた効果を有し、電気化学的および熱的安定性に優れて有機光電素子の駆動時に寿命特性を向上させることができる。
【0078】
このような本発明の一実施形態によれば、下記化学式1または2で表される有機光電素子用化合物を提供する。
【0079】
【化22】

【0080】
前記化学式1中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【0081】
前記コアベンゼンの3個の置換基のうちの少なくとも2つは、ヘテロアリール基であってもよい。つまり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−である。
【0082】
各ヘテロアリール基に含まれているヘテロ原子の数により多様な組み合わせが可能である。各組み合わせにより化合物の特性が変わり得、要求される特性により各組み合わせを選択することができる。
【0083】
好ましくは、ヘテロ原子はNであってもよい。但し、これに限定されない。
【0084】
また、前記化学式1の一実施形態のうちの一つである化合物は、下記化学式2で表される化合物であってもよい。
【0085】
【化23】

【0086】
前記化学式2中、Ar1〜Ar4、X1〜X6、Y1、Y2およびB1の定義は、前記化学式1に定義されたとおりである。
【0087】
前記Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であってもよい。より具体的な例として、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のピリダジニル基、置換または非置換のキノリニル基および置換または非置換のイソキノリニル基からなる群より選択され得る。
【0088】
前記Ar1〜Ar4の役割は、電子の輸送を円滑にすることができるという点である。つまり、電子を引く作用基の役割を果たすことができるため、電子の移動速度を正孔と同じように合わせることができる。所望の素子の特性に応じて適切に前記置換基を選択または変形して使用することができる。
【0089】
また、前記Ar1〜Ar4のπ共役長(π−conjugation length)を調節して可視領域で発光調節を可能にすることができる。これによって、前記化合物が有機光電素子の発光層に非常に有用に適用され得る。ただし、炭素数が前記範囲を越えるようになると、素子としての十分な効果を得られないことがある。
【0090】
また、このような置換基が結合された構造は、熱的安定性または酸化に対する抵抗性に優れ、有機光電素子の寿命特性を向上させることができる。
【0091】
前記置換基の種類により化合物の電子輸送能力を調節することができる。また、化合物の構造をバルクに製造することができ、結晶化度を低下することができる。化合物の結晶化度が低下すると素子の寿命が延長され得る。
【0092】
前記B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成することができ、その具体的な例としては、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のピレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のキノリニル基、置換または非置換のベンゾキノリニル基および置換または非置換のフェナントロリニル基からなる群より選択される化合物などがある。
【0093】
前記置換基の役割は電子の輸送を円滑にすることができるという点である。つまり、電子を引く作用基の役割を果たすことができるため、電子の移動速度を正孔と同じように合わせることができる。また、バルキーなアリール基を導入することによって熱的安定性を増加させることができる。所望の素子の特性により適切に前記置換基を選択または変形して使用することができる。
【0094】
前記有機光電素子用化合物は、下記化学式3〜化学式186で表示されるものを使用することができる。しかし、本発明は下記化合物に限定されない。
【0095】
【化24】

【0096】
【化25】

【0097】
【化26】

【0098】
【化27】

【0099】
【化28】

【0100】
【化29】

【0101】
【化30】

【0102】
【化31】

【0103】
【化32】

【0104】
【化33】

【0105】
【化34】

【0106】
【化35】

【0107】
【化36】

【0108】
【化37】

【0109】
【化38】

【0110】
【化39】

【0111】
【化40】

【0112】
【化41】

【0113】
【化42−1】

【0114】
【化42−2】

【0115】
【化42−3】

【0116】
【化42−4】

【0117】
【化42−5】

【0118】
前記のような化合物を含む有機光電素子用化合物は、ガラス転移温度が120℃以上であり、熱分解温度が400℃以上であって、熱的安定性に優れている。これによって、高効率の有機光電素子が実現可能である。
【0119】
前記のような化合物を含む有機光電素子用化合物は、発光、または電子注入および/または輸送の役割を果たすことができ、適切なドーパントと共に発光ホストとしての役割も果たすことができる。つまり、前記有機光電素子用化合物は、燐光または蛍光のホスト材料、青色の発光ドーパント材料、または電子輸送材料として使用され得る。
【0120】
本発明の一実施形態による有機光電素子用化合物は、有機薄膜層に使用されると有機光電素子の寿命特性、効率特性、電気化学的安定性および熱的安定性を向上させ、駆動電圧を低下させることができる。
【0121】
これによって、本発明の一実施形態は、前記有機光電素子用化合物を含む有機光電素子を提供する。この時、前記有機光電素子とは、有機発光ダイオード、有機太陽電池、有機トランジスタ、有機感光体ドラム、有機メモリ素子などを意味する。特に、有機太陽電池の場合には、本発明の一実施形態による有機光電素子用化合物が電極や電極バッファー層に含まれて量子効率を増加させ、有機トランジスタの場合には、ゲート、ソース−ドレイン電極などで電極物質として使用され得る。
【0122】
以下、有機光電素子について具体的に説明する。
【0123】
本発明の他の一実施形態は、陽極、陰極および前記陽極と陰極との間に配置される少なくとも一層以上の有機薄膜層を含む有機光電素子において、前記有機薄膜層のうちの少なくとも一層は、本発明の一実施形態による有機光電素子用化合物を含む有機光電素子を提供する。
【0124】
前記有機光電素子用化合物を含むことができる有機薄膜層としては、発光層、正孔輸送層(HTL)、正孔注入層(HIL)、電子輸送層(ETL)、電子注入層(EIL)、正孔阻止層およびこれらの組み合わせからなる群より選択される層を含むことができるところ、この中で少なくとも一層は、本発明による有機光電素子用化合物を含む。特に、電子輸送層(ETL)または電子注入層(EIL)に本発明の一実施形態による有機光電素子用化合物を含むことができる。また、前記有機光電素子用化合物が発光層内に含まれる場合、前記有機光電素子用化合物は燐光または蛍光ホストとして含まれ得、特に、蛍光青色ドーパント材料として含まれ得る。
【0125】
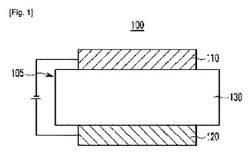
図1〜図5は、本発明の多様な実施形態による有機光電素子用化合物を含む有機光電素子の断面図である。
【0126】
図1〜図5を参照すれば、本発明の多様な実施形態による有機光電素子100、200、300、400、500は、陽極120、陰極110およびこの陽極と陰極との間に配置された少なくとも一層の有機薄膜層105を含む構造を有する。
【0127】
前記陽極120は、陽極物質を含み、この陽極物質としては、通常有機薄膜層へ正孔注入が円滑に行われるように仕事関数が大きい物質が好ましい。前記陽極物質の具体的な例としては、ニッケル、白金、バナジウム、クロム、銅、亜鉛、金のような金属またはこれらの合金;亜鉛酸化物、インジウム酸化物、インジウムスズ酸化物(ITO)、インジウム亜鉛酸化物(IZO)のような金属酸化物;ZnO:AlまたはSnO2:Sbのような金属含有酸化物;ポリ(3−メチルチオフェン)、ポリ[3,4−(エチレン−1,2−ジオキシ)チオフェン](polyehtylenedioxythiophene:PEDT)、ポリピロールおよびポリアニリンのような伝導性高分子などが挙げられるが、これに限定されない。好ましくは、前記陽極としてITO(indium tin oxide)を含む透明電極を使用することができる。
【0128】
前記陰極110は、陰極物質を含み、この陰極物質としては、通常有機薄膜層へ電子注入が容易に行われるように仕事関数が小さい物質であることが好ましい。陰極物質の具体的な例としては、マグネシウム、カルシウム、ナトリウム、カリウム、チタニウム、インジウム、イットリウム、リチウム、ガドリニウム、アルミニウム、銀、スズ、鉛、セシウム、バリウムなどのような金属またはこれらの合金;LiF/Al、LiO2/Al、LiF/Ca、LiF/AlおよびBaF2/Caのような多層構造物質などが挙げられるが、これに限定されない。好ましくは、前記陰極としてアルミニウムなどのような金属電極を使用することができる。
【0129】
まず、図1を参照すれば、図1は、有機薄膜層105として発光層130のみが存在する有機光電素子100を示した図面であり、前記有機薄膜層105は、発光層130のみで存在してもよい。
【0130】
図2を参照すれば、図2は、有機薄膜層105として電子輸送層(ETL)を含む発光層230と正孔輸送層(HTL)140が存在する2層型有機光電素子200を示した図面であり、図2に示されているように、有機薄膜層105は、発光層230および正孔輸送層(HTL)140を含む2層型であってもよい。この場合、発光層130は電子輸送層(ETL)の機能を果たし、正孔輸送層(HTL)140はITOのような透明電極との接合性および正孔輸送性を向上させる機能を果たす。
【0131】
図3を参照すれば、図3は、有機薄膜層105として電子輸送層(ETL)150、発光層130および正孔輸送層(HTL)140が存在する3層型有機光電素子300を示した図面であり、前記有機薄膜層105で発光層130は独立した形態からなっており、電子輸送性や正孔輸送性に優れた膜(電子輸送層(ETL)150および正孔輸送層(HTL)140)を別途の層で積んだ形態を示している。
【0132】
図4を参照すれば、図4は、有機薄膜層105として電子注入層(EIL)160、発光層130、正孔輸送層(HTL)140および正孔注入層(HIL)170が存在する4層型有機光電素子400を示した図面であり、前記正孔注入層(HIL)170は陽極として使用されるITOとの接合性を向上させることができる。
【0133】
図5を参照すれば、図5は、有機薄膜層105として電子注入層(EIL)160、電子輸送層(ETL)150、発光層130、正孔輸送層(HTL)140および正孔注入層(HIL)170のようなそれぞれ異なる機能を果たす5層が存在する5層型有機光電素子500を示した図面であり、前記有機光電素子500は、電子注入層(EIL)160を別途に形成して低電圧化に効果的である。
【0134】
前記図1〜図5において前記有機薄膜層105をなす電子輸送層(ETL)150、電子注入層(EIL)160、発光層130、230、正孔輸送層(HTL)140、正孔注入層(HIL)170およびこれらの組み合わせからなる群より選択されるいずれか一つは、前記有機光電素子用化合物を含む。この時、前記有機光電素子用化合物は、前記電子輸送層(ETL)150または電子注入層(EIL)160を含む電子輸送層(ETL)150に使用され得、その中でも電子輸送層(ETL)に含まれる場合、正孔阻止層(図示せず)を別途に形成する必要がないため、より単純化された構造の有機光電素子を提供することができるため好ましい。
【0135】
また、前記有機光電素子用化合物が発光層130、230内に含まれる場合、前記有機光電素子用化合物は燐光または蛍光ホストとして含まれ得、または蛍光青色ドーパントとして含まれ得る。
【0136】
上述した有機光電素子は、基板に陽極を形成した後、真空蒸着法(evaporation)、スパッタリング(sputtering)、プラズマメッキおよびイオンメッキのような乾式成膜法、またはスピンコーティング(spin coating)、浸漬法(dipping)、流動コーティング法(flow coating)のような湿式成膜法などで有機薄膜層を形成した後、その上に陰極を形成して製造することができる。
【0137】
本発明のさらに他の一実施形態によれば、前記有機光電素子を含む表示装置を提供する。
【実施例】
【0138】
以下の実施例を用いて本発明をより詳細に説明する。但し、これらの実施例は本発明を具体的に例示または説明するためのものに過ぎず、これらによって本発明が制限されてはならないことが理解されるであろう。
【0139】
(有機光電素子用化合物の製造)
実施例1:化合物3の合成
前記化合物3を下記反応式1に従って合成した。
【0140】
【化43】

【0141】
第1段階:中間体生成物(A)の合成
3,5−ジブロモベンズアルデヒド24.9g(94.7mmol)、2−アミノフェノール15.5g(142.0mmol)を酢酸(AcOH)700mlの溶媒に懸濁して懸濁液を製造し、収得した反応物を常温で12時間反応させた。収得した反応物を水1000ml中で固形化し、析出した固体化合物をろ過により分離し、水とメタノールで洗浄して乾燥した。収得した固体化合物と2,3−ジクロロ−5,6−ジシアノベンゼンキノン(DDQ)23.6g(104.2mmol)をジクロロメタン550mlに溶かした後、常温で1時間反応させた。収得した反応物の反応溶媒を減圧下で蒸留して除去した後、カラムで分離した後に乾燥させて中間体生成物(A)19.9g(収率:60%)の白色の固体を得た。
【0142】
第2段階:中間体生成物(B)の合成
中間体生成物(A)19.0g(53.82mmol)、ビス(ピナコレート)ジボラン32.8g(129.2mmol)、[1,1'−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(Pd(dppf)Cl2)2.2g(2.7mmol)、酢酸カリウム(KOAc)21.2g(215.3mmol)をジメチルホルムアミド(DMF)280mlの溶媒に溶かした後、80℃で12時間反応させた。収得した反応物をクロロホルムで抽出した後、溶媒を減圧下で除去してカラムで分離した後に乾燥させて中間体生成物(B)23.11g(収率:96%)の薄黄色の固体を得た。
【0143】
第3段階:中間体生成物(C)の合成
中間体生成物(B)10.0g(22.4mmol)、2,6−ジブロモ−4−ヨードピリジン13.48g(49.2mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]1.3g(1.1mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)12.4g(89.5mmol)を水200mlに溶解した溶液を添加して90℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去して水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて中間体生成物(C)10.0g(収率:99%)の白色の固体を得た。
【0144】
第4段階:化合物3の合成
中間体生成物(C)10.0g(20.5mmol)、フェニルボロン酸12.5g(102.6mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]2.4g(2.1mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)17.0g(123.2mmol)を水200mlに溶解した溶液を添加して100℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去して水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて化合物10.8g(収率:81%)の白色の固体を得た。(計算値:653.77/測定値:MS[M+1]654.25)
実施例2:化合物4の合成
前記化合物4を下記反応式2に従って合成した。
【0145】
【化44】

【0146】
第1段階:中間体生成物(D)の合成
9,10−フェナンスレンキノン13.0g(62.4mmol)、3,5−ジブロモベンズアルデヒド24.7g(93.7mmol)、アンモニウムバイカーボネート(NH4HCO3)24.7g(312.2mmol)をエタノール700mlに溶かした後、100℃で12時間反応させた。収得した反応物をろ過して分離した後、エタノールで洗浄し乾燥させて中間体生成物(D)89.4g(収率:73%)の薄黄色の固体を得た。
【0147】
第2段階:中間体生成物(E)の合成
中間体生成物(D)20.0g(44.4mmol)、ビス(ピナコレート)ジボラン26.9g(105.9mmol)、[1,1'−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(Pd(dppf)Cl2)1.8g(2.2mmol)、酢酸カリウム(KOAc)17.3g(215.3mmol)をジメチルホルムアミド(DMF)300mlの溶媒に溶かした後、80℃で12時間反応させた。収得した反応物をクロロホルムで抽出した後、溶媒を減圧下で除去し、カラムで分離した後に乾燥させて中間体生成物(E)22.65g(収率:94%)の白色の固体を得た。
【0148】
第3段階:中間体生成物(F)の合成
中間体生成物(E)10.0g(18.3mmol)、2,6−ジブロモ−4−ヨードピリジン11.0g(40.2mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]1.1g(0.9mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)10.1g(73.1mmol)を水200mlに溶解した溶液を添加して90℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去し、水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて中間体生成物(F)10.3g(収率:96%)の白色の固体を得た。
【0149】
第4段階:化合物4の合成
中間体生成物(F)10.0g(17.0mmol)、フェニルボロン酸10.4g(85.1mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]2.0g(1.7mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)14.1g(102.2mmol)を水200mlに溶解した溶液を添加して100℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去し、水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて化合物9.8g(収率:98%)の白色の固体を得た。(計算値:753.89/測定値:MS[M+1]754.28)
実施例3:化合物11の合成
前記化合物11を下記反応式3に従って合成した。
【0150】
【化45】

【0151】
第1段階:中間体生成物(G)の合成
エチルブロモアセテート105.0g(628.4mmol)とピリジン994.67g(12.6mol)の懸濁液を製造し、収得した反応物を常温で2時間反応させた。収得した反応物にジエチルエーテル1000mlを加えて固形化し、析出した固体化合物をろ過により分離し、ジエチルエーテルで洗浄し乾燥させて中間体生成物(G)152.3g(収率:98%)の薄黄色の固体を得た。
【0152】
第2段階:中間体生成物(H)の合成
中間体生成物(G)150.0g(609.5mmol)、トランスカルコン105.8g(609.5mmol)および酢酸アンモニウム(NH4OAC)375.85g(4.8mol)をメタノール1500mlに溶かした後、100℃で12時間反応させた。収得した反応物を水2000ml中で固形化し、析出した固体化合物をろ過により分離し、水とメタノールで洗浄し乾燥させて中間体生成物(H)98.15g(収率:78%)の白色の固体を得た。
【0153】
第3段階:中間体生成物(I)の合成
中間体生成物(H)98.0g(396.3mmol)、リン酸(P2O5)168.7g(1.2mol)およびテトラブチルアンモニウムブロマイド(TBAB)191.6g(594.4mol)をクロロベンゼン1400mlに溶かした後、140℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去し、収得した固体混合物を水500mlで洗浄した。収得した反応物をクロロホルムで抽出した後、溶媒を減圧下で除去してメタノール500mlで洗浄し乾燥させて中間体生成物(I)89.4g(収率:73%)の白色の固体を得た。
【0154】
第4段階:化合物11の合成
中間体生成物(B)17.0g(38.0mmol)、中間体生成物(I)28.3g(91.3mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]2.2g(1.9mmol)をテトラヒドロフラン(THF)500mlとトルエン300mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)21.0g(152mmol)を水300mlに溶解した溶液を添加し、110℃で24時間反応させた。収得した反応物の溶媒を減圧下で除去し、水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて化合物23.0g(収率:93%)の白色の固体を得た。(計算値:653.77/測定値:MS[M+1]654.25)
実施例4:化合物12の合成
前記化合物12を下記反応式4に従って合成した。
【0155】
【化46】

【0156】
中間体生成物(E)10.0g(18.3mmol)、中間体生成物(I)13.6g(43.9mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]1.1g(0.9mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)10.1g(73.1mmol)を水200mlに溶解した溶液を添加し、110℃で24時間反応させた。収得した反応物の溶媒を減圧下で除去し、水とメタノールで洗浄した。収得した固体化合物をクロロホルムとメタノールで再結晶し乾燥させて化合物11.5g(収率:83%)の白色の固体を得た。(計算値:753.89/測定値:MS[M+1]754.28)
(有機光電素子の製造)
実施例5:実施例1を用いた有機光電素子の製造
陽極としてはITOを1000Åの厚さに使用し、陰極としてはアルミニウム(Al)を1000Åの厚さに使用した。
【0157】
具体的に、有機光電素子の製造方法を説明すれば、陽極は、15Ω/cm2の面抵抗値を有するITOガラス基板を50mm×50mm×0.7mmの大きさに切断してアセトンとイソプロピルアルコールと純水中で各5分間超音波洗浄した後、30分間UVオゾン洗浄して使用した。
【0158】
前記ガラス基板上部に正孔注入層(HIL)として、N1,N1'−(ビフェニル−4,4'−ジイル)ビス(N1−(ナフタレン−2−イル)−N4,N4−ジフェニルベンゼン−1,4−ジアミン)585Åを蒸着し、次に正孔輸送層(HTL)としてN,N'−ジ(1−ナフチル)−N,N'−ジフェニルベンジジン50Åを蒸着した。
【0159】
発光層としてN,N,N',N'−テトラキス(3,4−ジメチルフェニル)クリセン−6,12−ジアミン4%および9−(3−(ナフタレン−1−イル)フェニル)−10−(ナフタレン−2−イル)アントラセン96%を200Åの厚さに蒸着した。
【0160】
次に、電子輸送層(ETL)として前記実施例1で製造された化合物およびLiq(1:1)300Åを蒸着した。
【0161】
前記電子輸送層(ETL)上部に電子注入層(EIL)としてリチウムキノレート(Lithium Quinolate、Liq)を5Åの厚さに真空蒸着し、Alを1000Åの厚さに真空蒸着してLiq/Al電極を形成した。
【0162】
実施例6:実施例2を用いた有機光電素子の製造
電子輸送層(ETL)として実施例1で製造された化合物の代わりに、実施例2で製造された化合物を使用したことを除いては、前記実施例5と同様に実施して有機光電素子を製造した。
【0163】
実施例7:実施例4を用いた有機光電素子の製造
電子輸送層(ETL)として実施例1で製造された化合物の代わりに、実施例4で製造された化合物を使用したことを除いては、前記実施例5と同様に実施して有機光電素子を製造した。
【0164】
比較例1:Alq3を用いた有機光電素子の製造
電子輸送層(ETL)として実施例1で製造された化合物の代わりに、トリス(8−ヒドロキシキノリナト)アルミニウム(Tris(8−hydroxyquinolinato)aluminium、Alq3)およびLiq300Åを使用したことを除いては、前記実施例5と同様に実施して有機光電素子を製造した。
【0165】
(有機光電素子の性能測定)
測定方法
このように製造されたそれぞれの有機光電素子に対して電圧による電流密度の変化、輝度の変化および発光効率を測定した。具体的な測定方法は次のとおりである。
【0166】
1)電圧変化による電流密度の変化測定
製造された有機光電素子に対し、電圧を0Vから4Vまで上昇させながら電流電圧計(Keithley 2400)を利用して単位素子に流れる電流値を測定し、測定された電流値を面積で割って結果を得た。その結果を図6に示した。
【0167】
2)電圧変化による輝度の変化測定
製造された有機光電素子に対し、電圧を0Vから4Vまで上昇させながら輝度計(Minolta Cs1000A)を利用してその時の輝度を測定して結果を得た。その結果を図7に示した。
【0168】
3)発光効率および電力効率の測定
前記1)および2)から測定された輝度と電流密度および電圧を利用して同一の明るさ(1000cd/m2)の電流効率(cd/A)および電力効率(lm/W)を計算した。その結果を図8および図9に示した。
【0169】
測定結果
上記で測定された結果を下記表1に示す。
【0170】
【表1】

【0171】
前記表1を参照すれば、有機発光ダイオードの特性評価結果、上記実施例5〜7の素子が駆動電圧側面で有利であり、発光効率および電力効率側面でも顕著に優れていることが分かる。したがって、素子寿命も増加することを予測することができる。
【0172】
本発明は前記実施例に限定されるものではなく、当業者によって特許請求の範囲の精神および技術的範囲に含まれる多様な変形および等価の形態で製造され得る。したがって、上記の実施例は例示的なものであり、本発明をいかようにも限定するものではないことを理解しなければならない。
【符号の説明】
【0173】
100、200、300、400、500…有機光電素子
110…陰極
120…陽極
105…有機薄膜層
130…発光層
140…正孔輸送層(HTL)
150…電子輸送層(ETL)
160…電子注入層(EIL)
170…正孔注入層(HIL)
230…発光層+電子輸送層(ETL)
【技術分野】
【0001】
本発明は、寿命、効率、電気化学的安定性および熱的安定性に優れた有機光電素子を提供することができる有機光電素子用化合物およびこれを含む有機光電素子に関する。
【背景技術】
【0002】
有機光電素子(organic photoelectric device)は、正孔または電子を利用した電極と有機材料との間での電荷交換を必要とする素子である。
【0003】
有機光電素子は動作原理に応じて次のように分類することができる。第一の有機光電素子は、外部の光源からの光子により有機材料層で励起子(exciton)が生成し、この励起子が電子と正孔に分離され、そしてこの電子と正孔が互いに異なる電極に電流源(電圧源)として移動することによって駆動される電子素子である。
【0004】
第二の有機光電素子は、少なくとも2つの電極に電圧または電流を加えて前記電極の界面に位置する有機材料半導体に正孔または電子を注入し、そして注入された電子および正孔により素子が駆動される電子素子である。
【0005】
有機光電素子の例としては、有機発光ダイオード(OLED)、有機太陽電池、有機感光体ドラム(organic photo conductor drum)、有機トランジスタ、有機メモリ素子などがあり、これらは正孔注入材料もしくは正孔輸送材料、電子注入材料もしくは電子輸送材料、または発光材料を必要とする。
【0006】
有機発光ダイオード(organic light emitting diode、OLED)は、近年、平板ディスプレイ(flat panel display)の需要が増加することに伴い注目されている。一般に有機発光とは、有機物質を利用して電気エネルギーを光エネルギーに変換させることをいう。
【0007】
このような有機発光ダイオードは、有機発光材料に電流を加えて電気エネルギーを光に変換させる素子であって、陽極(anode)と陰極(cathode)との間に機能性有機材料層が挿入された構造を有する。前記有機材料層は、有機発光ダイオードの効率および安全性を高めるために、それぞれ異なる材料を含む多層、例えば、正孔注入層(HIL)、正孔輸送層(HTL)、発光層、電子輸送層(ETL)、電子注入層(EIL)などを含む。
【0008】
このような有機発光ダイオードにおいて、陽極と陰極との間に電圧をかけると、陽極からは正孔(hole)が、陰極からは電子(electron)が有機材料層に注入され、注入された正孔と電子が会って再結合(recombination)によりエネルギーの高い励起子を生成する。生成した励起子が基底状態(ground state)に移動しながら特定の波長を有する光を生成する。
【0009】
1987年にイーストマンコダック(Eastman Kodak)社では、発光層形成用材料として低分子の芳香族ジアミンとアルミニウム錯体とを含む有機発光ダイオードを最初に開発した(Applied Physics Letters,51,913,1987)。1987年にC.W.Tangらが最初に有機発光ダイオードとして実用的な素子を報告した(Applied Physics Letters,51 12,913〜915,1987)。
【0010】
前記文献によれば有機層はジアミン誘導体の薄膜(正孔輸送層(HTL))とトリス(8−ヒドロキシ−キノレート)アルミニウム(tris(8−hydroxy−quinolate)aluminum、Alq3)の薄膜とが積層された構造を有する。
【0011】
最近は、蛍光発光材料のみならず、燐光発光材料も有機発光ダイオードの発光材料として使用され得ることが知られるようになった(D.F.O’Brienら、Applied Physics Letters,74 3,442〜444,1999;M.A.Baldoら、Applied Physics letters,75 1,4〜6,1999)。このような燐光材料は基底状態(ground state)から励起状態(excited state)に電子が遷移した後、項間交差(intersystem crossing)を通じて一重項励起子が三重項励起子に無輻射遷移した後、三重項励起子が基底状態に遷移して発光するメカニズムによって発光する。
【0012】
前記のように有機発光ダイオードにおいて有機材料層は、発光材料および電荷輸送材料、例えば正孔注入材料、正孔輸送材料、電子輸送材料、電子注入材料などを含む。
【0013】
また、発光材料は、発光色に応じて青色、緑色、および赤色発光材料とさらに改善された天然色に近い色を発光させるための黄色および橙色発光材料とに分類される。
【0014】
一方、発光材料として一つの材料のみを使用する場合、分子間相互作用により最大発光波長が長波長側に移動したり、色純度が落ちる、または発光クエンチング効果により素子の効率が低下する。したがって、色純度を改善し、エネルギー移動を通じて発光効率および安定性を増加させるために、発光材料としてホスト/ドーパント系を使用しても良い。
【0015】
有機発光ダイオードが前述した優れた特徴を十分に発揮するためには、有機材料層を構成する材料、例えば正孔注入材料、正孔輸送材料、発光材料、電子輸送材料、電子注入材料、ホストおよび/またはドーパントなどの発光材料が安定であり且つ良好な効率を有する必要がある。しかしながら、現在まで有機発光ダイオード用の有機材料層を形成する材料の開発がまだ十分ではなく、したがって新たな材料が要求されている。このような材料開発は前述した他の有機光電素子でも同様に要求されている。
【0016】
また、低分子有機光電素子は、真空蒸着法により薄膜形態で素子を製造するため、効率および寿命性能が良く、高分子有機発光ダイオードは、インクジェット(Inkjet)またはスピンコーティング(spin coating)法を用いるため、初期投資費用が少なく、大面積化に有利な長所がある。
【0017】
低分子有機光電素子および高分子有機光電素子は共に自発光、高速応答、広視野角、超薄型、高画質、耐久性、広い駆動温度範囲などの長所を持っていて次世代ディスプレイとして注目を浴びつつある。特に既存のLCD(liquid crystal displayay)と比較して自発光型であることから、暗いところや外部の光が入っても視認性が良く、バックライトが必要ないため、LCDの1/3水準に厚さおよび重量を減少させることができる。
【0018】
また、応答速度がLCDに比べて1000倍以上速いマイクロ秒単位であるため、残像がない完璧な動画を実現することができる。したがって、最近、本格的なマルチメディア時代に合わせて最適のディスプレイとして脚光を浴びることが期待され、このような長所を基に初めに1980年代後半に開発されて以降、効率80倍、寿命100倍以上となる急激な技術発展をなしてきており、最近は40インチ有機発光ダイオードパネルが発表されるなど大型化が急速に進行されている。
【0019】
大型化のためには、発光効率の増大および素子の寿命向上が伴わなければならない。この時、素子の発光効率は発光層内の正孔と電子の結合が円滑に行われなければならない。しかし、一般に有機材料の電子移動度は正孔移動度に比べて遅いため、発光層内の正孔と電子の結合が効率的に行われるためには、効率的な電子輸送層(ETL)を用いて陰極からの電子注入および移動度を高めると同時に、正孔の移動を遮断可能でなければならない。
【0020】
また、寿命向上のためには、素子の駆動時に発生するジュール熱(Joule heat)により材料が結晶化されることを防止しなければならない。したがって、電子の注入および移動性に優れ、電気化学的安定性の高い有機化合物に対する開発が必要である。
【発明の概要】
【発明が解決しようとする課題】
【0021】
本発明の例示的な実施形態は、発光、または電子注入および/または輸送の役割を果たすことができ、適切なドーパントと共に発光ホストとしての役割を果たすことができる有機光電素子用化合物を提供する。
【0022】
また、本発明の他の実施形態は、寿命、効率、駆動電圧、電気化学的安定性および熱的安定性に優れた有機光電素子を提供し、特に電子輸送層(ETL)として有機光電素子に使用される場合、素子が低い駆動電圧と共に優れた性能の効率特性を有することができる有機光電素子を提供する。
【課題を解決するための手段】
【0023】
本発明の一実施形態よれば、下記化学式1で表される有機光電素子用化合物を提供する。
【0024】
【化1】

【0025】
前記化学式1中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【0026】
本発明の一実施形態例によれば、前記有機光電素子用化合物は、下記化学式2で表されてもよい。
【0027】
【化2】

【0028】
前記化学式2中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【0029】
本発明の一実施形態例によれば、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のピリダジニル基、置換または非置換のキノリニル基および置換または非置換のイソキノリニル基からなる群より選択されてもよい。
【0030】
本発明の一実施形態例によれば、前記B1は、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のピレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のキノリニル基、置換または非置換のベンゾキノリニル基および置換または非置換のフェナントロリニル基からなる群より選択されてもよい。
【0031】
本発明の他の一実施形態によれば、下記化学式3〜186のうちのいずれか一つで表される有機光電素子用化合物を提供する。
【0032】
【化3】

【0033】
【化4】

【0034】
【化5】

【0035】
【化6】

【0036】
【化7】

【0037】
【化8】

【0038】
【化9】

【0039】
【化10】

【0040】
【化11】

【0041】
【化12】

【0042】
【化13】

【0043】
【化14】

【0044】
【化15】

【0045】
【化16】

【0046】
【化17】

【0047】
【化18】

【0048】
【化19】

【0049】
【化20】

【0050】
【化21−1】

【0051】
【化21−2】

【0052】
【化21−3】

【0053】
【化21−4】

【0054】
【化21−5】

【0055】
本発明のさらに他の実施形態によれば、陽極、陰極および前記陽極と陰極との間に配置される少なくとも一層以上の有機薄膜層を含む有機光電素子において、前記有機薄膜層のうちの少なくとも一層は、前述した有機光電素子用化合物を含む有機光電素子を提供する。
【0056】
前記有機薄膜層は、発光層、正孔輸送層(HTL)、正孔注入層(HIL)、電子輸送層(ETL)、電子注入層(EIL)、正孔阻止層およびこれらの組み合わせからなる群より選択されてもよい。
【0057】
前記有機光電素子用化合物は、電子輸送層(ETL)または電子注入層(EIL)内に含まれてもよい。
【0058】
前記有機光電素子用化合物は、発光層内に含まれてもよい。
【0059】
前記有機光電素子用化合物は、発光層内に燐光または蛍光ホスト材料として使用されてもよい。
【0060】
前記有機光電素子用化合物は、発光層内に蛍光青色ドーパント材料として使用されてもよい。
【0061】
前記有機光電素子は、有機発光ダイオード、有機太陽電池、有機トランジスタ、有機感光体ドラムおよび有機メモリ素子からなる群より選択されてもよい。
【0062】
本発明のさらに他の実施形態によれば、前述した有機光電素子を含む表示装置を提供する。
【発明の効果】
【0063】
本発明によれば、優れた電気化学的および熱的安定性により寿命特性に優れ、低い駆動電圧でも高い発光効率を有する有機光電素子を提供することができる。
【図面の簡単な説明】
【0064】
【図1】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図2】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図3】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図4】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図5】本発明の多様な実施形態による有機光電素子用化合物を用いて製造され得る有機光電素子を示す断面図である。
【図6】本発明の実施例および比較例の電圧変化による電流密度の変化測定データである。
【図7】本発明の実施例および比較例の電圧変化による発光輝度の変化測定データである。
【図8】本発明の実施例および比較例の発光効率測定データである。
【図9】本発明の実施例および比較例の電力効率測定データである。
【発明を実施するための形態】
【0065】
以下、本発明の例示的な実施形態を詳しく説明する。但し、これらの実施形態は単なる例示であり、これらによって本発明が制限されず、後述する特許請求の範囲の範疇のみによって定義される。
【0066】
本明細書で「置換」の用語は、別途の定義がない限り、C1〜C30アルキル基、C1〜C10アルキルシリル基、C3〜C30シクロアルキル基、C6〜C30アリール基、C1〜C10アルコキシ基、フルオロ基、トリフルオロメチル基などのC1〜C10トリフルオロアルキル基、またはシアノ基で置換されたものを意味する。
【0067】
本明細書で「ヘテロ」の用語は、別途の定義がない限り、一つの環内にN、O、SおよびPからなる群より選択されるヘテロ原子を1〜3個含有し、残りは炭素であることを意味する。
【0068】
本明細書で「これらの組み合わせ」の用語は、別途の定義がない限り、二つ以上の置換基が連結基で結合されていたり、二つ以上の置換基が縮合して結合されているものを意味する。
【0069】
本明細書で「アルキル(alkyl)」の用語は、別途の定義がない限り、脂肪族炭化水素基を意味する。アルキル部位は、いかなるアルケンやアルキン部位を含んでいないものを意味する「飽和アルキル(saturated alkyl)」基であってもよい。アルキル部位は、少なくとも一つのアルケンまたはアルキン部位を含んでいるものを意味する「不飽和アルキル(unsaturated alkyl)」基であってもよい。「アルケン(alkene)」基は、少なくとも二つの炭素原子が結合して少なくとも一つの炭素−炭素二重結合を形成する基を意味し、「アルキン(alkyne)」基は、少なくとも二つの炭素原子が結合して少なくとも一つの炭素−炭素三重結合を形成する基を意味する。飽和や不飽和に関係なくアルキル基は分枝型、直鎖型または環状であってもよい。
【0070】
アルキル基は、1〜20個の炭素原子を有することができる。アルキル基は、1〜10個の炭素原子を有する中間サイズのアルキルであってもよい。アルキル基は、1〜6個の炭素原子を有する低級アルキルであってもよい。
【0071】
例えば、C1〜C4アルキルは、アルキル鎖に1〜4個の炭素原子、つまり、アルキル鎖はメチル、エチル、プロピル、イソ−プロピル、n−ブチル、イソ−ブチル、sec−ブチルおよびt−ブチルからなる群より選択されるものを意味する。
【0072】
アルキ基の例は、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、t−ブチル、ペンチル、ヘキシル、エテニル、プロペニル、ブテニル、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルなどから選択され、個別的且つ独立的に選択された一つまたはそれ以上の置換基で置換され得る。
【0073】
用語「アリール(aryl)」は、共役π電子系を有している少なくとも一つの環を持つ炭素環式アリール(例えば、フェニル)を含むアリール基を意味する。この用語は、単環または融合した多環(つまり、炭素原子の隣接した対を分けて有する環)グループを含む。また、この用語は一つの炭素を接点で有しているスピロ(spiro)化合物を含む。
【0074】
用語「ヘテロアリール(heteroaryl)」は、共役π電子系を有している少なくとも一つの環を有している複素環アリール(例えば、ピリジン)を含むアリールグループを意味する。この用語は、単環または融合した多環(つまり、炭素原子の隣接した対を分けて有する環)グループを含む。また、この用語は、一つの炭素を接点で有しているスピロ(spiro)化合物を含む。
【0075】
本発明の一実施形態による有機光電素子用化合物は、ベンゼンコア構造にアリール基またはヘテロアリール基が3個結合された構造であってもよい。前記3個の置換基結合位置はコアベンゼンの1、3および5位であってもよい。
【0076】
また、前記有機光電素子用化合物は、コア部分と前記二つの置換基に多様な置換基を導入することによって、多様なエネルギーバンドギャップを有する化合物を合成することができるため、電子注入層(EIL)および輸送層のみならず、発光層で要求される条件を満たすことができる化合物になり得る。
【0077】
前記化合物の置換基により適切なエネルギー準位を有する化合物を有機光電素子に使用することによって、電子伝達能力が強化されて効率および駆動電圧の面で優れた効果を有し、電気化学的および熱的安定性に優れて有機光電素子の駆動時に寿命特性を向上させることができる。
【0078】
このような本発明の一実施形態によれば、下記化学式1または2で表される有機光電素子用化合物を提供する。
【0079】
【化22】

【0080】
前記化学式1中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【0081】
前記コアベンゼンの3個の置換基のうちの少なくとも2つは、ヘテロアリール基であってもよい。つまり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−である。
【0082】
各ヘテロアリール基に含まれているヘテロ原子の数により多様な組み合わせが可能である。各組み合わせにより化合物の特性が変わり得、要求される特性により各組み合わせを選択することができる。
【0083】
好ましくは、ヘテロ原子はNであってもよい。但し、これに限定されない。
【0084】
また、前記化学式1の一実施形態のうちの一つである化合物は、下記化学式2で表される化合物であってもよい。
【0085】
【化23】

【0086】
前記化学式2中、Ar1〜Ar4、X1〜X6、Y1、Y2およびB1の定義は、前記化学式1に定義されたとおりである。
【0087】
前記Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であってもよい。より具体的な例として、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のピリダジニル基、置換または非置換のキノリニル基および置換または非置換のイソキノリニル基からなる群より選択され得る。
【0088】
前記Ar1〜Ar4の役割は、電子の輸送を円滑にすることができるという点である。つまり、電子を引く作用基の役割を果たすことができるため、電子の移動速度を正孔と同じように合わせることができる。所望の素子の特性に応じて適切に前記置換基を選択または変形して使用することができる。
【0089】
また、前記Ar1〜Ar4のπ共役長(π−conjugation length)を調節して可視領域で発光調節を可能にすることができる。これによって、前記化合物が有機光電素子の発光層に非常に有用に適用され得る。ただし、炭素数が前記範囲を越えるようになると、素子としての十分な効果を得られないことがある。
【0090】
また、このような置換基が結合された構造は、熱的安定性または酸化に対する抵抗性に優れ、有機光電素子の寿命特性を向上させることができる。
【0091】
前記置換基の種類により化合物の電子輸送能力を調節することができる。また、化合物の構造をバルクに製造することができ、結晶化度を低下することができる。化合物の結晶化度が低下すると素子の寿命が延長され得る。
【0092】
前記B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成することができ、その具体的な例としては、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のピレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のキノリニル基、置換または非置換のベンゾキノリニル基および置換または非置換のフェナントロリニル基からなる群より選択される化合物などがある。
【0093】
前記置換基の役割は電子の輸送を円滑にすることができるという点である。つまり、電子を引く作用基の役割を果たすことができるため、電子の移動速度を正孔と同じように合わせることができる。また、バルキーなアリール基を導入することによって熱的安定性を増加させることができる。所望の素子の特性により適切に前記置換基を選択または変形して使用することができる。
【0094】
前記有機光電素子用化合物は、下記化学式3〜化学式186で表示されるものを使用することができる。しかし、本発明は下記化合物に限定されない。
【0095】
【化24】

【0096】
【化25】

【0097】
【化26】

【0098】
【化27】

【0099】
【化28】

【0100】
【化29】

【0101】
【化30】

【0102】
【化31】

【0103】
【化32】

【0104】
【化33】

【0105】
【化34】

【0106】
【化35】

【0107】
【化36】

【0108】
【化37】

【0109】
【化38】

【0110】
【化39】

【0111】
【化40】

【0112】
【化41】

【0113】
【化42−1】

【0114】
【化42−2】

【0115】
【化42−3】

【0116】
【化42−4】

【0117】
【化42−5】

【0118】
前記のような化合物を含む有機光電素子用化合物は、ガラス転移温度が120℃以上であり、熱分解温度が400℃以上であって、熱的安定性に優れている。これによって、高効率の有機光電素子が実現可能である。
【0119】
前記のような化合物を含む有機光電素子用化合物は、発光、または電子注入および/または輸送の役割を果たすことができ、適切なドーパントと共に発光ホストとしての役割も果たすことができる。つまり、前記有機光電素子用化合物は、燐光または蛍光のホスト材料、青色の発光ドーパント材料、または電子輸送材料として使用され得る。
【0120】
本発明の一実施形態による有機光電素子用化合物は、有機薄膜層に使用されると有機光電素子の寿命特性、効率特性、電気化学的安定性および熱的安定性を向上させ、駆動電圧を低下させることができる。
【0121】
これによって、本発明の一実施形態は、前記有機光電素子用化合物を含む有機光電素子を提供する。この時、前記有機光電素子とは、有機発光ダイオード、有機太陽電池、有機トランジスタ、有機感光体ドラム、有機メモリ素子などを意味する。特に、有機太陽電池の場合には、本発明の一実施形態による有機光電素子用化合物が電極や電極バッファー層に含まれて量子効率を増加させ、有機トランジスタの場合には、ゲート、ソース−ドレイン電極などで電極物質として使用され得る。
【0122】
以下、有機光電素子について具体的に説明する。
【0123】
本発明の他の一実施形態は、陽極、陰極および前記陽極と陰極との間に配置される少なくとも一層以上の有機薄膜層を含む有機光電素子において、前記有機薄膜層のうちの少なくとも一層は、本発明の一実施形態による有機光電素子用化合物を含む有機光電素子を提供する。
【0124】
前記有機光電素子用化合物を含むことができる有機薄膜層としては、発光層、正孔輸送層(HTL)、正孔注入層(HIL)、電子輸送層(ETL)、電子注入層(EIL)、正孔阻止層およびこれらの組み合わせからなる群より選択される層を含むことができるところ、この中で少なくとも一層は、本発明による有機光電素子用化合物を含む。特に、電子輸送層(ETL)または電子注入層(EIL)に本発明の一実施形態による有機光電素子用化合物を含むことができる。また、前記有機光電素子用化合物が発光層内に含まれる場合、前記有機光電素子用化合物は燐光または蛍光ホストとして含まれ得、特に、蛍光青色ドーパント材料として含まれ得る。
【0125】
図1〜図5は、本発明の多様な実施形態による有機光電素子用化合物を含む有機光電素子の断面図である。
【0126】
図1〜図5を参照すれば、本発明の多様な実施形態による有機光電素子100、200、300、400、500は、陽極120、陰極110およびこの陽極と陰極との間に配置された少なくとも一層の有機薄膜層105を含む構造を有する。
【0127】
前記陽極120は、陽極物質を含み、この陽極物質としては、通常有機薄膜層へ正孔注入が円滑に行われるように仕事関数が大きい物質が好ましい。前記陽極物質の具体的な例としては、ニッケル、白金、バナジウム、クロム、銅、亜鉛、金のような金属またはこれらの合金;亜鉛酸化物、インジウム酸化物、インジウムスズ酸化物(ITO)、インジウム亜鉛酸化物(IZO)のような金属酸化物;ZnO:AlまたはSnO2:Sbのような金属含有酸化物;ポリ(3−メチルチオフェン)、ポリ[3,4−(エチレン−1,2−ジオキシ)チオフェン](polyehtylenedioxythiophene:PEDT)、ポリピロールおよびポリアニリンのような伝導性高分子などが挙げられるが、これに限定されない。好ましくは、前記陽極としてITO(indium tin oxide)を含む透明電極を使用することができる。
【0128】
前記陰極110は、陰極物質を含み、この陰極物質としては、通常有機薄膜層へ電子注入が容易に行われるように仕事関数が小さい物質であることが好ましい。陰極物質の具体的な例としては、マグネシウム、カルシウム、ナトリウム、カリウム、チタニウム、インジウム、イットリウム、リチウム、ガドリニウム、アルミニウム、銀、スズ、鉛、セシウム、バリウムなどのような金属またはこれらの合金;LiF/Al、LiO2/Al、LiF/Ca、LiF/AlおよびBaF2/Caのような多層構造物質などが挙げられるが、これに限定されない。好ましくは、前記陰極としてアルミニウムなどのような金属電極を使用することができる。
【0129】
まず、図1を参照すれば、図1は、有機薄膜層105として発光層130のみが存在する有機光電素子100を示した図面であり、前記有機薄膜層105は、発光層130のみで存在してもよい。
【0130】
図2を参照すれば、図2は、有機薄膜層105として電子輸送層(ETL)を含む発光層230と正孔輸送層(HTL)140が存在する2層型有機光電素子200を示した図面であり、図2に示されているように、有機薄膜層105は、発光層230および正孔輸送層(HTL)140を含む2層型であってもよい。この場合、発光層130は電子輸送層(ETL)の機能を果たし、正孔輸送層(HTL)140はITOのような透明電極との接合性および正孔輸送性を向上させる機能を果たす。
【0131】
図3を参照すれば、図3は、有機薄膜層105として電子輸送層(ETL)150、発光層130および正孔輸送層(HTL)140が存在する3層型有機光電素子300を示した図面であり、前記有機薄膜層105で発光層130は独立した形態からなっており、電子輸送性や正孔輸送性に優れた膜(電子輸送層(ETL)150および正孔輸送層(HTL)140)を別途の層で積んだ形態を示している。
【0132】
図4を参照すれば、図4は、有機薄膜層105として電子注入層(EIL)160、発光層130、正孔輸送層(HTL)140および正孔注入層(HIL)170が存在する4層型有機光電素子400を示した図面であり、前記正孔注入層(HIL)170は陽極として使用されるITOとの接合性を向上させることができる。
【0133】
図5を参照すれば、図5は、有機薄膜層105として電子注入層(EIL)160、電子輸送層(ETL)150、発光層130、正孔輸送層(HTL)140および正孔注入層(HIL)170のようなそれぞれ異なる機能を果たす5層が存在する5層型有機光電素子500を示した図面であり、前記有機光電素子500は、電子注入層(EIL)160を別途に形成して低電圧化に効果的である。
【0134】
前記図1〜図5において前記有機薄膜層105をなす電子輸送層(ETL)150、電子注入層(EIL)160、発光層130、230、正孔輸送層(HTL)140、正孔注入層(HIL)170およびこれらの組み合わせからなる群より選択されるいずれか一つは、前記有機光電素子用化合物を含む。この時、前記有機光電素子用化合物は、前記電子輸送層(ETL)150または電子注入層(EIL)160を含む電子輸送層(ETL)150に使用され得、その中でも電子輸送層(ETL)に含まれる場合、正孔阻止層(図示せず)を別途に形成する必要がないため、より単純化された構造の有機光電素子を提供することができるため好ましい。
【0135】
また、前記有機光電素子用化合物が発光層130、230内に含まれる場合、前記有機光電素子用化合物は燐光または蛍光ホストとして含まれ得、または蛍光青色ドーパントとして含まれ得る。
【0136】
上述した有機光電素子は、基板に陽極を形成した後、真空蒸着法(evaporation)、スパッタリング(sputtering)、プラズマメッキおよびイオンメッキのような乾式成膜法、またはスピンコーティング(spin coating)、浸漬法(dipping)、流動コーティング法(flow coating)のような湿式成膜法などで有機薄膜層を形成した後、その上に陰極を形成して製造することができる。
【0137】
本発明のさらに他の一実施形態によれば、前記有機光電素子を含む表示装置を提供する。
【実施例】
【0138】
以下の実施例を用いて本発明をより詳細に説明する。但し、これらの実施例は本発明を具体的に例示または説明するためのものに過ぎず、これらによって本発明が制限されてはならないことが理解されるであろう。
【0139】
(有機光電素子用化合物の製造)
実施例1:化合物3の合成
前記化合物3を下記反応式1に従って合成した。
【0140】
【化43】

【0141】
第1段階:中間体生成物(A)の合成
3,5−ジブロモベンズアルデヒド24.9g(94.7mmol)、2−アミノフェノール15.5g(142.0mmol)を酢酸(AcOH)700mlの溶媒に懸濁して懸濁液を製造し、収得した反応物を常温で12時間反応させた。収得した反応物を水1000ml中で固形化し、析出した固体化合物をろ過により分離し、水とメタノールで洗浄して乾燥した。収得した固体化合物と2,3−ジクロロ−5,6−ジシアノベンゼンキノン(DDQ)23.6g(104.2mmol)をジクロロメタン550mlに溶かした後、常温で1時間反応させた。収得した反応物の反応溶媒を減圧下で蒸留して除去した後、カラムで分離した後に乾燥させて中間体生成物(A)19.9g(収率:60%)の白色の固体を得た。
【0142】
第2段階:中間体生成物(B)の合成
中間体生成物(A)19.0g(53.82mmol)、ビス(ピナコレート)ジボラン32.8g(129.2mmol)、[1,1'−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(Pd(dppf)Cl2)2.2g(2.7mmol)、酢酸カリウム(KOAc)21.2g(215.3mmol)をジメチルホルムアミド(DMF)280mlの溶媒に溶かした後、80℃で12時間反応させた。収得した反応物をクロロホルムで抽出した後、溶媒を減圧下で除去してカラムで分離した後に乾燥させて中間体生成物(B)23.11g(収率:96%)の薄黄色の固体を得た。
【0143】
第3段階:中間体生成物(C)の合成
中間体生成物(B)10.0g(22.4mmol)、2,6−ジブロモ−4−ヨードピリジン13.48g(49.2mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]1.3g(1.1mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)12.4g(89.5mmol)を水200mlに溶解した溶液を添加して90℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去して水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて中間体生成物(C)10.0g(収率:99%)の白色の固体を得た。
【0144】
第4段階:化合物3の合成
中間体生成物(C)10.0g(20.5mmol)、フェニルボロン酸12.5g(102.6mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]2.4g(2.1mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)17.0g(123.2mmol)を水200mlに溶解した溶液を添加して100℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去して水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて化合物10.8g(収率:81%)の白色の固体を得た。(計算値:653.77/測定値:MS[M+1]654.25)
実施例2:化合物4の合成
前記化合物4を下記反応式2に従って合成した。
【0145】
【化44】

【0146】
第1段階:中間体生成物(D)の合成
9,10−フェナンスレンキノン13.0g(62.4mmol)、3,5−ジブロモベンズアルデヒド24.7g(93.7mmol)、アンモニウムバイカーボネート(NH4HCO3)24.7g(312.2mmol)をエタノール700mlに溶かした後、100℃で12時間反応させた。収得した反応物をろ過して分離した後、エタノールで洗浄し乾燥させて中間体生成物(D)89.4g(収率:73%)の薄黄色の固体を得た。
【0147】
第2段階:中間体生成物(E)の合成
中間体生成物(D)20.0g(44.4mmol)、ビス(ピナコレート)ジボラン26.9g(105.9mmol)、[1,1'−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(Pd(dppf)Cl2)1.8g(2.2mmol)、酢酸カリウム(KOAc)17.3g(215.3mmol)をジメチルホルムアミド(DMF)300mlの溶媒に溶かした後、80℃で12時間反応させた。収得した反応物をクロロホルムで抽出した後、溶媒を減圧下で除去し、カラムで分離した後に乾燥させて中間体生成物(E)22.65g(収率:94%)の白色の固体を得た。
【0148】
第3段階:中間体生成物(F)の合成
中間体生成物(E)10.0g(18.3mmol)、2,6−ジブロモ−4−ヨードピリジン11.0g(40.2mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]1.1g(0.9mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)10.1g(73.1mmol)を水200mlに溶解した溶液を添加して90℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去し、水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて中間体生成物(F)10.3g(収率:96%)の白色の固体を得た。
【0149】
第4段階:化合物4の合成
中間体生成物(F)10.0g(17.0mmol)、フェニルボロン酸10.4g(85.1mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]2.0g(1.7mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)14.1g(102.2mmol)を水200mlに溶解した溶液を添加して100℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去し、水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて化合物9.8g(収率:98%)の白色の固体を得た。(計算値:753.89/測定値:MS[M+1]754.28)
実施例3:化合物11の合成
前記化合物11を下記反応式3に従って合成した。
【0150】
【化45】

【0151】
第1段階:中間体生成物(G)の合成
エチルブロモアセテート105.0g(628.4mmol)とピリジン994.67g(12.6mol)の懸濁液を製造し、収得した反応物を常温で2時間反応させた。収得した反応物にジエチルエーテル1000mlを加えて固形化し、析出した固体化合物をろ過により分離し、ジエチルエーテルで洗浄し乾燥させて中間体生成物(G)152.3g(収率:98%)の薄黄色の固体を得た。
【0152】
第2段階:中間体生成物(H)の合成
中間体生成物(G)150.0g(609.5mmol)、トランスカルコン105.8g(609.5mmol)および酢酸アンモニウム(NH4OAC)375.85g(4.8mol)をメタノール1500mlに溶かした後、100℃で12時間反応させた。収得した反応物を水2000ml中で固形化し、析出した固体化合物をろ過により分離し、水とメタノールで洗浄し乾燥させて中間体生成物(H)98.15g(収率:78%)の白色の固体を得た。
【0153】
第3段階:中間体生成物(I)の合成
中間体生成物(H)98.0g(396.3mmol)、リン酸(P2O5)168.7g(1.2mol)およびテトラブチルアンモニウムブロマイド(TBAB)191.6g(594.4mol)をクロロベンゼン1400mlに溶かした後、140℃で12時間反応させた。収得した反応物の溶媒を減圧下で除去し、収得した固体混合物を水500mlで洗浄した。収得した反応物をクロロホルムで抽出した後、溶媒を減圧下で除去してメタノール500mlで洗浄し乾燥させて中間体生成物(I)89.4g(収率:73%)の白色の固体を得た。
【0154】
第4段階:化合物11の合成
中間体生成物(B)17.0g(38.0mmol)、中間体生成物(I)28.3g(91.3mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]2.2g(1.9mmol)をテトラヒドロフラン(THF)500mlとトルエン300mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)21.0g(152mmol)を水300mlに溶解した溶液を添加し、110℃で24時間反応させた。収得した反応物の溶媒を減圧下で除去し、水とメタノールで洗浄した。収得した固体混合物をカラムで分離した後に乾燥させて化合物23.0g(収率:93%)の白色の固体を得た。(計算値:653.77/測定値:MS[M+1]654.25)
実施例4:化合物12の合成
前記化合物12を下記反応式4に従って合成した。
【0155】
【化46】

【0156】
中間体生成物(E)10.0g(18.3mmol)、中間体生成物(I)13.6g(43.9mmol)およびテトラキス(トリフェニルホスフィン)パラジウム[Pd(PPh3)4]1.1g(0.9mmol)をテトラヒドロフラン(THF)300mlとトルエン200mlとの混合溶媒に溶かした後、炭酸カリウム(K2CO3)10.1g(73.1mmol)を水200mlに溶解した溶液を添加し、110℃で24時間反応させた。収得した反応物の溶媒を減圧下で除去し、水とメタノールで洗浄した。収得した固体化合物をクロロホルムとメタノールで再結晶し乾燥させて化合物11.5g(収率:83%)の白色の固体を得た。(計算値:753.89/測定値:MS[M+1]754.28)
(有機光電素子の製造)
実施例5:実施例1を用いた有機光電素子の製造
陽極としてはITOを1000Åの厚さに使用し、陰極としてはアルミニウム(Al)を1000Åの厚さに使用した。
【0157】
具体的に、有機光電素子の製造方法を説明すれば、陽極は、15Ω/cm2の面抵抗値を有するITOガラス基板を50mm×50mm×0.7mmの大きさに切断してアセトンとイソプロピルアルコールと純水中で各5分間超音波洗浄した後、30分間UVオゾン洗浄して使用した。
【0158】
前記ガラス基板上部に正孔注入層(HIL)として、N1,N1'−(ビフェニル−4,4'−ジイル)ビス(N1−(ナフタレン−2−イル)−N4,N4−ジフェニルベンゼン−1,4−ジアミン)585Åを蒸着し、次に正孔輸送層(HTL)としてN,N'−ジ(1−ナフチル)−N,N'−ジフェニルベンジジン50Åを蒸着した。
【0159】
発光層としてN,N,N',N'−テトラキス(3,4−ジメチルフェニル)クリセン−6,12−ジアミン4%および9−(3−(ナフタレン−1−イル)フェニル)−10−(ナフタレン−2−イル)アントラセン96%を200Åの厚さに蒸着した。
【0160】
次に、電子輸送層(ETL)として前記実施例1で製造された化合物およびLiq(1:1)300Åを蒸着した。
【0161】
前記電子輸送層(ETL)上部に電子注入層(EIL)としてリチウムキノレート(Lithium Quinolate、Liq)を5Åの厚さに真空蒸着し、Alを1000Åの厚さに真空蒸着してLiq/Al電極を形成した。
【0162】
実施例6:実施例2を用いた有機光電素子の製造
電子輸送層(ETL)として実施例1で製造された化合物の代わりに、実施例2で製造された化合物を使用したことを除いては、前記実施例5と同様に実施して有機光電素子を製造した。
【0163】
実施例7:実施例4を用いた有機光電素子の製造
電子輸送層(ETL)として実施例1で製造された化合物の代わりに、実施例4で製造された化合物を使用したことを除いては、前記実施例5と同様に実施して有機光電素子を製造した。
【0164】
比較例1:Alq3を用いた有機光電素子の製造
電子輸送層(ETL)として実施例1で製造された化合物の代わりに、トリス(8−ヒドロキシキノリナト)アルミニウム(Tris(8−hydroxyquinolinato)aluminium、Alq3)およびLiq300Åを使用したことを除いては、前記実施例5と同様に実施して有機光電素子を製造した。
【0165】
(有機光電素子の性能測定)
測定方法
このように製造されたそれぞれの有機光電素子に対して電圧による電流密度の変化、輝度の変化および発光効率を測定した。具体的な測定方法は次のとおりである。
【0166】
1)電圧変化による電流密度の変化測定
製造された有機光電素子に対し、電圧を0Vから4Vまで上昇させながら電流電圧計(Keithley 2400)を利用して単位素子に流れる電流値を測定し、測定された電流値を面積で割って結果を得た。その結果を図6に示した。
【0167】
2)電圧変化による輝度の変化測定
製造された有機光電素子に対し、電圧を0Vから4Vまで上昇させながら輝度計(Minolta Cs1000A)を利用してその時の輝度を測定して結果を得た。その結果を図7に示した。
【0168】
3)発光効率および電力効率の測定
前記1)および2)から測定された輝度と電流密度および電圧を利用して同一の明るさ(1000cd/m2)の電流効率(cd/A)および電力効率(lm/W)を計算した。その結果を図8および図9に示した。
【0169】
測定結果
上記で測定された結果を下記表1に示す。
【0170】
【表1】

【0171】
前記表1を参照すれば、有機発光ダイオードの特性評価結果、上記実施例5〜7の素子が駆動電圧側面で有利であり、発光効率および電力効率側面でも顕著に優れていることが分かる。したがって、素子寿命も増加することを予測することができる。
【0172】
本発明は前記実施例に限定されるものではなく、当業者によって特許請求の範囲の精神および技術的範囲に含まれる多様な変形および等価の形態で製造され得る。したがって、上記の実施例は例示的なものであり、本発明をいかようにも限定するものではないことを理解しなければならない。
【符号の説明】
【0173】
100、200、300、400、500…有機光電素子
110…陰極
120…陽極
105…有機薄膜層
130…発光層
140…正孔輸送層(HTL)
150…電子輸送層(ETL)
160…電子注入層(EIL)
170…正孔注入層(HIL)
230…発光層+電子輸送層(ETL)
【特許請求の範囲】
【請求項1】
下記化学式1で表される有機光電素子用化合物:
【化1】

前記化学式1中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【請求項2】
前記有機光電素子用化合物は、下記化学式2で表される、請求項1に記載の有機光電素子用化合物:
【化2】

前記化学式2中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基または置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【請求項3】
Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のピリダジニル基、置換または非置換のキノリニル基および置換または非置換のイソキノリニル基からなる群より選択される、請求項1に記載の有機光電素子用化合物。
【請求項4】
前記B1は、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のピレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のキノリニル基、置換または非置換のベンゾキノリニル基および置換または非置換のフェナントロリニル基からなる群より選択されるものである、請求項1に記載の有機光電素子用化合物。
【請求項5】
下記化学式3〜186のうちのいずれか一つで表される、有機光電素子用化合物。
【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

【化12】

【化13】

【化14】

【化15】

【化16】

【化17】

【化18】

【化19】

【化20】

【化21】

【化22】

【化23】

【化24】

【化25】

【請求項6】
陽極、陰極および前記陽極と陰極との間に配置される少なくとも一層以上の有機薄膜層を含む有機光電素子において、
前記有機薄膜層のうちの少なくとも一層は、請求項1〜5のいずれか一項に記載の有機光電素子用化合物を含む、有機光電素子。
【請求項7】
前記有機薄膜層は、発光層、正孔輸送層(HTL)、正孔注入層(HIL)、電子輸送層(ETL)、電子注入層(EIL)、正孔阻止層およびこれらの組み合わせからなる群より選択される、請求項6に記載の有機光電素子。
【請求項8】
前記有機光電素子用化合物は、電子輸送層(ETL)または電子注入層(EIL)内に含まれる、請求項6に記載の有機光電素子。
【請求項9】
前記有機光電素子用化合物は、発光層内に含まれる、請求項6に記載の有機光電素子。
【請求項10】
前記有機光電素子用化合物は、発光層内に燐光または蛍光ホスト材料として使用される、請求項6に記載の有機光電素子。
【請求項11】
前記有機光電素子用化合物は、発光層内に蛍光青色ドーパント材料として使用される、請求項6に記載の有機光電素子。
【請求項12】
前記有機光電素子は、有機発光ダイオード、有機太陽電池、有機トランジスタ、有機感光体ドラムおよび有機メモリ素子からなる群より選択される、請求項6に記載の有機光電素子。
【請求項13】
請求項6に記載の有機光電素子を含む、表示装置。
【請求項1】
下記化学式1で表される有機光電素子用化合物:
【化1】

前記化学式1中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【請求項2】
前記有機光電素子用化合物は、下記化学式2で表される、請求項1に記載の有機光電素子用化合物:
【化2】

前記化学式2中、Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のC6〜C30アリール基あるいは置換または非置換のC3〜C30ヘテロアリール基であり、X1〜X6は、互いに同一または異なるものであって、それぞれ独立して、−N−または−CH−であり、X1〜X3のうちの少なくとも一つは、−N−であり、X4〜X6のうちの少なくとも一つは、−N−であり、Y1は、−O−、−S−、−NH−および−NR−からなる群より選択され、前記Rは、置換または非置換のC6〜C30アリール基、置換または非置換のC3〜C30ヘテロアリール基、置換または非置換のC1〜C6アルキル基、置換または非置換のC3〜C30シクロアルキル基、置換または非置換のシアノ基、置換または非置換のニトロ基、置換または非置換のカルボニル基および置換または非置換のアミド基からなる群より選択され、Y2は、−CH−または−N−であり、B1は、置換または非置換のC6〜C30アリール基または置換または非置換のC3〜C30ヘテロアリール基であり、隣接した元素と融合環を形成する。
【請求項3】
Ar1〜Ar4は、互いに同一または異なるものであって、それぞれ独立して、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のピリダジニル基、置換または非置換のキノリニル基および置換または非置換のイソキノリニル基からなる群より選択される、請求項1に記載の有機光電素子用化合物。
【請求項4】
前記B1は、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のアントラセニル基、置換または非置換のフェナントレニル基、置換または非置換のピレニル基、置換または非置換のペリレニル基、置換または非置換のクリセニル基、置換または非置換のピリジニル基、置換または非置換のキノリニル基、置換または非置換のベンゾキノリニル基および置換または非置換のフェナントロリニル基からなる群より選択されるものである、請求項1に記載の有機光電素子用化合物。
【請求項5】
下記化学式3〜186のうちのいずれか一つで表される、有機光電素子用化合物。
【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

【化12】

【化13】

【化14】

【化15】

【化16】

【化17】

【化18】

【化19】

【化20】

【化21】

【化22】

【化23】

【化24】

【化25】

【請求項6】
陽極、陰極および前記陽極と陰極との間に配置される少なくとも一層以上の有機薄膜層を含む有機光電素子において、
前記有機薄膜層のうちの少なくとも一層は、請求項1〜5のいずれか一項に記載の有機光電素子用化合物を含む、有機光電素子。
【請求項7】
前記有機薄膜層は、発光層、正孔輸送層(HTL)、正孔注入層(HIL)、電子輸送層(ETL)、電子注入層(EIL)、正孔阻止層およびこれらの組み合わせからなる群より選択される、請求項6に記載の有機光電素子。
【請求項8】
前記有機光電素子用化合物は、電子輸送層(ETL)または電子注入層(EIL)内に含まれる、請求項6に記載の有機光電素子。
【請求項9】
前記有機光電素子用化合物は、発光層内に含まれる、請求項6に記載の有機光電素子。
【請求項10】
前記有機光電素子用化合物は、発光層内に燐光または蛍光ホスト材料として使用される、請求項6に記載の有機光電素子。
【請求項11】
前記有機光電素子用化合物は、発光層内に蛍光青色ドーパント材料として使用される、請求項6に記載の有機光電素子。
【請求項12】
前記有機光電素子は、有機発光ダイオード、有機太陽電池、有機トランジスタ、有機感光体ドラムおよび有機メモリ素子からなる群より選択される、請求項6に記載の有機光電素子。
【請求項13】
請求項6に記載の有機光電素子を含む、表示装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2013−520410(P2013−520410A)
【公表日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願番号】特願2012−553800(P2012−553800)
【出願日】平成22年10月14日(2010.10.14)
【国際出願番号】PCT/KR2010/007058
【国際公開番号】WO2011/102586
【国際公開日】平成23年8月25日(2011.8.25)
【出願人】(500005066)チェイル インダストリーズ インコーポレイテッド (263)
【Fターム(参考)】
【公表日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願日】平成22年10月14日(2010.10.14)
【国際出願番号】PCT/KR2010/007058
【国際公開番号】WO2011/102586
【国際公開日】平成23年8月25日(2011.8.25)
【出願人】(500005066)チェイル インダストリーズ インコーポレイテッド (263)
【Fターム(参考)】
[ Back to top ]

