有機発光素子および有機発光素子を備える平板表示装置
【課題】低駆動電圧、優秀な電流密度、輝度、色純度、発光効率および寿命を有する有機発光素子および有機発光素子を備える平板表示装置を提供する。
【解決手段】基板200と、第1電極210と、第2電極260と、第1電極210と第2電極260との間に配置され、少なくとも発光層を備える有機層とを備え、第1電極210および第2電極260のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層は、特定の化合物を含む層を備える有機発光素子を提供する。
【解決手段】基板200と、第1電極210と、第2電極260と、第1電極210と第2電極260との間に配置され、少なくとも発光層を備える有機層とを備え、第1電極210および第2電極260のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層は、特定の化合物を含む層を備える有機発光素子を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、有機発光素子および平板表示装置に関する。
【背景技術】
【0002】
有機発光素子は、蛍光有機膜または燐光有機膜に電流を流すと、電子および正孔が有機層で結合するとともに、光を発生する現象を利用した自発光型素子である。有機発光素子は、軽量で部品が簡素であり、製作工程が比較的簡単な構造を備える。また、高画質の具現が可能であり、広い視野角を確保でき、動画を完璧に具現できる。それと共に、有機発光素子は、高色純度の具現、低消費電力、低電圧駆動が可能であり、携帯用電子機器に適した電気的特性を備える。
【0003】
有機発光素子は、発光効率の向上および駆動電圧の低下のために、有機膜を単一発光層のみで使用せず、電子注入層、発光層、正孔輸送層のような多層構造を使用することが一般的である。例えば、特許文献1には、正孔輸送層を備えた有機発光素子が開示されている。
【0004】
【特許文献1】特開2002−252089号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかし、従来の有機発光素子では、満足すべきレベルの駆動電圧、電流密度、輝度、色純度、発光効率および寿命を達成できないため、その改善が求められている。
【0006】
そこで、本発明は、このような問題に鑑みてなされたもので、その目的とするところは、駆動電圧、電流密度、輝度、色純度、発光効率および寿命などの特性を向上した有機発光素子および有機発光素子を具備する平板表示装置を提供することにある。
【課題を解決するための手段】
【0007】
上記課題を解決するために、本発明の第1の観点によれば、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層は、下記化学式1で表示される化合物、下記化学式2で表示される化合物および下記化学式3で表示される化合物のうち、少なくとも何れか一つ以上の化合物を含む層を備える有機発光素子が提供される。
【0008】
【化1】

・・・・・・(化学式1)
【0009】
【化2】

・・・・・・(化学式2)
【0010】
【化3】

・・・・・・(化学式3)
【0011】
上記化学式1〜3のうち、Xは、置換または非置換の炭素数1〜30のアルキレン基、置換または非置換の炭素数2〜30のアルケニレン基、置換または非置換の炭素数6〜30のアリーレン基、置換または非置換の炭素数2〜30のヘテロアリーレン基、または置換または非置換の炭素数2〜30の複素環を表すことができる。R1、R2、R3、R4、R5、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R1、R2、R3のうち2以上、R4、R5およびR6、R7、R8のうち2以上は、隣接した基と相互結合して、飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Ar1、Ar2およびAr3は、各々独立的に、置換または非置換の炭素数6〜30のアリール基または置換または非置換の炭素数2〜30のヘテロアリール基であってよい。Yは、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環を表すことができる。nは、0〜5の整数であってよい。
【0012】
第1電極は、基板側に配置され、第1電極は、反射型電極であってよく、第2電極は、半透明電極または透明電極であってよい。有機層で生成される光は、第2電極を介して外部に放出されてよい。
【0013】
有機発光素子の作動の際に、第1電極と第2電極との間に共振現象が起きてよい。
【0014】
有機発光素子の作動の際に、反射型電極の第1電極と半透明電極または透明電極の第2電極との間に、共振現象が起きてよい。
【0015】
本発明によれば、有機発光素子に第1電極、第2電極を備え、第1電極および第2電極のうち、一つは反射型電極であり、他の一つは透明電極または半透明電極である。これにより、有機発光素子駆動の際には、第1電極と第2電極との間に共振現象を起こすことができる。この共振現象により、有機発光素子の発光輝度、色純度を向上できる。また、有機発光素子駆動の際に共振現象を起こす一対の電極間に、優れた正孔移動度および耐熱性を有するフェニルカルバゾール系化合物を含む有機層を適用するため、有機発光素子は、低駆動電圧、優れた電流密度、発光輝度、色純度、発光効率および寿命を有することができる。さらに、有機発光素子駆動の際に共振現象を起こす一対の電極間に、各色別の発光層に対応した所定の厚さ範囲の正孔注入層を適用するため、共振現象を効果的に実施できる。従って、当該有機発光素子は、発光輝度、色純度、発光効率および寿命を向上することができ、特に、寿命特性を顕著に向上できる。
【0016】
上記化学式1で表示される化合物は、下記化学式1aの構造を有することができる。
【0017】
【化4】

・・・・・・(化学式1a)
【0018】
上記化学式1aのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R1、R2およびR3のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q1は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基であってよい。
【0019】
上記化学式1で表示される化合物は、下記化学式1bの構造を有することができる。
【0020】
【化5】

・・・・・・(化学式1b)
【0021】
上記化学式1bのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R1、R2およびR3は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q2は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基であってよい。
【0022】
上記化学式2で表示される化合物は、下記化学式2aの構造を有することができる。
【0023】
【化6】

・・・・・・(化学式2a)
【0024】
上記化学式2aのうち、R4およびR5は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R4およびR5は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q3は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基であってよい。
【0025】
上記化学式3で表示される化合物は、下記化学式3aの構造を有することができる。
【0026】
【化7】

・・・・・・(化学式3a)
【0027】
上記化学式3aのうち、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R6、R7およびR8のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q4は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基であってよい。
【0028】
上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物は、下記化合物1〜化合物62のうち何れか一つであってよい。
【0029】
【化8】

【0030】
【化9】

【0031】
【化10】

【0032】
【化11】

【0033】
【化12】

【0034】
【化13】

【0035】
【化14】

【0036】
【化15】

【0037】
【化16】

【0038】
【化17】

【0039】
【化18】

【0040】
【化19】

【0041】
【化20】

【0042】
【化21】

【0043】
【化22】

【0044】
【化23】

【0045】
【化24】

【0046】
【化25】

【0047】
【化26】

【0048】
【化27】

【0049】
【化28】

【0050】
【化29】

【0051】
【化30】

【0052】
上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物は、上記化合物8、上記化合物9、上記化合物10、上記化合物11、上記化合物14、上記化合物28、上記化合物35および上記化合物56のうち何れか一つであってよい。
【0053】
有機層において、上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物のうち、少なくとも一つ以上を含む層は、正孔注入層、正孔輸送層または正孔注入特性および正孔輸送特性をともに有する単一層であってよい。
【0054】
有機層において、上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物のうち、少なくとも一つ以上を含む層は、正孔注入層であってよい。
【0055】
有機層の発光カラーが赤色である場合、正孔注入層の厚さは、160nm〜220nmであってよい。
【0056】
有機層の発光カラーが緑色である場合、正孔注入層の厚さは、140nm〜180nmであってよい。
【0057】
有機層の発光カラーが青色である場合、正孔注入層の厚さは、100nm〜140nmであってよい。
【0058】
有機層は、正孔輸送層をさらに備えることができる。
【0059】
有機層の発光カラーが赤色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、200nm〜240nmであってよい。
【0060】
正孔注入層の厚さは、160nm〜220nmであってよい。
【0061】
有機層の発光カラーが緑色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、160nm〜200nmであってよい。
【0062】
正孔注入層の厚さは、140nm〜180nmであってよい。
【0063】
有機層の発光カラーが青色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、120nm〜160nmであってよい。
【0064】
正孔注入層の厚さは、100nm〜140nmであってよい。
【0065】
上記課題を解決するために、本発明の第2の観点によれば、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが赤色である場合、正孔注入層の厚さは、160nm〜220nmである有機発光素子が提供される。
【0066】
上記課題を解決するために、本発明の第3の観点によれば、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが緑色である場合、正孔注入層の厚さは、140nm〜180nmである有機発光素子が提供される。
【0067】
上記課題を解決するために、本発明の第4の観点によれば、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが青色である場合、正孔注入層の厚さは、100nm〜140nmである有機発光素子が提供される。
【0068】
第1電極は、基板側に配置され、第1電極は、反射型電極であってよく、第2電極は、半透明電極または透明電極であってよい。有機層で生成される光は、第2電極を介して外部に放出されてよい。
【0069】
有機発光素子の作動の際、第1電極と第2電極との間に共振現象がおきてよい。また、有機発光素子の作動の際、反射型電極の第1電極と半透明電極または透明電極の第2電極との間に、共振現象がおきてよい。
【0070】
上記課題を解決するために、本発明の第5の観点によれば、上述したような有機発光素子を備え、有機発光素子の第1電極は、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結される平板表示装置が提供される。また、本発明の平板表示装置は、上述のように、赤色の有機層を備える有機発光素子、緑色の有機層を備える有機発光素子、青色の有機層を備える有機発光素子のうち、少なくとも一つの有機発光素子、もしくは全ての有機発光素子を備えることができる。この時、各有機発光素子の各第1電極は、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結される。
【0071】
本発明の有機発光素子は、低駆動電圧、優れた電流密度、発光輝度、色純度、発光効率および寿命を備えることができる。特に、本発明の有機発光素子の寿命特性は、顕著に向上することができる。
【発明の効果】
【0072】
以上説明したように本発明によれば、有機発光素子作動の際に共振現象を起こす一対の電極間に、化学式1、化学式2または化学式3の構造を有する化合物を含む有機層を備えるか、または一対の電極間に上述したような厚さ範囲の正孔注入層を備えると、低駆動電圧、優れた電流密度、発光輝度、色純度、電流効率および寿命特性を実現できる。特に、本発明の有機発光素子を利用すると、顕著に向上した寿命特性を達成できる。これにより、本発明の有機発光素子を利用すると、信頼性の向上した平板表示装置を具現できる。
【発明を実施するための最良の形態】
【0073】
以下に添付図面を参照しながら、本発明の好適な実施の形態について詳細に説明する。なお、本明細書及び図面において、実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0074】
本発明の実施形態に係る有機発光素子は、基板、第1電極、第2電極および有機層を具備する。有機層は、第1電極と第2電極との間に配置され、少なくとも発光層を備える。発光層に用いられる物質によって、有機層は、赤色、緑色または青色の光を放出できる。
【0075】
第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極である。したがって、有機発光素子駆動の際に第1電極と第2電極との間に共振現象が起きる。これにより、有機発光素子の駆動の際、第1電極と第2電極との間の有機層で発生した光は、第1電極と第2電極との間で共振しながら、有機発光素子の外部に放出されるので、発光輝度および発光効率を向上することができる。
【0076】
ここで、共振現象について説明する。有機発光素子は、基板(例えば、ガラス基板)上に形成される蛍光性有機層および一対の電極から構成される面型発光デバイスであり、電極から注入される正孔および電子の再結合が有機層で起こることにより、発光する。従来の有機発光素子から放出される各々波長の光は、広い角度に渡って放出されるので光量ロスなどが起こり、有機発光素子の輝度が低下する場合がある。そこで、光の干渉を利用して有機発光素子の輝度を高めるために、有機発光素子の構造を以下の通りに設定する。まず、有機発光素子において、ガラス基板上に誘電体ミラーとしての反射型電極、正孔注入層、正孔輸送層、発光層、電子輸送層、透明電極(MgAg電極など)を順次積層して形成する。この構造が共振器(マイクロキャビティ)として作用する。つまり、透明電極(または、半透明電極)および反射型電極を備える共振構造によって、有機発光素子から放出される光は、透明電極と反射型電極との間を反射往復できることにより、共振(干渉)できる。有機発光素子から放出される光は、広い範囲の波長領域を有するので、共振により光を所望の波長に調節できる。さらに、共振(干渉)現象により、有機発光素子から放出される光の往復の光学的長さ(光路長)が、所望の発光波長の整数倍となることができる。これにより、有機発光素子から放出される光の発光スペクトルを単色化できるとともに、発光ピーク強度を向上できるため、有機発光素子の輝度を向上できる。さらに正孔注入層、正孔輸送層の厚さを最適化すると、共振効果に適した正孔注入特性および正孔輸送特性を有することができるので、より効果的に共振現象を実施できる。以上より、本発明の実施形態では、有機発光素子内に共振できる構造を備えるため、光の共振(干渉)によって有機発光素子の発光輝度、発光効率および色純度を向上できる。
【0077】
さらに具体的に、第1電極は、基板側に配置される。このとき、第1電極は、反射型電極であってよく、第2電極は、半透明電極または透明電極であってよい。したがって、有機発光素子の作動の際において、第1電極と第2電極との間に配置される有機層で発生した光は、第1電極と第2電極との間で共振しながら、第2電極を介して外部に(すなわち、基板の外側に)放出される。
【0078】
本発明の実施形態に係る有機発光素子の有機層は、フェニルカルバゾール系化合物などを含む層を備えることができる。さらに具体的には、有機層は、下記化学式1で表示される化合物、下記化学式2で表示される化合物および下記化学式3で表示される化合物のうち、少なくとも一つ以上の化合物を含む層を備える。
【0079】
【化31】

・・・・・・(化学式1)
【0080】
【化32】

・・・・・・(化学式2)
【0081】
【化33】

・・・・・・(化学式3)
【0082】
上記化学式1〜3のうち、Xは、置換または非置換の炭素数1〜30のアルキレン基、置換または非置換の炭素数2〜30のアルケニレン基、置換または非置換の炭素数6〜30のアリーレン基、置換または非置換の炭素数2〜30のヘテロアリーレン基、または置換または非置換の炭素数2〜30の複素環などを表す。Xにおいて、具体的な例としては、非置換の炭素数6〜30のアリーレン基の場合、フェニレン基、ビフェニレン基、ナフチレン基等があるが、これに限定されない。また置換の炭素数6〜30のアリーレン基の場合では、2,5-ジメチルフェニレン基などがあるがこれに限定されない。置換の炭素数2〜30のヘテロアリーレン基としては、フェニルカルバゾリレン基などがあるがこれに限定されない。R1、R2、R3、R4、R5、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R1、R2、R3のうち2以上、R4、R5およびR6、R7、R8のうち、2以上は、隣接した基と相互結合して、飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Ar1、Ar2およびAr3は、各々独立的に置換または非置換の炭素数6〜30のアリール基、または置換または非置換の炭素数2〜30のヘテロアリール基などである。Yは、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環などを表す。nは、0〜5の整数である。nが0の時、置換基として置換していないことを示す。Yの具体的な例として、フェニル基などがあるがこれに限定されない。
【0083】
上記化学式1、化学式2または化学式3で表示される化合物は、強直なカルバゾール構造(カルバゾール基)を有するので、ガラス転移点または融点が高い。したがって、有機発光素子の駆動の際に、有機層中、有機層の間または有機層と金属電極との間に発生するジュール熱に対する耐熱性および高温環境下での耐性に優れるので、本発明の実施形態の化合物を有機発光素子の有機層に使用した場合、優れた寿命特性および高い発光輝度を得ることができる。特に、分子内に強直なカルバゾール構造(カルバゾール基)を2個以上有する化学式1の化合物および化学式2の化合物は、優れた寿命特性および高い発光輝度を提供できると予想できる。また、上記化学式1、化学式2または化学式3で表示される化合物は、正孔移動能力の高いフェニルカルバゾール基を有するため、優れた正孔移動度を有することができる。
【0084】
また、上記化学式1、化学式2または化学式3で表示される化合物を含む有機層を備えた有機発光素子は、保存時および駆動時において、高い耐久性を有する。これは、特定理論に限定されるものではないが、上記化学式1、化学式2または化学式3で表示される化合物のTgが高いためであると分析される。つまり、従来の有機発光素子の有機層は、駆動時に発生する熱や、高温環境下によって、結晶化などを起こすことにより、その特性を低下する場合がある。これにより、有機発光素子自体の寿命および発光輝度が低下する。しかし、本発明の実施形態では、化学式1、化学式2、化学式3の構造を有する化合物を含む有機層を適用するため、有機層の耐熱特性等を向上できる。これにより、当該有機層を有機発光素子に適用すると、その高い耐熱性によって、有機発光素子自体の寿命および発光輝度等が有機発光素子駆動の際に発生する熱などで低下することがない。従って、本発明の実施形態では、有機発光素子の寿命および発光輝度を向上できる。
【0085】
このうち、上記化学式1で表示される化合物は、下記化学式1aの構造を有するが、これに限定されない。
【0086】
【化34】

・・・・・・(化学式1a)
【0087】
上記化学式1aのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R1、R2およびR3のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q1は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基などである。Q1において、炭素数1〜30のアルコキシ基の具体例としては、メトキシ基などがあるがこれに限定されない。また、炭素数6〜30のアリールオキシ基の具体例としては、フェニルオキシ基などがあるがこれに限定されない。これら具体例は、Q2、Q3、Q4でも適用される。
【0088】
上記化学式1で表示される化合物は、下記化学式1bの構造を有するが、これに限定されない。
【0089】
【化35】

・・・・・・(化学式1b)
【0090】
上記化学式1bのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R1、R2およびR3のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q2は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基などである。
【0091】
一方、上記化学式2で表示される化合物は、下記化学式2aの構造を有するが、これに限定されない。
【0092】
【化36】

・・・・・・(化学式2a)
【0093】
上記化学式2aのうち、R4およびR5は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R4およびR5は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q3は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基などである。Q3の置換の炭素数6〜30のアリール基の具体例としては、9,9−ジメチルフルオレニル基、9,9−ビフェニルフルオレニル基などがあるが、これに限定されない。これら具体例は、Q1、Q2、Q4でも適用される。
【0094】
上記化学式3で表示される化合物は、下記化学式3aの構造を有するが、これに限定されない。
【0095】
【化37】

・・・・・・(化学式3a)
【0096】
上記化学式3aのうち、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R6、R7およびR8のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q4は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基などである。Q4の置換のアミノ基の具体例としては、N,N−ビフェニルアミノ基などがあるがこれに限定されない。これら具体例は、Q1、Q2、Q3でも適用される。
【0097】
以下、本発明の実施形態の各上記化学式で用いられる官能基のうち、代表的な官能基の定義を次に説明する。
【0098】
上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、非置換の炭素数1〜30のアルキル基の具体的な例としては、メチル、エチル、プロピル、イソブチル、sec−ブチル、ペンチル、iso−アミル、へキシルなどが挙げられる。そして、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、置換の炭素数1〜30のアルキル基とは、アルキル基のうち一つ以上の水素原子を、ハロゲン原子、炭素数1〜30のアルキル基、炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、炭素数6〜30のアリールオキシ基、低級アルキルアミノ基、ヒドロキシ基、ニトロ基、シアノ基、アミノ基、アミジノ基、ヒドラジン、ヒドラゾン、カルボキシル基、スルホン酸基、リン酸基などの置換基に置換したものである。つまり、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aの各説明において、「置換の〜」とは、官能基のうち一つ以上の水素原子を、ハロゲン原子、炭素数1〜30のアルキル基、炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、炭素数6〜30のアリールオキシ基、低級アルキルアミノ基、ヒドロキシ基、ニトロ基、シアノ基、アミノ基、アミジノ基、ヒドラジン、ヒドラゾン、カルボキシル基、スルホン酸基、リン酸基などの置換基に置換することを意味する。
【0099】
上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、非置換の炭素数1〜30のアルコキシ基の具体的な例としては、メトキシ、エトキシ、プロポキシ、イソブチルオキシ、sec−ブチルオキシ、ペンチルオキシ、iso−アミルオキシ、へキシルオキシなどが挙げられる。そして、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、置換の炭素数1〜30のアルコシキ基とは、アルコキシ基のうち一つ以上の水素原子を、上述の炭素数1〜30のアルキル基の置換基と同じ置換基に置換できることを意味する。
【0100】
上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、非置換の炭素数6〜30のアリール基は、一つ以上の環を含む炭素環芳香族システムを意味する。環は、ペンダント方法で共に付着されるか、または融合される。つまり、言い換えると、炭素数6〜30のアリール基とは、一つ以上の芳香環を含み、各芳香環をペンダント状に結合するか、または各芳香環を縮合により結合するものである。また、炭素数6〜30のアリール基には、複素環も含まれて構成されてよい。アリールという用語は、フェニル、ナフチル、テトラヒドロナフチルなどのような芳香族システムを含む。また、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、置換の炭素数6〜30のアリール基とは、アリール基のうち一つ以上の水素原子を、上述の炭素数1〜30のアルキル基の置換基と同じ置換基に置換できることを意味する。
【0101】
上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、非置換の炭素数2〜30のヘテロアリール基は、N、O、PまたはSなどのうちから選択される1個、2個または3個のヘテロ原子を含み、残りの環原子がCである環原子数3〜30の一価単環の環化合物または環を、ペンダント方法で共に付着するか、または融合したものである。つまり、言い換えると、炭素数2〜30のヘテロアリール基とは、ヘテロ原子を含む環化合物または環を、ペンダント状に結合するか、または縮合により結合したものである。ヘテロ原子を含む環化合物または環は、N、O、PまたはSなどから選択される少なくとも一つ以上のヘテロ原子を含み、残りの環原子がCである環原子数3〜30の化合物となる。ヘテロアリール基の例としては、ピリジル、チエニル、フリルなどがある。また、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、置換の炭素数2〜30のヘテロアリール基とは、ヘテロアリール基のうち一つ以上の水素原子を、上述の炭素数1〜30のアルキル基の置換基と同じ置換基に置換できることを意味する。
【0102】
一方、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、Ar1、Ar2およびAr3は、相互独立的に、フェニル基、炭素数1〜10のアルキルフェニル基、炭素数1〜10のアルコキシフェニル基、ハロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、o−トリル基、m−トリル基、またはp−トリル基、o−クメニル基、m−クメニル基またはp−クメニル基、メシチル基、フェノキシフェニル基、(α,α−ジメチルベンゼン)フェニル基、(N,N’−ジメチル)アミノフェニル基、(N,N’−ジフェニル)アミノフェニル基、(炭素数1〜10のアルキルシクロへキシル)フェニル基、(アントラセニル)フェニル基、ビフェニル基、炭素数1〜10のアルキルビフェニル基、炭素数1〜10のアルコキシビフェニル基、ペンタレニル基、インデニル基、ナフチル基、炭素数1〜10のアルキルナフチル基、炭素数1〜10のアルコキシナフチル基、ハロナフチル基、シアノナフチル基、ビフェニレニル基、炭素数1〜10のアルキルビフェニレニル基、炭素数1〜10のアルコキシビフェニレニル基、アントラセニル基、アズレニル基、へプタレニル基、アセナフチレニル基、フェナレニル基、フルオレニル基、炭素数1〜10のアルキルフルオレニル基、炭素数6〜30のアリールフルオレニル基、アントラキノリル基、メチルアントリル基、フェナントレニル基、トリフェニレニル基、ピレニル基、クリセニル基、エチルクリセニル基、ピセニル基、ぺリレニル基、クロロぺリレニル基、ペンタフェニル基、ペンタセニル基、テトラフェニレニル基、ヘキサフェニル基、ヘキサセニル基、ルビセニル基、コロネニル基、トリナフチレニル基、へプタフェニル基、へプタセニル基、ピラントレニル基、オバレニル基、カルバゾリル基、炭素数1〜10のアルキルカルバゾリル基、炭素数6〜30のアリールカルバゾリル基、チオフェニル基、インドリル基、プリニル基、ベンズイミダゾリル基、キノリニル基、ベンゾチオフェニル基、パラチアジニル基、ピロリル基、ピラゾリル基、イミダゾリル基、イミダゾリニル基、オキサゾリル基、チアゾリル基、トリアゾリル基、テトラゾリル基、オキサジアゾリル基、ピリジニル基、ピリダジニル基、ピリミジニル、ピラジニル基およびチアントレニル基などからなる群から選択されるが、これに限定されるものではない。ここで、「炭素数〜の〜」とあるが、これは置換基に置換している基の炭素数を示す。例えば、炭素数1〜10のアルキルフェニル基の場合、フェニル基に置換しているアルキル基の炭素数が1〜10であることを意味する。
【0103】
さらに具体的に、上記化学式1、化学式2または化学式3で表示される化合物は、下記化合物1〜化合物62のうちいずれか一つであるが、これに限定されるものではない。
【0104】
【化38】

【0105】
【化39】

【0106】
【化40】

【0107】
【化41】

【0108】
【化42】

【0109】
【化43】

【0110】
【化44】

【0111】
【化45】


【0112】
【化46】

【0113】
【化47】

【0114】
【化48】

【0115】
【化49】

【0116】
【化50】

【0117】
【化51】

【0118】
【化52】

【0119】
【化53】

【0120】
【化54】

【0121】
【化55】

【0122】
【化56】

【0123】
【化57】

【0124】
【化58】

【0125】
【化59】

【0126】
上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物は、上記化合物8、上記化合物9、上記化合物10、上記化合物11、上記化合物14、上記化合物28、上記化合物35および上記化合物56のうち、何れか一つであってよい。
【0127】
上記化学式1で表示される化合物は、例えば、下記反応式1のようにフェニルカルバゾール(B’)とジアミン化合物(C’)とを反応させて得られる。
【0128】
【化60】

【0129】
上記反応式1のうち、X、R1、R2、R3、Ar1およびAr2についての詳細な説明は、上述したところを参照する。上記反応は、Pd2(dba)3(dba=ジベンジリデンアセトン)、tert−ブトキシドナトリウム(t−BuNaO)およびトリ(tert−ブチル)ホスフィン(P(tBu)3)存在下で実施され、反応温度は、約50℃〜約150℃であることが望ましい。
【0130】
本発明の実施形態に係る有機発光素子の有機層において、上記化学式1で表示される化合物、化学式2で表示される化合物および化学式3で表示される化合物のうち、少なくとも一つ以上を含む層は、正孔注入層または正孔輸送層であってよい。または、正孔注入特性および正孔輸送特性をともに有する単一層であってよい。
【0131】
例えば、本発明の実施形態に係る有機発光素子の有機層において、上記化学式1で表示される化合物、化学式2で表示される化合物および化学式3で表示される化合物のうち、少なくとも一つ以上を含む層は、正孔注入層であってよい。
【0132】
このとき、有機層の発光カラーが赤色である場合、正孔注入層の厚さは、約160nm〜約220nm、望ましくは、約190nm〜約220nmであってよい。正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、赤色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0133】
一方、有機層の発光カラーが緑色である場合、正孔注入層の厚さは、約140nm〜約180nm、望ましくは、約160nm〜約180nmであってよい。正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、緑色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0134】
最後に、有機層の発光カラーが青色である場合、正孔注入層の厚さは、約100nm〜約140nm、望ましくは、約110nm〜約130nmであってよい。正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、青色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0135】
上述したような有機層は、正孔注入層とともに正孔輸送層をさらに備えることができる。このとき、有機層の発光カラーが赤色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、約200nm〜約240nm、望ましくは、約210nm〜約230nmであってよい。この時、正孔注入層の厚さは、約160nm〜約220nm、望ましくは、約190nm〜約220nmであってよい。正孔注入層の厚さおよび正孔輸送層の厚さの総和および/または正孔注入層の厚さ範囲が上述の範囲を満足する場合、有機発光素子は、赤色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0136】
一方、有機層の発光カラーが緑色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、約160nm〜約200nm、望ましくは、約170nm〜約190nmであってよい。正孔注入層の厚さは、約140nm〜約180nm、望ましくは、約160nm〜約180nmであってよい。正孔注入層の厚さおよび正孔輸送層の厚さの総和および/または正孔注入層の厚さ範囲が上述の範囲を満足する場合、有機発光素子は、緑色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0137】
最後に、有機層の発光カラーが青色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、約120nm〜約160nm、望ましくは、約130nm〜約150nmであってよい。正孔注入層の厚さは、約100nm〜約140nm、望ましくは、約110nm〜約130nmであってよい。正孔注入層の厚さおよび正孔輸送層の厚さの総和および/または正孔注入層の厚さ範囲が上述の範囲を満足する場合、有機発光素子は、青色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。ここで、上記範囲の正孔注入層および正孔輸送層の厚さの総和および/または正孔注入層の厚さは、有機層の各発光カラー別に補強干渉が起こるように共振距離を確保できる厚さとなる。このような共振距離を確保した有機層において、正孔注入特性および/または正孔輸送特性を最適化することができる。
【0138】
一方、本発明の実施形態は、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが赤色である場合、正孔注入層の厚さは、約160nm〜約220nm、望ましくは、約190nm〜約220nmである有機発光素子を提供する。
【0139】
正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、赤色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0140】
また、本発明の実施形態は、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが緑色である場合、正孔注入層の厚さは、約140nm〜約180nm、望ましくは、約160nm〜約180nmである有機発光素子を提供する。
【0141】
正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、緑色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0142】
それと共に、本発明の実施形態は、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが青色である場合、正孔注入層の厚さは、約100nm〜約140nm、望ましくは、約110nm〜約130nmである有機発光素子を提供する。
【0143】
正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、青色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0144】
上述の有機発光素子には、有機発光素子の駆動の際、第1電極と第2電極との間に共振現象が発生する。このとき、第1電極と第2電極との間に配置される有機層において、正孔注入層は、有機層の発光カラー別に上述の厚さを有するため、低駆動電圧、優れた電流密度、発光輝度、色純度、発光効率および寿命特性を有することができる。
【0145】
上述したような有機発光素子の一具現形態では、第1電極は、基板側に配置される。このとき、第1電極は、反射型電極であってよく、第2電極は、半透明電極または透明電極であってよい。したがって、有機発光素子の駆動の際、第1電極と第2電極との間に共振現象が起こる。これで、有機発光素子の駆動の際、第1電極と第2電極との間に配置される有機層で発生した光は、第1電極と第2電極との間を共振しながら、第2電極を介して(すなわち、基板の外側に)外部に放出される。
【0146】
本発明の実施形態に係る有機発光素子の有機層は、発光層および正孔注入層を備える。発光層および正孔注入層以外に、有機層は、正孔輸送層、電子抑制層、正孔抑制層、電子輸送層および電子注入層のうち、少なくとも一つ以上の層をさらに備えることができる。したがって、本発明の実施形態に係る有機発光素子は、例えば、図1に示したような基板/第1電極/正孔注入層(HIL、Hole Injection Layer)/正孔輸送層(HTL、Hole Transport Layer)/発光層(EML、Emission Layer)/正孔抑制層(HBL、Hole Blocking Layer)/電子輸送層(ETL、Electron Transport Layer)/電子注入層(EIL、Electron Injection Layer)/第2電極の構造を備えることができる。
【0147】
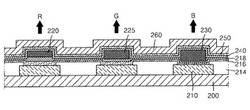
以下、図1および図2を参照して、本発明の実施形態に係る有機発光素子の実施例およびその製造方法を次に説明する。図1は、本発明の実施形態に係る有機発光素子の断面を概略的に示す図である。図2は、本発明の実施形態に係る有機発光素子の各々発光カラーをともに示す図である。
【0148】
まず、基板200の上部に第1電極210を形成する。ここで、基板200としては、通常の有機発光素子で使われる基板を使用する。基板200として、透明性、表面平滑性、取扱容易性および防水性などを考慮して、ガラス基板またはプラスチック基板などを多様に使用できる。
【0149】
第1電極210は、伝導性に優れた金属、例えば、Li、Mg、Al、Al−Li、Ca、Mg−In、Mg−Ag、Ca−Alなどの金属、またはITO(Indium Tin Oxide、インジウムスズ酸化物)、IZO(Indium Zinc Oxide、インジウム亜鉛酸化物)、In2O3(酸化インジウム)などのような金属酸化物を利用して、反射型電極、半透明電極または透明電極に形成される。金属および金属酸化物のうち、2以上の組み合わせを使用することも可能である。
【0150】
この後、有機層の形成領域を定義する画素定義膜214を所定の位置に形成する。画素定義膜214は、シリコンなどの酸化物および窒化物などのような無機物、または絶縁性有機物などを用いて、蒸着法またはコーティング法などの多様な方法によって形成される。
【0151】
この後、第1電極210の上部の画素定義膜214によって定義される領域に沿って、正孔注入層216および正孔輸送層218を真空熱蒸着、またはスピンコーティングして順次に形成する。
【0152】
このとき、正孔注入層216は、上述の化学式1で表示される化合物、化学式2で表示される化合物および化学式3で表示される化合物のうち、少なくとも一つ以上を含むことができる。一方、正孔輸送層218は、例えば、1,3,5−トリカルバゾリルベンゼン、4,4’−ビスカルバゾリルビフェニル、ポリビニルカルバゾール、m−ビスカルバゾリルフェニル、4,4’−ビスカルバゾリル−2,2’−ジメチルビフェニル、4,4’,4’’−トリ(N−カルバゾリル)トリフェニルアミン、1,3,5−トリ(2−カルバゾリルフェニル)ベンゼン、1,3,5−トリス(2−カルバゾリル−5−メトキシフェニル)ベンゼン、ビス(4−カルバゾリルフェニル)シラン、N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1−ビフェニル]−4,4’−ジアミン(TPD)、N,N’−ジ(ナフタレン−1−イル)−N,N’−ジフェニルベンジジン(α−NPD)、N,N’−ジフェニル−N,N’−ビス(1−ナフチル)−(1,1’−ビフェニル)−4,4’−ジアミン(NPB)、IDE320(出光社製)、ポリ(9,9−ジオクチルフルオレン−co−N−(4−ブチルフェニル)ジフェニルアミン)(TFB)またはポリ(9,9−ジオクチルフルオレン−co−ビス−(4−ブチルフェニル)−ビス−N,N−フェニル−1,4−フェニレンジアミン)(PFB)などを含むが、これに限定されない。
【0153】
正孔注入層216および正孔輸送層218の厚さは、上述した範囲内で適用される。正孔注入層216は、真空蒸着法、スピンコーティング法、キャスト法、LB(Langmuir Blodgett)法などのような公知の多様な方法を利用して形成される。
【0154】
真空蒸着法によって正孔注入層216を形成する場合、その蒸着条件は、正孔注入層216の材料として使用する化合物、正孔注入層216の構造および熱的特性によって異なるが、一般的に、蒸着温度は約100℃〜約500℃、真空度は約10−8〜約10−3torr、蒸着速度は約0.01〜約10nm/secの範囲で適切に選択されることが望ましい。
【0155】
スピンコーティング法によって正孔注入層216を形成する場合、そのコーティング条件は、正孔注入層216の材料として使用する化合物、正孔注入層216の構造および熱的特性によって異なるが、コーティング速度は、約2000rpm〜約5000rpm、コーティング後の溶媒除去のための熱処理温度は、約80℃〜約200℃の範囲で適切に選択されることが望ましい。
【0156】
正孔輸送層218も、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成できる。真空蒸着法およびスピンコーティング法などによって正孔輸送層218を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0157】
正孔注入層216および正孔輸送層218の上部には、各カラー別発光層220(赤色発光層)、カラー別発光層225(緑色発光層)、カラー別発光層230(青色発光層)を形成する。本発明の実施形態の発光層材料は、特別に制限されない。
【0158】
赤色発光層220には、例えば、DCM1、DCM2、Eu(テノイルトリフルオロアセトン)3(Eu(TTA)3)、ブチル−6−(1,1,7,7−テトラメチルジュロリジル−9−エニル)−4H−ピラン)(DCJTB)などが使われる。一方、赤色発光層220は、Alq3((8−ヒドロキシキノリン)アルミニウム)にDCJTBのようなドーパントをドーピングすることによって形成される、またはAlq3およびルブレンを共蒸着し、ドーパントをドーピングすることによって形成されてもよいし、4,4’−N,N’−ジカルバゾール−ビフェニル(CBP)にBTPIrまたはRD61のようなドーパントをドーピングすることもあるなど、多様な変形例が可能である。
【0159】
緑色発光層225には、例えば、クマリン6、C545T、キナクリドン、Ir(ppy)3などが使われる。一方、緑色発光層225は、CBPにIr(ppy)3をドーパントとして使用して形成される、またはホストとしてのAlq3にドーパントとしてクマリン系物質を使用して形成されるなど、多様な変形例が可能である。クマリン系ドーパントの具体的な例として、C314S、C343S、C7、C7S、C6、C6S、C314T、C545Tなどがある。
【0160】
青色発光層230には、例えば、オキサジアゾールダイマー染料(Bis−DAPOXP)、スピロ化合物(Spiro−DPVBi、Spiro−6P)、トリアリールアミン化合物、ビス(スチリル)アミン(DPVBi、DSA)、Flrpic、CzTT、アントラセン、TPB、PPCP、DST、TPA、OXD−4、BBOT、AZM−Zn、ナフタレンモエティを含有する芳香族炭化水素化合物であるBH−013X(出光社)などが多様に使われる。一方、青色発光層230は、IDE140(商品名、出光社製)にドーパントとしてIDE105(商品名、出光社製)を使用できるなど、多様な変形例が可能である。
【0161】
発光層の厚さは、約20nm〜約50nm、望ましくは、約30nm〜約40nmであることが望ましい。一方、R(赤)領域、G(緑)領域、B(青)領域の各々発光層の厚さは、相互同一または相異であってよい。もし、発光層の厚さが上述したような範囲を満足する場合、寿命特性および駆動電圧を改善できる。
【0162】
発光層は、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成できる。真空蒸着法およびスピンコーティング法によって発光層を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0163】
発光層上に正孔抑制用物質を真空蒸着、またはスピンコーティングして正孔抑制層(図1)を選択的に形成できる。この時に使用する正孔抑制層用物質は、特別に制限されないが、電子輸送能力を有して、発光化合物より高いイオン化ポテンシャルを有する必要がある。正孔抑制層用物質に用いられる物質の代表として、bis(2−メチル−8−キノラート)−(p−フェニルフェノラート)−アルミニウム(Balq)、バトクプロイン(BCP)、トリス(N−アリールベンジミダゾール)(TPBI)などが使われる。
【0164】
正孔抑制層の厚さは、約3nm〜約6nm、望ましくは、約4nm〜約5nmである。正孔抑制層の厚さが上述の範囲を満足する場合、優れた正孔抑制特性および駆動電圧特性を有することができる。
【0165】
正孔抑制層は、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成でき、真空蒸着法およびスピンコーティング法によって正孔抑制層を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0166】
発光層または正孔抑制層の上部に、電子輸送物質を用いて真空蒸着またはスピンコーティングなどを実施することにより、電子輸送層240を選択的に形成する。電子輸送物質は、特別に制限されず、Alq3などを用いることができる。
【0167】
電子輸送層240の厚さは、約10nm〜約40nm、望ましくは、約25nm〜約35nmであってよい。電子輸送層240の厚さが約10nm以上である場合には、適切な電荷均衡特性を得ることができ、約40nm未満である場合には、適切な駆動電圧を得ることができる。
【0168】
電子輸送層240は、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成でき、真空蒸着法およびスピンコーティング法によって電子輸送層240を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0169】
発光層、正孔抑制層または電子輸送層240の上部に電子注入層250を真空蒸着法またはスピンコーティング法などを利用して形成する。電子注入層250の形成材料としては、BaF2、LiF、NaCl、CsF、Li2O、BaO、Liqなどの物質を利用できるが、これに限定されるものではない。
【0170】
電子注入層250の厚さは、約0.2nm〜約1nm、望ましくは、約0.2nm〜約0.5nmであってよい。このうち、約0.2nm〜約0.4nmが特に適した厚さである。電子注入層250の厚さが上述の範囲を満足する場合、優れた電子注入特性および駆動電圧特性をえることができる。
【0171】
電子注入層250は、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成でき、真空蒸着法およびスピンコーティング法によって電子注入層250を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0172】
次いで、電子注入層250の上部に第2電極用物質を蒸着して第2電極260を形成することによって、有機発光素子が完成される。
【0173】
第2電極用物質としては、導電性に優れた透明な金属酸化物であるITO(Indium Tin Oxide、インジウムスズ酸化物)、IZO(Indium Zinc Oxide、インジウム亜鉛酸化物)、SnO2(酸化スズ)、ZnO(酸化亜鉛)などが使われる。または、Li、Mg、Al、Al−Li、Ca、Mg−In、Mg−Ag、Ca−Alなどを薄膜に形成することによって、反射型電極、半透明電極、または透明電極として第2電極260を多様に形成できる。第2電極260を形成する物質は、例示された金属および金属酸化物の組み合わせに限定されるものではない。
【0174】
第1電極210および第2電極260は、それぞれアノード電極およびカソード電極としての役割を実施でき、その逆も可能である。
【0175】
本発明の実施形態に係る有機発光素子は、多様な形態の平板表示装置、例えば、受動マトリックス有機発光表示装置および能動マトリックス有機発光表示装置に備えられる。特に、能動マトリックス有機発光表示装置に備えられる場合、基板側に備えられた第1電極は、画素電極であって、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結される。また、有機発光素子は、両面に画面を表示できる平板表示装置に備えられる。
つまり、本発明の実施形態に係る平板表示装置は、上述の本発明の実施形態に係る少なくとも一つ以上の有機発光素子を備える。当該有機発光素子の第1電極は、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結される。そして本発明の実施形態に係る平板表示装置は、基板と有機発光素子との間に、薄膜トランジスタ、バッファ層、ゲート絶縁層、層間絶縁層、平坦化層なども具備する。薄膜トランジスタは、半導体層と、ゲート電極と、ソース電極およびゲート電極とを具備する。ゲート電極は、半導体層に絶縁された状態で半導体層上部に位置する。ソース電極およびゲート電極は、ゲート電極と絶縁された状態でゲート電極上部に位置し、半導体層に電気的に連結される。本発明の実施形態の薄膜トランジスタの配置構成は、上記に限定されない。
【0176】
以下、化合物8、化合物9、化合物10、化合物11、化合物14、化合物28、化合物35および化合物56の望ましい合成例およびこれら化合物を含む層を備える有機発光素子の実施例を具体的に例示するが、本発明は、下記の実施例に限定されない。
【0177】
(合成例1、化合物8の製造)
下記化学反応式2の反応経路を経て化合物8を合成した。
【0178】
【化61】

・・・・・・(反応式2)
【0179】
(中間体Aの合成)
カルバゾール(16.7g、100mmol)、ヨードベンゼン(26.5g、130mmol)、CuI(1.9g、10mmol)、K2CO3(138g、1mol)および18−クラウン−6(530mg、2mmol)を、DMPU(1,3−ジメチル−3,4,5,6−テトラヒドロ−(1H)−ピリミジノン)(500mL)に溶かした後に、170℃で8時間加熱した。
【0180】
反応が完結された後、反応混合物を常温に冷やした後、固体物質を濾過し、濾過液にアンモニア水を少量添加した後にジエチルエーテル(300mL)で三回洗浄した。洗浄されたジエチルエーテル層をMgSO4で乾燥させた後、減圧乾燥して粗生成物を得て、シリカゲルカラムクロマトグラフィで分離精製して中間体Aを白色の固体で22g(収率90%)得た。
【0181】
中間体Aの構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(CDCl3、400MHz)δ(ppm)8.12(d、2H)、7.58〜7.53(m、4H)、7.46〜7.42(m、1H)、7.38(d、4H)、7.30〜7.26(m、2H)。
13C NMR(CDCl3、100MHz)δ(ppm)141.0、137.9、130.0、127.5、127.3、126.0、123.5、120.4、120.0、109.9。
【0182】
(中間体Bの合成)
中間体A2.433g(10mmol)を80%の酢酸100mLに入れた後、ヨード(I2)1.357g(5.35mmol)およびオルト−過ヨウ素酸(H5IO6)0.333g(1.46mmol)を固体状態で加えた後、窒素雰囲気で80℃、2時間攪拌した。
【0183】
反応終了後、エチルエーテル(50mL)で三回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体Bを白色の固体で3.23g(収率87%)得た。
【0184】
中間体Bの構造は、1H NMRで決定し、その結果を次に示す。1H NMR(CDCl3、300MHz)δ(ppm)8.43(d、1H)、8.05(d、1H)、7.62(dd、1H)、7.61〜7.75(m、2H)、7.51〜7.43(m、3H)、7.41〜7.35(m、2H)、7.27(dd、1H)、7.14(d、1H)。
【0185】
(中間体Cの合成)
4,4’−ジブロモジフェニル3.12g(10mmol)、アニリン2.3mL(25mmol)、t−BuONa2.9g(30mmol)、Pd2(dba)3183mg(0.2mmol)、P(t−Bu)320mg(0.1mmol)をトルエン30mLに溶かした後、90℃で3時間攪拌した。
【0186】
反応混合物を常温に冷やした後、蒸溜水およびジエチルエーテル30mLで3回抽出した。有機層に存在する沈殿物をフィルタでろ過した後、アセトンおよびジエチルエーテルで洗浄し、真空乾燥して中間体Cを0.3g(収率90%)得た。
【0187】
中間体Cの構造は、1H NMRおよび13C NMRで確認し、その結果を次に示す。1H NMR(DMSO−d6、400MHz)δ(ppm)8.22(s、2H)、7.48(d、4H)、7.23(t、4H)、7.10(dd、8H)、6.82(t、2H)。
13C NMR(DMSO−d6、100MHz)δ(ppm)145.7、144.3、133.7、131.4、128.7、121.2、119.2、118.9。
【0188】
(化合物8の合成)
中間体B912mg(2.47mmol)、中間体C336.4mg(1mmol)、t−BuONa300mg(3mmol)、Pd2(dba)340mg(0.02mmol)、P(t−Bu)33mg(0.01mmol)をトルエン5mLに溶かした後、90℃で3時間攪拌した。
【0189】
反応が完結された後、常温に冷やし、これを蒸溜水およびジエチルエーテル30mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥して溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製し、化合物8を黄色固体で570mg(収率70%)得た。
【0190】
化合物8の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(CDCl3、300MHz)δ(ppm)7.99(d、2H)、7.95(s、2H)、7.61〜7.57(m、8H)、7.48〜7.32(m、12H)、7.27〜7.19(m、8H)、7.18〜7.10(m、8H)、6.96(t、2H)。
13C NMR(CDCl3、100MHz)δ(ppm)148.4、147.3、141.3、140.4、138.0、137.6、133.9、129.9、129.1、127.4、127.1、127.0、126.1、125.6、124.3、123.0、122.9、122.8、121.7、120.5、119.9、118.5、110.7、109.9。
【0191】
上記過程によって得た化合物8をCHCl3で0.2mM(mmol/L)の濃度に希釈させて、UVスペクトルを測定した。化合物8の最大吸収波長は、353nm、306nm、238nmであった。
【0192】
また、化合物8に対して、TGA(Thermo Gravimetric Analysis)およびDSC(Differential Scanning Calorimetry)を利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内のPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃まで昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物8のTd=494℃、Tg=153℃を得た。
【0193】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物8のHOMO(Highest Occupied Molecular Orbital)エネルギー準位5.16eVおよびLUMO(Lowest Occupied Molecular Orbital)エネルギー準位2.16eVを得た。
【0194】
(合成例2、化合物9の製造)
下記化学反応式3の反応経路を経て化合物9を合成した。
【0195】
【化62】

・・・・・・(反応式3)
【0196】
合成例1の中間体Cの反応において、アニリンの代わりにパラトリルアミンを使用したという点を除いて、合成例1の中間体Cの合成と同じ方法で中間体Dを85%の収率で合成した。その後、合成例1の化合物8の合成反応において、中間体Cの代わりに、中間体Dを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で化合物9を黄色固体として2g(収率80%)得た。
【0197】
化合物9の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(C6D6、300MHz)δ(ppm)8.14(d、2H)、7.64(d、2H)、7.47(d、4H)、7.38〜7.28(m、6H)、7.27〜7.25(m、8H)、7.23〜7.01(m、16H)、6.96(d、2H)、2.19(s、6H)。
13C NMR(C6D6、100MHz)δ(ppm)149.0、147.5、142.6、142.2、139.1、138.9、135.1、132.6、130.1、130.7、128.1、127.9、127.2、126.5、125.9、125.0、124.5、123.6、121.8、121.1、119.2、111.8、110.8、21.5。
【0198】
上記過程によって得た化合物9をCHCl3で0.2mM(mmol/L)の濃度に希釈させて、UVスペクトルを測定した。化合物9の最大吸収波長は、358nm、309nm、253nmであった。
【0199】
また、化合物9に対してTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Pan使用である。DSCの分析条件は、N2雰囲気、常温から400℃まで昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物9のTd=480℃、Tg=155℃を得た。
【0200】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物9のHOMOエネルギー準位5.0eVおよびLUMOエネルギー準位2.02eVを得た。
【0201】
(合成例3、化合物10の製造)
下記化学反応式4の反応経路を経て化合物10を合成した。
【0202】
【化63】

・・・・・・(反応式4)
【0203】
(中間体Eの合成)
中間体B3.69g(10mmol)、4−アミノベンゾニトリル1.42g(12mmol)、t−BuONa1.44g(15mmol)、Pd2(dba)3183mg(0.2mmol)、P(t−Bu)340mg(0.2mmol)をトルエン50mLに溶かした後、90℃で3時間攪拌した。
【0204】
上記反応が完結した後、これを常温に冷やし、蒸溜水およびジエチルエーテル50mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体E1.8g(収率50%)を得た。
【0205】
(化合物10の合成)
合成例1の化合物8の反応において、中間体Bおよび中間体Cの代わりに、中間体Eおよび4,4’−ジブロモジフェニルを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で、化合物10を黄色固体として2.2g(収率86%)得た。
【0206】
化合物10の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(CDCl3、300MHz)δ(ppm)8.02(d、2H)、7.97(d、2H)、7.64〜7.48(m、14H)、7.43〜7.39(m、10H)、7.29〜7.22(m、8H)、7.03(d、4H)。
13C NMR(CDCl3、100MHz)δ(ppm)152.1、145.6、141.5、138.9、138.2、137.3、136.3、133.2、130.0、127.9、127.8、127.0、126.6、125.8、125.5、124.6、122.7、120.5、120.2、119.9、119.4、118.9、111.2、110.1、101.8。
【0207】
上記過程によって得た化合物10をCHCl3で0.2mM(mmol/L)の濃度に希釈して、UVスペクトルを測定した。化合物10の最大吸収波長は、304nm、238nmであった。
【0208】
また、化合物10に対してTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃までの昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物10のTd=492℃、Tg=178℃、Tm=263℃を得た。
【0209】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物10のHOMOエネルギー準位5.4eVおよびLUMOエネルギー準位2.47eVを得た。
【0210】
(合成例4、化合物11の製造)
下記化学反応式5の反応経路を経て化合物11を合成した。
【0211】
【化64】

・・・・・・(反応式5)
【0212】
合成例1の中間体Cの反応において、アニリンの代わりに、4−フルオロフェニルアミンを使用したという点を除いて、合成例1の中間体Cの合成と同じ方法で、中間体Fを95%の収率で合成した。その後、合成例1の化合物8の反応において、中間体Cの代わりに、中間体Fを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で化合物11を黄色固体として1.8g(収率84%)得た。
【0213】
化合物11の構造は、1H NMRで決定し、その結果を次に示す。1H NMR(C6D6、300MHz)δ(ppm)8.05(s、2H)、7.68(d、2H)、7.48(d、4H)、7.29〜7.11(m、22H)、7.09〜7.01(m、6H)、6.78(t、4H)。
【0214】
上記過程によって得た化合物11をCHCl3で0.2mM(mmol/L)の濃度に希釈して、UVスペクトルを測定した。化合物11の最大吸収波長は、351nm、297nm、248nmであった。
【0215】
また、化合物11に対するTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃までの昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物11のTd=464℃、Tg=151℃、Tm=299℃を得た。
【0216】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物11のHOMOエネルギー準位5.1eVおよびLUMOエネルギー準位2.28eVを得た。
【0217】
(合成例5、化合物14の製造)
下記化学反応式6の反応経路を経て化合物14を合成した。
【0218】
【化65】

・・・・・・(反応式6)
【0219】
合成例1の中間体Cの反応において、アニリンの代わりに、4−アミノビフェニルを利用したという点を除いて、合成例1の中間体Cの合成と同じ方法で、中間体Gを90%の収率で合成した。その後、合成例1の化合物8の反応において、中間体Cの代わりに中間体Gを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で、化合物14を黄色固体として3.1g(収率82%)得た。
【0220】
化合物14の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(CD2Cl2、300MHz)δ(ppm)8.02〜8.01(m、4H)、7.65〜7.56(m、12H)、7.51〜7.46(m、10H)、7.43〜7.36(m、10H)、7.32〜7.17(m、14H)。
13C NMR(CD2Cl2、100MHz)δ(ppm)148.2、147.6、141.8、141.0、140.6、138.6、137.9、134.5、134.4、130.3、129.1、127.9、127.8、127.4、127.3、127.0、126.8、126.6、126.1、124.7、123.5、123.4、123.0、120.8、120.3、119.0、111.1、110.3。
【0221】
上記過程によって得た化合物14をCHCl3で0.2mM(mmol/L)の濃度に希釈して、UVスペクトルを測定した。化合物14の最大吸収波長は、329nmであった。
【0222】
また、化合物14に対するTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃までの昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物14のTd=533℃、Tg=174℃を得た。
【0223】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物14のHOMOエネルギー準位5.2eVおよびLUMOエネルギー準位2.27eVを得た。
【0224】
(合成例6、化合物28の製造)
下記化学反応式7の反応経路を経て化合物28を合成した。
【0225】
【化66】

・・・・・(反応式7)
【0226】
合成例1の中間体Aの合成反応において、カルバゾールの代わりに、3,6−ジブロモカルバゾールを使用したという点を除いて、合成例1の中間体Aの合成と同じ方法で、中間体Hを80%の収率で合成した。その後、合成例1の中間体Cの合成反応において、4,4’−ジブロモジフェニルの代わりに、中間体Hを使用したという点を除いて、合成例1の中間体Cの合成と同じ方法で中間体Iを85%の収率で合成した。その後、合成例1の化合物8の反応において、中間体Bおよび中間体Cの代わりに、中間体Hおよび中間体Iを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で化合物28を黄色固体として2.3g(収率81%)得た。
【0227】
化合物28の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(C6D6、300MHz)δ(ppm)8.13(s、2H)、8.04(s、2H)、7.65(d、2H)、7.39〜7.31(m、4H)、7.27〜7.22(m、12H)、7.19〜6.99(m、21H)、6.82(t、2H)。
13C NMR(C6D6、100MHz)δ(ppm)150.4、142.1、141.9、141.8、138.8、138.2、138.0、130.0、129.9、129.4、128.3、128.0、127.8、127.7、127.3、127.2、127.1、126.4、126.3、125.2、125.1、125.0、123.8、121.0、120.7、120.4、120.2、119.0、117.7、111.2、110.9、109.9。
【0228】
上記過程によって得た化合物28をCHCl3で0.2mM(mmol/L)の濃度に希釈して、UVスペクトルを測定した。化合物28の最大吸収波長は、315nm、248nmであった。
【0229】
また、化合物28に対するTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃までの昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物28のTd=460℃、Tg=175℃を得た。
【0230】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物28のHOMOエネルギー準位5.0eVおよびLUMOエネルギー準位2.09eVを得た。
【0231】
(合成例7、化合物35の合成)
下記化学反応式8の反応経路を経て化合物35を合成した。
【0232】
【化67】

・・・・・・(反応式8)
【0233】
(中間体Jの合成)
中間体B0.316g(0.856mmol)と4−アミノベンゾニトリル0.142g(1.2mmol)とをトルエン5mLに溶かした後、t−BuONa0.144g(1.5mmol)、Pd2(dba)30.018g(0.02mmol)、(t−Bu)3P0.004〜0.006g(0.02〜0.03mmol)を加えて80℃で5時間攪拌した。反応液をエチルエーテル20mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体J0.218g(収率71%)を得た。
【0234】
(化合物35の合成)
中間体J0.221g(0.614mmol)と中間体B0.332g(0.9mmol)とをトルエン10mLに溶かした後、t−BuONa0.144g(1.5mmol)、Pd2(dba)30.018g(0.02mmol)、(t−Bu)3P0.004〜0.006g(0.02〜0.03mmol)を加えて90℃で6時間攪拌した。反応液をエチルエーテル30mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して化合物350.236g(収率64%)を得た。化合物35の構造を1H−NMRで確認し、その結果を次に示す。1H−NMR(CDCl3、400MHz)δ(ppm)8.05(d、2H)、8.03(dd、2H)、7.58(m、8H)、7.47(m、2H)、7.39(m、8H)、7.33(dd、2H)、7.24(m、2H)、6.94(d、2H)。化合物35のTgは、143℃であった。
【0235】
(合成例8、化合物56の合成)
下記化学反応式9の反応経路を経て化合物56を合成した。
【0236】
【化68】

・・・・・・(反応式9)
【0237】
(中間体Kの合成)
2−ブロモフルオレン13g(53mmol)を酢酸60mLに溶かし、重クロム酸ナトリウム60g(200mmol)を0℃で徐々に添加した。12時間後に混合物に蒸溜水200mLを添加してよく攪拌した。生成された黄色固体を濾過し、乾燥して中間体Kを10g(収率78%)で得た。
【0238】
(中間体Lの合成)
中間体K8g(31.6mmol)をTHF60mLに溶かして−78℃で1M(mol/L)の臭化フェニルマグネシウム38mL(38mmol)を徐々に添加した。2時間後に温度を常温に維持して5時間攪拌した。塩化アンモニウム水溶液50mLに希釈した後、酢酸エチル(40mL)で3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体L10g(収率95%)を得た。中間体Lの構造は、1H NMRで確認し、その結果を次に示す。1H NMR(CDCl3、400MHz)δ(ppm)7.64(d、1H)、7.54〜7.47(m、2H)、7.44(d、1H)、7.39〜7.33(m、3H)、7.30〜7.23(m、5H)、2.46(s、1H)。
【0239】
(中間体Mの合成)
中間体L10g(30mmol)をベンゼン60mLに溶かして、濃硫酸2.4mL(45mmol)を少量のベンゼンに希釈して添加した。80℃で5時間攪拌した後、ベンゼンを蒸発させて残った濾液に1N水酸化ナトリウム水溶液を添加して、反応液をPH7にした後に、酢酸エチル(40mL)で3回抽出した。集められた有機層を硫酸マグネシウムで乾燥して溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体M6g(収率50%)を得た。
【0240】
(中間体Oの合成)
中間体M340mg(0.856mmol)および4−アミノベンゾニトリル142mg(1.2mmol)をトルエン5mLに溶かした後、t−BuONa0.144g(1.5mmol)、Pd(dba)20.018g(0.02mmol)、(t−Bu)3P0.004〜0.006g(0.02〜0.03mmol)を加えて80℃で5時間攪拌した。反応液をエチルエーテル20mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥して溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体O0.27g(収率73%)を得た。
【0241】
(化合物56の合成)
中間体O267mg(0.614mmol)および中間体B(合成例1参照)0.332g(0.9mmol)をトルエン10mLに溶かした後、ここにt−BuONa0.144g(1.5mmol)、Pd(dba)20.018g(0.02mmol)、(t−Bu)3P0.004〜0.006g(0.02〜0.03mmol)を加えて90℃で6時間攪拌した。反応液をエチルエーテル30mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して化合物56を0.236g(収率57%)で得た。化合物56の構造は、1H NMRで確認し、その結果を次に示す。1H NMR(CDCl3、400MHz)δ(ppm)7.97(d、1H)、7.90(d、1H)、7.69(d、1H)、7.65(d、1H)、7.60(d、2H)、7.56(dd、2H)、7.48(m、1H)、7.40(d、2H)、7.35(m、6H)、7.24(m、3H)、7.16(m、10H)、7.11(dd、1H)、6.93(d、2H)。
【0242】
以上、上記の通り合成した本発明の実施形態の化合物8、化合物9、化合物10、化合物11、化合物14、化合物28は、比較的高いTd(熱分解温度)、Tg(ガラス転移温度)、Tm(融点)を示すことが分かった。また、IDE406のTg135℃に比べても、化合物8、化合物9、化合物10、化合物11、化合物14、化合物28、化合物35のTgは高いことが分かる。化合物56も、構造内にフェニルカルバゾール基を複数有することにより、高い耐熱性を有すると考えられる。これにより、上記化合物を正孔注入層の形成に用いると、正孔注入層自体の耐熱性を向上できるため、有機発光素子の寿命、発光輝度等を向上できる。
【実施例】
【0243】
(実施例1)
反射型電極(第1電極)として、130nmの厚さのアルミニウム基板およびITO(SDI社製)基板を、50mm×50mm×0.7mmサイズに切断してイソプロピルアルコールおよび純水の中で各5分間超音波洗浄した後、30分間UV、オゾン洗浄して使用した。
【0244】
第1電極の上部に正孔注入物質として化合物8を蒸着して、120nmの厚さの正孔注入層を形成した後、正孔注入層の上部に正孔輸送物質であるNPBを蒸着させて30nmの厚さの正孔輸送層を形成した。
【0245】
正孔輸送層の上部に青色蛍光ホストであるIDE140(出光社)と青色蛍光ドーパントであるIDE105(出光社)とを質量比98対2でともに蒸着して、30nmの厚さに青色発光層を形成した後、発光層の上部にBalqを蒸着して5nmの厚さの正孔抑制層を形成した。正孔抑制層の上部にAlq3を25nmの厚さに蒸着して電子輸送層を形成した後、LiFを0.3nmの厚さに蒸着して電子注入層を形成した。電子注入層の上部にMg−Agを18nmの厚さに蒸着して半透明電極(第2電極)を形成することによって、有機発光素子を製造した。
【0246】
有機発光素子は、駆動電圧5.5Vで、電流密度23.0mA/cm2、発光輝度1179cd/m2の高輝度を示した。色座標は、(0.113、0.130)であり、発光効率は、5.13cd/Aであった。
【0247】
(実施例2)
正孔注入層の形成時に、化合物8の代わりに化合物9を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0248】
有機発光素子は、駆動電圧5.5Vで、電流密度20.1mA/cm2、発光輝度1021cd/m2の高輝度を示した。色座標は、(0.113、0.120)であり、発光効率は、5.10cd/Aであった。
【0249】
(実施例3)
正孔注入層の形成時に、化合物8の代わりにIDE406(出光社製)を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0250】
有機発光素子は、駆動電圧5.5Vで、電流密度46.52mA/cm2、発光輝度784cd/m2の輝度を示した。色座標は(0.113、0.125)であり、発光効率は、4.74cd/Aであった。
【0251】
(実施例4)
正孔注入層の形成時に、化合物8の代わりにLi273(ドイツ、Sensient社)を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0252】
有機発光素子は、駆動電圧5.5Vで、電流密度17.43mA/cm2、発光輝度695cd/m2の輝度を示した。色座標は(0.122、0.110)であり、発光効率は、3.98cd/Aであった。
【0253】
(実施例5)
正孔注入層の形成時に、化合物8の代わりにHI102(米国UDC社)を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0254】
有機発光素子は、駆動電圧5.5Vで、電流密度0.67mA/cm2、発光輝度1.2cd/m2の低輝度を示した。色座標は(0.112、0.154)であり、発光効率は、0.18cd/Aであった。
【0255】
(実施例6)
正孔注入層の形成時に、化合物8の代わりに、ELM180(韓国、ELM社)を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0256】
有機発光素子は、駆動電圧5.5Vで、電流密度2.55mA/cm2、発光輝度52cd/m2の輝度を示した。色座標は(0.124、0.105)であり、発光効率は、2.04cd/Aであった。
【0257】
実施例1〜6から、正孔注入層材料として本発明の実施形態の化合物8または化合物9を使用して、かつ正孔注入層の厚さを本発明の実施形態の範囲内に調節した場合、正孔注入能力が向上するにつれて、同一駆動電圧で電流密度および電流効率値が向上することがわかった。また、これにより、色純度、輝度値が増加することを確認できた。同一駆動電圧下での電流効率値の比較結果は、図3に示す。図3より、本発明の実施形態の化合物8を用いた実施例1の電流効率値(発光効率)が最も高いことが分かった。
【0258】
一方、実施例1および実施例3の寿命特性および駆動電圧の変化量を評価して、各々図4および図5に表した。図4は、加速寿命条件である4000cd/m2で200時間経過した過程での実施例1の有機発光素子と実施例3の有機発光素子との寿命を測定した結果を示すものである。図4によると、実施例1の有機発光素子は、90.2%の寿命特性を表し、実施例3の有機発光素子は、86.2%の寿命特性を表した。つまり、4000cd/m2の加速寿命条件で200時間経過した後の実施例1の有機発光素子の輝度値は、加速寿命測定前の値に対して、90.2%であった。一方、4000cd/m2の加速寿命条件で200時間経過した後の実施例3の有機発光素子の輝度値は、加速寿命測定前の値に対して、86.2%であった。これにより、実施例1は実施例3より高い寿命を示すことが分かった。一方、図5は、加速寿命条件である4000cd/m2で400時間経過した過程での駆動電圧の変化量を測定した結果を示すものであって、実施例1の有機発光素子の駆動電圧は、400時間経過後に0.45V増加し、実施例3の有機発光素子の駆動電圧は、400時間経過後に1.65V増加した。これにより、実施例1は実施例3より、長時間の駆動時でも、比較的低電圧で駆動できることが分かった。図5から、本発明による実施例1の有機発光素子が、特に、低電圧、低消費電力(低駆動電圧)を実現できることが確認できる。これは、本発明の実施形態の化合物8は、耐熱性に優れているため、化合物8を用いた有機発光素子の耐久性および寿命が向上できたためである。
【0259】
(実施例7)
正孔注入層として化合物11を利用して160nmの厚さの正孔注入層を蒸着した後、正孔注入層の上部に正孔輸送物質であるNPBを蒸着させて30nmの厚さの正孔輸送層を形成した。青色発光層の代わりに、緑色発光物質としてCBPとIr(ppy)3とを利用して30nmの厚さに緑色発光層を形成したという点を除いては、実施例1と同じ方法で有機発光素子を形成した。
【0260】
有機発光素子は、駆動電圧5Vで、電流密度7.5mA/cm2、発光輝度2220cd/m2の高輝度を示した。色座標は(0.244、0.71)であり、発光効率は、29.6cd/Aであった。
【0261】
(実施例8)
正孔注入層の形成時に、化合物11の代わりに、IDE406(出光社)を利用したことを除いては、実施例7と同じ方法で有機発光素子を製作した。
【0262】
有機発光素子は、駆動電圧5Vで、電流密度7.86mA/cm2、発光輝度1900cd/m2の輝度を示した。色座標は(0.246、0.691)であり、発光効率は、23.9cd/Aであった。
【0263】
実施例7および実施例8の有機発光素子の電流効率値は、図6に示す。図6の結果より、本発明の実施形態の化合物11を用いた実施例7の方が、化合物11の代わりにIDE406を用いた実施例8より、電流効率(発光効率)が高いことが分かった。また、発光輝度値も実施例7の方が実施例8より高い。これは、化合物11の正孔移動度および耐熱性が優れているためである。これにより、化合物11を用いると、発光効率および発光輝度値を向上できることがわかった。
【0264】
(実施例9)
正孔注入層として化合物14を利用して200nmの厚さの正孔注入層を蒸着した後、正孔注入層の上部に正孔輸送物質であるNPBを蒸着させて30nmの厚さの正孔輸送層を形成した。青色発光層の代わりに、赤色発光物質としてCBPとBTPIrとを利用して30nmの厚さに赤色発光層を形成したという点を除いては、実施例1と同じ方法で有機発光素子を形成した。
【0265】
有機発光素子は、駆動電圧5Vで、電流密度11.8mA/cm2、発光輝度1534cd/m2の高輝度を示した。色座標は(0.687、0.310)であり、発光効率は、13.0cd/Aであった。
【0266】
(実施例10)
正孔注入層の形成時に、化合物14の代わりに、IDE406(出光社)を利用したことを除いては、実施例9と同じ方法で有機発光素子を製作した。
【0267】
有機発光素子は、駆動電圧5Vで、電流密度13.3mA/cm2、発光輝度1328cd/m2の輝度を示した。色座標は(0.692、0.306)であり、発光効率は、9.98cd/Aであった。
【0268】
実施例9および実施例10の有機発光素子の電流効率値は、図7に示す。図7の結果より、本発明の実施形態の化合物14を用いた実施例9の方が、化合物14の代わりにIDE406を用いた実施例10より、電流効率(発光効率)が高いことが分かった。また、発光輝度値も実施例9の方が実施例10より高い。これは、化合物14の正孔移動度および耐熱性が優れているためである。これにより、化合物14を用いると、発光効率および発光輝度値を向上できることがわかった。
【0269】
実施例1〜10に対する駆動電圧、発光効率および色純度(色座標)は、IVL測定装置(PhotoResearch PR650、Keithley 238)を利用して評価した。発光輝度および電流密度も、上記IVL測定装置を利用して測定した。
【0270】
(実施例11)
次のような方法によって、赤色発光層、緑色発光層および青色発光層を何れも備える有機発光素子を製作した。
【0271】
薄膜トランジスタが備えられた基板を準備した後、Alなどから形成される100nmの厚さの第1電極をストライプ状に形成した。このとき、第1電極は、基板の下部に備えられた薄膜トランジスタのソース電極またはドレイン電極と電気的に連結されるように形成した。
【0272】
第1電極の上部にシリコン酸化物を利用して赤色発光層、緑色発光層、青色発光層が配置される領域に、各々領域を定義する画素定義膜を形成した。そして、画素定義膜に沿って正孔注入材料である化合物8を、赤色発光層が形成される領域には、200nmの厚さに蒸着し、緑色発光層が形成される領域には、160nmの厚さに蒸着し、青色発光層が形成される領域には、120nmの厚さに蒸着し、各発光層別に正孔注入層を形成した。この後、正孔注入層の上部に正孔輸送物質であるNPBを30nmの厚さで蒸着した。
【0273】
正孔輸送層の上部には、赤色発光物質としてCBPとBTPIrとを30nmの厚さに蒸着し、緑色発光物質としてCBPとIr(ppy)3とを30nmの厚さに蒸着し、青色発光物質としてIDE140(出光社製)とIDE105(出光社製)とを15nmの厚さに蒸着し、各々赤色発光層、緑色発光層および青色発光層を形成した。
【0274】
発光層の上部にBalqを蒸着して、5nmの厚さの正孔抑制層を形成した。正孔抑制層の上部にAlq3を25nmの厚さに形成して電子輸送層を形成し、電子輸送層の上部にLiF0.3nmの厚さに蒸着して電子注入層を形成した。その後、電子注入層上に、Mg−Agを18nmの厚さに蒸着して半透明電極(第2電極)を形成することによって、赤色発光層、緑色発光層および青色発光層を何れも備えた有機発光素子を製造した。
【0275】
実施例1〜実施例10の発光効率および色座標の評価方法と同じ方法で、実施例11の有機発光素子の発光効率および色座標を評価して下記表1に示す。
【0276】
【表1】

【0277】
表1によると、実施例11から得た有機発光素子は、各々発光カラー別に優秀な発光効率および色純度を有することが分かる。一方、40%の有機発光素子が作動している状態で、実施例11の有機発光素子における赤色、緑色および青色カラーを混合した白色カラーの発光効率は、発光輝度150cd/m2で13.0cd/Aを示した。これに基づいた消費電力は、180mWであった。消費電力は、IVL測定装置(PhotoResearch PR650、Keithley 238)を利用して発光効率および色純度を評価した後、計算を通じて算出した。
【0278】
(実施例12)
正孔注入層の形成時に、化合物8の代わりに、IDE406(出光社)を利用したことを除いては、実施例11と同一の方法で有機発光素子を製作した。その発光効率および色座標の評価結果は、下記表2に示す。
【0279】
【表2】

【0280】
表2によると、実施例12から得た有機発光素子は、各々発光カラー別に優秀な発光効率および色純度を有することが分かる。一方、40%の有機発光素子が作動している状態で、実施例12の有機発光素子における赤色、緑色および青色カラーを混合した白色カラーの発光効率は、発光輝度150cd/m2で11.0cd/Aを示した。これに基づいた消費電力は、220mWであった。消費電力は、IVL測定装置(PhotoResearch PR650、Keithley 238)を利用して発光効率および色純度を評価した後、計算を通じて算出した。
【0281】
(比較例1)
薄膜トランジスタが備えられた基板を準備した後、アルミニウムから形成される100nmの厚さの第1電極をストライプ状に形成した。このとき、第1電極は、基板の下部に備えられた薄膜トランジスタのソース電極またはドレイン電極と電気的に連結されるように形成した。
【0282】
画素電極の上部にシリコン酸化物を利用して赤色発光層、緑色発光層、青色発光層が配置される領域に、各々定義する画素定義膜を形成した。そして、画素定義膜に沿って正孔注入物質であるm−TDATAで100nmの厚さの正孔注入層を形成した後、正孔注入層の上部に正孔輸送物質であるNPBを40nmの厚さに蒸着した。この後、フォトマスクを利用して緑色発光層が形成される領域には、40nmの厚さの正孔輸送物質であるNPBを追加蒸着し、赤色発光層が形成される領域には、80nmの厚さの正孔輸送物質であるNPBを追加蒸着して、赤色発光層が形成される領域の正孔輸送層の厚さは120nm、緑色発光層が形成される領域の正孔輸送層の厚さは80nm、青色発光層が形成される領域の正孔輸送層の厚さは40nmにした。
【0283】
正孔輸送層の上部に、各々赤色発光物質としてCBPとBTPIrとを30nmの厚さに形成し、緑色発光物質としてCBPとIr(ppy)3とを30nmの厚さに形成し、青色発光物質としてIDE140(出光社製)とIDE105(出光社製)とを15nmの厚さに形成し、各々赤色発光層、緑色発光層および青色発光層を形成した。
【0284】
発光層の上部に、Balqを蒸着して5nmの厚さの正孔抑制層を形成した。正孔抑制層の上部にAlq3を25nmの厚さに形成して電子輸送層を形成し、電子輸送層の上部にLiFを0.3nmの厚さで蒸着して電子注入層を形成した後、半透明電極(第2電極)としてMg−Agを18nmの厚さで形成し、有機発光素子を製造した。
【0285】
比較例1の発光効率および色座標の評価結果は、下記表3に示す。
【0286】
【表3】

【0287】
表3によると、本発明の実施例11の有機発光素子のように本発明の正孔注入物質を使用することもせず、実施例12の有機発光素子のように上記の正孔注入層の厚さ範囲を採用することもしない比較例1の有機発光素子より、本発明の実施例11および実施例12の有機発光素子が発光効率、色純度で優秀であるということが確認できる。また、実施例11は、実施例12より消費電力が少なかった。これは、実施例11で使用した化合物8の優れた耐熱性および正孔移動度による。
【0288】
以上結果より、本発明の実施形態の化合物を正孔注入層の形成に用いると、当該化合物の高い耐熱性および高い正孔移動度のために、寿命、発光効率、電流密度および発光輝度を向上でき、かつ低駆動電圧を実現できる。また、本発明の実施形態では、第1電極および第2電極のうち、いずれか一つを反射型電極で形成し、他の一つを透明電極または半透明電極で形成するため、有機層から放出される光は共振(干渉)できる。さらに共振をより効果的に実施するために、赤色、緑色、青色の発光層別に対応して正孔注入層の厚さを最適化する。この共振現象により、有機層(有機発光素子)から放出される光の輝度、色純度を向上できる。従って、上記のように構成される本発明の実施形態に係る有機発光素子を平板表示装置に適用すると、平板表示装置の性能を向上できる。
【0289】
以上、添付図面を参照しながら本発明の好適な実施形態について説明したが、本発明は係る例に限定されないことは言うまでもない。当業者であれば、特許請求の範囲に記載された範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、それらについても当然に本発明の技術的範囲に属するものと了解される。
【産業上の利用可能性】
【0290】
本発明は、平板表示装置関連の技術分野に適用可能である。
【図面の簡単な説明】
【0291】
【図1】本発明の実施形態に係る有機発光素子の一具現形態の構造を概略的に示す図面である。
【図2】本発明の実施形態に係る赤色発光層、緑色発光層および青色発光層を何れも備える有機発光素子を概略的に示す図面である。
【図3】本発明の実施形態に係る有機発光素子の電流効率、輝度を示す図面である。
【図4】本発明の実施形態に係る有機発光素子の輝度、寿命を示す図面である。
【図5】本発明の実施形態に係る有機発光素子の加速駆動電圧の変化量を示す図面である。
【図6】本発明の実施形態に係る有機発光素子の電流効率、輝度を示す図面である。
【図7】本発明の実施形態に係る有機発光素子の電流効率、輝度を示す図面である。
【符号の説明】
【0292】
200 基板
210 第1電極
214 画素定義膜
216 正孔注入層
218 正孔輸送層
220、225、230 発光層
240 電子輸送層
250 電子注入層
260 第2電極
【技術分野】
【0001】
本発明は、有機発光素子および平板表示装置に関する。
【背景技術】
【0002】
有機発光素子は、蛍光有機膜または燐光有機膜に電流を流すと、電子および正孔が有機層で結合するとともに、光を発生する現象を利用した自発光型素子である。有機発光素子は、軽量で部品が簡素であり、製作工程が比較的簡単な構造を備える。また、高画質の具現が可能であり、広い視野角を確保でき、動画を完璧に具現できる。それと共に、有機発光素子は、高色純度の具現、低消費電力、低電圧駆動が可能であり、携帯用電子機器に適した電気的特性を備える。
【0003】
有機発光素子は、発光効率の向上および駆動電圧の低下のために、有機膜を単一発光層のみで使用せず、電子注入層、発光層、正孔輸送層のような多層構造を使用することが一般的である。例えば、特許文献1には、正孔輸送層を備えた有機発光素子が開示されている。
【0004】
【特許文献1】特開2002−252089号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかし、従来の有機発光素子では、満足すべきレベルの駆動電圧、電流密度、輝度、色純度、発光効率および寿命を達成できないため、その改善が求められている。
【0006】
そこで、本発明は、このような問題に鑑みてなされたもので、その目的とするところは、駆動電圧、電流密度、輝度、色純度、発光効率および寿命などの特性を向上した有機発光素子および有機発光素子を具備する平板表示装置を提供することにある。
【課題を解決するための手段】
【0007】
上記課題を解決するために、本発明の第1の観点によれば、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層は、下記化学式1で表示される化合物、下記化学式2で表示される化合物および下記化学式3で表示される化合物のうち、少なくとも何れか一つ以上の化合物を含む層を備える有機発光素子が提供される。
【0008】
【化1】

・・・・・・(化学式1)
【0009】
【化2】

・・・・・・(化学式2)
【0010】
【化3】

・・・・・・(化学式3)
【0011】
上記化学式1〜3のうち、Xは、置換または非置換の炭素数1〜30のアルキレン基、置換または非置換の炭素数2〜30のアルケニレン基、置換または非置換の炭素数6〜30のアリーレン基、置換または非置換の炭素数2〜30のヘテロアリーレン基、または置換または非置換の炭素数2〜30の複素環を表すことができる。R1、R2、R3、R4、R5、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R1、R2、R3のうち2以上、R4、R5およびR6、R7、R8のうち2以上は、隣接した基と相互結合して、飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Ar1、Ar2およびAr3は、各々独立的に、置換または非置換の炭素数6〜30のアリール基または置換または非置換の炭素数2〜30のヘテロアリール基であってよい。Yは、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環を表すことができる。nは、0〜5の整数であってよい。
【0012】
第1電極は、基板側に配置され、第1電極は、反射型電極であってよく、第2電極は、半透明電極または透明電極であってよい。有機層で生成される光は、第2電極を介して外部に放出されてよい。
【0013】
有機発光素子の作動の際に、第1電極と第2電極との間に共振現象が起きてよい。
【0014】
有機発光素子の作動の際に、反射型電極の第1電極と半透明電極または透明電極の第2電極との間に、共振現象が起きてよい。
【0015】
本発明によれば、有機発光素子に第1電極、第2電極を備え、第1電極および第2電極のうち、一つは反射型電極であり、他の一つは透明電極または半透明電極である。これにより、有機発光素子駆動の際には、第1電極と第2電極との間に共振現象を起こすことができる。この共振現象により、有機発光素子の発光輝度、色純度を向上できる。また、有機発光素子駆動の際に共振現象を起こす一対の電極間に、優れた正孔移動度および耐熱性を有するフェニルカルバゾール系化合物を含む有機層を適用するため、有機発光素子は、低駆動電圧、優れた電流密度、発光輝度、色純度、発光効率および寿命を有することができる。さらに、有機発光素子駆動の際に共振現象を起こす一対の電極間に、各色別の発光層に対応した所定の厚さ範囲の正孔注入層を適用するため、共振現象を効果的に実施できる。従って、当該有機発光素子は、発光輝度、色純度、発光効率および寿命を向上することができ、特に、寿命特性を顕著に向上できる。
【0016】
上記化学式1で表示される化合物は、下記化学式1aの構造を有することができる。
【0017】
【化4】

・・・・・・(化学式1a)
【0018】
上記化学式1aのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R1、R2およびR3のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q1は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基であってよい。
【0019】
上記化学式1で表示される化合物は、下記化学式1bの構造を有することができる。
【0020】
【化5】

・・・・・・(化学式1b)
【0021】
上記化学式1bのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R1、R2およびR3は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q2は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基であってよい。
【0022】
上記化学式2で表示される化合物は、下記化学式2aの構造を有することができる。
【0023】
【化6】

・・・・・・(化学式2a)
【0024】
上記化学式2aのうち、R4およびR5は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R4およびR5は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q3は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基であってよい。
【0025】
上記化学式3で表示される化合物は、下記化学式3aの構造を有することができる。
【0026】
【化7】

・・・・・・(化学式3a)
【0027】
上記化学式3aのうち、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表すことができる。R6、R7およびR8のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q4は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基であってよい。
【0028】
上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物は、下記化合物1〜化合物62のうち何れか一つであってよい。
【0029】
【化8】

【0030】
【化9】

【0031】
【化10】

【0032】
【化11】

【0033】
【化12】

【0034】
【化13】

【0035】
【化14】

【0036】
【化15】

【0037】
【化16】

【0038】
【化17】

【0039】
【化18】

【0040】
【化19】

【0041】
【化20】

【0042】
【化21】

【0043】
【化22】

【0044】
【化23】

【0045】
【化24】

【0046】
【化25】

【0047】
【化26】

【0048】
【化27】

【0049】
【化28】

【0050】
【化29】

【0051】
【化30】

【0052】
上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物は、上記化合物8、上記化合物9、上記化合物10、上記化合物11、上記化合物14、上記化合物28、上記化合物35および上記化合物56のうち何れか一つであってよい。
【0053】
有機層において、上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物のうち、少なくとも一つ以上を含む層は、正孔注入層、正孔輸送層または正孔注入特性および正孔輸送特性をともに有する単一層であってよい。
【0054】
有機層において、上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物のうち、少なくとも一つ以上を含む層は、正孔注入層であってよい。
【0055】
有機層の発光カラーが赤色である場合、正孔注入層の厚さは、160nm〜220nmであってよい。
【0056】
有機層の発光カラーが緑色である場合、正孔注入層の厚さは、140nm〜180nmであってよい。
【0057】
有機層の発光カラーが青色である場合、正孔注入層の厚さは、100nm〜140nmであってよい。
【0058】
有機層は、正孔輸送層をさらに備えることができる。
【0059】
有機層の発光カラーが赤色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、200nm〜240nmであってよい。
【0060】
正孔注入層の厚さは、160nm〜220nmであってよい。
【0061】
有機層の発光カラーが緑色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、160nm〜200nmであってよい。
【0062】
正孔注入層の厚さは、140nm〜180nmであってよい。
【0063】
有機層の発光カラーが青色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、120nm〜160nmであってよい。
【0064】
正孔注入層の厚さは、100nm〜140nmであってよい。
【0065】
上記課題を解決するために、本発明の第2の観点によれば、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが赤色である場合、正孔注入層の厚さは、160nm〜220nmである有機発光素子が提供される。
【0066】
上記課題を解決するために、本発明の第3の観点によれば、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが緑色である場合、正孔注入層の厚さは、140nm〜180nmである有機発光素子が提供される。
【0067】
上記課題を解決するために、本発明の第4の観点によれば、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが青色である場合、正孔注入層の厚さは、100nm〜140nmである有機発光素子が提供される。
【0068】
第1電極は、基板側に配置され、第1電極は、反射型電極であってよく、第2電極は、半透明電極または透明電極であってよい。有機層で生成される光は、第2電極を介して外部に放出されてよい。
【0069】
有機発光素子の作動の際、第1電極と第2電極との間に共振現象がおきてよい。また、有機発光素子の作動の際、反射型電極の第1電極と半透明電極または透明電極の第2電極との間に、共振現象がおきてよい。
【0070】
上記課題を解決するために、本発明の第5の観点によれば、上述したような有機発光素子を備え、有機発光素子の第1電極は、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結される平板表示装置が提供される。また、本発明の平板表示装置は、上述のように、赤色の有機層を備える有機発光素子、緑色の有機層を備える有機発光素子、青色の有機層を備える有機発光素子のうち、少なくとも一つの有機発光素子、もしくは全ての有機発光素子を備えることができる。この時、各有機発光素子の各第1電極は、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結される。
【0071】
本発明の有機発光素子は、低駆動電圧、優れた電流密度、発光輝度、色純度、発光効率および寿命を備えることができる。特に、本発明の有機発光素子の寿命特性は、顕著に向上することができる。
【発明の効果】
【0072】
以上説明したように本発明によれば、有機発光素子作動の際に共振現象を起こす一対の電極間に、化学式1、化学式2または化学式3の構造を有する化合物を含む有機層を備えるか、または一対の電極間に上述したような厚さ範囲の正孔注入層を備えると、低駆動電圧、優れた電流密度、発光輝度、色純度、電流効率および寿命特性を実現できる。特に、本発明の有機発光素子を利用すると、顕著に向上した寿命特性を達成できる。これにより、本発明の有機発光素子を利用すると、信頼性の向上した平板表示装置を具現できる。
【発明を実施するための最良の形態】
【0073】
以下に添付図面を参照しながら、本発明の好適な実施の形態について詳細に説明する。なお、本明細書及び図面において、実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0074】
本発明の実施形態に係る有機発光素子は、基板、第1電極、第2電極および有機層を具備する。有機層は、第1電極と第2電極との間に配置され、少なくとも発光層を備える。発光層に用いられる物質によって、有機層は、赤色、緑色または青色の光を放出できる。
【0075】
第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極である。したがって、有機発光素子駆動の際に第1電極と第2電極との間に共振現象が起きる。これにより、有機発光素子の駆動の際、第1電極と第2電極との間の有機層で発生した光は、第1電極と第2電極との間で共振しながら、有機発光素子の外部に放出されるので、発光輝度および発光効率を向上することができる。
【0076】
ここで、共振現象について説明する。有機発光素子は、基板(例えば、ガラス基板)上に形成される蛍光性有機層および一対の電極から構成される面型発光デバイスであり、電極から注入される正孔および電子の再結合が有機層で起こることにより、発光する。従来の有機発光素子から放出される各々波長の光は、広い角度に渡って放出されるので光量ロスなどが起こり、有機発光素子の輝度が低下する場合がある。そこで、光の干渉を利用して有機発光素子の輝度を高めるために、有機発光素子の構造を以下の通りに設定する。まず、有機発光素子において、ガラス基板上に誘電体ミラーとしての反射型電極、正孔注入層、正孔輸送層、発光層、電子輸送層、透明電極(MgAg電極など)を順次積層して形成する。この構造が共振器(マイクロキャビティ)として作用する。つまり、透明電極(または、半透明電極)および反射型電極を備える共振構造によって、有機発光素子から放出される光は、透明電極と反射型電極との間を反射往復できることにより、共振(干渉)できる。有機発光素子から放出される光は、広い範囲の波長領域を有するので、共振により光を所望の波長に調節できる。さらに、共振(干渉)現象により、有機発光素子から放出される光の往復の光学的長さ(光路長)が、所望の発光波長の整数倍となることができる。これにより、有機発光素子から放出される光の発光スペクトルを単色化できるとともに、発光ピーク強度を向上できるため、有機発光素子の輝度を向上できる。さらに正孔注入層、正孔輸送層の厚さを最適化すると、共振効果に適した正孔注入特性および正孔輸送特性を有することができるので、より効果的に共振現象を実施できる。以上より、本発明の実施形態では、有機発光素子内に共振できる構造を備えるため、光の共振(干渉)によって有機発光素子の発光輝度、発光効率および色純度を向上できる。
【0077】
さらに具体的に、第1電極は、基板側に配置される。このとき、第1電極は、反射型電極であってよく、第2電極は、半透明電極または透明電極であってよい。したがって、有機発光素子の作動の際において、第1電極と第2電極との間に配置される有機層で発生した光は、第1電極と第2電極との間で共振しながら、第2電極を介して外部に(すなわち、基板の外側に)放出される。
【0078】
本発明の実施形態に係る有機発光素子の有機層は、フェニルカルバゾール系化合物などを含む層を備えることができる。さらに具体的には、有機層は、下記化学式1で表示される化合物、下記化学式2で表示される化合物および下記化学式3で表示される化合物のうち、少なくとも一つ以上の化合物を含む層を備える。
【0079】
【化31】

・・・・・・(化学式1)
【0080】
【化32】

・・・・・・(化学式2)
【0081】
【化33】

・・・・・・(化学式3)
【0082】
上記化学式1〜3のうち、Xは、置換または非置換の炭素数1〜30のアルキレン基、置換または非置換の炭素数2〜30のアルケニレン基、置換または非置換の炭素数6〜30のアリーレン基、置換または非置換の炭素数2〜30のヘテロアリーレン基、または置換または非置換の炭素数2〜30の複素環などを表す。Xにおいて、具体的な例としては、非置換の炭素数6〜30のアリーレン基の場合、フェニレン基、ビフェニレン基、ナフチレン基等があるが、これに限定されない。また置換の炭素数6〜30のアリーレン基の場合では、2,5-ジメチルフェニレン基などがあるがこれに限定されない。置換の炭素数2〜30のヘテロアリーレン基としては、フェニルカルバゾリレン基などがあるがこれに限定されない。R1、R2、R3、R4、R5、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R1、R2、R3のうち2以上、R4、R5およびR6、R7、R8のうち、2以上は、隣接した基と相互結合して、飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Ar1、Ar2およびAr3は、各々独立的に置換または非置換の炭素数6〜30のアリール基、または置換または非置換の炭素数2〜30のヘテロアリール基などである。Yは、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環などを表す。nは、0〜5の整数である。nが0の時、置換基として置換していないことを示す。Yの具体的な例として、フェニル基などがあるがこれに限定されない。
【0083】
上記化学式1、化学式2または化学式3で表示される化合物は、強直なカルバゾール構造(カルバゾール基)を有するので、ガラス転移点または融点が高い。したがって、有機発光素子の駆動の際に、有機層中、有機層の間または有機層と金属電極との間に発生するジュール熱に対する耐熱性および高温環境下での耐性に優れるので、本発明の実施形態の化合物を有機発光素子の有機層に使用した場合、優れた寿命特性および高い発光輝度を得ることができる。特に、分子内に強直なカルバゾール構造(カルバゾール基)を2個以上有する化学式1の化合物および化学式2の化合物は、優れた寿命特性および高い発光輝度を提供できると予想できる。また、上記化学式1、化学式2または化学式3で表示される化合物は、正孔移動能力の高いフェニルカルバゾール基を有するため、優れた正孔移動度を有することができる。
【0084】
また、上記化学式1、化学式2または化学式3で表示される化合物を含む有機層を備えた有機発光素子は、保存時および駆動時において、高い耐久性を有する。これは、特定理論に限定されるものではないが、上記化学式1、化学式2または化学式3で表示される化合物のTgが高いためであると分析される。つまり、従来の有機発光素子の有機層は、駆動時に発生する熱や、高温環境下によって、結晶化などを起こすことにより、その特性を低下する場合がある。これにより、有機発光素子自体の寿命および発光輝度が低下する。しかし、本発明の実施形態では、化学式1、化学式2、化学式3の構造を有する化合物を含む有機層を適用するため、有機層の耐熱特性等を向上できる。これにより、当該有機層を有機発光素子に適用すると、その高い耐熱性によって、有機発光素子自体の寿命および発光輝度等が有機発光素子駆動の際に発生する熱などで低下することがない。従って、本発明の実施形態では、有機発光素子の寿命および発光輝度を向上できる。
【0085】
このうち、上記化学式1で表示される化合物は、下記化学式1aの構造を有するが、これに限定されない。
【0086】
【化34】

・・・・・・(化学式1a)
【0087】
上記化学式1aのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R1、R2およびR3のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q1は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基などである。Q1において、炭素数1〜30のアルコキシ基の具体例としては、メトキシ基などがあるがこれに限定されない。また、炭素数6〜30のアリールオキシ基の具体例としては、フェニルオキシ基などがあるがこれに限定されない。これら具体例は、Q2、Q3、Q4でも適用される。
【0088】
上記化学式1で表示される化合物は、下記化学式1bの構造を有するが、これに限定されない。
【0089】
【化35】

・・・・・・(化学式1b)
【0090】
上記化学式1bのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R1、R2およびR3のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q2は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基などである。
【0091】
一方、上記化学式2で表示される化合物は、下記化学式2aの構造を有するが、これに限定されない。
【0092】
【化36】

・・・・・・(化学式2a)
【0093】
上記化学式2aのうち、R4およびR5は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R4およびR5は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q3は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基などである。Q3の置換の炭素数6〜30のアリール基の具体例としては、9,9−ジメチルフルオレニル基、9,9−ビフェニルフルオレニル基などがあるが、これに限定されない。これら具体例は、Q1、Q2、Q4でも適用される。
【0094】
上記化学式3で表示される化合物は、下記化学式3aの構造を有するが、これに限定されない。
【0095】
【化37】

・・・・・・(化学式3a)
【0096】
上記化学式3aのうち、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基などを表す。R6、R7およびR8のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成できる。当該飽和炭素環または当該不飽和炭素環の例としては、ナフタレン、アズレン(Azulene)、アントラセン、フロレン、フェナレン(Phenalene)などがある。Q4は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基などである。Q4の置換のアミノ基の具体例としては、N,N−ビフェニルアミノ基などがあるがこれに限定されない。これら具体例は、Q1、Q2、Q3でも適用される。
【0097】
以下、本発明の実施形態の各上記化学式で用いられる官能基のうち、代表的な官能基の定義を次に説明する。
【0098】
上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、非置換の炭素数1〜30のアルキル基の具体的な例としては、メチル、エチル、プロピル、イソブチル、sec−ブチル、ペンチル、iso−アミル、へキシルなどが挙げられる。そして、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、置換の炭素数1〜30のアルキル基とは、アルキル基のうち一つ以上の水素原子を、ハロゲン原子、炭素数1〜30のアルキル基、炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、炭素数6〜30のアリールオキシ基、低級アルキルアミノ基、ヒドロキシ基、ニトロ基、シアノ基、アミノ基、アミジノ基、ヒドラジン、ヒドラゾン、カルボキシル基、スルホン酸基、リン酸基などの置換基に置換したものである。つまり、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aの各説明において、「置換の〜」とは、官能基のうち一つ以上の水素原子を、ハロゲン原子、炭素数1〜30のアルキル基、炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、炭素数6〜30のアリールオキシ基、低級アルキルアミノ基、ヒドロキシ基、ニトロ基、シアノ基、アミノ基、アミジノ基、ヒドラジン、ヒドラゾン、カルボキシル基、スルホン酸基、リン酸基などの置換基に置換することを意味する。
【0099】
上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、非置換の炭素数1〜30のアルコキシ基の具体的な例としては、メトキシ、エトキシ、プロポキシ、イソブチルオキシ、sec−ブチルオキシ、ペンチルオキシ、iso−アミルオキシ、へキシルオキシなどが挙げられる。そして、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、置換の炭素数1〜30のアルコシキ基とは、アルコキシ基のうち一つ以上の水素原子を、上述の炭素数1〜30のアルキル基の置換基と同じ置換基に置換できることを意味する。
【0100】
上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、非置換の炭素数6〜30のアリール基は、一つ以上の環を含む炭素環芳香族システムを意味する。環は、ペンダント方法で共に付着されるか、または融合される。つまり、言い換えると、炭素数6〜30のアリール基とは、一つ以上の芳香環を含み、各芳香環をペンダント状に結合するか、または各芳香環を縮合により結合するものである。また、炭素数6〜30のアリール基には、複素環も含まれて構成されてよい。アリールという用語は、フェニル、ナフチル、テトラヒドロナフチルなどのような芳香族システムを含む。また、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、置換の炭素数6〜30のアリール基とは、アリール基のうち一つ以上の水素原子を、上述の炭素数1〜30のアルキル基の置換基と同じ置換基に置換できることを意味する。
【0101】
上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、非置換の炭素数2〜30のヘテロアリール基は、N、O、PまたはSなどのうちから選択される1個、2個または3個のヘテロ原子を含み、残りの環原子がCである環原子数3〜30の一価単環の環化合物または環を、ペンダント方法で共に付着するか、または融合したものである。つまり、言い換えると、炭素数2〜30のヘテロアリール基とは、ヘテロ原子を含む環化合物または環を、ペンダント状に結合するか、または縮合により結合したものである。ヘテロ原子を含む環化合物または環は、N、O、PまたはSなどから選択される少なくとも一つ以上のヘテロ原子を含み、残りの環原子がCである環原子数3〜30の化合物となる。ヘテロアリール基の例としては、ピリジル、チエニル、フリルなどがある。また、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、置換の炭素数2〜30のヘテロアリール基とは、ヘテロアリール基のうち一つ以上の水素原子を、上述の炭素数1〜30のアルキル基の置換基と同じ置換基に置換できることを意味する。
【0102】
一方、上記化学式1〜3、化学式1a、化学式1b、化学式2a、化学式3aにおいて、Ar1、Ar2およびAr3は、相互独立的に、フェニル基、炭素数1〜10のアルキルフェニル基、炭素数1〜10のアルコキシフェニル基、ハロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、o−トリル基、m−トリル基、またはp−トリル基、o−クメニル基、m−クメニル基またはp−クメニル基、メシチル基、フェノキシフェニル基、(α,α−ジメチルベンゼン)フェニル基、(N,N’−ジメチル)アミノフェニル基、(N,N’−ジフェニル)アミノフェニル基、(炭素数1〜10のアルキルシクロへキシル)フェニル基、(アントラセニル)フェニル基、ビフェニル基、炭素数1〜10のアルキルビフェニル基、炭素数1〜10のアルコキシビフェニル基、ペンタレニル基、インデニル基、ナフチル基、炭素数1〜10のアルキルナフチル基、炭素数1〜10のアルコキシナフチル基、ハロナフチル基、シアノナフチル基、ビフェニレニル基、炭素数1〜10のアルキルビフェニレニル基、炭素数1〜10のアルコキシビフェニレニル基、アントラセニル基、アズレニル基、へプタレニル基、アセナフチレニル基、フェナレニル基、フルオレニル基、炭素数1〜10のアルキルフルオレニル基、炭素数6〜30のアリールフルオレニル基、アントラキノリル基、メチルアントリル基、フェナントレニル基、トリフェニレニル基、ピレニル基、クリセニル基、エチルクリセニル基、ピセニル基、ぺリレニル基、クロロぺリレニル基、ペンタフェニル基、ペンタセニル基、テトラフェニレニル基、ヘキサフェニル基、ヘキサセニル基、ルビセニル基、コロネニル基、トリナフチレニル基、へプタフェニル基、へプタセニル基、ピラントレニル基、オバレニル基、カルバゾリル基、炭素数1〜10のアルキルカルバゾリル基、炭素数6〜30のアリールカルバゾリル基、チオフェニル基、インドリル基、プリニル基、ベンズイミダゾリル基、キノリニル基、ベンゾチオフェニル基、パラチアジニル基、ピロリル基、ピラゾリル基、イミダゾリル基、イミダゾリニル基、オキサゾリル基、チアゾリル基、トリアゾリル基、テトラゾリル基、オキサジアゾリル基、ピリジニル基、ピリダジニル基、ピリミジニル、ピラジニル基およびチアントレニル基などからなる群から選択されるが、これに限定されるものではない。ここで、「炭素数〜の〜」とあるが、これは置換基に置換している基の炭素数を示す。例えば、炭素数1〜10のアルキルフェニル基の場合、フェニル基に置換しているアルキル基の炭素数が1〜10であることを意味する。
【0103】
さらに具体的に、上記化学式1、化学式2または化学式3で表示される化合物は、下記化合物1〜化合物62のうちいずれか一つであるが、これに限定されるものではない。
【0104】
【化38】

【0105】
【化39】

【0106】
【化40】

【0107】
【化41】

【0108】
【化42】

【0109】
【化43】

【0110】
【化44】

【0111】
【化45】


【0112】
【化46】

【0113】
【化47】

【0114】
【化48】

【0115】
【化49】

【0116】
【化50】

【0117】
【化51】

【0118】
【化52】

【0119】
【化53】

【0120】
【化54】

【0121】
【化55】

【0122】
【化56】

【0123】
【化57】

【0124】
【化58】

【0125】
【化59】

【0126】
上記化学式1で表示される化合物、上記化学式2で表示される化合物および上記化学式3で表示される化合物は、上記化合物8、上記化合物9、上記化合物10、上記化合物11、上記化合物14、上記化合物28、上記化合物35および上記化合物56のうち、何れか一つであってよい。
【0127】
上記化学式1で表示される化合物は、例えば、下記反応式1のようにフェニルカルバゾール(B’)とジアミン化合物(C’)とを反応させて得られる。
【0128】
【化60】

【0129】
上記反応式1のうち、X、R1、R2、R3、Ar1およびAr2についての詳細な説明は、上述したところを参照する。上記反応は、Pd2(dba)3(dba=ジベンジリデンアセトン)、tert−ブトキシドナトリウム(t−BuNaO)およびトリ(tert−ブチル)ホスフィン(P(tBu)3)存在下で実施され、反応温度は、約50℃〜約150℃であることが望ましい。
【0130】
本発明の実施形態に係る有機発光素子の有機層において、上記化学式1で表示される化合物、化学式2で表示される化合物および化学式3で表示される化合物のうち、少なくとも一つ以上を含む層は、正孔注入層または正孔輸送層であってよい。または、正孔注入特性および正孔輸送特性をともに有する単一層であってよい。
【0131】
例えば、本発明の実施形態に係る有機発光素子の有機層において、上記化学式1で表示される化合物、化学式2で表示される化合物および化学式3で表示される化合物のうち、少なくとも一つ以上を含む層は、正孔注入層であってよい。
【0132】
このとき、有機層の発光カラーが赤色である場合、正孔注入層の厚さは、約160nm〜約220nm、望ましくは、約190nm〜約220nmであってよい。正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、赤色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0133】
一方、有機層の発光カラーが緑色である場合、正孔注入層の厚さは、約140nm〜約180nm、望ましくは、約160nm〜約180nmであってよい。正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、緑色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0134】
最後に、有機層の発光カラーが青色である場合、正孔注入層の厚さは、約100nm〜約140nm、望ましくは、約110nm〜約130nmであってよい。正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、青色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0135】
上述したような有機層は、正孔注入層とともに正孔輸送層をさらに備えることができる。このとき、有機層の発光カラーが赤色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、約200nm〜約240nm、望ましくは、約210nm〜約230nmであってよい。この時、正孔注入層の厚さは、約160nm〜約220nm、望ましくは、約190nm〜約220nmであってよい。正孔注入層の厚さおよび正孔輸送層の厚さの総和および/または正孔注入層の厚さ範囲が上述の範囲を満足する場合、有機発光素子は、赤色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0136】
一方、有機層の発光カラーが緑色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、約160nm〜約200nm、望ましくは、約170nm〜約190nmであってよい。正孔注入層の厚さは、約140nm〜約180nm、望ましくは、約160nm〜約180nmであってよい。正孔注入層の厚さおよび正孔輸送層の厚さの総和および/または正孔注入層の厚さ範囲が上述の範囲を満足する場合、有機発光素子は、緑色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0137】
最後に、有機層の発光カラーが青色である場合、正孔注入層の厚さおよび正孔輸送層の厚さの総和は、約120nm〜約160nm、望ましくは、約130nm〜約150nmであってよい。正孔注入層の厚さは、約100nm〜約140nm、望ましくは、約110nm〜約130nmであってよい。正孔注入層の厚さおよび正孔輸送層の厚さの総和および/または正孔注入層の厚さ範囲が上述の範囲を満足する場合、有機発光素子は、青色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。ここで、上記範囲の正孔注入層および正孔輸送層の厚さの総和および/または正孔注入層の厚さは、有機層の各発光カラー別に補強干渉が起こるように共振距離を確保できる厚さとなる。このような共振距離を確保した有機層において、正孔注入特性および/または正孔輸送特性を最適化することができる。
【0138】
一方、本発明の実施形態は、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが赤色である場合、正孔注入層の厚さは、約160nm〜約220nm、望ましくは、約190nm〜約220nmである有機発光素子を提供する。
【0139】
正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、赤色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0140】
また、本発明の実施形態は、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが緑色である場合、正孔注入層の厚さは、約140nm〜約180nm、望ましくは、約160nm〜約180nmである有機発光素子を提供する。
【0141】
正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、緑色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0142】
それと共に、本発明の実施形態は、基板と、第1電極と、第2電極と、第1電極と第2電極との間に配置され、少なくとも発光層および正孔注入層を備える有機層とを備え、第1電極および第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、有機層の発光カラーが青色である場合、正孔注入層の厚さは、約100nm〜約140nm、望ましくは、約110nm〜約130nmである有機発光素子を提供する。
【0143】
正孔注入層の厚さが上述の範囲を満足する場合、有機発光素子は、青色発光層から放出される光の共振効果に適した正孔注入特性および正孔伝達特性を有することができるので、色純度、発光効率および駆動電圧を改善できる。
【0144】
上述の有機発光素子には、有機発光素子の駆動の際、第1電極と第2電極との間に共振現象が発生する。このとき、第1電極と第2電極との間に配置される有機層において、正孔注入層は、有機層の発光カラー別に上述の厚さを有するため、低駆動電圧、優れた電流密度、発光輝度、色純度、発光効率および寿命特性を有することができる。
【0145】
上述したような有機発光素子の一具現形態では、第1電極は、基板側に配置される。このとき、第1電極は、反射型電極であってよく、第2電極は、半透明電極または透明電極であってよい。したがって、有機発光素子の駆動の際、第1電極と第2電極との間に共振現象が起こる。これで、有機発光素子の駆動の際、第1電極と第2電極との間に配置される有機層で発生した光は、第1電極と第2電極との間を共振しながら、第2電極を介して(すなわち、基板の外側に)外部に放出される。
【0146】
本発明の実施形態に係る有機発光素子の有機層は、発光層および正孔注入層を備える。発光層および正孔注入層以外に、有機層は、正孔輸送層、電子抑制層、正孔抑制層、電子輸送層および電子注入層のうち、少なくとも一つ以上の層をさらに備えることができる。したがって、本発明の実施形態に係る有機発光素子は、例えば、図1に示したような基板/第1電極/正孔注入層(HIL、Hole Injection Layer)/正孔輸送層(HTL、Hole Transport Layer)/発光層(EML、Emission Layer)/正孔抑制層(HBL、Hole Blocking Layer)/電子輸送層(ETL、Electron Transport Layer)/電子注入層(EIL、Electron Injection Layer)/第2電極の構造を備えることができる。
【0147】
以下、図1および図2を参照して、本発明の実施形態に係る有機発光素子の実施例およびその製造方法を次に説明する。図1は、本発明の実施形態に係る有機発光素子の断面を概略的に示す図である。図2は、本発明の実施形態に係る有機発光素子の各々発光カラーをともに示す図である。
【0148】
まず、基板200の上部に第1電極210を形成する。ここで、基板200としては、通常の有機発光素子で使われる基板を使用する。基板200として、透明性、表面平滑性、取扱容易性および防水性などを考慮して、ガラス基板またはプラスチック基板などを多様に使用できる。
【0149】
第1電極210は、伝導性に優れた金属、例えば、Li、Mg、Al、Al−Li、Ca、Mg−In、Mg−Ag、Ca−Alなどの金属、またはITO(Indium Tin Oxide、インジウムスズ酸化物)、IZO(Indium Zinc Oxide、インジウム亜鉛酸化物)、In2O3(酸化インジウム)などのような金属酸化物を利用して、反射型電極、半透明電極または透明電極に形成される。金属および金属酸化物のうち、2以上の組み合わせを使用することも可能である。
【0150】
この後、有機層の形成領域を定義する画素定義膜214を所定の位置に形成する。画素定義膜214は、シリコンなどの酸化物および窒化物などのような無機物、または絶縁性有機物などを用いて、蒸着法またはコーティング法などの多様な方法によって形成される。
【0151】
この後、第1電極210の上部の画素定義膜214によって定義される領域に沿って、正孔注入層216および正孔輸送層218を真空熱蒸着、またはスピンコーティングして順次に形成する。
【0152】
このとき、正孔注入層216は、上述の化学式1で表示される化合物、化学式2で表示される化合物および化学式3で表示される化合物のうち、少なくとも一つ以上を含むことができる。一方、正孔輸送層218は、例えば、1,3,5−トリカルバゾリルベンゼン、4,4’−ビスカルバゾリルビフェニル、ポリビニルカルバゾール、m−ビスカルバゾリルフェニル、4,4’−ビスカルバゾリル−2,2’−ジメチルビフェニル、4,4’,4’’−トリ(N−カルバゾリル)トリフェニルアミン、1,3,5−トリ(2−カルバゾリルフェニル)ベンゼン、1,3,5−トリス(2−カルバゾリル−5−メトキシフェニル)ベンゼン、ビス(4−カルバゾリルフェニル)シラン、N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1−ビフェニル]−4,4’−ジアミン(TPD)、N,N’−ジ(ナフタレン−1−イル)−N,N’−ジフェニルベンジジン(α−NPD)、N,N’−ジフェニル−N,N’−ビス(1−ナフチル)−(1,1’−ビフェニル)−4,4’−ジアミン(NPB)、IDE320(出光社製)、ポリ(9,9−ジオクチルフルオレン−co−N−(4−ブチルフェニル)ジフェニルアミン)(TFB)またはポリ(9,9−ジオクチルフルオレン−co−ビス−(4−ブチルフェニル)−ビス−N,N−フェニル−1,4−フェニレンジアミン)(PFB)などを含むが、これに限定されない。
【0153】
正孔注入層216および正孔輸送層218の厚さは、上述した範囲内で適用される。正孔注入層216は、真空蒸着法、スピンコーティング法、キャスト法、LB(Langmuir Blodgett)法などのような公知の多様な方法を利用して形成される。
【0154】
真空蒸着法によって正孔注入層216を形成する場合、その蒸着条件は、正孔注入層216の材料として使用する化合物、正孔注入層216の構造および熱的特性によって異なるが、一般的に、蒸着温度は約100℃〜約500℃、真空度は約10−8〜約10−3torr、蒸着速度は約0.01〜約10nm/secの範囲で適切に選択されることが望ましい。
【0155】
スピンコーティング法によって正孔注入層216を形成する場合、そのコーティング条件は、正孔注入層216の材料として使用する化合物、正孔注入層216の構造および熱的特性によって異なるが、コーティング速度は、約2000rpm〜約5000rpm、コーティング後の溶媒除去のための熱処理温度は、約80℃〜約200℃の範囲で適切に選択されることが望ましい。
【0156】
正孔輸送層218も、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成できる。真空蒸着法およびスピンコーティング法などによって正孔輸送層218を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0157】
正孔注入層216および正孔輸送層218の上部には、各カラー別発光層220(赤色発光層)、カラー別発光層225(緑色発光層)、カラー別発光層230(青色発光層)を形成する。本発明の実施形態の発光層材料は、特別に制限されない。
【0158】
赤色発光層220には、例えば、DCM1、DCM2、Eu(テノイルトリフルオロアセトン)3(Eu(TTA)3)、ブチル−6−(1,1,7,7−テトラメチルジュロリジル−9−エニル)−4H−ピラン)(DCJTB)などが使われる。一方、赤色発光層220は、Alq3((8−ヒドロキシキノリン)アルミニウム)にDCJTBのようなドーパントをドーピングすることによって形成される、またはAlq3およびルブレンを共蒸着し、ドーパントをドーピングすることによって形成されてもよいし、4,4’−N,N’−ジカルバゾール−ビフェニル(CBP)にBTPIrまたはRD61のようなドーパントをドーピングすることもあるなど、多様な変形例が可能である。
【0159】
緑色発光層225には、例えば、クマリン6、C545T、キナクリドン、Ir(ppy)3などが使われる。一方、緑色発光層225は、CBPにIr(ppy)3をドーパントとして使用して形成される、またはホストとしてのAlq3にドーパントとしてクマリン系物質を使用して形成されるなど、多様な変形例が可能である。クマリン系ドーパントの具体的な例として、C314S、C343S、C7、C7S、C6、C6S、C314T、C545Tなどがある。
【0160】
青色発光層230には、例えば、オキサジアゾールダイマー染料(Bis−DAPOXP)、スピロ化合物(Spiro−DPVBi、Spiro−6P)、トリアリールアミン化合物、ビス(スチリル)アミン(DPVBi、DSA)、Flrpic、CzTT、アントラセン、TPB、PPCP、DST、TPA、OXD−4、BBOT、AZM−Zn、ナフタレンモエティを含有する芳香族炭化水素化合物であるBH−013X(出光社)などが多様に使われる。一方、青色発光層230は、IDE140(商品名、出光社製)にドーパントとしてIDE105(商品名、出光社製)を使用できるなど、多様な変形例が可能である。
【0161】
発光層の厚さは、約20nm〜約50nm、望ましくは、約30nm〜約40nmであることが望ましい。一方、R(赤)領域、G(緑)領域、B(青)領域の各々発光層の厚さは、相互同一または相異であってよい。もし、発光層の厚さが上述したような範囲を満足する場合、寿命特性および駆動電圧を改善できる。
【0162】
発光層は、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成できる。真空蒸着法およびスピンコーティング法によって発光層を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0163】
発光層上に正孔抑制用物質を真空蒸着、またはスピンコーティングして正孔抑制層(図1)を選択的に形成できる。この時に使用する正孔抑制層用物質は、特別に制限されないが、電子輸送能力を有して、発光化合物より高いイオン化ポテンシャルを有する必要がある。正孔抑制層用物質に用いられる物質の代表として、bis(2−メチル−8−キノラート)−(p−フェニルフェノラート)−アルミニウム(Balq)、バトクプロイン(BCP)、トリス(N−アリールベンジミダゾール)(TPBI)などが使われる。
【0164】
正孔抑制層の厚さは、約3nm〜約6nm、望ましくは、約4nm〜約5nmである。正孔抑制層の厚さが上述の範囲を満足する場合、優れた正孔抑制特性および駆動電圧特性を有することができる。
【0165】
正孔抑制層は、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成でき、真空蒸着法およびスピンコーティング法によって正孔抑制層を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0166】
発光層または正孔抑制層の上部に、電子輸送物質を用いて真空蒸着またはスピンコーティングなどを実施することにより、電子輸送層240を選択的に形成する。電子輸送物質は、特別に制限されず、Alq3などを用いることができる。
【0167】
電子輸送層240の厚さは、約10nm〜約40nm、望ましくは、約25nm〜約35nmであってよい。電子輸送層240の厚さが約10nm以上である場合には、適切な電荷均衡特性を得ることができ、約40nm未満である場合には、適切な駆動電圧を得ることができる。
【0168】
電子輸送層240は、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成でき、真空蒸着法およびスピンコーティング法によって電子輸送層240を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0169】
発光層、正孔抑制層または電子輸送層240の上部に電子注入層250を真空蒸着法またはスピンコーティング法などを利用して形成する。電子注入層250の形成材料としては、BaF2、LiF、NaCl、CsF、Li2O、BaO、Liqなどの物質を利用できるが、これに限定されるものではない。
【0170】
電子注入層250の厚さは、約0.2nm〜約1nm、望ましくは、約0.2nm〜約0.5nmであってよい。このうち、約0.2nm〜約0.4nmが特に適した厚さである。電子注入層250の厚さが上述の範囲を満足する場合、優れた電子注入特性および駆動電圧特性をえることができる。
【0171】
電子注入層250は、真空蒸着法、スピンコーティング法、キャスト法、LB法などのような公知の多様な方法を利用して形成でき、真空蒸着法およびスピンコーティング法によって電子注入層250を形成する場合、その蒸着条件およびコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層216の形成とほぼ同じ条件範囲内で選択される。
【0172】
次いで、電子注入層250の上部に第2電極用物質を蒸着して第2電極260を形成することによって、有機発光素子が完成される。
【0173】
第2電極用物質としては、導電性に優れた透明な金属酸化物であるITO(Indium Tin Oxide、インジウムスズ酸化物)、IZO(Indium Zinc Oxide、インジウム亜鉛酸化物)、SnO2(酸化スズ)、ZnO(酸化亜鉛)などが使われる。または、Li、Mg、Al、Al−Li、Ca、Mg−In、Mg−Ag、Ca−Alなどを薄膜に形成することによって、反射型電極、半透明電極、または透明電極として第2電極260を多様に形成できる。第2電極260を形成する物質は、例示された金属および金属酸化物の組み合わせに限定されるものではない。
【0174】
第1電極210および第2電極260は、それぞれアノード電極およびカソード電極としての役割を実施でき、その逆も可能である。
【0175】
本発明の実施形態に係る有機発光素子は、多様な形態の平板表示装置、例えば、受動マトリックス有機発光表示装置および能動マトリックス有機発光表示装置に備えられる。特に、能動マトリックス有機発光表示装置に備えられる場合、基板側に備えられた第1電極は、画素電極であって、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結される。また、有機発光素子は、両面に画面を表示できる平板表示装置に備えられる。
つまり、本発明の実施形態に係る平板表示装置は、上述の本発明の実施形態に係る少なくとも一つ以上の有機発光素子を備える。当該有機発光素子の第1電極は、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結される。そして本発明の実施形態に係る平板表示装置は、基板と有機発光素子との間に、薄膜トランジスタ、バッファ層、ゲート絶縁層、層間絶縁層、平坦化層なども具備する。薄膜トランジスタは、半導体層と、ゲート電極と、ソース電極およびゲート電極とを具備する。ゲート電極は、半導体層に絶縁された状態で半導体層上部に位置する。ソース電極およびゲート電極は、ゲート電極と絶縁された状態でゲート電極上部に位置し、半導体層に電気的に連結される。本発明の実施形態の薄膜トランジスタの配置構成は、上記に限定されない。
【0176】
以下、化合物8、化合物9、化合物10、化合物11、化合物14、化合物28、化合物35および化合物56の望ましい合成例およびこれら化合物を含む層を備える有機発光素子の実施例を具体的に例示するが、本発明は、下記の実施例に限定されない。
【0177】
(合成例1、化合物8の製造)
下記化学反応式2の反応経路を経て化合物8を合成した。
【0178】
【化61】

・・・・・・(反応式2)
【0179】
(中間体Aの合成)
カルバゾール(16.7g、100mmol)、ヨードベンゼン(26.5g、130mmol)、CuI(1.9g、10mmol)、K2CO3(138g、1mol)および18−クラウン−6(530mg、2mmol)を、DMPU(1,3−ジメチル−3,4,5,6−テトラヒドロ−(1H)−ピリミジノン)(500mL)に溶かした後に、170℃で8時間加熱した。
【0180】
反応が完結された後、反応混合物を常温に冷やした後、固体物質を濾過し、濾過液にアンモニア水を少量添加した後にジエチルエーテル(300mL)で三回洗浄した。洗浄されたジエチルエーテル層をMgSO4で乾燥させた後、減圧乾燥して粗生成物を得て、シリカゲルカラムクロマトグラフィで分離精製して中間体Aを白色の固体で22g(収率90%)得た。
【0181】
中間体Aの構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(CDCl3、400MHz)δ(ppm)8.12(d、2H)、7.58〜7.53(m、4H)、7.46〜7.42(m、1H)、7.38(d、4H)、7.30〜7.26(m、2H)。
13C NMR(CDCl3、100MHz)δ(ppm)141.0、137.9、130.0、127.5、127.3、126.0、123.5、120.4、120.0、109.9。
【0182】
(中間体Bの合成)
中間体A2.433g(10mmol)を80%の酢酸100mLに入れた後、ヨード(I2)1.357g(5.35mmol)およびオルト−過ヨウ素酸(H5IO6)0.333g(1.46mmol)を固体状態で加えた後、窒素雰囲気で80℃、2時間攪拌した。
【0183】
反応終了後、エチルエーテル(50mL)で三回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体Bを白色の固体で3.23g(収率87%)得た。
【0184】
中間体Bの構造は、1H NMRで決定し、その結果を次に示す。1H NMR(CDCl3、300MHz)δ(ppm)8.43(d、1H)、8.05(d、1H)、7.62(dd、1H)、7.61〜7.75(m、2H)、7.51〜7.43(m、3H)、7.41〜7.35(m、2H)、7.27(dd、1H)、7.14(d、1H)。
【0185】
(中間体Cの合成)
4,4’−ジブロモジフェニル3.12g(10mmol)、アニリン2.3mL(25mmol)、t−BuONa2.9g(30mmol)、Pd2(dba)3183mg(0.2mmol)、P(t−Bu)320mg(0.1mmol)をトルエン30mLに溶かした後、90℃で3時間攪拌した。
【0186】
反応混合物を常温に冷やした後、蒸溜水およびジエチルエーテル30mLで3回抽出した。有機層に存在する沈殿物をフィルタでろ過した後、アセトンおよびジエチルエーテルで洗浄し、真空乾燥して中間体Cを0.3g(収率90%)得た。
【0187】
中間体Cの構造は、1H NMRおよび13C NMRで確認し、その結果を次に示す。1H NMR(DMSO−d6、400MHz)δ(ppm)8.22(s、2H)、7.48(d、4H)、7.23(t、4H)、7.10(dd、8H)、6.82(t、2H)。
13C NMR(DMSO−d6、100MHz)δ(ppm)145.7、144.3、133.7、131.4、128.7、121.2、119.2、118.9。
【0188】
(化合物8の合成)
中間体B912mg(2.47mmol)、中間体C336.4mg(1mmol)、t−BuONa300mg(3mmol)、Pd2(dba)340mg(0.02mmol)、P(t−Bu)33mg(0.01mmol)をトルエン5mLに溶かした後、90℃で3時間攪拌した。
【0189】
反応が完結された後、常温に冷やし、これを蒸溜水およびジエチルエーテル30mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥して溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製し、化合物8を黄色固体で570mg(収率70%)得た。
【0190】
化合物8の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(CDCl3、300MHz)δ(ppm)7.99(d、2H)、7.95(s、2H)、7.61〜7.57(m、8H)、7.48〜7.32(m、12H)、7.27〜7.19(m、8H)、7.18〜7.10(m、8H)、6.96(t、2H)。
13C NMR(CDCl3、100MHz)δ(ppm)148.4、147.3、141.3、140.4、138.0、137.6、133.9、129.9、129.1、127.4、127.1、127.0、126.1、125.6、124.3、123.0、122.9、122.8、121.7、120.5、119.9、118.5、110.7、109.9。
【0191】
上記過程によって得た化合物8をCHCl3で0.2mM(mmol/L)の濃度に希釈させて、UVスペクトルを測定した。化合物8の最大吸収波長は、353nm、306nm、238nmであった。
【0192】
また、化合物8に対して、TGA(Thermo Gravimetric Analysis)およびDSC(Differential Scanning Calorimetry)を利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内のPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃まで昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物8のTd=494℃、Tg=153℃を得た。
【0193】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物8のHOMO(Highest Occupied Molecular Orbital)エネルギー準位5.16eVおよびLUMO(Lowest Occupied Molecular Orbital)エネルギー準位2.16eVを得た。
【0194】
(合成例2、化合物9の製造)
下記化学反応式3の反応経路を経て化合物9を合成した。
【0195】
【化62】

・・・・・・(反応式3)
【0196】
合成例1の中間体Cの反応において、アニリンの代わりにパラトリルアミンを使用したという点を除いて、合成例1の中間体Cの合成と同じ方法で中間体Dを85%の収率で合成した。その後、合成例1の化合物8の合成反応において、中間体Cの代わりに、中間体Dを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で化合物9を黄色固体として2g(収率80%)得た。
【0197】
化合物9の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(C6D6、300MHz)δ(ppm)8.14(d、2H)、7.64(d、2H)、7.47(d、4H)、7.38〜7.28(m、6H)、7.27〜7.25(m、8H)、7.23〜7.01(m、16H)、6.96(d、2H)、2.19(s、6H)。
13C NMR(C6D6、100MHz)δ(ppm)149.0、147.5、142.6、142.2、139.1、138.9、135.1、132.6、130.1、130.7、128.1、127.9、127.2、126.5、125.9、125.0、124.5、123.6、121.8、121.1、119.2、111.8、110.8、21.5。
【0198】
上記過程によって得た化合物9をCHCl3で0.2mM(mmol/L)の濃度に希釈させて、UVスペクトルを測定した。化合物9の最大吸収波長は、358nm、309nm、253nmであった。
【0199】
また、化合物9に対してTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Pan使用である。DSCの分析条件は、N2雰囲気、常温から400℃まで昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物9のTd=480℃、Tg=155℃を得た。
【0200】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物9のHOMOエネルギー準位5.0eVおよびLUMOエネルギー準位2.02eVを得た。
【0201】
(合成例3、化合物10の製造)
下記化学反応式4の反応経路を経て化合物10を合成した。
【0202】
【化63】

・・・・・・(反応式4)
【0203】
(中間体Eの合成)
中間体B3.69g(10mmol)、4−アミノベンゾニトリル1.42g(12mmol)、t−BuONa1.44g(15mmol)、Pd2(dba)3183mg(0.2mmol)、P(t−Bu)340mg(0.2mmol)をトルエン50mLに溶かした後、90℃で3時間攪拌した。
【0204】
上記反応が完結した後、これを常温に冷やし、蒸溜水およびジエチルエーテル50mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体E1.8g(収率50%)を得た。
【0205】
(化合物10の合成)
合成例1の化合物8の反応において、中間体Bおよび中間体Cの代わりに、中間体Eおよび4,4’−ジブロモジフェニルを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で、化合物10を黄色固体として2.2g(収率86%)得た。
【0206】
化合物10の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(CDCl3、300MHz)δ(ppm)8.02(d、2H)、7.97(d、2H)、7.64〜7.48(m、14H)、7.43〜7.39(m、10H)、7.29〜7.22(m、8H)、7.03(d、4H)。
13C NMR(CDCl3、100MHz)δ(ppm)152.1、145.6、141.5、138.9、138.2、137.3、136.3、133.2、130.0、127.9、127.8、127.0、126.6、125.8、125.5、124.6、122.7、120.5、120.2、119.9、119.4、118.9、111.2、110.1、101.8。
【0207】
上記過程によって得た化合物10をCHCl3で0.2mM(mmol/L)の濃度に希釈して、UVスペクトルを測定した。化合物10の最大吸収波長は、304nm、238nmであった。
【0208】
また、化合物10に対してTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃までの昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物10のTd=492℃、Tg=178℃、Tm=263℃を得た。
【0209】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物10のHOMOエネルギー準位5.4eVおよびLUMOエネルギー準位2.47eVを得た。
【0210】
(合成例4、化合物11の製造)
下記化学反応式5の反応経路を経て化合物11を合成した。
【0211】
【化64】

・・・・・・(反応式5)
【0212】
合成例1の中間体Cの反応において、アニリンの代わりに、4−フルオロフェニルアミンを使用したという点を除いて、合成例1の中間体Cの合成と同じ方法で、中間体Fを95%の収率で合成した。その後、合成例1の化合物8の反応において、中間体Cの代わりに、中間体Fを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で化合物11を黄色固体として1.8g(収率84%)得た。
【0213】
化合物11の構造は、1H NMRで決定し、その結果を次に示す。1H NMR(C6D6、300MHz)δ(ppm)8.05(s、2H)、7.68(d、2H)、7.48(d、4H)、7.29〜7.11(m、22H)、7.09〜7.01(m、6H)、6.78(t、4H)。
【0214】
上記過程によって得た化合物11をCHCl3で0.2mM(mmol/L)の濃度に希釈して、UVスペクトルを測定した。化合物11の最大吸収波長は、351nm、297nm、248nmであった。
【0215】
また、化合物11に対するTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃までの昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物11のTd=464℃、Tg=151℃、Tm=299℃を得た。
【0216】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物11のHOMOエネルギー準位5.1eVおよびLUMOエネルギー準位2.28eVを得た。
【0217】
(合成例5、化合物14の製造)
下記化学反応式6の反応経路を経て化合物14を合成した。
【0218】
【化65】

・・・・・・(反応式6)
【0219】
合成例1の中間体Cの反応において、アニリンの代わりに、4−アミノビフェニルを利用したという点を除いて、合成例1の中間体Cの合成と同じ方法で、中間体Gを90%の収率で合成した。その後、合成例1の化合物8の反応において、中間体Cの代わりに中間体Gを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で、化合物14を黄色固体として3.1g(収率82%)得た。
【0220】
化合物14の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(CD2Cl2、300MHz)δ(ppm)8.02〜8.01(m、4H)、7.65〜7.56(m、12H)、7.51〜7.46(m、10H)、7.43〜7.36(m、10H)、7.32〜7.17(m、14H)。
13C NMR(CD2Cl2、100MHz)δ(ppm)148.2、147.6、141.8、141.0、140.6、138.6、137.9、134.5、134.4、130.3、129.1、127.9、127.8、127.4、127.3、127.0、126.8、126.6、126.1、124.7、123.5、123.4、123.0、120.8、120.3、119.0、111.1、110.3。
【0221】
上記過程によって得た化合物14をCHCl3で0.2mM(mmol/L)の濃度に希釈して、UVスペクトルを測定した。化合物14の最大吸収波長は、329nmであった。
【0222】
また、化合物14に対するTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃までの昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物14のTd=533℃、Tg=174℃を得た。
【0223】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物14のHOMOエネルギー準位5.2eVおよびLUMOエネルギー準位2.27eVを得た。
【0224】
(合成例6、化合物28の製造)
下記化学反応式7の反応経路を経て化合物28を合成した。
【0225】
【化66】

・・・・・(反応式7)
【0226】
合成例1の中間体Aの合成反応において、カルバゾールの代わりに、3,6−ジブロモカルバゾールを使用したという点を除いて、合成例1の中間体Aの合成と同じ方法で、中間体Hを80%の収率で合成した。その後、合成例1の中間体Cの合成反応において、4,4’−ジブロモジフェニルの代わりに、中間体Hを使用したという点を除いて、合成例1の中間体Cの合成と同じ方法で中間体Iを85%の収率で合成した。その後、合成例1の化合物8の反応において、中間体Bおよび中間体Cの代わりに、中間体Hおよび中間体Iを使用したという点を除いて、合成例1の化合物8の合成と同じ方法で化合物28を黄色固体として2.3g(収率81%)得た。
【0227】
化合物28の構造は、1H NMRおよび13C NMRで決定し、その結果を次に示す。1H NMR(C6D6、300MHz)δ(ppm)8.13(s、2H)、8.04(s、2H)、7.65(d、2H)、7.39〜7.31(m、4H)、7.27〜7.22(m、12H)、7.19〜6.99(m、21H)、6.82(t、2H)。
13C NMR(C6D6、100MHz)δ(ppm)150.4、142.1、141.9、141.8、138.8、138.2、138.0、130.0、129.9、129.4、128.3、128.0、127.8、127.7、127.3、127.2、127.1、126.4、126.3、125.2、125.1、125.0、123.8、121.0、120.7、120.4、120.2、119.0、117.7、111.2、110.9、109.9。
【0228】
上記過程によって得た化合物28をCHCl3で0.2mM(mmol/L)の濃度に希釈して、UVスペクトルを測定した。化合物28の最大吸収波長は、315nm、248nmであった。
【0229】
また、化合物28に対するTGAおよびDSCを利用した熱分析を実施した。TGAの分析条件は、N2雰囲気、常温〜600℃(温度上昇速度、10℃/min)、1回用Al Pan内でのPt Panの使用である。DSCの分析条件は、N2雰囲気、常温から400℃までの昇温、1回用Al Panの使用である。TGAおよびDSCを通じて、化合物28のTd=460℃、Tg=175℃を得た。
【0230】
UV吸収スペクトルおよびイオン化ポテンシャル測定機であるAC−2を通じて、化合物28のHOMOエネルギー準位5.0eVおよびLUMOエネルギー準位2.09eVを得た。
【0231】
(合成例7、化合物35の合成)
下記化学反応式8の反応経路を経て化合物35を合成した。
【0232】
【化67】

・・・・・・(反応式8)
【0233】
(中間体Jの合成)
中間体B0.316g(0.856mmol)と4−アミノベンゾニトリル0.142g(1.2mmol)とをトルエン5mLに溶かした後、t−BuONa0.144g(1.5mmol)、Pd2(dba)30.018g(0.02mmol)、(t−Bu)3P0.004〜0.006g(0.02〜0.03mmol)を加えて80℃で5時間攪拌した。反応液をエチルエーテル20mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体J0.218g(収率71%)を得た。
【0234】
(化合物35の合成)
中間体J0.221g(0.614mmol)と中間体B0.332g(0.9mmol)とをトルエン10mLに溶かした後、t−BuONa0.144g(1.5mmol)、Pd2(dba)30.018g(0.02mmol)、(t−Bu)3P0.004〜0.006g(0.02〜0.03mmol)を加えて90℃で6時間攪拌した。反応液をエチルエーテル30mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して化合物350.236g(収率64%)を得た。化合物35の構造を1H−NMRで確認し、その結果を次に示す。1H−NMR(CDCl3、400MHz)δ(ppm)8.05(d、2H)、8.03(dd、2H)、7.58(m、8H)、7.47(m、2H)、7.39(m、8H)、7.33(dd、2H)、7.24(m、2H)、6.94(d、2H)。化合物35のTgは、143℃であった。
【0235】
(合成例8、化合物56の合成)
下記化学反応式9の反応経路を経て化合物56を合成した。
【0236】
【化68】

・・・・・・(反応式9)
【0237】
(中間体Kの合成)
2−ブロモフルオレン13g(53mmol)を酢酸60mLに溶かし、重クロム酸ナトリウム60g(200mmol)を0℃で徐々に添加した。12時間後に混合物に蒸溜水200mLを添加してよく攪拌した。生成された黄色固体を濾過し、乾燥して中間体Kを10g(収率78%)で得た。
【0238】
(中間体Lの合成)
中間体K8g(31.6mmol)をTHF60mLに溶かして−78℃で1M(mol/L)の臭化フェニルマグネシウム38mL(38mmol)を徐々に添加した。2時間後に温度を常温に維持して5時間攪拌した。塩化アンモニウム水溶液50mLに希釈した後、酢酸エチル(40mL)で3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体L10g(収率95%)を得た。中間体Lの構造は、1H NMRで確認し、その結果を次に示す。1H NMR(CDCl3、400MHz)δ(ppm)7.64(d、1H)、7.54〜7.47(m、2H)、7.44(d、1H)、7.39〜7.33(m、3H)、7.30〜7.23(m、5H)、2.46(s、1H)。
【0239】
(中間体Mの合成)
中間体L10g(30mmol)をベンゼン60mLに溶かして、濃硫酸2.4mL(45mmol)を少量のベンゼンに希釈して添加した。80℃で5時間攪拌した後、ベンゼンを蒸発させて残った濾液に1N水酸化ナトリウム水溶液を添加して、反応液をPH7にした後に、酢酸エチル(40mL)で3回抽出した。集められた有機層を硫酸マグネシウムで乾燥して溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体M6g(収率50%)を得た。
【0240】
(中間体Oの合成)
中間体M340mg(0.856mmol)および4−アミノベンゾニトリル142mg(1.2mmol)をトルエン5mLに溶かした後、t−BuONa0.144g(1.5mmol)、Pd(dba)20.018g(0.02mmol)、(t−Bu)3P0.004〜0.006g(0.02〜0.03mmol)を加えて80℃で5時間攪拌した。反応液をエチルエーテル20mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥して溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して中間体O0.27g(収率73%)を得た。
【0241】
(化合物56の合成)
中間体O267mg(0.614mmol)および中間体B(合成例1参照)0.332g(0.9mmol)をトルエン10mLに溶かした後、ここにt−BuONa0.144g(1.5mmol)、Pd(dba)20.018g(0.02mmol)、(t−Bu)3P0.004〜0.006g(0.02〜0.03mmol)を加えて90℃で6時間攪拌した。反応液をエチルエーテル30mLで3回抽出した。集められた有機層を硫酸マグネシウムで乾燥し、溶媒を蒸発して得られた残留物をシリカゲルカラムクロマトグラフィで分離精製して化合物56を0.236g(収率57%)で得た。化合物56の構造は、1H NMRで確認し、その結果を次に示す。1H NMR(CDCl3、400MHz)δ(ppm)7.97(d、1H)、7.90(d、1H)、7.69(d、1H)、7.65(d、1H)、7.60(d、2H)、7.56(dd、2H)、7.48(m、1H)、7.40(d、2H)、7.35(m、6H)、7.24(m、3H)、7.16(m、10H)、7.11(dd、1H)、6.93(d、2H)。
【0242】
以上、上記の通り合成した本発明の実施形態の化合物8、化合物9、化合物10、化合物11、化合物14、化合物28は、比較的高いTd(熱分解温度)、Tg(ガラス転移温度)、Tm(融点)を示すことが分かった。また、IDE406のTg135℃に比べても、化合物8、化合物9、化合物10、化合物11、化合物14、化合物28、化合物35のTgは高いことが分かる。化合物56も、構造内にフェニルカルバゾール基を複数有することにより、高い耐熱性を有すると考えられる。これにより、上記化合物を正孔注入層の形成に用いると、正孔注入層自体の耐熱性を向上できるため、有機発光素子の寿命、発光輝度等を向上できる。
【実施例】
【0243】
(実施例1)
反射型電極(第1電極)として、130nmの厚さのアルミニウム基板およびITO(SDI社製)基板を、50mm×50mm×0.7mmサイズに切断してイソプロピルアルコールおよび純水の中で各5分間超音波洗浄した後、30分間UV、オゾン洗浄して使用した。
【0244】
第1電極の上部に正孔注入物質として化合物8を蒸着して、120nmの厚さの正孔注入層を形成した後、正孔注入層の上部に正孔輸送物質であるNPBを蒸着させて30nmの厚さの正孔輸送層を形成した。
【0245】
正孔輸送層の上部に青色蛍光ホストであるIDE140(出光社)と青色蛍光ドーパントであるIDE105(出光社)とを質量比98対2でともに蒸着して、30nmの厚さに青色発光層を形成した後、発光層の上部にBalqを蒸着して5nmの厚さの正孔抑制層を形成した。正孔抑制層の上部にAlq3を25nmの厚さに蒸着して電子輸送層を形成した後、LiFを0.3nmの厚さに蒸着して電子注入層を形成した。電子注入層の上部にMg−Agを18nmの厚さに蒸着して半透明電極(第2電極)を形成することによって、有機発光素子を製造した。
【0246】
有機発光素子は、駆動電圧5.5Vで、電流密度23.0mA/cm2、発光輝度1179cd/m2の高輝度を示した。色座標は、(0.113、0.130)であり、発光効率は、5.13cd/Aであった。
【0247】
(実施例2)
正孔注入層の形成時に、化合物8の代わりに化合物9を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0248】
有機発光素子は、駆動電圧5.5Vで、電流密度20.1mA/cm2、発光輝度1021cd/m2の高輝度を示した。色座標は、(0.113、0.120)であり、発光効率は、5.10cd/Aであった。
【0249】
(実施例3)
正孔注入層の形成時に、化合物8の代わりにIDE406(出光社製)を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0250】
有機発光素子は、駆動電圧5.5Vで、電流密度46.52mA/cm2、発光輝度784cd/m2の輝度を示した。色座標は(0.113、0.125)であり、発光効率は、4.74cd/Aであった。
【0251】
(実施例4)
正孔注入層の形成時に、化合物8の代わりにLi273(ドイツ、Sensient社)を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0252】
有機発光素子は、駆動電圧5.5Vで、電流密度17.43mA/cm2、発光輝度695cd/m2の輝度を示した。色座標は(0.122、0.110)であり、発光効率は、3.98cd/Aであった。
【0253】
(実施例5)
正孔注入層の形成時に、化合物8の代わりにHI102(米国UDC社)を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0254】
有機発光素子は、駆動電圧5.5Vで、電流密度0.67mA/cm2、発光輝度1.2cd/m2の低輝度を示した。色座標は(0.112、0.154)であり、発光効率は、0.18cd/Aであった。
【0255】
(実施例6)
正孔注入層の形成時に、化合物8の代わりに、ELM180(韓国、ELM社)を利用したことを除いては、実施例1と同じ方法で有機発光素子を製作した。
【0256】
有機発光素子は、駆動電圧5.5Vで、電流密度2.55mA/cm2、発光輝度52cd/m2の輝度を示した。色座標は(0.124、0.105)であり、発光効率は、2.04cd/Aであった。
【0257】
実施例1〜6から、正孔注入層材料として本発明の実施形態の化合物8または化合物9を使用して、かつ正孔注入層の厚さを本発明の実施形態の範囲内に調節した場合、正孔注入能力が向上するにつれて、同一駆動電圧で電流密度および電流効率値が向上することがわかった。また、これにより、色純度、輝度値が増加することを確認できた。同一駆動電圧下での電流効率値の比較結果は、図3に示す。図3より、本発明の実施形態の化合物8を用いた実施例1の電流効率値(発光効率)が最も高いことが分かった。
【0258】
一方、実施例1および実施例3の寿命特性および駆動電圧の変化量を評価して、各々図4および図5に表した。図4は、加速寿命条件である4000cd/m2で200時間経過した過程での実施例1の有機発光素子と実施例3の有機発光素子との寿命を測定した結果を示すものである。図4によると、実施例1の有機発光素子は、90.2%の寿命特性を表し、実施例3の有機発光素子は、86.2%の寿命特性を表した。つまり、4000cd/m2の加速寿命条件で200時間経過した後の実施例1の有機発光素子の輝度値は、加速寿命測定前の値に対して、90.2%であった。一方、4000cd/m2の加速寿命条件で200時間経過した後の実施例3の有機発光素子の輝度値は、加速寿命測定前の値に対して、86.2%であった。これにより、実施例1は実施例3より高い寿命を示すことが分かった。一方、図5は、加速寿命条件である4000cd/m2で400時間経過した過程での駆動電圧の変化量を測定した結果を示すものであって、実施例1の有機発光素子の駆動電圧は、400時間経過後に0.45V増加し、実施例3の有機発光素子の駆動電圧は、400時間経過後に1.65V増加した。これにより、実施例1は実施例3より、長時間の駆動時でも、比較的低電圧で駆動できることが分かった。図5から、本発明による実施例1の有機発光素子が、特に、低電圧、低消費電力(低駆動電圧)を実現できることが確認できる。これは、本発明の実施形態の化合物8は、耐熱性に優れているため、化合物8を用いた有機発光素子の耐久性および寿命が向上できたためである。
【0259】
(実施例7)
正孔注入層として化合物11を利用して160nmの厚さの正孔注入層を蒸着した後、正孔注入層の上部に正孔輸送物質であるNPBを蒸着させて30nmの厚さの正孔輸送層を形成した。青色発光層の代わりに、緑色発光物質としてCBPとIr(ppy)3とを利用して30nmの厚さに緑色発光層を形成したという点を除いては、実施例1と同じ方法で有機発光素子を形成した。
【0260】
有機発光素子は、駆動電圧5Vで、電流密度7.5mA/cm2、発光輝度2220cd/m2の高輝度を示した。色座標は(0.244、0.71)であり、発光効率は、29.6cd/Aであった。
【0261】
(実施例8)
正孔注入層の形成時に、化合物11の代わりに、IDE406(出光社)を利用したことを除いては、実施例7と同じ方法で有機発光素子を製作した。
【0262】
有機発光素子は、駆動電圧5Vで、電流密度7.86mA/cm2、発光輝度1900cd/m2の輝度を示した。色座標は(0.246、0.691)であり、発光効率は、23.9cd/Aであった。
【0263】
実施例7および実施例8の有機発光素子の電流効率値は、図6に示す。図6の結果より、本発明の実施形態の化合物11を用いた実施例7の方が、化合物11の代わりにIDE406を用いた実施例8より、電流効率(発光効率)が高いことが分かった。また、発光輝度値も実施例7の方が実施例8より高い。これは、化合物11の正孔移動度および耐熱性が優れているためである。これにより、化合物11を用いると、発光効率および発光輝度値を向上できることがわかった。
【0264】
(実施例9)
正孔注入層として化合物14を利用して200nmの厚さの正孔注入層を蒸着した後、正孔注入層の上部に正孔輸送物質であるNPBを蒸着させて30nmの厚さの正孔輸送層を形成した。青色発光層の代わりに、赤色発光物質としてCBPとBTPIrとを利用して30nmの厚さに赤色発光層を形成したという点を除いては、実施例1と同じ方法で有機発光素子を形成した。
【0265】
有機発光素子は、駆動電圧5Vで、電流密度11.8mA/cm2、発光輝度1534cd/m2の高輝度を示した。色座標は(0.687、0.310)であり、発光効率は、13.0cd/Aであった。
【0266】
(実施例10)
正孔注入層の形成時に、化合物14の代わりに、IDE406(出光社)を利用したことを除いては、実施例9と同じ方法で有機発光素子を製作した。
【0267】
有機発光素子は、駆動電圧5Vで、電流密度13.3mA/cm2、発光輝度1328cd/m2の輝度を示した。色座標は(0.692、0.306)であり、発光効率は、9.98cd/Aであった。
【0268】
実施例9および実施例10の有機発光素子の電流効率値は、図7に示す。図7の結果より、本発明の実施形態の化合物14を用いた実施例9の方が、化合物14の代わりにIDE406を用いた実施例10より、電流効率(発光効率)が高いことが分かった。また、発光輝度値も実施例9の方が実施例10より高い。これは、化合物14の正孔移動度および耐熱性が優れているためである。これにより、化合物14を用いると、発光効率および発光輝度値を向上できることがわかった。
【0269】
実施例1〜10に対する駆動電圧、発光効率および色純度(色座標)は、IVL測定装置(PhotoResearch PR650、Keithley 238)を利用して評価した。発光輝度および電流密度も、上記IVL測定装置を利用して測定した。
【0270】
(実施例11)
次のような方法によって、赤色発光層、緑色発光層および青色発光層を何れも備える有機発光素子を製作した。
【0271】
薄膜トランジスタが備えられた基板を準備した後、Alなどから形成される100nmの厚さの第1電極をストライプ状に形成した。このとき、第1電極は、基板の下部に備えられた薄膜トランジスタのソース電極またはドレイン電極と電気的に連結されるように形成した。
【0272】
第1電極の上部にシリコン酸化物を利用して赤色発光層、緑色発光層、青色発光層が配置される領域に、各々領域を定義する画素定義膜を形成した。そして、画素定義膜に沿って正孔注入材料である化合物8を、赤色発光層が形成される領域には、200nmの厚さに蒸着し、緑色発光層が形成される領域には、160nmの厚さに蒸着し、青色発光層が形成される領域には、120nmの厚さに蒸着し、各発光層別に正孔注入層を形成した。この後、正孔注入層の上部に正孔輸送物質であるNPBを30nmの厚さで蒸着した。
【0273】
正孔輸送層の上部には、赤色発光物質としてCBPとBTPIrとを30nmの厚さに蒸着し、緑色発光物質としてCBPとIr(ppy)3とを30nmの厚さに蒸着し、青色発光物質としてIDE140(出光社製)とIDE105(出光社製)とを15nmの厚さに蒸着し、各々赤色発光層、緑色発光層および青色発光層を形成した。
【0274】
発光層の上部にBalqを蒸着して、5nmの厚さの正孔抑制層を形成した。正孔抑制層の上部にAlq3を25nmの厚さに形成して電子輸送層を形成し、電子輸送層の上部にLiF0.3nmの厚さに蒸着して電子注入層を形成した。その後、電子注入層上に、Mg−Agを18nmの厚さに蒸着して半透明電極(第2電極)を形成することによって、赤色発光層、緑色発光層および青色発光層を何れも備えた有機発光素子を製造した。
【0275】
実施例1〜実施例10の発光効率および色座標の評価方法と同じ方法で、実施例11の有機発光素子の発光効率および色座標を評価して下記表1に示す。
【0276】
【表1】

【0277】
表1によると、実施例11から得た有機発光素子は、各々発光カラー別に優秀な発光効率および色純度を有することが分かる。一方、40%の有機発光素子が作動している状態で、実施例11の有機発光素子における赤色、緑色および青色カラーを混合した白色カラーの発光効率は、発光輝度150cd/m2で13.0cd/Aを示した。これに基づいた消費電力は、180mWであった。消費電力は、IVL測定装置(PhotoResearch PR650、Keithley 238)を利用して発光効率および色純度を評価した後、計算を通じて算出した。
【0278】
(実施例12)
正孔注入層の形成時に、化合物8の代わりに、IDE406(出光社)を利用したことを除いては、実施例11と同一の方法で有機発光素子を製作した。その発光効率および色座標の評価結果は、下記表2に示す。
【0279】
【表2】

【0280】
表2によると、実施例12から得た有機発光素子は、各々発光カラー別に優秀な発光効率および色純度を有することが分かる。一方、40%の有機発光素子が作動している状態で、実施例12の有機発光素子における赤色、緑色および青色カラーを混合した白色カラーの発光効率は、発光輝度150cd/m2で11.0cd/Aを示した。これに基づいた消費電力は、220mWであった。消費電力は、IVL測定装置(PhotoResearch PR650、Keithley 238)を利用して発光効率および色純度を評価した後、計算を通じて算出した。
【0281】
(比較例1)
薄膜トランジスタが備えられた基板を準備した後、アルミニウムから形成される100nmの厚さの第1電極をストライプ状に形成した。このとき、第1電極は、基板の下部に備えられた薄膜トランジスタのソース電極またはドレイン電極と電気的に連結されるように形成した。
【0282】
画素電極の上部にシリコン酸化物を利用して赤色発光層、緑色発光層、青色発光層が配置される領域に、各々定義する画素定義膜を形成した。そして、画素定義膜に沿って正孔注入物質であるm−TDATAで100nmの厚さの正孔注入層を形成した後、正孔注入層の上部に正孔輸送物質であるNPBを40nmの厚さに蒸着した。この後、フォトマスクを利用して緑色発光層が形成される領域には、40nmの厚さの正孔輸送物質であるNPBを追加蒸着し、赤色発光層が形成される領域には、80nmの厚さの正孔輸送物質であるNPBを追加蒸着して、赤色発光層が形成される領域の正孔輸送層の厚さは120nm、緑色発光層が形成される領域の正孔輸送層の厚さは80nm、青色発光層が形成される領域の正孔輸送層の厚さは40nmにした。
【0283】
正孔輸送層の上部に、各々赤色発光物質としてCBPとBTPIrとを30nmの厚さに形成し、緑色発光物質としてCBPとIr(ppy)3とを30nmの厚さに形成し、青色発光物質としてIDE140(出光社製)とIDE105(出光社製)とを15nmの厚さに形成し、各々赤色発光層、緑色発光層および青色発光層を形成した。
【0284】
発光層の上部に、Balqを蒸着して5nmの厚さの正孔抑制層を形成した。正孔抑制層の上部にAlq3を25nmの厚さに形成して電子輸送層を形成し、電子輸送層の上部にLiFを0.3nmの厚さで蒸着して電子注入層を形成した後、半透明電極(第2電極)としてMg−Agを18nmの厚さで形成し、有機発光素子を製造した。
【0285】
比較例1の発光効率および色座標の評価結果は、下記表3に示す。
【0286】
【表3】

【0287】
表3によると、本発明の実施例11の有機発光素子のように本発明の正孔注入物質を使用することもせず、実施例12の有機発光素子のように上記の正孔注入層の厚さ範囲を採用することもしない比較例1の有機発光素子より、本発明の実施例11および実施例12の有機発光素子が発光効率、色純度で優秀であるということが確認できる。また、実施例11は、実施例12より消費電力が少なかった。これは、実施例11で使用した化合物8の優れた耐熱性および正孔移動度による。
【0288】
以上結果より、本発明の実施形態の化合物を正孔注入層の形成に用いると、当該化合物の高い耐熱性および高い正孔移動度のために、寿命、発光効率、電流密度および発光輝度を向上でき、かつ低駆動電圧を実現できる。また、本発明の実施形態では、第1電極および第2電極のうち、いずれか一つを反射型電極で形成し、他の一つを透明電極または半透明電極で形成するため、有機層から放出される光は共振(干渉)できる。さらに共振をより効果的に実施するために、赤色、緑色、青色の発光層別に対応して正孔注入層の厚さを最適化する。この共振現象により、有機層(有機発光素子)から放出される光の輝度、色純度を向上できる。従って、上記のように構成される本発明の実施形態に係る有機発光素子を平板表示装置に適用すると、平板表示装置の性能を向上できる。
【0289】
以上、添付図面を参照しながら本発明の好適な実施形態について説明したが、本発明は係る例に限定されないことは言うまでもない。当業者であれば、特許請求の範囲に記載された範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、それらについても当然に本発明の技術的範囲に属するものと了解される。
【産業上の利用可能性】
【0290】
本発明は、平板表示装置関連の技術分野に適用可能である。
【図面の簡単な説明】
【0291】
【図1】本発明の実施形態に係る有機発光素子の一具現形態の構造を概略的に示す図面である。
【図2】本発明の実施形態に係る赤色発光層、緑色発光層および青色発光層を何れも備える有機発光素子を概略的に示す図面である。
【図3】本発明の実施形態に係る有機発光素子の電流効率、輝度を示す図面である。
【図4】本発明の実施形態に係る有機発光素子の輝度、寿命を示す図面である。
【図5】本発明の実施形態に係る有機発光素子の加速駆動電圧の変化量を示す図面である。
【図6】本発明の実施形態に係る有機発光素子の電流効率、輝度を示す図面である。
【図7】本発明の実施形態に係る有機発光素子の電流効率、輝度を示す図面である。
【符号の説明】
【0292】
200 基板
210 第1電極
214 画素定義膜
216 正孔注入層
218 正孔輸送層
220、225、230 発光層
240 電子輸送層
250 電子注入層
260 第2電極
【特許請求の範囲】
【請求項1】
基板と、
第1電極と、
第2電極と、
前記第1電極と前記第2電極との間に配置され、赤色発光層、緑色発光層及び青色発光層を含む発光層及び正孔注入層を備える有機層と、
を備え、
前記第1電極および前記第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、
前記正孔注入層は、前記赤色発光層の下部の第1領域、前記緑色発光層の下部の第2領域及び前記青色発光層の下部の第3領域のうち一つ以上の領域を含み、前記第1領域の厚さは160nm〜220nmであり、前記第2領域の厚さは140nm〜180nmであり、前記第3領域の厚さは100nm〜140nmであることを特徴とする有機発光素子。
【請求項2】
前記正孔注入層は、前記第1領域、前記第2領域及び前記第3領域の全てを含むことを特徴とする、請求項1に記載の有機発光素子。
【請求項3】
前記第1電極は、前記基板側に配置され、
前記第1電極は、前記反射型電極であり、前記第2電極は、前記半透明電極または前記透明電極であり、
前記有機層で生成される光は、前記第2電極を介して外部に放出されることを特徴とする、請求項1に記載の有機発光素子。
【請求項4】
前記有機発光素子の作動の際に、前記第1電極と前記第2電極との間に共振現象が起きることを特徴とする、請求項1〜3のいずれか1項に記載の有機発光素子。
【請求項5】
前記正孔注入層と前記発光層との間に設けられた正孔輸送層をさらに備えることを特徴とする、請求項1〜4のいずれか1項に記載の有機発光素子。
【請求項6】
前記正孔輸送層は、前記赤色発光層、緑色発光層及び青色発光層に対する共通層であることを特徴とする、請求項5に記載の有機発光素子。
【請求項7】
前記正孔注入層の前記第1領域と前記正孔輸送層との厚さの総和は、200nm〜240nmであることを特徴とする、請求項5または6に記載の有機発光素子。
【請求項8】
前記正孔注入層の前記第2領域と前記正孔輸送層との厚さの総和は、160nm〜200nmであることを特徴とする、請求項5〜7のいずれか1項に記載の有機発光素子。
【請求項9】
前記正孔注入層の前記第3領域と前記正孔輸送層との厚さの総和は、120nm〜160nmであることを特徴とする、請求項5〜8のいずれか1項に記載の有機発光素子。
【請求項10】
前記第1領域の厚さは、190nm〜220nmであることを特徴とする、請求項1〜9のいずれか1項に記載の有機発光素子。
【請求項11】
前記第2領域の厚さは、160nm〜180nmであることを特徴とする、請求項1〜10のいずれか1項に記載の有機発光素子。
【請求項12】
前記第3領域の厚さは、110nm〜130nmであることを特徴とする、請求項1〜11のいずれか1項に記載の有機発光素子。
【請求項13】
前記第1領域の厚さは、200nmであることを特徴とする、請求項1〜12のいずれか1項に記載の有機発光素子。
【請求項14】
前記第2領域の厚さは、160nmであることを特徴とする、請求項1〜13のいずれか1項に記載の有機発光素子。
【請求項15】
前記第3領域の厚さは、120nmであることを特徴とする、請求項1〜14のいずれか1項に記載の有機発光素子。
【請求項16】
前記正孔注入層は、下記化学式1で表示される化合物、下記化学式2で表示される化合物および下記化学式3で表示される化合物のうち、少なくとも一つ以上の化合物を含むことを特徴とする、請求項1〜15のいずれか1項に記載の有機発光素子。
【化1】

・・・・・・(化学式1)
【化2】

・・・・・・(化学式2)
【化3】

・・・・・・(化学式3)
前記化学式1〜3のうち、Xは、置換または非置換の炭素数1〜30のアルキレン基、置換または非置換の炭素数2〜30のアルケニレン基、置換または非置換の炭素数6〜30のアリーレン基、置換または非置換の炭素数2〜30のヘテロアリーレン基、または置換または非置換の炭素数2〜30の複素環を表し、
R1、R2、R3、R4、R5、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R1、R2、R3のうち2以上、R4、R5、およびR6、R7、R8のうち2以上は、隣接した基と相互結合して、飽和炭素環または不飽和炭素環を形成でき、
Ar1、Ar2およびAr3は、各々独立的に、置換または非置換の炭素数6〜30のアリール基または置換または非置換の炭素数2〜30のヘテロアリール基であり、
Yは、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環を表し、nは、0〜5の整数である。
【請求項17】
前記化学式1において、
Xは、置換または非置換の炭素数6〜30のアリーレン基、または置換または非置換の炭素数2〜30のヘテロアリーレン基を表し、
R1、R2、R3は、各々独立的に水素原子、または置換または非置換の炭素数1〜30のアルキル基を表し、
Ar1、Ar2は、各々独立的に、置換または非置換の炭素数6〜30のアリール基であり、
前記化学式2において、
R4、R5は、各々独立的に水素原子、または置換または非置換の炭素数1〜30のアルキル基を表し、
Ar2は、置換または非置換の炭素数6〜30のアリール基(置換の炭素数6のアリール基を除く)であり、
前記化学式3において、
R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、または非置換の炭素数6〜30のアリール基を表し、
Ar3は、置換または非置換の炭素数6〜30のアリール基であり、
Yは、置換または非置換の炭素数1〜30のアルキル基、非置換の炭素数6〜30のアリール基を表し、nは0または1であることを特徴とする、請求項16記載の有機発光素子。
【請求項18】
前記化学式1で表示される前記化合物は、下記化学式1aの構造を有することを特徴とする、請求項16または17に記載の有機発光素子。
【化4】

・・・・・・(化学式1a)
前記化学式1aのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R1、R2およびR3のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成でき、
Q1は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基である。
【請求項19】
前記化学式1で表示される前記化合物は、下記化学式1bの構造を有することを特徴とする、請求項16または17に記載の有機発光素子。
【化5】

・・・・・・(化学式1b)
前記化学式1bのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R1、R2およびR3は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成でき、
Q2は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基である。
【請求項20】
前記化学式2で表示される前記化合物は、下記化学式2aの構造を有することを特徴とする、請求項16〜19のいずれか1項に記載の有機発光素子。
【化6】

・・・・・・(化学式2a)
前記化学式2aのうち、R4およびR5は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R4およびR5は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成でき、
Q3は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基である。
【請求項21】
前記化学式3で表示される前記化合物は、下記化学式3aの構造を有することを特徴とする、請求項16〜20のいずれか1項に記載の有機発光素子。
【化7】

・・・・・・(化学式3a)
前記化学式3aのうち、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R6、R7およびR8のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成でき、
Q4は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基である。
【請求項22】
前記化学式1で表示される前記化合物、前記化学式2で表示される前記化合物および前記化学式3で表示される前記化合物は、下記化合物1〜化合物62のうち何れか一つであることを特徴とする、請求項16〜21のいずれか1項に記載の有機発光素子。
【化8】

【化9】

【化10】

【化11】

【化12】

【化13】

【化14】

【化15】

【化16】

【化17】

【化18】

【化19】

【化20】

【化21】

【化22】

【化23】

【化24】

【化25】

【化26】

【化27】

【化28】

【化29】

【化30】

【請求項23】
前記化学式1で表示される前記化合物、前記化学式2で表示される前記化合物および前記化学式3で表示される前記化合物は、前記化合物8、前記化合物9、前記化合物10、前記化合物11、前記化合物14、前記化合物28、前記化合物35および前記化合物56のうち何れか一つであることを特徴とする、請求項22に記載の有機発光素子。
【請求項24】
請求項1〜23のうちいずれか1項に記載の前記有機発光素子を備え、前記有機発光素子の前記第1電極は、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結されることを特徴とする、平板表示装置。
【請求項1】
基板と、
第1電極と、
第2電極と、
前記第1電極と前記第2電極との間に配置され、赤色発光層、緑色発光層及び青色発光層を含む発光層及び正孔注入層を備える有機層と、
を備え、
前記第1電極および前記第2電極のうち何れか一つは、反射型電極であり、他の一つは、半透明電極または透明電極であり、
前記正孔注入層は、前記赤色発光層の下部の第1領域、前記緑色発光層の下部の第2領域及び前記青色発光層の下部の第3領域のうち一つ以上の領域を含み、前記第1領域の厚さは160nm〜220nmであり、前記第2領域の厚さは140nm〜180nmであり、前記第3領域の厚さは100nm〜140nmであることを特徴とする有機発光素子。
【請求項2】
前記正孔注入層は、前記第1領域、前記第2領域及び前記第3領域の全てを含むことを特徴とする、請求項1に記載の有機発光素子。
【請求項3】
前記第1電極は、前記基板側に配置され、
前記第1電極は、前記反射型電極であり、前記第2電極は、前記半透明電極または前記透明電極であり、
前記有機層で生成される光は、前記第2電極を介して外部に放出されることを特徴とする、請求項1に記載の有機発光素子。
【請求項4】
前記有機発光素子の作動の際に、前記第1電極と前記第2電極との間に共振現象が起きることを特徴とする、請求項1〜3のいずれか1項に記載の有機発光素子。
【請求項5】
前記正孔注入層と前記発光層との間に設けられた正孔輸送層をさらに備えることを特徴とする、請求項1〜4のいずれか1項に記載の有機発光素子。
【請求項6】
前記正孔輸送層は、前記赤色発光層、緑色発光層及び青色発光層に対する共通層であることを特徴とする、請求項5に記載の有機発光素子。
【請求項7】
前記正孔注入層の前記第1領域と前記正孔輸送層との厚さの総和は、200nm〜240nmであることを特徴とする、請求項5または6に記載の有機発光素子。
【請求項8】
前記正孔注入層の前記第2領域と前記正孔輸送層との厚さの総和は、160nm〜200nmであることを特徴とする、請求項5〜7のいずれか1項に記載の有機発光素子。
【請求項9】
前記正孔注入層の前記第3領域と前記正孔輸送層との厚さの総和は、120nm〜160nmであることを特徴とする、請求項5〜8のいずれか1項に記載の有機発光素子。
【請求項10】
前記第1領域の厚さは、190nm〜220nmであることを特徴とする、請求項1〜9のいずれか1項に記載の有機発光素子。
【請求項11】
前記第2領域の厚さは、160nm〜180nmであることを特徴とする、請求項1〜10のいずれか1項に記載の有機発光素子。
【請求項12】
前記第3領域の厚さは、110nm〜130nmであることを特徴とする、請求項1〜11のいずれか1項に記載の有機発光素子。
【請求項13】
前記第1領域の厚さは、200nmであることを特徴とする、請求項1〜12のいずれか1項に記載の有機発光素子。
【請求項14】
前記第2領域の厚さは、160nmであることを特徴とする、請求項1〜13のいずれか1項に記載の有機発光素子。
【請求項15】
前記第3領域の厚さは、120nmであることを特徴とする、請求項1〜14のいずれか1項に記載の有機発光素子。
【請求項16】
前記正孔注入層は、下記化学式1で表示される化合物、下記化学式2で表示される化合物および下記化学式3で表示される化合物のうち、少なくとも一つ以上の化合物を含むことを特徴とする、請求項1〜15のいずれか1項に記載の有機発光素子。
【化1】

・・・・・・(化学式1)
【化2】

・・・・・・(化学式2)
【化3】

・・・・・・(化学式3)
前記化学式1〜3のうち、Xは、置換または非置換の炭素数1〜30のアルキレン基、置換または非置換の炭素数2〜30のアルケニレン基、置換または非置換の炭素数6〜30のアリーレン基、置換または非置換の炭素数2〜30のヘテロアリーレン基、または置換または非置換の炭素数2〜30の複素環を表し、
R1、R2、R3、R4、R5、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R1、R2、R3のうち2以上、R4、R5、およびR6、R7、R8のうち2以上は、隣接した基と相互結合して、飽和炭素環または不飽和炭素環を形成でき、
Ar1、Ar2およびAr3は、各々独立的に、置換または非置換の炭素数6〜30のアリール基または置換または非置換の炭素数2〜30のヘテロアリール基であり、
Yは、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環を表し、nは、0〜5の整数である。
【請求項17】
前記化学式1において、
Xは、置換または非置換の炭素数6〜30のアリーレン基、または置換または非置換の炭素数2〜30のヘテロアリーレン基を表し、
R1、R2、R3は、各々独立的に水素原子、または置換または非置換の炭素数1〜30のアルキル基を表し、
Ar1、Ar2は、各々独立的に、置換または非置換の炭素数6〜30のアリール基であり、
前記化学式2において、
R4、R5は、各々独立的に水素原子、または置換または非置換の炭素数1〜30のアルキル基を表し、
Ar2は、置換または非置換の炭素数6〜30のアリール基(置換の炭素数6のアリール基を除く)であり、
前記化学式3において、
R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、または非置換の炭素数6〜30のアリール基を表し、
Ar3は、置換または非置換の炭素数6〜30のアリール基であり、
Yは、置換または非置換の炭素数1〜30のアルキル基、非置換の炭素数6〜30のアリール基を表し、nは0または1であることを特徴とする、請求項16記載の有機発光素子。
【請求項18】
前記化学式1で表示される前記化合物は、下記化学式1aの構造を有することを特徴とする、請求項16または17に記載の有機発光素子。
【化4】

・・・・・・(化学式1a)
前記化学式1aのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R1、R2およびR3のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成でき、
Q1は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基である。
【請求項19】
前記化学式1で表示される前記化合物は、下記化学式1bの構造を有することを特徴とする、請求項16または17に記載の有機発光素子。
【化5】

・・・・・・(化学式1b)
前記化学式1bのうち、R1、R2およびR3は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R1、R2およびR3は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成でき、
Q2は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基である。
【請求項20】
前記化学式2で表示される前記化合物は、下記化学式2aの構造を有することを特徴とする、請求項16〜19のいずれか1項に記載の有機発光素子。
【化6】

・・・・・・(化学式2a)
前記化学式2aのうち、R4およびR5は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R4およびR5は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成でき、
Q3は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基である。
【請求項21】
前記化学式3で表示される前記化合物は、下記化学式3aの構造を有することを特徴とする、請求項16〜20のいずれか1項に記載の有機発光素子。
【化7】

・・・・・・(化学式3a)
前記化学式3aのうち、R6、R7およびR8は、各々独立的に水素原子、置換または非置換の炭素数1〜30のアルキル基、置換または非置換の炭素数1〜30のアルコキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数6〜30のアリールオキシ基、置換または非置換の炭素数2〜30の複素環、または置換または非置換の炭素数5〜30の縮合多環基、ヒドロキシ基、シアノ基、または置換または非置換のアミノ基を表し、
R6、R7およびR8のうち2以上は、隣接した基と相互結合して飽和炭素環または不飽和炭素環を形成でき、
Q4は、水素、シアノ基、フッ素、炭素数1〜30のアルコキシ基、置換または非置換の炭素数1〜30のアルキル基、炭素数6〜30のアリールオキシ基、置換または非置換の炭素数6〜30のアリール基、置換または非置換の炭素数2〜30の複素環、または置換または非置換のアミノ基である。
【請求項22】
前記化学式1で表示される前記化合物、前記化学式2で表示される前記化合物および前記化学式3で表示される前記化合物は、下記化合物1〜化合物62のうち何れか一つであることを特徴とする、請求項16〜21のいずれか1項に記載の有機発光素子。
【化8】

【化9】

【化10】

【化11】

【化12】

【化13】

【化14】

【化15】

【化16】

【化17】

【化18】

【化19】

【化20】

【化21】

【化22】

【化23】

【化24】

【化25】

【化26】

【化27】

【化28】

【化29】

【化30】

【請求項23】
前記化学式1で表示される前記化合物、前記化学式2で表示される前記化合物および前記化学式3で表示される前記化合物は、前記化合物8、前記化合物9、前記化合物10、前記化合物11、前記化合物14、前記化合物28、前記化合物35および前記化合物56のうち何れか一つであることを特徴とする、請求項22に記載の有機発光素子。
【請求項24】
請求項1〜23のうちいずれか1項に記載の前記有機発光素子を備え、前記有機発光素子の前記第1電極は、薄膜トランジスタのソース電極またはドレイン電極と電気的に連結されることを特徴とする、平板表示装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2011−23744(P2011−23744A)
【公開日】平成23年2月3日(2011.2.3)
【国際特許分類】
【出願番号】特願2010−224249(P2010−224249)
【出願日】平成22年10月1日(2010.10.1)
【分割の表示】特願2007−110746(P2007−110746)の分割
【原出願日】平成19年4月19日(2007.4.19)
【出願人】(308040351)三星モバイルディスプレイ株式會社 (764)
【Fターム(参考)】
【公開日】平成23年2月3日(2011.2.3)
【国際特許分類】
【出願日】平成22年10月1日(2010.10.1)
【分割の表示】特願2007−110746(P2007−110746)の分割
【原出願日】平成19年4月19日(2007.4.19)
【出願人】(308040351)三星モバイルディスプレイ株式會社 (764)
【Fターム(参考)】
[ Back to top ]

