有機金属錯体を有効成分として含有する抗がん剤
【課題】シスプラチンなどの従来の抗がん剤と比較して副作用が低減された抗がん剤を提供する。
【解決手段】下記化学式1:

で表される環状フェノール硫化物と金属とからなる有機金属錯体を有効成分として含有することを特徴とする抗がん剤により、上記課題は解決されうる。
【解決手段】下記化学式1:

で表される環状フェノール硫化物と金属とからなる有機金属錯体を有効成分として含有することを特徴とする抗がん剤により、上記課題は解決されうる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、有機金属錯体を有効成分として含有する抗がん剤に関する。
【背景技術】
【0002】
金属錯体を有効成分として含有する抗がん剤として、「白金製剤(プラチナ製剤)」に分類されるシスプラチンが知られている。シスプラチンは、下記化学式で表されるように、白金錯体としての構造を有する。
【0003】
【化1】

【0004】
このシスプラチンは、塩素原子を介して、がん細胞に含まれるDNAの構成塩基であるグアニンやアデニンのN−7位に結合する。これによりDNA鎖内には架橋が形成され、DNAの複製が阻害される結果、がん細胞の分裂・増殖が抑制され、がん細胞は死滅に至る。
【0005】
シスプラチンは、1965年、アメリカのローゼンバーグ博士によって細菌の増殖を抑制する抗菌薬として発見され、その後、抗腫瘍効果が確認されてがん治療に用いられるようになった。日本におけるシスプラチンの適応症は、睾丸腫瘍、膀胱がん、腎盂・尿管腫瘍、前立腺がん、卵巣がん、頭頸部がん、非小細胞肺がん、食道がん、子宮頸がん、神経芽細胞腫、胃がん、小細胞肺がん、骨肉腫、胚細胞腫瘍、悪性リンパ腫など、非常に広い範囲に及んでいる。
【0006】
このように、シスプラチンは、高い腫瘍縮小効果を有するものの、激しい副作用を示すという特徴をも有している。最も深刻な副作用は、強い腎毒性による腎不全などの腎臓機能の障害であり、投与上の大きな問題点とされている。かような腎臓障害は尿量が減少したときに発現しやすいことから、点滴によって水分を摂ったり、利尿剤を使用して尿量を増やしたりすることで、腎毒性を軽減するなどの対策が必要とされている。また、多くの患者に見られる悪心・嘔吐や食欲不振などの消化器症状に関しても、他の抗がん剤と比べてかなり強く発現することが知られている。このような消化器症状に対しては、主に制吐剤を併用することによって対応しているのが現状である。
【0007】
ところで、白金と同様に重金属であるカドミウムは、出生時にはほとんど体内に蓄積されていない。しかし、加齢に伴い徐々に体内に蓄積され、体内蓄積の50〜70%が肝臓と腎臓に認められる。濃度としては腎臓への蓄積が最も多く、一定の蓄積量(濃度)を超えると、腎機能への影響が発現する。さらに、最近ではカドミウムが骨粗鬆症の発症要因として関連しているとの報告もなされている。
【0008】
一方、シスプラチンとは異なるタイプの金属錯体として、ホスト分子に金属が包接されてなる包接錯体が知られている。包接錯体を構成するホスト分子としては、クラウンエーテル、シクロデキストリンなどが古くから知られていたが、近年、フェノールの2,6−位が連結基を介して複数個環状に連結されてなるオリゴマーであるカリックスアレーンが、新たなホスト分子として提案されている。そして、新世代のカリックスアレーンとして、連結基が硫黄原子を含む「チアカリックスアレーン」が開発され、水処理等の種々の用途への適用が検討されている。このチアカリックスアレーンをホスト分子とした包接錯体も提案されている(例えば、特許文献1を参照)。ただし、特許文献1において開示されているのは当該包接錯体のガス貯蔵体としての用途であり、かような包接錯体が抗がん剤としても機能しうることについては、いまだ知られていない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2008−308470号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、シスプラチンなどの従来の抗がん剤と比較して副作用が低減された抗がん剤を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、従来の技術における上述したような問題点に鑑み、鋭意検討を行なった。その結果、チアカリックスアレーンをホスト分子とする有機金属錯体が抗がん作用を示し、しかも、正常細胞に対しては毒性を示さないことを確認した。本発明は、かような知見に基づきなされたものである。すなわち、本発明は、下記化学式1:
【0012】
【化2】

【0013】
式中、
Xは、それぞれ独立して、水素原子、炭化水素基またはアシル基であり
Yは、それぞれ独立して、水素原子、炭化水素基、ハロゲン化炭化水素基、−COR1、−OR2、−COOR3、−CN、−CONH2、−NO2、−NR4R5、ハロゲン原子、−OSO3R6、または−SO3R7であり(この際、R1、R2、R3、R4、R5、R6、およびR7は、それぞれ独立して、水素原子または炭化水素基である)、
Zは、それぞれ独立して、スルフィド基、スルフィニル基、またはスルホニル基であり、
nは、3〜20の整数であり、
mは、それぞれ独立して、1〜7の整数である。
で表される環状フェノール硫化物と金属とからなる有機金属錯体を有効成分として含有することを特徴とする、抗がん剤である。
【発明の効果】
【0014】
本発明によれば、シスプラチンなどの従来の抗がん剤と比較して副作用が低減された抗がん剤が提供されうる。
【図面の簡単な説明】
【0015】
【図1】実施例においてTC4A−Cdの細胞毒性を評価した結果を示すグラフである。具体的には、図1は、Juakat細胞の生存率のグラフである。
【図2】実施例においてTC4A−Cdの細胞毒性を評価した結果を示すグラフである。具体的には、図2は、FLC−4細胞の生存率のグラフである。
【図3】実施例においてTC4A−Cdのマウスでの急性毒性を評価した結果を示すグラフである。具体的には、図3は、投与後2週間の観察におけるマウスの生存曲線を示すグラフである。
【図4】TC4A−Cd投与群(A−1〜A−4)および生理食塩水投与群(C−1〜C−4)のそれぞれのマウスから摘出された腫瘍を撮影した写真である。
【図5】TC4A−Cd投与群(A−1〜A−4)および生理食塩水投与群(C−1〜C−4)のそれぞれのマウスから摘出された腫瘍の重量の平均値を示すグラフである。
【発明を実施するための形態】
【0016】
以下、本発明を実施するための具体的な形態について詳細に説明するが、本発明の技術的範囲は下記の具体的な形態のみに限定されるわけではない。
【0017】
本発明の一形態は、下記化学式1:
【0018】
【化3】

【0019】
で表される環状フェノール硫化物と金属とからなる有機金属錯体を有効成分として含有することを特徴とする、抗がん剤である。
【0020】
本形態の抗がん剤は、有効成分として、所定の有機金属錯体を含有する。この有機金属錯体は、化学式1で表される環状フェノール硫化物と金属とからなる。具体的には、この有機金属錯体は、当該環状フェノール硫化物に当該金属が包接されてなる構成を有する。ここではまず、化学式1で表される環状フェノール硫化物の具体的な形態について、詳細に説明する。
【0021】
化学式1において、Xは、それぞれ独立して、水素原子、炭化水素基またはアシル基である。ここで、Xについて「それぞれ独立して」とあるのは、後述するようにnは3以上の整数であることから、化学式1の環状フェノール硫化物は分子中に複数のXを含むこととなり、この複数のXが互いに同一であってもよいし、異なっていてもよいことを意味する趣旨である。このことは、後述する符号(Y、Z、m)についても同様である。
【0022】
Xが炭化水素基である場合において、かような炭化水素基の炭素数について特に制限はなく、好ましくは1〜50であり、より好ましくは1〜20であり、さらに好ましくは1〜12であり、いっそう好ましくは1〜8であり、特に好ましくは1〜4であり、最も好ましくは1〜2である。
【0023】
かような炭化水素基としては、例えば、飽和脂肪族炭化水素基、不飽和脂肪族炭化水素基、脂環式炭化水素基、脂環式−脂肪族炭化水素基、芳香族炭化水素基、芳香族−脂肪族炭化水素基などが挙げられる。飽和脂肪族炭化水素基の具体例としては、例えば、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、tert−ブチル、、n−ペンチル、イソペンチル、ネオペンチル、tert−ペンチル、2−メチルブチル、n−ヘキシル、イソヘキシル、3−メチルペンチル、エチルブチル、n−ヘプチル、2−メチルヘキシル、n−オクチル、イソオクチル、tert−オクチル、2−エチルヘキシル、3−メチルヘプチル、n−ノニル、イソノニル、1−メチルオクチル、エチルヘプチル、n−デシル、1−メチルノニル、n−ウンデシル、1,1−ジメチルノニル、n−ドデシル、n−テトラデシル、n−ヘプタデシル、n−オクタデシル、およびエチレンやプロピレン、ブチレンの重合物またはそれらの共重合物からなる基などが挙げられる。また、不飽和脂肪族炭化水素基の具体例としては、例えば、ビニル、アリル、イソプロペニル、2−ブテニル、2−メチルアリル、1,1−ジメチルアリル、3−メチル−2−ブテニル、3−メチル−3−ブテニル、4−ペンテニル、ヘキセニル、オクテニル、ノネニル、デセニル基、およびアセチレンやブタジエン、イソプレンなどの重合物またはそれらの共重合物からなる基などが挙げられる。さらに、脂環式炭化水素基の具体例としては、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、3−メチルシクロヘキシル、4−メチルシクロヘキシル、4−エチルシクロヘキシル、2−メチルシクロオクチル、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニル、シクロヘプテニル、シクロオクテニル、4−メチルシクロヘキセニル、4−エチルシクロヘキセニル基などが挙げられる。また、脂環式−脂肪族炭化水素基の具体例としては、例えば、シクロプロピルエチル、シクロブチルエチル、シクロペンチルエチル、シクロヘキシルメチル、シクロヘキシルエチル、シクロヘプチルメチル、シクロオクチルエチル、3−メチルシクロヘキシルプロピル、4−メチルシクロヘキシルエチル、4−エチルシクロヘキシルエチル、2−メチルシクロオクチルエチル、シクロプロペニルブチル、シクロブテニルエチル、シクロペンテニルエチル、シクロヘキセニルメチル、シクロヘプテニルメチル、シクロオクテニルエチル、4−メチルシクロヘキセニルプロピル、4−エチルシクロヘキセニルペンチル基などが挙げられる。さらに、芳香族炭化水素基の具体例としては、例えば、フェニル、ナフチルなどのアリール基;4−メチルフェニル、3,4−ジメチルフェニル、3,4,5−トリメチルフェニル、2−エチルフェニル、n−ブチルフェニル、tert−ブチルフェニル、アミルフェニル、ヘキシルフェニル、ノニルフェニル、2−tert−ブチル−5−メチルフェニル、シクロヘキシルフェニル、クレジル、オキシエチルクレジル、2−メトキシ−4−tert−ブチルフェニル、ドデシルフェニルなどのアルキルアリール基などが挙げられる。また、芳香族−脂肪族炭化水素基の具体例としては、例えば、ベンジル、1−フェニルエチル、2−フェニルエチル、2−フェニルプロピル、3−フェニルプロピル、4−フェニルブチル、5−フェニルペンチル、6−フェニルヘキシル、1−(4−メチルフェニル)エチル、2−(4−メチルフェニル)エチル、2−メチルベンジル、1,1ージメチルー2ーフエニルエチル基などが挙げられる。
【0024】
続いて、Xがアシル基である場合において、かようなアシル基の炭素数について特に制限はなく、好ましくは1〜50であり、より好ましくは1〜20であり、さらに好ましくは1〜12であり、いっそう好ましくは1〜8であり、特に好ましくは1〜4であり、最も好ましくは1〜2である。アシル基の具体例としては、例えば、ホルミル、アセチル、プロピオニル、ブチリル、イソブチリル、バレリル、イソバレリル、オキサリル、サクシニル、ピバロイル、ステアロイル、ベンゾイル、フェニルプロピオニル、トルオイル、ナフトイル、フタロイル、インダンカルボニル、p−メチルベンゾイル、シクロヘキシルカルボニル基などが挙げられる。
【0025】
化学式1において、Xは、好ましくは水素原子または炭化水素基であり、より好ましくは水素原子または炭素数1〜12の炭化水素基であり、より好ましくは水素原子または炭素数1〜8の炭化水素基であり、いっそう好ましくは水素原子または炭素数1〜4の炭化水素基であり、特に好ましくは水素原子または炭素数1〜2の炭化水素基であり、最も好ましくは水素原子である。つまり、−OX基はヒドロキシ基(−OH基)であることが最も好ましい。
【0026】
化学式1において、Yは、それぞれ独立して、水素原子、炭化水素基、ハロゲン化炭化水素基、−COR1、−OR2、−COOR3、−CN、−CONH2、−NO2、−NR4R5、ハロゲン原子、−OSO3R6、または−SO3R7である。
【0027】
ここで、Yが炭化水素基である場合、その定義は上述したXにおける炭化水素基と同様であり、好ましい形態も同様である。また、Yが−COR1基である場合、その定義は上述したXにおけるアシル基と同様であり、好ましい形態も同様である。また、Yがハロゲン化炭化水素基である場合、その定義は上述したXにおける炭化水素基にハロゲン原子(F、Cl、BrまたはI)が置換したものであり、好ましい形態もXの具体的な形態に対応する。
【0028】
Yの定義におけるR1、R2、R3、R4、R5、R6、およびR7は、それぞれ独立して、水素原子または炭化水素基である。これらの定義における炭化水素基もまた、上述したXにおける炭化水素基と同様であり、好ましい形態も同様である。なお、当該炭化水素基は、−COR1、−OR2、−COOR3、−CN、−CONH2、−NO2、−NR4R5、ハロゲン原子、−OSO3R6、または−SO3R7などの官能基により置換されていてもよい。また、当該炭化水素基が置換される場合において、置換基は、1種でもよいし、2種以上でもよく、また単一でもよいし、2個以上の複数でもよい。また、Yがカルボキシ基(−COOH基)や−OSO3H基、スルホン酸基(−SO3H)などである場合、これらの基はアニオン形態であってもよい。換言すれば、Yは塩の形態をとりうる。
【0029】
化学式1において、Yは、好ましくは−CN、−CONH2、−NO2、−NR4R5、または−SO3R6もしくはその塩であり、最も好ましくはスルホン酸基(−SO3H)またはその塩である。Yがこれらの形態であると、環状フェノール硫化物が水溶性となりうるため、好ましい。
【0030】
化学式1において、Zは、それぞれ独立して、スルフィド基(−S−)、スルフィニル基(−SO−)、またはスルホニル基(−SO2−)である。中でも好ましくは、スルフィド基またはスルフィニル基であり、最も好ましくはスルフィド基である。
【0031】
化学式1において、mは、それぞれ独立して、1〜7の整数である。mは、好ましくは1〜5の整数であり、さらに好ましくは1〜3の整数であり、特に好ましくは1である。最も好ましい形態では、すべてのmが1である。
【0032】
化学式1において、nは、3〜20の整数であり、好ましくは4〜16であり、さらに好ましくは4〜12であり、いっそう好ましくは4〜8であり、非常に好ましくは4、6、または8であり、特に好ましくは4または6であり、最も好ましくは4である。
【0033】
続いて、本形態の抗がん剤の有効成分である有機金属錯体を構成する金属について説明する。この金属は、化学式1で表される環状フェノール硫化物に包接されることができ、がん細胞との接触によって抗がん作用または制がん作用を示すことができるものであれば特に制限されない。かような金属としては、例えば、白金族金属、遷移金属、または希土類金属が挙げられる。なかでも、白金族金属または遷移金属が好ましく、具体的には、カドミウム、白金、銅、亜鉛、ニッケル、コバルト、鉄、セリウム、ランタン、またはチタンが好ましい。高い抗がん作用を発揮しうるという観点からは、より好ましくはカドミウムまたは白金であり、最も好ましくはカドミウムである。これらの金属は1種のみが単独で用いられてもよいし、2種以上が併用されてもよいが、好ましくは1種のみが単独で用いられる。
【0034】
本形態の抗がん剤を構成する有機金属錯体において、環状フェノール硫化物と錯体を構成する(当該硫化物に包接される)金属原子のモル数は特に制限されない。この値は、環状フェノール硫化物におけるnの値や包接される金属原子の種類(価数)などに応じて変動しうるため、一義的には規定しづらいが、一例として、環状フェノール硫化物1モルに対して、金属原子が好ましくは1〜10モルであり、より好ましくは1〜8モルであり、特に好ましくは1〜6モルであり、最も好ましくは1〜2モルである。
【0035】
本形態の抗がん剤を構成する有機金属錯体の製造方法について特に制限はなく、従来公知の知見が適宜参照されうる。一例としては、化学式1で表される環状フェノール硫化物(チアカリックスアレーンとして知られている)と上述した金属(例えば、塩化物、炭酸塩、硫酸塩などの塩の形態で提供されうる)とを溶媒中で接触させて、硫化物に金属を包接させることができる。場合によっては、本形態に係る有機金属錯体を構成する金属とは異なる金属が包接されてなる他の錯体と、最終的に包接を希望する金属とを同様に溶媒中で接触させて、所望の有機金属錯体を得ることもできる(後述する実施例を参照)。なお、溶媒中で得られた有機金属錯体については、再結晶−濾過などの常法に従って精製することができる。
【0036】
有機金属錯体を構成する環状フェノール硫化物の入手経路についても特に制限はなく、市販品が存在する場合には当該市販品を購入することにより用いてもよい。場合によっては、従来公知の知見を参照しつつ、自ら合成することによって入手することも可能である。本形態に係る有機金属錯体を構成する環状フェノール硫化物を自ら合成する手法について特に制限はないが、例えば、対応するフェノール化合物と単体硫黄とを、アルカリ金属試薬またはアルカリ土類金属試薬の存在下反応させることにより、製造が可能である。
【0037】
ここではまず、化学式1におけるフェノール部位に対応するフェノール化合物(互いにパラ位にヒドロキシ基(−OH基)とY基が結合したものであって、Y基が水素原子または炭化水素基であるもの)を原料として準備する。そして当該フェノール化合物を、単体硫黄と反応させる。
【0038】
この際、フェノール化合物と単体硫黄との原料仕込比は特に制限されないが、フェノール化合物1グラム当量に対し、単体硫黄が0.1グラム当量以上であるとよく、好ましくは0.35グラム当量以上である。単体硫黄の原料仕込比の上限についても特に制限はないが、フェノール化合物1グラム当量に対し、20グラム当量以下が好ましく、10グラム当量以下がより好ましい。
【0039】
反応に用いられるアルカリ金属試薬としては、例えば、アルカリ金属単体、水素化アルカリ金属、水酸化アルカリ金属、炭酸アルカリ金属、アルカリ金属アルコキシド、ハロゲン化アルカリ金属などが挙げられる。また、アルカリ土類金属試薬としては、例えば、アルカリ土類金属単体、水素化アルカリ土類金属、水酸化アルカリ土類金属、酸化アルカリ土類金属、炭酸アルカリ土類金属、アルカリ土類金属アルコキシド、ハロゲン化アルカリ土類金属などが挙げられる。これらのうち、アルカリ金属試薬としては、アルカリ金属単体、水素化アルカリ金属、水酸化アルカリ金属、炭酸アルカリ金属、アルカリ金属アルコキシドが好ましく、アルカリ土類金属試薬としては、アルカリ土類金属単体、水素化アルカリ土類金属、水酸化アルカリ土類金属、酸化アルカリ土類金属、炭酸アルカリ土類金属、アルカリ土類金属アルコキシドが好ましい。アルカリ金属試薬の具体例としては、例えば、リチウム金属単体、ナトリウム金属単体、カリウム金属単体、水素化リチウム、水素化ナトリウム、水素化カリウム、水酸化リチウム、水酸化ナトリウム、水酸化カリウム、水酸化ルビジウム、水酸化セシウム、炭酸リチウム、炭酸ナトリウム、炭酸カリウム、炭酸ルビジウム、炭酸セシウム、リチウムブトキシド、リチウムエトキシド、ナトリウムブトキシド、ナトリウムエトキシド、カリウムブトキシド、カリウムエトキシドなどが挙げられる。また、アルカリ土類金属試薬の具体例としては、例えば、マグネシウム金属単体、カルシウム金属単体、水素化カルシウム、酸化マグネシウム、酸化ストロンチウム、酸化カルシウム、酸化バリウム、水酸化マグネシウム、水酸化ストロンチウム、水酸化カルシウム、水酸化バリウム、炭酸カルシウム、炭酸ストロンチウム、炭酸バリウム、マグネシウムブトキシド、マグネシウムエトキシドなどが挙げられる。これらの金属試薬は、1種が単独で用いられてもよいし、2種以上が併用されてもよい。金属試薬の使用量は、フェノール化合物1グラム当量に対し0.005グラム当量以上であるとよく、好ましくは0.01グラム当量以上である。一方、金属試薬の使用量の上限について特に制限はないが、好ましくは10グラム当量以下であり、特に好ましくは5グラム当量以下である。
【0040】
この反応は、不活性ガス雰囲気下で行なうことが好ましい。この際、不活性ガスとしては、例えば、窒素、アルゴン、ヘリウムなどが挙げられる。また、この反応は、反応時に生成する水および硫化水素を除去しつつ行なうことが好ましい。なお、反応時に生成する硫化水素を除去するためには、不活性ガス気流下で反応を行なうことが好ましい。この反応の反応温度は特に制限されないが、80℃以上が好ましく、100℃以上がより好ましい。また、反応温度の上限についても特に制限はなく、好ましくは300℃以下であり、より好ましくは280℃以下である。なお、この反応の反応時間は、通常1〜24時間程度である。
【0041】
反応には、必要に応じて溶媒を使用することが好ましい。溶媒は特に制限されないが、例えば、ヘキサデカン等の脂肪族炭化水素類;シメンやプソイドクメンなどの芳香族炭化水素;ジフェニルエーテル、ヘキシルエーテル、トリエチレングリコールジエチルエーテル、テトラエチレングリコールジメチルエーテル等のエーテル類;ジフェニルスルフィドなどのスルフィド類;エチレングリコール、ジエチレングリコールなどの二価アルコール類;これらの混合物などが挙げられる。なお、反応原料を均一化するために、反応当初に水を加えてもよい。反応の反応混合物を硫酸水溶液や塩酸水溶液などの酸性水溶液で加水分解することにより、反応生成物が得られる。反応生成物が2種以上の環状フェノール硫化物の混合物である場合には、通常の分離手段(例えば、カラムクロマトグラフィー、再結晶法など)によって、分離・精製することができる。
【0042】
上述した反応によって、化学式1において、Xが水素原子であり、Yが水素原子または炭化水素基である環状フェノール硫化物が得られる。その他の符号(Z、m、n)については、上述したとおりである。このZ、m、およびnについては、上述した反応の反応条件を適宜調整することによって、制御可能である。
【0043】
上記で生成した環状フェノール硫化物におけるヒドロキシ基を構成する水素原子を、化学式1における−OX基を構成するX(水素原子以外のもの)へと変換させることができる。例えば、当該ヒドロキシ基の水素原子を、アセチルクロライドや無水酢酸などのアシル化剤によって、アシル基へと変換させることができる。また、当該ヒドロキシ基の水素原子をアルカリ金属に置換し、これをハロゲン化炭化水素と反応させるウイリアムソン反応によって、炭化水素基へと変換させることができる。
【0044】
一方、上記で生成した環状フェノール硫化物における基Yを、化学式1におけるY(水素原子または炭化水素基以外のもの)へと変換させることができる。例えば、生成した環状フェノール硫化物における基Yがアルキル基である場合には、当該環状フェノール硫化物を塩化アルミニウム、コバルト酸化物触媒などと接触させることにより脱アルキル化し、Yを水素原子へと変換することができる。また、この脱アルキル化した環状フェノール硫化物に、ニトロ四フッ化ボロンや硝酸などの適当なニトロ化剤を作用させることにより、Yをニトロ基へと変換することができる。さらに、ニトロ基を鉄/塩酸などの適当な還元剤を用いて還元することにより、アミノ基へと変換することができる。また、さらに亜硝酸ナトリウムなどを用いてジアゾ化し、これを塩酸などの存在下、塩化銅などの適当なハロゲン化剤、シアノ化剤または水を作用させることにより、それぞれハロゲン原子、シアノ基またはヒドロキシ基へと変換させることができる。また、このヒドロキシ基は、硫酸などの硫酸エステル化剤の作用により、酸性硫酸エステル基へと変換することができる。さらに、ヒドロキシ基は、ナトリウムなどのアルカリ金属フェノキシドを経由して、ハロゲン化アルキルを作用させることにより、アルキルエーテルへと変換させることができる。
【0045】
一方、脱アルキル化した環状フェノール硫化物に発煙硫酸などを作用させることにより、スルホン酸基へと変換させることもできる。また、脱アルキル化した環状フェノール硫化物に、必要に応じてルイス酸などの触媒の共存下、酸ハロゲン化物を反応させることにより、アシル基へと変換させることもできる。さらに、環状アルキルフェノール硫化物を、過マンガン酸化合物などの適当な酸化剤を用いて酸化することにより、Yをカルボキシル基へと変換させることができる。得られたカルボン酸をアルコールと反応させることによりエステル基へと変換することもできるし、アミンと反応させることによりアミド基へと変換することもできる。
【0046】
本形態に係る有機金属錯体は、後述するように高い抗がん活性を有することから、抗がん剤として用いられうる。
【0047】
すなわち、本発明によれば、上述した有機金属錯体を有効成分として含有することを特徴とする抗がん剤が提供されるのである。
【0048】
本形態の抗がん剤が適用されるがんの種類は、特に限定されず、例えば、白血病、悪性黒色腫、悪性リンパ腫、消化器癌、肺癌、食道癌、胃癌、大腸癌、直腸癌、結腸癌、尿管腫瘍、胆嚢癌、胆管癌、胆道癌、乳癌、肝臓癌、膵臓癌、睾丸腫瘍、上顎癌、舌癌、口唇癌、口腔癌、咽頭癌、喉頭癌、卵巣癌、子宮癌、前立腺癌、甲状腺癌、脳腫瘍、カポジ肉腫、血管腫、真性多血症、神経芽腫、網膜芽腫、骨髄腫、膀胱腫、肉腫、骨肉腫、筋肉腫、皮膚癌、基底細胞癌、皮膚付属器癌、皮膚転移癌、皮膚黒色腫などが挙げられる。なかでも、本形態の抗がん剤は、白血病の治療に特に有用である。また、悪性腫瘍のみならず、良性腫瘍への適用も可能である。また、本形態の抗がん剤は、癌転移を抑制するために使用されることができ、特に、術後の癌転移抑制剤としても有用である。
【0049】
本形態の抗がん剤を使用するにあたっては、種々の形態でヒトまたは動物に(特に好ましくはヒトに)、本形態の抗癌剤を投与することができる。本形態の抗がん剤の投与形態としては、経口投与でもよいし、静脈内、筋肉内、皮下または皮内等への注射、直腸内投与、経粘膜投与などの非経口投与でもよい。経口投与に適する製剤形態としては、例えば、錠剤、丸剤、顆粒剤、散剤、カプセル剤、液剤、懸濁剤、乳剤、シロップ剤などが挙げられる。また、非経口投与に適する医薬組成物としては、例えば、注射剤、点滴剤、点鼻剤、噴霧剤、吸入剤、坐剤等の外用固形剤、または、軟膏、クリーム、粉状塗布剤、液状塗布剤、貼付剤等の経皮吸収剤などが挙げられる。さらに、本形態の抗がん剤の製剤形態としては、埋め込み用ペレットや公知の技術により調製される持続性製剤が挙げられる。
【0050】
好ましい投与形態や製剤形態等は、患者の年齢、性別、体質、症状、処置時期等に応じて、医師によって適宜選択される。
【0051】
本形態の抗がん剤が、錠剤、丸剤、散剤、粉剤、顆粒剤などの固形製剤である場合、これらの固形製剤は、本形態に係る有機金属錯体を、常法に従って適当な添加剤、例えば、乳糖、ショ糖、D−マンニトール、トウモロコシデンプン、合成もしくは天然ガム、結晶セルロース等の賦形剤、デンプン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、アラビアゴム、ゼラチン、ポリビニルピロリドン等の結合剤、カルボシキメチルセルロースカルシウム、カルボシキメチルセルロースナトリウム、デンプン、コーンスターチ、アルギン酸ナトリウム等の崩壊剤、タルク、ステアリン酸マグネシウム、ステアリン酸ナトリウム、ステアリン酸カルシウム等の滑沢剤、炭酸カルシウム、炭酸ナトリウム、リン酸カルシウム、リン酸ナトリウム等の充填剤または希釈剤等と適宜混合することにより、製造されうる。錠剤等には、必要に応じて、ヒドロキシプロピルメチルセルロース、白糖、ポリエチレングリコール、酸化チタン等のコーティング剤を用いて、糖衣、ゼラチン、腸溶被覆、フイルムコーティングなどが施されてもよい。
【0052】
本形態の抗がん剤が、注射剤、点眼剤、点鼻剤、吸入剤、噴霧剤、ローション剤、シロップ剤、液剤、懸濁剤、乳剤等の液状製剤である場合、これらの液状製剤は、本形態に係る有機金属錯体に、精製水、リン酸緩衝液等の適当な緩衝液、生理的食塩水、リンゲル溶液、ロック溶液等の生理的塩類溶液、カカオバター、ゴマ油、オリーブ油等の植物油、鉱油、高級アルコール、高級脂肪酸、エタノール等の有機溶媒等に溶解して、必要に応じてコレステロール等の乳化剤、アラビアゴム等の懸濁剤、分散助剤、浸潤剤、ポリオキシエチレン硬化ヒマシ油系、ポリエチレングリコール系等の界面活性剤、リン酸ナトリウム等の溶解補助剤、糖、糖アルコール、アルブミン等の安定化剤、パラベン等の保存剤、塩化ナトリウム、ブドウ糖、グリセリン等の等張化剤、緩衝剤、無痛化剤、吸着防止剤、保湿剤、酸化防止剤、着色剤、甘味料、フレーバー、芳香物質等を適宜添加することにより、滅菌された水溶液、非水溶液、懸濁液、リポソームまたはエマルジョン等として調製されうる。この際、注射剤は、生理学的なpHを有することが好ましく、6〜8の範囲内のpHを有することが特に好ましい。
【0053】
本形態の抗がん剤が、ローション剤、クリーム剤、軟膏等の半固形製剤の場合、これらの半固形製剤は、本形態に係る有機金属錯体を脂肪、脂肪油、ラノリン、ワセリン、パラフィン、蝋、硬膏剤、樹脂、プラスチック、グリコール類、高級アルコール、グリセリン、水、乳化剤、懸濁化剤等と適宜混和することにより、製造されうる。
【0054】
本形態の抗がん剤における、本形態に係る有機金属錯体の含有量は、投与形態、重篤度や所望の投与量などに応じて変動しうるが、一般的には、本形態の抗がん剤の全質量に対して、0.001〜80質量%、好ましくは0.1〜50質量%である。
【0055】
本形態の抗がん剤の投与量は、例えば患者の年齢、性別、体重、症状、および投与経路などの条件に応じて、医師により適宜決定されうる。一般的には、成人一日あたりの有効成分の量として1μg/kgから1,000mg/kg程度の範囲であり、好ましくは10μg/kgから10mg/kg程度の範囲である。かような投与量の抗がん剤は、一日一回で投与されてもよいし、一日数回(例えば、2〜4回程度)に分けて投与されてもよい。
【0056】
本形態の抗がん剤を使用するにあたっては、既知の化学療法、外科的治療法、放射線療法、温熱療法や免疫療法などと併用されてもよい。
【0057】
本形態の抗がん剤は、後述する実施例において示されるように、正常機能を有するヒトの細胞に対して細胞死の誘導などの悪影響を及ぼす虞が極めて少ない。このため、本発明によれば、重篤な副作用が問題となっているシスプラチンなどの他の金属含有抗がん剤と比較して、副作用が低減された抗がん剤が提供されうる。
【実施例】
【0058】
(有機金属錯体の合成)
まず、文献(Iki et al.,Chemistry Letters,1998,p.625−626)に記載の手法に従って、下記化学式:
【0059】
【化4】

【0060】
で表されるスルホン化チアカリックス[4]アレーン−Na錯体(TC4A−Na:分子量904.83)を合成した。このTC4A−Naは、4つのヒドロキシ基が互いに水素結合を介して固定されることにより、以下に示すようなお椀形の構造を有する。そしてその構造から、金属(Me)を包接するためのホスト分子として機能しうる。
【0061】
【化5】

【0062】
上記で合成したTC4A−Na 0.200g(0.22mmol)と、酢酸カドミウム二水和物(Cd(CH3COO)2・2H2O)59mg(0.22mmol)とを、イオン交換水(5mL)中に溶解させ、30分間加熱還流させた。次いで、水を減圧下で留去し、120℃にて減圧乾燥後、白色の固体を得た(収量:0.165g)。得られた化合物の同定については、IRにより行なった(IR(KBr):3449(O−H)、2360(C−H)、1186(SO3−)、1041(SO3−))。また、原子吸光光度法により分析したところ、得られた化合物1モル中にはNaが2モル、Cdが1モル含まれることが判明した。よって、得られた化合物(TC4A−Cd)の構造は、下記化学式:
【0063】
【化6】

【0064】
で表されるものと考えられる。なお、上記化学式に示す繰り返し単位は実際にはランダムに位置しており、上記化学式に示す順序に固定されているわけではない。
(細胞内でのCdの蓄積)
ヒトT細胞白血病由来Jurkat細胞株を培養している培地中にTC4A−Cdを投与した際の細胞内へのCdの蓄積を評価した。なお、Jurkat細胞株の培養については、RPMI/1640培地を用いて、5%CO2下、37℃で行なった。
【0065】
蓄積評価は、具体的には、まず、培地中に10μMのTC4A−CdまたはCdCl2をそれぞれ投与し、37℃にて12時間インキュベートした。その後、細胞内のCd2+濃度を原子吸光光度法により測定した。その結果を下記の表1に示す。表1に示すように、いずれの投与群においても、細胞内にCdが蓄積していた。
【0066】
【表1】

【0067】
(TC4A−Cdの細胞毒性)
Jurkat細胞および正常な肝機能を保持しているヒト肝がん由来細胞株であるFLC−4細胞に対するTC4A−Cd、CdCl2、およびTC4A−Naの細胞毒性を測定した。具体的には、それぞれの投与群について0.01μM、0.1μM、1μM、10μM、100μM、1000μMの濃度で投与を行い、MTTアッセイを用いて測定を行なった。具体的には、上記処理後72時間さらにインキュベーションを行った後、培地に5.5mg/mL濃度のMTT(3−[4,5−ジメチルチアゾール−2−イル]−2,5−ジフェニルテトラゾリウムブロマイド)を10μL添加し、37℃にて4時間インキュベートした。その後、抽出溶液(40%N,N−ジメチルホルムアミド、2%酢酸、20%SDS、および0.03N HCl)90μLを添加し、室温にて2時間インキュベートした。そして、マイクロプレートリーダー(モデル550、バイオラッド社製)により波長570nmにおける吸光度を測定することで、細胞の増殖(生存率)を評価した。
【0068】
それぞれの投与群についての添加濃度に対するJurkat細胞およびFLC−4細胞の生存率のグラフを、それぞれ図1および図2に示す。また、得られた結果から算出される、それぞれの細胞株の細胞死に対するTC4A−CdおよびCdCl2のIC50の値、並びにその特異性を、下記の表2に示す。
【0069】
【表2】

【0070】
図1および表2に示すように、TC4A−CdのJurkat細胞の細胞死に対するIC50は、6.9μMであった。この値は、種々のがん細胞に対するシスプラチンのIC50の値(1.9〜8.1μM)とほぼ同様であることから、TC4A−Cdは、がん細胞に対する細胞死の強い促進作用を示すことが示された。ここで、TC4A−CdのIC50はCdCl2のそれとほぼ等しいことから、TC4A−CdはJurkat細胞に効率よく取り込まれた後、細胞内でCdを徐放することで細胞死促進作用を発揮するものと思われる。なお、図1および表2に示すように、Cdを包接していないTC4A−NaのIC50は1mM以上であり、細胞死促進作用は観察されなかった。
【0071】
一方、図2および表2に示すように、正常な肝機能を保持しているヒト肝がん由来細胞株であるFLC−4細胞に対しては、TC4A−Cdによる細胞死の促進作用は観察されなかった。したがって、TC4A−Cdは、ヒトの正常細胞に対しては細胞死を引き起こすことなく、がん細胞(特に、白血病細胞)に対して特異的に作用し、抗がん作用を示すものと考えられる。
【0072】
(マウスでの急性毒性)
7週齢の雄のC57BL/6Nマウス(21匹)に、TC4A−Cd、CdCl2、および生理食塩水をそれぞれ図3に示す量で1回/週の頻度で腹腔内注射した。その後、2週間観察した。2週間の観察におけるマウスの生存曲線を図3に示す。
【0073】
図3に示すように、44μmol/kg体重を投与した場合、TC4A−Cd投与群では3例すべてが死亡し、CdCl2投与群でも3例中2例が死亡した。一方、13μmol/kg体重以下の投与量ではTC4A−Cd投与群、CdCl2投与群のいずれも全例生存しており、体重の顕著な減少は見られなかった。
【0074】
以上の結果、上記で観察された腫瘍縮小効果が見られたTC4A−Cdの腹腔内投与量(13μmol/kg体重)では、安全であることが判明した。
【0075】
(マウス皮下移植したJurkat細胞に対するTC4A−Cdの抗腫瘍効果)
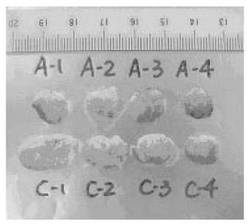
5×108細胞/mL濃度のJurkat細胞の浮遊液100μLを、Scidマウスの背部の皮下に異種移植した。20日間飼育した後、TC4A−Cd、CdCl2、および生理食塩水のそれぞれを腹腔内注射した。この際、各投与群の投与量は、TC4A−CdおよびCdCl2が13μmol/kg体重であり、生理食塩水が100μLであった。また、投与は週3回×2週間行ない、初回投与から2週間後にマウスを犠牲死させて、腫瘍のサイズおよび重量を測定した。その結果を図4および図5に示す。図4は、TC4A−Cd投与群(A−1〜A−4)および生理食塩水投与群(C−1〜C−4)のそれぞれのマウスから摘出された腫瘍を撮影した写真である。また、図5は、それぞれの腫瘍の重量の平均値を示すグラフである。図4および図5に示す結果から、TC4A−Cd投与群においては、Jurkat細胞株由来の腫瘍のサイズおよび重量が、ともに明らかに減少していることが示される。
【技術分野】
【0001】
本発明は、有機金属錯体を有効成分として含有する抗がん剤に関する。
【背景技術】
【0002】
金属錯体を有効成分として含有する抗がん剤として、「白金製剤(プラチナ製剤)」に分類されるシスプラチンが知られている。シスプラチンは、下記化学式で表されるように、白金錯体としての構造を有する。
【0003】
【化1】

【0004】
このシスプラチンは、塩素原子を介して、がん細胞に含まれるDNAの構成塩基であるグアニンやアデニンのN−7位に結合する。これによりDNA鎖内には架橋が形成され、DNAの複製が阻害される結果、がん細胞の分裂・増殖が抑制され、がん細胞は死滅に至る。
【0005】
シスプラチンは、1965年、アメリカのローゼンバーグ博士によって細菌の増殖を抑制する抗菌薬として発見され、その後、抗腫瘍効果が確認されてがん治療に用いられるようになった。日本におけるシスプラチンの適応症は、睾丸腫瘍、膀胱がん、腎盂・尿管腫瘍、前立腺がん、卵巣がん、頭頸部がん、非小細胞肺がん、食道がん、子宮頸がん、神経芽細胞腫、胃がん、小細胞肺がん、骨肉腫、胚細胞腫瘍、悪性リンパ腫など、非常に広い範囲に及んでいる。
【0006】
このように、シスプラチンは、高い腫瘍縮小効果を有するものの、激しい副作用を示すという特徴をも有している。最も深刻な副作用は、強い腎毒性による腎不全などの腎臓機能の障害であり、投与上の大きな問題点とされている。かような腎臓障害は尿量が減少したときに発現しやすいことから、点滴によって水分を摂ったり、利尿剤を使用して尿量を増やしたりすることで、腎毒性を軽減するなどの対策が必要とされている。また、多くの患者に見られる悪心・嘔吐や食欲不振などの消化器症状に関しても、他の抗がん剤と比べてかなり強く発現することが知られている。このような消化器症状に対しては、主に制吐剤を併用することによって対応しているのが現状である。
【0007】
ところで、白金と同様に重金属であるカドミウムは、出生時にはほとんど体内に蓄積されていない。しかし、加齢に伴い徐々に体内に蓄積され、体内蓄積の50〜70%が肝臓と腎臓に認められる。濃度としては腎臓への蓄積が最も多く、一定の蓄積量(濃度)を超えると、腎機能への影響が発現する。さらに、最近ではカドミウムが骨粗鬆症の発症要因として関連しているとの報告もなされている。
【0008】
一方、シスプラチンとは異なるタイプの金属錯体として、ホスト分子に金属が包接されてなる包接錯体が知られている。包接錯体を構成するホスト分子としては、クラウンエーテル、シクロデキストリンなどが古くから知られていたが、近年、フェノールの2,6−位が連結基を介して複数個環状に連結されてなるオリゴマーであるカリックスアレーンが、新たなホスト分子として提案されている。そして、新世代のカリックスアレーンとして、連結基が硫黄原子を含む「チアカリックスアレーン」が開発され、水処理等の種々の用途への適用が検討されている。このチアカリックスアレーンをホスト分子とした包接錯体も提案されている(例えば、特許文献1を参照)。ただし、特許文献1において開示されているのは当該包接錯体のガス貯蔵体としての用途であり、かような包接錯体が抗がん剤としても機能しうることについては、いまだ知られていない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2008−308470号公報
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、シスプラチンなどの従来の抗がん剤と比較して副作用が低減された抗がん剤を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、従来の技術における上述したような問題点に鑑み、鋭意検討を行なった。その結果、チアカリックスアレーンをホスト分子とする有機金属錯体が抗がん作用を示し、しかも、正常細胞に対しては毒性を示さないことを確認した。本発明は、かような知見に基づきなされたものである。すなわち、本発明は、下記化学式1:
【0012】
【化2】

【0013】
式中、
Xは、それぞれ独立して、水素原子、炭化水素基またはアシル基であり
Yは、それぞれ独立して、水素原子、炭化水素基、ハロゲン化炭化水素基、−COR1、−OR2、−COOR3、−CN、−CONH2、−NO2、−NR4R5、ハロゲン原子、−OSO3R6、または−SO3R7であり(この際、R1、R2、R3、R4、R5、R6、およびR7は、それぞれ独立して、水素原子または炭化水素基である)、
Zは、それぞれ独立して、スルフィド基、スルフィニル基、またはスルホニル基であり、
nは、3〜20の整数であり、
mは、それぞれ独立して、1〜7の整数である。
で表される環状フェノール硫化物と金属とからなる有機金属錯体を有効成分として含有することを特徴とする、抗がん剤である。
【発明の効果】
【0014】
本発明によれば、シスプラチンなどの従来の抗がん剤と比較して副作用が低減された抗がん剤が提供されうる。
【図面の簡単な説明】
【0015】
【図1】実施例においてTC4A−Cdの細胞毒性を評価した結果を示すグラフである。具体的には、図1は、Juakat細胞の生存率のグラフである。
【図2】実施例においてTC4A−Cdの細胞毒性を評価した結果を示すグラフである。具体的には、図2は、FLC−4細胞の生存率のグラフである。
【図3】実施例においてTC4A−Cdのマウスでの急性毒性を評価した結果を示すグラフである。具体的には、図3は、投与後2週間の観察におけるマウスの生存曲線を示すグラフである。
【図4】TC4A−Cd投与群(A−1〜A−4)および生理食塩水投与群(C−1〜C−4)のそれぞれのマウスから摘出された腫瘍を撮影した写真である。
【図5】TC4A−Cd投与群(A−1〜A−4)および生理食塩水投与群(C−1〜C−4)のそれぞれのマウスから摘出された腫瘍の重量の平均値を示すグラフである。
【発明を実施するための形態】
【0016】
以下、本発明を実施するための具体的な形態について詳細に説明するが、本発明の技術的範囲は下記の具体的な形態のみに限定されるわけではない。
【0017】
本発明の一形態は、下記化学式1:
【0018】
【化3】

【0019】
で表される環状フェノール硫化物と金属とからなる有機金属錯体を有効成分として含有することを特徴とする、抗がん剤である。
【0020】
本形態の抗がん剤は、有効成分として、所定の有機金属錯体を含有する。この有機金属錯体は、化学式1で表される環状フェノール硫化物と金属とからなる。具体的には、この有機金属錯体は、当該環状フェノール硫化物に当該金属が包接されてなる構成を有する。ここではまず、化学式1で表される環状フェノール硫化物の具体的な形態について、詳細に説明する。
【0021】
化学式1において、Xは、それぞれ独立して、水素原子、炭化水素基またはアシル基である。ここで、Xについて「それぞれ独立して」とあるのは、後述するようにnは3以上の整数であることから、化学式1の環状フェノール硫化物は分子中に複数のXを含むこととなり、この複数のXが互いに同一であってもよいし、異なっていてもよいことを意味する趣旨である。このことは、後述する符号(Y、Z、m)についても同様である。
【0022】
Xが炭化水素基である場合において、かような炭化水素基の炭素数について特に制限はなく、好ましくは1〜50であり、より好ましくは1〜20であり、さらに好ましくは1〜12であり、いっそう好ましくは1〜8であり、特に好ましくは1〜4であり、最も好ましくは1〜2である。
【0023】
かような炭化水素基としては、例えば、飽和脂肪族炭化水素基、不飽和脂肪族炭化水素基、脂環式炭化水素基、脂環式−脂肪族炭化水素基、芳香族炭化水素基、芳香族−脂肪族炭化水素基などが挙げられる。飽和脂肪族炭化水素基の具体例としては、例えば、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、tert−ブチル、、n−ペンチル、イソペンチル、ネオペンチル、tert−ペンチル、2−メチルブチル、n−ヘキシル、イソヘキシル、3−メチルペンチル、エチルブチル、n−ヘプチル、2−メチルヘキシル、n−オクチル、イソオクチル、tert−オクチル、2−エチルヘキシル、3−メチルヘプチル、n−ノニル、イソノニル、1−メチルオクチル、エチルヘプチル、n−デシル、1−メチルノニル、n−ウンデシル、1,1−ジメチルノニル、n−ドデシル、n−テトラデシル、n−ヘプタデシル、n−オクタデシル、およびエチレンやプロピレン、ブチレンの重合物またはそれらの共重合物からなる基などが挙げられる。また、不飽和脂肪族炭化水素基の具体例としては、例えば、ビニル、アリル、イソプロペニル、2−ブテニル、2−メチルアリル、1,1−ジメチルアリル、3−メチル−2−ブテニル、3−メチル−3−ブテニル、4−ペンテニル、ヘキセニル、オクテニル、ノネニル、デセニル基、およびアセチレンやブタジエン、イソプレンなどの重合物またはそれらの共重合物からなる基などが挙げられる。さらに、脂環式炭化水素基の具体例としては、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、3−メチルシクロヘキシル、4−メチルシクロヘキシル、4−エチルシクロヘキシル、2−メチルシクロオクチル、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニル、シクロヘプテニル、シクロオクテニル、4−メチルシクロヘキセニル、4−エチルシクロヘキセニル基などが挙げられる。また、脂環式−脂肪族炭化水素基の具体例としては、例えば、シクロプロピルエチル、シクロブチルエチル、シクロペンチルエチル、シクロヘキシルメチル、シクロヘキシルエチル、シクロヘプチルメチル、シクロオクチルエチル、3−メチルシクロヘキシルプロピル、4−メチルシクロヘキシルエチル、4−エチルシクロヘキシルエチル、2−メチルシクロオクチルエチル、シクロプロペニルブチル、シクロブテニルエチル、シクロペンテニルエチル、シクロヘキセニルメチル、シクロヘプテニルメチル、シクロオクテニルエチル、4−メチルシクロヘキセニルプロピル、4−エチルシクロヘキセニルペンチル基などが挙げられる。さらに、芳香族炭化水素基の具体例としては、例えば、フェニル、ナフチルなどのアリール基;4−メチルフェニル、3,4−ジメチルフェニル、3,4,5−トリメチルフェニル、2−エチルフェニル、n−ブチルフェニル、tert−ブチルフェニル、アミルフェニル、ヘキシルフェニル、ノニルフェニル、2−tert−ブチル−5−メチルフェニル、シクロヘキシルフェニル、クレジル、オキシエチルクレジル、2−メトキシ−4−tert−ブチルフェニル、ドデシルフェニルなどのアルキルアリール基などが挙げられる。また、芳香族−脂肪族炭化水素基の具体例としては、例えば、ベンジル、1−フェニルエチル、2−フェニルエチル、2−フェニルプロピル、3−フェニルプロピル、4−フェニルブチル、5−フェニルペンチル、6−フェニルヘキシル、1−(4−メチルフェニル)エチル、2−(4−メチルフェニル)エチル、2−メチルベンジル、1,1ージメチルー2ーフエニルエチル基などが挙げられる。
【0024】
続いて、Xがアシル基である場合において、かようなアシル基の炭素数について特に制限はなく、好ましくは1〜50であり、より好ましくは1〜20であり、さらに好ましくは1〜12であり、いっそう好ましくは1〜8であり、特に好ましくは1〜4であり、最も好ましくは1〜2である。アシル基の具体例としては、例えば、ホルミル、アセチル、プロピオニル、ブチリル、イソブチリル、バレリル、イソバレリル、オキサリル、サクシニル、ピバロイル、ステアロイル、ベンゾイル、フェニルプロピオニル、トルオイル、ナフトイル、フタロイル、インダンカルボニル、p−メチルベンゾイル、シクロヘキシルカルボニル基などが挙げられる。
【0025】
化学式1において、Xは、好ましくは水素原子または炭化水素基であり、より好ましくは水素原子または炭素数1〜12の炭化水素基であり、より好ましくは水素原子または炭素数1〜8の炭化水素基であり、いっそう好ましくは水素原子または炭素数1〜4の炭化水素基であり、特に好ましくは水素原子または炭素数1〜2の炭化水素基であり、最も好ましくは水素原子である。つまり、−OX基はヒドロキシ基(−OH基)であることが最も好ましい。
【0026】
化学式1において、Yは、それぞれ独立して、水素原子、炭化水素基、ハロゲン化炭化水素基、−COR1、−OR2、−COOR3、−CN、−CONH2、−NO2、−NR4R5、ハロゲン原子、−OSO3R6、または−SO3R7である。
【0027】
ここで、Yが炭化水素基である場合、その定義は上述したXにおける炭化水素基と同様であり、好ましい形態も同様である。また、Yが−COR1基である場合、その定義は上述したXにおけるアシル基と同様であり、好ましい形態も同様である。また、Yがハロゲン化炭化水素基である場合、その定義は上述したXにおける炭化水素基にハロゲン原子(F、Cl、BrまたはI)が置換したものであり、好ましい形態もXの具体的な形態に対応する。
【0028】
Yの定義におけるR1、R2、R3、R4、R5、R6、およびR7は、それぞれ独立して、水素原子または炭化水素基である。これらの定義における炭化水素基もまた、上述したXにおける炭化水素基と同様であり、好ましい形態も同様である。なお、当該炭化水素基は、−COR1、−OR2、−COOR3、−CN、−CONH2、−NO2、−NR4R5、ハロゲン原子、−OSO3R6、または−SO3R7などの官能基により置換されていてもよい。また、当該炭化水素基が置換される場合において、置換基は、1種でもよいし、2種以上でもよく、また単一でもよいし、2個以上の複数でもよい。また、Yがカルボキシ基(−COOH基)や−OSO3H基、スルホン酸基(−SO3H)などである場合、これらの基はアニオン形態であってもよい。換言すれば、Yは塩の形態をとりうる。
【0029】
化学式1において、Yは、好ましくは−CN、−CONH2、−NO2、−NR4R5、または−SO3R6もしくはその塩であり、最も好ましくはスルホン酸基(−SO3H)またはその塩である。Yがこれらの形態であると、環状フェノール硫化物が水溶性となりうるため、好ましい。
【0030】
化学式1において、Zは、それぞれ独立して、スルフィド基(−S−)、スルフィニル基(−SO−)、またはスルホニル基(−SO2−)である。中でも好ましくは、スルフィド基またはスルフィニル基であり、最も好ましくはスルフィド基である。
【0031】
化学式1において、mは、それぞれ独立して、1〜7の整数である。mは、好ましくは1〜5の整数であり、さらに好ましくは1〜3の整数であり、特に好ましくは1である。最も好ましい形態では、すべてのmが1である。
【0032】
化学式1において、nは、3〜20の整数であり、好ましくは4〜16であり、さらに好ましくは4〜12であり、いっそう好ましくは4〜8であり、非常に好ましくは4、6、または8であり、特に好ましくは4または6であり、最も好ましくは4である。
【0033】
続いて、本形態の抗がん剤の有効成分である有機金属錯体を構成する金属について説明する。この金属は、化学式1で表される環状フェノール硫化物に包接されることができ、がん細胞との接触によって抗がん作用または制がん作用を示すことができるものであれば特に制限されない。かような金属としては、例えば、白金族金属、遷移金属、または希土類金属が挙げられる。なかでも、白金族金属または遷移金属が好ましく、具体的には、カドミウム、白金、銅、亜鉛、ニッケル、コバルト、鉄、セリウム、ランタン、またはチタンが好ましい。高い抗がん作用を発揮しうるという観点からは、より好ましくはカドミウムまたは白金であり、最も好ましくはカドミウムである。これらの金属は1種のみが単独で用いられてもよいし、2種以上が併用されてもよいが、好ましくは1種のみが単独で用いられる。
【0034】
本形態の抗がん剤を構成する有機金属錯体において、環状フェノール硫化物と錯体を構成する(当該硫化物に包接される)金属原子のモル数は特に制限されない。この値は、環状フェノール硫化物におけるnの値や包接される金属原子の種類(価数)などに応じて変動しうるため、一義的には規定しづらいが、一例として、環状フェノール硫化物1モルに対して、金属原子が好ましくは1〜10モルであり、より好ましくは1〜8モルであり、特に好ましくは1〜6モルであり、最も好ましくは1〜2モルである。
【0035】
本形態の抗がん剤を構成する有機金属錯体の製造方法について特に制限はなく、従来公知の知見が適宜参照されうる。一例としては、化学式1で表される環状フェノール硫化物(チアカリックスアレーンとして知られている)と上述した金属(例えば、塩化物、炭酸塩、硫酸塩などの塩の形態で提供されうる)とを溶媒中で接触させて、硫化物に金属を包接させることができる。場合によっては、本形態に係る有機金属錯体を構成する金属とは異なる金属が包接されてなる他の錯体と、最終的に包接を希望する金属とを同様に溶媒中で接触させて、所望の有機金属錯体を得ることもできる(後述する実施例を参照)。なお、溶媒中で得られた有機金属錯体については、再結晶−濾過などの常法に従って精製することができる。
【0036】
有機金属錯体を構成する環状フェノール硫化物の入手経路についても特に制限はなく、市販品が存在する場合には当該市販品を購入することにより用いてもよい。場合によっては、従来公知の知見を参照しつつ、自ら合成することによって入手することも可能である。本形態に係る有機金属錯体を構成する環状フェノール硫化物を自ら合成する手法について特に制限はないが、例えば、対応するフェノール化合物と単体硫黄とを、アルカリ金属試薬またはアルカリ土類金属試薬の存在下反応させることにより、製造が可能である。
【0037】
ここではまず、化学式1におけるフェノール部位に対応するフェノール化合物(互いにパラ位にヒドロキシ基(−OH基)とY基が結合したものであって、Y基が水素原子または炭化水素基であるもの)を原料として準備する。そして当該フェノール化合物を、単体硫黄と反応させる。
【0038】
この際、フェノール化合物と単体硫黄との原料仕込比は特に制限されないが、フェノール化合物1グラム当量に対し、単体硫黄が0.1グラム当量以上であるとよく、好ましくは0.35グラム当量以上である。単体硫黄の原料仕込比の上限についても特に制限はないが、フェノール化合物1グラム当量に対し、20グラム当量以下が好ましく、10グラム当量以下がより好ましい。
【0039】
反応に用いられるアルカリ金属試薬としては、例えば、アルカリ金属単体、水素化アルカリ金属、水酸化アルカリ金属、炭酸アルカリ金属、アルカリ金属アルコキシド、ハロゲン化アルカリ金属などが挙げられる。また、アルカリ土類金属試薬としては、例えば、アルカリ土類金属単体、水素化アルカリ土類金属、水酸化アルカリ土類金属、酸化アルカリ土類金属、炭酸アルカリ土類金属、アルカリ土類金属アルコキシド、ハロゲン化アルカリ土類金属などが挙げられる。これらのうち、アルカリ金属試薬としては、アルカリ金属単体、水素化アルカリ金属、水酸化アルカリ金属、炭酸アルカリ金属、アルカリ金属アルコキシドが好ましく、アルカリ土類金属試薬としては、アルカリ土類金属単体、水素化アルカリ土類金属、水酸化アルカリ土類金属、酸化アルカリ土類金属、炭酸アルカリ土類金属、アルカリ土類金属アルコキシドが好ましい。アルカリ金属試薬の具体例としては、例えば、リチウム金属単体、ナトリウム金属単体、カリウム金属単体、水素化リチウム、水素化ナトリウム、水素化カリウム、水酸化リチウム、水酸化ナトリウム、水酸化カリウム、水酸化ルビジウム、水酸化セシウム、炭酸リチウム、炭酸ナトリウム、炭酸カリウム、炭酸ルビジウム、炭酸セシウム、リチウムブトキシド、リチウムエトキシド、ナトリウムブトキシド、ナトリウムエトキシド、カリウムブトキシド、カリウムエトキシドなどが挙げられる。また、アルカリ土類金属試薬の具体例としては、例えば、マグネシウム金属単体、カルシウム金属単体、水素化カルシウム、酸化マグネシウム、酸化ストロンチウム、酸化カルシウム、酸化バリウム、水酸化マグネシウム、水酸化ストロンチウム、水酸化カルシウム、水酸化バリウム、炭酸カルシウム、炭酸ストロンチウム、炭酸バリウム、マグネシウムブトキシド、マグネシウムエトキシドなどが挙げられる。これらの金属試薬は、1種が単独で用いられてもよいし、2種以上が併用されてもよい。金属試薬の使用量は、フェノール化合物1グラム当量に対し0.005グラム当量以上であるとよく、好ましくは0.01グラム当量以上である。一方、金属試薬の使用量の上限について特に制限はないが、好ましくは10グラム当量以下であり、特に好ましくは5グラム当量以下である。
【0040】
この反応は、不活性ガス雰囲気下で行なうことが好ましい。この際、不活性ガスとしては、例えば、窒素、アルゴン、ヘリウムなどが挙げられる。また、この反応は、反応時に生成する水および硫化水素を除去しつつ行なうことが好ましい。なお、反応時に生成する硫化水素を除去するためには、不活性ガス気流下で反応を行なうことが好ましい。この反応の反応温度は特に制限されないが、80℃以上が好ましく、100℃以上がより好ましい。また、反応温度の上限についても特に制限はなく、好ましくは300℃以下であり、より好ましくは280℃以下である。なお、この反応の反応時間は、通常1〜24時間程度である。
【0041】
反応には、必要に応じて溶媒を使用することが好ましい。溶媒は特に制限されないが、例えば、ヘキサデカン等の脂肪族炭化水素類;シメンやプソイドクメンなどの芳香族炭化水素;ジフェニルエーテル、ヘキシルエーテル、トリエチレングリコールジエチルエーテル、テトラエチレングリコールジメチルエーテル等のエーテル類;ジフェニルスルフィドなどのスルフィド類;エチレングリコール、ジエチレングリコールなどの二価アルコール類;これらの混合物などが挙げられる。なお、反応原料を均一化するために、反応当初に水を加えてもよい。反応の反応混合物を硫酸水溶液や塩酸水溶液などの酸性水溶液で加水分解することにより、反応生成物が得られる。反応生成物が2種以上の環状フェノール硫化物の混合物である場合には、通常の分離手段(例えば、カラムクロマトグラフィー、再結晶法など)によって、分離・精製することができる。
【0042】
上述した反応によって、化学式1において、Xが水素原子であり、Yが水素原子または炭化水素基である環状フェノール硫化物が得られる。その他の符号(Z、m、n)については、上述したとおりである。このZ、m、およびnについては、上述した反応の反応条件を適宜調整することによって、制御可能である。
【0043】
上記で生成した環状フェノール硫化物におけるヒドロキシ基を構成する水素原子を、化学式1における−OX基を構成するX(水素原子以外のもの)へと変換させることができる。例えば、当該ヒドロキシ基の水素原子を、アセチルクロライドや無水酢酸などのアシル化剤によって、アシル基へと変換させることができる。また、当該ヒドロキシ基の水素原子をアルカリ金属に置換し、これをハロゲン化炭化水素と反応させるウイリアムソン反応によって、炭化水素基へと変換させることができる。
【0044】
一方、上記で生成した環状フェノール硫化物における基Yを、化学式1におけるY(水素原子または炭化水素基以外のもの)へと変換させることができる。例えば、生成した環状フェノール硫化物における基Yがアルキル基である場合には、当該環状フェノール硫化物を塩化アルミニウム、コバルト酸化物触媒などと接触させることにより脱アルキル化し、Yを水素原子へと変換することができる。また、この脱アルキル化した環状フェノール硫化物に、ニトロ四フッ化ボロンや硝酸などの適当なニトロ化剤を作用させることにより、Yをニトロ基へと変換することができる。さらに、ニトロ基を鉄/塩酸などの適当な還元剤を用いて還元することにより、アミノ基へと変換することができる。また、さらに亜硝酸ナトリウムなどを用いてジアゾ化し、これを塩酸などの存在下、塩化銅などの適当なハロゲン化剤、シアノ化剤または水を作用させることにより、それぞれハロゲン原子、シアノ基またはヒドロキシ基へと変換させることができる。また、このヒドロキシ基は、硫酸などの硫酸エステル化剤の作用により、酸性硫酸エステル基へと変換することができる。さらに、ヒドロキシ基は、ナトリウムなどのアルカリ金属フェノキシドを経由して、ハロゲン化アルキルを作用させることにより、アルキルエーテルへと変換させることができる。
【0045】
一方、脱アルキル化した環状フェノール硫化物に発煙硫酸などを作用させることにより、スルホン酸基へと変換させることもできる。また、脱アルキル化した環状フェノール硫化物に、必要に応じてルイス酸などの触媒の共存下、酸ハロゲン化物を反応させることにより、アシル基へと変換させることもできる。さらに、環状アルキルフェノール硫化物を、過マンガン酸化合物などの適当な酸化剤を用いて酸化することにより、Yをカルボキシル基へと変換させることができる。得られたカルボン酸をアルコールと反応させることによりエステル基へと変換することもできるし、アミンと反応させることによりアミド基へと変換することもできる。
【0046】
本形態に係る有機金属錯体は、後述するように高い抗がん活性を有することから、抗がん剤として用いられうる。
【0047】
すなわち、本発明によれば、上述した有機金属錯体を有効成分として含有することを特徴とする抗がん剤が提供されるのである。
【0048】
本形態の抗がん剤が適用されるがんの種類は、特に限定されず、例えば、白血病、悪性黒色腫、悪性リンパ腫、消化器癌、肺癌、食道癌、胃癌、大腸癌、直腸癌、結腸癌、尿管腫瘍、胆嚢癌、胆管癌、胆道癌、乳癌、肝臓癌、膵臓癌、睾丸腫瘍、上顎癌、舌癌、口唇癌、口腔癌、咽頭癌、喉頭癌、卵巣癌、子宮癌、前立腺癌、甲状腺癌、脳腫瘍、カポジ肉腫、血管腫、真性多血症、神経芽腫、網膜芽腫、骨髄腫、膀胱腫、肉腫、骨肉腫、筋肉腫、皮膚癌、基底細胞癌、皮膚付属器癌、皮膚転移癌、皮膚黒色腫などが挙げられる。なかでも、本形態の抗がん剤は、白血病の治療に特に有用である。また、悪性腫瘍のみならず、良性腫瘍への適用も可能である。また、本形態の抗がん剤は、癌転移を抑制するために使用されることができ、特に、術後の癌転移抑制剤としても有用である。
【0049】
本形態の抗がん剤を使用するにあたっては、種々の形態でヒトまたは動物に(特に好ましくはヒトに)、本形態の抗癌剤を投与することができる。本形態の抗がん剤の投与形態としては、経口投与でもよいし、静脈内、筋肉内、皮下または皮内等への注射、直腸内投与、経粘膜投与などの非経口投与でもよい。経口投与に適する製剤形態としては、例えば、錠剤、丸剤、顆粒剤、散剤、カプセル剤、液剤、懸濁剤、乳剤、シロップ剤などが挙げられる。また、非経口投与に適する医薬組成物としては、例えば、注射剤、点滴剤、点鼻剤、噴霧剤、吸入剤、坐剤等の外用固形剤、または、軟膏、クリーム、粉状塗布剤、液状塗布剤、貼付剤等の経皮吸収剤などが挙げられる。さらに、本形態の抗がん剤の製剤形態としては、埋め込み用ペレットや公知の技術により調製される持続性製剤が挙げられる。
【0050】
好ましい投与形態や製剤形態等は、患者の年齢、性別、体質、症状、処置時期等に応じて、医師によって適宜選択される。
【0051】
本形態の抗がん剤が、錠剤、丸剤、散剤、粉剤、顆粒剤などの固形製剤である場合、これらの固形製剤は、本形態に係る有機金属錯体を、常法に従って適当な添加剤、例えば、乳糖、ショ糖、D−マンニトール、トウモロコシデンプン、合成もしくは天然ガム、結晶セルロース等の賦形剤、デンプン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、アラビアゴム、ゼラチン、ポリビニルピロリドン等の結合剤、カルボシキメチルセルロースカルシウム、カルボシキメチルセルロースナトリウム、デンプン、コーンスターチ、アルギン酸ナトリウム等の崩壊剤、タルク、ステアリン酸マグネシウム、ステアリン酸ナトリウム、ステアリン酸カルシウム等の滑沢剤、炭酸カルシウム、炭酸ナトリウム、リン酸カルシウム、リン酸ナトリウム等の充填剤または希釈剤等と適宜混合することにより、製造されうる。錠剤等には、必要に応じて、ヒドロキシプロピルメチルセルロース、白糖、ポリエチレングリコール、酸化チタン等のコーティング剤を用いて、糖衣、ゼラチン、腸溶被覆、フイルムコーティングなどが施されてもよい。
【0052】
本形態の抗がん剤が、注射剤、点眼剤、点鼻剤、吸入剤、噴霧剤、ローション剤、シロップ剤、液剤、懸濁剤、乳剤等の液状製剤である場合、これらの液状製剤は、本形態に係る有機金属錯体に、精製水、リン酸緩衝液等の適当な緩衝液、生理的食塩水、リンゲル溶液、ロック溶液等の生理的塩類溶液、カカオバター、ゴマ油、オリーブ油等の植物油、鉱油、高級アルコール、高級脂肪酸、エタノール等の有機溶媒等に溶解して、必要に応じてコレステロール等の乳化剤、アラビアゴム等の懸濁剤、分散助剤、浸潤剤、ポリオキシエチレン硬化ヒマシ油系、ポリエチレングリコール系等の界面活性剤、リン酸ナトリウム等の溶解補助剤、糖、糖アルコール、アルブミン等の安定化剤、パラベン等の保存剤、塩化ナトリウム、ブドウ糖、グリセリン等の等張化剤、緩衝剤、無痛化剤、吸着防止剤、保湿剤、酸化防止剤、着色剤、甘味料、フレーバー、芳香物質等を適宜添加することにより、滅菌された水溶液、非水溶液、懸濁液、リポソームまたはエマルジョン等として調製されうる。この際、注射剤は、生理学的なpHを有することが好ましく、6〜8の範囲内のpHを有することが特に好ましい。
【0053】
本形態の抗がん剤が、ローション剤、クリーム剤、軟膏等の半固形製剤の場合、これらの半固形製剤は、本形態に係る有機金属錯体を脂肪、脂肪油、ラノリン、ワセリン、パラフィン、蝋、硬膏剤、樹脂、プラスチック、グリコール類、高級アルコール、グリセリン、水、乳化剤、懸濁化剤等と適宜混和することにより、製造されうる。
【0054】
本形態の抗がん剤における、本形態に係る有機金属錯体の含有量は、投与形態、重篤度や所望の投与量などに応じて変動しうるが、一般的には、本形態の抗がん剤の全質量に対して、0.001〜80質量%、好ましくは0.1〜50質量%である。
【0055】
本形態の抗がん剤の投与量は、例えば患者の年齢、性別、体重、症状、および投与経路などの条件に応じて、医師により適宜決定されうる。一般的には、成人一日あたりの有効成分の量として1μg/kgから1,000mg/kg程度の範囲であり、好ましくは10μg/kgから10mg/kg程度の範囲である。かような投与量の抗がん剤は、一日一回で投与されてもよいし、一日数回(例えば、2〜4回程度)に分けて投与されてもよい。
【0056】
本形態の抗がん剤を使用するにあたっては、既知の化学療法、外科的治療法、放射線療法、温熱療法や免疫療法などと併用されてもよい。
【0057】
本形態の抗がん剤は、後述する実施例において示されるように、正常機能を有するヒトの細胞に対して細胞死の誘導などの悪影響を及ぼす虞が極めて少ない。このため、本発明によれば、重篤な副作用が問題となっているシスプラチンなどの他の金属含有抗がん剤と比較して、副作用が低減された抗がん剤が提供されうる。
【実施例】
【0058】
(有機金属錯体の合成)
まず、文献(Iki et al.,Chemistry Letters,1998,p.625−626)に記載の手法に従って、下記化学式:
【0059】
【化4】

【0060】
で表されるスルホン化チアカリックス[4]アレーン−Na錯体(TC4A−Na:分子量904.83)を合成した。このTC4A−Naは、4つのヒドロキシ基が互いに水素結合を介して固定されることにより、以下に示すようなお椀形の構造を有する。そしてその構造から、金属(Me)を包接するためのホスト分子として機能しうる。
【0061】
【化5】

【0062】
上記で合成したTC4A−Na 0.200g(0.22mmol)と、酢酸カドミウム二水和物(Cd(CH3COO)2・2H2O)59mg(0.22mmol)とを、イオン交換水(5mL)中に溶解させ、30分間加熱還流させた。次いで、水を減圧下で留去し、120℃にて減圧乾燥後、白色の固体を得た(収量:0.165g)。得られた化合物の同定については、IRにより行なった(IR(KBr):3449(O−H)、2360(C−H)、1186(SO3−)、1041(SO3−))。また、原子吸光光度法により分析したところ、得られた化合物1モル中にはNaが2モル、Cdが1モル含まれることが判明した。よって、得られた化合物(TC4A−Cd)の構造は、下記化学式:
【0063】
【化6】

【0064】
で表されるものと考えられる。なお、上記化学式に示す繰り返し単位は実際にはランダムに位置しており、上記化学式に示す順序に固定されているわけではない。
(細胞内でのCdの蓄積)
ヒトT細胞白血病由来Jurkat細胞株を培養している培地中にTC4A−Cdを投与した際の細胞内へのCdの蓄積を評価した。なお、Jurkat細胞株の培養については、RPMI/1640培地を用いて、5%CO2下、37℃で行なった。
【0065】
蓄積評価は、具体的には、まず、培地中に10μMのTC4A−CdまたはCdCl2をそれぞれ投与し、37℃にて12時間インキュベートした。その後、細胞内のCd2+濃度を原子吸光光度法により測定した。その結果を下記の表1に示す。表1に示すように、いずれの投与群においても、細胞内にCdが蓄積していた。
【0066】
【表1】

【0067】
(TC4A−Cdの細胞毒性)
Jurkat細胞および正常な肝機能を保持しているヒト肝がん由来細胞株であるFLC−4細胞に対するTC4A−Cd、CdCl2、およびTC4A−Naの細胞毒性を測定した。具体的には、それぞれの投与群について0.01μM、0.1μM、1μM、10μM、100μM、1000μMの濃度で投与を行い、MTTアッセイを用いて測定を行なった。具体的には、上記処理後72時間さらにインキュベーションを行った後、培地に5.5mg/mL濃度のMTT(3−[4,5−ジメチルチアゾール−2−イル]−2,5−ジフェニルテトラゾリウムブロマイド)を10μL添加し、37℃にて4時間インキュベートした。その後、抽出溶液(40%N,N−ジメチルホルムアミド、2%酢酸、20%SDS、および0.03N HCl)90μLを添加し、室温にて2時間インキュベートした。そして、マイクロプレートリーダー(モデル550、バイオラッド社製)により波長570nmにおける吸光度を測定することで、細胞の増殖(生存率)を評価した。
【0068】
それぞれの投与群についての添加濃度に対するJurkat細胞およびFLC−4細胞の生存率のグラフを、それぞれ図1および図2に示す。また、得られた結果から算出される、それぞれの細胞株の細胞死に対するTC4A−CdおよびCdCl2のIC50の値、並びにその特異性を、下記の表2に示す。
【0069】
【表2】

【0070】
図1および表2に示すように、TC4A−CdのJurkat細胞の細胞死に対するIC50は、6.9μMであった。この値は、種々のがん細胞に対するシスプラチンのIC50の値(1.9〜8.1μM)とほぼ同様であることから、TC4A−Cdは、がん細胞に対する細胞死の強い促進作用を示すことが示された。ここで、TC4A−CdのIC50はCdCl2のそれとほぼ等しいことから、TC4A−CdはJurkat細胞に効率よく取り込まれた後、細胞内でCdを徐放することで細胞死促進作用を発揮するものと思われる。なお、図1および表2に示すように、Cdを包接していないTC4A−NaのIC50は1mM以上であり、細胞死促進作用は観察されなかった。
【0071】
一方、図2および表2に示すように、正常な肝機能を保持しているヒト肝がん由来細胞株であるFLC−4細胞に対しては、TC4A−Cdによる細胞死の促進作用は観察されなかった。したがって、TC4A−Cdは、ヒトの正常細胞に対しては細胞死を引き起こすことなく、がん細胞(特に、白血病細胞)に対して特異的に作用し、抗がん作用を示すものと考えられる。
【0072】
(マウスでの急性毒性)
7週齢の雄のC57BL/6Nマウス(21匹)に、TC4A−Cd、CdCl2、および生理食塩水をそれぞれ図3に示す量で1回/週の頻度で腹腔内注射した。その後、2週間観察した。2週間の観察におけるマウスの生存曲線を図3に示す。
【0073】
図3に示すように、44μmol/kg体重を投与した場合、TC4A−Cd投与群では3例すべてが死亡し、CdCl2投与群でも3例中2例が死亡した。一方、13μmol/kg体重以下の投与量ではTC4A−Cd投与群、CdCl2投与群のいずれも全例生存しており、体重の顕著な減少は見られなかった。
【0074】
以上の結果、上記で観察された腫瘍縮小効果が見られたTC4A−Cdの腹腔内投与量(13μmol/kg体重)では、安全であることが判明した。
【0075】
(マウス皮下移植したJurkat細胞に対するTC4A−Cdの抗腫瘍効果)
5×108細胞/mL濃度のJurkat細胞の浮遊液100μLを、Scidマウスの背部の皮下に異種移植した。20日間飼育した後、TC4A−Cd、CdCl2、および生理食塩水のそれぞれを腹腔内注射した。この際、各投与群の投与量は、TC4A−CdおよびCdCl2が13μmol/kg体重であり、生理食塩水が100μLであった。また、投与は週3回×2週間行ない、初回投与から2週間後にマウスを犠牲死させて、腫瘍のサイズおよび重量を測定した。その結果を図4および図5に示す。図4は、TC4A−Cd投与群(A−1〜A−4)および生理食塩水投与群(C−1〜C−4)のそれぞれのマウスから摘出された腫瘍を撮影した写真である。また、図5は、それぞれの腫瘍の重量の平均値を示すグラフである。図4および図5に示す結果から、TC4A−Cd投与群においては、Jurkat細胞株由来の腫瘍のサイズおよび重量が、ともに明らかに減少していることが示される。
【特許請求の範囲】
【請求項1】
下記化学式1:
【化1】

式中、
Xは、それぞれ独立して、水素原子、炭化水素基またはアシル基であり
Yは、それぞれ独立して、水素原子、炭化水素基、ハロゲン化炭化水素基、−COR1、−OR2、−COOR3、−CN、−CONH2、−NO2、−NR4R5、ハロゲン原子、−OSO3R6、または−SO3R7であり(この際、R1、R2、R3、R4、R5、R6、およびR7は、それぞれ独立して、水素原子または炭化水素基である)、
Zは、それぞれ独立して、スルフィド基、スルフィニル基、またはスルホニル基であり、
nは、3〜20の整数であり、
mは、それぞれ独立して、1〜7の整数である。
で表される環状フェノール硫化物と金属とからなる有機金属錯体を有効成分として含有することを特徴とする、抗がん剤。
【請求項2】
前記化学式1において、nが4〜8である、請求項1に記載の抗がん剤。
【請求項3】
前記金属が、カドミウム、白金、銅、亜鉛、ニッケル、コバルト、鉄、セリウム、ランタン、およびチタンからなる群から選択される、請求項1または2に記載の抗がん剤。
【請求項4】
前記化学式1において、Xが水素原子である、請求項1〜3のいずれか1項に記載の抗がん剤。
【請求項5】
前記化学式1において、Yが−SO3Hまたはその塩である、請求項1〜4のいずれか1項に記載の抗がん剤。
【請求項6】
前記化学式1において、Zがスルフィド基であり、mが1である、請求項1〜5のいずれか1項に記載の抗がん剤。
【請求項7】
白血病の治療に用いられる、請求項1〜6のいずれか1項に記載の抗がん剤。
【請求項1】
下記化学式1:
【化1】

式中、
Xは、それぞれ独立して、水素原子、炭化水素基またはアシル基であり
Yは、それぞれ独立して、水素原子、炭化水素基、ハロゲン化炭化水素基、−COR1、−OR2、−COOR3、−CN、−CONH2、−NO2、−NR4R5、ハロゲン原子、−OSO3R6、または−SO3R7であり(この際、R1、R2、R3、R4、R5、R6、およびR7は、それぞれ独立して、水素原子または炭化水素基である)、
Zは、それぞれ独立して、スルフィド基、スルフィニル基、またはスルホニル基であり、
nは、3〜20の整数であり、
mは、それぞれ独立して、1〜7の整数である。
で表される環状フェノール硫化物と金属とからなる有機金属錯体を有効成分として含有することを特徴とする、抗がん剤。
【請求項2】
前記化学式1において、nが4〜8である、請求項1に記載の抗がん剤。
【請求項3】
前記金属が、カドミウム、白金、銅、亜鉛、ニッケル、コバルト、鉄、セリウム、ランタン、およびチタンからなる群から選択される、請求項1または2に記載の抗がん剤。
【請求項4】
前記化学式1において、Xが水素原子である、請求項1〜3のいずれか1項に記載の抗がん剤。
【請求項5】
前記化学式1において、Yが−SO3Hまたはその塩である、請求項1〜4のいずれか1項に記載の抗がん剤。
【請求項6】
前記化学式1において、Zがスルフィド基であり、mが1である、請求項1〜5のいずれか1項に記載の抗がん剤。
【請求項7】
白血病の治療に用いられる、請求項1〜6のいずれか1項に記載の抗がん剤。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−111438(P2011−111438A)
【公開日】平成23年6月9日(2011.6.9)
【国際特許分類】
【出願番号】特願2009−272200(P2009−272200)
【出願日】平成21年11月30日(2009.11.30)
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
【公開日】平成23年6月9日(2011.6.9)
【国際特許分類】
【出願日】平成21年11月30日(2009.11.30)
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
[ Back to top ]

