有機電界発光素子及び表示媒体
【課題】素子寿命が長い有機電界発光素子を提供する。
【解決手段】少なくとも一方が透明又は半透明である陽極及2び陰極7よりなる一対の電極と、該一対の電極間に挾持され、少なくとも一層がビス−3,3’ジフェニルジピリジイル誘導体により結合されたジアリールアミン誘導体を分子構造内部に含む特定の構造を有する電荷輸送性ポリエステルを1種以上含有する一つまたは複数の有機化合物層と、を有する、有機電界発光素子である。
【解決手段】少なくとも一方が透明又は半透明である陽極及2び陰極7よりなる一対の電極と、該一対の電極間に挾持され、少なくとも一層がビス−3,3’ジフェニルジピリジイル誘導体により結合されたジアリールアミン誘導体を分子構造内部に含む特定の構造を有する電荷輸送性ポリエステルを1種以上含有する一つまたは複数の有機化合物層と、を有する、有機電界発光素子である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、有機電界発光素子及び表示媒体に関するものである。
【背景技術】
【0002】
電界発光素子は、自発光性の全固体素子である。有機化合物を用いた電界発光素子研究は、最初アントラセン等の単結晶を用いて始まったが、その後蒸着法による薄膜化が試みられている(例えば、非特許文献1参照)。
これら素子の発光は、電極の一方から電子が注入され、もう一方の電極から正孔が注入されることにより、素子中の発光材料が高エネルギー準位に励起され、励起された発光体が基底状態に戻る際の余分なエネルギーを光として放出する現象である。
【0003】
有機電界発光素子としては、近年低分子化合物の代わりに高分子材料を用いる電界発光素子についても研究・開発が進められ、ポリ(p−フェニレンビニレン)等の導電性高分子素子(例えば、特許文献1又は非特許文献2参照)、ポリフォスファゼンの側鎖にトリフェニルアミンを導入した高分子素子(例えば、非特許文献3参照)、正孔輸送性ポリビニルカルバゾール中に電子輸送材料と蛍光色素を混入した素子(例えば、非特許文献4参照)が提案されている。
【0004】
また、特定のアミン構造から選択された少なくとも1種を部分構造として含む繰り返し単位よりなるホール輸送性ポリエステルを有機化合物層とする技術が開示されている(例えば、特許文献2参照)。
さらに、作製法においては、キャステイング法によって素子が得られることが報告されている(例えば、非特許文献5及び6参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−92576号公報
【特許文献2】特開2002−43066号公報
【非特許文献】
【0006】
【非特許文献1】Thin Solid Films,94,171(1982)
【非特許文献2】Nature,357,477(1992)
【非特許文献3】第42回高分子討論会予稿集20J21(1993)
【非特許文献4】第38回応用物理学関係連合講演会予稿集31p−G−12(1991)
【非特許文献5】第50回応用物理学会学術講演予稿集,29p−ZP−5(1989)
【非特許文献6】第51回応用物理学会学術講演予稿集,28a−PB−7(1990)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の課題は、ポリビニルカルバゾールを用いた有機電界発光素子と比べ、素子寿命が長い有機電界発光素子を提供することにある。
【課題を解決するための手段】
【0008】
上記課題は、以下の手段により解決される。即ち、
請求項1に係る発明は、
少なくとも一方が透明又は半透明である陽極及び陰極よりなる一対の電極と、
該一対の電極間に挾持され、少なくとも一層が下記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する一つ又は複数の有機化合物層と、を有する、有機電界発光素子である。
【0009】
【化1】

【0010】
前記一般式(I)中、A1は下記一般式(II)で示される構造から選択された少なくとも1種を表し、Y1は各々独立に置換又は未置換の2価の炭化水素基を表し、mは各々独立に1以上5以下の整数を表し、pは5以上5000以下の整数を表す。R1は各々独立に水素原子、アルキル基、置換若しくは未置換のアリール基又は置換若しくは未置換のアラルキル基を表す。
【0011】
【化2】

【0012】
前記一般式(II)中、Arは各々独立に置換若しくは未置換のフェニル基、置換若しくは未置換の芳香環数2の1価の多核芳香族炭化水素基、置換若しくは未置換の芳香環数2若しくは3の1価の縮合芳香族炭化水素基、又は置換若しくは未置換の1価の芳香族複素環基を表し、jは各々独立に0又は1を表し、Tは各々独立に炭素数1以上6以下の2価の直鎖状炭化水素基又は炭素数2以上10以下の2価の分枝鎖状炭化水素基を表し、Xは下記式(III)で示される基を表す。
【0013】
【化3】

【0014】
請求項2に係る発明は、
前記有機化合物層が、発光層と、電子輸送層及び電子注入層の少なくとも一層と、を含み、前記発光層、前記電子輸送層、及び前記電子注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子である。
【0015】
請求項3に係る発明は、
前記有機化合物層が、発光層と、正孔輸送層及び正孔注入層の少なくとも一層と、を含み、前記発光層、前記正孔輸送層、及び前記正孔注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子である。
【0016】
請求項4に係る発明は、
前記有機化合物層が、発光層と、正孔輸送層及び正孔注入層の少なくとも一層と、電子輸送層及び電子注入層の少なくとも一層と、を含み、前記発光層、前記正孔輸送層、前記正孔注入層、前記電子輸送層、及び前記電子注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子である。
【0017】
請求項5に係る発明は、
前記有機化合物層が、電荷輸送機能を持つ発光層のみから構成され、前記電荷輸送機能を持つ発光層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子である。
【0018】
請求項6に係る発明は、
請求項1から請求項5のいずれか1項に記載の有機電界発光素子を、マトリクス状及びセグメント状の少なくとも一方で配置した、表示媒体である。
【発明の効果】
【0019】
請求項1に係る発明によれば、ポリビニルカルバゾールを用いた有機電界発光素子と比べ、素子寿命が長い有機電界発光素子が得られる。
請求項2に係る発明によれば、上記層構成を有していない場合に比べ、発光効率が高い有機電界発光素子が得られる。
請求項3に係る発明によれば、上記層構成を有していない場合に比べ、耐久性が高い有機電界発光素子が得られる。
請求項4に係る発明によれば、上記層構成を有していない場合に比べ、より低電圧で駆動する有機電界発光素子が得られる。
請求項5に係る発明によれば、上記層構成を有していない場合に比べ、層構成が単純な有機電界発光素子が得られる。
請求項6に係る発明によれば、ポリビニルカルバゾールを用いた表示媒体と比べ、耐久性が高い表示媒体が得られる。
【図面の簡単な説明】
【0020】
【図1】実施形態の有機電界発光素子の層構成の一例を示した概略構成図である。
【図2】実施形態の有機電界発光素子の層構成の他の一例を示した概略構成図である。
【図3】実施形態の有機電界発光素子の層構成の他の一例を示した概略構成図である。
【図4】実施形態の有機電界発光素子の層構成の他の一例を示した概略構成図である。
【発明を実施するための形態】
【0021】
以下、本願発明の一例である実施形態について詳細に説明する。
<有機電界発光素子>
本実施形態の有機電界発光素子(以下、「有機EL素子」という場合がある)は、少なくとも一方が透明又は半透明である陽極及び陰極よりなる一対の電極と、該一対の電極間に挾持され、少なくとも一層が下記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する一つ又は複数の有機化合物層と、を有することを特徴とする。
【0022】
【化4】

【0023】
前記一般式(I)中、A1は下記一般式(II)で示される構造から選択された少なくとも1種を表し、Y1は各々独立に置換又は未置換の2価の炭化水素基を表し、mは各々独立に1以上5以下の整数を表し、pは5以上5000以下の整数を表す。R1は各々独立に水素原子、アルキル基、置換若しくは未置換のアリール基又は置換若しくは未置換のアラルキル基を表す
【0024】
【化5】

【0025】
前記一般式(II)中、Arは各々独立に置換若しくは未置換のフェニル基、置換若しくは未置換の芳香環数2の1価の多核芳香族炭化水素基、置換若しくは未置換の芳香環数2若しくは3の1価の縮合芳香族炭化水素基又は置換若しくは未置換の1価の芳香族複素環基を表し、jは各々独立に0又は1を表し、Tは各々独立に炭素数1以上6以下の2価の直鎖状炭化水素基又は炭素数2以上10以下の2価の分枝鎖状炭化水素基を表し、Xは下記式(III)で示される基を表す。
【0026】
【化6】

【0027】
本実施形態における電荷輸送性ポリエステルは、ビピリジンを分子構造中に含むことにより、イオン化ポテンシャルが低くコントロールされるため、電極からの電荷注入性が改善されるものと推測される。さらに上記ビピリジンを含んだ構造では溶剤や樹脂に対する溶解性及び相溶性に優れている。従って、上記電荷輸送性ポリエステルを用いることで、大面積化され、有機電界発光素子が容易に製造されるものと推測される。
【0028】
また、上記電荷輸送性ポリエステルは後述する構造を選択することで、正孔輸送能、電子輸送能のいずれの機能をも付与しうるため、目的に応じて正孔輸送層、発光層、電子輸送層等のいずれの層にも用いられる。さらに、本実施形態における電荷輸送性ポリエステルは、ガラス転移温度が比較的高く、しかも電荷の移動度が大きいことから、電流が流れやすく電圧の上昇が抑制され、発光時に熱が発生しにくくなることで安定性に優れ、素子寿命が長くなるものと推測される。
なお本実施形態において、「電荷輸送性ポリエステル」とは、正孔又は電子を電荷として輸送する半導体であるポリエステルを意味する。
【0029】
(電荷輸送性ポリエステル)
以下、本実施形態における前記電荷輸送性ポリエステルについて詳述する。まず、該電荷輸送性ポリエステルの特徴である一般式(I)におけるA1の構造について説明する。
前記一般式(II)中、Arは各々独立に、置換若しくは未置換のフェニル基、置換若しくは未置換の芳香環数2の1価の多核芳香族炭化水素基、置換若しくは未置換の芳香環数2若しくは3の1価の縮合芳香族炭化水素基又は置換若しくは未置換の1価の芳香族複素環基を表す。尚、一般式(II)中に2つ存在するArは、同一であっても異なっていても構わないが、同一である方が製造容易である。
【0030】
ここで、当該多核芳香族炭化水素基及び縮合芳香族炭化水素基とは、本実施形態においては、具体的には以下に定義される多環式芳香環(すなわち、多核芳香族炭化水素又は縮合芳香族炭化水素)を有する基のことを意味する。
すなわち、「多核芳香族炭化水素」とは、炭素と水素とから構成される芳香環が2個以上存在し、環同士が炭素−炭素結合によって結合している炭化水素を表す。具体的には、ビフェニル等が挙げられる。また、「縮合芳香族炭化水素」とは、炭素と水素とから構成される芳香環が2個以上存在し、これらの芳香環同士が隣接して結合する1対の炭素原子を共有している炭化水素化合物を表す。具体的には、ナフタレン、アントラセン、フェナントレン、フルオレン等が挙げられる。
【0031】
さらに一般式(II)中において、Arを表す構造として選択される芳香族複素環基とは、本実施形態においては、以下に定義される芳香族複素環を有する基のことを意味する。
すなわち、「芳香族複素環」とは、炭素と水素以外の元素も含む芳香環を表し、例えば、その環骨格を構成する原子数(Nr)が、5及び6の少なくともいずれかであるものが挙げられる。また、環骨格を構成する炭素原子以外の原子(異種原子)の種類及び数は特に限定されないが、例えば、硫黄原子、窒素原子、酸素原子等が用いられ、前記環骨格中には2種類以上の異種原子、及び、2個以上の異種原子の少なくともいずれかが含まれてもよい。特に5員環構造をもつ複素環として、例えば、チオフェン、ピロール及びフラン、または、前記化合物の3位及び4位の炭素を窒素で置き換えた複素環が用いられ、6員環構造を持つ複素環として、例えばピリジンが用いられる。
【0032】
更に、上記芳香族複素環基は、上記芳香族複素環を有していればよく、上記芳香族複素環で構成された基のほか、芳香環に上記芳香族複素環が置換した基、及び上記芳香族複素環に芳香環が置換した基の何れも含み、上記芳香環の具体例としては上述の芳香環が挙げられる。
すなわち、上記芳香族複素環基は、例えば、上述の多環式芳香環(すなわち芳香環数2以上の1価の多核芳香族炭化水素又は芳香環数2以上の1価の縮合芳香族炭化水素)において、1つ以上の芳香環が芳香族複素環に置き換えられた基であってもよく、具体的には、例えば、チオフェニルフェニル基、フェニルピリジン基、フェニルピロール基等が挙げられる。
【0033】
一般式(II)中、Arで表されるフェニル基、多核芳香族炭化水素基、縮合芳香族炭化水素基、又は芳香族複素環基を更に置換する置換基としては、例えば、水素原子、アルキル基、アルコキシ基、アリール基、アラルキル基、置換アミノ基、ハロゲン原子等が挙げられる。
前記アルキル基としては、例えば炭素数1以上10以下のものが挙げられ、例えば、メチル基、エチル基、プロピル基、イソプロピル基等が挙げられる。
前記アルコキシ基としては、例えば炭素数1以上10以下のものが挙げられ、例えば、メトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基等が挙げられる。
前記アリール基としては、例えば炭素数6以上20以下のものが挙げられ、例えば、フェニル基、トルイル基等が挙げられる、
前記アラルキル基としては、例えば炭素数7以上20以下のものが挙げられ、例えば、ベンジル基、フェネチル基等が挙げられる。
前記置換アミノ基の置換基としては、例えば、アルキル基、アリール基、アラルキル基等が挙げられ、具体例は前述の通りである。
【0034】
一般式(II)中、Tは、各々独立に、炭素数1以上6以下の2価の直鎖状炭化水素基又は炭素数2以上10以下の2価の分枝鎖状炭化水素基を表し、その中でも、例えば炭素数が2以上6以下の2価の直鎖状炭化水素基及び炭素数3以上7以下の2価の分枝鎖状炭化水素基のものが挙げられる。これらの中でもより具体的には、例えば以下に示す2価の炭化水素基が特に挙げられる。
【化7】

【0035】
一般式(II)中、jは、各々独立に、0又は1を表す。
なお、一般式(II)中に2つ存在するT及びjは、それぞれ同一であっても異なっていてもかまわないが、いずれも同一である方が、電荷輸送性ポリエステルの製造容易性が高い。
【0036】
以上説明した一般式(II)で示される構造から選択された少なくとも1種は、前記一般式(I)で示される電荷輸送性ポリエステルにおけるA1である。
なお、一般式(I)で表される電荷輸送性ポリエステル中に存在する複数のA1は、同一の構造であっても、異なった構造であってもよい。
【0037】
一般式(I)中、Y1は、各々独立に、置換若しくは未置換の2価の炭化水素基を表す。Y1で表される2価の炭化水素基は、2価のアルコール残基であり、例えば、アルキレン基、(ポリ)エチレンオキシ基、(ポリ)プロピレンオキシ基、アリーレン基、2価の複素環基又はこれらの組み合わせが挙げられる。Y1で表される2価の炭化水素基の炭素数としては、例えば、1以上18以下の範囲が挙げられ、炭素数1以上6以下の範囲であってもよい。
すなわち、Y1で表される2価の炭化水素基としては、具体的には、例えば、炭素数1以上10以下のアルキレン基、又は炭素数6以上18以下のアリーレン基が挙げられ、炭素数1以上5以下のアルキレン基であってもよい。
Y1は、具体的には、例えば、下記式(IV−1)から(IV−8)の中から選択される基が挙げられる。
なお、一般式(I)で表される電荷輸送性ポリエステル中に存在する複数のY1は、同一であっても異なっていてもよい。
【0038】
【化8】

【0039】
上記式(IV−1)、(IV−2)、(IV−5)及び(IV−6)中、R3及びR4は、それぞれ水素原子、置換若しくは未置換の炭素数1以上4以下のアルキル基、置換若しくは未置換の炭素数1以上4以下のアルコキシ基、置換若しくは未置換のフェニル基、置換若しくは未置換のアラルキル基、又はハロゲン原子を表し、a、b、及びcはそれぞれ独立に1以上10以下の整数を表し、eは0以上2以下の整数を表し、d及びfは0又は1を表し、Vは下記(V−1)から(V−12)で表される基を表す。
【0040】
【化9】

【0041】
上記式(V−1)、(V−10)、(V−11)、及び(V−12)中、gは1以上20以下の整数を、hは0以上10以下の整数を表す。
【0042】
一般式(I)中、mは、各々独立に1以上5以下の整数を表し、一般式(I)で表される電荷輸送性ポリエステル中に存在する複数のmは、同一であっても異なっていてもよい。
一般式(I)中、R1は、各々独立に水素原子、アルキル基、置換若しくは未置換のアリール基、又は置換若しくは未置換のアラルキル基を表す。上記アルキル基、アリール基、及びアラルキル基、並びにそれらを置換する置換基の具体例については、上記Arの芳香族環を置換する置換基として示した具体例と同じである。
また一般式(I)中、R1は、上記のなかでも、水素原子又はフェニル基が挙げられ、低コスト化、製造容易性の観点からは水素原子が挙げられる。また一般式(I)における2つのR1は、同一でも異なっていてもよいが、同一である方が製造上容易である。
【0043】
一般式(I)中、pは5以上5,000以下の整数を表すが、10以上1000以下の範囲であってもよい。
より具体的には、前記電荷輸送性ポリエステルの重量平均分子量Mwは、例えば5,000以上300,000以下の範囲が挙げられ、10,000以上100,0000以下の範囲であってもよい。
上記重量平均分子量Mwは以下の方法により測定される。すなわち重量平均分子量は、電荷輸送性ポリエステルの1.0質量%テトラヒドロフラン溶液を調製し、示差屈折率検出器(RI)を用いて、ゲル浸透クロマトグラフィー(GPC)により、標準サンプルとしてスチレンポリマーを用いて測定する。
【0044】
また、前記電荷輸送性ポリエステルのガラス転移温度(Tg)は、例えば60℃以上300℃以下が挙げられ、100℃以上200℃以下であってもよい。
なお、上記ガラス転移温度は、示差走査型熱量計によりα−Al2O3をリファレンスとし、サンプルをゴム状態になるまで昇温し、液体窒素に浸し急冷した後、再度昇温速度10℃/分の条件で昇温して測定する。
【0045】
一般式(I)で表される電荷輸送性ポリエステルは、例えば、下記構造式(VI)で示される電荷輸送性モノマーを、例えば第4版実験化学講座28巻(日本化学会編、丸善、1992)などに記載された公知の方法で重合することにより合成される。
【0046】
【化10】

【0047】
一般式(VI)中、Ar、X、T、及びjは、それぞれ前記一般式(II)におけるAr、X、T、及びjと同一である。一般式(VI)中、A2は、水酸基、ハロゲン原子、又は−O−R5(R5は、置換若しくは未置換のアルキル基、置換若しくは未置換のアリール基、又は置換若しくは未置換のアラルキル基を表す)を表す。
ここで、前記一般式(VI)で示される構造の具体例を、表1から表4に示す。なお、以下、下記表において化合物番号(構造番号)を付した電荷輸送性モノマーの各具体例に関し、例えば、5の番号を付した具体例については「モノマー化合物(5)」という。
なお、下記表に示した電荷輸送性モノマーの各具体例においては、一般式(VI)中に示された2つのAr、T、j、及びA2が、それぞれ同じである。
【0048】
【表1】

【0049】
【表2】

【0050】
【表3】

【0051】
【表4】

【0052】
ここでまず、上記一般式(VI)で示される電荷輸送性モノマーの合成法について説明する。以下に電荷輸送性モノマーの合成法を例示するが、これに限定するものではない。
上記一般式(VI)で示される電荷輸送性モノマー(ビピリジン化合物)の合成方法としては、例えば、クロスカップリングビアリール合成を利用する方法が挙げられる。クロスカップリングビアリール合成の具体例としては、例えば、Suzuki反応、Kharasch反応、Negishi反応、Stille反応、Grignard反応、又はUllmann反応等が挙げられる。
【0053】
上記一般式(VI)で示される電荷輸送性モノマーの合成方法の具体例としては、例えば、下記式のように、一般式(VII)で示される化合物と一般式(VIII)で示される化合物とのクロスカップリング反応による合成方法が挙げられるが、これに限定されるものではない。
【0054】
【化11】

【0055】
【化12】

【0056】
前記一般式(VII)、一般式(VIII)及び一般式(IX)中、X及びGは、ハロゲン原子、B(OH)2、前記構造式(XI−1)で示される置換基、前記構造式(XI−2)で示される置換基、又は前記構造式(XI−3)で示される置換基を表す。また、前記一般式(VII)、一般式(IX)及び一般式(X)中、A2、T、j、及びArは、それぞれ前記一般式(VI)中のA2、T、j、及びArと同義である。
また、前記反応の際に、必要に応じて、金属、金属錯体触媒、塩基、又は溶媒等を用いてもよい。
また、合成反応の際、金属若しくは金属錯体の触媒、塩基、溶媒、又は有機ホスフィン配位子などの助触媒を用いてもよい。
【0057】
上記金属としては、例えば、Pd、Cu、Ti、Sn、Ni、Pt、Zn等が用いられる。
上記金属錯体としては、例えば、テトラキス(トリフェニルホスフィン)パラジウム(Pd(PPh3)4)、酢酸パラジウム(II)(Pd(OCOCH3)2)、トリス(ジベンジリデンアセトン)ジパラジウム(0)(Pd2(dba)3)、ジ(トリフェニルホスフィン)ジクロロパラジウム(Pd(PPh3)2Cl2)、1,1′−ビス(ジフェニルホスフィノ)フェロセン−パラジウム(II)ジクロリド−ジクロロメタン錯体(Pd(dppf)2Cl2)、Pd/C、ニッケル(II)アセチルアセトナート(Ni(acac)2)、又は塩化亜鉛(ZnCl2)等が用いられる。
上記塩基としては、例えば、炭酸ナトリウム(Na2Co3)、炭酸カリウム(K2Co3)、炭酸セシウム(Cs2CO3)、又は水酸化バリウム(Ba(OH)2)などの無機塩基や、トリエチルアミン(NEt3)、ジイソプロピルアミン(NH(i−Pr)2)、ジエチルアミン(NHEt2)、ジメチルアミン(NHMe2)、トリメチルアミン(NMe3)、1,8−ジアザビシクロ[5.4.0]−7−ウンデセン(DBU)、N,N−ジメチル-4-アミノピリジン(DMAP)、ピリジンなどの有機塩基が用いられる。
上記溶媒は、反応を著しく阻害しない溶媒であればよく、例えば、ベンゼン、トルエン、キシレン、メシチレンなどの芳香族炭化水素溶媒、ジエチルエ−テル、テトラヒドロフラン、ジオキサンなどのエ−テル溶媒、アセトニトリル、ジメチルホルムアミド、ジメチルスルホキシド、メタノール、エタノール、イソプロピルアルコール又は水等が用いられる。
また、上記反応際に、必要に応じて、例えば、トリフェニルホスフィン(PPh3)、トリ−o−トリルホスフィン(P(o−Tol)3、トリブチルホスフィン(P(t−Bu)3)、トリエチルホスフィン(PEt3)等が用いられる。
ただし、上記Meは「CH3」、Etは「C2H5」、Phは「C6H5」、i−Prは「(CH3)2CH2」、o−Tolは「o−CH3C6H4」、t−Buは「(CH3)3C」を表す。
【0058】
上記反応は、例えば常圧下において、窒素又はアルゴンなどの不活性ガス雰囲気下で実施してもよいが、加圧条件下において実施してもよい。
上記反応における反応温度としては、例えば20℃以上300℃以下の範囲が挙げられるが、50℃以上180℃以下の範囲であってもよい。反応時間は反応条件により異なるが、例えば5分以上20時間以下の範囲から選択してもよい。
【0059】
上記金属又は金属錯体触媒の使用量は、特に限定されるものではないが、例えば一般式(VII)で示される化合物1モルに対して、0.001モル以上10モル以下の範囲が挙げられ、0.01モル以上5.0モル以下の範囲であってもよい。
塩基の使用量は、一般式(VII)で示される化合物1モルに対して、0.5モル以上4.0モル以下の範囲が挙げられ、1.0モル以上2.5モル以下の範囲であってもよい。
【0060】
上記反応の後は、例えば、反応溶液を水中に投入後、撹拌し、反応生成物が結晶の場合は吸引ろ過で、ろ取することにより粗生成物が得られる。反応生成物が油状物である場合には、例えば、酢酸エチル又はトルエン等の溶剤で抽出することにより粗生成物が得られる。このようにして得られた組成生物を、例えば、シリカゲル、アルミナ、活性白土、活性炭等でカラム精製してもよく、また溶液中にこれらの吸着剤を添加し、不要分を吸着させる等の処理を行ってもよく、さらに、反応生成物が結晶の場合にはヘキサン、メタノール、アセトン、エタノール、酢酸エチル、トルエン等の溶剤から、再結晶させて精製してもよい。
但し、本実施形態における合成法としてはこれらに限定されるものではない。
【0061】
以上のようにして得られた一般式(VI)で示される電荷輸送性モノマーを用い、公知の方法で重合することにより、前記一般式(I)で示される電荷輸送性ポリエステルを合成する。
具体的には、例えば、前記電荷輸送性モノマーの末端(すなわち一般式(VI)中のA2)に後述する置換基を導入することを行う方法が挙げられ、具体的には以下の合成法が挙げられる。
【0062】
1)A2が水酸基の場合
前記一般式(VI)で表される化合物に、HO−(Y1−O)m−Hで表される2価アルコール類を当量(質量比)混合し、酸触媒を用いて重合する。なお、上記Y1及びmは、前記一般式(I)におけるY1及びmと同義である。
【0063】
前記酸触媒としては、硫酸、トルエンスルホン酸、トリフルオロ酢酸等、通常のエステル化反応に用いるものが使用され、モノマー(すなわち一般式(VI)で表される化合物)1質量部に対して、例えば1/10,000質量部以上1/10質量部以下で用いられ、1/1,000質量部以上1/50質量部以下の範囲で用いてもよい。
重合中に生成する水を除去するために、例えば水と共沸する溶剤を用い、具体的には、例えばトルエン、クロロベンゼン、1−クロロナフタレン等が有効であり、モノマー1質量部に対して、例えば1質量部以上100質量部以下の範囲で用いられ、2質量部以上50質量部以下の範囲で用いてもよい。
反応温度は条件に応じて設定されるが、重合中に生成する水を除去するために、溶剤の沸点で反応させてもよい。
【0064】
反応終了後、溶剤を用いなかった場合には溶解する溶剤に溶解させる。溶剤を用いた場合には、反応溶液をそのまま、メタノール、エタノール等のアルコール類や、アセトン等のポリマーが溶解しにくい貧溶剤中に滴下し、ポリエステルを析出させポリエステルを分離した後、水や有機溶剤で洗浄し、乾燥させる。
更に、必要であれば適当な有機溶剤に溶解させ、貧溶剤中に滴下し、ポリエステルを析出させる再沈殿処理を繰り返してもよい。再沈殿処理の際には、メカニカルスターラー等で、効率よく撹拌しながら行ってもよい。再沈殿処理の際にポリエステルを溶解させる溶剤は、ポリエステル1質量部に対して、例えば1質量部以上100質量部以下で用いられ、2質量部以上50質量部以下の範囲で用いてもよい。また、貧溶剤はポリエステル1質量部に対して、例えば1質量部以上1,000質量部以下で用いられ、10質量部以上500質量部以下の範囲で用いてもよい。
【0065】
2)A2がハロゲンの場合
前記一般式(VI)で表される化合物に、HO−(Y1−O)m−Hで示される2価アルコール類を当量(質量比)混合し、ピリジンやトリエチルアミン等の有機塩基性触媒を用いて重合する。なお、上記Y1及びmは、前記一般式(I)におけるY1及びmと同義である。
【0066】
前記有機塩基性触媒は、モノマー1質量部に対して、例えば1質量部以上10質量部以下の範囲で用いられ、2質量部以上5質量部以下の範囲で用いてもよい。
溶剤としては、塩化メチレン、テトラヒドロフラン、トルエン、クロロベンゼン、1−クロロナフタレン等が有効であり、モノマー(すなわち一般式(VI)で表される化合物)1質量部に対して、例えば1質量部以上100質量部以下の範囲で用いられ、2質量部以上50質量部以下の範囲で用いてもよい。
反応温度は条件に応じて設定される。重合後、前述のように再沈殿処理し、精製する。
【0067】
また、ビスフェノール等の酸性度の高い2価アルコール類を用いる場合には、界面重合法を用いてもよい。すなわち、2価アルコール類を水に加え、当量(質量比)の塩基を加えて溶解させた後、激しく撹拌しながら2価アルコール類と当量のモノマー溶液を加えることによって重合する。この際、水は2価アルコール類1質量部に対して、例えば1質量部以上1,000質量部以下の範囲で用いられ、2質量部以上500質量部以下の範囲で用いてもよい。モノマーを溶解させる溶剤としては、塩化メチレン、ジクロロエタン、トリクロロエタン、トルエン、クロロベンゼン、1−クロロナフタレン等が有効である。
反応温度は条件に応じて設定され、反応を促進するために、アンモニウム塩、スルホニウム塩等の相間移動触媒を用いることが効果的である。相間移動触媒は、モノマー1質量部に対して、例えば0.1質量部以上10質量部以下の範囲で用いられ、0.2質量部以上5質量部以下の範囲で用いてもよい。
【0068】
3)A2が−O−R5の場合
前記一般式(VI)で表される化合物に、HO−(Y1−O)m−Hで示される2価アルコール類を過剰に加え、硫酸、リン酸等の無機酸、チタンアルコキシド、カルシウム及びコバルト等の酢酸塩或いは炭酸塩、亜鉛や鉛の酸化物を触媒に用いて加熱し、エステル交換により合成される。なお、上記Y1及びmは、前記一般式(I)におけるY1及びmと同義である。
【0069】
前記2価アルコール類はモノマー(一般式(VI)で表される化合物)1質量部に対して、例えば2質量部以上100質量部以下の範囲で用いられ、3質量部以上50質量部以下の範囲で用いてもよい。
前記触媒はモノマー1質量部に対して、例えば1/10,000質量部以上1質量部以下の範囲で用いられ、1/1,000質量部以上1/2質量部以下の範囲で用いてもよい。
【0070】
反応は、反応温度200℃以上300℃以下で行い、−O−R5から−O−(Y1−O)m−Hへのエステル交換終了後は、HO−(Y1−O)m−Hの脱離による重合を促進するため、例えば減圧下で反応させる。また、HO−(Y1−O)m−Hと共沸する1−クロロナフタレン等の高沸点溶剤を用いて、常圧下でHO−(Y1−O)m−Hを共沸で除きながら反応させてもよい。
【0071】
また、次のようにしてポリエステルを合成してもよい。
上記1)から3)のそれぞれの場合において、2価アルコール類を過剰に加えて反応させることによって下記一般式(XII)で示される化合物を生成した後、この化合物を前記一般式(VI)で示したモノマーの代わりとして用いて、2価カルボン酸又は2価カルボン酸ハロゲン化物等と反応させ、一般式(I)で表されるポリエステルが得られる。
【0072】
【化13】

【0073】
一般式(XII)中、Ar、X、T、及びjはそれぞれ前記一般式(II)におけるAr、X、T、及びjと同一であり、Y1及びmはそれぞれ前記一般式(I)におけるY1及びmと同一である。
【0074】
なお、前記1)から3)の合成法のうち、本実施形態における電荷輸送性ポリエステルとしては、1)の合成法によることが製造上容易である。
ここで、一般式(I)で示される電荷輸送性ポリエステルの具体例を表5から表8に示すが、本実施形態における電荷輸送性ポリエステルはこれら具体例に限定されるわけではない。尚、下記表において、モノマーの列のA1の欄(「一般式(I)A1の構造」の欄)の番号は、前記一般式(II)で示される構造の具体例の構造番号(表1から表4の電荷輸送性モノマーの「構造番号」)に対応している。
以下、下記表において化合物番号(ポリマー番号)を付した電荷輸送性ポリエステルの各具体例に関し、例えば、15の番号を付した具体例については「例示化合物(15)」という。また、下記表に示した電荷輸送性ポリエステルの各具体例においては、一般式(I)中に示された2つのY1、m、及びR1は、それぞれ同じである。
【0075】
【表5】

【0076】
【表6】

【0077】
【表7】

【0078】
【表8】

【0079】
次に、本実施形態の有機電界発光素子の構成について詳述する。
本実施形態の有機電界発光素子は、少なくとも一方が透明または半透明である一対の電極と、それら電極間に挾まれた一つまたは複数の有機化合物層より構成され、該有機化合物層の少なくとも一層に上記に説明した電荷輸送性ポリエステルを1種含有してなるものであればその層構成は特に限定されない。
【0080】
本実施形態の有機電界発光素子においては、有機化合物層が1つの場合は、有機化合物層は電荷輸送能を持つ発光層を意味し、該発光層が前記電荷輸送性ポリエステルを含有してなる。一方、有機化合物層が複数の場合(即ち、各層が異なる機能を有する機能分離型の場合)は、少なくともいずれか一層が発光層からなり、この発光層は電荷輸送能を持つ発光層であってもよい。この場合、前記発光層あるいは前記電荷輸送能を持つ発光層と、その他の層を含む層構成の具体例としては、下記(1)乃至(3)が挙げられる。
【0081】
(1)発光層と、電子輸送層及び電子注入層の少なくともいずれかの層と、から構成される層構成。
(2)正孔輸送層及び正孔注入層の少なくともいずれかの層と、発光層と、電子輸送層及び電子注入層の少なくともいずれかの層と、から構成される層構成。
(3)正孔輸送層及び正孔注入層の少なくともいずれかの層と、発光層と、から形成される層構成。
【0082】
これら層構成(1)乃至(3)の発光層及び電荷輸送能を持つ発光層以外の層は、電荷輸送層や電荷注入層としての機能を有する。
なお、層構成(1)乃至(3)のいずれの層構成においても、いずれか一層に前記電荷輸送性ポリエステルが含まれていればよい。
【0083】
また、本実施形態の有機電界発光素子において、発光層、正孔輸送層、正孔注入層、電子輸送層、電子注入層は、前記電荷輸送性ポリエステル以外の電荷輸送性化合物(正孔輸送材料、電子輸送材料)を更に含んでもよい。該電荷輸送性化合物の詳細については後述する。
【0084】
以下、図面を参照しつつ、より詳細に説明するが、本実施形態の有機電界発光素子はこれらに限定されるわけではない。
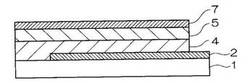
図1乃至図4は、本実施形態の有機電界発光素子の層構成を説明するための模式的断面図であって、図1、図2、図3の場合は、有機化合物層が複数の場合の一例であり、図4の場合は、有機化合物層が1つの場合の例を示す。なお、図1乃至図4において、同じような機能を有するものは同じ符号を付して説明する。
【0085】
図1に示す有機電界発光素子は、透明絶縁体基板1上に、透明電極2、発光層4、電子輸送層及び電子注入層の少なくとも一層5並びに背面電極7が順次積層されたもので、層構成(1)に相当するものである。但し、符号5で示される層が、電子輸送層及び電子注入層から構成される場合には、発光層4の背面電極7側に、電子輸送層、電子注入層、背面電極7がこの順に積層される。
【0086】
図2に示す有機電界発光素子は、透明絶縁体基板1上に、透明電極2、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4、電子輸送層及び電子注入層の少なくとも一層5並びに背面電極7が順次積層されたもので、層構成(2)に相当するものである。但し、符号3で示される層が、正孔輸送層及び正孔注入層から構成される場合には、透明電極2の背面電極7側に、正孔注入層、正孔輸送層、発光層4がこの順に積層される。また、符号5で示される層が、電子輸送層及び電子注入層から構成される場合には、発光層4の背面電極7側に、電子輸送層、電子注入層、背面電極7がこの順に積層される。
【0087】
図3に示す有機電界発光素子は、透明絶縁体基板1上に、透明電極2、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4並びに背面電極7が順次積層されたもので、層構成(3)に相当するものである。但し、符号3で示される層が、正孔輸送層及び正孔注入層から構成される場合には、透明電極2の背面電極7側に、正孔注入層、正孔輸送層、発光層4がこの順に積層される。
【0088】
図4に示す有機電界発光素子は、透明絶縁体基板1上に、透明電極2、電荷輸送能を持つ発光層6及び背面電極7が順次積層されたものである。
また、トップエミッション構造や陰極・陽極共に透明電極を用いて透過型にする場合、さらには図1乃至図4の層構成を複数段積重ねた構造も実現される。
以下、各々を詳しく説明する。
【0089】
本実施形態における前記電荷輸送性ポリエステルには、含有される有機化合物層の機能によって、正孔輸送能、電子輸送能のいずれの機能をも付与される。
例えば、前記電荷輸送性ポリエステルは、図1に示される有機電界発光素子の層構成の場合、発光層4及び電子輸送層及び電子注入層の少なくとも一層5のいずれに含有されてもよく、発光層4及び電子輸送層及び電子注入層の少なくとも一層5としていずれも作用する。また、図2に示される有機電界発光素子の層構成の場合、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4及び電子輸送層及び電子注入層の少なくとも一層5のいずれに含有されてもよく、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4及び電子輸送層及び電子注入層の少なくとも一層5としていずれも作用する。また、図3に示される有機電界発光素子の層構成の場合、正孔輸送層及び正孔注入層の少なくとも一層3及び発光層4のいずれに含有されてもよく、正孔輸送層及び正孔注入層の少なくとも一層3及び発光層4としていずれも作用する。さらに、図4に示される有機電界発光素子の層構成の場合、電荷輸送能を持つ発光層6に含有され、電荷輸送能を持つ発光層6として作用する。
【0090】
図1乃至図4に示される有機電界発光素子の層構成の場合、透明絶縁体基板1は、発光を取り出すため透明なものを用いてもよく、ガラス、プラスチックフィルム等が用いられるがこれに限られるものではない。なお、上記透明とは、可視領域の光の透過率が10%以上であることを意味し、更に透過率が75%以上であってもよい。以下これに準ずる。
また、透明電極2は、透明絶縁体基板に準じて発光を取り出すための透明または半透明であって、且つ正孔の注入を行うため仕事関数の大きなものを用いてもよく、例えば仕事関数が4eV以上のものが挙げられる。なお、前記半透明とは、可視領域の光の透過率が70%以上であることを意味し、更に透過率が80%以上であってもよい。以下これに準ずる。
【0091】
具体例として、酸化スズインジウム(ITO)、酸化スズ(NESA)、酸化インジウム、酸化亜鉛等の酸化膜、及び蒸着或いはスパッタされた金、白金、パラジウム等が用いられるが、これに限られるものではない。電極のシート抵抗は、低いほどよく、数百Ω/□以下が挙げられ、さらには100Ω/□以下であってもよい。また、透明絶縁体基板に準じて、可視領域の光の透過率が10%以上で、更に透過率が75%以上であってもよい。
【0092】
図1乃至図3に示される有機電界発光素子の層構成の場合、電子輸送層や正孔輸送層等は、目的に応じて機能(電子輸送能、正孔輸送能)が付与された前記電荷輸送性ポリエステル単独で形成されていてもよいが、例えば正孔移動度を調節するため、前記電荷輸送性ポリエステル以外の正孔輸送材料を、層を構成する材料全体に対して0.1質量%乃至50質量%の範囲で混合分散して形成されてもよい。
前記正孔輸送材料としては、テトラフェニレンジアミン誘導体、トリフェニルアミン誘導体、カルバゾール誘導体、スチルベン誘導体、スピロフルオレン誘導体、アリールヒドラゾン誘導体、ポルフィリン系化合物が挙げられるが、これらの中では、電荷輸送性ポリエステルとの相溶性がよいものとして、テトラフェニレンジアミン誘導体、スピロフルオレン誘導体、トリフェニルアミン誘導体が挙げられる。
【0093】
また、電子移動度を調整する場合は、層を構成する材料全体に対して電子輸送材料を0.1質量%から50質量%の範囲で混合分散して形成されてもよい。
前記電子輸送材料として、オキサジアゾール誘導体、ニトロ置換フルオレノン誘導体、ジフェノキノン誘導体、チオピランジオキシド誘導体、シロール誘導体、キレート型有機金属錯体、多核または縮合芳香環化合物、ペリレン誘導体、トリアゾール誘導体、フルオレニリデンメタン誘導体等が挙げられる。
【0094】
また、正孔移動度及び電子移動度の両方の調整が必要な場合は、前記電荷輸送性ポリエステルに前記正孔輸送材料及び電子輸送材料の両方を一緒に混在させてもよい。
【0095】
さらに、成膜性の向上、ピンホール防止等のため、適切な樹脂(ポリマー)、添加剤を加えてもよい。具体的な樹脂としては、ポリカーボネート樹脂、ポリエステル樹脂、メタクリル樹脂、アクリル樹脂、ポリ塩化ビニル樹脂、セルロース樹脂、ウレタン樹脂、エポキシ樹脂、ポリススチレン樹脂、ポリビニルアセテート樹脂、スチレンブタジエン共重合体、塩化ビニリデン−アクリロニトリル共重合体、塩化ビニル−酢酸ビニル−無水マレイン酸共重合体、シリコーン樹脂、ポリ−N−ビニルカルバゾール樹脂、ポリシラン樹脂、ポリチオフェン、ポリピロール等の導電性樹脂等を用いることがある。また、添加剤としては、公知の酸化防止剤、紫外線吸収剤、可塑剤等を用いることがある。
【0096】
また、電荷注入性を向上させる場合は、正孔注入層や電子注入層を用いる場合があるが、正孔注入材料としては、トリフェニルアミン誘導体、フェニレンジアミン誘導体、フタロシアニン誘導体、インダンスレン誘導体、ポリアルキレンジオキシチオフェン誘導体等が用いられる。また、これらには、ルイス酸、スルホン酸等を混合してもよい。電子注入材料としては、Li、Ca、Ba、Sr、Ag、Au等の金属、LiF、MgF等の金属フッ化物、MgO、Al2O3、LiO等の金属酸化物が用いられる。
【0097】
また、前記電荷輸送性ポリエステルを発光機能以外で用いる場合は、発光性化合物を発光材料として用いる。発光材料としては、固体状態で高い発光量子効率を示す化合物を用いる。発光材料は、低分子化合物または高分子化合物どちらでもよく、有機低分子である場合の具体例としては、キレート型有機金属錯体、多核または縮合芳香環化合物、ペリレン誘導体、クマリン誘導体、スチリルアリーレン誘導体、シロール誘導体、オキサゾール誘導体、オキサベンゾジチアゾール誘導体、オキサチアゾール誘導体、オキサジアゾール誘導体等が、高分子の場合、ポリパラフェニレン誘導体、ポリパラフェニレンビニレン誘導体、ポリチオフェン誘導体、ポリアセチレン誘導体等が用いられる。具体例として、下記の化合物(XV−1)から(XV−17)が挙げられるが、これらに限定されたものではない。
【0098】
【化14】

【0099】
【化15】

【0100】
なお、上記構造式(XV−13)乃至(XV−17)中、Vは前記Y1と同一の2価の有機基、n及びgはそれぞれ独立に1以上の整数を表す。
【0101】
また、有機電界発光素子の耐久性向上あるいは発光効率向上を目的として、上記発光材料または前記電荷輸送性ポリエステル中にゲスト材料として発光材料と異なる色素化合物をドーピングしてもよい。該色素化合物のドーピングの割合としては、対象となる層の0.001質量%乃至40質量%が挙げられ、0.01質量%乃至10質量%であってもよい。このドーピングに用いられる色素化合物としては、発光材料との相容性が良く、かつ発光層の良好な薄膜形成を妨げない有機化合物が用いられ、具体的にはクマリン誘導体、DCM誘導体、キナクリドン誘導体、ペリミドン誘導体、ベンゾピラン誘導体、ローダミン誘導体、ベンゾチオキサンテン誘導体、ルブレン誘導体、ポルフィリン誘導体、ルテニウム、ロジウム、パラジウム、銀、レニウム、オスニウム、イリジウム、白金、および金などの金属錯体化合物等が挙げられる。
色素化合物の具体例として、下記の化合物(XVI−1)乃至(XVI−6)が挙げられるが、これらに限定されたものではない。
【0102】
【化16】

【0103】
また、発光層4は、前記発光材料単独で形成されていてもよいが、電気特性及び発光特性をさらに改善する等の目的で、前記発光材料に前記電荷輸送性ポリエステルを1質量%ないし50質量%の範囲で混合・分散して形成させてもよい。若しくは前記発光材料中に、前記電荷輸送性ポリエステル以外の電荷輸送性材料を1質量%ないし50質量%の範囲で混合・分散して形成させてもよい。また、前記電荷輸送性ポリエステルが発光特性も兼ね備えたものである場合、発光材料として用いてもよく、その場合、電気特性及び発光特性をさらに改善する等の目的で、前記電荷輸送性ポリエステル以外の電荷輸送性材料を1質量%ないし50質量%の範囲で混合分散して形成させてもよい。
【0104】
図4に示される有機電界発光素子の層構成の場合、電荷輸送能を持つ発光層6は、目的に応じて機能(正孔輸送能、あるいは電子輸送能)が付与された前記電荷輸送性ポリエステル中に、発光材料(具体的には、例えば前記発光材料(XV−1)乃至(XV−17)から選ばれる少なくとも1種)を50質量%以下で分散させた有機化合物層であるが、有機電界発光素子に注入される正孔と電子のバランスを調節するために前記電荷輸送性ポリエステル以外の電荷輸送材料を10質量%乃至50質量%分散させてもよい。
前記電荷輸送材料としては、電子移動度を調節する場合、電子輸送材料としてオキサジアゾール誘導体、ニトロ置換フルオレノン誘導体、ジフェノキノン誘導体、チオピランジオキシド誘導体、フルオレニデンメタン誘導体等が挙げられる。
【0105】
図1乃至図4に示される有機電界発光素子の層構成の場合、背面電極7には、真空蒸着され、電子注入を行うため仕事関数の小さな金属、金属酸化物、金属フッ化物等が使用される。金属としてはマグネシウム、アルミニウム、金、銀、インジウム、リチウム、カルシウムおよびこれらの合金が挙げられる。金属酸化物としては、酸化リチウム、酸化マグネシウム、酸化アルミニウム、酸化スズインジウム、酸化スズ、酸化インジウム、酸化亜鉛、酸化インジウム亜鉛等が挙げられる。また、金属フッ化物としては、フッ化リチウム、フッ化マグネシウム、フッ化ストロンチウム、フッ化カルシウム、フッ化アルミニウムが挙げられる。
【0106】
また、背面電極7上には、さらに素子の水分や酸素による劣化を防ぐために保護層を設けてもよい。具体的な保護層の材料としては、In、Sn、Pb、Au、Cu、Ag、Alなどの金属、MgO、SiO2、TiO2等の金属酸化物、ポリエチレン樹脂、ポリウレア樹脂、ポリイミド樹脂等の樹脂が挙げられる。保護層の形成には、真空蒸着法、スパッタリング法、プラズマ重合法、CVD法、コーティング法が適用される。
【0107】
これら図1乃至図4に示される有機電界発光素子は、まず透明電極2の上に各有機電界発光素子の層構成に応じた個々の層を順次形成することにより作製される。なお、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4、電子輸送層及び電子注入層の少なくとも一層5、或いは、電荷輸送能を持つ発光層6は、上記各材料を真空蒸着法、若しくは、適切な有機溶媒に溶解或いは分散し、得られた塗布液を用いて前記透明電極上にスピンコーティング法、キャスト法、ディップ法、インクジェット法等により形成される。
【0108】
正孔輸送層及び正孔注入層の少なくとも一層3、発光層4、電子輸送層及び電子注入層の少なくとも一層5、並びに、電荷輸送能を持つ発光層6の膜厚は、各々10μm以下、特に0.001μm以上5μm以下の範囲が挙げられる。上記各材料(前記非共役系高分子、発光材料等)の分散状態は分子分散状態でも微結晶などの粒子状態でも構わない。塗布液を用いた成膜法の場合、分子分散状態とするために分散溶媒は上記各材料の分散性及び溶解性を考慮して選択する必要がある。粒子状に分散するためには、ボールミル、サンドミル、ペイントシェイカー、アトライター、ホモジナイザー、超音波法等が利用される。
【0109】
そして最後に、図1及び図2に示す有機電界発光素子の場合には、電子輸送層及び電子注入層の少なくとも一層5の上に背面電極7を真空蒸着法、スパッタリング法等により形成することにより、本実施形態の有機電界発光素子が得られる。また、図3に示す有機電界発光素子の場合には、発光層4の上に、図4に示す有機電界発光素子の場合には、電荷輸送能を持つ発光層6の上に背面電極7を真空蒸着法、スパッタリング法等により形成することにより本実施形態の有機電界発光素子が得られる。
【0110】
<表示媒体>
本実施形態の表示媒体は、前記本実施形態の有機電界発光素子を、マトリクス状及びセグメント状の少なくとも一方で配置したことを特徴とする。本実施形態において有機電界発光素子をマトリクス状に配置する場合、電極のみをマトリクス状に配置する態様であってもよいし、電極及び有機化合物層の両方をマトリクス状に配置する態様であってもよい。また、本実施形態において有機電界発光素子をセグメント状に配置する場合、電極のみをセグメント状に配置する態様であってもよいし、電極及び有機化合物層の両方をセグメント状に配置する態様であってもよい。
【0111】
前記マトリクス状またはセグメント状の有機化合物層は、例えば前述したインクジェット法を用いることにより容易に形成する。
マトリクス状に配置した有機電界発光素子及びセグメント状に配置した有機電界発光素子から構成される表示媒体の駆動装置及び駆動方法としては、従来公知のものが用いられる。
【実施例】
【0112】
以下、本発明を、実施例を挙げてさらに具体的に説明する。ただし、これら各実施例は、本発明を制限するものではない。
【0113】
<電荷輸送性ポリエステルの合成>
(合成例1−例示化合物(15)の合成−)
窒素雰囲気下、1.6Mのn−ブチルリチウム(78.0ml)を、無水テトラヒドロフラン(100ml)に溶解させ、5−ブロモ−2−クロロピリジン(20.0g)を無水THE(80ml)に溶解させたものを、滴下した後、−78℃で3時間半撹拌した。そこに、1.6Mのn−ブチルリチウム(19.6ml)を追加し、−78℃で1時間撹拌したホウ酸トリ−n−ブチル(28.8g)を入れ、−78℃で2時間撹拌し、その後室温(25℃)で一晩撹拌した。
反応終了後、反応溶液を分液漏斗に移して有機層と水層を分け、水層に適量の水酸化ナトリウム(10%)を入れてpHを8にし、ジエチルエーテルで3回抽出した。有機層に2,2-ジメチル−1,3−プロパンジオール(10.4g、104.0mmol)、硫酸ナトリウムを入れて乾燥した。吸引ろ過をして、ろ液を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=1/1)で精製し、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(13.2g)を得た。
【0114】
【化17】

【0115】
1−ブロモ−4−ヨードベンゼン(18.6g)、DAA−1(17.5g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(4.6g)、トリデカン(10ml)の混合液を、210℃で7時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
室温(25℃)に冷却し、トルエンを加えてセライト濾過した。純水で洗浄し、有機層を抽出し、有機溶媒を留去して得られた生成物をシリカゲルカラムクロマト(ヘキサン4:トルエン1)で分離し、TAA−1(15.7g)を得た。
【0116】
【化18】

【0117】
窒素雰囲気下、TAA−1(13.8g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g)、エタノール(30ml)、2Mの炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、6時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−2(4.1g)を得た。
【0118】
【化19】

【0119】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−2(3.9g)を入れ、50℃で4時間加熱撹拌した。反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(14)を1.5g得た。
【0120】
【化20】

【0121】
得られたモノマー化合物(14)を1.0g用い、エチレングリコール(10ml)及びテトラブトキシチタン(0.02g)を、50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で5時間加熱撹拌した。原料である上記モノマー化合物(14)が反応して消失したのをTLCにより確認した後、50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。
【0122】
その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。
得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.7gのポリマー〔例示化合物:(15)〕を得た。
【0123】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、重量平均分子量Mw=3.7×104(スチレン換算)、Mw/Mn=2.22であり、原料である低分子化合物(モノマー化合物)の分子量から求めた重合度pは約45であった。
【0124】
【化21】

【0125】
(合成例2−例示化合物(17)の合成−)
4−メチルアセトアニリド(21.0g)、4−ヨードフェニルプロピオン酸メチル(64.4g)、炭酸カリウム(38.3g)、硫酸銅五水和物(2.3g)、n−トリデカン(50ml)を500mlの三口フラスコに入れ、窒素気流下、230℃で20時間加熱撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
反応後、トルエンで抽出し、有機層を純水で洗浄した。次いで、無水硫酸ナトリウムで乾燥後、溶剤を減圧下留去し、ヘキサンから再結晶することによりDAA−2(34.1g)を得た。
【0126】
【化22】

【0127】
次に、1−ブロモ−4−ヨードベンゼン(22.8g)、DAA−2(20.0g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(5.2g)、トリデカン(20ml)の混合液を、210℃で7時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
室温(25℃)に冷却し、トルエンを加えてセライト濾過した。純水で洗浄し、有機層を抽出し、有機溶媒を留去して得られた生成物をシリカゲルカラムクロマト(ヘキサン4:トルエン1)で分離し、TAA−3(16.1g)を得た。
【0128】
【化23】

【0129】
次に、窒素雰囲気下、TAA−3(14.2g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g)、エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)を、トルエンに溶解させ、8時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−4(5.2g)を得た。
【0130】
【化24】

【0131】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(50ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−4(4.0g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(15)を1.3g得た。
【0132】
【化25】

【0133】
得られたモノマー化合物(15)(1.0g)、エチレングリコール(10ml)及びテトラブトキシチタン(0.02g)を、50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で6時間加熱撹拌した。原料である上記モノマー化合物(15)が反応して消失したのをTLCにより確認した後、50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。
【0134】
その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.6gのポリマー〔例示化合物:(17)〕を得た。
【0135】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=4.6×104(スチレン換算)、Mw/Mn=2.15であり、モノマーの分子量から求めた重合度pは約55であった。
【0136】
【化26】

【0137】
(合成例3−例示化合物(27)の合成−)
1−アセトアミドナフタレン(25.0g)、4−ヨードフェニルプロピオン酸メチル(64.4g)、炭酸カリウム(38.3g)、硫酸銅五水和物(2.3g)、n−トリデカン(50ml)を500mlの三口フラスコに入れ、窒素気流下、230℃で20時間加熱撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
反応後、トルエンで抽出し、有機層を純水で洗浄した。次いで、無水硫酸ナトリウムで乾燥後、溶剤を減圧下留去し、ヘキサンから再結晶することによりDAA−3(36.5g)を得た。
【0138】
【化27】

【0139】
次に、1−ブロモ−4−ヨードベンゼン(20.3g)、DAA−3(20.0g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(5.2g)、トリデカン(20ml)の混合液を、210℃で12時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
室温(25℃)に冷却し、トルエンを加えてセライト濾過した。純水で洗浄し、有機層を抽出し、有機溶媒を留去して得られた生成物をシリカゲルカラムクロマト(ヘキサン4:トルエン1)で分離し、TAA−5(17.2g)を得た。
【0140】
【化28】

【0141】
次に、窒素雰囲気下、TAA-5(15.3g)、テトラキス(トリフェニルホスフィン)パラジウム(0)を11.1g,エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5-ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、10時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−6(5.5g)を得た。
【0142】
【化29】

【0143】
さらに、窒素雰囲気下、トリフェニルホスフィンを(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−6(4.3g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(24)を1.1g得た。
【0144】
【化30】

【0145】
得られたモノマー化合物(24)(1.0g)、エチレングリコール(10ml)及びテトラブトキシチタン(0.02g)を50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で7時間加熱撹拌した。原料である上記モノマー化合物(24)が反応して消失したのをTLCにより確認した後50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。
【0146】
その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.5gのポリマー〔例示化合物:(27)〕を得た。
【0147】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=6.0×104(スチレン換算)、Mw/Mn=2.15であり、モノマーの分子量から求めた重合度pは約64であった。
【0148】
【化31】

【0149】
(合成例4−例示化合物(26)の合成−)
窒素雰囲気下、1−ブロモ−4−ヨードベンゼン(19.2g)、DAA−4(20.0g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(5.2g)、トリデカン(25ml)の混合液を、210℃で18時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
冷却後、トルエンを加えてセライト濾過し、トルエンを留出して得られた生成物をシリカゲルカラムクロマト(ヘキサン2:トルエン1)で分離し、TAA−7を14.5g得た。
【0150】
【化32】

【0151】
次に、窒素雰囲気下、TAA−7(16.4g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g)、エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、8時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA-8(5.8g)を得た。
【0152】
【化33】

【0153】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−8(4.6g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液により洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(23)を1.3g得た。
【0154】
【化34】

【0155】
得られたモノマー化合物(23)を1.0g、エチレングリコール(10ml)およびテトラブトキシチタン(0.02g)を50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で5時間加熱撹拌した。原料である上記モノマー化合物(23)が反応して消失したのをTLCにより確認した後50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.7gのポリマー〔例示化合物:((26)〕を得た。
【0156】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=4.7×104(スチレン換算)、Mw/Mn=2.43であり、モノマーの分子量から求めた重合度pは約48であった。
【0157】
【化35】

【0158】
(合成例5−例示化合物(18)の合成−)
1-ブロモ-4-ヨードベンゼン(21.0g)、DAA−5(20.0g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(5.2g)、トリデカン(20ml)の混合液を、210℃で7時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
室温(25℃)に冷却し、トルエンを加えてセライト濾過した。純水で洗浄し、有機層を抽出し、有機溶媒を留去して得られた生成物をシリカゲルカラムクロマト(ヘキサン4:トルエン1)で分離し、TAA−9(14.3g)を得た。
【0159】
【化36】

【0160】
次に、窒素雰囲気下、TAA−9(14.2g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g)、エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、6時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−10(4.1g)を得た。
【0161】
【化37】

【0162】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA-10(3.9g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(16)を1.4g得た。
【0163】
【化38】

【0164】
得られたモノマー化合物(16)(1.0g)、エチレングリコール(10ml)およびテトラブトキシチタン(0.02g)を50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で5時間加熱撹拌した。原料である上記モノマー化合物(16)が反応して消失したのをTLCにより確認した後50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.7gのポリマー〔例示化合物:(18)〕を得た。
【0165】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=6.1×104(スチレン換算)、Mw/Mn=2.31であり、モノマーの分子量から求めた重合度pは約72であった。
【0166】
【化39】

【0167】
(合成例6−例示化合物(25)の合成−)
窒素雰囲気下、3-ブロモビフェニル(26.3g)、DAA−6(28.0g)、硫酸銅(II)五水和物(1.2g)、炭酸カリウム(7.3g)、トリデカン(30ml)の混合液を、210℃で20時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
冷却後、トルエンを加えてセライト濾過し、トルエンを留出して得られた生成物をシリカゲルカラムクロマト(トルエン)で分離し、TAA−11(18.5g)を得た。
【0168】
【化40】

【0169】
次に、窒素雰囲気下、TAA−11(16.2g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g),エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、6時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−12(5.2g)を得た。
【0170】
【化41】

【0171】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−12(4.5g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(22)を1.2g得た。
【0172】
【化42】

【0173】
得られたモノマー合物(22)を1.0g、エチレングリコール(10ml)およびテトラブトキシチタン(0.02g)を50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で5時間加熱撹拌した。原料である上記モノマー化合物(22)が反応して消失したのをTLCにより確認した後、50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.5gのポリマー〔例示化合物:(25)〕を得た。
【0174】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=5.4×104(スチレン換算)、Mw/Mn=2.34であり、モノマーの分子量から求めた重合度pは約56であった。
【0175】
【化43】

【0176】
<実施例1>
透明絶縁基板上に形成されたITO(三容真空社製)を短冊状のフォトマスクを用いてフォトリソグラフィによりパターニングし、さらにエッチング処理することにより短冊状のITO電極(幅2mm)を形成した。次に、このITOガラス基板を中性洗剤、超純水、アセトン(電子工業用、関東化学製)及びイソプロパノール(電子工業用、関東化学製)で超音波を各5分間加えて洗浄した後、スピンコーターで乾燥させた。
前記基板に、正孔輸送層として、前記電荷輸送性ポリエステル〔例示化合物(15)〕の5質量%モノクロロベンゼン溶液を調製し、0.2μmのPTFEフィルターで濾過した後、スピンコーター法により厚さ0.050μmの薄膜を形成した。発光材料として前記例示化合物(XV−1)を蒸着して、厚さ0.055μmの発光層を形成した。続いて短冊状の穴が設けられている金属性マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0177】
<実施例2>
前記電荷輸送性ポリエステル〔例示化合物(17)1質量部、ポリ(N−ビニルカルバゾール)4質量部、及び前記例示化合物(XVI−1)0.02質量部の10質量%ジクロロエタン溶液を調製し、0.2μmのPTFEフィルターで濾過した。この溶液を用いて、実施例1に準じて短冊状のITO電極をエッチングし、洗浄し、乾燥したガラス基板上に、スピンコーター法により膜厚0.15μmの薄膜を形成した。充分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0178】
<実施例3>
実施例1に準じてエッチング、洗浄し、乾燥したITOガラス基板上に、実施例1に準じて前記電荷輸送性ポリエステル〔例示化合物(18)〕を厚さ0.050μmの正孔輸送層を形成した。次いで、発光層として前記例示化合物(XV−1)と前記例示化合物(XVI−1)との混合物(質量比:99/1)を厚さ0.065μm、電子輸送層として前記例示化合物(XV−9)を厚さ0.030μmで形成した。充分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0179】
<実施例4>
実施例1に準じてエッチング、洗浄したITOガラス基板上に、実施例1に準じて正孔輸送層として、電荷輸送性ポリエステル〔例示化合物(25)〕を厚さ0.050μmでインクジェット法(ピエゾインクジェット方式)により形成した。次いで、発光層として前記例示化合物(XVI−5)を5質量%含んだ前記例示化合物(XV−16、n=8)を厚さ0.065μmでスピンコーター法により形成した。充分乾燥させた後、Caを厚さ0.08μm、Alを厚さ0.15μmに蒸着して、2mm幅、合計0.23μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0180】
<実施例5>
実施例3で用いた電荷輸送性ポリエステル〔例示化合物(18)〕の代わりに、前記電荷輸送性ポリエステル〔例示化合物(25)〕を用いた以外は、実施例3に準じて有機電界発光素子を作製した。
【0181】
<実施例6>
実施例3で用いた電荷輸送性ポリエステル〔例示化合物(18)〕の代わりに、前記電荷輸送性ポリエステル〔例示化合物(26)〕を用いた以外は、実施例3に準じて有機電界発光素子を作製した。
【0182】
<実施例7>
実施例3で用いた電荷輸送性ポリエステル〔例示化合物(18)〕の代わりに、前記電荷輸送性ポリエステル〔例示化合物(27)〕を用いた以外は、実施例3に準じて有機電界発光素子を作製した。
【0183】
<実施例8>
電荷輸送性ポリエステル〔例示化合物(15)〕の1.5質量%ジクロロエタン溶液を調製し、0.2μmのPTFEフィルターで濾過した。この溶液を用いて、実施例1に準じてエッチング、洗浄し、乾燥したITOガラス基板に、インクジェット法により膜厚0.05μmの薄膜を形成した。次いで、発光材料として前記例示化合物(XVI−5)を5質量%含んだ前記例示化合物(XV−16、n=8)をスピンコート法により厚さ0.050μmの発光層を形成した。充分乾燥させた後、Caを厚さ0.08μm、Alを厚さ0.15μmに蒸着して、2mm幅、合計0.23μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0184】
<実施例9>
実施例1に準じてエッチング、洗浄し、乾燥したITOガラス基板上に、発光層として前記例示化合物(XV―16)を厚さ0.050μmとなるように形成した。電荷輸送性ポリエステル〔例示化合物(15)〕の1.5質量%ジクロロエタン溶液を調製し、0.2μmのPTFEフィルターで濾過した。この溶液を用いて、前記発光層上にスピンコーター法により厚さ0.015μmの電子輸送層を形成した。充分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0185】
<比較例1>
実施例3で用いた電荷輸送性ポリエステル〔例示化合物(18)〕の代わりに、下記構造式(XVII)で示される化合物を用いた他は、実施例3に準じて有機EL素子を作製した。
【0186】
【化44】

【0187】
<比較例2>
電荷輸送性ポリマーとしてポリビニルカルバゾール(PVK)を2質量部、発光材料として前記例示化合物(XV−1)を0.1質量部、電子輸送材料として前記化合物(XV−9)を1質量部混合し、10質量%ジクロロエタン溶液を調製し、0.2μmのPTFEフィルターで濾過した。この溶液を用いて、2mm幅の短冊型ITO電極をエッチングにより形成したガラス基板上に、ディップ法により塗布して膜厚0.15μmの正孔輸送層を形成した。十分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0188】
<比較例3>
電荷輸送性ポリマーとして下記構造式(XVIII)を2質量部、発光材料として前記例示化合物(XV−1)を0.1質量部、電子輸送材料として前記化合物(XV−9)を1質量部混合し、10質量%ジクロロエタン溶液を調製し、0.1μmのPTFEフィルターで濾過した。この溶液を用いて、2mm幅の短冊型ITO電極をエッチングにより形成したガラス基板上に、ディップ法により塗布して膜厚0.15μmの正孔輸送層を形成した。十分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0189】
【化45】

【0190】
以上のように作製した有機EL素子を、乾燥窒素中で、ITO電極側をプラス、背面電極をマイナスとして直流電圧を印加して測定を行った。
発光寿命の評価は、室温(25℃)において直流駆動方式(DC駆動)で初期輝度を1000cd/m2とし、比較例1の素子の輝度(初期輝度L0:1000cd/m2)が輝度L/初期輝度L0=0.5となった時点の駆動時間を1.0とした場合の相対時間、及び、素子の輝度が輝度L/初期輝度L0=0.5となった時点での電圧上昇分(=電圧/初期駆動電圧)により評価した。結果を表9に示す。
【0191】
【表9】

【0192】
表9の結果より、本実施形態における電荷輸送性ポリエステルを用いた実施例1乃至9の有機電界発光素子では、比較例1乃至3の有機電界発光素子に比べ電圧の上昇が抑制され、発光寿命が従来の電荷輸送性ポリマーを用いたものよりも良好であることがわかる。
また、本実施形態における有機電界発光素子では、電荷輸送性ポリエステルが有機溶媒に溶解性を示していることから、大面積化され、有機電界発光素子が容易に製造されることがわかる。
【符号の説明】
【0193】
1 透明絶縁体基板
2 透明電極
3 正孔輸送層及び正孔注入層の少なくとも一層
4 発光層
5 電子輸送層及び電子注入層の少なくとも一層
6 電荷輸送能を有する発光層
7 背面電極
【技術分野】
【0001】
本発明は、有機電界発光素子及び表示媒体に関するものである。
【背景技術】
【0002】
電界発光素子は、自発光性の全固体素子である。有機化合物を用いた電界発光素子研究は、最初アントラセン等の単結晶を用いて始まったが、その後蒸着法による薄膜化が試みられている(例えば、非特許文献1参照)。
これら素子の発光は、電極の一方から電子が注入され、もう一方の電極から正孔が注入されることにより、素子中の発光材料が高エネルギー準位に励起され、励起された発光体が基底状態に戻る際の余分なエネルギーを光として放出する現象である。
【0003】
有機電界発光素子としては、近年低分子化合物の代わりに高分子材料を用いる電界発光素子についても研究・開発が進められ、ポリ(p−フェニレンビニレン)等の導電性高分子素子(例えば、特許文献1又は非特許文献2参照)、ポリフォスファゼンの側鎖にトリフェニルアミンを導入した高分子素子(例えば、非特許文献3参照)、正孔輸送性ポリビニルカルバゾール中に電子輸送材料と蛍光色素を混入した素子(例えば、非特許文献4参照)が提案されている。
【0004】
また、特定のアミン構造から選択された少なくとも1種を部分構造として含む繰り返し単位よりなるホール輸送性ポリエステルを有機化合物層とする技術が開示されている(例えば、特許文献2参照)。
さらに、作製法においては、キャステイング法によって素子が得られることが報告されている(例えば、非特許文献5及び6参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−92576号公報
【特許文献2】特開2002−43066号公報
【非特許文献】
【0006】
【非特許文献1】Thin Solid Films,94,171(1982)
【非特許文献2】Nature,357,477(1992)
【非特許文献3】第42回高分子討論会予稿集20J21(1993)
【非特許文献4】第38回応用物理学関係連合講演会予稿集31p−G−12(1991)
【非特許文献5】第50回応用物理学会学術講演予稿集,29p−ZP−5(1989)
【非特許文献6】第51回応用物理学会学術講演予稿集,28a−PB−7(1990)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の課題は、ポリビニルカルバゾールを用いた有機電界発光素子と比べ、素子寿命が長い有機電界発光素子を提供することにある。
【課題を解決するための手段】
【0008】
上記課題は、以下の手段により解決される。即ち、
請求項1に係る発明は、
少なくとも一方が透明又は半透明である陽極及び陰極よりなる一対の電極と、
該一対の電極間に挾持され、少なくとも一層が下記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する一つ又は複数の有機化合物層と、を有する、有機電界発光素子である。
【0009】
【化1】

【0010】
前記一般式(I)中、A1は下記一般式(II)で示される構造から選択された少なくとも1種を表し、Y1は各々独立に置換又は未置換の2価の炭化水素基を表し、mは各々独立に1以上5以下の整数を表し、pは5以上5000以下の整数を表す。R1は各々独立に水素原子、アルキル基、置換若しくは未置換のアリール基又は置換若しくは未置換のアラルキル基を表す。
【0011】
【化2】

【0012】
前記一般式(II)中、Arは各々独立に置換若しくは未置換のフェニル基、置換若しくは未置換の芳香環数2の1価の多核芳香族炭化水素基、置換若しくは未置換の芳香環数2若しくは3の1価の縮合芳香族炭化水素基、又は置換若しくは未置換の1価の芳香族複素環基を表し、jは各々独立に0又は1を表し、Tは各々独立に炭素数1以上6以下の2価の直鎖状炭化水素基又は炭素数2以上10以下の2価の分枝鎖状炭化水素基を表し、Xは下記式(III)で示される基を表す。
【0013】
【化3】

【0014】
請求項2に係る発明は、
前記有機化合物層が、発光層と、電子輸送層及び電子注入層の少なくとも一層と、を含み、前記発光層、前記電子輸送層、及び前記電子注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子である。
【0015】
請求項3に係る発明は、
前記有機化合物層が、発光層と、正孔輸送層及び正孔注入層の少なくとも一層と、を含み、前記発光層、前記正孔輸送層、及び前記正孔注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子である。
【0016】
請求項4に係る発明は、
前記有機化合物層が、発光層と、正孔輸送層及び正孔注入層の少なくとも一層と、電子輸送層及び電子注入層の少なくとも一層と、を含み、前記発光層、前記正孔輸送層、前記正孔注入層、前記電子輸送層、及び前記電子注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子である。
【0017】
請求項5に係る発明は、
前記有機化合物層が、電荷輸送機能を持つ発光層のみから構成され、前記電荷輸送機能を持つ発光層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子である。
【0018】
請求項6に係る発明は、
請求項1から請求項5のいずれか1項に記載の有機電界発光素子を、マトリクス状及びセグメント状の少なくとも一方で配置した、表示媒体である。
【発明の効果】
【0019】
請求項1に係る発明によれば、ポリビニルカルバゾールを用いた有機電界発光素子と比べ、素子寿命が長い有機電界発光素子が得られる。
請求項2に係る発明によれば、上記層構成を有していない場合に比べ、発光効率が高い有機電界発光素子が得られる。
請求項3に係る発明によれば、上記層構成を有していない場合に比べ、耐久性が高い有機電界発光素子が得られる。
請求項4に係る発明によれば、上記層構成を有していない場合に比べ、より低電圧で駆動する有機電界発光素子が得られる。
請求項5に係る発明によれば、上記層構成を有していない場合に比べ、層構成が単純な有機電界発光素子が得られる。
請求項6に係る発明によれば、ポリビニルカルバゾールを用いた表示媒体と比べ、耐久性が高い表示媒体が得られる。
【図面の簡単な説明】
【0020】
【図1】実施形態の有機電界発光素子の層構成の一例を示した概略構成図である。
【図2】実施形態の有機電界発光素子の層構成の他の一例を示した概略構成図である。
【図3】実施形態の有機電界発光素子の層構成の他の一例を示した概略構成図である。
【図4】実施形態の有機電界発光素子の層構成の他の一例を示した概略構成図である。
【発明を実施するための形態】
【0021】
以下、本願発明の一例である実施形態について詳細に説明する。
<有機電界発光素子>
本実施形態の有機電界発光素子(以下、「有機EL素子」という場合がある)は、少なくとも一方が透明又は半透明である陽極及び陰極よりなる一対の電極と、該一対の電極間に挾持され、少なくとも一層が下記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する一つ又は複数の有機化合物層と、を有することを特徴とする。
【0022】
【化4】

【0023】
前記一般式(I)中、A1は下記一般式(II)で示される構造から選択された少なくとも1種を表し、Y1は各々独立に置換又は未置換の2価の炭化水素基を表し、mは各々独立に1以上5以下の整数を表し、pは5以上5000以下の整数を表す。R1は各々独立に水素原子、アルキル基、置換若しくは未置換のアリール基又は置換若しくは未置換のアラルキル基を表す
【0024】
【化5】

【0025】
前記一般式(II)中、Arは各々独立に置換若しくは未置換のフェニル基、置換若しくは未置換の芳香環数2の1価の多核芳香族炭化水素基、置換若しくは未置換の芳香環数2若しくは3の1価の縮合芳香族炭化水素基又は置換若しくは未置換の1価の芳香族複素環基を表し、jは各々独立に0又は1を表し、Tは各々独立に炭素数1以上6以下の2価の直鎖状炭化水素基又は炭素数2以上10以下の2価の分枝鎖状炭化水素基を表し、Xは下記式(III)で示される基を表す。
【0026】
【化6】

【0027】
本実施形態における電荷輸送性ポリエステルは、ビピリジンを分子構造中に含むことにより、イオン化ポテンシャルが低くコントロールされるため、電極からの電荷注入性が改善されるものと推測される。さらに上記ビピリジンを含んだ構造では溶剤や樹脂に対する溶解性及び相溶性に優れている。従って、上記電荷輸送性ポリエステルを用いることで、大面積化され、有機電界発光素子が容易に製造されるものと推測される。
【0028】
また、上記電荷輸送性ポリエステルは後述する構造を選択することで、正孔輸送能、電子輸送能のいずれの機能をも付与しうるため、目的に応じて正孔輸送層、発光層、電子輸送層等のいずれの層にも用いられる。さらに、本実施形態における電荷輸送性ポリエステルは、ガラス転移温度が比較的高く、しかも電荷の移動度が大きいことから、電流が流れやすく電圧の上昇が抑制され、発光時に熱が発生しにくくなることで安定性に優れ、素子寿命が長くなるものと推測される。
なお本実施形態において、「電荷輸送性ポリエステル」とは、正孔又は電子を電荷として輸送する半導体であるポリエステルを意味する。
【0029】
(電荷輸送性ポリエステル)
以下、本実施形態における前記電荷輸送性ポリエステルについて詳述する。まず、該電荷輸送性ポリエステルの特徴である一般式(I)におけるA1の構造について説明する。
前記一般式(II)中、Arは各々独立に、置換若しくは未置換のフェニル基、置換若しくは未置換の芳香環数2の1価の多核芳香族炭化水素基、置換若しくは未置換の芳香環数2若しくは3の1価の縮合芳香族炭化水素基又は置換若しくは未置換の1価の芳香族複素環基を表す。尚、一般式(II)中に2つ存在するArは、同一であっても異なっていても構わないが、同一である方が製造容易である。
【0030】
ここで、当該多核芳香族炭化水素基及び縮合芳香族炭化水素基とは、本実施形態においては、具体的には以下に定義される多環式芳香環(すなわち、多核芳香族炭化水素又は縮合芳香族炭化水素)を有する基のことを意味する。
すなわち、「多核芳香族炭化水素」とは、炭素と水素とから構成される芳香環が2個以上存在し、環同士が炭素−炭素結合によって結合している炭化水素を表す。具体的には、ビフェニル等が挙げられる。また、「縮合芳香族炭化水素」とは、炭素と水素とから構成される芳香環が2個以上存在し、これらの芳香環同士が隣接して結合する1対の炭素原子を共有している炭化水素化合物を表す。具体的には、ナフタレン、アントラセン、フェナントレン、フルオレン等が挙げられる。
【0031】
さらに一般式(II)中において、Arを表す構造として選択される芳香族複素環基とは、本実施形態においては、以下に定義される芳香族複素環を有する基のことを意味する。
すなわち、「芳香族複素環」とは、炭素と水素以外の元素も含む芳香環を表し、例えば、その環骨格を構成する原子数(Nr)が、5及び6の少なくともいずれかであるものが挙げられる。また、環骨格を構成する炭素原子以外の原子(異種原子)の種類及び数は特に限定されないが、例えば、硫黄原子、窒素原子、酸素原子等が用いられ、前記環骨格中には2種類以上の異種原子、及び、2個以上の異種原子の少なくともいずれかが含まれてもよい。特に5員環構造をもつ複素環として、例えば、チオフェン、ピロール及びフラン、または、前記化合物の3位及び4位の炭素を窒素で置き換えた複素環が用いられ、6員環構造を持つ複素環として、例えばピリジンが用いられる。
【0032】
更に、上記芳香族複素環基は、上記芳香族複素環を有していればよく、上記芳香族複素環で構成された基のほか、芳香環に上記芳香族複素環が置換した基、及び上記芳香族複素環に芳香環が置換した基の何れも含み、上記芳香環の具体例としては上述の芳香環が挙げられる。
すなわち、上記芳香族複素環基は、例えば、上述の多環式芳香環(すなわち芳香環数2以上の1価の多核芳香族炭化水素又は芳香環数2以上の1価の縮合芳香族炭化水素)において、1つ以上の芳香環が芳香族複素環に置き換えられた基であってもよく、具体的には、例えば、チオフェニルフェニル基、フェニルピリジン基、フェニルピロール基等が挙げられる。
【0033】
一般式(II)中、Arで表されるフェニル基、多核芳香族炭化水素基、縮合芳香族炭化水素基、又は芳香族複素環基を更に置換する置換基としては、例えば、水素原子、アルキル基、アルコキシ基、アリール基、アラルキル基、置換アミノ基、ハロゲン原子等が挙げられる。
前記アルキル基としては、例えば炭素数1以上10以下のものが挙げられ、例えば、メチル基、エチル基、プロピル基、イソプロピル基等が挙げられる。
前記アルコキシ基としては、例えば炭素数1以上10以下のものが挙げられ、例えば、メトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基等が挙げられる。
前記アリール基としては、例えば炭素数6以上20以下のものが挙げられ、例えば、フェニル基、トルイル基等が挙げられる、
前記アラルキル基としては、例えば炭素数7以上20以下のものが挙げられ、例えば、ベンジル基、フェネチル基等が挙げられる。
前記置換アミノ基の置換基としては、例えば、アルキル基、アリール基、アラルキル基等が挙げられ、具体例は前述の通りである。
【0034】
一般式(II)中、Tは、各々独立に、炭素数1以上6以下の2価の直鎖状炭化水素基又は炭素数2以上10以下の2価の分枝鎖状炭化水素基を表し、その中でも、例えば炭素数が2以上6以下の2価の直鎖状炭化水素基及び炭素数3以上7以下の2価の分枝鎖状炭化水素基のものが挙げられる。これらの中でもより具体的には、例えば以下に示す2価の炭化水素基が特に挙げられる。
【化7】

【0035】
一般式(II)中、jは、各々独立に、0又は1を表す。
なお、一般式(II)中に2つ存在するT及びjは、それぞれ同一であっても異なっていてもかまわないが、いずれも同一である方が、電荷輸送性ポリエステルの製造容易性が高い。
【0036】
以上説明した一般式(II)で示される構造から選択された少なくとも1種は、前記一般式(I)で示される電荷輸送性ポリエステルにおけるA1である。
なお、一般式(I)で表される電荷輸送性ポリエステル中に存在する複数のA1は、同一の構造であっても、異なった構造であってもよい。
【0037】
一般式(I)中、Y1は、各々独立に、置換若しくは未置換の2価の炭化水素基を表す。Y1で表される2価の炭化水素基は、2価のアルコール残基であり、例えば、アルキレン基、(ポリ)エチレンオキシ基、(ポリ)プロピレンオキシ基、アリーレン基、2価の複素環基又はこれらの組み合わせが挙げられる。Y1で表される2価の炭化水素基の炭素数としては、例えば、1以上18以下の範囲が挙げられ、炭素数1以上6以下の範囲であってもよい。
すなわち、Y1で表される2価の炭化水素基としては、具体的には、例えば、炭素数1以上10以下のアルキレン基、又は炭素数6以上18以下のアリーレン基が挙げられ、炭素数1以上5以下のアルキレン基であってもよい。
Y1は、具体的には、例えば、下記式(IV−1)から(IV−8)の中から選択される基が挙げられる。
なお、一般式(I)で表される電荷輸送性ポリエステル中に存在する複数のY1は、同一であっても異なっていてもよい。
【0038】
【化8】

【0039】
上記式(IV−1)、(IV−2)、(IV−5)及び(IV−6)中、R3及びR4は、それぞれ水素原子、置換若しくは未置換の炭素数1以上4以下のアルキル基、置換若しくは未置換の炭素数1以上4以下のアルコキシ基、置換若しくは未置換のフェニル基、置換若しくは未置換のアラルキル基、又はハロゲン原子を表し、a、b、及びcはそれぞれ独立に1以上10以下の整数を表し、eは0以上2以下の整数を表し、d及びfは0又は1を表し、Vは下記(V−1)から(V−12)で表される基を表す。
【0040】
【化9】

【0041】
上記式(V−1)、(V−10)、(V−11)、及び(V−12)中、gは1以上20以下の整数を、hは0以上10以下の整数を表す。
【0042】
一般式(I)中、mは、各々独立に1以上5以下の整数を表し、一般式(I)で表される電荷輸送性ポリエステル中に存在する複数のmは、同一であっても異なっていてもよい。
一般式(I)中、R1は、各々独立に水素原子、アルキル基、置換若しくは未置換のアリール基、又は置換若しくは未置換のアラルキル基を表す。上記アルキル基、アリール基、及びアラルキル基、並びにそれらを置換する置換基の具体例については、上記Arの芳香族環を置換する置換基として示した具体例と同じである。
また一般式(I)中、R1は、上記のなかでも、水素原子又はフェニル基が挙げられ、低コスト化、製造容易性の観点からは水素原子が挙げられる。また一般式(I)における2つのR1は、同一でも異なっていてもよいが、同一である方が製造上容易である。
【0043】
一般式(I)中、pは5以上5,000以下の整数を表すが、10以上1000以下の範囲であってもよい。
より具体的には、前記電荷輸送性ポリエステルの重量平均分子量Mwは、例えば5,000以上300,000以下の範囲が挙げられ、10,000以上100,0000以下の範囲であってもよい。
上記重量平均分子量Mwは以下の方法により測定される。すなわち重量平均分子量は、電荷輸送性ポリエステルの1.0質量%テトラヒドロフラン溶液を調製し、示差屈折率検出器(RI)を用いて、ゲル浸透クロマトグラフィー(GPC)により、標準サンプルとしてスチレンポリマーを用いて測定する。
【0044】
また、前記電荷輸送性ポリエステルのガラス転移温度(Tg)は、例えば60℃以上300℃以下が挙げられ、100℃以上200℃以下であってもよい。
なお、上記ガラス転移温度は、示差走査型熱量計によりα−Al2O3をリファレンスとし、サンプルをゴム状態になるまで昇温し、液体窒素に浸し急冷した後、再度昇温速度10℃/分の条件で昇温して測定する。
【0045】
一般式(I)で表される電荷輸送性ポリエステルは、例えば、下記構造式(VI)で示される電荷輸送性モノマーを、例えば第4版実験化学講座28巻(日本化学会編、丸善、1992)などに記載された公知の方法で重合することにより合成される。
【0046】
【化10】

【0047】
一般式(VI)中、Ar、X、T、及びjは、それぞれ前記一般式(II)におけるAr、X、T、及びjと同一である。一般式(VI)中、A2は、水酸基、ハロゲン原子、又は−O−R5(R5は、置換若しくは未置換のアルキル基、置換若しくは未置換のアリール基、又は置換若しくは未置換のアラルキル基を表す)を表す。
ここで、前記一般式(VI)で示される構造の具体例を、表1から表4に示す。なお、以下、下記表において化合物番号(構造番号)を付した電荷輸送性モノマーの各具体例に関し、例えば、5の番号を付した具体例については「モノマー化合物(5)」という。
なお、下記表に示した電荷輸送性モノマーの各具体例においては、一般式(VI)中に示された2つのAr、T、j、及びA2が、それぞれ同じである。
【0048】
【表1】

【0049】
【表2】

【0050】
【表3】

【0051】
【表4】

【0052】
ここでまず、上記一般式(VI)で示される電荷輸送性モノマーの合成法について説明する。以下に電荷輸送性モノマーの合成法を例示するが、これに限定するものではない。
上記一般式(VI)で示される電荷輸送性モノマー(ビピリジン化合物)の合成方法としては、例えば、クロスカップリングビアリール合成を利用する方法が挙げられる。クロスカップリングビアリール合成の具体例としては、例えば、Suzuki反応、Kharasch反応、Negishi反応、Stille反応、Grignard反応、又はUllmann反応等が挙げられる。
【0053】
上記一般式(VI)で示される電荷輸送性モノマーの合成方法の具体例としては、例えば、下記式のように、一般式(VII)で示される化合物と一般式(VIII)で示される化合物とのクロスカップリング反応による合成方法が挙げられるが、これに限定されるものではない。
【0054】
【化11】

【0055】
【化12】

【0056】
前記一般式(VII)、一般式(VIII)及び一般式(IX)中、X及びGは、ハロゲン原子、B(OH)2、前記構造式(XI−1)で示される置換基、前記構造式(XI−2)で示される置換基、又は前記構造式(XI−3)で示される置換基を表す。また、前記一般式(VII)、一般式(IX)及び一般式(X)中、A2、T、j、及びArは、それぞれ前記一般式(VI)中のA2、T、j、及びArと同義である。
また、前記反応の際に、必要に応じて、金属、金属錯体触媒、塩基、又は溶媒等を用いてもよい。
また、合成反応の際、金属若しくは金属錯体の触媒、塩基、溶媒、又は有機ホスフィン配位子などの助触媒を用いてもよい。
【0057】
上記金属としては、例えば、Pd、Cu、Ti、Sn、Ni、Pt、Zn等が用いられる。
上記金属錯体としては、例えば、テトラキス(トリフェニルホスフィン)パラジウム(Pd(PPh3)4)、酢酸パラジウム(II)(Pd(OCOCH3)2)、トリス(ジベンジリデンアセトン)ジパラジウム(0)(Pd2(dba)3)、ジ(トリフェニルホスフィン)ジクロロパラジウム(Pd(PPh3)2Cl2)、1,1′−ビス(ジフェニルホスフィノ)フェロセン−パラジウム(II)ジクロリド−ジクロロメタン錯体(Pd(dppf)2Cl2)、Pd/C、ニッケル(II)アセチルアセトナート(Ni(acac)2)、又は塩化亜鉛(ZnCl2)等が用いられる。
上記塩基としては、例えば、炭酸ナトリウム(Na2Co3)、炭酸カリウム(K2Co3)、炭酸セシウム(Cs2CO3)、又は水酸化バリウム(Ba(OH)2)などの無機塩基や、トリエチルアミン(NEt3)、ジイソプロピルアミン(NH(i−Pr)2)、ジエチルアミン(NHEt2)、ジメチルアミン(NHMe2)、トリメチルアミン(NMe3)、1,8−ジアザビシクロ[5.4.0]−7−ウンデセン(DBU)、N,N−ジメチル-4-アミノピリジン(DMAP)、ピリジンなどの有機塩基が用いられる。
上記溶媒は、反応を著しく阻害しない溶媒であればよく、例えば、ベンゼン、トルエン、キシレン、メシチレンなどの芳香族炭化水素溶媒、ジエチルエ−テル、テトラヒドロフラン、ジオキサンなどのエ−テル溶媒、アセトニトリル、ジメチルホルムアミド、ジメチルスルホキシド、メタノール、エタノール、イソプロピルアルコール又は水等が用いられる。
また、上記反応際に、必要に応じて、例えば、トリフェニルホスフィン(PPh3)、トリ−o−トリルホスフィン(P(o−Tol)3、トリブチルホスフィン(P(t−Bu)3)、トリエチルホスフィン(PEt3)等が用いられる。
ただし、上記Meは「CH3」、Etは「C2H5」、Phは「C6H5」、i−Prは「(CH3)2CH2」、o−Tolは「o−CH3C6H4」、t−Buは「(CH3)3C」を表す。
【0058】
上記反応は、例えば常圧下において、窒素又はアルゴンなどの不活性ガス雰囲気下で実施してもよいが、加圧条件下において実施してもよい。
上記反応における反応温度としては、例えば20℃以上300℃以下の範囲が挙げられるが、50℃以上180℃以下の範囲であってもよい。反応時間は反応条件により異なるが、例えば5分以上20時間以下の範囲から選択してもよい。
【0059】
上記金属又は金属錯体触媒の使用量は、特に限定されるものではないが、例えば一般式(VII)で示される化合物1モルに対して、0.001モル以上10モル以下の範囲が挙げられ、0.01モル以上5.0モル以下の範囲であってもよい。
塩基の使用量は、一般式(VII)で示される化合物1モルに対して、0.5モル以上4.0モル以下の範囲が挙げられ、1.0モル以上2.5モル以下の範囲であってもよい。
【0060】
上記反応の後は、例えば、反応溶液を水中に投入後、撹拌し、反応生成物が結晶の場合は吸引ろ過で、ろ取することにより粗生成物が得られる。反応生成物が油状物である場合には、例えば、酢酸エチル又はトルエン等の溶剤で抽出することにより粗生成物が得られる。このようにして得られた組成生物を、例えば、シリカゲル、アルミナ、活性白土、活性炭等でカラム精製してもよく、また溶液中にこれらの吸着剤を添加し、不要分を吸着させる等の処理を行ってもよく、さらに、反応生成物が結晶の場合にはヘキサン、メタノール、アセトン、エタノール、酢酸エチル、トルエン等の溶剤から、再結晶させて精製してもよい。
但し、本実施形態における合成法としてはこれらに限定されるものではない。
【0061】
以上のようにして得られた一般式(VI)で示される電荷輸送性モノマーを用い、公知の方法で重合することにより、前記一般式(I)で示される電荷輸送性ポリエステルを合成する。
具体的には、例えば、前記電荷輸送性モノマーの末端(すなわち一般式(VI)中のA2)に後述する置換基を導入することを行う方法が挙げられ、具体的には以下の合成法が挙げられる。
【0062】
1)A2が水酸基の場合
前記一般式(VI)で表される化合物に、HO−(Y1−O)m−Hで表される2価アルコール類を当量(質量比)混合し、酸触媒を用いて重合する。なお、上記Y1及びmは、前記一般式(I)におけるY1及びmと同義である。
【0063】
前記酸触媒としては、硫酸、トルエンスルホン酸、トリフルオロ酢酸等、通常のエステル化反応に用いるものが使用され、モノマー(すなわち一般式(VI)で表される化合物)1質量部に対して、例えば1/10,000質量部以上1/10質量部以下で用いられ、1/1,000質量部以上1/50質量部以下の範囲で用いてもよい。
重合中に生成する水を除去するために、例えば水と共沸する溶剤を用い、具体的には、例えばトルエン、クロロベンゼン、1−クロロナフタレン等が有効であり、モノマー1質量部に対して、例えば1質量部以上100質量部以下の範囲で用いられ、2質量部以上50質量部以下の範囲で用いてもよい。
反応温度は条件に応じて設定されるが、重合中に生成する水を除去するために、溶剤の沸点で反応させてもよい。
【0064】
反応終了後、溶剤を用いなかった場合には溶解する溶剤に溶解させる。溶剤を用いた場合には、反応溶液をそのまま、メタノール、エタノール等のアルコール類や、アセトン等のポリマーが溶解しにくい貧溶剤中に滴下し、ポリエステルを析出させポリエステルを分離した後、水や有機溶剤で洗浄し、乾燥させる。
更に、必要であれば適当な有機溶剤に溶解させ、貧溶剤中に滴下し、ポリエステルを析出させる再沈殿処理を繰り返してもよい。再沈殿処理の際には、メカニカルスターラー等で、効率よく撹拌しながら行ってもよい。再沈殿処理の際にポリエステルを溶解させる溶剤は、ポリエステル1質量部に対して、例えば1質量部以上100質量部以下で用いられ、2質量部以上50質量部以下の範囲で用いてもよい。また、貧溶剤はポリエステル1質量部に対して、例えば1質量部以上1,000質量部以下で用いられ、10質量部以上500質量部以下の範囲で用いてもよい。
【0065】
2)A2がハロゲンの場合
前記一般式(VI)で表される化合物に、HO−(Y1−O)m−Hで示される2価アルコール類を当量(質量比)混合し、ピリジンやトリエチルアミン等の有機塩基性触媒を用いて重合する。なお、上記Y1及びmは、前記一般式(I)におけるY1及びmと同義である。
【0066】
前記有機塩基性触媒は、モノマー1質量部に対して、例えば1質量部以上10質量部以下の範囲で用いられ、2質量部以上5質量部以下の範囲で用いてもよい。
溶剤としては、塩化メチレン、テトラヒドロフラン、トルエン、クロロベンゼン、1−クロロナフタレン等が有効であり、モノマー(すなわち一般式(VI)で表される化合物)1質量部に対して、例えば1質量部以上100質量部以下の範囲で用いられ、2質量部以上50質量部以下の範囲で用いてもよい。
反応温度は条件に応じて設定される。重合後、前述のように再沈殿処理し、精製する。
【0067】
また、ビスフェノール等の酸性度の高い2価アルコール類を用いる場合には、界面重合法を用いてもよい。すなわち、2価アルコール類を水に加え、当量(質量比)の塩基を加えて溶解させた後、激しく撹拌しながら2価アルコール類と当量のモノマー溶液を加えることによって重合する。この際、水は2価アルコール類1質量部に対して、例えば1質量部以上1,000質量部以下の範囲で用いられ、2質量部以上500質量部以下の範囲で用いてもよい。モノマーを溶解させる溶剤としては、塩化メチレン、ジクロロエタン、トリクロロエタン、トルエン、クロロベンゼン、1−クロロナフタレン等が有効である。
反応温度は条件に応じて設定され、反応を促進するために、アンモニウム塩、スルホニウム塩等の相間移動触媒を用いることが効果的である。相間移動触媒は、モノマー1質量部に対して、例えば0.1質量部以上10質量部以下の範囲で用いられ、0.2質量部以上5質量部以下の範囲で用いてもよい。
【0068】
3)A2が−O−R5の場合
前記一般式(VI)で表される化合物に、HO−(Y1−O)m−Hで示される2価アルコール類を過剰に加え、硫酸、リン酸等の無機酸、チタンアルコキシド、カルシウム及びコバルト等の酢酸塩或いは炭酸塩、亜鉛や鉛の酸化物を触媒に用いて加熱し、エステル交換により合成される。なお、上記Y1及びmは、前記一般式(I)におけるY1及びmと同義である。
【0069】
前記2価アルコール類はモノマー(一般式(VI)で表される化合物)1質量部に対して、例えば2質量部以上100質量部以下の範囲で用いられ、3質量部以上50質量部以下の範囲で用いてもよい。
前記触媒はモノマー1質量部に対して、例えば1/10,000質量部以上1質量部以下の範囲で用いられ、1/1,000質量部以上1/2質量部以下の範囲で用いてもよい。
【0070】
反応は、反応温度200℃以上300℃以下で行い、−O−R5から−O−(Y1−O)m−Hへのエステル交換終了後は、HO−(Y1−O)m−Hの脱離による重合を促進するため、例えば減圧下で反応させる。また、HO−(Y1−O)m−Hと共沸する1−クロロナフタレン等の高沸点溶剤を用いて、常圧下でHO−(Y1−O)m−Hを共沸で除きながら反応させてもよい。
【0071】
また、次のようにしてポリエステルを合成してもよい。
上記1)から3)のそれぞれの場合において、2価アルコール類を過剰に加えて反応させることによって下記一般式(XII)で示される化合物を生成した後、この化合物を前記一般式(VI)で示したモノマーの代わりとして用いて、2価カルボン酸又は2価カルボン酸ハロゲン化物等と反応させ、一般式(I)で表されるポリエステルが得られる。
【0072】
【化13】

【0073】
一般式(XII)中、Ar、X、T、及びjはそれぞれ前記一般式(II)におけるAr、X、T、及びjと同一であり、Y1及びmはそれぞれ前記一般式(I)におけるY1及びmと同一である。
【0074】
なお、前記1)から3)の合成法のうち、本実施形態における電荷輸送性ポリエステルとしては、1)の合成法によることが製造上容易である。
ここで、一般式(I)で示される電荷輸送性ポリエステルの具体例を表5から表8に示すが、本実施形態における電荷輸送性ポリエステルはこれら具体例に限定されるわけではない。尚、下記表において、モノマーの列のA1の欄(「一般式(I)A1の構造」の欄)の番号は、前記一般式(II)で示される構造の具体例の構造番号(表1から表4の電荷輸送性モノマーの「構造番号」)に対応している。
以下、下記表において化合物番号(ポリマー番号)を付した電荷輸送性ポリエステルの各具体例に関し、例えば、15の番号を付した具体例については「例示化合物(15)」という。また、下記表に示した電荷輸送性ポリエステルの各具体例においては、一般式(I)中に示された2つのY1、m、及びR1は、それぞれ同じである。
【0075】
【表5】

【0076】
【表6】

【0077】
【表7】

【0078】
【表8】

【0079】
次に、本実施形態の有機電界発光素子の構成について詳述する。
本実施形態の有機電界発光素子は、少なくとも一方が透明または半透明である一対の電極と、それら電極間に挾まれた一つまたは複数の有機化合物層より構成され、該有機化合物層の少なくとも一層に上記に説明した電荷輸送性ポリエステルを1種含有してなるものであればその層構成は特に限定されない。
【0080】
本実施形態の有機電界発光素子においては、有機化合物層が1つの場合は、有機化合物層は電荷輸送能を持つ発光層を意味し、該発光層が前記電荷輸送性ポリエステルを含有してなる。一方、有機化合物層が複数の場合(即ち、各層が異なる機能を有する機能分離型の場合)は、少なくともいずれか一層が発光層からなり、この発光層は電荷輸送能を持つ発光層であってもよい。この場合、前記発光層あるいは前記電荷輸送能を持つ発光層と、その他の層を含む層構成の具体例としては、下記(1)乃至(3)が挙げられる。
【0081】
(1)発光層と、電子輸送層及び電子注入層の少なくともいずれかの層と、から構成される層構成。
(2)正孔輸送層及び正孔注入層の少なくともいずれかの層と、発光層と、電子輸送層及び電子注入層の少なくともいずれかの層と、から構成される層構成。
(3)正孔輸送層及び正孔注入層の少なくともいずれかの層と、発光層と、から形成される層構成。
【0082】
これら層構成(1)乃至(3)の発光層及び電荷輸送能を持つ発光層以外の層は、電荷輸送層や電荷注入層としての機能を有する。
なお、層構成(1)乃至(3)のいずれの層構成においても、いずれか一層に前記電荷輸送性ポリエステルが含まれていればよい。
【0083】
また、本実施形態の有機電界発光素子において、発光層、正孔輸送層、正孔注入層、電子輸送層、電子注入層は、前記電荷輸送性ポリエステル以外の電荷輸送性化合物(正孔輸送材料、電子輸送材料)を更に含んでもよい。該電荷輸送性化合物の詳細については後述する。
【0084】
以下、図面を参照しつつ、より詳細に説明するが、本実施形態の有機電界発光素子はこれらに限定されるわけではない。
図1乃至図4は、本実施形態の有機電界発光素子の層構成を説明するための模式的断面図であって、図1、図2、図3の場合は、有機化合物層が複数の場合の一例であり、図4の場合は、有機化合物層が1つの場合の例を示す。なお、図1乃至図4において、同じような機能を有するものは同じ符号を付して説明する。
【0085】
図1に示す有機電界発光素子は、透明絶縁体基板1上に、透明電極2、発光層4、電子輸送層及び電子注入層の少なくとも一層5並びに背面電極7が順次積層されたもので、層構成(1)に相当するものである。但し、符号5で示される層が、電子輸送層及び電子注入層から構成される場合には、発光層4の背面電極7側に、電子輸送層、電子注入層、背面電極7がこの順に積層される。
【0086】
図2に示す有機電界発光素子は、透明絶縁体基板1上に、透明電極2、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4、電子輸送層及び電子注入層の少なくとも一層5並びに背面電極7が順次積層されたもので、層構成(2)に相当するものである。但し、符号3で示される層が、正孔輸送層及び正孔注入層から構成される場合には、透明電極2の背面電極7側に、正孔注入層、正孔輸送層、発光層4がこの順に積層される。また、符号5で示される層が、電子輸送層及び電子注入層から構成される場合には、発光層4の背面電極7側に、電子輸送層、電子注入層、背面電極7がこの順に積層される。
【0087】
図3に示す有機電界発光素子は、透明絶縁体基板1上に、透明電極2、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4並びに背面電極7が順次積層されたもので、層構成(3)に相当するものである。但し、符号3で示される層が、正孔輸送層及び正孔注入層から構成される場合には、透明電極2の背面電極7側に、正孔注入層、正孔輸送層、発光層4がこの順に積層される。
【0088】
図4に示す有機電界発光素子は、透明絶縁体基板1上に、透明電極2、電荷輸送能を持つ発光層6及び背面電極7が順次積層されたものである。
また、トップエミッション構造や陰極・陽極共に透明電極を用いて透過型にする場合、さらには図1乃至図4の層構成を複数段積重ねた構造も実現される。
以下、各々を詳しく説明する。
【0089】
本実施形態における前記電荷輸送性ポリエステルには、含有される有機化合物層の機能によって、正孔輸送能、電子輸送能のいずれの機能をも付与される。
例えば、前記電荷輸送性ポリエステルは、図1に示される有機電界発光素子の層構成の場合、発光層4及び電子輸送層及び電子注入層の少なくとも一層5のいずれに含有されてもよく、発光層4及び電子輸送層及び電子注入層の少なくとも一層5としていずれも作用する。また、図2に示される有機電界発光素子の層構成の場合、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4及び電子輸送層及び電子注入層の少なくとも一層5のいずれに含有されてもよく、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4及び電子輸送層及び電子注入層の少なくとも一層5としていずれも作用する。また、図3に示される有機電界発光素子の層構成の場合、正孔輸送層及び正孔注入層の少なくとも一層3及び発光層4のいずれに含有されてもよく、正孔輸送層及び正孔注入層の少なくとも一層3及び発光層4としていずれも作用する。さらに、図4に示される有機電界発光素子の層構成の場合、電荷輸送能を持つ発光層6に含有され、電荷輸送能を持つ発光層6として作用する。
【0090】
図1乃至図4に示される有機電界発光素子の層構成の場合、透明絶縁体基板1は、発光を取り出すため透明なものを用いてもよく、ガラス、プラスチックフィルム等が用いられるがこれに限られるものではない。なお、上記透明とは、可視領域の光の透過率が10%以上であることを意味し、更に透過率が75%以上であってもよい。以下これに準ずる。
また、透明電極2は、透明絶縁体基板に準じて発光を取り出すための透明または半透明であって、且つ正孔の注入を行うため仕事関数の大きなものを用いてもよく、例えば仕事関数が4eV以上のものが挙げられる。なお、前記半透明とは、可視領域の光の透過率が70%以上であることを意味し、更に透過率が80%以上であってもよい。以下これに準ずる。
【0091】
具体例として、酸化スズインジウム(ITO)、酸化スズ(NESA)、酸化インジウム、酸化亜鉛等の酸化膜、及び蒸着或いはスパッタされた金、白金、パラジウム等が用いられるが、これに限られるものではない。電極のシート抵抗は、低いほどよく、数百Ω/□以下が挙げられ、さらには100Ω/□以下であってもよい。また、透明絶縁体基板に準じて、可視領域の光の透過率が10%以上で、更に透過率が75%以上であってもよい。
【0092】
図1乃至図3に示される有機電界発光素子の層構成の場合、電子輸送層や正孔輸送層等は、目的に応じて機能(電子輸送能、正孔輸送能)が付与された前記電荷輸送性ポリエステル単独で形成されていてもよいが、例えば正孔移動度を調節するため、前記電荷輸送性ポリエステル以外の正孔輸送材料を、層を構成する材料全体に対して0.1質量%乃至50質量%の範囲で混合分散して形成されてもよい。
前記正孔輸送材料としては、テトラフェニレンジアミン誘導体、トリフェニルアミン誘導体、カルバゾール誘導体、スチルベン誘導体、スピロフルオレン誘導体、アリールヒドラゾン誘導体、ポルフィリン系化合物が挙げられるが、これらの中では、電荷輸送性ポリエステルとの相溶性がよいものとして、テトラフェニレンジアミン誘導体、スピロフルオレン誘導体、トリフェニルアミン誘導体が挙げられる。
【0093】
また、電子移動度を調整する場合は、層を構成する材料全体に対して電子輸送材料を0.1質量%から50質量%の範囲で混合分散して形成されてもよい。
前記電子輸送材料として、オキサジアゾール誘導体、ニトロ置換フルオレノン誘導体、ジフェノキノン誘導体、チオピランジオキシド誘導体、シロール誘導体、キレート型有機金属錯体、多核または縮合芳香環化合物、ペリレン誘導体、トリアゾール誘導体、フルオレニリデンメタン誘導体等が挙げられる。
【0094】
また、正孔移動度及び電子移動度の両方の調整が必要な場合は、前記電荷輸送性ポリエステルに前記正孔輸送材料及び電子輸送材料の両方を一緒に混在させてもよい。
【0095】
さらに、成膜性の向上、ピンホール防止等のため、適切な樹脂(ポリマー)、添加剤を加えてもよい。具体的な樹脂としては、ポリカーボネート樹脂、ポリエステル樹脂、メタクリル樹脂、アクリル樹脂、ポリ塩化ビニル樹脂、セルロース樹脂、ウレタン樹脂、エポキシ樹脂、ポリススチレン樹脂、ポリビニルアセテート樹脂、スチレンブタジエン共重合体、塩化ビニリデン−アクリロニトリル共重合体、塩化ビニル−酢酸ビニル−無水マレイン酸共重合体、シリコーン樹脂、ポリ−N−ビニルカルバゾール樹脂、ポリシラン樹脂、ポリチオフェン、ポリピロール等の導電性樹脂等を用いることがある。また、添加剤としては、公知の酸化防止剤、紫外線吸収剤、可塑剤等を用いることがある。
【0096】
また、電荷注入性を向上させる場合は、正孔注入層や電子注入層を用いる場合があるが、正孔注入材料としては、トリフェニルアミン誘導体、フェニレンジアミン誘導体、フタロシアニン誘導体、インダンスレン誘導体、ポリアルキレンジオキシチオフェン誘導体等が用いられる。また、これらには、ルイス酸、スルホン酸等を混合してもよい。電子注入材料としては、Li、Ca、Ba、Sr、Ag、Au等の金属、LiF、MgF等の金属フッ化物、MgO、Al2O3、LiO等の金属酸化物が用いられる。
【0097】
また、前記電荷輸送性ポリエステルを発光機能以外で用いる場合は、発光性化合物を発光材料として用いる。発光材料としては、固体状態で高い発光量子効率を示す化合物を用いる。発光材料は、低分子化合物または高分子化合物どちらでもよく、有機低分子である場合の具体例としては、キレート型有機金属錯体、多核または縮合芳香環化合物、ペリレン誘導体、クマリン誘導体、スチリルアリーレン誘導体、シロール誘導体、オキサゾール誘導体、オキサベンゾジチアゾール誘導体、オキサチアゾール誘導体、オキサジアゾール誘導体等が、高分子の場合、ポリパラフェニレン誘導体、ポリパラフェニレンビニレン誘導体、ポリチオフェン誘導体、ポリアセチレン誘導体等が用いられる。具体例として、下記の化合物(XV−1)から(XV−17)が挙げられるが、これらに限定されたものではない。
【0098】
【化14】

【0099】
【化15】

【0100】
なお、上記構造式(XV−13)乃至(XV−17)中、Vは前記Y1と同一の2価の有機基、n及びgはそれぞれ独立に1以上の整数を表す。
【0101】
また、有機電界発光素子の耐久性向上あるいは発光効率向上を目的として、上記発光材料または前記電荷輸送性ポリエステル中にゲスト材料として発光材料と異なる色素化合物をドーピングしてもよい。該色素化合物のドーピングの割合としては、対象となる層の0.001質量%乃至40質量%が挙げられ、0.01質量%乃至10質量%であってもよい。このドーピングに用いられる色素化合物としては、発光材料との相容性が良く、かつ発光層の良好な薄膜形成を妨げない有機化合物が用いられ、具体的にはクマリン誘導体、DCM誘導体、キナクリドン誘導体、ペリミドン誘導体、ベンゾピラン誘導体、ローダミン誘導体、ベンゾチオキサンテン誘導体、ルブレン誘導体、ポルフィリン誘導体、ルテニウム、ロジウム、パラジウム、銀、レニウム、オスニウム、イリジウム、白金、および金などの金属錯体化合物等が挙げられる。
色素化合物の具体例として、下記の化合物(XVI−1)乃至(XVI−6)が挙げられるが、これらに限定されたものではない。
【0102】
【化16】

【0103】
また、発光層4は、前記発光材料単独で形成されていてもよいが、電気特性及び発光特性をさらに改善する等の目的で、前記発光材料に前記電荷輸送性ポリエステルを1質量%ないし50質量%の範囲で混合・分散して形成させてもよい。若しくは前記発光材料中に、前記電荷輸送性ポリエステル以外の電荷輸送性材料を1質量%ないし50質量%の範囲で混合・分散して形成させてもよい。また、前記電荷輸送性ポリエステルが発光特性も兼ね備えたものである場合、発光材料として用いてもよく、その場合、電気特性及び発光特性をさらに改善する等の目的で、前記電荷輸送性ポリエステル以外の電荷輸送性材料を1質量%ないし50質量%の範囲で混合分散して形成させてもよい。
【0104】
図4に示される有機電界発光素子の層構成の場合、電荷輸送能を持つ発光層6は、目的に応じて機能(正孔輸送能、あるいは電子輸送能)が付与された前記電荷輸送性ポリエステル中に、発光材料(具体的には、例えば前記発光材料(XV−1)乃至(XV−17)から選ばれる少なくとも1種)を50質量%以下で分散させた有機化合物層であるが、有機電界発光素子に注入される正孔と電子のバランスを調節するために前記電荷輸送性ポリエステル以外の電荷輸送材料を10質量%乃至50質量%分散させてもよい。
前記電荷輸送材料としては、電子移動度を調節する場合、電子輸送材料としてオキサジアゾール誘導体、ニトロ置換フルオレノン誘導体、ジフェノキノン誘導体、チオピランジオキシド誘導体、フルオレニデンメタン誘導体等が挙げられる。
【0105】
図1乃至図4に示される有機電界発光素子の層構成の場合、背面電極7には、真空蒸着され、電子注入を行うため仕事関数の小さな金属、金属酸化物、金属フッ化物等が使用される。金属としてはマグネシウム、アルミニウム、金、銀、インジウム、リチウム、カルシウムおよびこれらの合金が挙げられる。金属酸化物としては、酸化リチウム、酸化マグネシウム、酸化アルミニウム、酸化スズインジウム、酸化スズ、酸化インジウム、酸化亜鉛、酸化インジウム亜鉛等が挙げられる。また、金属フッ化物としては、フッ化リチウム、フッ化マグネシウム、フッ化ストロンチウム、フッ化カルシウム、フッ化アルミニウムが挙げられる。
【0106】
また、背面電極7上には、さらに素子の水分や酸素による劣化を防ぐために保護層を設けてもよい。具体的な保護層の材料としては、In、Sn、Pb、Au、Cu、Ag、Alなどの金属、MgO、SiO2、TiO2等の金属酸化物、ポリエチレン樹脂、ポリウレア樹脂、ポリイミド樹脂等の樹脂が挙げられる。保護層の形成には、真空蒸着法、スパッタリング法、プラズマ重合法、CVD法、コーティング法が適用される。
【0107】
これら図1乃至図4に示される有機電界発光素子は、まず透明電極2の上に各有機電界発光素子の層構成に応じた個々の層を順次形成することにより作製される。なお、正孔輸送層及び正孔注入層の少なくとも一層3、発光層4、電子輸送層及び電子注入層の少なくとも一層5、或いは、電荷輸送能を持つ発光層6は、上記各材料を真空蒸着法、若しくは、適切な有機溶媒に溶解或いは分散し、得られた塗布液を用いて前記透明電極上にスピンコーティング法、キャスト法、ディップ法、インクジェット法等により形成される。
【0108】
正孔輸送層及び正孔注入層の少なくとも一層3、発光層4、電子輸送層及び電子注入層の少なくとも一層5、並びに、電荷輸送能を持つ発光層6の膜厚は、各々10μm以下、特に0.001μm以上5μm以下の範囲が挙げられる。上記各材料(前記非共役系高分子、発光材料等)の分散状態は分子分散状態でも微結晶などの粒子状態でも構わない。塗布液を用いた成膜法の場合、分子分散状態とするために分散溶媒は上記各材料の分散性及び溶解性を考慮して選択する必要がある。粒子状に分散するためには、ボールミル、サンドミル、ペイントシェイカー、アトライター、ホモジナイザー、超音波法等が利用される。
【0109】
そして最後に、図1及び図2に示す有機電界発光素子の場合には、電子輸送層及び電子注入層の少なくとも一層5の上に背面電極7を真空蒸着法、スパッタリング法等により形成することにより、本実施形態の有機電界発光素子が得られる。また、図3に示す有機電界発光素子の場合には、発光層4の上に、図4に示す有機電界発光素子の場合には、電荷輸送能を持つ発光層6の上に背面電極7を真空蒸着法、スパッタリング法等により形成することにより本実施形態の有機電界発光素子が得られる。
【0110】
<表示媒体>
本実施形態の表示媒体は、前記本実施形態の有機電界発光素子を、マトリクス状及びセグメント状の少なくとも一方で配置したことを特徴とする。本実施形態において有機電界発光素子をマトリクス状に配置する場合、電極のみをマトリクス状に配置する態様であってもよいし、電極及び有機化合物層の両方をマトリクス状に配置する態様であってもよい。また、本実施形態において有機電界発光素子をセグメント状に配置する場合、電極のみをセグメント状に配置する態様であってもよいし、電極及び有機化合物層の両方をセグメント状に配置する態様であってもよい。
【0111】
前記マトリクス状またはセグメント状の有機化合物層は、例えば前述したインクジェット法を用いることにより容易に形成する。
マトリクス状に配置した有機電界発光素子及びセグメント状に配置した有機電界発光素子から構成される表示媒体の駆動装置及び駆動方法としては、従来公知のものが用いられる。
【実施例】
【0112】
以下、本発明を、実施例を挙げてさらに具体的に説明する。ただし、これら各実施例は、本発明を制限するものではない。
【0113】
<電荷輸送性ポリエステルの合成>
(合成例1−例示化合物(15)の合成−)
窒素雰囲気下、1.6Mのn−ブチルリチウム(78.0ml)を、無水テトラヒドロフラン(100ml)に溶解させ、5−ブロモ−2−クロロピリジン(20.0g)を無水THE(80ml)に溶解させたものを、滴下した後、−78℃で3時間半撹拌した。そこに、1.6Mのn−ブチルリチウム(19.6ml)を追加し、−78℃で1時間撹拌したホウ酸トリ−n−ブチル(28.8g)を入れ、−78℃で2時間撹拌し、その後室温(25℃)で一晩撹拌した。
反応終了後、反応溶液を分液漏斗に移して有機層と水層を分け、水層に適量の水酸化ナトリウム(10%)を入れてpHを8にし、ジエチルエーテルで3回抽出した。有機層に2,2-ジメチル−1,3−プロパンジオール(10.4g、104.0mmol)、硫酸ナトリウムを入れて乾燥した。吸引ろ過をして、ろ液を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=1/1)で精製し、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(13.2g)を得た。
【0114】
【化17】

【0115】
1−ブロモ−4−ヨードベンゼン(18.6g)、DAA−1(17.5g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(4.6g)、トリデカン(10ml)の混合液を、210℃で7時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
室温(25℃)に冷却し、トルエンを加えてセライト濾過した。純水で洗浄し、有機層を抽出し、有機溶媒を留去して得られた生成物をシリカゲルカラムクロマト(ヘキサン4:トルエン1)で分離し、TAA−1(15.7g)を得た。
【0116】
【化18】

【0117】
窒素雰囲気下、TAA−1(13.8g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g)、エタノール(30ml)、2Mの炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、6時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−2(4.1g)を得た。
【0118】
【化19】

【0119】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−2(3.9g)を入れ、50℃で4時間加熱撹拌した。反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(14)を1.5g得た。
【0120】
【化20】

【0121】
得られたモノマー化合物(14)を1.0g用い、エチレングリコール(10ml)及びテトラブトキシチタン(0.02g)を、50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で5時間加熱撹拌した。原料である上記モノマー化合物(14)が反応して消失したのをTLCにより確認した後、50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。
【0122】
その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。
得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.7gのポリマー〔例示化合物:(15)〕を得た。
【0123】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、重量平均分子量Mw=3.7×104(スチレン換算)、Mw/Mn=2.22であり、原料である低分子化合物(モノマー化合物)の分子量から求めた重合度pは約45であった。
【0124】
【化21】

【0125】
(合成例2−例示化合物(17)の合成−)
4−メチルアセトアニリド(21.0g)、4−ヨードフェニルプロピオン酸メチル(64.4g)、炭酸カリウム(38.3g)、硫酸銅五水和物(2.3g)、n−トリデカン(50ml)を500mlの三口フラスコに入れ、窒素気流下、230℃で20時間加熱撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
反応後、トルエンで抽出し、有機層を純水で洗浄した。次いで、無水硫酸ナトリウムで乾燥後、溶剤を減圧下留去し、ヘキサンから再結晶することによりDAA−2(34.1g)を得た。
【0126】
【化22】

【0127】
次に、1−ブロモ−4−ヨードベンゼン(22.8g)、DAA−2(20.0g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(5.2g)、トリデカン(20ml)の混合液を、210℃で7時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
室温(25℃)に冷却し、トルエンを加えてセライト濾過した。純水で洗浄し、有機層を抽出し、有機溶媒を留去して得られた生成物をシリカゲルカラムクロマト(ヘキサン4:トルエン1)で分離し、TAA−3(16.1g)を得た。
【0128】
【化23】

【0129】
次に、窒素雰囲気下、TAA−3(14.2g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g)、エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)を、トルエンに溶解させ、8時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−4(5.2g)を得た。
【0130】
【化24】

【0131】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(50ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−4(4.0g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(15)を1.3g得た。
【0132】
【化25】

【0133】
得られたモノマー化合物(15)(1.0g)、エチレングリコール(10ml)及びテトラブトキシチタン(0.02g)を、50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で6時間加熱撹拌した。原料である上記モノマー化合物(15)が反応して消失したのをTLCにより確認した後、50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。
【0134】
その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.6gのポリマー〔例示化合物:(17)〕を得た。
【0135】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=4.6×104(スチレン換算)、Mw/Mn=2.15であり、モノマーの分子量から求めた重合度pは約55であった。
【0136】
【化26】

【0137】
(合成例3−例示化合物(27)の合成−)
1−アセトアミドナフタレン(25.0g)、4−ヨードフェニルプロピオン酸メチル(64.4g)、炭酸カリウム(38.3g)、硫酸銅五水和物(2.3g)、n−トリデカン(50ml)を500mlの三口フラスコに入れ、窒素気流下、230℃で20時間加熱撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
反応後、トルエンで抽出し、有機層を純水で洗浄した。次いで、無水硫酸ナトリウムで乾燥後、溶剤を減圧下留去し、ヘキサンから再結晶することによりDAA−3(36.5g)を得た。
【0138】
【化27】

【0139】
次に、1−ブロモ−4−ヨードベンゼン(20.3g)、DAA−3(20.0g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(5.2g)、トリデカン(20ml)の混合液を、210℃で12時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
室温(25℃)に冷却し、トルエンを加えてセライト濾過した。純水で洗浄し、有機層を抽出し、有機溶媒を留去して得られた生成物をシリカゲルカラムクロマト(ヘキサン4:トルエン1)で分離し、TAA−5(17.2g)を得た。
【0140】
【化28】

【0141】
次に、窒素雰囲気下、TAA-5(15.3g)、テトラキス(トリフェニルホスフィン)パラジウム(0)を11.1g,エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5-ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、10時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−6(5.5g)を得た。
【0142】
【化29】

【0143】
さらに、窒素雰囲気下、トリフェニルホスフィンを(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−6(4.3g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(24)を1.1g得た。
【0144】
【化30】

【0145】
得られたモノマー化合物(24)(1.0g)、エチレングリコール(10ml)及びテトラブトキシチタン(0.02g)を50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で7時間加熱撹拌した。原料である上記モノマー化合物(24)が反応して消失したのをTLCにより確認した後50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。
【0146】
その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.5gのポリマー〔例示化合物:(27)〕を得た。
【0147】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=6.0×104(スチレン換算)、Mw/Mn=2.15であり、モノマーの分子量から求めた重合度pは約64であった。
【0148】
【化31】

【0149】
(合成例4−例示化合物(26)の合成−)
窒素雰囲気下、1−ブロモ−4−ヨードベンゼン(19.2g)、DAA−4(20.0g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(5.2g)、トリデカン(25ml)の混合液を、210℃で18時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
冷却後、トルエンを加えてセライト濾過し、トルエンを留出して得られた生成物をシリカゲルカラムクロマト(ヘキサン2:トルエン1)で分離し、TAA−7を14.5g得た。
【0150】
【化32】

【0151】
次に、窒素雰囲気下、TAA−7(16.4g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g)、エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、8時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA-8(5.8g)を得た。
【0152】
【化33】

【0153】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−8(4.6g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液により洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(23)を1.3g得た。
【0154】
【化34】

【0155】
得られたモノマー化合物(23)を1.0g、エチレングリコール(10ml)およびテトラブトキシチタン(0.02g)を50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で5時間加熱撹拌した。原料である上記モノマー化合物(23)が反応して消失したのをTLCにより確認した後50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.7gのポリマー〔例示化合物:((26)〕を得た。
【0156】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=4.7×104(スチレン換算)、Mw/Mn=2.43であり、モノマーの分子量から求めた重合度pは約48であった。
【0157】
【化35】

【0158】
(合成例5−例示化合物(18)の合成−)
1-ブロモ-4-ヨードベンゼン(21.0g)、DAA−5(20.0g)、硫酸銅(II)五水和物(1.0g)、炭酸カリウム(5.2g)、トリデカン(20ml)の混合液を、210℃で7時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
室温(25℃)に冷却し、トルエンを加えてセライト濾過した。純水で洗浄し、有機層を抽出し、有機溶媒を留去して得られた生成物をシリカゲルカラムクロマト(ヘキサン4:トルエン1)で分離し、TAA−9(14.3g)を得た。
【0159】
【化36】

【0160】
次に、窒素雰囲気下、TAA−9(14.2g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g)、エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、6時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−10(4.1g)を得た。
【0161】
【化37】

【0162】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA-10(3.9g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(16)を1.4g得た。
【0163】
【化38】

【0164】
得られたモノマー化合物(16)(1.0g)、エチレングリコール(10ml)およびテトラブトキシチタン(0.02g)を50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で5時間加熱撹拌した。原料である上記モノマー化合物(16)が反応して消失したのをTLCにより確認した後50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.7gのポリマー〔例示化合物:(18)〕を得た。
【0165】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=6.1×104(スチレン換算)、Mw/Mn=2.31であり、モノマーの分子量から求めた重合度pは約72であった。
【0166】
【化39】

【0167】
(合成例6−例示化合物(25)の合成−)
窒素雰囲気下、3-ブロモビフェニル(26.3g)、DAA−6(28.0g)、硫酸銅(II)五水和物(1.2g)、炭酸カリウム(7.3g)、トリデカン(30ml)の混合液を、210℃で20時間撹拌した。
反応終了後、水酸化カリウム(15.6g)をエチレングリコール(300ml)に溶解したものを加え、窒素気流下で3.5時間加熱還流した後、室温(25℃)まで冷却し、反応液を1Lの蒸留水に注ぎ、塩酸で中和し、結晶を析出させた。結晶を吸引ろ過によりろ取し、水洗した後、1Lのフラスコに移した。これに、トルエン(500ml)を加え、加熱還流し、共沸により水を除去した後、濃硫酸(1.5ml)のメタノール(300ml)溶液を加え、窒素気流下で5時間加熱還流した。
冷却後、トルエンを加えてセライト濾過し、トルエンを留出して得られた生成物をシリカゲルカラムクロマト(トルエン)で分離し、TAA−11(18.5g)を得た。
【0168】
【化40】

【0169】
次に、窒素雰囲気下、TAA−11(16.2g)、テトラキス(トリフェニルホスフィン)パラジウム(0)(1.1g),エタノール(30ml)、2M炭酸ナトリウム(30ml)、2−クロロ−5−(5,5−ジメチル−1,3,2−ジオキサボリナン−2−イル)ピリジン(11.4g)をトルエンに溶解させ、6時間還流撹拌した。
反応終了後、反応溶液を分液漏斗に移して水およびトルエンを入れ分液し、有機層を飽和食塩水で洗浄した後、硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、粗生成物を得た。これをカラムクロマトグラフィー(ヘキサン/酢酸エチル=5/1)で精製し、TAA−12(5.2g)を得た。
【0170】
【化41】

【0171】
さらに、窒素雰囲気下、トリフェニルホスフィン(9.5g)、塩化ニッケル(II)(1.5g)、無水DMF(40ml)に溶解させ、50℃まで加熱撹拌した。亜鉛(0.6g)、TAA−12(4.5g)を入れ、50℃で4時間加熱撹拌した。
反応終了後、反応溶液を分液漏斗に移し、水、クロロホルムを入れて分液した。さらに水層をクロロホルムで抽出し、有機層を吸引ろ過し、ろ液に硫酸ナトリウムを入れて乾燥した。溶媒を減圧下で留去し、水を入れて吸引ろ過し、粗生成物を得た。これを、EDTA水溶液による洗浄した後、カラムクロマトグラフィー(ヘキサン/酢酸エチル=2/1)で精製し、モノマー化合物(22)を1.2g得た。
【0172】
【化42】

【0173】
得られたモノマー合物(22)を1.0g、エチレングリコール(10ml)およびテトラブトキシチタン(0.02g)を50mlの三口ナスフラスコに入れ、窒素雰囲気下、200℃で5時間加熱撹拌した。原料である上記モノマー化合物(22)が反応して消失したのをTLCにより確認した後、50Paに減圧してエチレングリコールを留去しながら210℃に加熱し、6時間反応を続けた。その後、室温(25℃)まで冷却し、テトラヒドロフラン(50ml)に溶解し、不溶物を0.5μmのポリテトラフルオロエチレン(PTFE)フィルターにてろ過し、ろ液を減圧下留去した後、モノクロロベンゼン(300ml)に溶解させ、1N−HCl(300ml)、水500ml×3の順に洗浄した。モノクロロベンゼン溶液を30mlまで減圧下留去して、酢酸エチル/メタノール=1/3:800ml中に滴下し、ポリマーを再沈殿させた。得られたポリマーをろ過し、メタノールで洗浄した後、60℃で16時間真空乾燥させ、0.5gのポリマー〔例示化合物:(25)〕を得た。
【0174】
このポリマーの分子量をゲルパーミエーションクロマトグラフィー(GPC)(東ソー社製、HLC−8120GPC)にて測定したところ、Mw=5.4×104(スチレン換算)、Mw/Mn=2.34であり、モノマーの分子量から求めた重合度pは約56であった。
【0175】
【化43】

【0176】
<実施例1>
透明絶縁基板上に形成されたITO(三容真空社製)を短冊状のフォトマスクを用いてフォトリソグラフィによりパターニングし、さらにエッチング処理することにより短冊状のITO電極(幅2mm)を形成した。次に、このITOガラス基板を中性洗剤、超純水、アセトン(電子工業用、関東化学製)及びイソプロパノール(電子工業用、関東化学製)で超音波を各5分間加えて洗浄した後、スピンコーターで乾燥させた。
前記基板に、正孔輸送層として、前記電荷輸送性ポリエステル〔例示化合物(15)〕の5質量%モノクロロベンゼン溶液を調製し、0.2μmのPTFEフィルターで濾過した後、スピンコーター法により厚さ0.050μmの薄膜を形成した。発光材料として前記例示化合物(XV−1)を蒸着して、厚さ0.055μmの発光層を形成した。続いて短冊状の穴が設けられている金属性マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0177】
<実施例2>
前記電荷輸送性ポリエステル〔例示化合物(17)1質量部、ポリ(N−ビニルカルバゾール)4質量部、及び前記例示化合物(XVI−1)0.02質量部の10質量%ジクロロエタン溶液を調製し、0.2μmのPTFEフィルターで濾過した。この溶液を用いて、実施例1に準じて短冊状のITO電極をエッチングし、洗浄し、乾燥したガラス基板上に、スピンコーター法により膜厚0.15μmの薄膜を形成した。充分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0178】
<実施例3>
実施例1に準じてエッチング、洗浄し、乾燥したITOガラス基板上に、実施例1に準じて前記電荷輸送性ポリエステル〔例示化合物(18)〕を厚さ0.050μmの正孔輸送層を形成した。次いで、発光層として前記例示化合物(XV−1)と前記例示化合物(XVI−1)との混合物(質量比:99/1)を厚さ0.065μm、電子輸送層として前記例示化合物(XV−9)を厚さ0.030μmで形成した。充分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0179】
<実施例4>
実施例1に準じてエッチング、洗浄したITOガラス基板上に、実施例1に準じて正孔輸送層として、電荷輸送性ポリエステル〔例示化合物(25)〕を厚さ0.050μmでインクジェット法(ピエゾインクジェット方式)により形成した。次いで、発光層として前記例示化合物(XVI−5)を5質量%含んだ前記例示化合物(XV−16、n=8)を厚さ0.065μmでスピンコーター法により形成した。充分乾燥させた後、Caを厚さ0.08μm、Alを厚さ0.15μmに蒸着して、2mm幅、合計0.23μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0180】
<実施例5>
実施例3で用いた電荷輸送性ポリエステル〔例示化合物(18)〕の代わりに、前記電荷輸送性ポリエステル〔例示化合物(25)〕を用いた以外は、実施例3に準じて有機電界発光素子を作製した。
【0181】
<実施例6>
実施例3で用いた電荷輸送性ポリエステル〔例示化合物(18)〕の代わりに、前記電荷輸送性ポリエステル〔例示化合物(26)〕を用いた以外は、実施例3に準じて有機電界発光素子を作製した。
【0182】
<実施例7>
実施例3で用いた電荷輸送性ポリエステル〔例示化合物(18)〕の代わりに、前記電荷輸送性ポリエステル〔例示化合物(27)〕を用いた以外は、実施例3に準じて有機電界発光素子を作製した。
【0183】
<実施例8>
電荷輸送性ポリエステル〔例示化合物(15)〕の1.5質量%ジクロロエタン溶液を調製し、0.2μmのPTFEフィルターで濾過した。この溶液を用いて、実施例1に準じてエッチング、洗浄し、乾燥したITOガラス基板に、インクジェット法により膜厚0.05μmの薄膜を形成した。次いで、発光材料として前記例示化合物(XVI−5)を5質量%含んだ前記例示化合物(XV−16、n=8)をスピンコート法により厚さ0.050μmの発光層を形成した。充分乾燥させた後、Caを厚さ0.08μm、Alを厚さ0.15μmに蒸着して、2mm幅、合計0.23μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0184】
<実施例9>
実施例1に準じてエッチング、洗浄し、乾燥したITOガラス基板上に、発光層として前記例示化合物(XV―16)を厚さ0.050μmとなるように形成した。電荷輸送性ポリエステル〔例示化合物(15)〕の1.5質量%ジクロロエタン溶液を調製し、0.2μmのPTFEフィルターで濾過した。この溶液を用いて、前記発光層上にスピンコーター法により厚さ0.015μmの電子輸送層を形成した。充分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0185】
<比較例1>
実施例3で用いた電荷輸送性ポリエステル〔例示化合物(18)〕の代わりに、下記構造式(XVII)で示される化合物を用いた他は、実施例3に準じて有機EL素子を作製した。
【0186】
【化44】

【0187】
<比較例2>
電荷輸送性ポリマーとしてポリビニルカルバゾール(PVK)を2質量部、発光材料として前記例示化合物(XV−1)を0.1質量部、電子輸送材料として前記化合物(XV−9)を1質量部混合し、10質量%ジクロロエタン溶液を調製し、0.2μmのPTFEフィルターで濾過した。この溶液を用いて、2mm幅の短冊型ITO電極をエッチングにより形成したガラス基板上に、ディップ法により塗布して膜厚0.15μmの正孔輸送層を形成した。十分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0188】
<比較例3>
電荷輸送性ポリマーとして下記構造式(XVIII)を2質量部、発光材料として前記例示化合物(XV−1)を0.1質量部、電子輸送材料として前記化合物(XV−9)を1質量部混合し、10質量%ジクロロエタン溶液を調製し、0.1μmのPTFEフィルターで濾過した。この溶液を用いて、2mm幅の短冊型ITO電極をエッチングにより形成したガラス基板上に、ディップ法により塗布して膜厚0.15μmの正孔輸送層を形成した。十分乾燥させた後、短冊状の穴が設けられている金属製マスクを用いて、LiFを0.0001μm蒸着し、続いてAlを0.150μm蒸着して、2mm幅、0.15μm厚の背面電極をITO電極と交差するように形成した。形成された有機電界発光素子の有効面積は0.04cm2であった。
【0189】
【化45】

【0190】
以上のように作製した有機EL素子を、乾燥窒素中で、ITO電極側をプラス、背面電極をマイナスとして直流電圧を印加して測定を行った。
発光寿命の評価は、室温(25℃)において直流駆動方式(DC駆動)で初期輝度を1000cd/m2とし、比較例1の素子の輝度(初期輝度L0:1000cd/m2)が輝度L/初期輝度L0=0.5となった時点の駆動時間を1.0とした場合の相対時間、及び、素子の輝度が輝度L/初期輝度L0=0.5となった時点での電圧上昇分(=電圧/初期駆動電圧)により評価した。結果を表9に示す。
【0191】
【表9】

【0192】
表9の結果より、本実施形態における電荷輸送性ポリエステルを用いた実施例1乃至9の有機電界発光素子では、比較例1乃至3の有機電界発光素子に比べ電圧の上昇が抑制され、発光寿命が従来の電荷輸送性ポリマーを用いたものよりも良好であることがわかる。
また、本実施形態における有機電界発光素子では、電荷輸送性ポリエステルが有機溶媒に溶解性を示していることから、大面積化され、有機電界発光素子が容易に製造されることがわかる。
【符号の説明】
【0193】
1 透明絶縁体基板
2 透明電極
3 正孔輸送層及び正孔注入層の少なくとも一層
4 発光層
5 電子輸送層及び電子注入層の少なくとも一層
6 電荷輸送能を有する発光層
7 背面電極
【特許請求の範囲】
【請求項1】
少なくとも一方が透明又は半透明である陽極及び陰極よりなる一対の電極と、
該一対の電極間に挾持され、少なくとも一層が下記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する一つ又は複数の有機化合物層と、を有する、有機電界発光素子。
【化1】

(前記一般式(I)中、A1は下記一般式(II)で示される構造から選択された少なくとも1種を表し、Y1は各々独立に置換又は未置換の2価の炭化水素基を表し、mは各々独立に1以上5以下の整数を表し、pは5以上5000以下の整数を表す。R1は各々独立に水素原子、アルキル基、置換若しくは未置換のアリール基又は置換若しくは未置換のアラルキル基を表す。)
【化2】

(前記一般式(II)中、Arは各々独立に置換若しくは未置換のフェニル基、置換若しくは未置換の芳香環数2の1価の多核芳香族炭化水素基、置換若しくは未置換の芳香環数2若しくは3の1価の縮合芳香族炭化水素基、又は置換若しくは未置換の1価の芳香族複素環基を表し、jは各々独立に0又は1を表し、Tは各々独立に炭素数1以上6以下の2価の直鎖状炭化水素基又は炭素数2以上10以下の2価の分枝鎖状炭化水素基を表し、Xは下記式(III)で示される基を表す。)
【化3】

【請求項2】
前記有機化合物層が、発光層と、電子輸送層及び電子注入層の少なくとも一層と、を含み、前記発光層、前記電子輸送層、及び前記電子注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子。
【請求項3】
前記有機化合物層が、発光層と、正孔輸送層及び正孔注入層の少なくとも一層と、を含み、前記発光層、前記正孔輸送層、及び前記正孔注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子。
【請求項4】
前記有機化合物層が、発光層と、正孔輸送層及び正孔注入層の少なくとも一層と、電子輸送層及び電子注入層の少なくとも一層と、を含み、前記発光層、前記正孔輸送層、前記正孔注入層、前記電子輸送層、及び前記電子注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子。
【請求項5】
前記有機化合物層が、電荷輸送機能を持つ発光層のみから構成され、前記電荷輸送機能を持つ発光層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子。
【請求項6】
請求項1から請求項5のいずれか1項に記載の有機電界発光素子を、マトリクス状及びセグメント状の少なくとも一方で配置した、表示媒体。
【請求項1】
少なくとも一方が透明又は半透明である陽極及び陰極よりなる一対の電極と、
該一対の電極間に挾持され、少なくとも一層が下記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する一つ又は複数の有機化合物層と、を有する、有機電界発光素子。
【化1】

(前記一般式(I)中、A1は下記一般式(II)で示される構造から選択された少なくとも1種を表し、Y1は各々独立に置換又は未置換の2価の炭化水素基を表し、mは各々独立に1以上5以下の整数を表し、pは5以上5000以下の整数を表す。R1は各々独立に水素原子、アルキル基、置換若しくは未置換のアリール基又は置換若しくは未置換のアラルキル基を表す。)
【化2】

(前記一般式(II)中、Arは各々独立に置換若しくは未置換のフェニル基、置換若しくは未置換の芳香環数2の1価の多核芳香族炭化水素基、置換若しくは未置換の芳香環数2若しくは3の1価の縮合芳香族炭化水素基、又は置換若しくは未置換の1価の芳香族複素環基を表し、jは各々独立に0又は1を表し、Tは各々独立に炭素数1以上6以下の2価の直鎖状炭化水素基又は炭素数2以上10以下の2価の分枝鎖状炭化水素基を表し、Xは下記式(III)で示される基を表す。)
【化3】

【請求項2】
前記有機化合物層が、発光層と、電子輸送層及び電子注入層の少なくとも一層と、を含み、前記発光層、前記電子輸送層、及び前記電子注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子。
【請求項3】
前記有機化合物層が、発光層と、正孔輸送層及び正孔注入層の少なくとも一層と、を含み、前記発光層、前記正孔輸送層、及び前記正孔注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子。
【請求項4】
前記有機化合物層が、発光層と、正孔輸送層及び正孔注入層の少なくとも一層と、電子輸送層及び電子注入層の少なくとも一層と、を含み、前記発光層、前記正孔輸送層、前記正孔注入層、前記電子輸送層、及び前記電子注入層から選択された少なくとも一層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子。
【請求項5】
前記有機化合物層が、電荷輸送機能を持つ発光層のみから構成され、前記電荷輸送機能を持つ発光層が、前記一般式(I)で示される電荷輸送性ポリエステルを1種以上含有する、請求項1に記載の有機電界発光素子。
【請求項6】
請求項1から請求項5のいずれか1項に記載の有機電界発光素子を、マトリクス状及びセグメント状の少なくとも一方で配置した、表示媒体。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−33835(P2013−33835A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2011−168828(P2011−168828)
【出願日】平成23年8月1日(2011.8.1)
【出願人】(000005496)富士ゼロックス株式会社 (21,908)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願日】平成23年8月1日(2011.8.1)
【出願人】(000005496)富士ゼロックス株式会社 (21,908)
【Fターム(参考)】
[ Back to top ]

