有機骨格構造体
本発明は、線状又は環状のホウ素含有クラスタに2つ又は3つのC6〜C204の芳香族環基が共有結合されて単位体をなし、前記単位体が隣り合う他の単位体と連続して連結され形成された板状層と、前記板状層内のホウ素含有クラスタに配位結合されたルイス塩基と、を含む有機骨格構造体を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ガス又は有機分子の吸脱着及び/又は貯蔵可能な有機骨格構造体に関する。
【背景技術】
【0002】
現在使用されているエネルギー需要の90%以上を占める化石燃料は、再生が不可能で且つその埋蔵量が有限である。また、化石燃料は、使用時に、NOx、SOx、粉塵などのような大気汚染物質を排出し、環境汚染を起こす。また、化石燃料の燃焼時に排出される二酸化炭素の大気中の濃度が近年上昇して地球温暖化の不安を招いている。
【0003】
このような化石燃料を代替する新燃料源として、化学製品の原料及び化学工程におけるガスとして広く使用されている水素が注目されている。水素は、次のような長所を持っている。第一に、水素は、原料として使用される場合、燃焼時において、極小量のNOx発生を除いては、公害物質を出さない。このため直接燃焼による燃料として又は燃料電池などの燃料として水素を簡便に使用できる。第二に、水素は、ガス状又は液状として容易に製造でき、高圧ガス、液体水素、金属水素化物などの種々の形態で容易に貯蔵できる。第三に、水素は、水から大量に製造でき、使用後は、水への再循環ができるので、資源枯渇が発生するおそれがない。第四に、水素は、産業用の基礎材料を始めとして、一般燃料、水素自動車、水素飛行機、燃料電池など、現在エネルギーシステムにおいて使用される全ての分野で利用できる。
【0004】
但し、このような水素を使用するには、多量の水素を容易に貯蔵可能な媒体が必要になる。そのため、近年、水素貯蔵媒体を開発するため、水素貯蔵合金、カーボンナノチューブ、ゼオライトなどに関する研究が行われている。しかしながら、前記水素貯蔵合金は、水素分子と非常に高い結合エネルギーで化学結合するため、結合した水素の放出過程においても別のエネルギーが必要になるという問題点がある。また、前記カーボンナノチューブあるいはゼオライトでは、水素貯蔵合金とは異なり、水素分子が非常に低い結合エネルギーで材料表面に物理吸着するため、常温常圧において水素貯蔵能が劣るという問題点がある。
【0005】
最近、カリフォルニア大学バークレー校のYaghi教授らの研究チームは、共有結合性有機骨格構造体(Covalent Organic Framework,以下「COF」と略する)について発表した(特許文献1参照)。前記共有結合性有機骨格構造体は、専ら水素、ホウ素、炭素、窒素、酸素などのような原子が共有結合により連結され形成されるものであって、ベンゼンジボロン酸(BDBA)の縮合反応により形成されることができる。このような共有結合性有機骨格構造体は、堅い多孔質(Micro−及びMeso−porous)構造を有するだけでなく、熱的安定性に優れ、かつ密度が低い。また、従来既知のゼオライト、多孔質シリケートなどに比べて比表面積が大きい。
【0006】
したがって、このような共有結合性有機骨格構造体を、新しい水素貯蔵媒体として利用するための研究が行われている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許出願公開2006/0154807 A1
【発明の概要】
【発明が解決しようとする課題】
【0008】
板状層を積み重ねた2D共有結合性有機骨格構造体では、板状層間の距離が非常に短いため、水素を細孔に挿入することはできるが、層間への挿入は難しいことを本発明者らは見出した。
【0009】
それで、線状又は環状のホウ素含有クラスタと2つ又は3つのC6〜C204の芳香族環基とを含む単位体(Building block)を連続して連結させることにより形成した板状層にルイス塩基を導入して板状層間の距離を適切に広げることにより、層間の空間を水素貯蔵に利用できることを本発明者らは見出した。本発明の目的は、大量の水素を吸着できる有機骨格構造体を提供することである。
【課題を解決するための手段】
【0010】
本発明は、線状又は環状のホウ素含有クラスタに2つ又は3つのC6〜C204の芳香族環基が結合した各単位体を連続して連結させることにより形成された多数の板状層と、これら板状層内のホウ素含有クラスタに配位結合されたルイス塩基とを含む有機骨格構造体を提供する。
【0011】
また、本発明は、上述のような有機骨格構造体を含有する吸着体、及び触媒を提供する。
【発明の効果】
【0012】
本発明に係る有機骨格構造体は、2つ又は3つのC6〜C204の芳香族環基と線状又は環状のホウ素含有クラスタとからなる隣接する各単位体を連続して連結させることにより形成された板状層内の線状又は環状のホウ素含有クラスタにルイス塩基を配位結合させる。前記板状層間の距離が、前記板状層に配位結合された前記ルイス塩基により広くなり、これによって、多量の水素を層間へ挿入されるので、多量の水素を吸着することができる。
【0013】
また、本発明に係る有機骨格構造体によれば、前記板状層に結合したルイス塩基によって水素を非可逆的に又は可逆的に吸着することができ、優れた貯蔵性能を有する水素貯蔵媒体として使用することができる。
【図面の簡単な説明】
【0014】
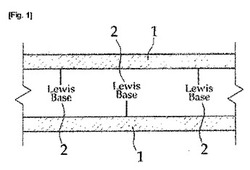
【図1】図1は、本発明の有機骨格構造体を模式的に示す断面図である。
【図2】図2は、本発明の一実施例に係る有機骨格構造体を三次元的に示す図である。
【図3】図3は、従来既知の有機骨格構造体(COF−1)を三次元的に示す図である。
【図4】図4は、本発明に係る有機骨格構造体内における板状層間の距離を示す図である。
【図5】図5は、実施例1で製造した有機骨格構造体(PCOF−1)及び対照群(COF−1)の赤外線スペクトルである。
【図6】図6は、実施例1で製造した有機骨格構造体(PCOF−1)及び対照群(COF−1)の熱重量分析(TGA)を示すグラフである。
【図7】図7は、実施例1で製造した有機骨格構造体(PCOF−1)及び対照群(COF−1)の粉末X線回折(PXRD)分析を示すグラフである。
【図8】図8は、実施例1で製造した有機骨格構造体(PCOF−1)及び対照群(COF−1)の水素ガス吸脱着特性を示すグラフである。
【発明を実施するための形態】
【0015】
以下、本発明の詳細を説明する。
本発明において「線状又は環状のホウ素含有クラスタ」とは、ホウ素の有効な反応部位のうち2つの反応部位のそれぞれにホウ素以外の他の原子が共有結合してなる線状又は環状のホウ素含有分子を意味する。
【0016】
また、本発明において、芳香族環基とは、芳香族環炭化水素、ヘテロ環芳香族化合物、多環芳香族化合物だけでなく、これらのうちの2つの芳香族環が縮合環を形成したものや結合したものを意味する。
【0017】
一般に、共有結合性有機骨格構造体(Covalent Organic Framework,COF)は、水素、ホウ素、炭素、窒素、酸素などの原子が共有結合して形成された多孔性物質である。例えば、従来既知の共有結合性有機骨格構造体は、線状又は環状のホウ素含有クラスタと芳香族環基とを含むそれぞれの単位体が共有結合により連結されてなる物質である。
【0018】
具体的には、共有結合性有機骨格構造体において、ホウ素原子と酸素や窒素のような周期律表において第15族及び/又は第16族に属する原子とが共有結合されて形成される線状又は環状のホウ素含有クラスタは、同一又は異なる2つ又は3つの芳香族環基(例えば、フェニレン基など)と共有結合され、この共有結合された芳香族環基が、また、他の1つ以上の線状又は環状のホウ素含有クラスタと共有結合により連続して連結されたネットワーク構造を有する。
【0019】
より具体的には、1単位体(第1の単位体)を構成する芳香族環基は、前記第1の単位体を構成する線状又は環状のホウ素含有クラスタだけでなく、隣り合う他の単位体(第2の単位体)を構成する線状又は環状のホウ素含有クラスタと共有結合し、前記第2の単位体の線状又は環状のホウ素含有クラスタは、さらに他の単位体(第3の単位体)の芳香族環基と共有結合するような方式で連続して連結されることができる。
【0020】
このように形成された共有結合性有機骨格構造体は、堅い多孔質構造を有すると共に、低密度かつ優れた熱的安定性を備えるようになる。
【0021】
なお、従来既知の共有結合性有機骨格構造体のうち、COF−1[(C3H2BO)6・(C9H12)1]又はCOF−5[C9H4BO2]などのように二次元の平面ネットワーク構造を有する共有結合性有機骨格構造体(以下「二次元の共有結合性有機骨格構造体」と称する)がある。具体的には、前記二次元の共有結合性有機骨格構造体は、他の共有結合性有機骨格構造体(以下「三次元の共有結合性有機骨格構造体」と称する)とは異なり、線状又は環状のホウ素含有クラスタとC6〜C204の芳香族環基とを含むそれぞれの単位体が連鎖的に連結されてなる板状層を多数有し、この板状層間の相互作用により各板状層が稠密に積層された構造を有する(図3参照)。
【0022】
このような二次元の共有結合性有機骨格構造体は、三次元の共有結合性有機骨格構造体に比べて水素との結合エネルギーが高いにもかかわらず、水素を吸着し得る表面積が少ないため、水素吸着量が少ない。
【0023】
特に、前記積層構造を有する二次元の共有結合性有機骨格構造体においては、内部に形成された気孔は、水素ガスより大きな分子が通過できる程度に大きい反面、前記板状層間の距離が、板状層間の相互作用により非常に狭い。例えば、COF−1においては、内部に形成された気孔の大きさは約15Åである反面、層間距離[各層の平面をなす原子(例えば、ホウ素、炭素など)中心間の距離](L1)が約3Åである(図4参照)。但し、各層の平面をなす原子のファンデルワールス半径(r)を考慮すると、実質的には、層間距離(L2)は、3Åより小さくなる。よって、動力学的直径(Kinetic diameter)が約2.89Åの水素ガス(水素分子)は、層間への挿入が容易でない。したがって、二次元の共有結合性有機骨格構造体を用いて水素を吸着・貯蔵する場合、水素は、気孔を通じてのみ挿入され、層間への挿入は難しい。
【0024】
このような理由から、二次元の共有結合性有機骨格構造体は、三次元の共有結合性有機骨格構造体に比べて水素吸着量が小さく、従来水素貯蔵媒体として使用されていたゼオライトや多孔質シリケートに比べて比表面積が大きいにもかかわらず、水素吸着量が多くない。また、前記水素の吸着が物理吸着であるため、周辺の温度や圧力変化によって前記有機骨格構造体に吸着された水素が脱着されることがあり、水素貯蔵媒体としての効率が劣るという問題点がある。
【0025】
当業界では、層状化合物の一種である黒鉛を用いて水素を吸着する場合、黒鉛の層間距離が約6Åの時に最も多量の水素が吸着されると予想している。
【0026】
したがって、本発明では、前記二次元の共有結合性有機骨格構造体内における板状層間の距離を広げるため、層間距離を広げながら水素のようなゲスト分子との相互作用力を増大させ得る因子としてルイス塩基を前記板状層内の線状又は環状のホウ素含有クラスタに配位結合させることにより、ゲスト分子が気孔だけでなく板状層の間へも挿入され、ゲスト分子の吸着量が向上することができる。
【0027】
具体的には、本発明に係る有機骨格構造体は、線状又は環状のホウ素含有クラスタに同一又は異なる2つ又は3つのC6〜C204の芳香族環基が共有結合して形成された単位体が隣り合う他の単位体と共有結合して形成された板状層を含んでおり、前記それぞれの板状層内、線状又は環状のホウ素含有クラスタのホウ素原子にはルイス塩基が配位結合されている。なお、前記ホウ素原子とルイス塩基との配位結合は、前記板状層の垂直方向に結合されることができる。
【0028】
このように各板状層に配位結合されているルイス塩基によって、板状層間の距離は、約4Å〜15Å程度に、従来既知の二次元の共有結合性有機骨格構造体の層間距離に比べてより広くなる。上記のように層間距離が約4Å〜15Åと広くなることで、水素は、内部に形成された気孔だけでなく、層の間にも容易に挿入され、これにより、本発明の有機骨格構造体に多量の水素が吸着されることができる。また、本発明の有機骨格構造体は、比表面積が300m2/g〜2,300m2/gであるため、多量の水素を吸着・貯蔵することができる。
【0029】
さらに、板状層の間に存在する空いた空間が、前記板状層にその垂直方向に規則又は不規則的に配位結合したルイス塩基によって規則又は不規則的に区画され、これにより、板状層の間には多数の区画空間が形成されるようになる。このように形成された区画空間は、有機骨格構造体内に挿入された水素が吸着され貯蔵される空間(又は部位)となり得る。なお、前記区画空間に吸着された水素は、従来既知の共有結合性有機骨格構造体と同様に物理吸着される。但し、本発明では、前記板状層に配位結合されるルイス塩基の種類を適宜選択することで、従来既知の共有結合性有機骨格構造体とは異なり、水素の吸着が物理吸着であるにもかかわらず、周辺の圧力や温度が変化しても、吸着された水素が脱着されるのを抑制することができる。即ち、本発明の有機骨格構造体は、水素を非可逆的に吸着することができる。これにより、本発明の有機骨格構造体は、優れた貯蔵性能を有する貯蔵媒体として使用されることができる。
【0030】
本発明の有機骨格構造体において、線状又は環状のホウ素含有クラスタは、ホウ素の有効な反応部位のうち2つの反応部位のそれぞれに周期律表の第15族及び第16族からなる群から選択された2つの原子(例えば、N、P、O、Sなど)を結合することにより形成できる。なお、前記ホウ素の反応部位に結合される2つの原子は、同一でもよく異なっていてもよい。また、前記ホウ素原子が電子対を収容することができるため、非共有電子対を有するルイス塩基が前記ホウ素原子に配位結合し、これにより、層間距離が広くなることができる。なお、前記ルイス塩基とホウ素との配位結合は、前記板状層の垂直方向に行われる。
【0031】
このような線状又は環状のホウ素含有クラスタは、下記の式1又は式2で示すことができる。
【化1】

【化2】

式中、Q1〜Q5は、それぞれ独立に、周期律表の第15族又は第16族に属する原子であり、R1〜R5は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基又はハロゲンである。但し、Q1〜Q5のいずれか1つ以上が第16族に属する原子である場合、この第16族原子に連結されたR1〜R6のいずれか1つ以上は存在しない。
【0032】
このような化学式で示される線状又は環状のホウ素含有クラスタとしては、例えば下記の化合物が挙げられるが、これらに限定されない。
【化3】

【0033】
本発明の線状又は環状のホウ素含有クラスタは、同一又は異なる2つ又は3つのC6〜C204の芳香族環基と共有結合して単位体を形成する。
前記C6〜C204の芳香族環基は、下記の式3、式4、式5及び式6のいずれか1つで示すことができるが、これらに制限されない。
【化4】

【化5】

【化6】

【化7】

式中、D1〜D33は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基及びハロゲンからなる群から選択されることができる。
【0034】
このような化学式で示されるC6〜C204の芳香族環基としては、例えば、次の化合物などが挙げられるが、これらに制限されない。
【化8】

上記のような線状又は環状のホウ素含有クラスタと同一又は異なる2つ又は3つのC6〜C204の芳香族環基とが共有結合されることにより、種々の形態を持つ単位体が形成されるようになる。
【0035】
前記式1で示される環状のホウ素含有クラスタ1つが、前記式3で示されるC6〜C204の芳香族環基3つと共有結合される場合は、下記の式7で示される単位体が形成されることができる。
【化9】

式中、Q1〜Q3及びR1〜R3は、式1での定義と同様であり、D1〜D4は、式3での定義と同様である。
【0036】
このような式7で示される単位体としては、例えば、下記の式7a及び式7bで示される単位体などが挙げられるが、これらに制限されない。
【化10】

【化11】

【0037】
前記式2で示される線状のホウ素含有クラスタ3つが、前記式3で示されるC6〜C204の芳香族環基3つ及び前記式4で示されるC6〜C204の芳香族環基1つと共有結合される場合は、下記の式8で示される単位体が形成されることができる。
【化12】

式中、Q4、Q5及びR4、R5は、前記式2での定義と同様であり、D1〜D10は、前記式3及び式4での定義と同様である。
【0038】
このような式8で示される単位体としては、例えば、下記の式8aで示される単位体が挙げられるが、これに制限されない。
【化13】

【0039】
本発明に係る有機骨格構造体の板状層では、前記式7又は式8で示される単位体(第1の単位体)を構成するC6〜C204の芳香族環基が、前記第1の単位体を構成する線状又は環状のホウ素含有クラスタだけでなく、前記第1の単位体と同じ形態を有する隣り合う他の単位体(第2の単位体)を構成する線状又は環状のホウ素含有クラスタと共有結合され、また、前記第2の単位体の線状のホウ素含有クラスタが、前記第1の単位体と同じ形態を有する隣り合うまた他の単位体(第3の単位体)のC6〜C204の芳香族環基と共有結合されるような方式で連続して連結されることができる。このように形成された板状層は、種々の形態を有することができる。
【0040】
本発明の板状層が、前記式7で示される単位体の連続結合によって形成される場合は、下記の式9で示すことができる。
【化14】

式中、Q1〜Q3及びR1〜R3は、前記式1での定義と同様であり、D1〜D4は、前記式3での定義と同様である。
【0041】
前記式9で示される板状層としては、例えば、下記の式9a及び式9bで示される板状層などが挙げられるが、これらに制限されない。
【化15】

【化16】

【0042】
本発明の板状層が、前記式8で示される単位体の連鎖的結合によって形成される場合は、下記の式10で示すことができる。
【化17】

式中、Q4、Q5及びR4、R5は、前記式2での定義と同様であり、D1〜D4は、前記式3での定義と同様である。
【0043】
前記式10で示される板状層としては、例えば、下記の式10aで示される板状層が挙げられるが、これに制限されない。
【化18】

【0044】
本発明に係る有機骨格構造体は、前述のような板状層1以外に、前記板状層1内における線状又は環状のホウ素含有クラスタに配位結合されたルイス塩基2を含む。なお、前記ホウ素含有クラスタ内、ホウ素原子に配位結合されるルイス塩基は、前記板状層の垂直方向に結合されることができる(図1参照)。例えば、前記式9aで示される板状層1に、ルイス塩基としてピリジン2が垂直方向に配位結合されている(図2参照)。このように、本発明の共有結合性有機骨格構造体は、従来の板状層のみからなる2次元の共有結合性有機骨格構造体とは異なる(図3参照)。
【0045】
このようにルイス塩基が板状層に配位結合されることで、板状層の間には、ルイス塩基が存在しない従来のCOFの場合に比べて大きなギャップ(サイズ:約4Å〜15Å)が生じる。これにより、板状層をなす原子のファンデルワールス半径を考慮しても、前記ギャップの大きさが、水素ガス(動力学的半径Kinetic diameter:約2.98Å)が挿入できる程度に十分に大きいため、このようなギャップを通じて水素が容易に挿入できる。また、前記ルイス塩基によって層間の空いた空間は、規則的又は不規則的に区画され、この区画された空間には、有機骨格構造体に挿入された水素が吸着され貯蔵されるようになる。
【0046】
本発明において、ルイス塩基は、非共有電子対を提供することのできるものであれば、特に制限されないが、第14族、第15族に属する少なくとも1つの原子を含有する化合物が好ましく使用される。例えば、前記ルイス塩基は、N、P、O及びSからなる群から選択される少なくとも1つの原子を含有するヘテロ環化合物であることができるが、これに制限されない。
【0047】
より具体的には、ルイス塩基としては、例えば、ピリジン、4−シアノピリジン、4−ジアルキルアミノピリジン、4,4’−ビピリジン、ピラジン、ピリダジン、ピリミジン、2−メチルピラジン、ピラゾール、イミダゾール、プリン、7−アザインドール、キノリン、イソキノリン、キノキサリン、1,4−ジアザビシクロ(2.2.2)オクタン、キヌクリジン、1,3,5−トリアジン、ヘキサメチレンテトラミン、ピペリジン、ピペラジン、ピロリジン、モルホリン、テトラヒドロフラン、1,4−ジオキサン、1,8−ナフチレンジスルフィドなどが挙げられるが、これらに制限されない。
【0048】
本発明の有機骨格構造体は、下記の方法により製造することができるが、これに制限されない。なお、製造される有機骨格構造体は、半結晶又は結晶である。
【0049】
例えば、前記有機骨格構造体は、メシチレン、1,4−ジオキサン及びこれらの混合物から選択される溶媒の存在下で、下記の式11、式12及び式13のいずれか1つで示されるホウ素含有化合物とルイス塩基との反応によって製造されることができる。
【化19】

【化20】

【化21】

式中、Ar1は、C6〜C204のアリール基又はC6〜C204のヘテロアリール基であり、Ar2は、C6〜C204のアリーレン基又はC6〜C204のヘテロアリーレン基であり、Ar3は、C6〜C204のアレントリイル基又はC6〜C204のヘテロアレントリイル基であり、E1〜E12は、それぞれ独立に、周期律表の第15族又は第16族に属する原子であり、G1〜G12は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基又はハロゲンである。
【0050】
本発明の一実施例によれば、溶媒メシチレンの存在下で、前記ホウ素含有化合物であるベンゼンジボロン酸(BDBA)をピリジンと反応させると、あるBDBAの−B−OH部位と他のBDBAの−B−OH部位との間の縮重合反応により前記式9aで示される板状層1が積層構造で形成されながら、前記BDBAとルイス塩基であるピリジンとの間の化学反応によって前記板状層1内のホウ素原子にピリジン2が前記板状層の垂直方向に配位結合されることで、従来とは異なり、板状層間の距離が広い本発明の有機骨格構造体が形成されるようになる(図2参照)。
【0051】
又は、前記有機骨格構造体は、メシチレン、1,4−ジオキサン及びこれらの混合物から選択される溶媒の存在下で、前記式11、式12及び式13のいずれか1つで示されるホウ素含有化合物と、芳香族ポリアルコール及びルイス塩基との反応により製造することができる。本発明の他の実施例によれば、メシチレンと1,4−ジオキサンとの混合溶媒の存在下で、前記ホウ素含有化合物であるベンゼンジボロン酸(BDBA)、芳香族ポリアルコールであるヘキサヒドロキシトリフェニレン(HHTP)及びピリジンを反応させると、あるBDBAの−B−OH部位と他のBDBAの−B−OH部位と、及び/又はあるBDBAの−B−OH部位とあるHHTPの−OH部位との間の縮重合反応により前記化10aで示される板状層1が積層構造で形成される。前記BDBAとルイス塩基であるピリジンとの間の化学反応により前記板状層1内のホウ素原子にピリジン2が前記板状層の垂直方向に配位結合される。このようにして本発明の有機骨格構造体では、従来とは異なり、板状層間の距離が広い有機骨格構造体が形成されるようになる。
【0052】
具体的には、本発明の有機骨格構造体は、(i)メシチレン、1,4−ジオキサン及びこれらの混合物から選択される溶媒に、前記式11、式12及び式13のいずれか1つで示されるホウ素含有化合物を分散させて分散液(第1の分散液)を形成するステップ、(ii)前記第1の分散液にルイス塩基を添加して分散液(第2の分散液)を形成するステップ、及び(iii)前記第2の分散液を加熱するステップ、を含む方法により製造することができるが、これに制限されない。また、上記の製造方法において、前記第1の分散液の形成時に芳香族ポリアルコールの追加的な分散を行うことができる。また、上記の製造方法は、前記第1の分散液を形成した後、前記第1の分散液を超音波装置で分散させるステップをさらに含むことができる。
【0053】
1)まず、本発明において使用される溶媒の含量は、約1ml〜3mlであることができる。溶媒の含量が1mlを下回ると、反応性が遅過ぎて反応が起こらないことがあり、溶媒の含量が3mlを上回ると、反応の進行が速くなって、非多孔質ポリマーが形成されることがある。
【0054】
また、前記溶媒がメシチレンと1,4−ジオキサンとの混合物である場合、メシチレンと1,4−ジオキサンとは、メシチレン:1,4−ジオキサン=1:1〜1:3の体積比で混合されることが好ましい。全体溶媒に対するメシチレンの体積比が高過ぎると、反応物の溶解度が低くなってしまい、反応の進行が遅くなったり、反応が起こらないことがあり得る。逆に、全体溶媒に対するメシチレンの体積比が低過ぎると、反応の進行が速過ぎて一定の骨格構造を有しない非多孔質ポリマー又はオリゴマが生成されることがあり得る。
【0055】
このような溶媒に分散される前記式11、式12及び式13のいずれか1つで示されるホウ素含有化合物としては、具体的に、例えば、ベンゼンジボロン酸(BDBA)、ビフェニル−4,4’−ジボロン酸(BPDA)、トラン−4,4’−ジボロン酸、スチルベン−4,4’−ジボロン酸、1,3,5−ベンゼントリボロン酸(BTBA)、1,3,5−ベンゼントリス(4−フェニルボロン酸)(BTPA)、1,4−フェニレンジボランジアミン、ビフェニル−4,4’−ジイルジボランジアミンなどが挙げられるが、これらに制限されない。
【0056】
このようなホウ素含有化合物は、溶媒100重量部に対して約50重量部〜250重量部で溶媒に分散されることができる。このような含量でホウ素含有化合物を使用することにより、本発明では、縮重合反応がより円滑に行われると共に、非多孔質ポリマー又はオリゴマが形成されないようにすることができる。
【0057】
本発明において、ホウ素含有化合物と共に、芳香族ポリアルコールを溶媒に分散させて第1の分散液を形成することができる。前記ホウ素含有化合物と芳香族ポリアルコールとの混合溶質の含量は、上記のホウ素含有化合物の含量と同様である。なお、ホウ素含有化合物と芳香族ポリアルコールとの混合比は、ホウ素含有化合物:芳香族ポリアルコール=1:1〜3:1のモル比であることが好ましい。
【0058】
本発明において使用可能な芳香族ポリアルコールとしては、例えば、ヘキサヒドロキシトリフェニレン、ベンゼン−1,4−ジオール、ビフェニル−4,4’−ジオールなどが挙げられるが、これらに制限されない。
【0059】
本発明では、選択的に、前記第1の分散液を、超音波装置を用いて分散液中のホウ素含有化合物又は芳香族ポリアルコールを均一に分散させることができる。なお、超音波装置は、超音波周波数が約40kHzの条件下で使用されることが好ましい。
【0060】
2)次に、前記第1の分散液にルイス塩基を添加して分散液(以下「第2の分散液」という)を形成する。なお、添加されるルイス塩基の含量は、溶媒100重量部に対して約3重量部〜10重量部の範囲であることができる。ルイス塩基の含量が3重量部を下回ると、板状層の一部においてのみ反応が起こることがあり、ルイス塩基の含量が10重量部を上回ると、ルイス塩基とホウ素との配位結合反応が速くなり、生成された結晶又は半結晶粒子の表面においてのみ反応が起こることがあり得る。
【0061】
3)次に、形成された第2の分散液を、ホウ素含有化合物間の縮合反応と共に前記ホウ素含有化合物とルイス塩基との間の化学反応が円滑に行われるように、加熱させる。この加熱温度は、約40℃〜160℃の範囲であることが好ましい。第2の分散液の加熱温度が低すぎると、前記ホウ素含有化合物とルイス塩基との間の化学反応に必要なエネルギーが十分に得られないため、反応が起こらないことがあり、その加熱温度が高すぎると、反応の進行が速くなってオリゴマが生成されることがあり得る。なお、この加熱は、前記第1の分散液を密封した状態で行われることが好ましい。
【0062】
本発明に係る有機骨格構造体は、多量のガス又は有機物質などを吸着又は貯蔵する吸着体として利用されることができる。前記ガスとしては、例えば、アンモニア、二酸化炭素、一酸化炭素、水素、アミン、メタン、酸素、アルゴン、窒素などが挙げられるが、これらに制限されない。前記有機物質としては、例えば、メタン、エタン、プロパン、ブタン、ペンタン、ヘキサン、シクロヘキサン、メタノール、エタノール、プロパノール、イソプロパノール、ベンゼン、トルエンなど、C1〜C12を含むものが挙げられるが、これらに制限されない。
【0063】
また、本発明の有機骨格構造体は、吸着体の他に、触媒(触媒用担持体を含む)、センサ、分離体、乾燥剤、イオン交換物質、分子篩(セパレータ)、クロマトグラフィ用材料、分子の選択的放出体及び吸収体、分子認識物質、ナノチューブ、ナノリアクターなどとして利用されることができる。
【実施例】
【0064】
以下、実施例を挙げて本発明をより詳細に説明する。但し、下記の実施例は、本発明の例示に過ぎず、本発明は、これらの実施例によって何等限定されるものではない。
【0065】
[実施例1]
溶媒メシチレン1.0mlの入った4ml入りガラス瓶に、BDBA(ベンゼンジボロン酸)25mg(0.15mmol)を入れて分散液を形成した後、超音波分解装置(超音波周波数:40kHz)を用いて前記分散液を1時間かけて分散させた。次いで、前記分散液にピリジン0.1mlを加えた。次いで、前記ガラス瓶を密封した後、温度85℃のオーブンで3日間加熱して得られた白色の固体状粉末をろ別し、アセトンで十分に洗浄した後、真空状態で約3時間以上かけて乾燥した。元素分析機を用いて前記得られた固体状粉末の元素を分析した。その分析結果は、次の通りである。
元素分析:(C3H2BO)6(メシチレン)3(ピリジン)2=C55H58N2O6B6,Calcd.C 72.76%,H 6.44%,N 3.09%.Found.C 72.77%、H 6.66%,N 2.98%.
【0066】
[実施例2]
溶媒メシチレン1.0mlに代えて、溶媒メシチレン0.5mlと1,4−ジオキサン0.5mlの混合物を使用した以外は、実施例1と同様にして固体状粉末を得た。
【0067】
(実験例1)有機骨格構造体の分析
1.IRスペクトル比較
実施例1で製造された有機骨格構造体内における板状層にルイス塩基が結合されているかを確認するため、赤外線分光法(IR)を用いて実施例1の有機骨格構造体(PCOF−1)のスペクトルを分析した。その結果を図5に示す。また、対照群としてCOF−1[C3H2BO]6・(C9H12)1](Covalent Organic Framework−1,Science 2005,310,1166)を使用した。
【0068】
図5に示すように、実施例1の有機骨格構造体(PCOF−1)では、1,600cm−1〜1,430cm−1の間でピークが現われ、これに対し、対照群(COF−1)では、前記波数の範囲でピークが現われなかった。前記波数の範囲(1,600cm−1〜1,430cm−1の間)におけるピークは、C−C、C−Nリングストレッチングがある時に現われるものである。また、実施例1の有機骨格構造体(PCOF−1)では、748cm−1及び704cm−1において、C−H面外曲げ(C−H out−of−plane bending)が現われることが確認される。これから、実施例1の有機骨格構造体(PCOF−1)においては、従来の有機骨格構造体(COF−1)とは異なり、板状層にピリジンが結合されていると推定できる。
【0069】
2.PXRDパターン比較
実施例1で製造された有機骨格構造体(PCOF−1)において、板状層にルイス塩基が結合されたかを確認するため、粉末X線回折(PXRD)分析を行った。その結果を図7に示す。また、対照群としてCOF−1[C3H2BO]6・(C9H12)1](Covalent Organic Framework−1,Science 2005,310,1166)を使用した。
【0070】
分析の結果、実施例1の有機骨格構造体(PCOF−1)においては、対照群(COF−1)の特徴的なピークが同様に表われた。これにより、実施例1の有機骨格構造体(PCOF−1)には、従来の有機骨格構造体(COF−1)と同じ構造を有する板状層が存在することがわかる。また、実施例1の有機骨格構造体(PCOF−1)には、従来の有機骨格構造体では現われないピークが存在し、このピークから前記板状層にルイス塩基が結合されていることが推測できる。
【0071】
(実験例2)有機骨格構造体の熱的特性分析
実施例1で製造された有機骨格構造体(PCOF−1)の熱的特性を測定するため、熱重量分析(TGA)を行った。その結果を図6に示す。また、対照群としてCOF−1[C3H2BO]6・(C9H12)1](Covalent Organic Framework−1,Science 2005,310,1166)を使用した。
【0072】
図6からわかるように、対照群(COF−1)は、約400℃の温度付近から熱分解が始まった。一方、実施例1の有機骨格構造体(PCOF−1)は、約500℃温度付近から熱分解が始まった。このような結果から、ルイス塩基が板状層の間に配位結合した、本発明に係る有機骨格構造体では、従来の二次元の平面有機骨格構造体に比べて熱的安定性に優れていることが確認された。
【0073】
また、対照群(COF−1)では、約225℃の温度付近で約20%の重量減少が起きた。一方、実施例1の有機骨格構造体(PCOF−1)では、約100℃の温度付近で約48%の重量減少が起きた。このような重量減少の原因は、有機骨格構造体の合成時に使用された溶媒が有機骨格構造体に吸着し、これが加熱により蒸発されたものと考えられる。このような溶媒の蒸発による重量減少の比率から、実施例1の有機骨格構造体(PCOF−1)が、従来の有機骨格構造体(COF−1)に比べてより多量のゲスト分子を吸着できることが間接的に予想される。
【0074】
(実験例3)有機骨格構造体の水素ガス吸着特性
実施例1で製造された有機骨格構造体(PCOF−1)の水素ガス吸脱着の様態を確認するため、自動吸着機を用いて温度77K及び圧力1atmの条件下で水素ガス吸着実験を行った。その実験結果を図8に示す。また、対照群としてCOF−1[C3H2BO]6・(C9H12)1](Covalent Organic Framework−1,Science 2005,310,1166)を使用した。
【0075】
実験の結果、図8からわかるように、実施例1の有機骨格構造体(PCOF−1)は、対照群(COF−1)とは異なり、有機骨格構造体に水素が非可逆的に吸着されていることが確認された。
【0076】
なお、実施例1の有機骨格構造体(PCOF−1)の水素吸着量は、P/P0=1.0の時に約0.75wt%であった。一方、対照群(COF−1)の水素吸着量は、P/P0=1.0の時に約0.55wt%であった。これは、実施例1の有機骨格構造体(PCOF−1)は、対照群(COF−1)とは異なり、ルイス塩基であるピリジンが導入されることで、新しい吸着部位が生成し、この生成した吸着部位の吸着エネルギーが高いため、水素の吸着量がより増大したものと考えられる。
【0077】
(実験例4)有機骨格構造体の気孔大きさ及び層間距離の測定
実施例1で製造された有機骨格構造体内における板状層間の距離を測定するため、分子モデリング技法を用い、実験的なパラメータが不要な量子力学計算を導入した。Materials Studio 4.3パッケージのDMo13プログラムを利用し、PBE/DNP組合を用いて構造を最適化した。また、層間距離は、各層のホウ素(B)原子がなす平面と隣り合う層のホウ素原子がなす平面との間の距離にした。具体的には、ある6つのホウ素原子からなる六角形平面の層において、その中央の座標を計算した後、その点から隣り合う六角形表面層の中央座標までの距離を計算した。計算の結果、層間距離は、約7.6Åであった。
【技術分野】
【0001】
本発明は、ガス又は有機分子の吸脱着及び/又は貯蔵可能な有機骨格構造体に関する。
【背景技術】
【0002】
現在使用されているエネルギー需要の90%以上を占める化石燃料は、再生が不可能で且つその埋蔵量が有限である。また、化石燃料は、使用時に、NOx、SOx、粉塵などのような大気汚染物質を排出し、環境汚染を起こす。また、化石燃料の燃焼時に排出される二酸化炭素の大気中の濃度が近年上昇して地球温暖化の不安を招いている。
【0003】
このような化石燃料を代替する新燃料源として、化学製品の原料及び化学工程におけるガスとして広く使用されている水素が注目されている。水素は、次のような長所を持っている。第一に、水素は、原料として使用される場合、燃焼時において、極小量のNOx発生を除いては、公害物質を出さない。このため直接燃焼による燃料として又は燃料電池などの燃料として水素を簡便に使用できる。第二に、水素は、ガス状又は液状として容易に製造でき、高圧ガス、液体水素、金属水素化物などの種々の形態で容易に貯蔵できる。第三に、水素は、水から大量に製造でき、使用後は、水への再循環ができるので、資源枯渇が発生するおそれがない。第四に、水素は、産業用の基礎材料を始めとして、一般燃料、水素自動車、水素飛行機、燃料電池など、現在エネルギーシステムにおいて使用される全ての分野で利用できる。
【0004】
但し、このような水素を使用するには、多量の水素を容易に貯蔵可能な媒体が必要になる。そのため、近年、水素貯蔵媒体を開発するため、水素貯蔵合金、カーボンナノチューブ、ゼオライトなどに関する研究が行われている。しかしながら、前記水素貯蔵合金は、水素分子と非常に高い結合エネルギーで化学結合するため、結合した水素の放出過程においても別のエネルギーが必要になるという問題点がある。また、前記カーボンナノチューブあるいはゼオライトでは、水素貯蔵合金とは異なり、水素分子が非常に低い結合エネルギーで材料表面に物理吸着するため、常温常圧において水素貯蔵能が劣るという問題点がある。
【0005】
最近、カリフォルニア大学バークレー校のYaghi教授らの研究チームは、共有結合性有機骨格構造体(Covalent Organic Framework,以下「COF」と略する)について発表した(特許文献1参照)。前記共有結合性有機骨格構造体は、専ら水素、ホウ素、炭素、窒素、酸素などのような原子が共有結合により連結され形成されるものであって、ベンゼンジボロン酸(BDBA)の縮合反応により形成されることができる。このような共有結合性有機骨格構造体は、堅い多孔質(Micro−及びMeso−porous)構造を有するだけでなく、熱的安定性に優れ、かつ密度が低い。また、従来既知のゼオライト、多孔質シリケートなどに比べて比表面積が大きい。
【0006】
したがって、このような共有結合性有機骨格構造体を、新しい水素貯蔵媒体として利用するための研究が行われている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許出願公開2006/0154807 A1
【発明の概要】
【発明が解決しようとする課題】
【0008】
板状層を積み重ねた2D共有結合性有機骨格構造体では、板状層間の距離が非常に短いため、水素を細孔に挿入することはできるが、層間への挿入は難しいことを本発明者らは見出した。
【0009】
それで、線状又は環状のホウ素含有クラスタと2つ又は3つのC6〜C204の芳香族環基とを含む単位体(Building block)を連続して連結させることにより形成した板状層にルイス塩基を導入して板状層間の距離を適切に広げることにより、層間の空間を水素貯蔵に利用できることを本発明者らは見出した。本発明の目的は、大量の水素を吸着できる有機骨格構造体を提供することである。
【課題を解決するための手段】
【0010】
本発明は、線状又は環状のホウ素含有クラスタに2つ又は3つのC6〜C204の芳香族環基が結合した各単位体を連続して連結させることにより形成された多数の板状層と、これら板状層内のホウ素含有クラスタに配位結合されたルイス塩基とを含む有機骨格構造体を提供する。
【0011】
また、本発明は、上述のような有機骨格構造体を含有する吸着体、及び触媒を提供する。
【発明の効果】
【0012】
本発明に係る有機骨格構造体は、2つ又は3つのC6〜C204の芳香族環基と線状又は環状のホウ素含有クラスタとからなる隣接する各単位体を連続して連結させることにより形成された板状層内の線状又は環状のホウ素含有クラスタにルイス塩基を配位結合させる。前記板状層間の距離が、前記板状層に配位結合された前記ルイス塩基により広くなり、これによって、多量の水素を層間へ挿入されるので、多量の水素を吸着することができる。
【0013】
また、本発明に係る有機骨格構造体によれば、前記板状層に結合したルイス塩基によって水素を非可逆的に又は可逆的に吸着することができ、優れた貯蔵性能を有する水素貯蔵媒体として使用することができる。
【図面の簡単な説明】
【0014】
【図1】図1は、本発明の有機骨格構造体を模式的に示す断面図である。
【図2】図2は、本発明の一実施例に係る有機骨格構造体を三次元的に示す図である。
【図3】図3は、従来既知の有機骨格構造体(COF−1)を三次元的に示す図である。
【図4】図4は、本発明に係る有機骨格構造体内における板状層間の距離を示す図である。
【図5】図5は、実施例1で製造した有機骨格構造体(PCOF−1)及び対照群(COF−1)の赤外線スペクトルである。
【図6】図6は、実施例1で製造した有機骨格構造体(PCOF−1)及び対照群(COF−1)の熱重量分析(TGA)を示すグラフである。
【図7】図7は、実施例1で製造した有機骨格構造体(PCOF−1)及び対照群(COF−1)の粉末X線回折(PXRD)分析を示すグラフである。
【図8】図8は、実施例1で製造した有機骨格構造体(PCOF−1)及び対照群(COF−1)の水素ガス吸脱着特性を示すグラフである。
【発明を実施するための形態】
【0015】
以下、本発明の詳細を説明する。
本発明において「線状又は環状のホウ素含有クラスタ」とは、ホウ素の有効な反応部位のうち2つの反応部位のそれぞれにホウ素以外の他の原子が共有結合してなる線状又は環状のホウ素含有分子を意味する。
【0016】
また、本発明において、芳香族環基とは、芳香族環炭化水素、ヘテロ環芳香族化合物、多環芳香族化合物だけでなく、これらのうちの2つの芳香族環が縮合環を形成したものや結合したものを意味する。
【0017】
一般に、共有結合性有機骨格構造体(Covalent Organic Framework,COF)は、水素、ホウ素、炭素、窒素、酸素などの原子が共有結合して形成された多孔性物質である。例えば、従来既知の共有結合性有機骨格構造体は、線状又は環状のホウ素含有クラスタと芳香族環基とを含むそれぞれの単位体が共有結合により連結されてなる物質である。
【0018】
具体的には、共有結合性有機骨格構造体において、ホウ素原子と酸素や窒素のような周期律表において第15族及び/又は第16族に属する原子とが共有結合されて形成される線状又は環状のホウ素含有クラスタは、同一又は異なる2つ又は3つの芳香族環基(例えば、フェニレン基など)と共有結合され、この共有結合された芳香族環基が、また、他の1つ以上の線状又は環状のホウ素含有クラスタと共有結合により連続して連結されたネットワーク構造を有する。
【0019】
より具体的には、1単位体(第1の単位体)を構成する芳香族環基は、前記第1の単位体を構成する線状又は環状のホウ素含有クラスタだけでなく、隣り合う他の単位体(第2の単位体)を構成する線状又は環状のホウ素含有クラスタと共有結合し、前記第2の単位体の線状又は環状のホウ素含有クラスタは、さらに他の単位体(第3の単位体)の芳香族環基と共有結合するような方式で連続して連結されることができる。
【0020】
このように形成された共有結合性有機骨格構造体は、堅い多孔質構造を有すると共に、低密度かつ優れた熱的安定性を備えるようになる。
【0021】
なお、従来既知の共有結合性有機骨格構造体のうち、COF−1[(C3H2BO)6・(C9H12)1]又はCOF−5[C9H4BO2]などのように二次元の平面ネットワーク構造を有する共有結合性有機骨格構造体(以下「二次元の共有結合性有機骨格構造体」と称する)がある。具体的には、前記二次元の共有結合性有機骨格構造体は、他の共有結合性有機骨格構造体(以下「三次元の共有結合性有機骨格構造体」と称する)とは異なり、線状又は環状のホウ素含有クラスタとC6〜C204の芳香族環基とを含むそれぞれの単位体が連鎖的に連結されてなる板状層を多数有し、この板状層間の相互作用により各板状層が稠密に積層された構造を有する(図3参照)。
【0022】
このような二次元の共有結合性有機骨格構造体は、三次元の共有結合性有機骨格構造体に比べて水素との結合エネルギーが高いにもかかわらず、水素を吸着し得る表面積が少ないため、水素吸着量が少ない。
【0023】
特に、前記積層構造を有する二次元の共有結合性有機骨格構造体においては、内部に形成された気孔は、水素ガスより大きな分子が通過できる程度に大きい反面、前記板状層間の距離が、板状層間の相互作用により非常に狭い。例えば、COF−1においては、内部に形成された気孔の大きさは約15Åである反面、層間距離[各層の平面をなす原子(例えば、ホウ素、炭素など)中心間の距離](L1)が約3Åである(図4参照)。但し、各層の平面をなす原子のファンデルワールス半径(r)を考慮すると、実質的には、層間距離(L2)は、3Åより小さくなる。よって、動力学的直径(Kinetic diameter)が約2.89Åの水素ガス(水素分子)は、層間への挿入が容易でない。したがって、二次元の共有結合性有機骨格構造体を用いて水素を吸着・貯蔵する場合、水素は、気孔を通じてのみ挿入され、層間への挿入は難しい。
【0024】
このような理由から、二次元の共有結合性有機骨格構造体は、三次元の共有結合性有機骨格構造体に比べて水素吸着量が小さく、従来水素貯蔵媒体として使用されていたゼオライトや多孔質シリケートに比べて比表面積が大きいにもかかわらず、水素吸着量が多くない。また、前記水素の吸着が物理吸着であるため、周辺の温度や圧力変化によって前記有機骨格構造体に吸着された水素が脱着されることがあり、水素貯蔵媒体としての効率が劣るという問題点がある。
【0025】
当業界では、層状化合物の一種である黒鉛を用いて水素を吸着する場合、黒鉛の層間距離が約6Åの時に最も多量の水素が吸着されると予想している。
【0026】
したがって、本発明では、前記二次元の共有結合性有機骨格構造体内における板状層間の距離を広げるため、層間距離を広げながら水素のようなゲスト分子との相互作用力を増大させ得る因子としてルイス塩基を前記板状層内の線状又は環状のホウ素含有クラスタに配位結合させることにより、ゲスト分子が気孔だけでなく板状層の間へも挿入され、ゲスト分子の吸着量が向上することができる。
【0027】
具体的には、本発明に係る有機骨格構造体は、線状又は環状のホウ素含有クラスタに同一又は異なる2つ又は3つのC6〜C204の芳香族環基が共有結合して形成された単位体が隣り合う他の単位体と共有結合して形成された板状層を含んでおり、前記それぞれの板状層内、線状又は環状のホウ素含有クラスタのホウ素原子にはルイス塩基が配位結合されている。なお、前記ホウ素原子とルイス塩基との配位結合は、前記板状層の垂直方向に結合されることができる。
【0028】
このように各板状層に配位結合されているルイス塩基によって、板状層間の距離は、約4Å〜15Å程度に、従来既知の二次元の共有結合性有機骨格構造体の層間距離に比べてより広くなる。上記のように層間距離が約4Å〜15Åと広くなることで、水素は、内部に形成された気孔だけでなく、層の間にも容易に挿入され、これにより、本発明の有機骨格構造体に多量の水素が吸着されることができる。また、本発明の有機骨格構造体は、比表面積が300m2/g〜2,300m2/gであるため、多量の水素を吸着・貯蔵することができる。
【0029】
さらに、板状層の間に存在する空いた空間が、前記板状層にその垂直方向に規則又は不規則的に配位結合したルイス塩基によって規則又は不規則的に区画され、これにより、板状層の間には多数の区画空間が形成されるようになる。このように形成された区画空間は、有機骨格構造体内に挿入された水素が吸着され貯蔵される空間(又は部位)となり得る。なお、前記区画空間に吸着された水素は、従来既知の共有結合性有機骨格構造体と同様に物理吸着される。但し、本発明では、前記板状層に配位結合されるルイス塩基の種類を適宜選択することで、従来既知の共有結合性有機骨格構造体とは異なり、水素の吸着が物理吸着であるにもかかわらず、周辺の圧力や温度が変化しても、吸着された水素が脱着されるのを抑制することができる。即ち、本発明の有機骨格構造体は、水素を非可逆的に吸着することができる。これにより、本発明の有機骨格構造体は、優れた貯蔵性能を有する貯蔵媒体として使用されることができる。
【0030】
本発明の有機骨格構造体において、線状又は環状のホウ素含有クラスタは、ホウ素の有効な反応部位のうち2つの反応部位のそれぞれに周期律表の第15族及び第16族からなる群から選択された2つの原子(例えば、N、P、O、Sなど)を結合することにより形成できる。なお、前記ホウ素の反応部位に結合される2つの原子は、同一でもよく異なっていてもよい。また、前記ホウ素原子が電子対を収容することができるため、非共有電子対を有するルイス塩基が前記ホウ素原子に配位結合し、これにより、層間距離が広くなることができる。なお、前記ルイス塩基とホウ素との配位結合は、前記板状層の垂直方向に行われる。
【0031】
このような線状又は環状のホウ素含有クラスタは、下記の式1又は式2で示すことができる。
【化1】

【化2】

式中、Q1〜Q5は、それぞれ独立に、周期律表の第15族又は第16族に属する原子であり、R1〜R5は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基又はハロゲンである。但し、Q1〜Q5のいずれか1つ以上が第16族に属する原子である場合、この第16族原子に連結されたR1〜R6のいずれか1つ以上は存在しない。
【0032】
このような化学式で示される線状又は環状のホウ素含有クラスタとしては、例えば下記の化合物が挙げられるが、これらに限定されない。
【化3】

【0033】
本発明の線状又は環状のホウ素含有クラスタは、同一又は異なる2つ又は3つのC6〜C204の芳香族環基と共有結合して単位体を形成する。
前記C6〜C204の芳香族環基は、下記の式3、式4、式5及び式6のいずれか1つで示すことができるが、これらに制限されない。
【化4】

【化5】

【化6】

【化7】

式中、D1〜D33は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基及びハロゲンからなる群から選択されることができる。
【0034】
このような化学式で示されるC6〜C204の芳香族環基としては、例えば、次の化合物などが挙げられるが、これらに制限されない。
【化8】

上記のような線状又は環状のホウ素含有クラスタと同一又は異なる2つ又は3つのC6〜C204の芳香族環基とが共有結合されることにより、種々の形態を持つ単位体が形成されるようになる。
【0035】
前記式1で示される環状のホウ素含有クラスタ1つが、前記式3で示されるC6〜C204の芳香族環基3つと共有結合される場合は、下記の式7で示される単位体が形成されることができる。
【化9】

式中、Q1〜Q3及びR1〜R3は、式1での定義と同様であり、D1〜D4は、式3での定義と同様である。
【0036】
このような式7で示される単位体としては、例えば、下記の式7a及び式7bで示される単位体などが挙げられるが、これらに制限されない。
【化10】

【化11】

【0037】
前記式2で示される線状のホウ素含有クラスタ3つが、前記式3で示されるC6〜C204の芳香族環基3つ及び前記式4で示されるC6〜C204の芳香族環基1つと共有結合される場合は、下記の式8で示される単位体が形成されることができる。
【化12】

式中、Q4、Q5及びR4、R5は、前記式2での定義と同様であり、D1〜D10は、前記式3及び式4での定義と同様である。
【0038】
このような式8で示される単位体としては、例えば、下記の式8aで示される単位体が挙げられるが、これに制限されない。
【化13】

【0039】
本発明に係る有機骨格構造体の板状層では、前記式7又は式8で示される単位体(第1の単位体)を構成するC6〜C204の芳香族環基が、前記第1の単位体を構成する線状又は環状のホウ素含有クラスタだけでなく、前記第1の単位体と同じ形態を有する隣り合う他の単位体(第2の単位体)を構成する線状又は環状のホウ素含有クラスタと共有結合され、また、前記第2の単位体の線状のホウ素含有クラスタが、前記第1の単位体と同じ形態を有する隣り合うまた他の単位体(第3の単位体)のC6〜C204の芳香族環基と共有結合されるような方式で連続して連結されることができる。このように形成された板状層は、種々の形態を有することができる。
【0040】
本発明の板状層が、前記式7で示される単位体の連続結合によって形成される場合は、下記の式9で示すことができる。
【化14】

式中、Q1〜Q3及びR1〜R3は、前記式1での定義と同様であり、D1〜D4は、前記式3での定義と同様である。
【0041】
前記式9で示される板状層としては、例えば、下記の式9a及び式9bで示される板状層などが挙げられるが、これらに制限されない。
【化15】

【化16】

【0042】
本発明の板状層が、前記式8で示される単位体の連鎖的結合によって形成される場合は、下記の式10で示すことができる。
【化17】

式中、Q4、Q5及びR4、R5は、前記式2での定義と同様であり、D1〜D4は、前記式3での定義と同様である。
【0043】
前記式10で示される板状層としては、例えば、下記の式10aで示される板状層が挙げられるが、これに制限されない。
【化18】

【0044】
本発明に係る有機骨格構造体は、前述のような板状層1以外に、前記板状層1内における線状又は環状のホウ素含有クラスタに配位結合されたルイス塩基2を含む。なお、前記ホウ素含有クラスタ内、ホウ素原子に配位結合されるルイス塩基は、前記板状層の垂直方向に結合されることができる(図1参照)。例えば、前記式9aで示される板状層1に、ルイス塩基としてピリジン2が垂直方向に配位結合されている(図2参照)。このように、本発明の共有結合性有機骨格構造体は、従来の板状層のみからなる2次元の共有結合性有機骨格構造体とは異なる(図3参照)。
【0045】
このようにルイス塩基が板状層に配位結合されることで、板状層の間には、ルイス塩基が存在しない従来のCOFの場合に比べて大きなギャップ(サイズ:約4Å〜15Å)が生じる。これにより、板状層をなす原子のファンデルワールス半径を考慮しても、前記ギャップの大きさが、水素ガス(動力学的半径Kinetic diameter:約2.98Å)が挿入できる程度に十分に大きいため、このようなギャップを通じて水素が容易に挿入できる。また、前記ルイス塩基によって層間の空いた空間は、規則的又は不規則的に区画され、この区画された空間には、有機骨格構造体に挿入された水素が吸着され貯蔵されるようになる。
【0046】
本発明において、ルイス塩基は、非共有電子対を提供することのできるものであれば、特に制限されないが、第14族、第15族に属する少なくとも1つの原子を含有する化合物が好ましく使用される。例えば、前記ルイス塩基は、N、P、O及びSからなる群から選択される少なくとも1つの原子を含有するヘテロ環化合物であることができるが、これに制限されない。
【0047】
より具体的には、ルイス塩基としては、例えば、ピリジン、4−シアノピリジン、4−ジアルキルアミノピリジン、4,4’−ビピリジン、ピラジン、ピリダジン、ピリミジン、2−メチルピラジン、ピラゾール、イミダゾール、プリン、7−アザインドール、キノリン、イソキノリン、キノキサリン、1,4−ジアザビシクロ(2.2.2)オクタン、キヌクリジン、1,3,5−トリアジン、ヘキサメチレンテトラミン、ピペリジン、ピペラジン、ピロリジン、モルホリン、テトラヒドロフラン、1,4−ジオキサン、1,8−ナフチレンジスルフィドなどが挙げられるが、これらに制限されない。
【0048】
本発明の有機骨格構造体は、下記の方法により製造することができるが、これに制限されない。なお、製造される有機骨格構造体は、半結晶又は結晶である。
【0049】
例えば、前記有機骨格構造体は、メシチレン、1,4−ジオキサン及びこれらの混合物から選択される溶媒の存在下で、下記の式11、式12及び式13のいずれか1つで示されるホウ素含有化合物とルイス塩基との反応によって製造されることができる。
【化19】

【化20】

【化21】

式中、Ar1は、C6〜C204のアリール基又はC6〜C204のヘテロアリール基であり、Ar2は、C6〜C204のアリーレン基又はC6〜C204のヘテロアリーレン基であり、Ar3は、C6〜C204のアレントリイル基又はC6〜C204のヘテロアレントリイル基であり、E1〜E12は、それぞれ独立に、周期律表の第15族又は第16族に属する原子であり、G1〜G12は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基又はハロゲンである。
【0050】
本発明の一実施例によれば、溶媒メシチレンの存在下で、前記ホウ素含有化合物であるベンゼンジボロン酸(BDBA)をピリジンと反応させると、あるBDBAの−B−OH部位と他のBDBAの−B−OH部位との間の縮重合反応により前記式9aで示される板状層1が積層構造で形成されながら、前記BDBAとルイス塩基であるピリジンとの間の化学反応によって前記板状層1内のホウ素原子にピリジン2が前記板状層の垂直方向に配位結合されることで、従来とは異なり、板状層間の距離が広い本発明の有機骨格構造体が形成されるようになる(図2参照)。
【0051】
又は、前記有機骨格構造体は、メシチレン、1,4−ジオキサン及びこれらの混合物から選択される溶媒の存在下で、前記式11、式12及び式13のいずれか1つで示されるホウ素含有化合物と、芳香族ポリアルコール及びルイス塩基との反応により製造することができる。本発明の他の実施例によれば、メシチレンと1,4−ジオキサンとの混合溶媒の存在下で、前記ホウ素含有化合物であるベンゼンジボロン酸(BDBA)、芳香族ポリアルコールであるヘキサヒドロキシトリフェニレン(HHTP)及びピリジンを反応させると、あるBDBAの−B−OH部位と他のBDBAの−B−OH部位と、及び/又はあるBDBAの−B−OH部位とあるHHTPの−OH部位との間の縮重合反応により前記化10aで示される板状層1が積層構造で形成される。前記BDBAとルイス塩基であるピリジンとの間の化学反応により前記板状層1内のホウ素原子にピリジン2が前記板状層の垂直方向に配位結合される。このようにして本発明の有機骨格構造体では、従来とは異なり、板状層間の距離が広い有機骨格構造体が形成されるようになる。
【0052】
具体的には、本発明の有機骨格構造体は、(i)メシチレン、1,4−ジオキサン及びこれらの混合物から選択される溶媒に、前記式11、式12及び式13のいずれか1つで示されるホウ素含有化合物を分散させて分散液(第1の分散液)を形成するステップ、(ii)前記第1の分散液にルイス塩基を添加して分散液(第2の分散液)を形成するステップ、及び(iii)前記第2の分散液を加熱するステップ、を含む方法により製造することができるが、これに制限されない。また、上記の製造方法において、前記第1の分散液の形成時に芳香族ポリアルコールの追加的な分散を行うことができる。また、上記の製造方法は、前記第1の分散液を形成した後、前記第1の分散液を超音波装置で分散させるステップをさらに含むことができる。
【0053】
1)まず、本発明において使用される溶媒の含量は、約1ml〜3mlであることができる。溶媒の含量が1mlを下回ると、反応性が遅過ぎて反応が起こらないことがあり、溶媒の含量が3mlを上回ると、反応の進行が速くなって、非多孔質ポリマーが形成されることがある。
【0054】
また、前記溶媒がメシチレンと1,4−ジオキサンとの混合物である場合、メシチレンと1,4−ジオキサンとは、メシチレン:1,4−ジオキサン=1:1〜1:3の体積比で混合されることが好ましい。全体溶媒に対するメシチレンの体積比が高過ぎると、反応物の溶解度が低くなってしまい、反応の進行が遅くなったり、反応が起こらないことがあり得る。逆に、全体溶媒に対するメシチレンの体積比が低過ぎると、反応の進行が速過ぎて一定の骨格構造を有しない非多孔質ポリマー又はオリゴマが生成されることがあり得る。
【0055】
このような溶媒に分散される前記式11、式12及び式13のいずれか1つで示されるホウ素含有化合物としては、具体的に、例えば、ベンゼンジボロン酸(BDBA)、ビフェニル−4,4’−ジボロン酸(BPDA)、トラン−4,4’−ジボロン酸、スチルベン−4,4’−ジボロン酸、1,3,5−ベンゼントリボロン酸(BTBA)、1,3,5−ベンゼントリス(4−フェニルボロン酸)(BTPA)、1,4−フェニレンジボランジアミン、ビフェニル−4,4’−ジイルジボランジアミンなどが挙げられるが、これらに制限されない。
【0056】
このようなホウ素含有化合物は、溶媒100重量部に対して約50重量部〜250重量部で溶媒に分散されることができる。このような含量でホウ素含有化合物を使用することにより、本発明では、縮重合反応がより円滑に行われると共に、非多孔質ポリマー又はオリゴマが形成されないようにすることができる。
【0057】
本発明において、ホウ素含有化合物と共に、芳香族ポリアルコールを溶媒に分散させて第1の分散液を形成することができる。前記ホウ素含有化合物と芳香族ポリアルコールとの混合溶質の含量は、上記のホウ素含有化合物の含量と同様である。なお、ホウ素含有化合物と芳香族ポリアルコールとの混合比は、ホウ素含有化合物:芳香族ポリアルコール=1:1〜3:1のモル比であることが好ましい。
【0058】
本発明において使用可能な芳香族ポリアルコールとしては、例えば、ヘキサヒドロキシトリフェニレン、ベンゼン−1,4−ジオール、ビフェニル−4,4’−ジオールなどが挙げられるが、これらに制限されない。
【0059】
本発明では、選択的に、前記第1の分散液を、超音波装置を用いて分散液中のホウ素含有化合物又は芳香族ポリアルコールを均一に分散させることができる。なお、超音波装置は、超音波周波数が約40kHzの条件下で使用されることが好ましい。
【0060】
2)次に、前記第1の分散液にルイス塩基を添加して分散液(以下「第2の分散液」という)を形成する。なお、添加されるルイス塩基の含量は、溶媒100重量部に対して約3重量部〜10重量部の範囲であることができる。ルイス塩基の含量が3重量部を下回ると、板状層の一部においてのみ反応が起こることがあり、ルイス塩基の含量が10重量部を上回ると、ルイス塩基とホウ素との配位結合反応が速くなり、生成された結晶又は半結晶粒子の表面においてのみ反応が起こることがあり得る。
【0061】
3)次に、形成された第2の分散液を、ホウ素含有化合物間の縮合反応と共に前記ホウ素含有化合物とルイス塩基との間の化学反応が円滑に行われるように、加熱させる。この加熱温度は、約40℃〜160℃の範囲であることが好ましい。第2の分散液の加熱温度が低すぎると、前記ホウ素含有化合物とルイス塩基との間の化学反応に必要なエネルギーが十分に得られないため、反応が起こらないことがあり、その加熱温度が高すぎると、反応の進行が速くなってオリゴマが生成されることがあり得る。なお、この加熱は、前記第1の分散液を密封した状態で行われることが好ましい。
【0062】
本発明に係る有機骨格構造体は、多量のガス又は有機物質などを吸着又は貯蔵する吸着体として利用されることができる。前記ガスとしては、例えば、アンモニア、二酸化炭素、一酸化炭素、水素、アミン、メタン、酸素、アルゴン、窒素などが挙げられるが、これらに制限されない。前記有機物質としては、例えば、メタン、エタン、プロパン、ブタン、ペンタン、ヘキサン、シクロヘキサン、メタノール、エタノール、プロパノール、イソプロパノール、ベンゼン、トルエンなど、C1〜C12を含むものが挙げられるが、これらに制限されない。
【0063】
また、本発明の有機骨格構造体は、吸着体の他に、触媒(触媒用担持体を含む)、センサ、分離体、乾燥剤、イオン交換物質、分子篩(セパレータ)、クロマトグラフィ用材料、分子の選択的放出体及び吸収体、分子認識物質、ナノチューブ、ナノリアクターなどとして利用されることができる。
【実施例】
【0064】
以下、実施例を挙げて本発明をより詳細に説明する。但し、下記の実施例は、本発明の例示に過ぎず、本発明は、これらの実施例によって何等限定されるものではない。
【0065】
[実施例1]
溶媒メシチレン1.0mlの入った4ml入りガラス瓶に、BDBA(ベンゼンジボロン酸)25mg(0.15mmol)を入れて分散液を形成した後、超音波分解装置(超音波周波数:40kHz)を用いて前記分散液を1時間かけて分散させた。次いで、前記分散液にピリジン0.1mlを加えた。次いで、前記ガラス瓶を密封した後、温度85℃のオーブンで3日間加熱して得られた白色の固体状粉末をろ別し、アセトンで十分に洗浄した後、真空状態で約3時間以上かけて乾燥した。元素分析機を用いて前記得られた固体状粉末の元素を分析した。その分析結果は、次の通りである。
元素分析:(C3H2BO)6(メシチレン)3(ピリジン)2=C55H58N2O6B6,Calcd.C 72.76%,H 6.44%,N 3.09%.Found.C 72.77%、H 6.66%,N 2.98%.
【0066】
[実施例2]
溶媒メシチレン1.0mlに代えて、溶媒メシチレン0.5mlと1,4−ジオキサン0.5mlの混合物を使用した以外は、実施例1と同様にして固体状粉末を得た。
【0067】
(実験例1)有機骨格構造体の分析
1.IRスペクトル比較
実施例1で製造された有機骨格構造体内における板状層にルイス塩基が結合されているかを確認するため、赤外線分光法(IR)を用いて実施例1の有機骨格構造体(PCOF−1)のスペクトルを分析した。その結果を図5に示す。また、対照群としてCOF−1[C3H2BO]6・(C9H12)1](Covalent Organic Framework−1,Science 2005,310,1166)を使用した。
【0068】
図5に示すように、実施例1の有機骨格構造体(PCOF−1)では、1,600cm−1〜1,430cm−1の間でピークが現われ、これに対し、対照群(COF−1)では、前記波数の範囲でピークが現われなかった。前記波数の範囲(1,600cm−1〜1,430cm−1の間)におけるピークは、C−C、C−Nリングストレッチングがある時に現われるものである。また、実施例1の有機骨格構造体(PCOF−1)では、748cm−1及び704cm−1において、C−H面外曲げ(C−H out−of−plane bending)が現われることが確認される。これから、実施例1の有機骨格構造体(PCOF−1)においては、従来の有機骨格構造体(COF−1)とは異なり、板状層にピリジンが結合されていると推定できる。
【0069】
2.PXRDパターン比較
実施例1で製造された有機骨格構造体(PCOF−1)において、板状層にルイス塩基が結合されたかを確認するため、粉末X線回折(PXRD)分析を行った。その結果を図7に示す。また、対照群としてCOF−1[C3H2BO]6・(C9H12)1](Covalent Organic Framework−1,Science 2005,310,1166)を使用した。
【0070】
分析の結果、実施例1の有機骨格構造体(PCOF−1)においては、対照群(COF−1)の特徴的なピークが同様に表われた。これにより、実施例1の有機骨格構造体(PCOF−1)には、従来の有機骨格構造体(COF−1)と同じ構造を有する板状層が存在することがわかる。また、実施例1の有機骨格構造体(PCOF−1)には、従来の有機骨格構造体では現われないピークが存在し、このピークから前記板状層にルイス塩基が結合されていることが推測できる。
【0071】
(実験例2)有機骨格構造体の熱的特性分析
実施例1で製造された有機骨格構造体(PCOF−1)の熱的特性を測定するため、熱重量分析(TGA)を行った。その結果を図6に示す。また、対照群としてCOF−1[C3H2BO]6・(C9H12)1](Covalent Organic Framework−1,Science 2005,310,1166)を使用した。
【0072】
図6からわかるように、対照群(COF−1)は、約400℃の温度付近から熱分解が始まった。一方、実施例1の有機骨格構造体(PCOF−1)は、約500℃温度付近から熱分解が始まった。このような結果から、ルイス塩基が板状層の間に配位結合した、本発明に係る有機骨格構造体では、従来の二次元の平面有機骨格構造体に比べて熱的安定性に優れていることが確認された。
【0073】
また、対照群(COF−1)では、約225℃の温度付近で約20%の重量減少が起きた。一方、実施例1の有機骨格構造体(PCOF−1)では、約100℃の温度付近で約48%の重量減少が起きた。このような重量減少の原因は、有機骨格構造体の合成時に使用された溶媒が有機骨格構造体に吸着し、これが加熱により蒸発されたものと考えられる。このような溶媒の蒸発による重量減少の比率から、実施例1の有機骨格構造体(PCOF−1)が、従来の有機骨格構造体(COF−1)に比べてより多量のゲスト分子を吸着できることが間接的に予想される。
【0074】
(実験例3)有機骨格構造体の水素ガス吸着特性
実施例1で製造された有機骨格構造体(PCOF−1)の水素ガス吸脱着の様態を確認するため、自動吸着機を用いて温度77K及び圧力1atmの条件下で水素ガス吸着実験を行った。その実験結果を図8に示す。また、対照群としてCOF−1[C3H2BO]6・(C9H12)1](Covalent Organic Framework−1,Science 2005,310,1166)を使用した。
【0075】
実験の結果、図8からわかるように、実施例1の有機骨格構造体(PCOF−1)は、対照群(COF−1)とは異なり、有機骨格構造体に水素が非可逆的に吸着されていることが確認された。
【0076】
なお、実施例1の有機骨格構造体(PCOF−1)の水素吸着量は、P/P0=1.0の時に約0.75wt%であった。一方、対照群(COF−1)の水素吸着量は、P/P0=1.0の時に約0.55wt%であった。これは、実施例1の有機骨格構造体(PCOF−1)は、対照群(COF−1)とは異なり、ルイス塩基であるピリジンが導入されることで、新しい吸着部位が生成し、この生成した吸着部位の吸着エネルギーが高いため、水素の吸着量がより増大したものと考えられる。
【0077】
(実験例4)有機骨格構造体の気孔大きさ及び層間距離の測定
実施例1で製造された有機骨格構造体内における板状層間の距離を測定するため、分子モデリング技法を用い、実験的なパラメータが不要な量子力学計算を導入した。Materials Studio 4.3パッケージのDMo13プログラムを利用し、PBE/DNP組合を用いて構造を最適化した。また、層間距離は、各層のホウ素(B)原子がなす平面と隣り合う層のホウ素原子がなす平面との間の距離にした。具体的には、ある6つのホウ素原子からなる六角形平面の層において、その中央の座標を計算した後、その点から隣り合う六角形表面層の中央座標までの距離を計算した。計算の結果、層間距離は、約7.6Åであった。
【特許請求の範囲】
【請求項1】
線状又は環状のホウ素含有クラスタに2つ又は3つのC6〜C204の芳香族環基が共有結合されて単位体をなし、前記単位体が隣り合う他の単位体と連続して連結され形成された板状層と、
前記板状層内のホウ素含有クラスタに配位結合されたルイス塩基と、
を含む有機骨格構造体。
【請求項2】
隣り合う板状層の層間距離が、4Å〜15Åの範囲である請求項1に記載の有機骨格構造体。
【請求項3】
ルイス塩基が、ホウ素含有クラスタ内のホウ素原子に配位結合されている請求項1に記載の有機骨格構造体。
【請求項4】
ルイス塩基が、板状層の垂直方向にホウ素含有クラスタ内の原子に配位結合されている請求項1に記載の有機骨格構造体。
【請求項5】
ホウ素含有クラスタが、周期律表の第15族及び第16族からなる群から選択された2つの原子がホウ素(B)に共有結合して形成され、前記2つの原子が同一でも異なってもよい請求項1に記載の有機骨格構造体。
【請求項6】
ホウ素に共有結合した各原子が、窒素(N)、酸素(O)、リン(P)及び硫黄(S)からなる群から選択される請求項5に記載の有機骨格構造体。
【請求項7】
ホウ素含有クラスタが、下記の式1又は式2で示される構造を有する請求項1に記載の有機骨格構造体。
【化1】

【化2】

(式中、Q1〜Q5は、それぞれ独立に、周期律表の第15族及び第16族から選ばれる原子を示し、R1〜R5は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基又はハロゲンを示す。但し、Q1〜Q5の少なくとも1つが第16族から選ばれる原子である場合、前記第16族原子に結合したR1〜R5の少なくとも1つは存在しない。)
【請求項8】
各C6〜C204芳香族環基が、下記の式3から式6のいずれか1つで示される請求項1に記載の有機骨格構造体。
【化3】

【化4】

【化5】

【化6】

(式中、D1〜D33は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基及びハロゲンからなる群から選択される。)
【請求項9】
各単位体が、下記の式7又は式8で示される請求項1に記載の有機骨格構造体。
【化7】

【化8】

(式中、Q1〜Q5及びR1〜R5は、請求項7での定義と同様であり、D1〜D10は、請求項8での定義と同様である。)
【請求項10】
各板状層が、下記の式9又は式10で示される請求項1に記載の有機骨格構造体。
【化9】

【化10】

(式中、Q1〜Q5及びR1〜R5は、請求項7での定義と同様であり、D1〜D10は、請求項8での定義と同様である。)
【請求項11】
ルイス塩基が、N、P、O及びSからなる群から選択される少なくとも1つを含有するヘテロ環化合物である請求項1に記載の有機骨格構造体。
【請求項12】
ルイス塩基が、ピリジン、4−シアノピリジン、4−ジアルキルアミノピリジン、4,4’−ビピリジン、ピラジン、ピリダジン、ピリミジン、2−メチルピラジン、ピラゾール、イミダゾール、プリン、7−アザインドール、キノリン、イソキノリン、キノキサリン、1,4−ジアザビシクロ(2.2.2)オクタン、キヌクリジン、1,3,5−トリアジン、ヘキサメチレンテトラミン、ピペリジン、ピペラジン、ピロリジン、モルホリン、テトラヒドロフラン、1,4−ジオキサン、及び1,8−ナフチレンジスルフィドからなる群から選択される請求項1に記載の有機骨格構造体。
【請求項13】
溶媒の存在下、i)下記の式11、式12及び式13のいずれか1つで示されるホウ素含有化合物とルイス塩基とを反応させ、又は、ii)下記の式11、式12及び式13のいずれか1つで示されるホウ素含有化合物を、芳香族ポリアルコール及びルイス塩基と反応させて製造される請求項1に記載の有機骨格構造体。
【化11】

【化12】

【化13】

(式中、Ar1は、C6〜C204のアリール基又はC6〜C204のヘテロアリール基を示し、Ar2は、C6〜C204のアリーレン基又はC6〜C204のヘテロアリーレン基を示し、Ar3は、C6〜C204のアレントリイル基又はC6〜C204のヘテロアレントリイル基であり、E1〜E12は、それぞれ独立に、周期律表の第15族及び第16族から選ばれる原子を示し、G1〜G12は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基、又はハロゲンを示す。)
【請求項14】
溶媒が、メシチレン、1,4−ジオキサン及びこれらの混合物から選択される請求項13に記載の有機骨格構造体。
【請求項15】
ホウ素含有化合物が、ベンゼンジボロン酸(BDBA)、ビフェニル−4,4’−ジボロン酸(BPDA)、トラン−4,4’−ジボロン酸、スチルベン−4,4’−ジボロン酸、1,3,5−ベンゼントリボロン酸(BTBA)、1,3,5−ベンゼントリス(4−フェニルボロン酸)(BTPA)、1,4−フェニレンジボランジアミン及びビフェニル―4,4’−ジイルジボランジアミンからなる群から選択され、芳香族ポリアルコールが、ヘキサヒドロキシトリフェニレン、ベンゼン−1,4−ジオール及びビフェニル−4,4’−ジオールからなる群から選択される請求項13に記載の有機骨格構造体。
【請求項16】
反応温度が、40℃〜160℃の範囲である請求項13に記載の有機骨格構造体。
【請求項17】
ガス又は有機分子の吸着、脱着又は両方を行うことができる請求項1に記載の有機骨格構造体。
【請求項18】
センサ、分離体、乾燥剤、イオン交換物質、分子篩、クロマトグラフィ用材料、選択的分子放出体及び吸収体、分子認識物質、ナノチューブ並びにナノリアクターからなる群から選択される用途で使用される請求項17に記載の有機骨格構造体。
【請求項19】
請求項1〜17のいずれかに記載の有機骨格構造体を含有する吸着体。
【請求項20】
アンモニア、二酸化炭素、一酸化炭素、水素、アミン、メタン、酸素、アルゴン及び窒素からなる群から選択されたガス又は有機物質を吸着又は貯蔵することができる請求項19に記載の吸着体。
【請求項21】
請求項1〜17のいずれかに記載の有機骨格構造体を含有する触媒。
【請求項1】
線状又は環状のホウ素含有クラスタに2つ又は3つのC6〜C204の芳香族環基が共有結合されて単位体をなし、前記単位体が隣り合う他の単位体と連続して連結され形成された板状層と、
前記板状層内のホウ素含有クラスタに配位結合されたルイス塩基と、
を含む有機骨格構造体。
【請求項2】
隣り合う板状層の層間距離が、4Å〜15Åの範囲である請求項1に記載の有機骨格構造体。
【請求項3】
ルイス塩基が、ホウ素含有クラスタ内のホウ素原子に配位結合されている請求項1に記載の有機骨格構造体。
【請求項4】
ルイス塩基が、板状層の垂直方向にホウ素含有クラスタ内の原子に配位結合されている請求項1に記載の有機骨格構造体。
【請求項5】
ホウ素含有クラスタが、周期律表の第15族及び第16族からなる群から選択された2つの原子がホウ素(B)に共有結合して形成され、前記2つの原子が同一でも異なってもよい請求項1に記載の有機骨格構造体。
【請求項6】
ホウ素に共有結合した各原子が、窒素(N)、酸素(O)、リン(P)及び硫黄(S)からなる群から選択される請求項5に記載の有機骨格構造体。
【請求項7】
ホウ素含有クラスタが、下記の式1又は式2で示される構造を有する請求項1に記載の有機骨格構造体。
【化1】

【化2】

(式中、Q1〜Q5は、それぞれ独立に、周期律表の第15族及び第16族から選ばれる原子を示し、R1〜R5は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基又はハロゲンを示す。但し、Q1〜Q5の少なくとも1つが第16族から選ばれる原子である場合、前記第16族原子に結合したR1〜R5の少なくとも1つは存在しない。)
【請求項8】
各C6〜C204芳香族環基が、下記の式3から式6のいずれか1つで示される請求項1に記載の有機骨格構造体。
【化3】

【化4】

【化5】

【化6】

(式中、D1〜D33は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基及びハロゲンからなる群から選択される。)
【請求項9】
各単位体が、下記の式7又は式8で示される請求項1に記載の有機骨格構造体。
【化7】

【化8】

(式中、Q1〜Q5及びR1〜R5は、請求項7での定義と同様であり、D1〜D10は、請求項8での定義と同様である。)
【請求項10】
各板状層が、下記の式9又は式10で示される請求項1に記載の有機骨格構造体。
【化9】

【化10】

(式中、Q1〜Q5及びR1〜R5は、請求項7での定義と同様であり、D1〜D10は、請求項8での定義と同様である。)
【請求項11】
ルイス塩基が、N、P、O及びSからなる群から選択される少なくとも1つを含有するヘテロ環化合物である請求項1に記載の有機骨格構造体。
【請求項12】
ルイス塩基が、ピリジン、4−シアノピリジン、4−ジアルキルアミノピリジン、4,4’−ビピリジン、ピラジン、ピリダジン、ピリミジン、2−メチルピラジン、ピラゾール、イミダゾール、プリン、7−アザインドール、キノリン、イソキノリン、キノキサリン、1,4−ジアザビシクロ(2.2.2)オクタン、キヌクリジン、1,3,5−トリアジン、ヘキサメチレンテトラミン、ピペリジン、ピペラジン、ピロリジン、モルホリン、テトラヒドロフラン、1,4−ジオキサン、及び1,8−ナフチレンジスルフィドからなる群から選択される請求項1に記載の有機骨格構造体。
【請求項13】
溶媒の存在下、i)下記の式11、式12及び式13のいずれか1つで示されるホウ素含有化合物とルイス塩基とを反応させ、又は、ii)下記の式11、式12及び式13のいずれか1つで示されるホウ素含有化合物を、芳香族ポリアルコール及びルイス塩基と反応させて製造される請求項1に記載の有機骨格構造体。
【化11】

【化12】

【化13】

(式中、Ar1は、C6〜C204のアリール基又はC6〜C204のヘテロアリール基を示し、Ar2は、C6〜C204のアリーレン基又はC6〜C204のヘテロアリーレン基を示し、Ar3は、C6〜C204のアレントリイル基又はC6〜C204のヘテロアレントリイル基であり、E1〜E12は、それぞれ独立に、周期律表の第15族及び第16族から選ばれる原子を示し、G1〜G12は、それぞれ独立に、水素、C1〜C12のアルキル基、C6〜C12のアリール基、又はハロゲンを示す。)
【請求項14】
溶媒が、メシチレン、1,4−ジオキサン及びこれらの混合物から選択される請求項13に記載の有機骨格構造体。
【請求項15】
ホウ素含有化合物が、ベンゼンジボロン酸(BDBA)、ビフェニル−4,4’−ジボロン酸(BPDA)、トラン−4,4’−ジボロン酸、スチルベン−4,4’−ジボロン酸、1,3,5−ベンゼントリボロン酸(BTBA)、1,3,5−ベンゼントリス(4−フェニルボロン酸)(BTPA)、1,4−フェニレンジボランジアミン及びビフェニル―4,4’−ジイルジボランジアミンからなる群から選択され、芳香族ポリアルコールが、ヘキサヒドロキシトリフェニレン、ベンゼン−1,4−ジオール及びビフェニル−4,4’−ジオールからなる群から選択される請求項13に記載の有機骨格構造体。
【請求項16】
反応温度が、40℃〜160℃の範囲である請求項13に記載の有機骨格構造体。
【請求項17】
ガス又は有機分子の吸着、脱着又は両方を行うことができる請求項1に記載の有機骨格構造体。
【請求項18】
センサ、分離体、乾燥剤、イオン交換物質、分子篩、クロマトグラフィ用材料、選択的分子放出体及び吸収体、分子認識物質、ナノチューブ並びにナノリアクターからなる群から選択される用途で使用される請求項17に記載の有機骨格構造体。
【請求項19】
請求項1〜17のいずれかに記載の有機骨格構造体を含有する吸着体。
【請求項20】
アンモニア、二酸化炭素、一酸化炭素、水素、アミン、メタン、酸素、アルゴン及び窒素からなる群から選択されたガス又は有機物質を吸着又は貯蔵することができる請求項19に記載の吸着体。
【請求項21】
請求項1〜17のいずれかに記載の有機骨格構造体を含有する触媒。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2012−506423(P2012−506423A)
【公表日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願番号】特願2011−533121(P2011−533121)
【出願日】平成21年11月17日(2009.11.17)
【国際出願番号】PCT/KR2009/006769
【国際公開番号】WO2010/056092
【国際公開日】平成22年5月20日(2010.5.20)
【出願人】(511089941)インシリコテック カンパニー リミテッド (1)
【Fターム(参考)】
【公表日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願日】平成21年11月17日(2009.11.17)
【国際出願番号】PCT/KR2009/006769
【国際公開番号】WO2010/056092
【国際公開日】平成22年5月20日(2010.5.20)
【出願人】(511089941)インシリコテック カンパニー リミテッド (1)
【Fターム(参考)】
[ Back to top ]

