架橋されたタンパク質ナノ結晶、架橋されたタンパク質ナノ凝集体およびそれらの調製方法
本発明は、架橋されたタンパク質ナノ粒子およびその調製方法に関する。本方法は、機械的もしくは流体力学的剪断、機械的破砕、音波キャビテーションおよび/または流体力学的キャビテーションによるタンパク質ナノ粒子前駆体材料(すなわち、ミクロン以上の大きさの架橋されたタンパク質)の調製およびナノ化(すなわち、ナノスケールへの大きさの縮小)を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、架橋されたタンパク質ナノ粒子および架橋されたタンパク質ナノ粒子を生成するためのナノ化方法に関する。
【背景技術】
【0002】
タンパク質を基礎とする応用(必ずしも限定されるものではないが、主に、酵素、抗体、受容体、ホルモンおよび構造タンパク質の使用)は、生物工学、生物医学、薬学、生体材料および化粧品産業において十分に確立されている。短い半減期、不十分な安定性、不十分な回収可能性、狭い使用範囲、高い費用、加水分解不安定性および不十分な生物学的利用能などの個々のタンパク質の応用に関するいくつかの一般的な問題の少なくとも一部は、架橋されたタンパク質結晶および凝集体を用いて対処されている。ミクロン以上の大きさの粒子を含む前記結晶および凝集体は、構造的および化学的に堅牢な長寿命の材料を提供し、個々のタンパク質に共通する多くの限界を回避し、それにより、いくつかの主な問題を改善している。それでもなお、それらのミクロン以上の大きさによって、物質輸送の限界、触媒中心へのアクセスの低下、架橋および不十分な生体吸収性に起因する限られた触媒効率などの個々のタンパク質に無関係な各種問題が生じている。場合によっては、前記調製物の再利用にも関わらず、高い費用も大きな原因となっている。
【0003】
また、ナノ技術の実施によってタンパク質製品の生理活性、安定性、貯蔵寿命、使用範囲および生物学的利用能を最適化する努力も続けられている。本明細書ではまとめてタンパク質ナノ粒子(すなわち、全方向(dimension)の断面長さが1ミクロン未満であるタンパク質材料)と呼ぶが、現在までのところ報告されている数例は、タンパク質ナノ凝集体(すなわち、二量体およびさらにより高次の会合体からなる非結晶タンパク質ナノクラスタ)およびタンパク質ナノ結晶(すなわち、結晶性タンパク質ナノ粒子)で構成されている。新規なナノサイズのタンパク質凝集体および結晶(特に架橋型)の調製および利用は、研究の一領域を占めるが、成功は限られている。
【0004】
タンパク質系製品の入手経路や範囲が限られていることや製造上の制約を鑑みると、新規な架橋されたタンパク質ナノ粒子などの材料を実現することが求められている。同様に、一般に産業および医学の現在の問題の多くに対処するために、その架橋されたタンパク質ナノ粒子をより十分に利用することができるように、好都合な調製方法を確立することも求められている。残念ながら、一般的かつ容易な解決法がないため、新しい架橋されたタンパク質ナノ粒子の開発および調製は、技術的問題によって遅れている。特にナノスケール材料に存在する物理化学的性状(例えば、本質的に高い界面エネルギーおよび反応性)は、これらの問題の根底にある1つの要因である。確立されているタンパク質系製品の中で、天然状態の個々のタンパク質を一緒にして、より大きな会合体を形成するボトムアップ戦略のみが、架橋されたタンパク質ナノ粒子を調製するために利用されている。対照的に、より大きな架橋されたタンパク質材料に対する物理的大きさの縮小方法(すなわち、トップダウン手法)を用いて、架橋されたタンパク質ナノ粒子を調製する手法は全く報告されていない。実際、ナノ化(すなわち、より大きな材料の大きさをナノスケールに縮小すること)またはナノ断片化(すなわち、ナノサイズの断片すなわち「ナノ断片」を得るためのより大きな材料の断片化)は、架橋されたタンパク質に対してまだ試験されていない。タンパク質が「人為的な」プロセス条件によって容易に損なわれるという一般に言われている考えは、サイズ縮小の利点に関する早期の評価を阻んだ1つの要因である。さらに、軟材料(タンパク質系材料を暗示している)を断片化する行為は、粒径が減少するにつれてますます難しくなることが知られている。この一般的な認識は、恐らく2つ目の阻止要因として機能している。
【0005】
本発明では、架橋されたタンパク質ナノ粒子を調製するという課題を、物理的大きさの縮小方法を架橋されたミクロン以上の大きさのタンパク質材料(以下、前駆体材料と呼ぶ)に適用することによって解決する。そのような手法によって、制御可能な大きさの堅牢なタンパク質系ナノ粒子材料が得られる。同様に、それによって、個々のタンパク質溶液から架橋されたタンパク質会合体を直接調製することに関する確立されている説得力のある技術的問題が回避される。これによって得られた架橋されたタンパク質(前記前駆体材料のナノ断片またはナノ断片化製品)は、全く新しい種類の架橋されたナノスケールのタンパク質製品を形成し、それを、本明細書では架橋されたタンパク質ナノ粒子(すなわち、各方向が1ミクロン未満の断面長さである架橋されたタンパク質ナノ結晶および架橋されたタンパク質ナノ凝集体)と呼ぶ。
【0006】
報告している製品に匹敵するものとして何気なく(すなわち、例えばタンパク質ナノ粒子という類似した用語が理由で)誤解されていると思われる先行技術例は、実際には別の種類の架橋されたタンパク質製品について述べている。これらの製品は個々の天然のタンパク質(すなわち、架橋されていない前駆体)から調製され、これは、本発明と比較されている場合、明らかに異なる前駆体源を示している。また、本発明の製品は、比較的非常に大きな構造の架橋されたナノ断片である。本発明の架橋されたナノ粒子は、医療従事者に知られている任意の数の従来の手段によって細胞内に容易に取り込まれるという点で、高い生物学的利用能を示し、個々のタンパク質と比較して体内により長く生存する。さらに、これらのナノ粒子は、著しい加水分解安定性を有するために摂取可能であり、従って、それらは、腸管関連リンパ系組織(gut-associated lymphoid tissue、以下GALTと記す)系などの体内への吸収のための新しい道を提供する。前記ナノ粒子は、それらの好ましい表面および拡散/物質輸送特性を考慮すると、高い生理活性、およびこの分野の経験者に知られている架橋効果による操作安定性の向上を示す。
【0007】
架橋されたタンパク質ナノ粒子の前駆体材料は、商業的に得られたものであってもよい。あるいは、前記架橋されたタンパク質ナノ粒子前駆体の調製方法は、当該技術分野に精通している誰にでも利用可能である。前記前駆体材料は、2つの工程で調製される。最初に、標的タンパク質に対して、好適な溶媒/反溶媒沈殿または凍結乾燥方法を行って、ミクロン以上の大きさのタンパク質凝集体を形成するか、あるいは結晶化方法を行って、ミクロン以上の大きさのタンパク質結晶を形成し、次いで、任意の従来の化学架橋方法(すなわち、化学試薬促進、化学反応性リンカー促進および/または酵素促進架橋)または脱水熱架橋方法(すなわち、熱促進縮合)を行って、共有結合的に架橋されたタンパク質材料(すなわち、本発明の前駆体材料)を形成する。架橋されたナノ粒子製品を調製するために、前記前駆体の大きさを物理的に縮小して、対応する架橋されたタンパク質ナノ凝集体またはナノ結晶を直接生成し、確立されているボトムアップ手法に典型的に付随する任意の問題を回避する。
【発明の概要】
【0008】
従って、本発明は、1種以上のタンパク質および少なくとも1種のゼロ以上の長さのタンパク質間架橋を含むナノ粒子が、各方向の最小長さが1ミクロンである組成的に同等またはほぼ同等な前駆体材料のナノ断片化製品として得られることを特徴とする、生物工学、化粧品、医薬および生物医学への応用を可能にするのに適した10〜999nm、好ましくは50〜200nmの大きさの共有結合的に架橋されたタンパク質ナノ粒子を提供する。
【0009】
本発明の別の態様は、購入されるか社内で容易に調製される前駆体材料(すなわち、架橋されたミクロン以上の大きさのタンパク質凝集体もしくは結晶)をナノ化する(すなわち、物理的大きさをナノスケールまで縮小させる)ことによって、架橋されたタンパク質ナノ粒子の驚くほど単純な調製方法に関する。
【0010】
本発明の別の態様は、経皮、経口(および最終的にGALT)、経粘膜(例えば、バッカル、舌下)、吸入および注射(例えば、腹腔内、筋肉内、皮下、クモ膜下腔内、実質内および注入)などの任意の局所もしくは全身投与経路によって実行を向上させるための、定義されている方法によって生成された架橋されたタンパク質ナノ粒子の使用に関する。
【0011】
本発明の別の態様は、公知のリソソーム貯蔵障害のいずれか1つに起因する代謝不均衡を回復させるための、定義されている方法によって生成された架橋されたタンパク質ナノ粒子の使用に関する。
【0012】
以下に示すように、架橋されたタンパク質会合体は、個々のタンパク質単位を物理的に組み立て、同時またはその後に、化学、酵素または脱水熱架橋方法を実施することによって以前から得られている。架橋の作用は徹底的に調査されており、その役割は変動的である。例えば、多くの場合、ナノ凝集体を形成するタンパク質の会合は、自然発生的もしくは予測可能なプロセスではなかった。従って、共有結合的架橋方法を使用して、タンパク質ナノ凝集体の組み立てを物理的に引き起こし、微調整している。
【0013】
米国特許第4001401号は、ナノサイズの可溶性粒子としての「ポリヘモグロビン」を得る溶液相ヘモグロビンの漸進的化学的架橋を開示している(クラスタ当たり13個以下のタンパク質会合体が形成されたため、このポリヘモグロビンという用語は誤称とみなされるかもしれない)。類似した例ならびに多タンパク質ヘモグロビン会合体が発見される可能性があり、それは、可能な代用血液として現在研究されている(F D'Agnillo and TMS Chang (1998) "Polyhemoglobin-superoxide dismutase-catalase as a blood substitute with antioxidant properties(抗酸化剤特性を有する代用血液としてのポリヘモグロビン−スーパーオキシドジスムターゼ−カタラーゼ)" Nature Biotechnology 16, 667-671;およびRobert Winslow (2006) Blood Substitutes(代用血液), Chp. 38, Elsevier, London, GB)。
【0014】
米国特許出願第2008/0296231A1号は、タンパク質会合の完了後のミクロンの大きさのタンパク質粒子を不溶化するための化学的架橋の使用を開示している。
J Leeらは、無機支持体の孔内での化学的に架橋された酵素凝集体の形成を開示している("Simple Synthesis of Hierarchically Ordered Mesocellular Mesoporous Silica Materials Hosting Crosslinked Enzyme Aggregates(架橋された酵素凝集体のホストとなる階層的に順序づけられたメソセル状(Mesocellular)メソ多孔質シリカ材料の単純な合成)" Small 1, 744-753, 2005)。ここでは、細孔径によって凝集体の大きさが決まる。
【0015】
米国特許出願第2009/0004278号は、ボトムアップ手法を用いて得られた酵素で架橋されたタンパク質ナノ粒子の調製を開示している。
BL Simonsらは、共有結合的に架橋されたタンパク質凍結乾燥物(lyophilisate)を形成するために使用する脱水熱方法を開示している("Covalent cross-linking of proteins without chemical reagents(化学試薬を使用しないタンパク質の共有結合的架橋)" Protein Science 11, 1558-1564, 2002)。
【0016】
RW MartinおよびKW Zilmは、急速なバッチ結晶化技術によるボトムアップ手法を用いてタンパク質ナノ結晶(すなわち架橋されていない)を調製した("Preparation of protein nanocrystals and their characterization by solid state NMR(タンパク質ナノ結晶の調製および固体NMRによるそれらの構造決定)" Journal of Magnetic Resonance 165, 162-174, 2003)。
【0017】
JC Falknerらは、グルタルアルデヒドによる化学的架橋を伴うボトムアップ手法を用いて架橋されたタンパク質ナノ結晶を調製した("Generation of size-controlled, submicrometer protein crystals(サイズ制御されたミクロン未満のタンパク質結晶の生成)" Chem. Mater. 17, 2679-2686, 2005)。
【0018】
上記から暗示されるように、先行技術の製品は本発明の製品とは異なる。特に、先行技術のナノスケールのタンパク質材料は全て、個々のタンパク質のクラスタ形成および架橋製品として定義可能である。著しく対照的に、本発明によって提供される架橋されたタンパク質ナノ粒子は、架橋されたタンパク質材料のナノ断片またはナノ断片化製品(すなわち、前駆体材料)として定義可能である。各先行技術例は、具体的な架橋されたナノ凝集体(非晶質ナノクラスタ)または架橋されていないナノ結晶を形成するためのボトムアップおよびカスタムメイド手法を実施するが、本発明は、任意の前駆体材料(繰り返すが、本明細書ではミクロン以上の大きさの架橋されたタンパク質凝集体もしくは結晶として定義されている)の大きさをナノスケールまで縮小させる一般的なサイズ縮小技術を用いるという点で、本発明に記載されている方法は上記先行技術とは対照的である。従って、根本的に異なり、かつ概念的に反対の手法によって、新規な架橋されたタンパク質製品が本発明で得られた。
【0019】
本発明の主な新規性は、大きな前駆体材料をナノサイズの架橋された粒子に変換するために用いられるサイズ縮小工程である。本発明の架橋されたタンパク質ナノ粒子の新規な前駆体材料を、文献に具体的に記載されているように、架橋されたミクロン以上の大きさのタンパク質結晶または架橋されたタンパク質凝集体を調製するために使用される任意の従来の方法によって得てもよい。あるいは、好適な前駆体材料を購入してもよい。Vertex Pharmaceuticals社のCLEC(登録商標)およびAlthus Biologicals社のCLEC(マサチューセッツ州ケンブリッジ)は、サーモリシン、エラスターゼ、エステラーゼ、リパーゼ、リゾチーム、アスパラギナーゼ、ウレアーゼ、ニトリラーゼ、ヒダントイナーゼおよびプロテアーゼの架橋されたミクロンサイズの結晶を商品化し、同様にCLEA Technologies社(オランダのデルフト)は、架橋された凝集体として不溶化されたプロテアーゼおよびリパーゼの販売を開始した。
【0020】
本発明の方法論は、先行技術とは明確に識別可能であり、著しく異なる物理化学的性質および性能特性を有する架橋されたタンパク質ナノ粒子が得られる。架橋時の非活性化の程度などの本発明の多くのナノ粒子特性は、前駆体材料に基づいて容易に予測可能であり、前記架橋されたタンパク質ナノ粒子は操作条件下で一般に長寿命であり、それらは乾燥粉末として貯蔵されるのが普通である。それらの前駆体材料は、長期の貯蔵寿命も有する。先行技術が個々のタンパク質で開始するボトムアップ手法によって製品を提供するため、先行技術の前駆体にはそのような利点は全くない。先行技術では、架橋前にマクロスケールの凝集体を得るために、タンパク質沈殿技術は使用されていない。逆に、個々の溶質タンパク質分子は溶媒環境で結合し、ナノサイズのタンパク質会合体を形成し、それは、懸濁液内に保持されるか、あるいはその微細な大きさを考慮すると、容易に分散される。従って、前駆体材料の歴史では架橋前に生じる実質的なタンパク質の沈殿は、先行技術に関して詳述している工程ならびに本発明の最終的な態様を定義している。
【0021】
適切に行われると、溶液からのタンパク質の破砕行為は、タンパク質構造、最終的な凝集体組成およびタンパク質間空間を僅かに変える効果を有することが当業者に知られている。従って、溶液中に並置されている個々のタンパク質(または最良な状態ではナノクラスタ)を架橋する行為は、既に沈殿されている大きな凝集体を架橋する力学と同等視することはできない。本発明の前駆体材料を形成するために使用される後者の例は、完全に異なる架橋動態学、架橋分布および空間依存性に従い、反応の終了時に本質的に異なる製品組成を示す。また、2つの架橋方法は、一方は均質相プロセス(すなわち、先行技術)を表し、他方は正に不均質相プロセス(すなわち、本発明)であるという理由で、概念的に異なる。タンパク質および架橋剤の組成、タンパク質−タンパク質パッキングの密度、架橋の密度および空間分布(すなわち、空間的に密度段階的な架橋不均質性としてまとめて定量化可能である)、架橋(化学、酵素または脱水熱による)の化学的性質、および1つのタンパク質当たりの1つ以上の正確な架橋部位は、本発明と先行技術とでは異なる。これは、同じ主成分タンパク質が各材料を含む場合であっても該当し、粒子の最終的な化学組成、粒子内のタンパク質間結合性およびタンパク質の相対的な空間的配向は異なる。従って、本発明によって説明されている架橋されたタンパク質ナノ粒子の特性は、先行技術で説明されているナノサイズの架橋されたタンパク質材料とは異なる。
【0022】
従って、ボトムアップおよびトップダウン戦略から生じる架橋されたナノ凝集体は、実際に2つの異なる識別可能な製品分類を定義する。本発明の架橋されたタンパク質ナノ結晶製品の場合、空間的に密度段階的な架橋不均質性、粒子形状ならびにそれらの表面トポロジーおよびエネルギー(ナノ化により生じる)、材料応力(材料特性を変える)、および場合により多形性(結晶化法の特性)は、先行技術に記載されているナノサイズの架橋されたタンパク質材料と比較して異なる。
【0023】
ミクロンサイズの架橋されたタンパク質凝集体および結晶に関しては、本発明は、(より良好な相互作用および、該当する場合、物質移動を可能にする高表面による)生物学的活性の向上および優れた生物学的利用能(ナノ粒子は、様々な経路によって体に吸収され、かつ取り込まれることが知られている)という明らかな利点を提供する。実際に、本発明の架橋されたタンパク質ナノ粒子の特性は、それらの前駆体材料とは明確に異なる。
【0024】
上記2つの段落を鑑みると、本発明は、一組の有利な特性を示す新しい架橋されたタンパク質ナノ粒子製品を提供する。このナノ粒子は、架橋されたミクロン以上の大きさのタンパク質凝集体もしくは結晶のナノ断片製品である。
【図面の簡単な説明】
【0025】
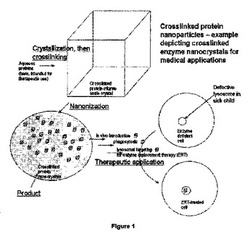
【図1】リソソーム貯蔵障害の治療/症状管理のための、架橋されたタンパク質ナノ粒子(図ではナノ結晶)の使用を示す。
【図2】ヨウ化カリウム粒子と共に前記ナノ粒子のアルカラーゼ(Alcalase)で架橋された酵素ナノ凝集体および再凝集の画像を示す(白色のヨウ化カリウムのバックグラウンドに対して黒いナノ粒子および再凝集)。後方散乱モード(5kV)で構成されたSEMを用いて前記画像を撮影した。前駆体(アルカラーゼCLEA)を、ヨウ化カリウムの存在下で機械的剪断によって乾燥状態でナノ化した。
【図3】以前は湿式ナノ化時の安定剤として機能していたヨウ化カリウム結晶と共に前記ナノ粒子のサビナーゼ(Savinase)で架橋された酵素ナノ凝集体および再凝集の画像を示す。後方散乱電子モード(4kV)で構成されたSEMを用いて撮影した前記画像は、サビナーゼのナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒いナノ粒子)ならびに再凝集ナノ粒子(DLSの結果の項を参照)を示す。前駆体(サビナーゼCLEA)は、ヨウ化カリウム水溶液に懸濁しながらホモジナイザを用いてナノ化した。
【図4】サビナーゼナノ凝集体および前記ナノ粒子の実質的な再凝集の画像を示す。二次電子モード(2kV)で構成されたSEMを用いて撮影した前記画像は、炭素のバックグラウンドに対してナノ粒子および再凝集を示している。前駆体(サビナーゼCLEA)は、水に懸濁しながらホモジナイザを用いてナノ化した。安定剤は全く添加しなかった。
【図5】ヨウ化カリウム粒子と共にサビナーゼナノ凝集体および前記ナノ粒子の僅かな再凝集の画像を示す。後方散乱電子モード(4kV)で構成されたSEMを用いて撮影した前記画像は、非常に効果的にナノ化された材料を示している。前駆体を、湿度から保護されていない乳鉢内で手によって粉砕した。機械的破砕は、粉砕助剤としてのヨウ化カリウム、担体およびナノ粒子安定剤の存在下で達成した。前駆体材料はサビナーゼCLEAであった。
【図6】二次電子モードで構成されたSEMを用いて2kVで炭素のバックグラウンドに対して撮影したサビナーゼCLEA(ナノ化されていない対照)の画像を示す。
【図7】架橋されたヘモグロビンナノ凝集体および場合によっては前記材料の再凝集ナノ粒子またはミクロンサイズの架橋されたヘモグロビン凝集体を含む一方または両方の可能性(不完全なナノ化を示す)の画像を示す。画像は、後方散乱電子モード(5kV)で構成されたSEMを用いて得られた。前駆体材料は、実施例の項に具体的に記載されているように社内で調製した。
【図8】ヨウ化カリウムを用いてGelimat G-I装置で粉砕したアルカラーゼCLEAの平均数対大きさ分布プロファイルを示す(実施例1を参照)。データは、Malvern Instruments社Nanoseries Zetasizer装置(すなわち、633nmレーザーと共に構成されたNano−ZSブランド)を用いて回収した。
【図9】ヨウ化カリウムと共に乳鉢内で手によって粉砕したサビナーゼCLEAの平均数対大きさ分布プロファイルを示す(実施例4を参照)。この場合も、データは、前記Malvern Instruments社Nanoseries Zetasizer装置を用いて回収した。
【発明を実施するための形態】
【0026】
本発明の新規性は、ミクロン以上の架橋されたタンパク質材料の物理的大きさの縮小、および前記ナノ化(すなわち、ナノスケールへの大きさの縮小)方法によって新しい架橋されたタンパク質ナノ粒子製品を調製することができるという事実に関する。
【0027】
架橋されたタンパク質結晶(ミクロンサイズ)は、溶液相タンパク質および架橋されていないタンパク質結晶と比較して、それらの実行安定性で特に有名である。ミクロン以上の大きさの架橋されたタンパク質凝集体(すなわち、架橋されたタンパク質沈殿物および凍結乾燥物)の場合には、架橋時の堅牢さの向上も示されている。前記架橋されたタンパク質製品は、有機溶媒中で100℃に近い温度でさらに生物学的に活性となる。架橋後に観察された堅牢効果の点から、架橋されたタンパク質凝集体が対応する架橋されていない材料よりもナノ化が容易であるということに注目すると特に驚きであった。より系統的に評価すると、共有結合で架橋しているタンパク質凝集体および結晶の作用がサイズ縮小プロセスを直接容易にすることが分かった。架橋された材料でより小さい粒子が形成されただけでなく、これらの粒子は、同一の力および断片化条件の適用下で、より短期間に形成された。手動の(すなわち、手による)粉砕でさえ、本発明によって説明されている前駆体材料を使用した場合に、架橋されたタンパク質ナノ粒子が容易に得られた。
【0028】
ナノ化事象は、機械的または流体力学的剪断、破砕機械力および/または音波もしくは流体力学的キャビテーションの適用、材料可塑性および化学分解を減少させるための低温の適用、化学分解を減少させるための捕捉剤分子の添加、サイズ縮小を助ける固体の添加(有利な場合)、および断片化後の再凝集を防止/制限するための安定剤分子の添加を含む。前駆体材料に物理的応力を加えることによって、肉眼サイズの架橋されたタンパク質粒子を断片化し、理想的には50〜200nmの範囲にあるミクロン未満の大きさの粒子分布を得る。ナノ化媒体中に存在する化学物質を個別に調整して、制御された粒子の断片化を容易にし、ナノ化された粒子の再会合を防止し、かつ各粒子を含む個々のタンパク質成分の生物学的完全性を保持してもよい。上記方法を用いて得られた製品は、生物学的活性、向上した生物学的利用能および優れた物質輸送特性を示す。場合により、これらの架橋されたナノサイズのタンパク質製品を、様々な物理的方法を用いて、より具体的なサイズ範囲に分類してもよい。同様に、その後の作業でそれらの表面を官能化してもよい。
【0029】
上述したように、サイズ縮小プロセスは、処理選択肢を調節することによって微調整が可能である。ナノ化媒体にさらなる化学物質(特に、粉砕可能であるが化学的に不活性な固体)を使用することによって、制御された粒子断片化を促進することができる。架橋されたタンパク質粉末の乾式粉砕などの場合、これらのさらなる固体は、架橋されたタンパク質よりも物理的に硬くなければならない。理想的には、それらは、架橋されたタンパク質のナノ化を容易にする程に十分に硬いものでなければならないが、タンパク質成分に損傷を与えるかナノ化プロセスを遅らせる程に極端に硬いものであってはならない。微量のタンパク質を粉砕する場合、不活性固体の添加は特に有用であり、そのような場合、前記固体は、余分な材料を系に添加し(担体の役割を担う)、粉砕プロセスを助け、形成されたナノ粒子を安定させるという3つの役割を担う。また、タンパク質および前記粉末状粉砕添加物を液体窒素で冷却した後、(瑪瑙乳鉢内で)手動粉砕してナノ粒子を得ることもできる。前記手順は、容易に損傷されるタンパク質に特によく適している。興味深いことに、室温での手動粉砕でも著しく短い期間でナノ粒子が得られるため、冷却は必ずしも必要ではない。架橋されたタンパク質粒子の湿式粉砕(例えば、水相もしくは有機相媒体に懸濁された粒子の機械的破砕)などの場合、再凝集を制限するために安定剤を使用しなければならない。これらの薬剤は流体力学的剪断によって引き起こされる粉砕プロセスの間およびその後に存在していなければならず、それにより、ナノ粒子として回収される画分を最適化する。十分な粉末密度がある場合、キャビテーション方法でも前記前駆体材料の湿式「粉砕」(すなわち、サイズ縮小)を容易にすることができる。キャビテーションによって溶媒分子から反応性化学種が生成される可能性があるため、ラジカル捕捉剤は前記条件下で特に推奨されている。連続的な流れ作業でミクロンサイズの架橋された粒子の断片化を達成するための技術として、流体力学的キャビテーションは特に魅力的である。
【0030】
生物学的利用能の観点から、本発明の前記製品は、コーティングされていない架橋されていないタンパク質粒子、架橋されたミクロン以上の大きさのタンパク質粒子および個々のタンパク質よりも有利である。第1に、架橋されたタンパク質ナノ粒子は腸およびGALT系に吸収させることができるが、架橋されたミクロンサイズの粒子は大き過ぎる。第2に、胃酸は架橋されたナノ粒子に著しい損傷をを与えないが、再可溶化された個々のタンパク質は小腸に辿り着くまで生存することができない。酵素補充戦略に精通しているものに知られている機構により、リソソーム貯蔵障害の代謝均衡を回復させる治療法として、前記方法によって生成された具体的な架橋された酵素ナノ結晶を図1に示す。そうは言っても、本発明の態様の可能な用途は医学に限定されない。
【0031】
本発明には多くの他の利点がある。前駆体材料の粉砕が可能であるため、粒径を微調整することができる。サイズ縮小プロセスは、ボトムアップ手法と比較してそれほど多くの変数を有していないため、十分に開発された系によって再現可能な粒径分布を有するナノ粒子を容易に得ることができる。同じ有用性は、ボトムアップ手法では容易に得ることができない。溶液でのボトムアッププロセスでは一般に、粒径を制御する際に固有の限界を経験する。多くの溶質分子のように、溶液中で偶然にナノクラスタを形成する架橋されていないタンパク質はさらに集合する傾向があり、高分子量のミクロンスケールの複合体が生じる場合もある。安定剤の使用によって、ナノサイズの新しく形成されたタンパク質会合体を維持することにある程度は成功している。逆に言えば、その場化学架橋剤は、ゆっくりと集合するタンパク質分子の直接的な溶液相集合を促進するために使用されているが、残念ながら、安定剤が存在していても、これらの薬剤は非常に高分子量の複合体の形成も促進する。上に暗示されているように、ナノスケールのタンパク質複合体がさらに会合する(または再溶解する)という固有の傾向によって、この2回目の操作の開始前に時間の経過と共に粒径が変わる可能性があるため、化学架橋剤がタンパク質ナノ粒子の形成後のみに導入される場合、架橋されたタンパク質ナノ粒子を調製することは同様に難しい。最後に、化学架橋剤と共に作用する場合、粒子間架橋は常に検討しなければならいリスクであり、多くの場合、粒子間架橋は粒子内架橋と競合(すなわち、1つの粒子内においてタンパク質間架橋およびタンパク質内架橋が存在)し、制御不能な大きさの増加が生じ、その大きさはナノスケールを超え、架橋されたミクロンスケールの粒子が生じる。
【0032】
上述のように、前駆体材料の歴史における架橋プロセスは、粉砕が容易という驚くべきかつ著しく有効な特性を用い、架橋されていないタンパク質材料に勝る利点を提供する。架橋によって柔軟性の低いタンパク質粒子が得られるように思われる。粒子の柔軟性が低いという事実によって、より小さい長さスケールでの断片化を効果的に継続することができる。強く溶媒和された結晶性タンパク質を用いる場合、架橋によって断片化時に結晶性が保持される。また、架橋によって、ナノ粒子を含むタンパク質単位の構造的な安定性が保持され、従って、断片化工程時に生理活性の保持が促進される。
【0033】
架橋されたタンパク質ナノ結晶は工業的に調製されていないが、ボトムアップ手法を用いた刊行物が先行技術に存在する。同様に、ボトムアップ集合手法のみを用いて、非常に具体的な用途のために、ナノ凝集体などの架橋されたナノサイズのタンパク質会合体が調製されている。本発明の態様は、利用可能な架橋されたナノ粒子ならびにそれらの製造技術の不足に対処する。特に、本発明の態様は、サイズ縮小原理を発展させたものであり、具体的には、物理的手段を用いた架橋されたタンパク質ナノ粒子の調製について記載しており、それは、断片化を引き起こす加力に基づいている。容易に調製される出発物質については、本発明のサイズ縮小手法は一般的であり、工業的に採用可能であり、容易に計測可能かつ好都合に制御可能である。従って、本発明によって、大量の架橋されたタンパク質ナノ粒子を、制御可能かつ好都合に調製することができる。
【0034】
溶液中で架橋されたミクロンサイズのタンパク質材料の性能を、対応する個々のタンパク質と比較した場合、前者は、より長寿命で、容易に回収可能であり、より加水分解性でプロテイナーゼ安定性であり、かつ、温度、有機溶媒および極端なpHに対してより耐容性を有することを証明している。本発明の架橋されたタンパク質ナノ粒子は、個々のタンパク質に勝る類似した利点を誇るものである。これらの粒子は、物質移動の向上、反応性の向上および生物学的利用能および有効性の向上などの確立されているミクロンサイズの粒子に勝る具体的な利点も有する。ナノサイズのこれらの粒子が性能特性に直接影響を及ぼすことを観察すると、そのようなナノ粒子が多くの個々のタンパク質ならびに多くのミクロンサイズの架橋されたタンパク質粒子の役割に取って代わることができると考えることは正しい。本明細書に示されている実施例の項の試験によって、サイズ縮小時の生理活性の観察可能な向上が分かる。
【0035】
最も重要なことに、ナノサイズのこれらの粒子は、酵素補充療法などの治療用途で非常に有用であることを証明しているかもしれない。本特許請求の理論的根拠は、他のナノ粒子に基づく文献の研究結果にあり、それは、酵素ナノ粒子が、適切に処理された場合に、それらの生物学的活性を保持し、かつ単量体酵素または可溶性酵素誘導体と比較して、複数の取り込み経路、良好な全身生物学的利用能、向上した脳への進入、急速な細胞内への取り込み、リソソームへの標的化送達、および非常に向上した生体内での安定性を経験することを強く示唆している。リソソーム貯蔵障害が細胞小器官の酵素欠損を強めるため、本発明は、恒常性を回復させることができ、確立されている薬物送達戦略の向上したより一般的な代替物としての役割を果たす。この治療法の理論的根拠を図1に示す。
【0036】
本発明の態様は、酵素療法の多くの形態に合わせて修正することができる。確立されている補充療法の場合、酵素欠損を直接に補償することができ、または基質減少/阻害療法の場合、さらなる基質の供給路をブロックすることによって酵素欠損を縮小化することができる。架橋されたナノ粒子が酸性タンパク質分解作用ならびに細胞質基質および細胞間汁液中に存在する他の加水分解プロセスに抵抗することができるため治療法をリソソーム貯蔵障害の範囲を超えて拡大させるという根拠は妥当である。小型の前記ナノ粒子は、容易な注射可能性、舌下、バッカルおよびGALT(腸管関連リンパ系組織)、粘膜プロセスを介した良好な吸収、および罹患した血管および外傷を受けた間質腔などの流れが抑制された領域への無制限のアクセスを暗示している。従って、架橋されたタンパク質ナノ粒子は、リソソーム貯蔵障害および嚢胞性線維症のような多くの奇病を治療する際に利点を示すことができると考えることができる。同様に、それは、消化疾患、酵素反応性の癌、糖尿病および低酸素状態、再灌流関連傷害および慢性創傷を助ける役割を担うかもれない。上に列挙した固有の可能な利点について熟慮すると、多くの重要な治療法がこの手法(特に、脳を標的とするタンパク質系薬物)を手本とする可能性がある。
【0037】
製品の詳細
本発明は、1種以上のタンパク質、吸着物質、および少なくとも1種のゼロ以上の長さのタンパク質間架橋を含むナノ粒子が、各次元(demension)軸の物理的長さが少なくとも1ミクロンの組成的に同等またはほぼ同等の前駆体材料のナノ断片化製品として得られる(すなわち、それがナノ断片化製品である)ことを特徴とする、生物工学、化粧品、医薬および生物医学への応用を可能にするのに適した10〜999nm、好ましくは50〜200nmの大きさの共有結合的に架橋されたタンパク質ナノ粒子を提供する。「ほぼ同等である」という用語は、サイズ縮小により生じ得る軽微な変化(例えば、溶媒交換、溶媒置換またはタンパク質間パッキングの変化)を可能にするように使用されている。「ナノ断片化」という用語は、本発明のミクロン以上の大きさの前駆体材料をナノサイズの断片に断片化または細分するという考えを伝えるために使用されている(そこで、ナノ断片化という用語を新しく作り出す)。タンパク質成分は、酵素、ホルモン、受容体、構造、輸送または抗体クラスのタンパク質の1種以上を含んでもよい。より具体的には、タンパク質成分は、加水分解酵素、プロヒドロラーゼ(prohydrolase)、異性化酵素、転移酵素、酸化還元酵素、リアーゼ、合成酵素、インスリン、グルカゴン、グルカゴン様ペプチド、エキセンジン(extendin)、エキセンジン誘導体、シムリン、ソマトカイン(somatokine)、インスリン抗体、プロインスリン抗体、インターフェロン、抗癌モノクローナル抗体、抗癌ワクチン、ナトレコール、抗血小板剤、サイトカイン、腫瘍壊死因子α、インターロイキン1受容体拮抗薬、HIV−1阻害性ペプチドT20、人工タンパク質5H−ex、ソマトスタチン、HIV融合阻害剤T−1249、抗微生物タンパク質、リゾチーム、ラクトフェリン、バクテリオシン、インターロイキン2、アンギオテンシノーゲン、アンジオテンシン、アンギオテンシン変換酵素阻害剤、ゼラチン、コラーゲン、プロコラーゲン、キトサン、絹タンパク質、ケラチン、ミオシン、アクチン、成長ホルモン、アルブミン、グロブリン、ヘモグロビン、ミオグロビンおよび/またはシトクロムで構成されていてもよい。調製方法に目を向けると、各架橋されたタンパク質ナノ粒子は、サイズ縮小時に、その前駆体材料の化学組成および架橋履歴を反映していることは明らかである。前駆体は、その後に架橋されるミクロン以上の大きさのタンパク質凝集体(タンパク質沈殿事象または凍結乾燥事象のいずれかによって生じる)またはタンパク質結晶である。前駆体の架橋の性質は、化学、酵素または脱水熱性であってもよく、全ての場合に共有結合性である。
【0038】
架橋は、カルボジイミドで処理されたか真空下で(すなわち、脱水熱的に)加熱された直接に結合したタンパク質の場合のようにゼロ長さのものから、二量体、三量体もしくは多量体リンカーを用いた20個以上の炭素単位タンパク質内架橋まで、様々であってもよい。前駆体材料中で架橋を形成するか架橋形成を促進する化学物質は、水または有機溶媒に可溶性または分散性であってもよい。化学物質は、限定されるものではないが、カルボジイミド、デキストランアルデヒド、ジイミド酸ジアルキルおよび最大20個の架橋炭素原子を有する他の二官能性もしくは三官能性架橋剤および/またはグルタルアルデヒドポリマー、澱粉アルデヒド、ポリアミン、有機シリコーンおよび少なくとも5個の官能基を有する他の多量体リンカーのうちのいずれか1つであってもよい。酵素的に形成された架橋の場合、前駆体は、任意の好適な加水分解酵素、転移酵素および/または酸化還元酵素、および場合によりグルタミン転移酵素などのアミノ基転移酵素で処理されていてもよい。脱水熱的に形成された架橋の場合、前駆体材料は、真空条件下70〜120℃で6〜48時間加熱されていてもよい。大部分がタンパク質系である架橋されたタンパク質ナノ粒子および前駆体は、それでもなお、表面に沿って吸着物質を収容することが期待されている。吸着物質の性質は、前駆体材料の調製履歴およびナノ粒子を生成する処理履歴を反映するものでなければならない。ナノ粒子および前駆体は、水、有機溶媒、塩、リオプロテクタント(lyoprotectant)、凍結保護剤および/または界面活性剤のうちの1つまたは多くを含み得る吸着物質を担持する。
【0039】
方法の詳細
本発明は、架橋されたタンパク質ナノ粒子の調製方法を開示する。本工程は、ミクロン以上の大きさのタンパク質凝集体もしくは結晶を調製すること、および凝集体もしくは結晶を架橋して前駆体材料を得ることを含む。次いで、前駆体をサイズ縮小プロセスに供し、それにより、ナノ化を達成して、架橋されたタンパク質ナノ粒子を得る。サイズ縮小プロセスでは、前駆体材料に沿って機械的剪断力を加える。例えば、120℃未満の温度で30秒〜10分の範囲の加力時間で、100〜15000rpm、好ましくは1000〜6000rpmで動作する従来の高剪断混合/配合装置を用いて必要な機械的剪断力を生成してもよい。サイズ縮小プロセスでは、流体力学的剪断応力を加えてもよく、ここでは、例えば、分散/混合装置としてのホモジナイザを用いて、水性もしくは有機媒体中で前記流体力学的剪断応力を前駆体材料に加える。均質化の場合、規定の操作条件は、100〜500rpm、好ましくは1000〜2000rpmであり、5分〜3時間、好ましくは30分〜1.5時間であり、かつ100℃未満の温度である。皮肉にも、過剰なヨウ化カリウムの存在下での乳鉢および乳棒を用いた手動粉砕(破砕機械力)であっても、架橋されたタンパク質ナノ粒子が本発明によって得られるため、器具は必ずしも必要ではない。前駆体/粉末(すなわち、粉砕助剤)の重量比は、2:1〜1:1000重量の間のいずれかの範囲とすることができる。最後に、ナノ化は、80℃未満の温度で音波もしくは流体力学的キャビテーションによって生成される圧力勾配応力を用いても達成することもできる。サイズ縮小方法のさらなる側面は、粉砕プロセスの前および間での任意の冷却の使用であり、それにより、前駆体材料を脆化させかつ好ましくない分解を減少させることができる。好都合な冷却源は液体窒素である。サイズ縮小方法のさらなる側面は、ラジカルプロセス、異方性結合分裂プロセスおよび酸化プロセスから生じるタンパク質分解を減少させるために、適当であると思われる場所で捕捉剤分子を含めるという選択肢である。そのような予防措置の組み込みは、かなりのラジカルを生成することで知られているキャビテーションプロセスの場合に有用であると証明することができる。添加する捕捉剤の有用な量は、前駆体材料に対して0.01〜2重量%である。前記捕捉剤は、必ずしも限定されるものではないが、α−トコフェロール、ナリンゲニン、レチノール、ヨウ化物、コエンザイムQ10、メラトニン、カロテン様テルペノイド、フラボノイドポリフェノール類、フェノール酸およびエステル、グルタチオン、N−アセチルシステイン、フィチン酸、シュウ酸、クエン酸、オイゲノール、キサントン、クルクミン、フラボノリグナン、R−リポ酸、尿酸、カロテン、ユビキノール、アスコルビン酸、ブチル化ヒドロキシトルエン、亜硫酸水素塩および/またはチオ硫酸塩のうちの1種以上を含むことができる。物理的サイズ縮小プロセスを容易にするために、固体の粉末添加剤も推奨されている。前駆体および固体粉末をそれぞれ、2:1〜1:1000の範囲の重量比で、サイズ縮小前に一緒にすることができる。固体粉末の選択肢は、ヨウ化カリウム、ヨウ化ナトリウム、塩化ナトリウム、他のアルカリ塩、アルカリ土類塩、活性炭、二酸化ケイ素、酸化アルミニウム、二酸化チタン、キチン、ケラチンおよび/またはポリイミドを含んでもよい。サイズ縮小プロセスのさらなる側面は、再凝集を防止/制限するために、2〜100倍の過剰重量の安定剤分子の添加である。安定剤分子の選択肢は、必ずしも限定されるものではないが、ヨウ化カリウム、ヨウ化ナトリウム、塩化ナトリウム、または任意のアルカリもしくはアルカリ土類塩、アンモニウム塩、炭水化物、ポリオール類、ポリビニルピリジン、ポリビニルピロリドン、ポリアミド類、クエン酸、アスコルビン酸、アルブミン、ヒプロメロースおよび/またはゼラチンのうちの1種以上の薬剤であってもよい。
【0040】
用途
本発明の方法によって生成される架橋されたタンパク質ナノ粒子は、生物学的活性および生物学的利用能を向上させることにより、タンパク質を基礎とする治療法の性能を向上させる。経口、バッカル、舌下、GALT、腹腔内、筋肉内、真皮下、皮下、クモ膜下腔内、実質内および静脈内などの大部分の任意の投与経路は、本発明からの利益を享受する。本発明の特定の標的は、リソソーム貯蔵障害に起因する代謝不均衡の回復である。ナノ粒子が細胞内に取り込まれるという事実および外来物質がリソソームに導かれるという事実は、前記欠陥のある細胞小器官に有効な治療法を提案するのに有用である。架橋によって急速なタンパク質分解が防止されるという事実は、前記架橋されたタンパク質ナノ粒子の経口薬物送達(児童には明らかにプラスである)を促進するのに有用である。前記ナノ粒子のタンパク質分解抵抗性は、リソソームまたは病的状態に罹患している他の領域での長い生体内活性も可能にする。
【実施例】
【0041】
実施例1:アルカラーゼCLEA(CLEA=架橋された酵素凝集体)のナノ化
アルカラーゼCLEA(1g、CLEA Technologies社)を、粉砕助剤および安定剤としてのヨウ化カリウム(69g)と穏やかに混合した。Draiswerke社(ニュージャージー州モーウォー)から得られたGシリーズGELIMAT G1混合/配合装置を用いて機械的剪断下で混合物を粉砕した。そのまま、材料を、ロッキングスライドを有する上部ホッパーから処理室に導入した。この機械は、互い違いのほぼ半径方向に延在する混合要素を備えた中心シャフトを有する水平に延在する円筒状処理室を有する。処理室には、エネルギー入力または電力消散を測定する電流計シャフトドライブと温度センサが備え付けられている。試料温度が決して63℃を超えないようにしながら、シャフトを回転させた(5000rpm、5分)。完了したら、細かく粉砕された混合物を遠心力の作用によって処理室から素早く排出した。後方散乱電子モード(5kV)で構成されたLEO Supra 35 VP装置を用いたSEM顕微鏡分析(図2)は、アルカラーゼのナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒い粒子)ならびに再凝集したナノ粒子(DLSの結果の項を参照)を示した。前記混合物は生物学的活性を保持していることが分かった。未処理の前駆体材料中にナノ粒子は観察されなかった(図示せず)。
【0042】
実施例2:サビナーゼCLEAのナノ化
サビナーゼCLEA(10mg、CLEA Technologies社)を、50mlファルコン管に入れ、安定剤として予め溶解したヨウ化カリウム(200mg)を含む蒸留水(10ml)に懸濁した。PT-DA 6050/2TM分散プローブが取り付けられた1600W PT-MR 6100 Polytronホモジナイザ(Kinematica社による分散および混合技術)を用いて、流体力学的剪断力を懸濁液に加えた(1500rpm、1.5時間、30〜35℃)。試料を抽出し、液体窒素で急速冷凍し、凍結乾燥した。後方散乱電子モード(4kV)で構成されたLEO Supra 35 VP装置を用いた試料のSEM顕微鏡分析(図3)は、サビナーゼのナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒い粒子)ならびに再凝集したナノ粒子(DLSの結果の項を参照)を示した。前記混合物は、原料容器からの未処理のサビナーゼに対して340%の生物学的活性を示した。未処理の前駆体材料中にナノ粒子は観察されなかった(図示せず)。
【0043】
実施例3:サビナーゼCLEAのナノ化
安定剤としてヨウ化カリウムを全く添加せず、炭素のバックグラウンドに対して二次電子モード(2kV)でSEM分析を行ったこと以外は、実施例2の手順を繰り返した。得られた遊離ナノ粒子はより少なかった。実際に、ほとんどの製品は、ミクロンサイズの再凝集したナノ粒子で構成されていた(図4)。興味深いことに、DLSの結果(DLSの項を参照)によって暗示されるように、これらの凝集体でさえ弱く会合しているようであった。さらに、未処理のミクロンサイズの前駆体に対して590%の印象的な生物学的活性が認められ(SEMは示さず)、前記ナノ粒子の生存および有利な特徴が証明された。
【0044】
実施例4:サビナーゼCLEAのナノ化
サビナーゼCLEA(20mg、CLEA Technologies社)を、湿度から保護されていない瑪瑙乳鉢内で手によって粉砕した(20分、室温)。ヨウ化カリウム(400mg)を粉砕助剤および安定剤として使用した。不均質な領域がもはや目視で認められない状態になったら、破砕機械的動作を中断した。後方散乱電子(4kV)を用いたSEM顕微鏡分析(図5)は、サビナーゼのナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒い粒子)を示した。再凝集したナノ粒子(さらなる考察のためにDLSの結果の項を参照)は、ほとんど認められず、手動粉砕方法の可能な有用性が証明された。未処理のCLEA原液に対して265%の生物学的活性が定量化された(図6に図示、炭素のバックグラウンドに対して2kVの二次電子モードを使用)。
【0045】
実施例5:架橋されたヘモグロビン凝集体のナノ化
全ての架橋および後処理工程を4℃で達成した。ウシヘモグロビン(Sigma社)をグルタルアルデヒドで架橋した。この溶液(5ml、100mgHb/ml)を、硫酸アンモニウム溶液(45ml、3M)に投入し、放置して(1時間)、不溶性の凝集体を得た。新しいグルタルアルデヒド溶液(1ml、25%)を反応器に添加し、ボルテックス撹拌を行い(3秒間)、混合物を穏やかに振盪しながらインキュベートした(20時間)。その後、トリス(ヒドロキシメチル)アミノメタン(TRIS)緩衝液(2ml、2M、pH8)を添加し、反応系を機械的振盪機で穏やかにインキュベートした(2時間)。タンパク質試料を遠心分離(10分、7000rpm)によって回収し、0.1MのTRIS緩衝液(pH8)で3回、水で1回洗浄した(洗浄は15〜20分の撹拌を表す;各洗浄の完了後、試料を7000rpmで10分間沈殿させた)。架橋されたヘモグロビン凝集体生成物を真空条件(室温)下で乾燥した。タンパク質(0.5g)を、ヨウ化カリウム(69g)と共に篩にかけた。混合物を、実施例1に記載されているようにGelimat配合器を用いて機械的剪断下で粉砕した。SEM分析(図7、後方散乱電子モード、5kV)は、ナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒い粒子)およびミクロンサイズの粒子またはナノサイズの凝集体のいずれかの存在を示した。対照および機械的に処理された架橋されたヘモグロビン試料は、生物学的に活性であり、後者の方が僅かに高かった。
【0046】
プロテアーゼのバイオアッセイ
基質としてゼラチン(1wt%のリン酸緩衝食塩水(PBS)緩衝液)を用いて、大きさを縮小したサビナーゼおよびアルカラーゼCLEAをアッセイした(2時間、37℃、550rpm)。アッセイ前に脱塩を試みなかった。アッセイするタンパク質を水で再構成し、1mg/mlの最終濃度を得た。等体積のタンパク質懸濁液およびゼラチン−PBS溶液を一緒にして、アッセイを開始した。処理していないCLEAを同様にアッセイした。ゼロタンパク質対照は、水(実施例3)または適切に調製されたヨウ化カリウム溶液(残りの実施例)で構成されていた。後に、アッセイ媒体をエッペンドルフ微量遠心機で遠心分離して(12000rpm)、あらゆる不溶性物質を除去し、上澄みの上にi−プロピオン酸ニンヒドリン溶液(lwt%)を送って2:1の水性/有機体積比(45分、70℃)を得て、分析した。発色現象後、反応系を冷却し、570nmでの分光測光法で定量化した。ベールの法則を超えた(すなわち、>1.5)場合、イソプロピルアルコールを用いて測定前に希釈を行った。全ての比較は相対的であり、未処理のCLEA原液に対して行った。サブチリシンをアッセイするために使用される任意の確立されている方法に従って、基質のN−アセチルグリシンエチルエステルに基づいて、pH7.5および40℃で他のバイオアッセイを行うことができる。
【0047】
架橋されたヘモグロビン凝集体のバイオアッセイ
発色現象試薬としてo−フェニレンジアミンを用いて、K Zhangら("Stopped-flow spectrophotometric determination of H2O2 with Hb as catalyst(触媒としてHbを用いたH2O2のストップフロー分光光度定量)" Talanta 51, 179-186, 2000)に基づいて修正したアッセイ法を行った。指定の緩衝液系の代わりにリン酸ナトリウム(10mM、pH8)使用した。インキュベーション(1時間、450rpm、室温)後、遠心分離によってあらゆる粒子材料を反応溶液から分離した。この刊行物に定められているように、色の分光光度検出を正確に行った。
【0048】
動的光散乱(DLS)を用いた、大きさを縮小した前駆体材料(すなわち、実施例1〜5から回収したもの)の粒径分析
ナノ粒子試料(実施例2〜3の場合、貯蔵のために先に急速冷凍および凍結乾燥した)を蒸留水で再構成した。得られた懸濁液を、必要に応じて、より多くの塩を添加して安定させた。次いで、試料の調製を最適化して、分析物を300μlのキュベットに移し、Malvern Instruments社製Nanoseries Zetasizer装置(すなわち、633nmレーザーと共に構成されたNano−ZSブランド)に入れた。極端な遅れによって一般に凝集(典型的には、1〜3ミクロンの粒子が生じる)や、さらには遠心沈降(長時間後の信号損失によって証明されるように、CLEAの場合、粒子の溶解(信号損失の第2の原因)という選択肢はない)が生じるため、調製後すぐに各試料を測定した。実施例1〜5から回収された試料について三つ組分析を行い、(妥当な粒径分布を有する)一般に500nm以下の粒径を得た。そのような2つの分析、すなわち、Gelimat G-1装置でヨウ化カリウムと共に粉砕されたアルカラーゼCLEA(すなわち、実施例1)、およびヨウ化カリウムと共に乳鉢でに手によって粉砕されたサビナーゼCLEA(すなわち、実施例4)のそれぞれの平均数対粒径分布スペクトルプロファイルが明確に示されている(図8および図9)。分析目的のために、0.3A(1mgCLEA/ml)および0.024A(0.025mgCLEA/ml)の粒子吸光度測定値をそれぞれ、分析プログラムに入力した。実施例1〜4の中で、SEM画像の多くの局所領域は、ミクロンサイズの粒子を描写しているようであったが、DLSの結果によって証明されているように、これらのより大きな粒子は、実際には架橋されたナノ粒子の再凝集したクラスタであった。従って、それらが、生物学的に活性なナノサイズの材料が得られる本質的に定量的なナノ断片化プロセスを示していたため、DLSの結果は本発明にとって非常に重要だった。実施例1〜3のDLSプロファイルは単峰性であり、実施例4のDLSプロファイルは二峰性であった。実施例5のDLSプロファイルも二峰性であったが、この例では、ナノ粒子およびミクロンサイズもしくは再凝集したナノ粒子のいずれか一方の両方が観察された。全体として、各SEM顕微鏡写真のナノ粒子の粒径分布は、対応するDLSの測定値と一致していた(光散乱プロフィルの方が約40〜50%大きな直径を有する粒子を一般に示した)。
【0049】
本文献の全体にわたって例示的な態様が示されている。本発明が他の具体的な形態で具現化できることが当業者によって理解されるであろう。当業者であれば、過度の実験をせずにそのような他の態様を実施することができるであろう。本発明の範囲は、本特許文献の目的において、具体的かつ例示的な態様または上記説明の代替物のみに限定されない。
【技術分野】
【0001】
本発明は、架橋されたタンパク質ナノ粒子および架橋されたタンパク質ナノ粒子を生成するためのナノ化方法に関する。
【背景技術】
【0002】
タンパク質を基礎とする応用(必ずしも限定されるものではないが、主に、酵素、抗体、受容体、ホルモンおよび構造タンパク質の使用)は、生物工学、生物医学、薬学、生体材料および化粧品産業において十分に確立されている。短い半減期、不十分な安定性、不十分な回収可能性、狭い使用範囲、高い費用、加水分解不安定性および不十分な生物学的利用能などの個々のタンパク質の応用に関するいくつかの一般的な問題の少なくとも一部は、架橋されたタンパク質結晶および凝集体を用いて対処されている。ミクロン以上の大きさの粒子を含む前記結晶および凝集体は、構造的および化学的に堅牢な長寿命の材料を提供し、個々のタンパク質に共通する多くの限界を回避し、それにより、いくつかの主な問題を改善している。それでもなお、それらのミクロン以上の大きさによって、物質輸送の限界、触媒中心へのアクセスの低下、架橋および不十分な生体吸収性に起因する限られた触媒効率などの個々のタンパク質に無関係な各種問題が生じている。場合によっては、前記調製物の再利用にも関わらず、高い費用も大きな原因となっている。
【0003】
また、ナノ技術の実施によってタンパク質製品の生理活性、安定性、貯蔵寿命、使用範囲および生物学的利用能を最適化する努力も続けられている。本明細書ではまとめてタンパク質ナノ粒子(すなわち、全方向(dimension)の断面長さが1ミクロン未満であるタンパク質材料)と呼ぶが、現在までのところ報告されている数例は、タンパク質ナノ凝集体(すなわち、二量体およびさらにより高次の会合体からなる非結晶タンパク質ナノクラスタ)およびタンパク質ナノ結晶(すなわち、結晶性タンパク質ナノ粒子)で構成されている。新規なナノサイズのタンパク質凝集体および結晶(特に架橋型)の調製および利用は、研究の一領域を占めるが、成功は限られている。
【0004】
タンパク質系製品の入手経路や範囲が限られていることや製造上の制約を鑑みると、新規な架橋されたタンパク質ナノ粒子などの材料を実現することが求められている。同様に、一般に産業および医学の現在の問題の多くに対処するために、その架橋されたタンパク質ナノ粒子をより十分に利用することができるように、好都合な調製方法を確立することも求められている。残念ながら、一般的かつ容易な解決法がないため、新しい架橋されたタンパク質ナノ粒子の開発および調製は、技術的問題によって遅れている。特にナノスケール材料に存在する物理化学的性状(例えば、本質的に高い界面エネルギーおよび反応性)は、これらの問題の根底にある1つの要因である。確立されているタンパク質系製品の中で、天然状態の個々のタンパク質を一緒にして、より大きな会合体を形成するボトムアップ戦略のみが、架橋されたタンパク質ナノ粒子を調製するために利用されている。対照的に、より大きな架橋されたタンパク質材料に対する物理的大きさの縮小方法(すなわち、トップダウン手法)を用いて、架橋されたタンパク質ナノ粒子を調製する手法は全く報告されていない。実際、ナノ化(すなわち、より大きな材料の大きさをナノスケールに縮小すること)またはナノ断片化(すなわち、ナノサイズの断片すなわち「ナノ断片」を得るためのより大きな材料の断片化)は、架橋されたタンパク質に対してまだ試験されていない。タンパク質が「人為的な」プロセス条件によって容易に損なわれるという一般に言われている考えは、サイズ縮小の利点に関する早期の評価を阻んだ1つの要因である。さらに、軟材料(タンパク質系材料を暗示している)を断片化する行為は、粒径が減少するにつれてますます難しくなることが知られている。この一般的な認識は、恐らく2つ目の阻止要因として機能している。
【0005】
本発明では、架橋されたタンパク質ナノ粒子を調製するという課題を、物理的大きさの縮小方法を架橋されたミクロン以上の大きさのタンパク質材料(以下、前駆体材料と呼ぶ)に適用することによって解決する。そのような手法によって、制御可能な大きさの堅牢なタンパク質系ナノ粒子材料が得られる。同様に、それによって、個々のタンパク質溶液から架橋されたタンパク質会合体を直接調製することに関する確立されている説得力のある技術的問題が回避される。これによって得られた架橋されたタンパク質(前記前駆体材料のナノ断片またはナノ断片化製品)は、全く新しい種類の架橋されたナノスケールのタンパク質製品を形成し、それを、本明細書では架橋されたタンパク質ナノ粒子(すなわち、各方向が1ミクロン未満の断面長さである架橋されたタンパク質ナノ結晶および架橋されたタンパク質ナノ凝集体)と呼ぶ。
【0006】
報告している製品に匹敵するものとして何気なく(すなわち、例えばタンパク質ナノ粒子という類似した用語が理由で)誤解されていると思われる先行技術例は、実際には別の種類の架橋されたタンパク質製品について述べている。これらの製品は個々の天然のタンパク質(すなわち、架橋されていない前駆体)から調製され、これは、本発明と比較されている場合、明らかに異なる前駆体源を示している。また、本発明の製品は、比較的非常に大きな構造の架橋されたナノ断片である。本発明の架橋されたナノ粒子は、医療従事者に知られている任意の数の従来の手段によって細胞内に容易に取り込まれるという点で、高い生物学的利用能を示し、個々のタンパク質と比較して体内により長く生存する。さらに、これらのナノ粒子は、著しい加水分解安定性を有するために摂取可能であり、従って、それらは、腸管関連リンパ系組織(gut-associated lymphoid tissue、以下GALTと記す)系などの体内への吸収のための新しい道を提供する。前記ナノ粒子は、それらの好ましい表面および拡散/物質輸送特性を考慮すると、高い生理活性、およびこの分野の経験者に知られている架橋効果による操作安定性の向上を示す。
【0007】
架橋されたタンパク質ナノ粒子の前駆体材料は、商業的に得られたものであってもよい。あるいは、前記架橋されたタンパク質ナノ粒子前駆体の調製方法は、当該技術分野に精通している誰にでも利用可能である。前記前駆体材料は、2つの工程で調製される。最初に、標的タンパク質に対して、好適な溶媒/反溶媒沈殿または凍結乾燥方法を行って、ミクロン以上の大きさのタンパク質凝集体を形成するか、あるいは結晶化方法を行って、ミクロン以上の大きさのタンパク質結晶を形成し、次いで、任意の従来の化学架橋方法(すなわち、化学試薬促進、化学反応性リンカー促進および/または酵素促進架橋)または脱水熱架橋方法(すなわち、熱促進縮合)を行って、共有結合的に架橋されたタンパク質材料(すなわち、本発明の前駆体材料)を形成する。架橋されたナノ粒子製品を調製するために、前記前駆体の大きさを物理的に縮小して、対応する架橋されたタンパク質ナノ凝集体またはナノ結晶を直接生成し、確立されているボトムアップ手法に典型的に付随する任意の問題を回避する。
【発明の概要】
【0008】
従って、本発明は、1種以上のタンパク質および少なくとも1種のゼロ以上の長さのタンパク質間架橋を含むナノ粒子が、各方向の最小長さが1ミクロンである組成的に同等またはほぼ同等な前駆体材料のナノ断片化製品として得られることを特徴とする、生物工学、化粧品、医薬および生物医学への応用を可能にするのに適した10〜999nm、好ましくは50〜200nmの大きさの共有結合的に架橋されたタンパク質ナノ粒子を提供する。
【0009】
本発明の別の態様は、購入されるか社内で容易に調製される前駆体材料(すなわち、架橋されたミクロン以上の大きさのタンパク質凝集体もしくは結晶)をナノ化する(すなわち、物理的大きさをナノスケールまで縮小させる)ことによって、架橋されたタンパク質ナノ粒子の驚くほど単純な調製方法に関する。
【0010】
本発明の別の態様は、経皮、経口(および最終的にGALT)、経粘膜(例えば、バッカル、舌下)、吸入および注射(例えば、腹腔内、筋肉内、皮下、クモ膜下腔内、実質内および注入)などの任意の局所もしくは全身投与経路によって実行を向上させるための、定義されている方法によって生成された架橋されたタンパク質ナノ粒子の使用に関する。
【0011】
本発明の別の態様は、公知のリソソーム貯蔵障害のいずれか1つに起因する代謝不均衡を回復させるための、定義されている方法によって生成された架橋されたタンパク質ナノ粒子の使用に関する。
【0012】
以下に示すように、架橋されたタンパク質会合体は、個々のタンパク質単位を物理的に組み立て、同時またはその後に、化学、酵素または脱水熱架橋方法を実施することによって以前から得られている。架橋の作用は徹底的に調査されており、その役割は変動的である。例えば、多くの場合、ナノ凝集体を形成するタンパク質の会合は、自然発生的もしくは予測可能なプロセスではなかった。従って、共有結合的架橋方法を使用して、タンパク質ナノ凝集体の組み立てを物理的に引き起こし、微調整している。
【0013】
米国特許第4001401号は、ナノサイズの可溶性粒子としての「ポリヘモグロビン」を得る溶液相ヘモグロビンの漸進的化学的架橋を開示している(クラスタ当たり13個以下のタンパク質会合体が形成されたため、このポリヘモグロビンという用語は誤称とみなされるかもしれない)。類似した例ならびに多タンパク質ヘモグロビン会合体が発見される可能性があり、それは、可能な代用血液として現在研究されている(F D'Agnillo and TMS Chang (1998) "Polyhemoglobin-superoxide dismutase-catalase as a blood substitute with antioxidant properties(抗酸化剤特性を有する代用血液としてのポリヘモグロビン−スーパーオキシドジスムターゼ−カタラーゼ)" Nature Biotechnology 16, 667-671;およびRobert Winslow (2006) Blood Substitutes(代用血液), Chp. 38, Elsevier, London, GB)。
【0014】
米国特許出願第2008/0296231A1号は、タンパク質会合の完了後のミクロンの大きさのタンパク質粒子を不溶化するための化学的架橋の使用を開示している。
J Leeらは、無機支持体の孔内での化学的に架橋された酵素凝集体の形成を開示している("Simple Synthesis of Hierarchically Ordered Mesocellular Mesoporous Silica Materials Hosting Crosslinked Enzyme Aggregates(架橋された酵素凝集体のホストとなる階層的に順序づけられたメソセル状(Mesocellular)メソ多孔質シリカ材料の単純な合成)" Small 1, 744-753, 2005)。ここでは、細孔径によって凝集体の大きさが決まる。
【0015】
米国特許出願第2009/0004278号は、ボトムアップ手法を用いて得られた酵素で架橋されたタンパク質ナノ粒子の調製を開示している。
BL Simonsらは、共有結合的に架橋されたタンパク質凍結乾燥物(lyophilisate)を形成するために使用する脱水熱方法を開示している("Covalent cross-linking of proteins without chemical reagents(化学試薬を使用しないタンパク質の共有結合的架橋)" Protein Science 11, 1558-1564, 2002)。
【0016】
RW MartinおよびKW Zilmは、急速なバッチ結晶化技術によるボトムアップ手法を用いてタンパク質ナノ結晶(すなわち架橋されていない)を調製した("Preparation of protein nanocrystals and their characterization by solid state NMR(タンパク質ナノ結晶の調製および固体NMRによるそれらの構造決定)" Journal of Magnetic Resonance 165, 162-174, 2003)。
【0017】
JC Falknerらは、グルタルアルデヒドによる化学的架橋を伴うボトムアップ手法を用いて架橋されたタンパク質ナノ結晶を調製した("Generation of size-controlled, submicrometer protein crystals(サイズ制御されたミクロン未満のタンパク質結晶の生成)" Chem. Mater. 17, 2679-2686, 2005)。
【0018】
上記から暗示されるように、先行技術の製品は本発明の製品とは異なる。特に、先行技術のナノスケールのタンパク質材料は全て、個々のタンパク質のクラスタ形成および架橋製品として定義可能である。著しく対照的に、本発明によって提供される架橋されたタンパク質ナノ粒子は、架橋されたタンパク質材料のナノ断片またはナノ断片化製品(すなわち、前駆体材料)として定義可能である。各先行技術例は、具体的な架橋されたナノ凝集体(非晶質ナノクラスタ)または架橋されていないナノ結晶を形成するためのボトムアップおよびカスタムメイド手法を実施するが、本発明は、任意の前駆体材料(繰り返すが、本明細書ではミクロン以上の大きさの架橋されたタンパク質凝集体もしくは結晶として定義されている)の大きさをナノスケールまで縮小させる一般的なサイズ縮小技術を用いるという点で、本発明に記載されている方法は上記先行技術とは対照的である。従って、根本的に異なり、かつ概念的に反対の手法によって、新規な架橋されたタンパク質製品が本発明で得られた。
【0019】
本発明の主な新規性は、大きな前駆体材料をナノサイズの架橋された粒子に変換するために用いられるサイズ縮小工程である。本発明の架橋されたタンパク質ナノ粒子の新規な前駆体材料を、文献に具体的に記載されているように、架橋されたミクロン以上の大きさのタンパク質結晶または架橋されたタンパク質凝集体を調製するために使用される任意の従来の方法によって得てもよい。あるいは、好適な前駆体材料を購入してもよい。Vertex Pharmaceuticals社のCLEC(登録商標)およびAlthus Biologicals社のCLEC(マサチューセッツ州ケンブリッジ)は、サーモリシン、エラスターゼ、エステラーゼ、リパーゼ、リゾチーム、アスパラギナーゼ、ウレアーゼ、ニトリラーゼ、ヒダントイナーゼおよびプロテアーゼの架橋されたミクロンサイズの結晶を商品化し、同様にCLEA Technologies社(オランダのデルフト)は、架橋された凝集体として不溶化されたプロテアーゼおよびリパーゼの販売を開始した。
【0020】
本発明の方法論は、先行技術とは明確に識別可能であり、著しく異なる物理化学的性質および性能特性を有する架橋されたタンパク質ナノ粒子が得られる。架橋時の非活性化の程度などの本発明の多くのナノ粒子特性は、前駆体材料に基づいて容易に予測可能であり、前記架橋されたタンパク質ナノ粒子は操作条件下で一般に長寿命であり、それらは乾燥粉末として貯蔵されるのが普通である。それらの前駆体材料は、長期の貯蔵寿命も有する。先行技術が個々のタンパク質で開始するボトムアップ手法によって製品を提供するため、先行技術の前駆体にはそのような利点は全くない。先行技術では、架橋前にマクロスケールの凝集体を得るために、タンパク質沈殿技術は使用されていない。逆に、個々の溶質タンパク質分子は溶媒環境で結合し、ナノサイズのタンパク質会合体を形成し、それは、懸濁液内に保持されるか、あるいはその微細な大きさを考慮すると、容易に分散される。従って、前駆体材料の歴史では架橋前に生じる実質的なタンパク質の沈殿は、先行技術に関して詳述している工程ならびに本発明の最終的な態様を定義している。
【0021】
適切に行われると、溶液からのタンパク質の破砕行為は、タンパク質構造、最終的な凝集体組成およびタンパク質間空間を僅かに変える効果を有することが当業者に知られている。従って、溶液中に並置されている個々のタンパク質(または最良な状態ではナノクラスタ)を架橋する行為は、既に沈殿されている大きな凝集体を架橋する力学と同等視することはできない。本発明の前駆体材料を形成するために使用される後者の例は、完全に異なる架橋動態学、架橋分布および空間依存性に従い、反応の終了時に本質的に異なる製品組成を示す。また、2つの架橋方法は、一方は均質相プロセス(すなわち、先行技術)を表し、他方は正に不均質相プロセス(すなわち、本発明)であるという理由で、概念的に異なる。タンパク質および架橋剤の組成、タンパク質−タンパク質パッキングの密度、架橋の密度および空間分布(すなわち、空間的に密度段階的な架橋不均質性としてまとめて定量化可能である)、架橋(化学、酵素または脱水熱による)の化学的性質、および1つのタンパク質当たりの1つ以上の正確な架橋部位は、本発明と先行技術とでは異なる。これは、同じ主成分タンパク質が各材料を含む場合であっても該当し、粒子の最終的な化学組成、粒子内のタンパク質間結合性およびタンパク質の相対的な空間的配向は異なる。従って、本発明によって説明されている架橋されたタンパク質ナノ粒子の特性は、先行技術で説明されているナノサイズの架橋されたタンパク質材料とは異なる。
【0022】
従って、ボトムアップおよびトップダウン戦略から生じる架橋されたナノ凝集体は、実際に2つの異なる識別可能な製品分類を定義する。本発明の架橋されたタンパク質ナノ結晶製品の場合、空間的に密度段階的な架橋不均質性、粒子形状ならびにそれらの表面トポロジーおよびエネルギー(ナノ化により生じる)、材料応力(材料特性を変える)、および場合により多形性(結晶化法の特性)は、先行技術に記載されているナノサイズの架橋されたタンパク質材料と比較して異なる。
【0023】
ミクロンサイズの架橋されたタンパク質凝集体および結晶に関しては、本発明は、(より良好な相互作用および、該当する場合、物質移動を可能にする高表面による)生物学的活性の向上および優れた生物学的利用能(ナノ粒子は、様々な経路によって体に吸収され、かつ取り込まれることが知られている)という明らかな利点を提供する。実際に、本発明の架橋されたタンパク質ナノ粒子の特性は、それらの前駆体材料とは明確に異なる。
【0024】
上記2つの段落を鑑みると、本発明は、一組の有利な特性を示す新しい架橋されたタンパク質ナノ粒子製品を提供する。このナノ粒子は、架橋されたミクロン以上の大きさのタンパク質凝集体もしくは結晶のナノ断片製品である。
【図面の簡単な説明】
【0025】
【図1】リソソーム貯蔵障害の治療/症状管理のための、架橋されたタンパク質ナノ粒子(図ではナノ結晶)の使用を示す。
【図2】ヨウ化カリウム粒子と共に前記ナノ粒子のアルカラーゼ(Alcalase)で架橋された酵素ナノ凝集体および再凝集の画像を示す(白色のヨウ化カリウムのバックグラウンドに対して黒いナノ粒子および再凝集)。後方散乱モード(5kV)で構成されたSEMを用いて前記画像を撮影した。前駆体(アルカラーゼCLEA)を、ヨウ化カリウムの存在下で機械的剪断によって乾燥状態でナノ化した。
【図3】以前は湿式ナノ化時の安定剤として機能していたヨウ化カリウム結晶と共に前記ナノ粒子のサビナーゼ(Savinase)で架橋された酵素ナノ凝集体および再凝集の画像を示す。後方散乱電子モード(4kV)で構成されたSEMを用いて撮影した前記画像は、サビナーゼのナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒いナノ粒子)ならびに再凝集ナノ粒子(DLSの結果の項を参照)を示す。前駆体(サビナーゼCLEA)は、ヨウ化カリウム水溶液に懸濁しながらホモジナイザを用いてナノ化した。
【図4】サビナーゼナノ凝集体および前記ナノ粒子の実質的な再凝集の画像を示す。二次電子モード(2kV)で構成されたSEMを用いて撮影した前記画像は、炭素のバックグラウンドに対してナノ粒子および再凝集を示している。前駆体(サビナーゼCLEA)は、水に懸濁しながらホモジナイザを用いてナノ化した。安定剤は全く添加しなかった。
【図5】ヨウ化カリウム粒子と共にサビナーゼナノ凝集体および前記ナノ粒子の僅かな再凝集の画像を示す。後方散乱電子モード(4kV)で構成されたSEMを用いて撮影した前記画像は、非常に効果的にナノ化された材料を示している。前駆体を、湿度から保護されていない乳鉢内で手によって粉砕した。機械的破砕は、粉砕助剤としてのヨウ化カリウム、担体およびナノ粒子安定剤の存在下で達成した。前駆体材料はサビナーゼCLEAであった。
【図6】二次電子モードで構成されたSEMを用いて2kVで炭素のバックグラウンドに対して撮影したサビナーゼCLEA(ナノ化されていない対照)の画像を示す。
【図7】架橋されたヘモグロビンナノ凝集体および場合によっては前記材料の再凝集ナノ粒子またはミクロンサイズの架橋されたヘモグロビン凝集体を含む一方または両方の可能性(不完全なナノ化を示す)の画像を示す。画像は、後方散乱電子モード(5kV)で構成されたSEMを用いて得られた。前駆体材料は、実施例の項に具体的に記載されているように社内で調製した。
【図8】ヨウ化カリウムを用いてGelimat G-I装置で粉砕したアルカラーゼCLEAの平均数対大きさ分布プロファイルを示す(実施例1を参照)。データは、Malvern Instruments社Nanoseries Zetasizer装置(すなわち、633nmレーザーと共に構成されたNano−ZSブランド)を用いて回収した。
【図9】ヨウ化カリウムと共に乳鉢内で手によって粉砕したサビナーゼCLEAの平均数対大きさ分布プロファイルを示す(実施例4を参照)。この場合も、データは、前記Malvern Instruments社Nanoseries Zetasizer装置を用いて回収した。
【発明を実施するための形態】
【0026】
本発明の新規性は、ミクロン以上の架橋されたタンパク質材料の物理的大きさの縮小、および前記ナノ化(すなわち、ナノスケールへの大きさの縮小)方法によって新しい架橋されたタンパク質ナノ粒子製品を調製することができるという事実に関する。
【0027】
架橋されたタンパク質結晶(ミクロンサイズ)は、溶液相タンパク質および架橋されていないタンパク質結晶と比較して、それらの実行安定性で特に有名である。ミクロン以上の大きさの架橋されたタンパク質凝集体(すなわち、架橋されたタンパク質沈殿物および凍結乾燥物)の場合には、架橋時の堅牢さの向上も示されている。前記架橋されたタンパク質製品は、有機溶媒中で100℃に近い温度でさらに生物学的に活性となる。架橋後に観察された堅牢効果の点から、架橋されたタンパク質凝集体が対応する架橋されていない材料よりもナノ化が容易であるということに注目すると特に驚きであった。より系統的に評価すると、共有結合で架橋しているタンパク質凝集体および結晶の作用がサイズ縮小プロセスを直接容易にすることが分かった。架橋された材料でより小さい粒子が形成されただけでなく、これらの粒子は、同一の力および断片化条件の適用下で、より短期間に形成された。手動の(すなわち、手による)粉砕でさえ、本発明によって説明されている前駆体材料を使用した場合に、架橋されたタンパク質ナノ粒子が容易に得られた。
【0028】
ナノ化事象は、機械的または流体力学的剪断、破砕機械力および/または音波もしくは流体力学的キャビテーションの適用、材料可塑性および化学分解を減少させるための低温の適用、化学分解を減少させるための捕捉剤分子の添加、サイズ縮小を助ける固体の添加(有利な場合)、および断片化後の再凝集を防止/制限するための安定剤分子の添加を含む。前駆体材料に物理的応力を加えることによって、肉眼サイズの架橋されたタンパク質粒子を断片化し、理想的には50〜200nmの範囲にあるミクロン未満の大きさの粒子分布を得る。ナノ化媒体中に存在する化学物質を個別に調整して、制御された粒子の断片化を容易にし、ナノ化された粒子の再会合を防止し、かつ各粒子を含む個々のタンパク質成分の生物学的完全性を保持してもよい。上記方法を用いて得られた製品は、生物学的活性、向上した生物学的利用能および優れた物質輸送特性を示す。場合により、これらの架橋されたナノサイズのタンパク質製品を、様々な物理的方法を用いて、より具体的なサイズ範囲に分類してもよい。同様に、その後の作業でそれらの表面を官能化してもよい。
【0029】
上述したように、サイズ縮小プロセスは、処理選択肢を調節することによって微調整が可能である。ナノ化媒体にさらなる化学物質(特に、粉砕可能であるが化学的に不活性な固体)を使用することによって、制御された粒子断片化を促進することができる。架橋されたタンパク質粉末の乾式粉砕などの場合、これらのさらなる固体は、架橋されたタンパク質よりも物理的に硬くなければならない。理想的には、それらは、架橋されたタンパク質のナノ化を容易にする程に十分に硬いものでなければならないが、タンパク質成分に損傷を与えるかナノ化プロセスを遅らせる程に極端に硬いものであってはならない。微量のタンパク質を粉砕する場合、不活性固体の添加は特に有用であり、そのような場合、前記固体は、余分な材料を系に添加し(担体の役割を担う)、粉砕プロセスを助け、形成されたナノ粒子を安定させるという3つの役割を担う。また、タンパク質および前記粉末状粉砕添加物を液体窒素で冷却した後、(瑪瑙乳鉢内で)手動粉砕してナノ粒子を得ることもできる。前記手順は、容易に損傷されるタンパク質に特によく適している。興味深いことに、室温での手動粉砕でも著しく短い期間でナノ粒子が得られるため、冷却は必ずしも必要ではない。架橋されたタンパク質粒子の湿式粉砕(例えば、水相もしくは有機相媒体に懸濁された粒子の機械的破砕)などの場合、再凝集を制限するために安定剤を使用しなければならない。これらの薬剤は流体力学的剪断によって引き起こされる粉砕プロセスの間およびその後に存在していなければならず、それにより、ナノ粒子として回収される画分を最適化する。十分な粉末密度がある場合、キャビテーション方法でも前記前駆体材料の湿式「粉砕」(すなわち、サイズ縮小)を容易にすることができる。キャビテーションによって溶媒分子から反応性化学種が生成される可能性があるため、ラジカル捕捉剤は前記条件下で特に推奨されている。連続的な流れ作業でミクロンサイズの架橋された粒子の断片化を達成するための技術として、流体力学的キャビテーションは特に魅力的である。
【0030】
生物学的利用能の観点から、本発明の前記製品は、コーティングされていない架橋されていないタンパク質粒子、架橋されたミクロン以上の大きさのタンパク質粒子および個々のタンパク質よりも有利である。第1に、架橋されたタンパク質ナノ粒子は腸およびGALT系に吸収させることができるが、架橋されたミクロンサイズの粒子は大き過ぎる。第2に、胃酸は架橋されたナノ粒子に著しい損傷をを与えないが、再可溶化された個々のタンパク質は小腸に辿り着くまで生存することができない。酵素補充戦略に精通しているものに知られている機構により、リソソーム貯蔵障害の代謝均衡を回復させる治療法として、前記方法によって生成された具体的な架橋された酵素ナノ結晶を図1に示す。そうは言っても、本発明の態様の可能な用途は医学に限定されない。
【0031】
本発明には多くの他の利点がある。前駆体材料の粉砕が可能であるため、粒径を微調整することができる。サイズ縮小プロセスは、ボトムアップ手法と比較してそれほど多くの変数を有していないため、十分に開発された系によって再現可能な粒径分布を有するナノ粒子を容易に得ることができる。同じ有用性は、ボトムアップ手法では容易に得ることができない。溶液でのボトムアッププロセスでは一般に、粒径を制御する際に固有の限界を経験する。多くの溶質分子のように、溶液中で偶然にナノクラスタを形成する架橋されていないタンパク質はさらに集合する傾向があり、高分子量のミクロンスケールの複合体が生じる場合もある。安定剤の使用によって、ナノサイズの新しく形成されたタンパク質会合体を維持することにある程度は成功している。逆に言えば、その場化学架橋剤は、ゆっくりと集合するタンパク質分子の直接的な溶液相集合を促進するために使用されているが、残念ながら、安定剤が存在していても、これらの薬剤は非常に高分子量の複合体の形成も促進する。上に暗示されているように、ナノスケールのタンパク質複合体がさらに会合する(または再溶解する)という固有の傾向によって、この2回目の操作の開始前に時間の経過と共に粒径が変わる可能性があるため、化学架橋剤がタンパク質ナノ粒子の形成後のみに導入される場合、架橋されたタンパク質ナノ粒子を調製することは同様に難しい。最後に、化学架橋剤と共に作用する場合、粒子間架橋は常に検討しなければならいリスクであり、多くの場合、粒子間架橋は粒子内架橋と競合(すなわち、1つの粒子内においてタンパク質間架橋およびタンパク質内架橋が存在)し、制御不能な大きさの増加が生じ、その大きさはナノスケールを超え、架橋されたミクロンスケールの粒子が生じる。
【0032】
上述のように、前駆体材料の歴史における架橋プロセスは、粉砕が容易という驚くべきかつ著しく有効な特性を用い、架橋されていないタンパク質材料に勝る利点を提供する。架橋によって柔軟性の低いタンパク質粒子が得られるように思われる。粒子の柔軟性が低いという事実によって、より小さい長さスケールでの断片化を効果的に継続することができる。強く溶媒和された結晶性タンパク質を用いる場合、架橋によって断片化時に結晶性が保持される。また、架橋によって、ナノ粒子を含むタンパク質単位の構造的な安定性が保持され、従って、断片化工程時に生理活性の保持が促進される。
【0033】
架橋されたタンパク質ナノ結晶は工業的に調製されていないが、ボトムアップ手法を用いた刊行物が先行技術に存在する。同様に、ボトムアップ集合手法のみを用いて、非常に具体的な用途のために、ナノ凝集体などの架橋されたナノサイズのタンパク質会合体が調製されている。本発明の態様は、利用可能な架橋されたナノ粒子ならびにそれらの製造技術の不足に対処する。特に、本発明の態様は、サイズ縮小原理を発展させたものであり、具体的には、物理的手段を用いた架橋されたタンパク質ナノ粒子の調製について記載しており、それは、断片化を引き起こす加力に基づいている。容易に調製される出発物質については、本発明のサイズ縮小手法は一般的であり、工業的に採用可能であり、容易に計測可能かつ好都合に制御可能である。従って、本発明によって、大量の架橋されたタンパク質ナノ粒子を、制御可能かつ好都合に調製することができる。
【0034】
溶液中で架橋されたミクロンサイズのタンパク質材料の性能を、対応する個々のタンパク質と比較した場合、前者は、より長寿命で、容易に回収可能であり、より加水分解性でプロテイナーゼ安定性であり、かつ、温度、有機溶媒および極端なpHに対してより耐容性を有することを証明している。本発明の架橋されたタンパク質ナノ粒子は、個々のタンパク質に勝る類似した利点を誇るものである。これらの粒子は、物質移動の向上、反応性の向上および生物学的利用能および有効性の向上などの確立されているミクロンサイズの粒子に勝る具体的な利点も有する。ナノサイズのこれらの粒子が性能特性に直接影響を及ぼすことを観察すると、そのようなナノ粒子が多くの個々のタンパク質ならびに多くのミクロンサイズの架橋されたタンパク質粒子の役割に取って代わることができると考えることは正しい。本明細書に示されている実施例の項の試験によって、サイズ縮小時の生理活性の観察可能な向上が分かる。
【0035】
最も重要なことに、ナノサイズのこれらの粒子は、酵素補充療法などの治療用途で非常に有用であることを証明しているかもしれない。本特許請求の理論的根拠は、他のナノ粒子に基づく文献の研究結果にあり、それは、酵素ナノ粒子が、適切に処理された場合に、それらの生物学的活性を保持し、かつ単量体酵素または可溶性酵素誘導体と比較して、複数の取り込み経路、良好な全身生物学的利用能、向上した脳への進入、急速な細胞内への取り込み、リソソームへの標的化送達、および非常に向上した生体内での安定性を経験することを強く示唆している。リソソーム貯蔵障害が細胞小器官の酵素欠損を強めるため、本発明は、恒常性を回復させることができ、確立されている薬物送達戦略の向上したより一般的な代替物としての役割を果たす。この治療法の理論的根拠を図1に示す。
【0036】
本発明の態様は、酵素療法の多くの形態に合わせて修正することができる。確立されている補充療法の場合、酵素欠損を直接に補償することができ、または基質減少/阻害療法の場合、さらなる基質の供給路をブロックすることによって酵素欠損を縮小化することができる。架橋されたナノ粒子が酸性タンパク質分解作用ならびに細胞質基質および細胞間汁液中に存在する他の加水分解プロセスに抵抗することができるため治療法をリソソーム貯蔵障害の範囲を超えて拡大させるという根拠は妥当である。小型の前記ナノ粒子は、容易な注射可能性、舌下、バッカルおよびGALT(腸管関連リンパ系組織)、粘膜プロセスを介した良好な吸収、および罹患した血管および外傷を受けた間質腔などの流れが抑制された領域への無制限のアクセスを暗示している。従って、架橋されたタンパク質ナノ粒子は、リソソーム貯蔵障害および嚢胞性線維症のような多くの奇病を治療する際に利点を示すことができると考えることができる。同様に、それは、消化疾患、酵素反応性の癌、糖尿病および低酸素状態、再灌流関連傷害および慢性創傷を助ける役割を担うかもれない。上に列挙した固有の可能な利点について熟慮すると、多くの重要な治療法がこの手法(特に、脳を標的とするタンパク質系薬物)を手本とする可能性がある。
【0037】
製品の詳細
本発明は、1種以上のタンパク質、吸着物質、および少なくとも1種のゼロ以上の長さのタンパク質間架橋を含むナノ粒子が、各次元(demension)軸の物理的長さが少なくとも1ミクロンの組成的に同等またはほぼ同等の前駆体材料のナノ断片化製品として得られる(すなわち、それがナノ断片化製品である)ことを特徴とする、生物工学、化粧品、医薬および生物医学への応用を可能にするのに適した10〜999nm、好ましくは50〜200nmの大きさの共有結合的に架橋されたタンパク質ナノ粒子を提供する。「ほぼ同等である」という用語は、サイズ縮小により生じ得る軽微な変化(例えば、溶媒交換、溶媒置換またはタンパク質間パッキングの変化)を可能にするように使用されている。「ナノ断片化」という用語は、本発明のミクロン以上の大きさの前駆体材料をナノサイズの断片に断片化または細分するという考えを伝えるために使用されている(そこで、ナノ断片化という用語を新しく作り出す)。タンパク質成分は、酵素、ホルモン、受容体、構造、輸送または抗体クラスのタンパク質の1種以上を含んでもよい。より具体的には、タンパク質成分は、加水分解酵素、プロヒドロラーゼ(prohydrolase)、異性化酵素、転移酵素、酸化還元酵素、リアーゼ、合成酵素、インスリン、グルカゴン、グルカゴン様ペプチド、エキセンジン(extendin)、エキセンジン誘導体、シムリン、ソマトカイン(somatokine)、インスリン抗体、プロインスリン抗体、インターフェロン、抗癌モノクローナル抗体、抗癌ワクチン、ナトレコール、抗血小板剤、サイトカイン、腫瘍壊死因子α、インターロイキン1受容体拮抗薬、HIV−1阻害性ペプチドT20、人工タンパク質5H−ex、ソマトスタチン、HIV融合阻害剤T−1249、抗微生物タンパク質、リゾチーム、ラクトフェリン、バクテリオシン、インターロイキン2、アンギオテンシノーゲン、アンジオテンシン、アンギオテンシン変換酵素阻害剤、ゼラチン、コラーゲン、プロコラーゲン、キトサン、絹タンパク質、ケラチン、ミオシン、アクチン、成長ホルモン、アルブミン、グロブリン、ヘモグロビン、ミオグロビンおよび/またはシトクロムで構成されていてもよい。調製方法に目を向けると、各架橋されたタンパク質ナノ粒子は、サイズ縮小時に、その前駆体材料の化学組成および架橋履歴を反映していることは明らかである。前駆体は、その後に架橋されるミクロン以上の大きさのタンパク質凝集体(タンパク質沈殿事象または凍結乾燥事象のいずれかによって生じる)またはタンパク質結晶である。前駆体の架橋の性質は、化学、酵素または脱水熱性であってもよく、全ての場合に共有結合性である。
【0038】
架橋は、カルボジイミドで処理されたか真空下で(すなわち、脱水熱的に)加熱された直接に結合したタンパク質の場合のようにゼロ長さのものから、二量体、三量体もしくは多量体リンカーを用いた20個以上の炭素単位タンパク質内架橋まで、様々であってもよい。前駆体材料中で架橋を形成するか架橋形成を促進する化学物質は、水または有機溶媒に可溶性または分散性であってもよい。化学物質は、限定されるものではないが、カルボジイミド、デキストランアルデヒド、ジイミド酸ジアルキルおよび最大20個の架橋炭素原子を有する他の二官能性もしくは三官能性架橋剤および/またはグルタルアルデヒドポリマー、澱粉アルデヒド、ポリアミン、有機シリコーンおよび少なくとも5個の官能基を有する他の多量体リンカーのうちのいずれか1つであってもよい。酵素的に形成された架橋の場合、前駆体は、任意の好適な加水分解酵素、転移酵素および/または酸化還元酵素、および場合によりグルタミン転移酵素などのアミノ基転移酵素で処理されていてもよい。脱水熱的に形成された架橋の場合、前駆体材料は、真空条件下70〜120℃で6〜48時間加熱されていてもよい。大部分がタンパク質系である架橋されたタンパク質ナノ粒子および前駆体は、それでもなお、表面に沿って吸着物質を収容することが期待されている。吸着物質の性質は、前駆体材料の調製履歴およびナノ粒子を生成する処理履歴を反映するものでなければならない。ナノ粒子および前駆体は、水、有機溶媒、塩、リオプロテクタント(lyoprotectant)、凍結保護剤および/または界面活性剤のうちの1つまたは多くを含み得る吸着物質を担持する。
【0039】
方法の詳細
本発明は、架橋されたタンパク質ナノ粒子の調製方法を開示する。本工程は、ミクロン以上の大きさのタンパク質凝集体もしくは結晶を調製すること、および凝集体もしくは結晶を架橋して前駆体材料を得ることを含む。次いで、前駆体をサイズ縮小プロセスに供し、それにより、ナノ化を達成して、架橋されたタンパク質ナノ粒子を得る。サイズ縮小プロセスでは、前駆体材料に沿って機械的剪断力を加える。例えば、120℃未満の温度で30秒〜10分の範囲の加力時間で、100〜15000rpm、好ましくは1000〜6000rpmで動作する従来の高剪断混合/配合装置を用いて必要な機械的剪断力を生成してもよい。サイズ縮小プロセスでは、流体力学的剪断応力を加えてもよく、ここでは、例えば、分散/混合装置としてのホモジナイザを用いて、水性もしくは有機媒体中で前記流体力学的剪断応力を前駆体材料に加える。均質化の場合、規定の操作条件は、100〜500rpm、好ましくは1000〜2000rpmであり、5分〜3時間、好ましくは30分〜1.5時間であり、かつ100℃未満の温度である。皮肉にも、過剰なヨウ化カリウムの存在下での乳鉢および乳棒を用いた手動粉砕(破砕機械力)であっても、架橋されたタンパク質ナノ粒子が本発明によって得られるため、器具は必ずしも必要ではない。前駆体/粉末(すなわち、粉砕助剤)の重量比は、2:1〜1:1000重量の間のいずれかの範囲とすることができる。最後に、ナノ化は、80℃未満の温度で音波もしくは流体力学的キャビテーションによって生成される圧力勾配応力を用いても達成することもできる。サイズ縮小方法のさらなる側面は、粉砕プロセスの前および間での任意の冷却の使用であり、それにより、前駆体材料を脆化させかつ好ましくない分解を減少させることができる。好都合な冷却源は液体窒素である。サイズ縮小方法のさらなる側面は、ラジカルプロセス、異方性結合分裂プロセスおよび酸化プロセスから生じるタンパク質分解を減少させるために、適当であると思われる場所で捕捉剤分子を含めるという選択肢である。そのような予防措置の組み込みは、かなりのラジカルを生成することで知られているキャビテーションプロセスの場合に有用であると証明することができる。添加する捕捉剤の有用な量は、前駆体材料に対して0.01〜2重量%である。前記捕捉剤は、必ずしも限定されるものではないが、α−トコフェロール、ナリンゲニン、レチノール、ヨウ化物、コエンザイムQ10、メラトニン、カロテン様テルペノイド、フラボノイドポリフェノール類、フェノール酸およびエステル、グルタチオン、N−アセチルシステイン、フィチン酸、シュウ酸、クエン酸、オイゲノール、キサントン、クルクミン、フラボノリグナン、R−リポ酸、尿酸、カロテン、ユビキノール、アスコルビン酸、ブチル化ヒドロキシトルエン、亜硫酸水素塩および/またはチオ硫酸塩のうちの1種以上を含むことができる。物理的サイズ縮小プロセスを容易にするために、固体の粉末添加剤も推奨されている。前駆体および固体粉末をそれぞれ、2:1〜1:1000の範囲の重量比で、サイズ縮小前に一緒にすることができる。固体粉末の選択肢は、ヨウ化カリウム、ヨウ化ナトリウム、塩化ナトリウム、他のアルカリ塩、アルカリ土類塩、活性炭、二酸化ケイ素、酸化アルミニウム、二酸化チタン、キチン、ケラチンおよび/またはポリイミドを含んでもよい。サイズ縮小プロセスのさらなる側面は、再凝集を防止/制限するために、2〜100倍の過剰重量の安定剤分子の添加である。安定剤分子の選択肢は、必ずしも限定されるものではないが、ヨウ化カリウム、ヨウ化ナトリウム、塩化ナトリウム、または任意のアルカリもしくはアルカリ土類塩、アンモニウム塩、炭水化物、ポリオール類、ポリビニルピリジン、ポリビニルピロリドン、ポリアミド類、クエン酸、アスコルビン酸、アルブミン、ヒプロメロースおよび/またはゼラチンのうちの1種以上の薬剤であってもよい。
【0040】
用途
本発明の方法によって生成される架橋されたタンパク質ナノ粒子は、生物学的活性および生物学的利用能を向上させることにより、タンパク質を基礎とする治療法の性能を向上させる。経口、バッカル、舌下、GALT、腹腔内、筋肉内、真皮下、皮下、クモ膜下腔内、実質内および静脈内などの大部分の任意の投与経路は、本発明からの利益を享受する。本発明の特定の標的は、リソソーム貯蔵障害に起因する代謝不均衡の回復である。ナノ粒子が細胞内に取り込まれるという事実および外来物質がリソソームに導かれるという事実は、前記欠陥のある細胞小器官に有効な治療法を提案するのに有用である。架橋によって急速なタンパク質分解が防止されるという事実は、前記架橋されたタンパク質ナノ粒子の経口薬物送達(児童には明らかにプラスである)を促進するのに有用である。前記ナノ粒子のタンパク質分解抵抗性は、リソソームまたは病的状態に罹患している他の領域での長い生体内活性も可能にする。
【実施例】
【0041】
実施例1:アルカラーゼCLEA(CLEA=架橋された酵素凝集体)のナノ化
アルカラーゼCLEA(1g、CLEA Technologies社)を、粉砕助剤および安定剤としてのヨウ化カリウム(69g)と穏やかに混合した。Draiswerke社(ニュージャージー州モーウォー)から得られたGシリーズGELIMAT G1混合/配合装置を用いて機械的剪断下で混合物を粉砕した。そのまま、材料を、ロッキングスライドを有する上部ホッパーから処理室に導入した。この機械は、互い違いのほぼ半径方向に延在する混合要素を備えた中心シャフトを有する水平に延在する円筒状処理室を有する。処理室には、エネルギー入力または電力消散を測定する電流計シャフトドライブと温度センサが備え付けられている。試料温度が決して63℃を超えないようにしながら、シャフトを回転させた(5000rpm、5分)。完了したら、細かく粉砕された混合物を遠心力の作用によって処理室から素早く排出した。後方散乱電子モード(5kV)で構成されたLEO Supra 35 VP装置を用いたSEM顕微鏡分析(図2)は、アルカラーゼのナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒い粒子)ならびに再凝集したナノ粒子(DLSの結果の項を参照)を示した。前記混合物は生物学的活性を保持していることが分かった。未処理の前駆体材料中にナノ粒子は観察されなかった(図示せず)。
【0042】
実施例2:サビナーゼCLEAのナノ化
サビナーゼCLEA(10mg、CLEA Technologies社)を、50mlファルコン管に入れ、安定剤として予め溶解したヨウ化カリウム(200mg)を含む蒸留水(10ml)に懸濁した。PT-DA 6050/2TM分散プローブが取り付けられた1600W PT-MR 6100 Polytronホモジナイザ(Kinematica社による分散および混合技術)を用いて、流体力学的剪断力を懸濁液に加えた(1500rpm、1.5時間、30〜35℃)。試料を抽出し、液体窒素で急速冷凍し、凍結乾燥した。後方散乱電子モード(4kV)で構成されたLEO Supra 35 VP装置を用いた試料のSEM顕微鏡分析(図3)は、サビナーゼのナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒い粒子)ならびに再凝集したナノ粒子(DLSの結果の項を参照)を示した。前記混合物は、原料容器からの未処理のサビナーゼに対して340%の生物学的活性を示した。未処理の前駆体材料中にナノ粒子は観察されなかった(図示せず)。
【0043】
実施例3:サビナーゼCLEAのナノ化
安定剤としてヨウ化カリウムを全く添加せず、炭素のバックグラウンドに対して二次電子モード(2kV)でSEM分析を行ったこと以外は、実施例2の手順を繰り返した。得られた遊離ナノ粒子はより少なかった。実際に、ほとんどの製品は、ミクロンサイズの再凝集したナノ粒子で構成されていた(図4)。興味深いことに、DLSの結果(DLSの項を参照)によって暗示されるように、これらの凝集体でさえ弱く会合しているようであった。さらに、未処理のミクロンサイズの前駆体に対して590%の印象的な生物学的活性が認められ(SEMは示さず)、前記ナノ粒子の生存および有利な特徴が証明された。
【0044】
実施例4:サビナーゼCLEAのナノ化
サビナーゼCLEA(20mg、CLEA Technologies社)を、湿度から保護されていない瑪瑙乳鉢内で手によって粉砕した(20分、室温)。ヨウ化カリウム(400mg)を粉砕助剤および安定剤として使用した。不均質な領域がもはや目視で認められない状態になったら、破砕機械的動作を中断した。後方散乱電子(4kV)を用いたSEM顕微鏡分析(図5)は、サビナーゼのナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒い粒子)を示した。再凝集したナノ粒子(さらなる考察のためにDLSの結果の項を参照)は、ほとんど認められず、手動粉砕方法の可能な有用性が証明された。未処理のCLEA原液に対して265%の生物学的活性が定量化された(図6に図示、炭素のバックグラウンドに対して2kVの二次電子モードを使用)。
【0045】
実施例5:架橋されたヘモグロビン凝集体のナノ化
全ての架橋および後処理工程を4℃で達成した。ウシヘモグロビン(Sigma社)をグルタルアルデヒドで架橋した。この溶液(5ml、100mgHb/ml)を、硫酸アンモニウム溶液(45ml、3M)に投入し、放置して(1時間)、不溶性の凝集体を得た。新しいグルタルアルデヒド溶液(1ml、25%)を反応器に添加し、ボルテックス撹拌を行い(3秒間)、混合物を穏やかに振盪しながらインキュベートした(20時間)。その後、トリス(ヒドロキシメチル)アミノメタン(TRIS)緩衝液(2ml、2M、pH8)を添加し、反応系を機械的振盪機で穏やかにインキュベートした(2時間)。タンパク質試料を遠心分離(10分、7000rpm)によって回収し、0.1MのTRIS緩衝液(pH8)で3回、水で1回洗浄した(洗浄は15〜20分の撹拌を表す;各洗浄の完了後、試料を7000rpmで10分間沈殿させた)。架橋されたヘモグロビン凝集体生成物を真空条件(室温)下で乾燥した。タンパク質(0.5g)を、ヨウ化カリウム(69g)と共に篩にかけた。混合物を、実施例1に記載されているようにGelimat配合器を用いて機械的剪断下で粉砕した。SEM分析(図7、後方散乱電子モード、5kV)は、ナノ粒子(白色のヨウ化カリウムのバックグラウンドに対して黒い粒子)およびミクロンサイズの粒子またはナノサイズの凝集体のいずれかの存在を示した。対照および機械的に処理された架橋されたヘモグロビン試料は、生物学的に活性であり、後者の方が僅かに高かった。
【0046】
プロテアーゼのバイオアッセイ
基質としてゼラチン(1wt%のリン酸緩衝食塩水(PBS)緩衝液)を用いて、大きさを縮小したサビナーゼおよびアルカラーゼCLEAをアッセイした(2時間、37℃、550rpm)。アッセイ前に脱塩を試みなかった。アッセイするタンパク質を水で再構成し、1mg/mlの最終濃度を得た。等体積のタンパク質懸濁液およびゼラチン−PBS溶液を一緒にして、アッセイを開始した。処理していないCLEAを同様にアッセイした。ゼロタンパク質対照は、水(実施例3)または適切に調製されたヨウ化カリウム溶液(残りの実施例)で構成されていた。後に、アッセイ媒体をエッペンドルフ微量遠心機で遠心分離して(12000rpm)、あらゆる不溶性物質を除去し、上澄みの上にi−プロピオン酸ニンヒドリン溶液(lwt%)を送って2:1の水性/有機体積比(45分、70℃)を得て、分析した。発色現象後、反応系を冷却し、570nmでの分光測光法で定量化した。ベールの法則を超えた(すなわち、>1.5)場合、イソプロピルアルコールを用いて測定前に希釈を行った。全ての比較は相対的であり、未処理のCLEA原液に対して行った。サブチリシンをアッセイするために使用される任意の確立されている方法に従って、基質のN−アセチルグリシンエチルエステルに基づいて、pH7.5および40℃で他のバイオアッセイを行うことができる。
【0047】
架橋されたヘモグロビン凝集体のバイオアッセイ
発色現象試薬としてo−フェニレンジアミンを用いて、K Zhangら("Stopped-flow spectrophotometric determination of H2O2 with Hb as catalyst(触媒としてHbを用いたH2O2のストップフロー分光光度定量)" Talanta 51, 179-186, 2000)に基づいて修正したアッセイ法を行った。指定の緩衝液系の代わりにリン酸ナトリウム(10mM、pH8)使用した。インキュベーション(1時間、450rpm、室温)後、遠心分離によってあらゆる粒子材料を反応溶液から分離した。この刊行物に定められているように、色の分光光度検出を正確に行った。
【0048】
動的光散乱(DLS)を用いた、大きさを縮小した前駆体材料(すなわち、実施例1〜5から回収したもの)の粒径分析
ナノ粒子試料(実施例2〜3の場合、貯蔵のために先に急速冷凍および凍結乾燥した)を蒸留水で再構成した。得られた懸濁液を、必要に応じて、より多くの塩を添加して安定させた。次いで、試料の調製を最適化して、分析物を300μlのキュベットに移し、Malvern Instruments社製Nanoseries Zetasizer装置(すなわち、633nmレーザーと共に構成されたNano−ZSブランド)に入れた。極端な遅れによって一般に凝集(典型的には、1〜3ミクロンの粒子が生じる)や、さらには遠心沈降(長時間後の信号損失によって証明されるように、CLEAの場合、粒子の溶解(信号損失の第2の原因)という選択肢はない)が生じるため、調製後すぐに各試料を測定した。実施例1〜5から回収された試料について三つ組分析を行い、(妥当な粒径分布を有する)一般に500nm以下の粒径を得た。そのような2つの分析、すなわち、Gelimat G-1装置でヨウ化カリウムと共に粉砕されたアルカラーゼCLEA(すなわち、実施例1)、およびヨウ化カリウムと共に乳鉢でに手によって粉砕されたサビナーゼCLEA(すなわち、実施例4)のそれぞれの平均数対粒径分布スペクトルプロファイルが明確に示されている(図8および図9)。分析目的のために、0.3A(1mgCLEA/ml)および0.024A(0.025mgCLEA/ml)の粒子吸光度測定値をそれぞれ、分析プログラムに入力した。実施例1〜4の中で、SEM画像の多くの局所領域は、ミクロンサイズの粒子を描写しているようであったが、DLSの結果によって証明されているように、これらのより大きな粒子は、実際には架橋されたナノ粒子の再凝集したクラスタであった。従って、それらが、生物学的に活性なナノサイズの材料が得られる本質的に定量的なナノ断片化プロセスを示していたため、DLSの結果は本発明にとって非常に重要だった。実施例1〜3のDLSプロファイルは単峰性であり、実施例4のDLSプロファイルは二峰性であった。実施例5のDLSプロファイルも二峰性であったが、この例では、ナノ粒子およびミクロンサイズもしくは再凝集したナノ粒子のいずれか一方の両方が観察された。全体として、各SEM顕微鏡写真のナノ粒子の粒径分布は、対応するDLSの測定値と一致していた(光散乱プロフィルの方が約40〜50%大きな直径を有する粒子を一般に示した)。
【0049】
本文献の全体にわたって例示的な態様が示されている。本発明が他の具体的な形態で具現化できることが当業者によって理解されるであろう。当業者であれば、過度の実験をせずにそのような他の態様を実施することができるであろう。本発明の範囲は、本特許文献の目的において、具体的かつ例示的な態様または上記説明の代替物のみに限定されない。
【特許請求の範囲】
【請求項1】
生物工学、化粧品、医薬および生物医学への応用を可能にするのに適した、10〜999nm、好ましくは50〜200nmの大きさの共有結合的に架橋されたタンパク質ナノ粒子であって、1種以上のタンパク質、1種以上の吸着物質および少なくとも1種のゼロ以上の長さのタンパク質間架橋を含む当該ナノ粒子が、各方向の最小長さが1ミクロンである組成的に同等またはほぼ同等な前駆体材料のナノ断片化製品であることを特徴とする、ナノ粒子。
【請求項2】
該タンパク質成分が、酵素、ホルモン、受容体、構造、輸送もしくは抗体クラスのタンパク質の1種以上含む、請求項1に記載の架橋されたタンパク質ナノ粒子。
【請求項3】
該タンパク質成分が、加水分解酵素、プロヒドロラーゼ、異性化酵素、転移酵素、酸化還元酵素、リアーゼ、合成酵素、インスリン、グルカゴン、グルカゴン様ペプチド、エキセンジン、エキセンジン誘導体、シムリン、ソマトカイン、インスリン抗体、プロインスリン抗体、インターフェロン、抗癌モノクローナル抗体、抗癌ワクチン、ナトレコール、抗血小板剤、サイトカイン、腫瘍壊死因子α、インターロイキン1受容体拮抗薬、HIV−1阻害性ペプチドT20、人工タンパク質5H−ex、ソマトスタチン、HIV融合阻害剤T−1249、抗微生物タンパク質、リゾチーム、ラクトフェリン、バクテリオシン、インターロイキン2、アンギオテンシノーゲン、アンジオテンシン、アンギオテンシン変換酵素阻害剤、ゼラチン、コラーゲン、プロコラーゲン、キトサン、絹タンパク質、ケラチン、ミオシン、アクチン、成長ホルモン、アルブミン、グロブリン、ヘモグロビン、ミオグロビンおよび/またはシトクロムのうちの1種以上からなる、請求項1または2に記載の架橋されたタンパク質ナノ粒子。
【請求項4】
該ナノ粒子が、該前駆体材料の化学組成、架橋履歴およびの処理履歴を反映している、請求項1〜3のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項5】
該前駆体が、架橋されたタンパク質凝集体(沈殿物または凍結乾燥物)もしくは結晶である、請求項1〜4のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項6】
該共有結合的架橋が、該前駆体材料を化学処理、酵素処理または脱水熱処理することによって達成されている、請求項1〜5のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項7】
該ゼロ以上の長さのタンパク質間架橋が、該前駆体材料を化学処理、酵素処理または脱水熱処理することによって実現されている、請求項1〜6のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項8】
該前駆体材料中で架橋を形成する化学物質が、水または有機溶媒材料に可溶性または分散性であり、カルボジイミド;デキストランアルデヒド;ジイミド酸ジアルキル、および最大20個の架橋炭素原子を有する他の二官能性もしくは三官能性架橋剤;および/またはグルタルアルデヒドポリマー、澱粉アルデヒド、ポリアミン、有機シリコーン、および少なくとも5個の官能基を有する他の多量体リンカーを含む、請求項1〜7のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項9】
該前駆体材料中で架橋を形成する該酵素が、加水分解酵素、転移酵素または酸化還元酵素である、請求項1〜8のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項10】
該前駆体材料中で架橋を形成する該酵素はアミノ基転移酵素である、請求項1〜9のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項11】
該前駆体材料が、真空条件下70〜120℃で6〜48時間のタンパク質粉末の加熱によって脱水熱架橋されている、請求項1〜10のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項12】
該前駆体材料中の該吸着物質が、水、有機溶媒、塩、リオプロテクタント、凍結保護剤および/または界面活性剤を含む、請求項1〜11のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項13】
請求項1に記載の該架橋されたタンパク質ナノ粒子の調製方法であって、ミクロン以上のスケールのタンパク質凝集体もしくは結晶を調製する工程と、該凝集体もしくは結晶を架橋して該前駆体材料を得る工程とを含むプロセスによるものであり、該前駆体を、ナノ化を引き起こして該最終製品を得るサイズ縮小プロセスに供することを特徴とする方法。
【請求項14】
機械的剪断力を該前駆体材料に加える、請求項13に記載のナノ化方法。
【請求項15】
100〜15000rpm、好ましくは1000〜6000rpmで動作する従来の高剪断混合/配合装置を用いて、機械的剪断力を該前駆体材料に加える、請求項13または14に記載のナノ化方法。
【請求項16】
機械的剪断力を120℃未満の温度で30秒〜10分間、該前駆体材料に加える、請求項13〜15のいずれかに記載のナノ化方法。
【請求項17】
流体力学的剪断応力を該前駆体材料に加える、請求項13〜16のいずれかに記載のナノ化方法。
【請求項18】
100〜5000rpm、好ましくは1000〜2000rpmで動作する分散/混合装置としてのホモジナイザを用いて、水性もしくは有機媒体中で流体力学的剪断応力を該前駆体材料に加える、請求項13〜17のいずれかに記載のナノ化方法。
【請求項19】
流体力学的剪断応力を100℃未満の温度で5分〜3時間、好ましくは30分〜1.5時間、該前駆体材料に加える、請求項13〜18のいずれかに記載のナノ化方法。
【請求項20】
破砕機械力を該前駆体材料に加える、請求項13〜19のいずれかに記載のナノ化方法。
【請求項21】
該前駆体を破砕するために乳鉢および乳棒を用いて手動粉砕によって破砕機械力を加え、その際、該前駆体材料および粉砕助剤としての固体粉末が2:1〜1:1000の範囲の各重量比で加えられている、請求項13〜20のいずれかに記載のナノ化方法。
【請求項22】
圧力勾配応力を、80℃未満の温度で音波もしくは流体力学的キャビテーションによって該前駆体材料に加える、請求項13〜21のいずれかに記載のナノ化方法。
【請求項23】
該前駆体材料を冷却して、脆化させる、及び分解減少させる、請求項13〜22のいずれかに記載のナノ化方法。
【請求項24】
液体窒素を用いてサイズ縮小の前および間の冷却を実現する、請求項13〜23のいずれかに記載のナノ化方法。
【請求項25】
タンパク質分解を減少させるために、該前駆体材料に対して0.01〜2重量%の範囲の量で捕捉剤分子を添加する、請求項13〜24のいずれかに記載のナノ化方法。
【請求項26】
前記捕捉剤分子が、α−トコフェロール、ナリンゲニン、レチノール、ヨウ化物、コエンザイムQ10、メラトニン、カロテン様テルペノイド、フラボノイドポリフェノール類、フェノール酸およびエステル、グルタチオン、N−アセチルシステイン、フィチン酸、シュウ酸、クエン酸、オイゲノール、キサントン、クルクミン、フラボノリグナン、R−リポ酸、尿酸、カロテン、ユビキノール、アスコルビン酸、ブチル化ヒドロキシトルエン、亜硫酸水素塩および/またはチオ硫酸塩である、請求項13〜25のいずれかに記載のナノ化方法。
【請求項27】
該物理的サイズ縮小プロセスを容易にするために固体粉末を添加し、その際、該前駆体および該固体粉末が2:1〜1:1000の範囲の各重量比で加えられている、請求項13〜26のいずれかに記載のナノ化方法。
【請求項28】
該固体粉末が、ヨウ化カリウム、ヨウ化ナトリウム、塩化ナトリウムまたは任意の他のアルカリもしくはアルカリ土類塩、活性炭、二酸化ケイ素、酸化アルミニウム、二酸化チタン、キチン、ケラチンおよび/またはポリイミドである、請求項13〜27のいずれかに記載のナノ化方法。
【請求項29】
再凝集を防止/制限するために、2〜100倍の過剰重量で安定剤分子を添加する、請求項13〜28のいずれかに記載のナノ化方法。
【請求項30】
安定剤分子が、ヨウ化カリウム、ヨウ化ナトリウム、塩化ナトリウムまたは任意のアルカリもしくはアルカリ土類塩、アンモニウム塩、炭水化物、ポリオール類、ポリビニルピリジン、ポリビニルピロリドン、ポリアミド類、クエン酸、アスコルビン酸、アルブミン、ヒプロメロースおよび/またはゼラチンである、請求項13〜29のいずれかに記載のナノ化方法。
【請求項31】
経口、バッカル、舌下、GALT、腹腔内、筋肉内、真皮下、皮下、クモ膜下腔内、実質内および静脈内などの任意の投与経路による治療性能を向上させるための、請求項1〜12のいずれかに記載され、かつ請求項13〜29のいずれかに記載の方法によって調製された架橋されたタンパク質ナノ粒子の使用。
【請求項32】
リソソーム貯蔵障害に起因する代謝不均衡の回復のための、請求項1〜12のいずれかに記載され、かつ請求項13〜29のいずれかに記載の方法によって調製された架橋されたタンパク質ナノ粒子の使用。
【請求項33】
奇病、嚢胞性線維症、消化疾患、酵素反応性の癌、糖尿病および低酸素性状態、再灌流関連傷害、慢性創傷および脳病理の治療のための、請求項1〜12のいずれかに記載され、かつ請求項13〜29のいずれかに記載の方法によって調製された架橋されたタンパク質ナノ粒子の使用。
【請求項1】
生物工学、化粧品、医薬および生物医学への応用を可能にするのに適した、10〜999nm、好ましくは50〜200nmの大きさの共有結合的に架橋されたタンパク質ナノ粒子であって、1種以上のタンパク質、1種以上の吸着物質および少なくとも1種のゼロ以上の長さのタンパク質間架橋を含む当該ナノ粒子が、各方向の最小長さが1ミクロンである組成的に同等またはほぼ同等な前駆体材料のナノ断片化製品であることを特徴とする、ナノ粒子。
【請求項2】
該タンパク質成分が、酵素、ホルモン、受容体、構造、輸送もしくは抗体クラスのタンパク質の1種以上含む、請求項1に記載の架橋されたタンパク質ナノ粒子。
【請求項3】
該タンパク質成分が、加水分解酵素、プロヒドロラーゼ、異性化酵素、転移酵素、酸化還元酵素、リアーゼ、合成酵素、インスリン、グルカゴン、グルカゴン様ペプチド、エキセンジン、エキセンジン誘導体、シムリン、ソマトカイン、インスリン抗体、プロインスリン抗体、インターフェロン、抗癌モノクローナル抗体、抗癌ワクチン、ナトレコール、抗血小板剤、サイトカイン、腫瘍壊死因子α、インターロイキン1受容体拮抗薬、HIV−1阻害性ペプチドT20、人工タンパク質5H−ex、ソマトスタチン、HIV融合阻害剤T−1249、抗微生物タンパク質、リゾチーム、ラクトフェリン、バクテリオシン、インターロイキン2、アンギオテンシノーゲン、アンジオテンシン、アンギオテンシン変換酵素阻害剤、ゼラチン、コラーゲン、プロコラーゲン、キトサン、絹タンパク質、ケラチン、ミオシン、アクチン、成長ホルモン、アルブミン、グロブリン、ヘモグロビン、ミオグロビンおよび/またはシトクロムのうちの1種以上からなる、請求項1または2に記載の架橋されたタンパク質ナノ粒子。
【請求項4】
該ナノ粒子が、該前駆体材料の化学組成、架橋履歴およびの処理履歴を反映している、請求項1〜3のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項5】
該前駆体が、架橋されたタンパク質凝集体(沈殿物または凍結乾燥物)もしくは結晶である、請求項1〜4のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項6】
該共有結合的架橋が、該前駆体材料を化学処理、酵素処理または脱水熱処理することによって達成されている、請求項1〜5のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項7】
該ゼロ以上の長さのタンパク質間架橋が、該前駆体材料を化学処理、酵素処理または脱水熱処理することによって実現されている、請求項1〜6のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項8】
該前駆体材料中で架橋を形成する化学物質が、水または有機溶媒材料に可溶性または分散性であり、カルボジイミド;デキストランアルデヒド;ジイミド酸ジアルキル、および最大20個の架橋炭素原子を有する他の二官能性もしくは三官能性架橋剤;および/またはグルタルアルデヒドポリマー、澱粉アルデヒド、ポリアミン、有機シリコーン、および少なくとも5個の官能基を有する他の多量体リンカーを含む、請求項1〜7のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項9】
該前駆体材料中で架橋を形成する該酵素が、加水分解酵素、転移酵素または酸化還元酵素である、請求項1〜8のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項10】
該前駆体材料中で架橋を形成する該酵素はアミノ基転移酵素である、請求項1〜9のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項11】
該前駆体材料が、真空条件下70〜120℃で6〜48時間のタンパク質粉末の加熱によって脱水熱架橋されている、請求項1〜10のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項12】
該前駆体材料中の該吸着物質が、水、有機溶媒、塩、リオプロテクタント、凍結保護剤および/または界面活性剤を含む、請求項1〜11のいずれかに記載の架橋されたタンパク質ナノ粒子。
【請求項13】
請求項1に記載の該架橋されたタンパク質ナノ粒子の調製方法であって、ミクロン以上のスケールのタンパク質凝集体もしくは結晶を調製する工程と、該凝集体もしくは結晶を架橋して該前駆体材料を得る工程とを含むプロセスによるものであり、該前駆体を、ナノ化を引き起こして該最終製品を得るサイズ縮小プロセスに供することを特徴とする方法。
【請求項14】
機械的剪断力を該前駆体材料に加える、請求項13に記載のナノ化方法。
【請求項15】
100〜15000rpm、好ましくは1000〜6000rpmで動作する従来の高剪断混合/配合装置を用いて、機械的剪断力を該前駆体材料に加える、請求項13または14に記載のナノ化方法。
【請求項16】
機械的剪断力を120℃未満の温度で30秒〜10分間、該前駆体材料に加える、請求項13〜15のいずれかに記載のナノ化方法。
【請求項17】
流体力学的剪断応力を該前駆体材料に加える、請求項13〜16のいずれかに記載のナノ化方法。
【請求項18】
100〜5000rpm、好ましくは1000〜2000rpmで動作する分散/混合装置としてのホモジナイザを用いて、水性もしくは有機媒体中で流体力学的剪断応力を該前駆体材料に加える、請求項13〜17のいずれかに記載のナノ化方法。
【請求項19】
流体力学的剪断応力を100℃未満の温度で5分〜3時間、好ましくは30分〜1.5時間、該前駆体材料に加える、請求項13〜18のいずれかに記載のナノ化方法。
【請求項20】
破砕機械力を該前駆体材料に加える、請求項13〜19のいずれかに記載のナノ化方法。
【請求項21】
該前駆体を破砕するために乳鉢および乳棒を用いて手動粉砕によって破砕機械力を加え、その際、該前駆体材料および粉砕助剤としての固体粉末が2:1〜1:1000の範囲の各重量比で加えられている、請求項13〜20のいずれかに記載のナノ化方法。
【請求項22】
圧力勾配応力を、80℃未満の温度で音波もしくは流体力学的キャビテーションによって該前駆体材料に加える、請求項13〜21のいずれかに記載のナノ化方法。
【請求項23】
該前駆体材料を冷却して、脆化させる、及び分解減少させる、請求項13〜22のいずれかに記載のナノ化方法。
【請求項24】
液体窒素を用いてサイズ縮小の前および間の冷却を実現する、請求項13〜23のいずれかに記載のナノ化方法。
【請求項25】
タンパク質分解を減少させるために、該前駆体材料に対して0.01〜2重量%の範囲の量で捕捉剤分子を添加する、請求項13〜24のいずれかに記載のナノ化方法。
【請求項26】
前記捕捉剤分子が、α−トコフェロール、ナリンゲニン、レチノール、ヨウ化物、コエンザイムQ10、メラトニン、カロテン様テルペノイド、フラボノイドポリフェノール類、フェノール酸およびエステル、グルタチオン、N−アセチルシステイン、フィチン酸、シュウ酸、クエン酸、オイゲノール、キサントン、クルクミン、フラボノリグナン、R−リポ酸、尿酸、カロテン、ユビキノール、アスコルビン酸、ブチル化ヒドロキシトルエン、亜硫酸水素塩および/またはチオ硫酸塩である、請求項13〜25のいずれかに記載のナノ化方法。
【請求項27】
該物理的サイズ縮小プロセスを容易にするために固体粉末を添加し、その際、該前駆体および該固体粉末が2:1〜1:1000の範囲の各重量比で加えられている、請求項13〜26のいずれかに記載のナノ化方法。
【請求項28】
該固体粉末が、ヨウ化カリウム、ヨウ化ナトリウム、塩化ナトリウムまたは任意の他のアルカリもしくはアルカリ土類塩、活性炭、二酸化ケイ素、酸化アルミニウム、二酸化チタン、キチン、ケラチンおよび/またはポリイミドである、請求項13〜27のいずれかに記載のナノ化方法。
【請求項29】
再凝集を防止/制限するために、2〜100倍の過剰重量で安定剤分子を添加する、請求項13〜28のいずれかに記載のナノ化方法。
【請求項30】
安定剤分子が、ヨウ化カリウム、ヨウ化ナトリウム、塩化ナトリウムまたは任意のアルカリもしくはアルカリ土類塩、アンモニウム塩、炭水化物、ポリオール類、ポリビニルピリジン、ポリビニルピロリドン、ポリアミド類、クエン酸、アスコルビン酸、アルブミン、ヒプロメロースおよび/またはゼラチンである、請求項13〜29のいずれかに記載のナノ化方法。
【請求項31】
経口、バッカル、舌下、GALT、腹腔内、筋肉内、真皮下、皮下、クモ膜下腔内、実質内および静脈内などの任意の投与経路による治療性能を向上させるための、請求項1〜12のいずれかに記載され、かつ請求項13〜29のいずれかに記載の方法によって調製された架橋されたタンパク質ナノ粒子の使用。
【請求項32】
リソソーム貯蔵障害に起因する代謝不均衡の回復のための、請求項1〜12のいずれかに記載され、かつ請求項13〜29のいずれかに記載の方法によって調製された架橋されたタンパク質ナノ粒子の使用。
【請求項33】
奇病、嚢胞性線維症、消化疾患、酵素反応性の癌、糖尿病および低酸素性状態、再灌流関連傷害、慢性創傷および脳病理の治療のための、請求項1〜12のいずれかに記載され、かつ請求項13〜29のいずれかに記載の方法によって調製された架橋されたタンパク質ナノ粒子の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2012−532860(P2012−532860A)
【公表日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願番号】特願2012−519107(P2012−519107)
【出願日】平成22年7月7日(2010.7.7)
【国際出願番号】PCT/IB2010/053104
【国際公開番号】WO2011/004328
【国際公開日】平成23年1月13日(2011.1.13)
【出願人】(512007410)サバンジュ・ウニベルシテシ (1)
【Fターム(参考)】
【公表日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願日】平成22年7月7日(2010.7.7)
【国際出願番号】PCT/IB2010/053104
【国際公開番号】WO2011/004328
【国際公開日】平成23年1月13日(2011.1.13)
【出願人】(512007410)サバンジュ・ウニベルシテシ (1)
【Fターム(参考)】
[ Back to top ]

