架橋剤、架橋高分子材料及びこの架橋高分子材料の製造方法
【課題】分子内に炭素−炭素二重結合やニトリル基等を有するNBR等の高分子材料を低温(例えば、20℃〜200℃)において架橋できる架橋剤、NBR等の高分子材料がこの架橋剤により架橋されてなる架橋高分子材料及びこの架橋高分子材料の製造方法を提供することを目的とする。
【解決手段】分子内にニトリルオキシドと反応する多重結合を有する高分子材料の架橋に用いられる架橋剤であって、芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドよりなる。
【解決手段】分子内にニトリルオキシドと反応する多重結合を有する高分子材料の架橋に用いられる架橋剤であって、芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドよりなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、架橋剤、高分子材料が架橋されてなる架橋高分子材料及び架橋高分子材料の製造方法に関するものである。
【背景技術】
【0002】
EPDM、NR、NBR等のように分子内に炭素−炭素二重結合を有するゴムの架橋は、一般的に硫黄によって行われている。これらのゴムを硫黄を用いて架橋するための実用加硫温度としては、150℃〜200℃の温度が必要となっている。そのため、架橋されたこれらのゴムは、加硫温度が高くなるにつれ架橋時の熱による劣化等によりゴムの特性が低下する懸念があった。その上、ゴム等を加熱するために多くのエネルギーが必要となっていた。そのため、加硫温度を低くすることが検討されており、その一つとして、各種促進剤等を組み合わせて使用する方法が検討されている。しかし、この方法では、加硫時間が長くなってしまい、実用化の域には至っていなかった。
【0003】
一方、低温でゴムを架橋する架橋剤として、特許文献1には、メシチレンジニトリルオキシド(MDNO)等のように、複数のニトリルオキシド基を分子内に有するポリニトリルオキシドが記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平11−180943号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、メシチレンジニトリルオキシド等のように一つの芳香環に二つのニトリルオキシド基を有するものや、ニトリルオキシド基のオルト位に水素原子があるもの、すなわち、ニトリルオキシド基のオルト位に置換基が導入されていないものは、安定性が悪く(段落0056、0057参照)、架橋剤として用いることができなかった。
【0006】
そこで、本発明は、分子内に炭素−炭素二重結合やニトリル基等を有するNBR等の高分子材料を通常より低い加硫温度で架橋できる架橋剤、NBR等の高分子材料がこの架橋剤により架橋されてなる架橋高分子材料及びこの架橋高分子材料の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
上記課題を解決するため、本発明の架橋剤は、分子内にニトリルオキシドと反応する多重結合を有する高分子材料の架橋に用いられる架橋剤であって、芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドよりなる。
【0008】
上記課題を解決するため、本発明の架橋高分子材料の製造方法は、芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドを用いて、高分子材料を架橋して架橋高分子材料を製造する。
【0009】
上記課題を解決するため、本発明の架橋高分子材料は、芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドにより、高分子材料が架橋されてなる。
【0010】
本発明における各要素の態様を以下に例示する。
【0011】
1.二官能性ニトリルオキシド
二官能性ニトリルオキシドとしては、特に限定はされないが、芳香環の一つの水素原子がニトリルオキシド基で置換され、そのニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造になっているとともに、この芳香族ニトリルオキシド誘導体構造の二つが、オキシ基を二つ有するジオキシ構造のこの二つのオキシ基にそれぞれ結合している、又は、カルボニル基を二つ有するジカルボニル構造のこの二つのカルボニル基にそれぞれ結合している構造をとることで、安定性が向上し、この二官能性ニトリルオキシドを架橋剤として用いることができる。
芳香環としては、特に限定はされないが、ベンゼン環、ナフタレン環等の複素環以外の芳香環であることが好ましい。
置換基としては、特に限定はされないが、アルキル基、アリール基等の炭化水素基や、オキシ基等が例示でき、安定性がより向上することから、オキシ基であることが好ましい。
ここで、アルキル基としては、特に限定はされないが、炭素数が1〜20の直鎖状又は分岐状のものが例示でき、好ましくは、炭素数が1〜4の直鎖状又は分岐状のものである、メチル基、エチル基、n−プロピル基、iso−プロピル基、n−ブチル基、sec−ブチル基、iso−ブチル基、tert−ブチル基である。
オキシ基としては、特に限定はされないが、アルコキシ基等の炭化水素オキシ基が例示できる。そして、芳香環がベンゼン環であるベンゾニトリルオキシド誘導体構造の場合には、少なくとも一方は、アルコキシ基であることが好ましい。また、ベンゾニトリルオキシド誘導体構造の二つの置換基のうち、一方がアルコキシ基である場合には、他方は、前記ジオキシ構造のオキシ基であることが好ましい。
ここで、アルコキシ基としては、特に限定はされないが、炭素数が1〜4の直鎖状又は分岐状のものが例示でき、好ましくは、炭素数が1〜3の直鎖状又は分岐状のものである、メトキシ基、エトキシ基、n−プロポキシ基、iso−プロポキシ基である。
【0012】
二官能性ニトリルオキシドの具体例としては、次に示す四つの化合物が例示できる。
・3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)
・2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)
・2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)
・2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)
【0013】
2.高分子材料
高分子材料は、二官能性ニトリルオキシドにより架橋されるよう、分子内にニトリルオキシドと反応する多重結合を有するものであれば、特に限定されることはない。
ここで、ニトリルオキシドと反応する多重結合としては、特に限定はされないが、C=S、N=N、P(V)=C、C=P(III)、C=As、C=C、C=N、C=Se、B=N、C≡P、C≡C、P(V)=N、C≡N、C=O等が例示できる。
高分子材料の具体例としては、分子内にニトリル基(C≡N)を有するPAN(ポリアクリロニトリル)、分子内に炭素−炭素二重結合(C=C)を有するNR(天然ゴム)、EPDM(エチレン−プロピレン−ジエン共重合ゴム)、分子内にニトリル基及び炭素−炭素二重結合を有するNBR(ニトリルゴム)等が例示できる。
【0014】
3.架橋過程
高分子材料を二官能性ニトリルオキシドで架橋する架橋過程は、排気設備や有機溶媒の回収設備等を設ける必要がないことから、有機溶媒を用いないで行うことが好ましく、硫黄を用いて架橋するときに使用する従来の設備を利用できることから、架橋過程を混練装置内で行うことがより好ましい。
ここで、混練装置としては、特に限定はされないが、バンバリーミキサー、インターミックス等の密閉式混練機や二軸押出機、単軸押出機、多軸押出機等の押出機等が例示できる。
一方、薄いシート状の成形体等が製造し易いことから、架橋過程は有機溶媒中で行うことが好ましい。
ここで、有機溶媒としては、特に限定はされないが、高分子材料及び二官能性ニトリルオキシドが共に溶解し易いものであることが好ましい。具体的には、クロロホルム、DMF(N,N−ジメチルホルムアミド)、アセトン等が例示できる。
架橋過程の温度としては、高分子材料が二官能性ニトリルオキシドで架橋される、すなわち、高分子材料と二官能性ニトリルオキシドとが反応する温度であれば、特に限定はされない。敢えていうならば、化学反応であることから温度が高ければ反応が促進され、また加熱等の温度調節を行わなければ製造工程の管理が容易になることから、0℃〜200℃であることが好ましい。さらにいうならば、高分子材料がNBR、NR、EPDM等のように、多重結合として少なくとも炭素−炭素二重結合を有するものである場合には、20℃〜200℃であることがより好ましく、PAN等のように、多重結合としてニトリル基のみを有するものである場合には、50℃〜200℃であることがより好ましい。
【発明の効果】
【0015】
本発明によれば、分子内に炭素−炭素二重結合やニトリル基等を有するNBR等の高分子材料を、通常より低い加硫温度(例えば、20℃〜150℃)で、または、通常の加硫温度(例えば、150℃〜200℃)では短時間で架橋できる架橋剤、NBR等の高分子材料がこの架橋剤により架橋されてなる架橋高分子材料及びこの架橋高分子材料の製造方法を提供することができる。
【図面の簡単な説明】
【0016】
【図1】二官能性ニトリルオキシドEを配合したNRのひずみと引張応力との関係のグラフである。
【図2】二官能性ニトリルオキシドEを配合したNBRのひずみと引張応力との関係のグラフである。
【図3】二官能性ニトリルオキシドFを配合したNBRのひずみと引張応力との関係のグラフである。
【図4】架橋剤を配合したNRの100℃における加硫曲線のグラフである。
【図5】二官能性ニトリルオキシドの架橋剤を配合したNRの70℃〜230℃における加硫曲線のグラフである。
【発明を実施するための形態】
【実施例】
【0017】
本発明の実施例として、以下に示す4種類の二官能性ニトリルオキシドを用いて、PAN、NBR、NR及びEPDMの4種類の高分子材料を架橋した。
また、比較例として、ニトリルオキシドの前駆体であるハロゲン化アルドキシムに塩基を作用させる方法又は一官能性ニトリルオキシドを用いる方法でPANとニトリルオキシドとを反応させた。
【0018】
それぞれの実施例及び比較例の製造(反応)条件びゲル化の有無を次の表1に示す。なお、表1の試薬の欄は、反応に用いた二官能性ニトリルオキシド等を示している。
【0019】
【表1】

【0020】
本実施例及び比較例には、次のものを用いた。
高分子材料としては、PAN(ポリアクリロニトリル)、NBR(ニトリルゴム)、NR(天然ゴム)、EPDM(エチレン−プロピレン−ジエン共重合ゴム)を用いた。このうち、NBRはアクリロニトリルの質量比が33%のものを、EPDMはジエンの質量比が10%のものを用いた。
【0021】
二官能性ニトリルオキシドとしては、次の<1>〜<4>に構造式を示す4種の化合物を用いた。
【0022】
<1>3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)・・・二官能性ニトリルオキシドC(化1参照)
【化1】

【0023】
この3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)は、次のようにして合成した。
【化2】

【0024】
・二官能性アルデヒド(3)の合成
化2に示すように、2,6−ジメトキシベンズアルデヒド(2)500mg(3.01mmol)を、無水トリフルオロ酢酸(TFAA)3.00mL中、アルゴン雰囲気下、室温で攪拌しているところに、イソフタル酸(1)209mg(1.43mmol)を加え、40℃に加熱し、1日間反応させた。そして、系を室温に戻し、クロロホルムを加えた後、純水および2N NaOHaq.(2Nの水酸化ナトリウム水溶液)で洗浄した。そして、溶媒を減圧濃縮して、560mg(1.21mmol、84%)のwhite solid(白色の固体)の二官能性アルデヒド(3)を得た。
【0025】
・二官能性オキシム(4)の合成
化2に示すように、二官能性アルデヒド(3)200mg(0.432mmol)を、EtOH(エタノール)5.00mL中、0℃で、空気中で懸濁させているところに、ヒドロキシルアミン塩酸塩167mg(2.41mmol)とNaOH120mg(3.01mmol)の純水1.00mLを滴下した。そして、室温で1時間反応させた後、50℃で2時間反応させた。そして、室温に戻してろ過し、純水およびクロロホルムで洗浄した残渣を乾燥させて、345mg(0.71mmol、71%)のwhite powder(白色の粉末)の二官能性オキシム(4)を得た。
【0026】
・二官能性ニトリルオキシドCの合成
化2に示すように、二官能性オキシム(4)2.50g(5.08mmol)を、クロロホルム50.0mL中、0℃で攪拌しているところに、トリエチルアミン1.55mL(10.7mmol)を滴下した後、N−クロロスクシンイミド(NCS)1.42g(11.2mmol)を加え、10分間反応させた。そして、反応溶液をクロロホルム/水の二相系に滴下した後、純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥させた後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)を少量のクロロホルムに溶解させ、酢酸エチル/ヘキサン=2/3(v/v)の混合溶媒中に再沈殿させて、1.90g(3.86mmol、76%)のwhite powder(白色の粉末)の二官能性ニトリルオキシドCを得た。
【0027】
<2>2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)・・・二官能性ニトリルオキシドD(化3参照)
【化3】

【0028】
この2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)は、次のようにして合成した。
【化4】

【0029】
・二官能性アルデヒド(7)の合成
化4に示すように、4,4’−メチレンビス(2,6−ジメチルフェノール)(6)3.78g(14.7mmol)と2−フルオロ−6−メトキシベンズアルデヒド(5)5.00g(32.4mmol)とを、DMF15mL中、アルゴン雰囲気下、室温で攪拌しているところに、炭酸カリウム4.48g(32.4mmol)を加えた後、140℃で4日間攪拌した。そして、系を室温に戻し、純水を加え酢酸エチルで抽出し、有機相を純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥した後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)をシリカゲルカラムクロマトグラフィー(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=2:1(v/v)、Rf=0.25)および再結晶(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=1:2(v/v))により精製して、4.91g(9.36mmol、64%)のcolorless crystal(無色の結晶)の二官能性アルデヒド(7)を得た。
【0030】
・二官能性オキシム(8)の合成
化4に示すように、二官能性アルデヒド(7)4.50g(8.58mmol)を、EtOH(エタノール)20mL中、0℃で、空気中で懸濁させているところに、ヒドロキシルアミン塩酸塩1.25g(18.0mmol)とNaOH1.03g(25.7mmol)の純水20mLを滴下した。そして、60℃で1日間反応させた後、ろ過し、純水およびクロロホルムで洗浄した残渣を乾燥させて、4.62g(8.33mmol、97%)のwhite powder(白色の粉末)の二官能性オキシム(8)を得た。
【0031】
・二官能性ニトリルオキシドDの合成
化4に示すように、二官能性オキシム(8)200mg(0.361mmol)を、クロロホルム1.8mL中、0℃で攪拌しているところに、トリエチルアミン110μL(0.793mmol)を滴下した後、N−クロロスクシンイミド(NCS)101mg(0.757mmol)を加え、10分間反応させた。そして、反応溶液を濾別した後、濾液に純水を加えクロロホルムで抽出し、有機相を純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥させた後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)をシリカゲルカラムクロマトグラフィー(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=3:2(v/v)、Rf=0.40(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=2:1(v/v)))により単離して、66.2mg(0.12mmol、33%)のwhite powder(白色の粉末)の二官能性ニトリルオキシドDを得た。
【0032】
<3>2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)・・・二官能性ニトリルオキシドE(化5参照)
【化5】

【0033】
この2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)は、次のようにして合成した。
【化6】

【0034】
・二官能性アルデヒド(10)の合成
化6に示すように、ビスフェノール誘導体(9)16.8g(59.0mmol)と2−フルオロ−6−メトキシベンズアルデヒド(5)20.0g(130mmol)とを、DMF59mL中、アルゴン雰囲気下、室温で攪拌しているところに、炭酸カリウム17.9g(130mmol)を加えた後、140℃で3日間攪拌した。そして、系を室温に戻し、純水を加えクロロホルムで抽出し、有機相を純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥した後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)をシリカゲルカラムクロマトグラフィー(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=1:1(v/v))により単離して、29.7g(91%)のwhite powder(白色の粉末)の二官能性アルデヒド(10)を得た。
【0035】
・二官能性オキシム(11)の合成
化6に示すように、二官能性アルデヒド(10)27.1g(49.0mmol)を、EtOH(エタノール)120mL中、0℃で、空気中で懸濁させているところに、ヒドロキシルアミン塩酸塩7.50g(108mmol)とNaOH5.88g(147mmol)の純水120mLを滴下した。そして、60℃で1日間反応させた後、ろ過し、純水およびBrine(ブライン)で洗浄しクロロホルムで抽出した。そして、有機相を無水硫酸マグネシウムで乾燥した後、濾別し、溶媒を減圧濃縮して、28.2g(99%)のwhite powder(白色の粉末)の二官能性オキシム(11)を得た。
【0036】
・二官能性ニトリルオキシドEの合成
化6に示すように、二官能性オキシム(11)1.0g(1.72mmol)を、クロロホルム120mL中、0℃で攪拌しているところに、トリエチルアミン717μL(5.15mmol)を滴下した後、N−クロロスクシンイミド(NCS)687mg(5.15mmol)を加え、20分間反応させた。そして、系に純水を加えた後、クロロホルムで抽出し、有機相を純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥させた後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)をシリカゲルカラムクロマトグラフィー(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=1:3(v/v))により単離して、975mg(98%)のwhite powder(白色の粉末)の二官能性ニトリルオキシドEを得た。
【0037】
<4>2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)・・・二官能性ニトリルオキシドF(化7参照)
【化7】

【0038】
この2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)は、次のようにして合成した。
【化8】

【0039】
・二官能性アルデヒド(14)の合成
化8に示すように、2−ヒドロキシ−1−ナフトアルデヒド(12)6.33g(36.8mmol)と1,8−ジブロモオクタン(13)3.38mL(18.4mmol)とを、DMF40mL中、空気中で、室温で攪拌しているところに、炭酸カリウム7.62g(55.2mmol)を加えた後、5時間還流した。そして、系を室温に戻し、純水を加えろ過し、残渣を乾燥させcrude(粗精製物)を得た。そして、このcrude(粗精製物)をクロロホルムから再結晶して、8.16g(18.0mmol、98%)のlight brown crystal(ライトブラウンの結晶)の二官能性アルデヒド(14)を得た。
【0040】
・二官能性オキシム(15)の合成
化8に示すように、二官能性アルデヒド(14)1.00g(2.20mmol)をEtOH(エタノール)10mL中、0℃で、空気中で懸濁させているところに、ヒドロキシルアミン塩酸塩336mg(4.84mmol)とNaOH264mg(6.60mmol)の純水10mLを滴下した。そして、室温で10分間反応させた後、純水を加え懸濁させた後、濾別し、残渣を純水で洗浄後、乾燥しcrude(粗精製物)を得た。そして、このcrude(粗精製物)のacetone(アセトン)可溶部を回収し、溶媒を減圧留去することで、493mg(1.02mmol、47%)のwhite powder(白色の粉末)の二官能性オキシム(15)を得た。
【0041】
・二官能性ニトリルオキシドFの合成
化8に示すように、二官能性オキシム(15)100mg(0.21mmol)をクロロホルム40mL中、0℃で攪拌し懸濁しているところに、トリエチルアミン86.2μL(0.62mmol)を滴下した後、N−クロロスクシンイミド(NCS)82.3mg(0.619mmol)を加え、15分間反応させた。そして、純水で洗浄し、無水硫酸マグネシウムで乾燥させた後、濾別し、溶媒を減圧濃縮して、99.2mg(0.21mmol、>99%)のlight brown crystal(ライトブラウンの結晶)の二官能性ニトリルオキシドFを得た。
【0042】
一官能性ニトリルオキシドとしては、次に構造式を示す化合物を用いた。
2,6−ジメトキシベンゾニトリルオキシド・・・B
【化9】

【0043】
ハロゲン化アルドキシムとしては、次に構造式を示す化合物を用いた。
・α−塩化ベンゾアルドキシム・・・A
【化10】

【0044】
次に各実施例について説明する。
実施例1は、DMF(N,N−ジメチルホルムアミド)の溶媒中にPANを溶解させ、そこに二官能性ニトリルオキシドとして3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)(以下Cと省略することがある)を0.1当量添加し、50℃の温度で1.5時間攪拌して反応を行った。
実施例2は、二官能性ニトリルオキシドとして2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)(以下Dと省略することがある)を用いるとともに、反応温度を70℃に変更した以外は実施例1と同じ条件で反応を行った。
【0045】
実施例3は、CHCl3(クロロホルム)の溶媒中にNBRを溶解させ、そこに二官能性ニトリルオキシドとしてCを0.1当量添加し、50℃の温度で1.5時間攪拌して反応を行った
実施例4は、二官能性ニトリルオキシドとしてDを用いるとともに、反応温度を室温(RT:約20℃)に変更した以外は実施例3と同じ条件で反応を行った。
【0046】
実施例5は、乳鉢中で、NBRに二官能性ニトリルオキシドとして2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)(以下Eと省略することがある)を0.1当量添加し、50℃の温度で1.5時間加圧混合して反応を行った。
【0047】
実施例6は、アセトンの溶媒中にNBRを溶解させ、そこに二官能性ニトリルオキシドとして2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)(以下Fと省略することがある)を0.1当量添加し、50℃の温度で24時間攪拌して反応を行った。また、この反応式を次に示す。
【0048】
【化11】

【0049】
実施例7は、二官能性ニトリルオキシドとしてFを用いた以外は、実施例5と同じ条件で反応を行った。
【0050】
実施例8は、CHCl3の溶媒中にNRを溶解させ、そこにEを0.1当量添加し、50℃の温度で1.5時間攪拌して反応を行った。
実施例9は、乳鉢中で、NRに二官能性ニトリルオキシドとしてEを0.1当量添加し、70℃の温度で1.5時間加圧混合して反応を行った。
【0051】
実施例10は、CHCl3の溶媒中にEPDMを溶解させ、そこにEを0.1当量添加し、50℃の温度で1.5時間攪拌して反応を行った。
実施例11は、乳鉢中で、EPDMに二官能性ニトリルオキシドとしてEを0.1当量添加し、50℃の温度で1.5時間加圧混合して反応を行った。
【0052】
実施例12は、液状EPDMに二官能性ニトリルオキシドとしてEを0.1当量添加し、80℃の温度で24時間攪拌して反応を行った。
【0053】
次に各比較例について説明する。
比較例1は、DMFの溶媒中にPANを溶解させ、そこにニトリルオキシドの前駆体としてα−塩化ベンゾアルドキシム(以下Aと省略することがある)を2.0当量添加するとともに添加剤としてEt3N(トリエチルアミン)を添加し、室温(RT:約20℃)で48時間攪拌して反応を行った。
比較例2は、DMFの溶媒中にPANを溶解させ、そこに一官能性ニトリルオキシドとして2,6−ジメトキシベンゾニトリルオキシド(以下Bと省略することがある)を2.0当量添加し、70℃の温度で48時間攪拌して反応を行った。
【0054】
(1)ゲル化
上記の反応により、架橋高分子材料が形成されている否かを、生成物を有機溶媒に溶解させたときの状態によって確認した。
具体的には、各反応後の生成物を有機溶媒(高分子材料がPANの場合にはDMF、高分子材料がPAN以外の場合にはCHCl3)に浸し、浸したものが、ゲル状になるか、それともゲル状にならず溶解するかで、架橋高分子材料の生成の有無を確認した。
ゲル状になったもの、すなわち、架橋高分子材料が生成されているものを○と判定し、溶解したもの、すなわち、架橋高分子材料が生成されていないものを×と判定した。
【0055】
表1に示すように、全ての実施例は、生成物を有機溶媒に浸したところゲル状になったことから、PAN、NBR、NR又はEPDMである高分子材料が架橋された架橋高分子材料を室温から80℃の温度範囲において生成することができた。具体的には、PANについては50℃〜70℃の温度範囲において、NBRについては室温(約20℃)〜50℃の温度範囲において、NRについては50℃〜70℃の温度範囲において、EPDMについては50℃〜80℃の温度範囲において、それぞれ架橋されたものを生成することができた。
実施例5、7、9、11、12は、高分子材料の架橋を有機溶媒を用いないで行うことができた。
【0056】
(2)ニトリルオキシドの安定性
次に、実施例に用いた二官能性ニトリルオキシドの一つである、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)の安定性をNMR測定装置を用いて測定した。また、一つのベンゼン環に二つのニトリルオキシド基を有する2,3,5,6−テトラメチルベンゼン−1,4−ジニトリルオキシドについても同様に安定性を測定した。
具体的には、各試料をDMSO−d6に溶解し、それを80℃に加熱し、その状態で各試料の量が半減するまでの時間(半減期)をNMR測定装置で測定した。
【0057】
測定より、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)については、半減期が約2時間であった。
一方、2,3,5,6−テトラメチルベンゼン−1,4−ジニトリルオキシドについては、半減期が約1時間であった。
安定性の測定結果から、一つのベンゼン環に二つのニトリルオキシド基を有する二官能性ニトリルオキシドより、異なる芳香環にそれぞれ一つのニトリルオキシド基を有する二官能性ニトリルオキシドの方が安定であった。
【0058】
(3)物性測定
次に、二官能性ニトリルオキシドの配合率を1.0〜10質量%の範囲で変えた、フィルム状の実施例を作成した。また、架橋を行っていない又は架橋剤に硫黄若しくは過酸化物を用いたフィルム状の比較例も作成した。そして、これらの試料について、膨潤試験及び引張試験を行ってその物性を測定し、その結果を表2に示す。なお、表2の配合率欄における括弧内は、高分子材料の多重結合(炭素−炭素二重結合とニトリル基)に対するニトリルオキシドの官能基のモル分率である。また、網目鎖濃度の欄のE−0xは、10の負の累乗を表し、例えば、1.40E−05は、1.40×10−5を表している。
また、実施例21〜26、28,29及び比較例21、24のひずみと引張応力との関係のグラフを図1、2に示し、実施例30及び比較例24のひずみと引張応力との関係のグラフを図3に示す。
【0059】
【表2】

【0060】
本実施例及び比較例には、次のものを用いた。
高分子材料としては、NR(天然ゴム)、アクリロニトリルの質量比が33%のNBR(ニトリルゴム)を用いた。
実施例の架橋剤である二官能性ニトリルオキシドとしては、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)(以下Eと省略することがある)又は2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)(以下Fと省略することがある)を用いた。
比較例の架橋剤として、硫黄又は過酸化物を用いた。なお、過酸化物としては、ジクミルパーオキサイドを40質量%に希釈したものを用いた。
【0061】
次に各実施例について説明する。
実施例21は、クロロホルム50mLにNR2.57gを溶解させた溶液を直径60mmのフッ素樹脂製のシャーレに入れ、そこに、クロロホルム1mLに二官能性ニトリルオキシドのEを26.0mg溶解させた溶液を加え攪拌した。その後、攪拌子を取り除き、ダイヤフラムで10分間脱気(10Torr)した後、40℃のホットプレート上に置き、解放系で1日間静置した。そして、生成したフィルムをクロロホルム中に1日間浸漬させた後、大気中、室温で、及び、真空中、50℃で乾燥させて、淡黄色フィルム状の試料を作成した。
実施例22は、NRを2.55g、二官能性ニトリルオキシドのEを52.0mgにそれぞれ変更した以外は、実施例21と同じである。
実施例23は、NRを2.47g、二官能性ニトリルオキシドのEを130mgにそれぞれ変更した以外は、実施例21と同じである。
実施例24は、クロロホルム18mLにNR1.20gを溶解させた溶液を直径42mmのフッ素樹脂製のシャーレに入れて行ったことと、二官能性ニトリルオキシドのEを102mgに変更した以外は、実施例21と同じである。
実施例25は、NRを2.34g、二官能性ニトリルオキシドのEを260mgにそれぞれ変更した以外は、実施例21と同じである。
【0062】
実施例26は、アセトン50mLにNBR2.57gを溶解させた溶液を直径60mmのフッ素樹脂製のシャーレに入れ、そこに、アセトン1mLに二官能性ニトリルオキシドのEを26.0mg溶解させた溶液を加え攪拌した。その後、攪拌子を取り除き、ダイヤフラムで10分間脱気(10Torr)した後、35℃のホットプレート上に置き、解放系で1日間静置した。そして、生成したフィルムをクロロホルム中に1日間浸漬させた後、大気中、室温で、及び、真空中、50℃で乾燥させて、白濁色フィルム状の試料を作成した。
実施例27は、NBRを2.55g、二官能性ニトリルオキシドのEを52.0mgにそれぞれ変更した以外は、実施例26と同じである。
実施例28は、NBRを2.47g、二官能性ニトリルオキシドのEを130mgにそれぞれ変更した以外は、実施例26と同じである。
実施例29は、NBRを2.34g、二官能性ニトリルオキシドのEを260mgにそれぞれ変更した以外は、実施例26と同じである。
【0063】
実施例30は、アセトン40mLにNBR2.55gを溶解させた溶液を直径60mmのフッ素樹脂製のシャーレに入れ、そこに、アセトン1mLに二官能性ニトリルオキシドのFを52.0mg(108μmol)溶解させた溶液を加え攪拌した。その後、攪拌子を取り除き、ダイヤフラムで10分間脱気(10Torr)した後、35℃のホットプレート上に置き、解放系で1日間静置した。そして、生成したフィルムをアセトン中に1日間浸漬させた後、大気中、室温で、及び、真空中、50℃で乾燥させて、2.40g(92%)の無色フィルム状の試料を作成した。
【0064】
次に各比較例について説明する。
比較例21は、架橋されていないNRである。
比較例24は、架橋されていないNBRである。
【0065】
比較例22は、NR200gに、架橋剤として硫黄7gを配合したものを、JIS K 6299:2001「ゴム−試験用試料の作製方法」に準拠して作製した。
【0066】
比較例23は、NR200gに、架橋剤として過酸化物17.5gを配合したものを、JIS K 6299:2001「ゴム−試験用試料の作製方法」に準拠して作製した。
【0067】
(a)膨潤試験
上記のようにして作成したフィルム状の試料を用いて、1辺が1.0cmの正方形状の試験片を作成した。この試験片を洗浄し、よく乾燥させた後、有機溶媒(NRからなる試料にはトルエンを用い、NBRからなる試料にはジクロロメタンを用いた)中に浸漬させ、1日間静置して試験を行った。
このように、有機溶媒に浸漬させた試験片について、試験(浸漬)直後の重量から試験(浸漬)前の重量を引いた値を試験前の重量で割って、膨潤度を算出した。
また、次に示す修正Flory−Rehnerの式を用いて、網目鎖濃度vを算出した。
【数1】

V :有機溶媒(トルエン又はジクロロメタン)の分子容
g :試験前における試験片中の架橋高分子材料の容積分率
μ :有機溶媒と試料(NR又はNBR)との相互作用定数
VR:膨潤した試験片中の架橋高分子材料の容積分率
【0068】
(b)引張試験
引張試験は、JIS K 6251「加硫ゴム及び熱可塑性ゴム−引張特性の求め方」に準拠して試験を行った。
【0069】
物性測定の結果から、NR又はNBRに配合する2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)の量を多くすることにより、膨潤度及び切断時伸びの値は小さくなり、一方、網目鎖濃度の値は大きくなった。従って、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)により、NRを40℃において架橋することができ、また、NBRを35℃において架橋することができた。
【0070】
また、2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)を用いても、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)と同じように、NBRを35℃において架橋することができた。
【0071】
(4)加硫試験
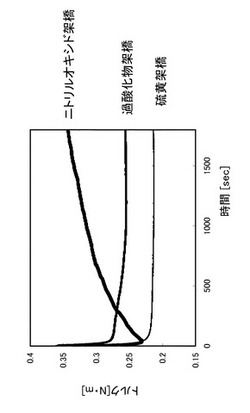
次に、架橋剤として、二官能性ニトリルオキシド、硫黄又は過酸化物を配合したNRの100℃における加硫特性をJIS K 6300−2「未加硫ゴム−物理特性−第2部:振動式加硫試験機による加硫特性の求め方」に準拠して測定し、その結果(加硫曲線)を図4に示す。また、各試料の配合を表3に示す。
また、二官能性ニトリルオキシドを配合したものについては、温度を70℃〜230℃の範囲で変更したときの加硫特性も同じく測定し、その結果(加硫曲線)を図5に示す。
【0072】
【表3】

【0073】
実施例の架橋剤である二官能性ニトリルオキシドとしては、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)(以下Eと省略することがある)を用いた。
過酸化物としては、ジクミルパーオキサイドを40質量%に希釈したものを用いた。
【0074】
加硫試験の結果としては、図4に示すように、100℃において、硫黄又は過酸化物を配合したものがまったく架橋の挙動を示さない(トルクが上昇しない)のに対し、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)を配合したものはトルクが徐々に上昇していることから、架橋反応の進行が示唆された。
また、図5に示すように、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)を配合したものは、初期の段階でのトルクの上昇があることから、70℃〜230℃の温度範囲において、架橋反応が起きている。また、70℃〜180℃の温度範囲において、加硫戻り(トルクが下降すること)がほぼ観られなかった。230℃においては若干観られた。このように、加硫戻りが生じない又は生じにくいのは、炭素−炭素の共有結合で架橋部が形成されていることによる。
この加硫試験の結果より、二官能性ニトリルオキシドは、硫黄等を用いた架橋と同じように、バンバリーミキサー等の混練装置を用いて高分子材料の架橋を行うことができる。
【0075】
以上より、本実施例の架橋剤によれば、PAN、NBR、NR、EPDMである高分子材料を、20℃〜230℃の温度範囲で架橋することができた。
また、これらの高分子材料が180℃以下の温度範囲で架橋された架橋高分子材料は、架橋戻りも生じなかった。
【0076】
なお、本発明は前記実施例に限定されるものではなく、発明の趣旨から逸脱しない範囲で適宜変更して具体化することもできる。
【技術分野】
【0001】
本発明は、架橋剤、高分子材料が架橋されてなる架橋高分子材料及び架橋高分子材料の製造方法に関するものである。
【背景技術】
【0002】
EPDM、NR、NBR等のように分子内に炭素−炭素二重結合を有するゴムの架橋は、一般的に硫黄によって行われている。これらのゴムを硫黄を用いて架橋するための実用加硫温度としては、150℃〜200℃の温度が必要となっている。そのため、架橋されたこれらのゴムは、加硫温度が高くなるにつれ架橋時の熱による劣化等によりゴムの特性が低下する懸念があった。その上、ゴム等を加熱するために多くのエネルギーが必要となっていた。そのため、加硫温度を低くすることが検討されており、その一つとして、各種促進剤等を組み合わせて使用する方法が検討されている。しかし、この方法では、加硫時間が長くなってしまい、実用化の域には至っていなかった。
【0003】
一方、低温でゴムを架橋する架橋剤として、特許文献1には、メシチレンジニトリルオキシド(MDNO)等のように、複数のニトリルオキシド基を分子内に有するポリニトリルオキシドが記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平11−180943号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、メシチレンジニトリルオキシド等のように一つの芳香環に二つのニトリルオキシド基を有するものや、ニトリルオキシド基のオルト位に水素原子があるもの、すなわち、ニトリルオキシド基のオルト位に置換基が導入されていないものは、安定性が悪く(段落0056、0057参照)、架橋剤として用いることができなかった。
【0006】
そこで、本発明は、分子内に炭素−炭素二重結合やニトリル基等を有するNBR等の高分子材料を通常より低い加硫温度で架橋できる架橋剤、NBR等の高分子材料がこの架橋剤により架橋されてなる架橋高分子材料及びこの架橋高分子材料の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
上記課題を解決するため、本発明の架橋剤は、分子内にニトリルオキシドと反応する多重結合を有する高分子材料の架橋に用いられる架橋剤であって、芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドよりなる。
【0008】
上記課題を解決するため、本発明の架橋高分子材料の製造方法は、芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドを用いて、高分子材料を架橋して架橋高分子材料を製造する。
【0009】
上記課題を解決するため、本発明の架橋高分子材料は、芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドにより、高分子材料が架橋されてなる。
【0010】
本発明における各要素の態様を以下に例示する。
【0011】
1.二官能性ニトリルオキシド
二官能性ニトリルオキシドとしては、特に限定はされないが、芳香環の一つの水素原子がニトリルオキシド基で置換され、そのニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造になっているとともに、この芳香族ニトリルオキシド誘導体構造の二つが、オキシ基を二つ有するジオキシ構造のこの二つのオキシ基にそれぞれ結合している、又は、カルボニル基を二つ有するジカルボニル構造のこの二つのカルボニル基にそれぞれ結合している構造をとることで、安定性が向上し、この二官能性ニトリルオキシドを架橋剤として用いることができる。
芳香環としては、特に限定はされないが、ベンゼン環、ナフタレン環等の複素環以外の芳香環であることが好ましい。
置換基としては、特に限定はされないが、アルキル基、アリール基等の炭化水素基や、オキシ基等が例示でき、安定性がより向上することから、オキシ基であることが好ましい。
ここで、アルキル基としては、特に限定はされないが、炭素数が1〜20の直鎖状又は分岐状のものが例示でき、好ましくは、炭素数が1〜4の直鎖状又は分岐状のものである、メチル基、エチル基、n−プロピル基、iso−プロピル基、n−ブチル基、sec−ブチル基、iso−ブチル基、tert−ブチル基である。
オキシ基としては、特に限定はされないが、アルコキシ基等の炭化水素オキシ基が例示できる。そして、芳香環がベンゼン環であるベンゾニトリルオキシド誘導体構造の場合には、少なくとも一方は、アルコキシ基であることが好ましい。また、ベンゾニトリルオキシド誘導体構造の二つの置換基のうち、一方がアルコキシ基である場合には、他方は、前記ジオキシ構造のオキシ基であることが好ましい。
ここで、アルコキシ基としては、特に限定はされないが、炭素数が1〜4の直鎖状又は分岐状のものが例示でき、好ましくは、炭素数が1〜3の直鎖状又は分岐状のものである、メトキシ基、エトキシ基、n−プロポキシ基、iso−プロポキシ基である。
【0012】
二官能性ニトリルオキシドの具体例としては、次に示す四つの化合物が例示できる。
・3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)
・2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)
・2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)
・2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)
【0013】
2.高分子材料
高分子材料は、二官能性ニトリルオキシドにより架橋されるよう、分子内にニトリルオキシドと反応する多重結合を有するものであれば、特に限定されることはない。
ここで、ニトリルオキシドと反応する多重結合としては、特に限定はされないが、C=S、N=N、P(V)=C、C=P(III)、C=As、C=C、C=N、C=Se、B=N、C≡P、C≡C、P(V)=N、C≡N、C=O等が例示できる。
高分子材料の具体例としては、分子内にニトリル基(C≡N)を有するPAN(ポリアクリロニトリル)、分子内に炭素−炭素二重結合(C=C)を有するNR(天然ゴム)、EPDM(エチレン−プロピレン−ジエン共重合ゴム)、分子内にニトリル基及び炭素−炭素二重結合を有するNBR(ニトリルゴム)等が例示できる。
【0014】
3.架橋過程
高分子材料を二官能性ニトリルオキシドで架橋する架橋過程は、排気設備や有機溶媒の回収設備等を設ける必要がないことから、有機溶媒を用いないで行うことが好ましく、硫黄を用いて架橋するときに使用する従来の設備を利用できることから、架橋過程を混練装置内で行うことがより好ましい。
ここで、混練装置としては、特に限定はされないが、バンバリーミキサー、インターミックス等の密閉式混練機や二軸押出機、単軸押出機、多軸押出機等の押出機等が例示できる。
一方、薄いシート状の成形体等が製造し易いことから、架橋過程は有機溶媒中で行うことが好ましい。
ここで、有機溶媒としては、特に限定はされないが、高分子材料及び二官能性ニトリルオキシドが共に溶解し易いものであることが好ましい。具体的には、クロロホルム、DMF(N,N−ジメチルホルムアミド)、アセトン等が例示できる。
架橋過程の温度としては、高分子材料が二官能性ニトリルオキシドで架橋される、すなわち、高分子材料と二官能性ニトリルオキシドとが反応する温度であれば、特に限定はされない。敢えていうならば、化学反応であることから温度が高ければ反応が促進され、また加熱等の温度調節を行わなければ製造工程の管理が容易になることから、0℃〜200℃であることが好ましい。さらにいうならば、高分子材料がNBR、NR、EPDM等のように、多重結合として少なくとも炭素−炭素二重結合を有するものである場合には、20℃〜200℃であることがより好ましく、PAN等のように、多重結合としてニトリル基のみを有するものである場合には、50℃〜200℃であることがより好ましい。
【発明の効果】
【0015】
本発明によれば、分子内に炭素−炭素二重結合やニトリル基等を有するNBR等の高分子材料を、通常より低い加硫温度(例えば、20℃〜150℃)で、または、通常の加硫温度(例えば、150℃〜200℃)では短時間で架橋できる架橋剤、NBR等の高分子材料がこの架橋剤により架橋されてなる架橋高分子材料及びこの架橋高分子材料の製造方法を提供することができる。
【図面の簡単な説明】
【0016】
【図1】二官能性ニトリルオキシドEを配合したNRのひずみと引張応力との関係のグラフである。
【図2】二官能性ニトリルオキシドEを配合したNBRのひずみと引張応力との関係のグラフである。
【図3】二官能性ニトリルオキシドFを配合したNBRのひずみと引張応力との関係のグラフである。
【図4】架橋剤を配合したNRの100℃における加硫曲線のグラフである。
【図5】二官能性ニトリルオキシドの架橋剤を配合したNRの70℃〜230℃における加硫曲線のグラフである。
【発明を実施するための形態】
【実施例】
【0017】
本発明の実施例として、以下に示す4種類の二官能性ニトリルオキシドを用いて、PAN、NBR、NR及びEPDMの4種類の高分子材料を架橋した。
また、比較例として、ニトリルオキシドの前駆体であるハロゲン化アルドキシムに塩基を作用させる方法又は一官能性ニトリルオキシドを用いる方法でPANとニトリルオキシドとを反応させた。
【0018】
それぞれの実施例及び比較例の製造(反応)条件びゲル化の有無を次の表1に示す。なお、表1の試薬の欄は、反応に用いた二官能性ニトリルオキシド等を示している。
【0019】
【表1】

【0020】
本実施例及び比較例には、次のものを用いた。
高分子材料としては、PAN(ポリアクリロニトリル)、NBR(ニトリルゴム)、NR(天然ゴム)、EPDM(エチレン−プロピレン−ジエン共重合ゴム)を用いた。このうち、NBRはアクリロニトリルの質量比が33%のものを、EPDMはジエンの質量比が10%のものを用いた。
【0021】
二官能性ニトリルオキシドとしては、次の<1>〜<4>に構造式を示す4種の化合物を用いた。
【0022】
<1>3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)・・・二官能性ニトリルオキシドC(化1参照)
【化1】

【0023】
この3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)は、次のようにして合成した。
【化2】

【0024】
・二官能性アルデヒド(3)の合成
化2に示すように、2,6−ジメトキシベンズアルデヒド(2)500mg(3.01mmol)を、無水トリフルオロ酢酸(TFAA)3.00mL中、アルゴン雰囲気下、室温で攪拌しているところに、イソフタル酸(1)209mg(1.43mmol)を加え、40℃に加熱し、1日間反応させた。そして、系を室温に戻し、クロロホルムを加えた後、純水および2N NaOHaq.(2Nの水酸化ナトリウム水溶液)で洗浄した。そして、溶媒を減圧濃縮して、560mg(1.21mmol、84%)のwhite solid(白色の固体)の二官能性アルデヒド(3)を得た。
【0025】
・二官能性オキシム(4)の合成
化2に示すように、二官能性アルデヒド(3)200mg(0.432mmol)を、EtOH(エタノール)5.00mL中、0℃で、空気中で懸濁させているところに、ヒドロキシルアミン塩酸塩167mg(2.41mmol)とNaOH120mg(3.01mmol)の純水1.00mLを滴下した。そして、室温で1時間反応させた後、50℃で2時間反応させた。そして、室温に戻してろ過し、純水およびクロロホルムで洗浄した残渣を乾燥させて、345mg(0.71mmol、71%)のwhite powder(白色の粉末)の二官能性オキシム(4)を得た。
【0026】
・二官能性ニトリルオキシドCの合成
化2に示すように、二官能性オキシム(4)2.50g(5.08mmol)を、クロロホルム50.0mL中、0℃で攪拌しているところに、トリエチルアミン1.55mL(10.7mmol)を滴下した後、N−クロロスクシンイミド(NCS)1.42g(11.2mmol)を加え、10分間反応させた。そして、反応溶液をクロロホルム/水の二相系に滴下した後、純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥させた後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)を少量のクロロホルムに溶解させ、酢酸エチル/ヘキサン=2/3(v/v)の混合溶媒中に再沈殿させて、1.90g(3.86mmol、76%)のwhite powder(白色の粉末)の二官能性ニトリルオキシドCを得た。
【0027】
<2>2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)・・・二官能性ニトリルオキシドD(化3参照)
【化3】

【0028】
この2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)は、次のようにして合成した。
【化4】

【0029】
・二官能性アルデヒド(7)の合成
化4に示すように、4,4’−メチレンビス(2,6−ジメチルフェノール)(6)3.78g(14.7mmol)と2−フルオロ−6−メトキシベンズアルデヒド(5)5.00g(32.4mmol)とを、DMF15mL中、アルゴン雰囲気下、室温で攪拌しているところに、炭酸カリウム4.48g(32.4mmol)を加えた後、140℃で4日間攪拌した。そして、系を室温に戻し、純水を加え酢酸エチルで抽出し、有機相を純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥した後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)をシリカゲルカラムクロマトグラフィー(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=2:1(v/v)、Rf=0.25)および再結晶(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=1:2(v/v))により精製して、4.91g(9.36mmol、64%)のcolorless crystal(無色の結晶)の二官能性アルデヒド(7)を得た。
【0030】
・二官能性オキシム(8)の合成
化4に示すように、二官能性アルデヒド(7)4.50g(8.58mmol)を、EtOH(エタノール)20mL中、0℃で、空気中で懸濁させているところに、ヒドロキシルアミン塩酸塩1.25g(18.0mmol)とNaOH1.03g(25.7mmol)の純水20mLを滴下した。そして、60℃で1日間反応させた後、ろ過し、純水およびクロロホルムで洗浄した残渣を乾燥させて、4.62g(8.33mmol、97%)のwhite powder(白色の粉末)の二官能性オキシム(8)を得た。
【0031】
・二官能性ニトリルオキシドDの合成
化4に示すように、二官能性オキシム(8)200mg(0.361mmol)を、クロロホルム1.8mL中、0℃で攪拌しているところに、トリエチルアミン110μL(0.793mmol)を滴下した後、N−クロロスクシンイミド(NCS)101mg(0.757mmol)を加え、10分間反応させた。そして、反応溶液を濾別した後、濾液に純水を加えクロロホルムで抽出し、有機相を純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥させた後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)をシリカゲルカラムクロマトグラフィー(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=3:2(v/v)、Rf=0.40(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=2:1(v/v)))により単離して、66.2mg(0.12mmol、33%)のwhite powder(白色の粉末)の二官能性ニトリルオキシドDを得た。
【0032】
<3>2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)・・・二官能性ニトリルオキシドE(化5参照)
【化5】

【0033】
この2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)は、次のようにして合成した。
【化6】

【0034】
・二官能性アルデヒド(10)の合成
化6に示すように、ビスフェノール誘導体(9)16.8g(59.0mmol)と2−フルオロ−6−メトキシベンズアルデヒド(5)20.0g(130mmol)とを、DMF59mL中、アルゴン雰囲気下、室温で攪拌しているところに、炭酸カリウム17.9g(130mmol)を加えた後、140℃で3日間攪拌した。そして、系を室温に戻し、純水を加えクロロホルムで抽出し、有機相を純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥した後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)をシリカゲルカラムクロマトグラフィー(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=1:1(v/v))により単離して、29.7g(91%)のwhite powder(白色の粉末)の二官能性アルデヒド(10)を得た。
【0035】
・二官能性オキシム(11)の合成
化6に示すように、二官能性アルデヒド(10)27.1g(49.0mmol)を、EtOH(エタノール)120mL中、0℃で、空気中で懸濁させているところに、ヒドロキシルアミン塩酸塩7.50g(108mmol)とNaOH5.88g(147mmol)の純水120mLを滴下した。そして、60℃で1日間反応させた後、ろ過し、純水およびBrine(ブライン)で洗浄しクロロホルムで抽出した。そして、有機相を無水硫酸マグネシウムで乾燥した後、濾別し、溶媒を減圧濃縮して、28.2g(99%)のwhite powder(白色の粉末)の二官能性オキシム(11)を得た。
【0036】
・二官能性ニトリルオキシドEの合成
化6に示すように、二官能性オキシム(11)1.0g(1.72mmol)を、クロロホルム120mL中、0℃で攪拌しているところに、トリエチルアミン717μL(5.15mmol)を滴下した後、N−クロロスクシンイミド(NCS)687mg(5.15mmol)を加え、20分間反応させた。そして、系に純水を加えた後、クロロホルムで抽出し、有機相を純水およびBrine(ブライン)で洗浄した。そして、無水硫酸マグネシウムで乾燥させた後、濾別し、溶媒を減圧濃縮してcrude(粗精製物)を得た。そして、このcrude(粗精製物)をシリカゲルカラムクロマトグラフィー(eluent(溶離剤);hexane(ヘキサン):AcOEt(酢酸エチル)=1:3(v/v))により単離して、975mg(98%)のwhite powder(白色の粉末)の二官能性ニトリルオキシドEを得た。
【0037】
<4>2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)・・・二官能性ニトリルオキシドF(化7参照)
【化7】

【0038】
この2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)は、次のようにして合成した。
【化8】

【0039】
・二官能性アルデヒド(14)の合成
化8に示すように、2−ヒドロキシ−1−ナフトアルデヒド(12)6.33g(36.8mmol)と1,8−ジブロモオクタン(13)3.38mL(18.4mmol)とを、DMF40mL中、空気中で、室温で攪拌しているところに、炭酸カリウム7.62g(55.2mmol)を加えた後、5時間還流した。そして、系を室温に戻し、純水を加えろ過し、残渣を乾燥させcrude(粗精製物)を得た。そして、このcrude(粗精製物)をクロロホルムから再結晶して、8.16g(18.0mmol、98%)のlight brown crystal(ライトブラウンの結晶)の二官能性アルデヒド(14)を得た。
【0040】
・二官能性オキシム(15)の合成
化8に示すように、二官能性アルデヒド(14)1.00g(2.20mmol)をEtOH(エタノール)10mL中、0℃で、空気中で懸濁させているところに、ヒドロキシルアミン塩酸塩336mg(4.84mmol)とNaOH264mg(6.60mmol)の純水10mLを滴下した。そして、室温で10分間反応させた後、純水を加え懸濁させた後、濾別し、残渣を純水で洗浄後、乾燥しcrude(粗精製物)を得た。そして、このcrude(粗精製物)のacetone(アセトン)可溶部を回収し、溶媒を減圧留去することで、493mg(1.02mmol、47%)のwhite powder(白色の粉末)の二官能性オキシム(15)を得た。
【0041】
・二官能性ニトリルオキシドFの合成
化8に示すように、二官能性オキシム(15)100mg(0.21mmol)をクロロホルム40mL中、0℃で攪拌し懸濁しているところに、トリエチルアミン86.2μL(0.62mmol)を滴下した後、N−クロロスクシンイミド(NCS)82.3mg(0.619mmol)を加え、15分間反応させた。そして、純水で洗浄し、無水硫酸マグネシウムで乾燥させた後、濾別し、溶媒を減圧濃縮して、99.2mg(0.21mmol、>99%)のlight brown crystal(ライトブラウンの結晶)の二官能性ニトリルオキシドFを得た。
【0042】
一官能性ニトリルオキシドとしては、次に構造式を示す化合物を用いた。
2,6−ジメトキシベンゾニトリルオキシド・・・B
【化9】

【0043】
ハロゲン化アルドキシムとしては、次に構造式を示す化合物を用いた。
・α−塩化ベンゾアルドキシム・・・A
【化10】

【0044】
次に各実施例について説明する。
実施例1は、DMF(N,N−ジメチルホルムアミド)の溶媒中にPANを溶解させ、そこに二官能性ニトリルオキシドとして3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)(以下Cと省略することがある)を0.1当量添加し、50℃の温度で1.5時間攪拌して反応を行った。
実施例2は、二官能性ニトリルオキシドとして2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)(以下Dと省略することがある)を用いるとともに、反応温度を70℃に変更した以外は実施例1と同じ条件で反応を行った。
【0045】
実施例3は、CHCl3(クロロホルム)の溶媒中にNBRを溶解させ、そこに二官能性ニトリルオキシドとしてCを0.1当量添加し、50℃の温度で1.5時間攪拌して反応を行った
実施例4は、二官能性ニトリルオキシドとしてDを用いるとともに、反応温度を室温(RT:約20℃)に変更した以外は実施例3と同じ条件で反応を行った。
【0046】
実施例5は、乳鉢中で、NBRに二官能性ニトリルオキシドとして2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)(以下Eと省略することがある)を0.1当量添加し、50℃の温度で1.5時間加圧混合して反応を行った。
【0047】
実施例6は、アセトンの溶媒中にNBRを溶解させ、そこに二官能性ニトリルオキシドとして2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)(以下Fと省略することがある)を0.1当量添加し、50℃の温度で24時間攪拌して反応を行った。また、この反応式を次に示す。
【0048】
【化11】

【0049】
実施例7は、二官能性ニトリルオキシドとしてFを用いた以外は、実施例5と同じ条件で反応を行った。
【0050】
実施例8は、CHCl3の溶媒中にNRを溶解させ、そこにEを0.1当量添加し、50℃の温度で1.5時間攪拌して反応を行った。
実施例9は、乳鉢中で、NRに二官能性ニトリルオキシドとしてEを0.1当量添加し、70℃の温度で1.5時間加圧混合して反応を行った。
【0051】
実施例10は、CHCl3の溶媒中にEPDMを溶解させ、そこにEを0.1当量添加し、50℃の温度で1.5時間攪拌して反応を行った。
実施例11は、乳鉢中で、EPDMに二官能性ニトリルオキシドとしてEを0.1当量添加し、50℃の温度で1.5時間加圧混合して反応を行った。
【0052】
実施例12は、液状EPDMに二官能性ニトリルオキシドとしてEを0.1当量添加し、80℃の温度で24時間攪拌して反応を行った。
【0053】
次に各比較例について説明する。
比較例1は、DMFの溶媒中にPANを溶解させ、そこにニトリルオキシドの前駆体としてα−塩化ベンゾアルドキシム(以下Aと省略することがある)を2.0当量添加するとともに添加剤としてEt3N(トリエチルアミン)を添加し、室温(RT:約20℃)で48時間攪拌して反応を行った。
比較例2は、DMFの溶媒中にPANを溶解させ、そこに一官能性ニトリルオキシドとして2,6−ジメトキシベンゾニトリルオキシド(以下Bと省略することがある)を2.0当量添加し、70℃の温度で48時間攪拌して反応を行った。
【0054】
(1)ゲル化
上記の反応により、架橋高分子材料が形成されている否かを、生成物を有機溶媒に溶解させたときの状態によって確認した。
具体的には、各反応後の生成物を有機溶媒(高分子材料がPANの場合にはDMF、高分子材料がPAN以外の場合にはCHCl3)に浸し、浸したものが、ゲル状になるか、それともゲル状にならず溶解するかで、架橋高分子材料の生成の有無を確認した。
ゲル状になったもの、すなわち、架橋高分子材料が生成されているものを○と判定し、溶解したもの、すなわち、架橋高分子材料が生成されていないものを×と判定した。
【0055】
表1に示すように、全ての実施例は、生成物を有機溶媒に浸したところゲル状になったことから、PAN、NBR、NR又はEPDMである高分子材料が架橋された架橋高分子材料を室温から80℃の温度範囲において生成することができた。具体的には、PANについては50℃〜70℃の温度範囲において、NBRについては室温(約20℃)〜50℃の温度範囲において、NRについては50℃〜70℃の温度範囲において、EPDMについては50℃〜80℃の温度範囲において、それぞれ架橋されたものを生成することができた。
実施例5、7、9、11、12は、高分子材料の架橋を有機溶媒を用いないで行うことができた。
【0056】
(2)ニトリルオキシドの安定性
次に、実施例に用いた二官能性ニトリルオキシドの一つである、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)の安定性をNMR測定装置を用いて測定した。また、一つのベンゼン環に二つのニトリルオキシド基を有する2,3,5,6−テトラメチルベンゼン−1,4−ジニトリルオキシドについても同様に安定性を測定した。
具体的には、各試料をDMSO−d6に溶解し、それを80℃に加熱し、その状態で各試料の量が半減するまでの時間(半減期)をNMR測定装置で測定した。
【0057】
測定より、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)については、半減期が約2時間であった。
一方、2,3,5,6−テトラメチルベンゼン−1,4−ジニトリルオキシドについては、半減期が約1時間であった。
安定性の測定結果から、一つのベンゼン環に二つのニトリルオキシド基を有する二官能性ニトリルオキシドより、異なる芳香環にそれぞれ一つのニトリルオキシド基を有する二官能性ニトリルオキシドの方が安定であった。
【0058】
(3)物性測定
次に、二官能性ニトリルオキシドの配合率を1.0〜10質量%の範囲で変えた、フィルム状の実施例を作成した。また、架橋を行っていない又は架橋剤に硫黄若しくは過酸化物を用いたフィルム状の比較例も作成した。そして、これらの試料について、膨潤試験及び引張試験を行ってその物性を測定し、その結果を表2に示す。なお、表2の配合率欄における括弧内は、高分子材料の多重結合(炭素−炭素二重結合とニトリル基)に対するニトリルオキシドの官能基のモル分率である。また、網目鎖濃度の欄のE−0xは、10の負の累乗を表し、例えば、1.40E−05は、1.40×10−5を表している。
また、実施例21〜26、28,29及び比較例21、24のひずみと引張応力との関係のグラフを図1、2に示し、実施例30及び比較例24のひずみと引張応力との関係のグラフを図3に示す。
【0059】
【表2】

【0060】
本実施例及び比較例には、次のものを用いた。
高分子材料としては、NR(天然ゴム)、アクリロニトリルの質量比が33%のNBR(ニトリルゴム)を用いた。
実施例の架橋剤である二官能性ニトリルオキシドとしては、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)(以下Eと省略することがある)又は2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)(以下Fと省略することがある)を用いた。
比較例の架橋剤として、硫黄又は過酸化物を用いた。なお、過酸化物としては、ジクミルパーオキサイドを40質量%に希釈したものを用いた。
【0061】
次に各実施例について説明する。
実施例21は、クロロホルム50mLにNR2.57gを溶解させた溶液を直径60mmのフッ素樹脂製のシャーレに入れ、そこに、クロロホルム1mLに二官能性ニトリルオキシドのEを26.0mg溶解させた溶液を加え攪拌した。その後、攪拌子を取り除き、ダイヤフラムで10分間脱気(10Torr)した後、40℃のホットプレート上に置き、解放系で1日間静置した。そして、生成したフィルムをクロロホルム中に1日間浸漬させた後、大気中、室温で、及び、真空中、50℃で乾燥させて、淡黄色フィルム状の試料を作成した。
実施例22は、NRを2.55g、二官能性ニトリルオキシドのEを52.0mgにそれぞれ変更した以外は、実施例21と同じである。
実施例23は、NRを2.47g、二官能性ニトリルオキシドのEを130mgにそれぞれ変更した以外は、実施例21と同じである。
実施例24は、クロロホルム18mLにNR1.20gを溶解させた溶液を直径42mmのフッ素樹脂製のシャーレに入れて行ったことと、二官能性ニトリルオキシドのEを102mgに変更した以外は、実施例21と同じである。
実施例25は、NRを2.34g、二官能性ニトリルオキシドのEを260mgにそれぞれ変更した以外は、実施例21と同じである。
【0062】
実施例26は、アセトン50mLにNBR2.57gを溶解させた溶液を直径60mmのフッ素樹脂製のシャーレに入れ、そこに、アセトン1mLに二官能性ニトリルオキシドのEを26.0mg溶解させた溶液を加え攪拌した。その後、攪拌子を取り除き、ダイヤフラムで10分間脱気(10Torr)した後、35℃のホットプレート上に置き、解放系で1日間静置した。そして、生成したフィルムをクロロホルム中に1日間浸漬させた後、大気中、室温で、及び、真空中、50℃で乾燥させて、白濁色フィルム状の試料を作成した。
実施例27は、NBRを2.55g、二官能性ニトリルオキシドのEを52.0mgにそれぞれ変更した以外は、実施例26と同じである。
実施例28は、NBRを2.47g、二官能性ニトリルオキシドのEを130mgにそれぞれ変更した以外は、実施例26と同じである。
実施例29は、NBRを2.34g、二官能性ニトリルオキシドのEを260mgにそれぞれ変更した以外は、実施例26と同じである。
【0063】
実施例30は、アセトン40mLにNBR2.55gを溶解させた溶液を直径60mmのフッ素樹脂製のシャーレに入れ、そこに、アセトン1mLに二官能性ニトリルオキシドのFを52.0mg(108μmol)溶解させた溶液を加え攪拌した。その後、攪拌子を取り除き、ダイヤフラムで10分間脱気(10Torr)した後、35℃のホットプレート上に置き、解放系で1日間静置した。そして、生成したフィルムをアセトン中に1日間浸漬させた後、大気中、室温で、及び、真空中、50℃で乾燥させて、2.40g(92%)の無色フィルム状の試料を作成した。
【0064】
次に各比較例について説明する。
比較例21は、架橋されていないNRである。
比較例24は、架橋されていないNBRである。
【0065】
比較例22は、NR200gに、架橋剤として硫黄7gを配合したものを、JIS K 6299:2001「ゴム−試験用試料の作製方法」に準拠して作製した。
【0066】
比較例23は、NR200gに、架橋剤として過酸化物17.5gを配合したものを、JIS K 6299:2001「ゴム−試験用試料の作製方法」に準拠して作製した。
【0067】
(a)膨潤試験
上記のようにして作成したフィルム状の試料を用いて、1辺が1.0cmの正方形状の試験片を作成した。この試験片を洗浄し、よく乾燥させた後、有機溶媒(NRからなる試料にはトルエンを用い、NBRからなる試料にはジクロロメタンを用いた)中に浸漬させ、1日間静置して試験を行った。
このように、有機溶媒に浸漬させた試験片について、試験(浸漬)直後の重量から試験(浸漬)前の重量を引いた値を試験前の重量で割って、膨潤度を算出した。
また、次に示す修正Flory−Rehnerの式を用いて、網目鎖濃度vを算出した。
【数1】

V :有機溶媒(トルエン又はジクロロメタン)の分子容
g :試験前における試験片中の架橋高分子材料の容積分率
μ :有機溶媒と試料(NR又はNBR)との相互作用定数
VR:膨潤した試験片中の架橋高分子材料の容積分率
【0068】
(b)引張試験
引張試験は、JIS K 6251「加硫ゴム及び熱可塑性ゴム−引張特性の求め方」に準拠して試験を行った。
【0069】
物性測定の結果から、NR又はNBRに配合する2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)の量を多くすることにより、膨潤度及び切断時伸びの値は小さくなり、一方、網目鎖濃度の値は大きくなった。従って、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)により、NRを40℃において架橋することができ、また、NBRを35℃において架橋することができた。
【0070】
また、2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)を用いても、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)と同じように、NBRを35℃において架橋することができた。
【0071】
(4)加硫試験
次に、架橋剤として、二官能性ニトリルオキシド、硫黄又は過酸化物を配合したNRの100℃における加硫特性をJIS K 6300−2「未加硫ゴム−物理特性−第2部:振動式加硫試験機による加硫特性の求め方」に準拠して測定し、その結果(加硫曲線)を図4に示す。また、各試料の配合を表3に示す。
また、二官能性ニトリルオキシドを配合したものについては、温度を70℃〜230℃の範囲で変更したときの加硫特性も同じく測定し、その結果(加硫曲線)を図5に示す。
【0072】
【表3】

【0073】
実施例の架橋剤である二官能性ニトリルオキシドとしては、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)(以下Eと省略することがある)を用いた。
過酸化物としては、ジクミルパーオキサイドを40質量%に希釈したものを用いた。
【0074】
加硫試験の結果としては、図4に示すように、100℃において、硫黄又は過酸化物を配合したものがまったく架橋の挙動を示さない(トルクが上昇しない)のに対し、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)を配合したものはトルクが徐々に上昇していることから、架橋反応の進行が示唆された。
また、図5に示すように、2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)を配合したものは、初期の段階でのトルクの上昇があることから、70℃〜230℃の温度範囲において、架橋反応が起きている。また、70℃〜180℃の温度範囲において、加硫戻り(トルクが下降すること)がほぼ観られなかった。230℃においては若干観られた。このように、加硫戻りが生じない又は生じにくいのは、炭素−炭素の共有結合で架橋部が形成されていることによる。
この加硫試験の結果より、二官能性ニトリルオキシドは、硫黄等を用いた架橋と同じように、バンバリーミキサー等の混練装置を用いて高分子材料の架橋を行うことができる。
【0075】
以上より、本実施例の架橋剤によれば、PAN、NBR、NR、EPDMである高分子材料を、20℃〜230℃の温度範囲で架橋することができた。
また、これらの高分子材料が180℃以下の温度範囲で架橋された架橋高分子材料は、架橋戻りも生じなかった。
【0076】
なお、本発明は前記実施例に限定されるものではなく、発明の趣旨から逸脱しない範囲で適宜変更して具体化することもできる。
【特許請求の範囲】
【請求項1】
分子内にニトリルオキシドと反応する多重結合を有する高分子材料の架橋に用いられる架橋剤であって、
芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドよりなる架橋剤。
【請求項2】
前記置換基は、オキシ基である請求項1記載の架橋剤。
【請求項3】
前記二官能性ニトリルオキシドは、
3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)、
2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)、
2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)又は
2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)である請求項2記載の架橋剤。
【請求項4】
芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドを用いて、高分子材料を架橋して架橋高分子材料を製造する架橋高分子材料の製造方法。
【請求項5】
前記置換基は、オキシ基である請求項4記載の架橋高分子材料の製造方法。
【請求項6】
前記二官能性ニトリルオキシドは、
3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)、
2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)、
2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)又は
2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)である請求項5記載の架橋高分子材料の製造方法。
【請求項7】
前記高分子材料は、PAN、NBR、NR又はEPDMである請求項4〜6のいずれか一項に記載の架橋高分子材料の製造方法。
【請求項8】
前記高分子材料を前記二官能性ニトリルオキシドで架橋する架橋過程は、有機溶媒を用いないで行う請求項4〜7のいずれか一項に記載の架橋高分子材料の製造方法。
【請求項9】
前記架橋過程を混練装置内で行う請求項8記載の架橋高分子材料の製造方法。
【請求項10】
前記高分子材料を前記二官能性ニトリルオキシドで架橋する架橋過程は、有機溶媒中で行う請求項4〜7のいずれか一項に記載の架橋高分子材料の製造方法。
【請求項11】
芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドにより、高分子材料が架橋されてなる架橋高分子材料。
【請求項12】
前記置換基は、オキシ基である請求項11記載の架橋高分子材料。
【請求項13】
前記二官能性ニトリルオキシドは、
3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)、
2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)、
2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)又は
2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)である請求項12記載の架橋高分子材料。
【請求項14】
前記高分子材料は、PAN、NBR、NR又はEPDMである請求項11〜13のいずれか一項に記載の架橋高分子材料。
【請求項1】
分子内にニトリルオキシドと反応する多重結合を有する高分子材料の架橋に用いられる架橋剤であって、
芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドよりなる架橋剤。
【請求項2】
前記置換基は、オキシ基である請求項1記載の架橋剤。
【請求項3】
前記二官能性ニトリルオキシドは、
3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)、
2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)、
2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)又は
2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)である請求項2記載の架橋剤。
【請求項4】
芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドを用いて、高分子材料を架橋して架橋高分子材料を製造する架橋高分子材料の製造方法。
【請求項5】
前記置換基は、オキシ基である請求項4記載の架橋高分子材料の製造方法。
【請求項6】
前記二官能性ニトリルオキシドは、
3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)、
2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)、
2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)又は
2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)である請求項5記載の架橋高分子材料の製造方法。
【請求項7】
前記高分子材料は、PAN、NBR、NR又はEPDMである請求項4〜6のいずれか一項に記載の架橋高分子材料の製造方法。
【請求項8】
前記高分子材料を前記二官能性ニトリルオキシドで架橋する架橋過程は、有機溶媒を用いないで行う請求項4〜7のいずれか一項に記載の架橋高分子材料の製造方法。
【請求項9】
前記架橋過程を混練装置内で行う請求項8記載の架橋高分子材料の製造方法。
【請求項10】
前記高分子材料を前記二官能性ニトリルオキシドで架橋する架橋過程は、有機溶媒中で行う請求項4〜7のいずれか一項に記載の架橋高分子材料の製造方法。
【請求項11】
芳香環の一つの水素原子がニトリルオキシド基で置換され、前記ニトリルオキシド基のオルト位にある水素原子の全てがニトリルオキシド基以外の置換基で置換された芳香族ニトリルオキシド誘導体構造を有し、二つの前記芳香族ニトリルオキシド誘導体構造が、オキシ基を二つ有するジオキシ構造の該二つのオキシ基、又は、カルボニル基を二つ有するジカルボニル構造の該二つのカルボニル基、にそれぞれ結合してなる二官能性ニトリルオキシドにより、高分子材料が架橋されてなる架橋高分子材料。
【請求項12】
前記置換基は、オキシ基である請求項11記載の架橋高分子材料。
【請求項13】
前記二官能性ニトリルオキシドは、
3,3’−[1,3−フェニレンビス(カルボニル)]ビス(2,6−ジメトキシベンゾニトリルオキシド)、
2,2’−[メチレンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)、
2,2’−[イソプロピリデンビス[(2,6−ジメチル−4,1−フェニレン)オキシ]]ビス(6−メトキシベンゾニトリルオキシド)又は
2,2’−オクタメチレンビス(オキシ)ビス(1−ナフトニトリルオキシド)である請求項12記載の架橋高分子材料。
【請求項14】
前記高分子材料は、PAN、NBR、NR又はEPDMである請求項11〜13のいずれか一項に記載の架橋高分子材料。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−208117(P2011−208117A)
【公開日】平成23年10月20日(2011.10.20)
【国際特許分類】
【出願番号】特願2010−182864(P2010−182864)
【出願日】平成22年8月18日(2010.8.18)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発行者名 社団法人高分子学会 刊行物名 精密ネットワークポリマー研究会 第3回若手シンポジウム講演要旨集 発行日 平成22年3月4日(2010年3月4日)
【出願人】(000241463)豊田合成株式会社 (3,467)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
【公開日】平成23年10月20日(2011.10.20)
【国際特許分類】
【出願日】平成22年8月18日(2010.8.18)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発行者名 社団法人高分子学会 刊行物名 精密ネットワークポリマー研究会 第3回若手シンポジウム講演要旨集 発行日 平成22年3月4日(2010年3月4日)
【出願人】(000241463)豊田合成株式会社 (3,467)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
[ Back to top ]

