染色体外ヒストンH2Bを介する二本鎖DNA認識機構の利用
【課題】 自然免疫機構における二本鎖DNAを認識する機序を詳細にあきらかとすること。
【解決手段】 ヒストンH2Bがヌクレオソーム形成としての役割だけでなく、外来二本鎖DNAを認識して細胞内シグナルを活性化し、I型インターフェロン産生に重要な役割を果たしていることをあきらかとした。本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体を提供する。また、本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体の調節因子をスクリーニングする方法、染色体外ヒストンH2Bと二本鎖DNAとの複合体による細胞内シグナル伝達の調節因子をスクリーニングする方法なども提供する。
【解決手段】 ヒストンH2Bがヌクレオソーム形成としての役割だけでなく、外来二本鎖DNAを認識して細胞内シグナルを活性化し、I型インターフェロン産生に重要な役割を果たしていることをあきらかとした。本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体を提供する。また、本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体の調節因子をスクリーニングする方法、染色体外ヒストンH2Bと二本鎖DNAとの複合体による細胞内シグナル伝達の調節因子をスクリーニングする方法なども提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、染色体外ヒストンH2Bと二本鎖DNAの複合体及びその用途に関する。
【背景技術】
【0002】
自然免疫機構はウイルス由来の核酸(B-DNA、immunostimulatory RNA)を認識して抗ウイルス防御機構を活性化することがあきらかとされ(非特許文献1)、またその一部の機序はDNAワクチンの免疫原性にも重要であることが報告されている (非特許文献2)。
【0003】
しかしながら、二本鎖DNAを認識する機序は詳細にあきらかとされておらず、抗ウイルス剤への応用、遺伝子を利用した治療方法の効果を増強させるための薬剤または方法への応用の試みはされていない。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Nature 441:101 2006, Nat Immunol 7:40 2006
【非特許文献2】Nature 451:725 2008, Curr Opin Immunol 20:383 2008
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、自然免疫機構における二本鎖DNAを認識する機序を詳細にあきらかとすることを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、ヒストンH2Bがヌクレオソーム形成としての役割だけでなく、外来二本鎖DNAを認識して細胞内シグナルを活性化し、I型インターフェロン産生に重要な役割を果たしていることをあきらかとした。ヒストンH2Bをノックダウンすることにより、パピローマウイルス、単純ヘルペスウイルス、アデノウイルス、ヒト免疫不全ウイルスの細胞内複製が著明に亢進することから、抗ウイルス自然免疫機構において重要であることがあきらかとなった。また、二本鎖DNAによるI型インターフェロンの誘導は遺伝子ワクチンの免疫原性に重要であることをすでにあきらかにしていることから、このメカニズムを調節しているヒストンH2Bは遺伝子を利用した治療方法の効果を決定づける重要な要素であることが示唆された。そこで、ヒストンH2Bまたはそれに相互作用するアダプター分子CIAOの発現量を増加させるまたは修飾する物質または方法により抗ウイルス剤としての応用、遺伝子を介する治療方法(DNAワクチン、遺伝子治療)の効果を増強させる方法の確立が可能となると考えられた。
【0007】
本発明の要旨は以下の通りである。
(1)染色体外ヒストンH2Bと二本鎖DNAとの複合体。
(2)さらにアダプター分子を含む(1)記載の複合体。
(3)アダプター分子がCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)及び/又はIPS-1(Interferon-βPromoter Stimulator 1)である(2)記載の複合体。
(4)染色体外ヒストンH2Bと二本鎖DNAとの複合体の調節因子をスクリーニングする方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む前記方法。
(5)染色体外ヒストンH2Bと二本鎖DNAとの複合体による細胞内シグナル伝達の調節因子をスクリーニングする方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む前記方法。
(6)二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞の製造方法であって、前記哺乳動物細胞における染色体外ヒストンH2Bの発現量を減少させることを含む前記方法。
(7)染色体外ヒストンH2Bの発現量を減少させることによって、二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞。
(8)哺乳動物における免疫応答を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
(9)下記の(a)及び/又は(b)により、前記細胞内シグナル伝達を調節する(8)記載の方法。
(a) 染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加又は減少させること
(b) 染色体外ヒストンH2B及び/又はそのアダプター分子を修飾すること
(10)哺乳動物におけるI型インターフェロン誘導を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
(11)哺乳動物におけるウイルスの増殖を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
(12)哺乳動物における遺伝子を利用した治療方法の効果を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
(13)ウイルスを製造する方法であって、哺乳動物又はその細胞における染色体外ヒストンH2Bの発現量を減少させること、及び前記哺乳動物又はその細胞をウイルスに感染させることを含む前記方法。
【発明の効果】
【0008】
二本鎖DNA認識のあらたな機序をあきらかとし、その機序を調節することにより、ウイルスに対する抵抗性を調節することに成功した。
【図面の簡単な説明】
【0009】
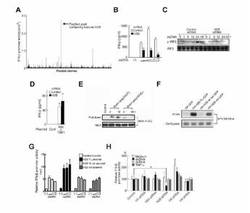
【図1】ヒストンH2BはdsDNAによって誘導される細胞活性化を媒介する。(A)dsDNAによって誘導されるIFN-βプロモーターの活性化の媒介能に基づいて、ヒト骨髄cDNA発現ライブラリーのスクリーニングを行った。(B〜D)HEK293細胞に対照siRNA又はH2Bを標的とするsiRNAを導入した。(B)細胞をdsDNA(poly(dA・dT))0、0.1、0.5又は2.5 μg/mLで処理し、ELISA法により上清のIFN-β(PBL)を測定した。(C)細胞をdsDNA(poly(dA・dT))0.5 μg/mLで0、3、6、12、24及び48時間処理し、イムノブロット解析により核内のリン酸化IRF3(p-IRF3)及び全細胞ライセート(Cell Lysate)中のIRF3(標準化のための対照)を検討した。(D)さらに、細胞にTBK1及びIKKiの発現プラスミドを導入し、ELISA法により上清のIFN-β(PBL)を測定した。(E)HEK293細胞にヒストンH2B-FLAGを導入し、ビオチン-poly(dA・dT)又はビオチン-poly(dG・dC)で処理した。細胞のライセートを回収し、ストレプトアビジンアガロースによりプルダウンアッセイを行った。抗FLAG Abを用いてイムノブロット法により複合体を解析した。(F)HEK293細胞に、HA-GFP、HA-H2B-GFP、HA-H2B N'-テール-GFP又はHA-H2B αH-GFPを導入した。第1のトランスフェクションの24時間後、さらに細胞にHPV 18ゲノムを導入した。第2のトランスフェクションの48時間後、細胞のライセートを回収し、抗HA Abにより免疫沈降反応を行った。HPV18 E6遺伝子を標的とする標準PCRを、各細胞ライセート及び免疫沈降複合体により行った。(G)HEK293細胞にH2B siRNAを導入し、次いでさらにpGL3 IFN-β及びpTK-RL+対照、H2B FL、H2B NLSドメイン又はH2B αHドメイン発現プラスミドを導入した。dsDNA(poly(dA・dT))0、0.1、0.5又は2.5 μg/mLで24時間処理後、ルシフェラーゼアッセイを行った。(H)HEK293に対照siRNA又はH2B、H1、H2A、H3、H4のいずれかを標的とするsiRNAを導入した。さらに、細胞にpGL3 IFN-β及びpTK-RLを導入し、0.5 μg/mLのdsDNA(poly(dA・dT))、dsRNA(poly(I:C))又はTNF-α(50 ng/mL)で24時間処理あり又は処理なしで、次いでルシフェラーゼアッセイを行った。ルシフェラーゼ活性は、各刺激において対照siRNAで処理された細胞から得られた試料に対するIFN-βプロモーター活性として示された(相対的IFN-βプロモーター活性)。(A)を除き、データはいずれも6〜8試料の平均値±SDで表す。*はp < 0.05。
【図2】ヒストンH2Bは、dsRNAやTLRリガンドではなく、dsDNAがトリガーとなるシグナル活性化に関与する。HEK293(A、B、D及びE)又はHUVEC(C)細胞に、対照siRNA又はH2B、ZBP1、RIG-Iのいずれかを標的とするsiRNAを導入した。(A及びB)さらに、pGL3 IFN-β+pTK-RLの存在下で、細胞にヒストンH2B、ZBP1及びRIG-Iの発現プラスミドを導入した。(A)トランスフェクションの24時間後、dsDNA(poly(dA・dT))0、0.1、0.5又は2.5 μg/mLで24時間処理後、ルシフェラーゼアッセイを行った。(B)トランスフェクションの24時間後、抗RIG-I、抗ZBP1、抗H2B又は抗-β-アクチンAbを用いてイムノブロット解析によりタンパク質発現のレベルを検討した。(C)細胞をdsDNA(poly(dA・dT))又は5'-三リン酸化RNA(ppp-RNA)0.1又は1.0 μg/mLで24時間処理し、ELISA法により上清のIFN-βを測定した。(D)さらに、細胞にpNF-κB-Luc+pTK-RLを導入し、TNF-α(50 ng/mL)で8時間処理あり又は処理なしで、ルシフェラーゼアッセイを行った。(E)さらに、TLR2又はTLR4+MD2の発現プラスミドの存在下で、細胞にpNF-κB-Luc+pTK-RLを導入し、ペプチドグリカン(PGN、1 μg/mL)又はLPS(100 ng/mL)で24時間処理あり又は処理なしで、ルシフェラーゼアッセイを行った。*はp < 0.05、***はp < 0.001。
【図3】染色体外ヒストンH2Bは、IPS-1と相互作用する。(A)HeLa細胞に対照又はH2B siRNAを導入した。トランスフェクションの12時間後、細胞を固定し、ヘキスト33258及び抗H2B Ab、その後Alexa 488結合抗マウスIgG Abで染色し、共焦点顕微鏡下で検討した。低い及び高い照明条件で写真を撮り、それぞれ「Low」及び「High」で示した。尺度バー=20 μm。(B)細胞をH2B siRNA処理の0、6又は12時間後に回収し、細胞のライセートを細胞質の抽出物、細胞核抽出物及び染色体画分に分画した。各画分を、抗H2B、GAPDH又はSp1 Abを用いてイムノブロット法により解析した。各H2Bバンドの密度を、対応するGAPDHバンド(細胞質の抽出物)又はSp1バンド(細胞核抽出物及び染色体画分)の密度によって正規化し、グラフ(n=3)として示した。(C)12又は24時間dsDNA又はdsRNAによる又はよらない刺激の後、HeLa細胞を固定し、抗H2B Ab及び抗-IPS-1 Ab、その後Alexa 488結合抗マウスIgG Ab及びAlexa 555結合抗ウサギIgG Abで染色した。次いで、細胞を共焦点顕微鏡下で検討した。尺度バー=100 μm(低拡大倍率写真[上のパネル])及び50 μm(高拡大倍率写真[下のパネル])。(D)HEK293細胞をdsDNA刺激の0、12又は24時間後に回収し、細胞のライセートを細胞質の抽出物及び細胞核抽出物に分画した。各画分を、対照IgG、抗H2B又は抗MAVS Abで免疫沈降した。免疫複合物を、抗H2B又は抗MAVS Abのいずれかを用いてイムノブロット法により解析した。*はp < 0.05。
【図4】CIAOはヒストンH2B及びIPS-1と結合してシグナル伝達複合体となり、それによりI型IFN産生を導くシグナルを伝達する。(A及びC〜F)図に示す発現プラスミドを導入したHEK293細胞のライセートを抗FLAG抗体で免疫沈降した。この免疫複合体を抗HA抗体又は抗FLAG抗体を用いてイムノブロット法により解析した。(B)ヒストンH2B、IPS-1又はCIAOをコードするCFP及びYFP融合タンパク質を導入した293-F細胞。FRETは、CFP励起により得られるYFP発光をCFP励起により得られるCFP発光で割った値として示す。(C〜F)CIAO、IPS-1、H2B及びそれらの欠失変異体の概略図を示す。「α」は、CIAO及びH2Bの推定αヘリックス領域を示す。「*」は、標的分子の予測された遺伝子産物を示す。(G)HeLa細胞に対照siRNA又はCIAO siRNAを導入した。抗インポーチン9(C末端)モノクローナルAbを用いてイムノブロット解析を行った。(H〜I)HeLa細胞に、図に示すレポータープラスミド+図に示す量(ng)の発現プラスミドを導入した、又は導入しなかった。図1の説明に従ってルシフェラーゼアッセイを行った。データは6〜8試料の相対ルシフェラーゼ活性の平均値±SDで表す。*はp < 0.05。
【図5】dsDNAを介するシグナル伝達におけるヒストンH2B及びIPS-1の種特異的関与。(A及びB)HeLa又はNIH3T3細胞に、対照siRNA又はH2B siRNAのいずれかを導入した。(A)さらに、細胞にpGL3 IFN-β及びpTK-RLを導入し、dsDNA(poly(dA・dT))0、0.1、0.5又は2.5 μg/mLで24時間処理後、ルシフェラーゼアッセイを行った。(B)イムノブロット解析によりH2Bタンパク質発現のレベルを検討した。(C)HEK293細胞にヒト又はマウスIPS-1及びCIAOの発現プラスミドを導入した後、免疫沈降反応解析を実施した。(D)マウス又はヒトIPS-1を安定して補ったIPS-1-/- MEFを、0.5 μg/mLのdsDNA(poly(dA・dT))で3、6、12、24、36及び48時間刺激した。細胞に対して、Ifnb1 mRNA及び18S rRNAについてリアルタイムPCR解析を行った。Ifnb1 mRNAのレベルを、18S rRNAの対応するレベルで正規化し、グラフとして示した(n=4)。*はp < 0.05、**はp < 0.01。
【図6】ヒストンH2BはDNAウイルスの複製の抑制に極めて重要な要素の1つである。(A〜E)HEK293細胞(A及びC)、SCC-4(B)、NIH3T3(D)又はHeLa細胞(E)を対照siRNA又はH2B siRNAで前処理した。(A)細胞をMVAdE3L(1×105又は1×107 pfu)に感染させた。感染の24時間後に、細胞ライセートの総STAT1、リン酸化STAT1(p-STAT1)又はERKをイムノブロット法により検討した。(B)細胞にHPV-11又はHPV-16ゲノムを導入し、トランスフェクションの24、36、60又は72時間後にエピソームDNA画分を回収した。PCRによりウイルス増殖を測定した。(C及びD)細胞をAdV 5型又はMCMV MW97.01に感染させた。感染の24時間後に、ウイルスゲノムDNAのPCR増幅及びプラークアッセイ(AdV)又はTCID50(MCMV)測定によりウイルス増殖を測定した。(E)細胞をEMCVに感染させた。感染の24時間後に、プラークアッセイによりウイルス増殖を測定した。*はp < 0.05、**はp < 0.01。
【図7】ヒストンH2B siRNAの効果。HeLa細胞にコントロールもしくは様々な組合わせのヒストンH2Bを標的にしたsiRNAをトランスフェクトし、免疫ブロッティング法によりヒストンH2Bの発現量を検討した。用いたsiRNAの配列は以下のとおり。histone H2Bf116 (#1) sense, 5’-CCG UUU ACG UGU ACA AGG UGC UGA A-3’(配列番号9); histone H2Bf116 (#1) antisense, 5’-UUC AGC ACC UUG UAC ACG UAA ACG G-3’ (配列番号10);histone H2Bf169 (#2) sense, 5’-UCC AAG GCC AUG GGC AUC AUG AAC U-3’ (配列番号11); histone H2Bf169 (#2) antisense, 5’-AGU UCA UGA UGC CCA UGG CCU UGG A-3’ (配列番号12);histone H2Bj67 (#3) sense, 5’-CAG AAG AAG GAU GGC AAG AAG CGU A-3’ (配列番号45); histone H2Bj67 (#3) antisense, 5’-UAC GCU UCU UGC CAU CCU UCU UCU G-3’ (配列番号46);histone H2Bb67ms (#4) sense, 5’-CAG AAG AAA GAU GGC AAG AAG CGC A-3’ (配列番号47); histone H2Bb67ms (#4) antisense, 5’-UGC GCU UCU UGC CAU CUU UCU UCU G-3’ (配列番号48). ヒストンH2Bに対するsiRNA#1と#2の組合わせが効果的であると考えられた。
【図8】様々な遺伝子プロモーター活性化におけるヒストンH2B siRNAの効果。HEK293細胞をコントロールsiRNA(openカラム)もしくはH2B siRNA(closedカラム)と共に、IFN-α4プロモーター、IFN-βプロモーター、NF-κB, ISRE, IRFEまたはGAS依存性プロモーターによりホタルルシフェラーゼを発現するプラスミドとpTK-RLプラスミドをトランスフェクトした。24時間後、 0, 0.1, 0.5, or 2.5 μg/mlのpoly(dA・dT)またはpoly(dG・dC)で24時間刺激し、ルシフェラーゼアッセイを行った。t検定による解析で**はp < 0.01、***はp < 0.001。
【図9】アデノウイルスの細胞内増幅におけるRIG-IまたはZBP-1 siRNAの効果。HEK293細胞にコントロール、RIG-I、ZBP-1 siRNAをトランスフェクトし、その後5型アデノウイルスを感染させた。感染後24時間のウイルス量をプラークアッセイにより解析した。
【発明を実施するための形態】
【0010】
以下、本発明の実施の形態についてより詳細に説明する。
【0011】
本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体を提供する。
【0012】
ヒストンH2Bは染色体構造に必須で、細胞の恒常性維持の役割を担っている。細胞のヒストンH2Bの一部は、生細胞で生理的にクロマチン再構成が生じる際に染色体外にも存在することが示されている(Kimura, H. (2005). Histone dynamics in living cells revealed by photobleaching. DNA Repair (Amst) 4, 939-950.; Kimura, H., and Cook, P.R. (2001). Kinetics of core histones in living human cells: little exchange of H3 and H4 and some rapid exchange of H2B. J. Cell. Biol. 153, 1341-1353.)。染色体外ヒストンH2Bは、染色体外に存在する遊離ヒストンである。染色体外ヒストンH2Bと二本鎖DNAとの複合体は、シグナルソーム(細胞内情報伝達複合体)であることが好ましい。
【0013】
染色体外ヒストンH2Bの由来生物は、ヒトが好ましいが、ヒトに限らず、他の哺乳動物(マウス、ラット、ハムスター、ウサギ、ネコ、イヌ、ウシ、ウマ、ヒツジ、サル等)であってもよい。ヒストンH2Bは、ヒトで17種類、マウスで13種類報告されており、いずれの種類のヒストンH2Bを用いてもよい。その遺伝子及びアミノ酸配列情報は以下の通りである。
【0014】
【表1】

二本鎖DNAは、特に限定されるわけではないが、自然界に存在する右巻き二本鎖DNA(B-DNA)など、細胞のI型インターフェロン(IFN)産生を促進できるものであるとよい。二本鎖DNAは、外来DNAであっても、ゲノムDNAであってもよい。二本鎖DNAのヌクレオチド配列は、特に限定されないが、poly(dA・dT) ・poly(dT・dA)などのAとTに富むヌクレオチド配列が好ましい。二本鎖DNAの塩基長は、特に限定されないが、50 bp以上が好ましい。例えば、後述の実施例では、50 bp以上100 kbp以下のpoly(dA・dT) ・poly(dT・dA)及びpoly(dG・dC) ・poly(dC・dG)を用いた。この他にも、ウシ胸腺ゲノムDNA、大腸菌ゲノムDNAなどを用いてもよい。
【0015】
染色体外ヒストンH2Bと二本鎖DNAとの複合体は、染色体外ヒストンH2Bと二本鎖DNAとを接触させることにより調製することができる。例えば、染色体外ヒストンH2Bの溶液に二本鎖DNAを添加してもよいし、二本鎖DNAの溶液に染色体外ヒストンH2Bを添加してもよい。
【0016】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成は、生化学的実験、免疫組織染色と共焦点顕微鏡を用いた解析などにより確認することができる。例えば、大腸菌で作製したリコンビナントGST-H2Bタンパクと二本鎖DNAを混合し、GST親和性レジンでpull-downを行うことにより、GST-H2Bタンパクと二本鎖DNAの複合体が共沈することを確認できる。Cy3ラベルしたpoly(dA・dT) ・poly(dT・dA)を導入した細胞を固定後、抗ヒストンH2B抗体さらにFITC標識二次抗体で免疫組織染色し、共焦点顕微鏡で解析することにより、poly(dA・dT) ・poly(dT・dA)とヒストンH2Bが細胞内で共局在することが確認できる。
【0017】
本発明の複合体を構成する染色体外ヒストンH2Bは、二本鎖DNAを認識して細胞内シグナル伝達を活性化できるのであれば、染色体外ヒストンの断片であってもよい。従って、染色体外ヒストンの断片と二本鎖DNAとの複合体も本発明に包含される。
【0018】
本発明の複合体は、さらにアダプター分子を含んでもよい。アダプター分子は、ヒストンH2Bに接着する分子で、細胞内シグナル伝達に関わるものであればよく、CIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1;以前はKIAA1192として報告)、IPS-1(Interferon-β Promoter Stimulator 1)などを例示することができる。KIAA1192の機能は現時点では解析されていないが、そのヌクレオチド配列はインポーチン9のC末端と一致しており、インポーチン9の選択的スプライシングによる転写産物の1つと考えられた(後述の表S1)。本発明者らは、KIAA1192の新たな役割に基づき、改めてこれをCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)と命名した。
【0019】
また、本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体の調節因子をスクリーニングする方法を提供する。この方法は、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む。
【0020】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアンタゴニストは、染色体外ヒストンH2Bに結合し、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成を阻害する物質であればよく、例えば、染色体外ヒストンH2Bとの結合について二本鎖DNAと競合するもの、染色体外ヒストンH2Bの二本鎖DNA結合サイト以外の部位に結合するアロステリックインヒビターなどを挙げることができる。
【0021】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニストは、染色体外ヒストンH2Bに結合したときに、ヒストンH2Bと二本鎖DNAとの複合体形成によりもたらされる機能(例えば、細胞内シグナル伝達の活性化など)と同様の機能をもたらす物質であればよく、例えば、染色体外ヒストンH2Bと結合して細胞内シグナル伝達を活性化するもの、染色体外ヒストンH2Bの二本鎖DNA結合サイト以外の部位に結合するアロステリックアクティベーターなどを挙げることができる。
【0022】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定するには、例えば、以下のようにするとよい。リコンビナントGST-H2Bタンパクと二本鎖DNAと被験物質を混合し、GST親和性レジンでpull-downを行うことにより、GST-H2Bタンパクと二本鎖DNAの複合体形成が解析できる。共沈してくる二本鎖DNAの相対量が変化することにより、被験物質のヒストンH2Bと二本鎖DNAとの相互作用に与える影響を確認できる。また。この被験物質をヒト臍帯血管内皮細胞細胞もしくはHEK293細胞等の培養系に投与した後、poly(dA・dT) ・poly(dT・dA)を細胞に導入し、24時間後のIFN-β産生量もしくはIFN-βプロモーター活性を解析することで、アゴニストまたはアンタゴニストとして作用するか検討できる。
【0023】
また、本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体による細胞内シグナル伝達の調節因子をスクリーニングする方法を提供する。この方法は、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む。
【0024】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアンタゴニストは、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達経路に作用して自然免疫を抑制する物質であればよく、例えば、染色体外ヒストンH2Bとの結合について二本鎖DNAと競合するもの、染色体外ヒストンH2Bの二本鎖DNA結合サイト以外の部位に結合するアロステリックインヒビターなどを挙げることができる。
【0025】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニストは、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達経路に作用して自然免疫を活性化する物質であればよく、例えば、染色体外ヒストンH2Bと結合して細胞内シグナル伝達を活性化するもの、染色体外ヒストンH2Bの二本鎖DNA結合サイト以外の部位に結合するアロステリックアクティベーターなどを挙げることができる。
【0026】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定するには、例えば、以下のようにするとよい。リコンビナントGST-H2Bタンパクと二本鎖DNAと被験物質を混合し、GST親和性レジンでpull-downを行うことにより、GST-H2Bタンパクと二本鎖DNAの複合体形成が解析できる。共沈してくる二本鎖DNAの相対量が変化することにより、被験物質のヒストンH2Bと二本鎖DNAとの相互作用に与える影響を確認できる。また。この被験物質をヒト臍帯血管内皮細胞もしくはHEK293細胞等の培養系に投与した後、poly(dA・dT) ・poly(dT・dA)を細胞に導入し、24時間後のIFN-β産生量もしくはIFN-βプロモーター活性を解析することで、アゴニストまたはアンタゴニストとして作用するか検討できる。
【0027】
さらに、本発明は、二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞の製造方法を提供する。この方法は、前記哺乳動物細胞における染色体外ヒストンH2Bの発現量を減少させることを含む。
【0028】
二本鎖DNAにより誘導される生物学的活性としては、I型インターフェロン産生、サイトカイン、ケモカイン産生、MHC分子、副刺激分子発現などを例示することができるが、これらに限定されることはない。
【0029】
I型インターフェロン産生の抑制は、例えば、以下のようにして調べることができる。血清もしくは培養上清を採取し、IFN-αもしくはIFN-βELISAキット(PBL社)を用いることで産生量の絶対値を測定および比較できる。
【0030】
また、血清もしくは培養上清を採取し、ELISAキットを用いることでサイトカインまたはケモカイン産生量の絶対値を測定および比較できる。また、MHC分子、副刺激分子については、細胞を特異抗体と作用させた後、フローサイトメトリーで解析することで、発現量を比較できる。
【0031】
哺乳動物細胞としては、HEK293T、HEK293、HeLa細胞、ヒト臍帯血管内皮細胞などを例示することができるが、これらに限定されることはない。
【0032】
哺乳動物細胞における染色体外ヒストンH2Bの発現量を減少させるには、例えば、RNA干渉、shRNA発現プラスミドの細胞内導入、all-trans retinoic acidの投与(BBRC 213:616 1995)などの方法を用いる。
【0033】
RNA干渉に用いる二本鎖DNA(siRNA)としては、以下のものを例示することができるが、これらに限定されることはない。
【0034】
ヒストンH2Bf116センス:5’-CCG UUU ACG UGU ACA AGG UGC UGA A-3’(配列番号9)、ヒストンH2Bf116アンチセンス:5’-UUC AGC ACC UUG UAC ACG UAA ACG G-3’(配列番号10)
ヒストンH2Bf169センス:5’-UCC AAG GCC AUG GGC AUC AUG AAC U-3’ (配列番号11)、ヒストンH2Bf169アンチセンス:5’- AGU UCA UGA UGC CCA UGG CCU UGG A-3’ (配列番号12)
siRNAを哺乳動物細胞に導入するには、細胞導入試薬を用いる方法、エレクトロポレーション法などを用いるとよい。
【0035】
また、本発明は、上記のように、染色体外ヒストンH2Bの発現量を減少させることによって、二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞も包含する。
【0036】
さらにまた、本発明は、哺乳動物における免疫応答を調節する方法を提供する。この方法は、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む。
【0037】
哺乳動物としては、ヒト、ヒト以外の動物(例えば、マウス、ラット、ハムスター、ウサギ、ネコ、イヌ、ウシ、ウマ、ヒツジ、サル等)を例示することができる。
【0038】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達の調節は、例えば、下記の(a)及び/又は(b)により行う。
【0039】
(a) 染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加又は減少させること
(b) 染色体外ヒストンH2B及び/又はそのアダプター分子を修飾すること
染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加させるには、例えば、ヒストンH2B及び/又はそのアダプター分子を発現させる遺伝子カセットを細胞内に導入する。
【0040】
染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加させることにより、哺乳動物における免疫応答を活性化することができる。
【0041】
染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を減少させるには、例えば、RNA干渉、all-trans retinoic acidの投与(BBRC 213:616 1995)などを用いる。
【0042】
RNA干渉に用いる二本鎖DNA(siRNA)の例は上述の通りである。
【0043】
siRNAを哺乳動物に導入するには、細胞導入試薬を用いる方法、エレクトロポレーション法などを用いるとよい。また、ベクターにshRNA(short hairpin RNA)を発現するカセットを組込み、同一のベクターから標的遺伝子とH2B shRNAを共発現させる方法を用いてもよい。
【0044】
染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を減少させることにより、哺乳動物における免疫応答を抑制することができる。
【0045】
染色体外ヒストンH2B及び/又はそのアダプター分子を修飾するとは、ヒストンH2Bの翻訳後修飾で、メチル化、リン酸化、アセチル化、ユビキチン化などを含む概念である。
【0046】
染色体外ヒストンH2B及び/又はそのアダプター分子を修飾するには、例えば、以下のようにすればよい。アセチル化修飾を抑制する方法としてanacardic acidを添加する。脱アセチル化を抑制する方法としてM344を添加する。
【0047】
染色体外ヒストンH2B及び/又はそのアダプター分子を修飾することにより、哺乳動物における免疫応答を調節(すなわち、活性化もしくは不活化)することができる。
【0048】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することにより、哺乳動物における免疫応答を調節できる他、哺乳動物におけるI型インターフェロン誘導を調節したり、哺乳動物におけるウイルスの増殖を調節したり、哺乳動物における遺伝子を利用した治療方法の効果を調節することができる。
【0049】
例えば、染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加させることにより、哺乳動物におけるI型インターフェロン誘導が促進したり、哺乳動物におけるウイルスの増殖が減少したり、哺乳動物における遺伝子を利用した治療方法の効果が増加しうる。
【0050】
また、例えば、染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を減少させることにより、哺乳動物におけるI型インターフェロン誘導が抑制されたり、哺乳動物におけるウイルスの増殖が増加したり、哺乳動物における遺伝子を利用した治療方法の効果が減少しうる。
【0051】
あるいは、例えば、染色体外ヒストンH2B及び/又はそのアダプター分子を修飾することにより、哺乳動物におけるI型インターフェロン誘導が促進したり、哺乳動物におけるウイルスの増殖が減少したり、哺乳動物における遺伝子を利用した治療方法の効果が増加しうる。
【0052】
従って、本発明は、哺乳動物におけるI型インターフェロン誘導を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法;哺乳動物におけるウイルスの増殖を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法;及び哺乳動物における遺伝子を利用した治療方法の効果を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法も包含する。
【0053】
また、染色体外ヒストンH2Bの発現量を減少させることにより、哺乳動物又はその細胞におけるウイルスの増殖を増加させることができる。従って、本発明は、ウイルスを製造する方法であって、哺乳動物又はその細胞における染色体外ヒストンH2Bの発現量を減少させること、及び前記哺乳動物又はその細胞をウイルスに感染させることを含む前記方法も包含する。
【0054】
哺乳動物をウイルスに感染させるには、例えば、1細胞当たり0.001〜1000 pfuのウイルスを感染させるとよい。
【0055】
哺乳動物をウイルスに感染させるには、例えば、動物1匹当たり1x107〜1x1013 pfuのウイルスを感染させるとよい。
【実施例】
【0056】
以下、実施例に基づいて本発明を詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【0057】
〔実施例1〕染色体外ヒストンH2Bは細胞内二本鎖DNAによって誘導される抗ウイルス自然免疫応答を媒介する
要約
右巻きらせん構造を取るdsDNA断片(B-DNA)は、細胞のI型インターフェロン(IFN)産生を促進する。アダプター分子の1つであるIFN-βプロモーター刺激因子(IPS-1)は、ヒト細胞においてdsDNAによる細胞内シグナル伝達を媒介するが、その背景にある分子機構は十分に解明されていない。今回本発明者らは、染色体外ヒストンH2Bがヒト細胞において抗ウイルス自然免疫応答を媒介することを示す。H2Bは、新たに同定されたCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)というアダプターと結合することでIPS-1と物理的に相互作用し、dsDNAによる細胞内シグナルを伝達するが、免疫賦活性RNAの細胞内シグナルは伝達しない。染色体外ヒストンH2Bは、DNAウイルス(アデノウイルス及びヒト乳頭腫ウイルス)の増殖を抑制する細胞自律的な応答において生物学的に重要であったが、RNAウイルス(水疱性口内炎ウイルス及び脳心筋炎ウイルス)の増殖は抑制しなかった。したがって今回の知見は、dsDNAにより誘発され、抗ウイルス自然免疫応答のトリガーとなるシグナル伝達経路に染色体外ヒストンH2Bが関与することを明らかにするものである。
【0058】
緒言
病原体又は宿主細胞に由来する核酸断片は、I型IFN産生の誘導を通じて、ある種のウイルスの増殖を抑制する細胞自律的な応答を活性化する(5)。こうした作用は、トランスフェクション法やエレクトロポレーション法によってdsDNAが細胞内区画に導入される場合に一段と顕著であり、DNAの感知システムが細胞内の異常DNA断片を認識することが示唆される(6, 21, 23)。右巻きらせん構造を取るdsDNA(すなわち、B-DNA)は、左巻きのジグザグ構造を取るZ-DNAよりもI型IFNの誘導能が高い(6)。dsDNAは、樹状細胞やマクロファージなどの免疫細胞、及び線維芽細胞や上皮細胞、甲状腺細胞などの非免疫細胞を含むさまざまな種類の細胞でI型IFNの産生を活性化する(6, 23)。dsDNAのこうした作用は、DNase II欠損マウスの細胞内に未分解のDNA断片が蓄積することにより、IFN-βの過剰産生、赤血球新生の調節不全、関節リウマチと類似の症状が認められることにより確認された(12, 28)。全身性エリテマトーデス(SLE)患者ではDnase I遺伝子の機能喪失型変異がみられ、事実、DNase I-/-マウスでは、SLE様症状とともに抗DNA抗体産生が認められる(18, 27)。
【0059】
dsDNAの免疫賦活性は、dsRNAや5'-三リン酸化RNA(5'-triphosphorylated RNA)といった免疫賦活性RNA(isRNA)の性質と酷似している(2, 6)。実際、dsDNAのシグナル伝達経路の一部はisRNAのシグナル伝達経路と共通している。レチノイン酸誘導遺伝子-I(retinoic acid-inducible gene I:RIG-I)及びメラノーマ分化関連遺伝子5(melanoma differentiation-associated gene 5:MDA5)はisRNAと直接結合してシグナル伝達のトリガーとなる一方、ヒト肝癌細胞株huH7において、RIG-IはdsDNAと直接的には相互作用しないがそのシグナル伝達を媒介することが示された(2)。IFN-βプロモーター刺激因子1(IPS-1;ミトコンドリア抗ウイルスシグナル伝達(MAVS)とも呼ばれる)は、ヒトではdsDNA又はisRNAによって誘導される下流シグナル伝達を媒介するが、マウスではisRNAによるシグナル伝達のみを媒介し、dsDNAによるシグナル伝達は媒介しない(2, 6, 15, 22)。これに対し、TANK結合キナーゼ1(TBK1)及び誘導性IκBキナーゼ(IKKi)は、ヒトとマウスの両方において、dsDNA又はisRNAによって誘導されるI型IFN産生に必須である(2, 6)。isRNAではなくdsDNAを介する上流シグナル伝達に関与する分子を調べたところ、少なくともマウス結合組織細胞株L929では、Z-DNA結合タンパク質1(ZBP1;DNA依存性IFN調節因子活性化分子(DAI)とも呼ばれる)が細胞質内DNAセンサーの候補分子として同定されたが、この分子のin vivoでの役割は必須ではなかった(7, 24, 26)。最近、PYHINファミリーのメンバーであるAIM2(absent in melanoma 2)が、インフラマソームのシグナル伝達アダプターの1つであるASC(apoptosis-associated speck-like protein containing a CARD)と結合し、dsDNAに応答するカスパーゼ1の活性化とIL-1β分泌に重要な役割を果たすことが示された(1, 3, 4, 20)。
【0060】
本研究において、本発明者らは、染色体外ヒストンH2Bがヒト細胞におけるdsDNA誘導性I型IFN産生とDNAウイルス感染への自然免疫反応の原因となっていることを示す。
【0061】
結果
dsDNAによって誘導されるIFN-βプロモーター活性化のメディエーターとしてのヒストンH2Bの同定
ヒト細胞においてdsDNAを介するI型IFN産生を担う分子を同定するため、IFN-βプロモーターの制御下にルシフェラーゼ遺伝子を安定発現しているHEK293T細胞を用いて、ヒト骨髄cDNA発現ライブラリーのスクリーニングを行った。調べた960,000個以上の独立クローンのうち、陽性クローンの1つにヒストンH2B1BのORFが含まれ、dsDNAによって誘導されるIFN-βプロモーターの活性化が著しく増強していた(図1A)。dsDNAによって誘導される自然免疫応答におけるヒストンH2Bの役割を確認するため、低分子干渉RNA(siRNA)を用いてRNA干渉を行った。H2B siRNA処理により、H2Bタンパク質の発現レベルが著しく抑制された(図7)。H2B siRNA処理は、HEK293細胞におけるIFN-β産生及びdsDNAによって誘導されるIFN制御因子3(IRF3)のリン酸化のレベルも抑制し(それぞれ図1B及び1C)、ヒストンH2Bのノックダウンにより、IFN関連遺伝子の発現を調節する各種遺伝子プロモーターの、dsDNAによって誘導される活性化が阻害された(図8)。dsDNAは、TBK1やIKKiといったIRFキナーゼを刺激する(6)。TBK1及びIKKiの過剰発現は、対照HEK293細胞とH2BノックダウンHEK293細胞の両細胞において同レベルのIFN-β産生を引き起こしたことから、H2Bがこれらキナーゼの上流で機能することが示唆された(図1D)。ヒストンH2B及びdsDNAの細胞内相互作用を確認するため、プルダウン及び免疫沈降解析を行った。その結果、ヒストンH2Bは、細胞にトランスフェクトしたビオチン化(poly(dA・dT))又は(poly(dG・dC))で共沈された(図1E)。さらにヒストンH2BのdsDNA相互作用ドメインを同定するために、H2B変異体を用いた免疫沈降解析を行った。ヒストンH2BのC末端αヘリックス領域(αHドメイン)がHPV DNAとの相互作用に十分であることが示された(図1F)。さらに、ノックダウン細胞の完全長ヒストンH2Bの相補性によって、dsDNAにより誘発されるIFN-βプロモーターの活性化のレベルが回復されたが、NH2-末端テール領域(N'-テール)やαHドメイン単独はそうではなかった(図1G)。これらの結果から、ヒストンH2Bは、αHドメインを介してdsDNAに結合するが、N'-テール及びαHドメインの両方がdsDNAを介するシグナル伝達に必要とされることが示唆される。ヒストンH1、H2A、H2B、H3又はH4を標的とする各siRNAについて試験したところ、H2B siRNAのみがdsDNAによって誘導されるIFN-βプロモーターの活性化を低下させた(図1H)。H2B siRNAのこうした作用は、dsRNA又はTNF-αによる刺激の後には観察されなかった(図1H)。これらの結果から、ヒストンH2Bは、dsDNAがトリガーとなるシグナル活性化に関与することが示唆される。
【0062】
ヒストンH2Bは、dsRNAやTLRリガンドではなく、dsDNAがトリガーとなるシグナル活性化に関与する
ZBP1又はRIG-Iは、それぞれマウス結合組織細胞株(L929)又はヒトヘパトーマ細胞株(huH7)における細胞質ゾルDNAセンサーとして知られたものである。dsDNAによって誘導されるIFN-βプロモーターの活性化は、ヒストンH2B siRNA処理した細胞では有意に抑制され、ZBP1又はRIG-Iを標的とするsiRNAで処理した細胞では抑制されなかったが(図2A)、それぞれのsiRNAは、HEK293細胞における標的タンパク質の発現レベルを特異的に低下させた(図2B)。ヒト臍帯静脈内皮細胞(HUVEC)では、ヒストンH2BのノックダウンによりdsDNA刺激に応答するIFN-β産生が抑制されたが、5'-三リン酸化RNA刺激に応答するIFN-β産生は抑制されなかった(図2C)。ヒストンH2Bは染色体の必須構成要素の1つであるが、本研究で用いたH2Bノックダウン細胞は正常に増殖することができ、TNF-α又はTLRリガンドへの反応は対照siRNA処理した細胞と同等であったことから(図2D及び2E)、これらのsiRNAの使用により細胞の生存やTNFR又はTLRを介するシグナル伝達経路に必須である染色体のヒストンH2Bは障害されなかったことが示唆される。これらの結果を総合すると、ヒストンH2Bは、dsRNAやTLRリガンドではなく、dsDNAがトリガーとなるシグナル活性化に関与することが示唆される。
【0063】
染色体外のヒストンH2Bは、細胞形質におけるIPS-1と結合する
ほとんどのヒストンH2Bはヘキスト染色(染色体)と共局在したものの、一部のH2Bが染色体外領域で染色したことが、免疫蛍光解析によって明らかになった(図3A)。細胞がH2B siRNAで処理される場合、そのような染色体外のH2Bのレベルは低下したが、同じ細胞の染色体H2Bは、対照細胞の染色体H2Bと同等のレベルで存在した。ヒストンも核から放出されることが知られていることから(14)、イムノブロット解析によって各細胞画分のヒストンH2Bのレベルを評価した。免疫蛍光解析の結果から、H2B siRNAは有意に染色体外H2Bを減少させたが、染色体H2Bは減少させなかった(図3B)。dsRNAではなくdsDNAにより細胞が12時間刺激された場合のみ、細胞形質においてH2B蛍光の点状のシグナルが検出されたが(図3C)、このことによって、dsDNAにより細胞形質におけるヒストンH2Bの凝集が誘導されるということが示唆される。興味深いことに、刺激後12時間のdsDNA刺激の後、IPS-1とのH2Bの共局在化が観察された(図3C、マゼンタの矢印)。ヒストンH2BとIPS-1との間の分子相互作用をさらに検討するため、免疫沈降反応解析を行った。dsDNAの有無にかかわらず刺激されるHEK293細胞から細胞質抽出物及び染色体の形成後の細胞核抽出物を分離した。図3Dに示すように、抗GAPDH(細胞質酵素)又は抗Sp1(核転写因子)Abによるイムノブロット解析によって、各抽出物の純度を確認した。IPS-1は、大部分が細胞質抽出物に存在したが、一方でヒストンH2Bは、両方の抽出物に存在した。細胞質抽出物からIPS-1を免疫沈降した際、ヒストンH2Bの共沈は、刺激前に検出されなかったが、dsDNA刺激の12時間後に検出された。これに対して、H2Bが細胞核抽出物から免疫沈降した際、dsDNA刺激の後であっても、検出可能なIPS-1は共沈しなかった。まとめると、これらの結果から、dsDNA刺激の後、細胞形質においてヒストンH2BとIPS-1との間の相互作用が生じることが示唆される。
【0064】
ヒストンH2B及びIPS-1を結合させる種特異的分子としてのCIAOの同定
ヒストンH2Bと直接結合する分子を同定するため、酵母ツーハイブリッド法を行った。その結果、陽性クローンの10個中3個がKIAA1192と同定された。KIAA1192の機能は現時点では解析されていないが、そのヌクレオチド配列はインポーチン9のC末端と一致しており、インポーチン9の選択的スプライシングによる転写産物の1つと考えられた(表S1)。本発明者らは、KIAA1192の新たな役割(後述)に基づき、改めてこれをCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)と命名した。免疫沈降法により、CIAOはヒストンH2B及びIPS-1とは結合するが、RIG-Iとは結合しないことが明確に示された(図4A)。完全長インポーチン9は、ヒストンH2Bと相互作用したが、IPS-1とは相互作用せず(データ示さず)、このことにより、インポーチン9の交互スプライシング変異体であり得るCIAOは、IPS-1の相互作用する相手としての特有の機能を得ることが示唆された。蛍光共鳴エネルギー転移(FRET)解析によって、細胞内におけるH2B、CIAO及びIPS-1の空間的配置をさらに検討した。図4Bに示すように、より高いレベルの特異的FRETシグナルは、CFP-H2B及びYFP-IPS-1を発現する細胞と比較して、CFP-CIAO及びYFP-H2B並びにCFP-CIAO及びYFP-IPS-1を発現する細胞内で検出されたが、このことによって、CIAO及びH2B或いはCIAO及びIPS-1が密な空間内に並び、且つ、CIAOは、分子複合体内のH2BとIPS-1との間に配置し、このことにより、ヒストンH2BをIPS-1に結合するアダプターとしての役割を果たすということが示唆される。分子相互作用を担うCIAO、ヒストンH2B及びIPS-1のドメインの特徴をさらに評価した。免疫沈降反応解析により、CIAOのC末端領域(194〜249 aa)はIPS-1との相互作用に十分であるが、CIAOの中央領域(91〜193 aa)は、H2Bとの相互作用に必要とされることが示された(図4C及び4D)。CIAOとの相互作用には、IPS-1のプロリンリッチドメイン(PRD)(94〜170 aa)が必要とされる一方で、H2BのN'-テール(1〜37 aa)が十分である(図4E及び4F)。CIAOはHeLa及びHEK293細胞において内因性発現し(図4G及びデータは示されない)、CIAO ORFを標的とするsiRNAの処理によって、有意にCIAOの発現レベルが抑制されたが、インポーチン9タンパク質の発現レベルは抑制されなかった(図4G)。CIAOのノックダウンにより、dsDNAにより誘導されたIFN-βプロモーターの活性化が著しく低下したが(図4H)、一方でCIAOの過剰発現は、IPS-1により誘導されたI型INFプロモーターの活性化を促進した(図4I)。まとめると、これらの結果から、CIAOはヒストンH2BをIPS-1に結合させ、このことにより、ヒト細胞において、H2Bを介するI型IFN産生が可能になることが示された。
【0065】
【表2】

dsDNAを介するシグナル伝達におけるヒストンH2B及びIPS-1の種特異的関与
以前の報告によって、種の間でdsDNAシグナル伝達に機構的な差があることが示されており、例えば、ヒトIPS-1はdsDNAを介する細胞性シグナル伝達に関与するが、マウスIPS-1は関与しない(2、6、15、22)。dsDNAによって誘導される種特異的シグナル伝達経路の基礎をなす分子機構を検討するため、ヒト及びマウスの細胞におけるH2Bノックダウンの効果を比較した。その結果、H2Bのノックダウンにより、HeLa細胞ではdsDNAを介するIFN-βプロモーターの活性化が抑制されたが、NIH3T3細胞では抑制されず(図5A及び5B)、このことにより、これらの種の間でヒストンH2Bの作用に差があることが示唆される。しかしながら、興味深いことに、ヒトのCIAOとIPS-1との間に相互作用が認められたにもかかわらず、マウスのCIAOとIPS-1との間に相互作用は認められなかった(図5C)。アミノ酸配列の高い同一性が、ヒトとマウスのH2Bサブタイプ(ヒトH2B1A、1B、1C、1D、1H、1J、1K、1L、1M、1N、1O、2E、2F、3B、FSとマウスH2B1A、1B、1C、1F、1H、1K、1M、1P、3A)の中(70.1%超)及びヒトとマウスのCIAOの間(99.2%)で認められた一方で、低い同一性が、ヒトとマウスのIPS-1アミノ酸配列の間(30.3%)に認められた。したがって、ヒトIPS-1はヒストンH2Bと相互作用してシグナルを伝達できるが、マウスIPS-1にはこの機能がないと考えられる。dsDNAを介するシグナル伝達におけるヒトIPS-1特異的機構をさらに検討するため、IPS-/-マウス胎児線維芽細胞(MEF)にマウスIPS-1(マウスIPS-1 MEF)又はヒトIPS-1(ヒトIPS-1 MEF)を補い、dsDNAに対するそれらの応答を調べた。Ifnb1 mRNA発現が3時間以内に誘導された一方で、そのレベルはdsDNA刺激の12時間後にピークに達し、その後マウスIPS-1 MEFにおいて減少した(図5D)。それに対して、Ifnb1 mRNA発現のレベルは、ヒトIPS-1 MEFのdsDNA刺激の24時間後にピークに達し、全体のレベルは、ヒトIPS-1 MEFが、マウスIPS-1 MEFよりも有意に高かった(図5D)。したがって、これらの結果をまとめると、ヒトIPS-1は、MEFに内因的に存在するdsDNAシグナル伝達によって媒介されるものと比較して、IFN-βの後期誘導を媒介することが示唆される(図5D)。
【0066】
染色体外ヒストンH2BはDNAウイルスの増殖の抑制に関与する
細胞自律的な抗ウイルス応答に対するヒストンH2Bの生物学的役割をさらに検討した。ヒストンH2Bをノックダウンしたところ、ワクシニアウイルスによって誘導されるIFN-β産生並びにSTAT1のリン酸化が抑制された(図6A)。H2Bノックダウン細胞では、ヒト乳頭腫ウイルス(HPV11及びHPV16)及びアデノウイルス5型(AdV)の増殖が著しく促進されたが(それぞれ図6B及び6C)、RIG-I又はZBP-1ノックダウン細胞では促進されなかった(図9)。しかし、H2Bのノックダウンは、マウス細胞におけるマウス-サイトメガロウイルス(MCMV)や、ヒト細胞におけるRNAウイルス(脳心筋炎ウイルス[EMCV])の増殖にはほとんど影響を及ぼさなかった(図6D及び6E)。これらの知見は、染色体外ヒストンH2BがDNAウイルス感染の感知機構に関与し、ヒト細胞における細胞自律的な抗ウイルス自然免疫応答を媒介することを示唆している。
【0067】
考察
今回の結果は、dsDNAがトリガーとなるシグナル伝達経路において染色体外ヒストンH2Bが重要な役割を果たしていることを直接的に証明するものである。生物学的には、dsDNAが放出されるのは、細胞に異常又は「危険な」状況(感染やアポトーシス、組織損傷など)が生じた場合である(6, 18, 23)。そのため、染色体外ヒストンH2B、CIAO及びIPS-1で構成されるシグナルソームを介したシグナル伝達経路は、病原体の認識に対応するものとしてだけでなく、異常な自己DNAに対する自己認識機構として進化してきたのかもしれない。
【0068】
通常、ヒストンH2Bはコアヒストンとしてヌクレオソームに組み込まれているが、生細胞内ではヒストンの交換や組み込みが頻繁に生じており、H2B全量の約3%は半減期が約6分、約40%は半減期が約130分、50%超は半減期が約8.5時間である。実際、NAP-1(nucleosome assembly protein 1)は、H2AとH2Bの交換やヌクレオソームのスライディングの援助を通じてクロマチンの流動性を媒介している(13)。細胞質コアヒストンの核内移行は、インポーチンファミリーメンバーを介する複数の重複した経路を通じて生じる。インポーチン9は、核のコア複合体を経由するH2Bの輸送における最も生産的な経路の1つを媒介する(8, 17)。興味深いことに、哺乳類インポーチン9の酵母ホモログの1つであるカリオフェリン114pは、細胞質のH2A-H2B複合体と結合する(16)。これらの証拠は、ヌクレオソームから解離した染色体外ヒストンH2BがdsDNAによって誘導されるシグナル伝達に重要な役割を果たすという今回の観察結果を強力に支持するものである。
【0069】
過去数十年間に示された一連の証拠は、ヒストンがどのようにゲノムDNAに組み込まれてヌクレオソームを構成するかを示している。ほとんどの研究は、ヒストンはある生理的条件の下でゲノムDNAのみを標的とするという仮定に注目していた。しかし近年の研究では、染色体外でヒストンのサブタイプが異なる役割を果たしていることが示されている。H2A.Xは、DNA二重鎖の切断が生じる場合にリン酸化してリクルートされ(19)、H3.3は遺伝子転写が活性化する場合に凝縮したクロマチンに蓄積する(9)。さらに特筆すべきは、H1.2は核からミトコンドリアに移行してDNA損傷に起因するアポトーシスシグナルを伝達し、これがミトコンドリアからのBak依存的なシトクロムc放出の制御に決定的な役割を果たすという事実である(14)。そのため、シグナルソームの構成要素の1つとしての染色体外ヒストンH2Bの性質を詳細に解析することは、染色体外ヒストンの生物学的役割や、病原体の侵入をdsDNAが感知した際の細胞自律的な防御機構を理解するのに役立つ可能性がある。
【0070】
CIAOは、インポーチン9のORF(793-1041)のC末端と同一である750 bpのORFをコードしており、シグナル伝達を担うドメインや領域は特にみられなかった。本発明者らはCIAOのC末端領域がIPS-1 PRDとの相互作用に十分であり、CIAOの中央領域がH2BのN末端tail領域との相互作用に必要であることを確認したが、生理的条件下、又はウイルス感染中のシグナルソーム形成のダイナミクスは今後の検討課題である。そうしたダイナミクスを調べるため、現在本発明者らは、複合体形成の前又は後に修飾された各分子の特定の残基を標的とすることにより内在性のCIAOとインポーチン9を識別する、又は染色体外ヒストンH2Bと染色体ヒストンH2Bを識別するための抗体や薬剤を作製中である。
【0071】
RIG-Iがヒト肝癌細胞株であるhuH7におけるIPS-1経由のdsDNA誘導性抗ウイルス応答に重要な役割を果たすことは実証されている(2)。しかしながら、本発明者らは、RIG-I又はZBP1ではなくヒストンH2BがHEK293細胞におけるdsDNA媒介シグナル伝達に関与していることを観察したが、このことはdsDNAによって活性化されたシグナル伝達経路におけるある種の細胞型特異的かつ重複性の機構が存在することを示している。事実、DAIとしても知られているZBP1がマウスL929細胞におけるdsDNA媒介シグナル伝達に関与しているが、そのin vivoにおける役割は重複している(7, 24)。
【0072】
本研究のデータは、染色体外ヒストンH2Bが’トランスフェクトされた’dsDNAだけでなく細胞質に暴露されたウイルスDNAも認識して、相互作用することを示す。この機構は、ワクシニアウイルス、AdV、及びHPVによる感染に対する細胞自律性自然反応に重大であるが、EMCVによる感染に対しては重大ではない。本発明者らの進行中の解析は、HIVの複製がH2BノックダウンMagic5細胞においても増強することを示しており(データは示さず)、このことは、HIVのゲノムRNAよりはプロウイルスdsDNAが染色体外ヒストンH2Bにより感知されることを示唆している。このように、ヒストンH2Bはウイルス感染において外来DNAとRNAを識別し、新規なアダプタータンパク質CIAOとの結合を経由するIPS-1媒介シグナル伝達を誘起するようであり、ヒトIPS-1は細胞内にDNA中間体を生産するヒトウイルスと戦うためにdsDNA及びヒストンH2Bが媒介するシグナル伝達を伝える可能性を進化の過程で獲得したことが示唆される。
【0073】
今回の研究をまとめると、染色体外ヒストンH2BはCIAOとの結合を通じてIPS-1と物理的に相互作用し、ヒト細胞においてdsDNAによって誘導されるI型IFN産生を伝達する特異的なシグナルソームを形成することが示された。このような分子プラットフォームは、細胞内に異常に存在するdsDNAのセンサーとして作用し、病原体(感染)やアポトーシス(ホルモン刺激、化学薬品、放射線照射)、壊死(損傷)といった切迫した危険を細胞に知らせている可能性がある。そのためこの機構は、自己免疫、移植拒絶反応、遺伝子ワクチンその他の治療への応用においても一定の役割を果たすと考えられる。
【0074】
材料及び実験方法
細胞及び試薬
HEK293T、HEK293、HeLa、NIH3T3、Vero、L929細胞はAmerican Type Culture Collection (Manassas, VA)から購入し、10% FCS及び50 μg/mLペニシリン/ストレプトマイシンを添加したDMEM中で維持した。SCC-4扁平上皮癌細胞(JCRB9118)はヒューマンサイエンス研究資源バンク(大阪)から入手した。ヒト臍帯静脈内皮細胞(HUVEC)はCambrex Bio Science(Waikersville, MD)から入手した。IPS-1-/-マウス胎仔線維芽細胞は既報の通りである(15)。EMCV又はMCMV MW97.01株は、それぞれ、T. Fujita氏(京都大学、京都、日本)又はUH Koszinowski氏(Max von Pettenkofer-Institute for Virology, Munchen, Germany)から厚意により提供された。Poly(dA・dT)・poly(dT・dA) 及びpoly(dG・dC)・poly(dG・dC) はAmersham Biosciences(Piscataway, NJ)から購入した。Poly(I:C)及びヒトTNF-αは、それぞれ、Invivogen(San Diego, CA)及びPeproTech EC(London, UK)から入手した。MVAdE3Lは Holger Ludwig博士(Paul-Ehrlich Institute、Langen, Germany)から分与いただいた。pBR322にクローニングされたHPVゲノム(pHPV11)はJCRB遺伝子バンク(大阪)から入手した。各核酸は、無血清培地中で一定の重量:容量比(1:3)となるようにTransIT-L1(Mirus Bio Corp., Madison, WI)又はLipofectamine 2000 reagent(Invitrogen)と15分間混合し、刺激に用いた。
【0075】
cDNA発現ライブラリーのスクリーニング
ヒト骨髄cDNA発現ライブラリー(Invitrogen)のスクリーニングを行った。ヒト骨髄cDNAライブラリー(Invitrogen)で形質転換したE. coli DH5α細胞を、約20個の独立クローン×4,800プールに分割した。各プールを30℃で48時間培養し、Wizard SV 96 Plasmid DNA Purification System(Promega、Madison, WI)を用いてライブラリープラスミドDNAを抽出した。pGL3 IFNβを安定導入したHEK293T細胞に、FuGENE6トランスフェクション試薬を用いてライブラリープラスミドの各プールを一過性に導入した。トランスフェクションの24時間後に細胞を洗浄し、0.5 μg/mLのpoly(dA・dT)・poly(dA・dT)(poly(dA・dT) と表す)で刺激した。刺激の24時間後に、Bright-Glo Luciferase Assay Systemを用いてルシフェラーゼアッセイを行った。最も高いルシフェラーゼ活性を示した3プールを用いてDH5αの形質転換を行い、50個の独立クローンに由来するライブラリープラスミドDNAを回収した。これらの単一プラスミドを用い、同様の方法で2次スクリーニングを行った。最後に、Genetic Analyzer 310(PE Applied Biosystems、Foster City, CA)を用いて選択クローンのインサートcDNAのシークエンシングを行い、BLASTプログラムで解析した。
【0076】
RNA干渉法
ヒストンmRNAの干渉は既報に従って行った(6)。dsRNAはInvitrogen(ステルスRNAi)(Carlsbad, CA)又はiGENE(北海道)が化学的に合成したものを用いた。各RNAの配列は、ヒストンH1センス:5’-GCC CAA GAA AGU AGC UAA AAG CCC UAG-3’(配列番号5)、ヒストンH1アンチセンス:5’-AGG GCU UUU AGC UAC UUU CUU GGG CAU-3’ (配列番号6)、ヒストンH2Aセンス:5’-CGC AAC GAC GAG GAA CUG AAC AAG CAG-3’ (配列番号7)、ヒストンH2Aアンチセンス:5’-GCU UGU UCA GUU CCU CGU CGU UGC GAU-3’ (配列番号8)、ヒストンH2Bf116センス:5’-CCG UUU ACG UGU ACA AGG UGC UGA A-3’ (配列番号9)、ヒストンH2Bf116アンチセンス:5’-UUC AGC ACC UUG UAC ACG UAA ACG G-3’ (配列番号10)、ヒストンH2Bf169センス:5’-UCC AAG GCC AUG GGC AUC AUG AAC U-3’ (配列番号11)、ヒストンH2Bf169アンチセンス:5’- AGU UCA UGA UGC CCA UGG CCU UGG A-3’ (配列番号12)、ヒストンH3センス:5’-GAG AUC GCU CAG GAC UUU AAG ACC GAG-3’ (配列番号13)、ヒストンH3アンチセンス:5’-CGG UCU UAA AGU CCU GAG CGA UCU CAU-3’ (配列番号14)、CIAOセンス:5’-AUG GAC AGU AUG AAG GCA AAG UCA GAG-3’ (配列番号15)、CIAOアンチセンス:5’-CUG ACU UUG CCU UCA UAC UGU CCA UAU-3’ (配列番号16)、ヒストンH4センス:5’-GGG ACA AUA UCC AAG GCA UUA CAA AAG-3’ (配列番号17)、ヒストンH4アンチセンス:5’-UUU GUA AUG CCU UGG AUA UUG UCC CAU-3’ (配列番号18)、ZBP1Aセンス:5’-AUU UCA UGU GGA UUC UCU GGG CGG C-3’ (配列番号19)、ZBP1Aアンチセンス:5’-GCC GCC CAG AGA AUC CAC AUG AAA U-3’ (配列番号20)、ZBP1Bセンス:5’-UGU UGC UGU UGC CGA UGG UGG CGU C-3’ (配列番号21)、ZBP1Bアンチセンス:5’-GAC GCC ACC AUC GGC AAC AGC AAC A-3’ (配列番号22)、ZBP1Cセンス:5’-UUC AUC CAC AUA GUG GCU GCC UUC U-3’ (配列番号23)、ZBP1Cアンチセンス:5’-AGA AGG CAG CCA CUA UGU GGA UGA A-3’ (配列番号24)、RIG-IAセンス:5’-UUA GGA UUC UCA UUG CUG GGA UCC C-3’ (配列番号25)、RIG-IAアンチセンス:5’-GGG AUC CCA GCA AUG AGA AUC CUA A-3’ (配列番号26)、RIG-IBセンス:5’-AUG UCU UGU ACU UCA CAU GGA UUC C-3’ (配列番号27)、RIG-IBアンチセンス:5’-GGA AUC CAU GUG AAG UAC AAG ACA U-3’ (配列番号28)、RIG-ICセンス:5’-UGG ACA UGA AUU CUC ACU AAG AUU C-3’ (配列番号29)、RIG-ICアンチセンス:5’-GAA UCU UAG UGA GAA UUC AUG UCC A-3’ (配列番号30)であった。メーカーのプロトコールに従い、Lipofectamine RNAi MAX試薬(Invitrogen)を用いて細胞(6×105)に各dsRNAを120 pmol導入した。
【0077】
哺乳類発現プラスミドの作製
ヒト又はマウスの脾臓cDNAライブラリー、若しくは単離したライブラリープラスミドを鋳型として、H2B、RIG-I、ZBP1、TBK1、又はCIAOのcDNAをPCRにより増幅した。シークエンシングによりcDNA断片を確認した後、pFLAG-CMV4(Sigma)、pFLAG-CMV5(Sigma)、pCIneo-HA(25)、pCAGGS-CFP、pCAGGS-YFP、又はpcDNA3-mRFP(10)に組み込んだ。CIAOの全長及び欠失変異体を得るために、全長CIAO ORF(1-249 aa)、1-121 aa、91-249 aa又は194-249 aa領域をGFP ORFに融合させ、pFLAG-CMV4(それぞれ、FLAG-CIAO FL-GFP, FLAG-CIAO N’-3a-GFP, FLAG-CIAO C’-4a-GFP又はFLAG-CIAO C’-2a-GFP)に導入した。ヒストンH2Bの欠失変異体を得るために、全長ヒストンH2B ORF(1-126 aa)、1-103 aa、1-86 aa、1-53 aa若しくは1-37 aa(核局在シグナル)領域、又は38-126 aa(αH)領域をGFP ORFに融合させ、pCIneo-HA(それぞれ、HA-H2B FL(N’-1α2α3α4α)-GFP, HA-H2B N’-1α2α3α-GFP, HA-H2B N’-1α2α-GFP, HA-H2B N’-1α-GFP, HA-H2B N’-tail-GFP又はHA-H2B αH-GFP)に導入した。IPS-1の全長又は欠失変異体を得るために、全長IPS-1 ORF(1-540 aa)、1-100 aa、91-180 aa、1-170 aa、1-100+170-540 aa又は1-514 aa領域をそのまま、あるいはGFP ORFに融合させ、その後、pCIneo-HA(それぞれ、HA-IPS-1 FL、HA-IPS-1 CARD-GFP、HA-IPS-1 PRD-GFP、HA-IPS-1-CARD-PRD、HA-IPS-1ΔPRD又はHA-IPS-1ΔTMD)に導入した。
【0078】
酵素ツーハイブリッド法
酵母ツーハイブリッド法は既報に従って行った(25)。概要を以下に示す。H2B cDNAをbaitプラスミドであるpGBKT7(BD Clontech、Palo Alto, CA)のGAL4 DNA結合領域にフレームを合わせて組み込んだ。baitプラスミド及びヒト骨髄Matchmaker cDNAライブラリー(BD Clontech)で酵母AH109株を形質転換した。Synthetic Dropout選択寒天培地(SD/-Leu/-Trp/-Ade/-His/X-α-gal、BD Clontech)上で1×106クローンをスクリーニングした後、陽性クローンをピッキングしてpACT2ライブラリープラスミドを回収した。インサートcDNAのシークエンシングを行い、BLASTプログラムで解析した。
【0079】
一過性トランスフェクション及びレポーター遺伝子アッセイ
細胞(1×104)に、pTK-RL(Promega)25 ngと、IFN-α4又はIFN-βプロモーター・ホタルルシフェラーゼ(FFL)遺伝子カセット(pGL3 IFNα4又はpGL3 IFNβ)をコードするレポータープラスミド、若しくはpNF-κB-Luc(Stratagene)のいずれか25 ngを導入した。場合によっては、H2B、ZBP1及びRIG-Iの発現プラスミドを同時導入した。トランスフェクションの24時間後に、0.1、0.5又は2.5 μg/mLのdsDNA(poly(dA・dT)又はpoly(dG・dC))で24時間、又は40 ng/mLのTNF-αで8時間細胞を刺激した。FFL活性及び同試料中のウミシイタケルシフェラーゼ活性の測定には、いずれもDual-Glo Luciferase Assay Systemを使用した。各試料のFFL活性はウミシイタケルシフェラーゼ活性に対して標準化し、相対ルシフェラーゼ活性を算出した。
【0080】
プルダウンアッセイ
HEK293細胞にH2B-FLAGを一過性にトランスフェクトし、0.5μg/mlのビオチン-poly(dA・dT)又はビオチン- poly(dG・dC)で4又は16時間刺激した。その後、氷上にて30分間、プロテイナーゼとホスファターゼの両方のインヒビターカクテル(Sigma)を含有する溶解バッファー(25 mM Tris-HCl(pH 7.5), 1 mM EDTA, 0.1 mM EGTA, 5 mM MgCl2, 100 mM NaCl, 10% グリセロール、及び1% Nonidet P40)で細胞を溶解した。遠心分離後、上清を回収し、ストレプトアビジン-アガロースと混合し、4℃で30分間回転させた。複合体を溶解バッファーで5回洗浄し、SDSサンプルバッファー中に懸濁させ、その後、抗FLAG M2抗体を用いたイムノブロット解析に上清をかけた。
【0081】
ウイルスゲノム結合アッセイ
HEK293細胞にHA-GFP、HA-H2B FL-GFP、HA-H2B N’-tail-GFP又はHA-H2b αH-GFPを一過性にトランスフェクトした。最初のトランスフェクションの24時間後、細胞にpHPV18をトランスフェクトした。第二のトランスフェクションの48時間後、氷上にて30分間、プロテイナーゼとホスファターゼの両方のインヒビターカクテル(Sigma)を含有する溶解バッファーで細胞を溶解した。遠心分離後、上清を回収し、抗HA抗体を用いて、HA融合分子を沈降させた。複合体を溶解バッファーで5回洗浄し、その後、以下のプライマーセット:HPV18 E6, 5’-CCT GCG GTG CCA GAA ACC GT-3’ (配列番号39)及び 5’-CGT TGG AGT CGT TCC TGT CG-3’(配列番号40)を用いるサブタイプ特異的E6遺伝子をターゲットとする通常のPCRにかけた。PCR産物は2%アガロースゲルで分離し、臭化エチジウム染色の後、紫外光で可視化した。
【0082】
免疫沈降及びイムノブロット解析
免疫沈降法及びイムノブロット法は、抗ZBP1(clone#RG7D12、Stefan Rothenburg博士(National Institute of Health, USA)から分与)、抗H2B(BioVision、Mountain View, CA)、抗phospho-IRF-3(Ser396)4G4D、抗IRF3(Cell Signaling, Danvers, MA)、抗RIG-I(AnaSpec, Inc.、San Jose, CA)、抗GAPDH 6C5(Abcam)、抗Sp1、抗STAT1、抗ERK、抗phospho-STAT1(Santa Cruz Biotechnology、Santa Cruz, CA)、抗FLAG M2(Sigma)又は抗HA抗体(Roche Diagnostics, Indianapolis, IN)を用い、既報に従って行った(25)。
【0083】
蛍光共鳴エネルギー転移(FRET)
FRETのフローサイトメトリー解析として、293-F細胞(Invitrogen)に、ヒストンH2B、IPS-1又はCIAOをコードするCFP及び/又はYFP融合タンパク質を293発現培地(Invitrogen)中で24時間トランスフェクトし、FACSAria(Becton Dickinson)とBD FACSDiVaソフトウェアを用いてYFP(励起488 nm、発光530 nm)、CFP(励起407 nm、発光510 nm)、FRET(励起407 nm、発光535 nm)を測定した。FRETは、CFP励起により得られるYFP発光をCFP励起により得られるCFP発光で割った値として示す(11)。
【0084】
HPVの一過性複製
対照siRNA又はH2B siRNAで処理したSCC-4細胞に、Lipofectamine 2000トランスフェクション試薬(Invitrogen)を用いてpHPV11又はpHPV18(VG012及びVG013、ヒューマンサイエンス研究資源バンク、大阪、日本)を導入した。37℃で24、36、60、又は72時間インキュベートの後、細胞をPBSで洗浄してHirt lysis buffer(0.6% SDS、20 mM EDTA、pH 8.0)中に懸濁させた。15分後、NaClを終濃度1 Mとなるように添加し、4℃に12時間置いた。遠心分離により得られた上清をフェノール/クロロホルムで処理し、イソプロパノールでDNAを沈殿させた。複製されたDNAとインプットDNA(pHPV11又はpHPV18)を区別するため、試料をDpn Iエンドヌクレアーゼで処理し、E. coli DH5α中で増殖したインプットDNAを分解した。得られた試料をTEに溶解し、OD 260を測定して濃度を調整の上、DNA試料200 ngを用いて通常のPCRを行った。サブタイプ特異的E6遺伝子をPCRの標的とし、プライマーセットはHPV11 E6:5’-CTC CAC GTC TGC AAC ATC TA-3’ (配列番号31)及び5’-TGA CAC AGG TAA CAA CGA AT-3’ (配列番号32)、HPV16 E6:5’-CAC CAA AAG AGA ACT GCA ATG-3’ (配列番号33)及び5’-TCA CGT CGC AGT AAC TGT TG-3’ (配列番号34)を用いた。PCR産物は2%アガロースゲルで分離し、臭化エチジウム染色の後、紫外光で可視化した。
【0085】
ウイルス増殖試験
HEK293又はNIH3T3細胞に、それぞれ、AdV 5型又はMCMV MW97.01株を感染させた24時間後に、DNeasy Tissue Kit(Qiagen)を用いて総DNAを回収した。各試料100 ngを用いてPCR反応を行った。プライマーセットはAdV Hexon 5遺伝子:5’-TGA AGC TGC TAC TGC TCT TGA A-3’ (配列番号35)及び5’-GCA TTC AAC TGC CAT GCT TGG C-3’ (配列番号36)(18サイクル)、又はヒトIfn-β遺伝子プロモーター領域(-110〜+20):5’-CTA AAA TGT AAA TGA CAT AGG-3’ (配列番号37)及び5’-AAA GGT TGC AGT TAG AAT GTC-3’ (配列番号38)(18サイクル)、MCMV Dna ポリメラーゼ遺伝子:5’-ACG CCG AGA AAG AGT ACG TGC TCA A-3’(配列番号41) 及び5’-TCG GAC TGC ATC CTC TCG CAG TAG-3’(配列番号42) (22サイクル)、又はマウスCd63遺伝子, 5’-GGT CTT GGG AAT TAT CTT CTC CTG CTG-3’(配列番号43) 及び5’-CAC AGG CGG CAA AAT TCT TAA ACA TTC-3’(配列番号44) (26サイクル)を用いた。細胞上清を回収した後、既報(10)に従って、ウイルスプラークアッセイ又はTCID50により各試料1 ml中の感染性ウイルスの数を測定した。
【0086】
統計解析
統計解析にはスチューデントt検定を用いた。
【0087】
REFERENCES
1. Burckstummer, T., C. Baumann, S. Bluml, E. Dixit, G 1 . Durnberger, H. Jahn, M. Planyavsky, M. Bilban, J. Colinge, K. L. Bennett, and G. Superti-Furga. 2009. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nat Immunol 10:266-72.
2. Cheng, G., J. Zhong, J. Chung, and F. V. Chisari. 2007. Double-stranded DNA and double-stranded RNA induce a common antiviral signaling pathway in human cells. Proc Natl Acad Sci U S A 104:9035-40.
3. Fernandes-Alnemri, T., J. W. Yu, P. Datta, J. Wu, and E. S. Alnemri. 2009. AIM2 activates the inflammasome and cell death in response to cytoplasmic DNA. Nature 458:509-13.
4. Hornung, V., A. Ablasser, M. Charrel-Dennis, F. Bauernfeind, G. Horvath, D. R. Caffrey, E. Latz, and K. A. Fitzgerald. 2009. AIM2 recognizes cytosolic dsDNA and forms a caspase-1-activating inflammasome with ASC. Nature 458:514-8.
5. Isaacs, A., R. A. Cox, and Z. Rotem. 1963. Foreign nucleic acids as the stimulus to make interferon. Lancet 2:113-6.
6. Ishii, K. J., C. Coban, H. Kato, K. Takahashi, Y. Torii, F. Takeshita, H. Ludwig, G. Sutter, K. Suzuki, H. Hemmi, S. Sato, M. Yamamoto, S. Uematsu, T. Kawai, O. Takeuchi, and S. Akira. 2006. A Toll-like receptor-independent antiviral response induced by double-stranded B-form DNA. Nat Immunol 7:40-8.
7. Ishii, K. J., T. Kawagoe, S. Koyama, K. Matsui, H. Kumar, T. Kawai, S. Uematsu, O. Takeuchi, F. Takeshita, C. Coban, and S. Akira. 2008. TANK-binding kinase-1 delineates innate and adaptive immune responses to DNA vaccines. Nature 451:725-9.
8. Jakel, S., J. M. Mingot, P. Schwarzmaier, E. Hartmann, and D. Gorlich. 2002. Importins fulfil a dual function as nuclear import receptors and cytoplasmic chaperones for exposed basic domains. Embo J 21:377-86.
9. Janicki, S. M., T. Tsukamoto, S. E. Salghetti, W. P. Tansey, R. Sachidanandam, K. V. Prasanth, T. Ried, Y. Shav-Tal, E. Bertrand, R. H. Singer, and D. L. Spector. 2004. From silencing to gene expression: real-time analysis in single cells. Cell 116:683-98.
10. Jounai, N., F. Takeshita, K. Kobiyama, A. Sawano, A. Miyawaki, K. Q. Xin, K. J. Ishii, T. Kawai, S. Akira, K. Suzuki, and K. Okuda. 2007. The Atg5 Atg12 conjugate associates with innate antiviral immune responses. Proc Natl Acad Sci U S A 104:14050-5.
11. Kawai, T., S. Sato, K. J. Ishii, C. Coban, H. Hemmi, M. Yamamoto, K. Terai, M. Matsuda, J. Inoue, S. Uematsu, O. Takeuchi, and S. Akira. 2004. Interferon-alpha induction through Toll-like receptors involves a direct interaction of IRF7 with MyD88 and TRAF6. Nat Immunol 5:1061-8.
12. Kawane, K., M. Ohtani, K. Miwa, T. Kizawa, Y. Kanbara, Y. Yoshioka, H. Yoshikawa, and S. Nagata. 2006. Chronic polyarthritis caused by mammalian DNA that escapes from degradation in macrophages. Nature 443:998-1002.
13. Kimura, H. 2005. Histone dynamics in living cells revealed by photobleaching. DNA Repair (Amst) 4:939-50.
14. Konishi, A., S. Shimizu, J. Hirota, T. Takao, Y. Fan, Y. Matsuoka, L. Zhang, Y. Yoneda, Y. Fujii, A. I. Skoultchi, and Y. Tsujimoto. 2003. Involvement of histone H1.2 in apoptosis induced by DNA double-strand breaks. Cell 114:673-88.
15. Kumar, H., T. Kawai, H. Kato, S. Sato, K. Takahashi, C. Coban, M. Yamamoto, S. Uematsu, K. J. Ishii, O. Takeuchi, and S. Akira. 2006. Essential role of IPS-1 in innate immune responses against RNA viruses. J Exp Med 203:1795-803.
16. Mosammaparast, N., K. R. Jackson, Y. Guo, C. J. Brame, J. Shabanowitz, D. F. Hunt, and L. F. Pemberton. 2001. Nuclear import of histone H2A and H2B is mediated by a network of karyopherins. J Cell Biol 153:251-62.
17. Muhlhausser, P., E. C. Muller, A. Otto, and U. Kutay. 2001. Multiple pathways contribute to nuclear import of core histones. EMBO Rep 2:690-6.
18. Napirei, M., H. Karsunky, B. Zevnik, H. Stephan, H. G. Mannherz, and T. Moroy. 2000. Features of systemic lupus erythematosus in Dnase1-deficient mice. Nat Genet 25:177-81.
19. Redon, C., D. Pilch, E. Rogakou, O. Sedelnikova, K. Newrock, and W. Bonner. 2002. Histone H2A variants H2AX and H2AZ. Curr Opin Genet Dev 12:162-9.
20. Roberts, T. L., A. Idris, J. A. Dunn, G. M. Kelly, C. M. Burnton, S. Hodgson, L. L. Hardy, V. Garceau, M. J. Sweet, I. L. Ross, D. A. Hume, and K. J. Stacey. 2009. HIN-200 proteins regulate caspase activation in response to foreign cytoplasmic DNA. Science 323:1057-60.
21. Stetson, D. B., and R. Medzhitov. 2006. Recognition of cytosolic DNA activates an IRF3-dependent innate immune response. Immunity 24:93-103.
22. Sun, Q., L. Sun, H. H. Liu, X. Chen, R. B. Seth, J. Forman, and Z. J. Chen. 2006. The specific and essential role of MAVS in antiviral innate immune responses. Immunity 24:633-42.
23. Suzuki, K., A. Mori, K. J. Ishii, J. Saito, D. S. Singer, D. M. Klinman, P. R. Krause, and L. D. Kohn. 1999. Activation of target-tissue immune-recognition molecules by double-stranded polynucleotides. Proc Natl Acad Sci U S A 96:2285-90.
24. Takaoka, A., Z. Wang, M. K. Choi, H. Yanai, H. Negishi, T. Ban, Y. Lu, M. Miyagishi, T. Kodama, K. Honda, Y. Ohba, and T. Taniguchi. 2007. DAI (DLM-1/ZBP1) is a cytosolic DNA sensor and an activator of innate immune response. Nature 448:501-5.
25. Takeshita, F., K. J. Ishii, K. Kobiyama, Y. Kojima, C. Coban, S. Sasaki, N. Ishii, D. M. Klinman, K. Okuda, S. Akira, and K. Suzuki. 2005. TRAF4 acts as a silencer in TLR-mediated signaling through the association with TRAF6 and TRIF. Eur J Immunol 35:2477-85.
26. Wang, Z., M. K. Choi, T. Ban, H. Yanai, H. Negishi, Y. Lu, T. Tamura, A. Takaoka, K. Nishikura, and T. Taniguchi. 2008. Regulation of innate immune responses by DAI (DLM-1/ZBP1) and other DNA-sensing molecules. Proc Natl Acad Sci U S A 105:5477-82.
27. Yasutomo, K., T. Horiuchi, S. Kagami, H. Tsukamoto, C. Hashimura, M. Urushihara, and Y. Kuroda. 2001. Mutation of DNASE1 in people with systemic lupus erythematosus. Nat Genet 28:313-4.
28. Yoshida, H., Y. Okabe, K. Kawane, H. Fukuyama, and S. Nagata. 2005. Lethal anemia caused by interferon-beta produced in mouse embryos carrying undigested DNA. Nat Immunol 6:49-56.
【0088】
〔実施例2〕ヒストンH2Bは裸のDNAと直接相互作用する
a) 大腸菌を用いてリコンビナントGSTもしくはGST-H2Bタンパクを作製した。ビオチン標識したpoly(dA・dT)・poly(dT・dA) またはpoly(dG・dC)・poly(dC・dG)と混合後、ストレプトアビジンビーズでpull-downを行い、共沈した分子を抗GST抗体を用いた免疫ブロッティング法にて解析した。
b) HEK293細胞にFLAG-H2Bを強制発現させた後、ビオチン標識したpoly(dA・dT)・poly(dT・dA) またはpoly(dG・dC)・poly(dC・dG)を細胞内に導入し、4時間もしくは16時間後に細胞を溶解後、ストレプトアビジンビーズでpull-downを行い、共沈した分子を抗FLAG抗体を用いた免疫ブロッティング法にて解析した。
c) HEK293細胞にGFP-H2Bを強制発現させた後、Cy3標識したpoly(dA・dT)・poly(dT・dA)を細胞内に導入し、12時間もしくは24時間後に細胞を固定後Hoechstで核染し、共焦点顕微鏡で観察した。
【0089】
以上の結果より、ヒストンH2Bはin vitroおよびin vivoにおいてpoly(dA・dT)・poly(dT・dA) またはpoly(dG・dC)・poly(dC・dG)と物理的に相互作用し、細胞内で共局在することがあきらかとなった。
【産業上の利用可能性】
【0090】
本発明は、抗ウイルス剤、遺伝子を利用した治療方法(遺伝子ワクチン、遺伝子治療)の効果を調節するための薬剤または方法などに利用できる。
【配列表フリーテキスト】
【0091】
<配列番号1>
配列番号1は、ヒトヒストンH2B1Bのヌクレオチド配列を示す。BC096728(GeneBank)
ATGCCGGATCCAGCGAAATCCGCTCCTGCTCCCAAGAAGGGCTCCAAAAAGGCTGTTACGAAAGTGCAGAAGAAGGACGGCAAGAAGCGCAAGCGCAGCCGCAAGGAGAGCTACTCCGTTTACGTGTACAAGGTGCTGAAGCAGGTCCACCCCGACACCGGCATCTCGTCCAAGGCCATGGGCATCATGAACTCCTTCGTCAACGACATCTTCGAGCGCATCGCGGGAGAGGCGTCCCGCCTGGCGCACTACAACAAGCGCTCCACCATCACATCCCGCGAGATCCAGACGGCCGTGCGCCTGCTGCTGCCCGGCGAGCTGGCCAAGCACGCCGTGTCCGAGGGCACCAAGGCGGTCACCAAGTACACCAGCTCGAAGTAA
<配列番号2>
配列番号2は、ヒトヒストンH2B1Bのアミノ酸配列を示す。P33778(UniProt/Swiss-Prot)
MPEPSKSAPAPKKGSKKAITKAQKKDGKKRKRSRKESYSIYVYKVLKQVHPDTGISSKAMGIMNSFVNDIFERIAGEASRLAHYNKRSTITSREIQTAVRLLLPGELAKHAVSEGTKAVTKYTSSK
<配列番号3>
配列番号3は、マウスヒストンH2B1Bのヌクレオチド配列を示す。X80328(GeneBank)
atgccagagccttctaagtctgcaccagcccctaagaagggatctaagaaagccatctctaaggcgcagaagaaggatggcaagaagcgcaagcgcagccgcaaggagagctattcggtgtacgtgtacaaggtgctgaagcaagtgcaccccgacaccggcatctcctccaaggccatgggcatcatgaactcgttcgtgaacgacatcttcgagcgcatcgcgagcgaggcgtcccgcctggcgcattacaacaagcgctcgaccatcacgtcccgggagatccagacggccgtgcgcctgctgctgcccggggagctggccaagcacgccgtgtcggagggcactaaggccgtcaccaagtacaccagctccaagtga
<配列番号4>
配列番号4は、マウスヒストンH2B1Bのアミノ酸配列を示す。Q64475(UniProt/Swiss-Prot)
MPEPSKSAPAPKKGSKKAISKAQKKDGKKRKRSRKESYSVYVYKVLKQVHPDTGISSKAMGIMNSFVNDIFERIASEASRLAHYNKRSTITSREIQTAVRLLLPGELAKHAVSEGTKAVTKYTSSK
<配列番号5〜30>
配列番号5〜30は、siRNAのヌクレオチド配列を示す。
<配列番号31〜32>
配列番号31〜32は、HPV11 E6を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号33〜34>
配列番号33〜34は、HPV6 E6を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号35〜36>
配列番号35〜36は、AdV Hexon 5遺伝子を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号37〜38>
配列番号37〜38は、ヒトIfn-β遺伝子プロモーター領域を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号39〜40>
配列番号39〜40は、サブタイプ特異的E6遺伝子を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号41〜42>
配列番号41〜42は、MCMV Dnaポリメラーゼ遺伝子を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号43〜44>
配列番号43〜44は、マウスCd63遺伝子を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号45〜48>
配列番号45〜48は、siRNAのヌクレオチド配列を示す。
【技術分野】
【0001】
本発明は、染色体外ヒストンH2Bと二本鎖DNAの複合体及びその用途に関する。
【背景技術】
【0002】
自然免疫機構はウイルス由来の核酸(B-DNA、immunostimulatory RNA)を認識して抗ウイルス防御機構を活性化することがあきらかとされ(非特許文献1)、またその一部の機序はDNAワクチンの免疫原性にも重要であることが報告されている (非特許文献2)。
【0003】
しかしながら、二本鎖DNAを認識する機序は詳細にあきらかとされておらず、抗ウイルス剤への応用、遺伝子を利用した治療方法の効果を増強させるための薬剤または方法への応用の試みはされていない。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Nature 441:101 2006, Nat Immunol 7:40 2006
【非特許文献2】Nature 451:725 2008, Curr Opin Immunol 20:383 2008
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、自然免疫機構における二本鎖DNAを認識する機序を詳細にあきらかとすることを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、ヒストンH2Bがヌクレオソーム形成としての役割だけでなく、外来二本鎖DNAを認識して細胞内シグナルを活性化し、I型インターフェロン産生に重要な役割を果たしていることをあきらかとした。ヒストンH2Bをノックダウンすることにより、パピローマウイルス、単純ヘルペスウイルス、アデノウイルス、ヒト免疫不全ウイルスの細胞内複製が著明に亢進することから、抗ウイルス自然免疫機構において重要であることがあきらかとなった。また、二本鎖DNAによるI型インターフェロンの誘導は遺伝子ワクチンの免疫原性に重要であることをすでにあきらかにしていることから、このメカニズムを調節しているヒストンH2Bは遺伝子を利用した治療方法の効果を決定づける重要な要素であることが示唆された。そこで、ヒストンH2Bまたはそれに相互作用するアダプター分子CIAOの発現量を増加させるまたは修飾する物質または方法により抗ウイルス剤としての応用、遺伝子を介する治療方法(DNAワクチン、遺伝子治療)の効果を増強させる方法の確立が可能となると考えられた。
【0007】
本発明の要旨は以下の通りである。
(1)染色体外ヒストンH2Bと二本鎖DNAとの複合体。
(2)さらにアダプター分子を含む(1)記載の複合体。
(3)アダプター分子がCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)及び/又はIPS-1(Interferon-βPromoter Stimulator 1)である(2)記載の複合体。
(4)染色体外ヒストンH2Bと二本鎖DNAとの複合体の調節因子をスクリーニングする方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む前記方法。
(5)染色体外ヒストンH2Bと二本鎖DNAとの複合体による細胞内シグナル伝達の調節因子をスクリーニングする方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む前記方法。
(6)二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞の製造方法であって、前記哺乳動物細胞における染色体外ヒストンH2Bの発現量を減少させることを含む前記方法。
(7)染色体外ヒストンH2Bの発現量を減少させることによって、二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞。
(8)哺乳動物における免疫応答を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
(9)下記の(a)及び/又は(b)により、前記細胞内シグナル伝達を調節する(8)記載の方法。
(a) 染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加又は減少させること
(b) 染色体外ヒストンH2B及び/又はそのアダプター分子を修飾すること
(10)哺乳動物におけるI型インターフェロン誘導を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
(11)哺乳動物におけるウイルスの増殖を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
(12)哺乳動物における遺伝子を利用した治療方法の効果を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
(13)ウイルスを製造する方法であって、哺乳動物又はその細胞における染色体外ヒストンH2Bの発現量を減少させること、及び前記哺乳動物又はその細胞をウイルスに感染させることを含む前記方法。
【発明の効果】
【0008】
二本鎖DNA認識のあらたな機序をあきらかとし、その機序を調節することにより、ウイルスに対する抵抗性を調節することに成功した。
【図面の簡単な説明】
【0009】
【図1】ヒストンH2BはdsDNAによって誘導される細胞活性化を媒介する。(A)dsDNAによって誘導されるIFN-βプロモーターの活性化の媒介能に基づいて、ヒト骨髄cDNA発現ライブラリーのスクリーニングを行った。(B〜D)HEK293細胞に対照siRNA又はH2Bを標的とするsiRNAを導入した。(B)細胞をdsDNA(poly(dA・dT))0、0.1、0.5又は2.5 μg/mLで処理し、ELISA法により上清のIFN-β(PBL)を測定した。(C)細胞をdsDNA(poly(dA・dT))0.5 μg/mLで0、3、6、12、24及び48時間処理し、イムノブロット解析により核内のリン酸化IRF3(p-IRF3)及び全細胞ライセート(Cell Lysate)中のIRF3(標準化のための対照)を検討した。(D)さらに、細胞にTBK1及びIKKiの発現プラスミドを導入し、ELISA法により上清のIFN-β(PBL)を測定した。(E)HEK293細胞にヒストンH2B-FLAGを導入し、ビオチン-poly(dA・dT)又はビオチン-poly(dG・dC)で処理した。細胞のライセートを回収し、ストレプトアビジンアガロースによりプルダウンアッセイを行った。抗FLAG Abを用いてイムノブロット法により複合体を解析した。(F)HEK293細胞に、HA-GFP、HA-H2B-GFP、HA-H2B N'-テール-GFP又はHA-H2B αH-GFPを導入した。第1のトランスフェクションの24時間後、さらに細胞にHPV 18ゲノムを導入した。第2のトランスフェクションの48時間後、細胞のライセートを回収し、抗HA Abにより免疫沈降反応を行った。HPV18 E6遺伝子を標的とする標準PCRを、各細胞ライセート及び免疫沈降複合体により行った。(G)HEK293細胞にH2B siRNAを導入し、次いでさらにpGL3 IFN-β及びpTK-RL+対照、H2B FL、H2B NLSドメイン又はH2B αHドメイン発現プラスミドを導入した。dsDNA(poly(dA・dT))0、0.1、0.5又は2.5 μg/mLで24時間処理後、ルシフェラーゼアッセイを行った。(H)HEK293に対照siRNA又はH2B、H1、H2A、H3、H4のいずれかを標的とするsiRNAを導入した。さらに、細胞にpGL3 IFN-β及びpTK-RLを導入し、0.5 μg/mLのdsDNA(poly(dA・dT))、dsRNA(poly(I:C))又はTNF-α(50 ng/mL)で24時間処理あり又は処理なしで、次いでルシフェラーゼアッセイを行った。ルシフェラーゼ活性は、各刺激において対照siRNAで処理された細胞から得られた試料に対するIFN-βプロモーター活性として示された(相対的IFN-βプロモーター活性)。(A)を除き、データはいずれも6〜8試料の平均値±SDで表す。*はp < 0.05。
【図2】ヒストンH2Bは、dsRNAやTLRリガンドではなく、dsDNAがトリガーとなるシグナル活性化に関与する。HEK293(A、B、D及びE)又はHUVEC(C)細胞に、対照siRNA又はH2B、ZBP1、RIG-Iのいずれかを標的とするsiRNAを導入した。(A及びB)さらに、pGL3 IFN-β+pTK-RLの存在下で、細胞にヒストンH2B、ZBP1及びRIG-Iの発現プラスミドを導入した。(A)トランスフェクションの24時間後、dsDNA(poly(dA・dT))0、0.1、0.5又は2.5 μg/mLで24時間処理後、ルシフェラーゼアッセイを行った。(B)トランスフェクションの24時間後、抗RIG-I、抗ZBP1、抗H2B又は抗-β-アクチンAbを用いてイムノブロット解析によりタンパク質発現のレベルを検討した。(C)細胞をdsDNA(poly(dA・dT))又は5'-三リン酸化RNA(ppp-RNA)0.1又は1.0 μg/mLで24時間処理し、ELISA法により上清のIFN-βを測定した。(D)さらに、細胞にpNF-κB-Luc+pTK-RLを導入し、TNF-α(50 ng/mL)で8時間処理あり又は処理なしで、ルシフェラーゼアッセイを行った。(E)さらに、TLR2又はTLR4+MD2の発現プラスミドの存在下で、細胞にpNF-κB-Luc+pTK-RLを導入し、ペプチドグリカン(PGN、1 μg/mL)又はLPS(100 ng/mL)で24時間処理あり又は処理なしで、ルシフェラーゼアッセイを行った。*はp < 0.05、***はp < 0.001。
【図3】染色体外ヒストンH2Bは、IPS-1と相互作用する。(A)HeLa細胞に対照又はH2B siRNAを導入した。トランスフェクションの12時間後、細胞を固定し、ヘキスト33258及び抗H2B Ab、その後Alexa 488結合抗マウスIgG Abで染色し、共焦点顕微鏡下で検討した。低い及び高い照明条件で写真を撮り、それぞれ「Low」及び「High」で示した。尺度バー=20 μm。(B)細胞をH2B siRNA処理の0、6又は12時間後に回収し、細胞のライセートを細胞質の抽出物、細胞核抽出物及び染色体画分に分画した。各画分を、抗H2B、GAPDH又はSp1 Abを用いてイムノブロット法により解析した。各H2Bバンドの密度を、対応するGAPDHバンド(細胞質の抽出物)又はSp1バンド(細胞核抽出物及び染色体画分)の密度によって正規化し、グラフ(n=3)として示した。(C)12又は24時間dsDNA又はdsRNAによる又はよらない刺激の後、HeLa細胞を固定し、抗H2B Ab及び抗-IPS-1 Ab、その後Alexa 488結合抗マウスIgG Ab及びAlexa 555結合抗ウサギIgG Abで染色した。次いで、細胞を共焦点顕微鏡下で検討した。尺度バー=100 μm(低拡大倍率写真[上のパネル])及び50 μm(高拡大倍率写真[下のパネル])。(D)HEK293細胞をdsDNA刺激の0、12又は24時間後に回収し、細胞のライセートを細胞質の抽出物及び細胞核抽出物に分画した。各画分を、対照IgG、抗H2B又は抗MAVS Abで免疫沈降した。免疫複合物を、抗H2B又は抗MAVS Abのいずれかを用いてイムノブロット法により解析した。*はp < 0.05。
【図4】CIAOはヒストンH2B及びIPS-1と結合してシグナル伝達複合体となり、それによりI型IFN産生を導くシグナルを伝達する。(A及びC〜F)図に示す発現プラスミドを導入したHEK293細胞のライセートを抗FLAG抗体で免疫沈降した。この免疫複合体を抗HA抗体又は抗FLAG抗体を用いてイムノブロット法により解析した。(B)ヒストンH2B、IPS-1又はCIAOをコードするCFP及びYFP融合タンパク質を導入した293-F細胞。FRETは、CFP励起により得られるYFP発光をCFP励起により得られるCFP発光で割った値として示す。(C〜F)CIAO、IPS-1、H2B及びそれらの欠失変異体の概略図を示す。「α」は、CIAO及びH2Bの推定αヘリックス領域を示す。「*」は、標的分子の予測された遺伝子産物を示す。(G)HeLa細胞に対照siRNA又はCIAO siRNAを導入した。抗インポーチン9(C末端)モノクローナルAbを用いてイムノブロット解析を行った。(H〜I)HeLa細胞に、図に示すレポータープラスミド+図に示す量(ng)の発現プラスミドを導入した、又は導入しなかった。図1の説明に従ってルシフェラーゼアッセイを行った。データは6〜8試料の相対ルシフェラーゼ活性の平均値±SDで表す。*はp < 0.05。
【図5】dsDNAを介するシグナル伝達におけるヒストンH2B及びIPS-1の種特異的関与。(A及びB)HeLa又はNIH3T3細胞に、対照siRNA又はH2B siRNAのいずれかを導入した。(A)さらに、細胞にpGL3 IFN-β及びpTK-RLを導入し、dsDNA(poly(dA・dT))0、0.1、0.5又は2.5 μg/mLで24時間処理後、ルシフェラーゼアッセイを行った。(B)イムノブロット解析によりH2Bタンパク質発現のレベルを検討した。(C)HEK293細胞にヒト又はマウスIPS-1及びCIAOの発現プラスミドを導入した後、免疫沈降反応解析を実施した。(D)マウス又はヒトIPS-1を安定して補ったIPS-1-/- MEFを、0.5 μg/mLのdsDNA(poly(dA・dT))で3、6、12、24、36及び48時間刺激した。細胞に対して、Ifnb1 mRNA及び18S rRNAについてリアルタイムPCR解析を行った。Ifnb1 mRNAのレベルを、18S rRNAの対応するレベルで正規化し、グラフとして示した(n=4)。*はp < 0.05、**はp < 0.01。
【図6】ヒストンH2BはDNAウイルスの複製の抑制に極めて重要な要素の1つである。(A〜E)HEK293細胞(A及びC)、SCC-4(B)、NIH3T3(D)又はHeLa細胞(E)を対照siRNA又はH2B siRNAで前処理した。(A)細胞をMVAdE3L(1×105又は1×107 pfu)に感染させた。感染の24時間後に、細胞ライセートの総STAT1、リン酸化STAT1(p-STAT1)又はERKをイムノブロット法により検討した。(B)細胞にHPV-11又はHPV-16ゲノムを導入し、トランスフェクションの24、36、60又は72時間後にエピソームDNA画分を回収した。PCRによりウイルス増殖を測定した。(C及びD)細胞をAdV 5型又はMCMV MW97.01に感染させた。感染の24時間後に、ウイルスゲノムDNAのPCR増幅及びプラークアッセイ(AdV)又はTCID50(MCMV)測定によりウイルス増殖を測定した。(E)細胞をEMCVに感染させた。感染の24時間後に、プラークアッセイによりウイルス増殖を測定した。*はp < 0.05、**はp < 0.01。
【図7】ヒストンH2B siRNAの効果。HeLa細胞にコントロールもしくは様々な組合わせのヒストンH2Bを標的にしたsiRNAをトランスフェクトし、免疫ブロッティング法によりヒストンH2Bの発現量を検討した。用いたsiRNAの配列は以下のとおり。histone H2Bf116 (#1) sense, 5’-CCG UUU ACG UGU ACA AGG UGC UGA A-3’(配列番号9); histone H2Bf116 (#1) antisense, 5’-UUC AGC ACC UUG UAC ACG UAA ACG G-3’ (配列番号10);histone H2Bf169 (#2) sense, 5’-UCC AAG GCC AUG GGC AUC AUG AAC U-3’ (配列番号11); histone H2Bf169 (#2) antisense, 5’-AGU UCA UGA UGC CCA UGG CCU UGG A-3’ (配列番号12);histone H2Bj67 (#3) sense, 5’-CAG AAG AAG GAU GGC AAG AAG CGU A-3’ (配列番号45); histone H2Bj67 (#3) antisense, 5’-UAC GCU UCU UGC CAU CCU UCU UCU G-3’ (配列番号46);histone H2Bb67ms (#4) sense, 5’-CAG AAG AAA GAU GGC AAG AAG CGC A-3’ (配列番号47); histone H2Bb67ms (#4) antisense, 5’-UGC GCU UCU UGC CAU CUU UCU UCU G-3’ (配列番号48). ヒストンH2Bに対するsiRNA#1と#2の組合わせが効果的であると考えられた。
【図8】様々な遺伝子プロモーター活性化におけるヒストンH2B siRNAの効果。HEK293細胞をコントロールsiRNA(openカラム)もしくはH2B siRNA(closedカラム)と共に、IFN-α4プロモーター、IFN-βプロモーター、NF-κB, ISRE, IRFEまたはGAS依存性プロモーターによりホタルルシフェラーゼを発現するプラスミドとpTK-RLプラスミドをトランスフェクトした。24時間後、 0, 0.1, 0.5, or 2.5 μg/mlのpoly(dA・dT)またはpoly(dG・dC)で24時間刺激し、ルシフェラーゼアッセイを行った。t検定による解析で**はp < 0.01、***はp < 0.001。
【図9】アデノウイルスの細胞内増幅におけるRIG-IまたはZBP-1 siRNAの効果。HEK293細胞にコントロール、RIG-I、ZBP-1 siRNAをトランスフェクトし、その後5型アデノウイルスを感染させた。感染後24時間のウイルス量をプラークアッセイにより解析した。
【発明を実施するための形態】
【0010】
以下、本発明の実施の形態についてより詳細に説明する。
【0011】
本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体を提供する。
【0012】
ヒストンH2Bは染色体構造に必須で、細胞の恒常性維持の役割を担っている。細胞のヒストンH2Bの一部は、生細胞で生理的にクロマチン再構成が生じる際に染色体外にも存在することが示されている(Kimura, H. (2005). Histone dynamics in living cells revealed by photobleaching. DNA Repair (Amst) 4, 939-950.; Kimura, H., and Cook, P.R. (2001). Kinetics of core histones in living human cells: little exchange of H3 and H4 and some rapid exchange of H2B. J. Cell. Biol. 153, 1341-1353.)。染色体外ヒストンH2Bは、染色体外に存在する遊離ヒストンである。染色体外ヒストンH2Bと二本鎖DNAとの複合体は、シグナルソーム(細胞内情報伝達複合体)であることが好ましい。
【0013】
染色体外ヒストンH2Bの由来生物は、ヒトが好ましいが、ヒトに限らず、他の哺乳動物(マウス、ラット、ハムスター、ウサギ、ネコ、イヌ、ウシ、ウマ、ヒツジ、サル等)であってもよい。ヒストンH2Bは、ヒトで17種類、マウスで13種類報告されており、いずれの種類のヒストンH2Bを用いてもよい。その遺伝子及びアミノ酸配列情報は以下の通りである。
【0014】
【表1】

二本鎖DNAは、特に限定されるわけではないが、自然界に存在する右巻き二本鎖DNA(B-DNA)など、細胞のI型インターフェロン(IFN)産生を促進できるものであるとよい。二本鎖DNAは、外来DNAであっても、ゲノムDNAであってもよい。二本鎖DNAのヌクレオチド配列は、特に限定されないが、poly(dA・dT) ・poly(dT・dA)などのAとTに富むヌクレオチド配列が好ましい。二本鎖DNAの塩基長は、特に限定されないが、50 bp以上が好ましい。例えば、後述の実施例では、50 bp以上100 kbp以下のpoly(dA・dT) ・poly(dT・dA)及びpoly(dG・dC) ・poly(dC・dG)を用いた。この他にも、ウシ胸腺ゲノムDNA、大腸菌ゲノムDNAなどを用いてもよい。
【0015】
染色体外ヒストンH2Bと二本鎖DNAとの複合体は、染色体外ヒストンH2Bと二本鎖DNAとを接触させることにより調製することができる。例えば、染色体外ヒストンH2Bの溶液に二本鎖DNAを添加してもよいし、二本鎖DNAの溶液に染色体外ヒストンH2Bを添加してもよい。
【0016】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成は、生化学的実験、免疫組織染色と共焦点顕微鏡を用いた解析などにより確認することができる。例えば、大腸菌で作製したリコンビナントGST-H2Bタンパクと二本鎖DNAを混合し、GST親和性レジンでpull-downを行うことにより、GST-H2Bタンパクと二本鎖DNAの複合体が共沈することを確認できる。Cy3ラベルしたpoly(dA・dT) ・poly(dT・dA)を導入した細胞を固定後、抗ヒストンH2B抗体さらにFITC標識二次抗体で免疫組織染色し、共焦点顕微鏡で解析することにより、poly(dA・dT) ・poly(dT・dA)とヒストンH2Bが細胞内で共局在することが確認できる。
【0017】
本発明の複合体を構成する染色体外ヒストンH2Bは、二本鎖DNAを認識して細胞内シグナル伝達を活性化できるのであれば、染色体外ヒストンの断片であってもよい。従って、染色体外ヒストンの断片と二本鎖DNAとの複合体も本発明に包含される。
【0018】
本発明の複合体は、さらにアダプター分子を含んでもよい。アダプター分子は、ヒストンH2Bに接着する分子で、細胞内シグナル伝達に関わるものであればよく、CIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1;以前はKIAA1192として報告)、IPS-1(Interferon-β Promoter Stimulator 1)などを例示することができる。KIAA1192の機能は現時点では解析されていないが、そのヌクレオチド配列はインポーチン9のC末端と一致しており、インポーチン9の選択的スプライシングによる転写産物の1つと考えられた(後述の表S1)。本発明者らは、KIAA1192の新たな役割に基づき、改めてこれをCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)と命名した。
【0019】
また、本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体の調節因子をスクリーニングする方法を提供する。この方法は、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む。
【0020】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアンタゴニストは、染色体外ヒストンH2Bに結合し、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成を阻害する物質であればよく、例えば、染色体外ヒストンH2Bとの結合について二本鎖DNAと競合するもの、染色体外ヒストンH2Bの二本鎖DNA結合サイト以外の部位に結合するアロステリックインヒビターなどを挙げることができる。
【0021】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニストは、染色体外ヒストンH2Bに結合したときに、ヒストンH2Bと二本鎖DNAとの複合体形成によりもたらされる機能(例えば、細胞内シグナル伝達の活性化など)と同様の機能をもたらす物質であればよく、例えば、染色体外ヒストンH2Bと結合して細胞内シグナル伝達を活性化するもの、染色体外ヒストンH2Bの二本鎖DNA結合サイト以外の部位に結合するアロステリックアクティベーターなどを挙げることができる。
【0022】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定するには、例えば、以下のようにするとよい。リコンビナントGST-H2Bタンパクと二本鎖DNAと被験物質を混合し、GST親和性レジンでpull-downを行うことにより、GST-H2Bタンパクと二本鎖DNAの複合体形成が解析できる。共沈してくる二本鎖DNAの相対量が変化することにより、被験物質のヒストンH2Bと二本鎖DNAとの相互作用に与える影響を確認できる。また。この被験物質をヒト臍帯血管内皮細胞細胞もしくはHEK293細胞等の培養系に投与した後、poly(dA・dT) ・poly(dT・dA)を細胞に導入し、24時間後のIFN-β産生量もしくはIFN-βプロモーター活性を解析することで、アゴニストまたはアンタゴニストとして作用するか検討できる。
【0023】
また、本発明は、染色体外ヒストンH2Bと二本鎖DNAとの複合体による細胞内シグナル伝達の調節因子をスクリーニングする方法を提供する。この方法は、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む。
【0024】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアンタゴニストは、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達経路に作用して自然免疫を抑制する物質であればよく、例えば、染色体外ヒストンH2Bとの結合について二本鎖DNAと競合するもの、染色体外ヒストンH2Bの二本鎖DNA結合サイト以外の部位に結合するアロステリックインヒビターなどを挙げることができる。
【0025】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニストは、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達経路に作用して自然免疫を活性化する物質であればよく、例えば、染色体外ヒストンH2Bと結合して細胞内シグナル伝達を活性化するもの、染色体外ヒストンH2Bの二本鎖DNA結合サイト以外の部位に結合するアロステリックアクティベーターなどを挙げることができる。
【0026】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定するには、例えば、以下のようにするとよい。リコンビナントGST-H2Bタンパクと二本鎖DNAと被験物質を混合し、GST親和性レジンでpull-downを行うことにより、GST-H2Bタンパクと二本鎖DNAの複合体形成が解析できる。共沈してくる二本鎖DNAの相対量が変化することにより、被験物質のヒストンH2Bと二本鎖DNAとの相互作用に与える影響を確認できる。また。この被験物質をヒト臍帯血管内皮細胞もしくはHEK293細胞等の培養系に投与した後、poly(dA・dT) ・poly(dT・dA)を細胞に導入し、24時間後のIFN-β産生量もしくはIFN-βプロモーター活性を解析することで、アゴニストまたはアンタゴニストとして作用するか検討できる。
【0027】
さらに、本発明は、二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞の製造方法を提供する。この方法は、前記哺乳動物細胞における染色体外ヒストンH2Bの発現量を減少させることを含む。
【0028】
二本鎖DNAにより誘導される生物学的活性としては、I型インターフェロン産生、サイトカイン、ケモカイン産生、MHC分子、副刺激分子発現などを例示することができるが、これらに限定されることはない。
【0029】
I型インターフェロン産生の抑制は、例えば、以下のようにして調べることができる。血清もしくは培養上清を採取し、IFN-αもしくはIFN-βELISAキット(PBL社)を用いることで産生量の絶対値を測定および比較できる。
【0030】
また、血清もしくは培養上清を採取し、ELISAキットを用いることでサイトカインまたはケモカイン産生量の絶対値を測定および比較できる。また、MHC分子、副刺激分子については、細胞を特異抗体と作用させた後、フローサイトメトリーで解析することで、発現量を比較できる。
【0031】
哺乳動物細胞としては、HEK293T、HEK293、HeLa細胞、ヒト臍帯血管内皮細胞などを例示することができるが、これらに限定されることはない。
【0032】
哺乳動物細胞における染色体外ヒストンH2Bの発現量を減少させるには、例えば、RNA干渉、shRNA発現プラスミドの細胞内導入、all-trans retinoic acidの投与(BBRC 213:616 1995)などの方法を用いる。
【0033】
RNA干渉に用いる二本鎖DNA(siRNA)としては、以下のものを例示することができるが、これらに限定されることはない。
【0034】
ヒストンH2Bf116センス:5’-CCG UUU ACG UGU ACA AGG UGC UGA A-3’(配列番号9)、ヒストンH2Bf116アンチセンス:5’-UUC AGC ACC UUG UAC ACG UAA ACG G-3’(配列番号10)
ヒストンH2Bf169センス:5’-UCC AAG GCC AUG GGC AUC AUG AAC U-3’ (配列番号11)、ヒストンH2Bf169アンチセンス:5’- AGU UCA UGA UGC CCA UGG CCU UGG A-3’ (配列番号12)
siRNAを哺乳動物細胞に導入するには、細胞導入試薬を用いる方法、エレクトロポレーション法などを用いるとよい。
【0035】
また、本発明は、上記のように、染色体外ヒストンH2Bの発現量を減少させることによって、二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞も包含する。
【0036】
さらにまた、本発明は、哺乳動物における免疫応答を調節する方法を提供する。この方法は、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む。
【0037】
哺乳動物としては、ヒト、ヒト以外の動物(例えば、マウス、ラット、ハムスター、ウサギ、ネコ、イヌ、ウシ、ウマ、ヒツジ、サル等)を例示することができる。
【0038】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達の調節は、例えば、下記の(a)及び/又は(b)により行う。
【0039】
(a) 染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加又は減少させること
(b) 染色体外ヒストンH2B及び/又はそのアダプター分子を修飾すること
染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加させるには、例えば、ヒストンH2B及び/又はそのアダプター分子を発現させる遺伝子カセットを細胞内に導入する。
【0040】
染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加させることにより、哺乳動物における免疫応答を活性化することができる。
【0041】
染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を減少させるには、例えば、RNA干渉、all-trans retinoic acidの投与(BBRC 213:616 1995)などを用いる。
【0042】
RNA干渉に用いる二本鎖DNA(siRNA)の例は上述の通りである。
【0043】
siRNAを哺乳動物に導入するには、細胞導入試薬を用いる方法、エレクトロポレーション法などを用いるとよい。また、ベクターにshRNA(short hairpin RNA)を発現するカセットを組込み、同一のベクターから標的遺伝子とH2B shRNAを共発現させる方法を用いてもよい。
【0044】
染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を減少させることにより、哺乳動物における免疫応答を抑制することができる。
【0045】
染色体外ヒストンH2B及び/又はそのアダプター分子を修飾するとは、ヒストンH2Bの翻訳後修飾で、メチル化、リン酸化、アセチル化、ユビキチン化などを含む概念である。
【0046】
染色体外ヒストンH2B及び/又はそのアダプター分子を修飾するには、例えば、以下のようにすればよい。アセチル化修飾を抑制する方法としてanacardic acidを添加する。脱アセチル化を抑制する方法としてM344を添加する。
【0047】
染色体外ヒストンH2B及び/又はそのアダプター分子を修飾することにより、哺乳動物における免疫応答を調節(すなわち、活性化もしくは不活化)することができる。
【0048】
染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することにより、哺乳動物における免疫応答を調節できる他、哺乳動物におけるI型インターフェロン誘導を調節したり、哺乳動物におけるウイルスの増殖を調節したり、哺乳動物における遺伝子を利用した治療方法の効果を調節することができる。
【0049】
例えば、染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加させることにより、哺乳動物におけるI型インターフェロン誘導が促進したり、哺乳動物におけるウイルスの増殖が減少したり、哺乳動物における遺伝子を利用した治療方法の効果が増加しうる。
【0050】
また、例えば、染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を減少させることにより、哺乳動物におけるI型インターフェロン誘導が抑制されたり、哺乳動物におけるウイルスの増殖が増加したり、哺乳動物における遺伝子を利用した治療方法の効果が減少しうる。
【0051】
あるいは、例えば、染色体外ヒストンH2B及び/又はそのアダプター分子を修飾することにより、哺乳動物におけるI型インターフェロン誘導が促進したり、哺乳動物におけるウイルスの増殖が減少したり、哺乳動物における遺伝子を利用した治療方法の効果が増加しうる。
【0052】
従って、本発明は、哺乳動物におけるI型インターフェロン誘導を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法;哺乳動物におけるウイルスの増殖を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法;及び哺乳動物における遺伝子を利用した治療方法の効果を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法も包含する。
【0053】
また、染色体外ヒストンH2Bの発現量を減少させることにより、哺乳動物又はその細胞におけるウイルスの増殖を増加させることができる。従って、本発明は、ウイルスを製造する方法であって、哺乳動物又はその細胞における染色体外ヒストンH2Bの発現量を減少させること、及び前記哺乳動物又はその細胞をウイルスに感染させることを含む前記方法も包含する。
【0054】
哺乳動物をウイルスに感染させるには、例えば、1細胞当たり0.001〜1000 pfuのウイルスを感染させるとよい。
【0055】
哺乳動物をウイルスに感染させるには、例えば、動物1匹当たり1x107〜1x1013 pfuのウイルスを感染させるとよい。
【実施例】
【0056】
以下、実施例に基づいて本発明を詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【0057】
〔実施例1〕染色体外ヒストンH2Bは細胞内二本鎖DNAによって誘導される抗ウイルス自然免疫応答を媒介する
要約
右巻きらせん構造を取るdsDNA断片(B-DNA)は、細胞のI型インターフェロン(IFN)産生を促進する。アダプター分子の1つであるIFN-βプロモーター刺激因子(IPS-1)は、ヒト細胞においてdsDNAによる細胞内シグナル伝達を媒介するが、その背景にある分子機構は十分に解明されていない。今回本発明者らは、染色体外ヒストンH2Bがヒト細胞において抗ウイルス自然免疫応答を媒介することを示す。H2Bは、新たに同定されたCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)というアダプターと結合することでIPS-1と物理的に相互作用し、dsDNAによる細胞内シグナルを伝達するが、免疫賦活性RNAの細胞内シグナルは伝達しない。染色体外ヒストンH2Bは、DNAウイルス(アデノウイルス及びヒト乳頭腫ウイルス)の増殖を抑制する細胞自律的な応答において生物学的に重要であったが、RNAウイルス(水疱性口内炎ウイルス及び脳心筋炎ウイルス)の増殖は抑制しなかった。したがって今回の知見は、dsDNAにより誘発され、抗ウイルス自然免疫応答のトリガーとなるシグナル伝達経路に染色体外ヒストンH2Bが関与することを明らかにするものである。
【0058】
緒言
病原体又は宿主細胞に由来する核酸断片は、I型IFN産生の誘導を通じて、ある種のウイルスの増殖を抑制する細胞自律的な応答を活性化する(5)。こうした作用は、トランスフェクション法やエレクトロポレーション法によってdsDNAが細胞内区画に導入される場合に一段と顕著であり、DNAの感知システムが細胞内の異常DNA断片を認識することが示唆される(6, 21, 23)。右巻きらせん構造を取るdsDNA(すなわち、B-DNA)は、左巻きのジグザグ構造を取るZ-DNAよりもI型IFNの誘導能が高い(6)。dsDNAは、樹状細胞やマクロファージなどの免疫細胞、及び線維芽細胞や上皮細胞、甲状腺細胞などの非免疫細胞を含むさまざまな種類の細胞でI型IFNの産生を活性化する(6, 23)。dsDNAのこうした作用は、DNase II欠損マウスの細胞内に未分解のDNA断片が蓄積することにより、IFN-βの過剰産生、赤血球新生の調節不全、関節リウマチと類似の症状が認められることにより確認された(12, 28)。全身性エリテマトーデス(SLE)患者ではDnase I遺伝子の機能喪失型変異がみられ、事実、DNase I-/-マウスでは、SLE様症状とともに抗DNA抗体産生が認められる(18, 27)。
【0059】
dsDNAの免疫賦活性は、dsRNAや5'-三リン酸化RNA(5'-triphosphorylated RNA)といった免疫賦活性RNA(isRNA)の性質と酷似している(2, 6)。実際、dsDNAのシグナル伝達経路の一部はisRNAのシグナル伝達経路と共通している。レチノイン酸誘導遺伝子-I(retinoic acid-inducible gene I:RIG-I)及びメラノーマ分化関連遺伝子5(melanoma differentiation-associated gene 5:MDA5)はisRNAと直接結合してシグナル伝達のトリガーとなる一方、ヒト肝癌細胞株huH7において、RIG-IはdsDNAと直接的には相互作用しないがそのシグナル伝達を媒介することが示された(2)。IFN-βプロモーター刺激因子1(IPS-1;ミトコンドリア抗ウイルスシグナル伝達(MAVS)とも呼ばれる)は、ヒトではdsDNA又はisRNAによって誘導される下流シグナル伝達を媒介するが、マウスではisRNAによるシグナル伝達のみを媒介し、dsDNAによるシグナル伝達は媒介しない(2, 6, 15, 22)。これに対し、TANK結合キナーゼ1(TBK1)及び誘導性IκBキナーゼ(IKKi)は、ヒトとマウスの両方において、dsDNA又はisRNAによって誘導されるI型IFN産生に必須である(2, 6)。isRNAではなくdsDNAを介する上流シグナル伝達に関与する分子を調べたところ、少なくともマウス結合組織細胞株L929では、Z-DNA結合タンパク質1(ZBP1;DNA依存性IFN調節因子活性化分子(DAI)とも呼ばれる)が細胞質内DNAセンサーの候補分子として同定されたが、この分子のin vivoでの役割は必須ではなかった(7, 24, 26)。最近、PYHINファミリーのメンバーであるAIM2(absent in melanoma 2)が、インフラマソームのシグナル伝達アダプターの1つであるASC(apoptosis-associated speck-like protein containing a CARD)と結合し、dsDNAに応答するカスパーゼ1の活性化とIL-1β分泌に重要な役割を果たすことが示された(1, 3, 4, 20)。
【0060】
本研究において、本発明者らは、染色体外ヒストンH2Bがヒト細胞におけるdsDNA誘導性I型IFN産生とDNAウイルス感染への自然免疫反応の原因となっていることを示す。
【0061】
結果
dsDNAによって誘導されるIFN-βプロモーター活性化のメディエーターとしてのヒストンH2Bの同定
ヒト細胞においてdsDNAを介するI型IFN産生を担う分子を同定するため、IFN-βプロモーターの制御下にルシフェラーゼ遺伝子を安定発現しているHEK293T細胞を用いて、ヒト骨髄cDNA発現ライブラリーのスクリーニングを行った。調べた960,000個以上の独立クローンのうち、陽性クローンの1つにヒストンH2B1BのORFが含まれ、dsDNAによって誘導されるIFN-βプロモーターの活性化が著しく増強していた(図1A)。dsDNAによって誘導される自然免疫応答におけるヒストンH2Bの役割を確認するため、低分子干渉RNA(siRNA)を用いてRNA干渉を行った。H2B siRNA処理により、H2Bタンパク質の発現レベルが著しく抑制された(図7)。H2B siRNA処理は、HEK293細胞におけるIFN-β産生及びdsDNAによって誘導されるIFN制御因子3(IRF3)のリン酸化のレベルも抑制し(それぞれ図1B及び1C)、ヒストンH2Bのノックダウンにより、IFN関連遺伝子の発現を調節する各種遺伝子プロモーターの、dsDNAによって誘導される活性化が阻害された(図8)。dsDNAは、TBK1やIKKiといったIRFキナーゼを刺激する(6)。TBK1及びIKKiの過剰発現は、対照HEK293細胞とH2BノックダウンHEK293細胞の両細胞において同レベルのIFN-β産生を引き起こしたことから、H2Bがこれらキナーゼの上流で機能することが示唆された(図1D)。ヒストンH2B及びdsDNAの細胞内相互作用を確認するため、プルダウン及び免疫沈降解析を行った。その結果、ヒストンH2Bは、細胞にトランスフェクトしたビオチン化(poly(dA・dT))又は(poly(dG・dC))で共沈された(図1E)。さらにヒストンH2BのdsDNA相互作用ドメインを同定するために、H2B変異体を用いた免疫沈降解析を行った。ヒストンH2BのC末端αヘリックス領域(αHドメイン)がHPV DNAとの相互作用に十分であることが示された(図1F)。さらに、ノックダウン細胞の完全長ヒストンH2Bの相補性によって、dsDNAにより誘発されるIFN-βプロモーターの活性化のレベルが回復されたが、NH2-末端テール領域(N'-テール)やαHドメイン単独はそうではなかった(図1G)。これらの結果から、ヒストンH2Bは、αHドメインを介してdsDNAに結合するが、N'-テール及びαHドメインの両方がdsDNAを介するシグナル伝達に必要とされることが示唆される。ヒストンH1、H2A、H2B、H3又はH4を標的とする各siRNAについて試験したところ、H2B siRNAのみがdsDNAによって誘導されるIFN-βプロモーターの活性化を低下させた(図1H)。H2B siRNAのこうした作用は、dsRNA又はTNF-αによる刺激の後には観察されなかった(図1H)。これらの結果から、ヒストンH2Bは、dsDNAがトリガーとなるシグナル活性化に関与することが示唆される。
【0062】
ヒストンH2Bは、dsRNAやTLRリガンドではなく、dsDNAがトリガーとなるシグナル活性化に関与する
ZBP1又はRIG-Iは、それぞれマウス結合組織細胞株(L929)又はヒトヘパトーマ細胞株(huH7)における細胞質ゾルDNAセンサーとして知られたものである。dsDNAによって誘導されるIFN-βプロモーターの活性化は、ヒストンH2B siRNA処理した細胞では有意に抑制され、ZBP1又はRIG-Iを標的とするsiRNAで処理した細胞では抑制されなかったが(図2A)、それぞれのsiRNAは、HEK293細胞における標的タンパク質の発現レベルを特異的に低下させた(図2B)。ヒト臍帯静脈内皮細胞(HUVEC)では、ヒストンH2BのノックダウンによりdsDNA刺激に応答するIFN-β産生が抑制されたが、5'-三リン酸化RNA刺激に応答するIFN-β産生は抑制されなかった(図2C)。ヒストンH2Bは染色体の必須構成要素の1つであるが、本研究で用いたH2Bノックダウン細胞は正常に増殖することができ、TNF-α又はTLRリガンドへの反応は対照siRNA処理した細胞と同等であったことから(図2D及び2E)、これらのsiRNAの使用により細胞の生存やTNFR又はTLRを介するシグナル伝達経路に必須である染色体のヒストンH2Bは障害されなかったことが示唆される。これらの結果を総合すると、ヒストンH2Bは、dsRNAやTLRリガンドではなく、dsDNAがトリガーとなるシグナル活性化に関与することが示唆される。
【0063】
染色体外のヒストンH2Bは、細胞形質におけるIPS-1と結合する
ほとんどのヒストンH2Bはヘキスト染色(染色体)と共局在したものの、一部のH2Bが染色体外領域で染色したことが、免疫蛍光解析によって明らかになった(図3A)。細胞がH2B siRNAで処理される場合、そのような染色体外のH2Bのレベルは低下したが、同じ細胞の染色体H2Bは、対照細胞の染色体H2Bと同等のレベルで存在した。ヒストンも核から放出されることが知られていることから(14)、イムノブロット解析によって各細胞画分のヒストンH2Bのレベルを評価した。免疫蛍光解析の結果から、H2B siRNAは有意に染色体外H2Bを減少させたが、染色体H2Bは減少させなかった(図3B)。dsRNAではなくdsDNAにより細胞が12時間刺激された場合のみ、細胞形質においてH2B蛍光の点状のシグナルが検出されたが(図3C)、このことによって、dsDNAにより細胞形質におけるヒストンH2Bの凝集が誘導されるということが示唆される。興味深いことに、刺激後12時間のdsDNA刺激の後、IPS-1とのH2Bの共局在化が観察された(図3C、マゼンタの矢印)。ヒストンH2BとIPS-1との間の分子相互作用をさらに検討するため、免疫沈降反応解析を行った。dsDNAの有無にかかわらず刺激されるHEK293細胞から細胞質抽出物及び染色体の形成後の細胞核抽出物を分離した。図3Dに示すように、抗GAPDH(細胞質酵素)又は抗Sp1(核転写因子)Abによるイムノブロット解析によって、各抽出物の純度を確認した。IPS-1は、大部分が細胞質抽出物に存在したが、一方でヒストンH2Bは、両方の抽出物に存在した。細胞質抽出物からIPS-1を免疫沈降した際、ヒストンH2Bの共沈は、刺激前に検出されなかったが、dsDNA刺激の12時間後に検出された。これに対して、H2Bが細胞核抽出物から免疫沈降した際、dsDNA刺激の後であっても、検出可能なIPS-1は共沈しなかった。まとめると、これらの結果から、dsDNA刺激の後、細胞形質においてヒストンH2BとIPS-1との間の相互作用が生じることが示唆される。
【0064】
ヒストンH2B及びIPS-1を結合させる種特異的分子としてのCIAOの同定
ヒストンH2Bと直接結合する分子を同定するため、酵母ツーハイブリッド法を行った。その結果、陽性クローンの10個中3個がKIAA1192と同定された。KIAA1192の機能は現時点では解析されていないが、そのヌクレオチド配列はインポーチン9のC末端と一致しており、インポーチン9の選択的スプライシングによる転写産物の1つと考えられた(表S1)。本発明者らは、KIAA1192の新たな役割(後述)に基づき、改めてこれをCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)と命名した。免疫沈降法により、CIAOはヒストンH2B及びIPS-1とは結合するが、RIG-Iとは結合しないことが明確に示された(図4A)。完全長インポーチン9は、ヒストンH2Bと相互作用したが、IPS-1とは相互作用せず(データ示さず)、このことにより、インポーチン9の交互スプライシング変異体であり得るCIAOは、IPS-1の相互作用する相手としての特有の機能を得ることが示唆された。蛍光共鳴エネルギー転移(FRET)解析によって、細胞内におけるH2B、CIAO及びIPS-1の空間的配置をさらに検討した。図4Bに示すように、より高いレベルの特異的FRETシグナルは、CFP-H2B及びYFP-IPS-1を発現する細胞と比較して、CFP-CIAO及びYFP-H2B並びにCFP-CIAO及びYFP-IPS-1を発現する細胞内で検出されたが、このことによって、CIAO及びH2B或いはCIAO及びIPS-1が密な空間内に並び、且つ、CIAOは、分子複合体内のH2BとIPS-1との間に配置し、このことにより、ヒストンH2BをIPS-1に結合するアダプターとしての役割を果たすということが示唆される。分子相互作用を担うCIAO、ヒストンH2B及びIPS-1のドメインの特徴をさらに評価した。免疫沈降反応解析により、CIAOのC末端領域(194〜249 aa)はIPS-1との相互作用に十分であるが、CIAOの中央領域(91〜193 aa)は、H2Bとの相互作用に必要とされることが示された(図4C及び4D)。CIAOとの相互作用には、IPS-1のプロリンリッチドメイン(PRD)(94〜170 aa)が必要とされる一方で、H2BのN'-テール(1〜37 aa)が十分である(図4E及び4F)。CIAOはHeLa及びHEK293細胞において内因性発現し(図4G及びデータは示されない)、CIAO ORFを標的とするsiRNAの処理によって、有意にCIAOの発現レベルが抑制されたが、インポーチン9タンパク質の発現レベルは抑制されなかった(図4G)。CIAOのノックダウンにより、dsDNAにより誘導されたIFN-βプロモーターの活性化が著しく低下したが(図4H)、一方でCIAOの過剰発現は、IPS-1により誘導されたI型INFプロモーターの活性化を促進した(図4I)。まとめると、これらの結果から、CIAOはヒストンH2BをIPS-1に結合させ、このことにより、ヒト細胞において、H2Bを介するI型IFN産生が可能になることが示された。
【0065】
【表2】

dsDNAを介するシグナル伝達におけるヒストンH2B及びIPS-1の種特異的関与
以前の報告によって、種の間でdsDNAシグナル伝達に機構的な差があることが示されており、例えば、ヒトIPS-1はdsDNAを介する細胞性シグナル伝達に関与するが、マウスIPS-1は関与しない(2、6、15、22)。dsDNAによって誘導される種特異的シグナル伝達経路の基礎をなす分子機構を検討するため、ヒト及びマウスの細胞におけるH2Bノックダウンの効果を比較した。その結果、H2Bのノックダウンにより、HeLa細胞ではdsDNAを介するIFN-βプロモーターの活性化が抑制されたが、NIH3T3細胞では抑制されず(図5A及び5B)、このことにより、これらの種の間でヒストンH2Bの作用に差があることが示唆される。しかしながら、興味深いことに、ヒトのCIAOとIPS-1との間に相互作用が認められたにもかかわらず、マウスのCIAOとIPS-1との間に相互作用は認められなかった(図5C)。アミノ酸配列の高い同一性が、ヒトとマウスのH2Bサブタイプ(ヒトH2B1A、1B、1C、1D、1H、1J、1K、1L、1M、1N、1O、2E、2F、3B、FSとマウスH2B1A、1B、1C、1F、1H、1K、1M、1P、3A)の中(70.1%超)及びヒトとマウスのCIAOの間(99.2%)で認められた一方で、低い同一性が、ヒトとマウスのIPS-1アミノ酸配列の間(30.3%)に認められた。したがって、ヒトIPS-1はヒストンH2Bと相互作用してシグナルを伝達できるが、マウスIPS-1にはこの機能がないと考えられる。dsDNAを介するシグナル伝達におけるヒトIPS-1特異的機構をさらに検討するため、IPS-/-マウス胎児線維芽細胞(MEF)にマウスIPS-1(マウスIPS-1 MEF)又はヒトIPS-1(ヒトIPS-1 MEF)を補い、dsDNAに対するそれらの応答を調べた。Ifnb1 mRNA発現が3時間以内に誘導された一方で、そのレベルはdsDNA刺激の12時間後にピークに達し、その後マウスIPS-1 MEFにおいて減少した(図5D)。それに対して、Ifnb1 mRNA発現のレベルは、ヒトIPS-1 MEFのdsDNA刺激の24時間後にピークに達し、全体のレベルは、ヒトIPS-1 MEFが、マウスIPS-1 MEFよりも有意に高かった(図5D)。したがって、これらの結果をまとめると、ヒトIPS-1は、MEFに内因的に存在するdsDNAシグナル伝達によって媒介されるものと比較して、IFN-βの後期誘導を媒介することが示唆される(図5D)。
【0066】
染色体外ヒストンH2BはDNAウイルスの増殖の抑制に関与する
細胞自律的な抗ウイルス応答に対するヒストンH2Bの生物学的役割をさらに検討した。ヒストンH2Bをノックダウンしたところ、ワクシニアウイルスによって誘導されるIFN-β産生並びにSTAT1のリン酸化が抑制された(図6A)。H2Bノックダウン細胞では、ヒト乳頭腫ウイルス(HPV11及びHPV16)及びアデノウイルス5型(AdV)の増殖が著しく促進されたが(それぞれ図6B及び6C)、RIG-I又はZBP-1ノックダウン細胞では促進されなかった(図9)。しかし、H2Bのノックダウンは、マウス細胞におけるマウス-サイトメガロウイルス(MCMV)や、ヒト細胞におけるRNAウイルス(脳心筋炎ウイルス[EMCV])の増殖にはほとんど影響を及ぼさなかった(図6D及び6E)。これらの知見は、染色体外ヒストンH2BがDNAウイルス感染の感知機構に関与し、ヒト細胞における細胞自律的な抗ウイルス自然免疫応答を媒介することを示唆している。
【0067】
考察
今回の結果は、dsDNAがトリガーとなるシグナル伝達経路において染色体外ヒストンH2Bが重要な役割を果たしていることを直接的に証明するものである。生物学的には、dsDNAが放出されるのは、細胞に異常又は「危険な」状況(感染やアポトーシス、組織損傷など)が生じた場合である(6, 18, 23)。そのため、染色体外ヒストンH2B、CIAO及びIPS-1で構成されるシグナルソームを介したシグナル伝達経路は、病原体の認識に対応するものとしてだけでなく、異常な自己DNAに対する自己認識機構として進化してきたのかもしれない。
【0068】
通常、ヒストンH2Bはコアヒストンとしてヌクレオソームに組み込まれているが、生細胞内ではヒストンの交換や組み込みが頻繁に生じており、H2B全量の約3%は半減期が約6分、約40%は半減期が約130分、50%超は半減期が約8.5時間である。実際、NAP-1(nucleosome assembly protein 1)は、H2AとH2Bの交換やヌクレオソームのスライディングの援助を通じてクロマチンの流動性を媒介している(13)。細胞質コアヒストンの核内移行は、インポーチンファミリーメンバーを介する複数の重複した経路を通じて生じる。インポーチン9は、核のコア複合体を経由するH2Bの輸送における最も生産的な経路の1つを媒介する(8, 17)。興味深いことに、哺乳類インポーチン9の酵母ホモログの1つであるカリオフェリン114pは、細胞質のH2A-H2B複合体と結合する(16)。これらの証拠は、ヌクレオソームから解離した染色体外ヒストンH2BがdsDNAによって誘導されるシグナル伝達に重要な役割を果たすという今回の観察結果を強力に支持するものである。
【0069】
過去数十年間に示された一連の証拠は、ヒストンがどのようにゲノムDNAに組み込まれてヌクレオソームを構成するかを示している。ほとんどの研究は、ヒストンはある生理的条件の下でゲノムDNAのみを標的とするという仮定に注目していた。しかし近年の研究では、染色体外でヒストンのサブタイプが異なる役割を果たしていることが示されている。H2A.Xは、DNA二重鎖の切断が生じる場合にリン酸化してリクルートされ(19)、H3.3は遺伝子転写が活性化する場合に凝縮したクロマチンに蓄積する(9)。さらに特筆すべきは、H1.2は核からミトコンドリアに移行してDNA損傷に起因するアポトーシスシグナルを伝達し、これがミトコンドリアからのBak依存的なシトクロムc放出の制御に決定的な役割を果たすという事実である(14)。そのため、シグナルソームの構成要素の1つとしての染色体外ヒストンH2Bの性質を詳細に解析することは、染色体外ヒストンの生物学的役割や、病原体の侵入をdsDNAが感知した際の細胞自律的な防御機構を理解するのに役立つ可能性がある。
【0070】
CIAOは、インポーチン9のORF(793-1041)のC末端と同一である750 bpのORFをコードしており、シグナル伝達を担うドメインや領域は特にみられなかった。本発明者らはCIAOのC末端領域がIPS-1 PRDとの相互作用に十分であり、CIAOの中央領域がH2BのN末端tail領域との相互作用に必要であることを確認したが、生理的条件下、又はウイルス感染中のシグナルソーム形成のダイナミクスは今後の検討課題である。そうしたダイナミクスを調べるため、現在本発明者らは、複合体形成の前又は後に修飾された各分子の特定の残基を標的とすることにより内在性のCIAOとインポーチン9を識別する、又は染色体外ヒストンH2Bと染色体ヒストンH2Bを識別するための抗体や薬剤を作製中である。
【0071】
RIG-Iがヒト肝癌細胞株であるhuH7におけるIPS-1経由のdsDNA誘導性抗ウイルス応答に重要な役割を果たすことは実証されている(2)。しかしながら、本発明者らは、RIG-I又はZBP1ではなくヒストンH2BがHEK293細胞におけるdsDNA媒介シグナル伝達に関与していることを観察したが、このことはdsDNAによって活性化されたシグナル伝達経路におけるある種の細胞型特異的かつ重複性の機構が存在することを示している。事実、DAIとしても知られているZBP1がマウスL929細胞におけるdsDNA媒介シグナル伝達に関与しているが、そのin vivoにおける役割は重複している(7, 24)。
【0072】
本研究のデータは、染色体外ヒストンH2Bが’トランスフェクトされた’dsDNAだけでなく細胞質に暴露されたウイルスDNAも認識して、相互作用することを示す。この機構は、ワクシニアウイルス、AdV、及びHPVによる感染に対する細胞自律性自然反応に重大であるが、EMCVによる感染に対しては重大ではない。本発明者らの進行中の解析は、HIVの複製がH2BノックダウンMagic5細胞においても増強することを示しており(データは示さず)、このことは、HIVのゲノムRNAよりはプロウイルスdsDNAが染色体外ヒストンH2Bにより感知されることを示唆している。このように、ヒストンH2Bはウイルス感染において外来DNAとRNAを識別し、新規なアダプタータンパク質CIAOとの結合を経由するIPS-1媒介シグナル伝達を誘起するようであり、ヒトIPS-1は細胞内にDNA中間体を生産するヒトウイルスと戦うためにdsDNA及びヒストンH2Bが媒介するシグナル伝達を伝える可能性を進化の過程で獲得したことが示唆される。
【0073】
今回の研究をまとめると、染色体外ヒストンH2BはCIAOとの結合を通じてIPS-1と物理的に相互作用し、ヒト細胞においてdsDNAによって誘導されるI型IFN産生を伝達する特異的なシグナルソームを形成することが示された。このような分子プラットフォームは、細胞内に異常に存在するdsDNAのセンサーとして作用し、病原体(感染)やアポトーシス(ホルモン刺激、化学薬品、放射線照射)、壊死(損傷)といった切迫した危険を細胞に知らせている可能性がある。そのためこの機構は、自己免疫、移植拒絶反応、遺伝子ワクチンその他の治療への応用においても一定の役割を果たすと考えられる。
【0074】
材料及び実験方法
細胞及び試薬
HEK293T、HEK293、HeLa、NIH3T3、Vero、L929細胞はAmerican Type Culture Collection (Manassas, VA)から購入し、10% FCS及び50 μg/mLペニシリン/ストレプトマイシンを添加したDMEM中で維持した。SCC-4扁平上皮癌細胞(JCRB9118)はヒューマンサイエンス研究資源バンク(大阪)から入手した。ヒト臍帯静脈内皮細胞(HUVEC)はCambrex Bio Science(Waikersville, MD)から入手した。IPS-1-/-マウス胎仔線維芽細胞は既報の通りである(15)。EMCV又はMCMV MW97.01株は、それぞれ、T. Fujita氏(京都大学、京都、日本)又はUH Koszinowski氏(Max von Pettenkofer-Institute for Virology, Munchen, Germany)から厚意により提供された。Poly(dA・dT)・poly(dT・dA) 及びpoly(dG・dC)・poly(dG・dC) はAmersham Biosciences(Piscataway, NJ)から購入した。Poly(I:C)及びヒトTNF-αは、それぞれ、Invivogen(San Diego, CA)及びPeproTech EC(London, UK)から入手した。MVAdE3Lは Holger Ludwig博士(Paul-Ehrlich Institute、Langen, Germany)から分与いただいた。pBR322にクローニングされたHPVゲノム(pHPV11)はJCRB遺伝子バンク(大阪)から入手した。各核酸は、無血清培地中で一定の重量:容量比(1:3)となるようにTransIT-L1(Mirus Bio Corp., Madison, WI)又はLipofectamine 2000 reagent(Invitrogen)と15分間混合し、刺激に用いた。
【0075】
cDNA発現ライブラリーのスクリーニング
ヒト骨髄cDNA発現ライブラリー(Invitrogen)のスクリーニングを行った。ヒト骨髄cDNAライブラリー(Invitrogen)で形質転換したE. coli DH5α細胞を、約20個の独立クローン×4,800プールに分割した。各プールを30℃で48時間培養し、Wizard SV 96 Plasmid DNA Purification System(Promega、Madison, WI)を用いてライブラリープラスミドDNAを抽出した。pGL3 IFNβを安定導入したHEK293T細胞に、FuGENE6トランスフェクション試薬を用いてライブラリープラスミドの各プールを一過性に導入した。トランスフェクションの24時間後に細胞を洗浄し、0.5 μg/mLのpoly(dA・dT)・poly(dA・dT)(poly(dA・dT) と表す)で刺激した。刺激の24時間後に、Bright-Glo Luciferase Assay Systemを用いてルシフェラーゼアッセイを行った。最も高いルシフェラーゼ活性を示した3プールを用いてDH5αの形質転換を行い、50個の独立クローンに由来するライブラリープラスミドDNAを回収した。これらの単一プラスミドを用い、同様の方法で2次スクリーニングを行った。最後に、Genetic Analyzer 310(PE Applied Biosystems、Foster City, CA)を用いて選択クローンのインサートcDNAのシークエンシングを行い、BLASTプログラムで解析した。
【0076】
RNA干渉法
ヒストンmRNAの干渉は既報に従って行った(6)。dsRNAはInvitrogen(ステルスRNAi)(Carlsbad, CA)又はiGENE(北海道)が化学的に合成したものを用いた。各RNAの配列は、ヒストンH1センス:5’-GCC CAA GAA AGU AGC UAA AAG CCC UAG-3’(配列番号5)、ヒストンH1アンチセンス:5’-AGG GCU UUU AGC UAC UUU CUU GGG CAU-3’ (配列番号6)、ヒストンH2Aセンス:5’-CGC AAC GAC GAG GAA CUG AAC AAG CAG-3’ (配列番号7)、ヒストンH2Aアンチセンス:5’-GCU UGU UCA GUU CCU CGU CGU UGC GAU-3’ (配列番号8)、ヒストンH2Bf116センス:5’-CCG UUU ACG UGU ACA AGG UGC UGA A-3’ (配列番号9)、ヒストンH2Bf116アンチセンス:5’-UUC AGC ACC UUG UAC ACG UAA ACG G-3’ (配列番号10)、ヒストンH2Bf169センス:5’-UCC AAG GCC AUG GGC AUC AUG AAC U-3’ (配列番号11)、ヒストンH2Bf169アンチセンス:5’- AGU UCA UGA UGC CCA UGG CCU UGG A-3’ (配列番号12)、ヒストンH3センス:5’-GAG AUC GCU CAG GAC UUU AAG ACC GAG-3’ (配列番号13)、ヒストンH3アンチセンス:5’-CGG UCU UAA AGU CCU GAG CGA UCU CAU-3’ (配列番号14)、CIAOセンス:5’-AUG GAC AGU AUG AAG GCA AAG UCA GAG-3’ (配列番号15)、CIAOアンチセンス:5’-CUG ACU UUG CCU UCA UAC UGU CCA UAU-3’ (配列番号16)、ヒストンH4センス:5’-GGG ACA AUA UCC AAG GCA UUA CAA AAG-3’ (配列番号17)、ヒストンH4アンチセンス:5’-UUU GUA AUG CCU UGG AUA UUG UCC CAU-3’ (配列番号18)、ZBP1Aセンス:5’-AUU UCA UGU GGA UUC UCU GGG CGG C-3’ (配列番号19)、ZBP1Aアンチセンス:5’-GCC GCC CAG AGA AUC CAC AUG AAA U-3’ (配列番号20)、ZBP1Bセンス:5’-UGU UGC UGU UGC CGA UGG UGG CGU C-3’ (配列番号21)、ZBP1Bアンチセンス:5’-GAC GCC ACC AUC GGC AAC AGC AAC A-3’ (配列番号22)、ZBP1Cセンス:5’-UUC AUC CAC AUA GUG GCU GCC UUC U-3’ (配列番号23)、ZBP1Cアンチセンス:5’-AGA AGG CAG CCA CUA UGU GGA UGA A-3’ (配列番号24)、RIG-IAセンス:5’-UUA GGA UUC UCA UUG CUG GGA UCC C-3’ (配列番号25)、RIG-IAアンチセンス:5’-GGG AUC CCA GCA AUG AGA AUC CUA A-3’ (配列番号26)、RIG-IBセンス:5’-AUG UCU UGU ACU UCA CAU GGA UUC C-3’ (配列番号27)、RIG-IBアンチセンス:5’-GGA AUC CAU GUG AAG UAC AAG ACA U-3’ (配列番号28)、RIG-ICセンス:5’-UGG ACA UGA AUU CUC ACU AAG AUU C-3’ (配列番号29)、RIG-ICアンチセンス:5’-GAA UCU UAG UGA GAA UUC AUG UCC A-3’ (配列番号30)であった。メーカーのプロトコールに従い、Lipofectamine RNAi MAX試薬(Invitrogen)を用いて細胞(6×105)に各dsRNAを120 pmol導入した。
【0077】
哺乳類発現プラスミドの作製
ヒト又はマウスの脾臓cDNAライブラリー、若しくは単離したライブラリープラスミドを鋳型として、H2B、RIG-I、ZBP1、TBK1、又はCIAOのcDNAをPCRにより増幅した。シークエンシングによりcDNA断片を確認した後、pFLAG-CMV4(Sigma)、pFLAG-CMV5(Sigma)、pCIneo-HA(25)、pCAGGS-CFP、pCAGGS-YFP、又はpcDNA3-mRFP(10)に組み込んだ。CIAOの全長及び欠失変異体を得るために、全長CIAO ORF(1-249 aa)、1-121 aa、91-249 aa又は194-249 aa領域をGFP ORFに融合させ、pFLAG-CMV4(それぞれ、FLAG-CIAO FL-GFP, FLAG-CIAO N’-3a-GFP, FLAG-CIAO C’-4a-GFP又はFLAG-CIAO C’-2a-GFP)に導入した。ヒストンH2Bの欠失変異体を得るために、全長ヒストンH2B ORF(1-126 aa)、1-103 aa、1-86 aa、1-53 aa若しくは1-37 aa(核局在シグナル)領域、又は38-126 aa(αH)領域をGFP ORFに融合させ、pCIneo-HA(それぞれ、HA-H2B FL(N’-1α2α3α4α)-GFP, HA-H2B N’-1α2α3α-GFP, HA-H2B N’-1α2α-GFP, HA-H2B N’-1α-GFP, HA-H2B N’-tail-GFP又はHA-H2B αH-GFP)に導入した。IPS-1の全長又は欠失変異体を得るために、全長IPS-1 ORF(1-540 aa)、1-100 aa、91-180 aa、1-170 aa、1-100+170-540 aa又は1-514 aa領域をそのまま、あるいはGFP ORFに融合させ、その後、pCIneo-HA(それぞれ、HA-IPS-1 FL、HA-IPS-1 CARD-GFP、HA-IPS-1 PRD-GFP、HA-IPS-1-CARD-PRD、HA-IPS-1ΔPRD又はHA-IPS-1ΔTMD)に導入した。
【0078】
酵素ツーハイブリッド法
酵母ツーハイブリッド法は既報に従って行った(25)。概要を以下に示す。H2B cDNAをbaitプラスミドであるpGBKT7(BD Clontech、Palo Alto, CA)のGAL4 DNA結合領域にフレームを合わせて組み込んだ。baitプラスミド及びヒト骨髄Matchmaker cDNAライブラリー(BD Clontech)で酵母AH109株を形質転換した。Synthetic Dropout選択寒天培地(SD/-Leu/-Trp/-Ade/-His/X-α-gal、BD Clontech)上で1×106クローンをスクリーニングした後、陽性クローンをピッキングしてpACT2ライブラリープラスミドを回収した。インサートcDNAのシークエンシングを行い、BLASTプログラムで解析した。
【0079】
一過性トランスフェクション及びレポーター遺伝子アッセイ
細胞(1×104)に、pTK-RL(Promega)25 ngと、IFN-α4又はIFN-βプロモーター・ホタルルシフェラーゼ(FFL)遺伝子カセット(pGL3 IFNα4又はpGL3 IFNβ)をコードするレポータープラスミド、若しくはpNF-κB-Luc(Stratagene)のいずれか25 ngを導入した。場合によっては、H2B、ZBP1及びRIG-Iの発現プラスミドを同時導入した。トランスフェクションの24時間後に、0.1、0.5又は2.5 μg/mLのdsDNA(poly(dA・dT)又はpoly(dG・dC))で24時間、又は40 ng/mLのTNF-αで8時間細胞を刺激した。FFL活性及び同試料中のウミシイタケルシフェラーゼ活性の測定には、いずれもDual-Glo Luciferase Assay Systemを使用した。各試料のFFL活性はウミシイタケルシフェラーゼ活性に対して標準化し、相対ルシフェラーゼ活性を算出した。
【0080】
プルダウンアッセイ
HEK293細胞にH2B-FLAGを一過性にトランスフェクトし、0.5μg/mlのビオチン-poly(dA・dT)又はビオチン- poly(dG・dC)で4又は16時間刺激した。その後、氷上にて30分間、プロテイナーゼとホスファターゼの両方のインヒビターカクテル(Sigma)を含有する溶解バッファー(25 mM Tris-HCl(pH 7.5), 1 mM EDTA, 0.1 mM EGTA, 5 mM MgCl2, 100 mM NaCl, 10% グリセロール、及び1% Nonidet P40)で細胞を溶解した。遠心分離後、上清を回収し、ストレプトアビジン-アガロースと混合し、4℃で30分間回転させた。複合体を溶解バッファーで5回洗浄し、SDSサンプルバッファー中に懸濁させ、その後、抗FLAG M2抗体を用いたイムノブロット解析に上清をかけた。
【0081】
ウイルスゲノム結合アッセイ
HEK293細胞にHA-GFP、HA-H2B FL-GFP、HA-H2B N’-tail-GFP又はHA-H2b αH-GFPを一過性にトランスフェクトした。最初のトランスフェクションの24時間後、細胞にpHPV18をトランスフェクトした。第二のトランスフェクションの48時間後、氷上にて30分間、プロテイナーゼとホスファターゼの両方のインヒビターカクテル(Sigma)を含有する溶解バッファーで細胞を溶解した。遠心分離後、上清を回収し、抗HA抗体を用いて、HA融合分子を沈降させた。複合体を溶解バッファーで5回洗浄し、その後、以下のプライマーセット:HPV18 E6, 5’-CCT GCG GTG CCA GAA ACC GT-3’ (配列番号39)及び 5’-CGT TGG AGT CGT TCC TGT CG-3’(配列番号40)を用いるサブタイプ特異的E6遺伝子をターゲットとする通常のPCRにかけた。PCR産物は2%アガロースゲルで分離し、臭化エチジウム染色の後、紫外光で可視化した。
【0082】
免疫沈降及びイムノブロット解析
免疫沈降法及びイムノブロット法は、抗ZBP1(clone#RG7D12、Stefan Rothenburg博士(National Institute of Health, USA)から分与)、抗H2B(BioVision、Mountain View, CA)、抗phospho-IRF-3(Ser396)4G4D、抗IRF3(Cell Signaling, Danvers, MA)、抗RIG-I(AnaSpec, Inc.、San Jose, CA)、抗GAPDH 6C5(Abcam)、抗Sp1、抗STAT1、抗ERK、抗phospho-STAT1(Santa Cruz Biotechnology、Santa Cruz, CA)、抗FLAG M2(Sigma)又は抗HA抗体(Roche Diagnostics, Indianapolis, IN)を用い、既報に従って行った(25)。
【0083】
蛍光共鳴エネルギー転移(FRET)
FRETのフローサイトメトリー解析として、293-F細胞(Invitrogen)に、ヒストンH2B、IPS-1又はCIAOをコードするCFP及び/又はYFP融合タンパク質を293発現培地(Invitrogen)中で24時間トランスフェクトし、FACSAria(Becton Dickinson)とBD FACSDiVaソフトウェアを用いてYFP(励起488 nm、発光530 nm)、CFP(励起407 nm、発光510 nm)、FRET(励起407 nm、発光535 nm)を測定した。FRETは、CFP励起により得られるYFP発光をCFP励起により得られるCFP発光で割った値として示す(11)。
【0084】
HPVの一過性複製
対照siRNA又はH2B siRNAで処理したSCC-4細胞に、Lipofectamine 2000トランスフェクション試薬(Invitrogen)を用いてpHPV11又はpHPV18(VG012及びVG013、ヒューマンサイエンス研究資源バンク、大阪、日本)を導入した。37℃で24、36、60、又は72時間インキュベートの後、細胞をPBSで洗浄してHirt lysis buffer(0.6% SDS、20 mM EDTA、pH 8.0)中に懸濁させた。15分後、NaClを終濃度1 Mとなるように添加し、4℃に12時間置いた。遠心分離により得られた上清をフェノール/クロロホルムで処理し、イソプロパノールでDNAを沈殿させた。複製されたDNAとインプットDNA(pHPV11又はpHPV18)を区別するため、試料をDpn Iエンドヌクレアーゼで処理し、E. coli DH5α中で増殖したインプットDNAを分解した。得られた試料をTEに溶解し、OD 260を測定して濃度を調整の上、DNA試料200 ngを用いて通常のPCRを行った。サブタイプ特異的E6遺伝子をPCRの標的とし、プライマーセットはHPV11 E6:5’-CTC CAC GTC TGC AAC ATC TA-3’ (配列番号31)及び5’-TGA CAC AGG TAA CAA CGA AT-3’ (配列番号32)、HPV16 E6:5’-CAC CAA AAG AGA ACT GCA ATG-3’ (配列番号33)及び5’-TCA CGT CGC AGT AAC TGT TG-3’ (配列番号34)を用いた。PCR産物は2%アガロースゲルで分離し、臭化エチジウム染色の後、紫外光で可視化した。
【0085】
ウイルス増殖試験
HEK293又はNIH3T3細胞に、それぞれ、AdV 5型又はMCMV MW97.01株を感染させた24時間後に、DNeasy Tissue Kit(Qiagen)を用いて総DNAを回収した。各試料100 ngを用いてPCR反応を行った。プライマーセットはAdV Hexon 5遺伝子:5’-TGA AGC TGC TAC TGC TCT TGA A-3’ (配列番号35)及び5’-GCA TTC AAC TGC CAT GCT TGG C-3’ (配列番号36)(18サイクル)、又はヒトIfn-β遺伝子プロモーター領域(-110〜+20):5’-CTA AAA TGT AAA TGA CAT AGG-3’ (配列番号37)及び5’-AAA GGT TGC AGT TAG AAT GTC-3’ (配列番号38)(18サイクル)、MCMV Dna ポリメラーゼ遺伝子:5’-ACG CCG AGA AAG AGT ACG TGC TCA A-3’(配列番号41) 及び5’-TCG GAC TGC ATC CTC TCG CAG TAG-3’(配列番号42) (22サイクル)、又はマウスCd63遺伝子, 5’-GGT CTT GGG AAT TAT CTT CTC CTG CTG-3’(配列番号43) 及び5’-CAC AGG CGG CAA AAT TCT TAA ACA TTC-3’(配列番号44) (26サイクル)を用いた。細胞上清を回収した後、既報(10)に従って、ウイルスプラークアッセイ又はTCID50により各試料1 ml中の感染性ウイルスの数を測定した。
【0086】
統計解析
統計解析にはスチューデントt検定を用いた。
【0087】
REFERENCES
1. Burckstummer, T., C. Baumann, S. Bluml, E. Dixit, G 1 . Durnberger, H. Jahn, M. Planyavsky, M. Bilban, J. Colinge, K. L. Bennett, and G. Superti-Furga. 2009. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nat Immunol 10:266-72.
2. Cheng, G., J. Zhong, J. Chung, and F. V. Chisari. 2007. Double-stranded DNA and double-stranded RNA induce a common antiviral signaling pathway in human cells. Proc Natl Acad Sci U S A 104:9035-40.
3. Fernandes-Alnemri, T., J. W. Yu, P. Datta, J. Wu, and E. S. Alnemri. 2009. AIM2 activates the inflammasome and cell death in response to cytoplasmic DNA. Nature 458:509-13.
4. Hornung, V., A. Ablasser, M. Charrel-Dennis, F. Bauernfeind, G. Horvath, D. R. Caffrey, E. Latz, and K. A. Fitzgerald. 2009. AIM2 recognizes cytosolic dsDNA and forms a caspase-1-activating inflammasome with ASC. Nature 458:514-8.
5. Isaacs, A., R. A. Cox, and Z. Rotem. 1963. Foreign nucleic acids as the stimulus to make interferon. Lancet 2:113-6.
6. Ishii, K. J., C. Coban, H. Kato, K. Takahashi, Y. Torii, F. Takeshita, H. Ludwig, G. Sutter, K. Suzuki, H. Hemmi, S. Sato, M. Yamamoto, S. Uematsu, T. Kawai, O. Takeuchi, and S. Akira. 2006. A Toll-like receptor-independent antiviral response induced by double-stranded B-form DNA. Nat Immunol 7:40-8.
7. Ishii, K. J., T. Kawagoe, S. Koyama, K. Matsui, H. Kumar, T. Kawai, S. Uematsu, O. Takeuchi, F. Takeshita, C. Coban, and S. Akira. 2008. TANK-binding kinase-1 delineates innate and adaptive immune responses to DNA vaccines. Nature 451:725-9.
8. Jakel, S., J. M. Mingot, P. Schwarzmaier, E. Hartmann, and D. Gorlich. 2002. Importins fulfil a dual function as nuclear import receptors and cytoplasmic chaperones for exposed basic domains. Embo J 21:377-86.
9. Janicki, S. M., T. Tsukamoto, S. E. Salghetti, W. P. Tansey, R. Sachidanandam, K. V. Prasanth, T. Ried, Y. Shav-Tal, E. Bertrand, R. H. Singer, and D. L. Spector. 2004. From silencing to gene expression: real-time analysis in single cells. Cell 116:683-98.
10. Jounai, N., F. Takeshita, K. Kobiyama, A. Sawano, A. Miyawaki, K. Q. Xin, K. J. Ishii, T. Kawai, S. Akira, K. Suzuki, and K. Okuda. 2007. The Atg5 Atg12 conjugate associates with innate antiviral immune responses. Proc Natl Acad Sci U S A 104:14050-5.
11. Kawai, T., S. Sato, K. J. Ishii, C. Coban, H. Hemmi, M. Yamamoto, K. Terai, M. Matsuda, J. Inoue, S. Uematsu, O. Takeuchi, and S. Akira. 2004. Interferon-alpha induction through Toll-like receptors involves a direct interaction of IRF7 with MyD88 and TRAF6. Nat Immunol 5:1061-8.
12. Kawane, K., M. Ohtani, K. Miwa, T. Kizawa, Y. Kanbara, Y. Yoshioka, H. Yoshikawa, and S. Nagata. 2006. Chronic polyarthritis caused by mammalian DNA that escapes from degradation in macrophages. Nature 443:998-1002.
13. Kimura, H. 2005. Histone dynamics in living cells revealed by photobleaching. DNA Repair (Amst) 4:939-50.
14. Konishi, A., S. Shimizu, J. Hirota, T. Takao, Y. Fan, Y. Matsuoka, L. Zhang, Y. Yoneda, Y. Fujii, A. I. Skoultchi, and Y. Tsujimoto. 2003. Involvement of histone H1.2 in apoptosis induced by DNA double-strand breaks. Cell 114:673-88.
15. Kumar, H., T. Kawai, H. Kato, S. Sato, K. Takahashi, C. Coban, M. Yamamoto, S. Uematsu, K. J. Ishii, O. Takeuchi, and S. Akira. 2006. Essential role of IPS-1 in innate immune responses against RNA viruses. J Exp Med 203:1795-803.
16. Mosammaparast, N., K. R. Jackson, Y. Guo, C. J. Brame, J. Shabanowitz, D. F. Hunt, and L. F. Pemberton. 2001. Nuclear import of histone H2A and H2B is mediated by a network of karyopherins. J Cell Biol 153:251-62.
17. Muhlhausser, P., E. C. Muller, A. Otto, and U. Kutay. 2001. Multiple pathways contribute to nuclear import of core histones. EMBO Rep 2:690-6.
18. Napirei, M., H. Karsunky, B. Zevnik, H. Stephan, H. G. Mannherz, and T. Moroy. 2000. Features of systemic lupus erythematosus in Dnase1-deficient mice. Nat Genet 25:177-81.
19. Redon, C., D. Pilch, E. Rogakou, O. Sedelnikova, K. Newrock, and W. Bonner. 2002. Histone H2A variants H2AX and H2AZ. Curr Opin Genet Dev 12:162-9.
20. Roberts, T. L., A. Idris, J. A. Dunn, G. M. Kelly, C. M. Burnton, S. Hodgson, L. L. Hardy, V. Garceau, M. J. Sweet, I. L. Ross, D. A. Hume, and K. J. Stacey. 2009. HIN-200 proteins regulate caspase activation in response to foreign cytoplasmic DNA. Science 323:1057-60.
21. Stetson, D. B., and R. Medzhitov. 2006. Recognition of cytosolic DNA activates an IRF3-dependent innate immune response. Immunity 24:93-103.
22. Sun, Q., L. Sun, H. H. Liu, X. Chen, R. B. Seth, J. Forman, and Z. J. Chen. 2006. The specific and essential role of MAVS in antiviral innate immune responses. Immunity 24:633-42.
23. Suzuki, K., A. Mori, K. J. Ishii, J. Saito, D. S. Singer, D. M. Klinman, P. R. Krause, and L. D. Kohn. 1999. Activation of target-tissue immune-recognition molecules by double-stranded polynucleotides. Proc Natl Acad Sci U S A 96:2285-90.
24. Takaoka, A., Z. Wang, M. K. Choi, H. Yanai, H. Negishi, T. Ban, Y. Lu, M. Miyagishi, T. Kodama, K. Honda, Y. Ohba, and T. Taniguchi. 2007. DAI (DLM-1/ZBP1) is a cytosolic DNA sensor and an activator of innate immune response. Nature 448:501-5.
25. Takeshita, F., K. J. Ishii, K. Kobiyama, Y. Kojima, C. Coban, S. Sasaki, N. Ishii, D. M. Klinman, K. Okuda, S. Akira, and K. Suzuki. 2005. TRAF4 acts as a silencer in TLR-mediated signaling through the association with TRAF6 and TRIF. Eur J Immunol 35:2477-85.
26. Wang, Z., M. K. Choi, T. Ban, H. Yanai, H. Negishi, Y. Lu, T. Tamura, A. Takaoka, K. Nishikura, and T. Taniguchi. 2008. Regulation of innate immune responses by DAI (DLM-1/ZBP1) and other DNA-sensing molecules. Proc Natl Acad Sci U S A 105:5477-82.
27. Yasutomo, K., T. Horiuchi, S. Kagami, H. Tsukamoto, C. Hashimura, M. Urushihara, and Y. Kuroda. 2001. Mutation of DNASE1 in people with systemic lupus erythematosus. Nat Genet 28:313-4.
28. Yoshida, H., Y. Okabe, K. Kawane, H. Fukuyama, and S. Nagata. 2005. Lethal anemia caused by interferon-beta produced in mouse embryos carrying undigested DNA. Nat Immunol 6:49-56.
【0088】
〔実施例2〕ヒストンH2Bは裸のDNAと直接相互作用する
a) 大腸菌を用いてリコンビナントGSTもしくはGST-H2Bタンパクを作製した。ビオチン標識したpoly(dA・dT)・poly(dT・dA) またはpoly(dG・dC)・poly(dC・dG)と混合後、ストレプトアビジンビーズでpull-downを行い、共沈した分子を抗GST抗体を用いた免疫ブロッティング法にて解析した。
b) HEK293細胞にFLAG-H2Bを強制発現させた後、ビオチン標識したpoly(dA・dT)・poly(dT・dA) またはpoly(dG・dC)・poly(dC・dG)を細胞内に導入し、4時間もしくは16時間後に細胞を溶解後、ストレプトアビジンビーズでpull-downを行い、共沈した分子を抗FLAG抗体を用いた免疫ブロッティング法にて解析した。
c) HEK293細胞にGFP-H2Bを強制発現させた後、Cy3標識したpoly(dA・dT)・poly(dT・dA)を細胞内に導入し、12時間もしくは24時間後に細胞を固定後Hoechstで核染し、共焦点顕微鏡で観察した。
【0089】
以上の結果より、ヒストンH2Bはin vitroおよびin vivoにおいてpoly(dA・dT)・poly(dT・dA) またはpoly(dG・dC)・poly(dC・dG)と物理的に相互作用し、細胞内で共局在することがあきらかとなった。
【産業上の利用可能性】
【0090】
本発明は、抗ウイルス剤、遺伝子を利用した治療方法(遺伝子ワクチン、遺伝子治療)の効果を調節するための薬剤または方法などに利用できる。
【配列表フリーテキスト】
【0091】
<配列番号1>
配列番号1は、ヒトヒストンH2B1Bのヌクレオチド配列を示す。BC096728(GeneBank)
ATGCCGGATCCAGCGAAATCCGCTCCTGCTCCCAAGAAGGGCTCCAAAAAGGCTGTTACGAAAGTGCAGAAGAAGGACGGCAAGAAGCGCAAGCGCAGCCGCAAGGAGAGCTACTCCGTTTACGTGTACAAGGTGCTGAAGCAGGTCCACCCCGACACCGGCATCTCGTCCAAGGCCATGGGCATCATGAACTCCTTCGTCAACGACATCTTCGAGCGCATCGCGGGAGAGGCGTCCCGCCTGGCGCACTACAACAAGCGCTCCACCATCACATCCCGCGAGATCCAGACGGCCGTGCGCCTGCTGCTGCCCGGCGAGCTGGCCAAGCACGCCGTGTCCGAGGGCACCAAGGCGGTCACCAAGTACACCAGCTCGAAGTAA
<配列番号2>
配列番号2は、ヒトヒストンH2B1Bのアミノ酸配列を示す。P33778(UniProt/Swiss-Prot)
MPEPSKSAPAPKKGSKKAITKAQKKDGKKRKRSRKESYSIYVYKVLKQVHPDTGISSKAMGIMNSFVNDIFERIAGEASRLAHYNKRSTITSREIQTAVRLLLPGELAKHAVSEGTKAVTKYTSSK
<配列番号3>
配列番号3は、マウスヒストンH2B1Bのヌクレオチド配列を示す。X80328(GeneBank)
atgccagagccttctaagtctgcaccagcccctaagaagggatctaagaaagccatctctaaggcgcagaagaaggatggcaagaagcgcaagcgcagccgcaaggagagctattcggtgtacgtgtacaaggtgctgaagcaagtgcaccccgacaccggcatctcctccaaggccatgggcatcatgaactcgttcgtgaacgacatcttcgagcgcatcgcgagcgaggcgtcccgcctggcgcattacaacaagcgctcgaccatcacgtcccgggagatccagacggccgtgcgcctgctgctgcccggggagctggccaagcacgccgtgtcggagggcactaaggccgtcaccaagtacaccagctccaagtga
<配列番号4>
配列番号4は、マウスヒストンH2B1Bのアミノ酸配列を示す。Q64475(UniProt/Swiss-Prot)
MPEPSKSAPAPKKGSKKAISKAQKKDGKKRKRSRKESYSVYVYKVLKQVHPDTGISSKAMGIMNSFVNDIFERIASEASRLAHYNKRSTITSREIQTAVRLLLPGELAKHAVSEGTKAVTKYTSSK
<配列番号5〜30>
配列番号5〜30は、siRNAのヌクレオチド配列を示す。
<配列番号31〜32>
配列番号31〜32は、HPV11 E6を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号33〜34>
配列番号33〜34は、HPV6 E6を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号35〜36>
配列番号35〜36は、AdV Hexon 5遺伝子を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号37〜38>
配列番号37〜38は、ヒトIfn-β遺伝子プロモーター領域を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号39〜40>
配列番号39〜40は、サブタイプ特異的E6遺伝子を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号41〜42>
配列番号41〜42は、MCMV Dnaポリメラーゼ遺伝子を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号43〜44>
配列番号43〜44は、マウスCd63遺伝子を増幅するためのプライマーのヌクレオチド配列を示す。
<配列番号45〜48>
配列番号45〜48は、siRNAのヌクレオチド配列を示す。
【特許請求の範囲】
【請求項1】
染色体外ヒストンH2Bと二本鎖DNAとの複合体。
【請求項2】
さらにアダプター分子を含む請求項1記載の複合体。
【請求項3】
アダプター分子がCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)及び/又はIPS-1(Interferon-βPromoter Stimulator 1)である請求項2記載の複合体。
【請求項4】
染色体外ヒストンH2Bと二本鎖DNAとの複合体の調節因子をスクリーニングする方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む前記方法。
【請求項5】
染色体外ヒストンH2Bと二本鎖DNAとの複合体による細胞内シグナル伝達の調節因子をスクリーニングする方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む前記方法。
【請求項6】
二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞の製造方法であって、前記哺乳動物細胞における染色体外ヒストンH2Bの発現量を減少させることを含む前記方法。
【請求項7】
染色体外ヒストンH2Bの発現量を減少させることによって、二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞。
【請求項8】
哺乳動物における免疫応答を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
【請求項9】
下記の(a)及び/又は(b)により、前記細胞内シグナル伝達を調節する請求項8記載の方法。
(a) 染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加又は減少させること
(b) 染色体外ヒストンH2B及び/又はそのアダプター分子を修飾すること
【請求項10】
哺乳動物におけるI型インターフェロン誘導を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
【請求項11】
哺乳動物におけるウイルスの増殖を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
【請求項12】
哺乳動物における遺伝子を利用した治療方法の効果を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
【請求項13】
ウイルスを製造する方法であって、哺乳動物又はその細胞における染色体外ヒストンH2Bの発現量を減少させること、及び前記哺乳動物又はその細胞をウイルスに感染させることを含む前記方法。
【請求項1】
染色体外ヒストンH2Bと二本鎖DNAとの複合体。
【請求項2】
さらにアダプター分子を含む請求項1記載の複合体。
【請求項3】
アダプター分子がCIAO(COOH-terminal Importin 9-related Adaptor Organizing histone H2B and IPS-1)及び/又はIPS-1(Interferon-βPromoter Stimulator 1)である請求項2記載の複合体。
【請求項4】
染色体外ヒストンH2Bと二本鎖DNAとの複合体の調節因子をスクリーニングする方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む前記方法。
【請求項5】
染色体外ヒストンH2Bと二本鎖DNAとの複合体による細胞内シグナル伝達の調節因子をスクリーニングする方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達のアゴニスト又はアンタゴニストとして被験物質が作用するか否かを測定することを含む前記方法。
【請求項6】
二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞の製造方法であって、前記哺乳動物細胞における染色体外ヒストンH2Bの発現量を減少させることを含む前記方法。
【請求項7】
染色体外ヒストンH2Bの発現量を減少させることによって、二本鎖DNAにより誘導される生物学的活性が抑制された哺乳動物細胞。
【請求項8】
哺乳動物における免疫応答を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
【請求項9】
下記の(a)及び/又は(b)により、前記細胞内シグナル伝達を調節する請求項8記載の方法。
(a) 染色体外ヒストンH2B及び/又はそのアダプター分子の発現量を増加又は減少させること
(b) 染色体外ヒストンH2B及び/又はそのアダプター分子を修飾すること
【請求項10】
哺乳動物におけるI型インターフェロン誘導を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
【請求項11】
哺乳動物におけるウイルスの増殖を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
【請求項12】
哺乳動物における遺伝子を利用した治療方法の効果を調節する方法であって、染色体外ヒストンH2Bと二本鎖DNAとの複合体形成により活性化される細胞内シグナル伝達を調節することを含む前記方法。
【請求項13】
ウイルスを製造する方法であって、哺乳動物又はその細胞における染色体外ヒストンH2Bの発現量を減少させること、及び前記哺乳動物又はその細胞をウイルスに感染させることを含む前記方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2011−109982(P2011−109982A)
【公開日】平成23年6月9日(2011.6.9)
【国際特許分類】
【出願番号】特願2009−270254(P2009−270254)
【出願日】平成21年11月27日(2009.11.27)
【出願人】(505155528)公立大学法人横浜市立大学 (101)
【Fターム(参考)】
【公開日】平成23年6月9日(2011.6.9)
【国際特許分類】
【出願日】平成21年11月27日(2009.11.27)
【出願人】(505155528)公立大学法人横浜市立大学 (101)
【Fターム(参考)】
[ Back to top ]

