染色性が改善されたポリマーの調製方法
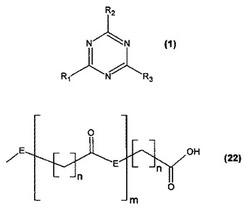
式(1)、
【化1】

(R1は、−A−B(式中、Aは、−O−または−NR4−であり、Bは、アミノ基である)であり、R2は、(22)
【化2】

であり、置換基を含み、R4は、水素またはアルキル基であり(式中、Eは、−O−または−NR5−であり、nは、3〜15であり、mは、O〜10であり、R5は、水素またはアルキル基である)、R3はR1であり、R2は−OR6または−NR7R8(式中、R6、R7、およびR8は、水素、アルキル、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)のトリアジン化合物の存在下に、対応するモノマーを重合させることを含む、ポリマーの調製方法。
【化1】

(R1は、−A−B(式中、Aは、−O−または−NR4−であり、Bは、アミノ基である)であり、R2は、(22)
【化2】

であり、置換基を含み、R4は、水素またはアルキル基であり(式中、Eは、−O−または−NR5−であり、nは、3〜15であり、mは、O〜10であり、R5は、水素またはアルキル基である)、R3はR1であり、R2は−OR6または−NR7R8(式中、R6、R7、およびR8は、水素、アルキル、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)のトリアジン化合物の存在下に、対応するモノマーを重合させることを含む、ポリマーの調製方法。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
本発明は、改善された染色性および良好な紡糸性を有するポリマーの調製方法ならびにこれらの好ましい特性を有するポリマーに関する。
【0002】
紡糸可能なポリマーのグレード、例えば、ポリアミドやポリエステルのようなポリマーの製造方法は当該技術分野において周知である。このようなグレードに不可欠な条件は、良好な紡糸性を有すること、すなわちこのグレードが中断することなく連続的に高速紡糸法で紡糸することができることと、得られた繊維が衣料や床用の敷物に使用されることが多いという理由から、良好な染色性を有することとにある。
【0003】
ポリマーの紡糸工程においては、ポリマーが加熱および溶融されることによって望ましくない作用である重縮合が起こり、その結果として粘度が上昇し、それによって紡糸が不規則になったり繊維が破断したりする場合がある。この重縮合を例えばポリアミドにおいて防止するためには、ポリマーのアミン末端基の数を少なくすることが好ましい。一方、ポリマーの染色性はアミン末端基が存在することによって向上する。そのため、ポリマーには相容れない要求が課せられる。
【0004】
ここで本発明は、重縮合の傾向が低減されているが依然として良好な染色性を有するポリマーを製造する方法を目的とする。
【0005】
この目的は、式、
【化1】

[式中、R1は、−A−B
(式中、Aは、−O−または−NR4−であり、
Bは、アミノ基含有置換基であり、
R4は、水素またはアルキル基である)であり、
R2は、
【化2】

(式中、Eは、−O−または−NR5−であり、
nは、3〜15であり、
mは、0〜10であり、
R5は、水素またはアルキル基である)であり、
R3は、R1、R2、−OR6、または−NR7R8
(式中、R6、R7、およびR8は、水素、アルキル、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)である]のトリアジン化合物の存在下に、対応するモノマーを重合させることを含む方法によって達成される。
【0006】
式(1)に一致するこれらのトリアジン化合物は、塩化シアヌルを塩基の存在下に、0.5〜5モル当量の式(2)、
H−A−B (2)
のアミンおよび0.5〜5モル当量の式(3)、
【化3】

に一致する化合物または式(4)、
【化4】

(式中、oは、0〜12であり、
Eは、−O−または−NR5−であり、
R5は、水素またはアルキル基である)に一致する化合物と反応させることによって製造することができ、この2つの反応ステップはどちらの順序で実施してもよい。
【0007】
意外にも、本発明者らは、アミノおよびカルボキシル基の両方を含む置換基で置換されたトリアジン化合物が、ポリエステルおよびポリアミドの反応性安定剤として有用であることを見出した。本発明の目的のための反応性安定剤は、そのアミノ−およびカルボキシル含有置換基を介してポリマーに組み込むことができ、したがってこれは、ポリマー鎖の構成ブロックである。このことは、本発明の安定剤が重合段階において添加することが可能であり、かつ重合過程においてポリマー鎖に組み込まれるという点で先行技術よりも有利である。したがって、安定剤をポリマーに混合するさらなるステップが不要となる。さらに、本発明のこのような安定剤は、ポリマーから溶出することができず、したがって、永久的に有効な安定剤が利用できるという利点を有する。このような化合物は経済的な方法によって調製できることが確認されているので、この目的が達成されたことはさらに意外なことである。
【0008】
本発明に使用することができるトリアジン化合物の構造は、式(1)、
【化5】

[R1は、−A−B
(式中、Aは、−O−または−NR4−であり、
Bは、アミノ基含有置換基であり、
R4は、水素またはアルキル基である)であり、
R2は、
【化6】

(式中、Eは、−O−または−NR5−であり、
nは、3〜15であり、
mは、0〜10であり、
R5は、水素またはアルキル基である)であり、
R3は、R1、R2、−OR6、または−NR7R8
(R6、R7、およびR8は、水素、アルキル、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)である]に一致する。
【0009】
トリアジン化合物のR1型の置換基の構造断片Aは、−O−だけでなく−NR4−であってもよく、R1およびR3型の置換基の構造断片Aは、同一であっても異なっていてもよい。好ましくは、構造断片Aは、−NR4−である。R4型の置換基は、水素だけでなくアルキル基であってもよい。好ましくは、R4型の置換基は、水素であるかまたは1〜10個、好ましくは2〜5個の炭素原子を有するアルキル基である。このR4型の置換基のアルキル基は、分岐であっても非分岐であってもよいが、好ましくは非分岐である。さらにこのアルキル基は、好ましくは非置換である。しかしながら、より好ましくは、R4型の置換基は水素である。
【0010】
B型の置換基は、特にアミノ基含有置換基であり、そのアミノ基は、脂肪族の支持骨格(supporting scaffold)上に位置していてもよいし、脂肪族環状アミンであってもよい。好ましくは、B型の置換基は、脂肪族環状アミンを含む。
【0011】
好ましくは、本発明において使用することができるトリアジン化合物は、R1型の置換基中に、式(5)、
【化7】

[式中、R9は、水素、アルキル、または式−O−R20のアルコキシ基
(R20は、いずれの場合も4〜16個の炭素原子を有する分岐もしくは非分岐アルキルまたは環状アルキル基である)]に一致するかまたは式(6)、
−(CH2)p−NR10R11 (6)
(式中、pは、1〜15、好ましくは2〜8、より好ましくは3〜6である)に一致するB型の置換基を含む。
【0012】
R10およびR11型の置換基は同一であっても異なっていてもよく、好ましくは、水素、アルキル、シクロアルキル、またはヘテロシクロアルキル基であり、特に、いずれの場合も、1〜20個、好ましくは2〜10個の炭素原子を有するかまたは1〜20個、好ましくは2〜10個の炭素およびヘテロ原子を有するものである。このR10およびR11型の置換基のアルキル基は、好ましくは分岐または非分岐であるが、より好ましくは非分岐である。さらに、これらは好ましくは非置換であるかまたはアミノ基で置換されているが、より好ましくは非置換である。R10およびR11型の置換基のシクロアルキル基は、好ましくは非置換であるかまたは置換されているが、特にこのシクロアルキル基は非置換である。R10およびR11型の置換基のヘテロシクロアルキル基は、好ましくは、非置換であるかまたは置換されているが、好ましくは、このヘテロシクロアルキル基は、1個またはそれ以上のメチル基で置換されており、好ましくは、これは、ヘテロ原子として1個またはそれ以上の窒素原子を含むヘテロシクロアルキル基であり、好ましくは、これは、式(5)に一致するヘテロシクロアルキル基である。
【0013】
R9型の置換基は、好ましくは、水素であるかまたは1〜16個、好ましくは1〜8個の炭素原子を有するアルキル基であるかまたは分岐もしくは非分岐のアルキル基を有するアルコキシ基であるかまたはシクロアルキル基であり、より好ましくは、R9型の置換基は水素である。
【0014】
好ましくは、トリアジン化合物は、式(6)に一致するB型の置換基を含む。より好ましくは、このトリアジン化合物は、式(6a)または(6b)、
【化8】

に一致するB型の置換基を含む。
【0015】
特に好ましいトリアジン化合物の実施形態においては、これらは、式(5)に一致するB型の置換基を含む。
【0016】
特に非常に好ましいトリアジン化合物は、式(7)、
【化9】

に一致するR1型の置換基を含むものである。
【0017】
トリアジン化合物のR2型の置換基は、好ましくは、−O−または−NR5−を有する構造断片Eを含み、R5型の置換基は、好ましくは、水素であるかまたは1〜16個、好ましくは1〜4個の炭素原子を有するアルキル基であり、好ましくは、R5型の置換基は水素である。R5型の置換基のアルキル基は、分岐または非分岐であるが、好ましくは非分岐である。さらに、このR5型の置換基のアルキル基は、好ましくは非置換である。R2型の置換基においては、nは、好ましくは3〜15の範囲、より好ましくは5〜11の範囲にあり、よりさらに好ましくは5であり、mは、好ましくは0〜10の範囲、より好ましくは0〜4の範囲にあり、よりさらに好ましくは、mは0である。
【0018】
本発明において使用されるトリアジン化合物は、好ましくは、R3型の置換基としてR1型の置換基を含む。特定の実施形態においては、トリアジン化合物は、R3型の置換基としてR2型の置換基を含む。このR1およびR2型の2種の置換基は、それぞれ同一であっても異なっていてもよく、好ましくは、同じ型の置換基は同一である。
【0019】
好ましい実施形態においては、トリアジン化合物は、以下の構造(7a)、(7b)、または(7c)、
【化10】

に一致するR1型の置換基を含む。
【0020】
この好ましい実施形態においては、R2型の置換基は、特に、式(8a)または(8b)、
−NH−(CH2)5−COOH (8a)
−NH−(CH2)11−COOH (8b)
に一致する構造を有している。
【0021】
この好ましい実施形態においては、R3型の置換基は、好ましくはR1型の置換基であり、より好ましくは、これらの2種の置換基は同一である。この好ましい実施形態においては、R3型の置換基は、同様にR2型の置換基であってもよく、ここでも同様に、これらの2種の置換基は好ましくは同一である。
【0022】
トリアジン化合物のさらなる実施形態においては、これらは、以下の式(14)および(15)、
−O−R6 (14) または −NR7R8 (15)
[式中、R6、R7、およびR8は、水素、アルキル基、またはアリール基であり、このアルキルまたはアリール基は、非置換であるかまたは1種もしくは複数の式R6、R7、R8、−SO3H、または−SO3M(式中、Mは、アルカリ金属陽イオン、好ましくは、リチウム、ナトリウム、またはカリウム陽イオンである)の置換基で置換されている]に一致するR3型の置換基を含む。R6、R7、またはR8型の置換基のアルキルおよび/またはアリール基は、好ましくは1〜4個の置換基、より好ましくは1〜2個の置換基、最も好ましくは1個の式−SO3Hまたは−SO3Mの置換基を含む。好ましくは、R6、R7、およびR8型の置換基は、水素であるかまたは1〜18個、好ましくは2〜16個の炭素原子を有するアルキル基である。このR6、R7、およびR8型の置換基のアルキル基は、分岐であっても非分岐であってもよいが、好ましくは非分岐である。R6、R7、およびR8型の置換基のアリール基は、好ましくはフェニル基または−SO3Hもしくは−SO3Mで好ましくはパラ位が置換されたフェニル基である。R6、R7、およびR8型の置換基は、すべて同一であっても、すべて異なっていても、あるいは同一の対を成していてもよい。好ましくは、R6、R7、およびR8型の置換基は、水素、フェニル基、または−SO3Hもしくは−SO3Mでパラ位が置換されたフェニル基である。
【0023】
式(1)、
【化11】

[式中、R1は、−A−B
(式中、Aは、−O−または−NR4−であり、
Bは、アミノ基含有置換基であり、
R4は、水素またはアルキル基である)であり、
R2は、
【化12】

(式中、Eは、−O−または−NR5−であり、
nは、3〜15であり、
mは、0〜10であり、
R5は、水素またはアルキル基である)であり、
R3は、R1、R2、−OR6、または−NR7R8
(式中、R6、R7、およびR8は、水素、アルキル基、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)である]に一致するトリアジン化合物の調製方法は、塩化シアヌルを、塩基の存在下に、0.5〜5モル当量の式(2)、
H−A−B (2)
のアミンおよび0.5〜5モル当量の式(3)、
【化13】

に一致する化合物または式(4)、
【化14】

(式中、oは、0〜12であり、
Eは、−O−または−NR5−であり、
R5は、水素またはアルキル基である)に一致する化合物と反応させることを含み、この2つの反応ステップはどちらの順序で実施してもよい。
【0024】
R1またはR2以外にR3を有する化合物が調製される本方法の実施形態においては、さらなる工程ステップにおいて、0.5〜5モル当量の式(16)または(17)、
H−OR6 (16) または H−NR7R8 (17)
に一致する化合物が塩基の存在下に反応される。
【0025】
R5型の置換基は、水素だけでなくアルキル基であってもよい。好ましくは、R5型の置換基は、水素または1〜16個、好ましくは1〜4個の炭素原子を有するアルキル基である。このR5型の置換基のアルキル基は、分岐または非分岐であってもよいが、好ましくは非分岐である。さらにこのR5型の置換基のアルキル基は、好ましくは非置換である。しかしながら、R5は、好ましくは水素である。式(3)または(4)に従う化合物においては、oは好ましくは0〜12であり、より好ましくは2〜8、特に好ましくは2である。
【0026】
本方法には、好ましくは、式(3)に一致する化合物としてラクタムまたはラクトンが利用されるが、より好ましくは、ラクタムが利用される。特に好ましくは、本方法においてはカプロラクタムが使用される。本方法の特定の一実施形態においては、式(4)に一致する化合物、より好ましくはアミノカプロン酸ナトリウムが利用される。
【0027】
式(4)に一致する反応体は、本方法において、例えば式(3)に一致する化合物および塩基、特にアルカリ金属水酸化物、例えば水酸化ナトリウムを使用することによってin situで形成させてもよい。ここで使用されるこの2種の反応体の物質比は、好ましくは、5:1〜1:1の範囲、好ましくは4:1〜1:1の範囲にあり、より好ましくは2:1〜1:1である。
【0028】
本方法は、式(3)または(4)に一致する化合物を、使用される塩化シアヌルを基準として0.5〜5、好ましくは1〜3、より好ましくは1〜2モル当量利用している。
【0029】
本方法は、好ましくは、さらなる反応体として、式(2)に一致するアミンを利用しており、構造断片Aは、−O−だけでなく−NR4−であってもよい。式(2)に一致する、構造断片Aとして−NR4−を含むアミンを使用することが好ましい。R4型の置換基は、水素だけでなくアルキル基であってもよい。好ましくは、R4型の置換基は、水素であるかまたは1〜10個、好ましくは2〜5個の炭素原子を有するアルキル基である。この構造断片Aのアルキル基は、分岐であっても非分岐であってもよいが、好ましくは非分岐である。さらに、このアルキル基は、好ましくは非置換である。しかしながら、より好ましくは、R4置換基は水素である。
【0030】
本方法は、式(2)(式中、B型の置換基は、好ましくは、アミノ基が脂肪族支持骨格上に位置していてもよく、または脂肪族環状アミンであってもよいアミノ基含有置換基である)のアミンを利用している。好ましくは、このB型の置換基は、脂肪族環状アミンを含む。
【0031】
本方法は、好ましくは、式(6)または式(5)に従うB型の置換基を含む式(2)のアミンを利用している。
【0032】
R10およびR11型の置換基は、同一であっても異なっていてもよく、好ましくは、水素、アルキル、シクロアルキル、またはヘテロシクロアルキル基(いずれの場合も、1〜20個、好ましくは2〜10個の炭素原子または1〜20個、好ましくは2〜10個の炭素およびヘテロ原子を含む)である。このR10およびR11型の置換基のアルキル基は、好ましくは、分岐または非分岐であるが、より好ましくは非分岐である。さらに、これらは好ましくは非置換であるかまたはアミノ基で置換されているが、より好ましくは非置換である。R10およびR11型の置換基のシクロアルキル基は、好ましくは非置換であるかまたは置換されており、特にこのシクロアルキル基は非置換である。R10およびR11型の置換基のヘテロシクロアルキル基は、好ましくは非置換であるかまたは置換されており、好ましくはこのヘテロシクロアルキル基は、1個またはそれ以上のメチル基で置換されており、好ましくは、これは、1個またはそれ以上の窒素原子をヘテロ原子として含むヘテロシクロアルキル基であり、好ましくは、これは、式(5)に従うヘテロシクロアルキル基である。
【0033】
R9型の置換基は、好ましくは、水素または1〜16個、好ましくは1〜8個の炭素原子を有するアルキル基であるかまたは分岐もしくは非分岐アルキル基もしくはシクロアルキル基を含むアルコキシ基であり、より好ましくは、R9型の置換基は水素である。
【0034】
本方法は、好ましくは、式(6)に一致するB型の置換基を有するアミンを利用している。しかしながら、式(6a)または(6b)に一致するB型の置換基を有するアミンを利用することが特に好ましい。式(2a)、
HNR4−(CH2)m−NR10R11 (2a)
に一致するアミンを利用することが特に非常に好ましい。
【0035】
本方法の特に好ましい一実施形態は、式(5)に一致するB型の置換基を含むアミンを利用している。本方法においては、式(2b)、
【化15】

に一致するアミンを利用することが特に非常に好ましい。
【0036】
本方法は、式(3)もしくは(4)に一致する、異なる化合物の混合物または式(2)に一致する、異なるアミンの混合物も利用してもよい。
【0037】
本方法のさらなる実施形態は、さらなる反応体として、式(16)または(17)[式中、R6、R7、およびR8は、それぞれ、水素、アルキル基、またはアリール基であり、このアルキルまたはアリール基は、非置換であるかまたは式R6、R7、R8、−SO3H、または−SO3M(式中、Mは、アルカリ金属陽イオン、好ましくは、リチウム、ナトリウム、またはカリウム陽イオンである)の1種またはそれ以上の置換基で置換されている]に一致する化合物を利用している。R6、R7、またはR8型の置換基のアルキルおよび/またはアリール基は、好ましくは、1〜4個の置換基、より好ましくは1〜2個の置換基、最も好ましくは1個の式−SO3Hまたは−SO3Mの置換基を含む。好ましくは、R6、R7、およびR8型の置換基は、水素であるかまたは1〜18個、好ましくは2〜16個の炭素原子を有するアルキル基である。このR6、R7、およびR8型の置換基のアルキル基は、分岐であっても非分岐であってもよく、好ましくは非分岐である。R6、R7、およびR8型の置換基のアリール基は、好ましくは、非置換のフェニル基であるかまたは−SO3Hもしくは−SO3Mで好ましくはパラ位をモノ置換されたフェニル基である。R6、R7、およびR8型の置換基は、すべて同一であっても、すべて異なっていても、あるいは同一の対を成していてもよい。好ましくは、R6、R7、およびR8型の置換基は、水素、フェニル基、またはパラ位を−SO3Hもしくは−SO3Mでモノ置換されたフェニル基である。
【0038】
調製すべきトリアジン化合物に応じて、この反応は、実際に転化または反応が起こる2または3つのステップからなっていてもよい。
【0039】
本方法の好ましい一実施形態は、第1ステップにおいて、塩化シアヌルを式(2)に一致するアミンと塩基の存在下に溶媒中で反応させることを含む。好ましくは、水酸化ナトリウム水溶液が塩基として使用される。アミンおよび塩基は、好ましくは、物質比1:1で使用される。この好ましい実施形態のこの第1反応ステップにおいては、水、芳香族炭化水素(特に、トルエン、キシレン)、アルカン、エーテル、ケトン(例えばアセトン等)、またはエステルから選択される溶媒を利用してもよく、好ましくは、水を溶媒として使用する。アルコール、第1級または第2級アミンは、この第1反応ステップの溶媒としては適していない。これに続く第2工程ステップは、式(3)または(4)に一致する化合物から選択される化合物と反応させることを含む。
【0040】
本方法のさらなる実施形態は、塩化シアヌルを式(3)または(4)に一致する化合物から選択される化合物と反応させる第1ステップを含み、次いで、さらなる反応ステップにおいて、式(2)に一致するアミンと反応させる。溶媒およびアミン対塩基の物質比は上記好ましい実施形態と同様に選択してもよい。
【0041】
反応体として式(3)に一致する化合物を含む反応は、好ましくは、開環塩基(ring−opening base)の存在下に実施される。ここで溶媒として使用されるのは、特に、水、トルエン、キシレン、アルカン、エーテル、ケトン(例えばアセトン等)、またはエステルであるが、水が好ましい。本方法の特定の一実施形態においては、溶媒としてラクタムが利用され、より具体的には、式(3)に一致する化合物が溶媒として使用され、そしてより好ましくは、溶媒としておよび反応体として同一の化合物が利用される。しかしながら、ある反応ステップにおいて式(4)に一致する化合物が反応体として利用される場合、この反応ステップは、過剰の式(3)に一致する対応する化合物の存在下に実施され、これは、式(3)に一致する化合物対塩化シアヌルの物質比が、好ましくは1:4、特に1.1:3.5であることを意味する。例えば、反応体として式(4)に一致する化合物としてアミノカプロン酸ナトリウムが使用される場合、この反応は、過剰のカプロラクタムの存在下に実施される。
【0042】
本方法を、式(1)(R3は、R1またはR2である)に一致するトリアジン化合物の調製に用いる場合は、塩化シアヌルを、塩化シアヌルの量を基準として好ましくは0.5〜3、より好ましくは1〜2モル当量の反応体Aと反応させる第1ステップを含み、反応体Aは、式(2)に一致するアミンまたは式(3)もしくは(4)に一致する化合物から選択される化合物のいずれかである。第2反応ステップにおいては、得られた中間体が、次いで、塩化シアヌルの量を基準として0.5〜5、好ましくは1〜4モル当量の反応体Bと反応され、反応体Bは、
反応体Aとして式(2)に一致するアミンが使用される場合は、式(3)もしくは(4)に一致する化合物から選択される化合物または
反応体Aとして式(3)もしくは(4)に一致する化合物から選択される化合物が使用される場合は、式(2)に一致するアミンである。
【0043】
第1反応ステップが実施される温度は、好ましくは、−20〜100℃の範囲、より好ましくは−10〜80℃の範囲、よりさらに好ましくは0〜60℃の範囲にある。一方、第2反応ステップが実施される温度は、好ましくは0〜200℃の範囲、より好ましくは10〜180℃の範囲、よりさらに好ましくは20〜170℃の範囲にある。第1ステップにおいて、塩化シアヌルの1個の塩素原子のみが反応体Aと反応し、塩化シアヌルの残り2個の塩素原子が第2ステップにおいて反応体Bと反応する本方法の一実施形態においては、第2ステップにおいて温度を変化させる(temperature ramp)と有利である。
【0044】
第1反応ステップが実施される圧力は、好ましくは0.5〜1.5バール、より好ましくは0.8〜1.2バール、よりさらに好ましくは大気圧である。一方、第2反応ステップが実施される圧力は、好ましくは1〜11バール、より好ましくは1〜9バール、よりさらに好ましくは1〜8バールである。
【0045】
本方法のさらなる実施形態は、塩化シアヌルを溶媒中において式(3)または(4)に一致する化合物から選択される化合物と反応させる第1反応ステップを含む。次いで、第2ステップにおいて、式(2)に一致するアミンとの反応が実施される。
【0046】
本方法の好ましい一実施形態においては、第1反応ステップは、塩化シアヌルを、塩化シアヌルの量を基準として1〜3モル当量、好ましくは2モル当量の反応体Aと反応させることを含み、第2ステップは、次いで、結果として得られた中間体を、塩化シアヌルの量を基準として0.5〜5、好ましくは1〜3モル当量の反応体Bと反応させることを含む。第1ステップが実施される温度は、好ましくは0〜100℃、より好ましくは10〜80℃、よりさらに好ましくは20〜60℃である。一方、第2ステップが実施される温度は、好ましくは80〜200℃、より好ましくは90〜180℃、よりさらに好ましくは100〜170℃である。
【0047】
本方法が、式(1)(式中、R3は、−OR6または−NR7R8)に一致するトリアジン化合物の調製に使用される場合、この方法は、塩化シアヌルを、塩化シアヌルの量を基準として0.5〜2モル当量、好ましくは1モル当量の反応体Aと反応させる第1反応ステップを含み、反応体Aは、式(2)に一致するアミンまたは式(3)もしくは(4)に一致する化合物から選択される化合物または式(16)もしくは(17)に一致するヒドロキシもしくはアミノ化合物のいずれかである。第2反応ステップにおいては、次いで、得られた中間体が塩化シアヌルの量を基準として0.5〜2モル当量、好ましくは1モル当量の反応体Bと反応され、反応体Bは、
反応体Aとして式(2)の化合物が使用される場合は、式(3)、(4)、(16)、もしくは(17)に一致する化合物から選択される化合物または
反応体Aとして式(3)もしくは(4)に一致する化合物から選択される化合物が使用される場合は、式(2)、(16)、もしくは(17)に一致する化合物から選択される化合物または
反応体Aとして式(16)もしくは(17)に一致する化合物から選択される化合物が使用される場合は、式(2)、(3)、もしくは(4)に一致する化合物から選択される化合物である。
【0048】
本方法のこの特定の実施形態の第3反応ステップにおいては、得られた中間体は、次いで、塩化シアヌルの量を基準として0.5〜2モル当量、好ましくは1モル当量の反応体Cと反応され、反応体Cは、
式(2)および(3)もしくは(4)の化合物が反応体AおよびBとして使用される場合は、式(16)もしくは(17)に一致する化合物から選択される化合物または
式(3)もしくは(4)および(16)もしくは(17)の化合物が反応体AおよびBとして使用される場合は、式(3)もしくは(4)に一致する化合物から選択される化合物または
式(3)もしくは(4)および(16)もしくは(17)の化合物が反応体AおよびBとして使用される場合は、式(2)に一致する化合物である。
【0049】
本方法のこの特定の実施形態の第1反応ステップが実施される温度は、好ましくは−20〜80℃、より好ましくは−10〜60℃、よりさらに好ましくは0〜40℃である。一方、第2ステップが実施される温度は、好ましくは0〜100℃、より好ましくは10〜80℃、よりさらに好ましくは20〜60℃である。第3ステップが実施される温度は、好ましくは80〜200℃、より好ましくは90〜180℃、よりさらに好ましくは100〜170℃である。
【0050】
本方法のこの特定の実施形態の第1および第2反応ステップが実施される圧力は、好ましくは0.5〜1.5バール、より好ましくは0.8〜1.2バール、よりさらに好ましくは大気圧である。一方、第3ステップが実施される圧力は、好ましくは1〜11バール、より好ましくは1〜9、よりさらに好ましくは1〜8バールである。
【0051】
本発明の方法の個々の反応ステップを、本発明の方法の任意の1段階で実施してもよく、いずれの場合に形成された中間体も、これらを次の段階の出発物質として使用することができるように分離および単離することが可能である。
【0052】
特定の一実施形態においては、ある段階の中間体は、最終段階を除いて分離も単離もされることなく、次の出発物質としてそのまま供給される。したがって、本発明の方法のこの実施形態においては、中間体はin situで形成される。
【0053】
本発明の方法のさらなる実施形態においては、すべての反応ステップが1つの反応器、特にオートクレーブ内で実施される。この実施形態においては、式(3)の化合物と塩基との反応を別の段階または別の反応槽内で実施してもよい。しかしながら、本発明の方法の反応ステップがすべて同一の反応槽内で行われるように、式(3)に一致する化合物と塩基との反応を同じ反応槽内で実施することもできる。このようにして、本発明の方法におけるトリアジン環上の3個の置換すべてを1つの反応槽内で実施することができる。
【0054】
一般に、式(3)に一致する化合物の塩基との反応を、別の段階または反応槽内で実施することができる。しかしながら、式(3)に一致する化合物と塩基との反応は、各反応段階が実施されるのと正に同じ反応槽内で実施することもできる。
【0055】
反応混合物の処理(working−up)は主として副生成物である塩化ナトリウムを除去する役割を果たす。トリアジン化合物が水に不溶な場合は、塩化ナトリウムを水に溶解させ、水性懸濁液を濾過した後に濾過ケーキを洗浄するかまたは目的の生成物を有機溶媒、好ましくは反応中に用いられる有機溶媒で抽出することによって除去する。トリアジン化合物が水溶性である場合は、同様に水溶性である塩化ナトリウムを好ましくは膜を介した電気透析またはイオン交換クロマトグラフィーによって除去するが、好ましくはイオン交換クロマトグラフィーによって塩化ナトリウムを除去する。
【0056】
このように処理された、水または有機溶媒中の溶液を構成する反応混合物は、次いでそのまま使用してもよく、特定の一実施形態においては、乾燥操作の前に安定剤として使用される。
【0057】
本方法の特定の一実施形態においては、個々の反応ステップの後に生じる中間体を反応混合物から単離して精製してもよい。これは、好ましくは、反応混合物から結晶化、濾過、および適切であれば洗浄を行うことによって達成される。この中間体の単離および精製は、有機溶媒、好ましくは反応中に既に用いられた有機溶媒で抽出することによって実施することもできる。こうして単離および精製された中間体は、通常は固体であり、次いで、本方法の次のステップに用いることができる。
【0058】
本方法のさらなる実施形態においては、これらの中間体は単離および処理に付されない。反応ステップは、中間体を単離および処理することなく連続して実施される。
【0059】
本方法においては、トリアジン化合物として、式(1)に一致する少なくとも2種の異なるトリアジン化合物を含む混合組成物も使用してもよい。その場合、この混合組成物は、好ましくは、
式(18)
【化16】

に一致するトリアジン化合物を85%〜95重量%、
式(19)
【化17】

に一致するトリアジン化合物を0%〜10重量%、
式(20)
【化18】

に一致するトリアジン化合物を0%〜10重量%
(式中、R’は、R1またはR2であり、R’’は、R2またはR1であり、R’はR’’と同一ではなく、これは特に、R’がR1である場合、R’’がR2であり、その逆も同様であることを意味する)を含む。
【0060】
この混合組成物の特定の一実施形態においては、R’はR1であり、R’’はR2である。この組成物は、本方法において、反応体である塩化シアヌル、式(2)のアミン、および式(3)または(4)に一致する化合物を、物質比1:2:1で用いることによって得ることができる。
【0061】
この混合組成物の特に好ましい一実施形態においては、R’はR1であり、R’’はR2である。この組成物は、反応体である塩化シアヌル、式(2)のアミン、および式(3)または(4)に一致する化合物を、物質比1:1:2で用いることによって得ることができる。
【0062】
混合組成物のさらなる実施形態は、
式(18)、
【化19】

に一致するトリアジン化合物を30%〜95重量%、
式(20)
【化20】

に一致するトリアジン化合物を0%〜60重量%、
式(19)および(21)
【化21】

に一致するトリアジン化合物を0%〜10重量%
(式中、R’はR1またはR2であり、R’’はR2またはR1であり、R’はR’’と同一ではなく、これは特に、R’がR1である場合はR’’がR2であり、その逆も同様であることを意味する)を含む。この組成物は、反応体である塩化シアヌル、式(2)のアミン、および式(3)または(4)に一致する化合物を、物質比1:1.5:1.5で用いることによって得ることができる。
【0063】
この組成物のさらなる好ましい実施形態は、
式(23)
【化22】

に一致するトリアジン化合物を60%〜90重量%、
それぞれR’、R’’、またはR’’’から選択される2個の同じ型の置換基および異なる第3の置換基を有するトリアジン化合物、例えば式(18)または(20)に一致するトリアジン化合物を1%〜30重量%、
3個の置換基すべてがR’、R’’、またはR’’’から選択される同じ型であるトリアジン化合物、例えば式(19)または(21)に一致するトリアジン化合物を0.5%〜10重量%
(式中、R’は、R1、R2、またはR3であり、R’’は、R2、R1、またはR3であり、R’’’は、R3、R2、またはR1であり、R’、R’’、およびR’’’は、同一ではなく、これは特に、R’がR1である場合、R’’はR2であり、かつR’’’がR3であり、その逆も同様であることを意味する)を含む。この組成物は、本方法において、反応体である塩化シアヌル、式(2)のアミン、式(3)または(4)に一致する化合物、および式(16)または(17)に一致する化合物を、物質比1:(0.5〜2):(0.5〜2):(0.5〜5)、好ましくは、物質比1:1:1:(1〜4)で用いることによって得ることができる。
【0064】
本発明による方法においては、トリアジン化合物は、カルボキシル部分を介してポリマー鎖のアミン末端基と反応し、したがってポリマーからアミン末端基を除去するが、それと同時に1または2個の非反応性アミン末端基を供与する。このような非反応性アミン末端基は重縮合に寄与しないが、染色性に与える効果は反応性末端基に匹敵することが見出された。したがって、紡糸工程中の重縮合が低減されることによって紡糸性が向上する一方で、染色性は保持されるかまたは向上さえする。
【0065】
好ましい実施形態においては、R1およびR3は両方とも、染色性を向上さえさせる利点を有するジアミン残基である。
【0066】
第2の好ましい実施形態においては、R3はアミノ酸残基である。この実施形態においては、トリアジン化合物は二塩基酸として機能し、そして鎖長調節剤として作用する(それ以外の場合は、これを別途添加する必要がある)。染色性は、R1のアミン末端基が存在することによって保持される。
【0067】
いずれの実施形態においても、Bは、好ましくは、染色性に加えてポリマーにUV安定性を付与する利点を有する非反応性アミノ末端基(好ましくはヒンダードアミン基)を含む。
【0068】
ポリマーの調製方法は、対応するモノマーから出発する通常の重合方法であってもよい。このような方法の例は、例えば、ウルマン工業化学百科事典(ウルマンズ・エンサイクロペディア・オブ・インダストリアル・ケミストリー;Ullman’s Encyclopedia of Industrial Chemistry)、第21A巻、「ポリアミド」および「ポリエステル」章に記載されている。ポリアミドの場合は、通常の加水分解重合法を適用することができる。この方法は、連続法であっても回分法であってもよい。
【0069】
この重合法は、通常の条件下でトリアジン化合物の存在下に実施される。トリアジン化合物は出発モノマーに添加してもよいし、あるいは重合装置に別々に添加してもよく、その場合は、この方法が実施される間に好ましくは制御された態様で行う。トリアジン化合物は、カルボキシル部分を介してポリマー鎖に化学結合するであろう。
【0070】
ポリマーがポリアミドである場合は、対応するモノマーは、好適な二塩基酸およびジアミンの混合物、対応する二塩基酸−ジアミン塩、またはラクタムであってもよい。例えば、ポリアミド−6(PA6)の場合は、対応するモノマーはカプロラクタムであり、PA6,6の重合は、通常は、ヘキサメチレンジアミンおよびアジピン酸の塩から開始される。さらなるポリアミドの対応する出発モノマーは当該技術分野において周知である。本発明の方法において好適なモノマーは、その加工性および機械特性が好ましいという観点から、重合によって熱可塑性ポリアミド、好ましくは半結晶性ポリアミドとなり得るものである。このようなポリアミドとしては、例えば、ポリアミド−6(PA−6)、PA−6,6、PA−4,6、PA−6,9、PA−6,10、PA−11、PA−12、PA−MXD6、ならびにこのようなポリアミドのコポリマーおよび混合物が挙げられる。好ましくは、ポリアミドは、PA6、PA66、PA46、またはそれを構成するモノマーのコポリアミドである。
【0071】
ポリマーがポリエステルである場合は、モノマーは、ジオールおよびジカルボン酸またはこれらのポリエステル形成性誘導体(ジメチルエステル等)であってもよい。好適なジオールは、式HO−R−OH(式中、Rは、2〜18個、好ましくは2〜12個の炭素原子を有する、2価の分岐または非分岐の脂肪族および/または脂環式基である)を有するものである。好適なジカルボン酸は、式HOOC−R’−COOH(式中、R’は、2〜18個、好ましくは4〜12個の炭素原子を有する2価の脂肪族、脂環式、または芳香族基である)を有するものである。このようなポリエステルの調製は従来技術であり、例えば、ウルマン工業化学百科事典、第21A巻、「ポリエステル」章に記載されている。
【0072】
トリアジン化合物は、少なくとも2mmol/kg、好ましくは少なくとも5mmol/kg、より好ましくは少なくとも10mmol/kgの量で存在する。またこれは、最大で70mmol/kg、好ましくは最大で40mmol/kg、より好ましくは最大で30mol/kgの量で存在する。上記量はすべて、任意のモノもしくはジアミンまたは一もしくは二塩基酸を含むモノマーおよびトリアジン化合物の総量に対するものである。
【0073】
本発明による方法においては、上に定義したトリアジンの混合組成物を適用してもよく、それによって、染色性改善作用およびUV安定化作用の組合せのバランスをとり、かつこれを向上させるのに適した条件が得られる。
【0074】
重合法は、このために用いられる周知のさらなる化合物、例えば、当該技術分野において通常量の、水、連鎖調節剤(例えば、一および二塩基酸ならびにモノ−およびジアミンが挙げられる)、顔料の存在下に実施してもよい。
【0075】
本発明はさらに、ポリマー鎖に化学結合している上に定義した式1で表される、置換されたトリアジン化合物が存在することを特徴とする、良好な紡糸性および染色性を有するポリマーに関する。
【0076】
本発明によるポリマーは、置換されたトリアジン化合物が存在することによって良好な紡糸性および良好な染色性が両立されており、これにより、特に衣料および床用敷物に適した繊維を製造するのに特に好適となる。
【0077】
好ましい実施形態においては、R1およびR3はいずれもジアミンであり、それによって、染色性が向上さえするという利点が得られる。
【0078】
第2の好ましい実施形態においては、R3はアミノ酸である。この実施形態、特にラクタムをベースとするポリアミドにおいては、トリアジン化合物は、通常、両方のカルボキシル部分がポリマー鎖に結合することとなり、この状況下においては、ポリマーの分子量分布Mw/Mnが、R3がジアミンである場合よりも狭くなることが見出された。これにより、ポリマー溶融物のレオロジー挙動が改善され、したがって、好ましい紡糸性が得られる。染色性は、R1のアミン末端基が存在することによって保持される。
【0079】
いずれの実施形態においても、Bは、好ましくは、染色性に加えてポリマーにUV安定性を付与する利点を有する非反応性アミノ末端基(好ましくはヒンダードアミン基)を含む。
【0080】
さらに、このUV安定性は、上に定義した式1で表される、置換されたトリアジン化合物をさらに含むポリアミドまたはポリエステルを含む組成物中においても存在することが見出された。
【0081】
本発明を以下の実施例によって例示するが、これらに限定されるものではない。
【0082】
[実施例I 重合]
20LのFourneオートクレーブ反応器に、カプロラクタム98重量%、安息香酸0.24重量%、ビス−トリアセトンアミノ−トリアジン−アミノカプロン酸(BTT−ACA)0.5重量%、および水1.26重量%からなる混合物10kgを160℃に予熱して添加した。混合物全体に対する安息香酸の量は20mmol/kgであり、BTT−ACAの量は5mmol/kgである。
【0083】
反応器を2.5℃/分の速度で160℃から260℃まで加熱した。第1重合ステップとして、反応器をこの温度および圧力4バールで30分間維持した。次のステップとして、圧力を1.6バールに低下させ、残った水を留去した。次いで、反応器を260℃および1.6バールで5.5時間維持した。
【0084】
次いで、溶融状態にある反応器の内容物を、複数の穴を含むプレートを通して温度250℃および圧力5.5バールで反応器から排出することによりストランドを形成し、これを冷却および切断して顆粒にした。
【0085】
未反応のカプロラクタムおよび他の成分を、100℃の熱湯を1.1バールの圧力で16時間流すことによって顆粒から抽出した。抽出された化合物の合計量は10重量%となった。抽出後のポリマーに対する、ポリマーに結合している安息香酸の量は22.2mmol/kgであり、結合しているBTT−ACAは5.6mmol/kgである。
【0086】
相対粘度(96%硫酸中1%溶液、23℃)が2.44であるポリマーの白色顆粒を得た。
【0087】
[実施例II 重合]
上記安息香酸を、当量すなわち20mmol/kgのテレフタル酸(0.32重量%)と置き換えて、水の量を全体で100重量%に達するように合わせるという条件下で実施例Iを繰り返した。第2重合ステップにおける圧力を1.94バールとした。それ以外の条件および量は変えなかった。
【0088】
相対粘度(96%硫酸中1%溶液、23℃)が2.46であるポリマーの白色顆粒を得た。
【0089】
[実施例III 紡糸]
実験IおよびIIで得られたポリマー顆粒を、この顆粒を押出機で加熱および溶融し、直径0.25mmのオリフィス24個を有する紡糸プレートから溶融物を押し出すことによって270℃の温度で溶融紡糸し、そしてBarmag SW46巻取装置で速度を4000〜6000m/分に変化させて巻き取った。溶融物の滞留時間を270℃で15分間とした。
【0090】
このポリアミドの紡糸挙動は、紡糸工程中における巻取速度(WUS)に応じた、
S=0.1×FC+FB+10×YB
(式中、FCは毛羽数であり、FBは単糸切れ回数であり、YBは、糸切れ回数である)として定義される紡糸性指数S(Spinnability Index)によって示されるように、非常に優れていた。Sの値は0.1〜3の範囲にあり、これよりも高い値になるのは、紡糸速度5000m/分超で一塩基(安息香)酸型のポリアミドを用いた場合のみであった。一般に、Sの値が10未満であれば「紡糸性が非常に優れている」と認定される。
【0091】
こうして得られた部分配向糸(POY)(一塩基酸および二塩基酸(テレフタル酸)型の両方のポリアミド)の機械特性、強度、伸度、弾性率、破壊仕事(work−to−rupture)(WTR)を表1に示す。4200m/分で紡糸された一塩基酸ポリアミドから製造された部分配向糸を様々な延伸比で完全延伸糸(FDY)にさらに延伸した。完全延伸糸の特性を表2に示す。ここに示す繊度は24単糸束のものである。
【0092】
【表1】

【0093】
【表2】

【発明の詳細な説明】
【0001】
本発明は、改善された染色性および良好な紡糸性を有するポリマーの調製方法ならびにこれらの好ましい特性を有するポリマーに関する。
【0002】
紡糸可能なポリマーのグレード、例えば、ポリアミドやポリエステルのようなポリマーの製造方法は当該技術分野において周知である。このようなグレードに不可欠な条件は、良好な紡糸性を有すること、すなわちこのグレードが中断することなく連続的に高速紡糸法で紡糸することができることと、得られた繊維が衣料や床用の敷物に使用されることが多いという理由から、良好な染色性を有することとにある。
【0003】
ポリマーの紡糸工程においては、ポリマーが加熱および溶融されることによって望ましくない作用である重縮合が起こり、その結果として粘度が上昇し、それによって紡糸が不規則になったり繊維が破断したりする場合がある。この重縮合を例えばポリアミドにおいて防止するためには、ポリマーのアミン末端基の数を少なくすることが好ましい。一方、ポリマーの染色性はアミン末端基が存在することによって向上する。そのため、ポリマーには相容れない要求が課せられる。
【0004】
ここで本発明は、重縮合の傾向が低減されているが依然として良好な染色性を有するポリマーを製造する方法を目的とする。
【0005】
この目的は、式、
【化1】

[式中、R1は、−A−B
(式中、Aは、−O−または−NR4−であり、
Bは、アミノ基含有置換基であり、
R4は、水素またはアルキル基である)であり、
R2は、
【化2】

(式中、Eは、−O−または−NR5−であり、
nは、3〜15であり、
mは、0〜10であり、
R5は、水素またはアルキル基である)であり、
R3は、R1、R2、−OR6、または−NR7R8
(式中、R6、R7、およびR8は、水素、アルキル、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)である]のトリアジン化合物の存在下に、対応するモノマーを重合させることを含む方法によって達成される。
【0006】
式(1)に一致するこれらのトリアジン化合物は、塩化シアヌルを塩基の存在下に、0.5〜5モル当量の式(2)、
H−A−B (2)
のアミンおよび0.5〜5モル当量の式(3)、
【化3】

に一致する化合物または式(4)、
【化4】

(式中、oは、0〜12であり、
Eは、−O−または−NR5−であり、
R5は、水素またはアルキル基である)に一致する化合物と反応させることによって製造することができ、この2つの反応ステップはどちらの順序で実施してもよい。
【0007】
意外にも、本発明者らは、アミノおよびカルボキシル基の両方を含む置換基で置換されたトリアジン化合物が、ポリエステルおよびポリアミドの反応性安定剤として有用であることを見出した。本発明の目的のための反応性安定剤は、そのアミノ−およびカルボキシル含有置換基を介してポリマーに組み込むことができ、したがってこれは、ポリマー鎖の構成ブロックである。このことは、本発明の安定剤が重合段階において添加することが可能であり、かつ重合過程においてポリマー鎖に組み込まれるという点で先行技術よりも有利である。したがって、安定剤をポリマーに混合するさらなるステップが不要となる。さらに、本発明のこのような安定剤は、ポリマーから溶出することができず、したがって、永久的に有効な安定剤が利用できるという利点を有する。このような化合物は経済的な方法によって調製できることが確認されているので、この目的が達成されたことはさらに意外なことである。
【0008】
本発明に使用することができるトリアジン化合物の構造は、式(1)、
【化5】

[R1は、−A−B
(式中、Aは、−O−または−NR4−であり、
Bは、アミノ基含有置換基であり、
R4は、水素またはアルキル基である)であり、
R2は、
【化6】

(式中、Eは、−O−または−NR5−であり、
nは、3〜15であり、
mは、0〜10であり、
R5は、水素またはアルキル基である)であり、
R3は、R1、R2、−OR6、または−NR7R8
(R6、R7、およびR8は、水素、アルキル、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)である]に一致する。
【0009】
トリアジン化合物のR1型の置換基の構造断片Aは、−O−だけでなく−NR4−であってもよく、R1およびR3型の置換基の構造断片Aは、同一であっても異なっていてもよい。好ましくは、構造断片Aは、−NR4−である。R4型の置換基は、水素だけでなくアルキル基であってもよい。好ましくは、R4型の置換基は、水素であるかまたは1〜10個、好ましくは2〜5個の炭素原子を有するアルキル基である。このR4型の置換基のアルキル基は、分岐であっても非分岐であってもよいが、好ましくは非分岐である。さらにこのアルキル基は、好ましくは非置換である。しかしながら、より好ましくは、R4型の置換基は水素である。
【0010】
B型の置換基は、特にアミノ基含有置換基であり、そのアミノ基は、脂肪族の支持骨格(supporting scaffold)上に位置していてもよいし、脂肪族環状アミンであってもよい。好ましくは、B型の置換基は、脂肪族環状アミンを含む。
【0011】
好ましくは、本発明において使用することができるトリアジン化合物は、R1型の置換基中に、式(5)、
【化7】

[式中、R9は、水素、アルキル、または式−O−R20のアルコキシ基
(R20は、いずれの場合も4〜16個の炭素原子を有する分岐もしくは非分岐アルキルまたは環状アルキル基である)]に一致するかまたは式(6)、
−(CH2)p−NR10R11 (6)
(式中、pは、1〜15、好ましくは2〜8、より好ましくは3〜6である)に一致するB型の置換基を含む。
【0012】
R10およびR11型の置換基は同一であっても異なっていてもよく、好ましくは、水素、アルキル、シクロアルキル、またはヘテロシクロアルキル基であり、特に、いずれの場合も、1〜20個、好ましくは2〜10個の炭素原子を有するかまたは1〜20個、好ましくは2〜10個の炭素およびヘテロ原子を有するものである。このR10およびR11型の置換基のアルキル基は、好ましくは分岐または非分岐であるが、より好ましくは非分岐である。さらに、これらは好ましくは非置換であるかまたはアミノ基で置換されているが、より好ましくは非置換である。R10およびR11型の置換基のシクロアルキル基は、好ましくは非置換であるかまたは置換されているが、特にこのシクロアルキル基は非置換である。R10およびR11型の置換基のヘテロシクロアルキル基は、好ましくは、非置換であるかまたは置換されているが、好ましくは、このヘテロシクロアルキル基は、1個またはそれ以上のメチル基で置換されており、好ましくは、これは、ヘテロ原子として1個またはそれ以上の窒素原子を含むヘテロシクロアルキル基であり、好ましくは、これは、式(5)に一致するヘテロシクロアルキル基である。
【0013】
R9型の置換基は、好ましくは、水素であるかまたは1〜16個、好ましくは1〜8個の炭素原子を有するアルキル基であるかまたは分岐もしくは非分岐のアルキル基を有するアルコキシ基であるかまたはシクロアルキル基であり、より好ましくは、R9型の置換基は水素である。
【0014】
好ましくは、トリアジン化合物は、式(6)に一致するB型の置換基を含む。より好ましくは、このトリアジン化合物は、式(6a)または(6b)、
【化8】

に一致するB型の置換基を含む。
【0015】
特に好ましいトリアジン化合物の実施形態においては、これらは、式(5)に一致するB型の置換基を含む。
【0016】
特に非常に好ましいトリアジン化合物は、式(7)、
【化9】

に一致するR1型の置換基を含むものである。
【0017】
トリアジン化合物のR2型の置換基は、好ましくは、−O−または−NR5−を有する構造断片Eを含み、R5型の置換基は、好ましくは、水素であるかまたは1〜16個、好ましくは1〜4個の炭素原子を有するアルキル基であり、好ましくは、R5型の置換基は水素である。R5型の置換基のアルキル基は、分岐または非分岐であるが、好ましくは非分岐である。さらに、このR5型の置換基のアルキル基は、好ましくは非置換である。R2型の置換基においては、nは、好ましくは3〜15の範囲、より好ましくは5〜11の範囲にあり、よりさらに好ましくは5であり、mは、好ましくは0〜10の範囲、より好ましくは0〜4の範囲にあり、よりさらに好ましくは、mは0である。
【0018】
本発明において使用されるトリアジン化合物は、好ましくは、R3型の置換基としてR1型の置換基を含む。特定の実施形態においては、トリアジン化合物は、R3型の置換基としてR2型の置換基を含む。このR1およびR2型の2種の置換基は、それぞれ同一であっても異なっていてもよく、好ましくは、同じ型の置換基は同一である。
【0019】
好ましい実施形態においては、トリアジン化合物は、以下の構造(7a)、(7b)、または(7c)、
【化10】

に一致するR1型の置換基を含む。
【0020】
この好ましい実施形態においては、R2型の置換基は、特に、式(8a)または(8b)、
−NH−(CH2)5−COOH (8a)
−NH−(CH2)11−COOH (8b)
に一致する構造を有している。
【0021】
この好ましい実施形態においては、R3型の置換基は、好ましくはR1型の置換基であり、より好ましくは、これらの2種の置換基は同一である。この好ましい実施形態においては、R3型の置換基は、同様にR2型の置換基であってもよく、ここでも同様に、これらの2種の置換基は好ましくは同一である。
【0022】
トリアジン化合物のさらなる実施形態においては、これらは、以下の式(14)および(15)、
−O−R6 (14) または −NR7R8 (15)
[式中、R6、R7、およびR8は、水素、アルキル基、またはアリール基であり、このアルキルまたはアリール基は、非置換であるかまたは1種もしくは複数の式R6、R7、R8、−SO3H、または−SO3M(式中、Mは、アルカリ金属陽イオン、好ましくは、リチウム、ナトリウム、またはカリウム陽イオンである)の置換基で置換されている]に一致するR3型の置換基を含む。R6、R7、またはR8型の置換基のアルキルおよび/またはアリール基は、好ましくは1〜4個の置換基、より好ましくは1〜2個の置換基、最も好ましくは1個の式−SO3Hまたは−SO3Mの置換基を含む。好ましくは、R6、R7、およびR8型の置換基は、水素であるかまたは1〜18個、好ましくは2〜16個の炭素原子を有するアルキル基である。このR6、R7、およびR8型の置換基のアルキル基は、分岐であっても非分岐であってもよいが、好ましくは非分岐である。R6、R7、およびR8型の置換基のアリール基は、好ましくはフェニル基または−SO3Hもしくは−SO3Mで好ましくはパラ位が置換されたフェニル基である。R6、R7、およびR8型の置換基は、すべて同一であっても、すべて異なっていても、あるいは同一の対を成していてもよい。好ましくは、R6、R7、およびR8型の置換基は、水素、フェニル基、または−SO3Hもしくは−SO3Mでパラ位が置換されたフェニル基である。
【0023】
式(1)、
【化11】

[式中、R1は、−A−B
(式中、Aは、−O−または−NR4−であり、
Bは、アミノ基含有置換基であり、
R4は、水素またはアルキル基である)であり、
R2は、
【化12】

(式中、Eは、−O−または−NR5−であり、
nは、3〜15であり、
mは、0〜10であり、
R5は、水素またはアルキル基である)であり、
R3は、R1、R2、−OR6、または−NR7R8
(式中、R6、R7、およびR8は、水素、アルキル基、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)である]に一致するトリアジン化合物の調製方法は、塩化シアヌルを、塩基の存在下に、0.5〜5モル当量の式(2)、
H−A−B (2)
のアミンおよび0.5〜5モル当量の式(3)、
【化13】

に一致する化合物または式(4)、
【化14】

(式中、oは、0〜12であり、
Eは、−O−または−NR5−であり、
R5は、水素またはアルキル基である)に一致する化合物と反応させることを含み、この2つの反応ステップはどちらの順序で実施してもよい。
【0024】
R1またはR2以外にR3を有する化合物が調製される本方法の実施形態においては、さらなる工程ステップにおいて、0.5〜5モル当量の式(16)または(17)、
H−OR6 (16) または H−NR7R8 (17)
に一致する化合物が塩基の存在下に反応される。
【0025】
R5型の置換基は、水素だけでなくアルキル基であってもよい。好ましくは、R5型の置換基は、水素または1〜16個、好ましくは1〜4個の炭素原子を有するアルキル基である。このR5型の置換基のアルキル基は、分岐または非分岐であってもよいが、好ましくは非分岐である。さらにこのR5型の置換基のアルキル基は、好ましくは非置換である。しかしながら、R5は、好ましくは水素である。式(3)または(4)に従う化合物においては、oは好ましくは0〜12であり、より好ましくは2〜8、特に好ましくは2である。
【0026】
本方法には、好ましくは、式(3)に一致する化合物としてラクタムまたはラクトンが利用されるが、より好ましくは、ラクタムが利用される。特に好ましくは、本方法においてはカプロラクタムが使用される。本方法の特定の一実施形態においては、式(4)に一致する化合物、より好ましくはアミノカプロン酸ナトリウムが利用される。
【0027】
式(4)に一致する反応体は、本方法において、例えば式(3)に一致する化合物および塩基、特にアルカリ金属水酸化物、例えば水酸化ナトリウムを使用することによってin situで形成させてもよい。ここで使用されるこの2種の反応体の物質比は、好ましくは、5:1〜1:1の範囲、好ましくは4:1〜1:1の範囲にあり、より好ましくは2:1〜1:1である。
【0028】
本方法は、式(3)または(4)に一致する化合物を、使用される塩化シアヌルを基準として0.5〜5、好ましくは1〜3、より好ましくは1〜2モル当量利用している。
【0029】
本方法は、好ましくは、さらなる反応体として、式(2)に一致するアミンを利用しており、構造断片Aは、−O−だけでなく−NR4−であってもよい。式(2)に一致する、構造断片Aとして−NR4−を含むアミンを使用することが好ましい。R4型の置換基は、水素だけでなくアルキル基であってもよい。好ましくは、R4型の置換基は、水素であるかまたは1〜10個、好ましくは2〜5個の炭素原子を有するアルキル基である。この構造断片Aのアルキル基は、分岐であっても非分岐であってもよいが、好ましくは非分岐である。さらに、このアルキル基は、好ましくは非置換である。しかしながら、より好ましくは、R4置換基は水素である。
【0030】
本方法は、式(2)(式中、B型の置換基は、好ましくは、アミノ基が脂肪族支持骨格上に位置していてもよく、または脂肪族環状アミンであってもよいアミノ基含有置換基である)のアミンを利用している。好ましくは、このB型の置換基は、脂肪族環状アミンを含む。
【0031】
本方法は、好ましくは、式(6)または式(5)に従うB型の置換基を含む式(2)のアミンを利用している。
【0032】
R10およびR11型の置換基は、同一であっても異なっていてもよく、好ましくは、水素、アルキル、シクロアルキル、またはヘテロシクロアルキル基(いずれの場合も、1〜20個、好ましくは2〜10個の炭素原子または1〜20個、好ましくは2〜10個の炭素およびヘテロ原子を含む)である。このR10およびR11型の置換基のアルキル基は、好ましくは、分岐または非分岐であるが、より好ましくは非分岐である。さらに、これらは好ましくは非置換であるかまたはアミノ基で置換されているが、より好ましくは非置換である。R10およびR11型の置換基のシクロアルキル基は、好ましくは非置換であるかまたは置換されており、特にこのシクロアルキル基は非置換である。R10およびR11型の置換基のヘテロシクロアルキル基は、好ましくは非置換であるかまたは置換されており、好ましくはこのヘテロシクロアルキル基は、1個またはそれ以上のメチル基で置換されており、好ましくは、これは、1個またはそれ以上の窒素原子をヘテロ原子として含むヘテロシクロアルキル基であり、好ましくは、これは、式(5)に従うヘテロシクロアルキル基である。
【0033】
R9型の置換基は、好ましくは、水素または1〜16個、好ましくは1〜8個の炭素原子を有するアルキル基であるかまたは分岐もしくは非分岐アルキル基もしくはシクロアルキル基を含むアルコキシ基であり、より好ましくは、R9型の置換基は水素である。
【0034】
本方法は、好ましくは、式(6)に一致するB型の置換基を有するアミンを利用している。しかしながら、式(6a)または(6b)に一致するB型の置換基を有するアミンを利用することが特に好ましい。式(2a)、
HNR4−(CH2)m−NR10R11 (2a)
に一致するアミンを利用することが特に非常に好ましい。
【0035】
本方法の特に好ましい一実施形態は、式(5)に一致するB型の置換基を含むアミンを利用している。本方法においては、式(2b)、
【化15】

に一致するアミンを利用することが特に非常に好ましい。
【0036】
本方法は、式(3)もしくは(4)に一致する、異なる化合物の混合物または式(2)に一致する、異なるアミンの混合物も利用してもよい。
【0037】
本方法のさらなる実施形態は、さらなる反応体として、式(16)または(17)[式中、R6、R7、およびR8は、それぞれ、水素、アルキル基、またはアリール基であり、このアルキルまたはアリール基は、非置換であるかまたは式R6、R7、R8、−SO3H、または−SO3M(式中、Mは、アルカリ金属陽イオン、好ましくは、リチウム、ナトリウム、またはカリウム陽イオンである)の1種またはそれ以上の置換基で置換されている]に一致する化合物を利用している。R6、R7、またはR8型の置換基のアルキルおよび/またはアリール基は、好ましくは、1〜4個の置換基、より好ましくは1〜2個の置換基、最も好ましくは1個の式−SO3Hまたは−SO3Mの置換基を含む。好ましくは、R6、R7、およびR8型の置換基は、水素であるかまたは1〜18個、好ましくは2〜16個の炭素原子を有するアルキル基である。このR6、R7、およびR8型の置換基のアルキル基は、分岐であっても非分岐であってもよく、好ましくは非分岐である。R6、R7、およびR8型の置換基のアリール基は、好ましくは、非置換のフェニル基であるかまたは−SO3Hもしくは−SO3Mで好ましくはパラ位をモノ置換されたフェニル基である。R6、R7、およびR8型の置換基は、すべて同一であっても、すべて異なっていても、あるいは同一の対を成していてもよい。好ましくは、R6、R7、およびR8型の置換基は、水素、フェニル基、またはパラ位を−SO3Hもしくは−SO3Mでモノ置換されたフェニル基である。
【0038】
調製すべきトリアジン化合物に応じて、この反応は、実際に転化または反応が起こる2または3つのステップからなっていてもよい。
【0039】
本方法の好ましい一実施形態は、第1ステップにおいて、塩化シアヌルを式(2)に一致するアミンと塩基の存在下に溶媒中で反応させることを含む。好ましくは、水酸化ナトリウム水溶液が塩基として使用される。アミンおよび塩基は、好ましくは、物質比1:1で使用される。この好ましい実施形態のこの第1反応ステップにおいては、水、芳香族炭化水素(特に、トルエン、キシレン)、アルカン、エーテル、ケトン(例えばアセトン等)、またはエステルから選択される溶媒を利用してもよく、好ましくは、水を溶媒として使用する。アルコール、第1級または第2級アミンは、この第1反応ステップの溶媒としては適していない。これに続く第2工程ステップは、式(3)または(4)に一致する化合物から選択される化合物と反応させることを含む。
【0040】
本方法のさらなる実施形態は、塩化シアヌルを式(3)または(4)に一致する化合物から選択される化合物と反応させる第1ステップを含み、次いで、さらなる反応ステップにおいて、式(2)に一致するアミンと反応させる。溶媒およびアミン対塩基の物質比は上記好ましい実施形態と同様に選択してもよい。
【0041】
反応体として式(3)に一致する化合物を含む反応は、好ましくは、開環塩基(ring−opening base)の存在下に実施される。ここで溶媒として使用されるのは、特に、水、トルエン、キシレン、アルカン、エーテル、ケトン(例えばアセトン等)、またはエステルであるが、水が好ましい。本方法の特定の一実施形態においては、溶媒としてラクタムが利用され、より具体的には、式(3)に一致する化合物が溶媒として使用され、そしてより好ましくは、溶媒としておよび反応体として同一の化合物が利用される。しかしながら、ある反応ステップにおいて式(4)に一致する化合物が反応体として利用される場合、この反応ステップは、過剰の式(3)に一致する対応する化合物の存在下に実施され、これは、式(3)に一致する化合物対塩化シアヌルの物質比が、好ましくは1:4、特に1.1:3.5であることを意味する。例えば、反応体として式(4)に一致する化合物としてアミノカプロン酸ナトリウムが使用される場合、この反応は、過剰のカプロラクタムの存在下に実施される。
【0042】
本方法を、式(1)(R3は、R1またはR2である)に一致するトリアジン化合物の調製に用いる場合は、塩化シアヌルを、塩化シアヌルの量を基準として好ましくは0.5〜3、より好ましくは1〜2モル当量の反応体Aと反応させる第1ステップを含み、反応体Aは、式(2)に一致するアミンまたは式(3)もしくは(4)に一致する化合物から選択される化合物のいずれかである。第2反応ステップにおいては、得られた中間体が、次いで、塩化シアヌルの量を基準として0.5〜5、好ましくは1〜4モル当量の反応体Bと反応され、反応体Bは、
反応体Aとして式(2)に一致するアミンが使用される場合は、式(3)もしくは(4)に一致する化合物から選択される化合物または
反応体Aとして式(3)もしくは(4)に一致する化合物から選択される化合物が使用される場合は、式(2)に一致するアミンである。
【0043】
第1反応ステップが実施される温度は、好ましくは、−20〜100℃の範囲、より好ましくは−10〜80℃の範囲、よりさらに好ましくは0〜60℃の範囲にある。一方、第2反応ステップが実施される温度は、好ましくは0〜200℃の範囲、より好ましくは10〜180℃の範囲、よりさらに好ましくは20〜170℃の範囲にある。第1ステップにおいて、塩化シアヌルの1個の塩素原子のみが反応体Aと反応し、塩化シアヌルの残り2個の塩素原子が第2ステップにおいて反応体Bと反応する本方法の一実施形態においては、第2ステップにおいて温度を変化させる(temperature ramp)と有利である。
【0044】
第1反応ステップが実施される圧力は、好ましくは0.5〜1.5バール、より好ましくは0.8〜1.2バール、よりさらに好ましくは大気圧である。一方、第2反応ステップが実施される圧力は、好ましくは1〜11バール、より好ましくは1〜9バール、よりさらに好ましくは1〜8バールである。
【0045】
本方法のさらなる実施形態は、塩化シアヌルを溶媒中において式(3)または(4)に一致する化合物から選択される化合物と反応させる第1反応ステップを含む。次いで、第2ステップにおいて、式(2)に一致するアミンとの反応が実施される。
【0046】
本方法の好ましい一実施形態においては、第1反応ステップは、塩化シアヌルを、塩化シアヌルの量を基準として1〜3モル当量、好ましくは2モル当量の反応体Aと反応させることを含み、第2ステップは、次いで、結果として得られた中間体を、塩化シアヌルの量を基準として0.5〜5、好ましくは1〜3モル当量の反応体Bと反応させることを含む。第1ステップが実施される温度は、好ましくは0〜100℃、より好ましくは10〜80℃、よりさらに好ましくは20〜60℃である。一方、第2ステップが実施される温度は、好ましくは80〜200℃、より好ましくは90〜180℃、よりさらに好ましくは100〜170℃である。
【0047】
本方法が、式(1)(式中、R3は、−OR6または−NR7R8)に一致するトリアジン化合物の調製に使用される場合、この方法は、塩化シアヌルを、塩化シアヌルの量を基準として0.5〜2モル当量、好ましくは1モル当量の反応体Aと反応させる第1反応ステップを含み、反応体Aは、式(2)に一致するアミンまたは式(3)もしくは(4)に一致する化合物から選択される化合物または式(16)もしくは(17)に一致するヒドロキシもしくはアミノ化合物のいずれかである。第2反応ステップにおいては、次いで、得られた中間体が塩化シアヌルの量を基準として0.5〜2モル当量、好ましくは1モル当量の反応体Bと反応され、反応体Bは、
反応体Aとして式(2)の化合物が使用される場合は、式(3)、(4)、(16)、もしくは(17)に一致する化合物から選択される化合物または
反応体Aとして式(3)もしくは(4)に一致する化合物から選択される化合物が使用される場合は、式(2)、(16)、もしくは(17)に一致する化合物から選択される化合物または
反応体Aとして式(16)もしくは(17)に一致する化合物から選択される化合物が使用される場合は、式(2)、(3)、もしくは(4)に一致する化合物から選択される化合物である。
【0048】
本方法のこの特定の実施形態の第3反応ステップにおいては、得られた中間体は、次いで、塩化シアヌルの量を基準として0.5〜2モル当量、好ましくは1モル当量の反応体Cと反応され、反応体Cは、
式(2)および(3)もしくは(4)の化合物が反応体AおよびBとして使用される場合は、式(16)もしくは(17)に一致する化合物から選択される化合物または
式(3)もしくは(4)および(16)もしくは(17)の化合物が反応体AおよびBとして使用される場合は、式(3)もしくは(4)に一致する化合物から選択される化合物または
式(3)もしくは(4)および(16)もしくは(17)の化合物が反応体AおよびBとして使用される場合は、式(2)に一致する化合物である。
【0049】
本方法のこの特定の実施形態の第1反応ステップが実施される温度は、好ましくは−20〜80℃、より好ましくは−10〜60℃、よりさらに好ましくは0〜40℃である。一方、第2ステップが実施される温度は、好ましくは0〜100℃、より好ましくは10〜80℃、よりさらに好ましくは20〜60℃である。第3ステップが実施される温度は、好ましくは80〜200℃、より好ましくは90〜180℃、よりさらに好ましくは100〜170℃である。
【0050】
本方法のこの特定の実施形態の第1および第2反応ステップが実施される圧力は、好ましくは0.5〜1.5バール、より好ましくは0.8〜1.2バール、よりさらに好ましくは大気圧である。一方、第3ステップが実施される圧力は、好ましくは1〜11バール、より好ましくは1〜9、よりさらに好ましくは1〜8バールである。
【0051】
本発明の方法の個々の反応ステップを、本発明の方法の任意の1段階で実施してもよく、いずれの場合に形成された中間体も、これらを次の段階の出発物質として使用することができるように分離および単離することが可能である。
【0052】
特定の一実施形態においては、ある段階の中間体は、最終段階を除いて分離も単離もされることなく、次の出発物質としてそのまま供給される。したがって、本発明の方法のこの実施形態においては、中間体はin situで形成される。
【0053】
本発明の方法のさらなる実施形態においては、すべての反応ステップが1つの反応器、特にオートクレーブ内で実施される。この実施形態においては、式(3)の化合物と塩基との反応を別の段階または別の反応槽内で実施してもよい。しかしながら、本発明の方法の反応ステップがすべて同一の反応槽内で行われるように、式(3)に一致する化合物と塩基との反応を同じ反応槽内で実施することもできる。このようにして、本発明の方法におけるトリアジン環上の3個の置換すべてを1つの反応槽内で実施することができる。
【0054】
一般に、式(3)に一致する化合物の塩基との反応を、別の段階または反応槽内で実施することができる。しかしながら、式(3)に一致する化合物と塩基との反応は、各反応段階が実施されるのと正に同じ反応槽内で実施することもできる。
【0055】
反応混合物の処理(working−up)は主として副生成物である塩化ナトリウムを除去する役割を果たす。トリアジン化合物が水に不溶な場合は、塩化ナトリウムを水に溶解させ、水性懸濁液を濾過した後に濾過ケーキを洗浄するかまたは目的の生成物を有機溶媒、好ましくは反応中に用いられる有機溶媒で抽出することによって除去する。トリアジン化合物が水溶性である場合は、同様に水溶性である塩化ナトリウムを好ましくは膜を介した電気透析またはイオン交換クロマトグラフィーによって除去するが、好ましくはイオン交換クロマトグラフィーによって塩化ナトリウムを除去する。
【0056】
このように処理された、水または有機溶媒中の溶液を構成する反応混合物は、次いでそのまま使用してもよく、特定の一実施形態においては、乾燥操作の前に安定剤として使用される。
【0057】
本方法の特定の一実施形態においては、個々の反応ステップの後に生じる中間体を反応混合物から単離して精製してもよい。これは、好ましくは、反応混合物から結晶化、濾過、および適切であれば洗浄を行うことによって達成される。この中間体の単離および精製は、有機溶媒、好ましくは反応中に既に用いられた有機溶媒で抽出することによって実施することもできる。こうして単離および精製された中間体は、通常は固体であり、次いで、本方法の次のステップに用いることができる。
【0058】
本方法のさらなる実施形態においては、これらの中間体は単離および処理に付されない。反応ステップは、中間体を単離および処理することなく連続して実施される。
【0059】
本方法においては、トリアジン化合物として、式(1)に一致する少なくとも2種の異なるトリアジン化合物を含む混合組成物も使用してもよい。その場合、この混合組成物は、好ましくは、
式(18)
【化16】

に一致するトリアジン化合物を85%〜95重量%、
式(19)
【化17】

に一致するトリアジン化合物を0%〜10重量%、
式(20)
【化18】

に一致するトリアジン化合物を0%〜10重量%
(式中、R’は、R1またはR2であり、R’’は、R2またはR1であり、R’はR’’と同一ではなく、これは特に、R’がR1である場合、R’’がR2であり、その逆も同様であることを意味する)を含む。
【0060】
この混合組成物の特定の一実施形態においては、R’はR1であり、R’’はR2である。この組成物は、本方法において、反応体である塩化シアヌル、式(2)のアミン、および式(3)または(4)に一致する化合物を、物質比1:2:1で用いることによって得ることができる。
【0061】
この混合組成物の特に好ましい一実施形態においては、R’はR1であり、R’’はR2である。この組成物は、反応体である塩化シアヌル、式(2)のアミン、および式(3)または(4)に一致する化合物を、物質比1:1:2で用いることによって得ることができる。
【0062】
混合組成物のさらなる実施形態は、
式(18)、
【化19】

に一致するトリアジン化合物を30%〜95重量%、
式(20)
【化20】

に一致するトリアジン化合物を0%〜60重量%、
式(19)および(21)
【化21】

に一致するトリアジン化合物を0%〜10重量%
(式中、R’はR1またはR2であり、R’’はR2またはR1であり、R’はR’’と同一ではなく、これは特に、R’がR1である場合はR’’がR2であり、その逆も同様であることを意味する)を含む。この組成物は、反応体である塩化シアヌル、式(2)のアミン、および式(3)または(4)に一致する化合物を、物質比1:1.5:1.5で用いることによって得ることができる。
【0063】
この組成物のさらなる好ましい実施形態は、
式(23)
【化22】

に一致するトリアジン化合物を60%〜90重量%、
それぞれR’、R’’、またはR’’’から選択される2個の同じ型の置換基および異なる第3の置換基を有するトリアジン化合物、例えば式(18)または(20)に一致するトリアジン化合物を1%〜30重量%、
3個の置換基すべてがR’、R’’、またはR’’’から選択される同じ型であるトリアジン化合物、例えば式(19)または(21)に一致するトリアジン化合物を0.5%〜10重量%
(式中、R’は、R1、R2、またはR3であり、R’’は、R2、R1、またはR3であり、R’’’は、R3、R2、またはR1であり、R’、R’’、およびR’’’は、同一ではなく、これは特に、R’がR1である場合、R’’はR2であり、かつR’’’がR3であり、その逆も同様であることを意味する)を含む。この組成物は、本方法において、反応体である塩化シアヌル、式(2)のアミン、式(3)または(4)に一致する化合物、および式(16)または(17)に一致する化合物を、物質比1:(0.5〜2):(0.5〜2):(0.5〜5)、好ましくは、物質比1:1:1:(1〜4)で用いることによって得ることができる。
【0064】
本発明による方法においては、トリアジン化合物は、カルボキシル部分を介してポリマー鎖のアミン末端基と反応し、したがってポリマーからアミン末端基を除去するが、それと同時に1または2個の非反応性アミン末端基を供与する。このような非反応性アミン末端基は重縮合に寄与しないが、染色性に与える効果は反応性末端基に匹敵することが見出された。したがって、紡糸工程中の重縮合が低減されることによって紡糸性が向上する一方で、染色性は保持されるかまたは向上さえする。
【0065】
好ましい実施形態においては、R1およびR3は両方とも、染色性を向上さえさせる利点を有するジアミン残基である。
【0066】
第2の好ましい実施形態においては、R3はアミノ酸残基である。この実施形態においては、トリアジン化合物は二塩基酸として機能し、そして鎖長調節剤として作用する(それ以外の場合は、これを別途添加する必要がある)。染色性は、R1のアミン末端基が存在することによって保持される。
【0067】
いずれの実施形態においても、Bは、好ましくは、染色性に加えてポリマーにUV安定性を付与する利点を有する非反応性アミノ末端基(好ましくはヒンダードアミン基)を含む。
【0068】
ポリマーの調製方法は、対応するモノマーから出発する通常の重合方法であってもよい。このような方法の例は、例えば、ウルマン工業化学百科事典(ウルマンズ・エンサイクロペディア・オブ・インダストリアル・ケミストリー;Ullman’s Encyclopedia of Industrial Chemistry)、第21A巻、「ポリアミド」および「ポリエステル」章に記載されている。ポリアミドの場合は、通常の加水分解重合法を適用することができる。この方法は、連続法であっても回分法であってもよい。
【0069】
この重合法は、通常の条件下でトリアジン化合物の存在下に実施される。トリアジン化合物は出発モノマーに添加してもよいし、あるいは重合装置に別々に添加してもよく、その場合は、この方法が実施される間に好ましくは制御された態様で行う。トリアジン化合物は、カルボキシル部分を介してポリマー鎖に化学結合するであろう。
【0070】
ポリマーがポリアミドである場合は、対応するモノマーは、好適な二塩基酸およびジアミンの混合物、対応する二塩基酸−ジアミン塩、またはラクタムであってもよい。例えば、ポリアミド−6(PA6)の場合は、対応するモノマーはカプロラクタムであり、PA6,6の重合は、通常は、ヘキサメチレンジアミンおよびアジピン酸の塩から開始される。さらなるポリアミドの対応する出発モノマーは当該技術分野において周知である。本発明の方法において好適なモノマーは、その加工性および機械特性が好ましいという観点から、重合によって熱可塑性ポリアミド、好ましくは半結晶性ポリアミドとなり得るものである。このようなポリアミドとしては、例えば、ポリアミド−6(PA−6)、PA−6,6、PA−4,6、PA−6,9、PA−6,10、PA−11、PA−12、PA−MXD6、ならびにこのようなポリアミドのコポリマーおよび混合物が挙げられる。好ましくは、ポリアミドは、PA6、PA66、PA46、またはそれを構成するモノマーのコポリアミドである。
【0071】
ポリマーがポリエステルである場合は、モノマーは、ジオールおよびジカルボン酸またはこれらのポリエステル形成性誘導体(ジメチルエステル等)であってもよい。好適なジオールは、式HO−R−OH(式中、Rは、2〜18個、好ましくは2〜12個の炭素原子を有する、2価の分岐または非分岐の脂肪族および/または脂環式基である)を有するものである。好適なジカルボン酸は、式HOOC−R’−COOH(式中、R’は、2〜18個、好ましくは4〜12個の炭素原子を有する2価の脂肪族、脂環式、または芳香族基である)を有するものである。このようなポリエステルの調製は従来技術であり、例えば、ウルマン工業化学百科事典、第21A巻、「ポリエステル」章に記載されている。
【0072】
トリアジン化合物は、少なくとも2mmol/kg、好ましくは少なくとも5mmol/kg、より好ましくは少なくとも10mmol/kgの量で存在する。またこれは、最大で70mmol/kg、好ましくは最大で40mmol/kg、より好ましくは最大で30mol/kgの量で存在する。上記量はすべて、任意のモノもしくはジアミンまたは一もしくは二塩基酸を含むモノマーおよびトリアジン化合物の総量に対するものである。
【0073】
本発明による方法においては、上に定義したトリアジンの混合組成物を適用してもよく、それによって、染色性改善作用およびUV安定化作用の組合せのバランスをとり、かつこれを向上させるのに適した条件が得られる。
【0074】
重合法は、このために用いられる周知のさらなる化合物、例えば、当該技術分野において通常量の、水、連鎖調節剤(例えば、一および二塩基酸ならびにモノ−およびジアミンが挙げられる)、顔料の存在下に実施してもよい。
【0075】
本発明はさらに、ポリマー鎖に化学結合している上に定義した式1で表される、置換されたトリアジン化合物が存在することを特徴とする、良好な紡糸性および染色性を有するポリマーに関する。
【0076】
本発明によるポリマーは、置換されたトリアジン化合物が存在することによって良好な紡糸性および良好な染色性が両立されており、これにより、特に衣料および床用敷物に適した繊維を製造するのに特に好適となる。
【0077】
好ましい実施形態においては、R1およびR3はいずれもジアミンであり、それによって、染色性が向上さえするという利点が得られる。
【0078】
第2の好ましい実施形態においては、R3はアミノ酸である。この実施形態、特にラクタムをベースとするポリアミドにおいては、トリアジン化合物は、通常、両方のカルボキシル部分がポリマー鎖に結合することとなり、この状況下においては、ポリマーの分子量分布Mw/Mnが、R3がジアミンである場合よりも狭くなることが見出された。これにより、ポリマー溶融物のレオロジー挙動が改善され、したがって、好ましい紡糸性が得られる。染色性は、R1のアミン末端基が存在することによって保持される。
【0079】
いずれの実施形態においても、Bは、好ましくは、染色性に加えてポリマーにUV安定性を付与する利点を有する非反応性アミノ末端基(好ましくはヒンダードアミン基)を含む。
【0080】
さらに、このUV安定性は、上に定義した式1で表される、置換されたトリアジン化合物をさらに含むポリアミドまたはポリエステルを含む組成物中においても存在することが見出された。
【0081】
本発明を以下の実施例によって例示するが、これらに限定されるものではない。
【0082】
[実施例I 重合]
20LのFourneオートクレーブ反応器に、カプロラクタム98重量%、安息香酸0.24重量%、ビス−トリアセトンアミノ−トリアジン−アミノカプロン酸(BTT−ACA)0.5重量%、および水1.26重量%からなる混合物10kgを160℃に予熱して添加した。混合物全体に対する安息香酸の量は20mmol/kgであり、BTT−ACAの量は5mmol/kgである。
【0083】
反応器を2.5℃/分の速度で160℃から260℃まで加熱した。第1重合ステップとして、反応器をこの温度および圧力4バールで30分間維持した。次のステップとして、圧力を1.6バールに低下させ、残った水を留去した。次いで、反応器を260℃および1.6バールで5.5時間維持した。
【0084】
次いで、溶融状態にある反応器の内容物を、複数の穴を含むプレートを通して温度250℃および圧力5.5バールで反応器から排出することによりストランドを形成し、これを冷却および切断して顆粒にした。
【0085】
未反応のカプロラクタムおよび他の成分を、100℃の熱湯を1.1バールの圧力で16時間流すことによって顆粒から抽出した。抽出された化合物の合計量は10重量%となった。抽出後のポリマーに対する、ポリマーに結合している安息香酸の量は22.2mmol/kgであり、結合しているBTT−ACAは5.6mmol/kgである。
【0086】
相対粘度(96%硫酸中1%溶液、23℃)が2.44であるポリマーの白色顆粒を得た。
【0087】
[実施例II 重合]
上記安息香酸を、当量すなわち20mmol/kgのテレフタル酸(0.32重量%)と置き換えて、水の量を全体で100重量%に達するように合わせるという条件下で実施例Iを繰り返した。第2重合ステップにおける圧力を1.94バールとした。それ以外の条件および量は変えなかった。
【0088】
相対粘度(96%硫酸中1%溶液、23℃)が2.46であるポリマーの白色顆粒を得た。
【0089】
[実施例III 紡糸]
実験IおよびIIで得られたポリマー顆粒を、この顆粒を押出機で加熱および溶融し、直径0.25mmのオリフィス24個を有する紡糸プレートから溶融物を押し出すことによって270℃の温度で溶融紡糸し、そしてBarmag SW46巻取装置で速度を4000〜6000m/分に変化させて巻き取った。溶融物の滞留時間を270℃で15分間とした。
【0090】
このポリアミドの紡糸挙動は、紡糸工程中における巻取速度(WUS)に応じた、
S=0.1×FC+FB+10×YB
(式中、FCは毛羽数であり、FBは単糸切れ回数であり、YBは、糸切れ回数である)として定義される紡糸性指数S(Spinnability Index)によって示されるように、非常に優れていた。Sの値は0.1〜3の範囲にあり、これよりも高い値になるのは、紡糸速度5000m/分超で一塩基(安息香)酸型のポリアミドを用いた場合のみであった。一般に、Sの値が10未満であれば「紡糸性が非常に優れている」と認定される。
【0091】
こうして得られた部分配向糸(POY)(一塩基酸および二塩基酸(テレフタル酸)型の両方のポリアミド)の機械特性、強度、伸度、弾性率、破壊仕事(work−to−rupture)(WTR)を表1に示す。4200m/分で紡糸された一塩基酸ポリアミドから製造された部分配向糸を様々な延伸比で完全延伸糸(FDY)にさらに延伸した。完全延伸糸の特性を表2に示す。ここに示す繊度は24単糸束のものである。
【0092】
【表1】

【0093】
【表2】

【特許請求の範囲】
【請求項1】
式、
【化1】

[式中、R1は、−A−B
(式中、Aは、−O−または−NR4−であり、
Bは、アミノ基含有置換基であり、
R4は、水素またはアルキル基である)であり、
R2は、
【化2】

(式中、Eは、−O−または−NR5−であり、
nは、3〜15であり、
mは、0〜10であり、
R5は、水素またはアルキル基である)であり、
R3は、R1、R2、−OR6、または−NR7R8
(式中、R6、R7、およびR8は水素、アルキル、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)である]のトリアジン化合物の存在下に、対応するモノマーを重合させることを含む、ポリマーの調製方法。
【請求項2】
R3がジアミン残基である、請求項1に記載の方法。
【請求項3】
R3が、アミノ酸残基である、請求項1に記載の方法。
【請求項4】
モノマーおよびトリアジン化合物全体に対する前記トリアジン化合物の量が、2〜70mmol/kgである、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記ポリマーが、ポリアミドまたはポリエステルである、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
ポリマー鎖に化学結合している請求項1に記載の式Iの置換されたトリアジン化合物が存在することを特徴とする、染色可能なポリマー。
【請求項7】
R3が、ジアミン残基である、請求項6に記載のポリマー。
【請求項8】
R3が、アミノ酸残基である、請求項6に記載のポリマー。
【請求項9】
前記ポリマーが、ポリアミドまたはポリエステルである、請求項6〜8のいずれか一項に記載のポリマー。
【請求項10】
ポリマーとして、請求項6〜9のいずれか一項に記載のポリマーまたは請求項1〜5のいずれか一項に記載の方法を用いて得られるポリマーを含む、ポリマー繊維。
【請求項11】
請求項10に記載の繊維を含む物品。
【請求項12】
前記物品が、衣料または床用敷物である、請求項11に記載の物品。
【請求項13】
請求項1に記載の式1の置換されたトリアジン化合物が存在することを特徴とするポリアミドまたはポリエステルを含む、UV安定化されたポリマー組成物。
【請求項1】
式、
【化1】

[式中、R1は、−A−B
(式中、Aは、−O−または−NR4−であり、
Bは、アミノ基含有置換基であり、
R4は、水素またはアルキル基である)であり、
R2は、
【化2】

(式中、Eは、−O−または−NR5−であり、
nは、3〜15であり、
mは、0〜10であり、
R5は、水素またはアルキル基である)であり、
R3は、R1、R2、−OR6、または−NR7R8
(式中、R6、R7、およびR8は水素、アルキル、またはアリール基であり、いずれの場合も置換されていても非置換であってもよい)である]のトリアジン化合物の存在下に、対応するモノマーを重合させることを含む、ポリマーの調製方法。
【請求項2】
R3がジアミン残基である、請求項1に記載の方法。
【請求項3】
R3が、アミノ酸残基である、請求項1に記載の方法。
【請求項4】
モノマーおよびトリアジン化合物全体に対する前記トリアジン化合物の量が、2〜70mmol/kgである、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記ポリマーが、ポリアミドまたはポリエステルである、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
ポリマー鎖に化学結合している請求項1に記載の式Iの置換されたトリアジン化合物が存在することを特徴とする、染色可能なポリマー。
【請求項7】
R3が、ジアミン残基である、請求項6に記載のポリマー。
【請求項8】
R3が、アミノ酸残基である、請求項6に記載のポリマー。
【請求項9】
前記ポリマーが、ポリアミドまたはポリエステルである、請求項6〜8のいずれか一項に記載のポリマー。
【請求項10】
ポリマーとして、請求項6〜9のいずれか一項に記載のポリマーまたは請求項1〜5のいずれか一項に記載の方法を用いて得られるポリマーを含む、ポリマー繊維。
【請求項11】
請求項10に記載の繊維を含む物品。
【請求項12】
前記物品が、衣料または床用敷物である、請求項11に記載の物品。
【請求項13】
請求項1に記載の式1の置換されたトリアジン化合物が存在することを特徴とするポリアミドまたはポリエステルを含む、UV安定化されたポリマー組成物。
【公表番号】特表2009−516039(P2009−516039A)
【公表日】平成21年4月16日(2009.4.16)
【国際特許分類】
【出願番号】特願2008−540514(P2008−540514)
【出願日】平成18年11月16日(2006.11.16)
【国際出願番号】PCT/EP2006/010992
【国際公開番号】WO2007/057180
【国際公開日】平成19年5月24日(2007.5.24)
【出願人】(503220392)ディーエスエム アイピー アセッツ ビー.ブイ. (873)
【Fターム(参考)】
【公表日】平成21年4月16日(2009.4.16)
【国際特許分類】
【出願日】平成18年11月16日(2006.11.16)
【国際出願番号】PCT/EP2006/010992
【国際公開番号】WO2007/057180
【国際公開日】平成19年5月24日(2007.5.24)
【出願人】(503220392)ディーエスエム アイピー アセッツ ビー.ブイ. (873)
【Fターム(参考)】
[ Back to top ]

