栄養組成物
【課題】肝疾患患者の栄養管理および栄養治療に有用な栄養組成物の提供。
【解決手段】ホエイタンパク質加水分解物、脂質代謝改善作用を有するレシチンおよび高オレイン酸含有油脂、ならびにインスリン節約効果を有するパラチノースを必須成分として含む栄養組成物が、ガラクトサミン肝障害の発症を抑制する。また、該栄養組成物中に含まれるホエイタンパク質加水分解物が、マクロファージにおけるエンドトキシン誘導性TNF-αおよびインターロイキン6(IL-6)産生を抑制する。
【解決手段】ホエイタンパク質加水分解物、脂質代謝改善作用を有するレシチンおよび高オレイン酸含有油脂、ならびにインスリン節約効果を有するパラチノースを必須成分として含む栄養組成物が、ガラクトサミン肝障害の発症を抑制する。また、該栄養組成物中に含まれるホエイタンパク質加水分解物が、マクロファージにおけるエンドトキシン誘導性TNF-αおよびインターロイキン6(IL-6)産生を抑制する。
【発明の詳細な説明】
【技術分野】
【0001】
技術分野
本発明は、肝疾患患者の栄養管理および栄養治療に有用な栄養組成物に関する。また本発明は、手術や感染、熱傷などの生体侵襲下の患者における代謝・栄養管理に有用な栄養組成物に関する。さらにまた本発明は、炎症性疾患患者の病態改善に有用な栄養組成物に関する。
【背景技術】
【0002】
背景技術
肝疾患の栄養病態は、糖質代謝では一般に解糖系酵素活性の変化と、末梢におけるインスリン感受性の低下により耐糖能異常が高頻度にみられる。とくに、肝硬変ではエネルギー消費が亢進し、エネルギー基質として糖質利用率も低下する。タンパク質代謝では肝炎や肝硬変で、血漿アミノ酸の不均衡(分枝鎖アミノ酸/芳香族アミノ酸の比(Fischer比)の低下)、タンパク質異化の亢進、負の窒素出納による低タンパク血症、高アンモニア血症がみられる。さらに、脂質代謝では多価飽和脂肪酸の減少、脂溶性ビタミンの低下が顕在化する。
【0003】
肝硬変のうち、代償性と非代償性で病態も違い、その代謝・栄養管理も異なる。代償性肝硬変ではおおむね慢性肝炎に準じた管理方針でよい。しかし、非代償性肝硬変では慢性肝不全状態にあり、タンパク質異化亢進が存在するため、過剰のタンパク質投与は高アンモニア血症を招きかねない。分枝鎖アミノ酸(BCAA)であるバリン、ロイシン、イソロイシンの経口投与は末梢組織のタンパク質異化を抑制し、肝でのタンパク質合成を促進する。さらに、筋で代謝されたBCAAはアラニンとなり、肝での糖新生(グルコース-アラニン回路)を活性化してエネルギー基質としての糖利用効率の改善に働く。これらのことから、骨格筋でのエネルギー不足を補充するため、BCAA 製剤(ヘパンEDR、アミノレバンENR:50〜150 g/日)が用いられている。
【0004】
一方、生体は、手術や感染、熱傷など過度の侵襲を受けると、局所や全身の炎症性メディエーターの産生が亢進する。なかでもサイトカインは、循環系、内分泌系、免疫系、代謝系などに多彩な反応を引き起こす重要なメディエーターである。
【0005】
一般に侵襲時に対する代謝反応の特徴は、体タンパク質、とくに骨格筋のタンパク質分解亢進、脂肪分解亢進によるグリセロールと脂肪酸の産生、さらに肝でのグルコース新生や急性期タンパク質産生、アルブミン産生などである。一方、免疫系は細胞性・液性免疫とも抑制されると考えられ、さらに侵襲時には著しいタンパク質異化亢進に伴い、免疫に関与するタンパク質合成の低下が予想される。
【0006】
このような侵襲生体での代謝変化に各種のサイトカインが関与していることは、サイトカイン自体の投与実験、サイトカイン産生、あるいはその作用をブロックする実験などで明らかにされてきた。すなわち、TNF-α、IL-1、IL-6による代謝変動は、(1) 糖代謝においては、高血糖・低血糖、グリコーゲン分解亢進であり(例えば、Meszaros K et.al.「Tumor necrosis factor increases in vivo glucose utilization of macrophage-rich tissues」Biochem. Biophys. Res. Commun., Vol. 149, No. 1, pp. 1-6, 1987年11月30日(非特許文献1);Tracey, KJ et.al.「Shock and tissue injury induced by recombinant human cachectin」Science, Vol. 234、No. 4775, pp. 470-474, 1986年10月24日(非特許文献2);Fukushima, R et.al.「Different roles of IL-1 and TNF on hemodynamics and interorgan amino acid metabolism in awake dogs」Am. J. Physiol., Vol. 262, No. 3, Pt. 1, pp. E275-E281, 1992年3月(非特許文献3)参照)、(2) アミノ酸・タンパク質代謝においては、筋崩壊・アミノ酸放出増加、腸グルタミン摂取増加、腸アラニン放出増加、肝アミノ酸摂取増加、急性期タンパク質合成亢進であり(例えば、Fukushima, R et.al.「Different roles of IL-1 and TNF on hemodynamics and interorgan amino acid metabolism in awake dogs」Am. J. Physiol., Vol. 262, No. 3, Pt. 1, pp. E275-E281, 1992年3月(非特許文献3);Moldawer, LL et.al.「Interleukin 1 and tumor necrosis factor do not regulate protein balance in skeletal muscle」Am. J. Physiol., Vol. 253, No. 6, Pt. 1, pp. C766-C773, 1987年12月(非特許文献4)参照)、そして(3) 脂質代謝においては、脂肪酸分解亢進、リポタンパク質リパーゼ(lipoprotein lipase)活性低下である(例えば、Feingold, KR et.al.「Multiple cytokines stimulate hepatic lipid synthesis in vivo」Endocrinology, Vol. 125, No. 1, pp. 267-274, 1989年7月(非特許文献5);Grunfeld, C et.al.「Tumor necrosis factor: immunologic, antitumor, metabolic, and cardiovascular activities」Adv. Intern. Med., Vol. 35, pp. 45-71, 1990年(非特許文献6);Feingold, KR et.al.「Tumor necrosis factor stimulates hepatic lipid synthesis and secretion」Endocrinology, Vol. 124, No. 5, pp. 2336-2342, 1989年5月(非特許文献7)参照)。
【0007】
サイトカインによる侵襲時の代謝異常や臓器障害を防止するには、局所のサイトカインは正常に産生させるが、全身へのこの波及を防止する方法が合理的である。そのような方法として、経腸栄養やω-3系脂肪酸、あるいは成長ホルモンなどがある。
【0008】
栄養投与経路の相違による侵襲時のサイトカイン産生の相違についていくつかの報告がある。侵襲のない健康成人では、経腸栄養あるいは経静脈栄養の1週間の施行で、血中のTNF-αやIL-6値に明らかな相違は生じない(例えば、Lowry, SF et.al.「Nutrient modification of inflammatory mediator production」New Horiz., Vol. 2, No. 2, pp. 164-174, 1994年5月(非特許文献8)参照)が、健康成人で経腸栄養あるいは経静脈栄養を7日間施行した後、エンドトキシンを静注すると、その際の発熱やTNF-α、侵襲ホルモン分泌などの全身生体反応が経静脈栄養よりも経腸栄養で軽微であることが報告されている(例えば、Fong, YM et.al.「Total parenteral nutrition and bowel rest modify the metabolic response to endotoxin in humans」Ann. Surgery, Vol. 210, No. 4, pp. 456-457, 1989年10月(非特許文献9)参照)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Meszaros K et.al.「Tumor necrosis factor increases in vivo glucose utilization of macrophage-rich tissues」Biochem. Biophys. Res. Commun., Vol. 149, No. 1, pp. 1-6, 1987年11月30日
【非特許文献2】Tracey, KJ et.al.「Shock and tissue injury induced by recombinant human cachectin」Science, Vol. 234、No. 4775, pp. 470-474, 1986年10月24日
【非特許文献3】Fukushima, R et.al.「Different roles of IL-1 and TNF on hemodynamics and interorgan amino acid metabolism in awake dogs」Am. J. Physiol., Vol. 262, No. 3, Pt. 1, pp. E275-E281, 1992年3月
【非特許文献4】Moldawer, LL et.al.「Interleukin 1 and tumor necrosis factor do not regulate protein balance in skeletal muscle」Am. J. Physiol., Vol. 253, No. 6, Pt. 1, pp. C766-C773, 1987年12月
【非特許文献5】Feingold, KR et.al.「Multiple cytokines stimulate hepatic lipid synthesis in vivo」Endocrinology, Vol. 125, No. 1, pp. 267-274, 1989年7月
【非特許文献6】Grunfeld, C et.al.「Tumor necrosis factor: immunologic, antitumor, metabolic, and cardiovascular activities」Adv. Intern. Med., Vol. 35, pp. 45-71, 1990年
【非特許文献7】Feingold, KR et.al.「Tumor necrosis factor stimulates hepatic lipid synthesis and secretion」Endocrinology, Vol. 124, No. 5, pp. 2336-2342, 1989年5月
【非特許文献8】Lowry, SF et.al.「Nutrient modification of inflammatory mediator production」New Horiz., Vol. 2, No. 2, pp. 164-174, 1994年5月
【非特許文献9】Fong, YM et.al.「Total parenteral nutrition and bowel rest modify the metabolic response to endotoxin in humans」Ann. Surgery, Vol. 210, No. 4, pp. 456-457, 1989年10月
【発明の概要】
【0010】
発明の開示
本発明は、肝不全患者の栄養管理および栄養治療に有用な栄養組成物を提供することを課題とする。また本発明は、手術や感染、熱傷などの高度生体侵襲下にある患者の代謝・栄養管理に有用な栄養組成物を提供することを課題とする。さらにまた本発明は、炎症性疾患患者の病態改善に有用な栄養組成物を提供することを課題とする。
【0011】
本発明者らは、ホエイタンパク質加水分解物、レシチンおよび高オレイン酸含有油脂、ならびにパラチノースを必須成分として含む栄養組成物が、ラットのガラクトサミン肝障害発症を抑制することを見出した。また、ホエイタンパク質加水分解物が、in vivoにおいてLPS誘導性TNF-αおよびインターロイキン6(IL-6)産生を抑制することを見出した。これらの結果から、本発明の栄養組成物は、肝疾患患者の栄養管理および栄養治療、そして手術や感染、熱傷などの高度生体侵襲下にある患者の代謝・栄養管理、さらに炎症性疾患の病態改善に有用であることを見出した。
【0012】
すなわち本発明は、以下を含む:
(1)タンパク質として乳タンパク質の加水分解物および発酵乳由来タンパク質、脂質として高オレイン酸含有油脂ならびにミルクレシチン及び/又は大豆レシチン、および糖質としてパラチノースを含む、肝疾患患者用栄養組成物、
(2)乳タンパク質が、カゼイン、乳タンパク質濃縮物(MPC)、ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン、β-ラクトグロブリンおよびラクトフェリンからなる群より選択される、(1)の肝疾患患者用栄養組成物、
(3)発酵乳由来タンパク質が発酵乳よりホエイを減少させた組成物に由来する、(1)の肝疾患患者用栄養組成物、
(4)発酵乳由来タンパク質がフレッシュチーズに由来する、(1)の肝疾患患者用栄養組成物、
(5)フレッシュチーズがクワルクである、(4)の肝疾患患者用栄養組成物、
(6)乳タンパク質の加水分解物が、ホエイタンパク質分離物(WPI)をバシラス・リシェニフォルムス(Bacillus licheniformus)由来のアルカラーゼで加水分解およびブタ膵臓由来のトリプシンで加水分解して得られうる、(1)の肝疾患患者用栄養組成物、
(7)分画分子量10,000の限外濾過膜でさらに処理して得られる透過画分(パーミエイト)である、(6)の肝疾患患者用栄養組成物、
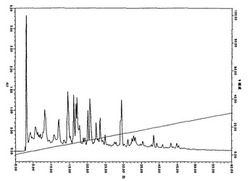
(8)逆相HPLCで分離したときのクロマトグラムが図1で示される、(7)の肝疾患患者用栄養組成物、
(9)タンパク質として乳タンパク質の加水分解物および発酵乳由来タンパク質、脂質として高オレイン酸含有油脂ならびにミルクレシチン及び/又は大豆レシチン、および糖質としてパラチノースを含む、生体高度侵襲患者用栄養組成物、
(10)乳タンパク質が、カゼイン、乳タンパク質濃縮物(MPC)、ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン、β-ラクトグロブリンおよびラクトフェリンからなる群より選択される、(9)の生体高度侵襲患者用栄養組成物、
(11)発酵乳由来タンパク質が発酵乳よりホエイを減少させた組成物に由来する、(9)の生体高度侵襲患者用栄養組成物、
(12)発酵乳由来タンパク質がフレッシュチーズに由来する、(9)の生体高度侵襲患者用栄養組成物、
(13)フレッシュチーズがクワルクである、(12)の生体高度侵襲患者用栄養組成物、
(14)乳タンパク質の加水分解物が、ホエイタンパク質分離物(WPI)をバシラス・リシェニフォルムス由来のアルカラーゼで加水分解およびブタ膵臓由来のトリプシンで加水分解して得られうる、(9)の生体高度侵襲患者用栄養組成物、
(15)分画分子量10,000の限外濾過膜でさらに処理して得られる透過画分(パーミエイト)である、(14)の生体高度侵襲患者用栄養組成物、
(16) 逆相HPLCで分離したときのクロマトグラムが図1で示される、(15)の生体高度侵襲患者用栄養組成物。
【図面の簡単な説明】
【0013】
【図1】ホエイタンパク質分離物(WPI)加水分解物のUF(分子量カットオフ値:10,000)パーミエイトの逆相クロマトグラムを示す。
【図2】ガラクトサミン肝障害モデルラットにおける栄養組成物およびメイバランスCのGOTおよびGPT上昇抑制効果を示す。
【図3】ガラクトサミン投与後の血中GOT、GPT濃度の変化を示す。
【図4】ConA投与後の血中GOT濃度の変化を示す。
【図5】ConA投与後の血中GPT濃度の変化を示す。
【図6】ConA投与後の血中TNF-α濃度の変化を示す。
【図7】ホエイタンパク質加水分解物のLPS誘導性TNF-α産生抑制作用を示す。
【図8】同上のIL-6産生抑制作用を示す。
【図9】ホエイタンパク質加水分解物の用量によるLPS誘導性TNF-α産生抑制作用を示す。
【発明を実施するための形態】
【0014】
1.タンパク質
1-1 乳タンパク質加水分解物
原料タンパク質として、カゼイン、ホエイタンパク質(ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン(α-La)、β-ラクトグロブリン(β-Lg))、乳タンパク質濃縮物(MPC、総乳タンパク質=TMPともいう)等を用いることができる。
【0015】
ホエイタンパク質の加水分解を例にとると、通常、該タンパク質の加水分解に用いる酵素は、ペプシン、トリプシンおよびキモトリプシンであるが、植物起源のパパイン、バクテリアや菌類由来のプロテアーゼを用いた研究報告(Food Technol., 48: 68-71, 1994;Trends Food Sci. Technol., 7: 120-125, 1996;Food Proteins and Their Applications, pp. 443-472, 1997)もある。ホエイタンパク質を加水分解する酵素活性は大きく変動する。ペプシンはα-Laおよび変性したα-Laを分解するが、未変性の(native)β-Lgを分解しない(Neth. Milk dairy J., 47: 15-22, 1993 )。トリプシンはα-Laをゆっくり加水分解するがβ-Lgはほとんど未分解のままである(Neth. Milk dairy J., 45: 225-240, 1991)。キモトリプシンはα-Laを速く分解するが、β-Lgはゆっくり分解される。パパインはウシ血清アルブミン(BSA)およびβ-Lgを加水分解したが、α-Laは抵抗性があった(Int. Dairy Journal 6: 13-31, 1996a)。しかしながら、Caを結合していないα-Laは酸性のpHでパパインにより完全に分解された(J. Dairy Sci., 76: 311-320, 1993)。
【0016】
乳タンパク質の酵素分解をコントロールして該タンパク質を修飾することにより、広範囲のpHおよびプロセッシング条件にわたって、該タンパク質の機能的特性を変更することができる(Enzyme and Chemical Modification of proteins in Food proteins and their Applications, pp. 393-423, 1997, Marcel Dekker, Inc., New York, 1997 ;Food Technol., 48: 68-71, 1994)。
【0017】
ペプチド結合の加水分解は、荷電基の数および疎水性の増加、低分子量化、および分子の立体配置の修飾をもたらす(J. Dairy Sci., 76: 311-320, 1993)。機能的特性の変化は大きく加水分解度に依存する。ホエイタンパク質の機能性に共通してみられる最も大きな変化は溶解性の増加と粘度の低下である。加水分解度が高い場合、しばしば、加水分解物は加熱しても沈澱せず、pH 3.5〜4.0で溶解性が高い。加水分解物は、また、無処置の(intact)タンパク質よりもはるかに粘度が低い。この差異はとくにタンパク質濃度が高い場合に顕著である。その他の影響は、ゲル特性の変化、熱安定性を高める、乳化および起泡性の増強、乳化および泡の安定性の低下である(Int. Dairy journal, 6: 13-31, 1996a;Dairy Chemistry 4, pp. 347-376, 1989;J. Dairy Sci., 79: 782-790, 1996)。
【0018】
乳タンパク質から派生するさまざまな生理活性オリゴペプチドが知られている(吉川正明「ミルクの先端機能」吉川正明ら編, p 188-195, 弘学出版, 1998;大谷元「ミルクの先端機能」吉川正明ら編, p 97-99, 弘学出版, 1998;大谷元、Milk Science 47: 183, 1998;Trends in Food Science and Technology, 9: 307-319, 1998)。アンギオテンシン変換酵素(ACE)阻害活性を有するペプチド(血圧降下作用をもつ)もそのうちの一つである。
【0019】
in vitro活性の測定から推定される、ACE阻害活性の可能性のある数多くのペプチドに関する報告がある(例えば、J. Dairy Res., 67: 53-64, 2000;Br. J. Nutr., 84: S33-S37, 2000)。加水分解物から、さまざまなクロマトグラフィー技術を用いて、ACE阻害ペプチドを精製および同定する研究報告がなされている(例えば、Maruyama, S., & Suzuki, H., Agricultural and Biological Chemistry, 46: 1393-1394, 1982;Miyoshi S. et al., Agri. Biol. Chem., 55: 1313-1318, 1991;Food Science and Biotechnology, 8: 172-178, 1999;Biosci. Biotech. Biochem., 57: 922-925, 1993)。
【0020】
これらの報告から、ACE阻害活性は、さまざまな分離原理に基づくカラム操作で得られた数多くのフラクションに存在していると考えられ、これはACE阻害物質の分子特性がかなり多様であることを示している。ACE阻害が、さまざまなタンパク質、プロテアーゼおよび加水分解条件で産生される加水分解物中に見出されるという事実は、多様なアミノ酸配列をもったさまざまなペプチドもまた、ACE阻害活性を有する可能性を示唆している。このようなペプチドの化学的多様性のために、加水分解物のクロマトグラフィーによる精製は、部分的な活性ペプチドの損失を常に伴うこととなろう。加水分解中、ACE阻害活性は連続的に形成され一方で分解される。加水分解物の最大活性はこれら2つのプロセスの最適化の結果である。加水分解物の全体的なペプチド組成は、ACE阻害活性を決定し、それは加水分解酵素の特異性およびプロセス条件に依存する。
【0021】
そこで、必要とする加水分解を最小限にとどめ、ACE阻害活性を最大化すべく、応答曲面法(response surface methodlogy)を用いたホエイタンパク質加水分解の最適化についての報告(International Dairy Journal 12: 813-820, 2002)がなされている。
【0022】
本発明において、乳タンパク質加水分解物は、in vivoにおけるLPS誘導性TNF-αおよびIL-6産生を抑制する作用を有することが初めて見出された。乳タンパク質から派生するペプチドのサイトカイン産生に対する影響に関しては、ウシカゼイン由来のペプチドが、ネズミ骨髄マクロファージからのLPS誘導性TNF-αおよびIL-6産生を増加させるという報告(J. Sci. Food Agric., 81: 300-304, 2000)やプロバイオティック(probiotic)乳酸菌による発酵乳の上清中に、LPS刺激によるIL-6産生を誘導するペプチドが存在するという報告(Milchwissenschaft, 57(2): 66-70, 2002)があるが、これらの炎症性サイトカインの産生抑制についての報告は本願発明者らの知る限り存在しない。LPS誘導性TNF-αおよびIL-6産生を抑制する作用を有するペプチドについても、上記ACE阻害活性を有するペプチドのように、さまざまな分離原理に基づくカラム操作で得られた数多くのフラクションに存在している可能性を否定することはできない。
【0023】
そこで、LPS誘導性TNF-α及び/又はIL-6産生の抑制効果を指標に乳タンパク質の加水分解条件(変性温度、pH、温度、加水分解時間および酵素/基質の比)の最適化を上記文献(International Dairy Journal 12: 813-820, 2002)を参考に試みることができる。したがって、この結果得られた加水分解の最適化条件は本発明に包含される。
【0024】
一方、乳タンパク質加水分解物については、上記に例示した文献に加えて数多くの特許(公開特許および特許)が存在する。例えば、カゼインとホエイタンパク質を別々に加水分解し、疎水性部分を吸着・除去した後、両者を所定割合で混合する特許(日本特許第2,986,764号)、ホエイタンパク質をバチルス属由来のプロテアーゼと放線菌由来のプロテアーゼによって加水分解した後、酵素と不溶性の加水分解物を除去する特許(日本特許第3,222,638号)、β-ラクトグロブリンを酵素で分解して得られる分岐鎖アミノ酸/芳香族アミノ酸のモル比が10重量%以上、芳香族アミノ酸が2.0重量%未満、平均分子量が数百〜数千のペプチド混合物の特許(日本特許第3,183,945号)、ホエイタンパク質中のβ-ラクトグロブリンを選択的に酵素分解する特許(日本特許第2,794,305号)、あるいはホエイタンパク質をB. リシェニホルミス(B. licheniformis)由来のプロテアーゼ及び/又は枯草菌(B. subtilis)由来のプロテアーゼにより、非−pH−スタット法により、15〜30%の加水分解度(DE)まで加水分解し、カットオフ値10,000を超える限外濾過膜の透過液を得る特許(日本特許第3167723号)等をあげることができ、本発明はこれらの特許以外の特許や公開特許を包含する。
【0025】
上記文献や特許の加水分解物が、LPS誘導性TNF-αおよびIL-6産生を抑制する作用を有するかどうかを公知のアッセイ系(例えば、実験医学別冊、「バイオマニュアルUP実験シリーズ」、サイトカイン実験法、宮島篤、山本雅 編、(株)羊土社、1997)で調べることができる。したがって、TNF-αやIL-6の産生抑制活性を示す加水分解物は本発明に包含される。
【0026】
最適化のための5つのパラメーターとして、例えば、予備加熱、酵素と基質の比(E/S)、pH、加水分解温度、および加水分解時間をとる。
予備加熱:65〜90℃
E/S:0.01〜0.2
pH:2〜10
加水分解温度:30〜65℃
加水分解時間:3〜20時間未満
【0027】
使用酵素としては、例えば、ノボノルディスク社の以下のものがあげられる。
1)エンド型プロテアーゼ
B. リシェニホルミス由来:アルカラーゼ(Alcalase)
B. レントゥス(B. lentus)由来:エスペラーゼ
枯草菌由来:ニュートラーゼ(Neutrase)
バクテリア由来:プロタメックス
豚膵臓由来:PTN(トリプシン)
2)エキソ型プロテアーゼ
アスペルギルス・オリゼ(Aspergillus oryzae)由来:フレーバーザイム
豚あるいはウシ内臓由来:カルボキシペプチダーゼ
【0028】
上記酵素の他に、動物由来のパンクレアチン、ペプシン、植物由来のパパイン、ブロメライン、微生物由来(例えば、乳酸菌、酵母、カビ、放線菌等)のエンドプロテアーゼおよびエキソプロテアーゼ、これらの粗精製物、菌体破砕物等を例示することができる。また、酵素の組み合わせとしては、B. リシェニホルミス由来のアルカラーゼと豚膵臓由来のPTN(トリプシン)の組み合わせがよく用いられる。
【0029】
本発明のタンパク質加水分解物は、LPS誘導性TNF-α及び/又はIL-6産生の抑制効果を有する酵素加水分解物そのもの、限外濾過膜処理後の保持液、あるいは透過液(パーミエイト)、さらに同様の活性を有する市販の乳タンパク質の加水分解物を包含する。
【0030】
乳タンパク質加水分解物の配合量は、製品100 mL当たり0.9〜3 g好ましくは1.2〜2 gと推定されるが、最適範囲は実験により(例えばTNF-α産生抑制活性を指標として)確認することができる。
【0031】
1-2 発酵乳由来タンパク質
発酵乳(ヨーグルト)由来タンパク質は、アミノ酸スコアが100で、発酵によりタンパク質の消化吸収性が高められており栄養価が高い。配合原料としては、発酵乳(ヨーグルト)から水分(ホエイ)を減少させたもの(例えば、日本特許第3,179,555号)をあげることができる。
【0032】
一方、フレッシュチーズはカッテージ、クワルク、ストリング、ヌーシャテル、クリームチーズ、モツァレラ、リコッタ、マスカルポーネなど多くの種類があるが、原料としてはクワルクが適当である。クワルクの製造方法は公知(例えば、特開平6-228013)である。
発酵乳由来タンパク質の配合量はタンパク質として製品100 mL当たり2〜6 g好ましくは2.5〜4.5 gと考えられる。
【0033】
2.脂質
2-1 リン脂質
リン脂質として乳由来レシチンと大豆由来レシチンあるいは卵黄レシチンの組み合わせを用いる。乳由来レシチン単独でもよい。レシチンという用語は、生化学、医学、薬学などの分野ではホスファチジルコリンだけに使用しているが、商業的あるいは工業的には、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルイノシトール、ホスファチジン酸および他のリン脂質の混合物の総称として使われている。食品添加物公定書第7版(1999)では、レシチンは、「油糧種子又は動物原料から得られたもので、その主成分は、リン脂質である」、と定義されている。本発明では乳由来のリン脂質も一括して「乳由来レシチン」と称する。
【0034】
乳由来レシチン
乳リン脂質(ミルクレシチン)は、スフィンゴミエリン(SM)、ホスファチジルコリン(PC)、ホスファチジルエタノールアミン(PE)、ホスファチジルイノシトール(PI)、ホスファチジルセリン(PS)、リゾホスファチジルコリン(LPC)からなり、乳脂肪球皮膜(MFGM)のみに局在している。MFGMリン脂質画分の成分組成を表1(乳業技術 Bulletin of Japan Dairy Technical Association, Vol. 50:pp. 58-91, 2000)に示す。
【0035】
ミルクレシチンの特徴は、表1に示すように、大豆レシチンには含まれないSMを多量に含むことである。ミルクレシチンはラットに投与した場合、大豆レシチンに比較して脳および肝臓内のDHA含量を高めること、また、大豆レシチンあるいは卵黄レシチンに比較して高脂血症や脂肪肝の改善に有効であること、が知られている。また、SMがコレステロールの生合成に関与しているHMG-CoAリダクターゼ活性を調節すること、コレステロールの腸管での吸収の調節に関与していることなど、SMがコレステロール代謝に関与していることが知られている。これらのことから、SMがPCやPEの脂質代謝改善効果をさらに高めていると考えられる(佐々木一、Milk Science 51(2): 93-94, 2002)
【0036】
(表1)

【0037】
MFGMを多く含むものとして、限外濾過(ultrafiltration:UF)および精密濾過(microfiltration:MF)の組み合わせで製造されるWPIの副産物(MF保持液)の凍結乾燥物、クリームあるいはバターから無水乳脂肪(anhydrous milk fat:AMF )を除いた画分(バターゼラム)、ホエイクリームからAMFを除いた画分(ホエイクリームゼラム)などがあげられる。これらを原料としてリン脂質濃縮物を得る方法は公知である(例えば特開平7-173182が本発明に包含される)。
【0038】
大豆レシチン
大豆レシチンは天然の食品添加物として、食品分野で広く使われる一方、ポリエンホスファチジルコリンは医薬品(適応:慢性肝疾患における肝機能の改善、脂肪肝、高脂質血症)としても使われている。大豆レシチンの生理作用として、(1) 生体膜の形態と機能の調整、(2) 肺機能改善、(3) 動脈硬化症の改善、(4) 脂質代謝の改善、(5) 肝臓脂質代謝の改善および(6)神経機能の改善・向上、があげられている(食品と開発, Vol. 29(3):18-21, 1994 )。
【0039】
いわゆる「天然系」の一連のレシチン製品に関しては、通常、製品中のPC含量によって序列されている。レシチンの用途に応じてグレートアップした各種のレシチンが製造されている。大豆レシチンの精製、分画による主なPC含量の違いにより、大豆レシチン製品は便宜的に表2のように分類されている(藤川琢馬、油化学 第40巻(10), pp.951-p58, 1991 )。
【0040】
(表2)

【0041】
ミルクレシチンと大豆レシチンはそれぞれ単独でもよく、また組み合わせてもよい。製品100 mL当たり配合量は合計0.1〜0.5 g好ましくは0.2〜0.3 gと考えられる。オレイン酸は含有量は2〜3 g好ましくは、2.1〜2.5 gと考えられる。
【0042】
2-2 その他の脂質
厚生省(厚生労働省)は、飽和脂肪酸(SFA:パルミチン酸、ステアリン酸等):一価不飽和脂肪酸(MUFA:オレイン酸等):多価不飽和脂肪酸(PUFA:リノール酸、リノレン酸等)の望ましい摂取比率を従来の1:1.5:1から3:4:3となるよう、また、n-6系脂肪酸:n-3系脂肪酸の比率が4:1となるよう勧告している。わが国において、MUFAの摂取比を1.5倍まで高めた食生活の実施は難しいということが理由の一つである。そこで、脂質の脂肪酸組成中一価不飽和脂肪酸(MUFA)の含量を高める。そのために一価不飽和脂肪酸であるオレイン酸を脂肪酸組成中30%以上、好ましくは30〜60%配合する。オレイン酸を多く含む脂質源としては、例えば、高オレイン酸のハイオレイックヒマワリ油、ナタネ油、オリーブ油、高オレイン酸ベニバナ油、大豆油、コーン油、パーム油などが挙げられる。またオレイン酸を含む脂質源として栄養調製油脂(日本油脂(株))が挙げられる。ヒマワリ油、ナタネ油、オリーブ油、およびオリーブ油との混合物も用いることができる。オレイン酸の配合量は製品100 g当たり適切な配合量は1〜6 gで選択される。さらに、DHA、EPA、アラキドン酸等の多価不飽和脂肪酸、カプリル酸、カプリン酸、ラウリン酸等の中鎖脂肪酸を加えて、飽和脂肪酸:一価不飽和脂肪酸:多価不飽和脂肪酸の比率を3:4:3に近くなるように調整する。
【0043】
3.糖質および食物繊維
糖質としては、パラチノースを主とする。その他の糖質としては、糖アルコール(ソルビトール、キシリトール、マルチトールなど)、ハチミツ、グラニュー糖、ブドウ糖、果糖、転化などがあげられる。
【0044】
パラチノースは、パラチノースシロップ、還元パラチノースあるいはパラチノース水飴などを含む。パラチノース水飴は、パラチノースの脱水縮合によって生じる四糖、六糖、八糖等のオリゴ糖を主成分とする水飴状の液状物である。パラチノースはショ糖と同様にグルコースとフルクトースに消化されて吸収される(合田敏尚ら、日本栄養・食糧学会誌, Vol. 36(3): 169-173, 1983)が、その加水分解速度がショ糖の1/5と遅い(Tsuji, Y. et al., J. Nutr. Sci. Vitaminol., 32: 93-100, 1986)ために、摂取後の血中グルコースおよびインスリン濃度を一定レベルに長時間維持する(Kawai, K. et al., Endocrinol, Japan, 32(6): 933-936, 1985)。
【0045】
パラチノースの配合量は製品100 mL当たり4〜15 g好ましくは5〜6 gと考えられる。
【0046】
タンパク質、脂質および糖質のエネルギー比率は、第六次改定日本人の栄養所要量にほぼ準ずるが、タンパク質15〜25 kcal、脂質20〜30 kcal、糖質45〜65 kcalと考えられる。
【0047】
食物繊維は水溶性食物繊維および不溶性食物繊維に分けられる。水溶性食物繊維として、難消化性オリゴ糖のラクツロース、ラクチトール、あるいはラフィノースを用いることができる。難消化性オリゴ糖の生理機能としては、未消化物のまま大腸に到達し、腸内ビフィズス菌の活性化および増殖に寄与し、腸内環境の改善すなわち整腸効果を有することが知られている。ラクツロースは、ガラクトースとフルクトースからなる合成二糖類であり、高アンモニア血症用に対する基本的な薬剤として使用される(Bircher, J. et al., Lancet i: 890, 1965 )。慢性肝不全による慢性再発型肝性脳症は、ラクツロースの投与、肝不全用特殊アミノ酸輸液(Fischer液)などに対してよく反応する。第二世代のラクツロースというべきラクチトール(β-galactosyl-sorbitol)の慢性肝性脳症に対する臨床効果はラクツロースと同程度であり(Lanthier, PL.and Morgan, M., Gut, 26: 415, 1985; Uribe, M., et al., Dig. Dis. Sci., 32: 1345, 1987; Heredia, D. et al., J. Hepatol, 7: 106, 1988; Riggio, O., et al., Dig. Dis. Sci., 34: 823, 1989)、現在高アンモニア血症治療剤として用いられている。
【0048】
その他の水溶性食物繊維の候補として、脂質代謝改善作用(コレステロールや中性脂肪の低下)を有するペクチン(プロトペクチン、ペクチニン酸、ペクチン酸)、グアーガム・酵素分解物、タマリンドシードガムなどがあげられる。グアーガム分解物には血糖値上昇抑制作用およびインスリン節約効果もみられる(大和谷一彦ら、日本栄養・食糧学会誌, 46: 199, 1993 )。さらに、水溶性食物繊維の候補として、高分子水溶性食物繊維では、こんにゃくグルコマンナン、アルギン酸、低分子アルギン酸、サイリウム、アラビアガム、海藻多糖類(セルロース、リグニン様物質、寒天、カラギーナン、アルギン酸、フコダイン、ラミナリン)、微生物ガム(ウエランガム、カードラン、キサンタンガム、ジェランガム、デキストラン、プルラン、ラムザンガム)、その他のガム(種子由来のローカストビーンガム、タマリンドガム、タラガム、樹液由来のカラヤガム、トラガントガム)など、低分子水溶性食物繊維のポリデキストロース、難消化性デキストリン、マルチトールなどがあげられる。
【0049】
不溶性食物繊維は、大腸での不消化物のカサを増やし、通過時間を短縮する。その結果排便回数が増し、便量の増加をもたらす。不溶性食物繊維の候補として、セルロース、ヘミセルロース、リグニン、キチン、キトサン、大豆食物繊維、小麦ふすま、パインファイバー、コーンファイバー、ビートファイバーなどがあげられる。
【0050】
4.ビタミン
現在ビタミンは13種類が知られている。そのうち肝臓に深いかかわりをもつことが知られているのは、ビタミンA、B群(B1、B2、ニコチン酸、B6、パントテン酸、葉酸、B12、ビオチン)およびKである。肝障害との関連においては、Aの欠乏症と過剰症、B群の欠乏症、Kの過剰症が主として問題になる。
【0051】
ビタミンAは閉塞性黄疸などで腸管内に胆汁が不足すると吸収率が低下し欠乏が起こる。また、タンパク質低栄養状態では、レチノール結合タンパク質(RBP)の生成が低下するためビタミンAが目標器官に輸送されず、欠乏症状が発現する。非代償性肝硬変などの場合は比較的少量でビタミンAの過剰による中毒症状が発現する。慢性肝疾患ではビタミンB群の利用障害がみられる。ビタミンKは腸内細菌が合成したものも利用されるので、通常、欠乏症はみられないが、閉塞性黄疸などで腸管内に胆汁が不足すると吸収率が低下する。
【0052】
このようにビタミンと肝臓とのかかわりに基づいて、各種ビタミンの適切な量を本栄養組成物に含ませることができる。
【0053】
5.ミネラル
体液管理を行う場合に通常問題となる電解質は、ナトリウム、塩素、カリウム、リン、カルシウムおよびマグネシウムである。ミネラルの処方を組み立てるさいには、(1) 細胞内に取り込まれるミネラルが十分に配分されているか、(2) 患者の内分泌環境が、投与しようとしている栄養基質の量とと種類に十分対応できるか、(3) 腎に対する浸透圧物質負荷量の推測と適正な尿浸透圧を維持するための投与水分量はどうか、の3点に配慮する。
【0054】
鉄、または天然物由来の微量元素、例えばミネラル酵母の銅、亜鉛、セレン、マンガン、クロムなどが含まれる。グルコン酸銅、グルコン亜鉛なども使用可能である。
【0055】
栄養組成物の浸透圧は約300〜1000 mOsm/l、例えば約300〜750 mOsm/lの浸透圧を有することができる。室温で測定する場合、栄養組成物の粘度は、約5〜40 cp(1 cp = 0.001 Pa・s)、好ましくは20未満である。
【0056】
栄養組成物のカロリーは、約1〜2 kcal/ml、好ましくは、1〜1.5 kcal/mlである。
【0057】
栄養組成物は、直接使用できる形態であることが望ましい。この形態で組成物は、経管で鼻−胃、空腸を経て、また、経口摂取することができる。このような栄養組成物は、各種形態、例えば、果実ジュース型飲料、乳シェーク型飲料などであってもよい。また、栄養組成物は、使用前に再構成できる可溶性粉末であってもよい。
【0058】
栄養組成物は、各種フレーバー(例えばバニラなど)、甘味料および他の添加物を含むことができる。人工甘味料、例えばアスパルテームなどが使用できる。
【0059】
また、便臭低減効果のあるシャンピニオンエキスを5 mg〜500 mg(0.005%〜0.5%)、栄養強化の目的でカロチノイド製剤(例えば、α-カロチン、 β-カロチン、リコピン、ルテインなどを含む)を10μg〜200μg (0.00001%〜0.0002%)含ませることもできる。
【0060】
さらにまた、抗酸化剤として、カテキン、ポリフェノールなどを含ませることもできる。
【0061】
栄養組成物は、例えば、表3に示す配合のタンパク質、糖質および脂質を混合することにより製造できる。この場合、乳化剤を混合物に含ませることができる。
【0062】
本発明の栄養組成物の製造は、当業界公知の方法で実施できる。例えば、液状栄養組成物を予め加熱滅菌した後、無菌的に容器に充填する方法(例えば、UHT滅菌法とアセプティック包装法を併用した方法)、また、液状栄養組成物を容器に充填した後、容器とともに加熱滅菌する方法(例えば、オートクレーブ法)などである。
【0063】
使用形態が液状の場合、均質化物は、缶容器に充填しレトルト殺菌を行うか、または、再度、約140〜145℃で約5〜8秒間加熱殺菌後、冷却し、無菌充填を行う。使用形態が粉末の場合、均質化物は例えば噴霧乾燥する。
【0064】
本発明の栄養組成物は、食品タイプとして、急性肝炎(劇症肝炎)、慢性肝炎、代償性肝硬変、非代償性肝硬変の栄養管理に用いることができる。とくに肝性脳症の発現の可能性を有する慢性肝不全の栄養管理に有用である。とくに、食事摂取が可能な慢性肝不全患者の栄養補充に用いることができる。
【0065】
また、本発明の栄養組成物は、手術や感染、熱傷などの侵襲下の患者の栄養管理に用いることができる。
【0066】
本発明の栄養組成物は、肝疾患患者の治療食用食品(肝臓病食)、あるいは経管・経腸栄養組成物としても用いることができる。
【0067】
患者への栄養組成物の給与は、患者の状態、患者の体重、患者の年令および栄養組成物が栄養の唯一のものであるかにより異なる。そしてその給与量は、患者の担当医により決定される。
【実施例】
【0068】
実施例
以下、本発明を実施例および試験例により具体的に説明するが、本発明はこれらに限定されるものではない。
【0069】
[実施例1] ホエイタンパク質加水分解物の調製
乾燥物として約90%のタンパク質含量のホエイタンパク質分離物(WPI、ダビスコ社)を、8%(w/v)のタンパク質含有量で蒸留水に溶解した。溶液は85℃2分間の加熱処理しタンパク質を変性させた。この加熱後の溶液のpHは約7.5であった。加水分解は、アルカラーゼ2.4L(酵素、ノボザイムス社)を基質に対して2.0%の濃度で添加し3時間55℃で反応させた。次に、豚由来のトリプシンである PTN 6.0S(ノボザイムズジャパン)を基質に対して3.0%の濃度で添加し3時間55℃で反応させた。全加水分解時間は6時間であった。反応終了時のpHは約7.0であった。ホエイタンパク質加水分解物は、遠心処理(20,000×g、10分)後、分画分子量10,000のUF膜処理(ミリポア社ウルトラフリー-MC)を行った。
【0070】
透過液(パーミエイト)を逆相HPLCに供した。そのクロマトグラムを図1に示した。
条件
試料 :ホエイタンパク質加水分解物のUFパーミエイト
カラム:C18 SG120(資生堂社)4.6 mmφ×250 mm
溶離液:A;0.1%トリフルオロ酢酸水溶液/アセトニトリル5/95
B;0.1%トリフルオロ酢酸水溶液/アセトニトリル32/68
A→B 60分の直線濃度勾配
流速 :1 mL/min
検出 :215 nm(紫外/可視検出器)
【0071】
[実施例2] 栄養組成物の調製
表3に示す成分を含む栄養組成物を常法により調製した。ホエイタンパク質加水分解物は実施例1で調製したものを用いた。パラチノースは新三井製糖(株)、新調製油脂は日本油脂株式会社、乳由来リン脂質は、例えば、特開平7-173182に記載の方法に準じて得ることができる。以下に一例を述べる。
【0072】
バターゼラム(BAEF)(Corman社)800 gに99.5%エタノール2000 mLを添加し、5 時間攪拌する。吸引濾過し、濾液を減圧濃縮し、粗脂肪160 gを得る。この粗脂肪にアセトン480 mLを添加し、0.5時間攪拌する。吸引濾過し、残渣にアセトン480 mLを添加し、0.5時間攪拌する。吸引濾過し、残渣を真空乾燥して、リン脂質濃縮物50 gを得る。
【0073】
(表3)

【0074】
調製油脂は、ハイオレィックひまわり93%およびしそ油7%からなり、n-6/n-3が1.54である。その組成を表4に示す。
【0075】
(表4)

【0076】
乳由来のリン脂質の組成を表5に示す。
【0077】
(表5)

【0078】
[試験例1a]ガラクトサミン肝障害抑制効果(1)
本発明の栄養組成物および比較対照としてメイバランスCの、ラットガラクトサミン肝炎に対する抑制効果を調べた。メイバランスC(明治乳業株式会社)は、半消化態の総合流動栄養食である。
【0079】
材料および方法
Sprague-Dawley系雄ラット(6週齡、日本SLC(株))を1週間予備飼育後、体重により、表3に示す栄養組成物飼育群(n=8)およびメイバランスC飼育群(n=8)に群分けした。
【0080】
各群に対し、D-ガラクトサミン塩酸塩(D-galactosamine・HCl、和光純薬株式会社)を生理食塩水200 mg/mLで溶解して、その300 mg/kgをラットの腹腔内に投与した(この日を0日目とする)。投与後、飼料を、栄養組成物あるいはメイバランスCに切り替えた。7日目にガラクトサミン塩酸塩600 mg/kgを各群ラットの腹腔内に投与した。9日目に、4時間絶食後、ジエチルエーテル麻酔下、腹部大動脈より採血し、遠心(3,000 rpm、10分間)して血清を得、測定日(翌日)まで−20℃に保存した。血清中のアンモニア濃度は採血日に測定した。また、肝臓および脾臓を摘出し重量を測定した。血清中のAST(GOT)、ALT(GPT)、総タンパク質、アルブミン、アンモニア、コレステロールおよびトリグリセリドの生化学検査的を富士ドライケムを用いて実施した。また、肝重量および脾重量を測定し、剖検した。実験期間中、飼料および水は自由摂取させた。体重および飼料摂取量を測定した。
【0081】
生化学検査の結果は平均±標準誤差で示した。統計的処理は、分散の等しい場合はStudent-t検定、分散が等しくない場合はMann-Whitney検定を用いた。有意水準を5%未満とした。
【0082】
GOTおよびGPTの測定結果を図2に示す。また、体重、餌の摂取量、肝重量、脾重量、総タンパク質、アルブミン、アンモニア、コレステロールおよびトリグリセリドの測定結果を表6にまとめた。
【0083】
(表6)

【0084】
図2に示すように、ガラクトサミン肝障害モデルにおいて、メイバランスC摂取群の血清GOTおよびGPTは上昇したが、栄養組成物摂取群で有意に抑制された。また、栄養組成物摂取群の血清総タンパク質量、アルブミン量、コレステロール量およびトリグリセリド量はメイバランスC群に対して有意に上昇し、アンモニア量は有意(p<0.05)に抑制された。
【0085】
一方、栄養組成物摂取群とメイバランスC群の餌の摂取量はほとんど同一で差は認められないが、栄養組成物摂取群の体重、肝重量および脾臓重量はメイバランスC群のそれらに比較して有意(p<0.05)に増加した。
【0086】
GOTおよびGPTは肝細胞が変性もしくは壊死に至ると血中に逸脱するもので、その血清中の活性を測定することによって、主に臓器障害の程度を把握することが可能である。また、血清総タンパク質量、アルブミン量、コレステロール量およびトリグリセリド量は、必ずしも臓器障害と平行した変動を示すとは限らないが、タンパク質合成や脂質代謝などの予備能を含めた肝の機能的側面に対する効能を評価するのに役立つ。
【0087】
これらの結果から、本発明の栄養組成物は、慢性肝不全の栄養治療に有効であることが期待される。
【0088】
[試験例1b]ガラクトサミン肝障害抑制効果(2)
実験動物は6週齡Balb/cマウスを日本SLC(株)より購入、1週間AIN-93M(オリエンタル酵母社製)で予備飼育後、体重で各群8匹に群分けを行った。群分け後、表7の組成で混合し、缶容器に充填後レトルト殺菌を行い、凍結乾燥した栄養組成物、へパス(森永クリニコ社製)で 8日間飼育した。飼育8日目にPBSに溶かしたD-ガラクトサミン(和光純薬)をマウス体重1kgあたり400 mg、次にLPS(和光純薬)をマウス体重1kgあたり10μgで腹腔内に投与した。投与後8時間後に尾静脈から採血し、翌日にエーテル麻酔下で動脈から採血を行った。飼料と水は自由摂取とした。血液は遠心を行い血清を分離し、富士ドライケムでGOT、GPTを測定した。結果は平均±SEで示し、Mann-Whitney検定を用い有意差検定を行った(*:p<0.05)。
【0089】
(表7)肝疾患患者用流動食配合組成

【0090】
現在、肝疾患患者用流動食として市場に市販されているのはへパスだけである。肝疾患患者用流動食として市場に市販されているへパスと表7に示す組成で調製した肝疾患患者用流動食の効果を比較した。マウスにガラクトサミンとLPSを腹腔内に投与し、8、24時間後GOT、GPT値を調べた。その結果、図3に示すとおりヘパスではGOT、GPT共に上昇が認められ肝炎が誘導された。一方、肝疾患患者用流動食はへパスに対し有意にGOT、GPTの上昇が抑制された。
【0091】
以上の結果から、へパスは肝炎抑制効果が認められなかった。一方、肝疾患患者用流動食はガラクトサミン/LPS誘発マウス肝炎モデルにおいても肝炎抑制効果があることが確認された。
【0092】
[試験例1c]ウイルス・自己免疫性肝障害抑制効果
実験動物は6週齡Balb/cマウスを日本SLC(株)より購入、1週間AIN-93Mで予備飼育後、体重で各群10匹に群分けを行った。群分け後、WPI(Davisco社)、実施例1で作製したホエイタンパク質加水分解物を飼料中蛋白質含量の25或いは50%の割合でAIN-93M(14%カゼインを含む)中のカゼインと置換した実験飼料に変え14日間飼育した。飼育14日目にPBSに溶かしたConA(Sigma)をマウス体重1kgあたり15 mgになるように静脈に注射した。投与後2、4、8時間後に尾静脈から採血し、翌日にエーテル麻酔下で動脈から採血を行った。飼料と水は自由摂取とした。血液は遠心を行い血清を分離し、富士ドライケムでGOT、GPTを測定した。サイトカインはTNF-αをELISA法(Amersham、Bioscience社)で測定した。結果は平均±SEで示し、Mann-WhitneyのU検定を用い有意差検定を行った(*:p<0.05)。
【0093】
カゼイン添加群ではConA投与後8から24時間で肝炎の指標であるGOT、GPTが上昇した。一方、WPI添加群及びホエイタンパク質加水分解物添加群でGOT、GPTの上昇が有意に抑制された(図4および5)。25%のホエイタンパク質加水分解物添加群で50%WPI添加群と同等かそれ以上の効果が認められたことから、WPIのホエイタンパク質分解物にはWPI以上の効果が期待できる。同じ個体で、サイトカインの産生についても同時に調べた。その結果、カゼイン添加群ではConA投与2時間後に血清のTNF-α濃度が上昇し、4時間後には低下した(図6)。ConA投与2時間後のTNF-α濃度はカゼイン群に比べWPI添加群とホエイタンパク質加水分解物添加群で有意に低い値を示した。WPI及びホエイタンパク質分解物にはTNF-αの分泌を抑制する作用があることが確認された。この様なサイトカインの産生抑制作用により、肝炎の誘導が抑制され、GOT、GPTの上昇を抑制したと考えられる。以上の様に、ConA誘発肝障害モデルにおいて、WPIのホエイタンパク質加水分解物に肝障害抑制効果が認められた。
【0094】
[試験例2]ホエイタンパク質加水分解物の抗炎症作用
方法
6週齢のICR系雄マウス(日本エスエルシー(株))を1週間予備飼育後、体重の平均値が等しくなるように3群(各群6匹)に分けた。タンパク質源として、100%カゼイン(対照群)、50%カゼイン+50% WPI(Davisco Foods社)、あるいは50%カゼイン+50%ホエイタンパク質加水分解物(実施例1で調製したもの)を精製飼料(AIN93M)に14%(重量)添加した実験飼料を各群に与え7日間飼育した。
【0095】
飼育後マウスの腹腔内にリポ多糖(LPS)を1.4μg/g体重の用量で投与した。90分後に眼窩採血し、遠心操作(10,000×g、15分間)により血清を得た。血清中のTNF-αおよびIL-6をELISAキット(Amersham bioscience社)により測定した。Fisher PLSDにより群間の有意差検定を行った。血清中のTNF-α濃度を図7に、IL-6濃度を図8に示す。
【0096】
結果
LPS投与後のTNF-α産生量は、カゼイン群(対照群)に対して、WPI群では抑制傾向がみられ、ホエイタンパク質加水分解物群では有意(p=0.033)に抑制された(図7)。
【0097】
一方、IL-6の産生量は、カゼイン群(対照群)に対して、WPI群では抑制傾向がみられ、ホエイタンパク質加水分解物群では有意(p=0.0002)に抑制された(図8)。
【0098】
以上の結果から、ホエイタンパク質加水分解物を経口摂取すると、その後のLPS刺激によるTNF-αおよびIL-6産生を有意に抑制することが見出されたので、ホエイタンパク質加水分解物の配合量を種々変えてTNF-α産生抑制効果を調べた。
【0099】
すなわち、タンパク質源として、100%カゼイン、80%カゼイン+20%ホエイタンパク質加水分解物、70%カゼイン+30%ホエイタンパク質加水分解物、および50%カゼイン+50%ホエイタンパク質加水分解物について同様の実験を行った。F検定後、Bonferroni/Dunn検定により群間の有意差検定を行った。結果を図9に示す。
【0100】
LPS投与後のTNF-α産生量は、カゼイン群に対して、20%ホエイタンパク質加水分解物群で抑制傾向がみられ、30%ホエイタンパク質加水分解物群および50%ホエイタンパク質加水分解物群で有意(p=0.0496およびp=0.0479)に抑制された。
【0101】
考察
1.肝疾患とTNF-αとの関連について
TNF-α、IL-1、IL-6は炎症や免疫反応に際し、主にマクロファージ系細胞と内皮細胞により産生され、それ自身が発熱物質として作用するとともに肝細胞に直接働き、急性期タンパク質(CRP)の産生を促す(Hepatology 23: 909-916, 1996;J. Immunol., 146: 3032-3037, 1991;Intensive Care Med., 24: 224-229, 1998;Hepatology 9: 497-499, 1989)。
【0102】
とくに、急性肝炎(とりわけ劇症肝炎)やアルコール性肝障害などの病態では、発熱、白血球増多、CRP陽性など炎症性サイトカインの関与を示す所見を認める。
【0103】
TNF-αは、エンドトキシン刺激によりマクロファージから産生され、多臓器不全を誘導することがある(「肝不全−基礎と臨床」日本医事新報社, 東京, 1994, pp30-46;「肝不全−基礎と臨床」日本医事新報社, 東京, 1994, pp123-137)。実際、劇症肝炎患者では網内系機能の低下があり、高エンドトキシン血症の続発がしばしば観察され、TNF-αやIL-1の産生が生体内で亢進していると考えられている(Lancet 2: 72-74, 1988)。劇症肝炎患者血中の炎症性サイトカイン濃度は急性肝炎に比べ、ほとんど有意に上昇し、とくにTNF-αとIL-6濃度は、肝再生の指標とされるヒト肝細胞増殖因子(HGF)のそれとよい相関を示す(Clin. Exp. Immunol., 98: 71-77, 1994)。
【0104】
一方、慢性肝疾患である肝硬変患者の炎症性サイトカインの血中濃度は、非肝硬変患者のそれに比べて有意に高いこと、また、病因にかかわらず炎症より肝機能障害を反映している可能性が示されている(Gastroenterology 103: 264-274, 1992)。B型慢性肝炎患者のIL-1産生は亢進しており、肝線維化の程度とよい相関を認め、IL-1が肝硬変への進展に重要であるとする報告がある(Gastroenterology 94: 999-1005, 1988)。
【0105】
肝疾患とIL-6との関連について
アルコール性肝硬変では、血中IL-6値と末梢血単核球のIL-6産生は増えており、その程度はIgA値と正の、IL-2やIFN-γ産生とは負の相関を示す(Clin. Exp. Immunol., 77: 221-225, 1989)。慢性肝炎の急性増悪時にも血中IL-6活性は上昇しており(Am. J. Gastroenterol., 86: 1804-1808, 1991)、血中IL-6値と末梢血単核球の非刺激時のIL-6産生は、それぞれ肝内の炎症の程度をよく反映するものと思われる。
【0106】
急性ウイルス性肝炎では、IL-6は、類洞壁内皮細胞、クッパー細胞、侵潤単核球に検出され(J. Clin. Pathol., 45: 408-411, 1992)、慢性肝炎では、主に門脈域の侵潤リンパ球や線維芽細胞に検出される。したがって、IL-6の発現は、急性および慢性肝疾患において、病因にかかわりなく炎症と免疫反応に密接に関連すると推定される。IL-6は肝細胞の再生を促進するとともに、過剰の産生は組織障害や線維化を誘導する可能性がある。
【0107】
2.栄養投与経路とサイトカイン産生
サイトカインによる侵襲時の代謝異常や臓器障害を防止するには局所のサイトカインは正常に産生させるが、全身へのこの波及を防止することは合理的と考えられる。そこで、栄養投与経路の相違で侵襲時のサイトカイン産生を修飾することが可能かどうかについて議論がなされている。侵襲のない健康成人では経腸栄養あるいは経静脈栄養の1週間の施行で、血中のTNFやIL-6値に明らかな相違は生じない(New Horizon 2: 164-174, 1994)。しかし、健康成人で経腸栄養あるいは経静脈栄養の7日間施行した後、エンドトキシンを静注すると、そのさいの発熱やTNF、侵襲ホルモン分泌などの全身生体反応は経静脈栄養より経腸栄養で軽微であることが報告されている(Ann. Surg., 210: 449-457, 1989)。斉藤らも栄養投与経路の異なる腹腔内細菌投与ラットを用いて、栄養投与経路とサイトカイン産生の関係を検討した結果、経腸栄養では経静脈栄養に比べて、サイトカイン産生の修飾が生体反応にとって有利な方向に向かうことを確認している(Ann. Surg., 223: 84-93, 1996)。
【0108】
3.栄養組成物と肝障害抑制効果の関連について
本発明の栄養組成物を経口摂取すると、エンドトキシン誘導性のTNF-αおよびIL-6の血中濃度上昇が有意に抑制された。その抑制作用は、主として栄養組成物中に含まれるホエイタンパク質加水分解物によるものであり、血中におけるTNF-αおよびIL-6濃度上昇抑制は経口摂取による修飾によるものと考えられる。
【0109】
産業上の利用可能性
本発明の栄養組成物は、急性肝炎(劇症肝炎)、慢性肝炎、代償性肝硬変、非代償性肝硬変の栄養管理に有用である。とくに肝性脳症の発現の可能性を有する慢性肝不全の栄養管理に有用である。慢性肝不全において、食事摂取が可能な例では、摂取タンパク質量の制限が基本である。しかし高度のタンパク質制限が長期間に及ぶと食欲を阻害し、タンパク質の異化を亢進させ、低栄養状態をさらに悪化させる。そこで何らかの栄養補充が必要となる。本発明の食品タイプの栄養組成物は食品タイプであり、栄養組成物を毎食に付加給与することのより、慢性肝不全の栄養状態の改善が期待できる。
【0110】
また、本発明の栄養組成物は、手術や感染、熱傷などの侵襲下の患者の栄養管理に有用である。
【技術分野】
【0001】
技術分野
本発明は、肝疾患患者の栄養管理および栄養治療に有用な栄養組成物に関する。また本発明は、手術や感染、熱傷などの生体侵襲下の患者における代謝・栄養管理に有用な栄養組成物に関する。さらにまた本発明は、炎症性疾患患者の病態改善に有用な栄養組成物に関する。
【背景技術】
【0002】
背景技術
肝疾患の栄養病態は、糖質代謝では一般に解糖系酵素活性の変化と、末梢におけるインスリン感受性の低下により耐糖能異常が高頻度にみられる。とくに、肝硬変ではエネルギー消費が亢進し、エネルギー基質として糖質利用率も低下する。タンパク質代謝では肝炎や肝硬変で、血漿アミノ酸の不均衡(分枝鎖アミノ酸/芳香族アミノ酸の比(Fischer比)の低下)、タンパク質異化の亢進、負の窒素出納による低タンパク血症、高アンモニア血症がみられる。さらに、脂質代謝では多価飽和脂肪酸の減少、脂溶性ビタミンの低下が顕在化する。
【0003】
肝硬変のうち、代償性と非代償性で病態も違い、その代謝・栄養管理も異なる。代償性肝硬変ではおおむね慢性肝炎に準じた管理方針でよい。しかし、非代償性肝硬変では慢性肝不全状態にあり、タンパク質異化亢進が存在するため、過剰のタンパク質投与は高アンモニア血症を招きかねない。分枝鎖アミノ酸(BCAA)であるバリン、ロイシン、イソロイシンの経口投与は末梢組織のタンパク質異化を抑制し、肝でのタンパク質合成を促進する。さらに、筋で代謝されたBCAAはアラニンとなり、肝での糖新生(グルコース-アラニン回路)を活性化してエネルギー基質としての糖利用効率の改善に働く。これらのことから、骨格筋でのエネルギー不足を補充するため、BCAA 製剤(ヘパンEDR、アミノレバンENR:50〜150 g/日)が用いられている。
【0004】
一方、生体は、手術や感染、熱傷など過度の侵襲を受けると、局所や全身の炎症性メディエーターの産生が亢進する。なかでもサイトカインは、循環系、内分泌系、免疫系、代謝系などに多彩な反応を引き起こす重要なメディエーターである。
【0005】
一般に侵襲時に対する代謝反応の特徴は、体タンパク質、とくに骨格筋のタンパク質分解亢進、脂肪分解亢進によるグリセロールと脂肪酸の産生、さらに肝でのグルコース新生や急性期タンパク質産生、アルブミン産生などである。一方、免疫系は細胞性・液性免疫とも抑制されると考えられ、さらに侵襲時には著しいタンパク質異化亢進に伴い、免疫に関与するタンパク質合成の低下が予想される。
【0006】
このような侵襲生体での代謝変化に各種のサイトカインが関与していることは、サイトカイン自体の投与実験、サイトカイン産生、あるいはその作用をブロックする実験などで明らかにされてきた。すなわち、TNF-α、IL-1、IL-6による代謝変動は、(1) 糖代謝においては、高血糖・低血糖、グリコーゲン分解亢進であり(例えば、Meszaros K et.al.「Tumor necrosis factor increases in vivo glucose utilization of macrophage-rich tissues」Biochem. Biophys. Res. Commun., Vol. 149, No. 1, pp. 1-6, 1987年11月30日(非特許文献1);Tracey, KJ et.al.「Shock and tissue injury induced by recombinant human cachectin」Science, Vol. 234、No. 4775, pp. 470-474, 1986年10月24日(非特許文献2);Fukushima, R et.al.「Different roles of IL-1 and TNF on hemodynamics and interorgan amino acid metabolism in awake dogs」Am. J. Physiol., Vol. 262, No. 3, Pt. 1, pp. E275-E281, 1992年3月(非特許文献3)参照)、(2) アミノ酸・タンパク質代謝においては、筋崩壊・アミノ酸放出増加、腸グルタミン摂取増加、腸アラニン放出増加、肝アミノ酸摂取増加、急性期タンパク質合成亢進であり(例えば、Fukushima, R et.al.「Different roles of IL-1 and TNF on hemodynamics and interorgan amino acid metabolism in awake dogs」Am. J. Physiol., Vol. 262, No. 3, Pt. 1, pp. E275-E281, 1992年3月(非特許文献3);Moldawer, LL et.al.「Interleukin 1 and tumor necrosis factor do not regulate protein balance in skeletal muscle」Am. J. Physiol., Vol. 253, No. 6, Pt. 1, pp. C766-C773, 1987年12月(非特許文献4)参照)、そして(3) 脂質代謝においては、脂肪酸分解亢進、リポタンパク質リパーゼ(lipoprotein lipase)活性低下である(例えば、Feingold, KR et.al.「Multiple cytokines stimulate hepatic lipid synthesis in vivo」Endocrinology, Vol. 125, No. 1, pp. 267-274, 1989年7月(非特許文献5);Grunfeld, C et.al.「Tumor necrosis factor: immunologic, antitumor, metabolic, and cardiovascular activities」Adv. Intern. Med., Vol. 35, pp. 45-71, 1990年(非特許文献6);Feingold, KR et.al.「Tumor necrosis factor stimulates hepatic lipid synthesis and secretion」Endocrinology, Vol. 124, No. 5, pp. 2336-2342, 1989年5月(非特許文献7)参照)。
【0007】
サイトカインによる侵襲時の代謝異常や臓器障害を防止するには、局所のサイトカインは正常に産生させるが、全身へのこの波及を防止する方法が合理的である。そのような方法として、経腸栄養やω-3系脂肪酸、あるいは成長ホルモンなどがある。
【0008】
栄養投与経路の相違による侵襲時のサイトカイン産生の相違についていくつかの報告がある。侵襲のない健康成人では、経腸栄養あるいは経静脈栄養の1週間の施行で、血中のTNF-αやIL-6値に明らかな相違は生じない(例えば、Lowry, SF et.al.「Nutrient modification of inflammatory mediator production」New Horiz., Vol. 2, No. 2, pp. 164-174, 1994年5月(非特許文献8)参照)が、健康成人で経腸栄養あるいは経静脈栄養を7日間施行した後、エンドトキシンを静注すると、その際の発熱やTNF-α、侵襲ホルモン分泌などの全身生体反応が経静脈栄養よりも経腸栄養で軽微であることが報告されている(例えば、Fong, YM et.al.「Total parenteral nutrition and bowel rest modify the metabolic response to endotoxin in humans」Ann. Surgery, Vol. 210, No. 4, pp. 456-457, 1989年10月(非特許文献9)参照)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Meszaros K et.al.「Tumor necrosis factor increases in vivo glucose utilization of macrophage-rich tissues」Biochem. Biophys. Res. Commun., Vol. 149, No. 1, pp. 1-6, 1987年11月30日
【非特許文献2】Tracey, KJ et.al.「Shock and tissue injury induced by recombinant human cachectin」Science, Vol. 234、No. 4775, pp. 470-474, 1986年10月24日
【非特許文献3】Fukushima, R et.al.「Different roles of IL-1 and TNF on hemodynamics and interorgan amino acid metabolism in awake dogs」Am. J. Physiol., Vol. 262, No. 3, Pt. 1, pp. E275-E281, 1992年3月
【非特許文献4】Moldawer, LL et.al.「Interleukin 1 and tumor necrosis factor do not regulate protein balance in skeletal muscle」Am. J. Physiol., Vol. 253, No. 6, Pt. 1, pp. C766-C773, 1987年12月
【非特許文献5】Feingold, KR et.al.「Multiple cytokines stimulate hepatic lipid synthesis in vivo」Endocrinology, Vol. 125, No. 1, pp. 267-274, 1989年7月
【非特許文献6】Grunfeld, C et.al.「Tumor necrosis factor: immunologic, antitumor, metabolic, and cardiovascular activities」Adv. Intern. Med., Vol. 35, pp. 45-71, 1990年
【非特許文献7】Feingold, KR et.al.「Tumor necrosis factor stimulates hepatic lipid synthesis and secretion」Endocrinology, Vol. 124, No. 5, pp. 2336-2342, 1989年5月
【非特許文献8】Lowry, SF et.al.「Nutrient modification of inflammatory mediator production」New Horiz., Vol. 2, No. 2, pp. 164-174, 1994年5月
【非特許文献9】Fong, YM et.al.「Total parenteral nutrition and bowel rest modify the metabolic response to endotoxin in humans」Ann. Surgery, Vol. 210, No. 4, pp. 456-457, 1989年10月
【発明の概要】
【0010】
発明の開示
本発明は、肝不全患者の栄養管理および栄養治療に有用な栄養組成物を提供することを課題とする。また本発明は、手術や感染、熱傷などの高度生体侵襲下にある患者の代謝・栄養管理に有用な栄養組成物を提供することを課題とする。さらにまた本発明は、炎症性疾患患者の病態改善に有用な栄養組成物を提供することを課題とする。
【0011】
本発明者らは、ホエイタンパク質加水分解物、レシチンおよび高オレイン酸含有油脂、ならびにパラチノースを必須成分として含む栄養組成物が、ラットのガラクトサミン肝障害発症を抑制することを見出した。また、ホエイタンパク質加水分解物が、in vivoにおいてLPS誘導性TNF-αおよびインターロイキン6(IL-6)産生を抑制することを見出した。これらの結果から、本発明の栄養組成物は、肝疾患患者の栄養管理および栄養治療、そして手術や感染、熱傷などの高度生体侵襲下にある患者の代謝・栄養管理、さらに炎症性疾患の病態改善に有用であることを見出した。
【0012】
すなわち本発明は、以下を含む:
(1)タンパク質として乳タンパク質の加水分解物および発酵乳由来タンパク質、脂質として高オレイン酸含有油脂ならびにミルクレシチン及び/又は大豆レシチン、および糖質としてパラチノースを含む、肝疾患患者用栄養組成物、
(2)乳タンパク質が、カゼイン、乳タンパク質濃縮物(MPC)、ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン、β-ラクトグロブリンおよびラクトフェリンからなる群より選択される、(1)の肝疾患患者用栄養組成物、
(3)発酵乳由来タンパク質が発酵乳よりホエイを減少させた組成物に由来する、(1)の肝疾患患者用栄養組成物、
(4)発酵乳由来タンパク質がフレッシュチーズに由来する、(1)の肝疾患患者用栄養組成物、
(5)フレッシュチーズがクワルクである、(4)の肝疾患患者用栄養組成物、
(6)乳タンパク質の加水分解物が、ホエイタンパク質分離物(WPI)をバシラス・リシェニフォルムス(Bacillus licheniformus)由来のアルカラーゼで加水分解およびブタ膵臓由来のトリプシンで加水分解して得られうる、(1)の肝疾患患者用栄養組成物、
(7)分画分子量10,000の限外濾過膜でさらに処理して得られる透過画分(パーミエイト)である、(6)の肝疾患患者用栄養組成物、
(8)逆相HPLCで分離したときのクロマトグラムが図1で示される、(7)の肝疾患患者用栄養組成物、
(9)タンパク質として乳タンパク質の加水分解物および発酵乳由来タンパク質、脂質として高オレイン酸含有油脂ならびにミルクレシチン及び/又は大豆レシチン、および糖質としてパラチノースを含む、生体高度侵襲患者用栄養組成物、
(10)乳タンパク質が、カゼイン、乳タンパク質濃縮物(MPC)、ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン、β-ラクトグロブリンおよびラクトフェリンからなる群より選択される、(9)の生体高度侵襲患者用栄養組成物、
(11)発酵乳由来タンパク質が発酵乳よりホエイを減少させた組成物に由来する、(9)の生体高度侵襲患者用栄養組成物、
(12)発酵乳由来タンパク質がフレッシュチーズに由来する、(9)の生体高度侵襲患者用栄養組成物、
(13)フレッシュチーズがクワルクである、(12)の生体高度侵襲患者用栄養組成物、
(14)乳タンパク質の加水分解物が、ホエイタンパク質分離物(WPI)をバシラス・リシェニフォルムス由来のアルカラーゼで加水分解およびブタ膵臓由来のトリプシンで加水分解して得られうる、(9)の生体高度侵襲患者用栄養組成物、
(15)分画分子量10,000の限外濾過膜でさらに処理して得られる透過画分(パーミエイト)である、(14)の生体高度侵襲患者用栄養組成物、
(16) 逆相HPLCで分離したときのクロマトグラムが図1で示される、(15)の生体高度侵襲患者用栄養組成物。
【図面の簡単な説明】
【0013】
【図1】ホエイタンパク質分離物(WPI)加水分解物のUF(分子量カットオフ値:10,000)パーミエイトの逆相クロマトグラムを示す。
【図2】ガラクトサミン肝障害モデルラットにおける栄養組成物およびメイバランスCのGOTおよびGPT上昇抑制効果を示す。
【図3】ガラクトサミン投与後の血中GOT、GPT濃度の変化を示す。
【図4】ConA投与後の血中GOT濃度の変化を示す。
【図5】ConA投与後の血中GPT濃度の変化を示す。
【図6】ConA投与後の血中TNF-α濃度の変化を示す。
【図7】ホエイタンパク質加水分解物のLPS誘導性TNF-α産生抑制作用を示す。
【図8】同上のIL-6産生抑制作用を示す。
【図9】ホエイタンパク質加水分解物の用量によるLPS誘導性TNF-α産生抑制作用を示す。
【発明を実施するための形態】
【0014】
1.タンパク質
1-1 乳タンパク質加水分解物
原料タンパク質として、カゼイン、ホエイタンパク質(ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン(α-La)、β-ラクトグロブリン(β-Lg))、乳タンパク質濃縮物(MPC、総乳タンパク質=TMPともいう)等を用いることができる。
【0015】
ホエイタンパク質の加水分解を例にとると、通常、該タンパク質の加水分解に用いる酵素は、ペプシン、トリプシンおよびキモトリプシンであるが、植物起源のパパイン、バクテリアや菌類由来のプロテアーゼを用いた研究報告(Food Technol., 48: 68-71, 1994;Trends Food Sci. Technol., 7: 120-125, 1996;Food Proteins and Their Applications, pp. 443-472, 1997)もある。ホエイタンパク質を加水分解する酵素活性は大きく変動する。ペプシンはα-Laおよび変性したα-Laを分解するが、未変性の(native)β-Lgを分解しない(Neth. Milk dairy J., 47: 15-22, 1993 )。トリプシンはα-Laをゆっくり加水分解するがβ-Lgはほとんど未分解のままである(Neth. Milk dairy J., 45: 225-240, 1991)。キモトリプシンはα-Laを速く分解するが、β-Lgはゆっくり分解される。パパインはウシ血清アルブミン(BSA)およびβ-Lgを加水分解したが、α-Laは抵抗性があった(Int. Dairy Journal 6: 13-31, 1996a)。しかしながら、Caを結合していないα-Laは酸性のpHでパパインにより完全に分解された(J. Dairy Sci., 76: 311-320, 1993)。
【0016】
乳タンパク質の酵素分解をコントロールして該タンパク質を修飾することにより、広範囲のpHおよびプロセッシング条件にわたって、該タンパク質の機能的特性を変更することができる(Enzyme and Chemical Modification of proteins in Food proteins and their Applications, pp. 393-423, 1997, Marcel Dekker, Inc., New York, 1997 ;Food Technol., 48: 68-71, 1994)。
【0017】
ペプチド結合の加水分解は、荷電基の数および疎水性の増加、低分子量化、および分子の立体配置の修飾をもたらす(J. Dairy Sci., 76: 311-320, 1993)。機能的特性の変化は大きく加水分解度に依存する。ホエイタンパク質の機能性に共通してみられる最も大きな変化は溶解性の増加と粘度の低下である。加水分解度が高い場合、しばしば、加水分解物は加熱しても沈澱せず、pH 3.5〜4.0で溶解性が高い。加水分解物は、また、無処置の(intact)タンパク質よりもはるかに粘度が低い。この差異はとくにタンパク質濃度が高い場合に顕著である。その他の影響は、ゲル特性の変化、熱安定性を高める、乳化および起泡性の増強、乳化および泡の安定性の低下である(Int. Dairy journal, 6: 13-31, 1996a;Dairy Chemistry 4, pp. 347-376, 1989;J. Dairy Sci., 79: 782-790, 1996)。
【0018】
乳タンパク質から派生するさまざまな生理活性オリゴペプチドが知られている(吉川正明「ミルクの先端機能」吉川正明ら編, p 188-195, 弘学出版, 1998;大谷元「ミルクの先端機能」吉川正明ら編, p 97-99, 弘学出版, 1998;大谷元、Milk Science 47: 183, 1998;Trends in Food Science and Technology, 9: 307-319, 1998)。アンギオテンシン変換酵素(ACE)阻害活性を有するペプチド(血圧降下作用をもつ)もそのうちの一つである。
【0019】
in vitro活性の測定から推定される、ACE阻害活性の可能性のある数多くのペプチドに関する報告がある(例えば、J. Dairy Res., 67: 53-64, 2000;Br. J. Nutr., 84: S33-S37, 2000)。加水分解物から、さまざまなクロマトグラフィー技術を用いて、ACE阻害ペプチドを精製および同定する研究報告がなされている(例えば、Maruyama, S., & Suzuki, H., Agricultural and Biological Chemistry, 46: 1393-1394, 1982;Miyoshi S. et al., Agri. Biol. Chem., 55: 1313-1318, 1991;Food Science and Biotechnology, 8: 172-178, 1999;Biosci. Biotech. Biochem., 57: 922-925, 1993)。
【0020】
これらの報告から、ACE阻害活性は、さまざまな分離原理に基づくカラム操作で得られた数多くのフラクションに存在していると考えられ、これはACE阻害物質の分子特性がかなり多様であることを示している。ACE阻害が、さまざまなタンパク質、プロテアーゼおよび加水分解条件で産生される加水分解物中に見出されるという事実は、多様なアミノ酸配列をもったさまざまなペプチドもまた、ACE阻害活性を有する可能性を示唆している。このようなペプチドの化学的多様性のために、加水分解物のクロマトグラフィーによる精製は、部分的な活性ペプチドの損失を常に伴うこととなろう。加水分解中、ACE阻害活性は連続的に形成され一方で分解される。加水分解物の最大活性はこれら2つのプロセスの最適化の結果である。加水分解物の全体的なペプチド組成は、ACE阻害活性を決定し、それは加水分解酵素の特異性およびプロセス条件に依存する。
【0021】
そこで、必要とする加水分解を最小限にとどめ、ACE阻害活性を最大化すべく、応答曲面法(response surface methodlogy)を用いたホエイタンパク質加水分解の最適化についての報告(International Dairy Journal 12: 813-820, 2002)がなされている。
【0022】
本発明において、乳タンパク質加水分解物は、in vivoにおけるLPS誘導性TNF-αおよびIL-6産生を抑制する作用を有することが初めて見出された。乳タンパク質から派生するペプチドのサイトカイン産生に対する影響に関しては、ウシカゼイン由来のペプチドが、ネズミ骨髄マクロファージからのLPS誘導性TNF-αおよびIL-6産生を増加させるという報告(J. Sci. Food Agric., 81: 300-304, 2000)やプロバイオティック(probiotic)乳酸菌による発酵乳の上清中に、LPS刺激によるIL-6産生を誘導するペプチドが存在するという報告(Milchwissenschaft, 57(2): 66-70, 2002)があるが、これらの炎症性サイトカインの産生抑制についての報告は本願発明者らの知る限り存在しない。LPS誘導性TNF-αおよびIL-6産生を抑制する作用を有するペプチドについても、上記ACE阻害活性を有するペプチドのように、さまざまな分離原理に基づくカラム操作で得られた数多くのフラクションに存在している可能性を否定することはできない。
【0023】
そこで、LPS誘導性TNF-α及び/又はIL-6産生の抑制効果を指標に乳タンパク質の加水分解条件(変性温度、pH、温度、加水分解時間および酵素/基質の比)の最適化を上記文献(International Dairy Journal 12: 813-820, 2002)を参考に試みることができる。したがって、この結果得られた加水分解の最適化条件は本発明に包含される。
【0024】
一方、乳タンパク質加水分解物については、上記に例示した文献に加えて数多くの特許(公開特許および特許)が存在する。例えば、カゼインとホエイタンパク質を別々に加水分解し、疎水性部分を吸着・除去した後、両者を所定割合で混合する特許(日本特許第2,986,764号)、ホエイタンパク質をバチルス属由来のプロテアーゼと放線菌由来のプロテアーゼによって加水分解した後、酵素と不溶性の加水分解物を除去する特許(日本特許第3,222,638号)、β-ラクトグロブリンを酵素で分解して得られる分岐鎖アミノ酸/芳香族アミノ酸のモル比が10重量%以上、芳香族アミノ酸が2.0重量%未満、平均分子量が数百〜数千のペプチド混合物の特許(日本特許第3,183,945号)、ホエイタンパク質中のβ-ラクトグロブリンを選択的に酵素分解する特許(日本特許第2,794,305号)、あるいはホエイタンパク質をB. リシェニホルミス(B. licheniformis)由来のプロテアーゼ及び/又は枯草菌(B. subtilis)由来のプロテアーゼにより、非−pH−スタット法により、15〜30%の加水分解度(DE)まで加水分解し、カットオフ値10,000を超える限外濾過膜の透過液を得る特許(日本特許第3167723号)等をあげることができ、本発明はこれらの特許以外の特許や公開特許を包含する。
【0025】
上記文献や特許の加水分解物が、LPS誘導性TNF-αおよびIL-6産生を抑制する作用を有するかどうかを公知のアッセイ系(例えば、実験医学別冊、「バイオマニュアルUP実験シリーズ」、サイトカイン実験法、宮島篤、山本雅 編、(株)羊土社、1997)で調べることができる。したがって、TNF-αやIL-6の産生抑制活性を示す加水分解物は本発明に包含される。
【0026】
最適化のための5つのパラメーターとして、例えば、予備加熱、酵素と基質の比(E/S)、pH、加水分解温度、および加水分解時間をとる。
予備加熱:65〜90℃
E/S:0.01〜0.2
pH:2〜10
加水分解温度:30〜65℃
加水分解時間:3〜20時間未満
【0027】
使用酵素としては、例えば、ノボノルディスク社の以下のものがあげられる。
1)エンド型プロテアーゼ
B. リシェニホルミス由来:アルカラーゼ(Alcalase)
B. レントゥス(B. lentus)由来:エスペラーゼ
枯草菌由来:ニュートラーゼ(Neutrase)
バクテリア由来:プロタメックス
豚膵臓由来:PTN(トリプシン)
2)エキソ型プロテアーゼ
アスペルギルス・オリゼ(Aspergillus oryzae)由来:フレーバーザイム
豚あるいはウシ内臓由来:カルボキシペプチダーゼ
【0028】
上記酵素の他に、動物由来のパンクレアチン、ペプシン、植物由来のパパイン、ブロメライン、微生物由来(例えば、乳酸菌、酵母、カビ、放線菌等)のエンドプロテアーゼおよびエキソプロテアーゼ、これらの粗精製物、菌体破砕物等を例示することができる。また、酵素の組み合わせとしては、B. リシェニホルミス由来のアルカラーゼと豚膵臓由来のPTN(トリプシン)の組み合わせがよく用いられる。
【0029】
本発明のタンパク質加水分解物は、LPS誘導性TNF-α及び/又はIL-6産生の抑制効果を有する酵素加水分解物そのもの、限外濾過膜処理後の保持液、あるいは透過液(パーミエイト)、さらに同様の活性を有する市販の乳タンパク質の加水分解物を包含する。
【0030】
乳タンパク質加水分解物の配合量は、製品100 mL当たり0.9〜3 g好ましくは1.2〜2 gと推定されるが、最適範囲は実験により(例えばTNF-α産生抑制活性を指標として)確認することができる。
【0031】
1-2 発酵乳由来タンパク質
発酵乳(ヨーグルト)由来タンパク質は、アミノ酸スコアが100で、発酵によりタンパク質の消化吸収性が高められており栄養価が高い。配合原料としては、発酵乳(ヨーグルト)から水分(ホエイ)を減少させたもの(例えば、日本特許第3,179,555号)をあげることができる。
【0032】
一方、フレッシュチーズはカッテージ、クワルク、ストリング、ヌーシャテル、クリームチーズ、モツァレラ、リコッタ、マスカルポーネなど多くの種類があるが、原料としてはクワルクが適当である。クワルクの製造方法は公知(例えば、特開平6-228013)である。
発酵乳由来タンパク質の配合量はタンパク質として製品100 mL当たり2〜6 g好ましくは2.5〜4.5 gと考えられる。
【0033】
2.脂質
2-1 リン脂質
リン脂質として乳由来レシチンと大豆由来レシチンあるいは卵黄レシチンの組み合わせを用いる。乳由来レシチン単独でもよい。レシチンという用語は、生化学、医学、薬学などの分野ではホスファチジルコリンだけに使用しているが、商業的あるいは工業的には、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルイノシトール、ホスファチジン酸および他のリン脂質の混合物の総称として使われている。食品添加物公定書第7版(1999)では、レシチンは、「油糧種子又は動物原料から得られたもので、その主成分は、リン脂質である」、と定義されている。本発明では乳由来のリン脂質も一括して「乳由来レシチン」と称する。
【0034】
乳由来レシチン
乳リン脂質(ミルクレシチン)は、スフィンゴミエリン(SM)、ホスファチジルコリン(PC)、ホスファチジルエタノールアミン(PE)、ホスファチジルイノシトール(PI)、ホスファチジルセリン(PS)、リゾホスファチジルコリン(LPC)からなり、乳脂肪球皮膜(MFGM)のみに局在している。MFGMリン脂質画分の成分組成を表1(乳業技術 Bulletin of Japan Dairy Technical Association, Vol. 50:pp. 58-91, 2000)に示す。
【0035】
ミルクレシチンの特徴は、表1に示すように、大豆レシチンには含まれないSMを多量に含むことである。ミルクレシチンはラットに投与した場合、大豆レシチンに比較して脳および肝臓内のDHA含量を高めること、また、大豆レシチンあるいは卵黄レシチンに比較して高脂血症や脂肪肝の改善に有効であること、が知られている。また、SMがコレステロールの生合成に関与しているHMG-CoAリダクターゼ活性を調節すること、コレステロールの腸管での吸収の調節に関与していることなど、SMがコレステロール代謝に関与していることが知られている。これらのことから、SMがPCやPEの脂質代謝改善効果をさらに高めていると考えられる(佐々木一、Milk Science 51(2): 93-94, 2002)
【0036】
(表1)

【0037】
MFGMを多く含むものとして、限外濾過(ultrafiltration:UF)および精密濾過(microfiltration:MF)の組み合わせで製造されるWPIの副産物(MF保持液)の凍結乾燥物、クリームあるいはバターから無水乳脂肪(anhydrous milk fat:AMF )を除いた画分(バターゼラム)、ホエイクリームからAMFを除いた画分(ホエイクリームゼラム)などがあげられる。これらを原料としてリン脂質濃縮物を得る方法は公知である(例えば特開平7-173182が本発明に包含される)。
【0038】
大豆レシチン
大豆レシチンは天然の食品添加物として、食品分野で広く使われる一方、ポリエンホスファチジルコリンは医薬品(適応:慢性肝疾患における肝機能の改善、脂肪肝、高脂質血症)としても使われている。大豆レシチンの生理作用として、(1) 生体膜の形態と機能の調整、(2) 肺機能改善、(3) 動脈硬化症の改善、(4) 脂質代謝の改善、(5) 肝臓脂質代謝の改善および(6)神経機能の改善・向上、があげられている(食品と開発, Vol. 29(3):18-21, 1994 )。
【0039】
いわゆる「天然系」の一連のレシチン製品に関しては、通常、製品中のPC含量によって序列されている。レシチンの用途に応じてグレートアップした各種のレシチンが製造されている。大豆レシチンの精製、分画による主なPC含量の違いにより、大豆レシチン製品は便宜的に表2のように分類されている(藤川琢馬、油化学 第40巻(10), pp.951-p58, 1991 )。
【0040】
(表2)

【0041】
ミルクレシチンと大豆レシチンはそれぞれ単独でもよく、また組み合わせてもよい。製品100 mL当たり配合量は合計0.1〜0.5 g好ましくは0.2〜0.3 gと考えられる。オレイン酸は含有量は2〜3 g好ましくは、2.1〜2.5 gと考えられる。
【0042】
2-2 その他の脂質
厚生省(厚生労働省)は、飽和脂肪酸(SFA:パルミチン酸、ステアリン酸等):一価不飽和脂肪酸(MUFA:オレイン酸等):多価不飽和脂肪酸(PUFA:リノール酸、リノレン酸等)の望ましい摂取比率を従来の1:1.5:1から3:4:3となるよう、また、n-6系脂肪酸:n-3系脂肪酸の比率が4:1となるよう勧告している。わが国において、MUFAの摂取比を1.5倍まで高めた食生活の実施は難しいということが理由の一つである。そこで、脂質の脂肪酸組成中一価不飽和脂肪酸(MUFA)の含量を高める。そのために一価不飽和脂肪酸であるオレイン酸を脂肪酸組成中30%以上、好ましくは30〜60%配合する。オレイン酸を多く含む脂質源としては、例えば、高オレイン酸のハイオレイックヒマワリ油、ナタネ油、オリーブ油、高オレイン酸ベニバナ油、大豆油、コーン油、パーム油などが挙げられる。またオレイン酸を含む脂質源として栄養調製油脂(日本油脂(株))が挙げられる。ヒマワリ油、ナタネ油、オリーブ油、およびオリーブ油との混合物も用いることができる。オレイン酸の配合量は製品100 g当たり適切な配合量は1〜6 gで選択される。さらに、DHA、EPA、アラキドン酸等の多価不飽和脂肪酸、カプリル酸、カプリン酸、ラウリン酸等の中鎖脂肪酸を加えて、飽和脂肪酸:一価不飽和脂肪酸:多価不飽和脂肪酸の比率を3:4:3に近くなるように調整する。
【0043】
3.糖質および食物繊維
糖質としては、パラチノースを主とする。その他の糖質としては、糖アルコール(ソルビトール、キシリトール、マルチトールなど)、ハチミツ、グラニュー糖、ブドウ糖、果糖、転化などがあげられる。
【0044】
パラチノースは、パラチノースシロップ、還元パラチノースあるいはパラチノース水飴などを含む。パラチノース水飴は、パラチノースの脱水縮合によって生じる四糖、六糖、八糖等のオリゴ糖を主成分とする水飴状の液状物である。パラチノースはショ糖と同様にグルコースとフルクトースに消化されて吸収される(合田敏尚ら、日本栄養・食糧学会誌, Vol. 36(3): 169-173, 1983)が、その加水分解速度がショ糖の1/5と遅い(Tsuji, Y. et al., J. Nutr. Sci. Vitaminol., 32: 93-100, 1986)ために、摂取後の血中グルコースおよびインスリン濃度を一定レベルに長時間維持する(Kawai, K. et al., Endocrinol, Japan, 32(6): 933-936, 1985)。
【0045】
パラチノースの配合量は製品100 mL当たり4〜15 g好ましくは5〜6 gと考えられる。
【0046】
タンパク質、脂質および糖質のエネルギー比率は、第六次改定日本人の栄養所要量にほぼ準ずるが、タンパク質15〜25 kcal、脂質20〜30 kcal、糖質45〜65 kcalと考えられる。
【0047】
食物繊維は水溶性食物繊維および不溶性食物繊維に分けられる。水溶性食物繊維として、難消化性オリゴ糖のラクツロース、ラクチトール、あるいはラフィノースを用いることができる。難消化性オリゴ糖の生理機能としては、未消化物のまま大腸に到達し、腸内ビフィズス菌の活性化および増殖に寄与し、腸内環境の改善すなわち整腸効果を有することが知られている。ラクツロースは、ガラクトースとフルクトースからなる合成二糖類であり、高アンモニア血症用に対する基本的な薬剤として使用される(Bircher, J. et al., Lancet i: 890, 1965 )。慢性肝不全による慢性再発型肝性脳症は、ラクツロースの投与、肝不全用特殊アミノ酸輸液(Fischer液)などに対してよく反応する。第二世代のラクツロースというべきラクチトール(β-galactosyl-sorbitol)の慢性肝性脳症に対する臨床効果はラクツロースと同程度であり(Lanthier, PL.and Morgan, M., Gut, 26: 415, 1985; Uribe, M., et al., Dig. Dis. Sci., 32: 1345, 1987; Heredia, D. et al., J. Hepatol, 7: 106, 1988; Riggio, O., et al., Dig. Dis. Sci., 34: 823, 1989)、現在高アンモニア血症治療剤として用いられている。
【0048】
その他の水溶性食物繊維の候補として、脂質代謝改善作用(コレステロールや中性脂肪の低下)を有するペクチン(プロトペクチン、ペクチニン酸、ペクチン酸)、グアーガム・酵素分解物、タマリンドシードガムなどがあげられる。グアーガム分解物には血糖値上昇抑制作用およびインスリン節約効果もみられる(大和谷一彦ら、日本栄養・食糧学会誌, 46: 199, 1993 )。さらに、水溶性食物繊維の候補として、高分子水溶性食物繊維では、こんにゃくグルコマンナン、アルギン酸、低分子アルギン酸、サイリウム、アラビアガム、海藻多糖類(セルロース、リグニン様物質、寒天、カラギーナン、アルギン酸、フコダイン、ラミナリン)、微生物ガム(ウエランガム、カードラン、キサンタンガム、ジェランガム、デキストラン、プルラン、ラムザンガム)、その他のガム(種子由来のローカストビーンガム、タマリンドガム、タラガム、樹液由来のカラヤガム、トラガントガム)など、低分子水溶性食物繊維のポリデキストロース、難消化性デキストリン、マルチトールなどがあげられる。
【0049】
不溶性食物繊維は、大腸での不消化物のカサを増やし、通過時間を短縮する。その結果排便回数が増し、便量の増加をもたらす。不溶性食物繊維の候補として、セルロース、ヘミセルロース、リグニン、キチン、キトサン、大豆食物繊維、小麦ふすま、パインファイバー、コーンファイバー、ビートファイバーなどがあげられる。
【0050】
4.ビタミン
現在ビタミンは13種類が知られている。そのうち肝臓に深いかかわりをもつことが知られているのは、ビタミンA、B群(B1、B2、ニコチン酸、B6、パントテン酸、葉酸、B12、ビオチン)およびKである。肝障害との関連においては、Aの欠乏症と過剰症、B群の欠乏症、Kの過剰症が主として問題になる。
【0051】
ビタミンAは閉塞性黄疸などで腸管内に胆汁が不足すると吸収率が低下し欠乏が起こる。また、タンパク質低栄養状態では、レチノール結合タンパク質(RBP)の生成が低下するためビタミンAが目標器官に輸送されず、欠乏症状が発現する。非代償性肝硬変などの場合は比較的少量でビタミンAの過剰による中毒症状が発現する。慢性肝疾患ではビタミンB群の利用障害がみられる。ビタミンKは腸内細菌が合成したものも利用されるので、通常、欠乏症はみられないが、閉塞性黄疸などで腸管内に胆汁が不足すると吸収率が低下する。
【0052】
このようにビタミンと肝臓とのかかわりに基づいて、各種ビタミンの適切な量を本栄養組成物に含ませることができる。
【0053】
5.ミネラル
体液管理を行う場合に通常問題となる電解質は、ナトリウム、塩素、カリウム、リン、カルシウムおよびマグネシウムである。ミネラルの処方を組み立てるさいには、(1) 細胞内に取り込まれるミネラルが十分に配分されているか、(2) 患者の内分泌環境が、投与しようとしている栄養基質の量とと種類に十分対応できるか、(3) 腎に対する浸透圧物質負荷量の推測と適正な尿浸透圧を維持するための投与水分量はどうか、の3点に配慮する。
【0054】
鉄、または天然物由来の微量元素、例えばミネラル酵母の銅、亜鉛、セレン、マンガン、クロムなどが含まれる。グルコン酸銅、グルコン亜鉛なども使用可能である。
【0055】
栄養組成物の浸透圧は約300〜1000 mOsm/l、例えば約300〜750 mOsm/lの浸透圧を有することができる。室温で測定する場合、栄養組成物の粘度は、約5〜40 cp(1 cp = 0.001 Pa・s)、好ましくは20未満である。
【0056】
栄養組成物のカロリーは、約1〜2 kcal/ml、好ましくは、1〜1.5 kcal/mlである。
【0057】
栄養組成物は、直接使用できる形態であることが望ましい。この形態で組成物は、経管で鼻−胃、空腸を経て、また、経口摂取することができる。このような栄養組成物は、各種形態、例えば、果実ジュース型飲料、乳シェーク型飲料などであってもよい。また、栄養組成物は、使用前に再構成できる可溶性粉末であってもよい。
【0058】
栄養組成物は、各種フレーバー(例えばバニラなど)、甘味料および他の添加物を含むことができる。人工甘味料、例えばアスパルテームなどが使用できる。
【0059】
また、便臭低減効果のあるシャンピニオンエキスを5 mg〜500 mg(0.005%〜0.5%)、栄養強化の目的でカロチノイド製剤(例えば、α-カロチン、 β-カロチン、リコピン、ルテインなどを含む)を10μg〜200μg (0.00001%〜0.0002%)含ませることもできる。
【0060】
さらにまた、抗酸化剤として、カテキン、ポリフェノールなどを含ませることもできる。
【0061】
栄養組成物は、例えば、表3に示す配合のタンパク質、糖質および脂質を混合することにより製造できる。この場合、乳化剤を混合物に含ませることができる。
【0062】
本発明の栄養組成物の製造は、当業界公知の方法で実施できる。例えば、液状栄養組成物を予め加熱滅菌した後、無菌的に容器に充填する方法(例えば、UHT滅菌法とアセプティック包装法を併用した方法)、また、液状栄養組成物を容器に充填した後、容器とともに加熱滅菌する方法(例えば、オートクレーブ法)などである。
【0063】
使用形態が液状の場合、均質化物は、缶容器に充填しレトルト殺菌を行うか、または、再度、約140〜145℃で約5〜8秒間加熱殺菌後、冷却し、無菌充填を行う。使用形態が粉末の場合、均質化物は例えば噴霧乾燥する。
【0064】
本発明の栄養組成物は、食品タイプとして、急性肝炎(劇症肝炎)、慢性肝炎、代償性肝硬変、非代償性肝硬変の栄養管理に用いることができる。とくに肝性脳症の発現の可能性を有する慢性肝不全の栄養管理に有用である。とくに、食事摂取が可能な慢性肝不全患者の栄養補充に用いることができる。
【0065】
また、本発明の栄養組成物は、手術や感染、熱傷などの侵襲下の患者の栄養管理に用いることができる。
【0066】
本発明の栄養組成物は、肝疾患患者の治療食用食品(肝臓病食)、あるいは経管・経腸栄養組成物としても用いることができる。
【0067】
患者への栄養組成物の給与は、患者の状態、患者の体重、患者の年令および栄養組成物が栄養の唯一のものであるかにより異なる。そしてその給与量は、患者の担当医により決定される。
【実施例】
【0068】
実施例
以下、本発明を実施例および試験例により具体的に説明するが、本発明はこれらに限定されるものではない。
【0069】
[実施例1] ホエイタンパク質加水分解物の調製
乾燥物として約90%のタンパク質含量のホエイタンパク質分離物(WPI、ダビスコ社)を、8%(w/v)のタンパク質含有量で蒸留水に溶解した。溶液は85℃2分間の加熱処理しタンパク質を変性させた。この加熱後の溶液のpHは約7.5であった。加水分解は、アルカラーゼ2.4L(酵素、ノボザイムス社)を基質に対して2.0%の濃度で添加し3時間55℃で反応させた。次に、豚由来のトリプシンである PTN 6.0S(ノボザイムズジャパン)を基質に対して3.0%の濃度で添加し3時間55℃で反応させた。全加水分解時間は6時間であった。反応終了時のpHは約7.0であった。ホエイタンパク質加水分解物は、遠心処理(20,000×g、10分)後、分画分子量10,000のUF膜処理(ミリポア社ウルトラフリー-MC)を行った。
【0070】
透過液(パーミエイト)を逆相HPLCに供した。そのクロマトグラムを図1に示した。
条件
試料 :ホエイタンパク質加水分解物のUFパーミエイト
カラム:C18 SG120(資生堂社)4.6 mmφ×250 mm
溶離液:A;0.1%トリフルオロ酢酸水溶液/アセトニトリル5/95
B;0.1%トリフルオロ酢酸水溶液/アセトニトリル32/68
A→B 60分の直線濃度勾配
流速 :1 mL/min
検出 :215 nm(紫外/可視検出器)
【0071】
[実施例2] 栄養組成物の調製
表3に示す成分を含む栄養組成物を常法により調製した。ホエイタンパク質加水分解物は実施例1で調製したものを用いた。パラチノースは新三井製糖(株)、新調製油脂は日本油脂株式会社、乳由来リン脂質は、例えば、特開平7-173182に記載の方法に準じて得ることができる。以下に一例を述べる。
【0072】
バターゼラム(BAEF)(Corman社)800 gに99.5%エタノール2000 mLを添加し、5 時間攪拌する。吸引濾過し、濾液を減圧濃縮し、粗脂肪160 gを得る。この粗脂肪にアセトン480 mLを添加し、0.5時間攪拌する。吸引濾過し、残渣にアセトン480 mLを添加し、0.5時間攪拌する。吸引濾過し、残渣を真空乾燥して、リン脂質濃縮物50 gを得る。
【0073】
(表3)

【0074】
調製油脂は、ハイオレィックひまわり93%およびしそ油7%からなり、n-6/n-3が1.54である。その組成を表4に示す。
【0075】
(表4)

【0076】
乳由来のリン脂質の組成を表5に示す。
【0077】
(表5)

【0078】
[試験例1a]ガラクトサミン肝障害抑制効果(1)
本発明の栄養組成物および比較対照としてメイバランスCの、ラットガラクトサミン肝炎に対する抑制効果を調べた。メイバランスC(明治乳業株式会社)は、半消化態の総合流動栄養食である。
【0079】
材料および方法
Sprague-Dawley系雄ラット(6週齡、日本SLC(株))を1週間予備飼育後、体重により、表3に示す栄養組成物飼育群(n=8)およびメイバランスC飼育群(n=8)に群分けした。
【0080】
各群に対し、D-ガラクトサミン塩酸塩(D-galactosamine・HCl、和光純薬株式会社)を生理食塩水200 mg/mLで溶解して、その300 mg/kgをラットの腹腔内に投与した(この日を0日目とする)。投与後、飼料を、栄養組成物あるいはメイバランスCに切り替えた。7日目にガラクトサミン塩酸塩600 mg/kgを各群ラットの腹腔内に投与した。9日目に、4時間絶食後、ジエチルエーテル麻酔下、腹部大動脈より採血し、遠心(3,000 rpm、10分間)して血清を得、測定日(翌日)まで−20℃に保存した。血清中のアンモニア濃度は採血日に測定した。また、肝臓および脾臓を摘出し重量を測定した。血清中のAST(GOT)、ALT(GPT)、総タンパク質、アルブミン、アンモニア、コレステロールおよびトリグリセリドの生化学検査的を富士ドライケムを用いて実施した。また、肝重量および脾重量を測定し、剖検した。実験期間中、飼料および水は自由摂取させた。体重および飼料摂取量を測定した。
【0081】
生化学検査の結果は平均±標準誤差で示した。統計的処理は、分散の等しい場合はStudent-t検定、分散が等しくない場合はMann-Whitney検定を用いた。有意水準を5%未満とした。
【0082】
GOTおよびGPTの測定結果を図2に示す。また、体重、餌の摂取量、肝重量、脾重量、総タンパク質、アルブミン、アンモニア、コレステロールおよびトリグリセリドの測定結果を表6にまとめた。
【0083】
(表6)

【0084】
図2に示すように、ガラクトサミン肝障害モデルにおいて、メイバランスC摂取群の血清GOTおよびGPTは上昇したが、栄養組成物摂取群で有意に抑制された。また、栄養組成物摂取群の血清総タンパク質量、アルブミン量、コレステロール量およびトリグリセリド量はメイバランスC群に対して有意に上昇し、アンモニア量は有意(p<0.05)に抑制された。
【0085】
一方、栄養組成物摂取群とメイバランスC群の餌の摂取量はほとんど同一で差は認められないが、栄養組成物摂取群の体重、肝重量および脾臓重量はメイバランスC群のそれらに比較して有意(p<0.05)に増加した。
【0086】
GOTおよびGPTは肝細胞が変性もしくは壊死に至ると血中に逸脱するもので、その血清中の活性を測定することによって、主に臓器障害の程度を把握することが可能である。また、血清総タンパク質量、アルブミン量、コレステロール量およびトリグリセリド量は、必ずしも臓器障害と平行した変動を示すとは限らないが、タンパク質合成や脂質代謝などの予備能を含めた肝の機能的側面に対する効能を評価するのに役立つ。
【0087】
これらの結果から、本発明の栄養組成物は、慢性肝不全の栄養治療に有効であることが期待される。
【0088】
[試験例1b]ガラクトサミン肝障害抑制効果(2)
実験動物は6週齡Balb/cマウスを日本SLC(株)より購入、1週間AIN-93M(オリエンタル酵母社製)で予備飼育後、体重で各群8匹に群分けを行った。群分け後、表7の組成で混合し、缶容器に充填後レトルト殺菌を行い、凍結乾燥した栄養組成物、へパス(森永クリニコ社製)で 8日間飼育した。飼育8日目にPBSに溶かしたD-ガラクトサミン(和光純薬)をマウス体重1kgあたり400 mg、次にLPS(和光純薬)をマウス体重1kgあたり10μgで腹腔内に投与した。投与後8時間後に尾静脈から採血し、翌日にエーテル麻酔下で動脈から採血を行った。飼料と水は自由摂取とした。血液は遠心を行い血清を分離し、富士ドライケムでGOT、GPTを測定した。結果は平均±SEで示し、Mann-Whitney検定を用い有意差検定を行った(*:p<0.05)。
【0089】
(表7)肝疾患患者用流動食配合組成

【0090】
現在、肝疾患患者用流動食として市場に市販されているのはへパスだけである。肝疾患患者用流動食として市場に市販されているへパスと表7に示す組成で調製した肝疾患患者用流動食の効果を比較した。マウスにガラクトサミンとLPSを腹腔内に投与し、8、24時間後GOT、GPT値を調べた。その結果、図3に示すとおりヘパスではGOT、GPT共に上昇が認められ肝炎が誘導された。一方、肝疾患患者用流動食はへパスに対し有意にGOT、GPTの上昇が抑制された。
【0091】
以上の結果から、へパスは肝炎抑制効果が認められなかった。一方、肝疾患患者用流動食はガラクトサミン/LPS誘発マウス肝炎モデルにおいても肝炎抑制効果があることが確認された。
【0092】
[試験例1c]ウイルス・自己免疫性肝障害抑制効果
実験動物は6週齡Balb/cマウスを日本SLC(株)より購入、1週間AIN-93Mで予備飼育後、体重で各群10匹に群分けを行った。群分け後、WPI(Davisco社)、実施例1で作製したホエイタンパク質加水分解物を飼料中蛋白質含量の25或いは50%の割合でAIN-93M(14%カゼインを含む)中のカゼインと置換した実験飼料に変え14日間飼育した。飼育14日目にPBSに溶かしたConA(Sigma)をマウス体重1kgあたり15 mgになるように静脈に注射した。投与後2、4、8時間後に尾静脈から採血し、翌日にエーテル麻酔下で動脈から採血を行った。飼料と水は自由摂取とした。血液は遠心を行い血清を分離し、富士ドライケムでGOT、GPTを測定した。サイトカインはTNF-αをELISA法(Amersham、Bioscience社)で測定した。結果は平均±SEで示し、Mann-WhitneyのU検定を用い有意差検定を行った(*:p<0.05)。
【0093】
カゼイン添加群ではConA投与後8から24時間で肝炎の指標であるGOT、GPTが上昇した。一方、WPI添加群及びホエイタンパク質加水分解物添加群でGOT、GPTの上昇が有意に抑制された(図4および5)。25%のホエイタンパク質加水分解物添加群で50%WPI添加群と同等かそれ以上の効果が認められたことから、WPIのホエイタンパク質分解物にはWPI以上の効果が期待できる。同じ個体で、サイトカインの産生についても同時に調べた。その結果、カゼイン添加群ではConA投与2時間後に血清のTNF-α濃度が上昇し、4時間後には低下した(図6)。ConA投与2時間後のTNF-α濃度はカゼイン群に比べWPI添加群とホエイタンパク質加水分解物添加群で有意に低い値を示した。WPI及びホエイタンパク質分解物にはTNF-αの分泌を抑制する作用があることが確認された。この様なサイトカインの産生抑制作用により、肝炎の誘導が抑制され、GOT、GPTの上昇を抑制したと考えられる。以上の様に、ConA誘発肝障害モデルにおいて、WPIのホエイタンパク質加水分解物に肝障害抑制効果が認められた。
【0094】
[試験例2]ホエイタンパク質加水分解物の抗炎症作用
方法
6週齢のICR系雄マウス(日本エスエルシー(株))を1週間予備飼育後、体重の平均値が等しくなるように3群(各群6匹)に分けた。タンパク質源として、100%カゼイン(対照群)、50%カゼイン+50% WPI(Davisco Foods社)、あるいは50%カゼイン+50%ホエイタンパク質加水分解物(実施例1で調製したもの)を精製飼料(AIN93M)に14%(重量)添加した実験飼料を各群に与え7日間飼育した。
【0095】
飼育後マウスの腹腔内にリポ多糖(LPS)を1.4μg/g体重の用量で投与した。90分後に眼窩採血し、遠心操作(10,000×g、15分間)により血清を得た。血清中のTNF-αおよびIL-6をELISAキット(Amersham bioscience社)により測定した。Fisher PLSDにより群間の有意差検定を行った。血清中のTNF-α濃度を図7に、IL-6濃度を図8に示す。
【0096】
結果
LPS投与後のTNF-α産生量は、カゼイン群(対照群)に対して、WPI群では抑制傾向がみられ、ホエイタンパク質加水分解物群では有意(p=0.033)に抑制された(図7)。
【0097】
一方、IL-6の産生量は、カゼイン群(対照群)に対して、WPI群では抑制傾向がみられ、ホエイタンパク質加水分解物群では有意(p=0.0002)に抑制された(図8)。
【0098】
以上の結果から、ホエイタンパク質加水分解物を経口摂取すると、その後のLPS刺激によるTNF-αおよびIL-6産生を有意に抑制することが見出されたので、ホエイタンパク質加水分解物の配合量を種々変えてTNF-α産生抑制効果を調べた。
【0099】
すなわち、タンパク質源として、100%カゼイン、80%カゼイン+20%ホエイタンパク質加水分解物、70%カゼイン+30%ホエイタンパク質加水分解物、および50%カゼイン+50%ホエイタンパク質加水分解物について同様の実験を行った。F検定後、Bonferroni/Dunn検定により群間の有意差検定を行った。結果を図9に示す。
【0100】
LPS投与後のTNF-α産生量は、カゼイン群に対して、20%ホエイタンパク質加水分解物群で抑制傾向がみられ、30%ホエイタンパク質加水分解物群および50%ホエイタンパク質加水分解物群で有意(p=0.0496およびp=0.0479)に抑制された。
【0101】
考察
1.肝疾患とTNF-αとの関連について
TNF-α、IL-1、IL-6は炎症や免疫反応に際し、主にマクロファージ系細胞と内皮細胞により産生され、それ自身が発熱物質として作用するとともに肝細胞に直接働き、急性期タンパク質(CRP)の産生を促す(Hepatology 23: 909-916, 1996;J. Immunol., 146: 3032-3037, 1991;Intensive Care Med., 24: 224-229, 1998;Hepatology 9: 497-499, 1989)。
【0102】
とくに、急性肝炎(とりわけ劇症肝炎)やアルコール性肝障害などの病態では、発熱、白血球増多、CRP陽性など炎症性サイトカインの関与を示す所見を認める。
【0103】
TNF-αは、エンドトキシン刺激によりマクロファージから産生され、多臓器不全を誘導することがある(「肝不全−基礎と臨床」日本医事新報社, 東京, 1994, pp30-46;「肝不全−基礎と臨床」日本医事新報社, 東京, 1994, pp123-137)。実際、劇症肝炎患者では網内系機能の低下があり、高エンドトキシン血症の続発がしばしば観察され、TNF-αやIL-1の産生が生体内で亢進していると考えられている(Lancet 2: 72-74, 1988)。劇症肝炎患者血中の炎症性サイトカイン濃度は急性肝炎に比べ、ほとんど有意に上昇し、とくにTNF-αとIL-6濃度は、肝再生の指標とされるヒト肝細胞増殖因子(HGF)のそれとよい相関を示す(Clin. Exp. Immunol., 98: 71-77, 1994)。
【0104】
一方、慢性肝疾患である肝硬変患者の炎症性サイトカインの血中濃度は、非肝硬変患者のそれに比べて有意に高いこと、また、病因にかかわらず炎症より肝機能障害を反映している可能性が示されている(Gastroenterology 103: 264-274, 1992)。B型慢性肝炎患者のIL-1産生は亢進しており、肝線維化の程度とよい相関を認め、IL-1が肝硬変への進展に重要であるとする報告がある(Gastroenterology 94: 999-1005, 1988)。
【0105】
肝疾患とIL-6との関連について
アルコール性肝硬変では、血中IL-6値と末梢血単核球のIL-6産生は増えており、その程度はIgA値と正の、IL-2やIFN-γ産生とは負の相関を示す(Clin. Exp. Immunol., 77: 221-225, 1989)。慢性肝炎の急性増悪時にも血中IL-6活性は上昇しており(Am. J. Gastroenterol., 86: 1804-1808, 1991)、血中IL-6値と末梢血単核球の非刺激時のIL-6産生は、それぞれ肝内の炎症の程度をよく反映するものと思われる。
【0106】
急性ウイルス性肝炎では、IL-6は、類洞壁内皮細胞、クッパー細胞、侵潤単核球に検出され(J. Clin. Pathol., 45: 408-411, 1992)、慢性肝炎では、主に門脈域の侵潤リンパ球や線維芽細胞に検出される。したがって、IL-6の発現は、急性および慢性肝疾患において、病因にかかわりなく炎症と免疫反応に密接に関連すると推定される。IL-6は肝細胞の再生を促進するとともに、過剰の産生は組織障害や線維化を誘導する可能性がある。
【0107】
2.栄養投与経路とサイトカイン産生
サイトカインによる侵襲時の代謝異常や臓器障害を防止するには局所のサイトカインは正常に産生させるが、全身へのこの波及を防止することは合理的と考えられる。そこで、栄養投与経路の相違で侵襲時のサイトカイン産生を修飾することが可能かどうかについて議論がなされている。侵襲のない健康成人では経腸栄養あるいは経静脈栄養の1週間の施行で、血中のTNFやIL-6値に明らかな相違は生じない(New Horizon 2: 164-174, 1994)。しかし、健康成人で経腸栄養あるいは経静脈栄養の7日間施行した後、エンドトキシンを静注すると、そのさいの発熱やTNF、侵襲ホルモン分泌などの全身生体反応は経静脈栄養より経腸栄養で軽微であることが報告されている(Ann. Surg., 210: 449-457, 1989)。斉藤らも栄養投与経路の異なる腹腔内細菌投与ラットを用いて、栄養投与経路とサイトカイン産生の関係を検討した結果、経腸栄養では経静脈栄養に比べて、サイトカイン産生の修飾が生体反応にとって有利な方向に向かうことを確認している(Ann. Surg., 223: 84-93, 1996)。
【0108】
3.栄養組成物と肝障害抑制効果の関連について
本発明の栄養組成物を経口摂取すると、エンドトキシン誘導性のTNF-αおよびIL-6の血中濃度上昇が有意に抑制された。その抑制作用は、主として栄養組成物中に含まれるホエイタンパク質加水分解物によるものであり、血中におけるTNF-αおよびIL-6濃度上昇抑制は経口摂取による修飾によるものと考えられる。
【0109】
産業上の利用可能性
本発明の栄養組成物は、急性肝炎(劇症肝炎)、慢性肝炎、代償性肝硬変、非代償性肝硬変の栄養管理に有用である。とくに肝性脳症の発現の可能性を有する慢性肝不全の栄養管理に有用である。慢性肝不全において、食事摂取が可能な例では、摂取タンパク質量の制限が基本である。しかし高度のタンパク質制限が長期間に及ぶと食欲を阻害し、タンパク質の異化を亢進させ、低栄養状態をさらに悪化させる。そこで何らかの栄養補充が必要となる。本発明の食品タイプの栄養組成物は食品タイプであり、栄養組成物を毎食に付加給与することのより、慢性肝不全の栄養状態の改善が期待できる。
【0110】
また、本発明の栄養組成物は、手術や感染、熱傷などの侵襲下の患者の栄養管理に有用である。
【特許請求の範囲】
【請求項1】
タンパク質として乳タンパク質の加水分解物および発酵乳由来タンパク質、脂質として高オレイン酸含有油脂ならびにミルクレシチン及び/又は大豆レシチン、および糖質としてパラチノースを含む、肝疾患患者用栄養組成物。
【請求項2】
乳タンパク質が、カゼイン、乳タンパク質濃縮物(MPC)、ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン、β-ラクトグロブリンおよびラクトフェリンからなる群より選択される、請求項1記載の肝疾患患者用栄養組成物。
【請求項3】
発酵乳由来タンパク質が発酵乳よりホエイを減少させた組成物に由来する、請求項1記載の肝疾患患者用栄養組成物。
【請求項4】
発酵乳由来タンパク質がフレッシュチーズに由来する、請求項1記載の肝疾患患者用栄養組成物。
【請求項5】
フレッシュチーズがクワルクである、請求項4記載の肝疾患患者用栄養組成物。
【請求項6】
乳タンパク質の加水分解物が、ホエイタンパク質分離物(WPI)をバシラス・リシェニフォルムス(Bacillus licheniformus)由来のアルカラーゼで加水分解およびブタ膵臓由来のトリプシンで加水分解して得られうる、請求項1記載の肝疾患患者用栄養組成物。
【請求項7】
分画分子量10,000の限外濾過膜でさらに処理して得られる透過画分(パーミエイト)である、請求項6記載の肝疾患患者用栄養組成物。
【請求項8】
逆相HPLCで分離したときのクロマトグラムが図1で示される、請求項7記載の肝疾患患者用栄養組成物。
【請求項9】
タンパク質として乳タンパク質の加水分解物および発酵乳由来タンパク質、脂質として高オレイン酸含有油脂ならびにミルクレシチン及び/又は大豆レシチン、および糖質としてパラチノースを含む、生体高度侵襲患者用栄養組成物。
【請求項10】
乳タンパク質が、カゼイン、乳タンパク質濃縮物(MPC)、ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン、β-ラクトグロブリンおよびラクトフェリンからなる群より選択される、請求項9記載の生体高度侵襲患者用栄養組成物。
【請求項11】
発酵乳由来タンパク質が発酵乳よりホエイを減少させた組成物に由来する、請求項9記載の生体高度侵襲患者用栄養組成物。
【請求項12】
発酵乳由来タンパク質がフレッシュチーズに由来する、請求項9記載の生体高度侵襲患者用栄養組成物。
【請求項13】
フレッシュチーズがクワルクである、請求項12記載の生体高度侵襲患者用栄養組成物。
【請求項14】
乳タンパク質の加水分解物が、ホエイタンパク質分離物(WPI)をバシラス・リシェニフォルムス由来のアルカラーゼで加水分解およびブタ膵臓由来のトリプシンで加水分解して得られうる、請求項9記載の生体高度侵襲患者用栄養組成物。
【請求項15】
分画分子量10,000の限外濾過膜でさらに処理して得られる透過画分(パーミエイト)である、請求項14記載の生体高度侵襲患者用栄養組成物。
【請求項16】
逆相HPLCで分離したときのクロマトグラムが図1で示される、請求項15記載の生体高度侵襲患者用栄養組成物。
【請求項1】
タンパク質として乳タンパク質の加水分解物および発酵乳由来タンパク質、脂質として高オレイン酸含有油脂ならびにミルクレシチン及び/又は大豆レシチン、および糖質としてパラチノースを含む、肝疾患患者用栄養組成物。
【請求項2】
乳タンパク質が、カゼイン、乳タンパク質濃縮物(MPC)、ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン、β-ラクトグロブリンおよびラクトフェリンからなる群より選択される、請求項1記載の肝疾患患者用栄養組成物。
【請求項3】
発酵乳由来タンパク質が発酵乳よりホエイを減少させた組成物に由来する、請求項1記載の肝疾患患者用栄養組成物。
【請求項4】
発酵乳由来タンパク質がフレッシュチーズに由来する、請求項1記載の肝疾患患者用栄養組成物。
【請求項5】
フレッシュチーズがクワルクである、請求項4記載の肝疾患患者用栄養組成物。
【請求項6】
乳タンパク質の加水分解物が、ホエイタンパク質分離物(WPI)をバシラス・リシェニフォルムス(Bacillus licheniformus)由来のアルカラーゼで加水分解およびブタ膵臓由来のトリプシンで加水分解して得られうる、請求項1記載の肝疾患患者用栄養組成物。
【請求項7】
分画分子量10,000の限外濾過膜でさらに処理して得られる透過画分(パーミエイト)である、請求項6記載の肝疾患患者用栄養組成物。
【請求項8】
逆相HPLCで分離したときのクロマトグラムが図1で示される、請求項7記載の肝疾患患者用栄養組成物。
【請求項9】
タンパク質として乳タンパク質の加水分解物および発酵乳由来タンパク質、脂質として高オレイン酸含有油脂ならびにミルクレシチン及び/又は大豆レシチン、および糖質としてパラチノースを含む、生体高度侵襲患者用栄養組成物。
【請求項10】
乳タンパク質が、カゼイン、乳タンパク質濃縮物(MPC)、ホエイタンパク質濃縮物(WPC)、ホエイタンパク質分離物(WPI)、α-ラクトアルブミン、β-ラクトグロブリンおよびラクトフェリンからなる群より選択される、請求項9記載の生体高度侵襲患者用栄養組成物。
【請求項11】
発酵乳由来タンパク質が発酵乳よりホエイを減少させた組成物に由来する、請求項9記載の生体高度侵襲患者用栄養組成物。
【請求項12】
発酵乳由来タンパク質がフレッシュチーズに由来する、請求項9記載の生体高度侵襲患者用栄養組成物。
【請求項13】
フレッシュチーズがクワルクである、請求項12記載の生体高度侵襲患者用栄養組成物。
【請求項14】
乳タンパク質の加水分解物が、ホエイタンパク質分離物(WPI)をバシラス・リシェニフォルムス由来のアルカラーゼで加水分解およびブタ膵臓由来のトリプシンで加水分解して得られうる、請求項9記載の生体高度侵襲患者用栄養組成物。
【請求項15】
分画分子量10,000の限外濾過膜でさらに処理して得られる透過画分(パーミエイト)である、請求項14記載の生体高度侵襲患者用栄養組成物。
【請求項16】
逆相HPLCで分離したときのクロマトグラムが図1で示される、請求項15記載の生体高度侵襲患者用栄養組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2011−6425(P2011−6425A)
【公開日】平成23年1月13日(2011.1.13)
【国際特許分類】
【出願番号】特願2010−164805(P2010−164805)
【出願日】平成22年7月22日(2010.7.22)
【分割の表示】特願2004−555008(P2004−555008)の分割
【原出願日】平成15年11月21日(2003.11.21)
【出願人】(000006138)明治乳業株式会社 (265)
【Fターム(参考)】
【公開日】平成23年1月13日(2011.1.13)
【国際特許分類】
【出願日】平成22年7月22日(2010.7.22)
【分割の表示】特願2004−555008(P2004−555008)の分割
【原出願日】平成15年11月21日(2003.11.21)
【出願人】(000006138)明治乳業株式会社 (265)
【Fターム(参考)】
[ Back to top ]

