核酸の分離精製方法および当該方法を利用した核酸分離キット
【課題】生体試料からの核酸分離において、簡便に、かつ、高収量、高濃度、高純度および長鎖の核酸を分離精製する方法および試薬、および、当該方法を利用した核酸分離キットを提供すること。
【解決手段】(a)生体試料に、緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬を添加し、生体試料を溶解させる工程、(b) 工程(a)で得られた溶液に、1種または2種以上のアルコールを含有する核酸析出試薬を添加し、核酸を析出させる工程、(c) 工程(b)で得られた核酸析出物を含む生体試料溶液から、核酸析出物を回収する工程、(d) 工程(c)で回収した核酸析出物に、核酸洗浄試薬を添加し、核酸析出物を洗浄する工程、(e) 工程(d)の洗浄後の核酸析出物に、核酸溶解試薬を添加し、核酸析出物を溶解させる工程、および、(f) 工程(e)で得られた核酸溶液を回収する工程、を含む、生体試料からの核酸の分離精製方法を提供する。
【解決手段】(a)生体試料に、緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬を添加し、生体試料を溶解させる工程、(b) 工程(a)で得られた溶液に、1種または2種以上のアルコールを含有する核酸析出試薬を添加し、核酸を析出させる工程、(c) 工程(b)で得られた核酸析出物を含む生体試料溶液から、核酸析出物を回収する工程、(d) 工程(c)で回収した核酸析出物に、核酸洗浄試薬を添加し、核酸析出物を洗浄する工程、(e) 工程(d)の洗浄後の核酸析出物に、核酸溶解試薬を添加し、核酸析出物を溶解させる工程、および、(f) 工程(e)で得られた核酸溶液を回収する工程、を含む、生体試料からの核酸の分離精製方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は生体試料などから核酸を分離精製する方法に関する。特に、核酸分離後に引き続き実施されるサザンブロッティング法やPCR法などの種々アプリケーションに対して十分な収量および純度を有する核酸を分離精製する方法に関する。
【背景技術】
【0002】
血液などの生体試料から核酸を分離精製する手段としては、一般的に、タンパク質等の核酸以外の夾雑物を沈殿させて除去した後に、核酸を沈殿させて遠心分離機で回収するといった方法が適用されている。
【0003】
例えば、血液から核酸分離を実施する場合、以下のような方法が従来から行われている。先ず初めに有核細胞すなわち白血球細胞を得るために赤血球除去操作を行う。この赤血球除去操作は、一般的には塩濃度0.9%以下の塩化ナトリウム水溶液あるいは塩化アンモニウム水溶液等の低塩濃度の水溶液を添加し、浸透圧を利用して赤血球の細胞膜を破壊した後、遠心分離等の固液分離操作を行い、ピペット吸引操作あるいはデカンテーション操作により赤血球成分を含む溶液を除去し、白血球細胞を回収するというものである。次に、白血球細胞核中に含まれる核酸を白血球細胞懸濁液中に溶出させるために、界面活性剤やカオトロピック試薬を添加して白血球細胞および細胞核を溶解する。この溶解液中には目的とする核酸のほか、タンパク質および脂質といった夾雑物が混在している。次に、プロテイナーゼK(proteinaseK)に代表されるようなタンパク質分解酵素を添加し、室温あるいは37℃〜65℃で数分〜数時間放置することで残存タンパク質を微細化した後、これら夾雑物を除去するためにフェノールおよびクロロホルム等の有機溶剤を添加し液液分離を行う。
【0004】
このように液液分離した際、目的とする核酸は水溶性のため水溶液側に溶解しており、一方、脂質は非水溶性のため有機溶剤側に溶解している。また、タンパク質は親水基および疎水基の両方を持ち備えている性質上、水溶液と有機溶剤の界面に析出する。目的とする核酸を含む水溶液は、比重の関係から、有機溶剤および析出したタンパク質の上部に位置しており、この核酸を含む水溶液をピペット吸引等で回収する。さらに、回収した核酸溶液に残存するタンパク質を除去する目的で、回収した核酸溶液にその後、核酸を含む溶液から核酸のみを回収するために、核酸を含む溶液に数%の塩と約70%以上の濃度のアルコール溶液を添加し、撹拌することで、塩析効果により核酸のみが析出する。核酸の回収には、一般的に0.1体積の3M酢酸ナトリウム水溶液と1.5〜2体積の99.5%エタノールあるいは0.6〜1.0体積の99.5%イソプロピルアルコールが用いられる。
次に、遠心分離等の固液分離法により核酸析出物を含む溶液から核酸析出物を回収する。得られた核酸析出物を70%エタノール等で数回洗浄後、減圧乾燥等で少量の残存アルコールを除去する。最後に得られた核酸沈殿に、水あるいは低塩濃度バッファー等を添加し、核酸溶液を得る。
【0005】
また、特許文献1および2に代表されるような、シリカやその誘導体あるいは核酸吸着性能を持った化学繊維などの吸着固相担体を使用した核酸の分離精製法も数多く報告されており、上記方法に適応した各種キットや自動化装置も数多く存在する。
【0006】
このような吸着固相担体を使用した核酸の分離精製法は、核酸がカオトロピック塩の存在下において、シリカやその誘導体あるいは核酸吸着性能を持った化学繊維などの吸着固相担体に吸着しやすいという性質を利用している。例えば、血液から核酸分離を実施する場合、先ず初めに、血液にカオトロピック試薬および界面活性剤等を添加して、血液中の細胞を全て溶解する。次に、溶解した血液溶液をシリカやその誘導体あるいは核酸吸着性能を持った化学繊維などの吸着固相担体と接触させることにより、核酸を吸着固相担体に吸着する。吸着固相担体の形状としては、シリカやその誘導体あるいは核酸吸着性能を持った化学繊維などをフィルター状に成形したもの、あるいはカラム充填したものが一般的である。また、特許文献3に示されるように、シリカやその誘導体を磁性粒子にコーティングした形状のものも存在する。
【0007】
核酸と吸着固相担体との接触方法は、フィルター形状あるいはカラム形状の場合、フィルターあるいはカラムの一方から血液溶液を添加し、遠心、加圧、吸引等の操作により、血液溶液とフィルターあるいはカラムとを接触させ、血液溶液を添加した側と反対の方向から核酸吸着後の血液溶液を除去する方法が一般的である。また、磁性粒子状のものを使用する場合は、マイクロチューブ等の、一方が開口可能であり他方が閉塞した容器中に、血液溶液と磁性粒子を懸濁させ磁性粒子表面に核酸を吸着させる。懸濁後、磁性を利用して磁石等で核酸を吸着した磁性粒子を回収する方法が一般的である。
【0008】
いずれの方法においても、核酸を吸着した吸着固相担体を、数回程度アルコール溶液や比較的高濃度の塩を含む水溶液等で洗浄を行う。洗浄操作は核酸吸着操作の場合と同様の操作で実施される。洗浄後、吸着固相担体に吸着した核酸を溶出するため、吸着操作の場合と同様の操作で、水あるいは低塩濃度の水溶液を吸着固相担体に接触させることにより核酸溶液を得る。
【0009】
しかしながら、上記方法は少なからずデメリットを有し、必ずしも最適な方法とは言い難い。例えば、タンパク質等の夾雑物を沈殿除去する方法では、高収量、高濃度、高純度および長鎖の核酸が得られるものの、一般的にはフェノールおよびクロロホルムを使用するため、人体への悪影響が懸念されるとともに、廃液処理にも細心の注意を払う必要がある。また、有核細胞の回収操作、夾雑物の沈殿除去操作および核酸の洗浄操作等の複数の操作が必要であること、かつ、1つの操作毎に誤操作、コンタミネーションおよび感染等に細心の注意が必要であることから非常に煩雑な操作である。
【0010】
一方、吸着固相担体を利用した場合、夾雑物の沈殿除去操作等が不要なため、操作の煩雑性は軽減され、比較的短時間で核酸を回収することが可能であるものの、核酸の吸着或いは溶離が不十分なことが多く、核酸の低収量および低濃度が懸念される。さらに、磁性粒子による吸着固相分離においては、核酸を吸着した各粒子が頻繁に接触するため核酸の細分化が顕著になり、核酸を長鎖のまま吸着、回収することは困難である。
【0011】
以上のように、吸着固相担体を利用した核酸分離精製法では、操作の簡便性は認められるものの、回収される核酸の品質が劣る場合が多々見受けられる。
【特許文献1】特許第2680462号公報
【特許文献2】特公平第7-130772号公報
【特許文献3】特許第2965131号公報
【発明の開示】
【発明が解決しようとする課題】
【0012】
上記の問題に鑑み、本発明は、生体試料からの核酸分離において、簡便に、かつ、高収量、高濃度、高純度にて比較的長鎖の核酸を分離精製する方法および試薬、および、当該方法を利用した核酸分離キットを提供することを目的とする。
【0013】
さらに本発明の目的は、かかる方法を、キット提供や自動化装置に適応させることで、さらなる簡便性および信頼性を提供することである。
【課題を解決するための手段】
【0014】
本発明者らは、核酸分離精製操作の簡便化を図り、かつ、高収量、高濃度、高純度および長鎖の核酸を分離精製する、生体試料から直接核酸のみを析出させて分離精製する方法を完成させた。本発明の方法は、核酸を選択的に析出させ、析出した核酸を固液分離の原理を利用して効率的に回収するものである。
【0015】
即ち本発明は、
(a)生体試料に、緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬を添加し、生体試料を溶解させる工程、
(b) 工程(a)で得られた溶液に、1種または2種以上のアルコールを含有する核酸析出試薬を添加し、核酸を析出させる工程、
(c) 工程(b)で得られた核酸析出物を含む生体試料溶液から、核酸析出物を回収する工程、
(d) 工程(c)で回収した核酸析出物に、核酸洗浄試薬を添加し、核酸析出物を洗浄する工程、
(e) 工程(d)の洗浄後の核酸析出物に、核酸溶解試薬を添加し、核酸析出物を溶解させる工程、および、
(f) 工程(e)で得られた核酸溶液を回収する工程、
を含む、生体試料からの核酸の分離精製方法を提供する。
【0016】
さらに本発明は、
緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬、および
1種または2種以上のアルコールを含有する核酸析出試薬、
を含む核酸分離試薬キットも提供する。
【0017】
即ち、本発明は生体試料から核酸を分離する方法およびその方法に使用する試薬を提供するものである。さらには、該試薬類等をキット化することにより、核酸分離精製の更なる簡便性および信頼性を追及し、ひいては自動化装置適応への可能性を拓くものである。
【発明の効果】
【0018】
本発明によると、直接核酸のみを選択的に析出させることにより、高収量、高濃度、高純度にて比較的長鎖の核酸が分離精製可能となる。
【0019】
さらに、本発明の核酸分離精製方法に使用する試薬類や固液分離デバイスをキット化することにより、操作の効率化が促進されると同時に、コンタミネーションおよび感染等のリスクが低減される。
【0020】
一般に、固相吸着法による核酸の分離精製法においては、核酸の固相担体への吸着および溶離の際に、吸着ロスおよび溶離ロスが生じ易いため、本発明法のような核酸を析出させて回収する方法に比べて低収量の傾向がある。さらに、固相吸着法においては、できる限り多くの収量を確保するために、溶離液の量を多くする、または溶離工程を複数回実施するなどの手法が用いられる場合がある。しかし、このような溶離操作を実施すると、核酸の収量は増すが、核酸濃度が低くなるために、高濃度の核酸溶液を得る場合には、引き続き濃縮操作が必要となり煩雑さが増すため最適な方法とは言い難い。
【0021】
本発明法によれば、従来の方法のように、収量に影響を与えるようなロスが生じる操作が無く高収量となる。さらに、核酸沈殿を溶解させる液量は任意で良いため、核酸溶液濃度を自由に調整可能である。
【0022】
さらに、ゲノムマッピングに代表されるような長鎖のゲノムDNAが要求される場合においても、固相吸着法は最適な方法とは言い難い。一般的に、吸着プロセスを経由する方法は、吸着担体の保持能力の限界、および物理的衝撃によるゲノムDNAの切断、といった問題から長鎖のゲノムDNAを得ることが困難である。本発明法は、吸着プロセスではなく析出回収プロセスであるため上記の問題が発生し難く、比較的長鎖のゲノムDNAが回収可能となる。
【発明を実施するための最良の形態】
【0023】
本発明において、生体試料とは、核酸を含むいずれの生物由来の試料であってもよく、例えば、血液やその他細胞を含む試料が含まれる。血液としては、全血のみならず、血清、血漿、および白血球懸濁液が挙げられる。細胞としては、組織片、培養細胞、口腔粘膜細胞などが挙げられる。生体試料には必要に応じて、抗凝固剤を添加してもよい。例えば、全血を用いる場合、あらかじめEDTA-2Na等の抗凝固剤を試料に添加することが好ましい。
【0024】
用いる生体試料の量は、生体試料の種類、得ようとする核酸の量によって異なり、特に限定されない。例えばPCRの目的で全血から核酸を分離精製する場合、全血10〜100μl程度を用いればよい。
【0025】
以下、本発明の方法を工程順に説明する。
【0026】
まず、工程(a)について説明する。工程(a)は、生体試料に、緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬を添加し、生体試料を溶解させる工程である。
【0027】
生体試料溶解試薬は、緩衝剤、界面活性剤およびカオトロピック剤を含有する水溶液である。
【0028】
生体試料溶解試薬に含有される緩衝剤の種類としては、トリスヒドロキシアミノメタン、リン酸カリウム、リン酸ナトリウムなどが挙げられ、好ましくはトリスヒドロキシアミノメタンである。生体試料溶解試薬中の緩衝剤の濃度は、1mM〜1M、好ましくは10mM〜500mMの範囲である。例えば、緩衝剤としてトリスヒドロキシアミノメタンを用いる場合、その終濃度が15mM以上、好ましくは20〜80mMの範囲になるように調整される。
【0029】
生体試料溶解試薬に含有される界面活性剤としては、陽イオン性、陰イオン性、両イオン性、および非イオン性のいずれも好適に用いられるが、特に好ましくは非イオン性界面活性剤である。例えば非イオン性界面活性剤であるTritonX-100を用いる場合、その終濃度が0.5〜4.0%、好ましくは0.8〜3.0%の範囲になるように調整される。
【0030】
生体試料溶解試薬に含有されるカオトロピック剤の種類としては、グアニジウム塩、ヨウ化ナトリウム、ヨウ化カリウム、(イソ)チオシアン酸ナトリウム、尿素などが挙げられ、好ましくはグアニジウム塩である。カオトロピック剤の濃度は、その種類によって適宜定められるが、例えば、カオトロピック剤としてグアニジン塩酸塩を用いる場合、その終濃度が2.0〜5.0M、好ましくは2.5〜3.5Mの範囲になるように調整される。
【0031】
生体試料溶解試薬に含まれる各成分の組成比は、各成分の種類、生体試料の種類、反応時間、反応温度などにより適宜定めればよい。例えば、実施例1の表1に示すものが特に好ましく例示される。
【0032】
本発明の生体試料溶解溶液のpHはDNAの損傷を防止するため、pH7.5〜8.5の中性範囲に調整されるのが好ましい。
【0033】
生体試料溶解試薬の、生体試料に対する添加量は、試料の種類あるいは試薬の組成によって適宜定めればよい。例えば実施例の表1に示す組成の生体試薬溶解試薬を使用し、血液を生体試料として用いる場合、血液量に対して体積比で1.5〜3.0倍量を添加するのが好ましい。反応時間は生体試料溶解試薬の添加量に応じて適宜定めればよい。
【0034】
工程(a)において、生体試料および生体試料溶解試薬を反応させる容器としては例えば、マイクロチューブ等の一方が開閉可能であり、他方が閉塞した形状が挙げられるがこれに限定されるものではない。
【0035】
なお工程(a)において、必要に応じてタンパク質分解酵素を添加してもよい。タンパク質分解酵素は、生体試料溶解試薬と同時に、あるいはその前後に添加しても良い。タンパク質分解酵素は特に限定されないが、例えばプロテイナーゼK、プロナーゼが挙げられ、好ましくはプロテイナーゼKである。タンパク質分解酵素はその種類に応じて適宜、添加量、反応時間および反応温度を適宜調整すれば良い。例えば、生体試料量として血液を用い、20mg/mlに調整されたプロテイナーゼKを添加する場合は、その添加量は、血液に対して体積比で0.01倍以上、好ましくは0.02〜0.05倍、より好ましくは0.03倍量用いるとよい。
【0036】
工程(a)において、タンパク質分解酵素を添加する場合の反応温度と反応時間は、例えば、反応温度を20℃程度に設定した場合には反応時間を60分以上に設定する、といったようにタンパク質分解酵素のタンパク質分解能力および添加量に応じて適宜決定すれば良い。好ましくは37〜80℃で1〜60分、さらに好ましくは、65℃、10分である。この場合も撹拌することが好ましい。
【0037】
生体試料溶解試薬には、上記のほか例えばRNA分解酵素を添加してもよい。
【0038】
工程(b)は、上記工程(a)で得られた溶液に1種または2種以上のアルコールを含有する核酸析出試薬を添加し、核酸を析出させる工程である。
【0039】
核酸析出試薬は1種または2種以上のアルコールを含有する溶液であり、アルコールとしてはエチルアルコール、イソプロピルアルコール、ブチルアルコール、メチルアルコール、イソアミルアルコールなどの脂肪族アルコールが挙げられる。好ましくは少なくともブチルアルコールあるいはイソアミルアルコールのいずれかを含む2種以上のアルコールの混合液、更に好ましくはブチルアルコールを含む2種以上のアルコールの混合液を用いる。核酸析出試薬はアルコール以外の成分、例えば水を含んでいてもよい。核酸析出試薬としては、好ましくはイソプロピルアルコールとブチルアルコールを各50%含むものが用いられる。
【0040】
例えば、工程(a)において、実施例1の表1の組成の生体試料溶解試薬を用いる場合、工程(b)の核酸析出試薬の組成はイソプロピルアルコールとブチルアルコールを各50%含むもの、あるいは、エチルアルコールとブチルアルコールを各50%含むものが好ましい。
【0041】
核酸析出試薬の添加量は限定的ではないが、生体試料および生体試料溶解試薬の体積和に対して、0.6倍〜2倍程度が好ましく、特に好ましくは体積比で等倍量である。
【0042】
核酸析出試薬を添加して、析出物を回収するまでの析出反応は、例えば、マイクロチューブ等の容器に全成分を入れ、転倒混和、あるいはボルテックスでの撹拌などによって行うことが出来る。反応温度は特に規定されないが、好ましくは4〜30℃である。反応時間は、核酸析出試薬の種類、その添加量および反応温度により適宜定めればよく、例えば、室温下(25℃)で等倍量のイソプロピルアルコール/ブチルアルコール混合液を核酸析出試薬として添加した場合、1〜10分程度である。
【0043】
工程(c)は、工程(b)で得られた核酸析出物を含む生体試料溶液から、核酸析出物を回収する工程である。
【0044】
核酸析出物を回収する手段としては、メンブレンなどを用いたろ過による手段と、遠心分離を用いる手段が挙げられる。
【0045】
メンブレンを用いる場合、その孔径は特には規制されないが、好ましくは0.01〜5.0μm、より好ましくは0.1〜1μm、特に好ましくは0.1〜0.65μmである。生体試料の種類、生体試料量、核酸量および夾雑物量に応じて、その孔径は適宜選択され得る。すなわち、メンブレン孔径は、生成する核酸析出物の大きさ以下に設定すれば良い。また、核酸量が多い場合はメンブレン孔径を比較的大きく、また、核酸量が少ない場合はメンブレン孔径を比較的小さく設定すれば良い。メンブレンとしては例えば限外濾過膜を用いてもよい。
【0046】
また、メンブレンの材質は特には規制されない。一般的に市販されているメンブレンフィルター、例えば、ポリエチレン、ポリプロピレンあるいはフッ素樹脂等の極めて汎用的な材質のメンブレンフィルター、例えばポリフッ化ビニリデン(PVDF)、ポリスルホン(PSU)が適用可能であり、その他の材質でも使用可能である。つまり、一般的な固液ろ過に適用される材質であれば良く、好ましくは、タンパク質や脂質等の核酸以外の夾雑物が吸着し難い材質が良い。
【0047】
例えば、核酸析出物を回収する際に、精密ろ過メンブレン等のろ過機能を有するメンブレンを付与した構造の容器を使用するのが好ましい。この場合、生体試料由来物質は核酸析出物以外すべて溶解状態にあるため、核酸析出物はメンブレン上に回収され、それ以外の溶液はメンブレンを透過し排出することができる。例えば、一方が開閉可能であり、他方が精密ろ過メンブレン等のろ過機能を有するメンブレンを付与した構造の容器を用いる場合にはこれを工程(c)だけでなく工程(a)から用いて工程を簡略化することができる。
【0048】
工程(c)および次の(d)に関して、ろ過メンブレンを付与した構造の容器としては特に限定されないが、例えば、ミリポア社ウルトラフリーが挙げられる。これは、一方が開口して他方が、ろ過機能を有するメンブレンを付与した構造である容器である。
【0049】
また工程(c)および次の(d)に関して、ろ過操作としては、加圧ろ過、遠心ろ過、吸引ろ過が挙げられる。例えば、加圧ろ過の場合、圧力は0.1〜3.0kgf/cm2程度が好ましく、例えば、1.0kgf/cm2が挙げられるが、必要に応じて適宜決定すれば良い。ただし限外濾過膜を用いる場合は遠心ろ過、または加圧ろ過が好ましい。
【0050】
上記のメンブレンを用いた析出物の回収工程において、容器に備えられたメンブレンが、核酸析出物をメンブレン上に捕獲するが、タンパク質等の夾雑物を含む溶液はメンブレン下方へろ液として排出することができる。
【0051】
また、核酸析出物を回収する手段としては、加圧ろ過、遠心ろ過および吸引ろ過といったろ過方式に限定されるものでなく、遠心沈殿方式でも実施可能である。遠心沈殿方式で実施する場合、ろ過メンブレンを付与した構造の容器を使用せず、マイクロチューブ等の底部が閉口した容器を用いて、遠心分離操作を実施し、容器底部に核酸沈殿を形成させ、上清液をピペット操作あるいはデカンテーション操作により除去する。遠心分離の程度は、例えば1.5〜2.0ml容量のマイクロチューブを用いる場合、遠心力が約7,500×gの場合は1〜2分、遠心力が約4,500×gの場合は3〜5分程度で十分である。
【0052】
工程(d)は、工程(c)で得られた核酸析出物に、核酸洗浄試薬を添加し、核酸析出物を洗浄する工程である。
【0053】
洗浄試薬は、アルコールを1種または2種以上を混合したアルコール溶液が好ましく、さらに、アルコール濃度が50%以上であることが好ましい。特に好ましくは少なくとも1種がブチルアルコールである2種以上のアルコールを含む溶液である。上記回収手段においてフィルターろ過を行う場合は特に、混合アルコール溶液で洗浄するのが好ましいが、1種のアルコール溶液で洗浄してもよい。特に好ましいアルコール溶液の組成・濃度はイソプロパノールとブチルアルコールの混合水溶液(各35%含有、純水30%含有)あるいはエチルアルコールとブチルアルコールの混合水液(各35%含有、純水30%含有)である。
【0054】
洗浄に用いる核酸洗浄試薬の添加量は特には限定されない。例えばメンブレンを用いて析出物を回収した場合、メンブレン上の核酸析出物、メンブレン表面およびメンブレンを保持した容器の内壁を洗浄するための必要量を適宜設定すれば良い。また、洗浄回数も特には限定されず、必要に応じて適宜設定すれば良い。メンブレンを用いて洗浄する場合は、核酸洗浄試薬をメンブレン下に排出するために必要に応じて、加圧ろ過、吸引ろ過、遠心ろ過を施せばよい。
【0055】
遠心分離を用いて析出物を回収した場合は、沈殿が析出した容器内で洗浄操作を実施し、同様に遠心分離操作により容器底部に核酸沈殿を回収する。この場合も洗浄試薬の添加量や洗浄回数は特に限定されない。この方式の場合、上清液の除去操作が煩雑ではあるが、低コストで実施可能であり、また、マイクロチューブ等の容器底部に核酸沈殿が回収されるため、工程(e)の核酸溶解操作が容易になる、といったメリットを有する。このように、洗浄に用いた反応容器がそのまま保存容器としても使用可能である場合、工程(e)での核酸溶解操作の後に、核酸溶液を保存する、あるいは、次のアプリケーションに用いる行為そのものが、工程(f)の回収工程に該当する。すなわち、一見すると工程(f)の回収工程を省略しているようにみえる方法も本発明の範囲に含まれる。
【0056】
工程(e)は、工程(d)の洗浄後の核酸析出物に、核酸溶解試薬を添加し、核酸析出物を溶解させる工程である。
【0057】
溶解試薬としては核酸を溶解する液体であれば特に限定されないが、好ましくは水、または塩類溶液、特に好ましくは純水または低塩濃度の水溶液、例えば、TE(Tris 10mM/EDTA 1mM (pH8))である。
【0058】
核酸溶解試薬の量は特に限定されるものではなく、必要に応じて適宜設定すれば良い。例えば、より高濃度のDNA溶液が必要であるならば、核酸溶解試薬の添加量を少量にすれば良い。
【0059】
メンブレン上の核酸析出物または遠心分離により沈殿した析出物を溶解するには、核酸溶解試薬投入後、ピペットで撹拌し、室温あるいは加温状態で放置すればよい。
【0060】
溶解時間は核酸量、試薬量、溶解温度、撹拌の有無に応じて適宜設定すれば良い。
【0061】
工程(f)は、工程(e)で得られた核酸溶液を回収する工程である。
【0062】
工程(c)において核酸析出物を、メンブレンを用いたろ過によって回収した場合であっても、遠心分離で回収した場合であっても、核酸溶液の回収は、ピペット吸引あるいはデカンテーションによって行うことが出来る
【0063】
しかし、核酸溶液の回収方法は、ピペット回収やデカンテーションに限定されるものではない。例えば、核酸析出物をメンブレンを用いたろ過により回収した場合は、加圧ろ過、遠心ろ過あるいは吸引ろ過により、核酸溶液をメンブレンの下方から回収しても良い。例えば、工程(c)で用いたものと同じろ過機能を有するメンブレンを付与した構造である容器の外側に、別の容器を装着し、遠心、加圧または吸引により下方から排出された核酸溶液を回収することも出来る。
【0064】
本発明の方法によって得られる核酸溶液は、タンパク質の混入度を表すA260/A280(核酸の吸光ピーク260nmでの吸光度と、タンパク質の吸光ピーク280nmでの吸光度の比)が1.7〜2.0の範囲であり、カオトロピック剤や糖の混入度を表すA230/A260(カオトロピック剤および糖の吸光ピーク230nmでの吸光度と核酸の吸光ピーク260nmでの吸光度の比)が0.4〜0.6の範囲であり、核酸の純度は十分に高い。
【0065】
本発明また、本発明の方法を実施するためのキットを提供する。本発明のキットは上記の試薬のうち、少なくとも
緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解溶液、および、
1種または2種以上のアルコールを含有する核酸析出試薬
を含むものである。
【0066】
本発明のキットは、これら2成分にさらに所望により、タンパク質分解酵素、核酸洗浄試薬、核酸溶解試薬の1種以上を含んでいてもよく、さらに、本発明の方法に利用できる容器、例えば、ろ過機能を有するメンブレンを付与した構造の容器を含むものであってもよい。
【実施例】
【0067】
以下、実施例により本発明を詳しく説明する。
なお、以下に示す実施例は本発明の理解の容易化のためのものであって、試薬組成、試薬添加量、固液分離手段、固液分離容器、メンブレン孔径およびメンブレン材質等の諸条件は以下に限定されるものではなく、必要に応じて適宜選択され得る。
【0068】
実施例1
ヒト全血からのゲノムDNA分離精製
ヒト全血200μl(抗凝固剤EDTA-2Na採血管使用)からのゲノムDNA分離精製を実施した。
本実施例に用いた試薬組成を表1に示す。以下の各工程におけるろ液は全て廃液であり、適宜容器等で回収した。
【0069】
工程(a):先ず初めに、1.5mlマイクロチューブに、全血200μlおよび表1に示す血液溶解試薬を血液量に対して体積比で2倍量(400μl)添加し、軽く撹拌した。次に、同マイクロチューブに表1に示す濃度に調整したタンパク質分解酵素プロテイナーゼKを血液量に対して体積比で0.03倍量(6μl)添加し、軽く攪拌した後、65℃に設定したインキュベーターに10分間静置した。
【0070】
工程(b):10分後、同マイクロチューブをインキュベーターから取り出し、表1に示す核酸析出試薬を血液量および血液溶解試薬の体積和に対して、体積比で等倍量(600μl)添加し、20回程度転倒混和した。
【0071】
工程(c):次に、同マイクロチューブ内の溶液を、一方が開口し、他方に精密ろ過メンブレンを付与した構造の容器であるミリポア社製ウルトラフリー(孔径:0.1μm、材質:親水性PVDF)に移し、加圧ろ過(圧力:1.0kgf/cm2)を実施することにより、核酸析出物をメンブレン上に得た。
【0072】
工程(d):次に、同ウルトラフリーのメンブレン装着された反対側から、表1に示す核酸洗浄試薬を添加し同様に加圧ろ過を2回実施することで、メンブレン上の核酸析出物を洗浄した。
【0073】
工程(e):次に、同ウルトラフリーのメンブレン装着された反対側の開口部から、表1に示す核酸溶解試薬を200μl添加し、ピペット撹拌を10回程度実施し、メンブレン上の核酸析出物を溶解させた。
【0074】
工程(f):最後に、工程(e)で使用した同ピペットにて核酸溶液を回収した。
【0075】
実施例1に使用した各試薬の組成および濃度
【表1】

【0076】
比較例1
ヒト全血からのゲノムDNA分離精製(固相吸着法)
核酸を固相吸着担体に吸着させて分離精製する方法の例として、固相吸着法の代表例であるシリカカラム方式の市販キットを使用し、ヒト全血(200μl)からのゲノムDNA分離精製を実施した。実施手順を以下に示すが、添加試薬の濃度や添加量および反応条件等は全て同キットに付属の取扱説明書に従った。
実施手順
1) 1.5mlマイクロチューブに、キット付属のプロテアーゼ溶液を所定量入れ、同マイクロチューブにヒト全血200μlおよびキット付属のバッファーAを所定量添加した後、10〜15秒間ボルテックス撹拌を行った。
2) 次に、同マイクロチューブを所定温度で所定時間インキュベートした後、100%エチルアルコールを所定量添加し、再度ボルテックス撹拌を行った。
3) 次に、同マイクロチューブ内のサンプル液を、キット付属のスピンカラムに移し、所定の遠心力で所定時間遠心分離を行い、スピンカラム内にDNAを吸着した(ろ液は廃棄)。
4) 次に、同スピンカラムにキット付属のバッファーBを所定量添加し、所定の遠心力で所定時間遠心分離を行い、スピンカラム内のDNAを洗浄した(ろ液は廃棄)。
5) 次に、同スピンカラムにキット付属のバッファーCを所定量添加し、所定の遠心力で所定時間遠心分離を行い、スピンカラム内のDNAを再度洗浄した(ろ液は廃棄)。
6) 最後に、同スピンカラム下部に新しい1.5mlマイクロチューブをセットした状態で、同スピンカラムにキット付属のバッファーDを所定量添加し、室温で数分間インキュベートした後、所定の遠心力で所定時間遠心分離を行い、スピンカラム内のDNAの溶出を行った。
【0077】
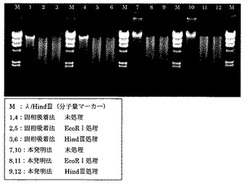
得られたゲノムDNAを評価するために、分光光度測定法、電気泳動法、リアルタイムPCR法および制限酵素処理法を適用した。なお、本発明法との完全比較のため、本比較例と実施例1は、サンプルに同一血液を使用し、同時に実施した。
【0078】
表2に本発明法と固相吸着法とで得られたゲノムDNAの分光光度測定結果を示す。ゲノムDNAの純度に関しては両者同等レベルであり、共にリアルタイムPCR法や制限酵素処理法といったアプリケーションに使用可能であった(表3および図1)。ところが収量に関しては大きな差異が認められ、本発明法により得られたゲノムDNAの収量は固相吸着法の約1.5倍であった。また、得られたゲノムDNAの長さに関しても、本発明法のほうが固相吸着法よりも長いことが電気泳動結果(図2)より明らかとなった。
【0079】
分光光度測定によるゲノムDNAの純度および収量
【表2】

【0080】
リアルタイムPCR法によるゲノムDNAの増幅効果
【表3】

注)Ct値は、核酸が急速に増幅するサイクル数である。
【図面の簡単な説明】
【0081】
【図1】本発明法および固相吸着法によってヒト全血から分離精製されたゲノムDNAの制限酵素処理後のアガロースゲル電気泳動写真。
【図2】本発明法および固相吸着法によってヒト全血から分離精製されたゲノムDNAのアガロースゲル電気泳動写真および拡大写真。
【技術分野】
【0001】
本発明は生体試料などから核酸を分離精製する方法に関する。特に、核酸分離後に引き続き実施されるサザンブロッティング法やPCR法などの種々アプリケーションに対して十分な収量および純度を有する核酸を分離精製する方法に関する。
【背景技術】
【0002】
血液などの生体試料から核酸を分離精製する手段としては、一般的に、タンパク質等の核酸以外の夾雑物を沈殿させて除去した後に、核酸を沈殿させて遠心分離機で回収するといった方法が適用されている。
【0003】
例えば、血液から核酸分離を実施する場合、以下のような方法が従来から行われている。先ず初めに有核細胞すなわち白血球細胞を得るために赤血球除去操作を行う。この赤血球除去操作は、一般的には塩濃度0.9%以下の塩化ナトリウム水溶液あるいは塩化アンモニウム水溶液等の低塩濃度の水溶液を添加し、浸透圧を利用して赤血球の細胞膜を破壊した後、遠心分離等の固液分離操作を行い、ピペット吸引操作あるいはデカンテーション操作により赤血球成分を含む溶液を除去し、白血球細胞を回収するというものである。次に、白血球細胞核中に含まれる核酸を白血球細胞懸濁液中に溶出させるために、界面活性剤やカオトロピック試薬を添加して白血球細胞および細胞核を溶解する。この溶解液中には目的とする核酸のほか、タンパク質および脂質といった夾雑物が混在している。次に、プロテイナーゼK(proteinaseK)に代表されるようなタンパク質分解酵素を添加し、室温あるいは37℃〜65℃で数分〜数時間放置することで残存タンパク質を微細化した後、これら夾雑物を除去するためにフェノールおよびクロロホルム等の有機溶剤を添加し液液分離を行う。
【0004】
このように液液分離した際、目的とする核酸は水溶性のため水溶液側に溶解しており、一方、脂質は非水溶性のため有機溶剤側に溶解している。また、タンパク質は親水基および疎水基の両方を持ち備えている性質上、水溶液と有機溶剤の界面に析出する。目的とする核酸を含む水溶液は、比重の関係から、有機溶剤および析出したタンパク質の上部に位置しており、この核酸を含む水溶液をピペット吸引等で回収する。さらに、回収した核酸溶液に残存するタンパク質を除去する目的で、回収した核酸溶液にその後、核酸を含む溶液から核酸のみを回収するために、核酸を含む溶液に数%の塩と約70%以上の濃度のアルコール溶液を添加し、撹拌することで、塩析効果により核酸のみが析出する。核酸の回収には、一般的に0.1体積の3M酢酸ナトリウム水溶液と1.5〜2体積の99.5%エタノールあるいは0.6〜1.0体積の99.5%イソプロピルアルコールが用いられる。
次に、遠心分離等の固液分離法により核酸析出物を含む溶液から核酸析出物を回収する。得られた核酸析出物を70%エタノール等で数回洗浄後、減圧乾燥等で少量の残存アルコールを除去する。最後に得られた核酸沈殿に、水あるいは低塩濃度バッファー等を添加し、核酸溶液を得る。
【0005】
また、特許文献1および2に代表されるような、シリカやその誘導体あるいは核酸吸着性能を持った化学繊維などの吸着固相担体を使用した核酸の分離精製法も数多く報告されており、上記方法に適応した各種キットや自動化装置も数多く存在する。
【0006】
このような吸着固相担体を使用した核酸の分離精製法は、核酸がカオトロピック塩の存在下において、シリカやその誘導体あるいは核酸吸着性能を持った化学繊維などの吸着固相担体に吸着しやすいという性質を利用している。例えば、血液から核酸分離を実施する場合、先ず初めに、血液にカオトロピック試薬および界面活性剤等を添加して、血液中の細胞を全て溶解する。次に、溶解した血液溶液をシリカやその誘導体あるいは核酸吸着性能を持った化学繊維などの吸着固相担体と接触させることにより、核酸を吸着固相担体に吸着する。吸着固相担体の形状としては、シリカやその誘導体あるいは核酸吸着性能を持った化学繊維などをフィルター状に成形したもの、あるいはカラム充填したものが一般的である。また、特許文献3に示されるように、シリカやその誘導体を磁性粒子にコーティングした形状のものも存在する。
【0007】
核酸と吸着固相担体との接触方法は、フィルター形状あるいはカラム形状の場合、フィルターあるいはカラムの一方から血液溶液を添加し、遠心、加圧、吸引等の操作により、血液溶液とフィルターあるいはカラムとを接触させ、血液溶液を添加した側と反対の方向から核酸吸着後の血液溶液を除去する方法が一般的である。また、磁性粒子状のものを使用する場合は、マイクロチューブ等の、一方が開口可能であり他方が閉塞した容器中に、血液溶液と磁性粒子を懸濁させ磁性粒子表面に核酸を吸着させる。懸濁後、磁性を利用して磁石等で核酸を吸着した磁性粒子を回収する方法が一般的である。
【0008】
いずれの方法においても、核酸を吸着した吸着固相担体を、数回程度アルコール溶液や比較的高濃度の塩を含む水溶液等で洗浄を行う。洗浄操作は核酸吸着操作の場合と同様の操作で実施される。洗浄後、吸着固相担体に吸着した核酸を溶出するため、吸着操作の場合と同様の操作で、水あるいは低塩濃度の水溶液を吸着固相担体に接触させることにより核酸溶液を得る。
【0009】
しかしながら、上記方法は少なからずデメリットを有し、必ずしも最適な方法とは言い難い。例えば、タンパク質等の夾雑物を沈殿除去する方法では、高収量、高濃度、高純度および長鎖の核酸が得られるものの、一般的にはフェノールおよびクロロホルムを使用するため、人体への悪影響が懸念されるとともに、廃液処理にも細心の注意を払う必要がある。また、有核細胞の回収操作、夾雑物の沈殿除去操作および核酸の洗浄操作等の複数の操作が必要であること、かつ、1つの操作毎に誤操作、コンタミネーションおよび感染等に細心の注意が必要であることから非常に煩雑な操作である。
【0010】
一方、吸着固相担体を利用した場合、夾雑物の沈殿除去操作等が不要なため、操作の煩雑性は軽減され、比較的短時間で核酸を回収することが可能であるものの、核酸の吸着或いは溶離が不十分なことが多く、核酸の低収量および低濃度が懸念される。さらに、磁性粒子による吸着固相分離においては、核酸を吸着した各粒子が頻繁に接触するため核酸の細分化が顕著になり、核酸を長鎖のまま吸着、回収することは困難である。
【0011】
以上のように、吸着固相担体を利用した核酸分離精製法では、操作の簡便性は認められるものの、回収される核酸の品質が劣る場合が多々見受けられる。
【特許文献1】特許第2680462号公報
【特許文献2】特公平第7-130772号公報
【特許文献3】特許第2965131号公報
【発明の開示】
【発明が解決しようとする課題】
【0012】
上記の問題に鑑み、本発明は、生体試料からの核酸分離において、簡便に、かつ、高収量、高濃度、高純度にて比較的長鎖の核酸を分離精製する方法および試薬、および、当該方法を利用した核酸分離キットを提供することを目的とする。
【0013】
さらに本発明の目的は、かかる方法を、キット提供や自動化装置に適応させることで、さらなる簡便性および信頼性を提供することである。
【課題を解決するための手段】
【0014】
本発明者らは、核酸分離精製操作の簡便化を図り、かつ、高収量、高濃度、高純度および長鎖の核酸を分離精製する、生体試料から直接核酸のみを析出させて分離精製する方法を完成させた。本発明の方法は、核酸を選択的に析出させ、析出した核酸を固液分離の原理を利用して効率的に回収するものである。
【0015】
即ち本発明は、
(a)生体試料に、緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬を添加し、生体試料を溶解させる工程、
(b) 工程(a)で得られた溶液に、1種または2種以上のアルコールを含有する核酸析出試薬を添加し、核酸を析出させる工程、
(c) 工程(b)で得られた核酸析出物を含む生体試料溶液から、核酸析出物を回収する工程、
(d) 工程(c)で回収した核酸析出物に、核酸洗浄試薬を添加し、核酸析出物を洗浄する工程、
(e) 工程(d)の洗浄後の核酸析出物に、核酸溶解試薬を添加し、核酸析出物を溶解させる工程、および、
(f) 工程(e)で得られた核酸溶液を回収する工程、
を含む、生体試料からの核酸の分離精製方法を提供する。
【0016】
さらに本発明は、
緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬、および
1種または2種以上のアルコールを含有する核酸析出試薬、
を含む核酸分離試薬キットも提供する。
【0017】
即ち、本発明は生体試料から核酸を分離する方法およびその方法に使用する試薬を提供するものである。さらには、該試薬類等をキット化することにより、核酸分離精製の更なる簡便性および信頼性を追及し、ひいては自動化装置適応への可能性を拓くものである。
【発明の効果】
【0018】
本発明によると、直接核酸のみを選択的に析出させることにより、高収量、高濃度、高純度にて比較的長鎖の核酸が分離精製可能となる。
【0019】
さらに、本発明の核酸分離精製方法に使用する試薬類や固液分離デバイスをキット化することにより、操作の効率化が促進されると同時に、コンタミネーションおよび感染等のリスクが低減される。
【0020】
一般に、固相吸着法による核酸の分離精製法においては、核酸の固相担体への吸着および溶離の際に、吸着ロスおよび溶離ロスが生じ易いため、本発明法のような核酸を析出させて回収する方法に比べて低収量の傾向がある。さらに、固相吸着法においては、できる限り多くの収量を確保するために、溶離液の量を多くする、または溶離工程を複数回実施するなどの手法が用いられる場合がある。しかし、このような溶離操作を実施すると、核酸の収量は増すが、核酸濃度が低くなるために、高濃度の核酸溶液を得る場合には、引き続き濃縮操作が必要となり煩雑さが増すため最適な方法とは言い難い。
【0021】
本発明法によれば、従来の方法のように、収量に影響を与えるようなロスが生じる操作が無く高収量となる。さらに、核酸沈殿を溶解させる液量は任意で良いため、核酸溶液濃度を自由に調整可能である。
【0022】
さらに、ゲノムマッピングに代表されるような長鎖のゲノムDNAが要求される場合においても、固相吸着法は最適な方法とは言い難い。一般的に、吸着プロセスを経由する方法は、吸着担体の保持能力の限界、および物理的衝撃によるゲノムDNAの切断、といった問題から長鎖のゲノムDNAを得ることが困難である。本発明法は、吸着プロセスではなく析出回収プロセスであるため上記の問題が発生し難く、比較的長鎖のゲノムDNAが回収可能となる。
【発明を実施するための最良の形態】
【0023】
本発明において、生体試料とは、核酸を含むいずれの生物由来の試料であってもよく、例えば、血液やその他細胞を含む試料が含まれる。血液としては、全血のみならず、血清、血漿、および白血球懸濁液が挙げられる。細胞としては、組織片、培養細胞、口腔粘膜細胞などが挙げられる。生体試料には必要に応じて、抗凝固剤を添加してもよい。例えば、全血を用いる場合、あらかじめEDTA-2Na等の抗凝固剤を試料に添加することが好ましい。
【0024】
用いる生体試料の量は、生体試料の種類、得ようとする核酸の量によって異なり、特に限定されない。例えばPCRの目的で全血から核酸を分離精製する場合、全血10〜100μl程度を用いればよい。
【0025】
以下、本発明の方法を工程順に説明する。
【0026】
まず、工程(a)について説明する。工程(a)は、生体試料に、緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬を添加し、生体試料を溶解させる工程である。
【0027】
生体試料溶解試薬は、緩衝剤、界面活性剤およびカオトロピック剤を含有する水溶液である。
【0028】
生体試料溶解試薬に含有される緩衝剤の種類としては、トリスヒドロキシアミノメタン、リン酸カリウム、リン酸ナトリウムなどが挙げられ、好ましくはトリスヒドロキシアミノメタンである。生体試料溶解試薬中の緩衝剤の濃度は、1mM〜1M、好ましくは10mM〜500mMの範囲である。例えば、緩衝剤としてトリスヒドロキシアミノメタンを用いる場合、その終濃度が15mM以上、好ましくは20〜80mMの範囲になるように調整される。
【0029】
生体試料溶解試薬に含有される界面活性剤としては、陽イオン性、陰イオン性、両イオン性、および非イオン性のいずれも好適に用いられるが、特に好ましくは非イオン性界面活性剤である。例えば非イオン性界面活性剤であるTritonX-100を用いる場合、その終濃度が0.5〜4.0%、好ましくは0.8〜3.0%の範囲になるように調整される。
【0030】
生体試料溶解試薬に含有されるカオトロピック剤の種類としては、グアニジウム塩、ヨウ化ナトリウム、ヨウ化カリウム、(イソ)チオシアン酸ナトリウム、尿素などが挙げられ、好ましくはグアニジウム塩である。カオトロピック剤の濃度は、その種類によって適宜定められるが、例えば、カオトロピック剤としてグアニジン塩酸塩を用いる場合、その終濃度が2.0〜5.0M、好ましくは2.5〜3.5Mの範囲になるように調整される。
【0031】
生体試料溶解試薬に含まれる各成分の組成比は、各成分の種類、生体試料の種類、反応時間、反応温度などにより適宜定めればよい。例えば、実施例1の表1に示すものが特に好ましく例示される。
【0032】
本発明の生体試料溶解溶液のpHはDNAの損傷を防止するため、pH7.5〜8.5の中性範囲に調整されるのが好ましい。
【0033】
生体試料溶解試薬の、生体試料に対する添加量は、試料の種類あるいは試薬の組成によって適宜定めればよい。例えば実施例の表1に示す組成の生体試薬溶解試薬を使用し、血液を生体試料として用いる場合、血液量に対して体積比で1.5〜3.0倍量を添加するのが好ましい。反応時間は生体試料溶解試薬の添加量に応じて適宜定めればよい。
【0034】
工程(a)において、生体試料および生体試料溶解試薬を反応させる容器としては例えば、マイクロチューブ等の一方が開閉可能であり、他方が閉塞した形状が挙げられるがこれに限定されるものではない。
【0035】
なお工程(a)において、必要に応じてタンパク質分解酵素を添加してもよい。タンパク質分解酵素は、生体試料溶解試薬と同時に、あるいはその前後に添加しても良い。タンパク質分解酵素は特に限定されないが、例えばプロテイナーゼK、プロナーゼが挙げられ、好ましくはプロテイナーゼKである。タンパク質分解酵素はその種類に応じて適宜、添加量、反応時間および反応温度を適宜調整すれば良い。例えば、生体試料量として血液を用い、20mg/mlに調整されたプロテイナーゼKを添加する場合は、その添加量は、血液に対して体積比で0.01倍以上、好ましくは0.02〜0.05倍、より好ましくは0.03倍量用いるとよい。
【0036】
工程(a)において、タンパク質分解酵素を添加する場合の反応温度と反応時間は、例えば、反応温度を20℃程度に設定した場合には反応時間を60分以上に設定する、といったようにタンパク質分解酵素のタンパク質分解能力および添加量に応じて適宜決定すれば良い。好ましくは37〜80℃で1〜60分、さらに好ましくは、65℃、10分である。この場合も撹拌することが好ましい。
【0037】
生体試料溶解試薬には、上記のほか例えばRNA分解酵素を添加してもよい。
【0038】
工程(b)は、上記工程(a)で得られた溶液に1種または2種以上のアルコールを含有する核酸析出試薬を添加し、核酸を析出させる工程である。
【0039】
核酸析出試薬は1種または2種以上のアルコールを含有する溶液であり、アルコールとしてはエチルアルコール、イソプロピルアルコール、ブチルアルコール、メチルアルコール、イソアミルアルコールなどの脂肪族アルコールが挙げられる。好ましくは少なくともブチルアルコールあるいはイソアミルアルコールのいずれかを含む2種以上のアルコールの混合液、更に好ましくはブチルアルコールを含む2種以上のアルコールの混合液を用いる。核酸析出試薬はアルコール以外の成分、例えば水を含んでいてもよい。核酸析出試薬としては、好ましくはイソプロピルアルコールとブチルアルコールを各50%含むものが用いられる。
【0040】
例えば、工程(a)において、実施例1の表1の組成の生体試料溶解試薬を用いる場合、工程(b)の核酸析出試薬の組成はイソプロピルアルコールとブチルアルコールを各50%含むもの、あるいは、エチルアルコールとブチルアルコールを各50%含むものが好ましい。
【0041】
核酸析出試薬の添加量は限定的ではないが、生体試料および生体試料溶解試薬の体積和に対して、0.6倍〜2倍程度が好ましく、特に好ましくは体積比で等倍量である。
【0042】
核酸析出試薬を添加して、析出物を回収するまでの析出反応は、例えば、マイクロチューブ等の容器に全成分を入れ、転倒混和、あるいはボルテックスでの撹拌などによって行うことが出来る。反応温度は特に規定されないが、好ましくは4〜30℃である。反応時間は、核酸析出試薬の種類、その添加量および反応温度により適宜定めればよく、例えば、室温下(25℃)で等倍量のイソプロピルアルコール/ブチルアルコール混合液を核酸析出試薬として添加した場合、1〜10分程度である。
【0043】
工程(c)は、工程(b)で得られた核酸析出物を含む生体試料溶液から、核酸析出物を回収する工程である。
【0044】
核酸析出物を回収する手段としては、メンブレンなどを用いたろ過による手段と、遠心分離を用いる手段が挙げられる。
【0045】
メンブレンを用いる場合、その孔径は特には規制されないが、好ましくは0.01〜5.0μm、より好ましくは0.1〜1μm、特に好ましくは0.1〜0.65μmである。生体試料の種類、生体試料量、核酸量および夾雑物量に応じて、その孔径は適宜選択され得る。すなわち、メンブレン孔径は、生成する核酸析出物の大きさ以下に設定すれば良い。また、核酸量が多い場合はメンブレン孔径を比較的大きく、また、核酸量が少ない場合はメンブレン孔径を比較的小さく設定すれば良い。メンブレンとしては例えば限外濾過膜を用いてもよい。
【0046】
また、メンブレンの材質は特には規制されない。一般的に市販されているメンブレンフィルター、例えば、ポリエチレン、ポリプロピレンあるいはフッ素樹脂等の極めて汎用的な材質のメンブレンフィルター、例えばポリフッ化ビニリデン(PVDF)、ポリスルホン(PSU)が適用可能であり、その他の材質でも使用可能である。つまり、一般的な固液ろ過に適用される材質であれば良く、好ましくは、タンパク質や脂質等の核酸以外の夾雑物が吸着し難い材質が良い。
【0047】
例えば、核酸析出物を回収する際に、精密ろ過メンブレン等のろ過機能を有するメンブレンを付与した構造の容器を使用するのが好ましい。この場合、生体試料由来物質は核酸析出物以外すべて溶解状態にあるため、核酸析出物はメンブレン上に回収され、それ以外の溶液はメンブレンを透過し排出することができる。例えば、一方が開閉可能であり、他方が精密ろ過メンブレン等のろ過機能を有するメンブレンを付与した構造の容器を用いる場合にはこれを工程(c)だけでなく工程(a)から用いて工程を簡略化することができる。
【0048】
工程(c)および次の(d)に関して、ろ過メンブレンを付与した構造の容器としては特に限定されないが、例えば、ミリポア社ウルトラフリーが挙げられる。これは、一方が開口して他方が、ろ過機能を有するメンブレンを付与した構造である容器である。
【0049】
また工程(c)および次の(d)に関して、ろ過操作としては、加圧ろ過、遠心ろ過、吸引ろ過が挙げられる。例えば、加圧ろ過の場合、圧力は0.1〜3.0kgf/cm2程度が好ましく、例えば、1.0kgf/cm2が挙げられるが、必要に応じて適宜決定すれば良い。ただし限外濾過膜を用いる場合は遠心ろ過、または加圧ろ過が好ましい。
【0050】
上記のメンブレンを用いた析出物の回収工程において、容器に備えられたメンブレンが、核酸析出物をメンブレン上に捕獲するが、タンパク質等の夾雑物を含む溶液はメンブレン下方へろ液として排出することができる。
【0051】
また、核酸析出物を回収する手段としては、加圧ろ過、遠心ろ過および吸引ろ過といったろ過方式に限定されるものでなく、遠心沈殿方式でも実施可能である。遠心沈殿方式で実施する場合、ろ過メンブレンを付与した構造の容器を使用せず、マイクロチューブ等の底部が閉口した容器を用いて、遠心分離操作を実施し、容器底部に核酸沈殿を形成させ、上清液をピペット操作あるいはデカンテーション操作により除去する。遠心分離の程度は、例えば1.5〜2.0ml容量のマイクロチューブを用いる場合、遠心力が約7,500×gの場合は1〜2分、遠心力が約4,500×gの場合は3〜5分程度で十分である。
【0052】
工程(d)は、工程(c)で得られた核酸析出物に、核酸洗浄試薬を添加し、核酸析出物を洗浄する工程である。
【0053】
洗浄試薬は、アルコールを1種または2種以上を混合したアルコール溶液が好ましく、さらに、アルコール濃度が50%以上であることが好ましい。特に好ましくは少なくとも1種がブチルアルコールである2種以上のアルコールを含む溶液である。上記回収手段においてフィルターろ過を行う場合は特に、混合アルコール溶液で洗浄するのが好ましいが、1種のアルコール溶液で洗浄してもよい。特に好ましいアルコール溶液の組成・濃度はイソプロパノールとブチルアルコールの混合水溶液(各35%含有、純水30%含有)あるいはエチルアルコールとブチルアルコールの混合水液(各35%含有、純水30%含有)である。
【0054】
洗浄に用いる核酸洗浄試薬の添加量は特には限定されない。例えばメンブレンを用いて析出物を回収した場合、メンブレン上の核酸析出物、メンブレン表面およびメンブレンを保持した容器の内壁を洗浄するための必要量を適宜設定すれば良い。また、洗浄回数も特には限定されず、必要に応じて適宜設定すれば良い。メンブレンを用いて洗浄する場合は、核酸洗浄試薬をメンブレン下に排出するために必要に応じて、加圧ろ過、吸引ろ過、遠心ろ過を施せばよい。
【0055】
遠心分離を用いて析出物を回収した場合は、沈殿が析出した容器内で洗浄操作を実施し、同様に遠心分離操作により容器底部に核酸沈殿を回収する。この場合も洗浄試薬の添加量や洗浄回数は特に限定されない。この方式の場合、上清液の除去操作が煩雑ではあるが、低コストで実施可能であり、また、マイクロチューブ等の容器底部に核酸沈殿が回収されるため、工程(e)の核酸溶解操作が容易になる、といったメリットを有する。このように、洗浄に用いた反応容器がそのまま保存容器としても使用可能である場合、工程(e)での核酸溶解操作の後に、核酸溶液を保存する、あるいは、次のアプリケーションに用いる行為そのものが、工程(f)の回収工程に該当する。すなわち、一見すると工程(f)の回収工程を省略しているようにみえる方法も本発明の範囲に含まれる。
【0056】
工程(e)は、工程(d)の洗浄後の核酸析出物に、核酸溶解試薬を添加し、核酸析出物を溶解させる工程である。
【0057】
溶解試薬としては核酸を溶解する液体であれば特に限定されないが、好ましくは水、または塩類溶液、特に好ましくは純水または低塩濃度の水溶液、例えば、TE(Tris 10mM/EDTA 1mM (pH8))である。
【0058】
核酸溶解試薬の量は特に限定されるものではなく、必要に応じて適宜設定すれば良い。例えば、より高濃度のDNA溶液が必要であるならば、核酸溶解試薬の添加量を少量にすれば良い。
【0059】
メンブレン上の核酸析出物または遠心分離により沈殿した析出物を溶解するには、核酸溶解試薬投入後、ピペットで撹拌し、室温あるいは加温状態で放置すればよい。
【0060】
溶解時間は核酸量、試薬量、溶解温度、撹拌の有無に応じて適宜設定すれば良い。
【0061】
工程(f)は、工程(e)で得られた核酸溶液を回収する工程である。
【0062】
工程(c)において核酸析出物を、メンブレンを用いたろ過によって回収した場合であっても、遠心分離で回収した場合であっても、核酸溶液の回収は、ピペット吸引あるいはデカンテーションによって行うことが出来る
【0063】
しかし、核酸溶液の回収方法は、ピペット回収やデカンテーションに限定されるものではない。例えば、核酸析出物をメンブレンを用いたろ過により回収した場合は、加圧ろ過、遠心ろ過あるいは吸引ろ過により、核酸溶液をメンブレンの下方から回収しても良い。例えば、工程(c)で用いたものと同じろ過機能を有するメンブレンを付与した構造である容器の外側に、別の容器を装着し、遠心、加圧または吸引により下方から排出された核酸溶液を回収することも出来る。
【0064】
本発明の方法によって得られる核酸溶液は、タンパク質の混入度を表すA260/A280(核酸の吸光ピーク260nmでの吸光度と、タンパク質の吸光ピーク280nmでの吸光度の比)が1.7〜2.0の範囲であり、カオトロピック剤や糖の混入度を表すA230/A260(カオトロピック剤および糖の吸光ピーク230nmでの吸光度と核酸の吸光ピーク260nmでの吸光度の比)が0.4〜0.6の範囲であり、核酸の純度は十分に高い。
【0065】
本発明また、本発明の方法を実施するためのキットを提供する。本発明のキットは上記の試薬のうち、少なくとも
緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解溶液、および、
1種または2種以上のアルコールを含有する核酸析出試薬
を含むものである。
【0066】
本発明のキットは、これら2成分にさらに所望により、タンパク質分解酵素、核酸洗浄試薬、核酸溶解試薬の1種以上を含んでいてもよく、さらに、本発明の方法に利用できる容器、例えば、ろ過機能を有するメンブレンを付与した構造の容器を含むものであってもよい。
【実施例】
【0067】
以下、実施例により本発明を詳しく説明する。
なお、以下に示す実施例は本発明の理解の容易化のためのものであって、試薬組成、試薬添加量、固液分離手段、固液分離容器、メンブレン孔径およびメンブレン材質等の諸条件は以下に限定されるものではなく、必要に応じて適宜選択され得る。
【0068】
実施例1
ヒト全血からのゲノムDNA分離精製
ヒト全血200μl(抗凝固剤EDTA-2Na採血管使用)からのゲノムDNA分離精製を実施した。
本実施例に用いた試薬組成を表1に示す。以下の各工程におけるろ液は全て廃液であり、適宜容器等で回収した。
【0069】
工程(a):先ず初めに、1.5mlマイクロチューブに、全血200μlおよび表1に示す血液溶解試薬を血液量に対して体積比で2倍量(400μl)添加し、軽く撹拌した。次に、同マイクロチューブに表1に示す濃度に調整したタンパク質分解酵素プロテイナーゼKを血液量に対して体積比で0.03倍量(6μl)添加し、軽く攪拌した後、65℃に設定したインキュベーターに10分間静置した。
【0070】
工程(b):10分後、同マイクロチューブをインキュベーターから取り出し、表1に示す核酸析出試薬を血液量および血液溶解試薬の体積和に対して、体積比で等倍量(600μl)添加し、20回程度転倒混和した。
【0071】
工程(c):次に、同マイクロチューブ内の溶液を、一方が開口し、他方に精密ろ過メンブレンを付与した構造の容器であるミリポア社製ウルトラフリー(孔径:0.1μm、材質:親水性PVDF)に移し、加圧ろ過(圧力:1.0kgf/cm2)を実施することにより、核酸析出物をメンブレン上に得た。
【0072】
工程(d):次に、同ウルトラフリーのメンブレン装着された反対側から、表1に示す核酸洗浄試薬を添加し同様に加圧ろ過を2回実施することで、メンブレン上の核酸析出物を洗浄した。
【0073】
工程(e):次に、同ウルトラフリーのメンブレン装着された反対側の開口部から、表1に示す核酸溶解試薬を200μl添加し、ピペット撹拌を10回程度実施し、メンブレン上の核酸析出物を溶解させた。
【0074】
工程(f):最後に、工程(e)で使用した同ピペットにて核酸溶液を回収した。
【0075】
実施例1に使用した各試薬の組成および濃度
【表1】

【0076】
比較例1
ヒト全血からのゲノムDNA分離精製(固相吸着法)
核酸を固相吸着担体に吸着させて分離精製する方法の例として、固相吸着法の代表例であるシリカカラム方式の市販キットを使用し、ヒト全血(200μl)からのゲノムDNA分離精製を実施した。実施手順を以下に示すが、添加試薬の濃度や添加量および反応条件等は全て同キットに付属の取扱説明書に従った。
実施手順
1) 1.5mlマイクロチューブに、キット付属のプロテアーゼ溶液を所定量入れ、同マイクロチューブにヒト全血200μlおよびキット付属のバッファーAを所定量添加した後、10〜15秒間ボルテックス撹拌を行った。
2) 次に、同マイクロチューブを所定温度で所定時間インキュベートした後、100%エチルアルコールを所定量添加し、再度ボルテックス撹拌を行った。
3) 次に、同マイクロチューブ内のサンプル液を、キット付属のスピンカラムに移し、所定の遠心力で所定時間遠心分離を行い、スピンカラム内にDNAを吸着した(ろ液は廃棄)。
4) 次に、同スピンカラムにキット付属のバッファーBを所定量添加し、所定の遠心力で所定時間遠心分離を行い、スピンカラム内のDNAを洗浄した(ろ液は廃棄)。
5) 次に、同スピンカラムにキット付属のバッファーCを所定量添加し、所定の遠心力で所定時間遠心分離を行い、スピンカラム内のDNAを再度洗浄した(ろ液は廃棄)。
6) 最後に、同スピンカラム下部に新しい1.5mlマイクロチューブをセットした状態で、同スピンカラムにキット付属のバッファーDを所定量添加し、室温で数分間インキュベートした後、所定の遠心力で所定時間遠心分離を行い、スピンカラム内のDNAの溶出を行った。
【0077】
得られたゲノムDNAを評価するために、分光光度測定法、電気泳動法、リアルタイムPCR法および制限酵素処理法を適用した。なお、本発明法との完全比較のため、本比較例と実施例1は、サンプルに同一血液を使用し、同時に実施した。
【0078】
表2に本発明法と固相吸着法とで得られたゲノムDNAの分光光度測定結果を示す。ゲノムDNAの純度に関しては両者同等レベルであり、共にリアルタイムPCR法や制限酵素処理法といったアプリケーションに使用可能であった(表3および図1)。ところが収量に関しては大きな差異が認められ、本発明法により得られたゲノムDNAの収量は固相吸着法の約1.5倍であった。また、得られたゲノムDNAの長さに関しても、本発明法のほうが固相吸着法よりも長いことが電気泳動結果(図2)より明らかとなった。
【0079】
分光光度測定によるゲノムDNAの純度および収量
【表2】

【0080】
リアルタイムPCR法によるゲノムDNAの増幅効果
【表3】

注)Ct値は、核酸が急速に増幅するサイクル数である。
【図面の簡単な説明】
【0081】
【図1】本発明法および固相吸着法によってヒト全血から分離精製されたゲノムDNAの制限酵素処理後のアガロースゲル電気泳動写真。
【図2】本発明法および固相吸着法によってヒト全血から分離精製されたゲノムDNAのアガロースゲル電気泳動写真および拡大写真。
【特許請求の範囲】
【請求項1】
(a)生体試料に、緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬を添加し、生体試料を溶解させる工程、
(b) 工程(a)で得られた溶液に、1種または2種以上のアルコールを含有する核酸析出試薬を添加し、核酸を析出させる工程、
(c) 工程(b)で得られた核酸析出物を含む生体試料溶液から、核酸析出物を回収する工程、
(d) 工程(c)で回収した核酸析出物に、核酸洗浄試薬を添加し、核酸析出物を洗浄する工程、
(e) 工程(d)の洗浄後の核酸析出物に、核酸溶解試薬を添加し、核酸析出物を溶解させる工程、および、
(f) 工程(e)で得られた核酸溶液を回収する工程、
を含む、生体試料からの核酸の分離精製方法。
【請求項2】
工程(a)において、タンパク質分解酵素をさらに添加する請求項1に記載の方法。
【請求項3】
生体試料が血液である請求項1または2に記載の方法。
【請求項4】
血液が、全血、血清、血漿、または白血球懸濁液である請求項3に記載の方法。
【請求項5】
核酸析出試薬が、ブチルアルコールおよびイソアミルアルコールからなる群から選択される少なくとも1種のアルコールを含む、2種以上のアルコール混合溶液であることを特徴とする請求項1から4のいずれかに記載の核酸の分離精製方法。
【請求項6】
工程(c)の核酸析出物を回収する手段として、メンブレンによるろ過を用い、メンブレン上に核酸析出物を回収することを特徴とする請求項1から5のいずれか1項に記載の核酸の分離精製方法。
【請求項7】
ろ過を遠心ろ過、加圧ろ過または吸引ろ過によって行う請求項6に記載の核酸の分離精製方法。
【請求項8】
工程(c)の核酸析出物を回収する手段が、ろ過機能を有するメンブレンを付与した構造である容器を使用することを特徴とする、請求項6または7のいずれか1項に記載の核酸の分離精製方法。
【請求項9】
工程(c)の核酸析出物を回収する手段が、遠心分離により核酸析出物を沈殿として回収することを特徴とする、請求項1から5のいずれか1項に記載の核酸の分離精製方法。
【請求項10】
工程(d)の核酸洗浄試薬が、1種または2種以上を混合したアルコール溶液であり、かつ、アルコール濃度が50%以上であることを特徴とする請求項1〜9のいずれか1項に記載の核酸の分離精製方法。
【請求項11】
核酸洗浄試薬が少なくともブチルアルコールを含む2種以上のアルコール混合溶液であることを特徴とする請求項10に記載の核酸の分離精製方法。
【請求項12】
工程(e)の核酸溶解試薬が純水あるいは低塩濃度の水溶液であることを特徴とする請求項1から11のいずれか1項に記載の核酸の分離精製方法。
【請求項13】
工程(f)の核酸溶液を回収する手段が、ピペット吸引あるいはデカンテーションであることを特徴とする請求項1から12のいずれか1項に記載の核酸の分離精製方法。
【請求項14】
工程(f)の核酸溶液を回収する手段が、ろ過機能を有するメンブレンを付与した構造である容器の外側に、容器を装着し、遠心、加圧または吸引により、該容器に核酸溶液を回収することを特徴とする請求項8に記載の核酸の分離精製方法。
【請求項15】
緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬、および
1種または2種以上のアルコールを含有する核酸析出試薬、
を含む核酸分離試薬キット。
【請求項16】
さらにタンパク質分解酵素を含む請求項15に記載の核酸分離試薬キット。
【請求項17】
さらに核酸洗浄試薬を含む請求項15または16に記載の核酸分離試薬キット。
【請求項18】
さらに、ろ過機能を有するメンブレンを付与した構造の容器を含む請求項15から17のいずれかに記載の核酸分離試薬キット。
【請求項1】
(a)生体試料に、緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬を添加し、生体試料を溶解させる工程、
(b) 工程(a)で得られた溶液に、1種または2種以上のアルコールを含有する核酸析出試薬を添加し、核酸を析出させる工程、
(c) 工程(b)で得られた核酸析出物を含む生体試料溶液から、核酸析出物を回収する工程、
(d) 工程(c)で回収した核酸析出物に、核酸洗浄試薬を添加し、核酸析出物を洗浄する工程、
(e) 工程(d)の洗浄後の核酸析出物に、核酸溶解試薬を添加し、核酸析出物を溶解させる工程、および、
(f) 工程(e)で得られた核酸溶液を回収する工程、
を含む、生体試料からの核酸の分離精製方法。
【請求項2】
工程(a)において、タンパク質分解酵素をさらに添加する請求項1に記載の方法。
【請求項3】
生体試料が血液である請求項1または2に記載の方法。
【請求項4】
血液が、全血、血清、血漿、または白血球懸濁液である請求項3に記載の方法。
【請求項5】
核酸析出試薬が、ブチルアルコールおよびイソアミルアルコールからなる群から選択される少なくとも1種のアルコールを含む、2種以上のアルコール混合溶液であることを特徴とする請求項1から4のいずれかに記載の核酸の分離精製方法。
【請求項6】
工程(c)の核酸析出物を回収する手段として、メンブレンによるろ過を用い、メンブレン上に核酸析出物を回収することを特徴とする請求項1から5のいずれか1項に記載の核酸の分離精製方法。
【請求項7】
ろ過を遠心ろ過、加圧ろ過または吸引ろ過によって行う請求項6に記載の核酸の分離精製方法。
【請求項8】
工程(c)の核酸析出物を回収する手段が、ろ過機能を有するメンブレンを付与した構造である容器を使用することを特徴とする、請求項6または7のいずれか1項に記載の核酸の分離精製方法。
【請求項9】
工程(c)の核酸析出物を回収する手段が、遠心分離により核酸析出物を沈殿として回収することを特徴とする、請求項1から5のいずれか1項に記載の核酸の分離精製方法。
【請求項10】
工程(d)の核酸洗浄試薬が、1種または2種以上を混合したアルコール溶液であり、かつ、アルコール濃度が50%以上であることを特徴とする請求項1〜9のいずれか1項に記載の核酸の分離精製方法。
【請求項11】
核酸洗浄試薬が少なくともブチルアルコールを含む2種以上のアルコール混合溶液であることを特徴とする請求項10に記載の核酸の分離精製方法。
【請求項12】
工程(e)の核酸溶解試薬が純水あるいは低塩濃度の水溶液であることを特徴とする請求項1から11のいずれか1項に記載の核酸の分離精製方法。
【請求項13】
工程(f)の核酸溶液を回収する手段が、ピペット吸引あるいはデカンテーションであることを特徴とする請求項1から12のいずれか1項に記載の核酸の分離精製方法。
【請求項14】
工程(f)の核酸溶液を回収する手段が、ろ過機能を有するメンブレンを付与した構造である容器の外側に、容器を装着し、遠心、加圧または吸引により、該容器に核酸溶液を回収することを特徴とする請求項8に記載の核酸の分離精製方法。
【請求項15】
緩衝剤、界面活性剤およびカオトロピック剤を含有する生体試料溶解試薬、および
1種または2種以上のアルコールを含有する核酸析出試薬、
を含む核酸分離試薬キット。
【請求項16】
さらにタンパク質分解酵素を含む請求項15に記載の核酸分離試薬キット。
【請求項17】
さらに核酸洗浄試薬を含む請求項15または16に記載の核酸分離試薬キット。
【請求項18】
さらに、ろ過機能を有するメンブレンを付与した構造の容器を含む請求項15から17のいずれかに記載の核酸分離試薬キット。
【図1】


【図2】




【図2】


【公開番号】特開2007−97503(P2007−97503A)
【公開日】平成19年4月19日(2007.4.19)
【国際特許分類】
【出願番号】特願2005−292730(P2005−292730)
【出願日】平成17年10月5日(2005.10.5)
【出願人】(000001096)倉敷紡績株式会社 (296)
【Fターム(参考)】
【公開日】平成19年4月19日(2007.4.19)
【国際特許分類】
【出願日】平成17年10月5日(2005.10.5)
【出願人】(000001096)倉敷紡績株式会社 (296)
【Fターム(参考)】
[ Back to top ]

